Изобретение относится к молекулярной биологии, генной инженерии, биотехнологиям и касается новых генетических конструкций и продуцентов, обеспечивающих направленную экспрессию в лизосомах клеток млекопитающих, в том числе человека, родопсина NsXeR из организма наногалоархеон Nanosalina, пригодного к дальнейшим исследованиям функционирования клетки на молекулярном уровне с помощью флуоресцентной микроскопии и проточной цитофлуориметрии. Ген интереса оптимизирован под экспрессию в клетках млекопитающих, и помещён в модифицированный плазмидный вектор pCMV. Изобретение позволяет защелачивать лизосомы клеток, что подтверждено по pH-чувствительным белковому и низкомолекулярному сенсорам, ингибированию лизосомных ферментов.
Введение
Известна конструкция родопсина NsXeR из организма наногалоархеон Nanosalina, депонированная в базе данных UniProtKB - (Bacteriorhodopsin, https://www.uniprot.org/uniprot/G0QG75, протонный, качающий внутрь клетки насос ксенородопсин). В данной заявке предлагается использовать этот белок для защелачивания лизосом.
Возможные молекулярные мишени закисления и защелачивания лизосом.
Поддержание низкой кислотности лизосом является необходимым воздействием для лечения заболеваний и замедления старения [10.1038/nm.3232, 10.1038/nature24620, 10.1126/science.aag3048]. Ценность лизосомной оптогенетики заключается в том, что эта отсутствовавшая до 2015 года методика [10.1038/nn.4161] позволяет обратимо и с высоким пространственно-временным разрешением осуществлять защелачивание/закисление люмена лизосом. Оптогенетически контролируемая регуляция рН в широком диапазоне позволяет менять лизосомную функцию и исследовать изменения в других процессах клетки, зависящих от лизосом. Наиболее важными известными клеточными процессами, на которые влияет pH лизосом, являются: лизосомально-митохондриальное взаимодействие (ось) [10.1016/j.molcel.2020.01.003], процессы сигнализации лизосома-ядро [10.1038/emboj.2012.32], ремоделирование эндоплазматического ретикулума (ЭР) [10.1038/ncb3324, 10.1126/SCIADV.ABC7209], метаболическая адаптация [10.1073/pnas.1419669112] и перепрограммирование [10.1016/j.cell.2018.05.009, 10.1038/s41422-018-0080-0], выход вирусов [10.1016/j.cell.2020.10.039].
Попытки клетки компенсировать защелачивание лизосом из-за ограниченности ресурсов теряют эффективность со временем. Длительное защелачивание приводит к нарушениям в клетке [10.1038/s41573-019-0036-1], что может использоваться в том числе для терапии рака [10.1038/s41417-019-0134-6]. С помощью lyso-NsXeR можно раскрыть все преимущества защелачивания лизосом и вместе с тем решить ряд проблем, сопровождающих такие изменения лизосом. Так, по сравнению с химическими и генетическими вмешательствами, с помощью оптогенетической стимуляции можно добиться клеточных ответов, осуществив лишь краткосрочное воздействие (яркий пример по ссылке [10.1073/pnas.1910574116]). В то же время стабильного пролонгированного воздействия легче добиться с помощью медикаментозного лечения или генного нокаута/нокдауна, однако оно будет сопряжено и со всем комплексом нежелательных побочных эффектов. Далее будут приведены возможные применения оптогенетического защелачивания лизосом.
Кальциевая сигнализация, позиционирование лизосом
Недавно было показано, что рН-зависимый лизосомальный транспортер кальция TRPML1 при ингибировании V-АТФазы или прямом подщелачивании лизосом вызывает выход из них ионов кальция [10.1016/j.celrep.2015.07.050]. Выброшенный лизосомами кальций может активировать TFEB (если mTORC1 неактивен [10.1038/emboj.2012.32]) и увеличить слияние лизосом с эндосомами и с аутофагосомами [10.1038/ncomms8007]. Лизосомный кальциевый выброс также вызывает движение лизосом к ядру [10.1038/ncb3324], их кластеризацию [10.1038/s41419-021-04243-0], что также поддерживает аутофагию. Таким образом, временное и обратимое оптогенетическое подщелачивание лизосом может усилить аутофагию и стать удобной моделью короткого острого голодания, характеризующегося теми же свойствами (движение лизосом к ядру, подщелачивание цитозоля, активация TRPML1 [10.1073/pnas.1419669112, 10.1038/ncb2204]). Также с помощью оптогенетики можно напрямую показать, зависит ли активация TRPML1 только от рН люмена лизосом или же от активности V-АТФазы.
Кроме того, митохондрии могут получать кальций через лизосомально-митохондриальные контакты [10.1073/pnas.2003236117], поэтому митохондрии также могут подвергаться влиянию лизосомного выброса Ca2+ после оптогенетического подщелачивания, что должно приводить к повышению производства АТФ [10.1134/S0006297919060026]. Важно отметить, что потеря функции TRPML1 приводит к лизосомному заболеванию муколипидоз IV типа (MLIV), при котором отсутствует лизосомально-митохондриальный обмен кальция и имеется ряд митохондриальных дефектов [10.1038/nature07311]. В связи с этим представляется заманчивым улучшить инструменты оптогенетики лизосом также с помощью кальциевого транспортера.
Поскольку локализация лизосом влияет и на эндоплазматический ретикулум [10.1126/SCIADV.ABC7209], можно предположить, что оптогенетическое подщелачивание лизосом имеет мультиорганельное воздействие (как минимум, лизосомы, митохондрии, ретикулум).
Чувствительность к питательным веществам и метаболическая адаптация/циркадные ритмы
В условиях ограничения калорий (среда HBSS) клетки имеют наиболее кислые лизосомы вблизи ядра [10.1083/JCB.201507112]. Это вызвано тем, что в этих условиях аутофагия является основным источником питательных веществ для клеток. Активность mTORC1 при голодании снижается [10.1038/ncb2204] до того момента, как аутофагическая деградация восстановит запас питательных веществ, что приведет к активации mTORC1, торможению аутофагии и отделению лизосом от аутофагосом [10.1038/nature09076]. mTORC1 активен на периферических лизосомах в условиях достаточного количества питательных веществ и неактивен в условиях гипоксии [10.1016/j.cell.2018.05.009]. В полной среде (DMEM-FBS, избыток питательных веществ) наиболее кислые лизосомы находятся на периферии клетки, что соответствует приоритету эндоцитоза и внеклеточного источника питательных веществ.
Активность mTORC1 связана с выходом аминокислот (АК) из лизосом, частично зависящим от активности V-АТФазы (рН-чувствительных АК-транспортеров) [10.1126/science.aan6298, 10.1016/j.celrep.2014.05.035], частично от рН-независимого SLC38A9 АК-транспортера (обзоры [10.1016/j.tcb.2014.03.003, 10.1134/S000629792004001X]). Комплекс V-АТФаза+Ragulator+Rag ("нутрисома") необходим для активации mTORC1, поэтому использование лигандов, избирательно ингибирующих образование такого комплекса путем модификации сайта связывания V-ATPase без влияния на закисление лизосом, может рассматриваться как дополнительный метод активации аутофагии [10.1038/s41589-019-0308-4]. Кроме того, pH лизосом контролирует эндоцитоз [10.1016/j.celrep.2014.05.035], поэтому кислая среда в люмене лизосом необходима для поглощения и восприятия питательных веществ в течение длительных периодов времени. Подщелачивание лизосом приводит к выходу Ca2+ из лизосом и эндоплазматического ретикулума, вызывая повышение концентрации цитозольного Ca2+ и действуя как стрессовый фактор, который ингибирует mTORC1 [10.1038/s41467-017-02332-3].
V-АТФаза является важным белком для регуляции mTORC1 [10.1126/science.1207056, 10.1016/j.cmet.2014.06.014], AMPK [10.1038/s41586-022-04431-8], процесса старения [10.1038/nchembio.2342]. Активность V-АТФазы контролируется обратимой диссоциацией субъединиц V0 и V1, на которую влияет концентрация питательных веществ, таких как глюкоза [10.1074/jbc.RA117.001327] и аминокислоты [10.1074/jbc.M115.659128]. Один из фундаментальных вопросов, который до сих пор требует разъяснения, - это как изменяется активность V-АТФазы при переходе клетки от состояния анаболизма к катаболизму. Например, ограничение калорий рассматривается и как активирующее [10.1074/jbc.ra120.013223, 10.1038/s41422-018-0080-0] и как ингибирующее [10.1016/j.cmet.2014.06.014, 10.1038/s41586-022-04431-8] V-АТФазу вмешательство. Оптогенетика с ее высоким временным разрешением может выявить каждый шаг метаболической адаптации, связанный с V-АТФазой.
В настоящее время принято считать, что подкисление лизосом скорее всего не требуется для активации mTORC1 [10.1016/j.tcb.2014.03.003, 10.1038/s41580-019-0199-y], и что только правильная конформация V-АТФазы необходима для образования комплекса нутрисомы. Однако есть аргументы в пользу того, что защелачивание или закисление лизосом может выключить mTORC1. Так, обработка хлорохином, приводящая к сильному защелачиванию лизосом, без прямого подавления V-АТФазы, вызывает инактивацию mTORC1 [10.1038/emboj.2012.32]. Более того, кислая среда через перемещение лизосом к периферии клетки (вероятно, связанное с их закислением и инактивацией TRPML1), вызывает инактивацию mTORC1 [10.1016/j.cell.2018.05.009]. Таким образом, с помощью оптогенетически управляемого закисления и защелачивания лизосом, не связанного с V-АТФазой, можно было бы прояснить ещё один фундаментальный вопрос - влияет ли непосредственно лизосомный рН на mTORC1.
Инактивация mTORC1 и последующая активация TFEB и PGC1a [10.1126/scitranslmed.3003799] может привести к аутофагии и биогенезу лизосом и митохондрий. Периодическое оптогенетическое подщелачивание лизосом могло бы послужить восстановлению циркадных ритмов активности mTORC1, ослабевающих по амплитуде в условиях стресса [10.1016/j.cell.2018.05.009] и старения [10.1038/ncb3107].
Третий фундаментальный вопрос, связанный с mTORC1, на который может помочь ответить оптогенетика лизосом, заключается в том, может ли mTORC1 управлять активностью V-АТФазы. Известно, что mTORC1 посредством изменения трансляции регулирует экспрессию V-АТФазы [10.1038/emboj.2011.257], но может ли ингибирование mTORC1 активировать V-АТФазу, как это делает ограничение калорий? Это неясно из-за положения mTORC1 ниже в сигнальном каскаде, чем комплекс нутрисомы, включающий V-АТФазу.
Падение концентрации АТФ, вызванное длительной активацией lyso-NsXeR и принудительным потреблением АТФ V-АТФазой, должно в конце концов приводить к энергетическому стрессу. В случае потребляющих много АТФ сенесцентных клеток (в том числе раковых клеток после химиотерапии цитостатиками) это может привести к гибели и окончательному избавлению от больных клеток [10.1038/nature12437].
Таким образом, подщелачивание лизосом с помощью оптогенетики может раскрыть различные аспекты клеточной сигнализации, связанной с питательными веществами. Пока V-АТФаза остается активной, оптогенетически опосредованное подщелачивание лизосом, не вызывающее ингибирования V-АТФазы, должно тормозить рН-зависимые АК-транспортеры, что позволит лучше выделить их влияние на активность mTORC1. Кроме того, зависимость канонической/неканонической активности AMPK [10.1080/15548627.2021.1933742], зависящей от V-АТФазы, можно измерить в условиях голодания, когда V-АТФаза ингибирована/активирована (на разных стадиях адаптации лизосом к голоданию), но лизосома кислая (от lyso-Arch3) или щелочная (от lyso-NsXeR). Такие временные и обратимые манипуляции с лизосомным рН могут помочь открыть новые свойства метаболической адаптации [10.1038/nrm3565] и в дальнейшем использовать их.
Раковые клетки и стресс-реакция: метаболическая перестройка
Повышение pH лизосом препятствует эндоцитозу железа, вызывает его дефицит в клетке с последующей стабилизацией гипоксического фактора транскрипции HIF1a даже в условиях нормоксии [10.7554/eLife.22693]. Истощение железа вызывает дисбаланс митохондрий и накопление активных форм кислорода (АФК) [10.1016/j.molcel.2020.01.003], усугубляемое невозможностью протекания митофагии в щелочных лизосомах (нарушение в лизосомально-митохондриальной оси). АФК помимо прочих эффектов, активируют TRPML1 [10.1038/ncomms12109], поэтому кальциевый стресс-ответ активируется во второй раз (первый раз непосредственно после защелачивания лизосом, вызывающей мультимеризацию TRPML1).
Длительное защелачивание лизосом, истощение железа и активация HIF1a вызовут метаболическую перестройку как при гипоксическом стрессе или онкотрансформации. Гликолиз подкисляет цитозоль до pH 6,5-7, что приостанавливает циркадные часы [10.1016/j.cell.2018.05.009]. Раковые клетки поддерживают щелочной цитозоль путем STAT3-опосредованной активации V-АТФаз лизосом и клеточной мембраны. Это приводит к сильно закисленным лизосомам [10.1038/s41422-018-0080-0]. Оптогенетическое подщелачивание лизосом в раковых клетках потенциально может стать средством борьбы с их инвазивностью [10.1016/j.ceb.2016.02.009, 10.1021/acsnano.8b08246].
В будущем, оптогенетика лизосом может быть перенесена на связанные с лизосомами органеллы [10.1038/nrm2745]. Поскольку подкисление требуется для функционирования различных клеточных органелл [10.1186/S12915-017-0395-1, 10.1034/J.1600-0854.2003.40201.X], оптогенетика, представленная здесь, может найти применение не только в лизосомах, но и в исследованиях клеточных функций и дисфункций, зависящих от рН других органелл. Это побуждает расширить оптогенетический инструментарий органелл другими ионными насосами и каналами.
Таким образом, оптогенетический контроль функции лизосом через регуляцию pH в широком диапазоне позволяет изучать широкий спектр фундаментальных клеточных функций, зависящих от лизосом. Более того, возможно применение данной технологии в диагностике и лечении заболеваний.
Существует большое количество патентов, касающихся создания прототипов лекарственных препаратов, в том числе противоопухолевых и антибактериальных, обладающих селективной цитотоксичностью за счёт защелачивания лизосом в быстро делящихся опухолевых клетках или обеспечивающих усиление антибактериального действия:
1. Препараты хлорохин, бафиломицин A1, аммоний хлорид, защелачивающие лизосомы, как адьюванты для бактерицидных агентов (https://patents.google.com/patent/US20180271952A1/en)
2. Хлорохин, защелачивающие лизосомы, как противоопухолевое средство (https://patents.google.com/patent/AU2014233757B2/en)
3. Комбинированные противоопухолевые стратегии лечения, включающие ингибирование аутофагии, в том числе защелачивание лизосом (https://patents.google.com/patent/TWI694837B/en)
Существует генетические конструкции для проведения оптогенетического защелачивания эндосом, органелл близких к лизосомам, с помощью родопсина ASRD217E [10.1016/j.neuron.2018.07.034].
В данной работе выбран более эффективный родопсин NsXeR [10.1126/sciadv.1603187] который доставляется в другую органеллу - лизосомы, руководящую аутофагией и эндоцитозом клетки.
Из данных отечественной и зарубежной литературы, патентов и патентных заявок авторам неизвестно, чтобы существовала конструкция родопсина таргетно экспрессирующаяся в лизосомах, обеспечивающая оптогенетическое защелачивание этих органелл.
Отличительным признаком изобретения являются: вставке гена NsXeR для светочувствительной протонной прокачки через липидную мембрану, комбинация родопсина с флуоресцентными белками, обеспечивающими детекцию pH лизосом, и лидерной последовательности для экспрессии данного родопсина в лизосомах.
Данное изобретение обеспечивает синтез родопсина NsXeR в лизосомах клеток млекопитающих с помощью временной трансфекции, а также возможность с помощью данного белка защелачивать лизосомы от pH 5 до pH 6 и ингибировать работу лизосомных протеолитических ферментов катепсинов.
Техническим результатом изобретения является возможность получения клеток с управляемыми светом процессами аутофагии, а также проведения функциональных тестов на таких клетках как моделях болезней, связанных с лизосомами.
Задачи заявляемого изобретения
Защелачивание лизосом.
Задачи решены путем
Направленная экспрессия белка родопсина NsXeR в лизосомах клеток млекопитающих.
Описание способа получения генетической конструкции заявляемого изобретения.
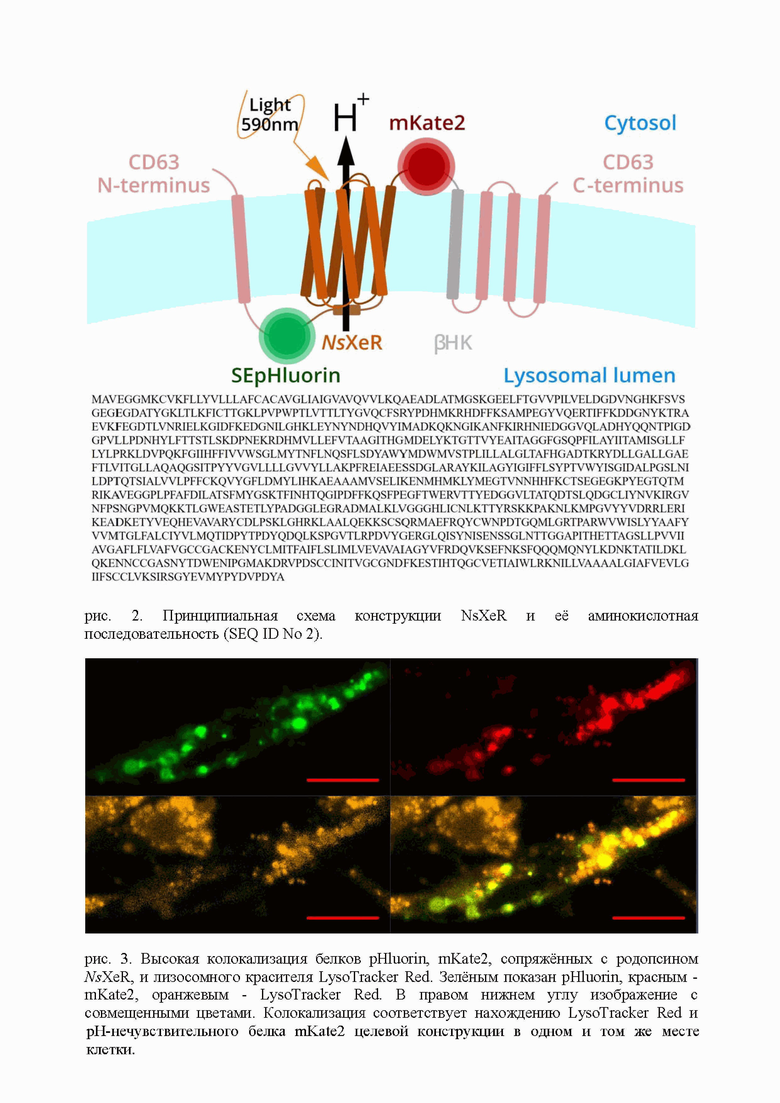
Плазмида pCMV-lyso-pHoenix были подарком от Christian Rosenmund (плазмида Addgene # 70112). Конструкции lyso-NsXeR получена по следующей процедуре. В pCMV-lyso-pHoenix плазмиде сайт рестрикции BsiWI заменяли сайтом рестрикции NotI с помощью ПЦР. Затем ген NsXeR [10.1126/sciadv.1603187] клонировали путем рестрикции с сайтами KpnI и NotI. Клонирование было подтвержено секвенированием ДНК. Для амплификации плазмиды использовался бактериальный копийный штамм E.coli, TOP10. Способ поясняется чертежами, где на рис. 1 представлена нуклеотидная последовательность генетической конструкции для экспрессии в лизосомах клеток млекопитающих родопсина NsXeR из организма наногалоархеон Nanosalina, позволяющего повышать pH лизосом и ингибировать работу лизосомных ферментов.
Крупным прямым шрифтом показан ген NsXeR, курсивом - гены флуоресцентных белков pHluorin (нежирным) и mKate2 (жирным). Подчёркнутым жирным прямым шрифтом показан ген лидерной лизосомной последовательности CD63, обрамляющей всю конструкцию. Подчёркнутым курсивом показана бета субъединица H+/K+-ATPase, обычным шрифтом - последовательность HA-Tag.
На рис. 2 представлена принципиальная схема конструкции NsXeR, цветом показаны ген NsXeR, гены флуоресцентых белков pHluorin и mKate2, лизосомные лидерные пептиды последовательностей. Также показана аминокислотная последовательность, кодирующая CD63-SEpHluorin-NsXeR-mKate2-bHK-CD63, требующаяся для защелачивания лизосом.
Схема построена при помощи vectr.com.
Полезность изобретения доказана применением конструкции для защелачивания лизосом.
Пример 1. Таргетирование в лизосомы клеток
Используя конструкцию lyso-NsXeR проведён ряд экспериментов, показывающих её практическую значимость.
Клетки человека HEK293T трансфецировались плазмидой (вектором), содержащей ген lyso-NsXeR. Через 48 часов клетки экспрессировали целевую конструкцию.
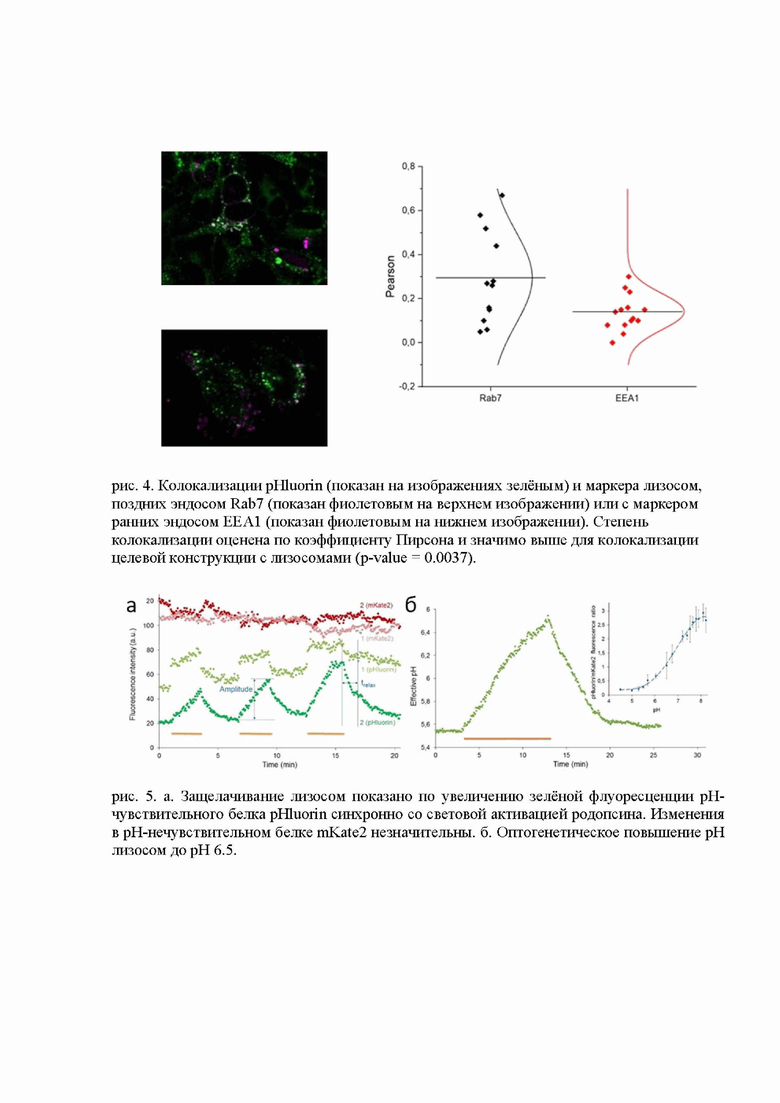
Используя конфокальную флуоресцентную микроскопию выявлено место нахождения целевого белка в клетке. Колокализация флуоресцентных меток pHluorin, mKate2, сопряжённых с родопсином, и лизосомотрофного красителя LysoTracker Red доказывает успешность доставки целевой белковой конструкции, содержащей pHluorin, mKate2 и NsXeR, в лизосомы (рис. 3). Также показано, что белок pHluorin из целевой конструкции даёт высокую колокализацию с белковым маркером лизосом Rab7, в то время как колокализация с белковым маркером ранних эндосом EEA1 значительно ниже (рис. 4).
Пример 2. Защелачивание лизосом клеток
Для подтверждения возможности защелачивания лизосом, клетки человека HEK293T трансфецировались плазмидой (вектором), содержащей ген lyso-NsXeR, и освещались светом с длиной волны 590нм, активирующим протонную прокачку родопсина. Данные конфокальной флуоресцентной микроскопии (рис. 5) показывают защелачивание лизосом по увеличению зелёной флуоресценции pH-чувствительного белка pHluorin синхронно со световой активацией родопсина. Отсутствие изменений флуоресценции в pH-нечувствительном белке mKate2 доказывает что движения лизосом не происходило и не может объяснить увеличения флуоресценции pHluorin. Калибровка флуоресценции pHluorin показывает, что оптогенетически можно добиться повышения pH лизосом на единицу.
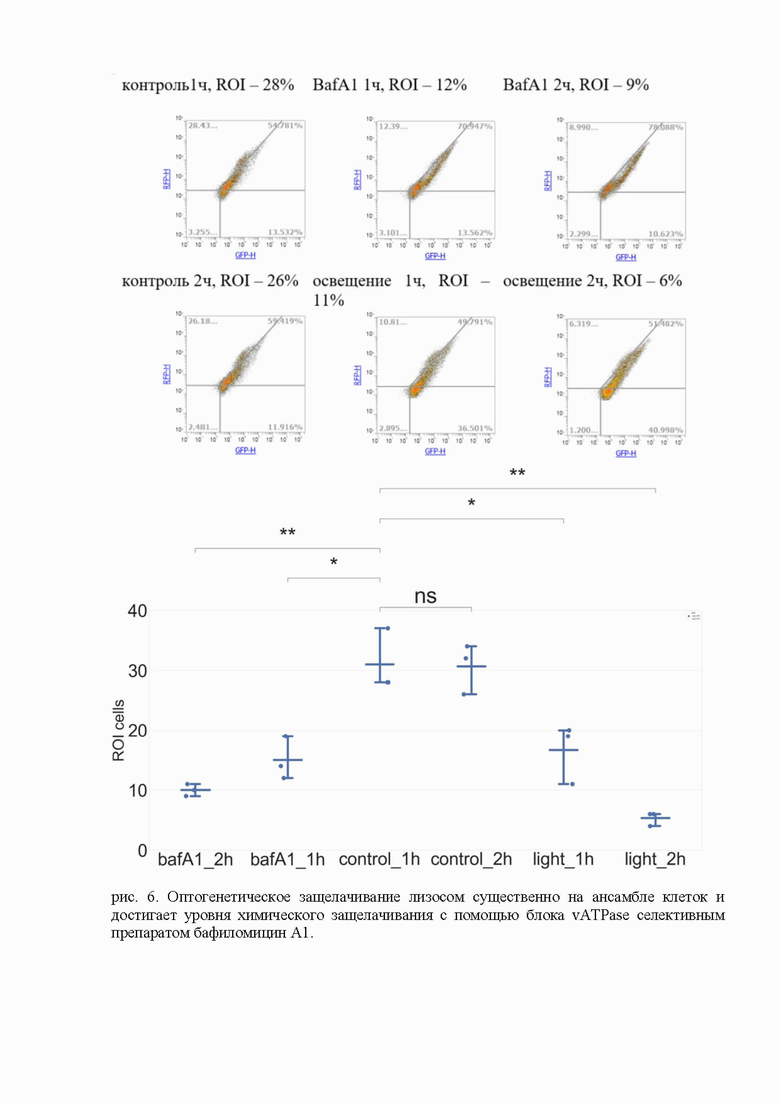
Данные проточной цитофлуориметрии (рис. 6) показывают, что оптогенетическое защелачивание лизосом существенно на ансамбле клеток и достигает уровня химического защелачивания с помощью блока vATPase селективным препаратом бафиломицин А1.
Пример 3. Защелачивание лизосом приводит к ингибированию протеолитического фермента
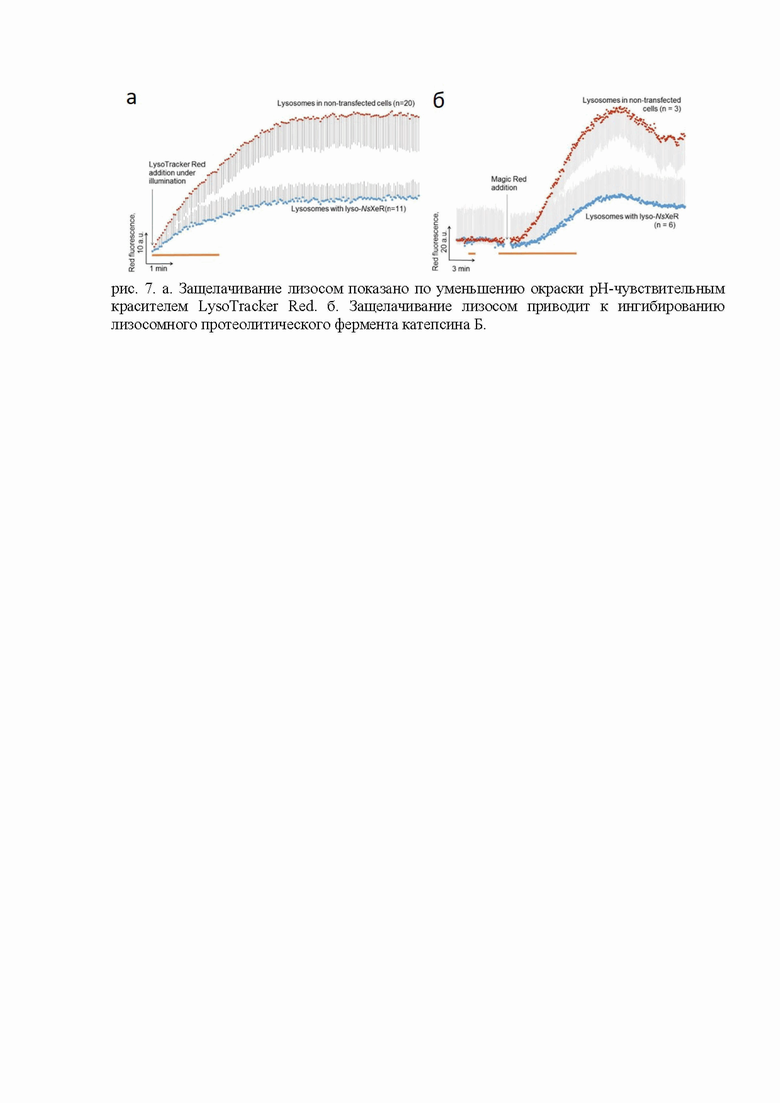
Защелачивание лизосом с помощью оптогенетики также подтверждено по ослаблению окрашивания лизосом, содержащих NsXeR, pH-чувствительной флуоресцентной краской LysoTracker Red (рис. 7а).
Подтверждением того, что оптогенетическое защелачивание лизосом действительно достигает значительных размеров, является ингибирование работы протеолитических лизосомных ферментов. Субстрат Magic Red-CTSB содержит пару аргининов, окружающих флуоресцентный краситель Crezyl violet (RR-Crezyl violet-RR). Активные катепсины Б селективно отщепляют аргинины, что приводит к росту флуоресценции Crezyl violet. Данные флуоресцентной микроскопии (рис. 7б) показывают, что катепсины Б слабее расщепляют субстрат Magic Red-CTSB в лизосомах с lyso-NsXeR при его активации светом. Таким образом, оптогенетическое ингибирование расщепления субстрата Magic Red-CTSB показывает возможность снижения активности лизосомных ферментов при помощи лизосомного NsXeR.
Заключение
Таким образом, создана генетическая конструкция для направления родопсина NsXeR в лизосомы клеток млекопитающих. Защелачивание достигнуто и приводит к ингибированию лизосомных ферментов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ HSP70 В КАЧЕСТВЕ РЕГУЛЯТОРА ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ | 2009 |
|
RU2521672C2 |
| ПРИМЕНЕНИЕ HSP70 В КАЧЕСТВЕ РЕГУЛЯТОРА ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ | 2009 |
|
RU2571946C2 |
| Способ экспериментальной биотерапии меланомы В16/F10 | 2022 |
|
RU2779698C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ РАКА | 2010 |
|
RU2575828C2 |
| СПОСОБ УПРАВЛЕНИЯ СЕКРЕЦИЕЙ ИНСУЛИНА β-КЛЕТКАМИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ПРИ ПОМОЩИ ТЕРМОГЕНЕТИКИ | 2022 |
|
RU2815935C1 |
| ИНГИБИТОР МИШЕНИ РАПАМИЦИНА В КЛЕТКАХ МЛЕКОПИТАЮЩИХ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2768583C2 |
| ИЗГОТОВЛЕНИЕ АКТИВНЫХ ВЫСОКОФОСФОРИЛИРОВАННЫХ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗ ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2510820C2 |
| СПОСОБ РЕГИСТРАЦИИ ВНУТРИКЛЕТОЧНОГО pH ОПУХОЛЕВЫХ КЛЕТОК | 2014 |
|
RU2565377C1 |
| Тест-система и способ выявления делеций гена SESN1 | 2021 |
|
RU2772504C1 |
| Способ формирования опухолевого роста в легких экспериментальных животных | 2023 |
|
RU2810431C1 |

Изобретение относится к области биотехнологии, в частности к новой генетической конструкции и продуцентам, обеспечивающим направленную экспрессию в лизосомах клеток млекопитающих, в том числе человека, родопсина NsXeR из организма наногалоархеон Nanosalina, пригодного к дальнейшим исследованиям функционирования клетки на молекулярном уровне с помощью флуоресцентной микроскопии и проточной цитофлуориметрии. Ген интереса оптимизирован под экспрессию в клетках млекопитающих и помещён в модифицированный плазмидный вектор pCMV. Модифицированный плазмидный вектор содержит ген устойчивости к антибиотикам NeoR/KanR, промотер вируса SV40, промотер цитомегаловируса CMV, точки начала репликации pUC ori, f1 ori, сигнальную последовательность вируса SV40. Изобретение позволяет получать клетки с управляемыми светом процессами аутофагии, а также проводить функциональные тесты на таких клетках, как модели болезней, связанных с лизосомами. 7 ил., 3 пр.
Генетическая конструкция с нуклеотидной последовательностью SEQ ID No 1 для защелачивания лизосом в клетках млекопитающих.
| WO 2018189247 A1, 18.10.2018 | |||
| SHEVCHENKO V | |||
| et al | |||
| Inward H+ pump xenorhodopsin: Mechanism and alternative optogenetic approach, Sci Adv., 2017, Vol | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ШЕВЧЕНКО В.А | |||
| Оптогенетические инструменты будущего, или как управлять мозгом с помощью света, Природа, 2019, Номер 5 (1245), стр | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WEISSBECKER J | |||
| et al | |||
| The Voltage Dependent | |||
Авторы
Даты
2024-06-14—Публикация
2023-08-11—Подача