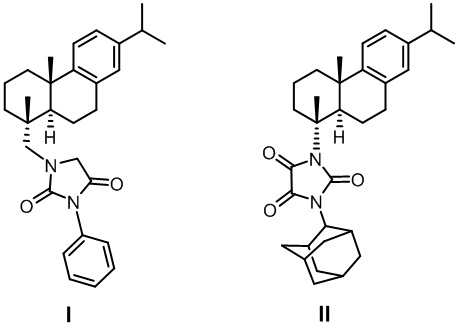
Изобретение относится к молекулярной биологии, биохимии, медицине и фармакологии, конкретно к соединениям I и II, являющимся производным смоляных кислот, у которых выявлена способность ингибировать миграцию клеток на перевиваемых клеточных линиях глиобластомы T98G и SNB-19.
Глиобластома (ГБМ) представляет собой наиболее часто встречающуюся и обладающую наивысшей, IV степенью злокачественности среди первичных опухолей мозга у взрослых, агрессивность которой в значительной степени определяется ее способностью к инвазии - активной инфильтрации отдельных злокачественных клеток или их групп в окружающую опухоль паренхиму головного мозга (Vollmann-Zwerenz, A., Leidgens, V., Feliciello, G., Klein, C. A., & Hau, P. (2020). Tumor Cell Invasion in Glioblastoma. International journal of molecular sciences, 21(6), 1932).
Современный стандарт лечения для пациентов с глиобластомой включает, по возможности, наиболее полную хирургическую резекцию опухоли, с последующей лучевой терапией и адъювантной химиотерапией темозоломидом, однако этот режим не обеспечивает длительной выживаемости пациентов (медиана которой составляет 12-15 месяцев с момента постановки диагноза, а 5-летняя выживаемость пациентов с ГБМ не превышает 5%). Как следует из сравнения значений медианы выживаемости пациентов, в режим которых включалась химиотерапия, по сравнению с этим же показателем пациентов, ее не получавших (14.6 месяцев и 12.2 месяца, соответственно), эффективность химиотерапии глиобластомы на сегодня является невысокой (Omuro A., DeAngelis L.M. (2013) Glioblastoma and other malignant gliomas: A clinical review. JAMA. 310, 1842-1850. doi: 10.1001/jama.2013.280319).
В то же время известно, что более чем у половины прооперированных пациентов с ГБМ достаточно быстро возникает рецидив опухоли непосредственно на месте расположения послеоперационной полости или в ее краевой зоне (не более 2 см от полости), а примерно у 20% пациентов развиваются удаленные, либо множественные рецидивы опухоли (Konishi, Y., Muragaki, Y., Iseki, H., Mitsuhashi, N., Okada, Y. (2012). Patterns of intracranial glioblastoma recurrence after aggressive surgical resection and adjuvant management: retrospective analysis of 43 cases. Neurol Med Chir (Tokyo), 52(8), 577-86. doi: 10.2176/nmc.52.577). Рецидивы ГБМ, являющиеся ключевой причиной низкой выживаемости прооперированных пациентов, связывают с процессами инвазии, в первом случае - обратной инвазии (реинвазии) клеток ГБМ, уже мигрировавших из первичной опухоли, обратно в зону послеоперационной полости, во втором - инвазией в удаленные от первичной опухоли участки мозга. Молекулярные и клеточные механизмы инвазии ГБМ сейчас активно исследуются in vitro и в животных моделях, однако, в клинической практике подходы к химеотерапии ГБМ, основанные на подавлении инвазии клеток этой опухоли, на сегодняшний день отсутствуют (Vollmann-Zwerenz, A., Leidgens, V., Feliciello, G., Klein, C. A., & Hau, P. (2020). Tumor Cell Invasion in Glioblastoma. International journal of molecular sciences, 21(6), 1932).
Инвазивность опухолевых клеток, лежащая в основе диссеминации первичного опухолевого процесса, в том числе, и при ГБМ, возможно оценить с помощью нескольких групп тестов для измерения миграционной способности/инвазивности клеток в культурах in vitro. При этом в экспериментальной биологии между миграцией и инвазией проводится формальная разница, заключающаяся в том, что миграция - это движение клеток в ответ на определенные стимулы в измерении 2D, то есть, по поверхности, а инвазия - это движение через 3D структуры (клеточного матрикса) с его ремоделированием (протеолитическим расщеплением), использованием его молекул в качестве субстрата для прикрепления, изменения формы опухолевых клеток для физического проникновения сквозь поры матрикса (Kramer, N., Walzl, A., Unger, C., Rosner, M., Krupitza, G., Hengstschläger, M., & Dolznig, H. (2013). In vitro cell migration and invasion assays. Mutation Research/Reviews in Mutation Research, 752(1), 10-24. doi:10.1016/j.mrrev.2012.08.001 ). Миграция является неотъемлемой чертой инвазивности, и миграционные тесты могут использоваться для оценки инвазивности конкретных клеточных культур или поиска химических соединений, способных эффективно подавлять этот процесс в разных типах опухолей. Самым простым из таких тестов является тест заживления раны/царапины (scratch assay/wound-healing assay), который был использован и нами для поиска новых перспективных веществ, способных подавлять миграцию клеток глиобластомы. В этом тесте, в культуре закрепляющихся клеток высокой (~90%) конфлуэнтности наносится вертикальная царапина стандартной ширины. Далее скорость закрытия царапины фиксируется несколько раз в течение 24 ч с помощью систем получения изображений клеточных культур, и эффективность (скорость) этого процесса определяется по полученным графикам. Проводя этот тест в присутствии исследуемых соединений и относя эффективность зарастания к контрольной величине, возможно определить влияние соединений на процесс миграции клеток ГБМ. Несколько более сложным является тест трансмиграции в лунке (в камере Бойдена), но результаты трансмиграционного теста и теста царапины, в целом, согласуются друг с другом (Kramer, N., Walzl, A., Unger, C., Rosner, M., Krupitza, G., Hengstschläger, M., & Dolznig, H. (2013). In vitro cell migration and invasion assays. Mutation Research/Reviews in Mutation Research, 752(1), 10-24. doi:10.1016/j.mrrev.2012.08.001 ).
Поскольку применение миграционного теста зарастания царапины производится с достаточно ограниченным набором клеточных линий (для ГБМ это перевиваемые линии глиобластомы человека U87MG, U251, LN229, SNB-19, T98G и глиобластомы крысы C6) и в относительно систематических условиях, это дает возможность сравнивать эффективность подавления миграции исследуемыми соединениями.
Ряд природных соединений показал значительную эффективность подавления миграции и инвазии клеток ГБМ в клеточных моделях in vitro, и, благодаря этой активности, некоторые из изученных веществ в значительной степени подавляли и прогрессию ГБМ на моделях лабораторных животных (Zhai, K., Siddiqui, M., Abdellatif, B., Liskova, A., Kubatka, P., Büsselberg, D. (2021). Natural Compounds in Glioblastoma Therapy: Preclinical Insights, Mechanistic Pathways, and Outlook. Cancers (Basel), 13(10), 2317. doi: 10.3390/cancers13102317).
Так, ксантофилловый каротеноид астаксантин, служащий красным пигментом у морских ракообразных, рыб и растений, и его промежуточный продукт, адониксантин, подавляют миграцию клеток глиобластомы (клеточной линии глиобластомы человека U251MG) на 21% и 26%, соответственно. При этом такая степень ингибирования достигалась в концентрациях обоих препаратов 10 мкМ, по сравнению c 15% ингибированием миграции клеток ГБМ стандартным референсным химиотерапевтическим препаратом, активным в отношении клеток глиобластомы, темозоломидом в концентрации 300 мкМ в таком же тесте подавления миграции, что применялся и для обоих каротеноидов. Цитотоксичность каротеноидов и темозоломида в указанных рабочих концентрациях была достаточно высокой и приводящей к гибели 30-35% обрабатываемой популяции клеток ГБМ (Tsuji, S., Nakamura, S., Maoka, T., Yamada, T., Imai, T., Ohba, T., Yako, T., Hayashi, M., Endo, K., Saio, M., Hara, H., Shimazawa, M. (2020). Antitumour Effects of Astaxanthin and Adonixanthin on Glioblastoma. Mar Drugs, 18(9), 474. doi: 10.3390/md18090474), в связи с чем сложно определить, является ли снижение миграции клеток результатом специфического ингибирования этого процесса движения клеток или же токсической гибели значительной доли клеток, способных к миграции в зону царапины.
Таким образом, наиболее близким к заявляемым соединениям - прототипом может считаться каротеноид астаксантин III (3,3'-дигидрокси-β-каротин-4,4'-дион), представляющий собой тетратерпен, состоящий из связанных линейной полиеновой цепи и двух концевых β-колец.
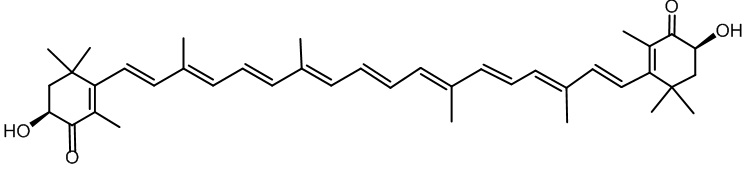 III
III
Недостатками известного соединения являются невысокая антиинвазивная активность в отношении клеточных линий глиобластомы.
Задачей изобретения является выявление новых эффективных агентов, обладающих антиинвазивными свойствами и способных снижать миграцию клеток на перевиваемых клеточных линиях глиобластомы. Технический результат: обнаружены соединения, способные в нецитотоксических концентрациях снижать способность клеток ГБМ перевиваемых линий к миграции (в тесте зарастания царапины) на 30 - 37%.
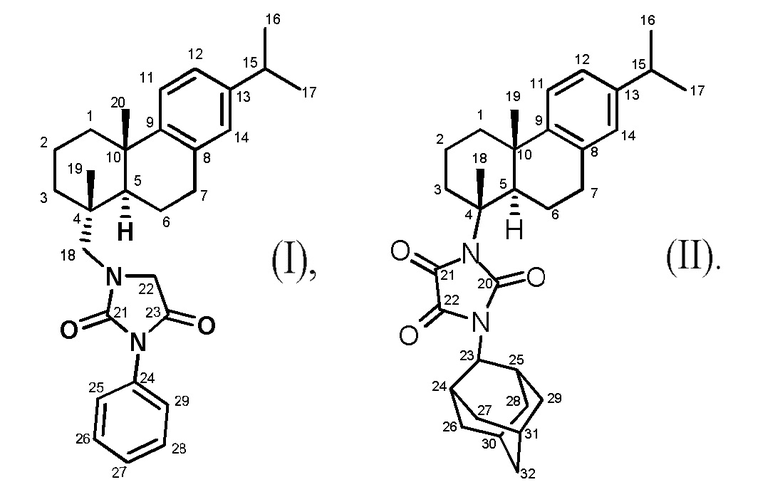
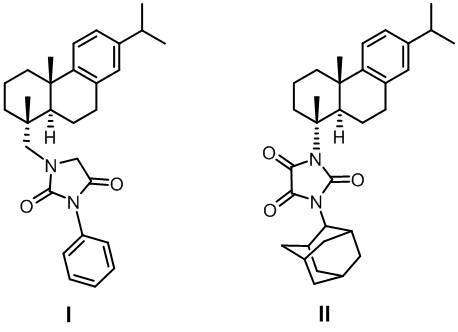
Поставленная задача решается применением новых производных смоляных кислот формулами I и II
 ,
,
у которых выявлена биологическая активность, заключающаяся в их способности снижать миграцию клеток на перевиваемых клеточных линиях глиобластомы T98G и SNB-19.
Ранее в литературе не было описано ни одного примера изучения активности синтетических производных смоляных кислот в качестве антиинвазивных агентов. Важность поиска новых антимиграционных средств именно среди природных соединений и их производных вызвана как значительным химическим разнообразием этих молекул, так и присущей многим природным соединениям комплементарностью к мишеням биологического происхождения. Кроме того, важным фактором является коммерческая доступность смоляных кислот. Исходными соединениями являются дегидроабиетиновая кислота и дегидроабиетиламин - дитерпеновый первичный амин, получаемый в промышленности из дегидроабиетиновой кислоты, содержащейся в живице хвойных деревьев. Важно отметить, что дегидроабиетиламин можно получать непосредственно из доступной живичной канифоли восстановлением нитрила дегидроабиетиновой кислоты.
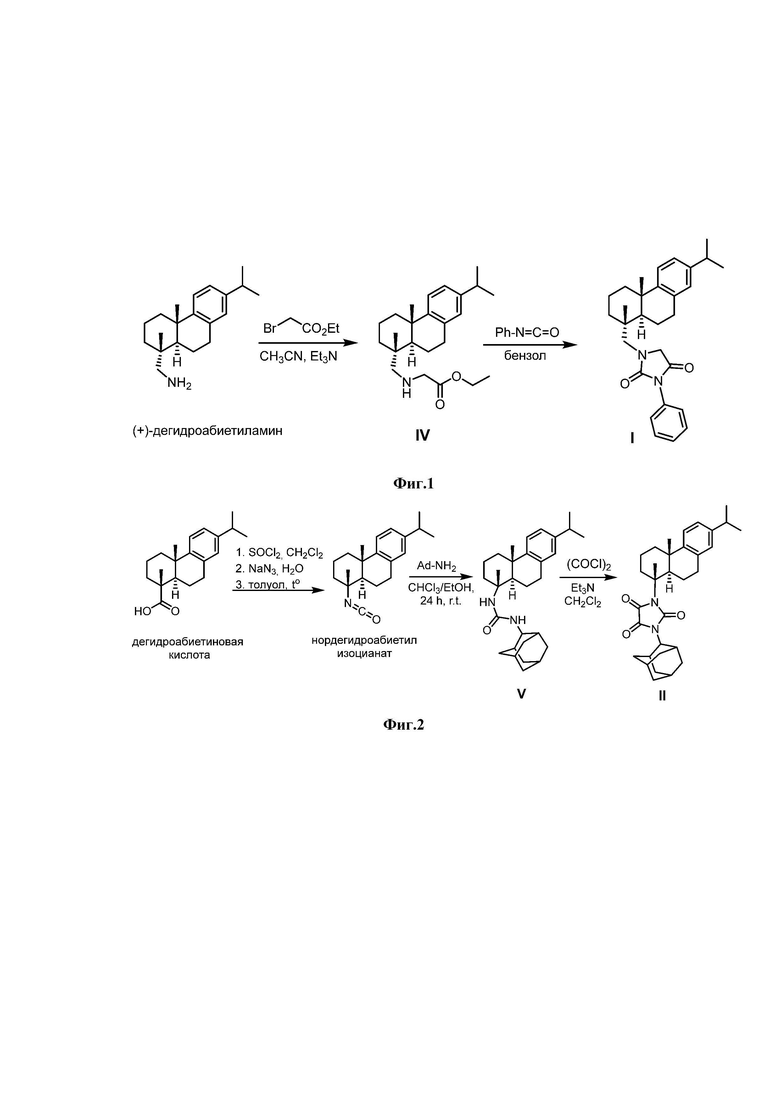
Синтез соединения I проводили в соответствии с Фиг. 1. Из (+)-дегидроабиетиламина, который может быть получен из природной дегидроабиетиновой кислоты по опубликованным методикам (Tao, P., Wu, C., Hao, J., Gao, Ya., He, X., Li, J., Shang, S., Song, Zh., Song, J. (2020), Journal of Agricultural and Food Chemistry, 68 (14), 4144-4154. DOI: 10.1021/acs.jafc.0c00562), получали соединение IV взаимодействием его с этилбромацетатом. Реакцию проводили по методике, ранее описанной в статье (Kovaleva, K., Mamontova, E., Yarovaya, O., Zakharova, O., Zakharenko, A., Lavrik, O., & Salakhutdinov, N. (2021). Dehydroabietylamine-based thiazolidin-4-ones and 2-thioxoimidazolidin-4-ones as novel tyrosyl-DNA phosphodiesterase 1 inhibitors. Molecular Diversity, 25(4), 2389-2397. https://doi.org/10.1007/s11030-020-10132-z). Соединение IV вводилось в реакцию с фенилизоцианатом, что в результате приводило к образованию целевого соединения I.
Соединение II синтезировали на основе дегидроабиетиновой кислоты согласно Фиг. 2. По описанной в литературе методике (Zeiss, H. H., & Martin, W. B. (1953) Synthesis and Stereochemistry of the 3-Keto-Δ4-steroidal System from Diterpenic Acids. Journal of the American Chemical Society, 75(23), 5935-5940. https://doi.org/10.1021/ja01119a045) из дегидроабиетиновой кислоты был получен нордегидроабиетил изоцианат. Синтез N-нордегидроабиетил-N'-2-адамантилмочевины V описан ранее в литературе (Kovaleva, K., Yarovaya, O., Ponomarev, K., Cheresiz, S., Azimirad, A., Chernyshova, I., Zakharenko, A., Konev, V., Khlebnikova, T., Mozhaytsev, E., Suslov, E., Nilov, D., Švedas, V., Pokrovsky, A., Lavrik, O., & Salakhutdinov, N. (2021). Design, Synthesis, and Molecular Docking Study of New Tyrosyl-DNA Phosphodiesterase 1 (TDP1) Inhibitors Combining Resin Acids and Adamantane Moieties. Pharmaceuticals, 14(5), 422. https://doi.org/10.3390/ph14050422).
Данные по цитотоксичности и эффективности ингибирования миграции заявляемыми соединениями - производными смоляных кислот I и II, приводятся в Таблице 1 и Таблице 2. Нами показано, что агенты I и II в концентрации GI15 7-15 мкМ ингибировали миграцию клеток ГБМ на 30-37% в обеих клеточных линиях.
Спектральные исследования выполнены в Химическом Сервисном Центре коллективного пользования СО РАН. Спектры ЯМР 1Н и 13С регистрировали на спектрометрах Bruker DRX-500 (1Н: 500.13 МГц, 13С: 125.76 МГц). В качестве внутреннего стандарта использовали остаточные сигналы растворителя - хлороформа (1H 7.24, 13С 76.90 м.д.). Отнесение сигналов в спектрах ЯМР проводилось с привлечением стандартных одномерных и двумерных экспериментов (COSY, HETCOR, COLOC, НМВС, HSQC). Нумерация атомов в соединениях дана для отнесения сигналов в спектрах ЯМР и не совпадает с нумерацией атомов в номенклатурном названии. Масс-спектры высокого разрешения записывали на спектрометре DFS ThermoScientific в режиме полного сканирования в диапазоне m/z 0-500, ионизация электронным ударом 70 эВ при прямом вводе образца. ИК-спектры записывали на спектрометре Vector22 (KBr). Температуру плавления измеряли с помощью прибора Termosystem FP 900 Mettler Toledo. Разделение продуктов реакций проводили с помощью колоночной хроматографии на силикагеле (60-200 μ, Masherey-Nagel).
Изобретение иллюстрируется следующими примерами:
Пример 1. Методика синтеза соединения I.
Соединение IV (0.3 г, 0.00135 моль) растворили в 30 мл бензола, добавили эквимолярное количество (0.00135 моль) фенилизоцианата. Реакционную смесь перемешивали 3 суток на магнитной мешалке, конверсию отслеживали методом тонкослойной хроматографии и хромато-масс спектроскопии. По завершении реакции промыли водным 10% раствором NaOH, растворитель упарили в вакууме. Продукт был выделен и очищен с помощью колоночной хроматографии на силикагеле, элюент CHCl3/MeOH (20:1).
1-(((1R,4aS,10aR)-7-изопропил-1,4a-диметил-1,2,3,4,4a,9,10,10a-октагидрофенантрен-1-ил)метил)-3-фенилимидазолидин-2,4-дион (I)
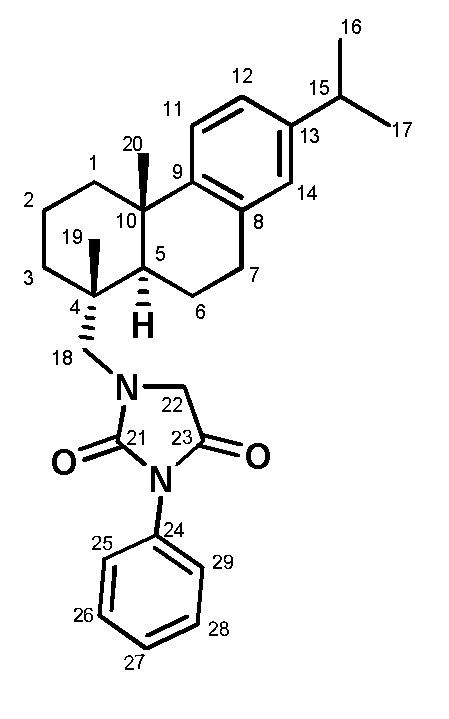
Белый порошок, выход 60%. Т. пл. 72.0°С. ЯМР 1H (500 МГц, CDCl3, δ, м.д., J/Гц): 6.89 (1H, д, J=1.7, H-14), 6.99 (1H, дд, J=8.1, J=1.7, H-12), 7.17 (1H, д, J=8.1, H-11), 7.28-7.46 (5H, м, H-25, H-26, H-27, H-28, H-29), 4.10 (2H, с, H-22), 3.25-3.74 (2H, м, H-18), 2.81 (1H, септ, J=6.9, H-15), 2.85-3.00 (2H, м, H-7), 2.28 (1H, д, J=13.0, H-1е), 1.88-2.00 (1H, м, H-5), 0.99 (3H, с, Me-19), 1.20 (6H, д, J=6.9, Me-16 и Me-17), 1.22 (3H, с, Me-20), 1.35-1.55 (4H, м, H-1а, H-6а, H-2a, H-2e), 1.65-1.86 (3H, м, H-6e, H-3a, H-3e). ЯМР 13C (125 МГц, CDCl3, δ, м.д.): 168.74 (C-23), 157.02 (C-21), 146.88 (C-9), 145.68 (C-13), 134.19 (С-8), 131.63 (C-24), 128.88 (C-26, C-28), 127.97 (C-27), 126.87 (C-14), 125.87 (C-25, C-29), 123.89 и 123.85 (C-11 и C-12), 18.79 (Me-19), 23.80 и 23.86 (Me-17 и Me-16), 25.35 (Me-20), 33.31 (C-15), 44.94 (C-5), 18.47 (C-2), 18.88 (C-6), 29.77 (C-7), 39.06 (C-4), 38.08 (C-1), 37.33 (C-10), 37.18 (C-3), 53.78 (С-18), 56.00 (C-22). ИК спектр, ν, см-1: 2927, 1719, 1454, 1416. Найдено, m/z: 444.2770 [M]+. (C29H36O2N2) +∙. Вычислено, m/z: 444.2771.
Пример 2. Методика синтеза соединения II.
Соединение V (0.2 г, 0.00045 моль) растворили в 30 мл CH2Cl2 с добавлением 0.4 мл триэтиламина. Добавляли по каплям оксалилхлорид (0.00225 моль, 0.285 г) при перемешивании на магнитной мешалке. Конверсию отслеживали по ТСХ. По завершении реакции промыли реакционную смесь дистилированной водой (3х20 мл), органический экстракт сушили над Na2SO4 прокаленным. После чего упарили растворитель на ротационном испарителе. Конечный продукт был очищен с помощью колоночной хроматографии на силикагеле, элюент гексан/этилацетат (9:1).
1-(2-Адамантил)-3-((1R,4aS,10aR)-7-изопропил-1,4a-диметил-1,2,3,4,4a,9,10,10a-октагидрофенантрен-1-ил)имидазолидин-2,4,5-трион (II)
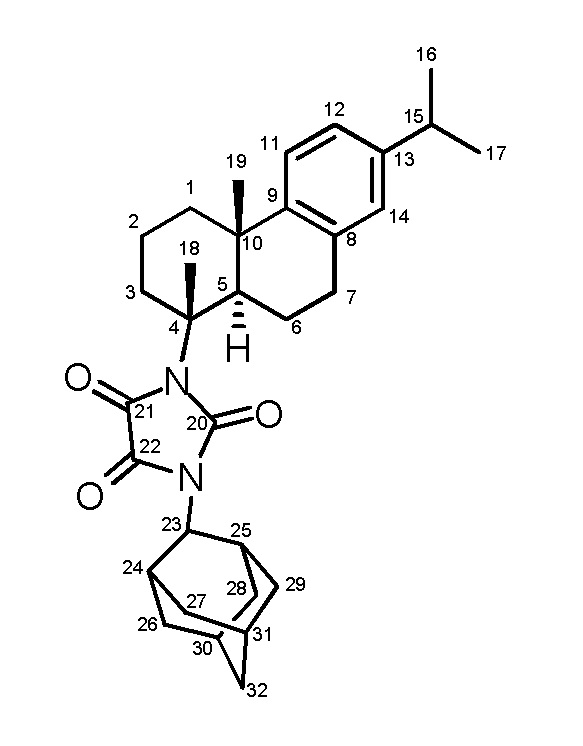
Белый порошок, выход 72%. Т. пл. 89.3°С. ЯМР 1H (500МГц, CDCl3, δ, м.д., J/Гц): 7.13 (1H, д, J=8.2, H-11), 6.98 (1H, дд, J=8.2, J=1.7, H-12), 6.85 (1H, д, J=1.7, H-14), 4.15 (1H, с уш., H-23), 2.73-2.89 (4H, м, H-5, H-15, 2H-7), 2.65-2.73 (1H, м, H-3), 2.48-2.55 (2H, м, H-24, H-25), 2.21-2.29 (1H, м, H-1), 2.06-2.13 (2H, м, H-26, H-28), 1.71-1.98 (12H, м, 2H-27, 2H-29, H-30, H-31, 2H-32, H-3, 2H-2, H-6), 1.76 (3H, с, Me-18), 1.64-1.71 (2H, м, H-26, H-28), 1.48-1.60 (2H, м, H-1, H-6), 1.22 (3H, с, Me-19), 1.20 (6H, д, J=6.9, Me-16 и Me-17). ЯМР 13C (125 МГц, CDCl3, δ, м.д.): 157.68, 155.77 и 155.52 (C-20, C-21 и C-22), 146.08 (C-9), 145.67 (C-13), 134.03 (С-8), 126.69 (C-14), 124.00 (C-11), 123.86 (C-12), 69.25 (C-4), 62.55 (С-23), 44.61 (C-5), 38.38 (C-10), 37.77 (C-27 и C-29), 37.11 (C-32), 36.75 (C-1), 35.12 (С-3), 33.26 (C-15), 32.43 и 32.48 (C-26 и C-28), 30.25 и 30.27 (C-24 и C-25), 29.52 (C-7), 27.07 и 26.37 (C-30 и C-31), 25.19 (Me-19), 23.79 (Me-17 и Me-16), 20.14 (Me-18), 19.84 (C-6), 19.06 (C-2). ИК спектр, ν, см-1: 2917, 1726, 1337. Найдено, m/z: 502.3188 [M]+. (C32H42O3N2) +∙. Вычислено, m/z: 502.3190.
Пример 3. Измерение цитотоксичности.
Цитотоксичность изучаемых соединений оценивали с помощью стандартного МТТ-теста (Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Meth., 65, 55-63.] путем колориметрического измерения количества формазана, конвертированного из 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия бромида (МТТ) клетками, подвергшимися воздействию соединения. Клетки культивировали в среде DMEM/F12, с 40 мкг/мл гентамицина, 100 ед/мл пенициллина, 0,1 мг/мл стрептомицина и 0,25 мкг/мл амфотерицина и в присутствии 10% эмбриональной бычьей сыворотки производства фирмы “Биолот” в атмосфере c 5% CO2. После формирования 50% монослоя в культуральную среду добавляли исследуемый препарат и контролировали пролиферацию клеточной культуры в течение 72 часов. В качестве контроля использовали клетки, культивируемые при соответствующей концентрации DMSO.
Для каждого соединения и для каждой из двух использованных клеточных линий ГБМ определялись величины 50% цитотоксичности (ингибирования роста), GI50%, и 15% цитотоксичности, GI15% (Таблица 1). Последнее значение концентраций изучаемых соединений использовалось в дальнейшем для подавления миграции клеток ГБМ в тесте зарастания царапины.
Таблица 1. Цитотоксический эффект соединений I и II в отношении клеток ГБМ человека линий SNB-19 и T98G.
Пример 4. Измерение клеточной миграции.
Эффективность подавления клеточной миграции изучаемыми соединениями оценивали с помощью теста заживления царапины.
Клетки перевиваемых линий ГБМ, SNB-19 и T98G, выращивали в пластиковых 6-луночных планшетах до достижения 100% плотности (конфлуэнтности) клеточного монослоя, после чего стандартная царапина шириной 700 мкм (ориентированная вертикально относительно лунки) наносилась кончиком пипетки (1000 мкл) в конфлуэнтном монослое). Лунки однократно промывали фосфатно-солевым буфером, а затем культивировали в среде с добавлением исследуемых веществ в концентрации ~ GI15% (0.5 мл на лунку 24-луночного планшета). Выбор концентрации, подавляющей метаболическую активность клеток не более чем на 15%, для этого типа анализа, определяется его желательными свойствами низкой цитотоксичности при значительной эффективности ингибирования зарастания царапины по сравнению с контролем.
Результаты экспериментов документировали и обрабатывали (производили измерение ширины царапины) с помощью системы анализа изображений клеток Paula (Leica). Изображения были получены в моменты времени 0, 6, 12, 18 и 24 часа с использованием объектива Neofuoar 0,3 (10×) и длины волны источника света 633 нм (Фиг. 3 Динамика зарастания царапины в монослое клеток ГБМ линий T98G и SNB-19 под действием соединения I (в концентрации GI15%) и Фиг. 4 Динамика зарастания царапины в монослое клеток ГБМ линий T98G и SNB-19 под действием соединения II (в концентрации GI15%)).
Количественный анализ ингибирования миграции исследуемыми соединениями проводили следующим образом: определялась средняя ширина царапины в каждой лунке через 0, 6, 12, 18 и 24 часа после начала эксперимента, обозначавшиеся как W0, W6, W12, W18, W24. Скорость зарастания на каждом отрезке времени определялась величина зарастания (в мкм), поделённая на 6 ч (длительность временного интервала) и выражалась в мкм/ч. Средняя скорость зарастания рассчитывалась как сумма скоростей на каждом интервале времени, поделённая на количество таких интервалов. При расчете средней скорости учитывались только те интервалы времени, в течение которых ни ширина царапины в контроле, ни таковая в присутствии исследуемых веществ не достигали нулевой величины (не зарастали полностью). В описанных экспериментах количество таких отрезков равнялось двум - от 0 до 6 и от 6 до 12 ч. Далее, скорость зарастания царапины в присутствии каждого из веществ нормировалась на скорость зарастания в контроле, давая величину относительной скорости зарастания. Принимая относительную скорость зарастания в контроле за единицу (100%) и вычитая из нее относительную скорость зарастания в присутствии каждого из веществ, получали величину ингибирования миграции (Таблица 2).
Таблица 2. Результаты ингибирования миграции клеток ГБМ линий T98G и SNB-19 под действием исследуемых веществ
| название | год | авторы | номер документа |
|---|---|---|---|
| 1,1'-(Гексан-1,6-диил)бис(3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы | 2019 |
|
RU2724882C1 |
| 1-Адамантил-3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы | 2019 |
|
RU2697409C1 |
| 7-ТРИАЗОЛИЛ-ЗАМЕЩЕННЫЕ ГИДРОКСИСПИРОСТАНЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2023 |
|
RU2798105C1 |
| Средство на основе производного арглабина, обладающее селективным цитотоксическим действием | 2023 |
|
RU2814738C1 |
| Производные арглабина, обладающие селективным цитотоксическим действием | 2023 |
|
RU2805915C1 |
| Средство на основе производного арглабина, обладающее селективным цитотоксическим действием | 2023 |
|
RU2814259C1 |
| КАРБОКСАМИДЫ ИЗОПИМАРОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2726613C1 |
| Новые пространственно-затрудненные фенолы, содержащие бензофуроксановые фрагменты, обладающие противоопухолевой активностью | 2022 |
|
RU2796810C1 |
| Бромсодержащие пространственно-затрудненные фенолы, обладающие противоопухолевой активностью | 2023 |
|
RU2822270C1 |
| Применение производных N-гидрокси-N-фенилбутандиамида в качестве ингибиторов металлопротеиназ в качестве соединений для противоопухолевой терапии и в качестве соединений с антиметастатической активностью | 2023 |
|
RU2836893C9 |


Изобретение относится к молекулярной биологии, биохимии, медицине и фармакологии, а именно к производным имидазолидин-2,4-диона и имидазолидин-2,4,5-триона, представляющим собой 1-(((1R,4aS,10aR)-7-изопропил-1,4a-диметил-1,2,3,4,4a,9,10,10a-октагидрофенантрен-1-ил)метил)-3-фенилимидазолидин-2,4-дион (I) и 1-(2-адамантил)-3-((1R,4aS,10aR)-7-изопропил-1,4a-диметил-1,2,3,4,4a,9,10,10a-октагидрофенантрен-1-ил)имидазолидин-2,4,5-трион (II). Технический результат – соединения формул (I) и (II), способные в нецитотоксических концентрациях снижать способность клеток ГБМ перевиваемых линий к миграции (в тесте зарастания царапины) на 30-37%. 4 ил., 2 табл., 4 пр.
1-(((1R,4aS,10aR)-7-изопропил-1,4a-диметил-1,2,3,4,4a,9,10,10a-октагидрофенантрен-1-ил)метил)-3-фенилимидазолидин-2,4-дион формулы I и 1-(2-адамантил)-3-((1R,4aS,10aR)-7-изопропил-1,4a-диметил-1,2,3,4,4a,9,10,10a-октагидрофенантрен-1-ил)имидазолидин-2,4,5-трион формулы II
 ,
,
проявляющие способность ингибировать миграцию клеток на перевиваемых клеточных линиях глиобластомы T98G и SNB-19.
| 1-Адамантил-3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы | 2019 |
|
RU2697409C1 |
| 1,1'-(Гексан-1,6-диил)бис(3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы | 2019 |
|
RU2724882C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛИДИН-2,4-ДИОНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2555999C2 |
| КОВАЛЕВА К.С | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ВСЕРОССИЙСКАЯ КОНФЕРЕНЦИЯ С МЕЖДУНАРОДНЫМ УЧАСТИЕМ "ИДЕИ И НАСЛЕДИЕ А.Е | |||
| ФАВОРСКОГО В ОРГАНИЧЕСКОЙ ХИМИИ", 03.06.2023, | |||
Авторы
Даты
2024-06-17—Публикация
2023-12-08—Подача