Изобретение относится к области органической химии и фармацевтике, в частности, к новым пространственно-затрудненным фенолам с фрагментами бензофуроксана, которые могут найти применение в качестве противоопухолевых средств в фармацевтике, медицине и ветеринарии.
В настоящее время онкологические заболевания - одна из самых серьезных проблем, стоящих перед человечеством, требующая разработки новых лекарств и методов лечения. Случаи совершенствования методов терапии онкологических заболеваний, приводящие к резкому улучшению результатов лечения, крайне редки, а большинство препаратов, применяемых для лечения рака, токсичны для организма в целом [Weber, G.F. DNA Damaging Drugs. Mol. Ther. Cancer 2014, 9-112, doi:10.1007/978-3-319-13278-5_2; Falzone, L.; Salomone, S.; Libra, M. Evolution of Cancer Pharmacological Treatments at the Turn of the Third Millennium. Front. Pharmacol. 2018, 9, 1300, doi:10.3389/fphar.2018.01300]. Среди противоопухолевых препаратов нового поколения перспективными являются препараты, способные избирательно вызывать гибель раковых клеток с минимальным токсическим действием по отношению к здоровым клеткам организма. Такая селективность может быть основана на избирательной индукции процессов гибели в раковых клетках: апоптоза, аутофагии или некроптоза.
Одной из стратегий противоопухолевой терапии является поиск препаратов и создание новых веществ направленного воздействия, в том числе вызывающих запуск процесса апоптоза по митохондриальному пути.
За последние 20 лет проведены многочисленные исследования о влиянии и участии митохондрий в регуляции запрограммированной гибели клеток [Wallace, D. Mitochondrial DNA in evolution and disease. Nature, 2016, 535, 498; Франциянц, Е.М.; Нескубина, И.В. Е.А. Шейко, Е.А. Митохондрии трансформированной клетки как мишень противоопухолевого воздействия. Исследования и практика в медицине 2020, 7, №2, 92]. Накопленные в последнее время данные указывают на роль митохондрий в метастазировании и распространении раковых клеток [Denisenko, T.V.; Gorbunova, A.S.; Zhivotovsky, B. Mitochondrial Involvement in Migration, Invasion and Metastasis. Front. Cell Dev. Biol. 2019, 7, Article 355; Battogtokh, G.; Choi, Y.S.; Kang, D.S.; Park, S.J.; Shim, M.S.; Huh, K.M; et al. Mitochondria-targeting drug conjugates for cytotoxic, anti-oxidizing and sensing purposes: current strategies and future perspectives. Acta Pharm Sin B. 2018, 8(6), 862. https:// doi.org/10.1016/j.apsb.2018.05.00].
Исследованиями доказано, что при росте опухолей и при многих других заболеваниях имеет место избыточное образование активных форм кислорода через повреждение ДНК и других биомолекул [Gonzalez, Frank J. Role of cytochromes P450 in chemical toxicity and oxidative stress: studies with CYP2E1, Mutation Research, Fundamental and Molecular Mechanisms of Mutagenesis (2005), 569(1-2), 101-110; Halliwell, Oxidative stress and cancer: have we moved forward? Biochem. J. 401 (2007) 1-11]. Антиоксиданты рассматривают, как важные факторы для лечения и профилактики рака, и разумно предположить, что соединения с функционализированными группами, обладающие антиоксидантными свойствами, могут быть полезны в качестве новых противоопухолевых лекарственных средств. Пространственно-затрудненные фенолы являются биомиметиками природного антиоксиданта α-токоферола (витамина Е) и представляют класс известных фенольных антиоксидантов, способных замедлять процессы пероксидного окисления липидов и снижать окислительный стресс организма. Известны оловоорганические соединения, содержащие пространственно-затрудненные фенольные фрагменты, эффективно ингибирующие индуцированное перекисное окисление липидов митохондрий и обладающие высокой противоопухолевой активностью [Milaeva, E.R.; Shpakovsky, D.B.; Gracheva, Y.A.; et al. Some insight into the mode of cytotoxic action of organotin compounds with protective 2,6-di-tert-butylphenol fragments. J. Organomet. Chem. 2015, 782, 96].
Пространственно-затрудненные фенолы - бис(3,5-ди-трет-бутил-4-гидрокси-фенилтиолат)диметилолова [RU2762730, опубл. 22.12.2021] и 3,5-ди-трет-бутил-4-гидроксифенилтиолат)трифенилолова [RU2765955, опубл. 07.02.2022] известны в качестве средств для ингибирования метастазирования меланомы и эпидермоидной карциномы Lewis в легких.
Апомин, бисфосфонатное производное пространственно-затрудненного фенола вызывает апоптоз в линиях опухолевых клеток, полученных из лейкоза, рака толстой кишки, печени, яичников и груди [Edwards, C.M.; Mueller, G.; Roelofs, A.J.; et al. Apomine™, an inhibitor of HMG-CoA-reductase, promotes apoptosis of myeloma cells in vitro and is associated with a modulation of myeloma in vivo. Int. J. Cancer. 2007, 120, 1657].
Тирфостин AG17 - (3,5-ди-трет-бутил-4-гидроксибензилиден)-малононитрил может частично изменять митохондриальную функцию и использоваться как потенциально полезный механизм модуляции пролиферации опухолевых клеток [Burger, A.M.; Kaur, G.; Alley, M.C.; et al. Tyrphostin AG17, [(3,5-di-tert-butyl-4-hydroxybenzylidene)-malononitrile], inhibits cell growth by disrupting mitochondria. Cancer Res. 1995, 55, 2794].
Пространственно-затрудненный фенол Анфен натрия оказался перспективным противоопухолевым препаратом, вызывающим торможение опухолевого процесса саркомы 37 и апоптоз в клетках карциномы Льюис, который начинался со снижения уровня антиапоптозного белка Вcl-2 в суспензии опухолевых клеток [Миль, Е.М.; Ерохин, В.Н.; Бинюков, В.И.; Албантова, А.А.; Володькин, А.А.; Голощапов, А.Н. Апоптотическое действие антиоксиданта анфена натрия в сочетании с H2O2 на опухолевые клетки карциномы Льюис. Известия Академии наук. Серия химическая 2019, № 12, 2359].
Таким образом, предшествующий уровень техники показывает, что соединения, содержащие в своей структуре пространственно-затрудненные фенолы, являются перспективными в качестве противоопухолевых средств, инициирующих митохондриальный путь апоптоза раковых клеток.
За последние десятилетия изучено и описано огромное количество производных бензофуроксанов, которые проявляют широкий спектр биологической активности [Jovené, C.C.; Chugunova, E.A.; Goumont, R. The properties and the use of substituted benzofuroxans in pharmaceutical and medicinal chemistry: A comprehensive review. Mini-Reviews Med. Chem. 2013, 13, 1089-1136, doi:10.2174/1389557511313080001]. C тех пор, как впервые были описаны противоопухолевые свойства некоторых бензофуроксанов [Ghosh PB, Whitehouse MW. Potential antileukemic and immunosuppressive drugs. Preparation and in vitro pharmacological acitivity of some benzo-2,1,3-oxadiazoles (benzofurazans) and their N-oxides (benzofuroxans). J Med Chem. 1968;11(2):305-311], многие производные бензофуроксана были протестированы в отношении клеточных линий рака человека в качестве цитотоксических соединений [Kessel D, Belton JG. Effects of 4-nitrobenzofurazans and their N-oxides on synthesis of protein and nucleic acid by murine leukemia cells. Cancer Res. 1975;35(12):3735-3740]. Некоторые соединения обладали значительной активностью в отношении лимфатической лейкемии P388 и асцитной карциномы Эрлиха у мышей. Было показано, что производные бензофуроксана ингибируют рост клеток М-HeLa in vitro [Belton JG, Conalty ML, O’Sullivan JF. Anticancer agents-XI. Antitumour activity of 4-amino-7-nitrobenzofuroxans and related compounds. Proc R Ir Acad B. 1976;76(9):133-149].
Введение фосфорсодержащего фрагмента в противоопухолевые препараты обеспечивает достаточно эффективный транспорт через клеточные мембраны. В исследованиях [Hochdörffer, K.; Abu Ajaj, K., Schäfer-Obodozie, C.; Kratz, F. Development of novel bisphosphonate prodrugs of doxorubicin for targeting bone metastases that are cleaved pH dependently or by cathepsin B: synthesis, cleavage properties, and binding properties to hydroxyapatite as well as bone matrix. J. Med. Chem. 2012, 55, 7502. Orsini, F.; Sello, G.; Sisti, M. Aminophosphonic acids and derivatives. Synthesis and biological applications. Curr. Med. Chem. 2010, 17, 289. Huang, X.; Huang, R.; Gou, S.; Wang, Z.; Wang, H. Anticancer platinum (IV) prodrugs containing monoaminophosphonate ester as a targeting group inhibit matrix metalloproteinases and reverse multidrug resistance. Bioconjug. Chem. 2017, 28, 1305] было показано, что введение фрагментов фосфатного эфира или бисфосфонатного эфира в противораковые агенты (например, цисплатин, камптотецин и доксорубицин) может эффективно улучшать противоопухолевую активность и растворимость лекарств.
Соединения, содержащие в своей структуре пространственно-затрудненные фенолы, фосфорсодержащие и бензофуроксановые фрагменты, обладающие противоопухолевой активностью, не известны заявителю из уровня техники.
Техническая проблема, на решение которой направлено заявляемое изобретение, состоит в расширении ассортимента противоопухолевых средств, инициирующих и реализующих апоптоз по митохондриальному пути.
Техническим результатом являются новые противоопухолевые средства, расширяющие арсенал средств указанного назначения, способные эффективно приводить к апоптозу по внутреннему митохондриальному пути, тем самым подавляя рост раковых клеток.
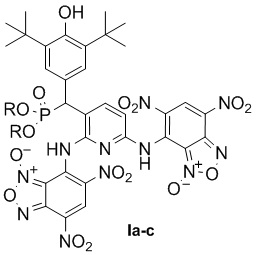
Указанная техническая проблема решается, и технический результат достигается новыми соединениями - заявляемыми пространственно-затрудненными фенолами, содержащими бензофуроксановые фрагменты, общей формулы I
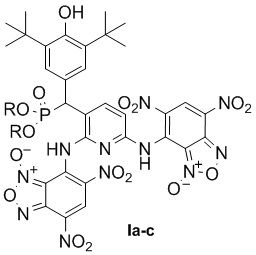 ,
,
где R = Me (a), iPr (b), Ph (c).
Техническая проблема также решается, и технический результат достигается применением заявляемых пространственно-затрудненных фенолов, содержащих бензофуроксановые фрагменты общей формулы I, в качестве соединений, обладающих противоопухолевой активностью.
Заявляемые соединения общей формулы I получают по методике, аналогичной описанной в статье [Design of novel 4-aminobenzofuroxans and evaluation of their antimicrobial and anticancer activity / E. Chugunova, A. Gazizov, M. Sazykina, N. et al. // International Journal of Molecular Sciences, 2020, 21(21), 8292; https://doi.org/10.3390/ijms21218292] по схеме:
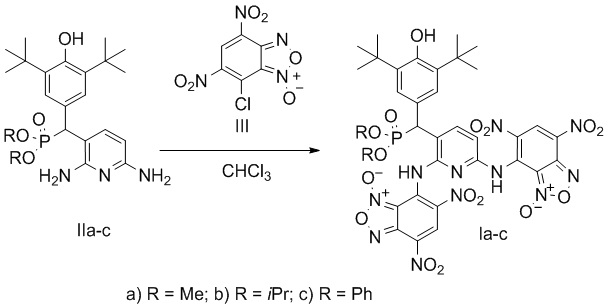
взаимодействием при эквимольном соотношении пространственно-затрудненного фенола (IIа-с) с 7-хлоро-4,6-динитробензофуроксаном (III) в хлороформе при комнатной температуре при постоянном перемешивании до образования осадка. Далее продукт выделяют известными методами. Получают продукт в виде порошка красно-бордового цвета с выходом 78-91%. Контроль прохождения реакции проверяют методом тонкослойной хроматографии, элюент толуол-этилацетат, 2:1.
Характеристики новых соединений формулы I приведены в соответствующих примерах, иллюстрирующих изобретение.
Исходные производные пространственно-затрудненного фенола (IIа-с) получают по методике (E. Gibadullina, T.T. Nguyen, A. Strelnik, A. Sapunova, A. Voloshina, I. Sudakov, A. Vyshtakalyuk, J. Voronina, M. Pudovik, A. Burilov, New 2,6-diaminopyridines containing a sterically hindered benzylphosphonate moiety in the aromatic core as potential antioxidant and anti-cancer drugs, Eur. J. Med. Chem. 184 (2019) 1117352).
Исходное соединение 7-хлоро-4,6-динитробензофуроксан (III) получают по методике (W.P. Norris, A. Chafin, R.J. Spear, R.W. Read, Synthesis and thermal rearrangement of 5-chloro-4,6-dinitrobenzofuroxan, Heterocycles 22 (1984) 271-274).
При получении и выделении заявляемых соединений используют коммерчески доступные растворители: хлороформ (База №1 ООО «Химреактив», Москва, Россия, чистота >99,5%), гексан (ООО «Компонент-Реактив», Москва, Россия, чистота >99%), диэтиловый эфир (ООО «Кузбассоргхим», Кемерово, Россия, чистота >99,5%), дистиллированная вода (полученная методом дистилляции на дистилляторе ДЭ-10, модель 789, соответствующая ФС 42-2619-97 «Вода очищенная» и ГОСТ 6709-72 «Вода дистиллированная»).
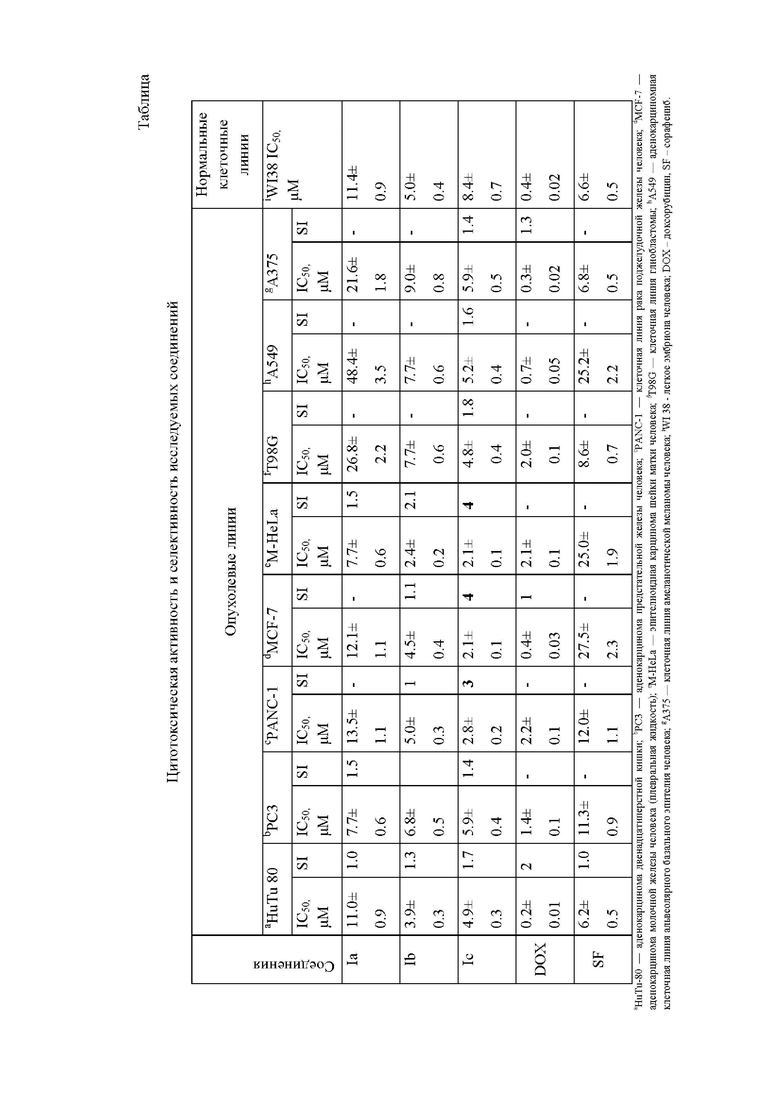
Заявленные соединения исследованы на цитотоксичность в отношении нормальных клеток линии эмбриона легкого человека (WI38) и в отношении раковых клеточных линий (Таблица). Предлагаемые соединения проявляют активность в отношении раковых линий:
М-HeLa клон 11 (эпителиоидная карцинома шейки матки, сублиния HeLa, клон M-HeLa);
T 98G - глиобластома человека;
PANC-1 - карцинома поджелудочной железы человека;
HuTu 80 - аденокарцинома двенадцатиперстной кишки человека;
MCF7 - аденокарцинома молочной железы человека (плевральная жидкость);
A549 - карцинома легкого человека;
PC3 - клеточная линия аденокарцинома предстательной железы;
WI38 - VA 13 subline 2RA -легкое эмбриона человека;
A 375 - меланома кожи человека.
Цитотоксическое действие заявляемых соединений в отношении раковых и нормальных клеточных линий оценивают в сравнении с действием известных, применяемых в настоящее время, противоопухолевых препаратов Доксорубицин и Сорафениб по значению IC50 - концентрации полумаксимального ингибирования исследуемого соединения, которая вызывает гибель 50% клеток в тестируемой популяции [Smolobochkin A.V., Gazizov A.S., Yakhshilikova L.J., Bekrenev D.D., Burilov A.R., Pudovik M.A., Lyubina A.P., Amerhanova S. K. and Voloshina A.D. Synthesis and Biological Evaluation of Taurine-Derived Diarylmethane and Dibenzoxanthene Derivatives as Possible Cytotoxic and Antimicrobial Agents. // Chem. Biodiversity. 2022. Vol. 19. e202100970. 10.1002/-cbdv.202100970]. Расчет IC50, концентрации тестируемого соединения, вызывающей подавление роста клеток на 50%, производился с помощью программы: MLA - «Quest Graph ™ IC50 Calculator». AAT Bioquest, Inc, 23 December, 2021, https://www.aatbio.com/tools/ic50-calculator, дата обращения 18.10.2022. Данные по цитотоксической активности (IC50) и селективности (SI) заявляемых средств и препаратов сравнения представлены в таблице.
Цитотоксическая активность заявляемых соединений продемонстрирована на культурах опухолевых клеток, полученных из Федерального государственного бюджетного учреждения науки «Институт цитологии Российской академии наук»:
М-HeLa клон 11 (эпителиоидная карцинома шейки матки, сублиния HeLa, клон M-HeLa);
T 98G - глиобластома человека;
PANC-1 - карцинома поджелудочной железы человека;
HuTu 80 - аденокарцинома двенадцатиперстной кишки человека;
MCF7 - аденокарцинома молочной железы человека (плевральная жидкость);
A549 - карцинома легкого человека;
PC3 - клеточная линия аденокарцинома предстательной железы из ATCC (American Type Cell Collection, USA; CRL 1435);
WI38 - VA 13 subline 2RA - легкое эмбриона человека из коллекции Института цитологии РАН (Санкт-Петербург);
A 375 - меланома кожи человека из клеточного репозитория CLS Cell Lines Service (Германия).
Значения таблицы свидетельствуют, что заявленные соединения проявляют цитотоксичность в отношении всех вышеуказанных опухолевых клеток.
Так, значения концентрации полумаксимального ингибирования (IC50) составили в отношении:
- аденокарциномы двенадцатиперстной кишки HuTu-80 для Ia - 11,0 μМ, Ib - 3,9 μМ, Iс - 4,9 μМ; для препаратов сравнения Доксорубицина (DOX) и Сорафениба (SF) - 0,2 и 6,2 μМ соответственно,
- клеточной линии аденокарциномы предстательной железы человека PC3 для Ia - 7,7 μМ, Ib - 6.8 μМ, Iс - 5,9 μМ, для DOX и SF - 1,4 и 11,3 μМ соответственно,
- клеточной линии рака поджелудочной железы человека PANC-1 для Ia - 13,5 μМ, для Ib - 5,0 μМ, для Iс - 2,8 μМ, для DOX и SF - 2,2 μМ и 12,0 μМ соответственно,
- культуры клеток линии аденокарциномы молочной железы MCF-7 для Ia - 12,1 μМ, для Ib - 4,5 μМ, для Iс - 2,1 μМ, для DOX и SF - 0,4 μМ и 27,5 μМ соответственно,
- карциномы шейки матки М-HeLa для Ia - 7,7 μМ, для Ib - 2,4 μМ, для Iс - 2,1 μМ, для DOX и SF - 2,1 μМ и 25,0 μМ соответственно,
- клеточной линии глиобластомы T98G для Ia - 26,8 μМ, для Ib - 7,7 μМ, для Iс - 4,8 μМ, для DOX и SF - 2,0 μМ и 8,6 μМ соответственно,
- аденокарциномы клеточной линии альвеолярного базального эпителия человека A549 для Ia - 48,4 μМ, для Ib - 7,7 μМ, для Iс - 5,2 μМ, для DOX и SF - 0,7 μМ и 25,2 μМ соответственно,
- клеточной линии амеланотической меланомы человека A375 для Ia - 21,6 μМ, для Ib - 9,0 μМ, для Iс - 5,9 μМ, для DOX и SF - 0,3 μМ, и 6,8 μМ соответственно.
Среди заявляемых соединений выявлено соединение Ic - соединение-лидер, продемонстрировавший в отношении ряда линий клеток - рака поджелудочной железы человека (PANC-1), аденокарциномы молочной железы (MCF-7) и карциномы шейки матки человека (M-HeLa) - активность на уровне и превосходящую препараты сравнения Доксорубицин и Сорафениб.
Селективность соединений в отношении раковых клеток является важным критерием оценки цитотоксического действия. Для ее оценки рассчитывают индекс селективности (SI) как отношение между значением IC50 для нормальных клеток и значением IC50 для раковых клеток. Соединения с SI≥3 можно считать селективными [M. Ayoup, Y. Wahby, H. Abdel-Hamid, E. Ramadan, M. Teleb, M. Abu-Serie, A. Noby, Design, synthesis and biological evaluation of novel a-acyloxy carboxamides via Passerini reaction as caspase 3/7 activators, Eur. J. Med. Chem. 168 (2019) 340-356. DOI: 10.1016/j.ejmech.2019.02.051].
Значения концентрации полумаксимального ингибирования (IC50) нормальных клеток печени эмбриона легкого человека WI38 составили для Ia - 11,4 μМ, для Ib - 5.0 μМ, для Ic - 8,4 μМ, для препаратов сравнения DOX и SF - 0,4 μМ, и 6,6 μМ соответственно. Данные показывают, что все заявляемые соединения проявляют активность только в значительных концентрациях в отношении культуры клеток печени эмбриона легкого человека WI38.
Значения селективности (SI) для заявленных соединений составили в отношении:
- аденокарциномы двенадцатиперстной кишки (HuTu-80) для Ia - 1,0, для Ib - 1,3, для Iс - 1,7, для DOX и SF - 2,0, и 1,0 соответственно,
- клеточной линии аденокарциномы предстательной железы человека (PC3) для Ia - 1,5, для Iс - 1,4, для остальных - ниже единицы (<1),
- клеточной линии рака поджелудочной железы человека (PANC-1) для Ib - 1,0, для Iс - 3,0, для остальных - ниже единицы (<1),
- аденокарциномы молочной железы (MCF-7) для Ib - 1,1, для Iс - 4,0, для остальных - ниже единицы (<1),
- карциномы шейки матки (М-HeLa) для Ia - 1,5, для Ib - 2,1, для Iс - 4,0, для остальных - ниже единицы (<1),
- культуры клеток линии глиобластомы (T98G) для Iс - 1,8, для остальных - ниже единицы (<1),
- аденокарциномы клеточной линии альвеолярного базального эпителия человека (A549) для Iс - 1,6, для остальных - ниже единицы (<1),
- культуры клеток линии амеланотической меланомы человека (A375) для Iс - 1,4, для DOX - 1,3, для остальных - ниже единицы (<1).
Значения таблицы свидетельствуют, что заявляемые соединения проявляют селективность и в этом превосходят препараты сравнения Доксорубицин и Сорафениб. Соединение-лидер Ic показал наилучшую селективность по отношению к клеточным линиям PANC-1, MCF-7 и M-HeLa. Значения SI для этих линий составили (2-4). Препараты сравнения Доксорурицин и Сорафениб значительно уступают по селективности ведущему соединению.
Способность исследуемого соединения вызывать разрушение эритроцитов крови человека иллюстрирует его токсическое действие на внутреннюю среду организма. Анализ гемолиза является простым скрининг-тестом, результаты которого могут помочь при изучении цитотоксичности на более сложных моделях.
Заявляемые соединения Iа-c не обладают гемолитической активностью, не способны разрушать эритроциты крови человека. Данные гемолитической активности [Amerhanova S., Voloshina A., Sapunova A., Lyubina А., Mikhailov V., Mirgorodskaya A., Zakharova L. Mitochondria-targeted Dicationic Imidazolium Surfactants.// European Journal of Clinical Investigation. - 2021. - Vol. 51. - P. 36] характеризуются значениями HC50 (концентрация исследуемого соединения, которая вызывает гемолиз 50% эритроцитов в опыте). Полученные значения (HC50>100 μM) (для дальнейших исследований представляют интерес соединения, гемолиз которых не превышает 50%) подтверждают, что соединения не обладают гемолитической активностью, т.е. заявляемые соединения не способны разрушать эритроциты крови человека, что свидетельствует об их нетоксичности.
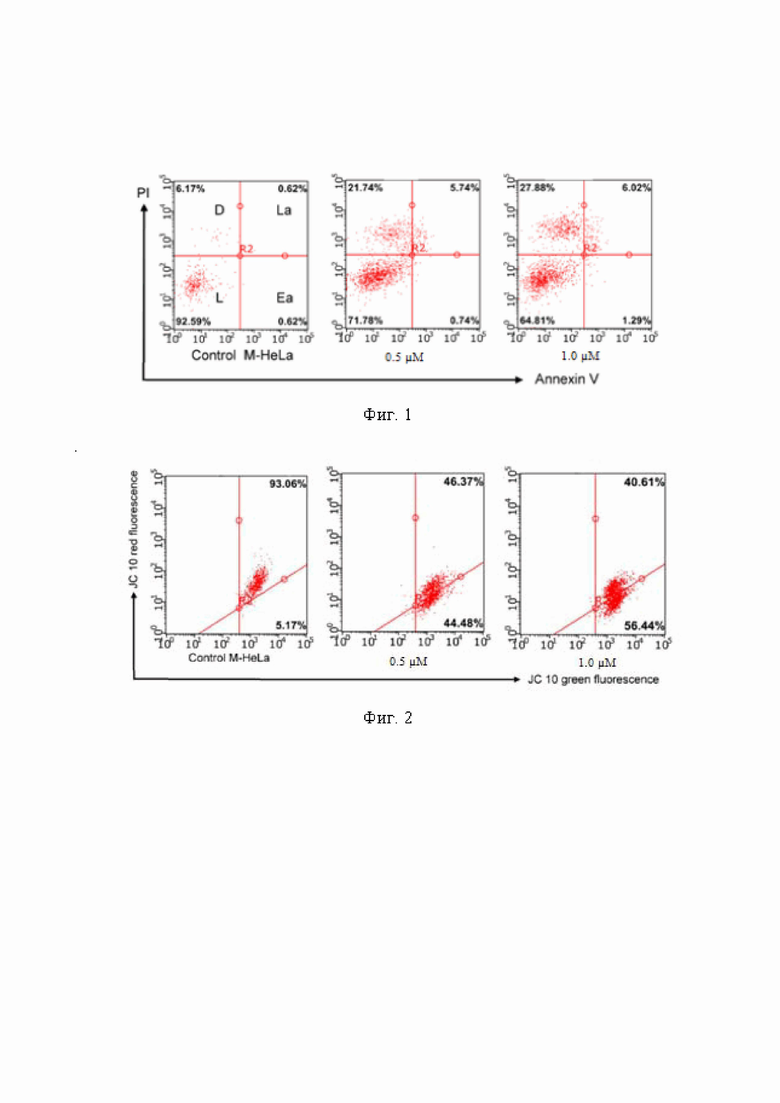
Заявляемые соединения вызывают апоптоз опухолевых клеток, что подтверждено методом проточной цитометрии с использованием протокола окрашивания аннексином V-Alexa Fluor 647. На фигуре 1 на примере клеток линии M-HeLa показано распределение живых, мертвых, а также клеток в раннем и позднем апоптозе после 48-часовой инкубации с соединением Ic (в концентрациях 0,5 μМ (средняя гистограмма) и в концентрации 1,0 μМ (правая гистограмма) в сравнении с контролем - опухолевые клетки без обработки (левая гистограмма). Значения представлены как среднее ± стандартное отклонение (n = 3), L - живые клетки; D - мертвые клетки; Ea - клетки в раннем апоптозе; La - клетки в позднем апоптозе [Voloshina AD, Sapunova AS, Kulik NV, Belenok MG, Strobykina IYu, Lyubina A, et al. Antimicrobial and cytotoxic effects of ammonium derivatives of diterpenoids steviol and isosteviol // Bioorg. Med. Chem. 2021. 32. 115974. DOI: 10.1016/j.bmc.2020.115974].
На фиг. 1 проиллюстрировано, что после контакта соединения Ic с клетками линии M-HeLa, увеличивается доля мертвых клеток (L - 92,58%, D - 6,17% в контроле, L - 71,78%, D - 21,74% для концентрации 0,5 μМ и L - 64,81%, D - 27,88% для концентрации 1,0 μМ), а также клеток в позднем апоптозе (Ea - 0,62%, La - 0,62% в контроле, Ea - 0,74%, La - 5,74% для концентрации 0,5 μМ, Ea - 1,29%, La - 6,02% для концентрации 1,0 μМ).
Механизм апоптоза заявляемых соединений протекает по внутреннему митохондриальному пути, что подтверждается данными проточной цитометрии с использованием флуоресцентного красителя JC-10 (в наборе Mitochondria Membrane Potential Kit) (SIGMA). Цитометрию осуществляют на цитометре (Guava easy Cyte, MERCK, USA). В нормальных клетках JC-10 накапливается в митохондриальном матриксе, где образует агрегаты с красной флуоресценцией, в апоптотических клетках JC-10 диффундирует из митохондрий, превращается в мономерную форму и испускает зеленую флуоресценцию, которую регистрирует прибор.
На фигуре 2 на примере клеток линии M-HeLa показан митохондриальный мембранный потенциал опухолевых клеток после 48-часовой инкубации с соединением Ic (в концентрациях 0,5 μМ (средняя гистограмма) и в концентрации 1,0 μМ (правая гистограмма) в сравнении с контролем - опухолевые клетки без обработки (левая гистограмма). Как видно на фигуре 2, взаимодействие раковых клеток с соединением Ic приводит к снижению митохондриального мембранного потенциала клеток M-HeLa, которое в контроле составляет 93,06% (левая гистограмма), для клеток M-HeLa, обработанных соединением Ic в концентрации 0,5 μМ - 46,37%, (средняя гистограмма) в концентрации 1,0 μМ - 40,61% (правая гистограмма). При этом интенсивность зеленой флуоресценции составляет 44,48% (при 0,5 μМ) и 56,44% (при 1,0 μМ), что в 8,6 и 10,9 раз соответственно превышает значения контроля 5,17% (клетки M-HeLa).
Изобретение иллюстрируется примерами получения заявляемых соединений Ia-с.
Пример 1. Синтез 7,7'-((3-((3,5-ди-трет-бутил-4-гидроксифенил)(диметоксифос-форил)метил)пиридин-2,6-диил)бис(азанедиил))бис(4,6-динитробензофуроксана) (Iа).
В раствор 0.01 моль 7-хлоро-4,6-динитробензофуроксана в 10 мл хлороформа при комнатной температуре при перемешивании прикапывают 0.01 моль диметил-((3,5-ди-трет-бутил-4-гидроксифенил)(2,6-диаминопиридин-3-ил)метил)фосфоната.
Реакционную смесь перемешивают в течение суток, (о завершении реакции судили с помощью метода тонкослойной хроматографии), высаживают в гексан. Выпавший осадок отфильтровывают, промывают последовательно водой, диэтиловым эфиром и высушивают в вакууме (0.06 мм.рт.ст.) при температуре 40°С до постоянной массы. Выход продукта Ia 91%. Порошок красного цвета, Тпл = 160-161°С. ИК-спектр, υ, см -1: 1378 (NO2 симм.), 1575 (NO2 асимм), 1626 (фураксановое кольцо). ЯМР 1H (500 МГц, ацетон-d6): δδ 1.46 (с, 18H, CH3), 3.61 и 3.66 (д, J = 10.3 Гц, 6H, CH3), 5.65 (д, J(PH) = 12.4 Гц, 1H, CH), 5.94 (с, 1H, OH), 7.09 (уш.с, 1H, HAr), 7.58 (м, 2H, HAr), 8.36 (д, J = 8.4 Гц, 1H, HAr), 8.61 (с, 1H, HBf), 9.08 (с, 1H, HBf), 11.05 (с, 2H, NH). ЯМР 13C (126 MГц, ацетон-d6) δ 157.4, 157.3, 154.5, 149.5, 148.1, 141.6, 141.5, 138.8, 138.7, 134.4, 132.8, 130.0, 129.8.1, 129.5 (C5-Bz2), 128.6, 128.0, 127.9 (d, J(PC) = 7.5 Гц), 115.7, 114.4, 113.7, 111.0, 54.4, 43.2 (д, J(PC) = 140.0 Гц), 35.9, 31.4. ЯМР 31P (162 MГц, ацетон-d6) δ 27.4. Элементный анализ. C34H34N11O16P. Вычислено, %: C, 46.21; H, 3.88; N, 17.44; P, 3.51; Найдено, %: C, 46.27; H, 3.84; N, 17.48; P, 3.49.
Пример 2. Синтез 7,7'-((3-((3,5-ди-трет-бутил-4-гидроксифенил)(диизопропокси-фосфорил)метил)пиридин-2,6-диил)бис(азанедиил))бис(4,6-динитробензофуроксана) (Ib).
Аналогично примеру 1 из 0.01 моль 7-хлоро-4,6-динитробензофуроксана и 0.01 моль диизопропил-((3,5-ди-трет-бутил-4-гидроксифенил)(2,6-диаминопиридин-3-ил)метил)фосфоната получают соединение Ib, порошок красного цвета с выходом 78%. Тпл = >250°С. ИК-спектр, υ, см -1: 1360 (NO2 симм.), 1556 (NO2 асимм), 1635 (фураксановое кольцо). ЯМР 1H (500 МГц, ацетон-d6): δδ 1.09, 1.18, 1.38 и 1.40 (д, J = 6.2 Гц, 12H, CH3), 1.49 (с, 18H, CH3), 4.68 и 4.83 (sept, J(PH) = 6.3 Гц, 8H, СH), 4.98 (д, J(PH) = 25.3 Гц, 1H, CH), 6.22 (с, 1H, OH), 7.53 (д, J = 8.4 Гц, 1H, HAr), 7.56 (д, J(PH) = 0.6 Гц, 2H, HAr), 8.15 (дд, J = 8.4 Гц, J(PH) = 1.0 Гц, 1H, HAr), 8.90 (с, 1H, HBf), 9.07 (с, 1H, HBf), 10.64 (с, 1H, NH), 11.30 (с, 1H, NH). ЯМР 13C (126 MГц, ацетон-d6,) δ 155.0, 149.9, 149.8, 147.4, 147.3, 144.0 (d, J(PC) = 4.7 Гц), 139.5, 139.3, 138.3, 132.1, 132.0, 130.9, 130.0, 129.7, 128.4 (д, J(PC) = 8.0 Гц), 128.2, 127.1 (д, J(PC) = 4.3 Гц), 125.9 (д, J(PC) = 5.7 Гц), 115.2, 114.2, 113.6, 73.5 и 73.0 (д, J(PC) = 7.0 Гц), 46.5 (д, J(PC) = 140.2 Гц), 36.0, 31.3, 25.2, 25.0 24.7 и 24.4 (д, J(PC) = 5.3 Гц). ЯМР 31P (162 MГц, ацетон-d6) δ 24.3. Элементный анализ. C38H42N11O16P. Вычислено, %: C, 48.57; H, 4.50; N, 16.39; P, 3.30; Найдено, %: C, 48.54; H, 4.54; N, 16.32; P, 3.35.
Пример 3. Синтез 7,7'-((3-((3,5-ди-трет-бутил-4-гидроксифенил)(дифенилфос-форил)метил)пиридин-2,6-диил)бис(азанедиил))бис(4,6-динитробензофуроксана) (Iс).
Аналогично примеру 1 из 0.01 моль 7-хлоро-4,6-динитробензофуроксана и 0.01 моль дифенил-((3,5-ди-трет-бутил-4-гидроксифенил)(2,6-диаминопиридин-3-ил)метил)-фосфоната получают соединение Ic, порошок бордового цвета с выходом 75%. Тпл = >250°С. ИК-спектр, υ, см -1: 1378 (NO2 симм.), 1569 (NO2 асимм), 1622 (фураксановое кольцо). ЯМР 1H (400 МГц, дмсо-d6): δ 1.24 (с, 18H, СH3), 5.27 (м, CH), 6.64 (д, 2H, J = 8.2 Гц, HAr), 6.86 (уш.с, 1H, OH), 6.99 (д, J = 8.3 Гц, 2H, HAr), 7.07 (м, 1H, HAr), 7.17 (м, 5H, HAr), 7.30 (д, J = 8.1 Гц, 2H, HAr), 8.28 (с, 1H, HAr), 8.34 (d, J = 8.4 Гц, 1H, HAr), 8.67 (с, 1H, HBf), 8.87 (с, 1H, HBf). ЯМР 31P (162 MГц, дмсо-d6) δ 18.8. Элементный анализ. C44H38N11O16P. Вычислено, %: C, 52.44; H, 3.80; N, 15.29; P, 3.07; Найдено, %: C, 52.49; H, 3.77; N, 15.35; P, 3.01.
Таким образом, предложены соединения, расширяющие арсенал противоопухолевых средств - новые фосфорсодержащие пространственно-затрудненные фенолы с фрагментами бензофуроксана. Соединения не обладают гемолитической активностью, менее токсичны в отношении линии нормальных клеток эмбриона легкого человека WI38, проявляют селективность против линий раковых клеток различного генеза и значительно превосходят по селективности препараты сравнения Доксорубицин и Сорафениб. Механизм действия протестированных соединений может быть связан с индукцией апоптоза, протекающего по внутреннему митохондриальному пути. Все вышесказанное делает их перспективными в качестве противоопухолевых агентов нового поколения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Бромсодержащие пространственно-затрудненные фенолы, обладающие противоопухолевой активностью | 2023 |
|
RU2822270C1 |
| Фосфониевые соли на основе алантолактона, обладающие противоопухолевой активностью, и способ их получения | 2023 |
|
RU2818095C1 |
| Фторсодержащие бензилированные изатины, обладающие противоопухолевой активностью | 2022 |
|
RU2802016C1 |
| Фторсодержащие бензилированные изатины | 2023 |
|
RU2816105C1 |
| Низкотоксичные аминофосфониевые соли, обладающие противоопухолевой активностью, и способ их получения | 2024 |
|
RU2836726C1 |
| Противоопухолевые средства на основе макро- и микроэлементсодержащих полигалактуронатов (варианты) | 2022 |
|
RU2792613C1 |
| Натрий-кобальт-полигалактуронат, обладающий противоопухолевой активностью | 2023 |
|
RU2794885C1 |
| Фосфониевые соли на основе бетулиновой кислоты, обладающие цитотоксической активностью в отношении аденокарциномы предстательной железы | 2018 |
|
RU2665922C1 |
| Пинановые C,N-палладациклы, содержащие L-аминокислоты, и их применение в качестве средств, обладающих противоопухолевой активностью | 2022 |
|
RU2799205C1 |
| Средство на основе производного арглабина, обладающее селективным цитотоксическим действием | 2023 |
|
RU2814259C1 |
Изобретение относится к области органической химии и медицины, в частности к новым пространственно-затрудненным фенолам с фрагментами бензофуроксана общей формулы I, которые могут найти применение в качестве противоопухолевых средств в фармацевтике, медицине и ветеринарии. Новые противоопухолевые средства способны эффективно разрушать митохондрии клеток, тем самым подавляя рост раковых клеток. 2 н.п. ф-лы, 2 ил., 1 табл., 3 пр.
R = Me (a), iPr (b), Ph (c)
1. Пространственно-затрудненный фенол, содержащий бензофуроксановый фрагмент, общей формулы I
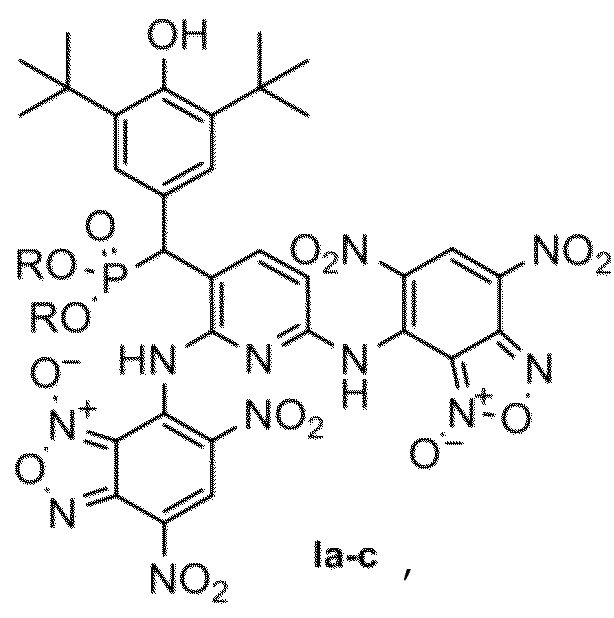
где R = Me (a), iPr (b), Ph (c).
2. Применение пространственно-затрудненного фенола, содержащего бензофуроксановый фрагмент, общей формулы I

где R = Me (a), iPr (b), Ph (c),
в качестве средства, обладающего противоопухолевой активностью.
| Новые азидобензофуроксаны, способ их получения и применение в качестве энергоемких соединений | 2021 |
|
RU2777317C1 |
| ЧУГУНОВА ЕЛЕНА АЛЕКСАНДРОВНА "НОВЫЕ СИНТЕТИЧЕСКИЕ ВОЗМОЖНОСТИ БЕНЗОФУРОКСАНОВОЙ ПЛАТФОРМЫ ДЛЯ КОНСТРУИРОВАНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СИСТЕМ", АВТОРЕФЕРАТ, КАЗАНЬ, 2020, 47 стр | |||
| E | |||
| Chugunova et al., "Design of Novel 4-Aminobenzofuroxans and Evaluation of Their Antimicrobial and Anticancer Activity", Int | |||
| J | |||
| Mol | |||
| Sci., | |||
Авторы
Даты
2023-05-29—Публикация
2022-10-25—Подача