ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение, в целом, относится к кристаллическим формам соединения, имеющего активность ингибитора киназы, взаимодействующей с MAP-киназой (Mnk), например, Mnk1 и Mnk2, а также к фармацевтическим композициям и способам получения соединения по изобретению, которое используют в качестве терапевтического средства для лечения Mnk-зависимых заболеваний, включая лечение рака.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Эукариотический фактор инициации 4E (eIF4E) представляет собой общий фактор трансляции, но он обладает способностью предпочтительно усиливать трансляцию матричных РНК (мРНК), которые приводят к продуцированию связанных со злокачественностью белков. Эта избирательность может быть связана с повышенной потребностью в eIF4E и его партнерах по связыванию для трансляции мРНК, содержащих обширную вторичную структуру в их 5’-нетранслируемых областях (5’-UTR). Повышенные уровни eIF4E были обнаружены в опухолях многих типов и клетках раковых линий, включая рак толстой кишки, молочной железы, мочевого пузыря, легкого, предстательной железы, желудочно-кишечного тракта, головы и шеи, лимфому Ходжкина и нейробластомы.
[0003] Путь PI3K (фосфоинозитид-3-киназа)/PTEN (гомолог фосфатазы и тензина, делетированный на хромосоме десять)/Akt/mTOR (мишень рапамицина млекопитающих) важен для регуляции трансляции мРНК генов, кодирующих про-онкогенные белки, и сигнализации активированного mTORC1 в большом количестве случаев рака, эти киназы активно изучались в качестве мишеней лекарственных средств в онкологии. Были идентифицированы многие фармакологические ингибиторы, некоторые из которых были доведены до поздних стадий клинических испытаний. Однако в последнее время стало ясно, что путь mTOR участвует в сложном цикле обратной связи, который может нарушать активацию Akt.
[0004] Mnk1 и Mnk2 представляют собой треонин/сериновые киназы и специфически фосфорилируют серин 209 (Ser209) в eIF4E в составе комплекса eIF4F. При том, что активность Mnk необходима для опосредованной eIF4E онкогенной трансформации, она необязательна для нормального развития. Таким образом, фармакологическое ингибирование Mnk является многообещающей стратегией лечения рака.
[0005] Несмотря на возросшее понимание структуры и функции Mnk, был достигнут незначительный прогресс в том, что касается выявления фармакологических ингибиторов Mnk, и сообщалось об относительно небольшом числе ингибиторов Mnk: CGP052088 (Tschopp et al., Mol Cell Biol Res Commun. 3(4):205-211, 2000); CGP57380 (Rowlett et al., Am J Physiol Gastrointest Liver Physiol. 294(2):G452-459, 2008); и Cercosporamide (Konicek et al., Cancer Res. 71(5):1849-1857, 2011). Однако эти соединения были в основном использованы для целей подтверждения мишеней Mnk. Совсем недавно исследователи предложили дополнительные соединения для лечения заболеваний, на которые влияет ингибирование активности киназы Mnk1 и/или Mnk2, включая, например, соединения, раскрытые в международной патентной заявке № WO/2017/075394; патентах США № 9382248; 9669031 и 9814718.
[0006] Соответственно, несмотря на прогресс, достигнутый в этой области, сохраняется значительная потребность в соединениях и фармацевтически приемлемых композициях, которые эффективно ингибируют активность киназы Mnk, в частности, что касается роли Mnk в регуляции путей онкогенеза, а также в связанных композициях и способах. Настоящее изобретение удовлетворяет эту потребность и обеспечивает дополнительные связанные с этим преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Настоящее изобретение относится к кристаллическим формам соединения, которое ингибирует или модулирует активность Mnk. Настоящее изобретение также относится к фармацевтически приемлемым композициям, содержащим такое соединение, и соответствующим способам лечения состояний, при которых может принести пользу ингибирование Mnk, таких как рак.
[0008] В одном варианте осуществления изобретение относится к кристаллическому соединению:
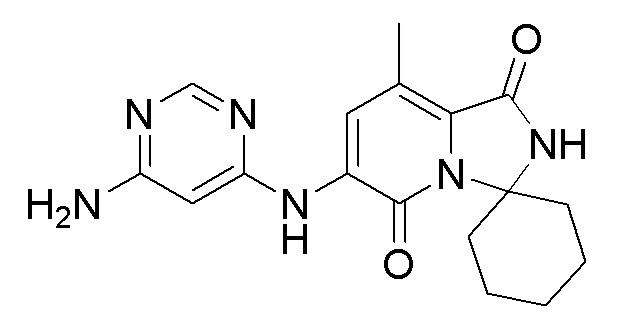 ,
,
или его стереоизомерам, таутомерам или сольватам.
[0009] В другом варианте осуществления изобретение относится к кристаллическому соединению, которое имеет диаграмму рентгеновской порошковой дифракции с характерными пиками, выраженными в значениях градусов 2Θ, при примерно 8,07; примерно 10,81; примерно 14,68 и примерно 22,07±0,2.
[0010] В одном из вариантов осуществления кристаллическое твердое соединение имеет диаграмму рентгеновской порошковой дифракции с характерными пиками, выраженными в значениях градусов 2Θ, при примерно 8,07; примерно 10,81; примерно 14,68; примерно 16,69; примерно 17,34 и примерно 22,07±0,2.
[0011] В другом варианте осуществления кристаллическое твердое соединение имеет диаграмму рентгеновской порошковой дифракции с характерными пиками, выраженными в значениях градусов 2Θ, при примерно 8,07; примерно 10,81; примерно 12,00; примерно 12,37; примерно 13,79; примерно 14,68; примерно 15,39; примерно 16,19; примерно 16,69; примерно 17,34; примерно 18,89; примерно 20,26; примерно 21,15; примерно 21,30; примерно 21,77; примерно 22,07; примерно 22,84; примерно 23,49; примерно 24,40; примерно 24,90; примерно 25,34; примерно 25,75; примерно 26,12; примерно 26,54; примерно 27,16; примерно 27,48; примерно 28,06; примерно 28,76; примерно 29,04; примерно 29,26 и примерно 29,59±0,2.
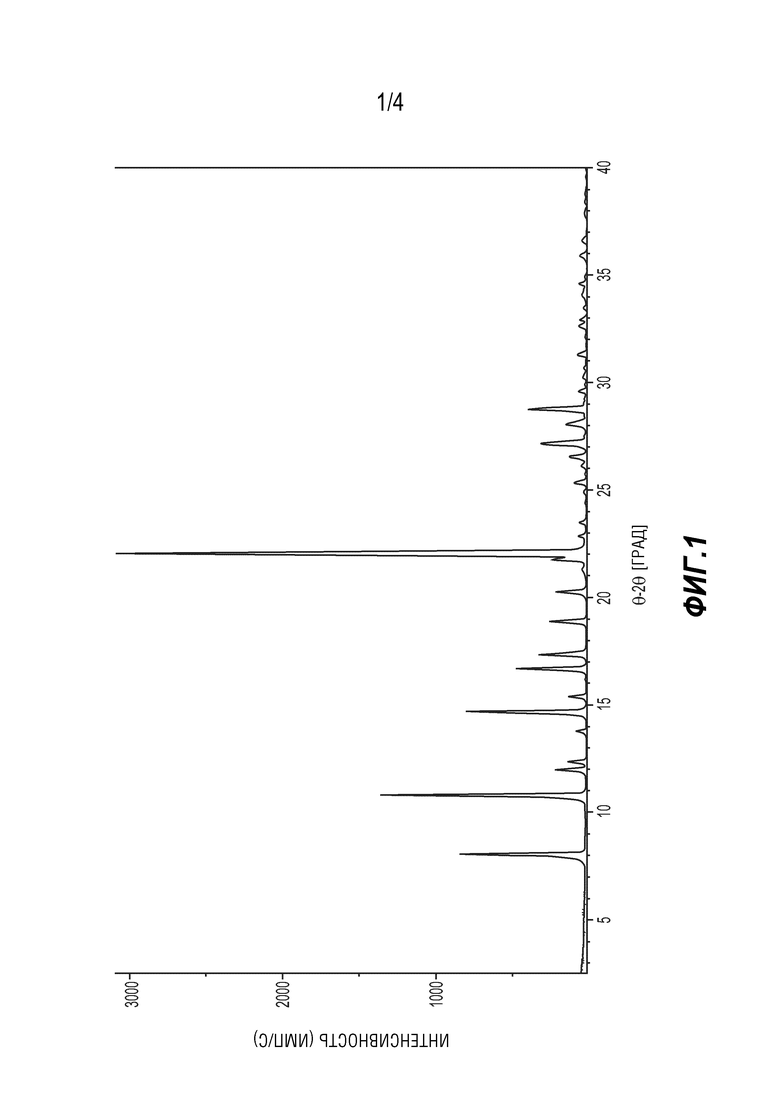
[0012] В следующем варианте осуществления кристаллическое твердое соединение имеет диаграмму рентгеновской порошковой дифракции практически такой, как показано на ФИГ. 1.
[0013] Настоящее изобретение также относится к фармацевтической композиции, содержащей (i) терапевтически эффективное количество по меньшей мере одного кристаллического твердого соединения по настоящей заявке, или его стереоизомера, таутомера или сольвата; (ii) в комбиниции с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
[0014] Настоящее изобретение также относится к способу уменьшения или ингибирования активности Mnk по меньшей мере в одной клетке, избыточно экспрессирующей Mnk, включающему контактирование по меньшей мере одной клетки с соединением по настоящей заявке или его стереоизомером, таутомером или сольватом.
[0015] В способе по изобретению по меньшей мере одна клетка представляет собой клетку рака толстого кишечника, клетку рака желудка, клетку рака щитовидной железы, клетку рака легкого, клетку лейкоза, клетку B-клеточной лимфомы, T-клеточной лимфомы, волосатоклеточной лимфомы, клетку лимфомы Ходжкина, клетку неходжскинской лимфомы, клетку лимфомы Беркитта, клетку рака поджелудочной железы, клетку меланомы, клетку множественной меланомы, клетку рака головного мозга, клетку рака ЦНС, клетку рака почки, клетку рака предстательной железы, клетку рака яичника или клетку рака молочной железы.
[0016] Настоящее изобретение относится к способу лечения Mnk-зависимого состояния у млекопитающего, которое нуждается в этом, включающему введение млекопитающему (i) терапевтически эффективного количества по меньшей мере одного соединения по настоящей заявке или его стереоизомера, таутомера или сольвата, или (ii) фармацевтической композиции соединения по настоящей заявке.
[0017] В одном из вариантов осуществления состояние, которое лечат способом по изобретению, представляет собой колоректальный рак, рак желудка, рак щитовидной железы, рак легкого, лейкоз, B-клеточную лимфому, T-клеточную лимфому, волосатоклеточную лимфому, лимфому Ходжкина, неходжскинскую лимфому, лимфому Беркитта, рак поджелудочной железы, меланому, множественную меланому, рак головного мозга, рак ЦНС, рак почки, рак предстательной железы, рак яичника или рак молочной железы. В другом варианте осуществления млекопитающее в способе по изобретению является человеком.
[0018] Вышеописанные варианты осуществления и другие аспекты изобретения станут понятны из подробного описания, следующего далее. С этой целью в настоящем документе приведены различные ссылки на литературные источники, в которых описана более подробно определенная исходная информация, процедуры, соединения и/или композиции, и которые включены в настоящий документ посредством ссылки в полном объеме.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0019] На ФИГ. 1 представлена диаграмма РПД формы A 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона.
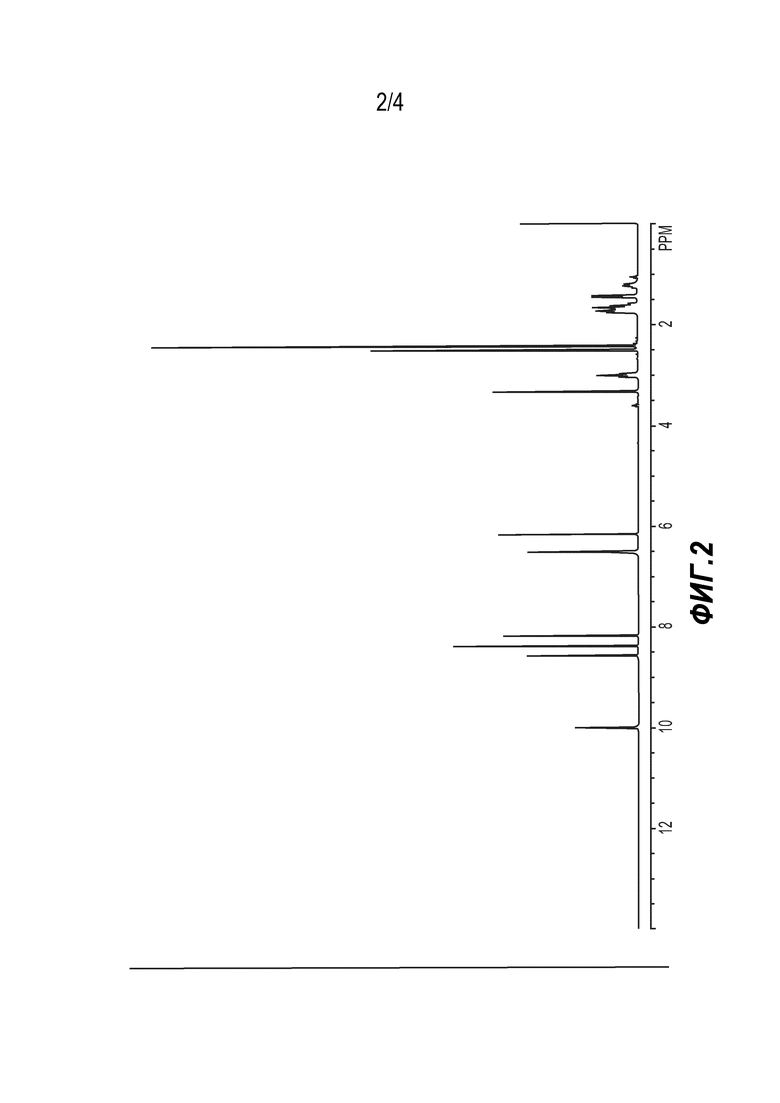
[0020] На ФИГ. 2 представлена диаграмма РПД формы B 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона.
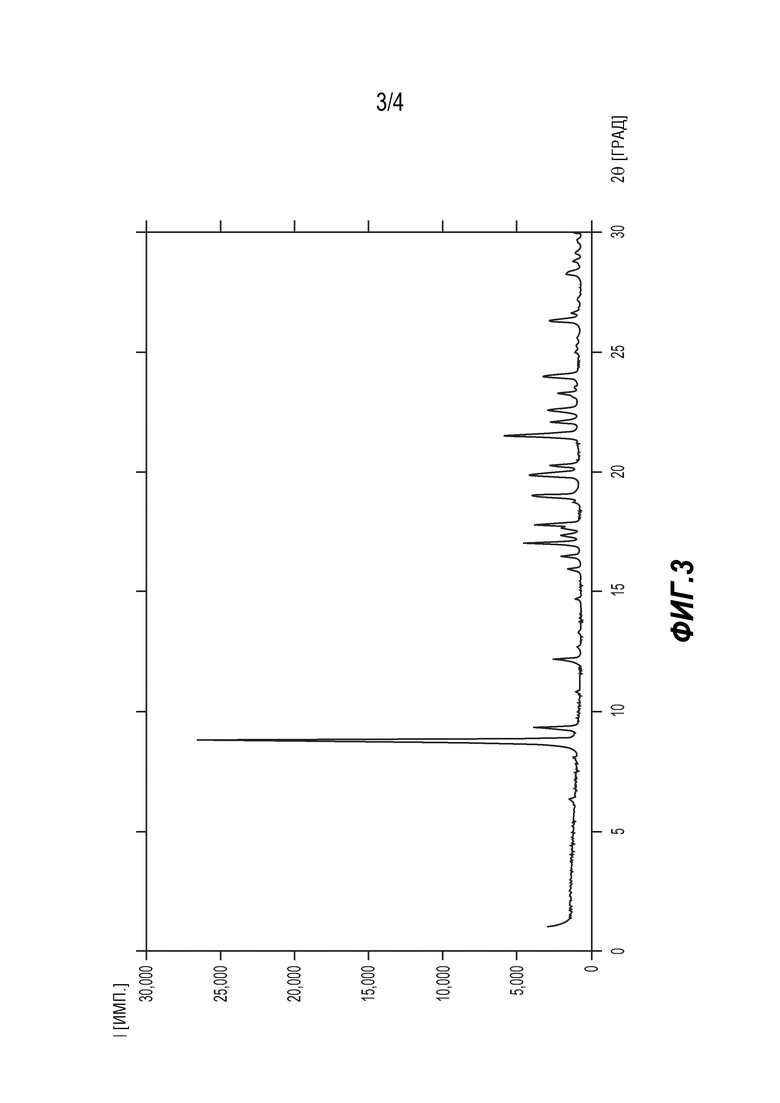
[0021] На ФИГ. 3 представлен диаграмма РПД формы C 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона.
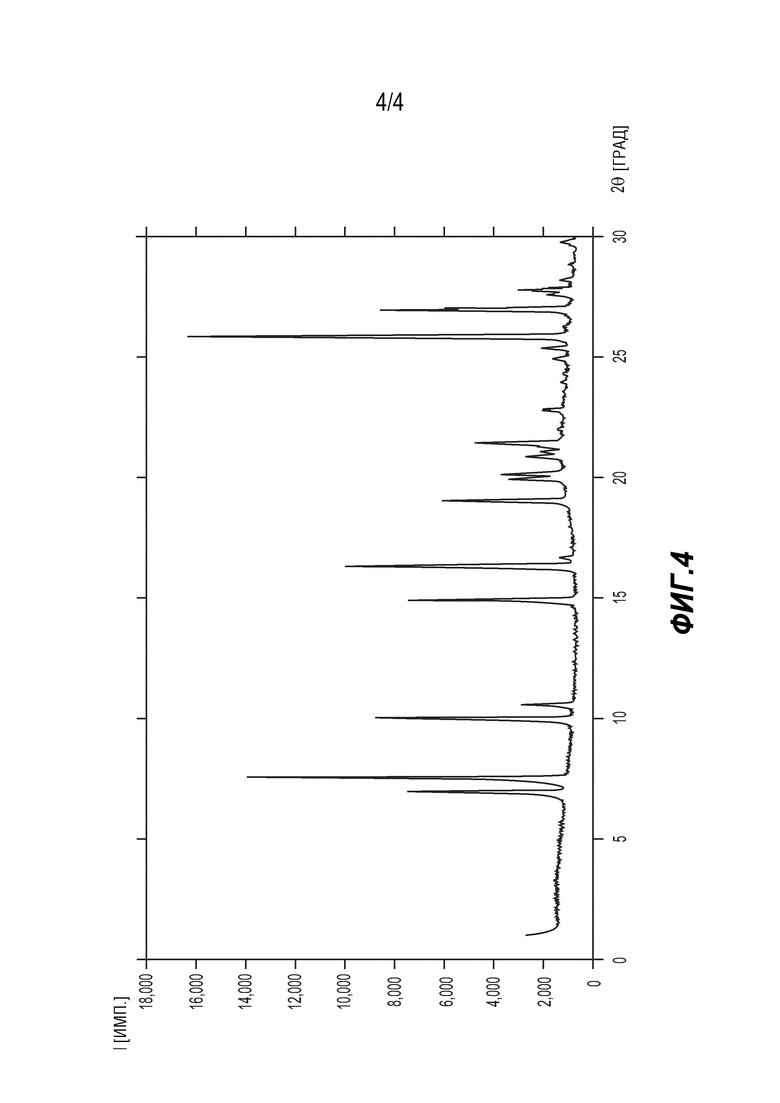
[0022] На ФИГ. 4 представлен диаграмма РПД формы D 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0023] В следующем далее описании приведены некоторые конкретные детали для лучшего понимания различных вариантов осуществления изобретения. Однако специалист в данной области понимает, что изобретение может быть осуществлено на практике без этих деталей. Если из контекста не следует иное, на всем протяжении настоящей спецификации и формулы изобретения слово «включать» и его вариации, такие как «включает» и «включая», должны быть истолкованы в открытом, инклюзивном смысле (то есть, как «включая, но без ограничения»).
[0024] Во всем тексте настоящей спецификации ссылка на «один вариант осуществления» или «один из вариантов осуществления» означает, что конкретный признак, структура или характеристика, описанные в связи с вариантом осуществления, включены по меньшей мере в один вариант осуществления настоящего изобретения. Таким образом, появление выражений «в одном варианте осуществления» или «в одном из вариантов осуществления» в различных местах в тексте настоящей спецификации не обязательно во всех случаях означает ссылку на один и тот же вариант осуществления. Более того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом в одном или более вариантах осуществления.
Определения
[0025] При использовании в настоящем документе, если не указано обратное, следующие термины и выражения имеют значения, приведенные ниже.
[0026] Соединение по изобретению может существовать в разных изомерных формах, а также в одной или более таутомерных формах, включая как одиночные таутомеры, так и смеси таутомеров. Термин «изомер» должен включать все изомерные формы соединения по настоящему изобретению, включая таутомерные формы соединения.
[0027] Некоторые соединения, описанные в настоящем документе, могут иметь асимметричные центры и, следовательно, существовать в разных энантиомерных и диастереомерных формах. Соединение по изобретению может иметь форму оптического изомера или диастереомера. Соответственно, изобретение охватывает соединения по изобретению и варианты их применения, описанные в настоящем документе, в форме их оптических изомеров, диастереомеров и их смесей, включая рацемическую смесь. Оптические изомеры соединений по изобретению могут быть получены известными методами, такими как асимметричный синтез, хиральная хроматография, или путем химического разделения стереоизомеров за счет использования оптически активных разделяющих средств.
[0028] Если нет иных указаний, термин «стереоизомер» означает один стереоизомер соединения, который практически свободен от других стереоизомеров данного соединения. Таким образом, стереомерно чистое соединение, имеющее один хиральный центр, будет практически свободным от противоположного энантиомера соединения. Стереомерно чистое соединение, имеющее два хиральных центра, будет практически свободным от других диастереомеров соединения. Типичное стереомерно чистое соединение содержит более примерно 80% по массе одного стереоизомера соединения и менее примерно 20% по массе других стереоизомеров соединения, например, более примерно 90% по массе одного стереоизомера соединения и менее примерно 10% по массе других стереоизомеров соединения, или более примерно 95% по массе одного стереоизомера соединения и менее примерно 5% по массе других стереоизомеров соединения, или более примерно 97% по массе одного стереоизомера соединения и менее примерно 3% по массе других стереоизомеров соединения.
[0029] Если существует несоответствие между изображенной структурой и названием, данным этой структуре, то изображенная структура имеет преимущественную силу. Кроме того, если стереохимия структуры, или части структуры, не обозначена, например, жирными или пунктирными линиями, то структуру, или часть структуры, следует интерпретировать, как включающую все ее стереоизомеры. Однако в некоторых случаях, в случае существования более чем одного хирального центра, структуры и названия могут быть представлены в виде одиночных энантиомеров для помощи в описании относительной стереохимии. Специалисты в области органического синтеза будут знать, получены ли соединения в виде одиночных энантиомеров, исходя из способов их получения.
[0030] Термины «лечить», «лечение» и «терапия» означают облегчение или устранение заболевания или симптомов, связанных с заболеванием. В конкретных вариантах осуществления такие термины означают минимизацию распространения или усугубления заболевания благодаря введению одного или более профилактических или терапевтических средств пациенту, имеющему такое заболевание. В контексте настоящего изобретения термины «лечить», «лечение» и «терапия» также означают:
(i) предотвращение возникновения заболевания или состояния у млекопитающего, в частности, когда такое млекопитающее имеет предрасположенность к состоянию, но состояние еще не было у него диагностировано;
(ii) подавление заболевания или состояния, то есть, остановку его развития;
(iii) облегчение заболевания или состояния, то есть, вызывание регрессии заболевания или состояния; или
(iv) облегчение симптомов, возникающих вследствие заболевания или состояния, то есть, облегчение боли без устранения лежащего в основе заболевания или состояния. В настоящем документе термины «заболевание» и «состояние» могут быть использованы взаимозаменяемо или могут отличаться в том, что конкретное заболевание или состояние может не иметь известного возбудителя (или что этиология еще не выяснена) и, следовательно, оно еще не признано заболеванием, а лишь нежелательным состоянием или синдромом, при этом клиницисты выявили более или менее конкретный набор симптомов.
[0031] Термины «модулировать», «модуляция» и тому подобные относятся к способности соединения увеличивать или уменьшать функцию, или активность, например, киназы, взаимодействующей с MAP-киназой (Mnk). Термин «модуляция» в его различных формах должен включать ингибирование, антагонизм, частичный антагонизм, активацию, агонизм и/или частичный агонизм активности, связанной с Mnk. Ингибиторы Mnk представляют собой соединения, которые связывают, частично или полностью блокируют стимуляцию, уменьшают, предотвращают, отсрочивают активацию, инактивируют, десенсибилизируют или ослабляют сигнальную трансдукцию. Способность соединения модулировать активность Mnk может быть продемонстрирована в ферментативном анализе или в клеточном анализе.
[0032] Термин «пациент», или «субъект», включает животного, такого как человек, корова, лошадь, овца, ягненок, свинья, курица, индейка, перепел, кошка, собака, мышь, крыса, кролик или морская свинка. Животное может быть млекопитающим, таким как не примет и примат (например, обезьяна и человек). В одном варианте осуществления пациент является человеком, например, младенцем, ребенком, подростком или взрослым.
[0033] Термин «пролекарство» означает предшественник лекарственного средства, соединение, которое при введении пациенту должно подвергнуться химическому превращению в результате метаболических процессов прежде, чем оно станет фармакологическим средством. Иллюстративные пролекарства соединений по настоящей заявке представляют собой сложные эфиры, ацетамиды и амиды.
[0034] Соединения по изобретению можно метить изотопами путем замены одного или более атомов на атом, имеющий иную атомную массу или иное массовое число. Примеры изотопов, которые могут быть включены, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, хлора или иода. Представителями таких изотопов являются 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 31P, 32P, 35S, 18F, 36Cl, 123I и 125I, соответственно. Эти радиоактивно меченые соединения можно использовать для измерения биораспределения, концентрации в тканях, а также кинетики перемещения и экскреции из биологических тканей субъекта, которому вводят такое меченое соединение. Меченые соединения также используют для определения терапевтической эффективности, зоны или механизма действия, а также аффинности связывания терапевтического средства-кандидата с фармакологически важной мишенью. Определенные радиоактивно меченые соединения полезны для исследований лекарственного средства и/или распределения в тканях. Радиоактивные изотопы тритий, то есть, 3H, и углерод-14, то есть, 14C, особенно полезны для данной цели ввиду легкости их включения и методов обнаружения.
[0035] Замена более тяжелыми изотопами, такими как дейтерий, то есть, 2H, обеспечивает определенные терапевтические преимущества вследствие более высокой метаболической стабильности, например, увеличенного периода полувыведения in vivo соединений, содержащих дейтерий. Замена водорода дейтерием может способствовать уменьшению дозы, необходимой для терапевтического эффекта, и, следовательно, может быть предпочтительной в исследованиях или в клинических условиях.
[0036] Замена позитронно-активными изотопами, такими как 11C, 18F, 15O и 13N, приводит к получению меченых аналогов соединений по изобретению, которые полезны в исследованиях методом позитронной эмиссионной томографии (ПЭТ), например, при изучении степени занятости рецептора субстратом. Меченые изотопами соединения по настоящей заявке, как правило, можно получать общепринятыми методами, известными специалистам в данной области, или методами, аналогичными тем, которые описаны в приведенном далее разделе «Примеры», с использованием соответственного метящего изотопами реагента.
[0037] Варианты осуществления изобретения, описанные в настоящем документе, также предназначены для охвата in vivo метаболических продуктов соединений по настоящей заявке. Такие продукты могут быть результатом, например, окисления, восстановления, гидролиза, амидирования, этерификации и тому подобных процессов, в первую очередь вследствие ферментативной активности после введения соединения по изобретению. Соответственно, изобретение включает соединения, которые образуются как побочные продукты ферментативной или не ферментативной активности из соединения по изобретению после введения такого соединения млекопитающему на период времени, достаточный для образования метаболического продукта. Метаболические продукты, в частности, фармацевтически активные метаболиты, как правило, определяют путем введения радиоактивно меченого соединения по изобретению в поддающейся обнаружению дозе субъекту, такому как крыса, мышь, морская свинка, обезьяна или человек, на достаточный период времени, в течение которого происходят метаболические процессы, и выделения метаболических продуктов из мочи, крови или других биологических образцов, полученных от субъекта, которому введено радиоактивно меченое соединение.
[0038] Часто при кристаллизации образуется сольват соединения по изобретению. Используемый в настоящем документе термин «сольват» означает агрегат, содержащий одну или более молекул соединения по изобретению с одной или более молекулами растворителя. Растворитель может представлять собой воду, в этом случае сольват может представлять собой гидрат. Альтернативно, растворитель может представлять собой органический растворитель. Таким образом, соединения по настоящему изобретению могут существовать в виде гидрата, включая моногидрат, дигидрат, гемигидрат, сесквигидрат, тригидрат, тетрагидрат и тому подобное, а также в виде соответствующих сольватированных форм. Соединение по изобретению может представлять собой истинный сольват, при этом в других случаях соединение по изобретению может просто удерживать постороннюю воду или смесь воды плюс некоторые случайные растворители.
[0039] Соединения по изобретению, или их фармацевтически приемлемые соли, могут иметь один или более асимметричных центров и, следовательно, могут давать начало энантиомерам, диастереомерам и другим стереоизомерным формам, которые могут быть определены, с точки зрения абсолютной стереохимии, как (R)- или (S)-, либо как (D)- или (L)- в случае аминокислот. Настоящее изобретение должно включать все такие возможные изомеры, а также их рацемические и оптически чистые формы. Оптически активные (+) и (-), (R)- и (S)- или (D)- и (L)-изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов, или разделены с использованием общепринятых методов, например, хроматографии и фракционной кристаллизации. Общепринятые методы получения/выделения отдельных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ). Когда соединения, описанные в настоящем документе, содержат олефиновые двойные связи или другие центры геометрической асимметрии, если не указано иначе, подразумевают, что соединения включают как E, так и Z, геометрические изомеры. Аналогично, все таутомерные формы также должны быть включены.
[0040] Термин «таутомер» означает соединение, в котором имеет место сдвиг протона от одного атома молекулы к другому атому той же самой молекулы.
[0041] Соединения по изобретению синтезируют с использованием общепринятых методов синтеза, и более конкретно, с использованием общих методов, описанных ниже. Конкретные протоколы синтеза соединений по настоящему изобретению описаны в разделе «Примеры».
Фармацевтические композиции
[0042] В одном варианте осуществления соединения по настоящей заявке сформулированы в виде фармацевтически приемлемых композиций, содержащих соединение в количестве, эффективном для лечения конкретного интересующего заболевания или состояния путем введения фармацевтической композиции млекопитающему. Фармацевтические композиции по настоящему изобретению могут содержать соединение в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
[0043] Используемый в настоящем документе термин «фармацевтически приемлемый носитель, разбавитель или эксципиент» включает, без ограничения, любой адъювант, носитель, эксципиент, средство, способствующее скольжению, подсластитель, разбавитель, консервант, краситель/красящее вещество, усилитель вкуса, сурфактант, увлажняющее средство, диспергирующее средство, суспендирующее средство, стабилизатор, изотоническое средство, растворитель или эмульгатор, который утвержден Управлением по контролю за качеством пищевых продуктов и медикаментов США как приемлемый для использования применительно к человеку или домашним животным.
[0044] Кроме того, термин «млекопитающее» охватывает людей, а также домашних и лабораторных животных, домашних любимцев (например, кошек, собак, свиней, крупный рогатый скот, овец, коз, лошадей, кроликов) и не одомашненных животных, таких как дикие животные, и тому подобное.
[0045] Фармацевтические композиции по изобретению могут быть получены путем объединения соединения по изобретению с соответствующим фармацевтически приемлемым носителем, разбавителем или эксципиентом, и быть сформулированы в препараты в твердой, полутвердой, жидкой и газообразной формах, такие как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, инъекционные препараты, ингаляционные препараты, гели, микросферы и аэрозоли. Типичные пути введения таких фармацевтических композиций включают, без ограничения, пероральный, топический, чрескожный, ингаляционный, парентеральный, подъязычный, трансбуккальный, ректальный, вагинальный и интраназальный пути введения. Используемый в настоящем документе термин «парентеральный» путь введения включает подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или инфузии. Фармацевтические композиции по изобретению сформулированы так, чтобы содержащиеся в них активные ингредиенты могли быть биодоступными при введении композиции пациенту. Композиции, которые вводят субъекту или пациенту, имеют форму одной или более дозированных единиц, при этом, например, таблетка может представлять собой одну дозированную единицу, и контейнер с соединением по изобретению в аэрозольной форме может содержать множество дозированных единиц. Реальные способы получения таких лекарственных форм известны, или очевидны, специалистам в данной области; например, смотри Remington: The Science and Practice of Pharmacy, 20th Edition (Philadelphia College of Pharmacy and Science, 2000). Вводимая композиция в любом случае будет содержать терапевтически эффективное количество соединения по изобретению, или его фармацевтически приемлемой соли, для лечения интересующего заболевания или состояния в соответствии с идеями настоящего изобретения.
[0046] Фармацевтическая композиция по изобретению может находиться в твердой или жидкой форме. В одном аспекте носитель(и) являются твердыми частицами, так что композиции, например, находятся в таблетированной или порошковой форме. Носитель(и) могут быть жидкими, когда композиции, например, представляют собой пероральный сироп, инъекционный жидкий препарат или аэрозоль, который может быть использован, например, для ингаляции. Фармацевтическая композиция, предназначенная для перорального введения, предпочтительно находится либо в твердой, либо в жидкой форме, при этом полутвердые, полужидкие, суспензионные и гелевые формы включены в формы, рассматриваемые в настоящем документе как твердые или жидкие.
[0047] В качестве твердой композиции для перорального введения фармацевтическая композиция может быть сформулирована в форме порошка, гранулы, прессованной таблетки, пилюли, капсулы, жевательной резинки, облатки или тому подобного. Такая твердая композиция, как правило, будет содержать один или более инертных разбавителей или съедобных носителей. Кроме того, могут присутствовать одно или более из следующего: связывающие вещества, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиенты, такие как крахмал, лактоза или декстрины; дезинтегрирующие средства, такие как альгиновая кислота, альгинат натрия, примогель, кукурузный крахмал и тому подобное; смазывающие средства, такие как стеарат магния или стеротекс; вещества, способствующие скольжению, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин; ароматические добавки, такие как перечная мята, метилсалицилат или апельсиновый ароматизатор; и красящее средство.
[0048] Когда фармацевтическая композиция имеет форму капсулы, например, желатиновой капсулы, она может содержать, помимо вышеперечисленных материалов, жидкий носитель, такой как полиэтиленгликоль или масло.
[0049] Фармацевтическая композиция может находиться в жидкой форме, например, эликсир, сироп, раствор, эмульсия или суспензия. Жидкость может быть предназначена для перорального введения или для доставки путем инъекции, в качестве двух примеров. В случае использования для перорального введения предпочтительная композиция содержит, помимо настоящих соединений, одно или более из подсластителя, консервантов, красителя/красящего вещества и усилителя вкуса. В композицию, предназначенную для введения путем инъекции, может быть включено одно или более из сурфактанта, консерванта, увлажняющего средства, диспергирующего средства, суспендирующего средства, буфера, стабилизатора и изотонического средства.
[0050] Жидкие фармацевтические композиции по изобретению, являются ли они растворами, суспензиями или другими подобными формами, могут включать один или более из следующих адъювантов: стерильные разбавители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический солевой раствор, раствор Рингера, изотонический хлорид натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспензионной среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и средства для корректировки тоничности, такие как хлорид натрия или декстроза. Парентеральный препарат может быть заключен в ампулах, шприцах одноразового использования или многодозовых флаконах, выполненных из стекла или пластика. Физиологический солевой раствор является предпочтительным адъювантом. Инъекционная фармацевтическая композиция предпочтительно является стерильной.
[0051] Жидкая фармацевтическая композиция по изобретению, предназначенная для парентерального или перорального введения, должна содержать такое количество соединения по изобретению, чтобы была получена соответствующая доза.
[0052] Фармацевтическая композиция по изобретению может быть предназначена для топического введения, в этом случае носитель может представлять собой основу для раствора, эмульсии, мази или геля. Основа может, например, содержать одно или более из следующего: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, а также эмульгаторы и стабилизаторы. В фармацевтической композиции для топического введения могут присутствовать загустители. Композиция, предназначенная для чрескожного введения, может включать чрескожный пластырь или устройство для ионтофореза.
[0053] Фармацевтическая композиция по изобретению может быть предназначена для ректального введения в форме, например, суппозитория, который будет таять в прямой кишке и высвобождать лекарственное средство. Композиция для ректального введения может содержать маслянистую основу в качестве подходящего нераздражающего эксципиента. Такие основы включают, без ограничения, ланолин, масло какао и полиэтиленгликоль.
[0054] Фармацевтическая композиция по изобретению может содержать различные материалы, которые изменяют физическую форму твердой или жидкой дозированной единицы. Например, композиция может содержать материалы, которые образуют оболочку покрытия вокруг активных ингредиентов. Материалы, образующие оболочку покрытия, как правило, являются инертными, и могут быть выбраны, например, из сахара, шеллака и других энтеросолюбильных средств для покрытия. Альтернативно, активные ингредиенты могут быть заключены в желатиновой капсуле.
[0055] Фармацевтическая композиция по изобретению в твердой или жидкой форме может содержать средство, которое связывает соединение по изобретению и, тем самым, способствует доставке соединения. Подходящие средства, которые могут выступать в этом качестве, включают моноклональное или поликлональное антитело, белок или липосому.
[0056] Фармацевтическая композиция по изобретению может состоять из дозированных единиц, которые можно вводить в виде аэрозоля. Термин «аэрозоль» используют для обозначения различных систем, от систем коллоидной природы до систем, состоящих из находящихся под давлением упаковок. Доставка может осуществляться при помощи сжиженного или сжатого газа, или при помощи подходящей насосной системы, которая распределяет активные ингредиенты. Аэрозоли соединений по изобретению могут быть доставлены в однофазной, двухфазной или трехфазной системах для доставки активного ингредиента(ов). Для доставки аэрозоля необходим соответствующий контейнер, активаторы, клапаны, субконтейнеры и тому подобное, которые вместе могут составлять набор. Специалист в данной области без излишнего экспериментирования может определять предпочтительные аэрозоли.
[0057] Фармацевтические композиции по изобретению могут быть получены с помощью любой методологии, хорошо известной в фармацевтической области. Например, фармацевтическая композиция, предназначенная для введения инъекцией, может быть получена путем объединения соединения по изобретению со стерильной дистиллированной водой, с образованием раствора. Можно добавлять сурфактант для облегчения образования гомогенного раствора или суспензии. Сурфактанты представляют собой соединения, которые нековалентно взаимодействуют с соединением по изобретению, облегчая растворение или однородное суспендирование соединения в водной системе доставки.
Также фармацевтическая композиция по изобретению, в которой фармацевтически приемлемый эксципиент включает:
(a) микрокристаллическую целлюлозу в количестве от 20,0 до 40,0 масс% в расчете на общую массу композиции;
(b) лимонную кислоту в диапазоне количеств от 5,0 до 20,0 масс% в расчете на общую массу композиции;
(c) бикарбонат натрия в количестве от 5,0 до 25,0 масс% в расчете на общую массу композиции;
(d) лаурилсульфат натрия в количестве от 1,0 до 10,0 масс% в расчете на общую массу композиции;
(e) пирогенный диоксид кремния в количестве от 0,1 до 5,0 масс% в расчете на общую массу композиции; и
(f) стеарат магния в количестве от 0,1 до 5,0 масс% в расчете на общую массу композиции.
Предпочтительно, фармацевтическая композиция по изобретению, в которой фармацевтически приемлемый эксципиент включает:
(a) микрокристаллическую целлюлозу в количестве от 25,0 до 35,0 масс% в расчете на общую массу композиции;
(b) лимонную кислоту в диапазоне количеств от 15,0 до 25,0 масс% в расчете на общую массу композиции;
(c) бикарбонат натрия в количестве от 10,0 до 20,0 масс% в расчете на общую массу композиции;
(d) лаурилсульфат натрия в количестве от 3,0 до 8,0 масс% в расчете на общую массу композиции;
(e) пирогенный диоксид кремния в количестве от 0,1 до 2,0 масс% в расчете на общую массу композиции; и
(f) стеарат магния в количестве от 0,1 до 2,0 масс% в расчете на общую массу композиции.
Более предпочтительно фармацевтическая композиция по изобретению, в которой фармацевтически приемлемый эксципиент включает:
(a) микрокристаллическую целлюлозу в количестве от 30,0 до 35,0 масс% в расчете на общую массу композиции;
(b) лимонную кислоту в диапазоне количеств от 10,0 до 15,0 масс% в расчете на общую массу композиции;
(c) бикарбонат натрия в количестве от 13,0 до 17,0 масс% в расчете на общую массу композиции;
(d) лаурилсульфат натрия в количестве от 3,0 до 8,0 масс% в расчете на общую массу композиции;
(e) пирогенный диоксид кремния в количестве от 0,5 до 1,5 масс% в расчете на общую массу композиции; и
(f) стеарат магния в количестве от 0,5 до 1,5 масс% в расчете на общую массу композиции.[0058] В конкретных вариантах осуществления фармацевтическую композицию, содержащую соединение по настоящей заявке, вводят млекопитающему в количестве, достаточном для ингибирования активности Mnk после введения, и предпочтительно с приемлемым уровнем токсичности. Активность в отношении Mnk кристаллической формы соединения по настоящей заявке может определять квалифицированный специалист в данной области, например, как описано ниже в разделе «Примеры». Специалист в данной области может с легкостью определять соответствующие концентрации и дозы.
[0059] В следующем аспекте изобретения соединения по изобретению или фармацевтически приемлемые препараты соединений по изобретению предложены в качестве ингибиторов активности Mnk. Такое ингибирование достигается при создании контакта клетки, экспрессирующей Mnk, с соединением или фармацевтически приемлемым препаратом, для снижения или ингибирования активности Mnk, с целью обеспечения эффективности при лечении Mnk-зависимого состояния у млекопитающего, которое нуждается в этом.
[0060] Терапевтически эффективные дозы соединения по настоящей заявке или фармацевтической композиции по настоящей заявке, как правило, будут находиться в диапазоне от примерно 1 до 2000 мг/сутки, от примерно 10 до примерно 1000 мг/сутки, от примерно 10 до примерно 500 мг/сутки, от примерно 10 до примерно 250 мг/сутки, от примерно 10 до примерно 100 мг/сутки или от примерно 10 до примерно 50 мг/сутки. Терапевтически эффективные дозы можно вводить в одной или нескольких дозах. Следует понимать, однако, что конкретные дозы соединений по изобретению для конкретного пациента будут зависеть от различных факторов, таких как возраст, пол, масса тела, общее состояние здоровья, диета, индивидуальная реакция организма пациента, получающего лечение, время введения, степень тяжести заболевания, подвергаемого лечению, активность конкретного используемого соединения, лекарственная форма, способ введения и сопутствующее медикаментозное лечение. Терапевтически эффективное количество для конкретной ситуации легко может быть определено путем рутинных экспериментов, что находится в пределах компетенции обычного клинициста или врача. В любом случае соединение или композицию следует вводить в дозах таким образом, который позволяет доставлять терапевтически эффективное количество в зависимости от уникального состояния пациента.
[0061] Лекарственная форма, описанная в настоящем документе, предпочтительно также может включать разрыхлитель, который вызывает набухание и распад лекарственной формы при применении, например, в условиях содержимого желудка человека, позволяя активному фармацевтическому ингредиенту лекарственной формы высвобождаться с профилем немедленного высвобождения. Разрыхлители представляют собой ингредиенты фармацевтических лекарственных форм, различные примеры которых известны и коммерчески доступны. Примеры разрыхлителей включают композиции, состоящие из, или содержащие лимонную кислоту, бикарбонат натрия или любое сочетание двух или более из вышеперечисленных, и другие фармацевтически приемлемые материалы, сформированные в частицы с конкретным размером, плотностью и так далее, позволяющие вводить разрыхлитель в лекарственную форму, используемую для немедленного высвобождения.
[0062] Разрыхлитель может присутствовать в лекарственной форме немедленного высвобождения в любом участке, позволяющем разрыхлителю действовать нужным образом, расширяясь внутри интактной лекарственной формы при проглатывании и вызывая распад проглоченной лекарственной формы, с желаемым немедленным высвобождением активного фармацевтического ингредиента из лекарственной формы в желудок. Одним полезным местом нахождения разрыхлителя может быть в качестве компонента эксципиента, используемого для содержания частиц ядро-оболочка, содержащих активный фармацевтический ингредиент, описанный в настоящем документе, в такой лекарственной форме, как прессованная таблетка или капсула.
[0063] При включении в качестве эксципиента лекарственной формы разрыхлитель может присутствовать в количестве, полезном для достижения немедленного высвобождения АФИ лекарственной формы. Примеры полезных количеств разрыхлителя в лекарственной форме немедленного высвобождения, описанной в настоящем документе, могут находиться в диапазоне от 0,5 до 50 массовых процентов разрыхлителя в расчете на общую массу лекарственной формы, например, от 1 до 30 массовых процентов разрыхлителя в расчете на общую массу лекарственной формы. Количество разрыхлителя в матрице лекарственной формы может быть сопоставимо с этими количествами, например, разрыхлитель может быть включен в матрицу (например, всей лекарственной формы, в отличие от покрытых частиц или АФИ) лекарственной формы в количестве, находящемся в диапазоне от 0,5 до 50 массовых процентов разрыхлителя в расчете на общую массу матрицы, например, от 1 до 30 массовых процентов разрыхлителя в расчете на общую массу матрицы.
[0064] Описанная лекарственная форма также может включать любые из различных известных и общепринятых фармацевтических эксципиентов, которые могут быть полезны для достижения желаемого процессинга и эксплуатационных свойств лекарственной формы немедленного высвобождения. Эти эксципиенты включают наполнители, связывающие вещества, смазывающие средства, вещества, способствующее скольжению, и так далее, и могут быть включены в частицы ядро-оболочка или в матрицу (например, прессованную матрицу) таблетки или капсулы. Более подробное описание фармацевтических эксципиентов, которые также можно включать в таблетки по настоящему изобретению, можно найти в сборнике The Handbook of Pharmaceutical Excipients, 5-е издание (2006).
[0065] Примеры наполнителей, которые могут быть полезны в описанной лекарственной форме немедленного высвобождения, включают лактозу, крахмал, декстрозу, сахарозу, фруктозу, мальтозу, маннит, сорбит, каолин, микрокристаллическую целлюлозу, порошковую целлюлозу, сульфат кальция, фосфат кальция, фосфат дикальция, лактит или любое сочетание из вышеперечисленного.
[0066] Наполнитель может присутствовать в любой части описанной лекарственной формы, включая частицу ядро-оболочка; наполнитель может присутствовать в ядре, в слое, содержащем активный фармацевтический ингредиент, который расположен на ядре, в устойчивой к растворителю пленке, в матрице, либо в двух или более из этих частей лекарственной формы. Наполнитель может присутствовать в любой одной или более из этих частей лекарственной формы в количестве, достаточном для обеспечения желаемого процессинга и эксплуатационных свойств части лекарственной формы и всей лекарственной формы. Общее количество наполнителя в лекарственной форме также может быть таким, чтобы обеспечивать желаемую функциональность, включая профиль немедленного высвобождения, например, количество может находиться в диапазоне от 0 до 80 массовых процентов наполнителя в расчете на общую массу лекарственной формы, например, от 5 до 50 процентов наполнителя в расчете на общую массу лекарственной формы.
[0067] Примеры смазывающих средств включают неорганические материалы, такие как тальк (гидратированный силикат магния); полимеры, такие как, ПЭГ 4000; жирные кислоты, такие как стеариновая кислота; сложные эфиры жирных кислот, такие как сложные эфиры глицерина (например, глицерил моностеарат, глицерил трибегенат и глицерил дибегенат); сложные эфиры сахара (например, сорбитан моностеарат и сахарозы монопальмитат); глицерил дибегенат; и соли металлов жирных кислот (например, лаурилсульфат натрия, стеарат магния, стеарат кальция и стеарат цинка). Смазывающее средство может быть включено в лекарственную форму немедленного высвобождения в любом полезном количестве, например, в диапазоне от 0,1 до 10 массовых процентов смазывающего средства в расчете на общую массу лекарственной формы, например, от 0,5 до 7 массовых процентов смазывающего средства в расчете на общую массу лекарственной формы.
[0068] Примеры веществ, способствующих скольжению, включают коллоидный диоксид кремния, необработанный пирогенный диоксид кремния (AEROSOL 200®), а также кристаллический или плавленый кварц. Вещество, способствующее скольжению, может быть включено в описанную лекарственную форму немедленного высвобождения в любом полезном количестве.
Терапевтическое применение
[0069] Соединения по изобретению, или их фармацевтически приемлемые соли, вводят в терапевтически эффективном количестве, которое будет варьироваться в зависимости от различных факторов, включая активность конкретного используемого соединения; метаболическую стабильность и продолжительность действия соединения; возраст, массу тела, общее состояние здоровья, пол и диету пациента; способ и время введения; скорость экскреции; сочетание лекарственных средств; степень тяжести конкретного заболевания или состояния; и субъекта, получающего терапию.
[0070] «Эффективное количество», или «терапевтически эффективное количество», означает количество соединения по изобретению, которое при введении млекопитающему, предпочтительно человеку, является достаточным для осуществления лечения, как описано ниже, Mnk-связанного состояния или заболевания у млекопитающего, предпочтительно человека. Количество соединения по изобретению, которое составляет «терапевтически эффективное количество», будет варьироваться в зависимости от соединения, состояния и его тяжести, способа введения, а также возраста млекопитающего, которого предстоит лечить, но может быть определено обычным способом специалистом в данной области с учетом его собственных знаний и настоящего изобретения.
[0071] Соединения по изобретению, или их фармацевтически приемлемую соль, также можно вводить одновременно с, до или после введения одного или более других терапевтических средств. Такая комбинированная терапия включает введение одного фармацевтического препарата, содержащего соединение по изобретению и одно или более дополнительных активных средств, а также введение соединения по изобретению и каждого активного средства в его отдельном фармацевтическом препарате. Например, соединение по изобретению и другое активное средство можно вводить пациенту совместно в одной пероральной дозированной композиции, такой как таблетка или капсула, или каждое средство можно вводить в отдельном пероральном лекарственном препарате. В случае использования отдельных лекарственных препаратов соединения по изобретению и одно или более дополнительных активных средств можно вводить практически в одно и то же время, то есть, одновременно, или ступенчато в разные моменты времени, то есть, последовательно; понятно, что комбинированная терапия включает все эти режимы.
[0072] В конкретных вариантах осуществления раскрытые соединения полезны для ингибирования активности Mnk и/или могут быть полезны для анализа сигнальной активности Mnk в модельных системах, и/или для предотвращения, лечения или облегчения симптома, связанного с заболеванием, нарушением или патологическим состоянием, зависимым от Mnk, предпочтительно таким, которое поражает людей. Соединение, которое ингибирует активность Mnk, будет полезным для предотвращения, лечения, облегчения или ослабления симптома или прогрессирования заболеваний, связанных с неконтролируемым ростом, пролиферацией и/или выживанием клеток, несоответствующими клеточными иммунными реакциями или несоответствующими клеточными воспалительными реакциями; или заболеваний, которые сопровождаются неконтролируемым ростом, пролиферацией и/или выживанием клеток, несоответствующими клеточными иммунными реакциями или несоответствующими клеточными воспалительными реакциями, в частности, при которых неконтролируемый рост, пролиферация и/или выживание клеток, несоответствующие клеточные иммунные реакции или несоответствующие клеточные воспалительные реакции опосредованы Mnk, таких как, например, гематологические опухоли, солидные опухоли и/или их метастазы, включая лейкозы и миелодиспластический синдром, макроглобулинемию Вальденстрема и злокачественные лимфомы, например, B-клеточную лимфому, T-клеточную лимфому, волосатоклеточную лимфому, лимфому Ходжкина, неходжскинскую лимфому и лимфому Беркитта, опухоли головы и шеи, включая опухоли мозга и метастазы в мозге, опухоли грудной клетки, включая немелкоклеточные и мелкоклеточные опухоли легкого, опухоли желудочно-кишечного тракта, эндокринные опухоли, опухоли молочных желез и другие гинекологические опухоли, урологические опухоли, включая опухоли почек, мочевого пузыря, предстательной железы, опухоли кожи и саркомы и/или их метастазы.
[0073] Кроме того, соединения по изобретению и их фармацевтические композиции являются потенциальными терапевтическими средствами для профилактики и/или терапии связанных с цитокинами заболеваний, таких как воспалительные заболевания, аллергия или другие состояния, связанные с провоспалительными цитокинами. Иллюстративные воспалительные заболевания включают, без ограничения, хроническое или острое воспаление, воспаление суставов, такое как хронический воспалительный артрит, ревматоидный артрит, псориатический артрит, остеоартрит, ювенильный ревматоидный артрит, синдром Рейтера, ревматоидный травматический артрит, артрит вследствие краснухи, острый синовит и подагрический артрит; воспалительные кожные заболевания, такие как солнечные ожоги, псориаз, эритродермический псориаз, пустулезный псориаз, экзема, дерматит, острое или хроническое отторжение трансплантата, атопический дерматит, контактный дерматит, крапивница и склеродермия; воспаление желудочно-кишечного тракта, например, воспалительное заболевание кишечника, болезнь Крона и связанные состояния, язвенный колит, колит и дивертикулит; нефрит, уретрит, сальпингит, оофорит, эндомиометрит, спондилит, системную красную волчанку и связанные заболевания, рассеянный склероз, астму, менингит, миелит, энцефаломиелит, энцефалит, флебит, тромбофлебит, респираторные заболевания, такие как астма, бронхит, хроническая обструктивная болезнь легких (ХОБЛ), воспалительные легочные заболевание и респираторный дистресс-синдром у взрослых, а также аллергический ринит; эндокардит, остеомиелит, ревматическую атаку, ревматический перикардит, ревматический эндокардит, ревматический миокардит, ревматическую недостаточность митрального клапана, ревматическое поражение аорты, простатит, простатоцистит, спондоартропатии, анкилозирующий спондилит, синовит, теносиновит, миозит, фарингит, ревматическую полимиалгию, тендинит плеча или бурсит, подагру, псевдо-подагру, васкулиты, воспалительные заболевания щитовидной железы, выбранные из гранулематозного тиреоидита, лимфоцитарного тиреоидита, инвазивного фиброзного тиреоидита, острого тиреоидита; тиреоидит Хашимото, болезнь Кавасаки, феномен Рейно, синдром Шегрена, нейровоспалительное заболевание, сепсис, конъюнктивит, кератит, иридоциклит, неврит зрительного нерва, отит, лимфаденит, назопахарингит, синусит, фарингит, тонзиллит, ларингит, эпиглоттит, бронхит, пневмонит, стоматит, гингивит, эзофагит, гастрит, перитонит, гепатит, желчнокаменную болезнь, холецистит, гломерулонефрит, синдром Гудпасчера, серповидный гломерулонефрит, панкреатит, эндомиометрит, миометрит, метрит, цервицит, эндоцервицит, экзоцервицит, параметрит, туберкулез, вагинит, вульвит, силикоз, саркоидоз, пневмокониоз, пирез, воспалительные полиартропатии, псориатические артропатии, фиброз кишечника, бронхоэктазы и энтеропатические артропатии.
[0074] Соответственно, некоторые варианты осуществления относятся к способу лечения Mnk-зависимого состояния у млекопитающего, которое нуждается в этом, включающему введение эффективного количества фармацевтической композиции, описанной выше (то есть, фармацевтической композиции, содержащей любое одно или более соединений по настоящей заявке), млекопитающему.
[0075] Как описано выше, нарушение регуляции белкового синтеза является распространенным явлением при раке человека. Ключевым регулятором трансляционного контроля является eIF4E, активность которого является ключевым фактором туморогенности. Поскольку активация eIF4E включает фосфорилирование ключевого остатка серина (Ser209) конкретно киназами, взаимодействующими с MAP-киназой (Mnk), ингибиторы Mnk являются подходящими потенциальными терапевтическими средствами для лечения пролиферативных заболеваний, таких как рак. Самые разные виды рака, включая солидные опухоли, лимфомы и лейкозы, являются восприимчивыми к лечению композициями и способами, раскрытыми в настоящем документе. Виды рака, которые можно лечить, включают, но без ограничения: аденокарциному молочной железы, предстательной железы и толстой кишки; все формы бронхогенной карциномы легкого; миелоидные новообразования; меланому; гепатому; нейробластому; папиллому; апудому; хористому; бранхиому; злокачественный карциноидный синдром; карциноидную болезнь сердца и карциному (например, Уокера, базальноклеточную, базосквамозную, Брауна-Пирса, протоковую, опухоль Эрлиха, Кребса 2, из клеток Меркеля, муцинозную, немелкоклеточную легкого, овсяно-клеточную, папиллярную, скиррозную, бронхиолярную, бронхогенную, плоскоклеточную и переходно-клеточную). Дополнительные виды рака, которые можно лечить, включают: гистиоцитарные заболевания; острый и хронический лейкоз, как миелоидный, так и лимфоидный/лимфобластный, включая волосатоклеточный лейкоз; злокачественный гистиоцитоз; болезнь Ходжкина; иммунопролиферативную болезнь тонкого кишечника; лимфому Ходжкина; B-клеточную и T-клеточную неходжскинскую лимфому, в том числе диффузную крупноклеточную B-клеточную лимфому и лимфому Беркитта; плазмацитому; ретикулоэндотелиоз; меланому; множественную миелому; хондробластому; хондрому; хондросаркому; фиброму; фибросаркому; миелофиброз; гигантоклеточные опухоли; гистиоцитому; липому; липосаркому; мезотелиому; миксому; миксосаркому; остеому; остеосаркому; хордому; краниофарингиому; дисгерминому; гамартому; мезенхимому; мезонефрому; миосаркому; амелобластому; цементому; одонтому; тератому; тимому; трофобластическую опухоль.
[0076] Другие виды рака, которые можно лечить с использованием соединений по изобретению, включают, без ограничения, аденому; холангиому; холестеатому; циклиндрому; цистаденокарциному; цистаденому; гранулезоклеточную опухоль; гинандробластому; гепатому; гидраденому; опухоль островков поджелудочной железы; опухоль из клеток Лейдига; папиллому; опухоль из клеток Сертоли; текаклеточную опухоль; леймеому; лейомиосаркому; миобластому; миому; миосаркому; рабдомиому; рабдомиосаркому; эпендимому; ганглионеврому; глиому; медуллобластому; менингиому; неврилеммому; нейробластому; нейроэпителиому; нейрофиброму; неврому; параганглиому; нехромаффинную параганглиому.
[0077] В одном варианте осуществления соединения по изобретению являются потенциальными терапевтическими средствами для лечения таких видов рака, как ангиокератома; ангиолимфоидная гиперплазия с эозинофилией; склерозирующая ангиома; ангиоматоз; гломангиома; гемангиоэндотелиома; гемангиома; гемангиоперицитома; гемангиосаркома; лимфангиома; лимфангиомиома; лимфангиосаркома; пинеалома; карциносаркома; хондросаркома; филлоидная саркома; фибросаркома; гемангиосаркома; лейомиосаркома; лейкосаркома; липосаркома; лимфангиосаркома; миосаркома; миксосаркома; карцинома яичника; рабдомиосаркома; саркома; новообразования; нерофиброматоз и дисплазия шейки матки.
[0078] В конкретном варианте осуществления настоящее изобретение относится к способам лечения рака толстого кишечника, колоректального рака, рака желудка, рака щитовидной железы, рака легкого, лейкоза, рака поджелудочной железы, меланомы, множественной меланомы, рака головного мозга, первичного и вторичного рака ЦНС, включая злокачественную глиому и глиобластому, рака почки, рака предстательной железы, включая кастрационно-резистентный рак предстательной железы, рака яичника или рака молочной железы, включая трижды негативный, HER2-положительный и положительный по гормональным рецепторам рак молочной железы. В соответствии с таким способом терапевтически эффективное количество по меньшей мере одного соединения по настоящей заявке, или его стереоизомера, таутомера или сольвата, можно вводить субъекту, у которого было диагностировано пролиферативное заболевание, такое как рак. Альтернативно, фармацевтическую композицию, содержащую по меньшей мере одно соединение по настоящей заявке, или его стереоизомер, таутомер или сольват, можно вводить субъекту, у которого был диагностирован рак.
[0079] В конкретных вариантах осуществления соединения по изобретению вводят субъекту, страдающему от рака, в сочетании с другими общепринятыми видами противораковой терапии, такими как лучевая терапия или хирургическая операция. Лучевая терапия хорошо известна в данной области и включает рентгенотерапию, такую как гамма-облучение, и терапию радиофармацевтическим средством.
[0080] В конкретных вариантах осуществления ингибирующие Mnk соединения по изобретению используют с по меньшей мере одним противораковым средством. Противораковые средства включают химиотерапевтические лекарственные средства. Химиотерапевтическое средство включает, но без ограничения, ингибитор функции хроматина, ингибитор топоизомеразы, ингибитор сборки микротрубочек, повреждающее ДНК средство, антиметаболит (например, антагонисты фолатных рецепторов, аналоги пиримидинов, аналоги пуринов и аналоги с модифицированным сахаром), ингибитор синтеза ДНК, взаимодействующее с ДНК средство (например, интеркалирующее средство) и ингибитор репарации ДНК.
[0081] Иллюстративные химиотерапевтические средства включают, без ограничений, следующие группы: антиметаболиты/противораковые средства, такие как аналоги пиримидинов (5-фторурацил, флоксуридин, капецитабин, гемцитабин и цитарабин) и аналоги пуринов, антагонисты фолатных рецепторов и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин (кладрибин)); антипролиферативные/антимитотические средства, включая природные продукты, такие как алкалоиды барвинка (винбластин, винкристин и винорелбин), средства, разрушающие микротрубочки, такие как таксан (паклитаксел, доцетаксел), винкристин, винбластин, нокодазол, эпотилоны и навельбин, эпидиподофиллотоксины (этопозид, тенипозид), повреждающие ДНК средства (актиномицин, амсакрин, антрациклины, блеомицин, бусульфан, камптотецин, карбоплатин, хлорамбуцил, цисплатин, циклофосфамид, цитоксан, дактиномицин, даунорубицин, доксорубицин, эпирубицин, гексаметилмеламиноксалиплатин, ифосфамид, мелфалан, мехлорэтамин, митомицин, митоксантрон, нитрозомочевину, пликамицин, прокарбазин, таксол, таксотер, темозоламид, тенипозид, триэтилентиофосфорамид и этопозид (VP 16)); антибиотики, такие как дактиномицин (актиномицин D), даунорубицин, доксорубицин (адриамицин), идарубицин, антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин; ферменты (L-аспарагиназу, которая системно метаболизирует L-аспарагин и лишает его клетки, не способные синтезировать собственный аспарагин); антитромбоцитарные средства; антипролиферативные/антимитотические алкилирующие средства, такие как азотистые иприты (мехлорэтамин, циклофосфамид и аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты -бусульфан, нитрозомочевину (кармустин (BCNU) и аналоги, стрептозоцин), тразены-дакарбазин (DTIC); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат); комплексные соединения платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевину, митотан, аминоглутетимид; гормоны, аналоги гормонов (эстроген, тамоксифен, гозерелин, бикалутамид, нилутамид) и ингибиторы ароматазы (лектрозол, анастрозол); антикоагулянты (гепарин, синтетические соли гепарина и другие ингибиторы тромбина); фибринолитические средства (такие как тканевой активатор плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрел, абциксимаб; средства, ингибирующие миграцию; средства, ингибирующие секрецию (бревелдин); иммуносупрессоры (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, микофенолят мофетил); антиангиогенные соединения (TNP470, генистеин) и ингибиторы факторов роста (ингибиторы фактора роста эндотелия сосудов (VEGF), ингибиторы фактора роста фибробластов (FGF)); блокатор рецепторов ангиотензина; доноры оксида азота; антисмысловые олигонуклеотиды; антитела (трастузумаб, ритуксимаб); химерные антигенные рецепторы; ингибиторы клеточного цикла и индукторы дифференциации (третиноин); ингибиторы mTOR, ингибиторы топоизомеразы (доксорубицин (адриамицин), амсакрин, камптотецин, даунорубицин, дактиномицин, энипозид, эпирубицин, этопозид, идарубицин, иринотекан (CPT-11) и митоксантрон, топотекан, иринотекан), кортикостероиды (кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизон и пренизолон); ингибиторы киназы сигнальной трансдукции факторов роста; индукторы нарушения митохондриальной функции, токсины, такие как холерный токсин, рицин, экзотоксин псевдомонад, аденилатциклазный токсин Bordetella pertussis или дифтерийный токсин, и активаторы каспазы; а также разрушители хроматина.
[0082] В конкретных вариантах осуществления ингибитор Mnk по настоящему изобретению используют одновременно, в одном и том же препарате или в разных препаратах, либо последовательно, с дополнительным средством(ами) как часть режима комбинированной терапии.
[0083] Ингибиторы Mnk по настоящей заявке, включая их соответствующие сольваты и фармацевтические композиции, также эффективны в качестве терапевтических средств для лечения или предотвращения опосредованных цитокинами заболеваний, таких как воспаление, у пациента, предпочтительно у человека. В одном варианте осуществления соединение или композиция по изобретению особенно полезны для лечения или предотвращения заболевания, выбранного из хронического или острого воспаления, хронического воспалительного артрита, ревматоидного артрита, псориаза, ХОБЛ, воспалительного заболевания кишечника, септического шока, болезни Крона, язвенного колита, рассеянного склероза и астмы.
[0084] Соединения по изобретению, их соответствующие сольваты и фармацевтически приемлемые композиции являются потенциальными терапевтическими средствами для лечения мозговых нарушений, которые включают, без ограничения, аутизм, синдром ломкой X-хромосомы, болезнь Паркинсона и болезнь Альцгеймера. Лечение осуществляют путем введения субъекту, который нуждается в лечении, соединения по настоящей заявке или его фармацевтически приемлемой композиции.
ПРИМЕРЫ
[0085] В схемах синтеза, описанных ниже, если нет иных указаний, все значения температуры приведены в градусах Цельсия, и все части и процентные доли приведены по массе. Реагенты приобретают у коммерческих поставщиков и используют без дополнительной очистки, если нет иных указаний. Все растворители приобретают у коммерческих поставщиков и используют в таком виде, как получены.
[0086] Приведенные ниже реакции, как правило, проводят в условиях положительного давления азота или аргона при температуре окружающей среды (если нет иных указаний) в безводных растворителях, и реакционные сосуды снабжены резиновыми перегородками (для колб) и колпачками (для флаконов) для введения субстратов и реагентов при помощи шприца. Стеклянную посуду сушат в сушильной камере и/или путем нагревания. Реакционные смеси анализируют методом ТСЖ и/или анализируют методом ЖХ-МС, и реакцию останавливают на основании расходования исходного материала. Иногда реакции останавливают раньше, поскольку искомые продукты начинают распадаться.
[0087] Аналитическую тонкослойную хроматографию (ТСХ) можно проводить на стеклянных пластинах, предварительно покрытых силикагелем, 60 F254 0,25-мм пластинах (EMD Chemicals), и визуализировать с использованием УФ-света (254 нм) и/или нанесения иода на силикагель и/или нагревания с окрашиванием ТСХ например, этанольным раствором фосфомолибдиновой кислоты, раствором нингидрина, раствором перманганата калия или раствором сульфата церия.
[0088] 1H-ЯМР спектры можно записывать на спектрофотометре Varian, работающем на частоте 400 МГц. Спектры ЯМР получают для растворов в CDCl3 (ppm) с использованием хлороформа в качестве эталонного стандарта (7,27 ppm для протона и 77,00 ppm для углерода), растворов в CD3OD с использованием 3,4 ppm и 4,8 ppm в качестве эталонных стандартов для протонов и 49,3 ppm в качестве эталонного стандарта для углерода, в DMSO-d6 (2,49 ppm для протона), или с внутренним стандартом тетраметилсиланом (0,00 ppm), когда это уместно. Другие растворители для ЯМР используют по мере необходимости. При указании мультиплетности пиков используют следующие сокращения: с (синглет), д (дублет), т (триплет), к (квартет), м (мультиплет), уш. (уширенный), уш.с (уширенный синглет), дд (дублет дублетов), дт (дублет триплетов). Константы взаимодействия, в случае их указания, указывают в герцах (Гц).
[0089] Следующие далее примеры приведены исключительно с целью иллюстрации.
Пример 1: Схема синтеза кристаллической формы A 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона (5)
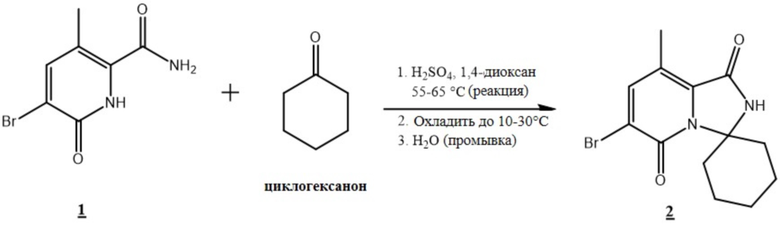
[0090] Синтез кристаллической формы A (5). 5-бром-3-метил-6-оксо-1,6-дигидропиридин-2-карбоксамид (1) объединяли с циклогексаноном в 1,4-диоксане. Добавляли серную кислоту, и температуру смеси доводили до 55°C - 65°C. Типичное время реакции составляло 1 час. После завершения температуру смеси доводили до 10°C - 30°C и перемешивали в течение примерно 6 часов. Полученные твердые вещества отфильтровывали, промывали водой, а затем сушили в вакууме, получая бромид (2) с примерным выходом 92%.
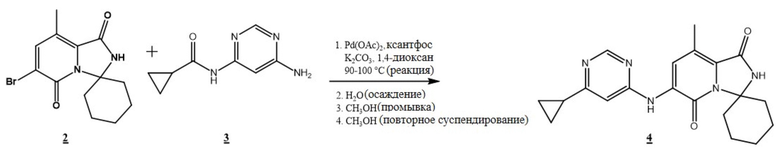
[0091] Бромид (2) объединяли с аминопиримидином (3) с карбонатом калия, ацетатом палладия (II) и 4,5-бис(дифенилфосфино)-9,9-диметилксантеном (ксантфос) в 1,4-диоксане в атмосфере азота. Температуру смеси доводили до 90°C - 100°C и перемешивали в течение примерно 18 часов. После завершения температуру доводили до комнатной температуры, а затем добавляли воду. Полученное твердое вещество отфильтровывали и затем промывали метанолом. Получали густую суспензию твердого вещества в метаноле при температуре 55°C - 65°C с необязательным введением затравки, охлаждали, фильтровали, а затем сушили в вакууме, получая циклопропилпиримидин (4) с примерным выходом 98%.
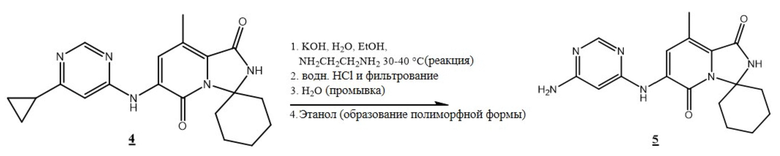
[0092] Циклопропилпиримидин (4) перемешивали с водой, этанолом и этилендиамином, а затем обрабатывали гидроксидом калия при температуре 30°C - 40°C. Перемешивание продолжали до завершения реакции по результатам ВЭЖХ. Необязательно, добавляли вторую порцию гидроксида калия. Типичное время реакции составляло 12 часов. Смесь фильтровали, и фильтрат обрабатывали соляной кислотой для доведения значения pH до примерно 9, получая 6-аминопиримидин (5) в виде свободного основания.
[0093] 6-аминопиримидин (5) возвращали в реакционный сосуд и суспендировали в водном этаноле при температуре 35°C - 45°C, охлаждали до комнатной температуры, фильтровали, а затем промывали этанолом. Влажный прессованный осадок сушили в вакууме до постоянной массы, получая форму A 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона (5) с примерным выходом 79%. Смотри Фигуру 1 и Таблицу 1.
[0094] Низкая растворимость циклопропилпиримидина (4) и свободного основания 6-аминопиримидина (5), а также соли соляной кислоты соединения (5) исключала использование обычных связанных с твердой подложкой поглотителей палладия (например, SILIAMETS® Thiol). Реакционная смесь была однородной после основного гидролиза циклопропиламида (KOH в 1:1:1 смеси THF/этанол/вода), при этом неожиданно было обнаружено, что использование этилендиамина приводило к снижению уровней палладия (II) до уровней, соответствующих допустимому суточного пределу, исходя из клинической дозы. При том, что в более ранних исследованиях использовали активированный уголь, это не могло снизить остаточный уровень палладия для соответствия допустимому суточного пределу, исходя из клинической дозы.
[0095] В кинетическом исследовании с целью обеспечения образования высокостабильного кристаллического твердого вещества был идентифицирован этанол в качестве системы растворителя для этапа получения конечной суспензии при синтезе формы A. Например, свободное основание (5) было суспендировано при температуре окружающей среды в разных системах растворителя, при разных температурах, с разными количествами воды. При использовании каждого растворителя твердые вещества выделяли для анализа РПД через 2, 4, 6, 24 и 72 часа. Затем рассчитывали равновесную растворимость в этих растворителях и использовали для выбора этанола для этапа получения конечной суспензии. Разница в свободной энергии между твердыми фазами с одним и тем же составом (то есть, полиморфные формы, гидраты или сольваты) прямо пропорциональна их относительной растворимости. Наиболее термодинамически стабильной полиморфной формой в изучаемых условиях является форма A.
[0096] Таблица 1. Таблица пиков РПД для формы A соединения (5)
[0097] Синтез кристаллической формы B соединения (5). Используя свободное основание (5), синтезированное, как описано выше, 6-аминопиримидин (5) суспендировали в смеси 39:61 (об/об) изопропанол/хлороформ. Суспензию сушили с продувкой азотом, получая форму B соединения (5). Смотри Фигуру 2 и Таблицу 2.
[0098] Таблица 2. Таблица пиков РПД для формы B соединения (5)
[0099] Синтез кристаллической формы C соединения (5). Используя свободное основание (5), 6-аминопиримидин (5) в достаточном количестве объединяли с этилендиамином, получая густую суспензию. Суспензию герметично закрывали в реакторе и перемешивали при комнатной температуре или при 40°C в течение 4-5 дней, получая форму C соединения (5). Аналитические данные показали, что форма C представляет собой моно-сольват этилендиамина. Смотри Фигуру 3 и Таблицу 3.
[0100] Таблица 3. Таблица пиков РПД для формы C соединения (5)
[0101] Синтез кристаллической формы D соединения (5). 6-аминопиримидин (5) объединяли с раствором смеси 25:75 (об/об) этанол/гексафторизопропанол, получая концентрированную смесь в небольшом флаконе. Флакон откупоривали и помещали в герметичный контейнер, содержащий этанол в качестве антирастворителя. Герметично закрытый контейнер выдерживали в условиях окружающей среды до обнаружения в растворе твердого вещества, которое представляло собой форму D соединения (5). Аналитические данные показали, что форма D представляет собой сольват гексафторизопропанола. Смотри Фигуру 4 и Таблицу 4.
[0102] Таблица 4. Таблица пиков РПД для формы D соединения (5)
Пример 2:
Получение капсул формы A
[0103] В соответствии с Таблицей 5, фармацевтическая композиция, содержащая кристаллические твердые вещества по настоящей заявке, может содержать фармацевтически приемлемые носители, разбавители и/или эксципиенты. В неограничивающем варианте осуществления композиция содержит форму A соединения (5), разрыхлитель, наполнитель, смазывающее вещество и вещество, способствующее скольжению. Было установлено, что микроионизация свободного основания, с включением эксципиентов, приводила к получению капсулы, обладающей неожиданной стабильностью в сравнении с солью соляной кислоты соединения (5) в виде препарата «порошок во флаконе».
[0104] Таблица 5. Получение капсул формы A соединения (5)
[0105] Различные варианты осуществления, описанные выше, можно объединять, получая дополнительные варианты осуществления. Все из патентов США, публикаций патентных заявок США, патентных заявок США, иностранных патентов, иностранных патентных заявок и не патентных публикаций, упомянутых в настоящей спецификации и/или перечисленных в информационном листке заявки, включены в настоящий документ посредством ссылки в полном объеме. Аспекты вариантов осуществления могут быть модифицированы, при необходимости, для использования концепций различных патентов, патентных заявок и публикаций с целью получения дополнительных вариантов осуществления.
[0106] Эти и другие изменения можно вносить в варианты осуществления в свете приведенного выше подробного описания. Как правило, в следующей далее формуле изобретения используемые термины не следует считать ограничивающими формулу изобретения конкретными вариантами осуществления, раскрытыми в спецификации и формуле изобретения, но следует считать включающими все возможные варианты осуществления наряду с полным объемом эквивалентов, которые соответствуют такой формуле изобретения. Соответственно, формула изобретения не ограничена описанием изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕТРАГИДРОПИРАНИЛ АМИНО-ПИРРОЛОПИРИМИДИНОН И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2020 |
|
RU2747991C1 |
| ТЕТРАГИДРОПИРАНИЛ АМИНО-ПИРРОЛОПИРИМИДИНОН И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2015 |
|
RU2715421C2 |
| ПРЕПАРАТЫ { 2-[(1S)-1-(3-ЭТОКСИ-4-МЕТОКСИФЕНИЛ)-2-МЕТАНСУЛЬФОНИЛЭТИЛ]-3-ОКСО-2,3-ДИГИДРО-1H-ИЗОИНДОЛ-4-ИЛ} АМИДА ЦИКЛОПРОПАНКАРБОНОВОЙ КИСЛОТЫ | 2012 |
|
RU2627471C2 |
| СПОСОБЫ И КОМПОЗИЦИИ С ИСПОЛЬЗОВАНИЕМ ИММУНОМОДУЛИРУЮЩИХ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ И ПОДДЕРЖАНИЯ СОСТОЯНИЯ ПРИ РАКЕ И ДРУГИХ ЗАБОЛЕВАНИЯХ | 2004 |
|
RU2348407C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2744897C2 |
| КОМБИНАЦИЯ ИНГИБИТОРА ГИСТОНДЕАЦЕТИЛАЗЫ И ИНГИБИТОРА ПРОТЕИНКИНАЗЫ И ЕЕ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2770754C1 |
| ПРОМЕЖУТОЧНЫЕ ХИМИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 2013 |
|
RU2635359C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И СОЛЬВАТЫ АВТ-263 ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ BCL-2 | 2010 |
|
RU2551376C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2726367C2 |
| КОМБИНИРОВАННЫЕ ТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2759963C2 |
Изобретение относится к способу получения кристаллического твердого соединения 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона, имеющего структуру (I), где кристаллическое твердое соединение имеет диаграмму рентгеновской порошковой дифракции с характерными пиками, выраженными в значениях градусов 2θ±0,2, при 8,07; 10,81; 14,68 и 22,07. Способ осуществляют путем (а) образования суспензии 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона в водном этаноле при температуре от 35 до 45°С, (b) охлаждения суспензии до комнатной температуры, (c) фильтрования суспензии для выделения прессованного осадка твердого вещества, (d) промывки прессованного осадка водным этанолом и (e) сушки прессованного осадка под вакуумом до постоянной массы. Технический результат – получение термодинамически стабильной полиморфной формы 6'-((6-аминопиримидин-4-ил)амино)-8'-метил-2'H-спиро[циклогексан-1,3'-имидазо[1,5-a]пиридин]-1',5'-диона. 3 з.п. ф-лы, 5 табл., 4 ил., 1 пр.
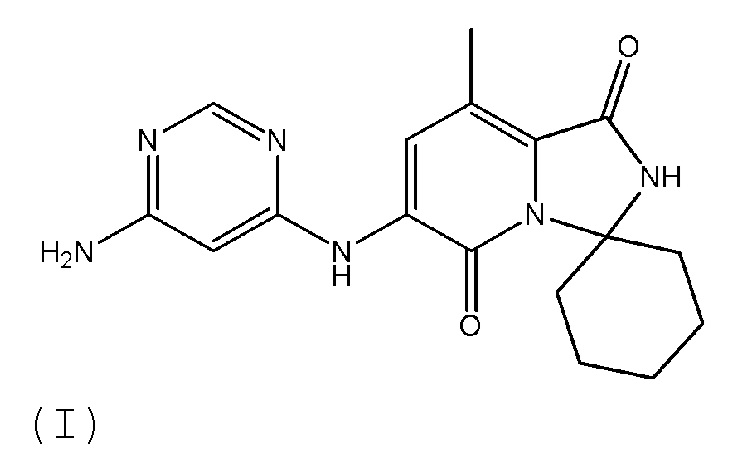
1. Способ получения кристаллического твердого соединения, имеющего структуру
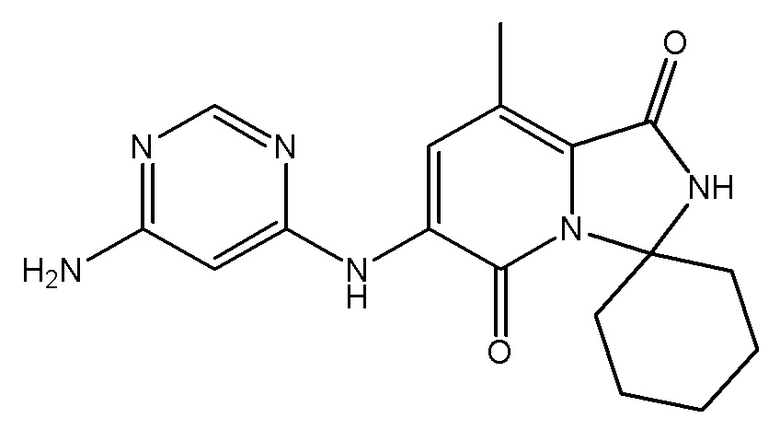 ,
,
где кристаллическое твердое соединение имеет диаграмму рентгеновской порошковой дифракции с характерными пиками, выраженными в значениях градусов 2θ±0,2, при 8,07; 10,81; 14,68 и 22,07, включающий:
а) образование суспензии соединения (5) в водном этаноле при температуре от 35 до 45°С;
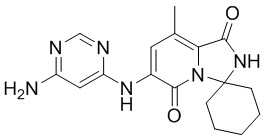 (5)
(5)
b) охлаждение суспензии до комнатной температуры;
c) фильтрование суспензии для выделения прессованного осадка твердого вещества;
d) промывку прессованного осадка водным этанолом; и
e) сушку прессованного осадка под вакуумом до постоянной массы.
2. Способ по п. 1, где кристаллическое твердое соединение имеет диаграмму рентгеновской порошковой дифракции с характерными пиками, выраженными в значениях градусов 2θ±0,2, при 8,07; 10,81; 12,00; 12,37; 13,79; 14,68; 15,39; 16,19; 16,69; 17,34; 18,89; 20,26; 21,15; 21.30; 21,77; 22,07; 22,84; 23,49; 24,40; 24,90; 25,34; 25,75; 26,12; 26,54; 27,16; 27,48; 28,06; 28,76; 29,04; 29,26 и 29,59.
3. Способ по п. 1, где кристаллическое твердое соединение характеризуется диаграммой рентгеновской порошковой дифракции, практически такой, как показано на ФИГ. 1.
4. Способ по п. 1, включающий:
a) взаимодействие соединения (1)
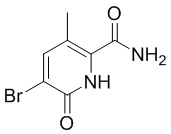 (1)
(1)
с циклогексаноном и серной кислотой с получением соединения (2)
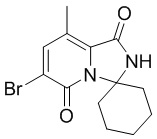 (2)
(2)
b) взаимодействие соединения (2) с соединением (3)
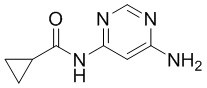 (3)
(3)
в присутствии Pd(OAc)2 и карбоната калия с образованием соединения (4)
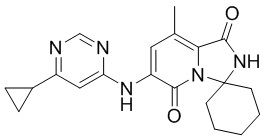 (4)
(4)
c) взаимодействие соединения (4) с этилендиамином и гидроксидом калия с получением соединения (5)
 (5).
(5).
| US 9382248 B2, 05.07.2015 | |||
| ЕА 201790078 А1, 31.05.2017 | |||
| Siegfried H.Reich, et al | |||
| Способ выделения сульфокислот из нефтяных масел | 1913 |
|
SU508A1 |
| Journal of Medicinal Chemistry, 2018, vol.61(8), p.3516-3540 | |||
| MINO R | |||
| CAIRA: | |||
Авторы
Даты
2024-06-19—Публикация
2019-10-23—Подача