Настоящее изобретение относится к способу превращения H2S в элементарную серу и серную кислоту, необязательно при установленном соотношении между элементарной серой и серной кислотой.
H2S является обычным побочным продуктом во многих процессах, включая гидрообессеривание потоков нефтеперерабатывающих заводов и производство вискозы. Желательно преобразовать H2S до выброса в атмосферу, поскольку H2S очень токсичен, имеет неприятный запах и представляет опасность для окружающей среды.
Процессы нефтепереработки, помимо получения хорошо известного высококонцентрированного газа H2S, часто могут также производить так называемый газ из отпарной колонны кислых вод, который содержит H2S, Н2О и NH3 примерно в равных молярных количествах.
В частности, на нефтеперерабатывающих заводах в качестве процесса для снижения выбросов H2S был выбран процесс Клауса, который был известен и оптимизировался более 8 десятилетий. Процесс Клауса протекает путем субстехиометрического сжигания H2S с образованием SO2 в печи реакции Клауса, обеспечивая сырьевой газ для конвертера Клауса. На последующих стадиях процесса Клауса H2S и SO2 преобразуют с образованием элементарной серы, которую можно конденсировать и отводить.
Как правило, эффективность удаления серы в процессе Клауса составляет от 95% до 98%, что недостаточно для соблюдения экологических норм. Поэтому общепринятой практикой является обработка остаточных газов после процесса Клауса, чтобы обеспечить снижение содержания серы выше 99%. Обработку остаточного газа иногда проводят на заводе по производству серной кислоты, что требует обращения с серной кислотой.
В настоящее время установлено, что серная кислота может быть рециркулирована в печь реакции Клауса, где она может способствовать образованию серы и, кроме того, предоставить возможности для оптимизации размеров оборудования для процесса Клауса и эксплуатационных затрат.
В WO 2012/152919 А1 представлен сернокислотный способ обработки остаточного газа реакции Клауса, в котором описано превращение H2S в H2SO4 в остаточном газе реакции Клауса. Стадии способа являются следующими:
1. Субстехиометрическое окисление
2. Превращение согласно реакции Класуса
3. Окисление восстановленных соединений серы (H2S) в остаточном газе реакции Клауса в обогащенной кислородом атмосфере при 400-700°С
4. Каталитическое окисление SO4 до SO3
5. Конденсация H2SO4
Признано, что продукт H2SO4 не всегда желателен, и предлагается рециркулировать серную кислоту на предшествующую стадию реакции Клауса или на стадию окисления H2S, как описано выше. Однако рециркуляция серной кислоты рассматривается просто как сокращение выбросов серной кислоты, и последствия рециркуляции H2SO4 для влажной серной кислоты или процесса Клауса не оценивались, т.е. не признано, что рециркуляция H2SO4 делает возможным уменьшить количество O2 (в виде воздуха, обогащенного воздуха или чистого кислорода), направляемого в печь реакции Клауса, а также реализовать положительное влияние на процессы реакции Клауса и серной кислоты.
В WO 2012/152919 А1 также раскрыто, что вспомогательное топливо может потребоваться как на стадии печи реакции Клауса, так и на стадии окисления H2S для получения желаемой рабочей температуры, без указания на реализацию полезных эффектов использования сырьевых газов в качестве вспомогательного топлива для оксигенации H2S в сернокислотном процессе.
Таким образом, предложение рециркулировать H2SO4 в печь реакции Клауса само по себе не обеспечивает рабочий способ, а требует дополнительных модификаций способа.
В соответствии с настоящим изобретением представлен способ превращения H2S в элементарную серу с повышенной эффективностью, в котором процесс Клауса сочетается с сернокислотным процессом. В соответствии с этим способом серная кислота, полученная в сернокислотном процессе обработки остаточного газа реакции Клауса, рециркулируется в печь реакции Клауса для разложения и получения элементарной серы.
Для целей настоящего изобретения стехиометрическое количество кислорода должно быть определено при допущении, что продукты, полученные из N, Н, С, S и О в сырьевом газе, представляют собой N2, Н2О, CO2 и SO2. Если присутствует количество кислорода ниже стехиометрического (также называемое субстехиометрическим), это означает, что не все компоненты сырья полностью окислены. Для сырьевого газа реакции Клауса это означает, что технологический газ после субстехиометрического сжигания/реакции может содержать непрореагировавшие H2S, NH3 и углеводороды из потока (потоков) сырья, а также Н2, СО, COS и CS2, образовавшиеся в среде с дефицитом O2.
Для целей настоящей заявки топливо определяется как вещество, состав которого при окислении O2 образует N2, Н2О, CO2 и SO2 в качестве продукта реакции и высвобождает значительное количество энергии в результате реакций. Смесь углеводородов (например, природного газа с CH4 и C2H6), а также H2S является типичным топливным газом, но топливный газ может также содержать СО, NH3 и Н2.
Для целей настоящего изобретения под кислородом (O2) понимается поток, содержащий O2, такой как воздух, обогащенный воздух и чистый кислород, но также может быть и другой газ, содержащий O2.
Согласно широкому аспекту настоящее изобретение относится к способу получения серы из сырьевого газа, состоящего из 15%, 20%, 30 об.%, 40 об.% или 50% - 99 об.% или 100 об.% H2S, и потока серной кислоты, включающий стадии
a. обеспечения сырьевого потока печи реакции Клауса, содержащего указанный сырьевой газ, количество серной кислоты, количество кислорода и необязательно количество топлива, где количество кислорода является субстехиометрическим,
b. направления указанного сырьевого потока печи реакции Клауса в печь реакции Клауса, работающую при повышенной температуре, как например выше 900°С, обеспечивая сырьевой газ для конвертера Клауса
c. охлаждения указанного сырьевого газа для конвертера Клауса с обеспечением охлажденного сырьевого газа для конвертера Клауса и необязательно отведения элементарной серы из газа
d. направления указанного охлажденного сырьевого газа для конвертера Клауса после необязательного предварительного нагрева для контакта с веществом, каталитически активным в реакции Клауса,
e. отвода остаточного газа реакции Клауса и элементарной серы, необязательно посредством охлаждения выходящего потока, от указанного вещества, каталитически активного в реакции Клауса,
f. направления потока, содержащего указанный остаточный газ реакции Клауса, на обработку остаточного газа реакции Клауса,
где указанная серная кислота, направленная в указанную печь реакции Клауса, находится в форме капель с распределением капель по размеру, характеризующимся тем, что 90% массы капель имеют диаметр ниже 500 мкм, 200 мкм или 100 мкм, с сопутствующим преимуществом такого способа, эффективно превращающего всю жидкую H2SO4 в газообразную H2SO4, а затем в SO3 и, в конечном итоге, в SO2, что хорошо подходит для процесса Клауса.
Согласно другому варианту осуществления по меньшей мере, количество серной кислоты направляют в указанную печь реакции Клауса через по меньшей мере одно воздушное сопло, получая серную кислоту и распыляющую среду, с сопутствующим преимуществом такого сопла, образующего мелкие капли, подходящие для быстрого испарения. Воздушные сопла также известны специалисту в данной области под терминами «пневмораспылители» или «двухфазные форсунки».
Согласно другому варианту осуществления распыляющая среда представляет собой сжатый воздух, и поток составляет от 25 Нм3 воздух/тонна кислоты или 50 Нм3 воздух/тонна кислоты л 200 Нм3 воздух/тонна кислоты или 500 Нм3 воздух/тонна кислоты, с сопутствующим преимуществом такой форсунки, работающей при этих параметрах, с образованием мелких капель с низким расходом распыляющей среды.
Согласно другому варианту осуществления по меньшей мере количество серной кислоты направляют в указанную печь реакции Клауса через по меньшей мере одно гидравлическое сопло, предназначенное для образования мелких капель, с сопутствующим преимуществом гидравлического сопло, которое просто в эксплуатации, обеспечивая достаточно мелкие капли, без разбавления технологического газа любой распыляющей средой.
Согласно другому варианту осуществления среднее время пребывания технологического газа в печи реакции Клауса составляет менее 5 секунд, более предпочтительно менее 2 секунд, с соответствующим преимуществом такой реакционной печи, имеющей соответствующий размер, в то же время предоставляя достаточное время для испарения капель серной кислоты, а также необходимое частичное химическое преобразование H2S и SO2 в элементарную серу.
Согласно другому варианту осуществления печь реакции Клауса включает один или несколько усилителей турбулентности с сопутствующим преимуществом, заключающимся в сокращении времени пребывания, температуры и распределения состава газа в печи реакции Клауса.
Согласно другому варианту осуществления печь реакции Клауса содержит средство импакции, такое как ударная стенка или объем, заполненный инертным материалом, с соответствующим преимуществом разрушения капель при столкновении, чтобы гарантировать отсутствие жидкой H2SO4 в сырьевом газе для конвертера Клауса.
Согласно другому варианту осуществления указанная обработка остаточного газа реакции Клауса включает стадии
g. направления потока, содержащего указанный остаточный газ реакции Клауса, кислород и топливо в качестве сырьевого газа, в камеру сгорания остаточного газа реакции Клауса, работающую при температуре выше 900°С, или каталитическое средство для окисления, обеспечивающее сырьевой газ для конвертера SO2,
h. направления указанного сырьевого газа для конвертера SO2 для контакта с веществом, каталитически активным при окислении SO2 до SO3, обеспечивая газ, обогащенный SO3,
i. превращения указанного газа, обогащенного SO3, в концентрированную серную кислоту, либо путем абсорбции SO3 серной кислотой, либо путем гидратации SO3, охлаждения и конденсации серной кислоты,
j. рециклизации по меньшей мере части полученной серной кислоты в печь реакции Клауса,
с сопутствующим преимуществом такого процесса, имеющего высокую конверсию и тепловую эффективность и позволяющего избежать нежелательного образования серной кислоты. Использование печи реакции Клауса и камеры сгорания остаточного газа реакции Клауса, работающей при температуре выше 900°С, обеспечивает полную конверсию присутствующих компонентов, и это может необязательно требовать присутствия топлива в дополнение к сырьевому газу. Кроме того, в печи реакции Клауса будут иметь место гомогенные реакции Клауса, так что сера может быть отведена при охлаждении сырьевого газа для конвертера Клауса. Поток, подаваемый в камеру сгорания остаточного газа реакции Клауса, обычно может включать H2S в качестве топлива из остаточного газа реакции Клауса, и/или отдельный поток, содержащий H2S, углеводород или другое топливо. В дополнение к упомянутым стадиям способа способ может включать дополнительные стадии, такие как теплообмен для изменения температуры (или иным образом кондиционирования технологических потоков) до диапазона, соответствующего происходящим процессам.
Согласно другому варианту осуществления сырьевой газ печи реакции Клауса содержит менее 0.1 об.% неэлементарного азота, как например NH3, с сопутствующим преимуществом, заключающимся в предотвращении образования, например, солей аммония, которые могут закупорить конденсатор(ы) Клауса.
Согласно другому варианту осуществления сырьевой поток печи реакции Клауса содержит менее 50%, 20%, 10% или 1% элементарного азота с сопутствующим преимуществом обеспечения процесса с высокой температурой в печи реакции Клауса и уменьшенного объема технологического газа из-за уменьшенного присутствия N2, избегая при этом чрезмерных температур ниже по ходу потока, поскольку испарение серной кислоты охлаждает технологический газ. Этого можно добиться, используя в качестве источника кислорода чистый O2 или воздух, обогащенный кислородом.
В альтернативном способе стадии d и е выполняются последовательно 2-5 раз, что дает преимущество, заключающееся в обеспечении более высокой конверсии в способе.
Согласно другому варианту осуществления соотношение H2S:SO2 указанного сырьевого газа для конвертера Клауса ниже 4:1, 3:1 или 2:1, с сопутствующим преимуществом такого сырьевого газа, обеспечивающего остаточный газ реакции Клауса, содержащий H2S, для камеры сгорания остаточного газа реакции Клауса, сводя к минимуму необходимость добавления топливного газа, поскольку окисление H2S высвобождает значительное количество энергии, тогда как SO2 не выделяет энергию в камере сгорания остаточного газа реакции Клауса.
Согласно другому варианту осуществления, соотношение H2S:SO2 указанного газа для конвертера Клауса ниже 1,6:1, 1,8:1 или 2:1, с сопутствующим преимуществом наличия по существу свободного от H2S остаточного газа реакции Клауса. На расположенном ниже по ходу потока устройстве по производству серной кислоты это может быть преимуществом, так как SO2 не будет окисляться без катализатора конверсии SO2, и, таким образом, можно будет предварительно нагреть остаточный газ реакции Клауса с комбинацией каталитического окисления SO2 (управляемый байпас сырьевого газа, содержащего H2S) и рециркуляция технологического газа вокруг каталитического окисления H2S, так что повышение температуры на катализаторе окисления H2S можно точно контролировать. При неизвестной и/или изменяющейся концентрации H2S в остаточном газе реакции Клауса высок риск перегрева катализатора окисления H2S.
Согласно другому варианту осуществления способ дополнительно включает стадию направления количества дополнительного сырьевого газа в указанную камеру сгорания остаточного газа реакции Клауса с сопутствующим преимуществом обеспечения дополнительной серы и топлива для сернокислотного процесса. Дополнительный сырьевой газ может содержать примеси, которые могут быть сожжены до обработки сернокислотным процессом, и/или сероводород и другие виды топлива, которые могут способствовать производству серной кислоты и сжиганию в камере сгорания остаточного газа реакции Клауса. Если дополнительный сырьевой газ содержит большое количество инертных газов или топлива, не содержащего серы, преимущество способа также состоит в том, что он позволяет избежать увеличения размера конвертера Клауса из-за второстепенного потока. Дополнительный сырьевой газ может происходить из того же источника, что и сырьевой газ, или из другого источника.
Согласно другому варианту осуществления указанный дополнительный сырьевой газ содержит более 5 об.% неэлементарного азота, такого как аммиак, с сопутствующим преимуществом, заключающимся в обеспечении способа, в котором компоненты неэлементарного азота, которые могут быть трудно окисляемы в субстехиометрической атмосфере печи реакции Клауса, можно направить в камеру сгорания остаточного газа реакции Клауса. Такой способ может быть особенно выгоден, если дополнительным сырьевым газом является газ отпарной колонны кислых вод (SWS), содержащий 10об.%-50об.% H2S, 10об.%-50об.% NH3 и 10об.%-50об.% Н2О - где в процессе Клауса желателен только H2S, a NH3 проблематичен в процессе Клауса из-за потенциальной закупорки солями аммония. Вместо этого такой газ SWS может быть направлен на устройство по производству серной кислоты, где хорошо зарекомендовали себя работы с NH3 из-за преобладающего там избытка кислорода.
Согласно другому варианту осуществления количество серы в дополнительном сырьевом газе составляет по меньшей мере 1%, 2% или 5% от общего количества элементарной серы, отводимой из процесса, с сопутствующим преимуществом такого сырьевого газа, который может обеспечивать тепловую энергию, а также вносить свой вклад в уменьшение серы.
Согласно другому варианту осуществления вещество, каталитически активное в реакции Клауса, содержит активированный оксид алюминия (III) или оксид титана (IV) с сопутствующим преимуществом такого вещества, обеспечивающего эффективный процесс производства элементарной серы.
Согласно другому варианту осуществления стадию (d) проводят при давлении 200 от мбар изб. до 700 мбар изб., температуре от 200°С до 350°С и объемной скорости от 800 Нм3/ч/м3 до 3000 Нм3/ч/м3, с сопутствующим преимуществом таких условий, эффективных для производства элементарной серы.
Согласно другому варианту осуществления стадию (d) проводят при температуре от 100°С до 150°С, а стадия (е) включает стадию периодического нагревания указанного вещества, каталитически активного в реакции Клауса, для обеспечения отвода конденсированной элементарной серы в жидкую или газовую фазу, с сопутствующим преимуществом низкой температуры, благоприятной для достижения очень высокой конверсии SO2 и H2S в элементарную серу, как из-за низкой температуры, так и из-за удаления продукта реакции, что обеспечивает еще лучшие условия для высокой.
Согласно другому варианту осуществления указанное вещество, каталитически активное при превращении SO2 в SO3, содержит ванадий, с сопутствующим преимуществом такого вещества, обеспечивающим эффективный способ получения серной кислоты.
Согласно другому варианту осуществления указанная стадия (h) окисления SO2 в SO3 проводится при давлении от 50 мбар изб до 200 мбар изб., температуре от 370°С до 530°С и объемной скорости от 800 Нм3/ч/м3 до 1500 Нм3/ч/м3, на слой катализатора, с сопутствующим преимуществом таких условий, которые эффективны для окисления SO2 с образованием SO3.
Согласно другому варианту осуществления количество серы в потоке серной кислоты составляет более 1%, 3% или 5% и менее 17%, 21% или 25% от общего количества элементарной серы, отводимой из процесса. Рециркуляция выше нижних пределов имеет то преимущество, что обеспечивает эффект уменьшения объема технологического газа, в то время как рециркуляция меньше верхних пределов позволяет избежать ситуации, когда в печь реакции Клауса необходимо добавлять дополнительное топливо, что приводит к дополнительным объему процесса и эксплуатационным расходам.
Согласно другому варианту осуществления серная кислота в потоке серной кислоты распыляется в указанной печи реакции Клауса с использованием воздушных сопел (приводимых в действие сжатым воздухом или другим сжатым газом, таким как пар или азот) или гидравлических сопел (также известных как нагнетательные сопла), и при этом время пребывания в печи реакции Клауса составляет по меньшей мере 0,5 секунды, 1 секунду или 1,5 секунды, при этом связанное с этим преимущество такого времени пребывания состоит в достаточности для полного испарения капель серной кислоты.
Согласно другому варианту осуществления молярное соотношение H2S:O2 компонентов, направляемых в печь реакции Клауса, составляет по меньшей мере 2,5, с сопутствующим преимуществом такого низкого содержания кислорода, обеспечивающим субсте-хиометрическую частичную конверсию H2S в SO2, посредством вклада термической диссоциации H2SO4, добавляя оставшийся O2 для получения желаемого соотношения H2S:SO2 2,0 в сырьевой газ для конвертера Клауса.
Согласно другому варианту осуществления количество газа в процессе охлаждают и направляют выше по ходу потока для контроля температуры процесса, что дает возможность активного контроля температуры сильно экзотермических процессов.
Согласно другому варианту осуществления один или несколько потоков, направленных в указанную печь реакции Клауса, предварительно нагреваются посредством теплообмена с горячим технологическим потоком, что позволяет свести к минимуму или избежать требований к вспомогательному топливу для достижения желаемой температуры для испарения серной кислоты и конверсии сырья.
Согласно другому варианту осуществления один или несколько потоков, направляемых в указанную камеру сгорания остаточного газа реакции Клауса, предварительно нагревают посредством теплообмена с горячим технологическим потоком с соответствующим преимуществом минимизации или устранения требования вспомогательного топлива для достижения желаемой температуры сгорания и последующего окисления SO2.
Согласно другому варианту осуществления по меньшей мере один из указанных каталитически активных веществ для окисления SO2 в SO3 или H2S в элементарную серу и/или по меньшей мере один продукт, отводимый из одного из указанных каталитически активных веществ, охлаждают путем теплообмена, такого как межслойный теплообмен или каталитический реактор с внутренним охлаждением, с сопутствующим преимуществом, позволяющим активно контролировать температуру сильно экзотермических процессов посредством межслойного теплообмена или каталитического реактора с внутренним охлаждением, такого как реактор с кипящей водой, имеющий трубчатый или пластинчатый охлаждающий контур.
Согласно другому аспекту настоящее изобретение относится к технологической установке, содержащей печь реакции Клауса, утилизационный котел Клауса, секцию конверсии Клауса, камеру сгорания остаточного газа реакции Клауса и секцию серной кислоты, где печь реакции Клауса имеет вход в печь, вход и выход сопла кислоты, утилизационный котел Клауса имеет вход для газа, выход для газа и выход для элементарной серы, секция конверсии Клауса имеет вход для газа, выход для газа и выход для элементарной серы, камера сгорания остаточного газа реакции Клауса имеет вход и выход, и секция серной кислоты имеет вход для газа, выход для газа и выход для серной кислоты, и где вход в печь реакции Клауса сконфигурирован для получения сырьевого газа и окислителя, а выход печи реакции Клауса сконфигурирован для жидкостного сообщения с входом утилизационного котла Клауса, где выход утилизационного котла Клауса сконфигурирован для жидкостного сообщения с входом секции конверсии Клауса, и где вход камеры сгорания остаточного газа реакции Клауса сконфигурирован для жидкостного сообщения с выходом указанного выхода секции конверсии Клауса для газа, причем выход камеры сгорания остаточного газа реакции Клауса сконфигурирован для жидкостного сообщения с входом в секцию серной кислоты, отличающейся дополнительно тем, что выход для серной кислоты секции серной кислоты находится в жидкостном сообщении с входом сопла кислоты указанной печи реакции Клауса, с сопутствующим преимуществом такого процесса, позволяющим избежать нежелательного производства серной кислоты, а также уменьшить объем технологического газа.
Согласно другому варианту осуществления технологическая установка дополнительно содержит резервуар для хранения серы, имеющий объем, соответствующий количеству серной кислоты, отводимому из выхода для серной кислоты секции серной кислоты, за от 1 дня до 4 дней, с сопутствующим преимуществом разделения процесса Клауса и сернокислотного процесса, обеспечивающим стабилизированную работу технологической установки
Настоящее изобретение описывает комбинацию процесса Клауса и сернокислотного процесса, которая может эффективно производить количество серной кислоты, необходимое для технологической установки, или даже избегать производства серной кислоты и превращать избыток серной кислоты в элементарную серу, которую можно транспортировать, в другие места.
Для максимального превращения в элементарную серу 1/3 H2S должна быть преобразована в SO2.

Стехиометрическое соотношение между H2S и SO2 контролируют, контролируя количество кислорода в печи реакции Клауса. Кислород обычно подают с атмосферным воздухом, но также может быть воздух, обогащенный O2, или даже чистый O2.
Добавление кислорода в печь реакции Клауса должно также учитывать количество NH3, СО, Н2 и углеводородов в потоках сырья.
Если температура горения в печи реакции Клауса меньше 1100°С, превращение, например, NH3 может быть неполным. Следствием этого будет сырьевой газ для конвертера Клауса, имеющий возможность образования солей аммиака, таких как (NH4)2SO4 и (NH4)2S2O3, которые могут закупорить конденсатор Клауса.
Частично окисленный сырьевой газ для конвертера Клауса затем превращают в элементарную серу с помощью следующих реакций при температуре обычно выше 200°С в присутствии каталитически активного вещества, такого как активированный оксид алюминия (III) или титана (IV).
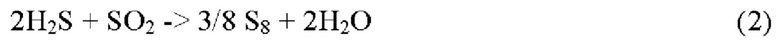
Часто 3-4 конвертера Клауса работают последовательно, чтобы увеличить превращение до максимума, что увеличивает стоимость установки Клауса.
Контроль температуры в процессе Клауса важен для обеспечения того, чтобы элементарная сера, образующаяся в каталитическом нейтрализаторе, оставалась газообразной, так что она конденсируется только в желаемом положении процесса. Еще одно ограничение связано с тем фактом, что, поскольку процесс Клауса является экзотермическим, выгодно работать при низких температурах.
Альтернативой вышеуказанному процессу является так называемый процесс Клауса при температуре ниже точки росы, в котором каталитически активное вещество работает при температурах, при которых элементарная сера не находится в газовой фазе. Для такого процесса Клауса при температуре ниже точки росы потребуется соответствующая схема отвода конденсированной серы, т.е. пульсированием температуры и продувкой элементарной серы инертным газом.
Даже при последовательном подключении 3-4 конвертеров/конденсаторов/перегревателей Клауса невозможно достичь извлечения серы более -98%, что недостаточно для соблюдения большинства экологических норм. Поэтому установка Клауса обычно оснащена так называемой установкой реакции Клауса для остаточного газа, одним из примеров которой является упомянутый выше процесс при температуре ниже точки росы. Существует множество процессов с остаточными газами, имеющих различные характеристики. Для достижения очень высокой эффективности удаления эти установки реакции Клауса для остаточного газа усложняются и приближаются к той же стоимости, что и сама установка Клауса.
Полученная элементарная сера, как правило, не имеет прямого применения на заводах, производящих поток отходов, содержащих H2S, но элементарную серу легко транспортировать на другие объекты и хранить в течение длительного периода времени.
Общепринятой альтернативой процессу Клауса является превращение H2S в серную кислоту, т.е. так называемым влажным сернокислотным процессом. Полученная серная кислота может использоваться в других химических процессах на заводе. Влажный сернокислотный процесс может также представлять собой очистку остаточных газов технологической установки Клауса. Аналогичный процесс с использованием сухой серной кислоты также может найти применение в этом отношении.
Сернокислотные процессы окисляют H2S до SO2, как правило, в камере сгорания остаточного газа реакции Клауса, a SO2 до SO3, а затем гидратируют SO3 до серной кислоты, либо путем реакции с водой в газовой фазе в так называемом влажном сернокислотном процессе, либо путем абсорбция в концентрированной серной кислоте в так называемом контактном процессе или сухом процессе. Температура реакции при окислении SO2 до SO3 будет находиться в диапазоне 370-530°С в присутствии каталитически активного вещества, обычно включающего ванадий. Как правило, влажные сернокислотные процессы производят серную кислоту с концентрацией в диапазоне 92%-98%, тогда как сухие сернокислотные процессы могут также производить серную кислоту с концентрацией выше 98%.
Кроме того, также может быть привлекательным собирать пар высокого давления в диапазоне от 30 бар изб. до 80 бар изб. из сильно экзотермических процессов с серной кислотой, тогда как процесс Клауса будет производить только пар более низкого давления.
Однако производство больших количеств серной кислоты может быть менее привлекательным, даже если серная кислота продается на коммерческой основе, поскольку транспортировка серной кислоты является сложной и регулируемой.
Реакциями, протекающими в сернокислотном процессе (сухом и влажном), являются



Общая реакция сернокислотного процесса может быть описана в соответствии с

Влажный сернокислотный процесс как обычное решение остаточного газа реакции Клауса обеспечивает решение, которое соответствует экологическим нормам при более низких капитальных и эксплуатационных затратах, чем альтернативы. Единственным недостатком влажного сернокислотного процесса до сих пор было получение серной кислоты, которая не всегда желательна.
В настоящее время стало понятно, что объединение процесса Клауса и сернокислотного процесса также может быть осуществлено путем рециркуляции всей или практически всей произведенной серной кислоты в печь реакции Клауса. С помощью нового изобретения интегрированный процесс Клауса/влажный сернокислотный процесс устраняет недостаток, связанный с неудобным сернокислотным продуктом, и в то же время уменьшает размер установки как процесса Клауса, так и влажного сернокислотного процесса.
Сжигание серной кислоты известно при регенерации отработанной серной кислоты на установке влажного сернокислотного процесса, но не применялось на практике в реакционной печи процесса Клауса или в условиях процесса Клауса.
Несмотря на то, что впрыск серной кислоты в установку влажного сернокислотного процесса и установку Клауса имеет сходство, цель и условия значительно различаются. На установке влажного сернокислотного процесса основной целью впрыска отработанной серной кислоты является сжигание смолистых соединений, присутствующих в кислоте, в то время как = H2SO4 и SO3 не имеют значения, поскольку процессы ниже по ходу потока будут преобразовывать соединения серы в H2SO4, что является конечным продуктом.
В процессе Клауса серная кислота из установки по производству серной кислоты, расположенной ниже по ходу потока, не содержит смол, и цель впрыска рециклизованной кислоты состоит в том, чтобы обеспечить полное разрушение H2SO4 и SO3 до того, как технологический газ покинет реакционную печь, так что элементарная сера является единственным продуктом. H2SO4/SO3, выходящий из реакционной печи, может вызвать дезактивацию катализатора и/или конденсацию серной кислоты и коррозию технологического оборудования.
В сернокислотном процессе для регенерации отработанной кислоты атмосфера является окислительной, и отработанная серная кислота обычно составляет более 80% от общего количества введенной серы, тогда как печь реакции Клауса в соответствии с настоящим изобретением работает с восстанавливающей атмосферой, и поток серной кислоты обычно составляет <10% от общего количества поступающей серы, хотя при особых обстоятельствах возможно до 25%. Еще одно отличие заключается в том, что частичное окисление H2S представляет собой экзотермический процесс с выделением тепла, тогда как сжигание серной кислоты при регенерации отработанной кислоты является эндотермическим процессом, требующим вспомогательное топливо.
Время пребывания в печи регенерации отработанной кислоты обычно составляет 2-5 секунд для обеспечения полного разрушения смолистых соединений, тогда как реакционная печь установки Клауса обычно рассчитана на время пребывания 1-2 секунды для обеспечения разрушения газообразных углеводородов и NH3, присутствующих в сырьевом газе.
Когда серная кислота вводится в печь реакции Клауса, происходит следующая общая реакция

Чтобы завершить эту общую реакцию, необходимо завершить следующие реакции:

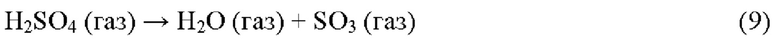
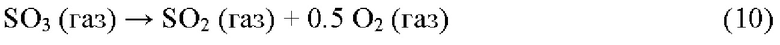
Реакция (8) является обычной реакцией испарения, в которой энергия, необходимая для нагрева жидкости и испарения воды и серной кислоты, обеспечивается горячим окружающим технологическим газом. Эффект полного испарения серной кислоты заключается в том, что газообразная H2SO4 гораздо менее агрессивна, чем капли жидкой H2SO4, а газообразная H2SO4 гораздо более реакционноспособна.
Реакция (9) представляет собой эндотермическую реакцию диссоциации, протекающую практически мгновенно при температуре выше 600°С. В этот момент времени некоторое количество SO3 начнет реагировать с H2S с образованием SO2, H2O и серы.
Реакция (10) представляет собой эндотермическую реакцию разложения, протекающую быстро при температурах выше 900°С. В насыщенных кислородом атмосферах химическое равновесие предотвращает полную диссоциацию, но в восстановительных атмосферах удаление продукта O2 (в результате реакции с H2S) позволяет полное разложение. Реакция между H2S и O2 протекает очень быстро при этих повышенных температурах. Атом S в SO3, образованного реакцией 9, находится в степени окисления +6 и является высокореактивным окислителем, способным окислять не только H2S, но и углеводороды (включая ВТХ = бензол, толуол и ксилол) и NH3. Углеводороды и NH3 обычно присутствуют в сырьевых потоках, и важно, чтобы эти соединения разрушались в реакционной печи, поскольку они могут вызвать дезактивацию катализатора, загрязнение и закупорку последующих стадий каталитической конверсии Клауса и конденсаторов серы.
По сравнению с NH3 и углеводородами, H2S имеет самое высокое сродство к O2, и, поскольку подача O2 является субстехиометрической, не остается O2 для окисления углеводородов и NH3 в соответствии с обычными реакциями окисления 11 и 12:


Реакция 11 представляет все виды углеводородов, поскольку они в принципе следуют одним и тем же общим механизмам окисления, то есть С и Н превращаются в CO2 и Н2О.
В отсутствие свободного O2 общая концепция состоит в том, что SO2 играет важную роль в окислении, поскольку атом S в SO2 находится в степени окисления +4 и, таким образом, является сильным окислителем. Как описано в Sulphur magazine no 375, March-April issue 2018, ("Combustion challenges in the reaction furnace"), следующие общие реакции ответственны за окисление СН4: (реакции масштабированы для облегчения обзора)




Суммируя реакции 13-16, общая реакция представляет собой
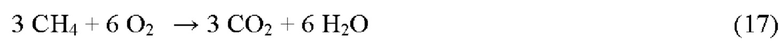
которая аналогична реакции 11, которая представляет собой окисление CH4 свободным O2.
Реакция 14 представляет собой реакцию, в которой SO2 окисляет атомы S в CS2 от степени окисления -2 до +0 в S2, в то время как атом S в SO2 восстанавливается от степени окисления +4 до 0.
Реакция 15 представляет собой обычную реакцию Клауса, которая уже происходит, а реакция 16 представляет собой очень быстрое окисление H2S свободным O2. Таким образом, реакции 13 и 14 будут определять степень и скорость разрушения углеводородов.
Поскольку SO3 отсутствует в регулярной печи реакции Клауса, приведенный выше анализ не учитывал присутствие этого соединения. Поскольку атом S в SO3 находится в степени окисления +6, окислительная способность выше, чем у SO2, и поэтому ожидается, что окисление атомов S в молекуле CS2 будет происходить с большей скоростью при той же температуре или при той же скорости, но при более низкой температуре.
Общая реакция между SO3 и CS2 предполагается следующей:
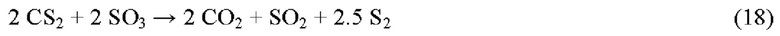
Эмпирическое правило традиционных процессов Клауса заключается в том, по меньшей мере 1000-1050°С требуется в печи реакции Клауса для полного окисления углеводородов в течение времени пребывания 1-2, но в присутствии SO3 ожидается, что углеводороды могут окисляться уже при 900°С.
Для разрушения NH3 нормальная реакция окисления описана в реакции 12, но поскольку в реакционной печи нет свободного O2, SO2 играет важную роль в качестве окислителя. Окисление NH3 без O2 также включает окислительные способности SO2, как описано в реакции 19:
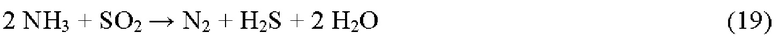

Суммируя реакции 19 и 20, общая реакция представляет собой:

Реакция 20 представляет собой очень быстрое окисление H2S свободным O2, и, таким образом, разложение NH3 ограничивается общей скоростью реакции 19.
Подобно разложению углеводородов, атом S в SO3 находится в степени окисления +6, тогда как атом S в SO2 находится в степени окисления +4, и, таким образом, SO3 является более сильным окислителем. Ожидается, что разложение NH3 будет происходить с большей скоростью в присутствии SO3, что либо позволит завершить реакцию за меньшее время пребывания при неизменной температуре в реакционной печи, либо при более низкой температуре с тем же временем пребывания.
Суммарная реакция разложения NH3 под действием SO3 принимается следующей:
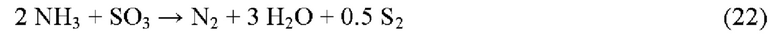
Эмпирическое правило заключается в том, что для обеспечения полного разложения NH3 за 1-2 секунды требуется температура реакционной печи 1200-1250°С. Присутствие SO3 в качестве окислителя может по аналогии с окислением углеводородов снизить температуру этой реакции на 50-200°С.
Поскольку время пребывания в печи реакции Клауса обычно составляет 1-2 секунды, необходимо убедиться, что реакции 8, 9, 10 и 1, а также разложения примесей завершены в течение этого времени, и что реакция 2 достигла химическое равновесие. При охлаждении технологического газа скорости реакции резко снижаются и дальнейшая конверсия в газовой фазе будет незначительной.
Присутствие O2 и/или SO3 в технологическом газе, контактирующем с катализатором в реакторах Клауса ниже по ходу потока, приведет к дезактивации катализатора вследствие реакции «сульфатирования», при которой каталитически активный оксид алюминия или оксид титана превращается в каталитически неактивный сульфат алюминия или сульфата титана и, следовательно, образование серы в этих реакторах уменьшится, что приведет к увеличению количества непрореагировавших соединений серы в остаточном газе сернокислотной установки ниже по ходу потока и к увеличению выбросов в атмосферу.
Кроме того SO3 в технологическом газе может при прохождении через узлы конденсации серы соединяться с водой, конденсироваться и образовывать серную кислоту в продукте элементарной серы, что может привести к коррозии технологического оборудования и нежелательному загрязнению продукта серы.
В то время как реакции 9 и 10 можно считать очень быстрыми, стадией, определяющей скорость, может быть реакция 8, т.е. испарение серной кислоты. Очевидно, что жидкая серная кислота с максимальной температурой кипения ~ 340°С не может находиться в равновесии в реакционной печи при температуре 1000°С, но скорость испарения лимитируется тепло- и массообменом между поверхностью жидкости и технологическим газом, и поэтому возможно временное существование капель серной кислоты. Детальный математический анализ испарения капель, включая конвективный тепломассоперенос, радиационный теплообмен и термодинамику серной кислоты, показывает, что время полного испарения капель зависит от температуры и квадрата начального диаметра капель.
Время полного испарения может составлять от 0,2 секунды для капли с начальным диаметром 200 мкм и до 2 секунд для капли с начальным диаметром 700 мкм. Таким образом, для обеспечения того, чтобы все капли испарялись и реагировали в реакционной печи, большое значение имеет распределение капель по размеру из сопла (сопел) для впрыска серной кислоты.
Таким образом, выбор сопла для распыления серной кислоты является важным фактором для достижения успешной работы установки Клауса - существует множество типов сопла для распыления, некоторые из которых могут обеспечить получение мелких капель серной кислоты, а некоторые нет.
Так называемые воздушные сопла (также известные как пневматические или двухжидкостные сопла) обычно создают мельчайшие капли. Эти сопла используют кинетическую энергию для распыления серной кислоты на достаточно мелкие капли и, таким образом, сжатый воздух смешивается с жидкостью на кончике сопла. Вместо воздуха можно использовать пар низкого давления, кислород, N2 и другие газообразные жидкости. При правильном выборе размера сопла и рабочего давления эти сопла обеспечивают распределение по размеру, подходящее для быстрого испарения капель.
Гидравлические распылительные сопла используют давление жидкости (например, серной кислоты) для обеспечения энергии для распыления жидкости, и при правильном выборе давления и конструкции сопла эти сопла также могут производить мелкие капли. Как правило, размер капель уменьшается с увеличением давления, уменьшением расхода и увеличением угла распыления. Преимущество гидравлического сопла заключается в более низких эксплуатационных расходах, так как не потребляется сжатый воздух. Однако производительность и динамический диапазон для этих сопел не так хороши, как для сопла с принудительной подачей воздуха.
Характеристики распылительных сопел обычно измеряются с использованием воды в качестве жидкости и воздуха в качестве распыляющей среды (только для пневматических сопел). Накопление по размеру измеряется и характеризуется одномерными параметрами, такими как VMD, SMD, DV0.9 и т.д. Актуальность характеристик зависит от области применения.
VMD - это средний объемный диаметр, что означает, что 50% объема/массы капель больше заданного диаметра.
SMD - это так называемый средний диаметр Соутера, определяемый как диаметр, который имеет то же отношение объема к поверхности, что и общий объем капель к общей площади поверхности капель.
D0.9 - диаметр, при котором 90% общего объема/массы капель меньше.
Dmax - максимальный диаметр, найденный в распределении по размеру.
Для целей испарения значения D0.9 и Dmax являются наиболее важными размерными параметрами сопла.
Эти значения, однако, не дают полной информации о распределении по размерам, где для настоящего изобретения особенно важно распределение самых больших капель.
Действительные размеры капель для жидкости с другими свойствами, кроме воды при комнатной температуре, можно лишь приблизительно оценить по свойствам жидкости, таким как вязкость, поверхностное натяжение и плотность. Плотность оказывает незначительное влияние на размер капель, тогда как увеличение вязкости и поверхностного натяжения приводит к увеличению размеров капель. Серная кислота имеет более высокую вязкость и более низкое поверхностное натяжение по сравнению с водой, и степень, в которой сложные взаимодействия двух противоположных эффектов компенсируют друг друга, должна быть определена экспериментально или путем детального моделирования.
Через некоторое время эксплуатации сопла в конечном итоге изнашиваются из-за эрозии кислотой и/или воздухом (с частицами) и из-за коррозии серной кислотой. Изношенные сопла будут давать менее равномерную модель распыления, а распределение по размерам сместится в сторону более крупных капель, поэтому важно убедиться, что сопла находятся в хорошем состоянии, т.е. путем визуального осмотра или наблюдения за перепадами давления жидкости и, в случае воздушного сопла, газа для сопла. Кроме того, при правильном проектировании системы ввода кислоты можно будет изолировать трубки для ввода кислоты и выводить их из реакционной печи, сохраняя при этом работу установки Клауса.
При правильном выборе и эксплуатации сопла для распыления серной кислоты полное испарение капель и полная конверсия SO3 и O2 могут быть достигнуты менее чем за 1-2 секунды, что является нормальным временем пребывания для печи реакции Клауса.
Однако существуют различные средства, гарантирующие, что большие капли, образующиеся на наконечнике сопла, не приведут к чрезмерному количеству капель и H2SO4/SO3, выходящих из реакционной печи.
Один вариант конструкции состоит в том, чтобы обеспечить большую камеру реакционной печи, так что время пребывания технологического газа будет большим, но это может быть дорогостоящим.
Турбулентность в камере реакционной печи может быть увеличена за счет сдерживания или перенаправления потока, т.е. за счет использования дроссельных колец, векторных стенок, тангенциальных впускных отверстий и т.д., которые обеспечат более узкое распределение времени пребывания капель, уменьшая вероятность того, что время пребывания капли будет намного меньше среднего.
Подобным образом, присутствие средства импакции, такого как ударная стенка, решетчатая стенка или уплотненный объем или отделение из инертного материала, может уменьшить количество крупных капель, которые из-за своей высокой инерции не смогут следовать за линиям потока газа, отводимого вблизи препятствия. Вместо этого большие капли будут двигаться дальше, сталкиваться с препятствием и испаряться с поверхности препятствия. Такое средство импакции, как правило, достаточно прочное и не является несущей конструкцией, чтобы избежать проблем со стабильностью из-за износа материала конструкции.
Чтобы избежать сульфатирования катализаторов Клауса, вещество, каталитически активное при превращении SO3 в SO2, включающее, например, одно или несколько соединений V, Mn, Fe, Со, Cu, Zn, Ni, Mo, W, Sb, Ti и Bi, нанесенных на одно или несколько соединений Al, Ti, Si, диатомовой земли, Zr, Mg и кордиерита, также может быть расположен ниже по ходу потока от печи реакции Клауса. Такое вещество может быть в форме гранул катализатора или структурированных катализаторов, таких как монолиты.
Если вся серная кислота, полученная в процессе производства серной кислоты ниже по ходу потока от процесса Клауса, направляется в печь реакции Клауса, можно использовать процесс Клауса, в котором для снижения выбросов H2S используется очень высокая эффективность удаления, а также термическая эффективность сернокислотной установки, но единственным продуктом которого является сера, которая проста в обращении и транспортировке.
Кроме того, при рециркуляции серной кислоты O2 высвобождается при разложении H2SO4, так что количество добавляемого окислителя горения будет уменьшено, что, если окислителем является атмосферный воздух, позволяет резко уменьшить объем процесса, поскольку атмосферный воздух содержит около 80% инертного N2, т.е. 4 объема N2 на объем O2.
Общая реакция, основанная на использовании воздуха в качестве носителя O2 для печи реакции Клауса, является следующей:
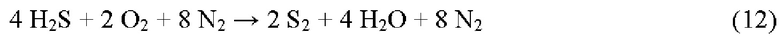
Подобным образом, общая реакция Клауса, основанная на H2SO4 в качестве носителя O2 для печи реакции Клауса, является следующей:

Сравнивая две реакции, становится очевидным, что H2SO4 является отличным носителем O2 и имеет (теоретический) потенциал для уменьшения объемного потока остаточного газа реакции Клауса на 67% по сравнению с атмосферным воздухом.
Также может быть полезно перенаправить некоторое количество сырьевого газа в камеру сгорания остаточного газа реакции Клауса, поскольку сырьевой газ имеет теплотворную способность, которую можно использовать в камере сгорания остаточного газа реакции Клауса, и, таким образом, снизить потребность в добавлении вспомогательного топлива. Это может быть даже более выгодно, если существуют два источника сырьевого газа, такие как один сырьевой газ, не содержащий NH3, и другой сырьевой газ, содержащий NH3, поскольку субстехиометрические условия в печи реакции Клауса препятствуют полному окислению NH3. Так называемые газы колонны для отпарки кислых вод (SWS) являются примером такого сырьевого газа, содержащего NH3.
В процессах Клауса для обработки газа SWS решающее значение имеет полное разрушение NH3 в печи реакции Клауса, в противном случае образуются соли аммиака, такие как (NH4)2SO4 и (NN4)2S2O3, которые закупоривают конечный конденсатор серы. Специальные высокоинтенсивные (двухступенчатые) горелки способны достигать высоких температур, необходимых для термической деструкции NH3, но требуют точного контроля кислорода в двух отдельных потоках.
Однако хорошо известна обработка газа SWS на сернокислотной установке, так как полное окисление NH3 до N2 и NO достигается избытком кислорода при температурах выше 1000°С. Таким образом, может быть желательным сконфигурировать интегрированный процесс Клауса/серной кислоты с двумя камерами сгорания для направления первого сырья, содержащего H2S и небольшого количества NH3 или без него, в печь реакции Клауса, при этом газ, содержащий NH3, такой как газ SWS, направляется в камеру сгорания остаточного газа реакции Клауса. В такой конфигурации может оказаться желательным спроектировать сернокислотную установку таким образом, чтобы она включала секцию селективного каталитического восстановления (SCR) NOx с помощью NH3 в присутствии катализатора на основе ванадия.
Интегрированный процесс в соответствии с настоящим изобретением может также иметь преимущество от использования воздуха, обогащенного кислородом, или практически чистого кислорода в печи реакции Клауса. Преимущество использования воздуха, обогащенного кислородом, заключается в уменьшении количества инертного азота в технологическом газе и, таким образом, уменьшении объема технологического газа и, таким образом, уменьшении размера установки. Отсутствие разбавления азотом также приводит к повышению температуры горения, что может быть полезным, если присутствуют примеси, требующие полной конверсии, тем более, что количество кислорода в печи реакции Клауса является субстехиометрическим. Так как катализатор Клауса чувствителен к примесям, таким как легкие углеводороды, часто может оказаться выгодным эксплуатировать печь реакции Клауса с воздухом, обогащенным кислородом, для достижения повышенной температуры для полного окисления примесей. Это также имеет дополнительное преимущество, заключающееся в возможности начальной гомогенной некаталитической конверсии Клауса, которая может происходить при температурах выше 900°С.
Однако с точки зрения термической эффективности высокая температура горения может быть ограничена выбором конструкционных материалов в печи реакции Клауса и последующего котла-утилизатора. Для сырьевых газов с высокой концентрацией H2S обогащение кислородом может привести к повышению температуры технологического газа выше расчетной температуры материалов. Однако комбинация рециркуляции H2SO4 (которая охлаждает технологический газ за счет испарения и разложения кислоты) делает возможным использование обогащенного O2 в такой схеме.
Камера сгорания остаточного газа реакции Клауса, как правило, будет работать с атмосферным воздухом, и, кроме того, может быть выгодно направлять газы с низкой концентрацией соединений серы в камеру сгорания остаточного газа реакции Клауса для полного сжигания соединений серы, высвобождая значительно больше энергии, чем парциальное окисление, происходящее в печи реакции Клауса.
Как следствие, может быть выгодно направлять сырьевые газы, содержащие высокие концентрации (например, более 50 об.%) H2S, на установку Клауса, отводя сырьевые газы с меньшей концентрацией, а также сырьевые газы, содержащие NH3, в камеру сгорания остаточного газа реакции Клауса.
Если камера сгорания остаточного газа реакции Клауса получает только остаточный газ реакции Клауса, содержащий только ограниченное количество H2S, теплотворная способность является слишком низкой для поддержания стабильного горения. В этой ситуации требуется добавление вспомогательного топлива. Это вспомогательное топливо может представлять собой H2S, газ SWS или углеводородное сырье, но предпочтительно использовать количество существующего сырьевого газа для интегрированной установки Клауса и серной кислоты.
Интеграция процесса Клауса и сернокислотного процесса обеспечивает преимущества интеграции. К ним относится возможность снижения объемного расхода в процессе Клауса за счет подачи окислителя в виде серной кислоты, которая может заменить атмосферный воздух. Кроме того, использование сырьевого газа может быть оптимизировано таким образом, что сырьевые газы, содержащие топливо, в значительной степени способствующее производству серы, могут направляться в процесс Клауса, тогда как сырьевые газы, содержащие тепловую энергию и не вступающие в реакцию продукты, такие как CO2, могут направляться в сернокислотный процесс. Если процесс предназначен для рециркуляции слишком большого количества серной кислоты, может потребоваться дополнительное топливо для обеспечения тепла, необходимого для испарения и диссоциации серной кислоты.
Интеграция двух процессов также позволяет реализовать процесс, в котором эксплуатация процесса Клауса осуществляется с низкой конверсией, такой как 90% или 95%, поскольку может быть дешевле проводить дополнительную конверсию в сернокислотном процессе по сравнению с добавлением дополнительной стадии конвертера Клауса.
В интегрированном процессе, в котором серная кислота из сернокислотного процесса рециркулируется на термическую стадию установки Клауса, промежуточный резервуар для хранения серной кислоты может быть выгодно расположен между выходом для серной кислоты на сернокислотной установке и вводом серной кислоты в печь реакции Клауса. Такой резервуар позволит более надежно и безопасно контролировать ввод кислоты в печь реакции Клауса, так что периоды смещения могут работать без ввода кислоты. Например, при пуске и остановке интегрированного процесса будет выгодно работать без ввода серной кислоты. Кроме того, если трубы для ввода кислоты требуют обслуживания, интегрированный процесс может работать без остановки процесса производства серной кислоты.
Резервуар также позволит отводить продукт серной кислоты, если он станет востребованным продуктом, а также позволит импортировать серную кислоту из других источников. Резервуар также может действовать как буфер, отделяющий процесс Клауса от процесса производства серной кислоты (сернокислотного процесса), что обеспечивает стабильность всей системы.
Емкость резервуара для производства серной кислоты в течение 1-4 дней является хорошим компромиссом между стоимостью резервуара и гибкостью интегрированного процесса Клауса и сернокислотного процесса.
Для надежной работы промышленной установки обычно используется «система отключения» для обнаружения и обработки непредвиденных отключений («отключений»). Для интегрированного процесса Клауса и сернокислотного процесса может произойти отключение в любом из двух процессов, и важно, чтобы процесс был устойчивым к таким отключениям, чтобы последствия были сведены к минимуму.
Может возникнуть необходимость остановить подачу серной кислоты в печь реакции Клауса из-за отказа кислотного насоса в баке серной кислоты, отказа регулятора расхода серной кислоты и потери распыляющей жидкости. В такой ситуации необходимо обновить систему отключения установки Клауса, чтобы справляться с такими инцидентами, позволяя отключать сопла для ввода кислоты, сохраняя при этом работу установки Клауса. В случае прекращения подачи кислоты система управления воздухом для горения печи реакции Клауса компенсирует недостаток кислорода за счет увеличения расхода воздуха, тем самым возвращая установку Клауса в нормальный режим работы.
Во время работы трубы и сопла для распыления серной кислоты охлаждаются потоком воздуха для распыления и особенно потоком серной кислоты. При остановке потока кислоты охлаждение в основном исчезает, а температура труб повышается. Материал трубы может выдержать рабочую температуру реакционной печи, но любая кислота, попавшая в трубу, будет нагреваться. Скорость коррозии значительно увеличится, а также может произойти кипение серной кислоты. Чтобы избежать этой ситуации, кислотные линии могут быть промыты газообразной промывочной средой для удаления жидкой кислоты из трубы, так что кислотная коррозия будет сведена к минимуму, а труба будет обеспечена некоторым дополнительным охлаждением, и избегают попадание технологического газа печи реакции Клауса газа в трубу. Промывка будет продолжаться до тех пор, пока поток кислоты не будет остановлен. Промывочная среда обычно представляет собой поток N2, который уже доступен и используется в установках Клауса, и представляет собой инертный газ, который не будет мешать химическому процессу в реакционной печи. В качестве альтернативы в качестве промывочной среды можно использовать воздух, но тогда в печь реакции Клауса будет добавляться еще и O2, и существует риск вмешательства в управление подачей воздуха для горения, если промывочный поток не оборудован расходомером. Прекращение подачи серной кислоты также приведет к повышению температуры в реакционной печи, но повышение температуры в большинстве случаев не будет проблемой, поскольку огнеупорные стенки смогут выдерживать более высокую температуру, а более высокая температура не окажет негативного воздействия на химию реакции в печи Клауса.
В случае срабатывания отключения ввода кислоты распыляющая среда воздушных сопел будет продолжать течь, так что труба будет охлаждаться, и предотвращается попадание технологического газа в трубу. После отключения потока кислоты застойная кислота останется в кислотной линии трубы, и без охлаждения, обеспечиваемого потоком кислоты, температура кислоты повысится, и, таким образом, скорость коррозии кислоты также увеличится. Чтобы избежать коррозии линии кислоты после отключения потока кислоты, линию кислоты промывают N2 или воздухом для очистки линии от кислоты. Эта промывка будет выполняться как для пневматических, так и для гидравлических сопел и будет продолжаться сколь угодно долго, чтобы избежать попадания технологического газа в сопла.
В дополнение к влажному способу производства серной кислоты, серная кислота также может быть получена в других процессах снижения выбросов серы, и эта серная кислота также может быть направлена в печь реакции Клауса по аналогичным принципам, особенно если полученная серная кислота составляет по меньшей мере 90%.
Стандартная схема установки Клауса требует >50 об.% H2S в сырьевом газе, чтобы быть термически самоподдерживающейся в печи реакции Клауса. При более низких концентрациях H2S требуется предварительный подогрев подаваемого газа и так называемая конфигурация с разделенным потоком. Установки Клауса, перерабатывающие сырьевые газы с содержанием H2S < 10-20 об.%, встречаются редко. С другой стороны, сернокислотные процессы очень эффективно обрабатывают эти так называемые обедненные газы H2S, производя концентрированную серную кислоту. Продукт серной кислоты будет иметь высокую концентрацию серы и кислорода.
Комбинация сернокислотной установки для обработки обедненного газа H2S (и/или других соединений серы) в сочетании с установкой Клауса для обработки газа с высоким содержанием H2S и приема кислоты из сернокислотной установки будет выгодной установкой, поскольку потоки сырья как для установки Клауса, так и для сернокислотной установки являются оптимальными с точки зрения эффективности конверсии, термической эффективности и размера/стоимости установки.
Сочетание процесса Клауса и сернокислотного процесса также можно использовать для оптимизации обработки сырья. Сернокислотные процессы и, в частности, влажный сернокислотный процесс имеют то преимущество, что они хорошо подходят для загрязненного сырья, включая газы SWS, содержащие аммиак, как обсуждалось выше, «грязная сера», содержащая органические примеси и умеренные количества неорганических примесей, разбавленные потоки H2S, SO2 и других соединений серы, включая дымовые газы от горелок и газ FCC. Точно так же газы с высоким содержанием сероводорода, которые должны быть разбавлены перед обработкой на установке для влажного сернокислотного процесса, вместо этого могут быть направлены непосредственно в процесс Клауса.
Краткое описание чертежей
На Фиг. 1 показан последовательный процесс Клауса + сернокислотный процесс в соответствии с предшествующим уровнем техники.
На фиг. 2 показан интегрированный процесс Клауса + сернокислотный процесс с вводом серной кислоты в печь реакции Клауса согласно настоящему изобретению
На Фиг. 1 показан способ получения серы и серной кислоты согласно предшествующему уровню техники. В данном случае сырьевой газ 2, обогащенный H2S, направляют в процесс Клауса, из которого остаточный газ 26 направляют в сернокислотный процесс. Сырьевой газ 2 обогащенный H2S, направляют в печь реакции Клауса 66, превращающую количество H2S в SO2, с образованием сырьевого газа для конвертера Клауса 4, имеющего соотношение H2S и SO2 близко к 2:1. Сырьевой газ для конвертера Клауса 4 направляют в конвертер 8, содержащий вещество, каталитически активное в реакции Клауса 12, обеспечивая продукт реакции Клауса 14. Продукт реакции Клауса 14 направляют в узел конденсации серы 16, обеспечивая конденсированную серу 18 и остаточный газ реакции Клауса 20. Влажный остаточный газ реакции Клауса 20 как правило дополнительно реагирует в присутствии вещества, каталитически активного в реакции Клауса, с последующей дополнительной конденсацией серы, за от одной до четырех дополнительные стадии Клауса (не показаны), с обеспечением конечного влажного остаточного газа реакции Клауса. Водную фазу 24 необязательно можно отделить от влажного остаточного газа реакции Клауса 20 в сепараторе 22, обеспечивая высушенный остаточный газ реакции Клауса 26, который направляют в камеру сгорания остаточного газа реакции Клауса 32, обеспечивая сырьевой газ 34 для конвертера SO2. Сырьевой газ 34 для конвертера SO охлаждаю и направляют в конвертер SO2 40, содержащий один или несколько шариков (слоев) каталитически активного вещества 42, 44, 46, необязательно с охлаждением между слоев, из которого газ, обогащенный SO3, 48 отводят. Так как обогащенный SO3 газ содержит воду, SO3 может гидратироваться с образованием H2SO4. H2SO4 конденсируется в виде концентрированной серной кислоты 52 в конденсаторе серной кислоты 50. Из конденсатора серной кислоты 50 по существу чистый газ 62 может быть отведен и направлен на вывод 64.
Для поддержания стабильного пламени и достаточно высокой температуры для полного окисления H2S, СО, CS2, COS и Н2 топливный газ может быть направлен в камеру сгорания остаточного газа реакции Клауса 32. Кислород также подается, как правило, по воздух, и предпочтительно горячий воздух из конденсатора серной кислоты (50), чтобы подавать кислород как для реакций горения в камере сгорания остаточного газа реакции Клауса 32, так и для подачи кислорода, необходимого для окисления SO2 в конвертере SO2. Для снижения расхода топлива кислород для окисления SO2 может быть добавлен между выходом камеры сгорания остаточного газа реакции Клауса 32 и входом конвертера SO2 40.
На Фиг. 2 показан интегрированный процесс Клауса/сернокислотный процесс с вводом серной кислоты в печь реакции Клауса 66 согласно настоящему изобретению. Сырьевой газ 2 обогащенный H2S, серную кислоту 56 и газ, обогащенный кислородом, 72, а также необязательно газ, содержащий топливо, и необязательно второй сырьевой газ, например, содержащий низкую концентрацию H2S и возможно NH3 направляют в печь реакции Клауса 66, и продукт сгорания направляют в качестве свободного от O2 сырьевого газа для конвертера Клауса 4 в конвертер 8. Между выходом в печь реакции Клауса 66 и входом конвертера Клауса 8, утилизационный котел и необязательно узел конденсации серы (не показан), как правило, обычно устанавливаются для снижения температуры до оптимальной рабочей температуры для катализатора Клауса, необязательно также удаляя элементарную серу, образующуюся в печи реакции Клауса 66. Свободный от O2 сырьевой газ для конвертера Клауса 4 направляют для контактирования с дополнительным веществом, каталитически активным при превращение SO3 в SO2 10 (содержащим, например, одно или несколько соединений V, Mn, Fe, Со, Cu, Zn, Ni, Mo, W, Sb, Ti и Bi, нанесенных на одно или несколько соединений Al, Ti, Si, диатомовую землю, Zr, Mg и кордиерит), и веществом, каталитически активным в реакции Клауса 12, содержащим, например, оксид алюминия или оксид титана, обеспечивая продукт реакции Клауса 14. Продукт реакции Клауса 14 направляют в узел конденсации серы 16, обеспечивающие конденсированную серу 18 и остаточный газ реакции Клауса 20. Остаточный газ реакции Клауса 20 может необязательно дополнительно реагировать в присутствии дополнительного каталитически активного вещества в процессе Клауса, с последующей конденсацией серы, в ходе от одной до четырех дополнительных стадий Клауса (не показаны здесь), с обеспечением конечного остаточного газа реакции Клауса. Конечный остаточный газ реакции Клауса, содержащий H2S, 20 направляют в камеру сгорания остаточного газа реакции Клауса 32, с получением сырьевого газа конденсатора SO2 34. Для того, чтобы обеспечить окисление соединений в остаточном газе реакции Клауса, газ, обогащенный O2 72 направляют в камеру сгорания остаточного газа реакции Клауса 32.
Сырьевой газ 34 конвертера SO2 обычно охлаждают в котле-утилизаторе (не показан) для обеспечения оптимальной температуры для первого слоя 42 катализатора в конвертере SO2 40. Сырьевой газ 34 конвертера SO2 направляют в конвертер SO2 40, содержащий один или большее количество слоев/слоев каталитически активного вещества 42, 44, 46, необязательно с охлаждением между слоями, из которых отводят газ 48, богатый SO3. Так как обогащенный SO3 газ содержит воду, SO3 может гидратироваться с образованием H2SO4. H2SO4 конденсируется в виде концентрированной серной кислоты 52 в конденсаторе 50 серной кислоты. Если количества воды недостаточно для полной гидратации SO3, может быть предпочтительным добавление пара в положение выше по ходу потока от конденсатора 50 серной кислоты. Из конденсатора 50 серной кислоты может быть отобран по существу чистый газ 62 и направлен в стояк 64. Как правило, вся серная кислота 56 рециркулируется в печь реакции Клауса 66, но необязательное количество серной кислоты может быть отобрано для других технологических целей. Для этой цели промежуточный резервуар для серной кислоты (54) может быть расположен между выходом для серной кислоты конденсатора серной кислоты 50 и печью реакции Клауса 66, который может действовать как буфер, отключая процесс Клауса от работы сернокислотного процесса, который обеспечивает стабильность всей системы.
Необязательный каталитический реактор 35 для окисления оставшихся примесей, таких как углеводороды, СО, COS, CS2, S, Н2 и H2S, также показан на фиг. 2.
Согласно другому варианту осуществления все количество вторичного сырья, содержащего NH3 и H2S 70, направляют в камеру сгорания остаточного газа реакции Клауса 32, устраняя риск образования солей NH3 в конденсаторах Клауса 16. Согласно этому варианту осуществления может быть установлена система восстановления NOX33, расположенная между выходом камеры сгорания остаточного газа реакции Клауса 32 и входом конвертера SO2 40. Обычно используется так называемый каталитический реактор SCR (селективная каталитическая реакция), требующий добавления NH3 для протекания реакции SCR. Добавление NH3 может происходить из внешнего источника или может представлять собой небольшой поток второго сырья, содержащего NH3 и H2S 70, который затем пропускают через камеру сгорания остаточного газа реакции Клауса.
В соответствии с выбранным вариантом осуществления превращение и конденсация серной кислоты могут быть осуществлены в две стадии, где оставшийся SO2 с первой стадии подвергается дальнейшему окислению, гидратации и конденсации с сопутствующим преимуществом обеспечения повышенного удаления серы.
Согласно данному варианту осуществления, дополнительная конверсия SO2 может быть достигнута за счет установки установки по очистке остаточных газов после сернокислотного процесса. Существует множество таких решений для остаточных газов, наиболее распространенными из которых являются щелочные скрубберы, которые не обязательно сочетаются с фильтрами тумана. Скрубберы, использующие H2O2 или NH3, являются предпочтительными, так как исходящий поток из этих скрубберов представляет собой H2SO4 и (NH4)2SO4 соответственно, оба из которых могут быть рециркулированы в печь реакции Клауса для термической деструкции, т.е. удаления потока отходов.
Согласно другому варианту осуществления сырьевой газ 34 конвертера SO2 может быть высушен, так что газ 48, обогащенный SO3, будет содержать мало воды или совсем не содержать ее. В этом случае конденсатор 50 может быть заменен абсорбером, в котором SO3 может быть абсорбирован серной кислотой для получения концентрированной серной кислоты с помощью процесса сухой серной кислоты.
Согласно другому варианту осуществления количество элементарной серы также может быть передано в камеру сгорания остаточного газа реакции Клауса 32, что будет иметь эффект подачи SO2 в процесс производства серной кислоты без введения воды, что может быть полезным, если желательно увеличьте концентрацию SO3, что может быть полезно в сухом сернокислотном процессе.
Согласно другому варианту осуществления количество топливного газа 68 направляют в камеру сгорания остаточного газа реакции Клауса 32 для обеспечения достаточно высокой температуры для полного окисления всех восстановленных соединений в остаточной газовой реакции Клауса 20.
Согласно данному варианту осуществления, количество сырьевого газа 2 обогащенного H2S также может быть разделено на количество, направляемое в камеру сгорания реакции Клауса 66, и количество, направляемое в камеру сгорания остаточного газа реакции Клауса 32. Это уменьшит потребность в дополнение топливного газа в камеру сгорания остаточного газа реакции Клауса 32.
Согласно другому варианту осуществления часть остаточного газа реакции Клауса 20 отводят от камера сгорания остаточного газа реакции Клауса 32 и объединяют с горячим отходящим газом 34 из камеры сгорания остаточного газа реакции Клауса в точке смешения газов сразу ниже по ходу потока камеры сгорания остаточного газа реакции Клауса. Это уменьшает количество топливного газа 68, необходимого камере сгорания остаточного газа реакции Клауса для поддержания достаточно высокой температуры. Комбинированный отходящий газ камеры сгорания остаточного газа реакции Клауса и отведенный остаточный газ реакции Клауса должен иметь температуру газовой смеси выше 400°С, чтобы обеспечить гомогенное (т.е. газовую фазу) окисление H2S. Для обеспечения полного окисления «трудных» соединений, таких как COS и СО, между точкой смешения газов и входом в конвертер SO2 40 может быть установлен дополнительный катализатор окисления 35. Для обеспечения оптимального контроля температуры катализатора окисления между точкой смешения газов и входом в катализатор окисления может быть установлен тепловой котел или любой другой теплообменник. Катализатор окисления обычно содержит благородный металл, такой как Pt или Pd.
Согласно другому варианту осуществления газ, содержащий кислород 72, может быть чистым кислородом или атмосферным воздухом, обогащенным кислородом, так что он содержит менее 50%, 20%, 10% или даже 1% N2+Ar.
Пример 1
Испарение капель серной кислоты было численно проанализировано с использованием подробной математической модели, включающей
1. Теплопередачу к капле за счет конвективного теплообмена.
2. Теплопередачу к капле теплообменом излучением от молекул газа и горячих огнеупорных стенок в реакционной печи.
3. Массоперенос между каплей и технологическим газом
4. Подробную термодинамику смесей серная кислота/вода.
Предполагается, что сопло распыления относится к пневматическому типу, начальная скорость капель составляет около 50 м/с, а скорость потока технологического газа составляет около 10 м/с.
Результаты моделирования для трех различных температур реакционной печи показаны на фиг. 3. Капли серной кислоты (93% мас./мас. H2SO4) попадают в горячую реакционную печь при низкой температуре и первоначально растут за счет поглощения воды из окружающего технологического газа. Когда капля нагревается, в основном испаряется вода, пока концентрация серной кислоты не достигнет примерно 98,5% мас./мас., что является концентрацией азеотропа. С этого момента концентрация и температура капли не меняются до тех пор, пока капля полностью не испарится.
Из результатов видно, что начальный размер капель имеет значение для безопасной и долгосрочной работы установки Клауса, особенно если время пребывания в реакционной печи должно быть установлено на уровне 1-2 секунд. Капли с начальным диаметром более 500 мкм в течение 1 секунды не испаряются полностью при температуре 1000°С. Как видно, температурный эффект действительно присутствует, однако влияние начального диаметра капель значительно сильнее.
Пример 2
Распыление серной кислоты требует тщательного выбора типа сопла и режима работы сопла. На рынке существует множество сопел со своими характеристиками в отношении объема жидкости, давления, типа и т.д., начиная от очень мелкодисперсных распылителей с малой производительностью и заканчивая крупными распылителями с очень большой производительностью, в зависимости от области применения.
Для целей испарения желателен небольшое распределение по размеру, и для этой цели предпочтительны воздушное сопло (воздушное, двухфазное) и гидравлическое (напорное) сопла, первые производят более мелкие капли, но с «затратами» потребления распыляющей жидкости, которой обычно является сжатый воздух.
На основе данных, приведенных в таблицах 18-18 и 18-19 в Perry's Chemical Engineers Handbook, 4th edition (McGraw-Hill 1963),было рассчитано значение D0.9, которое показано в таблице 1. D0.9 определяет диаметр, где 90% от общей массы (или объема) капель имеют меньший диаметр. Данные основаны на воде в виде жидкости и воздухе, в случае воздушного сопло, при комнатной температуре.
Как видно из таблицы, воздушное сопло образует мельчайшие капли. Гидравлическое сопло также дает мелкие капли, но размером до 500 мкм. Сопло №2 и №3 отличаются только давлением жидкости, и видно, что более высокое давление жидкости приводит к более мелким каплям. Несмотря на образование мелких капель, гидравлические сопла могут быть худшим выбором, если время пребывания в реакционной печи составляет всего 1 секунду, но при времени пребывания 2 секунды сопла будут работать нормально. На фиг. 3 показано время испарения капель серной кислоты. Для гидравлических сопел следует рассмотреть возможность установки в реакционной печи противоударной стенки или аналогичного материала, чтобы большинство самых крупных капель сталкивались со стенкой и испарялись внутри реакционной печи.

Чтобы задокументировать эффект объединения процесса Клауса и сернокислотного процесса, были проанализированы четыре дополнительных примера процесса, показанного на фиг. 2, в сравнении с процессом предшествующего уровня техники, как показано на фиг. 1.
Эти примеры основаны на следующих сырьевых газах:
Сырьевой газ, обогащенный H2S (поток 2 на фиг. 1 и 2):
Общий поток газа: 8190 Нм3/ч
Концентрация H2S: 94 об.%
Концентрация Н2О: 6 об.%
Газ, обогащенный H2S, типичен для нефтеперерабатывающих заводов, а также будет содержать различные количества легких углеводородов.
Сырьевой газ, обогащенный H2S и NH3 (поток 70 на фиг. 1 и 2):
Общий поток газа: 3669 Нм3/ч
Концентрация H2S: 28 об.%
Концентрация NH3: 45 об.%
Концентрация Н2О: 27 об.%
Эти потоки, содержащие H2S и NH3, обычно представляют собой отходящие газы от так называемых отпарных колон для кислых вод и считаются SWS-газами. Они также могут содержать различное количество легких углеводородов.
Топливный газ представляет собой смесь легких углеводородов (преимущественно СН4) с низшей теплотворной способностью 12 200 ккал/Нм3.
Потоки сырья, воздух для горения и остаточный газ реакции Клауса предварительно нагревают, насколько это возможно, за счет использования тепла, выделяющегося в комбинированном процессе Клауса + серной кислоты.
В этих примерах процесс Клауса работает с извлечением серы из сырья на уровне 94-95%, т.е. может представлять собой хорошо работающую установку Клауса только с двумя каталитическими стадиями.
Пример 3
Последовательный процесс Клауса + серной кислоты в соответствии с предшествующим уровнем техники.
В примере 3 все исходные потоки обрабатывают в процессе Клауса, обеспечивая поток 11,7 т/ч элементарной серы и остаточный газ реакции Клауса, содержащий ~5% S в сырьевых газах. В камере сгорания остаточного газа реакции Клауса соединения серы, присутствующие в остаточном газе реакции Клауса, окисляются, а топливный газ подается для поддержания температуры камеры сгорания 1000°С, так что все восстановленные соединения, такие как СО, COS, Н2, H2S, SX и CS2 полностью окисляются до CO2, Н2О и SO2.
Производство концентрированной серной кислоты составляет 2,4 т/ч в пересчете на 100% мас./мас. H2SO4.
Общее извлечение серы и серной кислоты составляет >99,9% серы в сырье, что соответствует самым строгим экологическим нормам.
Пример 4
Рецикл H2SO4 в печь реакции Клауса.
В этом примере H2SO4 не является желательным продуктом, и вся кислота, полученная в результате сернокислотного процесса, рециркулируется в печь реакции Клауса. Количество рециркулируемой H2SO4 соответствует примерно 6% от общего количества S в сырьевых потоках.
Общий поток продукта элементарной серы теперь равен S в потоках сырья, что соответствует 107% базового случая, как описано в примере 3.
Температура в печи реакции Клауса снижается на ~200°С за счет испарения и разложения H2SO4, но температура все еще значительно выше минимальной для полного сгорания углеводородов и NH3 Топливный газ не требуется в печи реакции Клауса.
Поскольку H2SO4 является отличным носителем O2, потребность в воздухе для горения уменьшается, и, следовательно, объем технологического газа уменьшается по мере уменьшения потока инертного N2. В целом расход технологического газа на выходе из печи Клауса реакции уменьшается до 94% от базового расхода, а поток технологического газа на выходе из камеры сгорания остаточного газа реакции Клауса уменьшается до 93% из-за этого уменьшения потока N2. Поскольку в камере сгорания остаточного газа реакции Клауса требуется нагревать меньше технологического газа до 1000°С, потребление топливного газа составляет всего 92% от базового случая.
Выгода от рециркуляции H2SO4 оказалась неожиданно высокой, так как производительность установки Клауса по образованию серы не только увеличилась на 7%, но в то же время объем технологического газа уменьшился на 6-7%. Это соответствует увеличению производительности установки Клауса примерно на 15% при условии, что расход технологического газа составляет 100% от базового случая.
Пример 5
Рецикл H2SO4 в печь реакции Клауса и отвод газа SWS в камеру сгорания остаточного газа реакции Клауса.
В этом примере потребление топливного газа в камере сгорания остаточного газа реакции Клауса было сведено к минимуму за счет пропуска части газа SWS в камеру сгорания остаточного газа реакции Клауса. Газ SWS имеет высокую теплотворную способность и может легко выступать в качестве топливного газа. Концентрированный сырьевой газ H2S также можно было бы использовать, но, поскольку газ SWS может быть проблематичным в процессе Клауса и не создает проблем в процессе влажной серной кислоты, отвод газа SWS имеет больше преимуществ, чем отвод газа H2S. Что касается технологического газа, объем газа также уменьшится, так как NH3 в газе SWS увеличит объем технологического газа в процессе Клауса из-за потребности в кислороде (воздухе) для сжигания NH3 в N2 и Н2О.
Количество рециркулируемого газа SWS регулируется таким образом, чтобы в камере сгорания остаточного газа реакции Клауса достигалась температура 1000°С, обеспечивающая полное сгорание восстановленных соединений остаточного газа реакции Клауса, таких как H2S, COS, СО, Н2, SX и CS2.
Поскольку топливный газ в камере сгорания остаточного газа реакции Клауса теперь содержит H2S, производство H2SO4 будет увеличиваться, что теперь составляет ~13% S в потоках сырья. Это большое количество рециркуляции серной кислоты приводит к значительному снижению температуры печи реакции Клауса.
При надлежащем предварительном подогреве сырьевого потока все еще возможно достичь достаточно высокой температуры в печи реакции Клауса без необходимости использования вспомогательного топлива.
Влияние на размер процесса Клауса является существенным: объем технологического газа снижается до 65% от базового варианта, при этом остается 107% производства элементарной серы. Это уменьшение объема технологического газа может быть использовано либо для повышения производительности существующей установки, либо для значительного снижения затрат на новую установку.
Кроме того, сернокислотная установка станет меньше, так как поток технологического газа составляет всего 90% от потока базового варианта. Это удивительно, так как производство H2SO4 увеличилось более чем в два раза по сравнению с базовым вариантом, но в основном это связано с большим уменьшением потока остаточного газа реакции Клауса.
Что наиболее примечательно, так это снижение расхода топливного газа, которое сейчас составляет всего 16% от расхода в базовом варианте, что способствует значительному снижению эксплуатационных расходов интегрированного сернокислотного процесса Клаус+.
Пример 6
Рецикл H2SO4 и полный отвод газа SWS в камеру сгорания остаточного газа реакции Клауса
В этом примере основное внимание уделяется полному исключению газа SWS в установке Клауса, что гарантирует невозможность образования солей аммиака в конденсаторах серы и, таким образом, снижает риск отказа установки Клауса.
Расход технологического газа на выходе из печи реакции Клауса составляет 69% от базового варианта, но немного выше по сравнению с примером 5, где отводят только часть газа SWS. Увеличение расхода технологического газа связано с необходимостью добавления топливного газа в печь реакции Клауса для поддержания высокой рабочей температуры.
Производство H2SO4 на установке для влажного сернокислотного процесса теперь увеличилось до 17% от содержания серы в сырьевых газах, рециркуляция всей продукции теперь гасит температуру печи реакции Клауса до такой степени, при которой требуется топливный газ. Технологический газ из камеры сгорания остаточного газа реакции Клауса увеличился до 107% от базового варианта из-за увеличения подачи серы на сернокислотную установку.
Даже если в печи реакции Клауса требуется топливный газ, общий расход топливного газа составляет всего 41% от базового варианта.
С точки зрения размера установки и эксплуатационных затрат этот пример кажется менее оптимальным, чем пример 5, т.е. существует оптимальное соотношение рециркуляции H2SO4, которое зависит от фактических потоков сырьевого газа и составов. Отвод еще большего количества сырьевого газа приведет к увеличению производства серной кислоты, что еще больше погасит печь реакции Клауса, что опять же потребует больше топливного газа, и, следовательно, поток остаточного газа реакции Клауса увеличится.
Для вышеописанных составов и потоков сырьевого оптимальным с точки зрения размеров установки и расхода топлива является поток рециркуляции H2SO4 в пределах от 13% до 17% от подачи S в потоках сырья.
В целом, оптимальный отвод запаса сырьевого газа близок к точке, в которой печь реакции Клауса работает при минимально допустимой температуре, т.е. запас сырья может быть отведен для производства большего количества серной кислоты до тех пор, пока температура реакции Клауса не достигнет предела для термической деструкции углеводородов и серной кислоты. Увеличение соотношения отвода запаса сырья снизит потребность в топливном газе в камере сгорания остаточного газа реакции Клауса, но увеличит потребление топливного газа в печи реакции Клауса на гораздо больший коэффициент, поскольку требуется топливный газ в камере реакции Клауса для испарения и разложения серной кислоты и нагревания технологического газа, тогда как в камере сгорания остаточного газа реакции Клауса требуется только нагрев технологического газа.
Для запаса сырьевого газа, например, 50 об.% H2S, оптимальный поток рециркуляции H2SO4 составляет ~7% от подачи S в сырьевом потоке. Отвод кислого газа в камеру сгорания остаточного газа Клауса составляет всего 2%, так как относительно низкая концентрация H2S приводит к низкой температуре в печи реакции Клауса, и, таким образом, серная кислота быстро снижает температуру и требует добавления топливного газа в печь реакция Клауса. Использование воздуха, обогащенного O2, в печи реакции Клауса позволит увеличить поток рециркуляции H2SO4.
Пример 7
Рециркуляция H2SO4, отвод газа SWS в камеру сгорания остаточного газа реакции Клауса и использование воздуха, обогащенного O2.
Для повышения производительности установки Клауса известен вариант конструкции, заключающийся в установке специальных горелок, способных работать с обогащенным воздухом с содержанием O2>21 об.%, обычное качество O2 составляет 93-99 об.% O2.
В данном примере используется обогащенный воздух с содержанием O2 80 об.%, как в процессе Клауса, тогда как в сернокислотном процессе используется атмосферный воздух.
Эффект обогащенного воздуха заключается в значительном снижении потока технологического газа, выходящего из печи реакции Клауса, в основном из-за уменьшения количества N2, связанного с потоком O2. Кроме того, меньший расход технологического газа позволяет эксплуатировать печь реакции Клауса без добавления топлива, так как требуется нагревать меньше инертного газа.
Поскольку расход технологического газа на выходе из печи реакции Клауса в настоящее время снижен только до 38% от базового варианта, подача остаточного газа реакции Клауса в камеру сгорания остаточного газа реакции Клауса также значительно уменьшена. Расход технологического газа из камеры сгорания остаточного газа реакции Клауса составляет всего 56% от базового варианта, что относительно выше расхода установки Клауса из-за большого количества отвода газа SWS на установку влажного сернокислотного процесса.
При такой конструкции можно работать без топливного газа как в процессе Клауса, так и в сернокислотном процессе, даже при таком высоком рециркуляционном потоке H2SO4 из сернокислотного процесса.
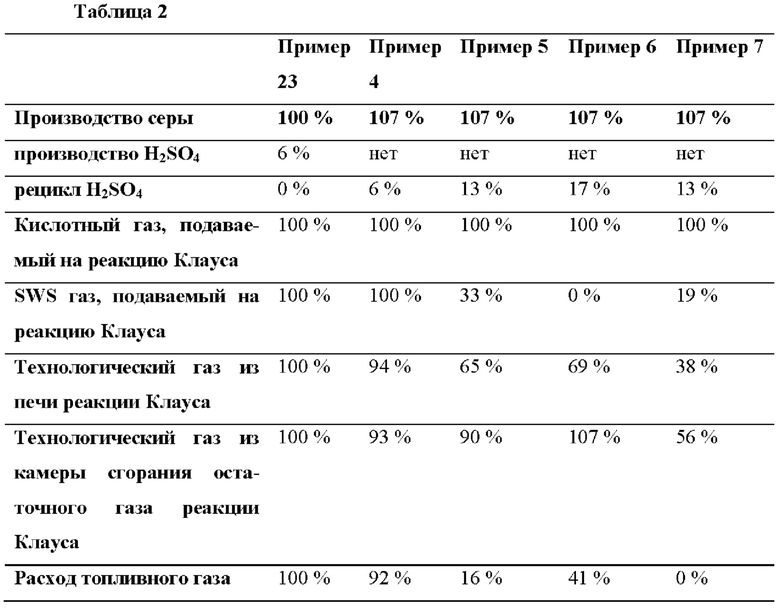
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭЛЕМЕНТАРНОЙ СЕРЫ И СЕРНОЙ КИСЛОТЫ | 2020 |
|
RU2824360C2 |
| МОДЕРНИЗАЦИЯ УСТАНОВКИ КЛАУСА СЕРНОКИСЛОТНОЙ УСТАНОВКОЙ | 2020 |
|
RU2827769C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЕРЫ | 2019 |
|
RU2806854C2 |
| СПОСОБ УТИЛИЗАЦИИ КИСЛЫХ ГАЗОВ, СОДЕРЖАЩИХ СЕРОВОДОРОД И АММИАК | 2013 |
|
RU2556935C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИОКСИДА СЕРЫ | 2017 |
|
RU2744704C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ ИЗ СЕРОСОДЕРЖАЩЕГО ИСХОДНОГО СЫРЬЯ С БЫСТРЫМ ГАЗОВЫМ ОХЛАЖДЕНИЕМ | 2017 |
|
RU2746896C2 |
| СПОСОБ ПРОИЗВОДСТВА СЕРНОЙ КИСЛОТЫ | 2007 |
|
RU2458857C9 |
| СПОСОБ ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2457173C2 |
| СПОСОБ ВЫДЕЛЕНИЯ СЕРЫ | 2007 |
|
RU2465196C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ С ПОМОЩЬЮ СЕРОВОДОРОДА | 2012 |
|
RU2564273C2 |
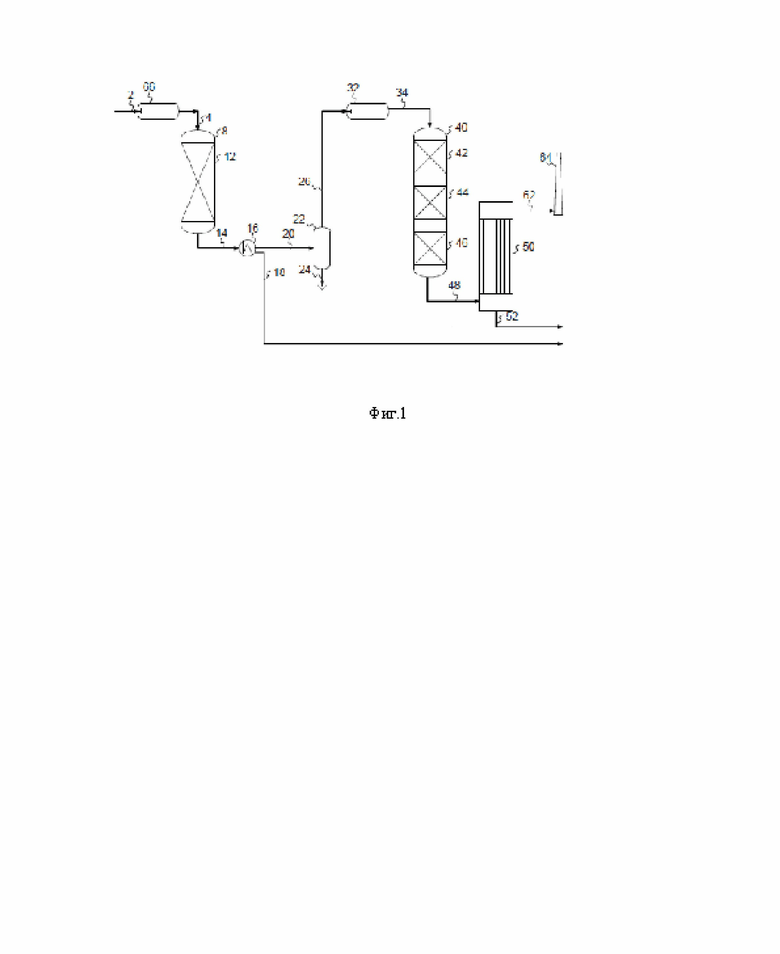
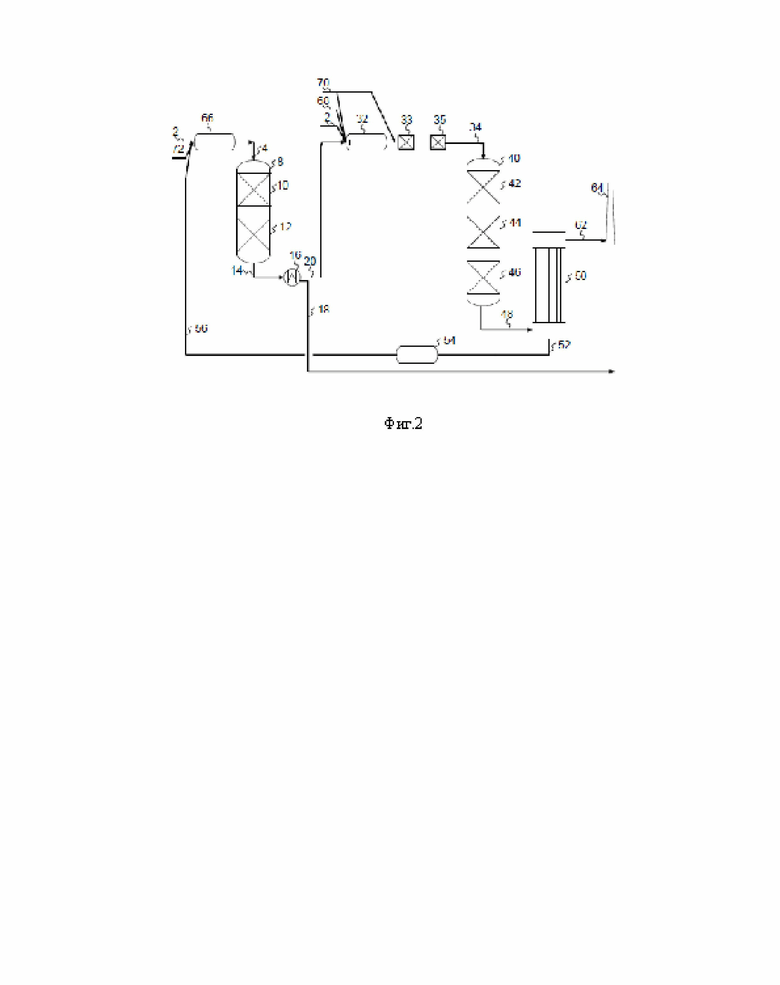
Изобретение относится к технологической установке и способу получения серы из сырьевого газа. Способ получения серы, состоящей из 15 об. %, 20 об. %, 30 об. %, 40 об. % или 50-99 об. % или 100 об. % H2S, и потока серной кислоты включает стадии: g. обеспечения сырьевого потока печи реакции Клауса, содержащего указанный сырьевой газ, количество серной кислоты, количество кислорода и необязательно количество топлива, где количество кислорода является субстехиометрическим, h. направления указанного сырьевого потока печи реакции Клауса в печь реакции Клауса, работающую при повышенной температуре, как, например, выше 900°С, обеспечивая сырьевой газ для конвертера Клауса, i. охлаждения указанного сырьевого газа для конвертера Клауса с обеспечением охлажденного сырьевого газа для конвертера Клауса и необязательно отведения элементарной серы из газа, j. направления указанного охлажденного сырьевого газа для конвертера Клауса после необязательного предварительного нагрева для контакта с веществом, каталитически активным в реакции Клауса, k. отвода остаточного газа реакции Клауса и элементарной серы, необязательно посредством охлаждения выходящего потока, от указанного вещества, каталитически активного в реакции Клауса, l. направления потока, содержащего указанный остаточный газ реакции Клауса, на обработку остаточного газа реакции Клауса, где указанная серная кислота, направленная в указанную печь реакции Клауса, находится в форме капель с распределением капель по размеру, характеризующимся тем, что 90% массы капель имеют диаметр ниже 500 мкм, 200 мкм или 100 мкм, с сопутствующим преимуществом такого способа, эффективно превращающего всю жидкую H2SO4 в газообразную H2SO4, а затем в SO3 и, в конечном итоге, в SO2, что хорошо подходит для процесса Клауса. Технический результат – повышение эффективности получения элементарной серы. 2 н. и 10 з.п. ф-лы, 3 ил., 2 табл.
1. Способ получения серы из сырьевого газа, содержащего 15 об. %, 20 об. %, 30 об. %, 40 об. % или 50-99 об. % или 100 об. % H2S, и потока серной кислоты, включающий стадии:
a. обеспечения сырьевого потока печи реакции Клауса, содержащего указанный сырьевой газ, количество серной кислоты, количество кислорода и необязательно количество топлива, где количество кислорода является субстехиометрическим,
b. направления указанного сырьевого потока печи реакции Клауса в печь реакции Клауса, работающую при повышенной температуре, как, например, выше 900°С, обеспечивая сырьевой газ для конвертера Клауса,
c. охлаждения указанного сырьевого газа для конвертера Клауса с обеспечением охлажденного сырьевого газа для конвертера Клауса и необязательно отведения элементарной серы из газа,
d. направления указанного охлажденного сырьевого газа для конвертера Клауса после необязательного предварительного нагрева для контакта с веществом, каталитически активным в реакции Клауса,
e. отвода остаточного газа реакции Клауса и элементарной серы, необязательно посредством охлаждения выходящего потока, от указанного вещества, каталитически активного в реакции Клауса,
f. направления потока, содержащего указанный остаточный газ реакции Клауса, на обработку остаточного газа реакции Клауса,
отличающийся тем, что указанная серная кислота, направленная в указанную печь реакции Клауса, находится в форме капель с распределением капель по размеру, характеризующимся тем, что 90% массы капель имеют диаметр ниже 500 мкм, 200 мкм или 100 мкм.
2. Способ по п. 1, в котором по меньшей мере количество серной кислоты направляют в указанную печь реакции Клауса через по меньшей мере одно воздушное сопло, получая серную кислоту и распыляющую среду.
3. Способ по п. 2, в котором распыляющая среда представляет собой сжатый воздух, а поток составляет от 25 Нм3 воздух/тонна кислоты или от 50 до 200 Нм3 воздух/тонна кислоты или 500 Нм3 воздух/тонна кислоты.
4. Способ по п. 1, в котором по меньшей мере количество серной кислоты направляют в указанную печь реакции Клауса посредством по меньшей мере одного гидравлического сопла.
5. Способ по п. 1, где среднее время пребывания технологического газа в печи реакции Клауса составляет менее 5 с, более предпочтительно менее 2 с.
6. Способ по п. 1, где печь реакции Клауса содержит усилитель турбулентности.
7. Способ по п. 1, где печь реакции Клауса содержит средство импакции.
8. Способ по п. 1, где указанная обработка остаточного газа реакции Клауса включает стадии:
g. направления потока, содержащего указанный остаточный газ реакции Клауса, кислород и топливо в качестве сырьевого газа, в камеру сгорания остаточного газа реакции Клауса, работающую при температуре выше 900°С, или каталитическое средство для окисления, обеспечивающее сырьевой газ для конвертера SO2,
h. направления указанного сырьевого газа для конвертера SO2 для контакта с веществом, каталитически активным при окислении SO2 до SO3, обеспечивая газ, обогащенный SO3,
i. превращения указанного газа, обогащенного SO3, в концентрированную серную кислоту либо путем абсорбции SO3 серной кислотой, либо путем гидратации SO3, охлаждения и конденсации серной кислоты,
j. рециклизации по меньшей мере части полученной серной кислоты в печь реакции Клауса.
9. Способ по п. 1, где количество серной кислоты происходит из источника, отличного от обработки остаточного газа реакции Клауса.
10. Способ по п. 1, где количество серы в потоке серной кислоты выше 1%, 3% или 5% и меньше 17%, 21% или 25% от общего количества элементарной серы, отводимого из процесса.
11. Технологическая установка, содержащая печь реакции Клауса, утилизационный котел Клауса, секцию конверсии Клауса, камеру сгорания остаточного газа реакции Клауса и секцию серной кислоты, где печь реакции Клауса имеет вход в печь, вход и выход сопла кислоты, утилизационный котел Клауса имеет вход для газа, выход для газа и выход для элементарной серы, секция конверсии Клауса имеет вход для газа, выход для газа и выход для элементарной серы, камера сгорания остаточного газа реакции Клауса имеет вход и выход, и секция серной кислоты имеет вход для газа, выход для газа и выход для серной кислоты, и где вход в печь реакции Клауса сконфигурирован для получения сырьевого газа и окислителя, а выход печи реакции Клауса сконфигурирован для жидкостного сообщения с входом утилизационного котла Клауса, где выход утилизационного котла Клауса сконфигурирован для жидкостного сообщения с входом секции конверсии Клауса, и где вход камеры сгорания остаточного газа реакции Клауса сконфигурирован для жидкостного сообщения с выходом указанного выхода секции конверсии Клауса для газа, причем выход камеры сгорания остаточного газа реакции Клауса сконфигурирован для жидкостного сообщения с входом в секцию серной кислоты, отличающаяся дополнительно тем, что выход для серной кислоты секции серной кислоты находится в жидкостном сообщении с входом сопла кислоты указанной печи реакции Клауса.
12. Технологическая установка по п. 11, дополнительно содержащая резервуар для хранения серы, имеющий объем, соответствующий количеству серной кислоты, отводимому из выхода для серной кислоты секции серной кислоты за от 1 до 4 дней.
| WO 2017220655 A1, 28.12.2018 | |||
| US 4208192 A, 17.06.1980 | |||
| US 4070424 A, 24.01.1978 | |||
| СПОСОБ ОЧИСТКИ ГАЗА ОТ СЕРОВОДОРОДА | 1993 |
|
RU2048865C1 |
Авторы
Даты
2024-07-02—Публикация
2020-04-30—Подача