Настоящее изобретение относится к способу превращения H2S в элементарную серу в установке процесса Клауса, в котором добавляют H2SO4 на термической стадии установки процесса Клауса.
H2S является распространенным побочным продуктом во многих процессах, включая гидродесульфуризацию потоков нефтепереработки, производство вискозы и очистку природного газа от соединений серы. Желательно, перед выбросом в атмосферу подвергать H2S преобразованию, так как H2S является высокотоксичным, обладает неприятным запахом и представляет реальную угрозу для окружающей среды.
Процессы нефтепереработки, помимо образования хорошо известного газа с высокой концентрацией H2S, часто могут также производить так называемый газ из отпарной колонны кислой воды, который содержит H2S, H2O и NH3 в почти эквимолярных количествах.
В частности, на нефтеперерабатывающих заводах для снижения выбросов H2S выбирают процесс, представляющий собой процесс Клауса, который известен и оптимизирован в течение уже более 8 десятилетий. Процесс Клауса протекает в результате субстехиометрического сжигания H2S с образованием SO2 в реакционной печи Клауса с получением исходного газа для конвертера Клауса. В последующем процессе Клауса преобразовывают оставшийся H2S и образовавшийся SO2 в элементарную серу, которая может быть сконденсирована и выведена.
В настоящее время установлено, что добавление серной кислоты в реакционную печь Клауса обеспечивает возможности для оптимизации размеров установки процесса Клауса и эксплуатационных затрат.H2SO4 является концентрированным источником O2 и температурным регулятором. Оба свойства ценны для повышения производительности процесса Клауса. Было также установлено, что данное добавление H2SO4 может повредить катализатору процесса Клауса посредством сульфатирования и, таким образом, потребовать предохраняющего от SO3 материала перед каталитическим процессом Клауса.
В международной заявке WO 2012/152919 А1 представлен способ получения серной кислоты для обработки отходящего газа установки Клауса, в котором описывается превращение H2S в H2SO4 в отходящем газе установки Клауса. Стадиями процесса являются:
1. Субстехиометрическое окисление в реакционной печи Клауса
2. Конверсия Клауса
3. Окисление восстановленных соединений серы (H2S) в отходящем газе установки Клауса в атмосфере с высоким содержанием кислорода при 400 - 700°С
4. Каталитическое окисление SO2 до SO3
5. Конденсация H2SO4.
Нельзя не отметить, что продукт H2SO4 не всегда является желаемым, и поэтому предлагается рециркулировать серную кислоту в находящуюся выше по потоку реакционную печь Клауса или на стадию окисления H2S, как описано выше. Однако, рециркуляция серной кислоты задумывалась всего лишь как снижение выбросов серной кислоты, и последствия рециркуляции H2SO4 в сернокислотном процессе или процессе Клауса не были проанализированы, то есть, не было учтено, что рециркуляция H2SO4 требует уменьшения количества O2, направленного в реакционную печь Клауса, а также не реализуется благотворное влияние на процесс Клауса и сернокислотный процесс. Также не рассматривалось влияние на химические превращения в установке Клауса. Наконец, в документе не обсуждается вопрос о неполном превращении H2SO4 в SO2 - поэтому основным предположением в данном документе является отсутствие SO3 в процессе Клауса, и не приводится рекомендаций по необходимому удалению SO3.
Серная кислота не должна рециркулироваться из находящейся ниже по потоку сернокислотной установки, действующей в качестве установки обработки отходящих газов процесса Клауса, но может поступать из других источников. Преимущество добавления H2SO4 в технологическую установку Клауса может оправдать затраты на введение H2SO4, поскольку H2SO4 одновременно действует как эффективный носитель O2 и как регулятор температуры, как описано в патентной заявке РСТ/ЕР 2017/080721. Добавление H2SO4 может увеличить производительность установки процесса Клауса до 50%, не влияя на поток технологического газа в установке процесса Клауса.
В датской заявке на патент РА 2018 00057 описаны различные средства добавления жидкого потока H2SO4 на термическую стадию установки процесса Клауса, также известной как реакционная печь Клауса. Важно следить за тем, чтобы впрыскивание сильно не мешало пламени в реакционной печи, и при этом находилось достаточно близко к горячему пламени для быстрого испарения и последующего смешивания с газовой фазой для осуществления желаемой реакции Клауса.
Предшествующий уровень техники, относящийся к подаче H2SO4 на термическую стадию установки процесса Клауса, предполагает полное испарение серной кислоты и количественное превращение в SO2. Однако настоящее раскрытие основано на понимании того, что указанное превращение H2SO4 в SO2 может быть неполным.
В широком аспекте настоящее изобретение относится к способу получения по существу свободного от SO3 исходного газа конвертера Клауса из сырьевого газа, содержащего от 30% объемн., 40% объемн. или 50% до 99% объемн. или 100% объемн. H2S, и потока серной кислоты, включающему стадии
а. предоставление потока исходного сырья для реакционной печи Клауса, содержащего указанный сырьевой газ, некоторое количество серной кислоты, некоторое количество кислорода и при необходимости некоторое количество топлива, причем количество кислорода является субстехиометрическим,
b. направления указанного потока исходного сырья реакционной печи Клауса в реакционную печь Клауса, работающую при повышенной температуре, такой как выше 900°С, с получением отходящего газа реакционной печи Клауса,
c. охлаждение указанного отходящего газа реакционной печи Клауса и при необходимости выведение элементарной серы из газа,
d. направление указанного охлажденного отходящего газа реакционной печи Клауса для контакта с предохраняющим от SO3 материалом, поглощающим и/или преобразующим SO3, с получением по существу свободного от SO3 исходного газ конвертера Клауса,
e. направления указанного по существу свободного от SO3 исходного газа конвертера Клауса для контакта с материалом, каталитически активным в реакции Клауса,
f. выведения элементарной серы, при необходимости посредством охлаждения вытекающего потока из указанного материала, каталитически активного в реакции Клауса,
отличающийся тем, что указанный предохраняющий от SO3 материал отличается от указанного материала, каталитически активного в реакции Клауса, причем указанный предохраняющий от SO3 материал, активный в удалении SO3, обеспечивает длительную работу катализатора, активного в реакции Клауса, в случае если капли серной кислоты не полностью испаряются и восстанавливаются в газовой фазе, так что может быть обеспечена длительная работа установки для процесса Клауса, даже когда указанный материал, каталитически активный в реакции Клауса, не обладает активностью или обладает только временной активностью в преобразовании или абсорбции SO3.
В дополнительном варианте осуществления предохраняющий от SO3 материал представляет собой абсорбент SO3, в котором содержание SO3 увеличивается с течением времени, такой как оксид алюминия или оксид титана, с соответствующим преимуществом такого абсорбента, являющегося недорогим, и с дополнительным преимуществом оксида алюминия и оксида титана, обладающих умеренным каталитическим эффектом, позволяющим некоторое преобразование абсорбированного SO3.
В другом варианте осуществления, где предохраняющий от SO3 материал является материалом, каталитически активным в восстановлении SO3 посредством реакцией с H2S, предоставляя по существу свободный от SO3 исходный газ конвертера Клауса, с соответствующим преимуществом срока службы предохраняющего от SO3 материала, не ограниченного абсорбционной способностью.
В другом варианте осуществления предохраняющий от SO3 материал расположен ниже по потоку от реакционной печи Клауса и выше по потоку от конвертера Клауса, с соответствующим преимуществом предохраняющего от SO3 материала, расположенного удаленно и, таким образом, не зависящего от пламени в реакционной печи Клауса.
В другом варианте осуществления предохраняющий от SO3 материал расположен в качестве верхнего слоя на материале, каталитически активном в реакции Клауса, с соответствующим преимуществом, заключающимся в отсутствии затрат на отдельный реактор для предохраняющего от SO3 материала.
В другом варианте осуществления материал, каталитически активный в восстановлении SO3, содержит один или несколько элементов, взятых из группы, состоящей из V, Mn, Fe, Со, Cu, Zn, Ni, Mo, W, Sb, Ti и Bi, и носитель, содержащий один или несколько элементов, взятых из группы, состоящей из Al, Ti, Si, Zr и Mg, с соответствующим преимуществом таких материалов, активных в преобразовании SO3 в SO2 или серу.
В другом варианте осуществления носитель содержит диатомовую землю и/или кордиерит с соответствующим преимуществом, заключающимся в том, что такие материалы являются стабильными и имеют большую площадь поверхности.
В другом варианте осуществления материал, активный в восстановлении SO3, имеет форму гранул или монолита, с соответствующим преимуществом, заключающимся в том, что производство гранул является эффективным с точки зрения стоимости, тогда как монолиты обладают преимуществом от наличия низкого перепада давления.
В другом варианте осуществления реакционная печь Клауса работает при температуре от 900°С до 1500°С, с соответствующим преимуществом данного температурного диапазона, подходящего для разложения H2SO4 до H2O и SO3, для дальнейшего разложения SO3 до SO2, для частичного окисления H2S и для разложения примесей.
В другом варианте осуществления материал, каталитически активный в восстановлении SO3, работает при температуре между 130°С и 1500°С, с соответствующим преимуществом, заключающимся в том, что температура находится соответственно в интервале температур каталитической реакции Клауса и печи некаталитической реакции Клауса.
В другом варианте осуществления материал, каталитически активный в восстановлении SO3, работает при температуре между 250°С и 500°С, с соответствующим преимуществом, заключающимся в работе в температурном диапазоне, в котором преобразование SO3 в SO2 и/или серу происходит быстро, без потребности в высокостойких материалах.
В другом варианте осуществления материал, каталитически активный в восстановлении SO3, эксплуатируется при температуре между 300°С и 400°С, с соответствующим преимуществом, заключающимся в работе в температурном диапазоне, в котором преобразование SO3 в SO2 или серу происходит быстро, без потребности в экзотических материалах.
В другом варианте осуществления поток серной кислоты получают в сернокислотной установке мокрого типа обработкой хвостового газа установки Клауса, с соответствующим преимуществом такого процесса, являющегося термически эффективным и способным в очень высокой степени снизить выбросы сернистых соединений.
Компонент жидкой фазы серная кислота означает смесь H2SO4 и H2O, поскольку H2SO4 является гигроскопичной и абсорбирует воду из газовой фазы. В принципе, в реакционную печь Клауса может быть введена H2SO4 любой концентрации, но желательны высокие концентрации, так как это уменьшает энергию, необходимую для испарения, и сводит к минимуму разбавление отходящего газа реакционной печи Клауса попутной водой. Из практических соображений наиболее подходящей считается только серная кислота с >90% масс/масс.H2SO4.
Компоненты газовой фазы Н2504(серная кислота) и SO3 (серный ангидрид) часто просто называют "SO3", поскольку реакция гидратации SO3 (SO3+H2O↔H2SO4) считается очень быстрой и с уверенностью может считаться находящейся в химическом равновесии. Распределение между SO3 и H2SO4 зависит от температуры, давления и концентрации H2O в газе, SO3 преобладает при высоких температурах и низких концентрациях H2O, а H2SO4 преобладает при низких температурах и высокой концентрации H2O. Выше 400°С присутствует очень мало H2SO4, а ниже 200°С - очень мало SO3, и в диапазоне 200-400°С обе молекулы будут присутствовать в различных количествах (в случае влажного газа).
В реакционной печи имеют место следующие химические реакции, связанные с H2SO4:

"S" представляет собой элементарную серу в любой форме от S2 до S8
Реакции (5) и (6) являются общими реакциями для процесса Клауса, в котором H2S в исходном газе сжигается при дефиците O2 с образованием горючего газа с соотношением H2S/SO2 около 2, что является оптимальным соотношением для наибольшего превращения в элементарную серу.
При введении H2SO4 из реакции (2)+(3) видно, что серная кислота разлагается на SO2 и O2, уменьшая в конечном счете потребность в O2 на 2 моля для каждого моля H2SO4. В случае воздуха в качестве источника O2, 2 моля O2 сопровождаются 8 молями N2, и, таким образом, добавление H2SO4 значительно уменьшает количество инертного газа в технологическом газе.
Реакция (1) описывает испарение жидкой серной кислоты после впрыскивания в реакционную печь. Обычно поток серной кислоты распыляют в виде "тумана", состоящего из мелких капель, распределение капель по размерам определяется методом распыления. Испарение капель происходит с внешней поверхности капли, и, таким образом, начальный размер капли имеет важное значение для времени, необходимого для полного испарения. Время полного испарения зависит от 3-й степени диаметра капли, то есть удвоение диаметра капли увеличивает время испарения в 8 раз. Температура технологического газа и смешивание капель с газом также оказывают значительное влияние на время испарения капель.
Для получения мельчайших капель требуется двухфазное распыление, при котором для "разрезания" потока жидкости на мелкие капли используют распыляющую среду, обычно представляющую собой сжатый воздух, N2 или пар.
Реакция (2) представляет собой очень быструю газофазную реакцию, и можно суверенностью предположить химическое равновесие между SO3 и H2SO4.
Реакция (3) и (4) описывает общие реакции разложения SO3 на SO2 и O2, которые затем могут реагировать с H2S по реакции (5) и (6), либо непосредственно реагировать с H2S с образованием SO2 и S, где SO2 может взаимодействовать с H2S по реакции (6).
Реакция (3) сильно зависит от температуры и протекает только при более высокой температуре, т.е. >800°С, если только не присутствует катализатор.
Реакция (4) протекает и при более низких температурах, но скорость реакции при температурах ниже 400°С может быть слишком низкой, чтобы подходить для промышленного применения.
При температуре реакционной печи Клауса реакции (2) - (6) протекают очень быстро и обычно достигают химического равновесия менее чем за 0,5 секунды. Время пребывания в реакционной печи обычно составляет менее 1-2 секунд.
Согласно расчетам химического равновесия, ни H2SO4, ни SO3, ни O2 не будут присутствовать в технологическом газе при условиях газа реакционной печи Клауса.
Стехиометрический баланс между H2S и O2 в отсутствие H2SO4 составляет 2:1. Однако в присутствии H2SO4 требуется меньше O2. Таким образом, субстехиометрическое количество молекулярного кислорода определяется как молярное количество, составляющее менее половины молярного количества H2S.
Реакционная печь Клауса предпочтительно работает при температуре между 900 и 1500°С.
Для относительно больших капель реакция (1) будет ограничивающей стадией для перехода реакций к равновесию, и доступных 1-2 секунд времени пребывания может быть слишком мало для завершения реакций. Такие ситуации могут возникнуть, если, например, сопло для распыления серной кислоты изношено и/или поток или давление распыляющей среды выходят за пределы нормального диапазона. Следствием этого является то, что H2SO4/SO3 покидают реакционную печь Клауса не полностью преобразованными и поступают в теплообменник (котел-утилизатор), который охлаждает газ реакционной печи Клауса примерно до 300-400°С. При этой температуре реакции (1) и (2) все еще активны, тогда как скорости реакции для (3) - (6) слишком малы, чтобы иметь какое-либо практическое значение.
В широко используемой схеме процесса Клауса отходящий газ реакционной печи Клауса при температуре 300-400°С направляют в каталитический реактор Клауса, в котором установлен катализатор, активный в реакции (6). Данный катализатор хорошо известен в промышленности и чаще всего используется в виде гранул с активным материалом, представляющим собой TiO2 или Al2O3. Также хорошо известно, что указанный катализатор чувствителен к "сульфатированию", то есть активные центры катализатора "отравляются" сульфатом и, таким образом, катализатор теряет каталитическую активность, вследствие чего образуется меньше продукта и увеличиваются выбросы H2S и SO2. Сульфат может образовываться в результате реакции между SO2 и O2, образуя SO3 на поверхности катализатора, или SO3, присутствующий в технологическом газе, может непосредственно прикрепляться к поверхности катализатора.
В другой схеме процесса Клауса отходящий газ реакционной печи Клауса с температурой 300-400°С направляют в конденсатор серы, в котором технологический газ охлаждают до 130-160°С для конденсации элементарной серы и выведения продукта. Затем технологический газ повторно нагревают и направляют в каталитический реактор Клауса, как описано выше. Если в отходящем газе реакционной печи Клауса присутствует SO3, то существует риск конденсации серной кислоты в продукте элементной серы, образующей некондиционный продукт, и существует повышенный риск коррозии оборудования для обработки серы. Отходящий газ из конденсатора серы также будет содержать фракцию SO3 (в виде H2SO4), присутствующую в отходящем газе реакционной печи Клауса, и данный SO3 отравит находящийся ниже по потоку катализатор Клауса.
Как описано выше, очень важно, чтобы отходящий газ реакционной печи Клауса не содержал значительных количеств SO3, поскольку он может оказывать вредное воздействие на расположенный ниже по потоку катализатор, оборудование и работу установки для процесса Клауса.
Для обеспечения безопасной и длительной работы установки для процесса Клауса был разработан новый катализатор, активный в реакции SO3 с H2S с образованием смеси SO2 и S. Катализатор также способен подавлять реакцию с SO3, образующую O2 (реакция 3), поскольку проскок O2 так же сопряжен с проблемами, как и проскок SO3. Катализатор предпочтительно устанавливают между выходом из котла-утилизатора, подключенного к реакционной печи Клауса, и входом в оборудование и/или к катализаторам, которые могут быть повреждены присутствием SO3. Данный новый катализатор может быть установлен либо в отдельном реакторе, как это было бы необходимо в схеме процесса Клауса, в которой охлажденный отходящий газ реакционной печи Клауса направляют в конденсатор серы перед каталитическим реактором Клауса, либо в качестве верхнего слоя в существующем реакторе Клауса, что возможно в схеме, где технологический газ поступает непосредственно в каталитический реактор Клауса.
В другом варианте катализатор устанавливают на выходе из реакционной печи Клауса, используя преимущество высокой температуры и высоких скоростей реакции.
Катализатор может быть любой формы и размера, считающихся оптимальными для схемы установки процесса Клауса. Если его располагают в качестве верхнего слоя в реакторе Клауса, то наиболее желательным будет катализатор в форме гранул, поскольку катализатор Клауса обычно имеет форму гранул.
В случае, если материал, каталитически активный в восстановлении SO3 (и H2SO4) посредством реакцией с H2S, должен быть расположен в отдельном резервуаре, может быть установлен либо катализатор в форме гранул, либо монолитный катализатор, в зависимости от имеющегося перепада давления со стороны технологического газа, ограничений пространства для реактора и того, какое решение является наиболее экономичным.
Материал, каталитически активный в восстановлении SO3 (и H2SO4) посредством реакции с H2S, содержит одно или несколько соединений V, Mn, Fe, Со, Cu, Zn, Ni, Mo, W, Sb, Ti и Bi нанесенных на одно или несколько соединений Al, Ti, Si, Zr, Mg, и кордиерит, часто с носителем, содержащим диатомовую землю. Хотя Al2O3 и ТЮ2 сами по себе склонны к сульфатному отравлению, эти соединения могут быть использованы в качестве носителя для соединений, активных при превращении SO3 в SO2 и S, которые безвредны для расположенных ниже по потоку катализаторов Клауса. Кроме того, считается вероятным, что Al2O3 и TiO2 могут выступать в качестве предохраняющих материалов в результате поглощения SO3 посредством сульфатирования, и, таким образом, такие материалы без активных металлов могут функционировать в качестве предохраняющий материалов, но требуют периодической замены или повторной активации.
Материал, каталитически активный в восстановлении SO3 (и H2SO4) посредством реакции с H2S, эксплуатируют при температуре между 130 и 1500°С, например, между 250 и 500°С или между 300 и 400°С.
Фигуры:
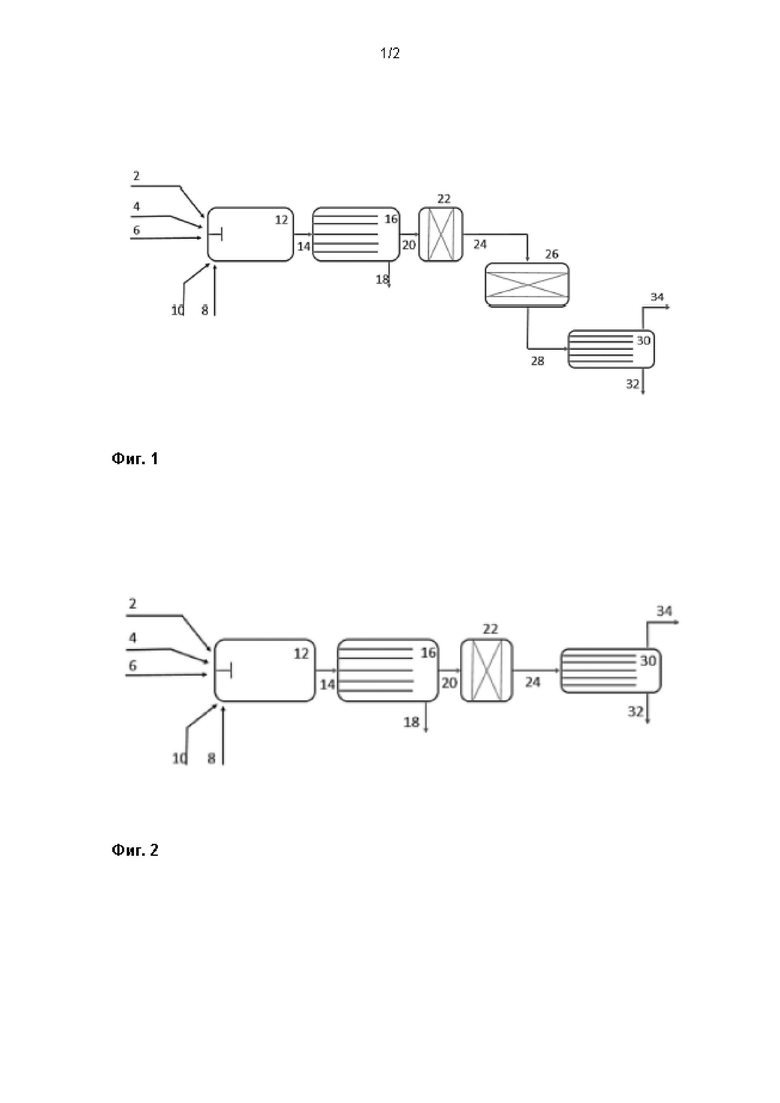
На фиг. 1 показана реакционная печь Клауса с 1-м реактором Клауса, расположенным выше по потоку от 1-ого конденсатора серы.
На фиг. 2 показана реакционная печь Клауса с 1-м конденсатором серы, расположенным выше по потоку от 1-ого реактора Клауса.
На фигуре 1 сырьевые потоки в реакционную печь Клауса (термическая стадия Клауса) представляют собой один или несколько кислых газов, содержащих H2S (2), при необходимости топливный газ (4), источник кислорода (6), обычно представляющий собой воздух с 21% объемн. O2 или обогащенный воздух с 21-100% объемн. O2 и поток серной кислоты (8). Поток серной кислоты при необходимости может быть концентрированной серной кислотой, получаемой на сернокислотной установке, установленной в качестве установки обработки хвостовых газов для установки процесса Клауса. Метод распыления серной кислоты, в котором образуются мельчайшие капли, представляет собой двухфазное распыление, в котором распыляющая среда (10) используется для "разрезания" сернокислотной жидкости на капли. Распылительной средой чаще всего является сжатый воздух или пар, но возможны и другие среды, такие как топливный газ, обогащенный воздух или технологический газ.
В камере реакционной печи Клауса (12) часть H2S окисляется до SO2, который затем соединяется с H2S с образованием элементарной серы. Серная кислота испаряется и вступает в реакцию с H2S с образованием SO2 и элементарной серы. Температура в реакционной печи обычно превышает 900°С, а среднее время пребывания обычно составляет 1-2 секунды. Отходящий газ из реакционной камеры (14) проводят через теплообменник (16), где технологический газ охлаждают до 300-400°С. Теплообменник обычно представляет собой котел-утилизатор, производящий пар высокого давления. Если элементарная сера конденсируется в теплообменнике, ее сливают через выход для жидкости (18).
Охлажденный отходящий газ реакционной печи Клауса (20) затем пропускают через один или несколько слоев катализатора (22), в которых любой SO3 в отходящем газе реакционной печи Клауса эффективно преобразуется в SO2 и S посредством реакции с H2S, образуя по существу свободный от SO3 исходный газ (24), который направляют в слой катализатора Клауса в реакторе Клауса (26). Можно объединить (22) и (26) таким образом, чтобы катализатор разложения SO3 в (22) мог быть верхним слоем в реакторе Клауса (26).
В реакторе Клауса (26) образуется больше элементарной серы в результате реакции между H2S и SO2, а отходящий газ реактора Клауса (28) подают в первый конденсатор серы (30), в котором технологический газ охлаждают, и часть элементарной серы конденсируют и выводят в виде жидкости через выход 32. Отходящий газ (34) обычно повторно нагревают и пропускают через один или несколько циклов обработки реактор Клауса - конденсатор серы - подогреватель, чтобы обеспечить достаточно высокую конверсию H2S в элементарную серу.
На фиг. 2 реакционная печь Клауса (12) и котел-утилизатор (16) аналогичны схеме и работе, описанным для фигуры 1. Разница в схеме заключается в том, что охлажденный отходящий газ реакционной печи Клауса (20) подают непосредственно в первый конденсатор серы (30) для конденсации и вывода продукта элементарной серы по линии 32 перед тем, как отходящий газ конденсатора (34) повторно нагревают и направляют в 1-й реактор Клауса. При такой схеме из-за отвода продукта в 1-м реакторе Клауса преобладает равновесие реакции Клауса и, таким образом, может быть достигнута более высокая общая конверсия на выходе из 1-го реактора Клауса. Для такой схемы необходимо установить материал, каталитически активный в восстановлении SO3 (и H2SO4) посредством реакции с H2S, в отдельном резервуаре (22), таким образом, чтобы по существу свободный от SO3 технологический газ (24) поступал в первый конденсатор серы (30), тем самым избегая возможного загрязнения серного продукта серной кислотой и избегая прохождения неконденсированной серной кислоты в расположенный ниже по потоку первый реактор Клауса.
Пример 1:
В лабораторных масштабах некаталитическая реакция между H2S и SO3 была исследована в реакционной камере, состоящей из стеклянной трубки диаметром 13 мм и длиной 40 см, установленной в терморегулируемой печи.
H2S подавали из газового баллона и разбавляли N2 перед добавлением в реакционную камеру. 2-й поток N2 насыщали водой, чтобы в технологическом газе присутствовала H2O. 3-й небольшой поток N2 пропускали через раствор олеума для насыщения потока SO3.
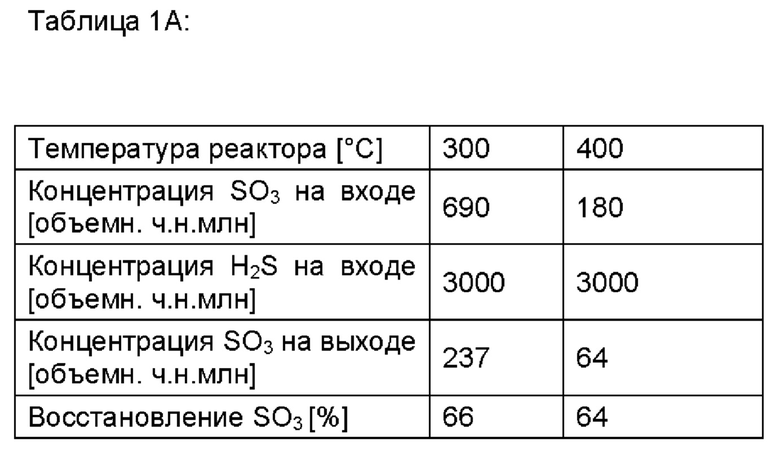
В таблице 1А показаны исходные эксперименты при произвольном времени пребывания около 1 секунды, когда добавляли данные три потока и позволяли им реагировать при контролируемых температурах в интервале 300-400°С.
Выходящий из реакционной камеры материал анализировали на содержание элементарной серы, серной кислоты (=SO3, прореагировавший с H2O в газовой фазе) и SO2. Результаты, приведенные в таблице 1А, показывают, что имеет место некая газофазная реакция между SO3 и H2S, но также и то, что реакция является относительно медленной и недостаточно быстрой для обеспечения полного разложения SO3 в промышленной установке процесса Клауса.
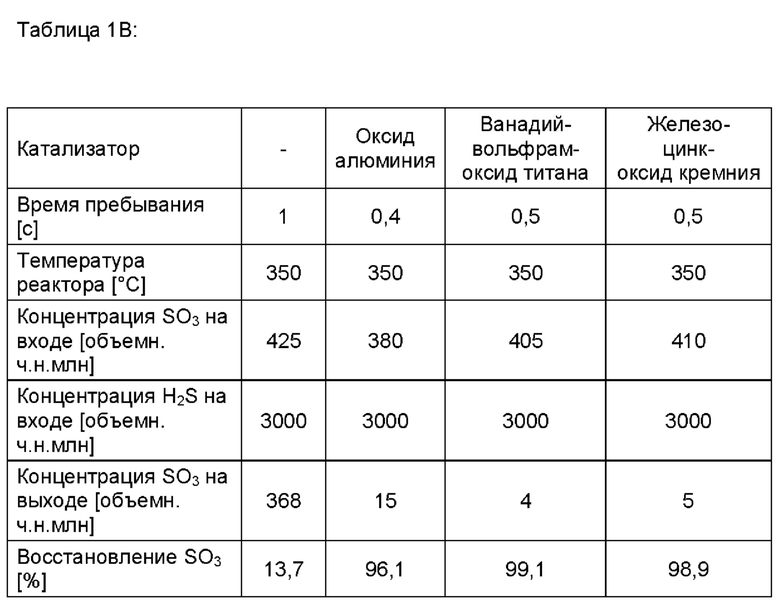
В таблице 1В показаны дополнительные эксперименты при контролируемом времени пребывания, когда добавляли данные три потока и позволяли им реагировать при контролируемых температурах в 350°С с временем пребывания в реакционной камере от 0,4 секунды до 1 секунды.
Результаты, приведенные в таблице 1В, также показывают, что имеет место некая газофазная реакция между SO3 и H2S, но также и то, что газофазная реакция является относительно медленной и недостаточно быстрой для обеспечения полного разложения SO3 в промышленной установке процесса Клауса. В отличие от этого быстрое и почти полное разложение SO3 возможно при применении катализатора.
Осмотр материалов показал, что удаление SO3 над оксидом алюминия может быть связано с сульфатированием оксида алюминия, а не с каталитическим превращением. Однако такое сульфатирование все еще может иметь коммерческое значение, если некоторое количество оксида алюминия используют в качестве предохраняющего материала, поскольку последующий катализатор Клауса защищен от дезактивации SO3.
Пример 2
В реакционной печи Клауса протекает множество химических реакций и все они были рассчитаны с использованием очень подробной кинетической модели, включающей более 50 химических компонентов и более 1000 химических элементарных реакций, каждая из которых описывается константой скорости, зависящей от температуры.
Эта модель была использована для расчета, как кинетики реакционной печи Клауса, так и химического равновесия смеси реакционной печи Клауса, то есть модель была использована для прогнозирования того, будет ли сернокислотное сырье полностью реагировать с H2S в реакционной печи.
Подаваемый в качестве сырья в реакционную печь Клауса кислый газ, состоящий из 91,4% объемн. H2S, 2,1% объемн. СO2, 3,3% объемн. H2O, 1,4% объемн. СН4 и 1,9% объемн. Н2, представляет собой концентрированный кислый газ, полученный, например, в процессе нефтепереработки.
Серная кислота была 93%-ной по массе H2SO4, что представляет собой концентрацию продукта серной кислоты из сернокислотной установки мокрого типа, установленной в качестве установки обработки хвостовых газов, расположенной ниже по потоку от установки процесса Клауса. Поток серной кислоты составлял 9,8% от общего количества серы, поступающей в реакционную печь Клауса.
Температура реакции составляла 1050°С, а абсолютное давление - 1,65 бар.
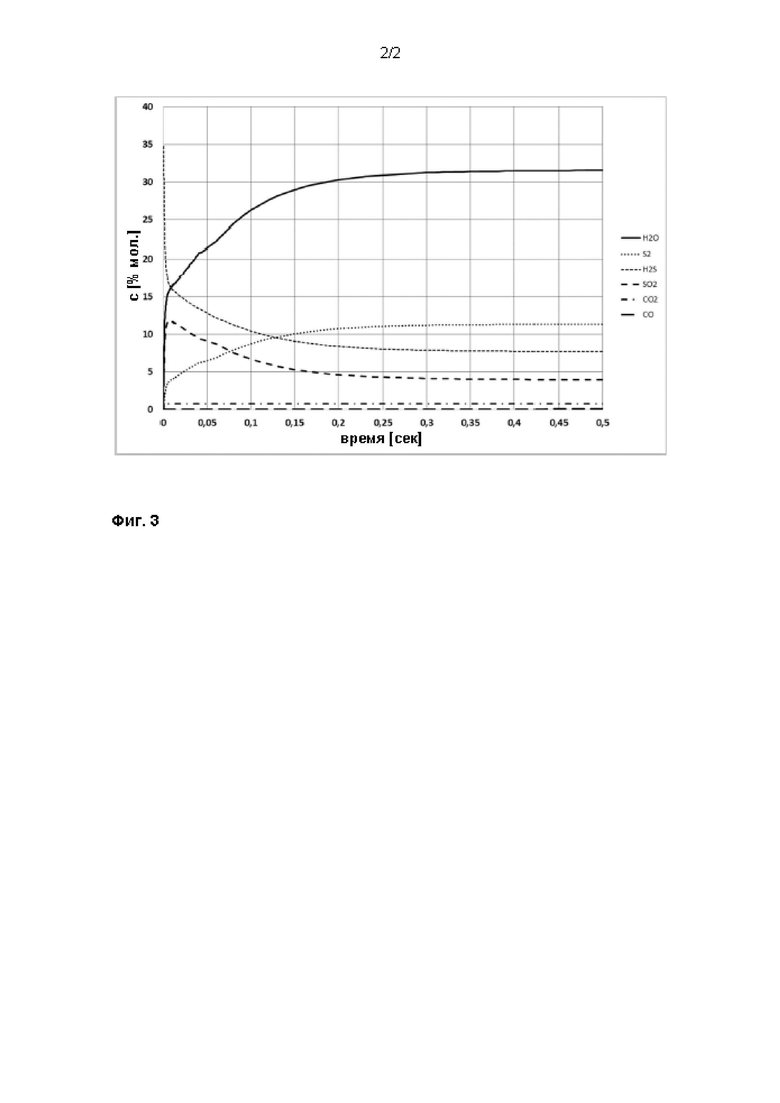
На фиг. 3 показано, что химические реакции в реакционной печи Клауса протекают очень быстро и менее чем за 0,5 секунды достигается химическое равновесие, то есть состав технологического газа не изменяется.
Однако кинетическая модель включает только компоненты газовой фазы, и время, необходимое для испарения капель серной кислоты, не было включено. Если испарение капель достигается менее чем за 0,5 секунды, то технологический газ из реакционной печи Клауса (с 1-секундным временем пребывания) будет по существу свободен от SO3, и работа технологической установки Клауса будет беспроблемной. Однако если испарение некоторых капель занимает более 1-2 секунд, то отходящий газ реакционной печи не может считаться свободным от SO3 и беспроблемная работа технологической установки Клауса не может быть гарантирована.
В такой ситуации разработанный новый материал, каталитически активный в восстановлении SO3 (и H2SO4) посредством реакции с H2S, необходим для длительной работы установки для процесса Клауса.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДЕРНИЗАЦИЯ УСТАНОВКИ КЛАУСА СЕРНОКИСЛОТНОЙ УСТАНОВКОЙ | 2020 |
|
RU2827769C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭЛЕМЕНТАРНОЙ СЕРЫ И СЕРНОЙ КИСЛОТЫ | 2020 |
|
RU2824360C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЕРЫ И СЕРНОЙ КИСЛОТЫ | 2020 |
|
RU2822142C2 |
| СПОСОБ УТИЛИЗАЦИИ КИСЛЫХ ГАЗОВ, СОДЕРЖАЩИХ СЕРОВОДОРОД И АММИАК | 2013 |
|
RU2556935C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2457173C2 |
| СПОСОБ И КАТАЛИЗАТОР ДЛЯ ОКИСЛЕНИЯ В СЕРУ КАТАЛИТИЧЕСКИМ МЕТОДОМ HS, СОДЕРЖАЩЕГОСЯ В НЕБОЛЬШОЙ КОНЦЕНТРАЦИИ В ГАЗЕ | 1995 |
|
RU2142405C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЕРЫ ИЗ СЕРОВОДОРОДСОДЕРЖАЩЕГО ГАЗА | 1992 |
|
RU2040464C1 |
| СПОСОБ ОБРАБОТКИ СЕРОСОДЕРЖАЩИХ ОТХОДОВ ПЕРЕРАБАТЫВАЮЩИХ И ОБОГАТИТЕЛЬНЫХ ПРОИЗВОДСТВ | 2019 |
|
RU2827330C2 |
| Процесс окисления сероводорода | 2016 |
|
RU2632014C1 |
| ОБРАБОТКА ГАЗОВ | 2014 |
|
RU2669606C2 |
Изобретение относится к способу превращения H2S в элементарную серу в установке процесса Клауса. Исходное сырье, содержащее сырьевой газ, содержащий 30-100 об.% H2S, серную кислоту, молекулярный кислород в субстехиометрическом количестве и при необходимости топливо направляют в реакционную печь Клауса с получением отходящего газа реакционной печи Клауса. Охлаждают отходящий газ и при необходимости выводят элементарную серу из газа. Направляют полученный отходящий газ для контакта с предохраняющим от SO3 материалом, поглощающим и/или преобразующим SO3. Направляют полученный свободный от SO3 газ для контакта с материалом, каталитически активным в реакции Клауса. Выделяют элементарную серу, при необходимости посредством охлаждения вытекающего потока из материала, каталитически активного в реакции Клауса. Причем указанный предохраняющий от SO3 материал отличается от указанного материала, каталитически активного в реакции Клауса. Обеспечивается безопасная и длительная работа установки для процесса Клауса. 12 з.п. ф-лы, 3 ил., 2 табл., 2 пр.
1. Способ получения серы из сырьевого газа, содержащего от 30 об.%, от 40 об.% или от 50 до 99 об.% или до 100 об.% H2S, и потока серной кислоты, включающий стадии
a. предоставления потока исходного сырья для реакционной печи Клауса, содержащего указанный сырьевой газ, серную кислоту, молекулярный кислород и при необходимости топливо, причем молекулярный кислород присутствует в субстехиометрическом количестве,
b. направления указанного потока исходного сырья реакционной печи Клауса в реакционную печь Клауса с получением отходящего газа реакционной печи Клауса,
c. охлаждения указанного отходящего газа реакционной печи Клауса с получением охлажденного отходящего газа реакционной печи Клауса и при необходимости выведения элементарной серы из газа,
d. направления указанного охлажденного отходящего газа реакционной печи Клауса для контакта с предохраняющим от SO3 материалом, поглощающим и/или преобразующим SO3, с получением по существу свободного от SO3 исходного газа конвертера Клауса,
e. направления указанного свободного от SO3 исходного газа конвертера Клауса для контакта с материалом, каталитически активным в реакции Клауса,
f. выведения элементарной серы, при необходимости посредством охлаждения вытекающего потока из указанного материала, каталитически активного в реакции Клауса,
отличающийся тем, что указанный предохраняющий от SO3 материал отличается от указанного материала, каталитически активного в реакции Клауса.
2. Способ по п. 1, причем предохраняющий от SO3 материал представляет собой абсорбент SO3, в котором содержание SO3 возрастает с течением времени, такой как оксид алюминия или оксид титана.
3. Способ по п. 1, причем предохраняющий от SO3 материал представляет собой материал, каталитически активный в восстановлении SO3 посредством реакции с H2S, обеспечивающий по существу свободный от SO3 исходный газ конвертера Клауса.
4. Способ по п. 1, причем предохраняющий от SO3 материал расположен ниже по потоку от реакционной печи Клауса и выше по потоку от конвертера Клауса.
5. Способ по п. 1, причем предохраняющий от SO3 материал расположен в качестве верхнего слоя на материале, каталитически активном в реакции Клауса.
6. Способ по п. 3, причем материал, каталитически активный в восстановлении SO3, содержит один или несколько элементов, взятых из группы, состоящей из V, Mn, Fe, Со, Cu, Zn, Ni, Mo, W, Sb, Ti и Bi, и носитель, содержащий один или несколько элементов, взятых из группы, состоящей из Al, Ti, Si, Zr, и Mg.
7. Способ по п. 6, причем носитель содержит диатомовую землю и/или кордиерит.
8. Способ по п. 1, причем материал, активный в восстановлении SО3, имеет форму гранул или монолита.
9. Способ по п. 1, причем реакционная печь Клауса работает при температуре между 900 и 1500°С.
10. Способ по п. 1, причем материал, каталитически активный в восстановлении SO3, работает при температуре между 130 и 1500°С.
11. Способ по п. 1, причем материал, каталитически активный в восстановлении SO3, работает при температуре между 250 и 500°С.
12. Способ по п. 1, причем материал, каталитически активный в восстановлении SO3, работает при температуре между 300 и 400°С.
13. Способ по одному из пп. 1-10, причем поток серной кислоты получают в сернокислотной установке мокрого типа обработкой хвостового газа из установки Клауса.
| WO 2017220655 A1, 28.12.2017 | |||
| СПОСОБ КАТАЛИТИЧЕСКОГО ОБЕССЕРИВАНИЯ ГАЗА, СОДЕРЖАЩЕГО СОЕДИНЕНИЯ HS И SO, И КАТАЛИЗАТОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2142402C1 |
| WO 2015022524 A1, 19.02.2015 | |||
| US 9023309 B1, 05.05.2015 | |||
| СПОСОБ ПОЛУЧЕНИЯ СЕРЫ ИЗ ПО КРАЙНЕЙ МЕРЕ ОДНОГО КИСЛОГО ГАЗА, СОДЕРЖАЩЕГО СЕРОВОДОРОД, И ТЕРМИЧЕСКИЙ РЕАКТОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1992 |
|
RU2085480C1 |
Авторы
Даты
2023-11-08—Публикация
2019-10-25—Подача