ОБЛАСТЬ ТЕХНИКИ И ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к новой неводной гелевой композиции, особенно полезной в качестве носителя для фармацевтически активных агентов. Настоящее изобретение также относится к высвобождающему устройству, содержащему эту неводную гелевую композицию, и к применению этой неводной гелевой композиции в качестве компонента фармацевтической композиции или лекарственного средства.
Благодаря своим вязкостным свойствам гелевые композиции часто используются в качестве носителей для местного и перорального введения фармацевтически активных агентов. Важными для введения гелевых композиций являются, например, специфические вязкостные свойства, которые, с одной стороны, обеспечивают достаточную возможность введения через шприц, т.е. способность высвобождаться из шприца и/или втягиваться в него, и, с другой стороны, хорошую адгезию композиции к тканям органов при температуре, примерно равной температуре тела, в частности, в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, после однократного введения в ткань органа.
Поэтому часто используют термообратимые водные гелевые композиции, вязкость которых изменяется при характерной температуре, содержащие главным образом сополимеры в количестве, достаточном для обеспечения гелеобразования при температуре, примерно равной температуре тела.
Однако, несмотря на хорошие вязкостные свойства, водные гелевые композиции имеют недостаток, заключающийся в неспособности переносить фармацевтически активные агенты, имеющие свойство относительно слабо растворяться в воде, если эти фармацевтически активные агенты не подлежат введению в виде суспензии в геле.
Неводные гелевые композиции являются хорошей альтернативой в качестве носителей для указанных фармацевтически активных агентов, характеризующихся свойством относительно слабо растворяться в воде. Кроме того, ввиду своей липофильной природы неводные гелевые композиции могут создавать возможность по меньшей мере частичного прохождения фармацевтически активного агента через клеточные мембраны.
Однако, когда дело касается вязкостных свойств, которые будут обеспечивать хорошую возможность для введения через шприц и хорошую адгезию к тканям органов, оказывается, что традиционные неводные гелевые композиции не обладают такими свойствами термообратимости.
В частности, в случае введения гелевых композиций во внутренние органы существует потребность во введении фармацевтической композиции с применением шприца. Кроме того, внутренние органы, такие как глаза, уши, нос, рот, губа, влагалище, отверстие уретры и анус, почти всегда покрыты слизью или слизистыми оболочками, что затрудняет адгезию (мукоадгезию).
Таким образом, традиционные неводные гелевые композиции не могут обеспечить как надлежащую вязкость, которая давала бы хорошую возможность для введения через шприц, так и хорошую адгезию к тканям органов.
Термообратимые водные гелевые компо1зиции известны из ЕР 3501521 А1 и WO 2019210107. Соответствующие композиции содержат фармацевтически активные агенты, такие как цисплатин, карбоплатин, оксиплатин, или кортикостероиды, в частности дексаметазон, или ингибиторы JNK (c-Jun-N-концевой киназы), для лечения или предупреждения ототоксичности, вызываемой лекарственными средствами.
В US 20180000950 А1 описывается неводная гелевая композиция, содержащая терапевтический агент, триглицериды и по меньшей мере один модулирующий вязкость агент. Триглицериды присутствуют в количестве, достаточном для стабилизации терапевтического агента, предназначенного для инъекций в ухо. Предпочтительно, чтобы по меньшей мере один модулирующий вязкость агент представлял собой диоксид кремния.
Существует несколько патентных документов, описывающих неводные термообратимые гели для применения в лечении разных заболеваний, например WO 2014076569 А2 и ЕР 0530965 А1.
В ЕР 0530965 А1 описывается композиция для назального применения, содержащая по меньшей мере одно лекарственное средство на основе полового гормона, по меньшей мере один липофильный носитель и одно поверхностно-активное вещество. Кроме того, композиция содержит регулирующий вязкость агент, представляющий собой коллоидный диоксид кремния.
В US 2013150410 А1 описывается способ лечения слуховых расстройств, выбранных из группы, состоящей из болезни Меньера, эндолимфатической водянки, прогрессирующей потери слуха, головокружения, вертиго и шума в ушах, включающий транстимпанальное введение стерильной фармацевтической композиции в ухо. Композиция содержит состоящий из множества частиц агент, модулирующий действие ионных каналов, благодаря чему непрерывное высвобождение агента, модулирующего действие ионных каналов агента, в ухе происходит в течение по меньшей мере 5 суток.
В US 2019038469 А1 заявлена система доставки терапевтической композиции во внутреннее ухо. Также описывается система, содержащая необходимый для доставки интродьюсер, имеющий внутренний просвет, и канюлю, конфигурация которой способствует введению через этот внутренний просвет в указанном интродьюсере. Канюля имеет канал для доставки терапевтической композиции и дистальный наконечник для прокалывания барабанной перепонки с целью доставки терапевтической композиции к вторичной барабанной перепонке с возможностью адгезии композиции к вторичной барабанной перепонке. Кроме того, композиция содержит терапевтический агент для лечения заболевания внутреннего уха и тиксотропное вещество, позволяющее терапевтической композиции существовать в жидкой форме при введении через канюлю.
Целью настоящего изобретения является разработка новой гелевой композиции, превосходящей по своим свойствам традиционные гелевые композиции.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Упомянутая выше цель и другие цели достигаются путем разработки неводной гелевой композиции по п. 1, высвобождающего устройства по п. 9 и неводной гелевой композиции для применения в фармацевтической композиции или лекарственном средстве по п. 10. Предпочтительные воплощения определены в зависимых пунктах формулы изобретения. Предпочтительно, но не обязательно, чтобы указанная неводная гелевая композиция особенно подходила для транстимпанального введения и содержала фармацевтически активный агент с относительно слабой растворимостью в воде, как определено в зависимых пунктах формулы изобретения.
Согласно настоящему изобретению предложена неводная гелевая композиция, содержащая:
- касторовое масло, присутствующее в количестве от 85 до 95 масс. %, из расчета на общую массу композиции,
- олеоилмакроголглицерид, предпочтительно Labrafil®, присутствующий в количестве от 2 до 6 масс. %, из расчета на общую массу композиции,
- по меньшей мере один загуститель, предпочтительно диоксид кремния, более предпочтительно коллоидный диоксид кремния, присутствующий в количестве от 1 до 6 масс. %, из расчета на общую массу композиции, и при этом
- вязкость композиции при температуре 25°С составляет от 1400 до 2400 мПа⋅с, предпочтительно составляет от 1400 до 1800 мПа⋅с.
В этой композиции касторовое масло выполняет функцию липофильного носителя, а олеоилмакроголглицерид, предпочтительно Labrafil®, выполняет функцию поверхностно-активного вещества.
В предпочтительном воплощении изобретения неводная гелевая композиция по настоящему изобретению является стерильной.
В другом предпочтительном воплощении изобретения неводная гелевая композиция по настоящему изобретению представляет собой олеогель.
Термины, использованные в формуле изобретения и повсюду в описании, определяют так, как приведено ниже.
Термин "неводная композиция", использованный в данном описании, означает композицию, которая не содержит воды или по существу не содержит воды.
Термин "олеогель", использованный в данном описании, означает полутвердую неводную гелевую композицию, обладающую вязкоупругими свойствами, обусловленными присутствием липидов, в частности жиров.
Термин "липофильный носитель", использованный в данном описании, означает субстрат, предпочтительно липофильный субстрат, применяемый в способе доставки фармацевтически активного соединения, который служит для улучшения процесса введения фармацевтически активных агентов с различной липофильностью.
Термин "поверхностно-активное вещество", использованный в данном описании, означает соединение, которое уменьшает поверхностное натяжение между двумя жидкостями или между жидкостью и твердым веществом в композиции, обеспечивая или поддерживая образование дисперсии и улучшая смачиваемость композиции. Поверхностно-активное вещество также может действовать как детергент, эмульгатор и пенообразующий агент.
Термин "загуститель", использованный в данном описании, означает вещество, которое может увеличивать вязкость жидкой композиции, по существу не изменяя других ее свойств. Предпочтительно, чтобы загуститель действовал как геллант, образующий когезивную внутреннюю структуру, в особенности гель, и поэтому он также известен как гелеобразующий агент.
Термин "область или структура уха", использованный в данном описании, означает область уха, в частности, область среднего уха, или структуру уха, в частности, структуру вторичной барабанной перепонки уха, при этом указанная структура уха является частью указанной области уха.
Термин "транстимпанальное введение", использованный в данном описании, означает инъекцию через барабанную перепонку в среднее ухо для введения в среднее ухо, в частности, на вторичную барабанную перепонку, при этом указанное введение на вторичную барабанную перепонку должно способствовать диффузии через вторичную барабанную перепонку.
Термин "гель с замедленным высвобождением", использованный в данном описании, означает гелевую композицию, содержащую по меньшей мере одно фармацевтически активное соединение, которая обеспечивает в равной степени непрерывное и контролируемое высвобождение, в частности, высвобождение по меньшей мере одного фармацевтически активного соединения в организме, в частности, в организме человека и его тканях.
Термин "состоящий из множества частиц", использованный в данном описании, означает множество частиц по меньшей мере одного фармацевтически активного агента, при этом частицы имеют одинаковый размер или разные размеры.
Термин "микронизированный", использованный в данном описании, означает вещество, в частности, фармацевтически активный агент, размер частиц которого уменьшен до размера частиц, измеряемых в мкм.
Термин "стерильный", использованный в данном описании, означает "не содержащий живых микробов или микроорганизмов", в частности асептический.
Термин "мукоадгезия", использованный в данном описании, означает адгезию к тканям органов, которые почти всегда покрыты слизью или слизистыми оболочками, таких как глаза, уши, нос, рот, губа, влагалище, отверстие уретры и анус.
Термин "термообратимый гель", использованный в данном описании, означает гелевую композицию, вязкость которой изменяется при характерной температуре. Это связанное с температурой поведение включает в себя то, что на данное свойство геля не влияет повторение циклов нагревания и охлаждения, и что вязкость геля может обратимо изменяться до ее исходного значения.
В предпочтительном воплощении изобретения вязкость неводной гелевой композиции по настоящему изобретению при температуре 25°С составляет от 1400 до 2300 мПа⋅с, более предпочтительно от 1600 до 2000 мПа⋅с. В пределах последнего упомянутого диапазона значения вязкости от 1700 до 1800 мПа⋅с являются еще более предпочтительными.
Согласно изобретению вязкость неводной гелевой композиции по настоящему изобретению при температуре 37°С предпочтительно составляет от 500 до 1200 мПа⋅с, более предпочтительно от 700 до 1000 мПа⋅с.
В отличие от традиционных гелевых композиций преимущество неводной гелевой композиции по настоящему изобретению заключается в том, что вязкость термообратимой гелевой композиции изменяется при характерной температуре.
Упомянутые выше обусловленные термообратимостью вязкостные свойства обеспечивают разработку неводной гелевой композиции с вязкостью, делающей ее особенно полезной в качестве фармацевтической композиции или лекарственного средства для местного введения. Предусматривается вязкость, достаточно пригодная для введения через шприц при (фармацевтически приемлемой) комнатной температуре от 15°С до 25°С, т.е. способность высвобождаться из шприца и/или втягиваться в него, и вязкость, обеспечивающая хорошую адгезию композиции для местного введения к тканям органов при температуре, примерно равной температуре тела, обычно от 35°С до 38°С, в частности, в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, например, после однократного введения в ткань органа.
Это дает особое преимущество в случае введения гелевых композиций во внутренние органы, когда существует и необходимость во введении композиции с помощью шприца, и потребность в хорошей адгезии, особенно в хорошей мукоадгезии.
Неводная гелевая композиция по настоящему изобретению предпочтительно имеет вязкость и гелевую структуру, пригодные для введения через иглу подходящего диаметра калибра 18-27 (по Бирмингемской системе калибров), более предпочтителен калибр 20-23, в частности, калибр 20. Неводная гелевая композиция по настоящему изобретению также подойдет в случае внесения в небольших объемах от 20 мкл до 200 мкл, например, во внутреннее ухо и/или среднее ухо.
Согласно изобретению вязкость, как правило, измеряют с использованием вискозиметра, в частности реометра. Реометр обычно представляет собой лабораторный прибор, с помощью которого измеряют характеристики потока жидкости, суспензии или взвеси в ответ на приложенную силу. Распространенным типом прибора является так называемый сдвиговый реометр, в котором к соответствующему материалу прикладывается напряжение сдвига. Приборы, которые можно использовать для измерения вязкости неводных гелевых композиций по изобретению, представляют собой реометры от Brookfield (АМЕТЕК Brookfield).
В другом воплощении изобретения неводная гелевая композиция по настоящему изобретению предпочтительно не содержит полимеров, в том числе сополимеров.
В другом воплощении изобретения в касторовом масле неводной гелевой композиции по настоящему изобретению может содержаться по меньшей мере один дополнительный липофильный носитель, предпочтительно по меньшей мере один глицерид, выбранный из группы, содержащей моноглицерид, диглицерид, триглицерид и их смеси, при этом предпочтительно, чтобы глицерид представлял собой триглицерид.
Согласно изобретению по меньшей мере один глицерид предпочтительно содержит по меньшей мере одну ненасыщенную или насыщенную, предпочтительно ненасыщенную, жирную кислоту с длиной цепи у этой жирной кислоты, составляющей от 16 до 20 атомов С, предпочтительно 18 атомов С.
В предпочтительном воплощении изобретения по меньшей мере одна жирная кислота предпочтительно выбрана из группы, содержащей рицинолевую кислоту, олеиновую кислоту, стеариновую кислоту, линолевую кислоту, пальмитиновую кислоту.
В другом предпочтительном воплощении изобретения по меньшей мере один дополнительный липофильный носитель предпочтительно включает триглицерид, содержащий три ненасыщенные жирные кислоты с длиной цепи жирной кислоты, содержащей 18 атомов С, при этом жирная кислота представляет собой рицинолевую кислоту.
Согласно изобретению по меньшей мере один дополнительный липофильный носитель, содержащий по меньшей мере один глицерид, предпочтительно выбран из группы, содержащей миндальное масло, льняное масло, рапсовое масло, кукурузное масло, хлопковое масло, пальмовое масло, арахисовое масло, маковое масло, соевое масло и их смеси.
В предпочтительном воплощении изобретения по меньшей мере один дополнительный липофильный носитель, содержащий по меньшей мере один глицерид, из группы, содержащей природное масло, синтетическое масло, полусинтетическое масло и их смеси.
В другом воплощении изобретения олеоилмакроголглицерид, предпочтительно Labrafil®, в неводной гелевой композиции по настоящему изобретению может включать по меньшей мере одно дополнительное поверхностно-активное вещество, предпочтительно выбранное из группы, содержащей олеоилмакроголглицериды, ацилглицерины, лецитины, полиоксиэтилен, полиоксиэтиленсорбитаны, полиглицерин, полиэтилен гликоль и их смеси.
Описанные выше поверхностно-активные вещества, в частности олеоилмакроголглицерид, особенно полезны для улучшения смачиваемости композиции с целью обеспечения равномерного распределения гидрофобных частиц, предпочтительно гидрофобных частиц фармацевтически активного агента, в неводной гелевой композиции по настоящему изобретению.
Согласно изобретению олеоилмакроголглицерид предпочтительно представляет собой Labrafil®, более предпочтительно Labrafil® М1944 CS. Labrafil® М1944 CS представляет собой олеоилполиокси-6-глицерид.
Labrafil® является зарегистрированной торговой маркой Gattefosse. Серия Labrafil® включает в себя Labrafil® М 1944 CS, Labrafil® М 2125 CS (линолеоилполиоксил-6-глицерид) и Labrafil® М 2130 CS (лауроилполиоксил-6-глицерид).
Согласно изобретению по меньшей мере один загуститель предпочтительно представляет собой диоксид кремния, более предпочтительно коллоидный диоксид кремния. В другом воплощении изобретения по меньшей мере один загуститель предпочтительно выбран из группы, содержащей стеарат, коллоидный диоксид кремния, мезопористый диоксид кремния и их смеси.
Было обнаружено, что вышеупомянутые загустители, в частности коллоидный диоксид кремния, особенно полезны для улучшения адгезивных свойств неводной гелевой композиции по настоящему изобретению к тканям органов при температуре, примерно равной температуре тела (обычно 35-38°С), в частности, в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, в частности, после однократного введения в ткань органа.
В предпочтительном воплощении изобретения по меньшей мере один загуститель предпочтительно представляет собой коллоидный диоксид кремния.
В другом предпочтительном воплощении изобретения по меньшей мере один загуститель предпочтительно не растворяется, а диспергируется в неводной гелевой композиции по настоящему изобретению. Таким образом, образуется тиксотропная гелевая структура, в результате чего получается неводная гелевая композиция, которая проявляет повышенную вязкость в течение периода приложения к композиции определенного напряжения сдвига.
Согласно изобретению касторовое масло присутствует в неводной гелевой композиции по настоящему изобретению в количестве от 85 до 95 масс. %, предпочтительно в количестве от 91 до 94 масс. %, более предпочтительно в количестве 94 масс. %, из расчета на общую массу композиции.
В предпочтительном воплощении по меньшей мере один дополнительный липофильный носитель присутствует в касторовом масле в количестве менее 5%.
Согласно изобретению олеоилмакроглицерид, предпочтительно Labrafil®, присутствует в неводной гелевой композиции по настоящему изобретению в количестве от 2 до 6 масс. %, предпочтительно в количестве 3,5 масс. %, из расчета на общую массу композиции.
В предпочтительном воплощении по меньшей мере одно дополнительное поверхностно-активное вещество присутствует в виде олеоилмакроглицерида, предпочтительно в виде Labrafil®, в количестве менее 5%.
Обнаружено, что данное количество поверхностно-активного вещества, особенно олеоилмакроглицерида, предпочтительно Labrafil®, в неводной гелевой композиции важно для обеспечения хорошей смачиваемости, с одной стороны, без негативного влияния на адгезионные свойства неводной гелевой композиции, с другой стороны. Обнаружено, что количество по меньшей мере одного поверхностно-активного вещества, в частности олеоилмакроглицерида, предпочтительно Labrafil®, описанного выше, особенно полезно для обеспечения хорошей смачиваемости и хороших адгезионных свойств неводной гелевой композиции.
Согласно изобретению по меньшей мере один дополнительный загуститель, предпочтительно диоксид кремния, более предпочтительно коллоидный диоксид кремния, присутствует в неводной гелевой композиции по настоящему изобретению в количестве от 1 до 6 масс. %, предпочтительно в количестве 2 масс. %, из расчета на общую массу композиции.
Количество по меньшей мере одного загустителя, в частности коллоидного диоксида кремния, содержащегося в неводной гелевой композиции по настоящему изобретению, описанной выше, особенно полезно для обеспечения достаточной возможности введения композиции через шприц при комнатной температуре (см. выше).
Было обнаружено, что неводная гелевая композиция по настоящему изобретению особенно полезна для обеспечения длительного высвобождения in vivo терапевтически эффективного количества фармацевтически активных агентов после введения, предпочтительно во внутренние органы, в частности, после транстимпанального введения, в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, после однократного введения в ткань органа.
Согласно изобретению неводная гелевая композиция по настоящему изобретению дополнительно содержит предпочтительно по меньшей мере один фармацевтически активный агент.
В одном из воплощений изобретения неводная гелевая композиция по настоящему изобретению предпочтительно представляет собой гель с замедленным высвобождением, содержащий по меньшей мере одно фармацевтически активное соединение, который обеспечивает в равной степени длительное и регулируемое высвобождение, в частности, высвобождение по меньшей мере одного фармацевтически активного соединения в организме, в частности, в организме человека, в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, более предпочтительно в течение по меньшей мере 1 месяца после однократного введения, в частности, в ткань органа.
Согласно изобретению по меньшей мере один фармацевтически активный агент предпочтительно присутствует в количестве от 0,05 до 10 масс. %, предпочтительно от 0,1 до 10 масс. %, более предпочтительно от 0,5 до 5 масс. %, более предпочтительно в количестве 0,6% или 3 масс. %, альтернативно от 3 до 10 масс. %, предпочтительно от 6 до 10 масс. %, из расчета на общую массу композиции, включая активный агент.
Было обнаружено, что данное количество по меньшей мере одного фармацевтически активного агента особенно полезно для получения геля с замедленным высвобождением, высвобождающего фармацевтически активный агент из неводной гелевой композиции по настоящему изобретению в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, после однократного введения в ткань органа.
Согласно изобретению по меньшей мере один фармацевтически активный агент предпочтительно имеет средний размер частиц 0,01-100 мкм, предпочтительно 5-80 мкм, более предпочтительно 20-50 мкм.
Термин "средний размер частиц", использованный в данном описании, означает частицу, размеры которой, в частности ее диаметр, предпочтительно средний диаметр, лежит в диапазоне от 0,01-100 мкм, предпочтительно 5-80 мкм, более предпочтительно 20-50 мкм. В этом контексте под термином "диаметр" в случае сферической частицы следует понимать средний диаметр сферы, т.е. удвоенный радиус сферы. В случае частицы несферической формы под термином "диаметр" следует понимать максимально возможное расстояние, на которое могут быть удалены друг от друга две точки по периферии частицы.
Распределение частиц по средним размерам предпочтительно получают методом лазерной дифракции. В ходе измерения методом лазерной дифракции луч лазера проходит через образец диспергированных частиц, и производится измерение интенсивности рассеянного света в зависимости от изменения угла рассеяния. Крупные частицы рассеивают свет под малыми углами относительно луча лазера, а мелкие частицы рассеивают свет под большими углами. Затем, чтобы рассчитать размер частиц, создавших эту картину рассеяния, анализируют данные по интенсивности углового рассеяния, используя теорию Ми рассеяния света. Размер частиц указывают как объемный эквивалентный диаметр сферы. Конструкция оптической системы с изломанной оптической осью в анализаторе Mastersizer 3000 (от Malvern Panalytical), которая, в частности была применена для измерений, обеспечивает измерение частиц с размером в диапазоне от 10 нм до 3,5 мм включительно с использованием одного оптического пути измерения. Для проведения измерения по всему диапазону размеров частиц в Mastersizer 3000 последовательно используется комбинация измерений с источниками красного и синего света.
Было обнаружено, что частицы по меньшей мере одного фармацевтически активного агента описанного выше среднего размера оказались особенно полезными для получения однородного распределения по меньшей мере одного фармацевтически активного агента в неводной гелевой композиции.
В одном из воплощений изобретения частицы желаемого размера по меньшей мере одного фармацевтически активного агента предпочтительно были получены путем помола, измельчения в шаровой мельнице, гомогенизации под высоким давлением, гомогенизации, микронизации или комбинации по меньшей мере двух из этих описанных методов.
Кроме того, благодаря описанному выше размеру частиц по меньшей мере одного фармацевтически активного агента всасывание по меньшей мере одного фармацевтически активного агента из композиции по изобретению в организме после введения в ткани органов является особенно предпочтительным по сравнению с другими традиционными гелевыми композициями, содержащими фармацевтически активные агенты. Благодаря такому предпочтительному поглощению фармацевтически активного агента из неводной гелевой композиции по настоящему изобретению в организме, требуются меньшие количества фармацевтически активного агента в композиции для достижения такого же терапевтического эффекта, как у традиционных гелевых композиций.
Термин "всасывание фармацевтически активного агента в организме", использованный в данном описании, означает всасывание фармацевтически активного агента в организме млекопитающего, в частности, организме человека и/или животного, в частности, в перилимфе и/или эндолимфе организма млекопитающего, в частности, организма человека и/или животного.
В одном из воплощений изобретения неводная гелевая композиция по настоящему изобретению содержит, с учетом концентрации фармацевтически активного агента, суспензию фармацевтически активного агента, состоящую из множества частиц.
В предпочтительном воплощении изобретения неводная гелевая композиция по настоящему изобретению предпочтительно содержит раствор фармацевтически активного агента.
Согласно изобретению по меньшей мере один фармацевтически активный агент предпочтительно имеет (низкую) растворимость в воде при комнатной температуре (22-26°С), составляющую меньше 1 мг/мл, предпочтительно меньше 0,1 мг/мл.
Низкая растворимость фармацевтически активных агентов отрицательно влияет на всасывание фармацевтически активного агента в организме, в частности, в перилимфе и/или эндолимфе организма, после введения, в частности, во внутренние органы, например, после транстимпанального введения. Вследствие этого, терапевтического эффекта невозможно достичь посредством однократного введения, поэтому необходимо разработать композицию в депо-форме для локального введения, в которой используется низкая растворимость, присущая фармацевтически активным агентам в подходящей гелевой композиции, для достижения длительного поглощения фармацевтически активных агентов в течение желаемого интервала времени.
Преимущество неводной гелевой композиции по настоящему изобретению заключается в том, что она особенно полезна для переноса фармацевтически активных агентов, имеющих (низкую) растворимость, описанных выше, в частности, при местном введении. Кроме того, неводную гелевую композицию по настоящему изобретению можно вводить с целью образования локального депо для достижения длительного поглощения фармацевтически активных агентов в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, в частности, после однократного введения в ткань органа.
В предпочтительном воплощении изобретения по меньшей мере один фармацевтически активный агент предпочтительно является веществом II класса согласно Биофармацевтической классификационной системе (BCS, класс II), характеризующимся свойствами низкой растворимости и высокой проникающей способности, при этом классификация основана на использовании Биофармацевтической классификационной системы (BCS).
Система BCS была введена для того, чтобы лучше охарактеризовать фармацевтически активные агенты с низкой растворимостью. В системе BCS проводится разделение на четыре категории с учетом растворимости и проникающей способности фармацевтически активного агента.
Согласно изобретению по меньшей мере один фармацевтически активный агент предпочтительно имеет формулу I:

где
- R представляет собой незамещенную циклоалкильную группу, в частности, бициклоалкильную группу, незамещенную или замещенную фенильную группу либо незамещенную или замещенную тиенильную группу, при этом указанная замещенная тиенильная группа или фенильная группа замещена по меньшей мере одним галогеном, предпочтительно выбранным из группы, содержащей по меньшей мере один атом F, атом Cl, атом Br или атом I, более предпочтительно по меньшей мере один атом F или по меньшей мере один атом Cl, и
- R1 представляет собой F, SF5, CF3 или OCF3.
Согласно изобретению по меньшей мере один фармацевтически активный агент предпочтительно выбран из группы, содержащей:
(1R,2R,4S)-rel-N-(3-(пентафторсульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(пентафторсульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид
либо стереоизомеры или таутомеры
(1S,2S,4R)-N -(3-(пентафторсульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамида,
в частности:
энантиомер (1R,2R,4S)-rel-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4S)-rel-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4S)-rel-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
п-хлор-N-(4-трифторметокси)бензил)бензамид,
п-хлор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-хлор-N-(4-трифторметокси)бензил)бензамид,
п-хлор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-хлор-N-(4-(трифторметил)бензил)бензамид и
п-хлор-N-(4-(трифторметил)бензил)бензамид.
Перечисленные выше фармацевтически активные агенты принадлежат к классу соединений, которые предпочтительно функционируют в качестве веществ, открывающих калиевые каналы, в частности как вещества, открывающие калиевый канал Kv7.4, и поэтому особенно полезны в лечении расстройств, ассоциированных с аберрантной активностью калия, таких как болезнь Альцгеймера и болезнь Паркинсона. Другими расстройствами являются неврологические состояния, такие как эпилепсия, или когнитивные психические расстройства, такие как депрессия, мания и шизофрения. В частности, известно, что калиевые каналы играют важную роль для нормального функционирования наружных волосковых клеток (ОНС) в кортиевом органе. Таким образом, перечисленные выше фармацевтически активные агенты являются перспективными кандидатами для лечения и/или профилактики потери слуха, например, перед лечением лекарственным средством, вызывающими ототоксичность.
Фармацевтически активный агент, описанный выше, в частности (1SR,2SR,4RS)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид (в дальнейшем именуемый соединением А), его энантиомер (1S,2S,4R)-N-(3-(пентафтор-A6-сульфанил)бензил)бицико[2.2.1]гептан-2-карбоксамид (в дальнейшем именуемый соединением В), демонстрируют (низкую) растворимость в воде при комнатной температуре (22-26°С), составляющую меньше 1 мг/мл, предпочтительно меньше 0,1 мг/мл, и поэтому могут быть классифицированы как лекарственные субстанции II класса согласно BCS.
Согласно изобретению предпочтительной является неводная гелевая композиция, где:
- касторовое масло присутствует в количестве от 85 до 95 масс. %, из расчета на общую массу композиции,
- олеоилмакроголглицерид, предпочтительно Labrafil®, присутствует в количестве от 2 до 6 масс. %, из расчета на общую массу композиции,
- по меньшей мере один загуститель, предпочтительно диоксид кремния, более предпочтительно коллоидный диоксид кремния, присутствует в количестве от 1 до 6 масс. %, из расчета на общую массу композиции,
- вязкость композиции при температуре 25°С составляет от 1400 до 2400 мПа⋅с, предпочтительно составляет от 1400 до 1800 мПа⋅с, и
- по меньшей мере один фармацевтически активный агент выбран из группы, содержащей:
(1R,2R,4S)-rel-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
либо стереоизомеры или таутомеры
(1S,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамида,
в частности:
энантиомер (1S,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1] гептан-2-карбоксамида или
рацемическую смесь (1SR,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)-бицикло[2.2.1] гептан-2-карбоксамида),
(1R,2R,4S)- rel-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4S)-rel-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
п-хлор-N-(4-трифторметокси)бензил)бензамид,
п-хлор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-хлор-N-(4-трифторметокси)бензил)бензамид,
п-хлор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-хлор-N-(4-(трифторметил)бензил)бензамид и
п-хлор-N-(4-(трифторметил)бензил)бензамид.
Было установлено, что упомянутая выше композиция оказалась особенно предпочтительной в плане свойств адгезии и вязкости, а также поглощения фармацевтически активного агента из неводной гелевой композиции по настоящему изобретению в организме, обеспечивая длительное высвобождение соединения в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, после однократного введения в ткань органа.
Согласно изобретению также предложено высвобождающее устройство, в частности шприц, при этом высвобождающее устройство заполнено неводной гелевой композицией, заявленной в формуле изобретения и определенной выше.
В одном из воплощений изобретения высвобождающее устройство предпочтительно соединено с иглой, подходящей для транстимпанального введения, предпочтительно иглой с диаметром калибра 18-27 (по Бирмингемской системе калибров), более предпочтителен калибр 20-23, в частности, калибр 20, пригодной для внесения гелевой композиции по настоящему изобретению в небольших объемах от 20 мкл до 200 мкл, в частности, для транстимпанального введения.
В другом воплощении изобретения высвобождающее устройство предпочтительно представляет собой шприц из циклоолефинового полимера (СОР), преимущество которого состоит в отсутствии риска включения каких-либо оставшихся в ходе процесса изготовления частиц стекла.
В другом воплощении изобретения высвобождающее устройство предпочтительно содержит стоппер и поршень.
Кроме того, высвобождающее устройство предпочтительно содержит контейнер для шприца, в частности пластиковый или картонный контейнер для шприца, который особенно полезен для предотвращения любого повреждения шприца во время транспортировки.
В следующем воплощении изобретения высвобождающее устройство, в частности шприц, предпочтительно заполнен в асептических условиях стерильной неводной гелевой композицией по изобретению.
Что касается других особенностей и преимуществ высвобождающего устройства, в частности, с точки зрения неводной гелевой композиции, то полная информация об этом приводится в предшествующем описании.
Окончательно, согласно изобретению предложена неводная гелевая композиция, содержащая по меньшей мере один фармацевтически активный агент, заявленный в формуле изобретения и определенный выше, для применения в фармацевтической композиции или лекарственном средстве, причем предпочтительно, чтобы указанное применение было предназначено для предупреждения или лечения заболеваний внутреннего уха, при этом предпочтительно, чтобы указанная неводная гелевая композиция была предназначена для транстимпанального введения.
В одном из воплощений изобретения предпочтительно, что неводную гелевую композицию, содержащую по меньшей мере один фармацевтически активный агент, вводят посредством транстимпанального введения для обеспечения длительного высвобождения фармацевтически активного агента в ухе, предпочтительно во внутреннем ухе, в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, в частности после однократного введения. Вследствие своих вязкостных свойств описанная выше неводная гелевая композиция по настоящему изобретению особенно полезна для длительного высвобождения фармацевтически активного агента, особенно в случае транстимпанального введения, с целью лечения слуховых расстройств, включая, но не ограничиваясь этим, индуцированную потерю слуха и индуцированную приемом лекарственных средств ототоксичность.
Помимо этого, неводная гелевая композиция по настоящему изобретению предпочтительно демонстрирует хорошо регулируемую вязкость и гелевую структуру, особенно подходящие для введения в виде капель. После транстимпанального введения композиция предпочтительно прикрепляется, в частности, в форме капли, к вторичной барабанной перепонке или собственно слизистой оболочке и не вымывается из среднего уха и/или вторичной барабанной перепонки, и ввиду этого обеспечивается длительное высвобождение фармацевтически активного агента в течение по меньшей мере 3 суток, предпочтительно в течение по меньшей мере 5 суток, после однократного введения в ткань органа, что позволяет тем самым избегать частого транстимпанального введения в ухо пациента.
Что касается других признаков и преимуществ применения, в частности, с точки зрения неводной гелевой композиции, то полная информация об этом приводится в предшествующем описании.
Дополнительные признаки и преимущества изобретения станут понятны из приведенных далее примеров в сочетании с предметом зависимых пунктов формулы изобретения. Индивидуальные признаки могут быть реализованы либо по отдельности, либо в комбинации в одном из воплощений изобретения. Предпочтительные воплощения служат только для иллюстрации и лучшего понимания изобретения, и их не следует рассматривать как каким-либо образом ограничивающие данное изобретение.
ПРИМЕРЫ Испытания в лабораторных масштабах
Для данных испытаний в качестве фармацевтически активного агента использовали (1SR,2SR,4RS)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид (соединение А) или (1S,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид (соединение В).
Перед применением фармацевтически активный агент измельчают в системе ступка/пестик до частиц соответствующего размера.
После этого измельченный фармацевтически активный агент интенсивно перемешивают с поверхностно-активным веществом, получая практически полностью увлажненные частицы фармацевтически активного агента. Смешивание осуществляют в стеклянном реакторе с двойной рубашкой. После этого постадийно при интенсивном перемешивании добавляют предварительно нагретый (примерно до 50°С) липофильный носитель. Суспензию перемешивают в течение соответствующего периода времени, чтобы обеспечить получение гомогенной суспензии фармацевтически активного агента. Наконец, осторожно с перемешиванием при температуре примерно 50°С добавляют загуститель, пока он полностью не диспергируется и не образуется неводная гелевая композиция. Конечную неводную гелевую композицию помещают в стеклянный сосуд и содержащиеся пузырьки воздуха удаляют при пониженном давлении (сначала при примерно 150-80 мбар (15-80 кПа), затем при примерно 18-20 мбар (1,8-2 кПа)). В случае проведения заполнения, конечной неводной гелевой композицией заполняют прозрачные шприцы, например, шприцы из циклоолефинового полимера или циклоолефинового сополимера (СОР или СОС) с люэровским наконечником, либо стеклянные шприцы I типа, соответствующего размера (например, 0,5; 1,0; 2,25; 3,0 мл) с помощью системы для заполнения, и в конце для закрывания шприцов сверху неводной гелевой композиции помещают стопперы. До применения шприцы хранят в горизонтальном или вертикальном положении в соответствующих условиях (например, при 2-8°С или при температуре не выше 25°С).
Испытания в опытно-промышленных масштабах в стерильных условиях
Все операции необходимо проводить в стерильных условиях, создаваемых в изоляторе. Перед началом процесса необходимо приготовить стерильные исходные вещества. Помимо этого, до стерилизации веществ нужно отобрать образцы на микрофлору.
Вспомогательные вещества Labrafil® М 1944 CS и очищенное касторовое масло стерилизуют с использованием стерилизующей фильтрации, в каждом случае с применением 2 фильтрующих капсул с последовательным расположением. Мембрана из полиэфирсульфона (PES), состоящая из одного слоя с порами размера 0,65 мкм, а также 0,2 мкм, считается оптимальной, но помимо этого можно использовать другие мембраны. До и после фильтрации проводят тестирования целостности фильтра. Тестируют каждый отдельный фильтр. Тестирования целостности до стерилизующей фильтрации проводят, используя мембраны, смоченные водой. Перед проведением стерилизующей фильтрации воду удаляют. Соответствующее количество первой порции проходящего стерилизацию фильтруемого вещества отбрасывают.
По завершении стерилизующей фильтрации тестирование целостности фильтровальных мембран выполняют еще раз.
Для облегчения фильтрования касторовое масло и Labrafil® М 1944 CS предварительно нагревают примерно до 50-55°С. Фильтрование следует проводить незадолго до начала процесса производства.
С учетом концентрации активного фармацевтического ингредиента (АФИ) в олеогеле, к смеси касторового масла и Labrafil® М 1944 CS можно добавить активный фармацевтический ингредиент и провести стерилизующую фильтрацию. Если концентрация активного фармацевтического ингредиента превышает предел растворимости в данном олеогеле, то стерилизующую фильтрацию касторового масла и Labrafil® М 1944 CS необходимо провести отдельно, а активный фармацевтический ингредиент следует подвергнуть гамма-облучению и после этого добавить в стерильных условиях к стерильно отфильтрованной смеси касторового масла и Labrafil® М 1944 CS.
Диоксид кремния представляет собой нерастворимое твердое вещество, которое перед приготовлением композиции необходимо подвергнуть гамма-облучению, чтобы сделать его стерильным. Активный фармацевтический ингредиент должен быть подвергнут гамма-облучению только в случае высоких, превышающих предел растворимости концентраций. Количества, необходимые для приготовления партии композиции, предварительно отвешивают с точным измерением массы, необходимой для текущего объема партии, и после этого подвергают гамма-облучению. Контейнеры с подвергнутым облучению веществом хранят до начала приготовления композиции.
В случае раствора активного фармацевтического ингредиента в масляной основе применяют приведенные далее стадии приготовления композиции.
Приготовление олеогеля осуществляют в стеклянном реакторе с двойной рубашкой. На первой стадии Labrafil® М 1944 CS и касторовое масло предварительно смешивают при примерно 50-55°С и в этой смеси растворяют активный фармацевтический ингредиент. После этого данную смесь подвергают стерилизующей фильтрации в стеклянном реакторе с рубашкой (раствор 1). Реактор предварительно нагревают до температуры примерно 50-55°С.
Диспергирование стерильного диоксида кремния должно быть выполнено быстро, чтобы избежать высокого значения вязкости у дисперсии до момента смачивания всего диоксида кремния. После диспергирования всего количества диоксида кремния в растворе 1 гомогенизацию композиции завершают с использованием диспергатора Ultra-Turrax и дальнейшего перемешивания.
После этого непосредственно в стеклянном реакторе производится удаление содержащегося в дисперсии воздуха. После подключения к подходящему вакуумному насосу и разделения реактора и насоса стерильным воздушным фильтром удаление осуществляют путем приложения пониженного давления (приблизительно 25 мбар (2,5 кПа)) в течение определенного периода времени. Понижение давления необходимо выполнять осторожно, контролируя подъем пузырьков воздуха, чтобы предотвратить вскипание.
И наконец, стеклянный реактор подсоединяют к подходящему насосу для проведения заполнения. Осуществляют заполнение шприцев и проводят окончательное укупоривание. Шприцы помещают обратно в их упаковки и выносят из изолятора.
Шприцы помечают прозрачной этикеткой с двумя метками, которые обеспечивают точное введение намеченного небольшого объема (например, 100 мкл).
Примеры для неводных гелевых композиций
В соответствии с общей методикой, описанной выше, готовили несколько партий в лабораторном масштабе с добавлением и без добавления фармацевтически активного агента. В приведенных ниже Таблицах 1-3 представлено общее описание некоторых релевантных партий.
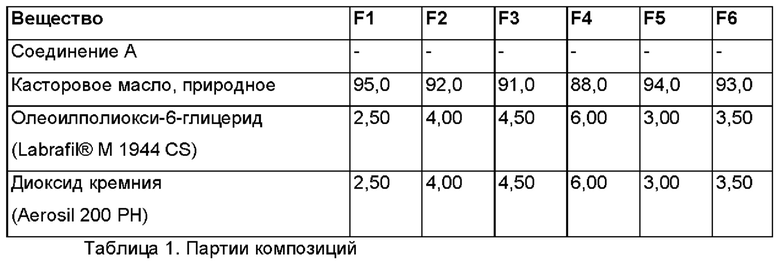

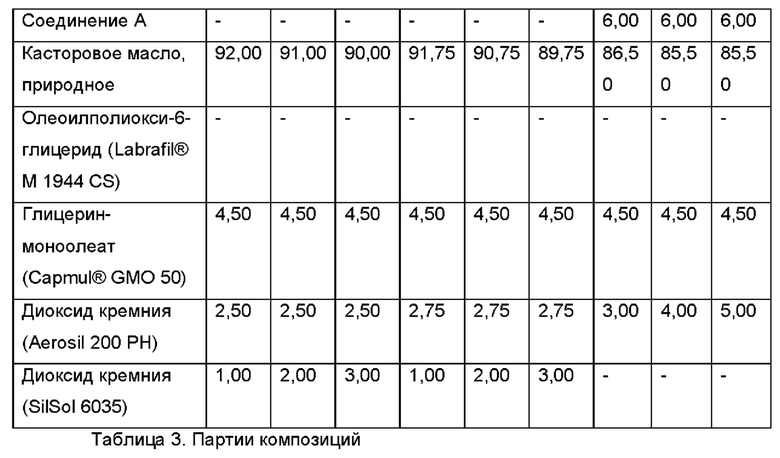
Capmul® представляет собой ацилглицерин, Capmul® GMO 50 представляет собой глицеринмоноолеат, Capmul® представляет собой зарегистрированную торговую марку фирмы ABITEC, серия Capmul® включает в себя Capmul® GMO 50, Capmul® 708G (глицерилмонокаприлат), Capmul® МСМ (среднецепочечные моно- и диглицериды) и Capmul® МСМ С8 (глицерилмонокаприлат), Capmul® PG-8 (пропиленгликоля монокаприлат), Capmul® PG-12 (пропиленгликоля монолаурат), Capmul® PG-2L (пропиленгликоля дилаурат) и Capmul® S12L (лауроиллактилат натрия).
SILSOL® представляет собой мезопористый диоксид кремния 6035 и продукт фирмы W. R. Grace & Co.-Conn.
В другом воплощении были получены, как описано выше, партии в лабораторном масштабе с конечным выбранным составом. В качестве репрезентативных примеров описаны две партии.
Партия А в лабораторном масштабе Размер партии: примерно 250 г.
Дозировка: 0,6% активного ингредиента соединения В. Состав (Таблица 4)

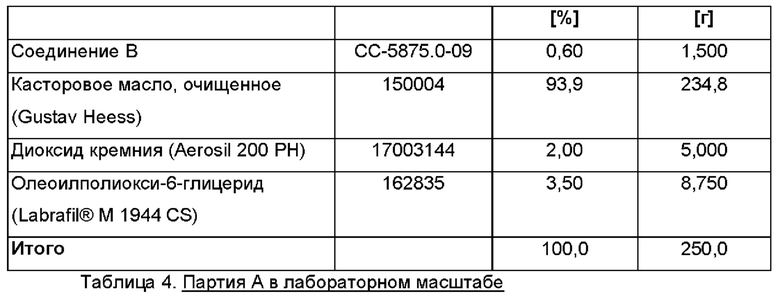
Партия В в лабораторном масштабе
Размер партии: примерно 250 г.
Дозировка: 0,6% активного ингредиента соединения.
Состав (Таблица 5)
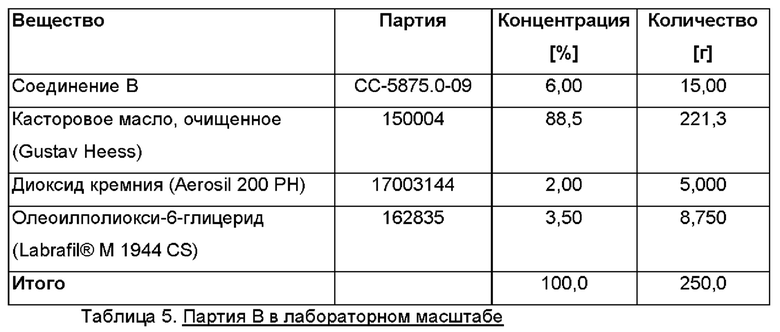
Партии в опытно-промышленном масштабе приготовлены в стерильных условиях так, как описано выше. В качестве примера описаны две репрезентативные партии.
Партия А в опытно-промышленном масштабе
Размер партии: примерно 2200 г
Дозировка: 0,6% активного ингредиента соединения В
Состав (Таблица 6)
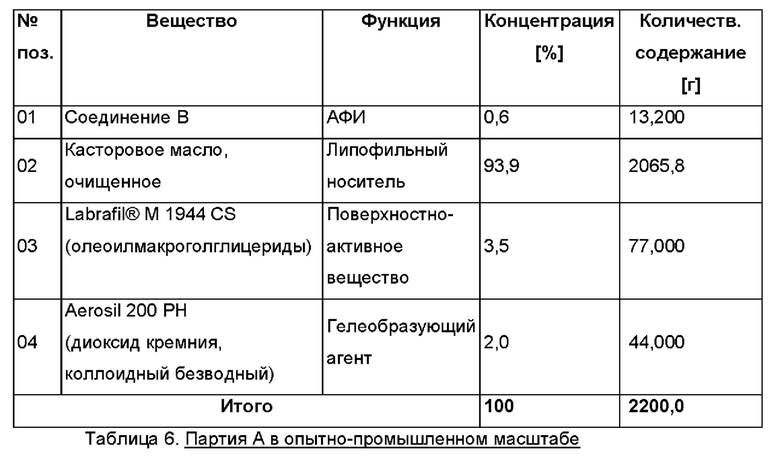
Партия В в опытно-промышленном масштабе Размер партии: примерно 2200 г Дозировка: 6,0% активного ингредиента соединения В Состав (Таблица 7)
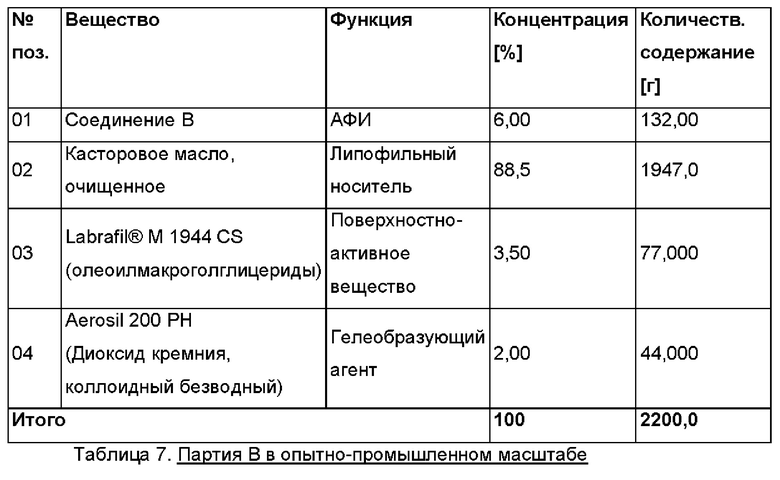
Определение реологических свойств и возможности введения через шприц
Значения вязкости измеряют реометром Brookfield RST с конической пластиной. Можно использовать скорость сдвига 5001/с при постоянном вращении. Подходящее время измерения составляет 120 секунд. Температура, при которой производят измерения, составляет 25°С и 37°С.
Для приготовления образца и выполнения измерения реометр нагревают до температуры, при которой желательно проводить измерение, используя термостат. Затем образец (0,6 мл) по каплям помещают на пластину для образцов, используя снабженную шкалой пипетку производства Eppendorf или подходящий шприц, для достижения полного заполнения измерительной щели реометра. После удаления избытка вещества образца образец также нагревают до желаемой температуры и выполняют измерения.
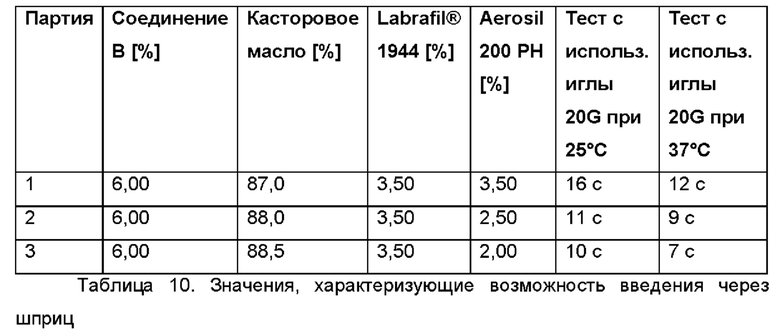
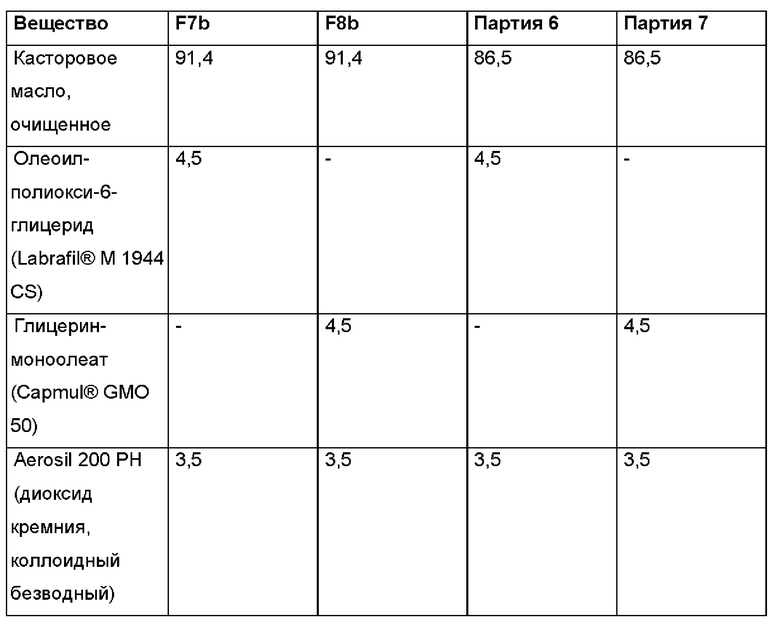
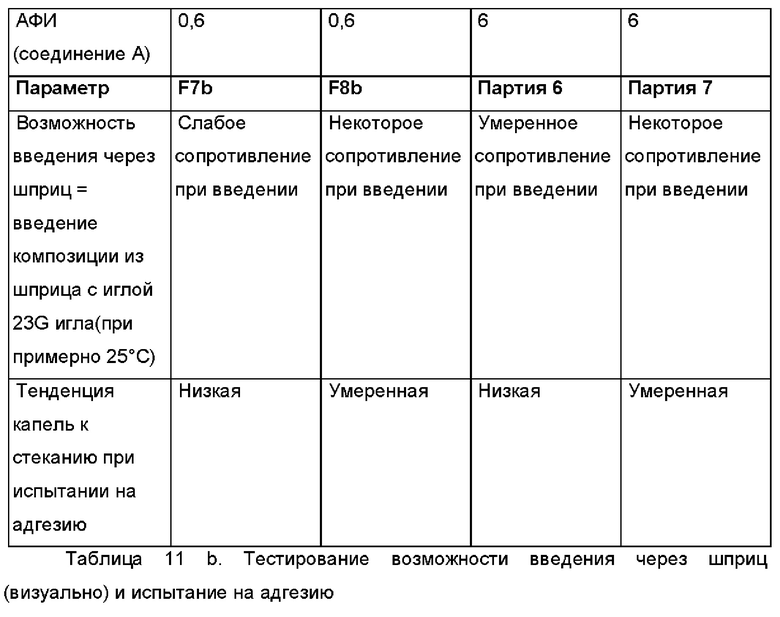
В следующем воплощении проведено тестирование некоторых партий композиций, перечисленных выше, на предмет адгезионных свойств, вязкости и возможности введения через шприц.
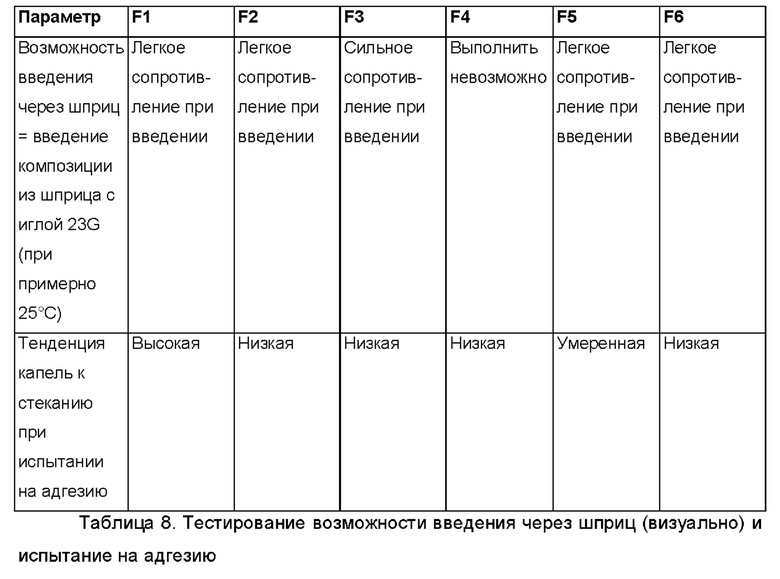
Соответствующие значения вязкости для F1-F6 приведены далее, п. а. означает "данные отсутствуют".
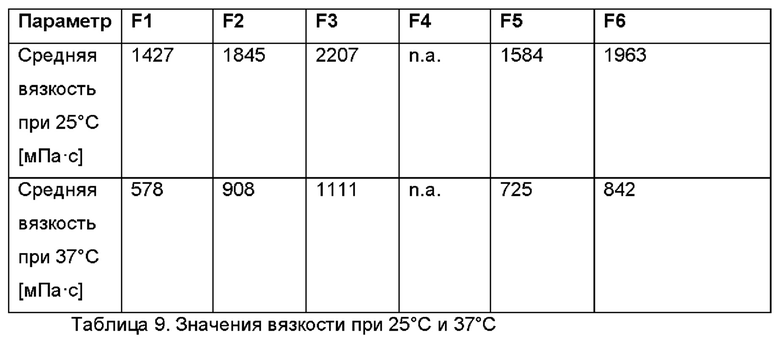
В другом воплощении, в частности, в случае неводной гелевой композиции, содержащей касторовое масло, олеоилмакроголглицериды (Labrafil® М 1944 CS) и диоксид кремния (Aerosil 200 РН, также известный как Aerosil® Pharma, продукт Evonik Operations GmbH), проведено тестирование на предмет возможности введения через шприц и испытание на адгезию.
Распределение частиц по размерам (PSD) в случае неводной гелевой композиции, содержащей соединение В
В некоторых воплощениях PSD (распределение частиц по размерам) для фармацевтически активного агента измеряли с использованием анализатора MasterSizer 2000 или 3000 от Malvern (в воде в качестве дисперсионной среды, скорость мешалки 1500 об/мин, согласно представлению Ми), получая приведенные далее результаты (Таблица 11). PSD для активного ингредиента в неводной гелевой композиции оставалось неизменным. На Фиг. 5 приведены некоторые из этих измельченных партий с полным профилем PSD.

Было приготовлено несколько партий лабораторного масштаба в соответствии с общей методикой, описанной выше, с добавлением и без добавления олеоилмакроголглицерида Labrafil® и с добавлением и без добавления фармацевтически активного агента (АФИ). В приведенных далее Таблицах 11а и 11b представлен краткий обзор некоторых релевантных партий. В Таблицах 11а и 11b показано, что Labrafil® в неводной гелевой композиции по настоящему изобретению имеет преимущество по сравнению с (Capmul® в том, что в результате получается композиция, более пригодная к введению через шприц и характеризующаяся лучшей тенденцией к отеканию.
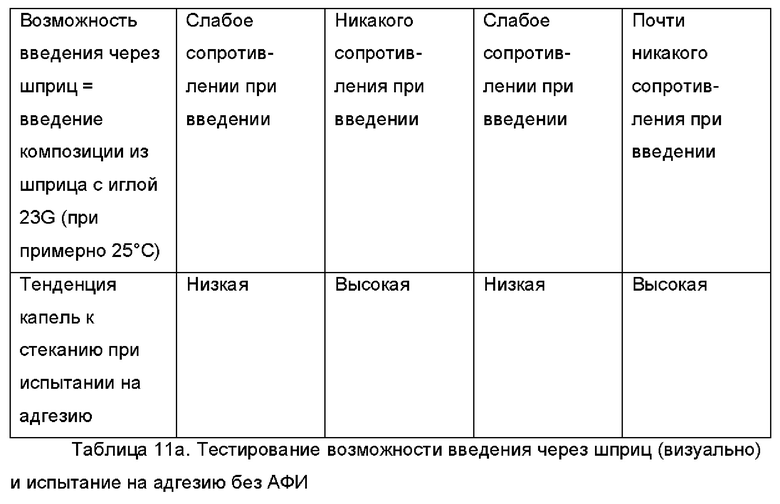
В случае партий F6, F2, F7b и 6, содержащих Labrafil®, получались композиции со слабым или умеренным сопротивлением при введении с использованием иглы 23G (при примерно 25°С), и поэтому они легко высвобождаются из шприца и/или втягиваются в него. Для сравнения, в случае партий F7a, F10al, F8b и 7, содержащих Capmul®, получались композиции, не обладающие никаким сопротивлением при введении с использованием иглы 23G (при примерно 25°С), и поэтому они в меньшей степени подходят для нанесения в случае применения, поскольку они вытекают капля за каплей из шприца без приложения сильного давления на шприц.
Аналогичные результаты получали при исследовании тенденции капель к стеканию при испытании на адгезию, в котором имитируется адгезия композиции к тканям органов. Поскольку в случае партий F6, F2, F7b и 6, содержащих Labrafil®, получались композиции с низкой тенденцией к стеканию, то следовательно они более подходят с точки зрения адгезии к тканям органов. В случае партий F7a, F10a, F8b и 7, содержащих Capmul®, получались композиции с высокой и умеренной тенденцией к стеканию, и поэтому они в меньшей степени подходят с точки зрения адгезии к тканям органов, в частности, в течение по меньшей мере 3 суток, после однократного введения.
При испытании на адгезию капли каждой композиции наносили на чашку Петри. Затем чашку Петри ставили вертикально для выяснения возможных эффектов, связанных со стеканием этих капель. Кроме этого, на чашку Петри наносили дополнительные капли, которую после этого наполняли водой, чтобы выяснить возможный эффект, связанный с откреплением капли. 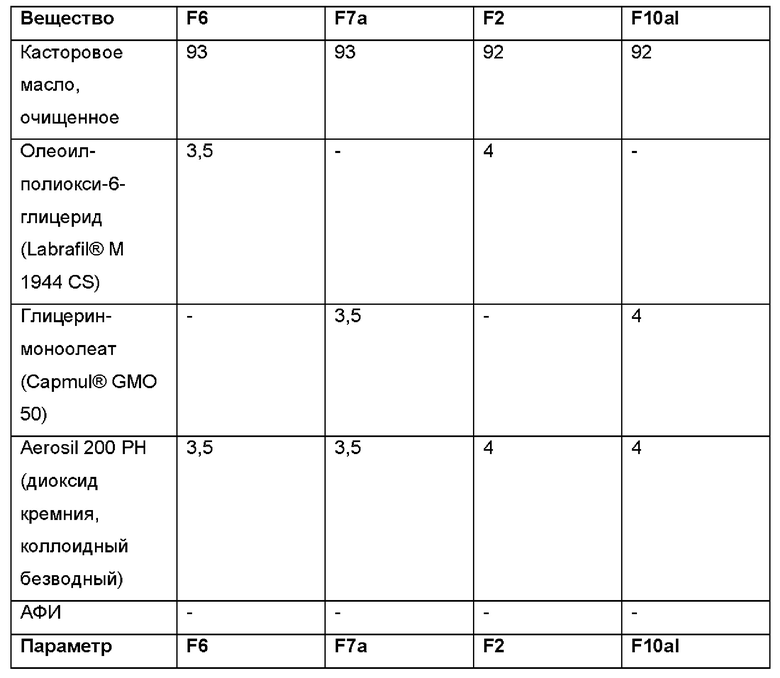
Стерилизация
Для диоксида кремния были использованы приведенные далее условия. Источник: 60Со.
Упаковка: флаконы из коричневого стекла или флаконы из HDPE (полиэтилена высокой плотности) с устойчивыми к облучению крышками, упакованные в сухой лед.
Доза облучения: 25-50 кГр (килогрей; стандартный диапазон).
Для процедур стерилизующей фильтрации касторового масла и Labrafil® или смесей касторовое масло/Labrafil® использованы фильтры из PES. Для создания асептических условий применен изолятор 5 класса качества согласно Международной организации по стандартизации (ISO). Стерильность диоксида кремния и конечного продукта подтверждена методами, валидизированными Европейской фармакопеей (Ph.Eur.).
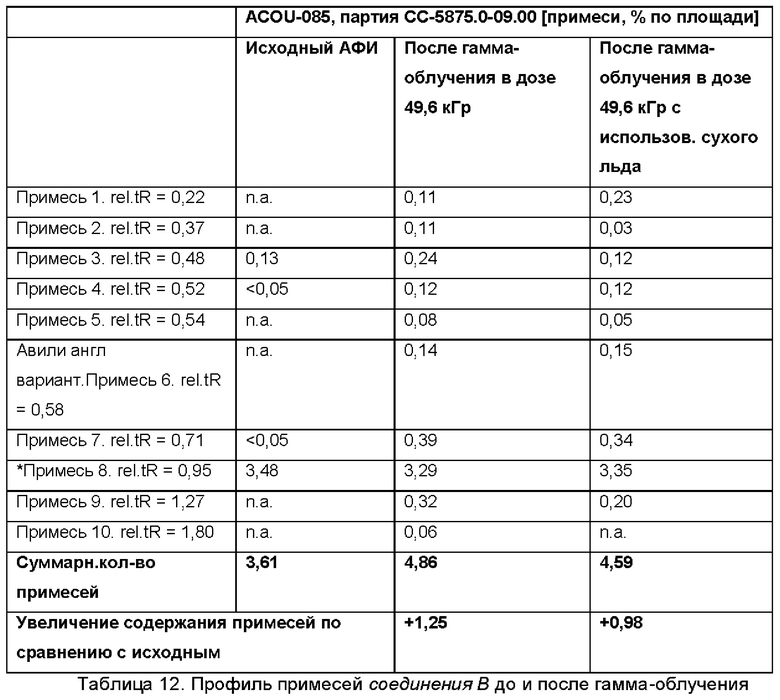
Профиль примесей в активном ингредиенте до и после гамма-облучения
В некоторых воплощениях профиль примесей в соединении В исследован с использованием высокоэффективной жидкостной хроматографии (HPLC) до и после гамма-облучения, подтвердив что гамма-облучение (стандартные условия) лишь незначительно влияет на качество активного ингредиента в случае использования для охлаждения сухого льда.
rel.tR означает относительное время удерживания.
Профили растворения
В других воплощениях проводили тестирование растворения in vitro, применяя лопастную систему от Sotax с обработкой ультразвуком (US) и программным обеспечением Т7 (Sotax Т7 smart US paddle system) при 37°C, 100 об/мин, при рН 7,4 (в забуференном фосфатом физиологическом растворе (PBS)) с 3% додецилсульфата натрия (SDS). Определенное количество разных неводных гелевых композиций равномерно распределяют на предметном стекле (8 см в диаметре) и предметное стекло с нанесенной композицией помещают на дно сосуда для тестирования растворения. Результаты представлены в качестве примера на Фиг. 1, 2 и 9 или сведены ниже в таблицу с данными по стабильности образцов.
Стабильность
В другом воплощении исследована стабильность безводной гелевой композиции по настоящему изобретению. Результаты представлены в качестве примера для неводной гелевой композиции с 0,6% содержанием АФИ, описанной в Таблице 4 и Таблице 5. Приведенные результаты являются доказательством превосходной стабильности в исследованном интервале при температуре 2-8°С и 25°С и относительной влажности 60%.
Фармакокинетические профили
Исследования на морских свинках
Введение
Транстимпанальное введение, в виде разовой дозы 100 мкл.
Описание животных
Вид: морская свинка линии Dunkin Hartley. Пол: самки.
Экспериментальные группы и дозы Группа: по 3 на одну временную точку.
Доза: 100 мкл 0,6%-ной неводной гелевой композиции (описанной в Таблице 4 и Таблице 5) или 100 мкл 6%-ной неводной гелевой композиции (описанной в Таблице 4 и Таблице 5)/животное/ухо.
Для лучшего понимания того, что было раскрыто в изобретении, прилагается несколько фигур, на которых схематично или графически и исключительно в качестве неограничивающего примера показаны случаи практического воплощения настоящего изобретения.
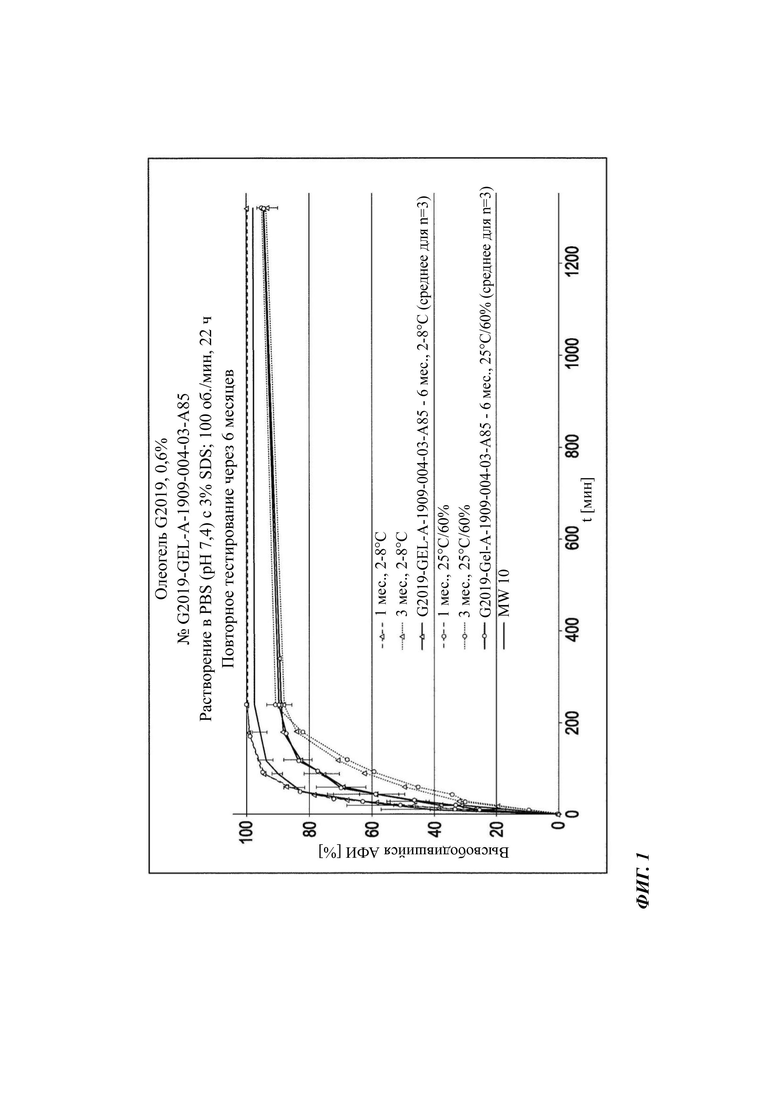
На Фиг. 1 графически показаны данные по растворению in vitro (лопастный аппарат II, с обработкой ультразвуком (US), 37°С) неводной гелевой композиции, содержащей 0,6% соединения В (описанной в Таблице 4 и Таблице 5) (в исходный момент времени, через 3 месяца и 6 месяцев).
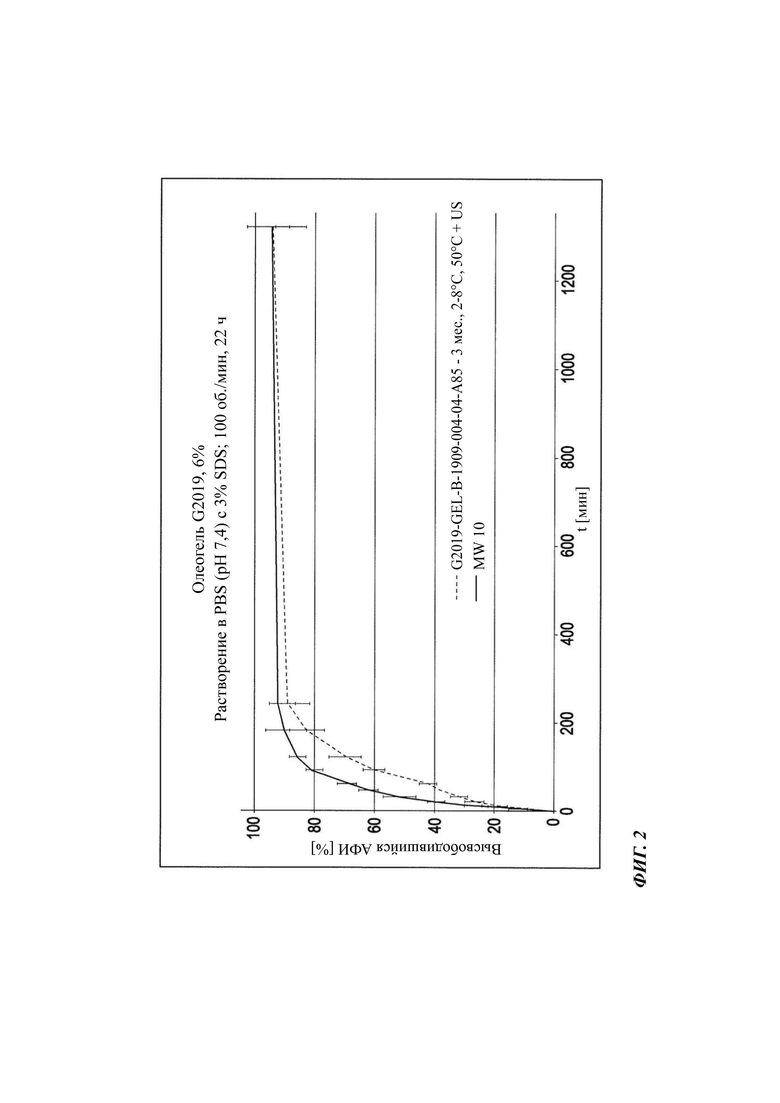
На Фиг. 2 графически показаны данные по растворению in vitro (лопастный аппарат II, US, 37°С) неводной гелевой композиции, содержащей 6% соединения В (описанной в Таблице 4 и Таблице 5) (в исходный момент времени, через 3 месяца).
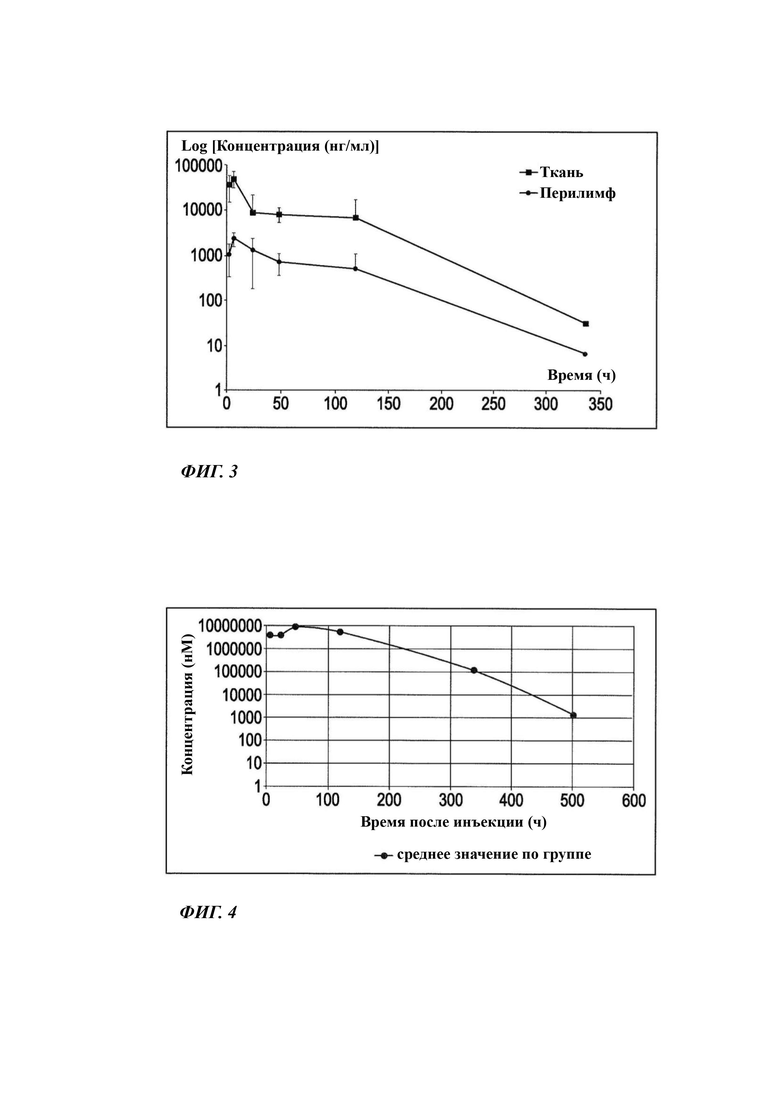
На Фиг. 3 графически показаны уровни фармацевтически активного агента в фармакокинетическом (ФК) исследовании на морских свинках неводной гелевой композиции, содержащей 6% соединения В (описанной в Таблице 4 и Таблице 5).
На Фиг. 4 графически показаны уровни фармацевтически активного агента (в ткани внутреннего уха, средние значения) в исследовании на морских свинках с использованием неводной гелевой композиции, содержащей 6% соединения В (описанной в Таблице 4 и Таблице 5).
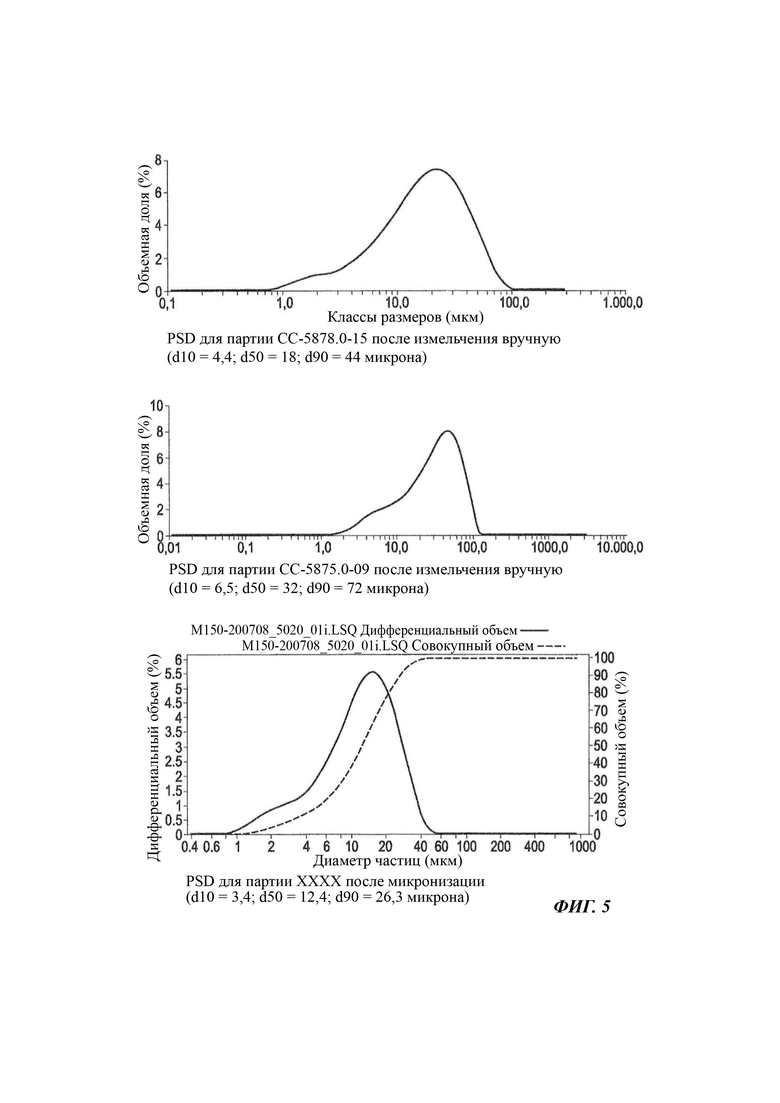
На Фиг. 5 графически показаны примеры распределения частиц по размерам (PSD) для партий соединения В, использованных в неводной гелевой композиции по настоящему изобретению (результаты, полученные с использованием Mastersizer).
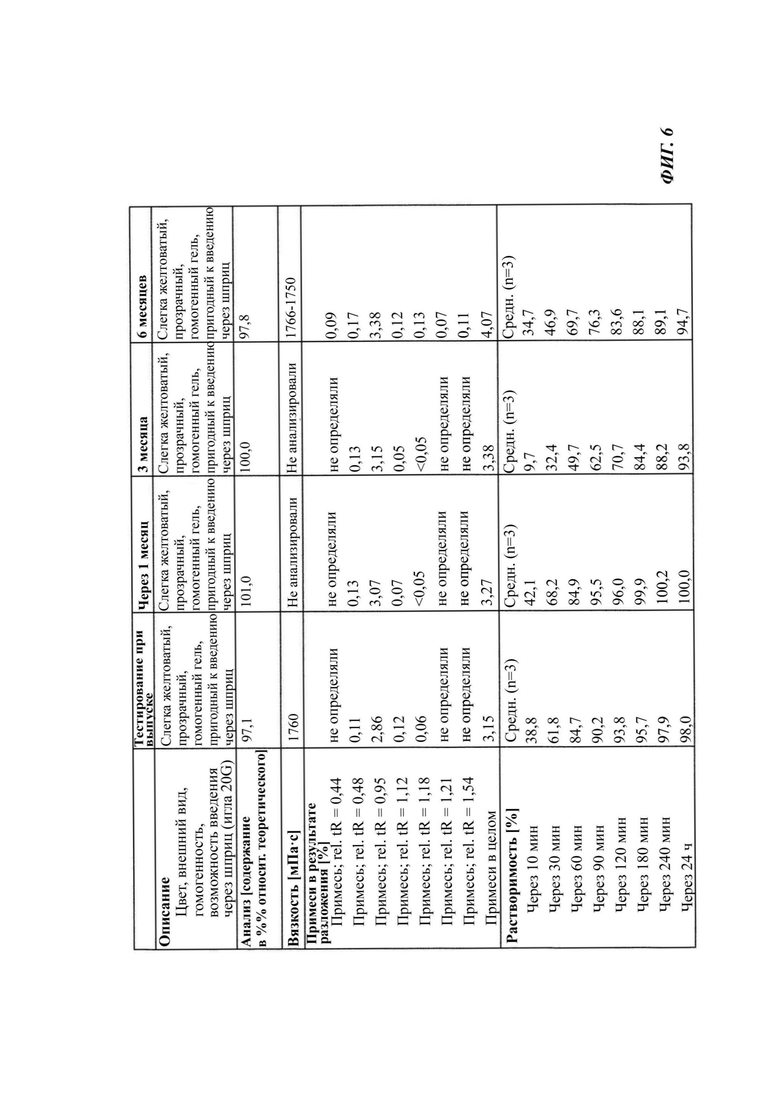
На Фиг. 6 показаны данные по стабильности неводной гелевой композиции, содержащей 0,6% соединения В, хранившейся в шприце в течение 6 месяцев при 2-8°С.
На Фиг. 7 показаны данные по стабильности неводной гелевой композиции, содержащей 0,6% соединения В, хранившейся в шприце в течение 6 месяцев при 25°С/относительной влажности (r.h.) 60%.
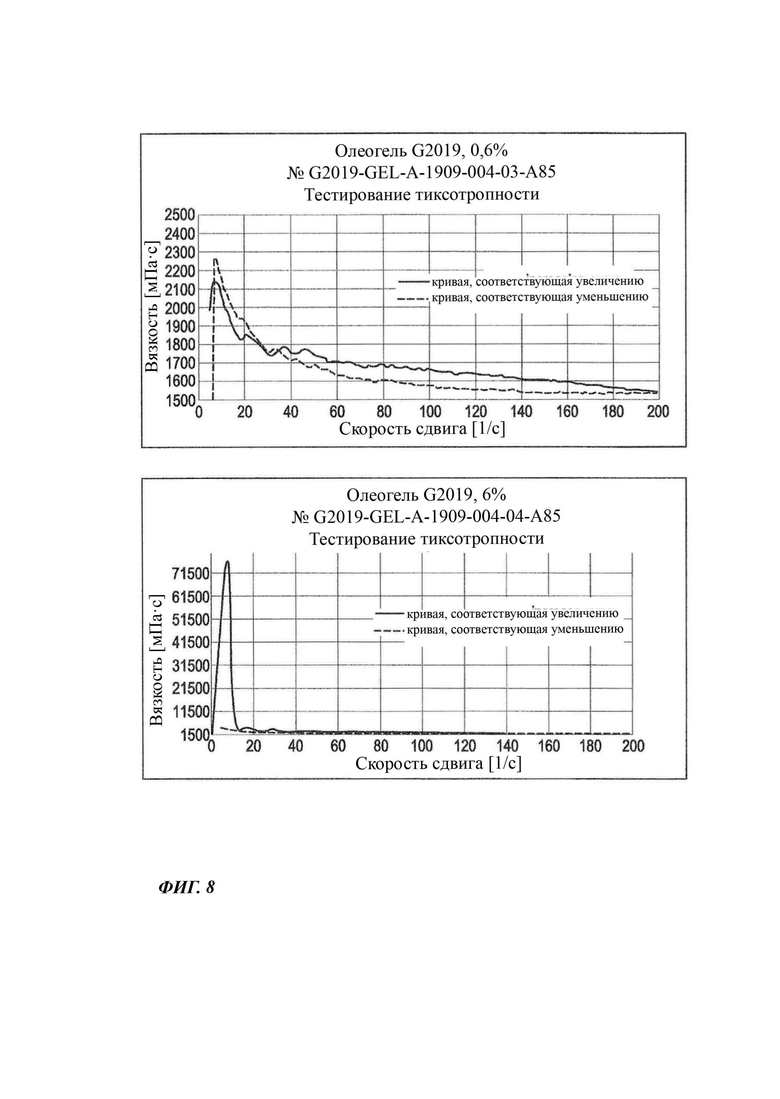
На Фиг. 8 графически показаны данные по вязкости неводных гелевых композиций, содержащих 0,6% и 6% соединения В, при напряжении сдвига.
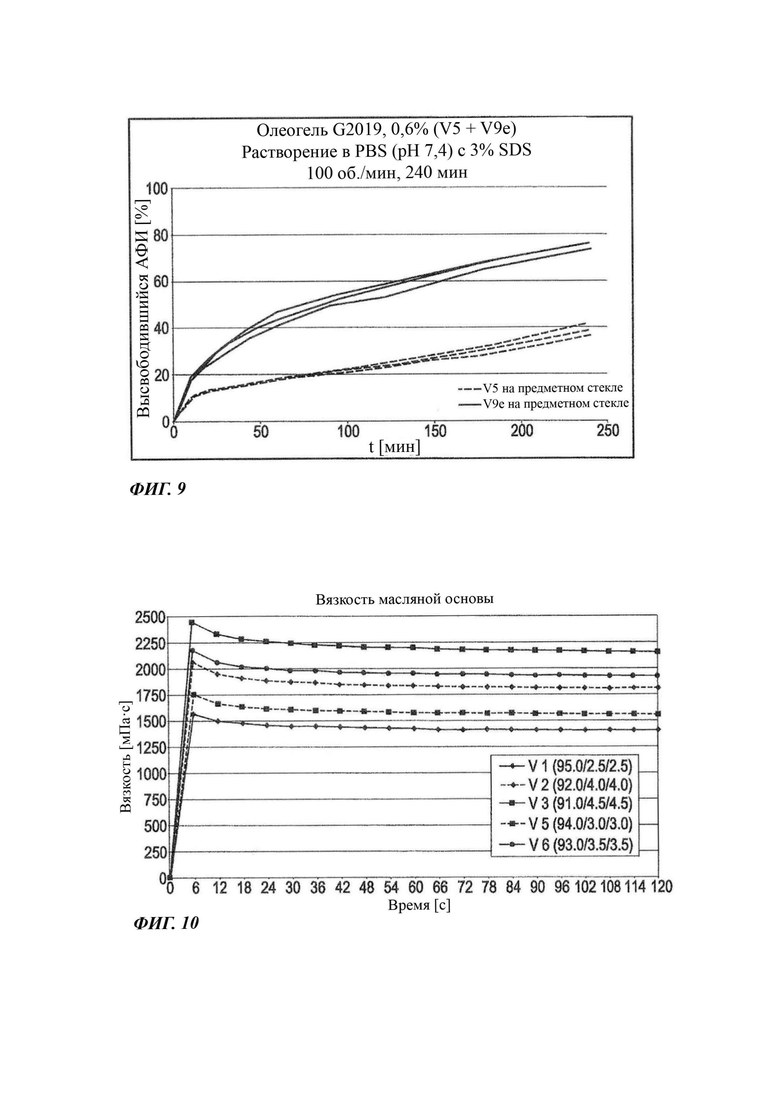
На Фиг. 9 графически показан профиль растворения in vitro (лопастный аппарат II, US, 37°С) неводных гелевых композиций, содержащих 0,6% соединения В.
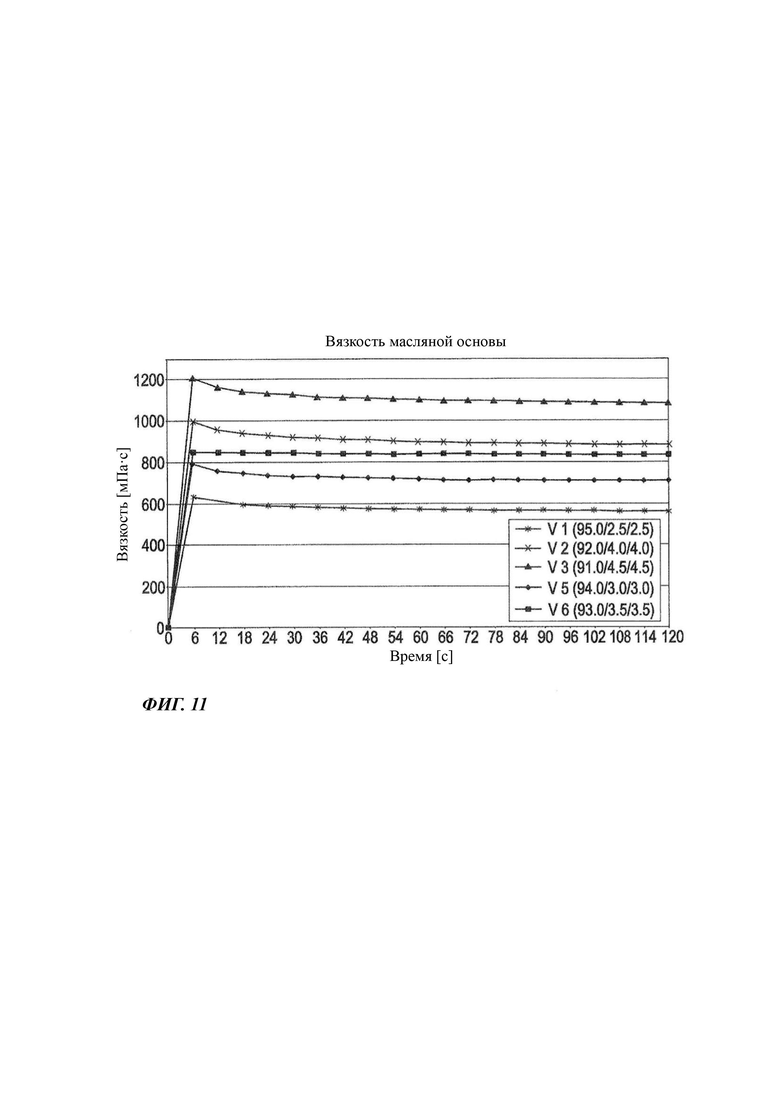
На Фиг. 10 графически показаны результаты измерения вязкости F1-F3, F5 и F6 (обозначенных здесь как V1, V2, V3, V5, V6) при 25°С.
На Фиг. 11 графически показаны результаты измерения вязкости F1-F3, F5 и F6 (обозначенных здесь как V1, V2, V3, V5, V6) при 37°С.
Для Фиг. 1 даются следующие пояснения: на Фиг. 1 демонстрируется профиль непрерывного высвобождения неводной гелевой композиции, содержащей 0,6% соединения В, в течение 22 часов при 37°С, полученный методом с использованием лопастного аппарата II (с US) после хранения при 2-8°С и 25°C/r.h. 60% в течение 1 месяца (1 мес.) и 3 месяцев (3 мес). Одиночные и средние значения с n=3 представлены в сравнении с профилем высвобождения в начальный момент времени (MWt0).
"Высвободившийся АФИ" означает "высвободившийся активный фармацевтический ингредиент".
Для Фиг. 2 даются следующие пояснения: на Фиг. 2 демонстрируется эффект термической обработки при 50°С в течение 2 часов с последующей обработкой ультразвуком (US) в течение 15 мин (возможна повторная гомогенизация) для неводной гелевой композиции, содержащей 6% соединения В, хранившейся при 2-8°С в течение 3 месяцев (3 мес), и влияние на профиль растворения при 37°С с использованием лопастного аппарата (с US) в сравнении с профилем высвобождения в начальный момент времени (MWt0).
Для Фиг. 3 даются следующие пояснения: на Фиг. 3 показаны уровни концентрации, выраженной в нг/мл, фармацевтически активного агента в ткани и перилимфе в ФК исследовании на морских свинках неводной гелевой композиции, содержащей 6% соединения В, демонстрирующие эффект длительного высвобождения в течение периода времени свыше 150 часов.
Для Фиг. 4 даются следующие пояснения: на Фиг. 4 показаны уровни концентрации, выраженной в нМ, фармацевтически активного агента в ткани и перилимфе в ФК исследовании на морских свинках неводной гелевой композиции, содержащей 6% соединения В, в виде средних значений, демонстрирующие эффект длительного высвобождения в течение периода времени свыше 150 часов.
Для Фиг. 5 даются следующие пояснения: на Фиг. 5 графически показаны примеры распределения частиц по размерам (PSD) в случае партий соединения В, использованных в неводной гелевой композиции по настоящему изобретению (результаты, полученные с применением Mastersizer), при этом значения d10 составляют 4,4, соответственно 6,5 микрона, значения d50 составляют 18, соответственно 32 микрона, а значения d90 составляют 44, соответственно 72 микрона для образцов, измельченных вручную (верхняя и средняя иллюстрации), и значение d10 составляет 3,4, значение d50 составляет 12,4, а значение d90 составляет 26,3 микрона для микронизированного образца, приготовленного с использованием струйной мельницы для микронизации (нижняя иллюстрация).
Для Фиг. 6 даются следующие пояснения: на Фиг. 6 показаны данные по стабильности неводной гелевой композиции, содержащей 0,6% соединения В, хранившейся в шприце в течение 6 месяцев при 2-8°С, и проведен анализ представленных параметров, таких как описание, анализ (с использованием HPLC), вязкость, разложение (с использованием HPLC) и растворение при 37°С (лопастный аппарат II типа, US), демонстрирующие хорошую стабильность неводного геля в течение периода исследования.
Для Фиг. 7 даются следующие пояснения: на Фиг. 7 показаны данные по стабильности неводной гелевой композиции, содержащей 0,6% соединения В, хранившейся в шприце в течение 6 месяцев при 25°C/r.h. 60%, и проведен анализ представленных параметров, таких как описание, анализ (с использованием HPLC), вязкость, разложение (с использованием HPLC) и растворение при 37°С (лопастный аппарат II типа, US), демонстрирующие хорошую стабильность неводного геля в течение периода исследования.
Для Фиг. 8 даются следующие пояснения: на Фиг. 8 (верхний график) графически показаны данные по вязкости неводных гелевых композиций, содержащих 0,6% соединения В, при температуре в диапазоне от 20°С до 25°С при напряжении сдвига, демонстрирующие, что кривая в случае увеличения напряжения и кривая в случае уменьшения напряжения почти полностью идентичны и, следовательно, подтверждающие, что вязкость уменьшается от начальных значений, составляющих примерно 2100-2200 мПа⋅с, до установившегося уровня, составляющего примерно 1500-1600 мПа⋅с, при увеличении скорости (напряжения) сдвига, что типично для тиксотропной среды, и что наблюдается обратимый эффект.
На Фиг. 8 (нижний график) графически показаны данные по вязкости неводных гелевых композиций, содержащих 6% соединения В, при температуре в диапазоне от 20°С до 25°С при напряжении сдвига, подтверждающие, что вязкость уменьшается от начального значения, составляющего примерно 71500 мПа⋅с, до установившегося уровня, составляющего примерно 1500 мПа⋅с, при увеличении скорости (напряжения) сдвига, что типично для тиксотропной среды, но при поддержании эффекта сдвига в течение более длительных периодов времени и при сохранении низких уровней вязкости (вследствие более высокой нагрузки соединением В) в случае уменьшения скорости сдвига.
Для Фиг. 9 даются следующие пояснения: на Фиг. 9 графически показаны профиль растворения in vitro (лопастный аппарат II, US, 37°С) для двух неводных гелевых композиций, содержащих 0,6% соединения В, и влияние изменения поверхностно-активного вещества в композиции на профиль высвобождения (данные относятся к Таблицам 1 и 2; партия V5 идентична F5, a V9e идентична F9e, в качестве источника партий).
Для Фиг. 10 даются следующие пояснения: на Фиг. 10 графически показаны результаты измерения вязкости для F1, F2, F3, F5 и F6 из Таблицы 1 (обозначенных здесь как V1, V2, V3, V5 и V6) при 25°С. По составу F1, F2, F3, F5 и F6 идентичны V1, V2, V3, V5 и V6. Обозначение было изменено, поскольку эта фигура относится к новому эксперименту. На этом графике показано увеличение вязкости в зависимости от состава неводного геля.
В соответствии с более ранним объяснением измерения вязкости выполняли с применением реометра Brookfield RST-CPS (с конусом и пластиной) при температуре 25°С. Использовали скорость сдвига 500 1/с.
Для Фиг. 11 даются следующие пояснения: на Фиг. 11 графически показаны результаты измерения вязкости для F1, F2, F3, F5 и F6 (обозначенных здесь как V1, V2, V3, V5 и V6) при 37°С. По составу F1, F2, F3, F5 и F6 идентичны V1, V2, V3, V5 и V6. Обозначение было изменено, поскольку эта фигура относится к новому эксперименту. На этом графике показано увеличение вязкости в зависимости от состава неводного геля. Использовали то же оборудование и те же условия (но при 37°С), которые были разъяснены выше для Фиг. 10.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СОЕДИНЕНИЯ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ОТКРЫВАТЕЛЕЙ КАЛИЕВЫХ КАНАЛОВ | 2018 |
|
RU2779131C2 |
| НОВЫЕ СОЕДИНЕНИЯ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ОТКРЫВАТЕЛЕЙ КАЛИЕВЫХ КАНАЛОВ | 2018 |
|
RU2779111C2 |
| СРЕДСТВА, ИНДУЦИРУЮЩИЕ АПОПТОЗ, ДЛЯ ЛЕЧЕНИЯ РАКА, ИММУННЫХ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2568611C2 |
| ДИСПЕРГИРУЕМЫЙ ПРЕПАРАТ ПРОТИВОВОСПАЛИТЕЛЬНОГО АГЕНТА | 2004 |
|
RU2319508C2 |
| АМИНОНОРБОРНАНОВОЕ ПРОИЗВОДНОЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ, А ТАКЖЕ ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2809188C2 |
| 2-ОКСА-5-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2015 |
|
RU2697651C2 |
| ПРОИЗВОДНОЕ 7H-ПИРРОЛО[2,3-D]ПИРИМИДИН-4-АМИНА | 2020 |
|
RU2796605C2 |
| ИНГИБИТОРЫ ЦИСТЕИНПРОТЕАЗ КАТЕПСИНОВ | 2014 |
|
RU2692799C2 |
| СОЕДИНЕНИЯ АЗЕТИДИНА, КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РАСТВОРИМОЙ ЭПОКСИДГИДРОЛАЗЫ | 2012 |
|
RU2615995C2 |
| АПОПТОЗ-ИНДУЦИРУЮЩИЕ АГЕНТЫ | 2018 |
|
RU2782469C2 |

В настоящем изобретении описана неводная гелевая композиция, полезная для введения фармацевтически активных агентов, в частности, для транстимпанального введения фармацевтически активных агентов. Неводная гелевая композиция содержит: касторовое масло, присутствующее в количестве от 85 до 95 масс. %, из расчета на общую массу композиции, олеоилмакроголглицерид, предпочтительно Labrafil®, присутствующий в количестве от 2 до 6 масс. %, из расчета на общую массу композиции, по меньшей мере один загуститель, предпочтительно диоксид кремния, более предпочтительно коллоидный диоксид кремния, присутствующий в количестве от 1 до 6 масс. %, из расчета на общую массу композиции, и при этом вязкость композиции при температуре 25°С составляет от 1400 до 2400 мПа⋅с, предпочтительно составляет от 1400 до 1800 мПа⋅с. 2 н. и 9 з.п. ф-лы, 11 ил., 11 табл.
1. Неводная гелевая композиция для транстимпанального введения фармацевтически активных агентов, содержащая:
- касторовое масло, присутствующее в количестве от 85 до 95 масс. %, из расчета на общую массу композиции,
- Labrafil®, присутствующий в количестве от 2 до 6 масс. %, из расчета на общую массу композиции,
- по меньшей мере один загуститель, присутствующий в количестве от 1 до 6 масс. %, из расчета на общую массу композиции, и при этом вязкость указанной композиции при температуре 25°С составляет от 1400 до 2400 мПа⋅с,
указанная неводная гелевая композиция дополнительно содержит по меньшей мере один фармацевтически активный агент, имеющий средний размер частиц от 0,01 до 100 мкм,
где указанный по меньшей мере один фармацевтически активный агент имеет формулу I:
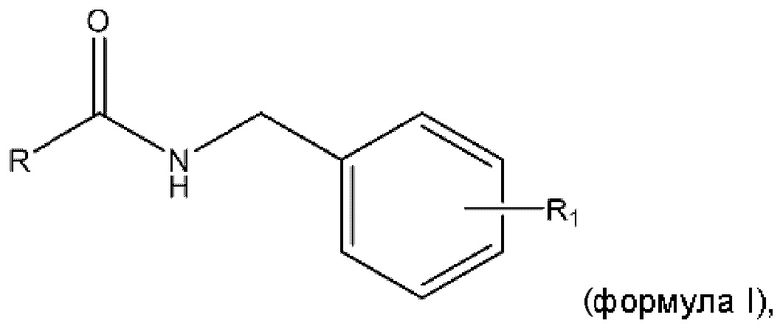
где
- R представляет собой незамещенную циклоалкильную группу, в частности, бициклоалкильную группу, незамещенную или замещенную фенильную группу либо незамещенную или замещенную тиенильную группу, при этом указанная замещенная тиенильная группа или фенильная группа замещена по меньшей мере одним галогеном, предпочтительно по меньшей мере одним атомом F или по меньшей мере одним атомом Cl, и
- R1 представляет собой F, SF5, CF3 или OCF3.
2. Неводная гелевая композиция по п. 1, отличающаяся тем, что указанный по меньшей мере один фармацевтически активный агент присутствует в количестве от 0,05 до 10 масс. %, предпочтительно от 0,1 до 10 масс. %, более предпочтительно от 0,5 до 5 масс. %, из расчета на общую массу композиции.
3. Неводная гелевая композиция по п. 1 или 2, отличающаяся тем, что указанный по меньшей мере один фармацевтически активный агент имеет средний размер частиц от 5 до 80 мкм, предпочтительно от 20 до 50 мкм.
4. Неводная гелевая композиция по любому из предшествующих пунктов, отличающаяся тем, что указанный по меньшей мере один фармацевтически активный агент имеет (низкую) растворимость в воде при комнатной температуре, составляющую меньше 1 мг/мл, предпочтительно меньше 0,1 мг/мл.
5. Неводная гелевая композиция по любому из предшествующих пунктов, отличающаяся тем, что указанный по меньшей мере один фармацевтически активный агент выбран из группы, включающей
(1R,2R,4S)-rel-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4S)-rel-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4S)-rel-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
п-хлор-N-(4-трифторметокси)бензил)бензамид,
п-хлор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-фтор-N-(4-трифторметокси)бензил)бензамид,
п-фтор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-хлор-N-(4-(трифторметил)бензил)бензамид и
п-фтор-N-(4-(трифторметил)бензил)бензамид.
6. Неводная гелевая композиция по п. 5, отличающаяся тем, что:
- касторовое масло присутствует в количестве от 85 до 95 масс. %, из расчета на общую массу композиции,
- Labrafil® присутствует в количестве от 2 до 6 масс. %, из расчета на общую массу композиции,
- по меньшей мере один загуститель, предпочтительно диоксид кремния, более предпочтительно коллоидный диоксид кремния, присутствует в количестве от 1 до 6 масс. %, из расчета на общую массу композиции,
- вязкость композиции при температуре 25°С составляет от 1400 до 2400 мПа⋅с, предпочтительно составляет от 1400 до 1800 мПа⋅с,
- указанная неводная гелевая композиция дополнительно содержит по меньшей мере один фармацевтически активный агент, имеющий средний размер частиц от 0,01 до 100 мкм, и
- указанный по меньшей мере один фармацевтически активный агент выбран из группы, включающей
(1R,2R,4S)-rel-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4S)-rel-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4S)-rel-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
п-хлор-N-(4-трифторметокси)бензил)бензамид,
п-хлор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-фтор-N-(4-трифторметокси)бензил)бензамид,
п-фтор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-хлор-N-(4-(трифторметил)бензил)бензамид и
п-фтор-N-(4-(трифторметил)бензил)бензамид.
7. Неводная гелевая композиция по п. 5, состоящая из:
- касторового масла, присутствующего в количестве от 85 до 95 масс. %, из расчета на общую массу композиции,
- Labrafil®, присутствующего в количестве от 2 до 6 масс. %, из расчета на общую массу композиции,
- по меньшей мере одного загустителя, предпочтительно диоксида кремния, более предпочтительно коллоидного диоксида кремния, присутствующего в количестве от 1 до 6 масс. %, из расчета на общую массу композиции,
- по меньшей мере одного фармацевтически активного агента, имеющего средний размер частиц от 0,01 до 100 мкм, и
- указанный по меньшей мере один фармацевтически активный агент выбран из группы, включающей
(1R,2R,4S)-rel-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(пентафтор-λ6-сульфанил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4S)-rel-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1R,2R,4R)-rel-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметил)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
(1S,2S,4R)-N-(3-(трифторметокси)бензил)бицикло[2.2.1]гептан-2-карбоксамид,
п-хлор-N-(4-трифторметокси)бензил)бензамид,
п-хлор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-фтор-N-(4-трифторметокси)бензил)бензамид,
п-фтор-N-(4-(пентафторсульфанил)бензил)бензамид,
п-хлор-N-(4-(трифторметил)бензил)бензамид и
п-фтор-N-(4-(трифторметил)бензил)бензамид, при этом
- вязкость композиции при температуре 25°С составляет от 1400 до 2400 мПа⋅с, предпочтительно составляет от 1400 до 1800 мПа⋅с.
8. Неводная гелевая композиция по любому из предшествующих пунктов, где указанный по меньшей мере один загуститель представляет собой диоксид кремния, предпочтительно коллоидный диоксид кремния.
9. Неводная гелевая композиция по любому из предшествующих пунктов, где вязкость композиции при температуре 25°С составляет от 1400 до 1800 мПа⋅с.
10. Шприц для транстимпанального введения фармацевтически активных агентов, отличающийся тем, что шприц заполнен неводной гелевой композицией по любому из пп. 1-9.
11. Неводная гелевая композиция по любому из пп. 1-5 для применения в качестве фармацевтической композиции или лекарственного средства, где указанное применение предназначено для предупреждения или лечения заболеваний внутреннего уха, при этом указанная неводная гелевая композиция предпочтительно предназначена для транстимпанального введения.
| US 2018296472 A1, 2018.10.18 | |||
| WO 2019202504 A1, 2019.10.24 | |||
| WO 2012156820 A, 2012.11.22 | |||
| WO 2019140012 A1, 2019.07.18 | |||
| WO 2018140792 A2, 2018.08.02 | |||
| WO 2019126783 A1, 2019.06.27 | |||
| EP 3256463 A1, 2017.12.20 | |||
| WO 2018158256 A2, 2018.09.07 | |||
| WO 2020112390 A1, 2020.06.04 | |||
| СИСТЕМА ДОСТАВКИ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ ДЛЯ НАЗАЛЬНОГО ПРИМЕНЕНИЯ НЕЙРОТРАНСМИТТЕРОВ | 2007 |
|
RU2480208C2 |
Авторы
Даты
2024-07-09—Публикация
2021-11-18—Подача