Область техники
[0001] Настоящее изобретение относится к области биоинженерии, а именно к способу выявления регуляторных элементов генома, влияющих на транскрипцию, и использования их в биотехнологиях. Настоящее изобретение может быть использовано в научных исследованиях, ветеринарии и медицине, в частности, в генной терапии или продукции терапевтических белков.
Уровень техники
[0002] Обеспечение заданного уровня и стабильности экспрессии трансгенов является одной из принципиальных технических задач в различных биотехнологических подходах, таких как генная терапия или продукция терапевтических белков. Оптимизация системы экспрессии является сложным и трудозатратным процессом, которая включает в себя подбор системы доставки целевого гена, отработку условий культивирования клеток-продуцентов и пр. (Tripathi & Shrivastava, 2019). Одним из основополагающих подходов для оптимизации системы экспрессии является рациональный дизайн вектора экспрессии, проведенный с учетом требований к генотоксичности, уровню экспрессии целевого гена и типа клеток-продуцентов.
[0003] Исследования, связанные с оптимизацией векторов экспрессии, сосредоточены на поиске регуляторных элементов и/или их комбинаций, обеспечивающих максимальный уровень транскрипции целевого гена, так как количество молекул мРНК непосредственно влияет на уровень продукции желаемого белка. Особенное внимание уделяют выбору промоторов и энхансеров, хотя без внимания также не остаются терминаторы транскрипции и даже интроны (Zhou et al., 2023). Так, было показано, что определённые комбинации обозначенных регуляторных элементов положительно влияют на синтез мРНК целевого гена. Например, было показано, что использование в векторе экспрессии комбинации энхансера CMV (cytomegalovirus) и EF-1α промотора приводит к повышению уровня транскрипции целевого гена относительно уровней, полученных с использованием векторов, содержащих энхансер и промотор CMV. Также к усилению транскрипции приводили определённые комбинации энхансера, промотора и терминатора транскрипции (Zhou et al., 2023).
[0004] Однако в ряде случаев требуется не максимизировать уровень экспрессии целевого гена (на уровне мРНК и/или белка), а выбрать такую комбинацию регуляторных элементов, чтобы не нарушить активность метаболических путей в клетке или чтобы не допустить сверхпродукции, приводящей к неправильному процессированию белков и/или накоплению их агрегатов в клетках (Hunter et al., 2018; Jervis et al., 2019; Jones et al., 2015; Lee et al., 2013; Seo et al., 2014). Также в некоторых случаях необходимо синтезировать белки, токсичные для клеток-продуцентов. Тогда требуется либо использовать индуцибельные промоторы, либо подобрать комбинацию регуляторных элементов, которые будут менее активны, чем стандартно используемые вирусные промоторы и/или энхансеры (Hunter et al., 2018; Sou et al., 2022; Thaisuchat et al., 2015). Наличие в составе вектора экспрессии регуляторных элементов, влияющих на экспрессию целевого гена как на транскрипционном, так и пост-транскрипционном уровне, предоставляют массу возможностей для точной настройки уровня экспрессии. Например, добавление тканеспеспецифичных энхансеров или подбор подходящего промотора позволяет добиться экспрессии целевого гена в отдельных тканях организма, снижая потребность в сложных системах таргетной доставки целевого гена при генной терапии (Gruh et al., 2008; Montaño-Samaniego et al., 2020; Nair et al., 2020).
[0005] Так, в исследованиях, связанных с генной терапией мышечных заболеваний, было показано, что использование повсеместно работающих промоторов (в частности, CMV) для экспрессии мышечно-специфичного гена CAPN3 приводило к повреждениям цитоскелета немышечных клеток из-за избыточной продукции белка и активации иммунного ответа (Bartoli et al., 2006; Dietz et al., 2023; Shirley et al., 2020). Такого побочного эффекта можно избежать, используя тканеспецифичные энхансеры и/или промоторы. Однако поиск тканеспецифичных энхансеров представляется сложной задачей, так как энхансеры не имеют консенсусных последовательностей и могут быть расположены на значительном расстоянии от регулируемых ими генов.
[0006] Для продукции рекомбинантных белков, в том числе, в терапевтических целях, часто используют линию клеток млекопитающих CHO. Как правило, в векторах экспрессии, которые используют для трансфекции клеток CHO, целевой ген находится либо под контролем вирусных промоторов и/или энхансеров, либо под контролем промоторов повсеместно экспрессирующихся генов позвоночных. При сравнении активности различных промоторов на примере экспрессии зелёного флуоресцентного белка (GFP) в клетках CHO было обнаружено, что именно вирусные промоторы позволяют получить более высокий уровень экспрессии целевого гена по сравнению с прочими (Wang et al., 2016). Однако использование вирусных промоторов SV40 или CMV в векторах экспрессии может приводить к клеточному стрессу из-за избыточного синтеза мРНК и белка. Помимо этого, используемые вирусные промоторы подвержены ДНК-метилированию за счёт наличия множества CpG динуклеотидов в их последовательностях. Такое метилирование приводит к снижению активности указанных промоторов, что приводит к снижению уровня транскрипции целевого гена и, как следствие, белка, особенно при долгосрочном культивировании (Ho et al., 2016; Kim et al., 2011; Mehta et al., 2009; Moritz, Becker & Göpfert, 2015).
[0007] Выходом из подобной ситуации может являться использование в векторах экспрессии эндогенных регуляторных элементов, а именно последовательностей промоторов и/или энхансеров, которые активны в целевом клеточном типе. В частности, ранее был описан способ выявления эндогенных промоторов высокоактивных генов в линии клеток CHO-K1, основанный на анализе доступных данных о транскриптоме этих клеток. При таком анализе происходил отбор генов, которые демонстрировали наивысший уровень активности относительно прочих. После отбора генов-кандидатов последовательности их промоторов были амплифицированы при помощи полимеразной цепной реакции (ПЦР). Таким образом удалось идентифицировать несколько промоторов, активность которых оказалась сопоставима со стандартно используемым промотором CMV. Однако в отличие от вирусного промотора эндогенные промоторы не подвержены ДНК-метилированию и стабильно активны в конкретном клеточном типе при длительной культивации. Это позволяет использовать выявленные эндогенные промоторы для стабильной экспрессии рекомбинантных белков в данном типе клеток (Tossolini et al., 2022). Данный способ выявления промоторов требует дополнительной функциональной проверки обнаруженных кандидатных ДНК-последовательностей.
[0008] Другой способ выявления эндогенных промоторов, активных в определенном типе клеток, заключался в следующем. Геномную ДНК, выделенную из линии клеток CHO, подвергали механической и энзиматической обработке для получения набора случайных фрагментов (длиной 500 - 3000 пар нуклеотидов), далее эти фрагменты встраивали в репортерный вектор, несущий ген люциферазы, для установления их промоторной активности. Таким образом были выявлены кандидатные последовательности промоторов, которые возможно использовать в векторах экспрессии. Аналогичный способ анализа фрагментов геномной ДНК также используется для поиска энхансерных последовательностей (Pontiller et al., 2010). Однако эффективность данного способа невысока ввиду того, что отбор кандидатных последовательностей ДНК не был обусловлен их связью с активаторами транскрипции.
[0009] Известен еще один способ выявления регуляторных последовательностей, включая как промоторы, так и энхансеры, основанный на биоинформатическом анализе (ChromHMM, скрытые Марковские модели) данных экспериментов по иммунопреципитации хроматина с использованием антител против модификаций гистоновых белков. Так как регуляторные элементы характеризуются определённой комбинацией подобных модификаций, то биоинформатический анализ позволяет предсказать положение потенциальных регуляторных элементов. Однако подобный метод поиска также требует дополнительной функциональной проверки обнаруженных последовательностей. (Feichtinger et al., 2016).
[0010] Таким образом, существует необходимость в создании технологии, позволяющей одновременно выявлять большое количество регуляторных элементов в геноме определенных типов клеток для последующего использования выявленных регуляторных элементов генома при создании векторов экспрессии, обеспечивающих необходимый уровень экспрессии целевого гена.
Термины и сокращения
[0011] CHO - (Chinese hamster ovary) эпителиальная клеточная линия, полученная из яичника китайского хомячка, часто используемая в производстве рекомбинантных терапевтических белков.
[0012] GFP - green fluorescent protein, зелёный флуоресцентный белок. eGFP - (Enhanced green fluorescent protein) зеленый флуоресцентный белок с повышенным уровнем флуоресценции.
[0013] RNA-seq - РНК-секвенирование, метод определения первичной структуры молекул РНК, представляющий собой высокочувствительный и точный инструмент для изучения транскриптома.
[0014] ДНК-библиотека для массового параллельного репортерного анализа (МПРА) - набор репортерных конструкций со встроенными кандидатнами ДНК-последовательностями, полученными с помощью иммунопреципитации хроматина. Причем в указанном наборе каждая конструкция включает одну кандидатную ДНК-последовательность.
[0015] Вектор экспрессии - плазмидная или вирусная ДНК, включающая целевой ген и обеспечивающая экспрессию этого гена в трансфицированной клетке. Целевым геном может быть репортерный ген, чей уровень экспрессии свидетельствует от наличии или отсутствии регуляторной активности последовательности ДНК, которую встраивают в вектор экспрессии. Также целевой ген может быть геном, кодирующим РНК или белок, используемый при генной терапии. Целевой ген может кодировать определенный белок, синтезируемый в клетках-продуцентах, трансфицированных данным вектором экспрессии.
[0016] Генетическая репортерная конструкция - плазмидная ДНК, включающая промотор, интрон, участок для встройки кандидатной ДНК-последовательности в открытой рамке считывания и сигнал полиаденилирования; служит для создания ДНК-бибилиотеки для МПРА.
[0017] ДНК - дезоксирибонуклеиновая кислота.
[0018] Иммунопреципитация хроматина - метод специфического выделения последовательностей ДНК, связанных с исследуемым белком в живых клетках использованием антител, специфически узнающих исследуемый белок.
[0019] Кандидатная ДНК-последовательность - последовательность нуклеотидов ДНК, потенциально обладающая регуляторной активностью в отношении транскрипции одного или нескольких генов.
[0020] Клетки-продуценты - бактериальные или эукариотические клетки, продуцирующие в больших количествах определенное биологически активное соединение.
[0021] Конфлюэнтность - степень покрытия клетками культуральной поверхности.
[0022] МПРА - массовый параллельный репортерный анализ.
[0023] Открытая рамка считывания (ORF) - open reading frame, это последовательность ДНК, начинающаяся со старт-кодона и не содержащая в себе стоп-кодона, которая потенциально может кодировать белок. В контексте данной работы, открытая рамка считывания в репортерном векторе представляет собой первые 20 кодонов гена eGFP, включая старт-кодон.
[0024] Промотор - последовательность ДНК, узнаваемая РНК-полимеразой как стартовая площадка для начала транскрипции. Минимальный промотер - последовательность нуклеотидов ДНК, достаточная для начала транскрипции гена РНК-полимеразой.
[0025] ПЦР - полимеразная цепная реакция.
[0026] Регуляторный элемент генома - последовательность ДНК, с которой связываются белки, регулирующие транскрипцию одного или нескольких генов. В данной работе речь идет о регуляторных элементах, положительно влияющих на транскрипцию. К таким элементам относятся, например, промоторы и энхансеры.
[0027] Трансген - фрагмент ДНК, переносимый при помощи генно-инженерных манипуляций либо природой в новое место генома того же или другого организма.
[0028] Транскриптом - совокупность всех транскриптов, синтезируемых одной клеткой или группой клеток, включая мРНК и некодирующие РНК.
[0029] Трансфекция - процесс введения нуклеиновой кислоты в клетки эукариот невирусным методом.
[0030] Хроматин - это макромолекулярный комплекс, состоящий из ДНК и белков, физически связанных с ДНК прямо или опосредованно через другие белки.
[0031] Эндогенная последовательность ДНК - последовательность нуклеотидов ДНК в определенном месте генома, являющаяся природной для соответствующего таксона.
[0032] Энхансер - последовательность ДНК, с которой связываются белки, активирующие транскрипцию одного или нескольких генов.
Сущность изобретения
[0033] Задачей настоящего изобретения является выявление большого количества регуляторных элементов генома, активирующих транскрипцию на разном уровне в определенном типе клеток, пригодных для создания векторов экспрессии, обеспечивающих заданный уровень экспрессии целевого гена в данном типе клеток.
[0034] Данная задача реализуется заявляемым изобретением за счет достижения такого технического результата как возможность массового выявления эндогенных регуляторных элементов генома, влияющих на транскрипцию, для улучшения характеристик процесса белковой наработки.
[0035] Технический результат достигается заявленным изобретением за счет того, что способ выявления регуляторных элементов генома включает следующие этапы:
а) Отбор кандидатных ДНК-последовательностей, обладающих признаками, характерными для регуляторных элементов генома, влияющих на транскрипцию. В предпочтительном варианте реализации отбор кандидатных ДНК-последовательностей проводят с помощью иммунопреципитации хроматина с использованием антител, узнающих белки, ассоциированные с известными регуляторными элементами генома, влияющими на транскрипцию. В одном из вариантов реализации для иммунопреципитации используют антитела, узнающие модификацию гистона H3 (H3K27Ac) - известного маркера энхансеров и промоторов активно транскрибирующихся генов.
б) Встраивание полученных кандидатных ДНК-последовательностей в репортерные конструкции с получением ДНК-библиотеки для массового параллельного репортерного анализа,
где каждая репортерная конструкция включает промотор, интрон, сайт встраивания кандидатной ДНК-последовательности в открытой рамке считывания и сигнал полиаденилирования,
причем в результате встраивания кандидатных ДНК-последовательностей каждая репортерная конструкция в ДНК-библиотеке включает одну кандидатную ДНК-последовательность, расположенную между промотором и сайтом полиаденилирования;
в) Введение полученной ДНК-библиотеки в клетки путем трансфекции;
г) Выявление регуляторной активности кандидатных ДНК-последовательностей путем анализа транскриптома трансфицированных клеток с помощью транзиентной экспрессии полученных генетических конструкций.
[0036] Ключевыми этапами заявленного метода является получение ДНК-библиотеки для МПРА и анализ транскриптома клеток, трансфицированных указанной ДНК-библиотекой. В предпочтительном варианте реализации изобретения анализ транскриптома для выявления регуляторной активности кандидатных ДНК-последовательностей проводят с использованием данных RNA-seq, полученных для клеток, трансфицированных ДНК-библиотекой для МПРА. Обогащение транскриптома определенной кандидатной ДНК-последовательностью говорит о регуляторной активности данной кандидатной ДНК-последовательности.
[0037] В одном из вариантов реализации заявленный способ включает этап подтверждения регуляторной активности отдельных выявленных элементов генома или их комбинаций. Данный этап включает встраивание одного или нескольких выбранных регуляторных элементов генома в вектор экспрессии, включающий целевой ген. В одном варианте реализации целевой ген может быть геном, используемым для генной терапии, или геном, служащим для синтеза определенного белка в клетках-продуцентах. В предпочтительном варианте реализации целевой ген является репортерным геном. Полученным вектором экспрессии трансфицируют клетки определенного типа и определяют уровень экспрессии целевого гена. В одном варианте реализации уровень экспрессии целевого гена могут определять на уровне кодируемого им белка. Например, могут использовать специфические антитела, узнающие белок, кодируемый целевым геном. В другом случае могут измерять флуоресценцию, если целевой ген кодирует репортерный флуоресцентный белок. В еще одном варианте реализации уровень экспрессии целевого гена определяют на уровне транскрипции. В этом случае, в предпочтительном варианте реализации, определение уровня транскрипции целевого гена осуществляют методом ПЦР в реальном времени. Данный этап позволяет определить уровень экспрессии целевого гена под контролем выявленного регуляторного элемента генома или их комбинации в определенном типе клеток.
[0038] В одном из вариантов реализации уровень регуляторной активности одного или нескольких выявленных регуляторных элементов генома сравнивают с уровнем регуляторной активности известных регуляторных элементов.
[0039] Все выявленные регуляторные элементы генома, активирующие транскрипцию, затем ранжируют по их регуляторной активности для дальнейшего использования при создании вектора экспрессии, обеспечивающего заданный уровень экспрессии целевого гена в том типе клеток, в котором были выявлены данные регуляторные элементы генома.
[0040] Обеспечение возможности массового выявления эндогенных регуляторных элементов генома, влияющих на транскрипцию, осуществляется за счет обработки большого количества кандидатных ДНК-последовательностей, а также подтверждения их предполагаемой регуляторной активности на нескольких этапах - массовом и индивидуальных отборах.
[0041] Для осуществления этапа получения ДНК-библиотек с кандидатными ДНК-последовательностями регуляторных элементов необходима векторная конструкция, которая позволит провести последующие этапы массового параллельного репортерного анализа и подтвердить регуляторную активность кандидатных ДНК-последовательностей.
[0042] Заявленная репортерная конструкция включает следующие элементы:
а) промотор, необходимый для инициации транскрипции;
б) интрон, необходимый для создания кДНК библиотек и дальнейшей аналитики транскриптома, а также для точного определения количества мРНК по отношению к плазмидной ДНК, с которой происходила транскрипция, методом ПЦР в реальном времени;
в) открытая рамка считывания;
г) сайт встраивания кандидатной ДНК-последовательности в открытой рамке считывания, расположенной между промотором и сигналом полиаденилирования;
д) сигнал полиаденилирования для терминации транскрипции и осуществления процесса полиаденилирования, необходимого для стабильности мРНК в эукариотических клетках, а также для возможности обогащения пула мРНК,
в которой кандидатная ДНК-последовательность способна влиять на уровень транскрипции мРНК с собственной последовательности, в случае наличия регуляторной активности.
[0043] В некоторых вариантах реализации изобретения сайт для встраивания кандидатной ДНК-последовательности, расположенный в открытой рамке считывания, находится между интроном и сигналом полиаденилирования
[0044] В предпочтительном варианте реализации изобретения генетическую конструкцию используют для осуществления транзиентной экспрессии в клеточных линиях.
[0045] Обеспечение возможности массового выявления эндогенных регуляторных элементов генома, влияющих на транскрипцию, осуществляется за счет особенностей структуры репортерной генетической конструкции таким образом, что при наличии регуляторной активности у кандидатной ДНК-последовательности, изменяется уровень экспрессии данной последовательности. Это достигается расположением кандидатной ДНК-последовательности в открытой рамке считывания, находящейся между промотором и сигналом полиаденилирования, а также наличием интрона перед открытой рамкой считывания.
[0046] Заявленный способ позволяет одновременно выявлять множество регуляторных элементов генома, способных влиять на транскрипцию в разной степени в определенном типе клеток, которые, действительно ассоциированы с белком-регулятором транскрипции в интересующем типе клеток.
[0047] Хотя иммунопреципитация хроматина является предпочтительным методом отбора кандидатных ДНК-последовательностей, заявленный способ оставляет возможность для изменения стратегии отбора кандидатных ДНК-последовательностей. При этом при выборе стратегии предпочтение отдается методам, позволяющим физически выделить набор кандидатных ДНК-последовательностей, обладающих признаками, характерными для регуляторов транскрипции. Такая стратегия позволяет на самом первом этапе способа отобрать для дальнейшего анализа кандидатные ДНК-последовательности, которые, действительно, ассоциированы с белком-регулятором транскрипции в интересующем типе клеток. Таким образом, благодаря использованию иммунопреципитации хроматина, снижается количество исследуемых ДНК последовательностей, но увеличивается среди них доля искомых регуляторных элементов генома.
[0048] Несмотря на то, что заявленный способ требует высокого уровня владения молекулярно-биологическими методиками, его неоспоримое преимущество заключается в том, что с его помощью выявление регуляторных элементов можно распространить на любые типы клеток.
Описание чертежей
[0049] На Фиг. 1 представлена схема массового параллельного репортерного анализа фрагментов генома.
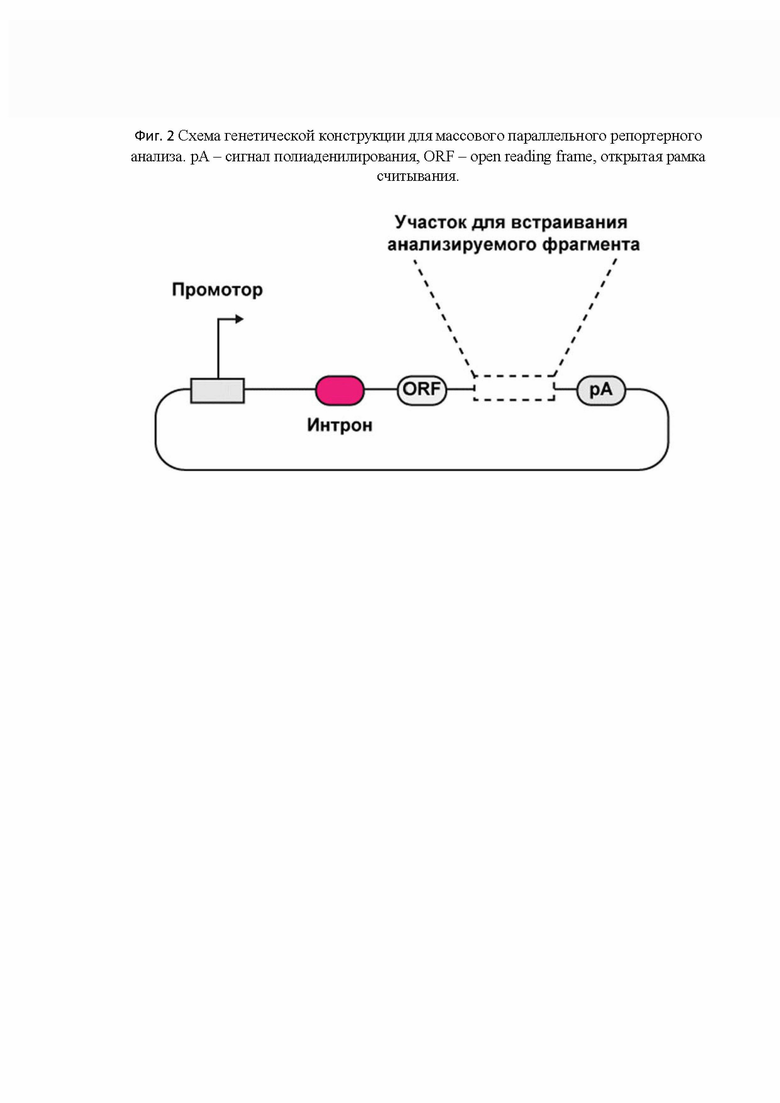
[0050] На Фиг. 2 представлена схема генетической конструкции для массового параллельного репортерного анализа.
[0051] На Фиг. 3 представлена схема генетической конструкции для индивидуального репортерного анализа.
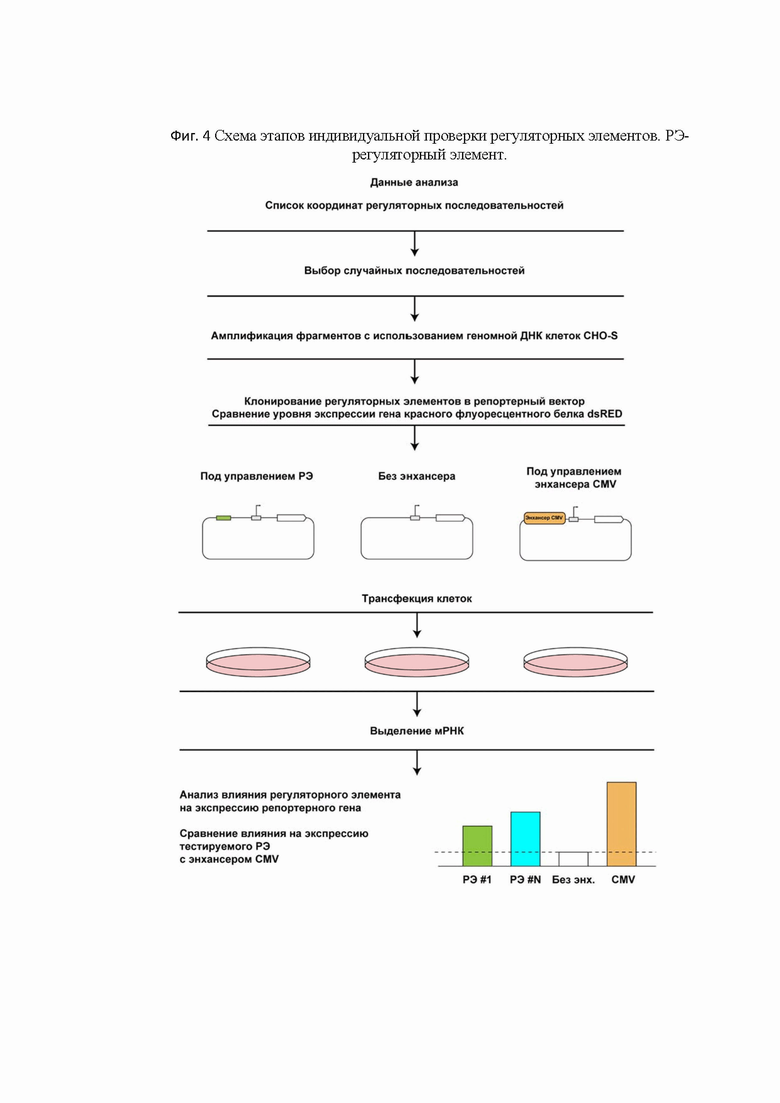
[0052] На Фиг. 4 представлена схема этапов индивидуальной проверки регуляторных элементов.
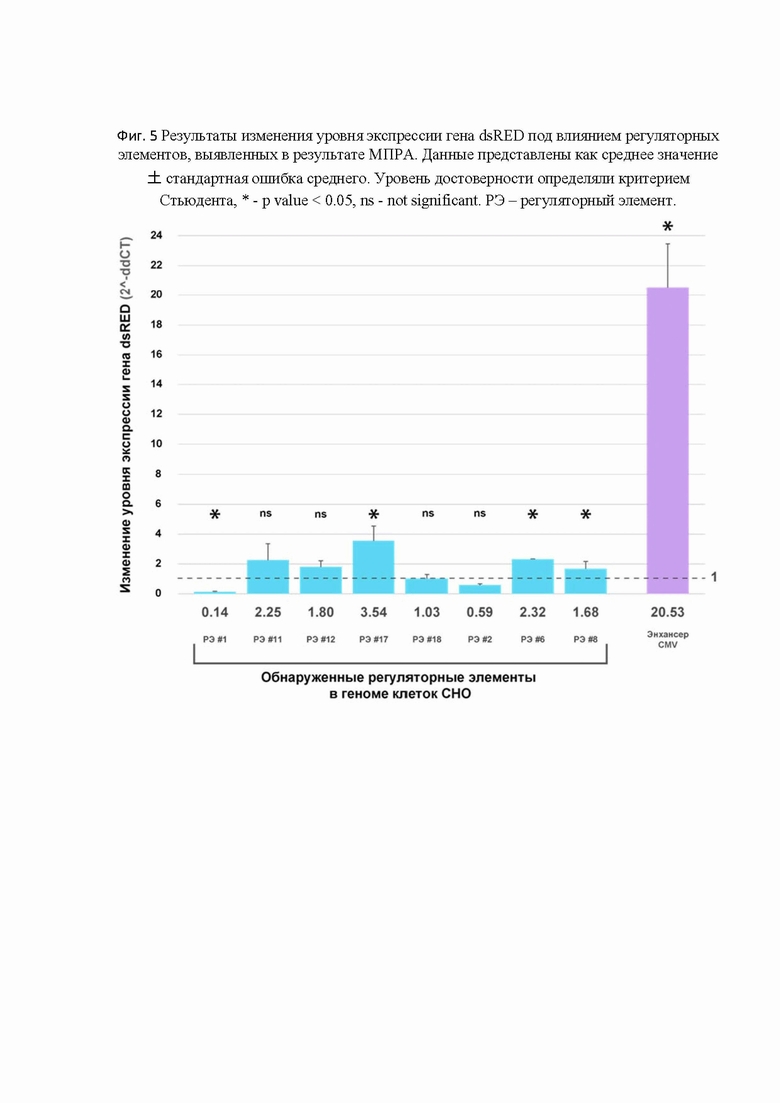
[0053] На Фиг. 5 представлены результаты изменения уровня экспрессии гена dsRED под влиянием регуляторных элементов, выявленных в результате МПРА.
Подробное описание изобретения
[0054] В приведенном ниже подробном описании реализации изобретения приведены многочисленные детали реализации, призванные обеспечить отчетливое понимание настоящего изобретения. Однако, квалифицированному в предметной области специалисту, очевидно, каким образом можно использовать настоящее изобретение, как с данными деталями реализации, так и без них. В других случаях хорошо известные методы, процедуры и компоненты не описаны подробно, чтобы не затруднять излишне понимание особенностей настоящего изобретения.
[0055] Кроме того, из приведенного изложения ясно, что изобретение не ограничивается приведенной реализацией. Многочисленные возможные модификации, изменения, вариации и замены, сохраняющие суть и форму настоящего изобретения, очевидны для квалифицированных в предметной области специалистов.
[0056] Способ выявления регуляторных элементов генома, влияющих на транскрипцию, включает этапы, показанные на Фиг. 1:
а) Физический отбор кандидатных ДНК-последовательностей, обладающих признаками, характерными для регуляторных элементов генома, влияющих на транскрипцию;
б) Встраивание полученных кандидатных ДНК-последовательностей в репортерные конструкции с получением ДНК-библиотеки для МПРА;
в) Введение полученной ДНК-библиотеки в клетки путем трансфекции;
г) Выявление регуляторной активности кандидатных ДНК-последовательностей путем анализа транскриптома трансфицированных клеток.
[57] В предпочтительном варианте реализации отбор кандидатных ДНК-последовательностей проводят с помощью иммунопреципитации хроматина с использованием антител, узнающих белки, ассоциированные с известными регуляторными элементами генома, влияющими на транскрипцию. Примерами таких белков-маркеров активной транскрипции могут служить Mediator, Oct4, Sox2, Nanog, или Klf4. В некоторых вариантах реализации для иммунопреципитации хроматина могут использовать антитела, узнающие определенные гистоновые модификации, например, модификацию гистона H3 (H3K27Ac) - известного маркера энхансеров и промоторов активно транскрибирующихся генов. При этом источником хроматина могут быть любые интересующие пользователя клетки, например, клеточные линии млекопитающих, используемые как продуценты рекомбинантных белков, в том числе, терапевтических белков. В некоторых вариантах реализации отбор кандидатных ДНК-последовательностей проводят по результатам анализа доступности хроматина с помощью таких методов как DNase-seq MNase-seq или ATAC-seq. В некоторых вариантах реализации изобретения кандидатные ДНК-последовательности синтезируют in vitro и затем используют на следующих этапах способа.
[58] На этапе б) полученные кандидатные ДНК-последовательности встраивают в репортерные конструкции (Фиг. 2) с получением ДНК-библиотеки для МПРА. Клонирование кандидатных ДНК-последовательностей в репортерный вектор может осуществляться любым доступным методом генной инженерии, в том числе, сборкой по методу Гибсона, безлигазным клонированием, рестрикцией-лигированием и другими. В предпочтительном варианте сборка генетических конструкций, содержащих кандидатные ДНК-последовательности, осуществляется методом Гибсона. При этом в составе указанной ДНК библиотеки каждая репортерная конструкция включает одну ДНК-последовательность. В предпочтительном варианте реализации ДНК-библиотеку дополнительно амплифицируют путем трансформации бактериальных клеток с последующей культивацией этих клеток и выделением плазмидной ДНК. Ту же плазмидную ДНК используют для подготовки нормировочной библиотеки для секвенирования.
[59] Затем на этапе в) проводят трансфекцию полученной ДНК-библиотекой тех клеток, в которых хотят использовать искомые регуляторные элементы генома. В предпочтительном варианте реализации проводят трансфекцию эукариотических клеток, в том числе, клеток млекопитающих.
[60] Клетки, трансфицированные ДНК-библиотекой культивируют, а затем на этапе г) анализируют их транскриптом. В предпочтительном варианте реализации для анализа транскриптома используют метод RNA-seq. Структура репортерной конструкции, которая также является частью данного изобретения и будет подробно описана ниже, позволяет встроенной кандидатной ДНК-последовательности регулировать собственную транскрипцию. Таким образом, если конкретная кандидатная ДНК-последовательность обладает регуляторной активностью, в кДНК, полученной с мРНК трансфицированных клеток, будет встречаться эта конкретная кандидатная ДНК-последовательность. Чем выше уровень регуляторной активности конкретной кандидатной ДНК-последовательности, тем больше ее будет в пуле кДНК, если, например, исследуется энхансерная активность.
[61] На этапе биоинформатической обработки данных секвенирования амплифицируют кандидатные ДНК-последовательности в составе ДНК-библиотеки для МПРА и в составе кДНК-библиотеки, полученной путем обратной транскрипции с мРНК со специфическими праймерами к определенной последовательности мРНК, которая содержит репортерную часть с регуляторным элементом, из клеток, трансфицированных ДНК-библиотекой для МПРА. Указанную амплификацию проводят в двух технических репликах и секвенируют на подходящих под данную задачу платформах, например, на платформе Illumina MiSeq. Качество полученных данных анализируют с использованием программного обеспечения, например, FastQC, после чего удаляют некорректные прочтения. Из прошедших первый этап фильтрации данных выделяют те сиквенсы, которые соответствуют «пустому» вектору. Так как они не имеют регуляторной активности, то эти данные являются внутренним контролем относительно которого далее кандидатные ДНК-последовательности будут рассматриваться либо как энхансеры, либо как сайленсеры транскрипции. Производят подсчёт количества таких прочтений «пустых» векторов в ДНК-библиотеке для МПРА и кДНК-библиотеке. Оставшийся пул данных соответствует кандидатным ДНК-последовательностям, которые выравнивают на геном при помощи программного обеспечения, например программы Bowtie2.
[62] Далее для каждой кандидатной ДНК-последовательности подсчитывают количества прочтений в ДНК-библиотеке для МПРА и кДНК-библиотеке. Для выявления регуляторной активности кандидатной ДНК-последовательности полученные при подсчёте данные нормализируют при помощи программного обеспечения, например, DeSeq2: представленность каждой кандидатной ДНК-последовательности в данной библиотеке делится на коэффициент, пропорциональный общему количеству кандидатных ДНК-последовательностей в библиотеке. Далее при помощи программного обеспечения, например, DeSeq2, высчитывают Fold Change - отношение нормированных величин в кДНК-библиотеке по сравнению с ДНК-библиотекой. После подсчитывается величина E=log2(FoldChange), т. е. показатель, характеризующий изменение представленности кандидатной ДНК-последовательности в пуле отсеквенированных фрагментов. Если в результате транскрипции представленность фрагмента увеличилась по сравнению с другими фрагментами (log2 (FoldChange)>0), то мы можем с надёжностью утверждать, что данная кандидатная ДНК-последовательность увеличивает транскрипцию. Однако для того, чтобы рассматривать кандидатную ДНК-последовательность как, например, энхансер, необходимо принять за точку отсчёта log2 (FoldChange), подсчитанный на основе внутреннего контроля, т. е. «пустого» вектора.
[63] В некоторых вариантах реализации заявленный способ включает дополнительный этап подтверждения регуляторной активности выявленных регуляторных элементов генома или их комбинаций. Данный этап включает встраивание одного или нескольких выявленных регуляторных элементов генома в вектор экспрессии, включающий целевой ген (Фиг. 3). В одном варианте реализации целевой ген может быть геном, используемым для генной терапии, или геном, служащим для синтеза определенного белка в клетках-продуцентах. В предпочтительном варианте реализации целевой ген является репортерным геном. В предпочтительном варианте реализации регуляторные элементы генома для индивидуального анализа (Фиг. 4) получают с помощью ПЦР с использованием специфических праймеров к кандидатным ДНК-последовательностям и геномной ДНК исследуемых клеток в качестве матрицы. Эти продукты ПЦР встраивают в вектор экспрессии для последующего анализа. В предпочтительном варианте реализации вектор экспрессии включает минимальный промотор, для того, чтобы исключить влияние дополнительных регуляторных последовательностей на экспрессию целевого гена. Полученным вектором экспрессии трансфицируют клетки определенного типа и определяют уровень экспрессии целевого гена. В одном варианте реализации уровень экспрессии целевого гена могут определять на уровне кодируемого им белка. Например, могут использовать специфические антитела, узнающие белок, кодируемый целевым геном. В другом случае могут измерять флуоресценцию, если целевой ген кодирует репортерный флуоресцентный белок, например dsRED. В еще одном варианте реализации уровень экспрессии целевого гена определяют на уровне транскрипции. В этом случае, в предпочтительном варианте реализации, определение уровня транскрипции целевого гена осуществляют методом ПЦР в реальном времени. Данный этап позволяет определить уровень экспрессии целевого гена под контролем выявленного регуляторного элемента генома или их комбинации в определенном типе клеток.
[64] В одном из вариантов реализации уровень регуляторной активности одного или нескольких выявленных регуляторных элементов генома сравнивают с уровнем регуляторной активности известных регуляторных элементов. В качестве таких регуляторных элементов могут быть использованы вирусные энхансеры CMV или SV40. В этом случае получают вектора экспрессии со встроенными известными регуляторными элементами. Полученные вектора экспрессии, а также исходный вектор экспрессии, не содержащий никаких встроек, используют для трансфекции исследуемых клеток, после чего проводят измерение относительного уровня экспрессии мРНК целевого гена.
[65] Генетическая репортерная конструкция, используемая для получения ДНК-библиотеки для МПРА, также является предметом заявленного изобретения. Именно структура генетической репортерной конструкции является ключевым аспектом, позволяющим реализовать заявленный способ. Генететическая репортерная конструкция включает следующие элементы:
а) промотор как основной элемент для инициации транскрипции;
б) интрон;
в) открытая рамка считывания;
г) участок для встраивания кандидатной ДНК в открытой рамке считывания;
д) сигнал полиаденилирования.
[66] Промотор - основной элемент для инициации транскрипции. В предпочтительном варианте используют минимальный промотор при создании репортерной конструкции, чтобы исключить дополнительное влияние особенности структуры промотора на уровень экспрессии. В случае поиска энхансерных последовательностей, минимальный промотор позволяет корректно интерпретировать активацию и усиление работы именно минимального промотора.
[67] Интрон - некодирующая последовательность ДНК, необходимая для создания кДНК библиотек и корректного определения количества мРНК, транскрибируемой с матрицы плазмидной ДНК репортерного вектора или вектора экспрессии методом ПЦР в реальном времени. Праймеры для ПЦР в реальном времени и амплификации кДНК по матрице мРНК подбираются так, чтобы их отжиг не происходил на матрицу ДНК, содержащую интрон, но происходил на матрицу кДНК, синтезированной по матрице мРНК и не содержащей интрон в результате сплайсинга. Таким образом, в эксперименте исключаются учёт вклада продукта в уровень экспрессии с примеси плазмидной ДНК вектора и контаминация библиотек матрицей плазмидной ДНК репортерного вектора. Предпочтительно интрон в репортерном векторе расположен после промотора и перед участком для встраивания кандидатной ДНК-последовательности в открытой рамке считывания. Последовательность интрона может быть последовательностью любого известного интрона, использующегося в дизайне генетических конструкций для трансфекции клеток эукариот, например, химерный интрон бета-глобин/IgG.
[68] Участок для встраивания кандидатной ДНК-последовательности находится в открытой рамке считывания, которая представляет собой последовательность ДНК, кодирующей первые 20 аминокислот гена eGFP, учитывая старт-кодон. Транслируемый полипептид не дает функционального белка, 20 кодонов выступают в роли экзона и необходимы в качестве случайной последовательности, которая кодирует случайный белок и может транслироваться. Благодаря наличию данной открытой рамки считывания в репортерном векторе, успешно проходит сплайсинг и удаляется последовательность интрона из зрелой мРНК, что является необходимом условием для корректного создания кДНК-библиотек, а также корректного определения уровня экспрессии и контроля на примесь плазмидной ДНК репортерного вектора, с которой так же может амплифицироваться целевой продукт. Участок для встраивания кандидатной ДНК-последовательности может представлять полилинкер для удобства встраивания в репортерный вектор. Обязательным условием является его расположение между промотором и сигналом полиаденилирования.
[69] Сигнал полиаденилирования необходим для терминации транскрипции, ядерного экспорта, осуществления трансляции и стабильности мРНК. Векторы экспрессии млекопитающих в основном содержат сигналы полиаденилирования SV40, hGH, BGH и rbGlob, они включают мотив последовательности AAUAAA, который способствует как полиаденилированию, так и терминации. Из перечисленных SV40 late polyA и rbGlob polyA считаются более эффективными в терминации транскрипции. Допустимо использование других вариантов сигнала полиаденилирования или его фрагмента, которые соответствуют требованиям, указанным выше. Также, поли(А)-хвост может быть необходим для проведения реакции обогащения пула мРНК для дальнейшего получения кДНК-библиотек.
[70] Данный тип построения репортерного вектора подходит, в основном, для эукариотической системы экспрессии.
[71] Выявленные регуляторные элементы могут использоваться в получении конструкций для экспрессии целевых генов с последующей их встройкой в геном клеток-продуцентов для постоянной экспрессии целевого трансгена. Однако в этом случае для преодоления возможного влияния регуляторного элемента, например, энхансера, на «нецелевые» гены в векторе экспрессии используют последовательности инсуляторов, которые способны ограничить активирующее влияние.
[72] За счет структуры генетической репортерной конструкции кандидатная ДНК-последовательность в ее составе способна влиять на транскрипцию мРНК с собственной последовательности, в случае наличия регуляторной активности. Именно это позволяет реализовать заявленный способ.
[73] Способ, благодаря массовому параллельному репортерному анализу, даёт возможность оценить влияние того или иного элемента генома на экспрессию целевого гена в исследуемых клетках. Важной особенностью способа является его высокая производительность в условиях обработки большого количества данных.
[74] Способ позволяет выявлять различные регуляторные элементы, влияющие на транскрипцию, например, энхансеры и сайленсеры.
[75] Как было упомянуто ранее, выявление, например, тканеспецифичных энхансеров, представляется сложной задачей. Ключевыми сложностями для использования эндогенных энхансеров являются следующие аспекты: во-первых, энхансеры могут располагаться на различном расстоянии от регулируемого гена, во-вторых, они не имеют консенсусной последовательности, которая могла бы помочь их идентифицировать, что затрудняет их клонирование и использование в векторах экспрессии для управления экспрессией трансгена. Однако предлагаемый в данной заявке подход позволяет одновременно проверить множество фрагментов генома на наличие у них регуляторной активности, на примере поиска энхансеров, благодаря специфической генетической конструкции.
[76] Для того чтобы более четко продемонстрировать технические решения, предоставляемые настоящим изобретением, способ выявления регуляторных элементов генома будет подробно описан ниже в виде конкретных примеров.
ПРИМЕРЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Пример 1. Отбор кандидатных ДНК-последовательностей путем иммунопреципитации хроматина в линии клеток CHO-S и получение ДНК-библиотеки для массового параллельного репортерного анализа.
[77] Для проведения эксперимента клеточную линию CHO-S культивировали в среде DMEM+10% FBS (Fetal bovine serum) + 1% Pen/Strep (пенициллин/стрептомицин) в инкубаторе при 37С и 5% CO2. Перед проведением иммунопреципитации хроматина клетки выращивали в культуральном флаконе T-75 до достижения уровня конфлюентности ~90%.
[78] Процедуру иммунопреципитации хроматина проводили с использованием набора iDeal ChIP-qPCR (Diagenode), согласно рекомендациям производителя. Для иммунопреципитации хроматина использовали антитела, узнающие модификацию гистона Н3 (H3K27Ac), в качестве отрицательного контроля использовались антитела против IgG. Полученные кандидатные ДНК-последовательности встраивали в конструкцию для массового параллельного репортерного анализа с помощью сборки по Гибсону. Таким образом получали ДНК-библиотеку для массового параллельного репортерного анализа, в которой каждая конструкция включала одну кандидатную ДНК-последовательность, полученную на этапе иммуноприципитации хроматина. Полученную ДНК-библиотеку амплифицировали путем трансформации электрокомпетентных клеток E.coli с последующим выделением ДНК с использованием набора Qiagen Plasmid midi (QIAGEN).
Пример 2. Выявление регуляторной активности кандидатных ДНК-последовательностей.
[79] ДНК-библиотеку, амплифицированную в Примере 1, использовали для трансфекции клеток линии CHO-S. Клетки линии CHO-S трансфицировали с использованием полиэтиленимина (PEI). Клетки культивировали при стандартных условиях на чашке Петри (площадь 10 см2) до достижения конфлюентности ~70% (4-5 миллионов клеток). Для одной трансфекции использовали 8 мкг плазмидной ДНК, соотношение PEI (1 мг/мл):ДНК = 3:1. Ту же ДНК-библиотеку использовали для подготовки нормировочной библиотеки для секвенирования.
[80] Через 24 часа после трансфекции из клеток выделяли тотальную РНК с использованием реактива Trizol согласно инструкции производителя. Выделенную РНК обрабатывали ДНКазой I (NEB) для избавления от возможной контаминации геномной и/или плазмидной ДНК и далее очищали при помощи набора RNeasy. Качество образцов РНК оценивали при помощи гель-электрофореза, количество РНК оценивают при помощи спектрофотометра Nanodrop (ThermoFisher Scientific). Образцы РНК использовали для синтеза кДНК при помощи набора SuperScript IV. Полученные образцы кДНК обрабатывали РНКазой А с дальнейшей очисткой реакций с использованием магнитных частиц Ampure XP beads. При помощи ПЦР (junction PCR) амплифицировали пул целевых кДНК, полученных с тех мРНК, которые транскрибировались только с ДНК-библиотеки для массового параллельного репортерного анализа. Продукты ПЦР очищали с использованием магнитных частиц Ampure XP beads. Далее кДНК ещё раз подвергали амплификации с использованием индексированных праймеров Illumina i5/i7, с дальнейшей очисткой на магнитных частицах. Полученные в результате финальной амплификации библиотеки использовали для секвенирования на платформе Illumina Miseq.
[81] В результате анализа данных секвенирования для каждой кандидатной ДНК-последовательности определялиа величину log2(Fold Change). Выбирали те кандидатные ДНК-последовательности, для которых log2 (FoldChange)>0.В результате описанного массового параллельного репортерного анализа было обнаружено около 1000 регуляторных элементов генома, активирующих транскрипцию в клетках линии CHO-S.
Пример 3. Подтверждение регуляторной активности выявленных регуляторных элементов генома с помощью индивидуального репортерного анализа.
[82] Поскольку для клеток CHO-S МПРА был проведён впервые, было необходимо было дополнительно подтвердить регуляторную активность выявленных регуляторных элементов. Для этого провели индивидуальный репортерный анализ. Кроме того, МПРА даёт представление только об уровне регуляторной активности конкретной кандидатной ДНК-последовательности относительно регуляторной активности остальных кандидатных ДНК-последовательностей. Поэтому была проведена оценка изменения уровня экспрессии репортерного гена под влиянием вирусного энхансера CMV.
[83] Для того чтобы провести индивидуальный репортерный анализ регуляторных элементов генома их встраивали в репортерный вектор, включающий репортерный ген dsRED. В качестве положительного контроля использовали репортерный вектор со встроенным вирусным энхансером CMV. В данном эксперименте проанализировали регуляторную активность восьми регуляторных элементов генома, выявленных с помощью МПРА в Примере 2. Согласно полученным результатам, ни один из выявленных регуляторных элементов генома не показал активности сравнимой с активностью энхансера CMV (Фиг. 5). Тем не менее использование некоторых выявленных регуляторных элементов генома привело к достоверному повышению уровня экспрессии мРНК dsRED в линии клеток CHO-S. Различный уровень активации экспрессии репортеного гена позволяет подобрать один или несколько элементов генома, которые могут обеспечить определенный уровень экспрессии, например, терапевтического белка в данном типе клеток.
[84] Таким образом, были воспроизведены все этапы заявленного способа выявления регуляторных элементов генома. На примере репортерного гена было показано, что при встраивании в вектор экспрессии могут обеспечивать определенный уровень экспрессии репортерного гена или целевого гена , кодирующего белка при их дальнейшем клонировании в вектора экспрессии, получены генетические конструкции для анализа транскрипционной активности кандидатных ДНК-последовательностей и получена клеточная линия-продуцент на основе клеточной линии CHO-S и созданных генетических конструкций с выявленными регуляторными элементами.
[85] Вышеизложенное является лишь предпочтительным вариантом осуществления настоящего изобретения, но объем настоящего изобретения этим не ограничивается, и любой специалист в данной области может легко придумать изменения или в рамках технического объема настоящего раскрытия. Предполагается, что объем настоящего изобретения охватывает альтернативные варианты. Следовательно, объем охраны настоящего изобретения должен определяться объемом формулы изобретения.
Литература
1. Bartoli, M., J. Poupiot, A. Goyenvalle, N. Perez, L. Garcia, O. Danos, и I. Richard. 2006. «Noninvasive monitoring of therapeutic gene transfer in animal models of muscular dystrophies». Gene Therapy 13 (1): 20-28. https://doi.org/10.1038/sj.gt.3302594.
2. Dietz, Julienne, Frank Jacobsen, Heidi Zhuge, Nassam Daya, Anne Bigot, Wenli Zhang, Anja Ehrhardt, Matthias Vorgerd, и Eric Ehrke-Schulz. 2023. «Muscle Specific Promotors for Gene Therapy - A Comparative Study in Proliferating and Differentiated Cells». Journal of Neuromuscular Diseases 10 (4). https://doi.org/10.3233/JND-221574.
3. Emery, David W. 2011. «The use of chromatin insulators to improve the expression and safety of integrating gene transfer vectors». Human Gene Therapy 22 (6): 761-74. https://doi.org/10.1089/hum.2010.233.
4. Feichtinger, Julia, Inmaculada Hernández, Christoph Fischer, Michael Hanscho, Norbert Auer, Matthias Hackl, Vaibhav Jadhav, и др. 2016. «Comprehensive genome and epigenome characterization of CHO cells in response to evolutionary pressures and over time». Biotechnology and Bioengineering 113 (10): 2241-53. https://doi.org/10.1002/bit.25990.
5. Gruh, I., S. Wunderlich, M. Winkler, K. Schwanke, J. Heinke, U. Blömer, A. Ruhparwar, и др. 2012. «Human CMV immediate-early enhancer: a useful tool to enhance cell-type-specific expression from lentiviral vectors». Journal of Gene Medicine 14 (1): 44-53. https://doi.org/doi.org/10.1002/jgm.1122.
6. Ho, Steven C.L., Esther Y.C. Koh, Benjamin P.C. Soo, Sheng Hao Chao, и Yuansheng Yang. 2016. «Evaluating the use of a CpG free promoter for long-term recombinant protein expression stability in Chinese hamster ovary cells». BMC Biotechnology 16 (1): 1-14. https://doi.org/10.1186/s12896-016-0300-y.
7. Hunter, Molly, Ping Yuan, Divya Vavilala, и Mark Fox. 2019. «Optimization of Protein Expression in Mammalian Cells». Current Protocols in Protein Science 95 (1): 1-28. https://doi.org/10.1002/cpps.77.
8. Jervis, Adrian J., Pablo Carbonell, Sandra Taylor, Rehana Sung, Mark S. Dunstan, Christopher J. Robinson, Rainer Breitling, Eriko Takano, и Nigel S. Scrutton. 2019. «SelProm: A Queryable and Predictive Expression Vector Selection Tool for Escherichia coli». ACS Synthetic Biology 8 (7): 1478-83. https://doi.org/10.1021/acssynbio.8b00399.
9. Jones, J. Andrew, T. Duhan Toparlak, и Mattheos A.G. Koffas. 2015. «Metabolic pathway balancing and its role in the production of biofuels and chemicals». Current Opinion in Biotechnology 33: 52-59. https://doi.org/10.1016/j.copbio.2014.11.013.
10. Kim, Minsoo, Peter M. O’Callaghan, Kurt A. Droms, и David C. James. 2011. «A mechanistic understanding of production instability in CHO cell lines expressing recombinant monoclonal antibodies». Biotechnology and Bioengineering 108 (10): 2434-46. https://doi.org/10.1002/bit.23189.
11. Lee, Michael E., Anil Aswani, Audrey S. Han, Claire J. Tomlin, и John E. Dueber. 2013. «Expression-level optimization of a multi-enzyme pathway in the absence of a high-throughput assay». Nucleic Acids Research 41 (22): 10668-78. https://doi.org/10.1093/nar/gkt809.
12. Mehta, Abhishek Kumar, Subeer S. Majumdar, Parwez Alam, Neerja Gulati, и Vani Brahmachari. 2009. «Epigenetic regulation of cytomegalovirus major immediate-early promoter activity in transgenic mice». Gene 428 (1-2): 20-24. https://doi.org/10.1016/j.gene.2008.09.033.
13. Montaño-Samaniego, Mariela, Diana M. Bravo-Estupiñan, Oscar Méndez-Guerrero, Ernesto Alarcón-Hernández, и Miguel Ibáñez-Hernández. 2020. «Strategies for Targeting Gene Therapy in Cancer Cells With Tumor-Specific Promoters». Frontiers in Oncology 10 (December): 1-18. https://doi.org/10.3389/fonc.2020.605380.
14. Moritz, Benjamin, Peter B. Becker, и Ulrich Göpfert. 2015. «CMV promoter mutants with a reduced propensity to productivity loss in CHO cells». Scientific Reports 5: 1-8. https://doi.org/10.1038/srep16952.
15. Nair, Rajeevkumar Raveendran, Stefan Blankvoort, Maria Jose Lagartos, и Cliff Kentros. 2020. «Enhancer-Driven Gene Expression (EDGE) Enables the Generation of Viral Vectors Specific to Neuronal Subtypes». iScience 23 (3): 100888. https://doi.org/10.1016/j.isci.2020.100888.
16. Özdemir, Isa, и Maria Cristina Gambetta. 2019. «The role of insulation in patterning gene expression». Genes. https://doi.org/10.3390/genes10100767.
17. Pérez-González, Ana, и Elena Caro. 2019. «Benefits of using genomic insulators flanking transgenes to increase expression and avoid positional effects». Scientific Reports 9 (1): 1-11. https://doi.org/10.1038/s41598-019-44836-6.
18. Pontiller, Jens, Andreas Maccani, Martina Baumann, Ingo Klancnik, и Wolfgang Ernst. 2010. «Identification of CHO endogenous gene regulatory elements». Molecular Biotechnology 45 (3): 235-40. https://doi.org/10.1007/s12033-010-9278-1.
19. Rodova, Marianna, Renuka Jayini, Reddy Singasani, Elizabeth Chipps, и M. Rafiq Islam. 2013. «CMV promoter is repressed by p53 and activated by JNK pathway». Plasmid 69 (3): 223-30. https://doi.org/10.1016/j.plasmid.2013.01.004.
20. Romanova, Nadiya, и Thomas Noll. 2018. «Engineered and Natural Promoters and Chromatin-Modifying Elements for Recombinant Protein Expression in CHO Cells». Biotechnology Journal 13 (3). https://doi.org/10.1002/biot.201700232.
21. Seo, Sang Woo, Jae Seong Yang, Han Saem Cho, Jina Yang, Seong Cheol Kim, Jong Moon Park, Sanguk Kim, и Gyoo Yeol Jung. 2014. «Predictive combinatorial design of mRNA translation initiation regions for systematic optimization of gene expression levels». Scientific Reports 4: 1-7. https://doi.org/10.1038/srep04515.
22. Shirley, Jamie L., Ype P. de Jong, Cox Terhorst, и Roland W. Herzog. 2020. «Immune Responses to Viral Gene Therapy Vectors». Molecular Therapy 28 (3): 709-22. https://doi.org/10.1016/j.ymthe.2020.01.001.
23. Sou, Si Nga, Claire L. Harris, Rebecca Williams, Dorota Kozub, Fabio Zurlo, Yash D. Patel, Praveen Kallamvalli Illam Sankaran, и др. 2023. «CHO synthetic promoters improve expression and product quality of biotherapeutic proteins». Biotechnology Progress. https://doi.org/10.1002/btpr.3348.
24. Thaisuchat, Haruthai, Martina Baumann, Jens Pontiller, Friedemann Hesse, и Wolfgang Ernst. 2011. «Identification of a novel temperature sensitive promoter in cho cells». BMC Biotechnology 11 (1): 51. https://doi.org/10.1186/1472-6750-11-51.
25. Tossolini, Ileana, Agustina Gugliotta, Fernando López Díaz, Ricardo Kratje, и Claudio Prieto. 2022. «Screening of CHO-K1 endogenous promoters for expressing recombinant proteins in mammalian cell cultures». Plasmid 119-120. https://doi.org/10.1016/j.plasmid.2022.102620.
26. Tripathi, Nagesh K., и Ambuj Shrivastava. 2019. «Recent Developments in Bioprocessing of Recombinant Proteins: Expression Hosts and Process Development». Frontiers in Bioengineering and Biotechnology 7 (December). https://doi.org/10.3389/fbioe.2019.00420.
27. Wang, Xiao Yin, Jun He Zhang, Xi Zhang, Qiu Li Sun, Chun Peng Zhao, и Tian Yun Wang. 2016. «Impact of Different Promoters on Episomal Vectors Harbouring Characteristic Motifs of Matrix Attachment Regions». Scientific Reports 6 (May): 1-10. https://doi.org/10.1038/srep26446.
28. Zhou, Lu Yu, Shuang Zhang, Li Yun Li, Guo Yu Yang, и Lei Zeng. 2023. «Optimization of mammalian expression vector by cis-regulatory element combinations». Molecular Genetics and Genomics 298 (5): 1121-33. https://doi.org/10.1007/s00438-023-02042-0.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СОЗДАНИЯ ТРАНСГЕННЫХ ЖИВОТНЫХ СО СТАБИЛЬНЫМ И ВЫСОКИМ УРОВНЕМ ЭКСПРЕССИИ ЦЕЛЕВОГО БЕЛКА В МОЛОКЕ | 2012 |
|
RU2525712C2 |
| Индуцибельный промотор, вектор и клетка-хозяин на его основе | 2021 |
|
RU2820059C2 |
| Способ получения синтетической CG-богатой генетической последовательности и ее использование в растениях | 2016 |
|
RU2630650C1 |
| СПОСОБЫ И КОМПОНЕНТЫ ИНДУКЦИИ ОПУХОЛЬ-СПЕЦИФИЧЕСКОЙ ЦИТОТОКСИЧНОСТИ | 1998 |
|
RU2214280C2 |
| Нуклеиновая кислота, имеющая промоторную активность, и ее применение | 2022 |
|
RU2818112C2 |
| ВИРУСНЫЕ ВАКЦИНЫ | 2017 |
|
RU2778312C2 |
| ПОЛУЧЕНИЕ ВИРУСНОГО ВЕКТОРА | 2014 |
|
RU2658487C2 |
| СПОСОБ СОЗДАНИЯ ТРАНСГЕННЫХ ЛИНИЙ КЛЕТОК МЛЕКОПИТАЮЩЕГО СО СТАБИЛЬНЫМ И ВЫСОКИМ УРОВНЕМ ЭКСПРЕССИИ ТРАНСГЕННОГО БЕЛКА | 2009 |
|
RU2425882C1 |
| НУКЛЕАЗА PaCas9 | 2018 |
|
RU2706298C1 |
| КОНСТИТУТИВНЫЕ ПРОМОТОРЫ СОИ | 2014 |
|
RU2714724C2 |


Изобретение относится к биоинженерии, а именно к способу выявления регуляторных элементов генома, влияющих на транскрипцию, и использования их в биотехнологиях. Заявленный способ дает возможность массового выявления эндогенных регуляторных элементов генома, влияющих на транскрипцию, для улучшения характеристик процесса белковой наработки. Благодаря массовому параллельному репортерному анализу оценивается влияние того или иного элемента генома на экспрессию целевого гена в исследуемых клетках. Важной особенностью способа является его высокая производительность в условиях обработки большого количества данных. За счет структуры генетической репортерной конструкции для создания ДНК-библиотек, используемой в заявленном способе, кандидатная ДНК-последовательность в ее составе способна влиять на транскрипцию мРНК с собственной последовательности, в случае наличия регуляторной активности, что позволяет реализовать заявленный способ. 2 н. и 10 з.п. ф-лы, 5 ил., 3 пр.
1. Способ выявления регуляторных элементов генома, влияющих на транскрипцию, включающий этапы:
а) отбор кандидатных ДНК-последовательностей, обладающих признаками, характерными для регуляторных элементов генома, влияющих на транскрипцию;
б) встраивание полученных кандидатных ДНК-последовательностей в генетические репортерные конструкции с получением ДНК-библиотеки для массового параллельного репортерного анализа,
где каждая репортерная конструкция включает промотор, интрон, сайт встраивания кандидатной ДНК-последовательности в открытой рамке считывания и сигнал полиаденилирования,
причем в результате встраивания кандидатных ДНК-последовательностей каждая репортерная конструкция в ДНК-библиотеке содержит кандидатную ДНК-последовательность, расположенную между промотором и сайтом полиаденилирования;
в) введение полученной ДНК-библиотеки в клетки путем трансфекции;
г) выявление регуляторной активности кандидатных ДНК-последовательностей путем анализа транскриптома трансфицированных клеток.
2. Способ по п. 1, в котором отбор кандидатных ДНК-последовательностей проводят путем иммунопреципитации хроматина с использованием антител, узнающих белок, ассоциированный с известными регуляторными элементами генома, влияющими на транскрипцию.
3. Способ по п. 2, в котором иммунопреципитацию хроматина проводят с использованием антител, узнающих модификацию гистона H3 - (H3K27Ac).
4. Способ по п. 1, в котором анализ транскриптома осуществляют путем анализа результатов RNA-seq.
5. Способ по п. 1, дополнительно включающий этап подтверждения выявленной регуляторной активности индивидуальной кандидатной ДНК-последовательности путем встраивания этой индивидуальной кандидатной ДНК-последовательности в вектор экспрессии.
6. Способ по п. 5, дополнительно включающий определение уровня выявленной регуляторной активности индивидуальной кандидатной ДНК-последовательности путем сравнения с уровнем регуляторной активности одного или нескольких известных регуляторных элементов.
7. Способ по п. 5, в котором уровень выявленной регуляторной активности индивидуальной кандидатной ДНК-последовательности определяют методом ПЦР в реальном времени.
8. Генетическая репортерная конструкция для массового параллельного репортерного анализа, включающая:
а) промотор;
б) интрон;
в) открытую рамку считывания;
г) сайт встраивания кандидатной ДНК-последовательности, полученной с помощью иммунопреципитации хроматина с использованием антител, узнающих белки, ассоциированные с ДНК-последовательностями энхансеров и/или других регуляторных элементов генома;
д) сигнал полиаденилирования,
причем сайт для встраивания кандидатной ДНК-последовательности, расположенный в открытой рамке считывания, находится между промотором и сигналом полиаденилирования.
9. Конструкция по п. 8, в которой сайт для встраивания кандидатной ДНК-последовательности, расположенный в открытой рамке считывания, находится между интроном и сигналом полиаденилирования.
10. Конструкция по п. 8, пригодная для трансформации бактериальных клеток и способная к самовоспроизведению в бактериальных клетках.
11. Конструкция по п. 10, включающая ориджин репликации и один или несколько генов, обеспечивающих устойчивость к одному или нескольким антибиотикам.
12. Конструкция по п. 8, которую используют для трансфекции клеток млекопитающих.
| LETIAGINA A.E | |||
| et al., MPRAdecoder: Processing of the Raw MPRA Data With a priori Unknown Sequences of the Region of Interest and Associated Barcodes, Front Genet, 2021, vol | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| OMELINA E.S | |||
| et al., Optimized PCR conditions minimizing the formation of chimeric DNA molecules from MPRA plasmid libraries, BMC Genomics, 2019, vol | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
Авторы
Даты
2024-07-15—Публикация
2023-11-10—Подача