Изобретение относится к медицине, а именно к хирургии, и может быть использовано для курации (ведения) пациентов в периоперационном периоде (включающем в себя предоперационный, интраоперационный и послеоперационный периоды, или этапы) при хирургическом лечении стриктур проксимальной части бульбарного и мембранозного отделов уретры (БМО) методом заместительной уретропластики.
Стриктурная болезнь уретры - это частичное или полное сужение просвета мочеиспускательного канала. Поражение проксимальной части бульбарного и мембранозного отделов уретры является относительно редкой, но тяжелой патологией, определяющей развитие в последующем ряда осложнений в виде хронической задержки мочи, мочевой инфекции, уремии вплоть до летального исхода. Мембранозная уретра -это свободный отдел уретры, который пересекает тазовое дно и окружен дистальным мочевым сфинктером [1]. Гистологически уретра данного отдела покрыта нежным переходным многорядным столбчатым эпителием. Дистальнее расположенный бульбарный отдел укрыт спонгиозным телом, фиксирован и имеет иное строение эпителия [2, 3]. Общая протяженность его составляет 10-20 мм, а диаметр не превышает 5 мм [4]. Дистальнее мембранозного отдела уретры имеется так называемая переходная зона - бульбо-мембранозный переход, считающийся также частью проксимальной бульбарной уретры. Подобное двойное определение обусловлено анатомическими особенностями данного «перехода». Эпителий переходной зоны соответствует мембранозной уретре, а не бульбарной [2]. Эта короткая (не более 5-10 мм) переходная зона частично окружена спонгиозным телом (на протяжении нескольких миллиметров, в большинстве случаев только вентрально), а в проксимальной части (между спонгиозным телом и промежностной мембраной) свободна [5]. При ятрогенных повреждениях [6, 7, 8], а также дистракционньгх дефектах [9, 10] в первую очередь травмируется область мембранозного отдела и бульбо-мембранозного перехода. Таким образом, БМО уретры начинается от апекса предстательной железы (зоны Crista urethralis) и тянется через мочеполовую диафрагму до бульбы спонгиозного тела уретры (до устьев Куперовских желез -Orifiicium ductiex cretorii glandulae bulbourethralis). Общая протяженность его составляет 2-2,5 см [1].
Любой процесс, который вызывает поражение уретрального эпителия, может вызвать образование стриктуры уретры [11]. Наиболее распространенной причиной повреждений БМО уретры в развитых странах является ятрогенная травма. Предполагающими факторами являются анатомические и функциональные особенности БМО мочеиспускательного канала: прямой угол изгиба, наименьший диаметр просвета в сравнении с другими отделами уретры, непроизвольно и волевым образом (у пациентов в сознании) сомкнутый наружный мочевой сфинктер [7, 12]. Ятрогенные повреждения случаются при катетеризации мочевого пузыря, при трансуретральной резекции, при выполнении аденомэктомии или простатэктомии, и др. Следующей частой причиной является травматическое повреждение задней уретры при переломе костей таза и при тупой травме промежности. Поствоспалительные стриктуры уретры, связанные с гонореей, очень часто встречались в прошлом, но в настоящее время редки; роль же хламидийной или уреаплазменной инфекции в развитии стриктурной болезни уретры не установлена. Идиопатические и врожденные стриктуры, а также таковые изменения, связанные с развитием лихенизирующего склеродерматита и введением в уретру агрессивных химических соединений, встречаются реже.
Абсолютными показаниями к хирургическому лечению стриктур уретры является выявление уродинамически значимой (показатель максимальной скорости потока мочи менее 12 мл/сек или объем остаточной мочи более 100-150 мл) стриктуры уретры. Стриктуры мембранозного отдела уретры, в связи с малой нормальной площадью поперечного сечения, в большей части случаев изначально проявляются значимым нарушением мочеиспускания со снижением скорости потока мочи менее 5 мл/сек и объемом остаточной мочи более 100 мл. Потому их хирургическое лечение показано во всех выявленных случаях [8].
В настоящее время отсроченная анастомозирующая уретропластика (ЕРА -иссечение и прямой анастомоз/Excision and primary anastomosis) является «золотым» стандартом лечения [13] у пациентов с поражениями мембранозного отдела уретры и рекомендуется к применению при травмах уретры по прошествии 2-3 месяцев [там же], а при иных причинах развития поражения - в различные сроки «холодного» периода. Стандартная анастомозирующая операция методами Русакова [14] или Turner-Warwick [15] предполагает соединение неизмененных концов уретры без натяжения (ЕРА). Для этого при протяженных стриктурах БМО уретры в ряде случаев с целью выпрямления естественной кривизны уретры вынужденно рассекают межпещеристую перегородку, резецируют нижнюю ветвь лобковой кости, перемещают уретру (рерутинг) над ножкой кавернозного тела (операция Дж. Вебстера [16]). Все это представляется трудной, продолжительной и травматичной операцией, которая, однако, обеспечивает результативность более чем в 90% случаев [17-24]. Однако данная методика может привести к развитию инконтиненции, импотенции и других осложнений [23, 25]. Крупные (573 случая) исследования [26] влияния ЕРА БМО на эректильную функцию и удержание мочи свидетельствуют о 9,1% риске развития неудержания или недержания мочи и ухудшения эрекции после ЕРА в 86%.
Для восстановления нормальной проходимости уретры также применяется заместительная уретропластика. Способ предполагает замещение части уретры аутологичным, алло-ксенологичным или ткане-инженерным материалом. Он является одним из наиболее эффективных при реконструкциях других отделов уретры, но при вмешательствах в мембранозном отделе уступает по эффективности анастомотическим пластикам. Тем не менее, в случаях невозможности выполнения анастомозирующей операции (при протяженном дистракционном дефекте, стриктурах уретры более 7 см [27] или при неэффективности одно-двукратной анастомотической пластики [8]) рекомендуется реконструкция васкуляризированным, свободным или реваскуляризированным (тубуляризированным) трансплантатом [28, 29]. Выполнение пластики мембранозной уретры свободным (graft) или васкуляризированным (flap) трансплантатом представляется более простой задачей в сравнении с анастомозирующей операцией Вебстера-Русакова.
Слизистая оболочка ротовой полости (щеки, языка, губ) является предпочтительным трансплантатом для заместительной уретропластики [30-36]. При этом свободный (graft) оральный трансплантат предпочтительнее васкуляризированного (flap) кожного трансплантата в связи с меньшей частотой рецидива заболевания [20]. Качество жизни пациентов после операций с использованием буккальных графтов значимо выше, чем при использовании других трансплантатов. Это объясняется меньшим риском развития дриблинга, незначительной травматичностью при заборе материала и отсутствием его мацерации в последующем [37, 38]. Оральный трансплантат обладает рядом преимуществ перед иными трансплантатами: большей гистосовместимостью со слизистой уретры; большей физико-химической резистентностью; значительным местным иммунитетом; выраженной склонностью к неоангиогенезу; легкой доступностью для забора [39]. Все свои особенные свойства пересаженный оральный трансплантат сохраняет и спустя много лет, не подвергаясь метаплазии под воздействием мочи [40].
Программа ускоренного выздоровления (ПУВ), Fast Track surgery (FTS), а также ERAS (enhanced recovery after surgery/rapid recovery after surgery programs) -мультимодальная и мультидисциплинарная стратегия лечения, предназначенная для сокращения сроков нетрудоспособности и улучшения качества оказания медицинской помощи. Данная программа включает подготовку на предоперационном этапе, использование минимально инвазивной техники выполнения хирургического вмешательства и активное ведение послеоперационного.периода с целью уменьшения сроков стационарного лечения, времени реабилитации и максимально быстрого возвращения пациентов к обычной жизни. Одним из ключевых факторов успешности ПУВ является внедрение мультидисциплинарного взаимодействия на всех этапах обследования и лечения [41].
Первым систематический подход в формировании программы ускоренного выздоровления применил Г. Келет в 1995 году, опубликовавший серию статей, посвященных различным аспектам стратегии [42, 43]. В том числе были представлены результаты клинического исследования программы ускоренного выздоровления после колоректальных вмешательств на 18 пациентах. Сформулированы выводы: сбалансированная анальгезия, ранняя мобилизация и пероральное послеоперационное питание способны сократить сроки восстановления [44]. Шестью годами позднее совместно с Д. Вилмором профессор Келет опубликовал окончательно сформулированную концепцию стратегии «fast track surgery» [45]. Представленные публикации дали старт разработке аналогичных программ в смежных хирургических специальностях, в том числе и в урологии.
В 1996, 1997 и 1999 годах опубликованы исследования ускоренного выздоровления при выполнении трансуретральной резекции и вапоризации предстательной железы [46-48]. Дальнейшее концептуальное изучение привело к формированию протокола, допускающего досуточное пребывание и раннее удаление мочевого катетера с сопоставимым риском развития осложнений [49].
В последующем понимание Fast track было усложнено, и в 2000 году дан старт новой, более сложной стратегии ускоренного выздоровления после хирургического лечения (ERAS) [50]. С каждым годом отмечается все большее вовлечение медицинских работников в разработку и применение программ.
Термин «программа ускоренного выздоровления» (ПУВ) был введен решением заседания Российского общества хирургов под руководством И.И. Затевахина в 2015 году, как официальное российское наименование новой мультимодальной стратегии [51]. При этом ошибочно считать, что в основе ПУВ лежит только ранняя выписка из больницы. Ускоренная реабилитация и сокращение сроков пребывания в стационаре - это результат внедрения новых подходов лечения хирургических больных, отражающий их эффективность [51, с. 14].
При разработке и внедрении программ ускоренного выздоровления важно понимать, что разрабатываемые меры носят не только организационный характер, но и напрямую влияют на физиологию и патофизиологию операционной травмы. Хирургическая травма, боль, кровотечение, голодание, ограничение мобильности - наиболее важные факторы, негативно влияющие на организм пациента. Их влияние носит не изолированный, а синергетический характер, и способно значительно преумножаться по непредсказуемому сценарию. Исходом является активация цепочки воспалительных реакций и симпатической нервной системы, что приводит к нарушению обмена инсулина. Как следствие, происходит нарушение распределения не только углеводов, но и липидов, и белков. Происходит централизация потребления глюкозы, снижение потребления ее на периферии и, как следствие, развивается гипергликемия. Начинается разрушение гликогена, запускается протеолиз. Указанный механизм особо важен для пациентов с исходным нарушением обмена углеводов [52]. Причем нельзя объяснять возникновение осложнений и замедление реабилитации пациентов только одной физической составляющей. Важным является психоэмоциональное состояние больного перед операцией, его реакция на предстоящую операцию и готовность сотрудничать с медперсоналом в процессе лечения [51, с. 15].
Поддержание нормального уровня гликемии обеспечивается двумя основными механизмами: поглощение глюкозы тканями и ее выработка печенью. Под воздействием хирургического стресса происходит высвобождение катехоламинов (катехоламины, глюкагон, кортизол, гормон роста) и провоспалительных цитокинов (фактор некроза опухоли-альфа [TNF-α]; интерлейкины: IL-1, IL-6). Как следствие увеличивается выработка глюкозы и снижается ее потребление в тканях, возрастает уровень гликемии.
Формально считается, что гипергликемический ответ способствует лучшей сопротивляемости тканей стрессу, за счет лучшего обеспечения энергией. В первую очередь это необходимо клеткам крови, клеткам нервной системы и иммунным клеткам. Однако воздействие катехоламинов приводит к ингибированию инсулиннезависимого мембранного транспорта глюкозы в миокарде и скелетной мускулатуре и экспрессии в клетках головного мозга и иммунных клетках. Так как обмен указанных клеток не регулируется инсулином, это приводит к их перегрузке глюкозой, развитию гликозилирования внутриклеточных белков, деактивации иммуноглобулинов, снижению хемотаксиса и фагоцитарной активности нейтрофилов [53]. Итогом становится избыток супероксидных радикалов, митохондриальная дисфункция и апоптоз. Закономерным исходом становится ухудшение результатов хирургического лечения даже при небольшом возрастании гликемии [54]. Пациенты с гипергликемией натощак имеют в восемнадцать раз большие риски послеоперационной летальности, продленной госпитализации и риски развития осложнений в сравнении с пациентами с нормальным уровнем глюкозы крови [55, 56].
Важно отметить, что гипергликемия способствует развитию послеоперационных, в том числе хронических болей. А коррекция гликемии позволяет снизить послеоперационную болезненность и потребность в анальгетиках [53]. Также гипергликемия приводит к неврологическим расстройствам центральной нервной системы, таким как расстройство личности и снижение когнитивной функции [57]. В крупном когортном исследовании на более чем шестидесяти тысячах пациентов установлено (р<0,003), что периоперационная гипергликемия приводит к увеличению риска развития осложнений и послеоперационной летальности [58].
Инсулинорезистентность - это любое состояние, сопровождающееся снижением отзывчивости (изменение максимального ответа на инсулин при неизменной концентрации) или чувствительности (влияние концентрации инсулина на достижение эффекта) к инсулину. Снижение чувствительности связано с изменением взаимодействия с рецепторами, а уменьшение ответа - с пост рецепторным взаимодействием [59]. В рамках хирургического стресса развивается именно изменение чувствительности к инсулину. Это обусловлено высвобождением контринсулярных (и других контррегуляторных) гормонов [60], активирующих катаболизм, подавляющих выработку инсулина и его периферическое действие. Также в развитии инсулинорезистентности принимают участие медиаторы воспаления, например интерлейкин 6 [61, 62]. Послеоперационная инсулинорезистентность достигает максимального патофизиологического эффекта примерно через сутки после хирургической травмы и сохраняется до двух-трех недель. На длительность и выраженность резистентности влияет объем (инвазивность) и продолжительность травмы, иммобилизация после операции, вид анестезиологического пособия, кровопотеря, послеоперационное голодание, общее физическое состояние организма, меры преабилитации и реабилитации [63, 64]. Практический вывод - минимизация операционной травмы и уменьшение времени операции, снижение кровопотери, оптимизация периоперационного режима питания, ранняя мобилизация, меры реабилитации способствуют уменьшению выраженности послеоперационной инсулинорезистентности.
Белковый гомеостаз достигается балансом катаболизма и анаболизма. Хирургический стресс приводит к активации симпатической и депрессии парасимпатической нервной системы, что реализуется преобладанием катаболизма. Белки скелетной мускулатуры подвергаются протеолизу, образовавшиеся аминокислоты трансформируются печенью в эндогенную глюкозу [65]. На фоне дисбаланса между катаболизмом и анаболизмом происходит потеря структурного и функционального белков организма [65]. Инсулинорезистентность удваивает суточную потерю белка [51, 66]. Инсулинорезистентность на фоне парентерального питания усугубляет белковый дисбаланс, что приводит к быстрой атрофии мышц [67]. Атрофические изменения скелетной мускулатуры сохраняются в течение пяти-восьми лет после перенесенной операции [68].
В настоящее время количество и качество рандомизированных исследований, посвященных изучению применения ПУВ в реконструктивной урологии, чрезвычайно мало. Существующие исследования носят ограниченный характер. Это работы случай-контроль, пилотные группы, либо недостаточно качественные клинические исследования. Таким образом, разработка и внедрение способа периоперационной курации (ведения) пациента при оперативном лечении стриктур уретры методом заместительной уретропластики - актуальная задача.
Известны способы периоперационного ведения пациентов при разработке и внедрении программы ускоренного выздоровления в хирургии [Затевахин, И.И. Программа ускоренного выздоровления хирургических больных. Fast track / И.И. Затевахин, К.В. Лядова, Пасечник И.Н. - Москва: ГЭОТАР-Медиа, 2017. - 208 с.]. Описаны особенности ПУВ на всех этапах курации пациента, а также представлено несколько протоколов в торакоабдоминальной хирургии и онкологии. Суммированы основные компоненты ПУВ. В дооперационном периоде это: консультация на догоспитальном этапе, психологическая подготовка, нутритивная поддержка, отказ от голодания, углеводный напиток, антибиотикопрофилактика, профилактика тромботических осложнений, отказ от рутинного назначения премедикации. В операционном периоде: малоинвазивная хирургия, использование короткодействующих анестетиков, анальгетиков, гипнотиков и управляемых мышечных релаксантов, цель-ориентированная инфузионная терапия, поддержание нормотермии, отказ от рутинной установки зондов и дренажей, кровосберегающие технологии. На послеоперационном этапе: мультимодальное послеоперационное обезболивание, профилактика тошноты и рвоты, раннее энтеральное питание, ранняя мобилизация больных, раннее удаление мочевого катетера, аудит осложнений и исходов. Подчеркивается, что деление на этапы достаточно условное, так применение кровосберегающих технологий затрагивает весь периоперационный период, начиная с коррекции анемии до операции и кончая рациональным использованием антикоагулянтов для профилактики послеоперационных тромботических осложнений. То же самое относится и к нутритивной поддержке, которая неразрывно связана с инфузионной терапией и профилактикой послеоперационной тошноты и рвоты. Научная работа представляется полноценным и концептуальным исследованием проблемы ускоренного выздоровления в хирургии. Недостатком предлагаемых способов является, прежде всего, то, что конкретно урологический профиль в данной работе не представлен.
Известно применение отдельных элементов ПУВ, преимущественно мультимодального обезболивания и спинальной анестезии в детской урологической практике [Сатвалдиева, Э.А. Использование Fast-Track в детской урологии / Э.А. Сатвалдиева, М.У. Шакарова, И.Б. Маматкулов и др. // Урология. - 2022. - №4. - С. 52-55. DOI: 10.18565/urology.2022.4.52-55]. В сравнении представлен анализ 42 случаев пациентов с урологическими заболеваниями, прооперированных с применением спинальной анестезии. Авторы подчеркивают, что, поскольку ни один из известных методов общей анестезии не способен полноценно блокировать прохождение ноцицептивных импульсов ни на спинальном, ни даже на супраспинальном уровне и не предотвращает развития ответной реакции на хирургический стресс, сбалансированная регионарная анестезия (РА) в педиатрии рассматривает блокады не как альтернативу общей анестезии, а как дополнение к последней, позволяя значительно уменьшать концентрацию и дозировки ингаляционных, а также системных анестетиков и опиоидов. РА входит в обязательный компонент технологии Fast-Track. РА является наиболее эффективным способом прерывания (торможения) ноцицептивной информации на периферическом нейрональном и спинальном уровнях. Научная работа выполнена на базе Ташкентского педиатрического медицинского института. В результате исследования установлено, что мультимодальное обезболивание достоверно снижает стресс-индуцированные реакции, в том числе гемодинамические и метаболические. Недостатком данного исследования является то, что акцент сделан в основном только на одном компоненте концепции ERAS - использовании регионарной анестезии и мультимодального обезболивания.
Известен способ применения программы раннего восстановления пациентов при различных урологических вмешательствах [Кутлуев, М.М. Наш опыт применения программы раннего восстановления пациентов при различных урологических вмешательствах / М.М. Кутлуев, Р.И. Сафиуллин // Медицинский Вестник Башкортостана. - 2017. - Т. 12. - №3 (69). - С. 41-44]. На малых группах (по 6 случаев) представлен опыт применения концепции ERAS при уролитиазе и онкоурологических операциях (лапароскопические вмешательства - лапароскопическая резекция почек, лапароскопическая нефрэктомия, эндоскопическое вмешательство - трансуретральная уретерореноскопия с литоэкстракцией).
Протокол ERAS включал:
- Информирование пациента;
- Отказ от подготовки кишечника (только для лапароскопических операций, при эндоскопических вмешательствах проводилась очистительная клизма за 1 час до операции в объеме 1500 мл);
- Отказ от полного голодания (прекращение приема пищи за 6 часов до операции);
- Парентеральное введение жидкости перед операцией (за 2 часа до операции);
- Периоперационная антибиотикопрофилактика (раствором «Цефтриаксон» 1,0 внутривенно);
- Адекватный объем периоперационной инфузии;
- Применение минимально инвазивных технологий;
- Перевод из отделения реанимации и интенсивной терапии (ОРИТ) в первые 2-3 часа (только для лапароскопических операций, поскольку при эндоскопических вмешательствах пациенты в ОРИТ не поступали);
- Использование НПВС;
- Удаление дренажей и уретрального катетера в первые сутки;
- Раннее энтеральное питание (в течение первых 24 часов, при лапароскопии - в первые сутки жидкая пища, при эндоскопических операциях - с первых суток полный объем питания);
- Ранняя мобилизация;
- Ранняя выписка из стационара (на 3-й сутки).
Научная работа выполнена на базе ФГОУ ВО «Башкирский государственный медицинский университет» Минздрава России. Отмечена экономическая целесообразность применения ПУВ и важная роль мультидисциплинарного взаимодействия при ее внедрении. Использование предложенной программы ранней реабилитации пациентов позволяет сократить сроки госпитализации. Недостатком является то, что в исследовании были применены только отдельные элементы протокола ERAS, как и отметили сами авторы (с. 43). Также существенными недостатками являются: использование дренажей, несмотря на их ранее удаление; механическая очистка кишечника путем очистительных клизм для группы пациентов, которым проводились эндоскопические операции; при лапароскопических вмешательствах - отказ от дополнительного использования регионарной (эпидуральной) анестезии, вместо чего использовался только интубационный наркоз с ранним переводом пациента на самостоятельное дыхание.
Известен способ применения fast-track стратегии в ведении пациентов при выполнении перкутанной нефролитотомии (ПИЛ) при лечении крупных и коралловидных камней почек [Мазуренко, Д.А. Стратегия «fast-track» послеоперационного ведения пациентов после перкутанной, нефролитотомии / Д.А. Мазуренко, А.В. Живов, Е.В. Берников и др. // Экспериментальная И Клиническая Урология. - 2016. - №1. - С. 36-40; Мазуренко Д.А., Берников Е.В., Нерсисян Л.А., Дунец К.А., Енгай В.А., Гаджиев Н.К., Старцев В.Ю. Новая концепция послеоперационного ведения пациентов с конкрементами почек // Современные проблемы науки и образования. - 2017. - №3. - с. 7. DOI: 10.17513/spno.26394].
Дооперационная стратегия:
- визуализация + планирование доступа;
- исключение/лечение инфекций мочевыводящих путей;
- определение факторов риска;
- отказ от очищения кишечника;
- информирование пациента о стратегии Fast track. Интраоперационная стратегия:
а) оптимизация анестезиологического пособия:
- антибиотикопрофилактика (в течение 7-10 дней, использовались препараты широкого спектра действия);
- использование анестетиков короткого действия;
- в некоторых случаях использование регионарной анестезии;
- в некоторых случаях использование перинефральной блокады.
б) оптимизация хирургического пособия:
- подогрев ирригационной жидкости (профилактика гипотермии);
- работа на минимальном внутрилоханочном давлении;
- использование кожухов;
- низкое давление подачи жидкости, предотвращение перерастяжения ЛМС при ретроградном и антеградном введении контрастных препаратов;
- методика без ретроградной катетеризации и контрастирования чашечно-лоханочной системы;
- форсированный диурез в конце операции;
- миниатюризация инструментов;
- бездренажные методики (Tubeless, Totally tubeless);
- профилактика кровотечения (использование баллонных нефростом, каутеризация хода, использование клеев, матриц для закрытия хода, профилактика смещения нефростомы).
В исследование ПУВ при выполнении ПНЛ включено более 67 случаев, научная работа выполнена на базе Институт последипломного профессионального образования ФГБУГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России. В результате проведенного исследования установлено, что программа ускоренного выздоровления позволяет вдвое сократить срок госпитализации с сопоставимыми рисками развития осложнений. Стратегия fast-track хирургии при выполнении ПНЛ позволяет уменьшить стоимость лечения и минимизировать распространение внутрибольничных инфекций. В качестве недостатков данного способа можно отметить то, что он представляет результаты применения только отдельных элементов стратегии ПУВ и их влияние на исходы лечения, например, предварительная подготовка к операции (преабилитация) включает выявление и лечение инфекций мочевыводящих путей, не распространяясь на выявление и коррекцию иных заболеваний (сердечно-сосудистой системы и т.д.), также в данном исследовании не уделено достаточно внимания разработке протокола ведения пациента в послеоперационном периоде и реабилитации пациента.
Известны клинические рекомендации международного сообщества «ERAS Society» по профилю «урология» и «онкология» от 2013 года, которые представляют протокол ускоренного выздоровления при выполнении радикальной цистэктомии [73]. Протокол состоит из 22 элементов:
I. Предоперационный этап.
1. На предоперационном этапе пациенту должно быть проведено консультирование об этапах и исходах лечения, особенно стоит сосредоточиться на формировании уростомы, ее особенностям и необходимым мерам ухода.
2. Предоперационная подготовка должна включать отказ от употребления алкоголя, табакокурения и повышение физической активности не менее чем за месяц до планируемой операции. Также следует оценить и корригировать нутритивный статус, возможную анемию.
3. Не рекомендуется проводить предоперационную подготовку кишечника.
4. Пациентам без сахарного диабета показана предоперационная углеводная загрузка.
5. Разрешается прием прозрачных жидкостей за 2 часа до индукции общей анестезии. Прием твердой пищи разрешен за 6 часов до общей анестезии.
6. Избегание седативных средств длительного действия для преанестезии для улучшения послеоперационного восстановления и мобилизации. Препараты короткого действия можно безопасно вводить, они облегчают позиционирование пациента и установку эпидурального катетера.
7. Профилактика тромбоэмболических осложнений: компрессионные чулки и использование низкомолекулярного или нефрагментированного гепарина, причем следует проводить длительную расширенную профилактику в течение 4 недель. Соблюдать 12-часовой интервал между инъекциями и эпидуральными манипуляциями.
II. Интраоперационный этап.
8. Эпидуральная анальгезия. Рекомендуется использование торакальной эпидуральной анальгезии в течение 72 часов после цистэктомии.
9. Минимально инвазивный подход. При этом авторы исследования не рекомендовали лапароскопическую/роботизированную цистэктомию, поскольку на момент издания рекомендаций (2013 г. ) не был накоплен достаточный опыт клинических испытаний и не были получены долгосрочные результаты.
10. Не рекомендуется отказ от страхового дренирования из-за высокой вероятности утечки мочи.
11. Рекомендована однократная антимикробная профилактика - до разреза кожи и менее чем за 1 час до операции (однократный периоперационный курс цефалоспоринов 2-го или 3-го поколения). Рекомендована обработка операционного поля средством для обработки кожи на основе хлоргексидина и спирта.
12. Рекомендуется сочетание эпидуральной анестезии и общего наркоза с применением миорелаксантов, интраоперационного контроля жизнедеятельности и BIS-мониторинг.
13. Рекомендуется строгий контроль жидкости для достижения эуволемии посредством трансэзофагеальной допплерографии или других методов. Возможно применение вазопрессоров при гипотонии.
14. Требуется особенно строгое поддержание нормотермии, в том числе в послеоперационном периоде при продленной эпидуральной анестезии.
III. Послеоперационный период.
15. Рекомендуется раннее прекращение назогастральной интубации. Ее рутинное продление после операции не рекомендуется.
16. Оптимальная продолжительность наружного стентирования и возможной катетеризации артифициального мочевого пузыря не установлена.
17. Профилактика послеоперационной кишечной непроходимости для восстановления функции кишечника включает жевание резинки и прием магнезии внутрь.
18. Всем пациентам рекомендовано проведение мультимодальной профилактики тошноты и рвоты.
19. Послеоперационный мультимодальный контроль боли должен включать продленную эпидуральную анестезию в течение 48-72 часов после операции.
20. Рекомендуется ранняя мобилизация, 2 часа вне постели в первые сутки и 6 часов вне постели на вторые сутки.
21. Раннее послеоперационное питание должно быть начато через 4 часа после операции.
22. Все пациенты должны быть проверены на соответствие и возможность выполнения протокола. Должен осуществляться аудит результатов применения протокола.
Результаты применения протокола ERAS при выполнении радикальной цистэктомии были представлены в виде систематического обзора и мета-анализа данных в 2021 году. Всего в анализ включено 15 исследований, 1853 случая, из которых 953 по протоколу ERAS. Применение протокола ускорило восстановление самостоятельного опорожнения кишечника (ОШ - 1,30; 95% ДИ от -1,90 до -0,70; р<0,00001) и сократило длительность госпитализации (ОШ -0,49; 95% ДИ от -0,77 до -0,20; р<0,00001), где ДИ -доверительный интервал, ОШ - отношение шансов. Вероятность повторного обращения и риски развития осложнений оказались сопоставимы [74].
Можно выделить целый ряд недостатков клинических рекомендаций «ERAS Society». В первую очередь, данная клиническая рекомендация является единственной по разделу «урология» и рассчитана на протокол ведения пациентов при конкретной операции - радикальной цистэктомии. Сами авторы отмечают ограниченность проведенного исследования - необходимы дополнительные данные, чтобы доказать эффективность ERAS при применении к основным урологическим процедурам. Следует отметить, что на данный момент рекомендации по пункту 3 несколько устарели, в настоящее время этот раздел подразумевает отказ от принудительного механического очищения, однако применение оральных кишечных антисептиков или антибиотиков перед операцией целесообразно [75]. По пункту 10 рекомендация использовать страховой дренаж во избежание утечки мочи относится к слабым предикторам вследствие отсутствия убедительных доказательств и является более мнением авторов, чем результатом научного исследования. Уменьшить вероятность утечки и сократить сроки дренирования возможно с помощью оптимизации хирургической техники или применением естественных или искусственных клеев. Особенно актуальна данная мера при реконструктивных вмешательствах [76, 77]. По пункту 11 подобная схема профилактики противоречит современной концепции ERAS: вследствие высокого риска утечки анастомоза кишечного или мочевого, а также учитывая общую высокую травматичность и продолжительность операции, следует проводить антибиотикопрофилактику в течение 5 дней после операции, а спиртовые антисептики не рекомендуются к применению из-за повышенного риска возгорания при работе с источниками высоких энергий (коагуляторами) [51, 78]. Что касается рекомендаций по пункту 16: сформулированы общие рекомендации - уретральный катетер подлежит удалению так скоро, как это возможно [79]. Относительно пункта 18 следует напомнить, что установлен современный алгоритм профилактики: дексаметазон 4 мг и один из препаратов группы сетронов [80].
Известен способ ведения пациентов в периоперационный период при лапароскопическом хирургическом лечении ряда заболеваний в урологии: резекции почки, нефрэктомии, иссечении кист почки, нефроуретерэктомии, реконструктивных операциях на верхних мочевых путях, аденомэктомии, уретеролитотомии, пиелолитотомии, операциях при раке предстательной железы и мочевого пузыря [Глыбочко, П.В. Хирургия быстрого восстановления в условиях урологического стационара: трудности и перспективы / П.В. Глыбочко, Е.А. Безруков, Т.М. Алексеева и др. // Медицинский Вестник Башкортостана. - 2017. - Т. 12. - Хирургия Быстрого Восстановления В Условиях Урологического Стационара. - №3(69). - С. 118-125]. В ретроспективное исследование включено более 1500 случаев, научная работа выполнена на базе ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России. Предоперационный период включает в себя:
- информирование и обучение пациента (что уменьшает беспокойство и страх пациента перед операцией и ускоряет процесс выздоровления и срок выписки);
- мультиспиральная компьютерная томография и 3D-моделирование для предоперационного планирования;
- обязательная оценка исходного нутритивного статуса пациента, выявление трофологической недостаточности с последующей ее коррекцией (коррекция белково-энергетической недостаточности врачом-нутрициологом; коррекция анемии при взаимном сотрудничестве анестезиологов, хирургов и трансфузиологов - назначение препаратов железа, эритропоэтинов, в тяжелых случаях переливание компонентов крови);
- отказ от механической подготовки кишечника (вместо этого - переход на бесшлаковую диету за 2-3 дня до операции);
- отказ от голодания (вплоть до 2 часов до начала наркоза; твердую пищу разрешается принимать за 6 часов до наркоза);
- использование пищевых углеводных смесей (перед сном накануне операции и за 2 часа до операции прием углеводов (сладкий чай, сок, сиппинги до 200 мл);
- отказ от премедикации рутинными седативными препаратами (вместо этого назначают нестероидные противовоспалительные средства (НПВС) в сочетании с антигистаминными препаратами; препарат «Дексдор» (дексмедетомидин);
- профилактика тромбоэмболических осложнений (ТЭО): использование эластической компрессии нижних конечностей начинается до операции, продолжается во время и после нее вплоть до восстановления двигательной активности; также назначение медикаментозной профилактики (гепарин не позднее, чем за 2 часа, клексан не позднее, чем за 12 часов до операции; продолжение профилактики ТЭО после операции, в стационаре - парентерально, амбулаторно - перорально (ксарелта, продакса, эликвис).
Интраоперационый период включает:
- антибиотикопрофилактику (не ранее, чем за 60 минут до начала операции при использовании антибиотиков цефалоспоринового ряда), в зависимости от антибиотикограммы (больной госпитализируется в стационар только при наличии бактериологического исследования мочи);
- мультимодальная аналгезия, что включает регионарную (эпидуральную) анальгезию, использование анестетиков короткого действия;
- ограничение периоперационной инфузионной терапии;
- отказ от рутинной назогастральной интубации;
- нормотермию (все растворы подогреваются, а также обеспечивается поддержание оптимального температурного режима в операционной);
- отказ от использования дренажей;
- минимальноинвазивные операции (лапароскопические и роботассистированные хирургические вмешательства).
Послеоперационный период включает в себя:
- эффективное обезболивание (эпидуральная анестезия либо мультимодальное обезболивание на основе нестероидных противовоспалительных средств (НПВС) -парацетамола и нефопама);
- профилактика тошноты и рвоты (в том числе назначение дексаметазона и ондансетрона);
- ранняя мобилизация (нахождение пациента вне постели в течение 2-х часов в день операции и не менее 6 часов вне постели в последующие сутки);
- раннее энтеральное питание (потребление пациентом более 300 мл жидкости в день операции и прекращение внутривенных инфузий в 1-й день после операции; прием жидкой пищи через 6 часов после операции, а в течение 1-й 2-го дней вместе с жидким питанием назначают твердую пищу).
В результате проведенного исследования установлено, что пациенты по протоколу ускоренного выздоровления имели сравнительно более низкий показатель послеоперационных осложнений и меньшую продолжительность госпитализации. По совокупности существенных признаков данный способ ведения пациентов в периоперационный период при применении «хирургии быстрого восстановления» в условиях урологического стационара принят за наиболее близкий аналог (прототип). Недостатком прототипа является то, что работа представляет результаты применения только отдельных возможных элементов стратегии ПУВ и их влияние на исходы лечения, в частности, не описано решение вопроса касательно срока катетеризации пациентов, недостаточно проработаны этапы преабилитации и послеоперационного восстановления.
В качестве общего недостатка выявленных аналогов и прототипа предлагаемого способа следует отметить, что разработка способа периоперационной курации пациентов должна осуществляться для конкретного заболевания и для определенного конкретного метода хирургического лечения. Спектр компонентов ПУВ, которые используются у конкретного пациента, определяется зоной операции, характером хирургического вмешательства, возможностями лечебного учреждения. В колоректальной хирургии акцент делается на нутритивную подготовку, а при операциях на суставах повышенное внимание уделяется кровосберегающим технологиям и профилактике тромботических осложнений. ПУВ представляет собой динамически меняющуюся концепцию, и появление методов с доказанной эффективностью лечения позволяет ей непрерывно развиваться. [51, с. 16-17]. Вне зависимости от хирургической дисциплины существует возможность разработки и оптимизации программы под конкретные нозологии. Можно сделать однозначный вывод - нет никаких препятствий для расширений применения ПУВ на другие хирургические процедуры в рамках профиля «урология», в том числе реконструктивные вмешательства по урологическому профилю.
Задачей предлагаемого изобретения является разработка способа периоперационной курации пациентов при хирургическом лечении стриктур проксимальной части бульбарного и мембранозного отделов уретры (БМО) методом заместительной уретропластики, отвечающего требованиям концепции программы ускоренного выздоровления (ПУВ) (Fast Track surgery (FTS), ERAS (enhanced recovery after surgery).
Технический результат - достоверное сокращение средней продолжительности госпитализации, в койко-днях.
Также можно выделить следующие дополнительные технические результаты:
1) уменьшение степени выраженности симптомов нижних мочевых путей (СНМП) по показателю шкалы IPSS,
2) улучшение эректильной функции по показателю шкалы IIEF-5 (МИЭФ-5);
3) снижение выраженности послеоперационного болевого синдрома по данным визуально-аналоговой шкалы Visual Analog scale (VAS/ВАШ) боли у пациентов, получающих периоперационнную курацию согласно заявленному способу в сравнении со стандартным протоколом курации;
4) получение успешных (т.е. свободных от рецидива) результатов лечения пациентов со следующими параметрами спустя 3 месяца и более после операции:
- достижение максимальной скорости потока мочи более 12 мл/сек, оцененное по данным урофлоуметрии;
- отсутствие остаточной мочи в мочевом пузыре по данным ультразвукового исследования;
- по данным уретрографии: нормальный диаметр просвета уретры в зоне пластики 5 мм и более;
- отсутствие тяжелых СНМП (сумма баллов по опроснику IPSS должна быть более
20);
- отсутствие неудовлетворительного качества жизни (показатель QoL шкалы IPSS) по субъективной оценке пациентов (3 и менее балла).
Способ периоперационной курации пациентов при хирургическом лечении стриктур проксимальной части бульбарного и мембранозного отделов уретры (БМО) методом заместительной уретропластики в соответствии с концепцией программы ускоренного выздоровления включает в себя следующие признаки (так же по тексту сразу даны пояснения, каким образом признаки способа положительно влияют на физиологические и патофизиологические процессы, что напрямую влияет на достижение технического результата - сокращения средней продолжительности госпитализации в койко-днях, а также на получение дополнительных технических результатов: уменьшение степени выраженности СНМП, улучшение эректильной функции по МИЭФ-5, снижение выраженности послеоперационного болевого синдрома по шкале VAS, получение успешных, свободных от рецидива результатов лечения спустя 3 месяца и более после операции):
1. На предоперационном этапе:
1.1. Пациента информируют о заболевании, вариантах лечения и возможных исходах с указанием усредненной эффективности, рисках развития осложнений, типичном послеоперационном состоянии, сроках катетеризации, госпитализации, возможных методах преабилитации и дальнейших методах реабилитации.
Предоперационный стресс, как комплекс психогенных и патофизиологических процессов, влияет на уровень гликемии. Каждый четвертый пациент без ранее установленного диагноза сахарного диабета в предоперационном периоде демонстрирует аномальный уровень гликемии натощак. Только у одного из десяти пациентов, страдающих сахарным диабетом, в предоперационном периоде был выявлен нормальный уровень глюкозы крови [82]. Предоперационное обучение и меры психологической поддержки являются одним из базовых элементов программ ускоренного выздоровления [83]. Подобная подготовка демонстрирует достоверное преимущество: снижается общая тревожность и восприятие боли, уменьшаются риски развития осложнений, улучшается восприятие качества лечения пациентом [84, 85].
1.2. Выполняют пациенту МСКТ или МРТ-уретрографию с 3D-моделированием и оценкой состояния костно-суставного аппарата таза, внутренних органов. Это необходимо для точной визуализации строения и состояния соответствующих органов пациента для планирования предстоящего хирургического вмешательства.
Опционально пациенту также может быть выполнена дополнительно мультиспиральная компьютерная томография (МСКТ) или магнитно-резонансная томография (МРТ) малого таза, также может быть выполнена дополнительно МСКТ или МРТ мочевой системы;
1.3. Проводят строгую оценку показаний для хирургического лечения: максимальная скорость потока мочи менее 12 мл/секунду по данным урофлоуметрии, диаметр просвета уретры менее 4 мм, наличие остаточной мочи в мочевом пузыре, наличие дистракционного дефекта уретры;
1.4. Проводят мультидисциплинарный осмотр пациента: уролог, анестезиолог, ЛОР-врач, стоматолог, терапевт или кардиолог, рентгенолог, врач лечебной физкультуры.
Мультидисциплинарное взаимодействие обоснованно на всех этапах обследования и лечения, что подтверждено множеством более ранних научных работ.Командное взаимодействие амплифицирует потенциал программы для достижения лучших результатов и позволяет, в том числе, снизить вероятность развития общих и ятрогенных осложнений [87]. Команда должна включать профильного специалиста, анестезиолога, терапевта, врача-реабилитолога, рентгенолога и прочих [88].
1.5. Пациенту назначают преабилитацию по показаниям. Преабилитация - это новый и сложный для восприятия в русскоязычном научном обществе термин, означающий предварительную подготовку к операции с целью улучшения результатов лечения [89]. Воздействие на сопутствующие заболевания (нарушения со стороны сердечно-сосудистой системы, заболевания почек, анемия, сахарный диабет, и другие) позволяет улучшить сопротивляемость периоперационному стрессу и снизить риски [90, 91]. Так же, как и в прототипе, обязательно проводится оценка исходного нутритивного статуса пациента, выявление трофологической недостаточности с последующей коррекцией. Согласно предлагаемому способу:
- вычисляют индекс массы тела (ИМТ) пациента, при ИМТ больше 30-35 устанавливают ожирение и обеспечивают консультации диетолога и эндокринолога, при ИМТ меньше 18,5 устанавливают истощение и обеспечивают консультации диетолога и эндокринолога;
Ожирение предоставляет высокие риски развития послеоперационных осложнений. Повышаются риски развития интра- и послеоперационных кровотечений. Рекомендованы бедные углеводами, низкокалорийные диеты, употребление большого количества воды [92]. Пациенты с недоеданием сравнительно медленнее восстанавливаются после хирургической травмы, страдают от повышенных рисков развития осложнений и послеоперационной летальности [93]
- проводят исследование уровня гемоглобина в крови пациента, при уровне гемоглобина ниже 130 г/л для мужчин диагностируют анемию, которую корригируют.Коррекция анемии может проводиться пероральными или внутривенными препаратами железа, причем внутривенные инфузии могут использовать как альтернативную пероральному приему терапию, или как стартовую терапию с последующим переходом на пероральный прием.
Пероральный прием представляется самым простым и дешевым способом. Однако сопровождается повышенным риском развития осложнений со стороны желудочно-кишечного тракта. Режимы дозирования влияют на усваиваемость в кишечнике: зачастую эффективность абсорбции выше при назначении низких доз (60 мг в день), чем стандартных (200 мг в день) [94];
проводят динамометрию и тест с ходьбой, биоимпедансометрию и антропометрию для выявления саркопении, и устанавливают диагноз саркопении, если полученные значения контрольных показателей меньше, чем установленные показатели для эталонной группы по возрасту. Преабилитация при саркопении заключается в повышении физической активности пациента и употреблении богатой белками пищи [95]. Стандартная программа коррекции рассчитана на четыре недели тренировок, сочетающих питание с повышенным содержанием белков, ходьбу и упражнения с сопротивлением [96].
- при выявлении нарушения толерантности к углеводам либо сахарного диабета проводят консультацию эндокринолога. Оценку инсулинорезистентности проводят методом гиперинсулинемического-нормогликемического зажима (метод ДеФронзо): инсулин вводят с постоянной скоростью до достижения уровня, превышающего показатель натощак [97, 98, 99].
Пациенты со сниженным весом, ведущие гиподинамичный образ жизни и возрастные пациенты с саркопенией являются группой риска по нарушению белкового гомеостаза [100]. Таким группам пациентов целесообразно проведение преабилитационных мероприятий, направленных на увеличение массы скелетной мускулатуры.
Также пациентам с саркопенией целесообразно назначить применение парентерального питания коротким курсом в раннем послеоперационном периоде [101].
1.6. Переводят пациента на бесшлаковую диету за 2-3 дня до операции: стол №4 по Певзнеру [М.И. Певзнер. Основы лечебного питания. Издание третье, перераб. -Государственное издательство медицинской литературы, Медгиз, Москва, 1958 г. 594 стр.].
1.7. Проводят предоперационную антибактериальную терапию по показаниям: наличие скрытой или явной инфекции мочеполовой системы (по результатам бактериологического исследования и полимеразной цепной реакции в реальном времени (количественная ПЦР, Real-time PCR)), а также инфекции других органов.
1.8. Пациентам с положительным аллергоанамнезом профилактически назначают антигистаминные препараты.
1.9. Отказываются от назначения механического очищения кишечника пациенту. В качестве недостатка этой традиционной меры следует подтвердить, что механическое очищение кишечника приводит к электролитным нарушениям и увеличивает риски кардиогенных и нефрогенных нарушений [103], что зачастую значительно перевешивает недостатки полного отсутствия предоперационной подготовки. Также механическая подготовка приводит к послеоперационным парезам кишечника и ухудшает заживление анастомозов [104].
1.10. Назначают и обеспечивают пациенту последний прием твердой пищи при операции в утренние часы в 21-22 часа накануне, при операции в послеобеденное время -не позднее, чем за 6 часов до операции;
1.11. Назначают пациенту подготовку кишечника: дают пациенту слабительный препарат либо выполняют однократно микроклизму, а при регулярном самостоятельном стуле - отменяют подготовку;
1.12. Отказываются от предоперационной седации. Возрастные пациенты являются группой риска, у которых на фоне приема седативных препаратов возможно наступление делириозных расстройств или снижение когнитивной функции [105].
Вместо этого осуществляют премедикацию согласно рекомендациям премедикации к общей анестезии, основанным на принципах научной доказательности (однако ранее данная схема премедикации применялась при эндопротезировании коленного сустава, а не в урологической практике): целекоксиб 100 мг, габапентин 600 мг, дексаметазон 10 мг [106], назначают однократно внутрь за 2-3 часа до операции;
1.13. Выполняют бритье операционного поля с последующей обработкой растворами кожных антисептиков без содержания спирта накануне по необходимости;
1.14. Пациент выполняет полоскание полости рта водным раствором хлоргексидина (поскольку уретропластика прланируется с использованием орального трансплантата из слизистой оболочки щеки (buccal mucosa graft) в течение дня между приемами пищи за 3-7 дней до предполагаемой операции, последний раз - за 3 часа до операции.
1.15. Проводят профилактику тромбоэмболических осложнений с помощью компрессии нижних конечностей и введения низкомолекулярных гепаринов, что является обязательной мерой, вне зависимости от участия в программе ускоренного выздоровления. В литературе описано, что выполнение радикальной цистэктомии, или проведение неоадъювантной химиотерапии сопровождаются высоким риском тромбоза глубоких вен (каждый двадцатый пациент) в течение первых 30 послеоперационных дней. Применение компрессионного трикотажа или переменной компрессии в сочетании с инъекцией низкомолекулярных гепаринов за 12 часов до и через 6 часов после операции являются обязательной мерой подготовки [107]. Выполнение профилактики венозной тромбоэмболии в России строго регламентировано отраслевыми приказами, и включает компрессию нижних конечностей в сочетании с антикоагулянтными препаратами [108].
Пациент согласно предлагаемому способу носит компрессионный трикотаж: со дня госпитализации, начиная ношение до операции, на срок до 21 дня после операции, а также пациенту вводят эноксапарин натрия 0,4 мл подкожно 1 раз в день либо фраксипарин 0,3 мл подкожно 1 раз в день, первая инъекция выполняется до операции и продолжают инъекции до выписки из стационара.
1.16. Пациенту обеспечивают употребление содержащей углеводы (при отсутствии противопоказаний: сахарный диабет, нарушение эвакуаторной функции желудка) и белки жидкости в объеме 200 мл за 2,5 часа до операции.
Употребление углеводно-белковых смесей непосредственно перед операцией уменьшает риски развития послеоперационной инсулинорезистентности [109]. Голодание перед плановой операцией - это традиционная мера подготовки кишечника, которая, как считалось ранее, позволяет снизить риск регургитации и рвотной аспирации. Однако в последней четверти двадцатого века стало появляться большое количество работ, опровергающих данные риски и свидетельствующих о вредности предоперационного голодания [110]. Экспериментальные исследования на животных и добровольцах продемонстрировали худший ответ на хирургический стресс в состоянии голода [109, 111]. Однако изначальная стратегия парентерального введения глюкозы оказалась ошибочной, результаты подобного подхода были хуже в сравнении с предоперационной пероральной углеводной загрузкой. Парентеральное питание усугубляет стрессовую гипергликемию [112]. Углеводная загрузка предполагает употребление богатой низкомолекулярными углеводами жидкости за 2-3 часа до операции. Предоперационное питание позволило снизить послеоперационную потерю азота и уменьшить инсулинорезистентность [113]. Специально для решения проблемы предоперационного питания была предложена мальтодекстрозная смесь, содержащая в 400 мл около 200 ккал. Клинические сцинтиграфические исследования доказали, что подобный объем раствора полностью эвакуируется из кишечника в течение полутора часов после приема пищи [114]. Последующее масштабное применение данного подхода на миллионах пациентов подтвердило эффективность и безопасность предоперационной углеводной загрузки. В Кокрейновском обзоре не получено данных об увеличении рисков аспирации, регургитации или других функциональных расстройств кишечника при углеводной загрузке [115]. Однако требуется учитывать различные состояния, связанные с нарушением опорожнения желудка и нарушением пассажа в кишечнике. Важно отметить, что применение углеводной загрузки допускается у пациентов с контролируемым сахарным диабетом [116]. В целом предоперационное питание позволяет нормализовать инсулин-углеводный баланс в первые часы непосредственно после перенесенной операции [115]. Достоверно установлено, что углеводная загрузка снижает потери азота и уменьшает эндогенный синтез глюкозы из аминокислот, то есть имеется убедительное метаболическое обоснование [117].
1.17. Проводят антибиотикопрофилактику за 60 минут до операции препаратами цефалоспоринов 3-го поколения при стерильном посеве мочи, однократно.
2. Интраоперационный период:
2.1. Во время операции пациента размещают в модифицированном литотомическом положении на операционном столе.
2.2. Предпочтительный метод анестезии согласно предлагаемому способу -региональная анестезия. Возможно также применение мультимодальной анестезии (сочетанное местное и общее обезболивание). Мультимодальное обезболивание определяется анестезиологом для каждого пациента.
Применение эпидуральной анестезии за счет уменьшения стрессового ответа в первые двое суток после операции уменьшает инсулинорезистентность, снижает выраженность гипергликемии и катаболизма [118]. Согласно концепции программ ускоренного выздоровления обезболивание должно начинаться до хирургического вмешательства и продолжаться в послеоперационном периоде до тех пор, пока не будут минимизированы риски возврата спровоцированных болью метаболических и функциональных нарушений [119]. То есть, до тех пор пока сохраняется умеренная или выраженная послеоперационная боль [120].
2.3. Используют увеличительную оптику.
2.4. Отказываются от назогастральной интубации. Кокрейновский обзор применения назогастральных зондов доказал: зонды замедляют выздоровление, продляют госпитализацию, увеличивают количество легочных осложнений и вероятность развития послеоперационной тошноты и рвоты. Помимо прочего, влияние зондов было оценено в различных хирургических сценариях при абдоминальных вмешательствах, например, резекции желудка или толстого кишечника. Во всех случаях применение зондов приводило к худшим результатам. Таким образом, нет ни одного обоснования профилактического применения назогастральных зондов [121].
2.5. Отказываются от применения монополярной коагуляции и резекции, вместо этого - применяют только биполярную коагуляцию, в частности, могут быть использованы аппараты LigaSure, Harmonic, что имеет обоснование: при использовании лазерной энергии в мочевых путях остро встает проблема конвекции тепловой энергии [122]. Монополярная коагуляция чаще приводит к утечке тока, повреждению окружающих здоровых тканей, в сравнении с биполярной [123].
2.6. Осуществляют подогрев пациента во время операции с контролем нормотермии; подогрев выполняют с помощью электроподогревающих матрасов и одеял с целью предотвратить охлаждение пациента;
2.7. Осуществляют подогрев инфузионных растворов и ингаляционных газов до температуры 30°С;
Гипотермия - это состояние охлаждения тела пациента ниже 36°С. Гипотермия стимулирует избыточный выброс катехоламинов, что провоцирует возрастание нагрузки на сердце, вероятность ишемии и аритмии, снижает локальный иммунитет в ране и приводит к развитию коагулопатии. Падение общей температуры тела на один градус повышает риски кровотечений и переливаний крови до 20% [124]. Поддержание нормотермии требуется если продолжительность операции превышает полчаса. Соответственно требуется подогрев инфузионных и орошающих растворов, газов, а также подогрев тела пациента с помощью термических матрасов и одеял [125]. Поддержание интраоперационной нормотермии прямым (подогрев пациента) и опосредованным (подогрев газов и растворов) способами позволяет снизить катехоламиновый ответ на стресс, снизить выраженность атрофии скелетной мускулатуры [126].
2.8. Поддерживают состояние интраоперационной эуволемии у пациента. Гипергидратация приводит к повреждению сосудистого эндотелия и повышению
гидростатического давления, выделению диуретических факторов и потере электролитов. Гипогидратация провоцирует снижение перфузии и гиповолемию, ацидоз слизистых и нарушение процессов ранозаживления [127]. В целом, введение избыточного количества жидкости или обезвоживание приводят к сходным неблагоприятным последствиям воспалительного и метаболического характера: ишемизации тканей, усилению катаболизма, инфекции и потери резервов [128, 129]. Основным путем достижения эуволемии является оптимизация периоперационного питания с минимизацией интраоперационных внутривенных инфузий [130]. В целом предоперационное и ранее послеоперационное кормление во многом снизили влияние интраоперационного контроля объема инфузий [131].
2.9. Устанавливают пациенту силиконовый мочевой катетер 14Fr. Экспериментальные исследования выявили сходную токсичность силикона и латекса, с незначительным преимуществом первого [132].
2.10. Выполняют линейный промежностный доступ.Разрез проводят по средней линии промежности по направлению к мошонке, отступив вверх не менее 2 см от ануса. Протяженность разреза кожи не более 4-5 см.
2.11. Доступ выполняют послойно к бульбо-спонгиозной мышце. Последнюю раздвигают вдоль волокон и формируют окно к передней поверхности бульбарного тела уретры таким образом, чтобы не отделить мышцу по латеральным поверхностям бульбы.
2.12. Определяют дистальный конец сужения уретры с помощью интраоперационной уретроцистоскопии или с использованием уретрального катетера.
2.13. Рассекают поэтапно спонгиозное тело и уретру в проекции бульбо-мембранозного физиологического изгиба, но дистальнее сужения просвета уретры. Протяженность уретротомного доступа 2-3 см.
2.14. Края уретры разводят предварительно затупленными крючками ранорасширителя Скотта. Возможно подшивание краев уретры к белочной оболочке бульбарного тела. Через полученное окно раздвигают просвет проксимальной части бульбарного и мембранозного отделов уретры, что позволяет визуализировать стриктуру.
2.15. В мочевой пузырь через суженную часть мочеиспускательного канала заводят проводник.
2.16. Суженную часть уретры рассекают вентрально с проникновением за пределы уретры в мышечную толщу. Затем иссекают рубцово-измененные ткани уретры в вентральной полуокружности в пределах от пяти до семи часов по циферблату. Формируют площадку для трансплантата в пределах иссеченных рубцовых тканей уретры. Проксимальные и дистальные границы сформированной площадки находятся на 10 мм в пределах неизмененных тканей уретры.
2.17. Отказываются от коагуляции на спонгиозном теле и уретре.
2.18. Адекватность просвета уретры проверяют заведением бужа 24Ch в мочевой пузырь.
2.19. В качестве замещающего материала используют трансплантат слизистой оболочки ротовой полости. Форму и размеры трансплантата выбирают в соответствии с параметрами сформированной под него площадки. Под местной анестезией выполняют забор орального трансплантата. Дефект слизистой ротовой полости на месте забора трансплантата ушивают.
2.20. Подготовленный оральный трансплантат фиксируют без натяжения в ложе уретры путем пришивания непрерывным швом рассасывающимся шовным материалом 4\6-0.
2.21. Вначале фиксируют проксимальную часть трансплантата с треугольными вершинами по методике вкладки (Inlay).
2.22. Далее выполняют сквозное его прошивание по центру к подлежащим структурам, что позволяет исключить формирование патологической полости.
2.23. Контроль качества хирургического шва выполняют методом интраоперационной уретроскопии и с использованием увеличительной оптики.
2.24. Затем в мочевой пузырь проводят уретральный катетер Фолея 16-18Ch, раздувают баллон на 5-10 мл.
2.25. Затем по методике накладки (Onlay) прошивают и фиксируют дистальную часть трансплантата без натяжения.
2.26. Применяют инъекции в подслизистый слой уретры и в окружающие ткани плазмы, обогащенной тромбоцитами, полученной по методу PRP путем центрифугирования в пробирках из периферической венозной крови пациента, что направлено на скорейшее завершение альтерации и ускорение процесса пролиферации тканей [133].
Применение подслизистой инъекции PRP при внутренней оптической уретротомии значительно уменьшает риск рецидива (9.09% против 26.82%, р 0.032) в отдаленном послеоперационном периоде [134].
2.27. Уретротомный доступ закрывают непрерывным швом с прошиванием подслизистой основы трансплантата для исключения формирования патологической полости монокрилом 4/6-0.
2.28. Производят пликацию фибринового клея или биодеградируемого сульфакрилата на уретральный шов. Фибриновый клей (по методу i-PRF и Superfibrin) получают методом центрифугирования в пробирках из периферической венозной крови пациента. Биодеградируемый клей Сульфакрилат приобретают в готовом виде, он состоит из этил-а-цианакрилата (связующий компонент), бутилакрилата (пластификатор) и сульфоланметакрилата (противовоспалительный, антимикробный компонент), представляет собой бесцветную прозрачную жидкость со специфическим запахом, удельный вес 1,05-1,07 г/см3, вязкость 8-85 сст [Инструкция по применению медицинского изделия «Клей медицинский «Сульфакрилат» (ТУ 9398-063-03533913-2010; Регистрационное удостоверение на медицинское изделие №ФСР 2010/09805 от 31 декабря 2010 г.) URL: https://www.sulfakrilat.ru/o-produkte/instruktsiya/ производитель: АО «Федеральный научно-производственный центр «Алтай»]. Клей применяют с помощью длинной тонкой иглы.
Интраоперационное применение цианакриловых клеев с целью герметизации шва позволяет удалять катетеры в ранние сроки, либо их используют с целью фиксации уретральных стентов на срок до двух недель [135]. Одномоментные уретропластики с использованием буккальных графтов и клея продемонстрировали свою эффективность на пилотных группах [76]. В настоящее время клинические исследования применения цианакриловых клеев носят пилотный характер: представлены успешные исследования на животных [136], лечение уретральных свищей у человека [137-139]. Цианоакрилаты также применяются для лечения мочеточниковых и иных урогенитальных свищей, в том числе с одномоментным выполнением пластических реконструкций [140, 141].
Для биодеградируемых вариантов цианакриловых клеев (сульфакрилаты) установлена их безопасность по отношению к уротелию [142, 143]. Возможной альтернативой цианоакрилатов являются ауто-фибриновые клеи, также применяемые с целью гемостаза или герметизации швов.
2.29. Отказываются от установки страховых дренажей.
Негативное влияние профилактического применения дренажей доказано: дренаж может закупориться, он служит воротами для инфекции, препятствует ранозаживлению, вызывает компрессию органов и тканей, может спровоцировать перфорацию или развитие пролежней. Кокрейновский обзор применения дренажей при операциях на брюшной полости не продемонстрировал никакого позитивного влияния профилактического дренирования на развитие осложнений и исходы лечения [144]. Применение дренажей с целью оценки патологической утечки или несостоятельности шва также оказалось необоснованным. Эффективнее для оценки утечек и кровотечений использовать методы визуализации в послеоперационном периоде [145], в связи с чем согласно заявляемому способу применяют перикатетерную уретрографию в послеоперационном периоде.
2.30. Закрывают промежностный доступ косметическим швом кожи без свободных концов и узлов на коже монокрилом 4-0. Используют клеевую повязку на кожу биодеградируемым цианакриловым клеем.
Внутрикожные швы и использование клеевых повязок значимо не влияют на исходы лечения, но обеспечивают лучшее восприятие послеоперационного периода пациентами вследствие отсутствия необходимости посещения перевязок и облегченный уход. Подобный шов не требует удаления, обеспечивает хороший косметический эффект, а клеевая повязка позволяет осуществлять рутинные гигиенические процедуры и отказаться от применения обычных пластырных повязок. Учитывая высокий риск контактных дерматитов в ответ на пластырный перевязочный материал, данная мера считается эффективной [146].
2.31. Интраоперационно проводят мультимодальную профилактику послеоперационной тошноты и рвоты: вводят внутривенно дексаметазон 4 мг и ондансетрон 4 мг однократно в процессе операции.
3. В послеоперационном периоде:
3.1. Пациента после завершения операции переводят в отделение интенсивной терапии и реанимации, где пациент находится в течение 2-3 часов.
3.2. Осуществляют мультимодальную анальгезию с целью контроля боли: назначают нестероидные противовоспалительные средства (НПВС) в сочетании с ацетаминофеном.
Повреждение тканей любым способом приводит к активации множества патофизиологических механизмов, приводящих к высвобождению химических медиаторов, стрессовых гормонов, развитию воспаления. Все это сопровождается преобладанием активности симпатической нервной системы, а, следовательно, развитием дисфункции органов (парез кишечника), уменьшением потребления кислорода тканями (например, сердцем) и нарушением процессов восстановления за счет катаболизма. Метаболический ответ на альтерацию провоцирует гиперкоагуляцию и увеличение вязкости крови. Нарушается дыхательная функция, в том числе происходит подавление кашлевого рефлекса, что увеличивает послеоперационные риски легочных осложнений [120]. Поэтому профилактика боли, направленная на уменьшение болевой афферентации после операции обязательна. Механизм действия парацетамола (ацетаминофена) остается не полностью объяснимым. Известно, что он подавляет центральный и периферический синтез простаноидов [147]. Ацетаминофен подавляет пирогенные реакции и оказывает обезболивающий эффект, но не влияет на механизмы воспаления. Но ключевым свойством является способность потенцировать эффект нестероидных противовоспалительных средств (НПВС) и опиатов, при высочайшем профиле безопасности [148].
3.3. Пациенту обеспечивают раннее употребление жидкости - через 2-3 часа после операции, и пищи - через 6 часов после операции.
Раннее послеоперационное питание стимулирует выработку эндогенного инсулина, ингибирует протеолиз, облегчает синтез белка [149]. В целом раннее послеоперационное питание уменьшает риски инфекционных осложнений, риск несостоятельности анастомоза и общую длительность госпитализации [150].
3.4. Пациенту обеспечивают использование жевательной резинки в первые и вторые сутки после операции, периодически в течение дня. Это один из простейших, дешевых и эффективных способов профилактики послеоперационной тошноты и рвоты, а также пареза кишечника [151].
3.5. С целью защиты от стресс-язв применяют блокаторы протоновой помпы: Ранитидин внутрь 150-300 мг на ночь, до стихания болевого синдрома и прекращения приема нестероидных противовоспалительных средств (НПВС);
3.6. Осуществляют раннюю активизацию пациента: посадить или поставить пациента через 6-8 часов после операции, после оценки состояния пациента анестезиологом.
Ранняя мобилизация уменьшает риски тромбоэмболических и инфекционных осложнений. У пациентов с очень низким риском ТЭО ранняя мобилизация может быть единственной мерой профилактики, без необходимости механической компрессии или применения медикаментозных средств [107]. Общая рекомендация - активизация должна начинаться в первый послеоперационный день даже после радикальной цистэктомии [73]. Мобилизация снижает риски кардиопульмонарных, тромбоэмболических осложнений и сокращает госпитализацию [152].
3.7. Пациент строго соблюдает послеоперационную гигиену половых органов и послеоперационных ран - гигиенический душ ежедневно с первых суток. Также отказываются от ежедневных перевязок благодаря использованию клеевой повязки на кожу биодеградируемым цианакриловым клеем;
3.8. Производят контроль показателей крови и мочи в первые сутки после операции;
3.9. Производят строгий контроль гликемии у пациентов с нарушением толерантности к углеводам и сахарным диабетом. В связи с установлением патофизиологии процесса, в современной научной литературе стал использоваться термин «диабет травмы» [153], и был сформулирован важный вывод: периоперационный контроль гликемии важнее факта предоперационной установки диагноза сахарного диабета;
3.10. Продолжают профилактику тромбоэмболических осложнений компрессией нижних конечностей и применением низкомолекулярных гепаринов: ношение компрессионного трикотажа со дня госпитализации на срок до 21 дня после операции, а также эноксапарин натрия 0,4 мл подкожно 1 раз в день либо фраксипарин 0,3 мл подкожно 1 раз в день до выписки из стационара;
3.11. Применяют препараты, улучшающие микроциркуляцию, репаранты: пентоксифиллин по 100 мг внутрь 2 раза в день, 14 дней. Также осуществляют сеансы гипербарической оксигенации со вторых-третьих суток после операции в режиме 1,0-1,5 атм., по 45 минут, 5-10 сеансов 1 раз в день ежедневно (при отсутствии противопоказаний);
3.12. Выполняют перикатетерную уретрографию перед удалением уретрального катетера для оценки возможного дефекта герметичности уретры.
Хорошо изучены негативные последствия и преимущества уретрального дренирования при уретропластических операциях, операциях на простате и мочевом пузыре. Осложнения представлены преимущественно инфекционными и травматическими исходами (стриктуры уретры, травмы шейки мочевого пузыря с кровотечениями и прочее). В связи с этим сформулированы общие рекомендации: уретральный катетер подлежит удалению так скоро, как это возможно [79].
3.13. Уретральный катетер удаляют после выполнения перикатетерной уретрографии не позднее седьмых суток после операции.
3.14. Проводят подробное обсуждение поведения пациента и плана реабилитации перед выпиской, пациенту выдают подробные инструкции в выписных документах;
3.15. Осуществляют выписку пациента из стационара через 1-3 дня после операции с переводом пациента на амбулаторное наблюдение, при этом критериями выписки установлены: возможность мобилизации пациента, адекватный контроль боли и полноценное самостоятельное питание. Отсутствие самостоятельного стула исключено из противопоказаний к выписке [154, 155].
3.16. Пациент возвращается к работе через два дня после выписки после удаления уретрального катетера.
3.17. Пациент применяет ферментный препарат Лонгидаза, ректальные свечи, по истечении 14 суток после проведения операции по схеме: 1 свеча ректально 1 раз в 2 дня (то есть свечи применяют через день), курс составляет 20 штук свечей, указанные курсы препарата повторяют каждые 6 месяцев на протяжении 2-3 лет.
3.18. Пациенту составляют строгий план контрольных осмотров в послеоперационном периоде и обеспечивают ежедневный контакт пациента с лечащим врачом.
Способ иллюстрируется следующим клиническим примером.
Пациент К., 62 лет, поступил с жалобами: на невозможность адекватного мочеиспускания, наличие цистостомы. Из анамнеза известно, что стриктура уретры выявлена случайно. В связи с острой задержкой мочеиспускания в 2021 году установлена цистостома. По данным трансректального ультразвукового исследования (ТРУЗИ) выявлен объем простаты 20,7 см3. По уретрограмме от 22.12.21 выявлена стриктура бульбо-мембранозного отдела уретры с сужением просвета до 1 мм. 29.12.2021 года выполнены трансуретральная резекция (ТУР) простаты и внутренняя оптическая уретротомия, цистостома сохранена. В послеоперационном периоде мочеиспускание не восстановилось. По данным контрольной уретроцистоскопии и МСКТ-уретроцистографии установлен диагноз: Стриктура бульбо-мембранозного отдела уретры, рецидив. Осложнение основного - Вторичный хронический цистит.Хроническая задержка мочи. Цистостома. Госпитализируется в плановом порядке для хирургического лечения стриктуры уретры.
Периоперационная курация выполнена согласно заявленному способу. Проведена миниинвазивная интрауретральная заместительная уретропластика с использованием трансплантата слизистой оболочки ротовой полости по запатентованному способу (Воробьев В.А., Белобородов В.А. Способ оперативного лечения сужения уретры // патент №2694477 от 15.07.19). Проведена реабилитация в послеоперационном периоде согласно заявленному способу.
В предоперационном периоде выполнено подробное консультирование о возможных принципах лечения стриктур уретры, причинах возникновения и последствиях отказа от лечения. Представлены возможные альтернативные методы лечения, такие как эндоскопическое рассечение, дилятация, анастомотическая уретропластика и другие. Представлен обзор предоперационного периода, интраоперационные нюансы и охарактеризовано ожидаемое состояние в послеоперационном периоде, представлены возможные осложнения, а также меры реабилитации.
Непосредственно после первичного консультирования получено согласие пациента на хирургическое лечение согласно заявляемому способу периоперационной курации при хирургическом лечении стриктур проксимальной части бульбарного и мембранозного отделов уретры методом заместительной уретропластики в соответствии с принципами концепции ускоренного выздоровления. Назначен план обследования в рамках ускоренного пути: все исследования выполнены на следующий день в течение трех часов. На основании результатов обследования повторно оценены показания и противопоказания к операции. Установлены показания к операции: максимальная скорость потока мочи 6,6 мл/секунду по данным урофлоуметрии, диаметр просвета уретры до 1 мм (то есть менее 4 мм), наличие остаточной мочи в мочевом пузыре 100 мл, наличие дистракционного дефекта уретры. Выполнено мультидисциплинарное обсуждение в команде специалистов: врач-уролог, анестезиолог, терапевт, рентгенолог, медицинская сестра и реабилитолог.Оценена возможность соблюдения протокола по религиозным, этическим, социальным и другим признакам.
Оценена необходимость преабилитации. Индекс массы тела (ИМТ) равен 24,6. Уровень гемоглобина в крови равен 143 г/л. Уровень глюкозы крови натощак в пределах нормы - 5,5 ммоль/л. Потребность в преабилитации не установлена.
Рекомендована бесшлаковая диета (стол №4 по Певзнеру) за 2-3 дня до операции. Назначено полоскание полости рта водным раствором хлоргексидина в течение дня между приемами пищи на протяжении 3 дней до операции.
Выполнены 3D-моделирование и оценка состояния костно-суставного аппарата таза и внутренних органов пациента по данным МСКТ малого таза, МСКТ-уретрографии.
Пациенту назначена дата операции. Госпитализация в день операции, за три часа до планируемого хирургического вмешательства. Последний прием твердой пищи до операции за 6 часов до планируемой операции. Подготовка самостоятельная дома: подготовка кишечника с помощью перорального слабительного препарата однократно. Очищение кишечника с помощью клизмы не выполнялось. Бритье операционного поля - промежности с после предварительной обработки кожным антисептиком без содержания спирта.
Поскольку аллергоанамнез пациента не отягощен, профилактическое назначение антигистаминных препаратов не проводилось.
Профилактика венозной тромбоэмболии - назначен компрессионный трикотаж, ношение со дня госпитализации до начала операции и до 21 дня после проведения операции, и произведена инъекция подкожно раствора фраксипарин 0,3 мл в день госпитализации до операции.
При поступлении, за 3 часа до операции, пациенту выполнена премедикация по схеме: целекоксиб 100 мг, габапентин 600 мг, дексаметазон 10 мг однократно внутрь, также с целью защиты от стресс-язв Ранитидин 150 мг однократно внутрь. Полоскание полости рта раствором хлоргексидина последний раз за 3 часа до операции. Выполнена углеводная загрузка 200 мл мальтодекстрозной смеси перорально за 2,5 часа до операции.
Антибактериальная профилактика выполнена однократно за 60 минут до начала операции согласно рекомендациям (Профилактика инфекций области хирургического вмешательства. Клинические рекомендации. - Н. Новгород: Изд-во «Ремедиум Приволжье», 2018. - 72 с.): применен цефтриаксон 1 г внутривенно однократно. Посев мочи перед операцией с ростом патогенной микрофлоры, составлен план послеоперационной антибиотикотерапии согласно результатам посева.
Интраоперационно метод анестезии - эпидуральная анестезия. Время операции 50 минут. Пациент размещен в модифицированном литотомическом положении на операционном столе. Установлен силиконовый мочевой катетер 14Fr. Интраоперационный подогрев пациента с помощью электронагревающего матраса. Подогрев инфузионных растворов с помощью проточного подогревателя до 30 градусов Цельсия. Интраоперационная эуволемия отслеживалась анестезиологом на основании количества полученной мочи, объема влитой с помощью инфузий жидкости, и ряда других параметров. Для проведения операции использовали увеличительную оптику 4,5х - лупы хирургические бинокулярные на очковой оправе и осветитель налобный.
Хирургический доступ промежностный линейный миниинвазивный - 2 см, отступив вверх 2 см от ануса.
Монополярная коагуляция не применялась. Коагуляция на спонгиозном теле и уретре на проводилась.
Выполнен послойно доступ к бульбо-спонгиозной мышце, которую раздвигали вдоль волокон и формировали окно к передней поверхности бульбарного тела уретры таким образом, чтобы не отделить мышцу по латеральным поверхностям бульбы.
Определен дистальный конец сужения уретры с помощью интраоперационной уретроцистоскопии.
Спонгиозное тело и уретра в проекции бульбо-мембранозного физиологического изгиба рассечены послойно, дистальнее сужения просвета уретры, доступ выполнен протяженностью 2 см.
Края уретры разведены предварительно затупленными крючками ранорасширителя Скотта. Через полученное окно раздвинут просвет проксимальной части бульбарного и мембранозного отделов уретры, и визуализирована стриктура уретры. В мочевой пузырь через суженную часть мочеиспускательного канала заведен проводник.
Суженную часть уретры рассекли вентрально с проникновением за пределы уретры в мышечную толщу. Затем иссекли рубцово-измененные ткани уретры в вентральной полуокружности в пределах от пяти до семи часов (по стандартному циферблату). Сформирована площадка для трансплантата в пределах иссеченных рубцовых тканей уретры. Проксимальные и дистальные границы сформированной площадки находятся на 10 мм в пределах неизмененных тканей уретры.
Заведен буж 24Ch в мочевой пузырь, установлена адекватность просвета уретры. После удаления рубцовых тканей уретры, под местной анестезией раствором Лидокаина 2% 20 мл из ротовой полости, а именно с внутренней поверхности левой щеки, выполнен забор орального трансплантата слизистой 3x1 см. Дефект слизистой ротовой полости ушит викрилом 3-0.
Трансплантат фиксирован в сформированной ложе с помощью непрерывного шва монокрилом 5-0. Вначале фиксирована проксимальная часть трансплантата с треугольными вершинами по методике вкладки (Inlay), затем выполнено сквозное прошивание трансплантата по центру к подлежащим структурам. Затем в мочевой пузырь провели уретральный катетер Фолея 16-18Ch, баллон был раздут на 5-10 мл. Далее по методике накладки (Onlay) прошита и зафиксирована дистальная часть трансплантата без натяжения.
Путем центрифугирования (центрифуга «Armed») в пробирках из периферической венозной крови пациента получена плазма, обогащенная тромбоцитами. Выполнены инъекции плазмы, обогащенной тромбоцитами, в подслизистый слой уретры и в окружающие ткани.
Уретротомный доступ ушит монокрилом 4-0 с прошиванием подслизистой основы трансплантата.
Выполнена герметизация уретрального шва с помощью клея Сульфакрилат (приобретен в готовом виде, производитель: АО «Федеральный научно-производственный центр «Алтай»). Контроль гемостаза. Дренирование не выполнялось. Закрытие промежностного доступа монокрилом 4-0 послойно, непрерывными швами. Косметический шов на кожу монокрилом 4-0 с клеевой повязкой клеем Сульфакрилат.Интраоперационно выполнена профилактика послеоперационной тошноты и рвоты - дексаметазон 4 мг и ондансетрон 4 мг внутривенно однократно.
После операции на 3 часа пациент переведен в палату послеоперационного наблюдения. Интраоперационное обезболивание продолжено в послеоперационном периоде согласно принципу «нет боли», то есть выполнение профилактики, а не устранение боли. После прекращения действия эпидуральной анестезии назначено - внутрь целекоксиб 100 мг и ацетоминофен (парацетамол) 250 мг каждые 6-8 часов в первые послеоперационные сутки. Употребление мальтодекстрозной смеси предложено через 2 часа после операции. Разрешено послеоперационное употребление твердой пищи через 6 часов после операции. Рекомендовано применение жевательной резинки в первые-вторые сутки после операции для уменьшения риска послеоперационных функциональных расстройств кишечника, в течение дня - жевать 3 раза в день по 30 минут.
Назначен Ранитидин внутрь 150-300 мг на ночь, до прекращения приема нестероидных противовоспалительных средств (НПВС).
Пациент активизирован через 6 часов после операции, после прекращения действия эпидуральной анестезии и после осмотра анестезиологом.
Назначены сеансы гипербарической оксигенации со вторых суток после операции в режиме 1,5 атм., по 45 минут, 7 сеансов 1 раз в день ежедневно.
Назначено применение пентоксифиллина по 100 мг внутрь 2 раза в день (т.е. ежедневная доза 200 мг), в течение 14 дней.
Контроль уровня гликемии в первый и второй послеоперационные дни, коррекция не потребовалась. На второй послеоперационный день выполнен контрольный клинический анализ крови. Послеоперационная антибиотикотерапия проводилась согласно данным посева - левофлоксацин 500 мг 1 раз в день, 5 дней. Обработка ран и ежедневные перевязки не проводились. Рекомендована вместо этого самостоятельная ежедневная гигиена - принимать душ ежедневно с первых суток.
Продолжена профилактика тромбоэмболических осложнений - ношение компрессионного трикотажа до 21 дня после операции, режим обильного питья, подкожно инъекции раствора фраксипарин 0,3 мл 1 раз в день до выписки из стационара.
Пациент выписан из стационара на амбулаторный режим на третий послеоперационный день.
Уретральный катетер удален через 7 дней после операции, после выполнения контрольной перикатетерной уретрографии для оценки возможной утечки мочи из линии доступа.
Ежедневный контакт с лечащим врачом через телефонные звонки и мессенджер в течение первых 10 дней, затем 1 раз в 2-3 дня до месяца. Затем ежемесячно в течение года. Осмотры и контрольное УЗИ на третьи, седьмые, десятые, двадцатые, тридцатые сутки, затем через 3, 6 и 12 месяцев.
Через 14 дней после операции рекомендовано применение препарата Лонгидаза по схеме 1 свеча ректально 1 раз в 2 дня (то есть через день), курс 20 свечей, рекомендовано указанные курсы препарата повторяют каждые 6 месяцев на протяжении 2-3 лет.
Интраоперационных и послеоперационных осложнений II класса и выше по классификации Clavien-Dindo у пациента не зафиксировано.
По данным контрольной уретроцистографии и уретроскопии через год после операции признаков рецидива стриктуры уретры не выявлено. Диаметр уретры в зоне уретропластики составляет 6,5 мм. Максимальная скорость потока мочи 18,6 мл/секунду по данным урофлоуметрии, остаточная моча в мочевом пузыре отсутствует.По международной шкале оценки симптомов нижних мочевых путей IPSS пациент оценивает симптомы на 5 баллов (легкая степень СНМП), показатель качества жизни QoL указанной шкалы пациент оценивает на 1 балл (хорошо), по шкале МИЭФ-5 - 20 баллов (легкая дисфункция). Показатели качества жизни соответствовали средним популяционным значениям.
Эффективность предлагаемого способа была оценена в сравнительном исследовании. Проведение клинического исследования было одобрено локальным этическим комитетом ФГБОУ ВО «Иркутский государственный медицинский университет» Минздрава России и локальным клиническим комитетом клинической базы. Проспективное слепое рандомизированное исследование выполнено на клинической базе университета.
Клиническая часть исследования включает анализ результатов обследования и лечения пациентов, которым были выполнены хирургические вмешательства по поводу стриктуры уретры за период с января 2019 г. по октябрь 2022 г.
В окончательный клинический анализ были включены 80 пациентов, отвечающих всем критериям исследования. Из них были сформированы 2 группы пациентов. Группа пациентов, получивших стандартный протокол лечения (n=42, I группа), и группа вылеченных согласно предлагаемому способу периоперационной курации в соответствии с концепцией программы ускоренного выздоровления (n=38, II группа).
Хирургические вмешательства выполнялись: для группы I - методом анастомозирования уретры после иссечения пораженного участка (ЕРА), для группы II разработанным и запатентованным способом заместительной интрауретральной пластики (ЗИП) буккальным трансплантатом [Патент РФ на изобретение №2694477 «Способ оперативного лечения сужения уретры», В.А. Воробьев, В.А. Белобородов, дата приоритета: 04.05.2016]. Однако, техника выполнения швов в сравнении с изобретением немного изменена - согласно патенту на изобретение №2694477, в ходе операции используют отдельные узловые швы, в предлагаемом же изобретении швы выполняются только непрерывными.
Запатентованный способ относится к методам заместительной уретропластики с использованием аутотрансплантатов. Суть метода заключается в увеличении диаметра просвета пораженной уретры за счет «вкладки» (Inlay) в стенку уретры трансплантированного материала.
На основании сравнительного анализа оперативной техники различных методов выявлены следующие преимущества и особенности запатентованного способа заместительной интрауретральной пластики: 1. Отсутствует необходимость частичной или полной мобилизации бульбарной и мембранозной уретры, что позволяет сохранить сосудистые и нервные структуры, целостность мышц промежности и элементов дистальной части мочевого сфинктера. Следовательно, исключается риск развития недержания мочи, эректильной дисфункции. 2. Размеры хирургического промежностного доступа значительно меньше (3-5 см), чем при использовании традиционных способов (7-10 см) уретропластики. Не требуется дополнительное Y-образное расширение доступа по направлению к седалищным буграм. Экспериментальным путем доказано, что уровень стрессовых реакций напрямую зависит от объема хирургической травмы. Малый объем травмы оказывает незначительное влияние на гликемию [157]. Данный постулат представляется особенно важным в рамках программ ускоренного выздоровления. Миниинвазивные вмешательства, вне зависимости от вида, примерно в равной мере уменьшают объем и вероятность кровопотери [158]. Уменьшить выраженность инсулинорезистентности и катаболизма возможно минимизацией операционной травмы. Это достигается уменьшением общих суммарных размеров хирургических доступов, отказом от разрезания мышц в пользу их разведения. Особенности хирургического доступа и техника фиксации трансплантата разработанным способом заместительной интрауретральной пластики (ЗИП) позволяют осуществлять вмешательство с лучшим визуальным контролем, в сравнении с альтернативными методами. 3. Отсутствует необходимость в иссечении пораженного сегмента уретры и, следовательно, нивелируется риск укорочения полового члена после пластики, отсутствует вероятность натяжения анастомоза и его несостоятельности. 4. В отличие от существующих методов заместительной пластики естественная реваскуляризация слизистого трансплантата в мембранозной части уретры при предлагаемом способе осуществляется из нескольких источников (дистально - от неизмененной спонгиозной ткани бульбарной уретры, проксимально - от простатической части уретры и подлежащей мышечной ткани), что обеспечивает лучшие результаты приживления. В отличие от методик с применением кожных и реваскуляризированных кожных трансплантатов при используемом способе ЗИП нет необходимости в многоэтапных операциях, меньше косметический дефект.
Сравнительные данные о значениях исходных параметров пациентов в группах исследования представлены в таблице 1.
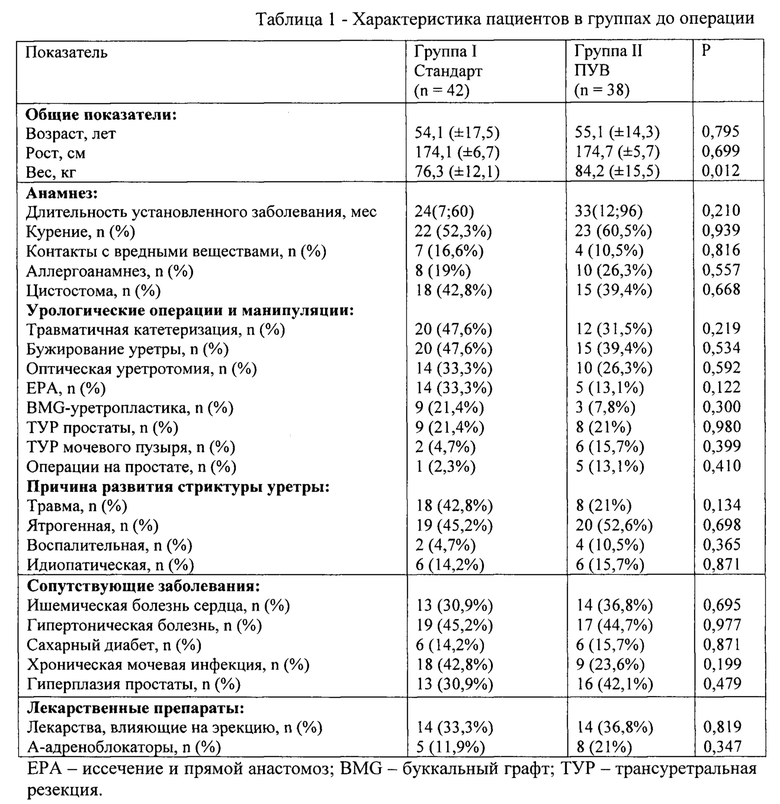
В таблице 2 представлены сравнительные данные результатов объективного обследования и состояния функционального статуса у пациентов групп сравнения.


Таким образом, при анализе основных характеристик пациентов групп сравнения установлена их сопоставимость по большинству параметров (р>0,05).
При обследовании были использованы анамнестические (с целью установления давности заболевания, сопутствующих болезней и прочее), клинические, биохимические, ультразвуковые, томографические, рентгенологические, эндоскопические методы исследования.
Для уточнения характера и степени патологических изменений в уретре выполняли уретроцистографию (рентген или МСКТ) и уретроцистоскопию. Для оценки объема остаточной мочи и объема простаты выполняли ультразвуковое исследование, максимальную скорость потока мочи (Qmax) оценивали по данным урофлоуметрии. Субъективное состояние пациентов и их функциональный статус при обращении к врачу оценивали по рекомендованным шкалам оценки симптомов нижних мочевых путей (СНМП/IPSS), качества жизни (QoL), эректильной функции (IIEF-5; МИЭФ-5) и другим параметрам. Эректильную функцию трактовали на основании шкалы МИЭФ-5 как нормальную (21-25 баллов), как легкую (16-20 баллов) эректильную дисфункцию (ЭД), как умеренную (11-15 баллов) ЭД, или как значительную (5-10 баллов) ЭД (импотенция). Качество жизни (QoL) пациенты оценивали субъективно (0 баллов - прекрасно; 6 баллов -очень плохо). По степени выраженности симптомов нижних мочевых путей шкалы СНМП (IPSS) выделяют три категории тяжести: сумма баллов 7 или меньше - легкие нарушения, 8-19 баллов - умеренные нарушения, 20-35 баллов - тяжелые нарушения. Оценка указанных субъективных признаков проводилась пациентами самостоятельно с использованием стандартных бланков анкет-опросников. Выраженность послеоперационного болевого синдрома оценивали по данным визуально-аналоговой шкалы Visual Analog scale (ВАШ/VAS) боли. Данные оценки субъективного состояния интерпретировались следующим образом: 0-1 балл - боли нет; 2-3 балла - легкая боль; 4-5 баллов - умеренная непостоянная боль; 6-7 баллов - умеренная постоянная боль; 8-9 баллов - сильная боль; более 10 баллов - невыносимая боль.
Перед удалением уретрального катетера выполнялась перикатетерная уретрография для оценки возможного дефекта герметичности уретры и решения вопроса о продленном уретральном дренировании.
Эффективность проведенного лечения оценивали по нескольким критериям: максимальная скорость потока мочи (методом урофлоуметрии), диаметр просвета уретры в зоне пластики (по данным уретрографии), объем остаточной мочи (УЗ-оценка). Объем остаточной постмикционной мочи (после мочеиспускания) оценивали в два этапа: определение объема мочевого пузыря до и после мочеиспускания.
По достижении трехмесячного периода после операции все пациенты не реже чем один раз в полгода-год проходили установленную протоколом исследования стандартную оценку состояния: консультацию уролога, клинические анализы крови и мочи, уретрографию, уретроскопию, урофлоуметрию, УЗИ мочевыделительной системы. Также проводилась оценка субъективного статуса по шкалам IPSS, QoL, МИЭФ-5. Фиксировали жалобы пациентов.
Эффективность проведенного лечения оценивали по нескольким критериям: максимальная скорость потока мочи (методом урофлоуметрии), диаметр просвета уретры в зоне пластики (по данным уретрографии), объем остаточной мочи (УЗ-оценка), показатели оценочных шкал (IPSS, QoL и МИЭФ-5). Успешными (свободными от рецидива) считали результаты лечения пациентов со следующими параметрами спустя 3 месяца и более после операции: Qmax более 12 мл/сек; отсутствие остаточной мочи, признаков рецидива по данным уретрографии (нормальный диаметр просвета уретры в зоне пластики 5 мм и более); отсутствие тяжелых СНМП, неудовлетворительного качества жизни.
При проведении исследования использовали два различных протокола лечения: стандартный (группа I), описанный, к примеру, в [В.К. Гостищев. Общая хирургия: учебник. Москва: ГЭОТАР [Электронный ресурс] / В.К. Гостищев http://www.studmedlib.ru/book/ISBN9785970438787.htmlМедиа,M.: ГЭОТАР 2016. - 736 с. Медиа, 2016.], когда пациенту запрещено употребление жидкости и пищи в день операции, осуществлялось очищение кишечника накануне вечером и утром в день операции, выполнялась премедикация седативным препаратом (диазепам). Интраоперационно применялся рассасывающийся шовный материал для отдельных узловых швов, использовалась в том числе монополярная диатермокоагуляция. Кожный шов отдельноузловой, стандартные перевязки. В первые сутки после операции разрешалось только употребление жидкости, прием пищи допускался со второго послеоперационного дня. В послеоперационном периоде в первые сутки после операции выполнялось обезболивание наркотическими анальгетиками по необходимости. Мобилизация пациента осуществлялась на вторые сутки после операции. Инфузионную терапию проводили в течение первых 24-48 часов. Антибактериальная профилактика стандартная. Соблюдался минимальный рекомендованный срок госпитализации после хирургического лечения - 7 дней. Уретральный катетер удалялся на 10-21 сутки после операции после выполнения перикатетерной уретрографии.
Всем пациентам обеих групп использовалась нейроаксиальная анестезия, проводилась профилактика тромбоэмболических осложнений (низкомолекулярные гепарины и компрессионный трикотаж), защита от стресс-язв (блокаторы протоновой помпы). Выраженность послеоперационного болевого синдрома оценивали по данным визуально-аналоговой шкалы (ВАШ) боли в первые сутки после хирургического лечения.
Для сравнительной оценки ближайших результатов хирургического лечения стриктурной болезни уретры после стандартного протокола лечения (ST, I группа) и после осуществления предлагаемого способа периоперационной курации в соответствии с концепцией программы ускоренного выздоровления (ER, II группа) проведен сравнительных анализ послеоперационных параметров состояния пациентов и конечных результатов исследования.
В раннем и позднем послеоперационном периоде случаев летальности в обеих группах не зафиксировано. В раннем и позднем послеоперационном периоде не зафиксировано осложнений анестезиологического пособия, либо ухудшения состояния по общесоматическому статусу. Потребности в искусственной вентиляции легких или проведении дыхательной поддержки не возникло ни в одном случае в группах сравнения. Сердечная недостаточность, потребовавшая инотропной поддержки, также была не зафиксирована ни в одном наблюдении.
Межгрупповой анализ размеров хирургического доступа показал, что средние линейные его размеры у пациентов I группы составили 7,1±2,2 см, что достоверно больше, чем у пациентов II группы (3,2±1,1 см, р<0,001). На фиг. 1 показана диаграмма размаха размеров хирургического доступа в группах сравнения., где: 1 - для группы I, 2 - для группы II.
Выполнен хронометрический анализ операционного периода. Среднее значение продолжительности оперативного вмешательства у пациентов в группах I и II составило 1,2±0,32 ч и 1,1±0,26 часов, соответственно (р=0,085).
В таблице 3 представлена сравнительная характеристика показателей послеоперационного состояния пациентов групп сравнения.
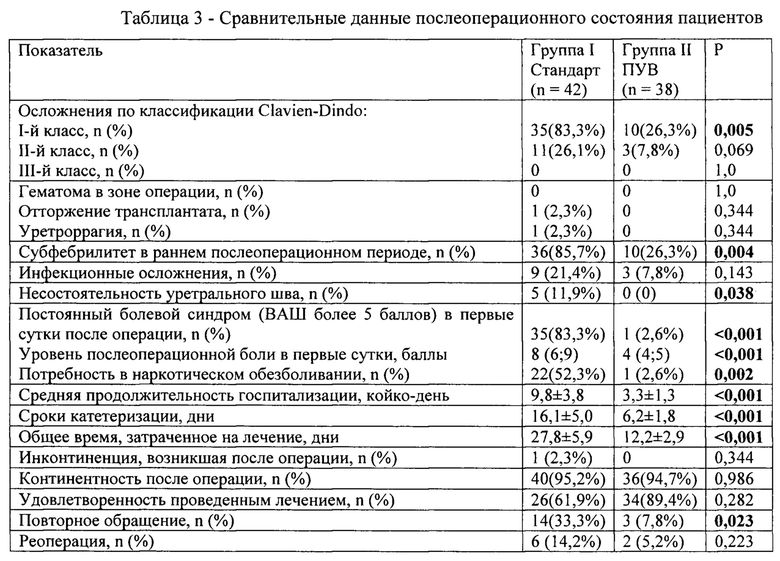
При анализе результатов исследования установлено, что в обеих группах сравнения послеоперационные осложнения второго класса по классификации Clavien-Dindo в раннем и позднем периодах развивались сопоставимо редко, осложнения третьего класса не встречались (р>0,05).
Несостоятельность уретрального шва и вероятность повторного осложнения с большей вероятностью происходили в группе I стандартного лечебного протокола (р<0,05). Общее время, затраченное на лечение и длительность госпитализации были значимо меньше в группе II по предлагаемому способу периоперационной курации (р<0,05).
Болевой синдром в первые сутки и потребность в наркотических анальгетиках были более выражены в группе I (р<0,05).
В отдаленном послеоперационном периоде отмечен единственный эпизод летальности в группе I, не связанный с проведенной пластической операцией.
В отдаленном послеоперационном периоде отмечен ряд значимых осложнений. В 9 (21,4%) случаях из I группы и в 3 случаях (7,8%) из II группы отмечен острый воспалительный процесс мочеполовой системы в период от 3 до 12 месяцев, что потребовало назначение антибактериальных препаратов (р=0,143).
Жалобы на укорочение полового члена при активном опросе через 3 месяца после операции предъявили 9 (21,4%) пациентов I группы и 5 (13,1%) пациентов II группы (р=0,414).
Следует отметить, что развитие инконтиненции возникло только в одном случае в группе I. Таким образом, однофакторный логистический регрессионный анализ этого показателя не выявил статистически значимой взаимосвязи с исходными параметрами (р>0,05) в группах сравнения.
Послеоперационные показатели уродинамики, объективного статуса и функционального статуса (IPSS, QoL, МИЭФ-5) в группах сравнения представлены в таблице 4.
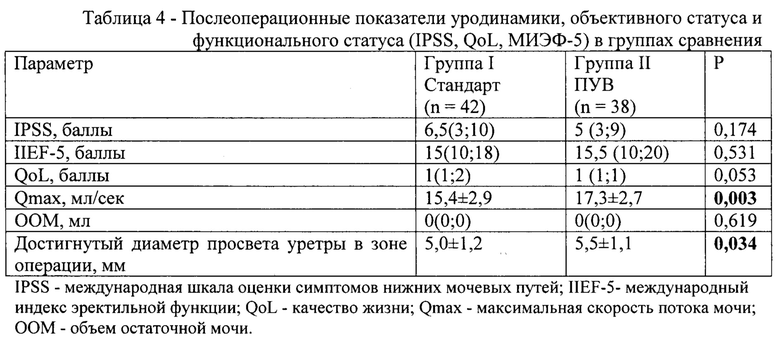
Проведен сравнительный межгрупповой анализ этих показателей. Отмечены лучшее функциональное и объективное состояние пациентов группы II по ряду параметров, таких как средняя максимальная скорость потока мочи и достигнутый минимальный диаметр уретры в зоне пластики (р<0,05).
Средний срок клинических наблюдений составил 888 дней с 95% ДИ (доверительный интервал) 375-513 дней, максимальный срок - 1634 дней. Общие показатели отдаленного послеоперационного периода в группах сравнения представлены в таблице 5.

Для пациентов I группы средний срок наблюдений составил 910 дней с 95% ДИ 367-570 дней (максимальный период 1634 дней). Для пациентов II группы средний срок наблюдений составил 865 день с 95%ДИ 344-547 дня (максимальный период 1419 дней). Период наблюдения оказался сопоставим для обеих групп (р=0,648).
Сравнительные сведения об успешности хирургического лечения пациентов в группах сравнения представлены в таблице 6.

У пациентов I группы из 42 первичных операций успешными оказались 36 (85,7%). У пациентов II группы из 38 первичных операций успешными были 36. Таким образом, первичная эффективность составила 94,7%.
Значения оценок Каплана-Мейера свободы от рецидива стриктуры уретры в I группе оказались равными 94,8±3,5% в течение первого года (95% ДИ 80,7-98,6%), через четыре года - 83,24±6,2% (95% ДИ 66,3-92,1%). Эти показатели у пациентов II группы в течение первого года были равны 97,1±8,1% (95% ДИ 81,4-99,5%), а через четыре года -93,9±4,1% (95% ДИ 77,6-98,4%).
Лог-ранговый критерий не выявил статистически значимых различий (гомогенность групп: р=0,215; χ2=1,536) по частоте рецидива за весь период наблюдения (р=0,218; χ2=1,52), что графически выражено по методу Каплана-Мейера (на фиг. 2 представлен график свободы от рецидива в группах исследования по методу Каплан-Мейера), где график 1 - для группы I, график 2 - для группы II.
Отбор предикторных переменных осуществлялся по исходным параметрам, а также по параметрам контроля в послеоперационном периоде. Регрессионная модель пропорциональных рисков Кокса, демонстрирующая влияние переменных на риск рецидива представлена в таблице 7.
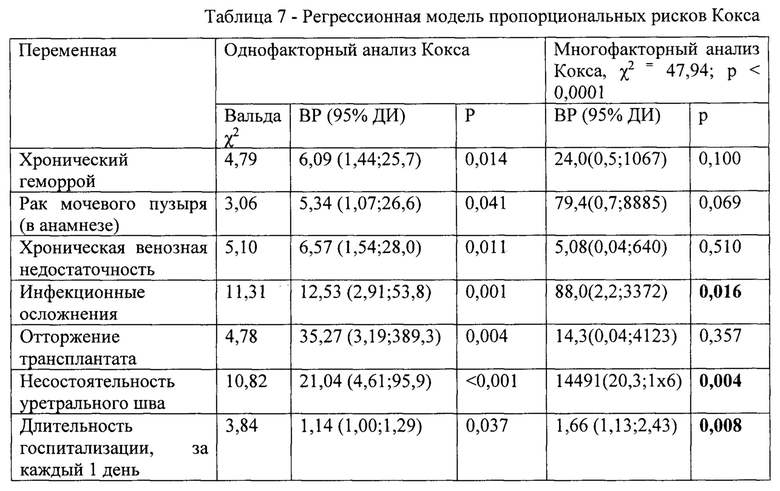
Многофакторный регрессионный анализ пропорциональных рисков Кокса (выборка из р<0,05) продемонстрировал значимость несостоятельности уретрального шва, инфекционных осложнений и длительности госпитализации в прогнозировании возможного рецидива после уретропластической операции. Заявляемый способ предлагает несколько простых приемов для минимизации подобного риска. Во-первых, предлагается использовать только непрерывный и герметичный уретральный шов, во-вторых, шов дополнительно обрабатывается клеем, и в-третьих, окружающие ткани инфильтрируются плазмой, обогащенной тромбоцитами. Применение плазмы, обогащенной тромбоцитами, позволяют уменьшить зоны некроза, снизить выраженность локального воспаления и улучшить ангиогенез, что было подтверждено рядом работ [133, 134, 160, 161]. Фибриновый клей обеспечивают лучшую герметичность, надежную фиксацию трансплантата, уменьшает риски периуретральных затеков [162], а также снижает риски формирования свищей [163]. Имеются данные об успешном применении смеси фибринового и цианакрилового клея для лечения несостоятельности пузырно-уретральных анастомозов после простатэктомии [164]. Риски инфекционных осложнения и продленной госпитализации имеют прямую логическую связь: избыточное пребывание в стационаре повышает вероятность инфицирования госпитальной микрофлорой. Также к повышенным рискам инфекционных осложнений приводит длительное уретральное дренирование. Таким образом, сокращения длительности госпитализации и сроков катетеризации уменьшают риски инфекционных осложнений.
Анализируя сравнительную межгрупповую эффективность проведенного лечения на основании установленных в исследовании критериев, хорошие результаты лечения были получены у 6 (14,2%) пациентов I группы и у 28 (73,6%) пациентов II группы (р=0,0006). Удовлетворительные результаты получены у 30 (71,4%) пациентов I группы и 8 (21%) пациентов II группы (р=0,0059). Неудовлетворительные итоги зафиксированы у 6 (14,72%) пациентов I группы и у 2 (5,2%) пациента II групп (р=0,223).
Список использованной литературы:
1. Myers, R.P. Male urethral sphincteric anatomy and radical prostatectomy / R.P. Myers // Urol. Clin. North Am. - 1991. - Vol. 18, №2. - P. 211-227.
2. Anatomy and histology of the lower urinary tract / W. Pradidarcheep, C. Wallner, N.F. Dabhoiwala, W.H. Lamers // Handb. Exp.Pharmacol. - 2011. - №202. - P. 117-148. - doi: 10.1007/978-3-642-16499-6_7.
3. Raz, S. The vascular component in the production of intraurethral pressure / S. Raz, M. Caine, M. Zeigler // J. Urol. - 1972. - Vol. 108, №1. - P. 93-6.
4. Котов С.В. Выбор оптимального метода уретропластики при лечении стриктур мочеиспускательного канала: дис… д-ра мед. наук: 14.01.23 / Котов Сергей Владиславович. - М., 2015. - 306 с., Пушкарь, Д.Ю. Урология: учебник / Д.Ю. Пушкарь. - 2-е издани изд. - М.: ГЭОТАР-Медиа, 2017. - 472 с.
5. Campbell-Walsh urology: eleventh edition review [Электронный ресурс] / W.S. William, S. McDougal, A.J. Wein [et al.]. - Elsiever, 2016. - URL: http://www.worldcat.org/title/campbell-walsh-urology-eleventh-edition-review/oclc/933336446 (accessed: 30.05.2018).
6. Buddha, S. Complication of urethral catheterisation / S. Buddha // Lancet. - 2005. -Vol. 365, №9462. - P. 909. - doi:10.1016/S0140-6736(05)71051-5.
7. Incidence and prevention of iatrogenic urethral injuries / C. Kashefi, K. Messer, R. Barden [et al.] // J. Urol. - 2008. - Vol. 179, №6. - P. 2254-2257. - doi:10.1016/j.juro.2008.01.108.
8. Mundy, A.R. Urethral trauma. Part II: Types of injury and their management / A.R. Mundy, D.E. Andrich // BJU Int. - 2011. - Vol. 108, №5. - P. 630-650. - doi:10.1111/j.l464-410X.2011.10340.x.
9. Contemporary urethral stricture characteristics in the developed world / E. Palminteri, E. Berdondini, P. Verze [et al.] // Urology. - 2013. - Vol. 81, №1. - P. 191-197. - doi:10.1016/j.urology.2012.08.062.
10. Etiology of urethral stricture disease in the 21st century / N. Lumen, P. Hoebeke, P. Willemsen [et al.] // J. Urol. - 2009. - Vol. 182, №3. - P. 983-987. - doi:10.1016/j.juro.2009.05.023
11. Park, S. Straddle injuries to the bulbar urethra: management and outcomes in 78 patients / S. Park, J.W. McAninch // J. Urol. - 2004. - Vol. 171, №2. - P. 722-725. - doi:10.1097/01.ju.0000108894.09050.c0.
12. A geographic analysis of male urethral stricture aetiology and location / D.M. Stein, D.J. Thum, G. Barbagli [et al.] // BJU Int. - 2013. - Vol. 112, №6. - P. 830-834. - doi: 10.11111]. 1464-410X.2012.11600.x.
13. Urological Trauma [Электронный ресурс] / N.D. Kitrey (Chair), N. Djakovic, F.E. Kuehhas [et al.] / European Association of Urology. - Arnhem, 2018. - URL: http://uroweb.Org/guideline/urological-trauma/#note_261 (accessed: 30.05.2018).
14. Русаков, В.И. Хирургия мочеиспускательного канала / В.И. Русаков. - М.: Медицина, 1991.-269 с.
15. Turner-Warwick, R. Complex traumatic posterior urethral strictures / R. Turner-Warwick // Trans. Am. Assoc. Genitourin. Surg. - 1976. - Vol. 68. - P. 60-72.
16. Webster, G.D. Perineal transpubic repair: a technique for treating post-traumatic prostatomembranous urethral strictures / G.D. Webster, B. Goldwasser // J. Urol. - 1986. – Vol .135, №2. - P. 278-279.
17. Corriere, J.N. 1-Stage delayed bulboprostatic anastomotic repair of posterior urethral rupture: 60 patients with 1-year followup / J.N. Corriere // J. Urol. - 2001. - Vol. 165, №2. - P. 404-07. - doi:10.1097/00005392-200102000-00012.
18. Corriere, J.N. Voiding and erectile function after delayed one-stage repair of posterior urethral disruptions in 50 men with a fractured pelvis / J.N. Corriere, D.C. Rudy, G.S. Benson // J. Trauma. - 1994. - Vol. 37, №4. - P. 587-589.
19. Flynn, B.J. Perineal repair of pelvic fracture urethral distraction defects: experience in 120 patients during the last 10 years / B.J. Flynn, F.C. Delvecchio, G.D. Webster // J Urol. -2003. - Vol. 170, №5. - P. 1877-1880. - doi:10.1097/01.ju.0000091642.41368.f5.
20. Koraitim, М.М. Posttraumatic posterior urethral strictures in children: a 20-year experience / M.M. Koraitim // J. Urol. - 1997. - Vol. 157, №2. - P. 641-645.
21. Mundy, A.R. Urethroplasty for posterior urethral strictures / A.R. Mundy // BJU. - 1996. - Vol. 78, №2. - P. 243-247.
22. Santucci, R.A. Anastomotic urethroplasty for bulbar urethral stricture: analysis of 168 patients / R.A. Santucci, L.A. Mario, J.W. McAninch // J. Urol. - 2002. - Vol. 167, №4. -P. 1715-1719.
23. The relationship between erectile dysfunction and open urethroplasty: a systematic review and meta-analysis / U.A.S. Review, C. Feng, Y. Xu, G. Barbagli // J. Sex. Med. - 2013. -Vol. 10, №8. - P. 2060-2068 - doi:10.1111/jsm.12181.
24. Zinman, L.M. The management of traumatic posterior urethral distraction defects / L.M. Zinman//J. Urol. - 1997. - Vol. 157, №2. - P. 511-512.
25. Perineal anastomotic urethroplasty for posttraumatic urethral stricture with or without previous urethral manipulations: a review of 61 cases with long-term followup / N. Lumen, P. Hoebeke, B. De Troyer [et al.] // J. Urol. - 2009. - Vol. 181, №3. - P. 1196-1200. - doi:10.10167j.juro.2008.10.170.
26. Recurrence and complications after transperineal bulboprostatic anastomosis for posterior urethral strictures resulting from pelvic fracture: a retrospective study from a urethral referral centre / Q. Fu, J. Zhang, Y. Sa [et al.] // BJU Int. - 2013. - Vol. 112, №4. - P. 358-363. - doi:10.1111/bju.12171.
27. Oosterlinck, W. Surgical treatment of urethral stenoses: technical aspects / W. Oosterlinck, N. Lumen, G. Van Cauwenberghe // Annales d'urologie. - 2007. - Vol. 41, №4. - P. 173-207.
28. Особенности применения методики анастомотической уретропластики при посттравматических стриктурах бульбомембранозной уретры / А.В. Живов, О.Б. Лоран, С.В. Котов [и др.] // Урология. - 2010. - №5. - С. 41-46.
29. Koraitim, М.М. The lessons of 145 posttraumatic posterior urethral strictures treated in 17 years / M.M. Koraitim // J. Urol. - 1995. - Vol. 153, №1. - P. 63-66. - doi:10.1097/00005392-199501000-00024.
30. Dorsal onlay lingual mucosal graft urethroplasty for urethral strictures in women / G.K. Sharma, A. Pandey, H. Bansal [et al.] // BJU Int. - 2010. - Vol. 105, №9. - P. 1309-1312. - doi:10.1111/j.1464-410X.2009.08951.x.
31. Lingual mucosal graft urethroplasty for anterior urethral reconstruction / A. Simonato, A. Gregori, С Ambruosi [et al.] // Eur. Urol. - 2008. - Vol. 54, №1. - P. 79-87. - doi:10.1016/j.eururo.2008.01.023.
32. Lingual mucosal graft urethroplasty for anterior urethral strictures / S.K. Das, A. Kumar, G.K. Sharma [et al.] // Urology. - 2009. - Vol. 73, №1. - P. 105-108. - doi:10.1016/j.urology.2008.06.041.
33. One-stage dorsal lingual mucosal graft urethroplasty for the treatment of failed hypospadias repair / H.-B. Li, Y.-M. Xu, Q. Fu [et al.] // Asian J. Androl. - 2016. - Vol. 18, №3. - P. 467-470. - doi:10.4103/1008-682X.157545.
34. The long-term results of lingual mucosal grafts for repairing long anterior urethral strictures / H. Abdelhameed, S. Elgamal, M.A. Farha [et al.] // Arab. J. Urol. - 2015. - Vol. 13, №2. - P. 128-133. - doi:10.1016/j.aju.2014.11.009.
35. The use of lingual mucosal graft in adult anterior urethroplasty: surgical steps and short-term outcome / G. Barbagli, M. De Angelis, G. Romano [et al.] // Eur. Urol. - 2008. - Vol. 54, №3. - P. 671-676. - doi:10.1016/j.eururo.2007.12.011.
36. Treatment of urethral strictures using lingual mucosas urethroplasty: experience of 92 cases / Y. Xu, Q. Fu, Y. Sa [et al.] // Chin. Med. J. - 2010. - Vol. 123, №4. - P. 458-462.
37. Dorsal onlay buccal mucosa versus penile skin flap urethroplasty for anterior urethral strictures: results from a randomized prospective trial / D. Dubey, V. Vijjan, R. Kapoor [et al.] // J Urol. - 2007. - Vol. 178, №6. - P. 2466-2469. - doi:10.1016/j.juro.2007.08.010.
38. Dorsal onlay urethroplasty using buccal mucosa graft versus penile skin flap for management of long anterior urethral strictures: a prospective randomized study / M.G. Soliman, M. Abo Farha, A.S. El Abd [et al.] // Scand. J. Urol. - 2014. - Vol. 48, №5. - P. 466-73. - doi:10.3109/21681805.2014.888474.
39. Выбор оптимального свободного лоскута для заместительной уретропластики при протяженных стриктурах уретры / О.Б. Лоран, Е.И. Велиев, С.В. Котов, С.В. Беломытцев // Урология. - 2011. - №4. - С. 11-16.
40. Histopathological characteristics of buccal mucosa transplants in humans after engraftment to the urethra: a prospective study / A. Soave, S. Steurer, R. Dahlem [et al.] // J. Urol. - 2014. - Vol. 192, №6. - P. 1725-1729. - doi:10.1016/j.juro.2014.06.089.
41. Nanavati, A.J. A comparative study of «fast-track» versus traditional peri-operative care protocols in gastrointestinal surgeries / A.J. Nanavati, S. Prabhakar // Journal of Gastrointestinal Surgery: Official Journal of the Society for Surgery of the Alimentary Tract. - 2014.-T. 18. - №4. - C. 757-767. DOI: 10.1007/s11605-013-2403-2.
42. Kehlet, H. Synergism between analgesics / H. Kehlet // Annals of Medicine. - 1995. - T. 27. - №2. – С. 259-262. DOI:10.3109/07853899509031968.
43. Kehlet, H. Late post-operative hypoxaemia and organ dysfunction / H. Kehlet, J. Rosenberg // European Journal of Anaesthesiology. Supplement. - 1995. - T. 10. - С. 31-34.
44.  Convalescence and hospital stay after colonic surgery with balanced analgesia, early oral feeding, and enforced mobilisation /
Convalescence and hospital stay after colonic surgery with balanced analgesia, early oral feeding, and enforced mobilisation /  P. Hesselfeldt и др. // The European Journal of Surgery=Acta Chirurgica. - 1995. - T. 161. - №4. - C. 283-288.
P. Hesselfeldt и др. // The European Journal of Surgery=Acta Chirurgica. - 1995. - T. 161. - №4. - C. 283-288.
45. Wilmore, D.W. Management of patients in fast track surgery / D.W. Wilmore, H. Kehlet // BMJ (Clinical research ed.). - 2001. - T. 322. - №7284. - C. 473-476. DOI: 10.1136/bmj.322.7284.473.
46. Wareing, M. Piloting day-case surgery for prostate resection / M. Wareing, S. Candler // Professional Nurse (London, England). - 1999. - T. 14. - №11. - C. 754-758.
47. Brinkman, M.J. Fast track transurethral resection of the prostate: application of case map improves length of stay without compromising patient outcome / M.J. Brinkman, J. Duffin, S.K. Wilson, J.R. Delk // Nursing Case Management: Managing the Process of Patient Care. -1997. - T. 2. - Fast track transurethral resection of the prostate. - №3. - С. 115-121.
48. Mueller, E.J. Reduction of length of stay and cost of transurethral resection of the prostate by early catheter removal / E.J. Mueller, E.J. Zeidman, P.M. Desmond и др. // British Journal of Urology. - 1996. - T. 78. - №6. - C. 893-896. DOI:10.1046/j.1464-410x.1996.01614.x.
49. Prasopsuk, S. Safety of a first-day catheter removal after transurethral resection of the prostate (TURP): a propensity score-matched historical control study / S. Prasopsuk, S. Tunruttanakul // Insight Urology. - 2021. - Vol.42. - Safety of a first-day catheter removal after transurethral resection of the prostate (TURP). - №1. - P. 40-45. DOI: 10.52786/isu.a.21.
50. Ljungqvist, O. Enhanced Recovery After Surgery: A Review / O. Ljungqvist, M. Scott, K.C. Fearon // JAMA surgery. - 2017. - T. 152. - Enhanced Recovery After Surgery. - №3. - C. 292-298. DOI: 10.1001/jamasurg.2016.4952.
51. Затевахин, И.И. Программа ускоренного выздоровления хирургических больных. Fast track / И.И. Затевахин, К.В. Лядова, Пасечник И. Н. - Москва: ГЭОТАР-Медиа, 2017. - 208 с.
52. Schricker, Т. Туре 2 diabetes mellitus and the catabolic response to surgery / T. Schricker, R. Gougeon, L. Eberhart и др. // Anesthesiology. - 2005. - Т. 102. - №2. - С. 320-326. DOI: 10.1097/00000542-200502000-00013.
53. Ross-Huot, M.-C. Effects of glycemic regulation on chronic postischemia pain / M.-C. Ross-Huot, A. Laferriere, CM. Gi и др. // Anesthesiology. - 2011. - Т. 115. - №3. - С. 614-625. DOI: 10.1097/ALN.0b013e31822a63c9.
54. Shohat, N. Inadequate Glycemic Control Is Associated With Increased Surgical Site Infection in Total Joint Arthroplasty: A Systematic Review and Meta-Analysis / N. Shohat, K. Muhsen, R. Gilat и др. // The Journal of Arthroplasty. - 2018. - T. 33. - Inadequate Glycemic Control Is Associated With Increased Surgical Site Infection in Total Joint Arthroplasty. - №7. - C. 2312-2321.e3. DOI:10.1016/j.arth.2018.02.020.
55. Umpierrez, G.E. Hyperglycemia: an independent marker of in-hospital mortality in patients with undiagnosed diabetes / G.E. Umpierrez, S.D. Isaacs, N. Bazargan и др. // The Journal of Clinical Endocrinology and Metabolism. - 2002. - T. 87. - Hyperglycemia. - №3. - C. 978-982. DOI: 10.1210/jcem.87.3.8341.
56. Kwon, S. Importance of perioperative glycemic control in general surgery: a report from the Surgical Care and Outcomes Assessment Program / S. Kwon, R. Thompson, P. Dellinger и др. // Annals of Surgery. - 2013. - T. 257. - Importance of perioperative glycemic control in general surgery. - №1. - C. 8-14. DOI: 10.1097/SLA.0b013e31827b6bbc.
57. Hermanides, J. Perioperative hyperglycemia and neurocognitive outcome after surgery: a systematic review / J. Hermanides, E. Qeva, B. Preckel, F. Bilotta // Minerva Anestesiologica. - 2018. - T. 84. - Perioperative hyperglycemia and neurocognitive outcome after surgery. - №10. - C. 1178-1188. DOI: 10.23736/S0375-9393.18.12400-X.
58. Abdelmalak, B.B. Preoperative blood glucose concentrations and postoperative outcomes after elective non-cardiac surgery: an observational study / B.B. Abdelmalak, J. Knittel, J.B. Abdelmalak и др. // British Journal of Anaesthesia. - 2014. - Т. 112. - Preoperative blood glucose concentrations and postoperative outcomes after elective non-cardiac surgery. -№1. - C. 79-88. DOI: 10.1093/bja/aet297.
59. Kahn, C.R. Insulin resistance, insulin insensitivity, and insulin unresponsiveness: a necessary distinction / C.R. Kahn // Metabolism: Clinical and Experimental. - 1978. - T. 27. -Insulin resistance, insulin insensitivity, and insulin unresponsiveness. - №12 Suppl 2. - C. 1893-1902. DOI: 10.1016/s0026-0495(78)80007-9.
60. Кобылянский В.И. Роль контринсулярных гормонов в регуляции гомеостаза глюкозы и патогенезесахарного диабета 2-го типа при ХОБЛ / В.И. Кобылянский // Проблемы Эндокринологии. - 2021. - Т. 67. -№2. - С. 93-101. DOI: 10.14341/prob12566.
61. Тарасова И.А. Инсулинорезистентность после хирургических вмешательств / И.А. Тарасова, А.Л. Шестаков, В.В. Никода // Сахарный диабет. - 2017. - Т. 20. - №2. - С. 119-125. DOI: 10.14341/7637.
62. Thorell, A. Insulin resistance: a marker of surgical stress / A. Thorell, J. Nygren, O. Ljungqvist // Current Opinion in Clinical Nutrition and Metabolic Care. - 1999. - T. 2. - Insulin resistance. - №l. - C. 69-78. DOI: 10.1097/00075197-199901000-00012.
63. Bagry, H.S. Metabolic syndrome and insulin resistance: perioperative considerations / H.S. Bagry, S. Raghavendran, F. Carli // Anesthesiology. - 2008. - T. 108. - Metabolic syndrome and insulin resistance. - №3. - C. 506-523. DOI: 10.1097/ALN.0b013e3181649314.
64. Wang, Z.G. Randomized clinical trial to compare the effects of preoperative oral carbohydrate versus placebo on insulin resistance after colorectal surgery / Z.G. Wang, Q. Wang, W.J. Wang, H.L. Qin // The British Journal of Surgery. - 2010. - T. 97. - №3. - C. 317-327. DOI: 10.1002/bjs.6963.
65. Giannoudis, P.V. Surgical stress response / P.V. Giannoudis, H. Dinopoulos, B. Chalidis, G.M. Hall // Injury. - 2006. - T. 37 Suppl 5. - C. S3-9. DOI: 10.1016/S0020-1383(07)70005-0.
66. Kinney, J.M. Protein metabolism and injury / J.M. Kinney, D.H. Elwyn // Annual Review of Nutrition. - 1983. - Т. 3. - C. 433-466. DOI: 10.1146/annurev.nu.03.070183.002245.
67. Donatelli, F. Preoperative Insulin Resistance and the Impact of Feeding on Postoperative Protein Balance: A Stable Isotope Study / F. Donatelli, D. Corbella, M. Di Nicola и др. // The Journal of Clinical Endocrinology & Metabolism. - 2011. - T. 96. - Preoperative Insulin Resistance and the Impact of Feeding on Postoperative Protein Balance. - №11. - С. E1789-E1797. DOI: 10.1210/jc.2011-0549.
68. Iwashyna, T.J. Long-term cognitive impairment and functional disability among survivors of severe sepsis / T.J. Iwashyna, E.W. Ely, D.M. Smith, K.M. Langa // JAMA. - 2010. - T. 304. - №16. - C. 1787-1794. DOI: 10.1001/jama.2010.1553.
69. Сатвалдиева, Э.А. Использование Fast-Track в детской урологии / Э.А. Сатвалдиева, М.У. Шакарова, И.Б. Маматкулов и др. // Урология. - 2022. - №4. - С. 52-55. DOI: 10.18565/urology.2022.4.52-55.
70. Кутлуев, М.М. Наш опыт применения программы раннего восстановления пациентов при различных урологических вмешательствах / М.М. Кутлуев, Р.И. Сафиуллин // Медицинский Вестник Башкортостана. - 2017. - Т. 12. - №3 (69). - С. 41-44.
71. Мазуренко, Д.А. Стратегия «fast-track» послеоперационного ведения пациентов после перкутанной нефролитотомии / Д.А. Мазуренко, А.В. Живов, Е.В. Берников и др. // Экспериментальная И Клиническая Урология. - 2016. - №1. - С. 36-40.
72. Мазуренко Д.А., Берников Е.В., Нерсисян Л.А., Дунец К.А., Енгай В.А., Гаджиев Н.К., Старцев В.Ю. Новая концепция послеоперационного ведения пациентов с конкрементами почек // Современные проблемы науки и образования. - 2017. - №3. - с. 7.. DOI: 10.17513/spno.26394.
73. Cerantola, Y. Guidelines for perioperative care after radical cystectomy for bladder cancer: Enhanced Recovery After Surgery (ERAS®) society recommendations / Y. Cerantola, M. Valerio, В. Persson и др. // Clinical Nutrition. - 2013. - Т. 32. - Guidelines for perioperative care after radical cystectomy for bladder cancer. - №6. - C. 879-887. DOI: 10.1016/j.clnu.2013.09.014.
74. Peerbocus, M. Enhanced Recovery After Surgery and Radical Cystectomy: A Systematic Review and Meta-Analysis / M. Peerbocus, Z.-J. Wang // Research and Reports in Urology. - 2021. - T. 13. - Enhanced Recovery After Surgery and Radical Cystectomy. - C. 535-547. DOI: 10.2147/RRU.S307385.
75. Toh, J.W.T. The role of mechanical bowel preparation and oral antibiotics for left-sided laparoscopic and open elective restorative colorectal surgery with and without faecal diversion / J.W.T. Toh, K. Phan, G. Ctercteko и др. // International Journal of Colorectal Disease. - 2018. - T. 33. - №12. - C. 1781-1791. DOI: 10.1007/s00384-018-3166-8.
76. Barbagli, G. One-stage Penile Urethroplasty Using Oral Mucosal Graft and Glue / G. Barbagli, G. Pellegrini, F. Corradini и др. // European Urology. - 2016. - T. 70. - №6. - C. 1069-1075. DOI: 10.1016/j.eururo.2016.04.025.
77. Farouk, A. Fibrin glue as a sealant in stentless laparoscopic pyeloplasty: A randomised controlled trial / A. Farouk, A. Tawfick, M. Reda и др. // Arab Journal of Urology. -2019. - T. 17. - Fibrin glue as a sealant in stentless laparoscopic pyeloplasty. - №3. - C. 228-233. DOI: 10.1080/2090598X.2019.1611990.
78. Ljungqvist, O. Enhanced Recovery After Surgery: A Complete Guide to Optimizing Outcomes. Enhanced Recovery After Surgery / O. Ljungqvist, N.K. Francis, R.D. Urman Google-Books-ID: xwXaDwAAQBAJ. - Springer Nature, 2020. - 630 p.
79. Meddings, J. Reducing unnecessary urinary catheter use and other strategies to prevent catheter-associated urinary tract infection: an integrative review / J. Meddings, M.A.M. Rogers, S.L. Krein и др. // BMJ quality & safety. - 2014. - T. 23. - Reducing unnecessary urinary catheter use and other strategies to prevent catheter-associated urinary tract infection. - №4. - C. 277-289. DOI: 10.1136/bmjqs-2012-001774.
80. Weibel, S. Drugs for preventing postoperative nausea and vomiting in adults after general anaesthesia: a network meta-analysis / S. Weibel,  L.H. Eberhart и др. // The Cochrane Database of Systematic Reviews. - 2020. - T. 10. - Drugs for preventing postoperative nausea and vomiting in adults after general anaesthesia. - C. CD012859. DOI: 10.1002/14651858.CD012859.pub2.
L.H. Eberhart и др. // The Cochrane Database of Systematic Reviews. - 2020. - T. 10. - Drugs for preventing postoperative nausea and vomiting in adults after general anaesthesia. - C. CD012859. DOI: 10.1002/14651858.CD012859.pub2.
81. Глыбочко, П.В. Хирургия быстрого восстановления в условиях урологического стационара: трудности и перспективы / П.В. Глыбочко, Е.А. Безруков, Т.М. Алексеева и др. // Медицинский Вестник Башкортостана. - 2017. - Т. 12. - Хирургия Быстрого Восстановления В Условиях Урологического Стационара. - №3 (69). - С. 118-125.
82. Hatzakorzian, R. Fasting blood glucose levels in patients presenting for elective surgery / R. Hatzakorzian, H. Bui, G. Carvalho и др. // Nutrition (Burbank, Los Angeles County, Calif.). - 2011. - T. 27. - №3. - C. 298-301. DOI: 10.1016/j.nut.2010.02.003.
83. Iqbal, U. Preoperative patient preparation in enhanced recovery pathways / U. Iqbal, J.B. Green, S. Patel и др. // Journal of Anaesthesiology, Clinical Pharmacology. - 2019. - T. 35. - № Suppl 1. - C. S14-S23. DOI: 10.4103/joacp.JOACP_54_18.
84. Forsmo, H.M. Randomized Controlled Trial of Extended Perioperative Counseling in Enhanced Recovery After Colorectal Surgery / H.M. Forsmo, C. Erichsen, A. Rasdal и др. // Diseases of the Colon and Rectum. - 2018. - T. 61. - №6. - C. 724-732. DOT. 10.1097/DCR.0000000000001007.
85. Guo, P. Preoperative education interventions to reduce anxiety and improve recovery among cardiac surgery patients: a review of randomised controlled trials / P. Guo // Journal of Clinical Nursing. - 2015. - T. 24. - Preoperative education interventions to reduce anxiety and improve recovery among cardiac surgery patients. - №1-2. - C. 34-46. DOI: 10.1111/jocn.12618.
86. Prionas, A. Feasibility, Safety and Efficacy of Enhanced Recovery After Living Donor Nephrectomy: Systematic Review and Meta-Analysis of Randomized Controlled Trials / A. Prionas, C. Craddock, V. Papalois // Journal of Clinical Medicine. - 2020. - T. 10. - Feasibility, Safety and Efficacy of Enhanced Recovery After Living Donor Nephrectomy. - №1. - С. E21. DOI: 10.3390/jcm10010021.
87. Beloborodov, V. A multidisciplinary approach to urinary system iatrogenic injuries / V. Beloborodov, V. Vorobev, I. Golub и др. // Central European Journal of Urology. - 2020. - T. 73. - №4. - C. 534-543. DOI: 10.5173/ceju.2020.0153.
88. Терновой, С.К. Междисциплинарность в урологии. Современная лучевая диагностика в урологии / С.К. Терновой, Ю.Г. Аляев, А.В. Амосов // Урология. - 2019. - Т. 4. - С. 25-27. DOI: 10.18565/urology.2019.4(Suppl.).25-27.
89. Бубнова, М.Г. Преабилитация как важный этап перед кардиохирургическими вмешательствами / М.Г. Бубнова, Д.М. Аронов, А.А. Сприкут и др. // Кардиоваскулярная терапия и профилактика. - 2021. - Т. 20. - №6. - С. 2998. DOI: 10.15829/1728-8800-2021 -2998.
90. Aronson, S. A Perioperative Medicine Model for Population Health: An Integrated Approach for an Evolving Clinical Science / S. Aronson, J. Westover, N. Guinn и др. // Anesthesia and Analgesia. - 2018. - T. 126. - A Perioperative Medicine Model for Population Health. - №2. - C. 682-690. DOI: 10.1213/ANE.0000000000002606.
91. Minnella, E.M. Patients with poor baseline walking capacity are most likely to improve their functional status with multimodal prehabilitation / E.M. Minnella, R. Awasthi, C. Gillis и др. // Surgery. - 2016. - Т. 160. - №4. - С. 1070-1079. DOI: 10.1016/j.surg.2016.05.036.
92. Barth, R.J. Short-term Preoperative Diet Decreases Bleeding After Partial Hepatectomy: Results From a Multi-institutional Randomized Controlled Trial / R.J. Barth, J.B. Mills, A.A. Suriawinata и др. // Annals of Surgery. - 2019. - T. 269. - Short-term Preoperative Diet Decreases Bleeding After Partial Hepatectomy. - №1. - C. 48-52. DOI: 10.1097/SLA.0000000000002709.
93. Jagoe, R.T. The influence of nutritional status on complications after operations for lung cancer / R.T. Jagoe, Т.Н. Goodship, G.J. Gibson // The Annals of Thoracic Surgery. - 2001. - T. 71. - №3. - C. 936-943. DOI: 10.1016/s0003-4975(00)02006-3.
94. Munoz, M. International consensus statement on the peri-operative management of anaemia and iron deficiency / M. Munoz, A.G. Acheson, M. Auerbach и др. // Anaesthesia. - 2017. - Т. 72. - №2. - С. 233-247. DOI: 10.1111/anae.13773.
95. Irving, B.A. Combined training enhances skeletal muscle mitochondrial oxidative capacity independent of age / B.A. Irving, I.R. Lanza, G.C. Henderson и др. // The Journal of Clinical Endocrinology and Metabolism. - 2015. - T. 100. - №4. - C. 1654-1663. DOI: 10.1210/jc.2014-3081.
96. Barberan-Garcia, A. Personalised Prehabilitation in High-risk Patients Undergoing Elective Major Abdominal Surgery: A Randomized Blinded Controlled Trial / A. Barberan-Garcia, M. Ubre, J. Roca и др. // Annals of Surgery. - 2018. - T. 267. - Personalised Prehabilitation in High-risk Patients Undergoing Elective Major Abdominal Surgery. - №1. - C. 50-56. DOI: 10.1097/SLA.0000000000002293.
97. DeFronzo, R.A. Glucose clamp technique: a method for quantifying insulin secretion and resistance / R.A. DeFronzo, J.D. Tobin, R. Andres // The American Journal of Physiology. - 1979. - T. 237. - Glucose clamp technique. - №3. - С. E214-223. DOI: 10.1152/ajpendo.1979.237.3.E214.
98. Nakadate, Y. Body mass index predicts insulin sensitivity during cardiac surgery: a prospective observational study / Y. Nakadate, H. Sato, T. Sato и др. // Canadian Journal of Anaesthesia=Journal Canadien D'anesthesie. - 2018. - T. 65. - Body mass index predicts insulin sensitivity during cardiac surgery. - №5. - C. 551-559. DOI: 10.1007/s12630-018-1081-7.
99. Sato, H. The association of preoperative glycemic control, intraoperative insulin sensitivity, and outcomes after cardiac surgery / H. Sato, G. Carvalho, T. Sato и др. // The Journal of Clinical Endocrinology and Metabolism. - 2010. - T. 95. - №9. - C. 4338-4344. DOI: 10.1210/jc.2010-0135.
100. Morais, J.A. Protein turnover and requirements in the healthy and frail elderly / J.A. Morais, S. Chevalier, R. Gougeon // The Journal of Nutrition, Health & Aging. - 2006. - T. 10. - №4. - C. 272-283.
101. Bozzetti, F. Perioperative total parenteral nutrition in malnourished, gastrointestinal cancer patients: a randomized, clinical trial / F. Bozzetti, C. Gavazzi, R. Miceli и др. // JPEN. Journal of parenteral and enteral nutrition. - 2000. - T. 24. - Perioperative total parenteral nutrition in malnourished, gastrointestinal cancer patients. - №1. - C. 7-14. DOI: 10.1177/014860710002400107.
102. М.И. Певзнер. Основы лечебного питания. Издание третье, перераб. - Государственное издательство медицинской литературы, Медгиз, Москва, 1958 г. 594 стр.
103. Shapira, Z. Bowel preparation: comparing metabolic and electrolyte changes when using sodium phosphate/polyethylene glycol / Z. Shapira, L. Feldman, R. Lavy и др. // International Journal of Surgery (London, England). - 2010. - T. 8. - Bowel preparation. - №5. - C. 356-358. DOI: 10.1016/j.ijsu.2010.04.009.
104. Rollins, K.E. Impact of mechanical bowel preparation in elective colorectal surgery: A meta-analysis / K.E. Rollins, H. Javanmard-Emamghissi, D.N. Lobo // World Journal of Gastroenterology. - 2018. - T. 24. - Impact of mechanical bowel preparation in elective colorectal surgery. - №4. - C. 519-536. DOI: 10.3748/wjg.v24.i4.519.
105. Nygren, J. Guidelines for perioperative care in elective rectal/pelvic surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations / J. Nygren, J. Thacker, F. Carli и др. // Clinical Nutrition (Edinburgh, Scotland). - 2012. - T. 31. - Guidelines for perioperative care in elective rectal/pelvic surgery. - №6. - C. 801-816. DOI: 10.1016/j.clnu.2012.08.012.
106. Kardash, K. Single-dose premedication enhances multimodal analgesia after knee arthroplasty / K. Kardash, E. Harvey, S. Payne, S.S. Yang // Journal of Perioperative Practice. - 2022. - C. 17504589211049292. DOI: 10.1177/17504589211049292.
107. Gould, M.K. Prevention of VTE in nonorthopedic surgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines / M.K. Gould, D.A. Garcia, S.M. Wren и др. // Chest. - 2012. - Т. 141. - Prevention of VTE in nonorthopedic surgical patients. - №2 Suppl. - C. e227S-e277S. DOI: 10.1378/chest.11-2297.
108. Бокерия, JI.A. Российские Клинические Рекомендации По Диагностике, Лечению И Профилактике Венозных Тромбоэмболических Осложнений (ВТЭО) / Л.А. Бокерия, И.И. Затевахин, А.И. Кириенко и др. // Флебология. - 2015. - Т. 9. - №4-2. - С. 1-52.
109. Ljungqvist, О. Modulating postoperative insulin resistance by preoperative carbohydrate loading / O. Ljungqvist // Best Practice & Research. Clinical Anaesthesiology. -2009. - T. 23. - №4. - C. 401-409. DOI: 10.1016/j.bpa.2009.08.004.
110. Brady, M. Preoperative fasting for adults to prevent perioperative complications / M. Brady, S. Kinn, P. Stuart // The Cochrane Database of Systematic Reviews. - 2003. - №4. - C. CD004423. DOI: 10.1002/14651858.CD004423.
111. Ljungqvist, O. Glucose infusion instead of preoperative fasting reduces postoperative insulin resistance / O. Ljungqvist, A. Thorell, M. Gutniak и др. // Journal of the American College of Surgeons. - 1994. - T. 178. - №4. - C. 329-336.
112. Eberhart, L.H.J. Randomised controlled trial of the effect of oral premedication with dexamethasone on hyperglycaemic response to abdominal hysterectomy / L.H.J. Eberhart, J. Graf, A.M. Morin и др. // European Journal of Anaesthesiology. - 2011. - T. 28. - №3. - C. 195-201. DOI: 10.1097/EJA.0b013e32834296b9.
113. Crowe, P.J. The effect of pre-operative glucose loading on postoperative nitrogen metabolism / P.J. Crowe, A. Dennison, G.T. Royle // The British Journal of Surgery. - 1984. - T. 71. - №8. - C. 635-637. DOI: 10.1002/bjs.1800710828
114. Nygren, J. Preoperative oral carbohydrate nutrition: an update / J. Nygren, A. Thorell, O. Ljungqvist // Current Opinion in Clinical Nutrition and Metabolic Care. - 2001. -T. 4. - Preoperative oral carbohydrate nutrition. - №4. - C. 255-259. DOI: 10.1097/00075197-200107000-00002.
115. Smith, M.D. Preoperative carbohydrate treatment for enhancing recovery after elective surgery / M.D. Smith, J. McCall, L. Plank и др. // The Cochrane Database of Systematic Reviews. - 2014. -№8. - C. CD009161. DOI: 10.1002/14651858.CD009161.pub2.
116. Gustafsson, U.O. Pre-operative carbohydrate loading may be used in type 2 diabetes patients / U.O. Gustafsson, J. Nygren, A. Thorell и др. // Acta Anaesthesiologica Scandinavica. - 2008. - T. 52. - №7. - C. 946-951. DOI: 10.1111/j.l399-6576.2008.01599.x.
117. Soop, M. Preoperative oral carbohydrate treatment attenuates endogenous glucose release 3 days after surgery / M. Soop, J. Nygren, A. Thorell и др. // Clinical Nutrition (Edinburgh, Scotland). - 2004. - T. 23. - №4. - C. 733-741. DOI: 10.1016/j.clnu.2003.12.007.
118. Lugli, A.K. Epidural analgesia enhances the postoperative anabolic effect of amino acids in diabetes mellitus type 2 patients undergoing colon surgery / A.K. Lugli, F. Donatelli, T. Schricker и др. // Anesthesiology. - 2008. - Т. 108. - №6. - С. 1093-1099. DOI: 10.1097/ALN.0b013e3181730239.
119. Brown, E.N. Multimodal General Anesthesia: Theory and Practice / E.N. Brown, K.J. Pavone, M. Naranjo // Anesthesia and Analgesia. - 2018. - T. 127. - Multimodal General Anesthesia. - №5. - C. 1246-1258. DOI: 10.1213/ANE.0000000000003668.
120. Gustafsson, U.O. Guidelines for Perioperative Care in Elective Colorectal Surgery: Enhanced Recovery After Surgery (ERAS®) Society Recommendations: 2018 / U.O. Gustafsson, M.J. Scott, M. Hubner и др. // World Journal of Surgery. - 2019. - T. 43. - Guidelines for Perioperative Care in Elective Colorectal Surgery. - №3. - C. 659-695. DOI: 10.1007/s00268-018-4844-y.
121. Nelson, R. Prophylactic nasogastric decompression after abdominal surgery / R. Nelson, S. Edwards, B. Tse // The Cochrane Database of Systematic Reviews. - 2007. - №3. - C. CD004929. DOI: 10.1002/14651858.CD004929.pub3.
122. Dean, N.S. Endourologic Procedures of the Upper Urinary Tract and the Effects on Intrarenal Pressure and Temperature / N.S. Dean, A.E. Krambeck // Journal of Endourology. - 2022. DOI: 10.1089/end.2022.0630.
123. Muraki, R. Comparison of operative outcomes between monopolar and bipolar coagulation in hepatectomy: a propensity score-matched analysis in a single center / R. Muraki, Y. Morita, S. Ida и др. // BMC Gastroenterology. - 2022. - Т. 22. - Comparison of operative outcomes between monopolar and bipolar coagulation in hepatectomy. - №1. - C. 154. DOI: 10.1186/s12876-022-02231-y.
124. Sessler, D.I. Perioperative thermoregulation and heat balance / D.I. Sessler // Lancet (London, England). - 2016. - T. 387. - №10038. - C. 2655-2664. DOI: 10.1016/S0140-6736(15)00981-2.
125. Hypothermia: prevention and management in adults having surgery: National Institute for Health and Care Excellence: Guidelines. Hypothermia. - London: National Institute for Health and Care Excellence (NICE), 2016. - Режим доступа: http://www.ncbi.nlm.nih.gov/books/NBK554181/ (дата обращения: 30.09.2022). - [Электронный ресурс].
126. Carli, F. Thermogenesis after surgery: effect of perioperative heat conservation and epidural anesthesia / F. Carli, J. Webster, P. Nandi и др. // The American Journal of Physiology. - 1992. - T. 263. - Thermogenesis after surgery. - №3 Pt 1. - С. E441-447. DOI: 10.1152/ajpendo.1992.263.3.E441.
127. Becker, B.F. Endothelial glycocalyx and coronary vascular permeability: the fringe benefit / B.F. Becker, D. Chappell, M. Jacob // Basic Research in Cardiology. - 2010. - T. 105. - Endothelial glycocalyx and coronary vascular permeability. - №6. - C. 687-701. DOI: 10.1007/s00395-010-0118-z.
128. Gustafsson, U.O. Adherence to the enhanced recovery after surgery protocol and outcomes after colorectal cancer surgery / U.O. Gustafsson, J. Hausel, A. Thorell и др. // Archives of Surgery (Chicago, Ill.: 1960). - 2011. - T. 146. - №5. - C. 571-577. DOI: 10.1001/archsurg.2010.309.
129. Levy, B.F. Randomized clinical trial of epidural, spinal or patient-controlled analgesia for patients undergoing laparoscopic colorectal surgery / B.F. Levy, M.J. Scott, W. Fawcett и др. // The British Journal of Surgery. - 2011. - T. 98. - №8. - C. 1068-1078. DOI: 10.1002/bjs.7545.
130. Srinivasa, S. Randomized clinical trial of goal-directed fluid therapy within an enhanced recovery protocol for elective colectomy / S. Srinivasa, M.H.G. Taylor, P.P. Singh и др. // The British Journal of Surgery. - 2013. - T. 100. - №1. - C. 66-74. DOI: 10.1002/bjs.8940.
131. Rollins, K.E. Intraoperative Goal-directed Fluid Therapy in Elective Major Abdominal Surgery: A Meta-analysis of Randomized Controlled Trials / K.E. Rollins, D.N. Lobo // Annals of Surgery. - 2016. - T. 263. - Intraoperative Goal-directed Fluid Therapy in Elective Major Abdominal Surgery. - №3. - C. 465-476. DOI: 10.1097/SLA.0000000000001366.
132. Beattie, M. Silver alloy vs. uncoated urinary catheters: a systematic review of the literature / M. Beattie, J. Taylor // Journal of Clinical Nursing. - 2011. - T. 20. - Silver alloy vs. uncoated urinary catheters. - №15-16. - C. 2098-2108. DOI: 10.1111/j.1365-2702.2010.03561.x.
133. Wu, Y.-N. Optimization of platelet-rich plasma and its effects on the recovery of erectile function after bilateral cavernous nerve injury in a rat model: Optimization of PRP and its effects in a cavernous nerve rat model / Y.-N. Wu, C.-C. Wu, M.-T. Sheu et al. // Journal of Tissue Engineering and Regenerative Medicine. - 2016. - Vol. 10. - Optimization of platelet-rich plasma and its effects on the recovery of erectile function after bilateral cavernous nerve injury in a rat model. - №10. - P. E294-E304. DOI: 10.1002/term.l806.
134. Rezaei, M. The effect of platelet-rich plasma injection on post-internal urethrotomy stricture recurrence / M. Rezaei, R. Badiei, R. Badiei // World Journal of Urology. - 2019. - T. 37. - №9. - C. 1959-1964. DOI: 10.1007/s00345-018-2597-8.
135. Tan, H.-L. The use of octyl cyanoacrylate (superglue) in hypospadias repair including its use as a fixator for urethral stents / H.-L. Tan, S.A. Nah, I.I. Budianto и др. // Journal of Pediatric Surgery. - 2012. - T. 47. - №12. - C. 2294-2297. DOI: 10.1016/j.jpedsurg.2012.09.022.
136. Singh, Т. Evaluation of Cyanoacrylate and Fibrin Glue for the Repair of Urethral Incision in Male Goats / T. Singh, A. Amarpal, P. Kinjavdekar и др. // Journal of Applied Animal Research - J APPL ANIM RES. - 2007. - T. 32. - C. 13-17. DOI: 10.1080/09712119.2007.9706838.
137. Etienney, I. Fibrin glue sealing in the treatment of a recto-urethral fistula in Crohn's disease: A case report / I. Etienney, N. Rabahi, C.-A. Cuenod et al. // Gastroenterologie Clinique et Biologique. - 2009. - Vol.33. - Fibrin glue sealing in the treatment of a recto-urethral fistula in Crohn's disease. - №12. - P. 1094-1097. DOI: 10.1016/j.gcb.2009.03.019.
138. Macedo, A.R.S. Endoscopic use of cyanoacrylate glue in the treatment of urethral fistula / A.R.S. Macedo, S.H.M. de Almeida, M.A. de F. Rodrigues и др. // International braz j urol. - 2013. - T. 39. - №4. - C. 602-603. DOI: 10.1590/S1677-5538.IBJU.2013.04.22.
139. Sharma, M. EUS-guided cyanoacrylate glue injection for treatment of anourethral fistula / M. Sharma, S. Jindal, R. Lingampalli, P. Somani // VideoGIE. - 2017. - T. 2. - №10. - C. 272-273. DOI: 10.1016/j.vgie.2017.03.013.
140. Saad, W.E.A. Ureteric embolization for lower urinary tract fistulae: use of two amplatzer vascular plugs and N-butyl cyanoacrylate employing the «sandwich» technique / W.E.A. Saad, S. Kalagher, U.C. Turba и др. // Cardiovascular and Interventional Radiology. -2013. - T. 36. - Ureteric embolization for lower urinary tract fistulae. - №4. - C. 1068-1072. DOI: 10.1007/s00270-012-0510-1.
141. Agarwal, S. Post-traumatic bilateral vesicocutaneous fistula of thighs treated with buccal mucosa graft urethroplasty and cyanoacrylate glue instillation: a novel treatment for management of a complicated fistula / S. Agarwal, A. Sharma, A. Gupta, S.N. Sankwar // BMJ case reports. - 2018. - T. 2018. - Post-traumatic bilateral vesicocutaneous fistula of thighs treated with buccal mucosa graft urethroplasty and cyanoacrylate glue instillation. - C. bcr-2018-226438. DOI: 10.1136/bcr-2018-226438.
142. Heberling, U. Superglue in the Urethra: Surgical Treatment / U. Heberling, M. Frohner, S. Oehlschlager, M.P. Wirth // Urologia Internationalis. - 2016. - T. 96. - Superglue in the Urethra. - №l. - C. 119-121. DOI: 10.1159/000360586.
143. Young, M.J. Surgical technique for the delayed removal of superglue from the male urethra / M.J. Young, T. Noblet, S.J. Symons // Central European Journal of Urology. - 2016. - T. 69. - №3. - C. 290-292. DOI: 10.5173/ceju.2016.838.
144. Zhang, W. Prophylactic abdominal drainage for pancreatic surgery / W. Zhang, S. He, Y. Cheng и др. // The Cochrane Database of Systematic Reviews. - 2018. - T. 6. - C. CD010583. DOI: 10.1002/14651858.CD010583.pub4.
145. Gurusamy, K.S. Routine abdominal drainage versus no abdominal drainage for uncomplicated laparoscopic cholecystectomy / K.S. Gurusamy, R. Koti, B.R. Davidson // The Cochrane Database of Systematic Reviews. - 2013. - №9. - C. CD006004. DOI: 10.1002/14651858.CD006004.pub4.
146. Azmat, C.E. Wound Closure Techniques / C.E. Azmat, M. Council. -[Электронный ресурс] // StatPearls. - Treasure Island (FL): StatPearls Publishing, 2022. - Режим доступа: http://www.ncbi.nlm.nih.gov/books/NBK470598/ (дата обращения: 13.12.2022).
147. Benzon, Н. Essentials of Pain Medicine / H. Benzon, S.N.R. MD, S.M.F. MD, и др.; R.W.H.M. PhD ред.. - 4th edition. - Philadelphia, PA: Elsevier, 2017. - 872 c.
148. Gropper, M.A. Miller's Anesthesia, 2-Volume Set E-Book / M.A. Gropper, R.D. Miller, L.I. Eriksson, et al. Google-Books-ID: cHK0DwAAQBAJ. - Elsevier Health Sciences, 2019. - 3490 p.
149. Hill, G.L. Metabolic basis for the management of patients undergoing major surgery / G.L. Hill, R.G. Douglas, D. Schroeder // World Journal of Surgery. - 1993. - T. 17. - №2. - C. 146-153. DOI: 10.1007/BF01658920.
150. Tian, Y. Early enteral feeding after intestinal anastomosis in children: a systematic review and meta-analysis of randomized controlled trials / Y. Tian, H. Zhu, B.C. Gulack и др. // Pediatric Surgery International. - 2021. - T. 37. - Early enteral feeding after intestinal anastomosis in children. - №3. - C. 403-410. DOI: 10.1007/s00383-020-04830-w.
151. Short, V. Chewing gum for postoperative recovery of gastrointestinal function / V. Short, G. Herbert, R. Perry и др. // The Cochrane Database of Systematic Reviews. - 2015. - №2. - C. CD006506. DOI: 10.1002/14651858.CD006506.pub3.
152. Ne, E. A review article on the benefits of early mobilization following spinal surgery and other medical/surgical procedures / E. Ne. - [Electronic resource] // Surgical neurology international. - 2014. - Vol. 5. - №Suppl 3. - Mode of access: https://pubmed.ncbi.nlm.nih.gov/24843814/ (date of access: 10.11.2022).
153. Vanhorebeek, I. Diabetes of injury: novel insights / I. Vanhorebeek, G. Van den Berghe // Endocrinology and Metabolism Clinics of North America. - 2006. - T. 35. - Diabetes of injury. - №4. - C. 859-872, x. DOI: 10.1016/j.ecl.2006.09.002.
154. McLemore, E. Same day discharge following elective, minimally invasive, colorectal surgery: A review of enhanced recovery protocols and early outcomes by the SAGES Colorectal Surgical Committee with recommendations regarding patient selection, remote monitoring, and successful implementation / E. McLemore, L. Lee, H. Tl et al. - [Electronic resource] // Surgical endoscopy. - 2022. - Vol. 36. - Same day discharge following elective, minimally invasive, colorectal surgery. - №11. - Mode of access: https://pubmed.ncbi.nlm.nih.gov/36131162/ (date of access: 14.11.2022).
155. Jf, F. Hospital discharge criteria following colorectal surgery: a systematic review / F. Jf, B. L, B. A et al. - [Electronic resource] // Colorectal disease: the official journal of the Association of Coloproctology of Great Britain and Ireland. - 2012. - Vol. 14. - Hospital discharge criteria following colorectal surgery. - №3. - Mode of access: https://pubmed.ncbi.nlm.nih.gov/20977587/ (date of access: 14.11.2022).
156. Патент РФ на изобретение №2694477 «Способ оперативного лечения сужения уретры», авторы: В.А. Воробьев, В.А. Белобородое, дата приоритета: 04.05.2016.
157. Polderman, J.A. Hyperglycemia and ambulatory surgery / J.A. Polderman, L. Van Velzen, L.G. Wasmoeth и др. // Minerva Anestesiologica. - 2015. - T. 81. - №9. - C. 951-959.
158. Khan, J.S. Robotic rectal surgery has advantages over laparoscopic surgery in selected patients and centres / J.S. Khan, A.K. Banerjee, S.-H. Kim и др. // Colorectal Disease: The Official Journal of the Association of Coloproctology of Great Britain and Ireland. - 2018. - T. 20. - №10. - C. 845-853. DOI: 10.1111/codi.14367.
159. B.K. Гостищев. Общая хирургия хирургия: учебник. Москва: ГЭОТАР [Электронный ресурс] / В.К. Гостищев http://www.studmedlib.ru/book/ISBN9785970438787.htmlМедиа,М.: ГЭОТАР 2016. - 736 с. Медиа, 2016.
160. Котов, С.В. Оценка регенеративного потенциала плазмы, обогащенной тромбоцитами, при уретропластике в экспериментальной модели / С.В. Котов, М.М. Ирицян, Р.И. Гуспанов и др. // Урология. - 2020. - №4. - С. 27-35. DOI: 10.18565/urology.2020.4.27-35.
161. Котов, С.В. Патоморфологические аспекты стриктур уретры различной этиологии / С.В. Котов, А.П. Ракша, Р.И. Гуспанов и др. // Урология. - 2021. - №2. - С. 5-13. DOI: 10.18565/urology.2021.2.5-13.
162. Barbagli, G. Experience with fibrin glue in bulbar urethral reconstruction using dorsal buccal mucosa graft / G. Barbagli, S. De Stefani, M.C. Sighinolfi и др. // Urology. -2006. - Т. 67. - №4. - С. 830-832. DOI: 10.1016/j.urology.2005.10.033.
163. Gopal, S.C. Use of fibrin glue in preventing urethrocutaneous fistula after hypospadias repair / S.C. Gopal, A.N. Gangopadhyay, T.V. Mohan и др. // Journal of Pediatric Surgery. - 2008. - T. 43. - №10. - С. 1869-1872. DOI: 10.1016/j.jpedsurg.2008.04.022.
164. Lim, J.H. Cystoscopic injection of N-butyl-2-cyanoacrylate followed by fibrin glue for the treatment of persistent or massive vesicourethral anastomotic urine leak after radical prostatectomy / J.H. Lim, D. You, I.G. Jeong и др. // International Journal of Urology: Official Journal of the Japanese Urological Association. - 2013. - T. 20. - №10. - C. 980-985. DOI: 10.1111/iju.12094.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЕРИОПЕРАЦИОННОЙ КУРАЦИИ ПАЦИЕНТОВ ПРИ ЛАПАРОСКОПИЧЕСКОЙ ПЛАСТИКЕ ЛОХАНОЧНО-МОЧЕТОЧНИКОВОГО СЕГМЕНТА В СООТВЕТСТВИИ С КОНЦЕПЦИЕЙ ПРОГРАММЫ УСКОРЕННОГО ВЫЗДОРОВЛЕНИЯ | 2023 |
|
RU2836677C2 |
| СПОСОБ ХИРУРГИЧЕСКОЙ КОРРЕКЦИИ СТРИКТУРЫ ЛАДЬЕВИДНОЙ ЯМКИ УРЕТРЫ | 2024 |
|
RU2834815C1 |
| Способ оперативного лечения сужения уретры | 2016 |
|
RU2694477C2 |
| Способ хирургического лечения протяженных рецидивных стриктур передней уретры туберкулезного генеза | 2022 |
|
RU2789969C1 |
| Способ уретропластики | 2024 |
|
RU2832648C1 |
| Способ хирургического лечения протяженных стриктур спонгиозной уретры | 2019 |
|
RU2722054C1 |
| СПОСОБ ХИРУРГИЧЕСКОЙ КОРРЕКЦИИ РЕЦИДИВНОГО СТЕНОЗА ШЕЙКИ МОЧЕВОГО ПУЗЫРЯ | 2021 |
|
RU2773793C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ РЕЦИДИВНЫХ ФОРМ НЕДЕРЖАНИЯ МОЧИ У ЖЕНЩИН | 2023 |
|
RU2803694C1 |
| Модифицированный способ YV-пластики шейки мочевого пузыря у пациентов со стенозом шейки мочевого пузыря | 2021 |
|
RU2765332C1 |
| СПОСОБ ОПЕРАЦИИ ДЛЯ УСТРАНЕНИЯ РЕЦИДИВНЫХ ФОРМ РЕКТОУРЕТРАЛЬНОГО СВИЩА У ДЕТЕЙ | 2022 |
|
RU2810289C1 |
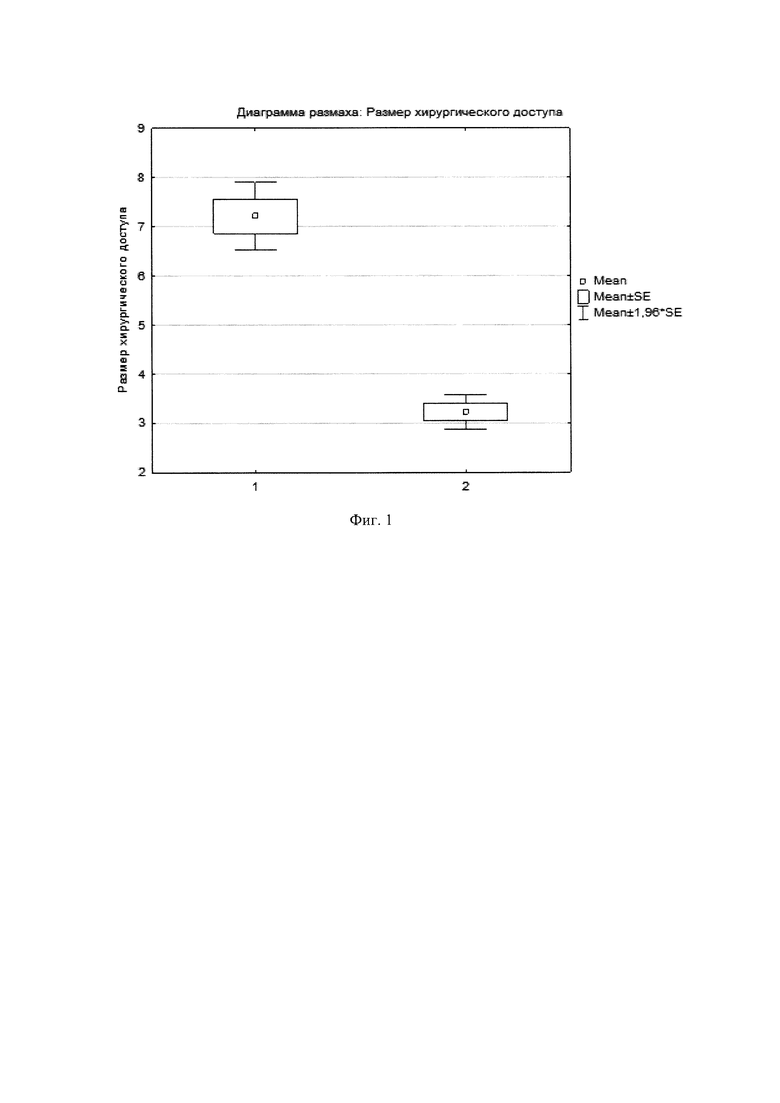
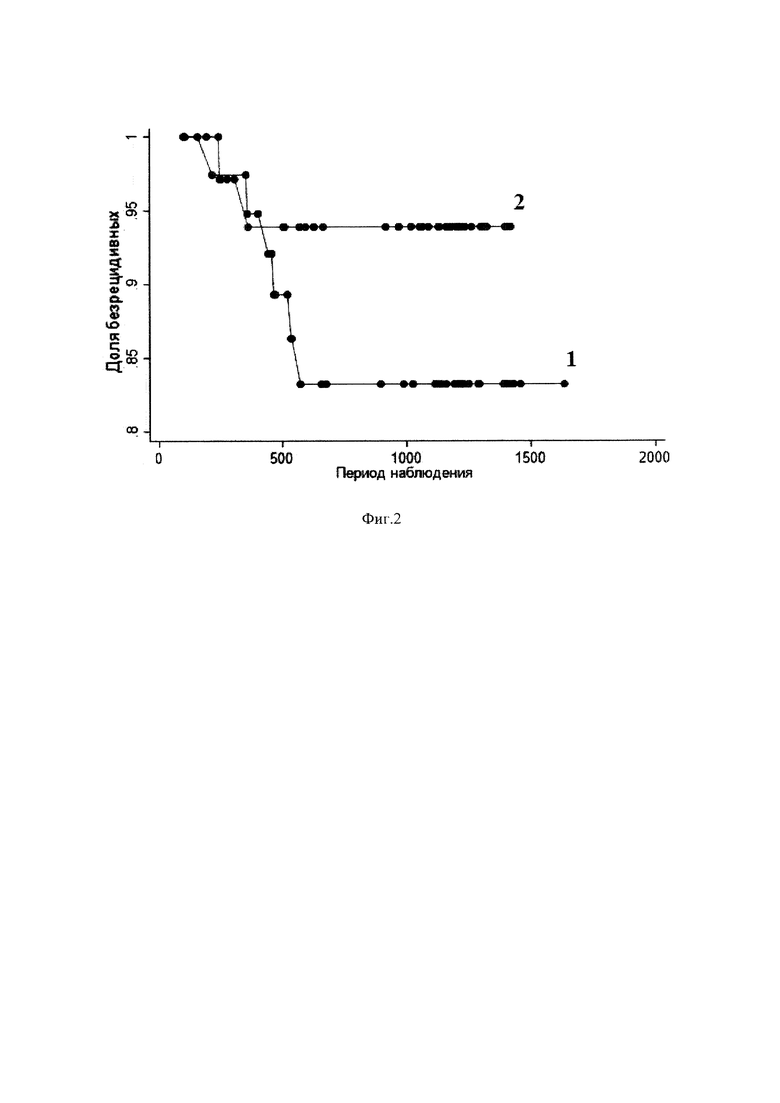
Изобретение относится к медицине, а именно к хирургии. Осуществляют заместительную уретропластику в соответствии с концепцией программы ускоренного выздоровления, включающей в себя следующие действия: на предоперационном этапе выполняют пациенту МСКТ-уретрографию или МРТ-уретрографию с 3D-моделированием и оценкой состояния костно-суставного аппарата таза, внутренних органов. Проводят оценку исходного нутритивного статуса пациента. Выявляют трофологическую недостаточность с последующей ее коррекцией, за 2-3 дня до операции переводят пациента на питание в соответствии с диетой: стол N4 по Певзнеру. Осуществляют компрессию нижних конечностей, которую начинают до операции и продолжают во время и после нее, а также вводят низкомолекулярные гепарины. Используют пищевые углеводные смеси до операции в объеме 200 мл. Проводят антибиотикопрофилактику за 60 минут до операции, используя антибиотики цефалоспоринового ряда. На интраоперационном этапе: во время операции поддерживают нормотермию, в том числе осуществляют подогрев вводимых растворов. Поддерживают состояние интраоперационной эуволемии у пациента, проводят профилактику тошноты и рвоты с использованием дексаметазона и ондансетрона. На послеоперационном этапе: используют мультимодальное обезболивание на основе нестероидных противовоспалительных средств. При этом на предоперационном этапе: проводят оценку показаний для хирургического лечения: максимальная скорость потока мочи менее 12 мл/секунду по данным урофлоуметрии, диаметр просвета уретры менее 4 мм, наличие остаточной мочи в мочевом пузыре, наличие дистракционного дефекта уретры; проводят мультидисциплинарный осмотр пациента: уролог, анестезиолог, ЛОР-врач, стоматолог, терапевт или кардиолог, рентгенолог, врач лечебной физкультуры; для оценки исходного нутритивного статуса пациента: вычисляют индекс массы тела - ИМТ пациента, при ИМТ больше 30-35 - устанавливают ожирение и обеспечивают консультации диетолога и эндокринолога. При ИМТ меньше 18,5 - устанавливают истощение пациента и обеспечивают консультации диетолога и эндокринолога. Проводят исследование уровня гемоглобина в крови пациента: при уровне гемоглобина ниже 130 г/л диагностируют анемию, которую корригируют; проводят динамометрию и тест с ходьбой, биоимпедансометрию и антропометрию для выявления саркопении, при установлении саркопении - пациенту повышают физическую активность и обеспечивают употребление содержащей белки пищи сроком на четыре недели до операции. Проводят оценку инсулинорезистентности методом гиперинсулинемического-нормогликемического зажима: для этого инсулин вводят с постоянной скоростью до достижения уровня, превышающего показатель натощак. При выявлении нарушения толерантности к углеводам либо сахарного диабета - проводят консультацию эндокринолога. Обеспечивают пациенту последний прием твердой пищи при операции в утренние часы - в 21-22 часа накануне, при операции в послеобеденное время - не позднее, чем за 6 часов до операции. Дают пациенту слабительные препараты либо выполняют однократную микроклизму; осуществляют предоперационную премедикацию: целекоксиб 100 мг, габапентин 600 мг, дексаметазон 10 мг однократно внутрь за 2-3 часа до операции. Пациент выполняет полоскание полости рта водным раствором хлоргексидина в течение дня между приемами пищи за 3-7 дней до операции, последний раз - за 3 часа до операции; пациент носит компрессионный трикотаж со дня госпитализации, начиная ношение до операции и на срок до 21 дня после операции, а также в качестве низкомолекулярных гепаринов пациенту вводят эноксапарин натрия 0,4 мл подкожно 1 раз в день, либо фраксипарин 0,3 мл подкожно 1 раз в день, первую инъекцию выполняют до операции и продолжают выполнять инъекции до выписки из стационара. Обеспечивают пациенту употребление содержащей углеводы и белки жидкости в объеме 200 мл за 2,5 часа до операции при отсутствии противопоказаний: сахарный диабет, нарушение эвакуаторной функции желудка. Проводят антибиотикопрофилактику за 60 минут до операции препаратами цефалоспоринов 3-го поколения при стерильном посеве мочи, однократно. На интраоперационном этапе пациента размещают в модифицированном литотомическом положении на операционном столе, используют региональную анестезию, используют увеличительную оптику. Применяют биполярную коагуляцию. Выполняют поддержание нормотермии, подогревая пациента во время операции с помощью электроподогревающих матрасов и одеял с контролем нормотермии, а также подогревают инфузионные растворы и ингаляционные газы до температуры 30°С. Устанавливают пациенту силиконовый мочевой катетер 14 Fr, выполняют линейный промежностный доступ, разрез проводят по средней линии промежности по направлению к мошонке, отступив вверх не менее 2 см от ануса, протяженность разреза кожи не более 4-5 см, доступ выполняют послойно к бульбо-спонгиозной мышце, раздвигая данную мышцу вдоль волокон и формируют окно к передней поверхности бульбарного тела уретры таким образом, чтобы не отделить мышцу по латеральным поверхностям бульбы, определяют дистальный конец сужения уретры с помощью интраоперационной уретроцистоскопии или с использованием уретрального катетера, рассекают поэтапно спонгиозное тело и уретру в проекции бульбо-мембранозного физиологического изгиба, но дистальнее сужения просвета уретры, протяженность уретротомного доступа 2-3 см, края уретры разводят предварительно затупленными крючками ранорасширителя Скотта, через полученное окно раздвигают просвет проксимальной части бульбарного и мембранозного отделов уретры, в мочевой пузырь через суженную часть мочеиспускательного канала заводят проводник, суженную часть уретры рассекают вентрально с проникновением за пределы уретры в мышечную толщу, затем иссекают рубцово-измененные ткани уретры в вентральной полуокружности в пределах от пяти до семи часов по циферблату, формируют площадку для трансплантата в пределах иссеченных рубцовых тканей уретры таким образом, чтобы проксимальная и дистальная границы сформированной площадки занимали 10 мм в пределах неизмененных тканей уретры. Адекватность просвета уретры проверяют заведением бужа 24Ch в мочевой пузырь. В качестве замещающего материала используют трансплантат слизистой оболочки ротовой полости, форму и размеры трансплантата выбирают в соответствии с параметрами сформированной под него площадки, под местной анестезией выполняют забор орального трансплантата, дефект слизистой ротовой полости на месте забора трансплантата ушивают. Подготовленный оральный трансплантат фиксируют без натяжения в ложе уретры путем пришивания непрерывным швом рассасывающимся шовным материалом 4\6-0, вначале фиксируют проксимальную часть трансплантата с треугольными вершинами по методике вкладки, далее выполняют сквозное его прошивание по центру к подлежащим структурам. Контролируют качество хирургического шва методом интраоперационной уретроскопии. Затем в мочевой пузырь проводят уретральный катетер Фолея 16-18Ch, раздувают баллон на 5-10 мл, затем по методике накладки прошивают и фиксируют дистальную часть трансплантата без натяжения. Применяют инъекции в подслизистый слой уретры и в окружающие ткани плазмы, обогащенной тромбоцитами, полученной по методу PRP путем центрифугирования в пробирках из периферической венозной крови пациента. Уретротомный доступ закрывают непрерывным швом с прошиванием подслизистой основы трансплантата монокрилом 4/6-0. Производят с помощью иглы пликацию фибринового клея или биодеградируемого сульфакрилата на уретральный шов. Закрывают промежностный доступ косметическим швом кожи монокрилом 4-0, наносят клеевую повязку на кожу биодеградируемым цианакриловым клеем. Интраоперационно проводят мультимодальную профилактику послеоперационной тошноты и рвоты с использованием дексаметазона и ондансетрона по следующей схеме: вводят внутривенно дексаметазон 4 мг и ондансетрон 4 мг однократно в процессе операции. На послеоперационном этапе пациента после завершения операции переводят в отделение интенсивной терапии и реанимации на 2-3 часа. Осуществляют мультимодальную анальгезию с использованием нестероидных противовоспалительных средств в сочетании с ацетаминофеном. Пациенту обеспечивают употребление жидкости через 2-3 часа после операции, и пищи - через 6 часов после операции, пациенту обеспечивают использование жевательной резинки в первые и вторые сутки после операции, периодически в течение дня. Применяют блокаторы протоновой помпы: Ранитидин внутрь 150-300 мг на ночь, до стихания болевого синдрома и прекращения приема нестероидных противовоспалительных средств. Пациента сажают или ставят вертикально через 6-8 часов после операции, после оценки состояния пациента анестезиологом. Пациент соблюдает послеоперационную гигиену половых органов и послеоперационных ран - гигиенический душ ежедневно с первых суток; производят контроль показателей крови и мочи в первые сутки после операции. Применяют препараты, улучшающие микроциркуляцию, репаранты: пентоксифиллин по 100 мг внутрь 2 раза в день, 14 дней. Осуществляют сеансы гипербарической оксигенации со вторых-третьих суток после операции в режиме 1,0-1,5 атм., по 45 минут, 5-10 сеансов 1 раз в день ежедневно при отсутствии противопоказаний. Выполняют перикатетерную уретрографию перед удалением уретрального катетера, при этом уретральный катетер удаляют не позднее седьмых суток после операции. Осуществляют выписку пациента из стационара через 1-3 дня после операции, при этом критериями выписки являются: возможность мобилизации пациента, контроль боли и полноценное самостоятельное питание. Пациент возвращается к работе через два дня после выписки, после удаления уретрального катетера. Пациент использует ректальные свечи Лонгидаза по истечении 14 суток после проведения операции по схеме: 1 свеча ректально 1 раз в 2 дня, то есть свечи применяют через день, курс составляет 20 штук свечей, указанный курс препарата Лонгидаза повторяют каждые 6 месяцев на протяжении 2-3 лет. Пациенту составляют план контрольных осмотров в послеоперационном периоде и обеспечивают ежедневный контакт пациента с лечащим врачом. Способ позволяет достоверно сократить среднюю продолжительность госпитализации, в койко-днях, а также уменьшить степень выраженности симптомов нижних мочевых путей по показателю шкалы IPSS, улучшить эректильную функцию по показателю шкалы IIEF-5 (МИЭФ-5), снизить выраженность послеоперационного болевого синдрома по данным визуально-аналоговой шкалы Visual Analog scale боли у пациентов, достичь максимальную скорость потока мочи более 12 мл/сек, оцененную по данным урофлоуметрии. 11 з.п. ф-лы, 2 ил., 7 табл. 1 пр.
1. Способ периоперационной курации пациентов при хирургическом лечении стриктур проксимальной части бульбарного и мембранозного отделов уретры методом заместительной уретропластики в соответствии с концепцией программы ускоренного выздоровления, включающий в себя следующие действия: на предоперационном этапе выполняют пациенту МСКТ-уретрографию или МРТ-уретрографию с 3D-моделированием и оценкой состояния костно-суставного аппарата таза, внутренних органов, проводят оценку исходного нутритивного статуса пациента, выявляют трофологическую недостаточность с последующей ее коррекцией, за 2-3 дня до операции переводят пациента на питание в соответствии с диетой: стол №4 по Певзнеру, осуществляют компрессию нижних конечностей, которую начинают до операции и продолжают во время и после нее, а также вводят низкомолекулярные гепарины, используют пищевые углеводные смеси до операции в объеме 200 мл, проводят антибиотикопрофилактику за 60 минут до операции, используя антибиотики цефалоспоринового ряда; на интраоперационном этапе: во время операции поддерживают нормотермию, в том числе осуществляют подогрев вводимых растворов, поддерживают состояние интраоперационной эуволемии у пациента, проводят профилактику тошноты и рвоты с использованием дексаметазона и ондансетрона; на послеоперационном этапе: используют мультимодальное обезболивание на основе нестероидных противовоспалительных средств, отличающийся тем, что на предоперационном этапе: проводят оценку показаний для хирургического лечения: максимальная скорость потока мочи менее 12 мл/секунду по данным урофлоуметрии, диаметр просвета уретры менее 4 мм, наличие остаточной мочи в мочевом пузыре, наличие дистракционного дефекта уретры; проводят мультидисциплинарный осмотр пациента: уролог, анестезиолог, ЛОР-врач, стоматолог, терапевт или кардиолог, рентгенолог, врач лечебной физкультуры; для оценки исходного нутритивного статуса пациента: вычисляют индекс массы тела (ИМТ) пациента, при ИМТ больше 30-35 - устанавливают ожирение и обеспечивают консультации диетолога и эндокринолога, при ИМТ меньше 18,5 - устанавливают истощение пациента и обеспечивают консультации диетолога и эндокринолога; проводят исследование уровня гемоглобина в крови пациента: при уровне гемоглобина ниже 130 г/л диагностируют анемию, которую корригируют; проводят динамометрию и тест с ходьбой, биоимпедансометрию и антропометрию для выявления саркопении, при установлении саркопении - пациенту повышают физическую активность и обеспечивают употребление содержащей белки пищи сроком на четыре недели до операции; проводят оценку инсулинорезистентности методом гиперинсулинемического-нормогликемического зажима: для этого инсулин вводят с постоянной скоростью до достижения уровня, превышающего показатель натощак; при выявлении нарушения толерантности к углеводам либо сахарного диабета - проводят консультацию эндокринолога; обеспечивают пациенту последний прием твердой пищи при операции в утренние часы - в 21-22 часа накануне, при операции в послеобеденное время - не позднее, чем за 6 часов до операции; дают пациенту слабительные препараты либо выполняют однократную микроклизму; осуществляют предоперационную премедикацию: целекоксиб 100 мг, габапентин 600 мг, дексаметазон 10 мг однократно внутрь за 2-3 часа до операции; пациент выполняет полоскание полости рта водным раствором хлоргексидина в течение дня между приемами пищи за 3-7 дней до операции, последний раз - за 3 часа до операции; пациент носит компрессионный трикотаж со дня госпитализации, начиная ношение до операции и на срок до 21 дня после операции, а также в качестве низкомолекулярных гепаринов пациенту вводят эноксапарин натрия 0,4 мл подкожно 1 раз в день, либо фраксипарин 0,3 мл подкожно 1 раз в день, первую инъекцию выполняют до операции и продолжают выполнять инъекции до выписки из стационара; обеспечивают пациенту употребление содержащей углеводы и белки жидкости в объеме 200 мл за 2,5 часа до операции при отсутствии противопоказаний: сахарный диабет, нарушение эвакуаторной функции желудка; проводят антибиотикопрофилактику за 60 минут до операции препаратами цефалоспоринов 3-го поколения при стерильном посеве мочи, однократно; на интраоперационном этапе пациента размещают в модифицированном литотомическом положении на операционном столе, используют региональную анестезию, используют увеличительную оптику; применяют биполярную коагуляцию; выполняют поддержание нормотермии, подогревая пациента во время операции с помощью электроподогревающих матрасов и одеял с контролем нормотермии, а также подогревают инфузионные растворы и ингаляционные газы до температуры 30°С; устанавливают пациенту силиконовый мочевой катетер 14Fr, выполняют линейный промежностный доступ, разрез проводят по средней линии промежности по направлению к мошонке, отступив вверх не менее 2 см от ануса, протяженность разреза кожи не более 4-5 см, доступ выполняют послойно к бульбо-спонгиозной мышце, раздвигая данную мышцу вдоль волокон и формируют окно к передней поверхности бульбарного тела уретры таким образом, чтобы не отделить мышцу по латеральным поверхностям бульбы, определяют дистальный конец сужения уретры с помощью интраоперационной уретроцистоскопии или с использованием уретрального катетера, рассекают поэтапно спонгиозное тело и уретру в проекции бульбо-мембранозного физиологического изгиба, но дистальнее сужения просвета уретры, протяженность уретротомного доступа 2-3 см, края уретры разводят предварительно затупленными крючками ранорасширителя Скотта, через полученное окно раздвигают просвет проксимальной части бульбарного и мембранозного отделов уретры, в мочевой пузырь через суженную часть мочеиспускательного канала заводят проводник, суженную часть уретры рассекают вентрально с проникновением за пределы уретры в мышечную толщу, затем иссекают рубцово-измененные ткани уретры в вентральной полуокружности в пределах от пяти до семи часов по циферблату, формируют площадку для трансплантата в пределах иссеченных рубцовых тканей уретры, таким образом, чтобы проксимальная и дистальная границы сформированной площадки занимали 10 мм в пределах неизмененных тканей уретры; адекватность просвета уретры проверяют заведением бужа 24Ch в мочевой пузырь; в качестве замещающего материала используют трансплантат слизистой оболочки ротовой полости, форму и размеры трансплантата выбирают в соответствии с параметрами сформированной под него площадки, под местной анестезией выполняют забор орального трансплантата, дефект слизистой ротовой полости на месте забора трансплантата ушивают; подготовленный оральный трансплантат фиксируют без натяжения в ложе уретры путем пришивания непрерывным швом рассасывающимся шовным материалом 4\6-0, вначале фиксируют проксимальную часть трансплантата с треугольными вершинами по методике вкладки, далее выполняют сквозное его прошивание по центру к подлежащим структурам; контролируют качество хирургического шва методом интраоперационной уретроскопии; затем в мочевой пузырь проводят уретральный катетер Фолея 16-18Ch, раздувают баллон на 5-10 мл, затем по методике накладки прошивают и фиксируют дистальную часть трансплантата без натяжения; применяют инъекции в подслизистый слой уретры и в окружающие ткани плазмы, обогащенной тромбоцитами, полученной по методу PRP путем центрифугирования в пробирках из периферической венозной крови пациента; уретротомный доступ закрывают непрерывным швом с прошиванием подслизистой основы трансплантата монокрилом 4/6-0; производят с помощью иглы пликацию фибринового клея или биодеградируемого сульфакрилата на уретральный шов; закрывают промежностный доступ косметическим швом кожи монокрилом 4-0, наносят клеевую повязку на кожу биодеградируемым цианакриловым клеем; интраоперационно проводят мультимодальную профилактику послеоперационной тошноты и рвоты с использованием дексаметазона и ондансетрона по следующей схеме: вводят внутривенно дексаметазон 4 мг и ондансетрон 4 мг однократно в процессе операции; на послеоперационном этапе пациента после завершения операции переводят в отделение интенсивной терапии и реанимации на 2-3 часа; осуществляют мультимодальную анальгезию с использованием нестероидных противовоспалительных средств в сочетании с ацетаминофеном; пациенту обеспечивают употребление жидкости через 2-3 часа после операции, и пищи - через 6 часов после операции, пациенту обеспечивают использование жевательной резинки в первые и вторые сутки после операции, периодически в течение дня; применяют блокаторы протоновой помпы: Ранитидин внутрь 150-300 мг на ночь, до стихания болевого синдрома и прекращения приема нестероидных противовоспалительных средств; пациента садят или ставят вертикально через 6-8 часов после операции, после оценки состояния пациента анестезиологом; пациент соблюдает послеоперационную гигиену половых органов и послеоперационных ран - гигиенический душ ежедневно с первых суток; производят контроль показателей крови и мочи в первые сутки после операции; применяют препараты, улучшающие микроциркуляцию, репаранты: пентоксифиллин по 100 мг внутрь 2 раза в день, 14 дней; осуществляют сеансы гипербарической оксигенации со вторых-третьих суток после операции в режиме 1,0-1,5 атм., по 45 минут, 5-10 сеансов 1 раз в день ежедневно при отсутствии противопоказаний; выполняют перикатетерную уретрографию перед удалением уретрального катетера, при этом уретральный катетер удаляют не позднее седьмых суток после операции; осуществляют выписку пациента из стационара через 1-3 дня после операции, при этом критериями выписки являются: возможность мобилизации пациента, контроль боли и полноценное самостоятельное питание; пациент возвращается к работе через два дня после выписки, после удаления уретрального катетера; пациент использует ректальные свечи Лонгидаза по истечении 14 суток после проведения операции по схеме: 1 свеча ректально 1 раз в 2 дня, то есть свечи применяют через день, курс составляет 20 штук свечей, указанный курс препарата Лонгидаза повторяют каждые 6 месяцев на протяжении 2-3 лет; пациенту составляют план контрольных осмотров в послеоперационном периоде и обеспечивают ежедневный контакт пациента с лечащим врачом.
2. Способ по п. 1, отличающийся тем, что на предопепрационном этапе пациенту выполняют дополнительно мультиспиральную компьютерную томографию или магнитно-резонансную томографию малого таза, дополнительно мультиспиральную компьютерную томографию или магнитно-резонансную томографию мочевой системы.
3. Способ по п. 1 или 2, отличающийся тем, что при выявлении анемии ее корригируют назначением пероральных или внутривенных препаратов железа.
4. Способ по п. 2, отличающийся тем, что внутривенные инфузии препаратов железа используют как альтернативную пероральному приему железа терапию анемии.
5. Способ по п. 2, отличающийся тем, что внутривенные инфузии препаратов железа используют как стартовую терапию анемии с последующим переходом на пероральный прием препаратов железа.
6. Способ по п. 1 или 2, отличающийся тем, что проводят предоперационную антибактериальную терапию по показаниям: наличие скрытой или явной инфекции мочеполовой системы по результатам бактериологического исследования и полимеразной цепной реакции в реальном времени, а также инфекции других органов;
7. Способ по п. 1, или 2, или 5, отличающийся тем, что пациентам с положительным аллергоанамнезом профилактически назначают антигистаминные препараты;
8. Способ по п. 1, или 2, или 5, или 6, отличающийся тем, что на предоперационном этапе выполняют бритье операционного поля с последующей обработкой растворами кожных антисептиков без содержания спирта накануне по необходимости.
9. Способ по п. 1, или 2, или 5, или 6, или 7, отличающийся тем, что на интраоперационном этапе применяют мультимодальную анестезию - сочетанное местное и общее обезболивание, при этом мультимодальное обезболивание определяет анестезиолог для каждого пациента.
10. Способ по п. 1, или 2, или 5, или 6, или 7, или 8, отличающийся тем, что для выполнения биполярной коагуляции используют аппараты LigaSure, Harmonic.
11. Способ по п. 1, или 2, или 5, или 6, или 7, или 8, или 9, отличающийся тем, что после поэтапного рассечения спонгиозного тела и уретры в проекции бульбо-мембранозного физиологического изгиба при разведении краев уретры применяют подшивание краев уретры к белочной оболочке бульбарного тела.
12. Способ по п. 1, или 2, или 5, или 6, или 7, или 8, или 9, или 10, отличающийся тем, что на послеоперационном этапе производят контроль гликемии у пациентов с нарушением толерантности к углеводам и сахарным диабетом.
| В.А.ВОРОБЬЕВ и др | |||
| Ускоренное выздоровление | |||
| Актуальность, история, патофизиология | |||
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| Способ хирургического лечения протяженных стриктур бульбозного отдела уретры у мужчин | 2020 |
|
RU2723744C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ПОСТТРАВМАТИЧЕСКИХ СТРИКТУР УРЕТРЫ | 2009 |
|
RU2391053C1 |
| М.М.КУТЛУЕВ | |||
| Наш опыт применения программы раннего восстановления пациентов при различных урологических вмешательствах | |||
| Медицинский Вестник | |||
Авторы
Даты
2024-08-08—Публикация
2023-03-30—Подача