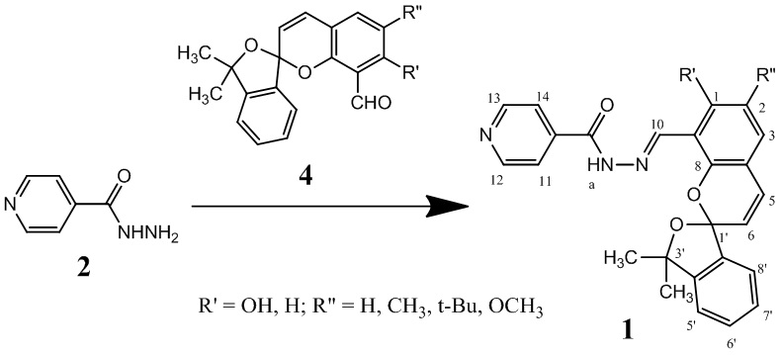
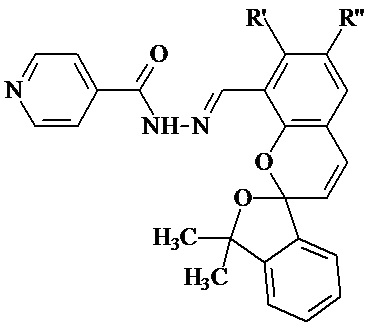
Изобретение относится к новым соединениям в ряду гидразонов на основе изониазида, а именно к гидразонам изониазида и замещенных спиропиранов оксаинданового ряда (E)-N'-((замещенные-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-ил)метилен)изоникотиногидразидам общей формулы (1):
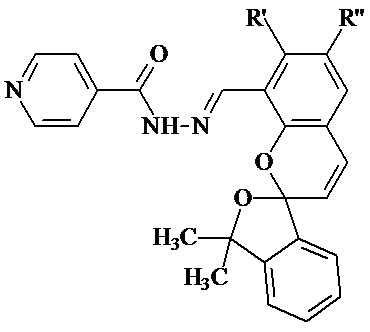 ,
,
где R' = OH, H; R'' = H, CH3, t-Bu, OCH3,
в частности, при условии 1а) R' = OH; R'' = H; 1б) R' = H; R'' = CH3; 1в) R' = H; R'' = t-Bu; 1г) R' = H; R'' = OCH3, а также к способу их получения, и может использоваться при разработке противотуберкулезных лекарственных препаратов.
Согласно отчету, опубликованному Всемирной организацией здравоохранения в 2016 г., примерно 10 млн. человек ежегодно заражаются туберкулезом, что приводит к 1,4 млн. смертей в год и еще 0,4 млн. смертей от туберкулеза среди людей, зараженных вирусом иммунодефицита человека. Несмотря на доступные методы лечения туберкулеза, глобальное распространение заболевания остается серьезной проблемой за счет того, что Mycobacterium tuberculosis - бактерия-возбудитель туберкулеза, становится резистентной к лекарственным препаратам и схемам лечения, применяемым в стандартной терапии.
С целью предупреждения повышения резистентности к имеющимся в настоящее время лекарственным препаратам, туберкулез лечат с использованием комбинаций из трех или более препаратов. Кроме того, для лечения туберкулеза часто требуется терапия несколькими препаратами. Однако такой подход теряет свою эффективность.
По статистике ВОЗ новые формы туберкулеза, обнаружены в 92 странах мира, при этом отмечается проявление множественной лекарственной устойчивости, а в последние годы введено понятие широкой лекарственной устойчивости. Подобные данные заставляют искать новые формы лекарственных препаратов эффективных в отношении туберкулеза.
Известны соединения, проявляющие противотуберкулезную активность in vitro, содержащие спироуглеродный атом в составе молекулы - 4'-гидрокси-1'-(2-гидроксифенил)-3'-ацил-спиро[бензо[b][1,4]тиазин-2,2'-пиррол]-3,5' (1'H,4H)-дионы, 9-ароил-8-гидрокси-6-(2-гидроксиэтил)-1,3,6-триаза спиро [4,4]нон-8-ен-2,4,7-трионы, 8-гидрокси-6-(2-гидроксифенил)-1,3-дифенил-9-(4-хлорбензоил)-1,3,6 триазаспиро[4.4]нон8-ен-2,4,7-трион (патенты РФ: RU №2806097, А61К31/547, 2023 г.; RU №2798423, C07D 487/10, 2023 г.; RU №2785344, А61К31/4188, C07D 487/10, 2023 г).
Одним из эффективных препаратов первой линии для борьбы с микобактерией туберкулеза является изониазид (2) (European Journal of Medicinal Chemistry 2017, 133, 255-267 doi.org/10.1016/j.ejmech.2017.04.002).
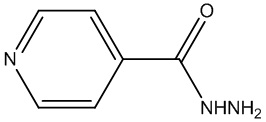
2
В ряду гидразонов на основе изониазида (производных гидразида изоникотиновой кислоты), проявляющих противотуберкулезную активность, известен фтивазид (3а) (Molecules 2015, 20, 8800-8815 10.1016/j.ejmech.2017.04.002). Способ его получения включает четырехстадийный синтез, требующий особых условий, где конечный продукт выделяют из водного раствора (Химия и медицина. Фтивазид. Медгиз, 1954, С. 12.).
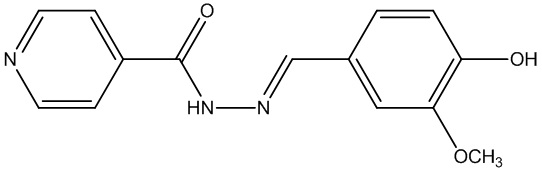
3а
В ряду гидразонов на основе изониазида известны также метазид (3б) и салюзид (3в) (Molecules 2015, 20, 8800-8815 10.1016/j.ejmech.2017.04.002). Способ получения метазида включает двухстадийную димеризацию изониазида в водной среде (патент Великобритании №720787; С.А., 1955, 49, 8334). Способ получения салюзида включает конденсациию изониазида с опиановой кислотой в их водных растворах при нагревании растворов компонентов перед конденсацией и выдерживании смеси при 70-80°С (Журнал общей химии, 1953, Т. 23, С. 687; авт. св. СССР №100923, А61К 31/4409, 1955 г.).
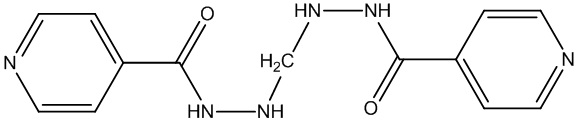
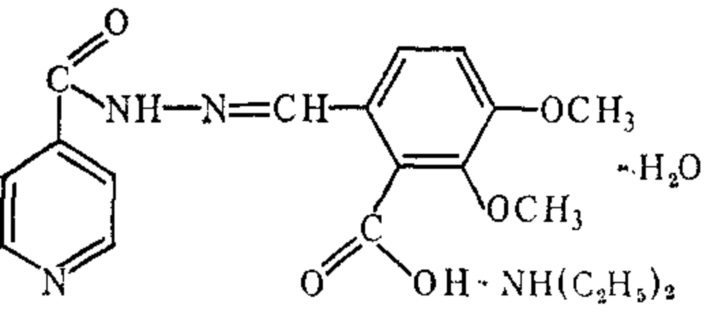
3б 3в
Наиболее близким по структуре гидразоном на основе изониазида является ларусан (3г) (Molecules 2015, 20, 8800-8815 10.1016/j.ejmech.2017.04.002). Способ его получения заключается в кипячении исходных компонентов в метаноле в течение 1 часа, последующем длительном охлаждении (порядка 13 часов) при разных температурных режимах и очистке промыванием метанолом и горячей водой (Журнал прикладной химии. 1952, Т. 25, С. 1238).
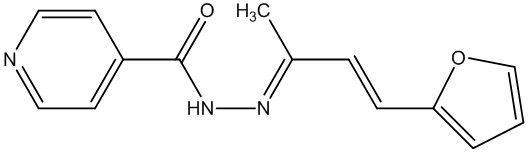
3г
В ряду гидразонов изониазида не описаны гидразоны спиропиранов оксаинданового ряда.
Задачей изобретения является расширение арсенала соединений, обладающих противотуберкулезной активностью.
Техническим результатом являются новые соединения в ряду гидразонов на основе изониазида и спиропиранов оксаинданового ряда, обладающие новым для данного ряда свойством противотуберкулезной активности, сравнимой с активностью гидразонов на основе изониазида, используемых в качестве лекарственных средств, а также увеличение всасываемости в кишечнике среди гидразонов на основе изониазида.
Технический результат достигается соединением 1.
Технический результат достигается также способом получения соединения 1, который заключается во взаимодействии изониазида (2) с 8-формил замещенными 3,3-диметил [2Н-1-безопиран-2,1-[2]-оксаинданами] (4) в инертной среде при кипячении в неполярных низкокипящих растворителях, с последующим охлаждением и очисткой.
В качестве растворителя могут быть использованы, например, метанол, этанол, изопропанол.
В качестве инертной среды может быть использован, например, газообразный азот, аргон, гелий.
Отличием предлагаемого способа от известных способов получения гидразонов изониазида, является проведение процесса в инертной среде для получения спиропиранового фрагмента в циклической форме.
В предпочтительном варианте кипячение смеси компонентов можно проводить с предварительным кипячением раствора исходного изониазида, при этом после смешения компонентов достаточно кратковременного кипячения (в течении 3-10 мин.), во избежание образования многокомпонентных неразделимых смесей термоиндуцированных форм спиропиранов. В предпочтительном варианте достаточно проведения охлаждения в течение 0,5-1,5 часа. В предпочтительном варианте очистку можно проводить без использования воды, например, промывкой горячим бензолом конечного продукта для очистки от активных термоиндуцированных форм спиропирана.
Конечный продукт представляет собой хорошо растворимый в органических растворителях порошок.
Общий выход гидразонов составляет 50-65%.
Полученные гидразоны устойчивы при хранении в сухом виде при 20° по крайней мере в течение 1,5 лет. При нагревании уже до 200° соответствующие гидразоны разлагаются (не подлежат термостерилизации).
Ниже приведены примеры получения соединений.
Пример 1. Гидразон 1a - (E)-N'-((7-гидрокси-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-ил)метилен)изоникотиногидразид.
Раствор 0,01 моль (1,37 г) изониазида в 15 мл этанола кипятили в течении 30 минут пропуская через раствор газообразный азот. Затем к раствору прибавили 0,01 молярный (2,86 г) раствор 7-гидрокси-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-карбальдегида в 10 мл этанола. Раствор окрашивается в красный цвет. Полученную смесь кипятили в течение 5 минут. Далее при охлаждении в течении одного часа образуется красный осадок, pH смеси 5,3. Образовавшийся окрашенный осадок фильтруют и промывают горячим бензолом. Затем перекристаллизовывают из изооктана. Выход: 55,0%, светло-розовый, т. пл. 195°С. ИК спектр, v, см-1: 934 (С-O), 1610 (С=N), 3122 (OH), 3401 (NHa). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д. (J, Гц): 11,40 (с, 1H, NHa), 10,30 (с, 1H, OH), 8,42 (с, 1H, H10), 7,25-7,75 (м, 8H, H5′, H6′, H7′, H8′, H11, H12, H13, H14), 7,22 (д, 1H, J = 8,39, H3), 6,84 (д, 1H, J = 9,64, H5), 6,55 (д, 1H, J = 8,37, H2), 5,70 (д, 1H, J = 9,50, H6), 1,59 (с, 3H, 1СН3спиро), 1,44 (c, 3H, 1СН3спиро). Найдено, %: C 69,79; H 4,90; N 9,02. C25H21N3O4. Вычислено, %: C 70,25; H 4,95; N 9,83.
Аналогичные результаты получены при кипячении смеси в течение 3 мин.
Пример 2. Гидразон 1б - (E)-N'-((3',3',6-триметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-ил)метилен)изоникотиногидразид.
Раствор 0,01 моль (1,37 г) изониазида в 15 мл метанола кипятили в течении 40 минут пропуская через раствор газообразный аргон. Затем к раствору прибавили 0,01 молярный (3,06 г) раствор 3',3',6-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-карбальдегида в 15 мл метанола. Раствор приобретает желтый цвет. Полученную смесь кипятили в течении 5 минут. Далее при охлаждении в течении 0,5 часа образуется желтый осадок, pH смеси 5,3. Образовавшийся окрашенный осадок фильтруют и промывают петролейным эфиром. Затем перекристаллизовывают из гексана. Выход: 58,0%, белый, т. пл. 187°С. ИК спектр, v, см-1: 937 (С-O), 1615 (С=N), 3420 (NHa). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д. (J, Гц): 11,40 (с, 1H, NHa), 8,42 (с, 1H, H10), 7,25-7,75 (м, 8H, H5′, H6′, H7′, H8′, H11, H12, H13, H14), 7,22 (д, 1H, J = 8,39, H3), 6,84 (д, 1H, J = 9,64, H5), 6,55 (д, 1H, J = 8,37, H2), 5,70 (д, 1H, J = 9,50, H6), 1,59 (с, 3H, 1СН3спиро), 1,44 (c, 3H, 1СН3спиро), 1,09 (с, 3H, 1CH3). Найдено, %: C 71,29; H 5,90; N 9,52; C26H23N3O3. Вычислено, %: C 73,39; H 5,45; N 9,88.
Аналогичные результаты получены при кипячении смеси 10 минут.
Пример 3. Гидразон 1в - (E)-N'-((6-(трет-бутил)-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-ил)метилен)изоникотиногидразид.
Раствор 0,01 моль (1,37 г) изониазида в 15 мл изопропанола кипятили в течении 20 минут пропуская через раствор газообразный гелий. Затем к раствору прибавили 0,01 молярный (3,48 г) раствор 6-(трет-бутил)-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-карбальдегида в 10 мл изопропанола. Полученную смесь кипятили в течении 5 минут. Далее при охлаждении в течении 1,5 часа образуется белый осадок, pH смеси 5,5. Образовавшийся осадок фильтруют и промывают петролейным эфиром. Затем перекристаллизовывают из изооктана. Выход: 60,5%, белый, т. пл. 170°С. ИК спектр, v, см-1: 939 (С-O), 1608 (С=N), 3394 (NHa). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д. (J, Гц): 11,33 (с, 1H, NHa), 8,35 (c, 1H, H10), 7,25-7,75 (м, 8H, H5′, H6′, H7′, H8′, H11, H12, H13, H14), 7,22 (д, 1H, J = 8,37, H3), 6,85 (д, 1H, J = 9,64, H5), 6,57 (д, 1H, J = 8,39, H2), 5,70 (д, 1H, J = 9,58, H6), 1,60 (с, 3H, 1СН3спиро), 1,46 (c, 3H, 1СН3спиро), 1,40 (c, 9H, 3CH3t-Bu). Найдено, %: C 74,01; H 6,04; N 9,08. C29H29N3O3. Вычислено, %: C 74,50; H 6,25; N 8,99.
Пример 4. Гидразон 1г - (E)-N'-((6-метокси-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-ил)метилен)изоникотиногидразида.
Раствор 0,01 моль (1,37 г) изониазида в 15 мл этанола кипятили в течении 50 минут пропуская через раствор газообразный азот. Затем к раствору прибавили 0,01 молярный (7,89 г) раствор 6-метокси-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-карбальдегида в 10 мл этанола. Полученную смесь кипятили в течении 5 минут. Далее при охлаждении в течении одного часа образуется оранжевый осадок, pH смеси 5,3. Образовавшийся осадок фильтруют и промывают горячим бензолом. Затем перекристаллизовывают из изооктана. Выход: 65,0%, светло-оранжевый, т. пл. 186°С. ИК спектр, v, см-1: 934 (С-O), 1614 (С=N), 3401 (NHa). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д. (J, Гц): 11,40 (с, 1H, NHa), 8,42 (с, 1H, H10), 7,25-7,75 (м, 8H, H5′, H6′, H7′, H8′, H11, H12, H13, H14), 7,22 (д, 1H, J = 8,39, H3), 6,84 (д, 1H, J = 9,64, H5), 6,55 (д, 1H, J = 8,37, H2), 5,70 (д, 1H, J = 9,50, H6), 4,37 (с, 3H, CH3 метокси), 1,59 (с, 3H, 1СН3спиро), 1,44 (c, 3H, 1СН3спиро). Найдено, %: C 70,49; H 4,98; N 9,02. C26H23N3O4. Вычислено, %: C 70,73; H 5,25; N 9,52.
Аналогичные результаты получены без предварительного кипячения раствора 0,01 моль (1,37 г) изониазида с кипячением смеси в течение 1 часа.
In silico оценка (компьютерное моделирование эксперимента) противотуберкулезной активности гидразонов изониазида типа 1, проведенная с использованием методов молекулярного докинга и ADMET, показала их высокую активность в качестве прямых ингибиторов синтеза белка inhA, который составляет основу биохимического механизма лекарственной устойчивости микобактерии туберкулеза и отвечает за выработку миколовых кислот, составляющих защитную оболочку mycobacterium tuberculosis. Действие на белок inhA обуславливает противотуберкулезные свойства соединений типа 1. Для сравнения, в качестве эталонных веществ были использованы фтивазид, метазид, салюзид, ларусан.
Для понимания связывания спиропиранов и их производных в активном центре белка, было проведено молекулярное моделирование. В этом исследовании использовались три различные конформации белка inhA (с сокристаллизованными ингибиторами), отличающиеся размером полости активного центра - PDB: 2X23; 3FNG; 4TZK. Кристаллические структуры были взяты из электронной библиотеки Protein Data Bank. Расчеты проводились с использованием программного обеспечения Schrodinger (Maestro, v. 11.8: Schrodinger, LLC, USA).
Места связывания для исследуемых соединений были определены, для “открытых'' конформаций InhA (PDB: 3FNG; 4TZK). В обоих случаях наблюдались взаимодействия аналогичные для типичных ингибиторов inhA.
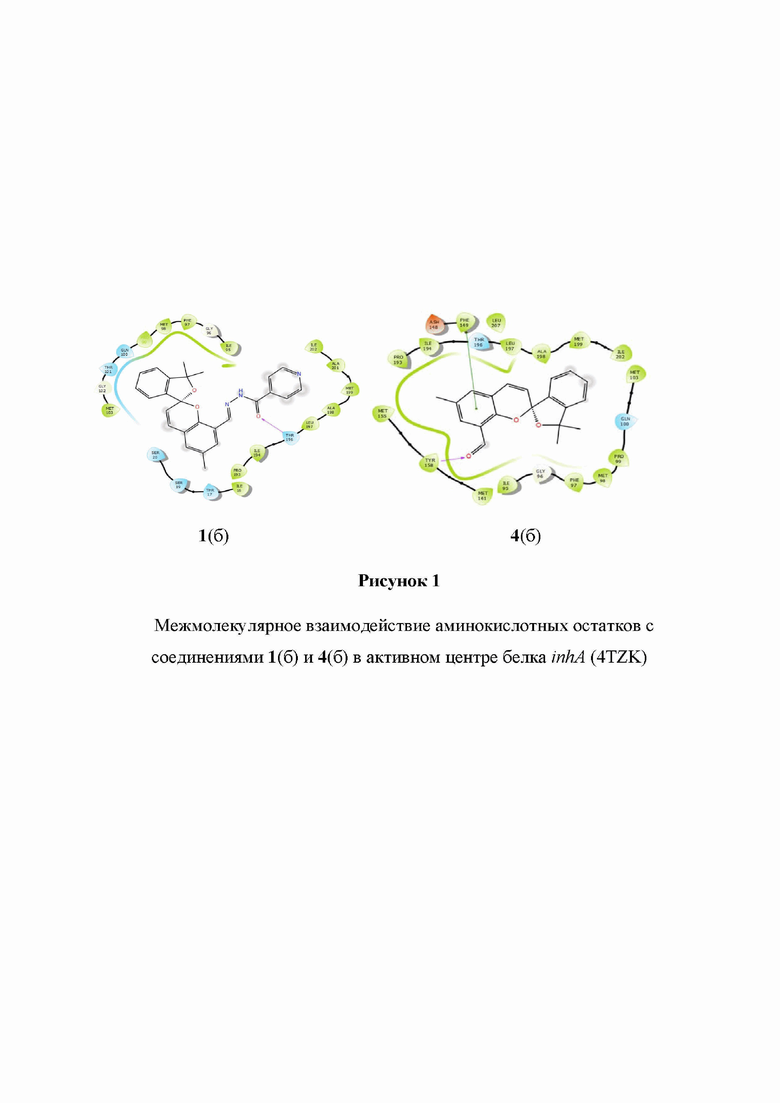
На рисунке 1 показаны взаимодействия исходного спиропирана 4б (R' = H; R'' = CH3) и гидразона на его основе 1б, а именно межмолекулярное взаимодействие аминокислотных остатков с соединениями 1(б) и 4(б) в активном центре белка inhA (4TZK). Согласно проведенному моделированию, обнаружены π-стэкинг взаимодействия бензопиранового фрагмента молекулы с аминокислотным остатком Phe149, и взаимодействия с образованием водородных связей между кислородом формильной группы и Tyr158 для 4(б) и кислородом гидразинового фрагмента молекулы с Thr196 1(б).
Аналогичный результат получается для соединений 1а, в, г и 4а, в, г.
Исходя из приведенных результатов оценки энергии взаимодействия соединений с белком InhA (Табл. 1), отмечается, что энергии сродства связывания для соединений 1а, 1б и 4б близки к энергии, полученной для фтивазида и салюзида, и сравнимы с метазидом и ларусаном. Это позволяет прогнозировать достаточно высокую противотуберкулезную активность соединений типа 1.
Таблица 1 - результаты молекулярного моделирования взаимодействия между белком-мишенью InhA и анализируемыми соединениями
Аналогичные результаты получены для соединений 1 в, г и 4 а, в, г.
Также проведена оценка фармакокинетических свойств ADMET (адсорбция, распределение, метаболизм, экскреция, токсичность), для соединений 1 и спиропирана, входящего в молекулу конечного гидразона в качестве фрагмента.
Прогнозы выполнены с использованием онлайн-программного обеспечения PreADMET (для Caco2, HIA) и SwissADME (для TPSA, LogP, нарушений правил Липински и Вебера). Данные представлены в таблице 2.
Таблица 2 - Физико-химические свойства, липофильность и лекарственное подобие
a MW - молекулярная масса, Да (<500).
б TPSA - площадь топологической полярной поверхности, Å2.
в LogP - логарифм коэффициента разделения соединения между н-октанолом и водой.
г Caco-2 - проницаемость клеток, нм/с: <4 - низкий, 4-70 - средний, >70 - высокий.
д HIA - всасывание в кишечнике человека: 0-20 - плохое, 20-70 - умеренное, 70-100 - хорошее).
Аналогичные результаты получены для соединений 1 а, в, г и 4 а, в, г.
Обнаружено, что соединения 1 и спиропираны 4 обладают высоким процентом всасываемости в кишечнике (HIA 96,49 -98.65%). Для гидразонов типа 1 этот показатель выше чем для фтивазида, метазида, салюзида и ларусана. Площадь топологической полярной поверхности, обеспечивающая хорошую биодоступность всех анализируемых соединений, и находится в диапазоне 35,53- 72,81 Å2. Кроме того, анализируемые соединения обладают умеренной проницаемостью клеток при значениях Caco2 в оптимальном диапазоне 27,60-45,65 нм/с.
Как видно из представленных данных (табл.2), соединения 1 обладают большей проницаемостью клеток (Caco2) по сравнению с салюзидом, фтивазидом и метазидом, и имеют высокое поглощение кишечником (TPSA), тогда как для салюзида, фтивазида и метазида эти показатели ниже. Соединения 1 обладают большим всасыванием в кишечнике человека (HIA) по сравнению с салюзидом, фтивазидом, метазидом, а также ларусаном.
Противотуберкулезная активность соединений 1 является новой для ряда гидразонов на основе изониазида и спиропиранов оксаинданового ряда, при этом активность сравнима с активностью гидразонов на основе изониазида, используемых в качестве лекарственных средств, а по показателю всасывания в кишечнике человека (HIA) активность выше, в том числе, по сравнению с наиболее близким по структуре ларусаном.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРИДИНОИЛГИДРАЗОНЫ ДИАЛКИЛ(2-МЕТИЛ-4-ОКСОПЕНТ-2-ИЛ) ФОСФИНОКСИДОВ, ОБЛАДАЮЩИЕ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2498990C1 |
| НИКОТИНОИЛГИДРАЗОН ДИМЕФОСФОНА, ОБЛАДАЮЩИЙ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2471787C1 |
| Противотуберкулезное средство на основе производного пиридоксина | 2021 |
|
RU2772219C1 |
| ИЗОНИКОТИНОИЛГИДРАЗОН ДИМЕФОСФОНА, ОБЛАДАЮЩИЙ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2457212C1 |
| ИЗОНИКОТИНОИЛГИДРАЗОНЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОТУБЕРКУЛЕЗНУЮ АКТИВНОСТЬ | 1993 |
|
RU2054002C1 |
| ДИЙОДИДХЛОРИДЫ 1,2,3-ЗАМЕЩЕННОГО БЕНЗИМИДАЗОЛИЯ И ИХ ВОДОРАСТВОРИМАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2148578C1 |
| ДИЙОДБРОМИДЫ 1,2,3-ЗАМЕЩЕННЫХ БЕНЗИМИДАЗОЛИЯ И ИХ ВОДОРАСТВОРИМАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2135476C1 |
| ПРОИЗВОДНЫЕ β-КАРБОЛИНА, ОБЛАДАЮЩИЕ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ, ИХ ПРИМЕНЕНИЯ ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННОГО СРЕДСТВА, СПОСОБ ИХ СИНТЕЗА, А ТАКЖЕ НОВЫЕ МЕТОДЫ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2419431C1 |
| 1,3,3-триметил-5-метокси-6´-бром-8´-[(Е)-2-(1´´,3´´,3´´-триметил-5-метокси-3Н-индолий-2´´-ил)винил]-спиро[индолин-2,2´-2Н-хромен] йодид, обладающий фотохромными свойствами | 2022 |
|
RU2786996C1 |
| 3-ТРИАЗЕНОИНДОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ПРОТИВ МИКОБАКТЕРИЙ | 2016 |
|
RU2724334C1 |
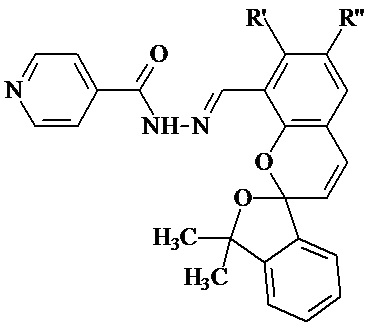
Изобретение относится к новым соединениям в ряду гидразонов на основе изониазида, а именно к гидразонам изониазида и замещенных спиропиранов оксаинданового ряда (E)-N'-((замещённые-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-ил)метилен)изоникотиногидразидам общей формулы:
 ,
,
где R' = OH, H; R'' = H, CH3, t-Bu, OCH3, в частности, при условии 1а) R' = OH; R'' = H; 1б) R' = H; R'' = CH3; 1в) R' = H; R'' = t-Bu; 1г) R' = H; R'' = OCH3, а также к способу их получения, и может использоваться при разработке противотуберкулезных лекарственных препаратов. Технический результат: получены новые соединения формулы 1, обладающие новым для данного ряда свойством противотуберкулёзной активности, сравнимой с активностью гидразонов на основе изониазида, используемых в качестве лекарственных средств. 2 н. и 6 з.п. ф-лы, 1 ил., 2 табл., 4 пр.
1. (E)-N'-((замещённые-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензофуран]-8-ил)метилен)изоникотиногидразиды общей формулой 1:
 ,
,
где R’ = OH, H; R” = H, СH3, t-Bu, OCH3.
2. (E)-N'-((замещённые-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензо фуран]-8-ил)метилен)изоникотиногидразиды по п.1 при условии 1а) R’ = OH; R” = H или 1б) R’ = H; R” = СH3 или 1в) R’ = H или R” = t-Bu или 1г) R’ = H; R” = OCH3.
3. E)-N'-((замещённые-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензо фуран]-8-ил)метилен)изоникотиногидразиды по п.1, проявляющие противотуберкулёзную активность.
4. Способ получения E)-N'-((замещённые-3',3'-диметил-3'H-спиро[хромен-2,1'-изобензо фуран]-8-ил)метилен)изоникотиногидразиды по п.1, характеризующихся тем, что изониазид вводят во взаимодействие с 8-формил замещенными 3,3-диметил [2Н-1-безопиран-2,1-[2]-оксаинданами] в инертной среде при кипячении в неполярном низкокипящем растворителе с последующим охлаждением и очисткой.
5. Способ по п.4, характеризующийся тем, что в качестве инертной среды используют газообразный азот, или аргон или гелий.
6. Способ по п. 4, характеризующийся тем, что в качестве растворителя используют метанол или этанол или изопропанол.
7. Способ по п.4, характеризующийся тем, что кипячение смеси компонентов проводят с предварительным кипячением раствора исходного изониазида, а после смешения компонентов кипятят смесь кратковременно в течение 3-10 мин.
8. Способ по п.4, характеризующийся тем, что охлаждение проводят в течение 0,5-1,5 часов.
| Нгуен С.Т., и др., СИНТЕЗ, ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА И ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ТИОСЕМИКАРБАЗОНОВ НА ОСНОВЕ 7-ГИДРОКСИ-3',3'-ДИМЕТИЛ-3'H-СПИРО[ХРОМЕН-2,1'-ИЗОБЕНЗОФУРАН]-8-КАРБАЛЬДЕГИДА, Известия Санкт-Петербургского государственного технологического института (технического университета), 65 (91), С | |||
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
| 6-(1,3-бензимидазол-2-ил)-7-гидрокси-замещенные спиро[бензопиран-индолины], обладающие флуоресценцией | 2015 |
|
RU2605984C1 |
| WO | |||
Авторы
Даты
2024-08-12—Публикация
2024-01-29—Подача