ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке США №62/812911, поданной 1 марта 2019 г.; и предварительной заявке США №62/980823, поданной 24 февраля 2020 г., полное содержание обеих из которых включено в данный документ посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка включает перечень последовательностей, который был подан в электронном виде в формате ASCII и полное содержание которого включено посредством ссылки. Указанная копия в формате ASCII, созданная 21 февраля 2020 г., названа АТ-023_03WO_SL.txt и имеет размер 251652 байта.
УРОВЕНЬ ТЕХНИКИ
[0003] Адоптивный перенос иммунных клеток (например, Т-клеток), генетически модифицированных для распознавания антигенов, ассоциированных со злокачественными новообразованиями, является новым перспективным подходом к лечению рака. Например, Т-клетки можно генетически модифицировать для экспрессии химерных антигенных рецепторов (CAR), которые представляют собой слитые белки, состоящие из антигенраспознающего фрагмента и доменов активации Т-клеток.
[0004] Пролиферация, цитотоксическая активность и устойчивость Т-клеток находятся под контролем путей передачи сигналов. Обычные конструкции CAR обеспечивают два сигнала - активацию CD3-дзета (Сигнал 1) и костимуляцию (Сигнал 2, например, за счет экспрессии 4-1 ВВ, OX40 и/или CD28). В некоторых случаях может быть желательным третий сигнал (Сигнал 3) - индуцированная цитокином передача сигналов цитокиновым рецептором (например, цитокиновая поддержка для иммунной стимуляции). Однако подходы к обеспечению Сигнала 3 имеют значительные ограничения.
[0005] Один из подходов к обеспечению цитокиновой поддержки включает комбинирование терапии CAR-T-клетками с системными инфузиями рекомбинантных цитокинов/миметиков цитокинов и модификацию CAR-T-клеток для внеклеточной секреции/экспрессии цитокинов. Поскольку цитокины обладают плейотропными эффектами, а также могут влиять на функцию других типов клеток, системное введение или выработка иммуно стимулирующих цитокинов CAR-T-клетками имеют по меньшей мере два основных недостатка: (i) эти подходы могут вызывать системную токсичность у человека, и (ii) в случае терапии аллогенными CAR-Т-клетками эти подходы могут вызывать случайную (bystander) активацию иммунной системы хозяина, которая может ускорить отторжение аллогенных CAR-T-клеток, что ухудшает терапевтическую эффективность. Другой подход к обеспечению цитокиновой поддержки был основан на введении конститутивно активированного димеризованного цитокинового рецептора, IL-7Ra, это ограничивает характер (передача сигналов только IL-7) и величину выходного сигнала. В еще одном подходе к обеспечению цитокиновой поддержки применялось включение Сигнала 3 непосредственно в молекулу CAR (Nat Med. 2018 Mar;24(3):352-359.). Ограничение этого подхода заключается в том, что сила Сигнала 3 зависит от силы активации CAR. В отсутствие мишени (и активации CAR) Сигнал 3 не будет передаваться.
[0006] Необходимы решения для преодоления этих недостатков путем нацеливания цитокиновых сигналов конкретно на CAR-T-клетки регулируемым способом, что позволит улучшить профиль безопасности и терапевтическую эффективность. Согласно настоящему изобретению предложены композиции и способы, которые удовлетворяют эту потребность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Согласно настоящему раскрытию предложены конститутивно активные химерные цитокиновые рецепторы (CACCR). В случае присутствия CACCR на иммунных клетках, несущих химерный антигенный рецептор (CAR) (CAR-1 клетках, например, CAR-T-клетках), они обеспечивают повышенную активацию, пролиферацию, устойчивость и/или активность иммунных клеток. Также предложены способы получения и применения CACCR, описанных в данном документе.
[0008] Соответственно, согласно одному аспекту настоящего изобретения предложен CACCR, состоящий из двух мономеров, причем каждый мономер содержит: (а) транс мембранный домен; (b) домен, связывающий янус-киназу (JAK); и (с) домен привлечения, при этом указанные мономеры конститутивно димеризованы. Согласно некоторым вариантам реализации CACCR не содержит лигандсвязывающего домена внеклеточного домена.
[0009] Согласно некоторым вариантам реализации трансмембранный домен и/или JAK-связывающий домен происходит из рецептора TPOR/MPLR. Согласно некоторым вариантам реализации трансмембранный домен и/или JAK-связывающий домен происходит из аминокислот 478-582 встречающегося в природе рецептора TPOR/MPLR из SEQ ID NO: 6. Согласно некоторым вариантам реализации рецептор TPOR/MPLR содержит одну или более аминокислотных замен, выбранных из H499L, S505N, W515K и G509N. Согласно некоторым вариантам реализации рецептор TPOR/MPLR содержит замены H499L, S505N и W515K или замены S505N и W515K. Согласно некоторым вариантам реализации домен привлечения представляет собой домен привлечения STAT. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL7Ra, например; IL7Ra(316-459). Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL2Rb, например, IL2Rb(333-551), IL2Rb(393-433, 518-551), IL2Rb(339-379, 393-433, 518-551), IL2Rb(333-551, Y381S, Y384S, Y387S), IL2Rb(333-551, Y364S, Y381S, Y384S, Y387S). Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rbl, например, IL12Rb 1(622-662). Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rb2, например, IL12Rb2(714-862) или IL12Rb2(775-825). Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL21R, например, IL21R(322-538).
[0010] Согласно связанному аспекту настоящего изобретения предложен полинуклеотид, кодирующий любой из CACCR согласно настоящему раскрытию, и вектор экспрессии, содержащий такой полинуклеотид. Согласно некоторым вариантам реализации полинуклеотид дополнительно кодирует химерный антигенный рецептор (CAR), причем указанный CAR связывается с ВСМА, EGFRvIII, Flt-3, WT-1, CD20, CD23, CD30, CD38, CD70, CD33, CD133, LeY, NKG2D, CS1, CD44v6, ROR1, CD19, клаудином-18.2 (клаудин-18A2 или изоформа 2 клаудина18), DLL3 (дельта-подобный белок 3, дельта-гомолог 3 дрозофилы, Delta3), Muc17 (муцин17, Muc3, Muc3), FAP альфа (белок активации фибробластов альфа), Ly6G6D (белок локуса G6d лимфоцитарного антигенного комплекса 6, c6orf23, G6D, MEGT1, NG25) и/или RNF43 (RNF43 убиквитинлигазы (Е3), белок с RING-пальцем 43).
[0011] Согласно другому аспекту настоящего изобретения предложены сконструированные иммунные клетки, содержащие по меньшей мере один химерный антигенный рецептор (CAR) и по меньшей мере один CACCR согласно настоящему раскрытию. Согласно некоторым вариантам реализации иммунная клетка представляет собой Т-клетку. Согласно некоторым вариантам реализации иммунная клетка представляет собой аллогенную иммунную клетку. Согласно другим вариантам реализации иммунная клетка представляет собой аутологичную иммунную клетку. Иммунная клетка может быть выбрана из группы, состоящей из: Т-клетки, дендритной клетки; дендритной клетки-киллера, тучной клетки, NK-клетки, макрофага, моноцита, В-клетки и иммунной клетки, происходящей из стволовой клетки. Согласно связанному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая любые из сконструированных иммунных клеток согласно настоящему раскрытию, и набор, содержащий такую фармацевтическую композицию.
[0012] Согласно другому аспекту настоящего изобретения предложен способ лечения рака у субъекта, включающий введение указанному субъекту терапевтически эффективного количества любых из сконструированных иммунных клеток, описанных в данном документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0013] ФИГ. 1 схематически показывает сконструированный CACCR согласно настоящему раскрытию.
[0014] ФИГ. 2 схематически показывает вектор согласно настоящему раскрытию, который можно применять для совместной экспрессии CACCR и CAR согласно настоящему раскрытию. Один или более цитоплазматических хвостов могут быть соединены в тандеме для имитации передачи сигналов от одного или более цитокинов. Также показано схематическое изображение вектора, экспрессирующего контрольный BFP (синий флуоресцентный белок) CAR.
[0015] ФИГ. 3А-3В показывают идентификацию мутантов трансмембранного домена (ТМ) TpoR, которые конститутивно активируют передачу сигналов цитокиновым рецептором.
[0016] ФИГ. 4А-4С показывают результаты, касающиеся размножения CAR-T-клеток, коэкспрессирующих конститутивно активный химерный цитокиновый рецептор.
[0017] ФИГ. 5 показывает дифференцировку и распределение субпопуляции Т-клеток памяти в продукте CAR-T-клеток в условиях, различающихся по IL-2.
[0018] ФИГ. 6А-6В показывают степень конститутивной передачи цитокиновых сигналов, опосредуемой каждым вариантом ТМ TpoR.
[0019] ФИГ. 7A-7D показывают цитотоксическую активность мутантов ТМ TpoR, это свидетельствует о том, что конститутивная передача сигналов цитокиновым рецептором повышает активность CAR-T-клеток.
[0020] ФИГ. 8А-8В показывают цитотоксическую активность и устойчивость мутантов ТМ TpoR.
[0021] ФИГ. 9 показывает обогащение CAR-T-клеток с течением времени в анализе, независимом от фактора роста.
[0022] ФИГ. 10А-10В показывают кратность размножения CAR-T-клеток с течением времени в анализе, независимом от фактора роста.
[0023] ФИГ. 11 показывает распределение субпопуляции Т-клеток памяти среди CAR+ Т-клеток с течением времени в анализе, независимом от фактора роста.
[0024] ФИГ. 12 показывает активацию путей передачи сигналов STAT CAR-T-клетками, коэкспрессирующими указанный CACCR.
[0025] ФИГ. 13А-13В и ФИГ. 14А-14В показывают оптимизацию силы передачи сигналов CACCR Т-клетками, экспрессирующими полноразмерные или усеченные цитоплазматические хвосты, показанную в репортерном анализе на клетках HEK293.
[0026] ФИГ. 15 показывает оптимизацию силы передачи сигналов CACCR, показанную на первичных CAR-T-клетках, коэкспрессирующих полноразмерные или усеченные цитоплазматические хвосты.
[0027] ФИГ. 16А-16С показывают, что CACCR CAR-T-клетки, несущие усеченные цитоплазматические хвосты IL2Rb, более точно имитируют передачу сигналов IL-15, но не IL-2.
[0028] ФИГ. 17A-17D показывают комбинаторные выходные сигналы различных цитоплазматических хвостов, слитых в виде тандема.
[0029] ФИГ. 18А-18В отображают эффекты CACCR на дифференцировку CAR-T-клеток в клетки памяти.
[0030] ФИГ. 19A-19D отображают влияние CACCR на выживаемость и дифференцировку CAR-T-клеток в клетки памяти в условиях, независимых от фактора роста.
[0031] ФИГ. 20А-20В отображают цитотоксическую активность CAR-T-клеток, коэкспрессирующих различные CACCR.
[0032] ФИГ. 21 показывает, что CACCR улучшили цитотоксическую активность CAR-T-клеток, направленных против ВСМА-мишени гемобластоза.
[0033] ФИГ. 22А-22С показывают, что CACCR улучшили in vivo противоопухолевую активность и устойчивость ВСМА CAR-T-клеток против ортотопической множественной миеломы.
[0034] ФИГ. 23 показывает, что CACCR улучшили противоопухолевую активность CAR-Т-клеток против развившихся солидных опухолей.
ПОДРОБНОЕ ОПИСАНИЕ
[0035] Согласно настоящему раскрытию предложены конститутивно активные химерные цитокиновые рецепторы (CACCR). Присутствие конститутивно активного, регулируемого химерного цитокинового рецептора обеспечивает иммунную стимуляцию Сигнала 3 для удовлетворения потребности в иммунной стимуляции. Соответственно, когда такие CACCR присутствуют на иммунных клетках, несущих химерный антигенный рецептор (CAR) (CAR-1 клетках, например, CAR-T-клетках), они обеспечивают повышенную активацию, пролиферацию, устойчивость и/или активность иммунных клеток. Согласно настоящему изобретению также предложены способы получения и применения CACCR, описанных в данном документе.
[0036] CACCR согласно настоящему раскрытию являются регулируемыми и имеют легко изменяемые выходные цитокиновые сигналы для повышения активности, устойчивости и т.п. CAR-T-клеток Компоненты, способы получения и применения последовательно описаны ниже.
I. Конститутивно активные химерные цитокиновые рецепторы (CACCR)
[0037] CACCR согласно настоящему раскрытию состоят из двух мономеров, причем каждый мономер содержит: (а) трансмембранный домен; (b) JAK-связывающий домен; и (с) домен привлечения, при этом указанные мономеры конститутивно димеризованы. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию не содержит внеклеточного лигандсвязывающего домена.
[0038] Согласно некоторым вариантам реализации мономеры идентичны, что приводит к образованию конститутивно активного гомодимера. Согласно таким вариантам реализации уменьшается количество белков, которые необходимо экспрессировать в векторе. Согласно некоторым вариантам реализации мономеры не идентичны, что приводит к образованию конститутивно активного гетеродимера, который может быть желательным при определенных обстоятельствах.
[0039] Мономеры CACCR согласно настоящему раскрытию способны к спонтанной димеризации и могут активировать передачу сигналов в отсутствие какой-либо экзогенной стимуляции или лиганда (лиганд-независимая димеризация). Уровень активности можно контролировать с помощью мутаций, введенных в трансмембранный домен CACCR. Квалифицированный специалист поймет, что мономеры CACCR не димеризованы в 100% случаев и могут существовать в виде мономера.
А. Трансмембранные домены
[0040] CACCR согласно настоящему раскрытию содержат трансмембранные домены. Трансмембранные домены согласно настоящему раскрытию содержат последовательности, которые обеспечивают конститутивную димеризацию пары мономеров, обеспечивая, таким образом, конститутивную активацию JAK во внутриклеточной части и конститутивное привлечение и фосфорилирование, например, STAT в цитоплазматической области рецептора.
[0041] Трансмембранные домены находятся на N-конце и связаны с внутриклеточными/цитоплазматическими доменами на С-конце. Согласно некоторым вариантам реализации связывание достигается необязательно посредством линкера.
[0042] В данном документе трансмембранные домены способны встраиваться в мембрану клетки, в которой они экспрессируются. Согласно некоторым вариантам реализации транс мембранные домены согласно настоящему раскрытию пронизывают клеточную мембрану и содержат внеклеточную часть и/или внутриклеточную часть.
[0043] Согласно некоторым вариантам реализации трансмембранные домены согласно настоящему раскрытию являются сконструированными (синтетическими) и не похожи на какой-либо встречающийся в природе трансмембранный домен, например, они не встречаются в природе.
[0044] Согласно другим вариантам реализации трансмембранные домены согласно настоящему раскрытию происходят из встречающихся в природе рецепторов.
[0045] Согласно некоторым вариантам реализации транс мембранные домены и/или JAK-активирующие домены согласно настоящему раскрытию происходят, например, из одного или более из следующих рецепторов: рецептора эритропоэтина (EpoR), передатчика сигнала интерлейкина 6 (GP130 или IL6ST), рецептора пролактина (PrlR), рецептора гормона роста (GHR), рецептора гранулоцитарного колониестимулирующего фактора (GCSFR) и рецептора тромбопоэтина/рецептора белка миелопролиферативного лейкоза (TPOR/MPLR). В случае происхождения из встречающихся в природе рецепторов весь рецептор или вся трансмембранная последовательность рецептора могут не потребоваться для осуществления конститутивной активации и конститутивного связывания/активации JAK во внутриклеточной части. Соответственно, можно использовать фрагменты встречающихся в природе рецепторов. Кроме того, определенные мутации могут быть введены в трансмембранные домены, происходящие из встречающихся в природе рецепторов, для дальнейшей регулировки последующей передачи сигналов.
[0046] Согласно некоторым вариантам реализации трансмембранный домен и/или JAK-активирующий домен согласно настоящему раскрытию происходит из встречающегося в природе рецептора EpoR.
[0047] Согласно некоторым вариантам реализации трансмембранный домен и/или JAK-активирующий домен согласно настоящему раскрытию происходит из встречающегося в природе рецептора GP130.
[0048] Согласно некоторым вариантам реализации трансмембранный домен и/или JAK-активирующий домен согласно настоящему раскрытию происходит из встречающегося в природе рецептора PrlR.
[0049] Согласно некоторым вариантам реализации трансмембранный домен и/или JAK-активирующий домен согласно настоящему раскрытию происходит из встречающегося в природе рецептора GHR.
[0050] Согласно некоторым вариантам реализации трансмембранный домен и/или JAK-активирующий домен согласно настоящему раскрытию происходит из встречающегося в природе рецептора GCSF.
[0051] Согласно некоторым вариантам реализации трансмембранный домен и/или JAK-активирующий домен согласно настоящему раскрытию происходит из встречающегося в природе рецептора TPOR.
[0052] В Таблице 1а приведены примерные полноразмерные последовательности встречающихся в природе рецепторов, предложенных в настоящем раскрытии, из которых происходят трансмембранные белки. Последовательности, приведенные в Таблице 1а, являются референсными последовательностями, по отношению к которым отражены более поздние мутации, например, в Таблицах 1b и 1 с.






[0053] Согласно некоторым вариантам реализации транс мембранный домен согласно настоящему раскрытию происходит из усеченного варианта встречающегося в природе рецептора TPOR/MPLR (белок миелопролиферативного лейкоза), показанного в Таблице 1а.
[0054] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR в Таблице 1а.
[0055] В Таблице 1b представлены примерные аминокислотные последовательности транс мембранного домена согласно настоящему раскрытию, причем указанный транс мембранный домен происходит из встречающегося в природе рецептора TPOR.
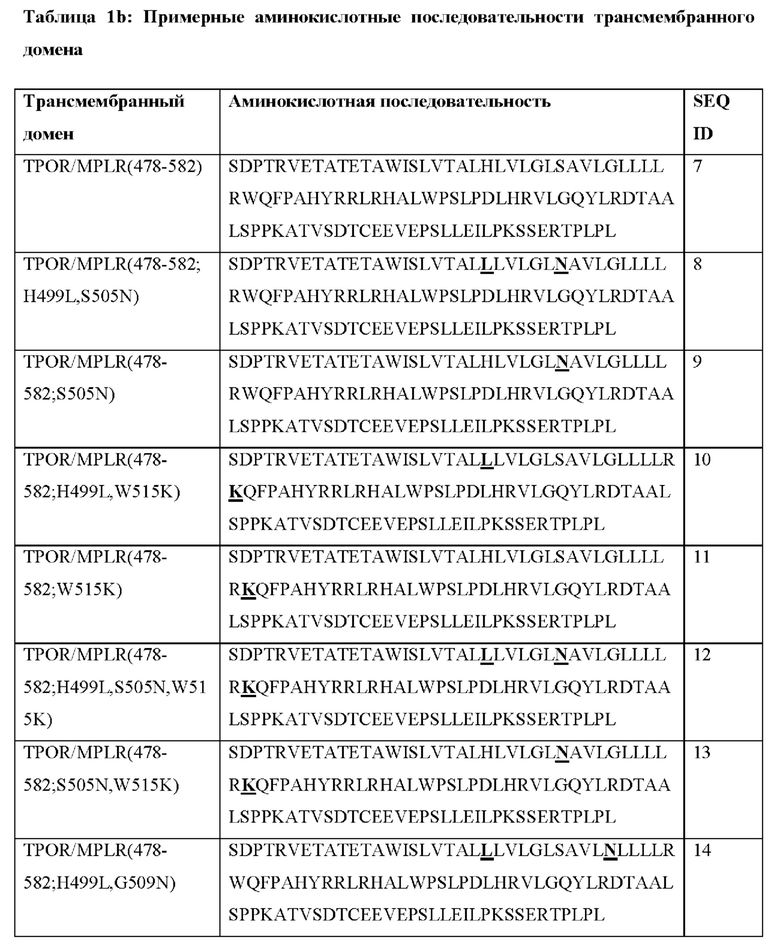
[0056] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену по меньшей мере в Н499. Согласно некоторым вариантам реализации трансмембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену H499L.
[0057] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену по меньшей мере в S505. Согласно некоторым вариантам реализации трансмембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену S505N.
[0058] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену по меньшей мере в G509. Согласно некоторым вариантам реализации трансмембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену G509N.
[0059] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену по меньшей мере в W515. Согласно некоторым вариантам реализации трансмембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену W515K.
[0060] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену в Н499 и S505 (последовательность представлена в Таблице 1b).
[0061] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену в Н499 и W515 (последовательность представлена в Таблице 1b).
[0062] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену в Н499, S505 и W515 (последовательность представлена в Таблице 1b).
[0063] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену в S505 и W515 (последовательность представлена в Таблице 1b).
[0064] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену в Н499 и G509 (последовательность представлена в Таблице 1b).
[0065] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотные замены H499L и S505N (последовательность представлена в Таблице 1b).
[0066] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотные замены H499L и W515K (последовательность представлена в Таблице 1b).
[0067] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотные замены H499L и G509N (последовательность представлена в Таблице 1b).
[0068] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотные замены S505N и W515K (последовательность представлена в Таблице 1b).
[0069] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотные замены H499L, S505N и W515K (последовательность представлена в Таблице 1b).
[0070] Согласно некоторым вариантам реализации транс мембранный домен CACCR содержит аминокислоты 478-582 рецептора TPOR и аминокислотную замену в Н499 и S505 (последовательность представлена в Таблице 1b).
[0071] CACCR согласно настоящему раскрытию можно регулировать для достижения уровня Сигнала 3/иммунной стимуляции, необходимого в иммунной клетке, несущей CAR (например, CAR-T-клетке), и желаемого в конкретном случае или условии.
[0072] Согласно некоторым вариантам реализации в иммунной клетке, несущей CAR (например; CAR-T-клетке), желателен низкий уровень активации STAT5. В качестве примера, в таких вариантах реализации, может быть введен транс мембранный домен CACCR, содержащий аминокислоты 478-582 рецептора TPOR и аминокислотную замену S505N, W515K или H499L/G509N.
[0073] Согласно некоторым вариантам реализации в иммунной клетке, несущей CAR (например, CAR-T-клетке), желателен повышенный уровень активации STAT5. В качестве примера, в таких вариантах реализации, может быть введен транс мембранный домен CACCR, содержащий аминокислоты 478-582 рецептора TPOR и аминокислотные замены H499L, S505N и W515K. В качестве другого примера, в таких вариантах реализации, может быть введен трансмембранный домен CACCR, содержащий аминокислоты 478-582 рецептора TPOR и аминокислотные замены S505N и W515K.
[0074] Согласно некоторым вариантам реализации желательной является повышенная дифференцировка иммунных клеток, несущих CAR (например, CAR-T-клеток), в Т-клетки памяти. В качестве примера, в таких вариантах реализации, может быть введен транс мембранный домен CACCR, содержащий аминокислоты 478-582 рецептора TPOR и аминокислотные замены W515K или H499L/G509N.
[0075] Согласно некоторым вариантам реализации желательной является повышенная дифференцировка иммунных клеток, несущих CAR (например, CAR-T-клеток), в Т-клетки памяти. В качестве примера, в таких вариантах реализации, может быть введен транс мембранный домен CACCR, содержащий аминокислоты 478-582 рецептора TPOR и аминокислотные замены S505N/W515K и H499L/S505N/W515K.
[0076] Согласно настоящему изобретению также предложены замены для повышения цитотоксической активности, устойчивости ответа и повышенной устойчивости, например, замены S505N/W515K и H499L/S505N/W515K.


В. Связывающие янус-киназу (JAK) домены
[0077] CACCR согласно настоящему раскрытию содержат внутриклеточные JAK-связывающие домены. JAK-связывающий домен связан с С-концом транс мембранного домена либо непосредственно, либо за счет линкера. JAK-связывающий домен связан с транс мембранным доменом на внутриклеточной стороне химерного цитокинового рецептора.
[0078] Согласно некоторым вариантам реализации JAK-связывающий домен представляет собой JAK-1-связывающий домен, JAK-2-связывающий домен, JAK-3-связывающий домен или TYK2-связывающий домен.
[0079] Согласно некоторым вариантам реализации JAK-связывающие домены CACCR согласно настоящему раскрытию встречаются в природе и происходят из встречающегося в природе рецептора.
[0080] Согласно некоторым вариантам реализации JAK-связывающие домены CACCR согласно настоящему раскрытию являются синтетическими.
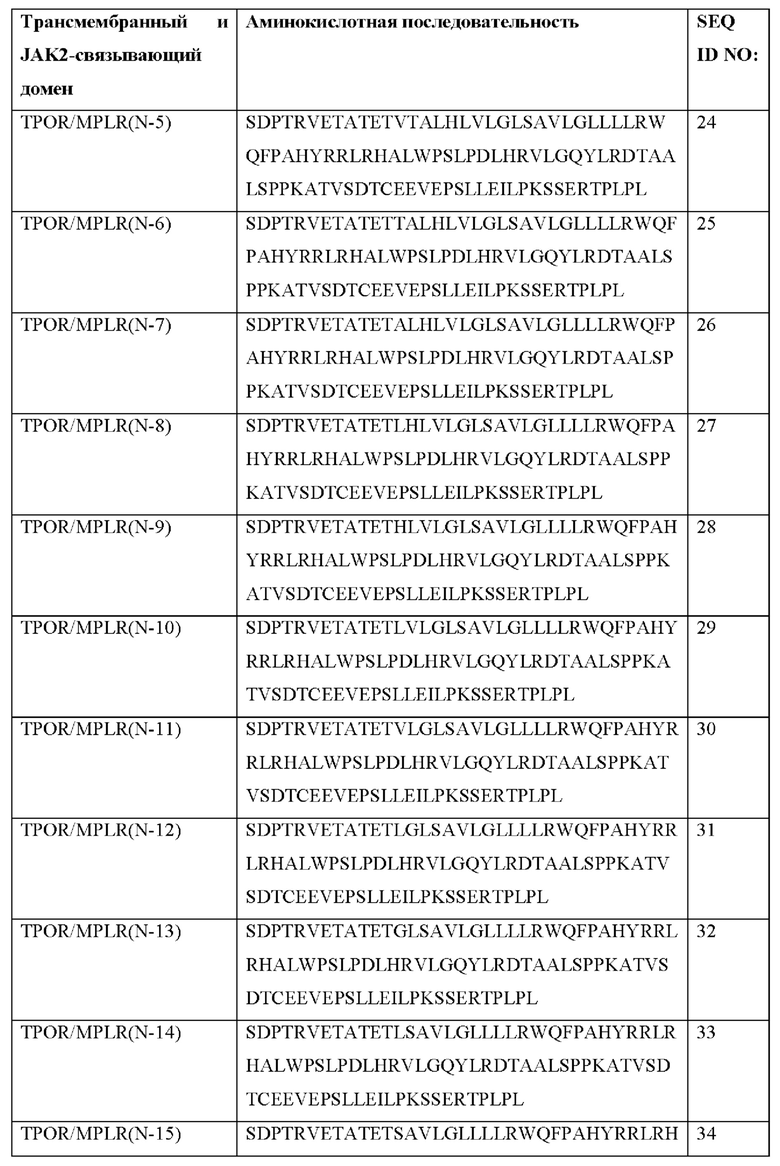
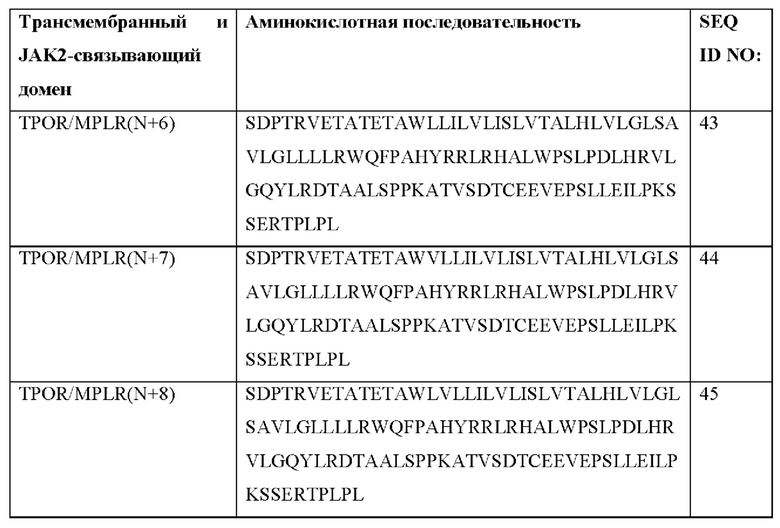
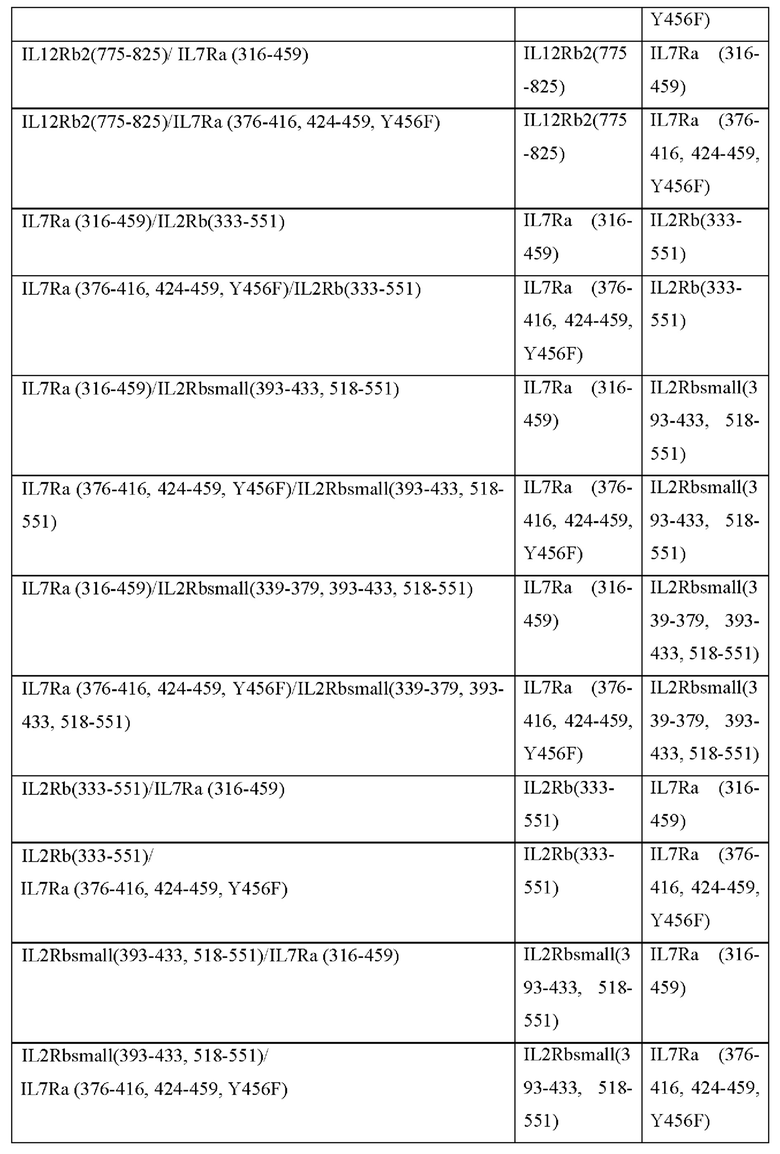
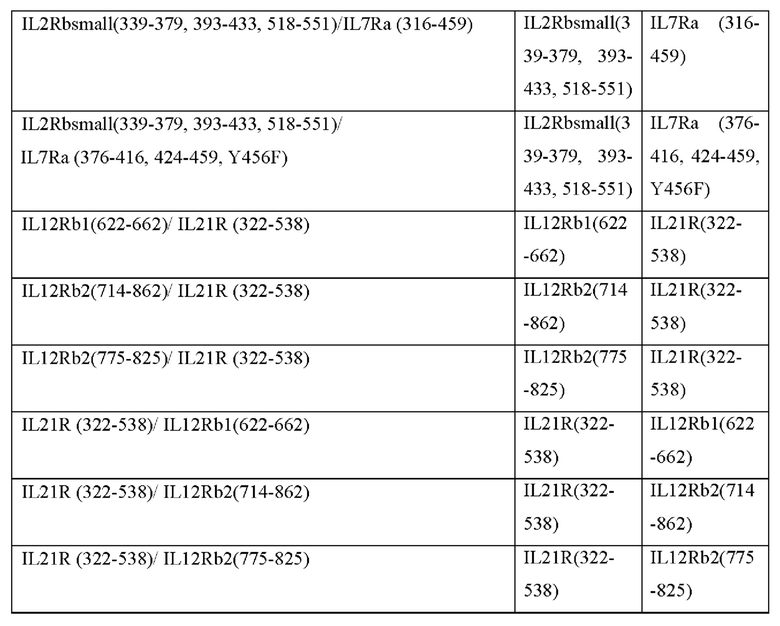
[0081] В Таблице 1b и Таблице 1с представлены примерные аминокислотные последовательности трансмембранных и JAK2-связывающих доменов согласно настоящему раскрытию. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит транс мембранный и JAK2-связывающий домен, содержащий аминокислотную последовательность, выбранную из последовательностей в Таблицах 1b и 1с. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит транс мембранный и JAK2-связывающий домен, содержащий аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 98%, 99% или 100% идентична любой из последовательностей в Таблицах 1b и 1с.
С. Домены привлечения
[0082] CACCR согласно настоящему раскрытию содержат цитоплазматические домены привлечения. Домен привлечения может представлять собой домен привлечения STAT, домен привлечения AP1, домен привлечения Мус/Мах; или домен привлечения NFkB. Согласно некоторым вариантам реализации домен привлечения представляет собой домены привлечения передатчика сигнала и активатора транскрипции (STAT) (STAT-активирующие), например, из хвостов рецепторов (цитоплазматических хвостов) или из хвостов цитокиновых рецепторов. Эти внутриклеточные домены привлечения CACCR согласно настоящему раскрытию обеспечивают распространение Сигнала 3 в иммунной клетке, содержащей CAR и химерный цитокиновый рецептор (например, в CAR-T-клетке с химерным цитокиновым рецептором согласно настоящему раскрытию). Передача цитокиновых сигналов, распространяемых посредством домена привлечения Stat, обеспечивает основанную на цитокинах иммунную стимуляцию клетки. Согласно некоторым вариантам реализации иммунная стимуляция является гомеостатической, например, передача сигналов приводит к увеличению количества иммунных клеток, несущих CAR. Согласно некоторым вариантам реализации иммунная стимуляция является воспалительной, например, передача сигналов приводит к увеличению активности иммунных клеток, несущих CAR. Согласно некоторым вариантам реализации иммунная стимуляция предотвращает истощение, например, передача сигналов поддерживает долговременную функциональность иммунных клеток, несущих CAR.
[0083] Согласно некоторым вариантам реализации домены привлечения согласно настоящему раскрытию являются синтетическими и не похожи на какой-либо фрагмент встречающегося в природе рецептора. Согласно некоторым вариантам реализации иммунная стимуляция предотвращает истощение, например, передача сигналов поддерживает долговременную функциональность иммунных клеток, несущих CAR.
[0084] Согласно некоторым вариантам реализации домены привлечения Stat согласно настоящему раскрытию являются синтетическими и не похожи на какой-либо фрагмент встречающегося в природе рецептора.
[0085] Согласно другим вариантам реализации домены привлечения Stat согласно настоящему раскрытию происходят из цитоплазматических хвостов встречающихся в природе рецепторов, например, происходят из встречающихся в природе цитокиновых рецепторов. Эти цитоплазматические хвосты встречающихся в природе рецепторов могут представлять собой области, расположенные после JAK-активирующих доменов транс мембранного домена рецептора. Домены привлечения Stat химерных цитокиновых рецепторов содержат по меньшей мере один домен привлечения STAT по меньшей мере из одного рецептора. Согласно некоторым вариантам реализации домен привлечения Stat содержит по меньшей мере один домен привлечения STAT1. Согласно некоторым вариантам реализации домен привлечения Stat содержит по меньшей мере один домен привлечения STAT2. Согласно некоторым вариантам реализации домен привлечения Stat содержит по меньшей мере один домен привлечения STAT3. Согласно некоторым вариантам реализации домен привлечения Stat содержит по меньшей мере один домен привлечения STAT4. Согласно некоторым вариантам реализации домен привлечения Stat содержит по меньшей мере один домен привлечения STAT5. Согласно некоторым вариантам реализации домен привлечения Stat содержит по меньшей мере один домен привлечения STAT6. Согласно некоторым вариантам реализации домен привлечения Stat содержит по меньшей мере один домен привлечения STAT7.
[0086] Согласно некоторым вариантам реализации встречающийся в природе рецептор, из которого происходит домен привлечения Stat, не является цитокиновым рецептором.
[0087] Согласно некоторым вариантам реализации встречающийся в природе рецептор, из которого происходит домен привлечения Stat, представляет собой цитокиновый рецептор. Примерные цитокиновые рецепторы, посредством которых передаются сигналы цитокинов, усиливающих иммунную стимуляцию Т-клеток, включают, но не ограничиваются перечисленными, рецептор IL-2, рецептор IL-7, рецептор IL-15 и рецептор IL-21. Согласно альтернативным вариантам реализации рецептор, из которого происходит домен привлечения Stat, не является цитокиновым рецептором. Рецептор может быть перенаправлен на выбранную передачу сигналов с помощью выбора домена привлечения Stat CACCR.
[0088] Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит домен привлечения, соединенный с С-концом трансмембранного/JAK2-связывающего домена, с линкером или без него. Согласно некоторым вариантам реализации линкер содержит один или более аминокислотных остатков.
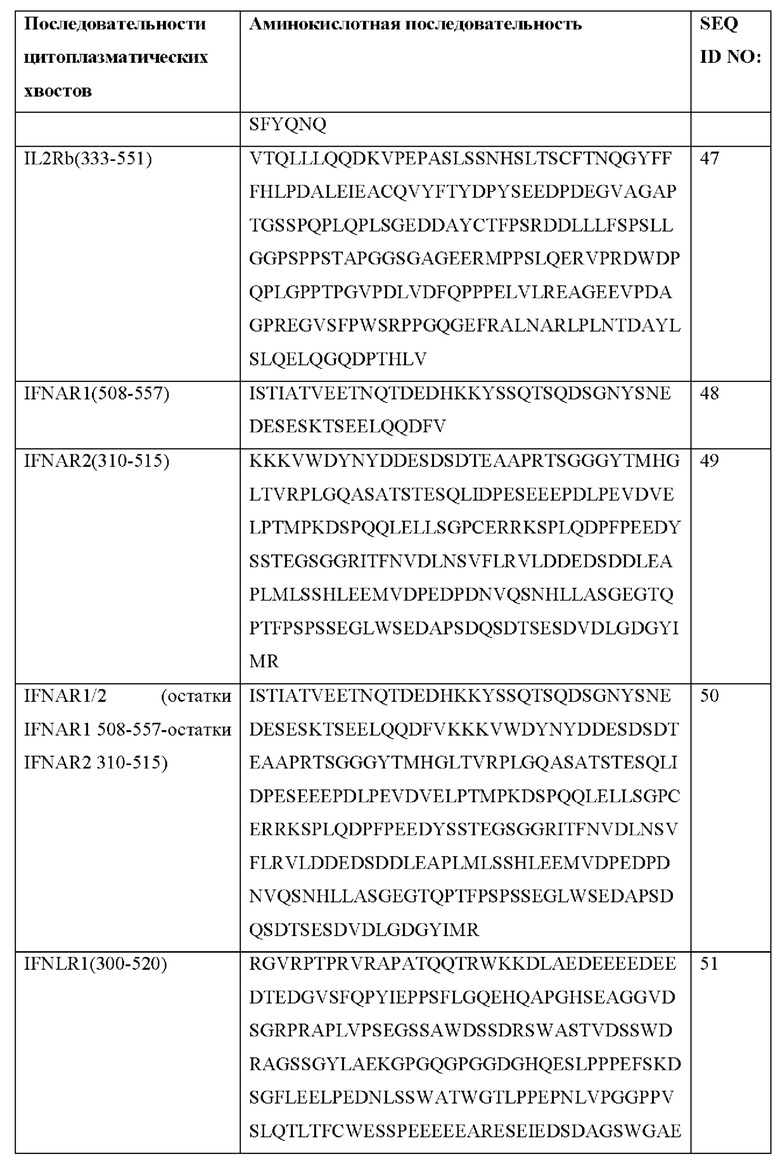
[0089] В Таблице 2а представлены примерные рецепторы, из которых происходят домены привлечения CACCR согласно настоящему раскрытию. В Таблице 2b представлены примерные аминокислотные последовательности доменов привлечения согласно настоящему раскрытию. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит домен привлечения, содержащий аминокислотную последовательность, выбранную из одной или более рецепторных последовательностей в Таблице 2b. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит домен привлечения, содержащий аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 98%, 99% или 100% идентична любой из последовательностей в Таблице 2b.


[0090] Согласно некоторым вариантам реализации домен привлечения Stat CACCR согласно настоящему раскрытию содержит домен привлечения STAT из одного рецептора.
[0091] Для получения нескольких выходных сигналов, два или более доменов привлечения STAT могут быть соединены в тандеме, чтобы имитировать передачу сигналов от одного или более цитокинов.
[0092] Согласно некоторым вариантам реализации два или более доменов привлечения STAT могут быть соединены в тандеме с линкером или без него. Согласно некоторым вариантам реализации линкер содержит один или более аминокислотных остатков.
[0093] Согласно некоторым вариантам реализации домен привлечения STAT содержит части более чем одного рецептора, например, содержит более одного домена привлечения STAT. Согласно таким вариантам реализации предложен тандемный домен передачи цитокиновых сигналов, обеспечивающий повышенную передачу сигналов. Соответственно, в некоторых вариантах реализации, домен привлечения STAT мономера CACCR согласно настоящему раскрытию содержит домены привлечения STAT более чем из одного рецептора, например, содержит домены привлечения STAT из двух, трех, четырех, пяти или даже шести рецепторов. Например, в некоторых вариантах реализации, домены привлечения STAT могут быть связаны в тандеме для стимуляции нескольких путей передачи сигналов (например, слияние фрагментов IL7R(316-459)-IL12Rb2(775-825) для обеспечения устойчивости сигнального пути STAT5 и провоспалительной передачи сигнала STAT4; IL7R(316-459)-IL2Rbsmall(393-433,518-551) для обеспечения устойчивости; IL7R(316-459)-EGFR(1122-1165) для обеспечения устойчивости и предотвращения истощения; IL2Rbsmall(393-433,518-551)-EGFR(1122-1165) для обеспечения устойчивости и предотвращения истощения).
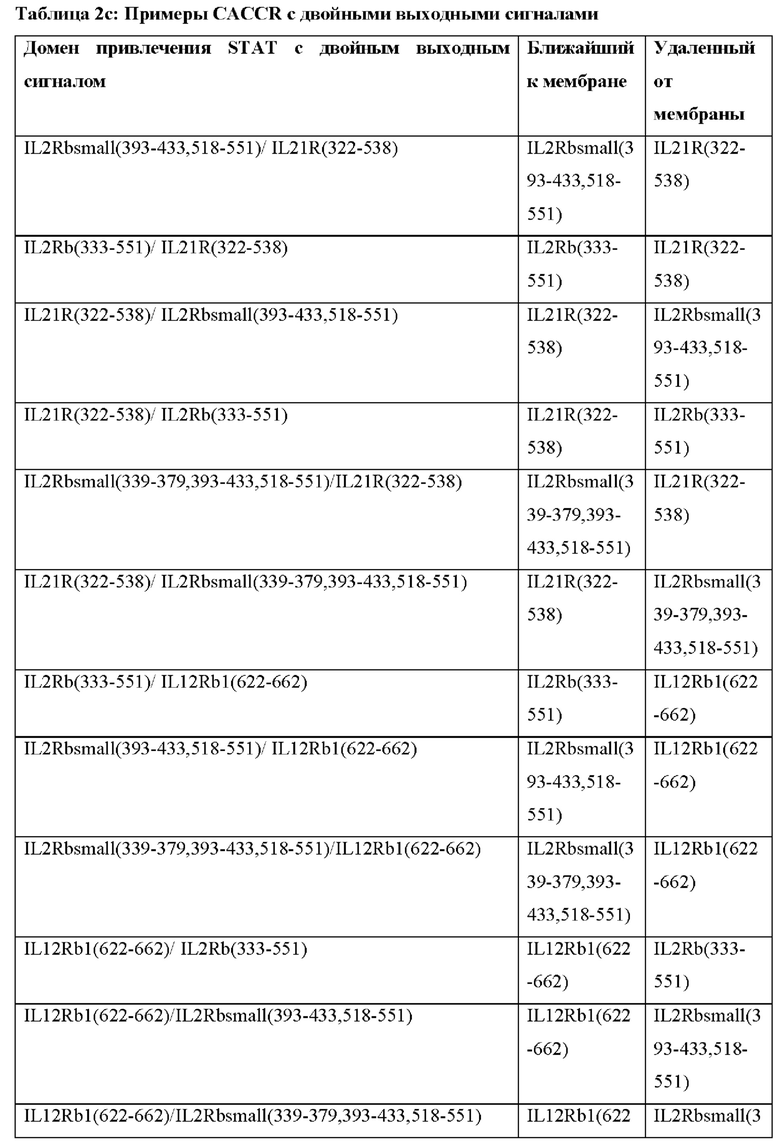
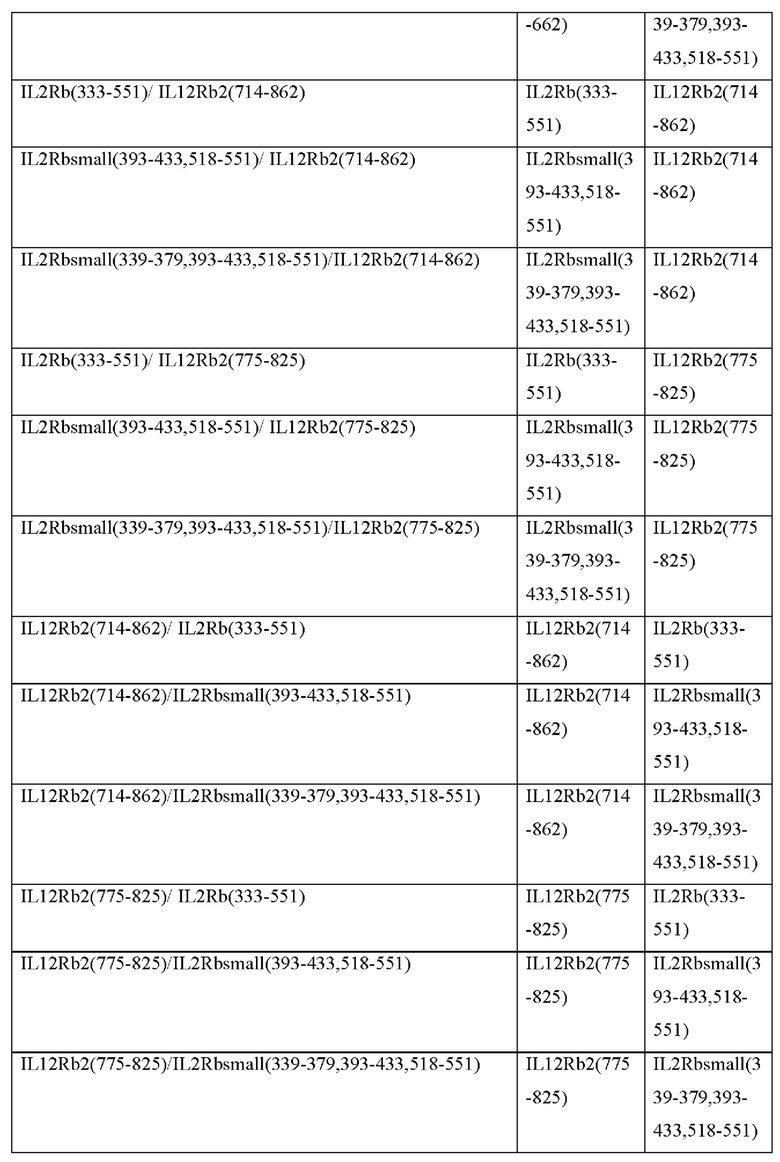
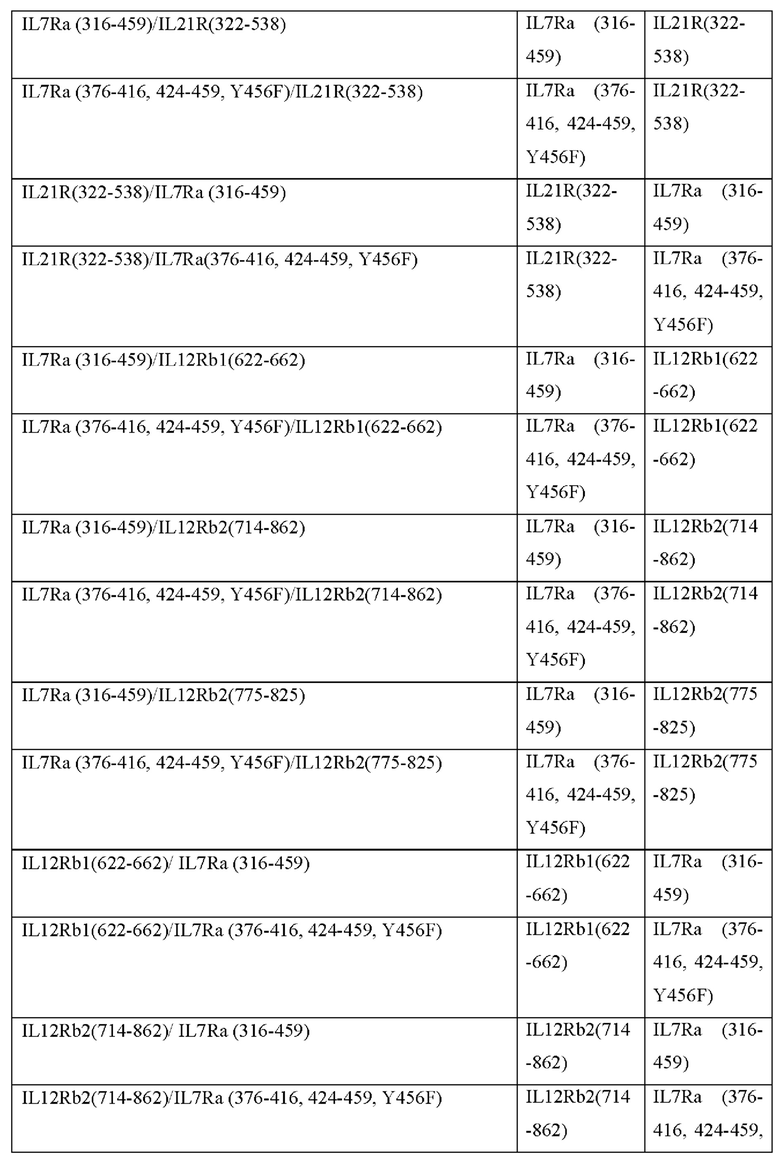
[0094] При генерации нескольких выходных сигналов близость отдельных доменов привлечения STAT к клеточной мембране может влиять на силу их соответствующих выходных сигналов. В Таблице 2с представлены примеры CACCR с двойными выходными сигналами, где каждый выходной сигнал может быть размещен ближе или дальше по отношению к клеточной мембране. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержат домен привлечения с двойными выходными сигналами, выбранный из Таблицы 2с.
[0095] Не ограничиваясь какой-либо теорией или механизмом, в некоторых вариантах реализации JAK-белок (JAK1, JAK2, JAK3 или TYK2) связан с димеризованным CACCR согласно настоящему раскрытию. Активируются два связанных JAK-белка, которые способны фосфорилировать остатки тирозина на домене привлечения CACCR. Затем фосфорилированные домены привлечения способны связывать привлеченные белки (например, фосфорилированный домен привлечения STAT связывает STAT-белок), которые, в свою очередь, реализовывают события транскрипции в ядре.
D. Примерные CACCR
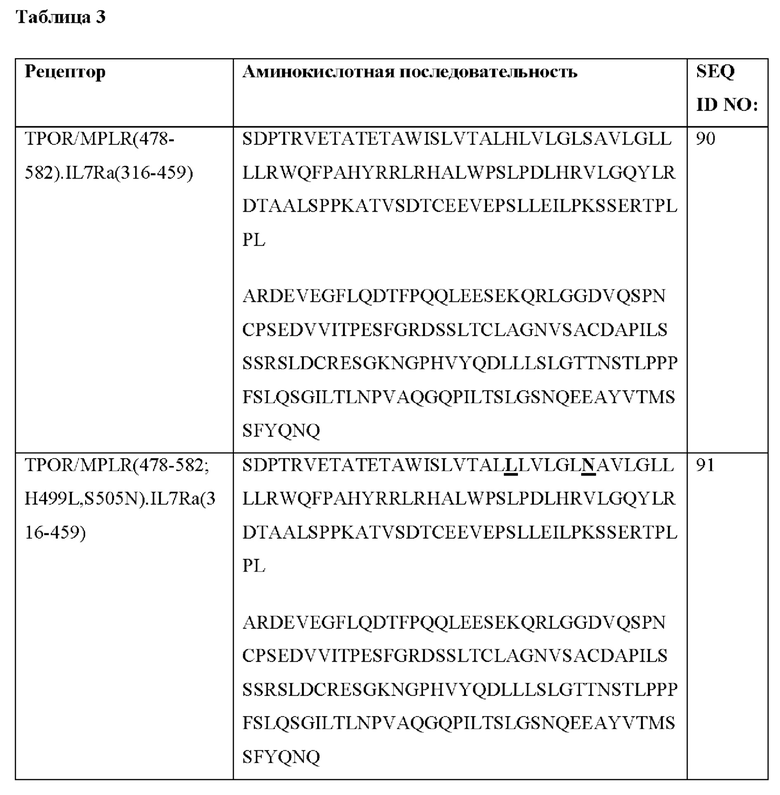
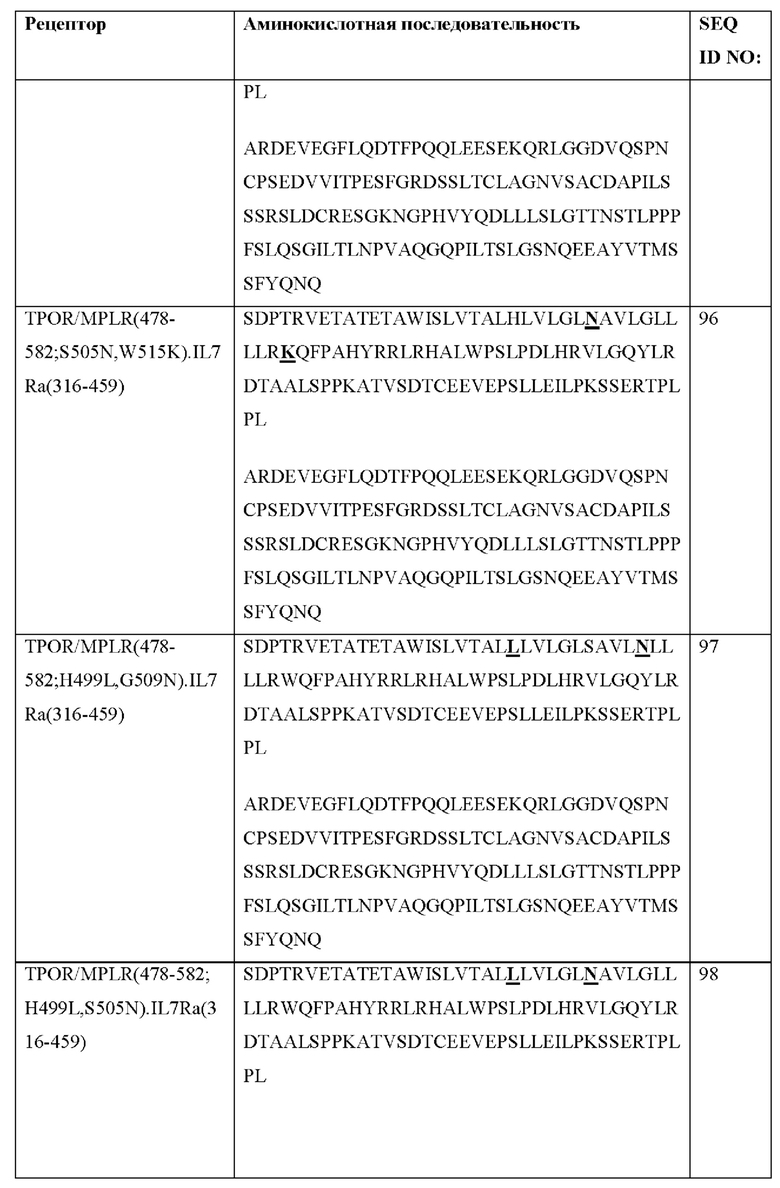
[0096] В Таблице 3 показаны примерные последовательности CACCR согласно настоящему раскрытию. Рецепторы могут быть экспрессированы с сигнальной последовательностью, например, CD8SS, имеющим последовательность MALPVTALLLPLALLLHAARP (SEQ ID NO: 89).
[0097] Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит любую из последовательностей в Таблице 3. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична любой из аминокислотных последовательностей SEQ ID NO: 90-98 и 107-139. Согласно некоторым вариантам реализации рецептор TPOR/MPLR содержит любую из аминокислотных последовательностей SEQ ID NO: 90-98 и 107-139.
[0098] Согласно некоторым вариантам реализации CACCR содержит трансмембранный домен и/или JAK-связывающий домен, происходящие из рецептора TPOR/MPLR. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит аминокислоты 478-582 встречающегося в природе рецептора TPOR/MPLR из SEQ ID NO: 6. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17. Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит аминокислотную последовательность SEQ ID NO: 17. Согласно некоторым вариантам реализации CACCR дополнительно содержит домен привлечения, содержащий аминокислотную последовательность одной или более из рецепторных последовательностей, представленных в Таблице 2b. Согласно некоторым вариантам реализации CACCR дополнительно содержит один или более доменов привлечения, выбранных из группы, состоящей из доменов привлечения STAT из IL7Ra, IL2Rb, IL12Rb1, IL12Rb2 и IL21R. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL7Ra. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL2Rb. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rb1 или IL12Rb2. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL21R. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 54. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность SEQ ID NO: 54. Согласно некоторым вариантам реализации CACCR содержит один или более доменов привлечения, представленных в Таблице 2 с. Согласно некоторым вариантам реализации домены привлечения содержат домены привлечения STAT из IL7Ra и IL2Rb. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb1. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb2. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 90 или 119, с сигнальной последовательностью или без нее. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность SEQ ID NO: 90 или 119, с сигнальной последовательностью или без нее.
[0099] Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит трансмембранный домен и/или JAK-связывающий домен из рецептора TPOR/MPLR, который содержит одну или более аминокислотных замен в Н499, S505, G509 или W515. Согласно некоторым вариантам реализации рецептор TPOR/MPLR содержит замену H499L. Согласно некоторым вариантам реализации рецептор TPOR/MPLR содержит замену S505N. Согласно некоторым вариантам реализации рецептор TPOR/MPLR содержит замену G509N. Согласно некоторым вариантам реализации рецептор TPOR/MPLR содержит замену W515K. Согласно некоторым вариантам реализации CACCR дополнительно содержит домен привлечения, содержащий аминокислотную последовательность одной или более из рецепторных последовательностей, представленных в Таблице 2b. Согласно некоторым вариантам реализации CACCR дополнительно содержит один или более доменов привлечения, выбранных из группы, состоящей из доменов привлечения STAT из IL7Ra, IL2Rb, IL12Rb1, IL12Rb2 и IL21R. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL7Ra. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL2Rb. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rb1 или IL12Rb2. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL21R. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 54. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность SEQ ID NO: 54. Согласно некоторым вариантам реализации CACCR содержит один или более доменов привлечения, представленных в Таблице 2с. Согласно некоторым вариантам реализации домены привлечения содержат домены привлечения STAT из IL7Ra и IL2Rb. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb1. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb2. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 92, 94, 121 или 123, с сигнальной последовательностью или без нее. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность SEQ ID N0: 92, 94, 121 или 123, с сигнальной последовательностью или без нее.
[00100] Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит трансмембранный домен и/или JAK-связывающий домен из рецептора TPOR/MPER, который содержит замены H499L и S505N. Согласно некоторым вариантам реализации CACCR дополнительно содержит домен привлечения, содержащий аминокислотную последовательность одной или более из рецепторных последовательностей, представленных в Таблице 2b. Согласно некоторым вариантам реализации CACCR дополнительно содержит один или более доменов привлечения, выбранных из группы, состоящей из доменов привлечения STAT из IL7Ra, IL2Rb, IL12Rb1, IL12Rb2 и IL21R. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL7Ra. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL2Rb. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rb1 или IL12Rb2. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL21R. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 54. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность SEQ ID NO: 54. Согласно некоторым вариантам реализации CACCR содержит один или более доменов привлечения, представленных в Таблице 2 с. Согласно некоторым вариантам реализации домены привлечения содержат домены привлечения STAT из IL7Ra и IL2Rb. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb1. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb2. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 91, 98, 120 или 127, с сигнальной последовательностью или без нее. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность SEQ ID NO: 91, 98, 120 или 127, с сигнальной последовательностью или без нее.
[00101] Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит трансмембранный домен и/или JAK-связывающий домен из рецептора TPOR/MPLR, который содержит замены H499L и W515K или замены H499L и G509N. Согласно некоторым вариантам реализации CACCR дополнительно содержит домен привлечения, содержащий аминокислотную последовательность одной или более из рецепторных последовательностей, представленных в Таблице 2b. Согласно некоторым вариантам реализации CACCR дополнительно содержит один или более доменов привлечения, выбранных из группы, состоящей из доменов привлечения STAT из IL7Ra, IL2Rb, IL12Rb1, IL12Rb2 и IL21R. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL7Ra. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL2Rb. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rb1 или IL12Rb2. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL21R. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 54. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность SEQ ID NO: 54. Согласно некоторым вариантам реализации CACCR содержит один или более доменов привлечения, представленных в Таблице 2 с. Согласно некоторым вариантам реализации домены привлечения содержат домены привлечения STAT из IL7Ra и IL2Rb. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb1. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb2. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 97 или 126, с сигнальной последовательностью или без нее. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность SEQ ID NO: 97 или 126, с сигнальной последовательностью или без нее.
[00102] Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит трансмембранный домен и/или JAK-связывающий домен из рецептора TPOR/MPLR, который содержит замены S505N и W515K. Согласно некоторым вариантам реализации CACCR дополнительно содержит домен привлечения, содержащий аминокислотную последовательность одной или более из рецепторных последовательностей, представленных в Таблице 2b. Согласно некоторым вариантам реализации CACCR дополнительно содержит один или более доменов привлечения, выбранных из группы, состоящей из доменов привлечения STAT из IL7Ra, IL2Rb, IL12Rb1, IL12Rb2 и IL21R. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL7Ra. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL2Rb. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rb1 или IL12Rb2. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения STAT из IL12RM или IL12Rb2 содержит аминокислотную последовательность SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL21R. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 54. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность SEQ ID NO: 54. Согласно некоторым вариантам реализации CACCR содержит один или более доменов привлечения, представленных в Таблице 2 с. Согласно некоторым вариантам реализации домены привлечения содержат домены привлечения STAT из IL7Ra и IL2Rb. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb1. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb2. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 96, 107, 109, 111, 113, 115, 117, 125, 128, 129, 132, 134, 136 или 138, с сигнальной последовательностью или без нее. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность SEQ ID NO: 96, 107, 109, 111, 113, 115, 117, 125, 128, 129, 132, 134, 136 или 138, с сигнальной последовательностью или без нее.
[00103] Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит трансмембранный домен и/или JAK-связывающий домен из рецептора TPOR/MPLR, который содержит замены H499L и W515K. Согласно некоторым вариантам реализации CACCR дополнительно содержит домен привлечения, содержащий аминокислотную последовательность одной или более из рецепторных последовательностей, представленных в Таблице 2b. Согласно некоторым вариантам реализации CACCR дополнительно содержит один или более доменов привлечения, выбранных из группы, состоящей из доменов привлечения STAT из IL7Ra, IL2Rb, IL12Rb1, IL12Rb2 и IL21R. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL7Ra. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL2Rb. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rb1 или IL12Rb2. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL21R. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 54. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность SEQ ID NO: 54. Согласно некоторым вариантам реализации CACCR содержит один или более доменов привлечения, представленных в Таблице 2 с. Согласно некоторым вариантам реализации домены привлечения содержат домены привлечения STAT из IL7Ra и IL2Rb. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb1. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb2. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 93, с сигнальной последовательностью или без нее. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность SEQ ID NO: 93, с сигнальной последовательностью или без нее.
[00104] Согласно некоторым вариантам реализации CACCR согласно настоящему раскрытию содержит трансмембранный домен и/или JAK-связывающий домен из рецептора TPOR/MPLR, который содержит замены H499L, S505N и W515K. Согласно некоторым вариантам реализации CACCR дополнительно содержит домен привлечения, содержащий аминокислотную последовательность одной или более из рецепторных последовательностей, представленных в Таблице 2b. Согласно некоторым вариантам реализации CACCR дополнительно содержит один или более доменов привлечения, выбранных из группы, состоящей из доменов привлечения STAT из IL7Ra, IL2Rb, IL12Rb1, IL12Rb2 и IL21R. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL7Ra. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения STAT из IL7Ra содержит аминокислотную последовательность SEQ ID NO: 46, 68, 69, 70, 71 или 72. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL2Rb. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения STAT из IL2Rb содержит аминокислотную последовательность SEQ ID NO: 47, 73, 74, 75, 76, 77, 78, 106 или 143. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL12Rb1 или IL12Rb2. Согласно некоторым вариантам реализации домен привлечения STAT из IL12Rb1 или IL12Rb2 содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения STAT из IL12RM или IL12Rb2 содержит аминокислотную последовательность SEQ ID NO: 67, 86 или 87. Согласно некоторым вариантам реализации домен привлечения содержит домен привлечения STAT из IL21R. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 54. Согласно некоторым вариантам реализации домен привлечения STAT из IL21R содержит аминокислотную последовательность SEQ ID NO: 54. Согласно некоторым вариантам реализации CACCR содержит один или более доменов привлечения, представленных в Таблице 2с. Согласно некоторым вариантам реализации домены привлечения содержат домены привлечения STAT из IL7Ra и IL2Rb. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb1. Согласно некоторым вариантам реализации домен привлечения содержит домены привлечения STAT из IL7Ra и IL12Rb2. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 95, 108, 110, 112, 114, 116, 118, 124, 130, 131, 133, 135, 137 или 139, с сигнальной последовательностью или без нее. Согласно некоторым вариантам реализации CACCR содержит аминокислотную последовательность SEQ ID NO: 95, 108, 110, 112, 114, 116, 118, 124, 130, 131, 133, 135, 137 или 139, с сигнальной последовательностью или без нее.

Е. Экспрессия CACCR
[00105] Согласно настоящему изобретению предложены полинуклеотиды, кодирующие любой из CACCR, предложенных в данном документе. Аналогичным образом, согласно настоящему изобретению предложены векторы экспрессии, содержащие такие полинуклеотиды. Согласно некоторым вариантам реализации вектор представляет собой вирусный вектор. Согласно некоторым вариантам реализации вектор не является вирусным вектором.
[00106] Согласно некоторым вариантам реализации вектор экспрессии содержит CACCR и полинуклеотид, экспрессирующий химерный антигенный рецептор (CAR).
[00107] Согласно некоторым вариантам реализации CACCR и CAR экспрессируются в виде одной полипептидной цепи, разделенной линкером. ФИГ. 2 схематически показывает вектор, который можно применять для совместной экспрессии CACCR и CAR согласно настоящему раскрытию. Один или более доменов привлечения могут быть соединены в тандеме для имитации передачи сигналов от одного или более цитокинов.
II. CAR-несущие иммунные клетки
[00108] Согласно настоящему изобретению предложены сконструированные иммунные клетки, содержащие полинуклеотид, кодирующий химерный антигенный рецептор (CAR) и CACCR согласно настоящему раскрытию; также согласно настоящему изобретению предложены сконструированные иммунные клетки, экспрессирующие химерный антигенный рецептор (CAR-I клетка) и CACCR согласно настоящему раскрытию. Примеры иммунных клеток включают Т-клетки, например, альфа/бета-Т-клетки и гамма/дельта-Т-клетки, В-клетки, естественные киллерные клетки (NK-клетки), естественные киллерные Т-клетки (NKT-клетки), инвариантные NKT-клетки, тучные клетки, фагоциты миелоидного происхождения, дендритные клетки, дендритные клетки-киллеры, макрофаги и моноциты. Иммунные клетки также относятся к клеткам, происходящим из, например, но не ограничиваясь этим, стволовой клетки. Стволовые клетки могут представлять собой стволовые клетки взрослого организма, эмбриональные стволовые клетки нечеловеческого происхождения, более конкретно стволовые клетки нечеловеческого происхождения, стволовые клетки пуповинной крови, клетки-предшественники, стволовые клетки костного мозга, индуцированные плюрипотентные стволовые клетки, тотипотентные стволовые клетки или гемопоэтические стволовые клетки.
[00109] Соответственно, согласно некоторым вариантам реализации настоящего изобретения предложены CAR-T-клетки, содержащие CACCR согласно настоящему раскрытию.
[00110] Согласно некоторым вариантам реализации CAR могут содержать внеклеточный лигандсвязывающий домен (например, одноцепочечный вариабельный фрагмент (scFv)), транс мембранный домен и внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации внеклеточный лигандсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен находятся в одном полипептиде, т.е. в одной цепи. Согласно настоящему изобретению также предложены многоцепочечные CAR и полипептиды. Согласно некоторым вариантам реализации многоцепочечные CAR содержат: первый полипептид, содержащий транс мембранный домен и по меньшей мере один внеклеточный лигандсвязывающий домен, и второй полипептид, содержащий транс мембранный домен и по меньшей мере один внутриклеточный сигнальный домен, причем указанные полипептиды собираются вместе с образованием многоцепочечного CAR.
[00111] Внеклеточный лигандсвязывающий домен CAR специфично связывается с мишенью, представляющей интерес.Представляющей интерес мишенью может быть любая представляющая интерес молекула, включая, например, но не ограничиваясь перечисленными, ВСМА, EGFRvIII, Flt-3, WT-1, CD20, CD23, CD30, CD38, CD70, CD33, CD133, LeY, NKG2D, CS1, CD44v6, ROR1, CD 19, клаудин-18.2 (клаудин-18A2 или изоформа 2 клаудина 18), DLL3 (дельта-подобный белок 3, дельта-гомолог 3 дрозофилы, Delta3), Muc17 (муцин17, Muc3, Muc3), FAP альфа (белок активации фибробластов альфа), Ly6G6D (белок локуса G6d лимфоцитарного антигенного комплекса 6, c6orf23, G6D, MEGT1, NG25) и/или RNF43 (RNF43 убиквитинлигазы (Е3), белок с RING-пальцем 43).
[00112] Согласно некоторым вариантам реализации внеклеточный лигандсвязывающий домен CAR содержит scFv, содержащий вариабельную область легкой цепи (VL) и вариабельную область тяжелой цепи (VH) моноклонального антитела (мАТ), специфичного в отношении целевого антигена, соединенные гибким линкером. Одноцепочечные фрагменты вариабельных областей получают путем связывания вариабельных областей легкой и/или тяжелой цепей с использованием короткого связывающего пептида (Bird et al., Science 242:423-426, 1988) (например, содержащих глицин-серин линкеров). В целом линкеры могут представлять собой короткие гибкие полипептиды и обычно состоят из примерно 20 или меньшего числа аминокислотных остатков. Линкеры, в свою очередь, могут быть модифицированы для выполнения дополнительных функций, таких как присоединение лекарственных средств или присоединение к твердым подложкам. Одноцепочечные варианты могут быть получены либо рекомбинантно, либо путем синтеза. Для получения scFv путем синтеза можно использовать автоматический синтезатор. Для рекомбинантного получения scFv подходящая плазмида, содержащая полинуклеотид, который кодирует указанный scFv, может быть введена в подходящую клетку-хозяина, либо эукариотическую, такую как клетки дрожжей, растений, насекомых или млекопитающих, либо прокариотическую, такую как Е. coli. Полинуклеотиды, кодирующие представляющий интерес scFv, могут быть получены посредством рутинных манипуляций, таких как лигирование полинуклеотидов. Полученный scFv можно выделить с использованием стандартных методик очистки белка, известных в данной области техники.
[00113] Внутриклеточный сигнальный домен CAR в соответствии с настоящим изобретением отвечает за внутриклеточную передачу сигналов после связывания внеклеточного лигандсвязывающего домена с мишенью, что приводит к активации иммунной клетки и иммунного ответа (Сигналы 1 и/или 2). Внутриклеточный сигнальный домен способен активировать по меньшей мере одну из нормальных эффекторных функций иммунной клетки, в которой экспрессируется CAR. Например, эффекторная функция Т-клетки может представлять собой цитолитическую активность или вспомогательную активность, включая секрецию цитокинов.
[00114] Согласно некоторым вариантам реализации внутриклеточный сигнальный домен для применения в CAR может представлять собой цитоплазматические последовательности, например, но не ограничиваясь перечисленными, Т-клеточного рецептора и корецепторов, которые действуют совместно, инициируя передачу сигнала после взаимодействия с антигенным рецептором, а также любое производное или вариант этих последовательностей и любую синтетическую последовательность, обладающую такой же функциональной способностью. Внутриклеточные сигнальные домены содержат два различных класса цитоплазматических сигнальных последовательностей: те, которые инициируют антиген-зависимую первичную активацию, и те, которые действуют антиген-независимым образом, обеспечивая вторичный или костимулирующий сигнал. Первичные цитоплазматические сигнальные последовательности могут содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы, ITAM. ITAM представляют собой хорошо определенные сигнальные мотивы, обнаруженные во внутрицитоплазматическом хвосте различных рецепторов, которые служат сайтами связывания для тирозинкиназ класса syk/zap70. Примеры ITAM, использованных в настоящем изобретении, могут включать в качестве неограничивающих примеров те, которые происходят из TCRζ, FcRγ, FcRβ, FcRε, CD3γ, CD3δ, CD3ε, CD5, CD22, CD79a, CD79b и CD66d. Согласно некоторым вариантам реализации внутриклеточный сигнальный домен CAR может содержать сигнальный домен CD3ζ.
Согласно некоторым вариантам реализации внутриклеточный сигнальный домен CAR согласно настоящему изобретению содержит домен костимулирующей молекулы.
[00115] Согласно некоторым вариантам реализации внутриклеточный сигнальный домен CAR согласно настоящему изобретению содержит часть костимулирующей молекулы, выбранной из группы, состоящей из фрагмента 41 ВВ (GenBank: ААА53133.) и CD28 (NP 006130.1).
[00116] CAR экспрессируются на поверхностной мембране клетки. Таким образом, CAR содержит трансмембранный домен. Подходящие трансмембранные домены для CAR, раскрытого в данном документе, обладают способностью (а) экспрессироваться на поверхности клетки, предпочтительно иммунной клетки, такой как, например, но не ограничиваясь перечисленными, лимфоциты или естественные киллерные клетки (NK-клетки), и (b) взаимодействовать с лигандсвязывающим доменом и внутриклеточным сигнальным доменом для направления клеточного ответа иммунной клетки на заранее определенную клетку-мишень. Трансмембранный домен может происходить либо из природного, либо из синтетического источника. Трансмембранный домен может происходить из любого мембраносвязанного или транс мембранного белка. В качестве неограничивающих примеров, транс мембранный полипептид может представлять собой субъединицу Т-клеточного рецептора, такую как α, β, γ или δ, полипептид, составляющий комплекс CD3, р55 (а-цепь), р75 (β-цепь) или γ-цепь рецептора IL-2, цепь субъединицы рецепторов Fc, в частности, рецептора FcγIII, или белков CD. В качестве альтернативы, транс мембранный домен может быть синтетическим и может содержать преимущественно гидрофобные остатки, такие как лейцин и валин. Согласно некоторым вариантам реализации указанный трансмембранный домен происходит из цепи CD8a человека (например, NP 001139345.1). Трансмембранный домен может дополнительно содержать стеблевой домен между внеклеточным лигандсвязывающим доменом и указанным трансмембранным доменом. Стеблевой домен может содержать до 300 аминокислот, предпочтительно от 10 до 100 аминокислот и наиболее предпочтительно от 25 до 50 аминокислот.Стеблевая область может происходить из всей или части встречающихся в природе молекул, например, из всей или части внеклеточной области CD8, CD4 или CD28, или из всей или части константной области антитела. В качестве альтернативы, стеблевой домен может представлять собой синтетическую последовательность, которая соответствует встречающейся в природе последовательности стеблевого домена, или может представлять собой полностью синтетическую последовательность стеблевого домена. Согласно некоторым вариантам реализации указанный стеблевой домен является частью цепи CD8α человека (например, NP 001139345.1). В другом конкретном варианте реализации указанные транс мембранный и шарнирный домены содержат часть цепи CD8α человека. Согласно некоторым вариантам реализации внутриклеточный сигнальный домен содержит сигнальный домен CD3ζ. Согласно некоторым вариантам реализации внутриклеточный сигнальный домен содержит сигнальный домен CD3ζ, и дополнительно второй сигнальный домен. Согласно некоторым вариантам реализации внутриклеточный сигнальный домен содержит сигнальный домен CD3ζ и сигнальный домен 4-1ВВ. Согласно некоторым вариантам реализации CAR, раскрытые в данном документе, могут содержать внеклеточный лигандсвязывающий домен, который специфично связывает ВСМА или EGFRvIII, шарнирный и трансмембранный домены CD8α человека, сигнальный домен CD3ζ и сигнальный домен 4-1ВВ. Согласно некоторым вариантам реализации EGFRvIII-специфичный CAR содержит аминокислотную последовательность SEQ ID NO: 140. Согласно некоторым вариантам реализации ВСМА-специфичный CAR содержит аминокислотную последовательность SEQ ID NO: 141 или 142, с сигнальной последовательностью или без нее.
[00117] Согласно некоторым аспектам CAR-иммунная клетка представляет собой ВСМА CAR-T-клетку, содержащую CACCR согласно настоящему раскрытию. Согласно некоторым вариантам реализации CACCR из ВСМА CAR-T-клетки содержит трансмембранный/JAK-связывающий домен, содержащий аминокислоты 478-582 встречающегося в природе рецептора TPOR/MPLR из SEQ ID NO: 6, с тремя заменами H499L, S505N и W515K или двумя заменами S505N и W515K (например, SEQ ID NO: 12 или 13). Согласно некоторым вариантам реализации CACCR дополнительно содержит домен привлечения из IL2Rb. Согласно некоторым вариантам реализации CACCR из ВСМА CAR-T-клетки дополнительно содержит домен привлечения из IL2Rb (393-433,518-551) или IL2Rb (339-379,393-433,518-551) (например, SEQ ID NO: 77 или 78). Согласно некоторым вариантам реализации ВСМА-специфичный CAR содержит аминокислотную последовательность SEQ ID NO: 141 или 142, с сигнальной последовательностью или без нее. Согласно некоторым вариантам реализации ВСМА CAR-T-клетки содержат CACCR, который содержит аминокислотную последовательность SEQ ID NO: 113, 114 или 116, с сигнальной последовательностью или без нее.
[00118] Согласно некоторым вариантам реализации CAR может быть введен в иммунную клетку в виде трансгена с помощью плазмидного вектора. Согласно некоторым вариантам реализации плазмидный вектор также может содержать, например, селективный маркер, который обеспечивает идентификацию и/или селекцию клеток, которые получили вектор.
[00119] В Таблице 4 приведены примерные последовательности компонентов CAR, которые можно применять в CAR, раскрытых в данном документе, а также последовательности антител и/или CAR, приведенных в данном документе в качестве примеров. 


[00120] Согласно некоторым вариантам реализации CAR-иммунная клетка (например, CAR-T-клетка) согласно настоящему раскрытию содержит полинуклеотид, кодирующий полипептид «самоуничтожения», такой как, например, RQR8. См., например, WO 2013153391 A, полное содержание которого включено в данный документ посредством ссылки. Согласно некоторым вариантам реализации полипептид «самоуничтожения» экспрессируется на поверхности клетки. Согласно некоторым вариантам реализации полипептид «самоуничтожения» включен в конструкцию CAR. Согласно некоторым вариантам реализации полипептид «самоуничтожения» не является частью конструкции CAR.
[00121] Согласно некоторым вариантам реализации внеклеточный домен любого из CAR, раскрытых в данном документе, может содержать один или более эпитопов, специфичных в отношении моноклонального антитела (мАТ) (специфично распознаваемых им). Эти эпитопы также называются в данном документе мАТ-специфичными эпитопами. Примерные мАТ-специфичные эпитопы раскрыты в международной публикации патента №WO 2016/120216, которая полностью включена в данный документ. В данных вариантах реализации внеклеточный домен CAR содержит антигенсвязывающие домены, которые специфично связываются с представляющей интерес мишенью, и один или более эпитопов, которые связываются с одним или более моноклональными антителами (мАТ). CAR, содержащие мАТ-специфичные эпитопы, могут быть одноцепочечными или многоцепочечными.
[00122] Включение эпитопов, специфичных в отношении моноклональных антител, во внеклеточный домен CAR, описанных в данном документе, позволяет сортировать и истощать сконструированные иммунные клетки, экспрессирующие CAR. Согласно некоторым вариантам реализации возможность истощения обеспечивает «защитный выключатель» в случае вредных эффектов, например, при введении субъекту.
[00123] Согласно настоящему изобретению также предложены способы подготовки сконструированных иммунных клеток для применения в иммунотерапии. Согласно некоторым вариантам реализации способы включают введение CACCR и CAR в иммунные клетки и размножение указанных клеток. Согласно некоторым вариантам реализации настоящее изобретение относится к способу модификации иммунной клетки, включающему: обеспечение клетки и экспрессию CACCR, и экспрессию на поверхности указанной клетки по меньшей мере одного CAR. Согласно некоторым вариантам реализации способ включает: трансфекцию клетки по меньшей мере одним полинуклеотидом, кодирующим CACCR, и по меньшей мере одним полинуклеотидом, кодирующим CAR, и экспрессию полинуклеотидов в клетке. Согласно некоторым вариантам реализации способ включает: трансфекцию клетки по меньшей мере одним полинуклеотидом, кодирующим CACCR, по меньшей мере одним полинуклеотидом, кодирующим CAR, и экспрессию полинуклеотидов в клетке.
[00124] Согласно некоторым вариантам реализации полинуклеотиды, кодирующие CACCR и CAR, присутствуют в одном или более векторах экспрессии для стабильной экспрессии в клетках. Согласно некоторым вариантам реализации полинуклеотиды присутствуют в вирусных векторах для стабильной экспрессии в клетках. Согласно некоторым вариантам реализации вирусные векторы могут представлять собой, например, лентивирусные векторы или аденовирусные векторы.
[0100] Согласно некоторым вариантам реализации полинуклеотиды, кодирующие полипептиды в соответствии с настоящим раскрытием, могут представлять собой мРНК, которую вводят непосредственно в клетки, например, с помощью электропорации. Согласно некоторым вариантам реализации для кратковременной пермеабилизации живых клеток, чтобы доставить генетический материал в клетки, можно использовать технологию электропорации CytoPulse, такую как PulseAgile (например, US 6078490; PCT/US 2011/000827; и PCT/US 2004/005237). Параметры могут быть изменены для определения условий для высокой эффективности трансфекции с минимальной смертностью.
[0101] Согласно настоящему изобретению также предложены способы трансфекции иммунной клетки, например, Т-клетки. Согласно некоторым вариантам реализации способ включает: приведение Т-клетки в контакт с РНК и применение к Т-клетке динамической импульсной последовательности. Согласно некоторым вариантам реализации способ трансфекции иммунной клетки (например, Т-клетки) включает приведение иммунной клетки в контакт с РНК и применение к клетке динамической импульсной последовательности.
[0102] Согласно некоторым вариантам реализации способ может дополнительно включать этап генетической модификации клетки путем инактивации по меньшей мере одного гена, экспрессирующего, например, но не ограничиваясь перечисленными, компонент TCR, мишень для иммуносупрессорного агента, ген HLA и/или белок иммунной контрольной точки, такой как, например, PDCD1 или CTLA-4. При инактивации гена подразумевается, что представляющий интерес ген не экспрессируется в функциональной белковой форме. Согласно некоторым вариантам реализации ген, который необходимо инактивировать, выбран из группы, состоящей, например, но не ограничиваясь перечисленными, из TCRα, TCRβ, CD52, GR, дезоксицитидинкиназы (DCK), PD-1 и CTLA-4. Согласно некоторым вариантам реализации способ включает инактивацию одного или более генов путем введения в клетки редкощепящей эндонуклеазы, способной селективно инактивировать ген путем селективного расщепления ДНК. Согласно некоторым вариантам реализации редкощепящая эндонуклеаза может представлять собой, например, нуклеазу на основе эффектора, подобного активатору транскрипции (TALE-нуклеазу), или эндонуклеазу на основе CRISPR (например, Cas-9 или Cas12a).
[0103] В другом аспекте этап генетической модификации клеток может включать: модификацию иммунных клеток (например, Т-клеток) путем инактивации по меньшей мере одного гена, экспрессирующего мишень для иммуносупрессорного агента, и; размножение клеток, необязательно в присутствии иммуносупрессорного агента.
[0104] Согласно некоторым вариантам реализации сконструированные иммунные клетки (например, Т-клетки), предложенные в данном документе, проявляют улучшенную цитотоксичность, повышенную пролиферацию и/или повышенные уровни маркеров фенотипа памяти по сравнению со сконстрированными иммунными клетками, которые не экспрессируют CACCR.
[0105] Согласно некоторым вариантам реализации сконструированные иммунные клетки (например, Т-клетки), предложенные в данном документе, конститутивно проявляют (i) повышенную устойчивость in vivo, (ii) повышенную активацию STAT, (iii) повышенную цитотоксичность, (iv) повышенные уровни маркеров фенотипа памяти, (v) усиление размножения (пролиферации) или комбинации этих функциональных признаков по сравнению со сконструированными иммунными клетками, которые не экспрессируют CACCR. Согласно некоторым вариантам реализации улучшение одного или более функциональных признаков, описанных в данном документе, является регулируемым, в зависимости от мутаций/модификаций, введенных в CACCR. Согласно некоторым вариантам реализации STAT, активируемые сконструированной иммунной клеткой, содержащей один или более раскрытых CACCR, представляют собой STAT1, STAT2, STAT3, STAT4, STAT5, STAT6 или их комбинации. Согласно одному варианту реализации маркеры фенотипа памяти, количество которых повышено или поддерживается иммунной клеткой, содержащей CACCR, включают маркер стволовых Т-клеток памяти (Tscm) и маркер Т-клеток центральной памяти (Tcm).
[0106] Согласно некоторым вариантам реализации один или более функциональных признаков, проявляемых сконструированной иммунной клеткой, содержащей CACCR, предложенный в данном документе, улучшаются по меньшей мере примерно в 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз, 25 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз, 100 раз, 125 раз, 150 раз, 200 раз, 250 раз, 300 раз, 350 раз, 400 раз, 450 раз или даже примерно в 10500 раз, включая значения и диапазоны между ними, по сравнению с иммунной клеткой, которая не экспрессирует CACCR.
[0107] Согласно некоторым вариантам реализации один или более функциональных признаков, проявляемых сконструированной иммунной клеткой, содержащей CACCR, предложенный в данном документе, улучшаются по меньшей мере примерно на 10%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 70%, 75%, 80%, 90%, 100%, 125%, 150%, 200%, 250%, 300%, 350%, 400% или даже примерно 80%500%, включая значения и диапазоны между ними, по сравнению с иммунной клеткой, которая не экспрессирует CACCR.
III. Способы лечения
[0108] Согласно настоящему изобретению предложены фармацевтические композиции, содержащие клетки, несущие CACCR и CAR согласно настоящему раскрытию.
[0109] Сконструированные иммунные клетки, несущие CACCR и несущие CAR (например, Т-клетки), полученные с помощью способов, описанных выше, или клеточные линии, происходящие из таких сконструированных иммунных клеток, можно применять в качестве лекарственного средства. Согласно некоторым вариантам реализации такое лекарственное средство можно применять для лечения нарушения, такого как, например, вирусное заболевание, бактериальное заболевание, рак, воспалительное заболевание, иммунное заболевание или заболевание, ассоциированное со старением. Согласно некоторым вариантам реализации рак представляет собой солидный рак. Согласно некоторым вариантам реализации рак представляет собой гемобластоз. Рак может быть выбран из группы, состоящей из рака желудка, саркомы, лимфомы, лейкоза, рака головы и шеи, рака тимуса, эпителиального рака, рака слюнной железы, рака печени, рака желудка, рака щитовидной железы, рака легких, рака яичников, рака молочной железы, рака простаты, рака пищевода, рака поджелудочной железы, глиомы, лейкоза, множественной миеломы, почечно-клеточной карциномы, рака мочевого пузыря, рака шейки матки, хориокарциномы, рака толстой кишки, рака полости рта, рака кожи и меланомы. Согласно некоторым вариантам реализации субъект представляет собой ранее лечившегося взрослого субъекта с местнораспространенной или метастатической меланомой, плоскоклеточным раком головы и шеи (SCHNC), карциномой яичников, саркомой или рецидивирующей или рефрактерной классической лимфомой Ходжкина (cHL).
[0110] Согласно некоторым вариантам реализации сконструированные иммунные клетки или клеточную линию, происходящую из сконструированных иммунных клеток, можно применять в изготовлении лекарственного средства для лечения нарушения у субъекта, нуждающегося в этом. Согласно некоторым вариантам реализации нарушение может представлять собой, например, рак, аутоиммунное нарушение или инфекцию.
[0111] Согласно настоящему изобретению также предложены способы лечения субъектов, нуждающихся в таком лечении.
[0112] В данном документе термин «субъект» относится к любому позвоночному, включая, но не ограничиваясь перечисленными, людей и других приматов (например, шимпанзе, яванских макак и разные виды человекообразных и других обезьян), сельскохозяйственных животных (например, крупный рогатый скот, овец, свиней, коз и лошадей), домашних млекопитающих (например, собак и кошек), лабораторных животных (например, кроликов, грызунов, таких как мыши, крысы и морские свинки) и птиц (например, домашних, диких и промысловых птиц, таких как куры, индейки и другие Куриные, утки, гуси и т.д.). Согласно некоторым вариантам реализации субъект представляет собой млекопитающее. В примерных вариантах реализации субъект представляет собой человека.
[0113] Согласно некоторым вариантам реализации способ включает обеспечение иммунных клеток согласно настоящему раскрытию, несущих CACCR и CAR, описанные в данном документе, нуждающемуся в этом субъекту.
[0114] Согласно некоторым вариантам реализации Т-клетки, несущие CACCR или CAR, согласно настоящему изобретению могут претерпевать устойчивое размножение Т-клеток in vivo и могут сохраняться в течение продолжительного периода времени.
[0115] Способы лечения согласно настоящему изобретению могут быть улучшающими, лечебными или профилактическими. Способ согласно настоящему изобретению может быть либо частью аутологичной иммунотерапии, либо частью лечения аллогенной иммунотерапией.
[0116] Согласно другому аспекту настоящего изобретения предложен способ ингибирования роста или прогрессирования опухоли у субъекта, у которого есть опухоль, включающий введение указанному субъекту эффективного количества CACCR-экспрессирующих и CAR-экспрессирующих иммунных клеток, как описано в данном документе. Согласно другому аспекту настоящего изобретения предложен способ ингибирования или предотвращения метастазирования раковых клеток у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества сконструированных иммунных клеток, как описано в данном документе. Согласно другому аспекту настоящего изобретения предложен способ индукции регрессии опухоли у субъекта, у которого есть опухоль, включающий введение субъекту эффективного количества сконструированных иммунных клеток, как описано в данном документе.
[0117] Согласно некоторым вариантам реализации сконструированные Т-клетки согласно настоящему изобретению могут быть введены субъекту парентерально.
[0118] Также предложено применение любых сконструированных Т-клеток, предложенных в данном документе, в изготовлении лекарственного средства для лечения рака или для ингибирования роста или прогрессирования опухоли у субъекта, нуждающегося в этом.
[0119] Согласно некоторым вариантам реализации лечение можно осуществлять у субъектов, проходящих иммуносупрессорное лечение. Действительно, настоящее изобретение предпочтительно опирается на клетки или популяцию клеток, которым придали устойчивость по меньшей мере к одному иммуносупрессорному агенту благодаря инактивации гена, кодирующего рецептор такого иммуносупрессорного агента. В этом аспекте иммуносупрессорное лечение должно способствовать отбору и размножению Т-клеток в соответствии с настоящим изобретением у субъекта. Введение клеток или популяции клеток в соответствии с настоящим изобретением можно осуществлять любым удобным способом, включая ингаляцию аэрозолем, инъекцию, прием внутрь, переливание, имплантацию или трансплантацию. Композиции, описанные в данном документе, могут быть введены субъекту подкожно, внутрикожно, внутрь опухоли, внутрь узлов, интрамедуллярно, внутримышечно, путем внутривенной или внутрилимфатической инъекции, или внутрибрюшинно. Клетки, несущие CACCR и CAR согласно настоящему раскрытию, или их фармацевтические композиции могут быть введены посредством одного или более из следующих путей введения: внутривенного, внутриглазного, интравитреального, внутримышечного, подкожного, местного, перорального, трансдермального, внутрибрюшинного, внутриглазничного, путем имплантации, путем ингаляции, интратекального, внутрижелудочкового, через ухо или интраназального.
[0120] Согласно некоторым вариантам реализации введение клеток или популяции клеток (несущих CACCR или CAR согласно настоящему раскрытию) может включать введение, например, от примерно 104 до примерно 109 клеток на кг массы тела, включая все целые значения числа клеток в этих диапазонах. Согласно некоторым вариантам реализации введение клеток или популяции клеток может включать введение от примерно 104 до 105 клеток на кг массы тела, от 105 до 106 клеток на кг массы тела, от 106 до 107 клеток на кг массы тела, от 107 до 108 клеток на кг массы тела или от 108 до 109 клеток на кг массы тела. Клетки или популяцию клеток можно вводить в виде одной или более доз. Согласно некоторым вариантам реализации указанное эффективное количество клеток можно вводить в виде однократной дозы. Согласно некоторым вариантам реализации указанное эффективное количество клеток можно вводить в виде более чем одной дозы в течение определенного периода времени. Время введения определяется лечащим врачом и зависит от клинического состояния субъекта. Клетки или популяция клеток могут быть получены из любого источника, такого как банк крови или донор. Несмотря на то, что индивидуальные потребности варьируются, определение оптимальных диапазонов эффективных количеств конкретного типа клеток для конкретного заболевания или состояний находится в пределах компетенции специалиста в этой области техники. Эффективное количество означает количество, которое обеспечивает терапевтическую или профилактическую пользу. Вводимая дозировка будет зависеть от возраста, состояния здоровья и веса реципиента, вида сопутствующего лечения, если таковое имеется, частоты лечения и характера желаемого эффекта. Согласно некоторым вариантам реализации эффективное количество клеток или композиции, содержащей эти клетки, вводят парентерально. Согласно некоторым вариантам реализации введение может представлять собой внутривенное введение. Согласно некоторым вариантам реализации введение можно осуществлять непосредственно путем инъекции внутрь опухоли.
[0121] Способы могут дополнительно включать введение одного или более агентов субъекту перед введением сконструированных иммунных клеток, несущих CAR и CACCR, предложенных в данном документе. Согласно определенным вариантам реализации агент представляет собой схему лимфодеплеции (прекондиционирования). Например, способы лимфодеплеции субъекта, нуждающегося в такой терапии, включают введение указанному субъекту указанных полезных доз циклофосфамида (от 200 мг/м2/сутки до 2000 мг/м2/сутки, примерно 100 мг/м2/сутки и примерно 2000 мг/м2/сутки; например, примерно 100 мг/м2/сутки, примерно 200 мг/м2/сутки, примерно 300 мг/м2/сутки, примерно 400 мг/м2/сутки, примерно 500 мг/м2/сутки, примерно 600 мг/м2/сутки, примерно 700 мг/м2/сутки, примерно 800 мг/м2/сутки, примерно 900 мг/м2/сутки, примерно 1000 мг/м2/сутки, примерно 1500 мг/м2/сутки или примерно 2000 мг/м2/сутки) и указанных доз флударабина (от 20 мг/м2/сутки до 900 мг/м2/сутки, от примерно 10 мг/м2/сутки до примерно 900 мг/м2/сутки; например, примерно 10 мг/м2/сутки, примерно 20 мг/м2/сутки, примерно 30 мг/м2/сутки, примерно 40 мг/м2/сутки, примерно 40 мг/м2/сутки, примерно 50 мг/м2/сутки, примерно 60 мг/м2/сутки, примерно 70 мг/м2/сутки, примерно 80 мг/м2/сутки, примерно 90 мг/м2/сутки, примерно 100 мг/м2/сутки, примерно 500 мг/м2/сутки или примерно 900 мг/м2/сутки). Примерная схема дозирования включает лечение субъекта, включающее ежедневное введение пациенту примерно 300 мг/м2/сутки циклофосфамида в комбинации или до или после введения примерно 30 мг/м2/сутки флударабина в течение трех суток до введения терапевтически эффективного количества сконструированных иммунных клеток пациенту.
[0122] Согласно некоторым вариантам реализации, особенно в случае, когда сконструированные клетки, предложенные в данном документе, были подвергнуты редактированию генов для устранения или минимизации поверхностной экспрессии CD52, лимфодеплеция дополнительно включает введение антитела к CD52, такого как алемтузумаб. Согласно некоторым вариантам реализации антитело к CD52 вводят в дозе примерно 1-20 мг/сутки внутривенно, например, примерно 13 мг/сутки внутривенно в течение 1, 2, 3 или более суток. Антитело можно вводить в сочетании с, до или после введения других элементов схемы лимфодеплеции (например, циклофосфамида и/или флударабина).
[0123] Согласно определенным вариантам реализации композиции, содержащие CACCR-и CAR-экспрессирующие иммунные эффекторные клетки, раскрытые в данном документе, могут быть введены в сочетании с любым числом химиотерапевтических агентов.
IV. Наборы и готовые изделия
[0124] Согласно настоящему раскрытию предложены наборы, содержащие любое одно или более из CACCR и CAR-несущих клеток, описанных в данном документе, и их фармацевтических композиций. Согласно настоящему раскрытию также предложены готовые изделия, содержащие любое одно или более из CACCR и CAR-несущих CAR-I-клеток, описанных в данном документе, их фармацевтических композиций и наборов, описанных в данном документе.
[0125] Следующие ниже примеры включены только в целях иллюстрации и не предназначены для ограничения объема настоящего раскрытия.
[0126] Все патентные и непатентные документы, на которые имеются ссылки в данном раскрытии, полностью включены в данный документ посредством ссылки для всех целей.
ПРИМЕРЫ
Пример 1: Идентификация мутантов ТМ TpoR, которые конститутивно активируют передачу цитокиновых сигналов
[0127] Прототипический конститутивно активный химерный цитокиновый рецептор (CACCR) конструировали с использованием последовательностей из рецептора тромбопоэтина (TpoR). TpoR способен активировать путь передачи сигналов JAK-Stat и передавать сигналы как гомодимерный рецептор. В отношении активности TpoR было показано, что одноточечные мутации (замены аминокислот) модулируют активность рецептора (Proc Natl Acad Sci USA. 2013 Feb 12;110(7):2540-5.;FASEB J. 2011 Jul;25(7):2234-44.; J Biol Chem. 2016 Feb 5;291(6):2974-87). В этом примере конститутивно активный химерный цитокиновый рецептор конструировали из встречающегося в природе рецептора TpoR: внеклеточный домен встречающегося в природе рецептора TpoR был удален, поэтому он больше не обладает лигандсвязывающей способностью; в его транс мембранный домен были внесены 1-3 мутации; и цитоплазматический хвост TpoR был заменен цитоплазматический хвостом целевого/описанного цитокинового рецептора. ФИГ. 1 схематически показывает сконструированный конститутивно активный химерный цитокиновый рецептор.
[0128] Чтобы продемонстрировать применимость конститутивно активного химерного цитокинового рецептора в случае CAR-T-клеток, каждый вариант трансмембранного (ТМ) домена TpoR клонировали в лентивирусный вектор, кодирующий EGFRvIII-специфичный CAR второго поколения (2173scFv; описанный в Sci Transl Med. 2015 Feb 18; 7(275): 275ra22.). Для обеспечения стехиометрической совместной экспрессии цитокинового рецептора и CAR, оба гена соединяли за счет пептида Р2А. Для облегчения детектирования трансдуцированных клеток, эпитопную метку v5 ((KPIPNPLLGLDST) SEQ ID NO: 144) вставляли между scFv и шарнирным доменом CD8.
[0129] ФИГ. 2 схематически показывает лентивирусный вектор, использованный для совместной экспрессии конститутивно активного химерного цитокинового рецептора и CAR.
[0130] В Таблице 4 показаны последовательности, относящиеся к использованным конструкциям.
[0131] Анализ по гену-репортеру клеток НЕК293Т использовали для скрининга вариантов ТМ TpoR, способных к конститутивной передаче цитокиновых сигналов. В общих чертах, 20000 клеток НЕК293Т высевали в каждую лунку 96-луночного планшета с плоским дном, покрытым поли-L-лизином, и оставляли для прикрепления на ночь. Конструкцию цитокиновый рецептор-CAR (2,5 нг), элемент ответа Stat, который управляет люциферазой светлячка (100 нг; Promega), и контрольный репортерный вектор люциферазы Renilla (1 нг; Promega) смешивали в конечном объеме 5 мкл в Opti-MEM (Gibco) («смесь ДНК»). В качестве отрицательного контроля клетки трансфицировали конструкцией BFP CAR, в которой отсутствуют все домены передачи цитокиновых сигналов. В качестве положительного контроля клетки трансфицировали вектором, кодирующим полноразмерный EpoR человека (рецептор эритропоэтина вместо конструкции цитокиновый рецептор-CAR), так, что передача сигналов StatS могла быть индуцирована добавлением экзогенного рекомбинантного Еро человека. 0,3 мкл Липофектамина 2000 (Invitrogen) в 5 мкл Opti-MEM инкубировали при комнатной температуре в течение 5 минут, а затем добавляли к смеси ДНК. Смесь инкубировали при комнатной температуре в течение 20 минут, и общий объем 10 мкл добавляли в каждую лунку, содержащую НЕК-293Т. Через 48 часов после трансфекции активность репортера Stat5 оценивали с использованием системы анализа люциферазы «Dual-Glo» (Promega). Кратность индукции активности репортера StatS нормировали к таковой для клеток НЕК293Т, трансфицированных всеми векторами, за исключением цитокинового рецептора, и которые не подвергались воздействию.
[0132] ФИГ. 3а и 3b показывают идентификацию мутантов ТМ TpoR, которые конститутивно активируют передачу сигналов цитокиновым рецептором. ФИГ. За схематически показывает использованный лентивирусный вектор. Указанный вектор несет цитоплазматический хвост IL7R(316-459) для имитации передачи сигналов IL7 в CAR-T-клетках. ФИГ. 3b показывает активность репортера Stat5, определенную с помощью анализа люциферазы «Dual-Glo». Цитокиновый рецептор, несущий домен ТМ TpoR дикого типа (TpoR(478-582)), не активировал спонтанно StatS. Мутанты TpoR(478-582;S505N), TpoR(478-582;W515K) и TpoR(478-582;H499L,G509N) привели к слабой активации Stat5. TpoR(478-582;H499L,S505N,W515K) привел к умеренной активности Stat5, в то время как TpoR(478-582; S505N,W515K) вызвал самый сильный сигнал Stat5.
Пример 2: Получение CAR-T-клеток, экспрессирующих конститутивно активные химерные цитокиновые рецепторы
[0133] Затем авторы настоящего изобретения протестировали, передавали ли эти цитокиновые рецепторы сигналы в случае первичных CAR-T-клеток человека. Для получения лентивируса, кодирующего цитокиновый рецептор-CAR, клетки НЕК293Т высевали из расчета 0,45 миллиона клеток на мл в 2 мл DMEM (Gibco) с добавлением 10% фетальной бычьей сыворотки (ФБС) (Hyclone) на лунку 6-луночного планшета за день до трансфекции. В день трансфекции лентивирус получали путем смешивания 1,5 мкг лентивирусных упаковочных векторов psPAX2, 0,5 мкг pMD2G и 0,5 мкг соответствующего вектора для переноса CAR в 250 мкл Opti-MEM (Gibco) на лунку 6-луночного планшета («смесь ДНК»). 10 мкл Липофектамина 2000 (Invitrogen) в 250 мкл Opti-MEM инкубировали при комнатной температуре в течение 5 минут, а затем добавляли к смеси ДНК. Смесь инкубировали при комнатной температуре в течение 20 минут, и общий объем 500 мкл медленно добавляли по бокам лунок, содержащих НЕК293Т. Через 1 день после трансфекции среды из каждой лунки с клетками НЕК293Т в 6-луночном планшете заменяли 2 мл на лунку сред для трансдукции Т-клеток, т.е. X-Vivo-15 с добавлением 10% ФБС.Через 2 дня после трансфекции лентивирусные супернатанты от клеток НЕК293Т собирали и пропускали через фильтр с размером пор 0,45 микрон (EMD Millipore) для удаления клеточного дебриса, концентрировали в 25 раз с использованием концентратора Lenti-X (Takara Bio) в соответствии с инструкциями производителя и быстро замораживали в виде аликвот.Титры лентивирусов определяли путем размораживания аликвоты замороженного лентивируса, проведения 4-кратных последовательных разведений и выполнения титрования методом предельных разведений на клетках JurkaT (клон Е6-1; АТСС). В День 0 очищенные Т-клетки активировали в среде Х-Vivo-15 (Lonza) с добавлением 100 МЕ/мл IL-2 человека (Miltenyi Biotec), 10% ФБС (Hyclone) и Т TransAct человека (Miltenyi Biotec, №по каталогу 130-111-160, разведение 1:100) в планшете Grex-24 (Wilson Wolf, №по каталогу 80192М). В День 2 Т-клетки ресуспендировали из расчета 0,5 миллиона клеток на мл в средах для трансдукции Т-клеток, трансдуцировали соответствующими концентрированными суспензиями лентивируса при МОГ=5 с 100 МЕ/мл IL-2 человека в планшете Grex-24. В День 5, когда трансдукция была завершена, клетки собирали и промывали для удаления остаточного IL-2. Затем клетки ресуспендировали в средах для размножения Т-клеток, т.е. в X-Vivo-15 с добавлением 5% сыворотки крови человека АВ (Gemini Bio), и каждый образец разделили на 2 равные части, причем одна часть получила 100 МЕ/мл IL-2 человека согласно стандартному протоколу, а другая часть получила более низкую концентрацию 25 МЕ/мл IL-2 человека. При необходимости клетки размножали в более крупных сосудах G-Rex (Wilson Wolf), используя среды для размножения Т-клеток и соответствующие концентрации IL-2 человека. В Дни 5, 9 и 14 подсчитывали абсолютное количество Т-клеток в каждом образце и определяли эффективность трансдукции путем детектирования процента Т-клеток, которые связали FITC-конъюгированное моноклональное антитело к метке v5 (Thermo Fisher), с использованием проточной цитометрии. В День 14 или 15 продукты CAR-T-клеток криоконсервировали и размораживали по мере необходимости для дальнейших анализов.
[0134] ФИГ. 4а-4 с показывают результаты, касающиеся получения CAR-T-клеток, коэкспрессирующих конститутивно активный химерный цитокиновый рецептор. По сравнению с культурами CAR-T-клеток, несущих цитокиновый рецептор с ТМ TpoR дикого типа (TpoR(478-582)), культуры CAR-T-клеток, несущих мутантов ТМ TpoR, претерпевали более устойчивое размножение с точки зрения как общего количества Т-клеток (ФИГ. 4а), так и количества CAR-T-клеток (ФИГ. 4b). ФИГ. 4а-4 с показывают, что эффективность трансдукции мутантов ТМ TpoR была равна или превышала таковую аналогов TpoR(478-582) дикого типа. Мутанты ТМ TpoR позволяют получать больший выход продукта CAR-T-клеток. Кроме того, размножение мутантов ТМ TpoR при более низких концентрациях IL-2 не влияло на размножение или выход CAR-T-клеток (ФИГ. 4 с).
[0135] В День 14 продукции CAR-T-клеток определяли фенотип памяти CAR-T-клеток. В общих чертах, образцы промывали фосфатно-солевым буфером (ФСБ), блокировали Fc, затем окрашивали следующей смесью антител, разведенной в ФСБ+1% БСА: BUV395-конъюгированное антитело к CD3 человека, BV510-конъюгированное антитело к CD8 человека, BV605-конъюгированное антитело к CD4 человека и FITC-конъюгированное антитело к метке v5 (для детектирования CAR), РЕ/Су7-конъюгированное антитело к CD62L человека (Biolegend) и BV785-конъюгированное антитело к CD45RO человека (Biolegend). В завершение образцы промывали в ФСБ и клеточные осадки ресуспендировали в 130 мкл ФСБ+1% БСА для анализа методом FACS.
[0136] ФИГ. 5 показывает распределение субпопуляции Т-клеток памяти в продукте CAR Т-клеток. По сравнению с их аналогом TpoR(478-582) дикого типа мутанты TpoR(478-582;W515K) и TpoR(478-582;H499L,G509N) показали более значительную дифференцировку при размножении в условиях стандартной концентрации 100 МЕ/мл IL-2. Размножение в условиях низкой концентрации IL-2 уменьшило дифференцировку. В сочетании со стандартными концентрациями IL-2 более сильная передача сигналов Stat5, индуцированная мутантами TpoR(478-582;W515K) и TpoR(478-582;H499L,G509N), может привести к ускоренной дифференцировке CAR-T-клеток, и размножение в условиях низкой концентрации IL-2 может быть более благоприятным в случае CAR-T-клеток, экспрессирующих конститутивные цитокиновые рецепторы.
Пример 3: Мутанты ТМ TpoR конститутивно активируют передачу цитокиновых сигналов в CAR-T-клетках человека
[0137] Для определения силы передачи цитокиновых сигналов, опосредуемой мутантами ТМ TpoR, CAR-T-клетки, несущие цитокиновые рецепторы с вариантами ТМ TpoR, подвергали нехватке сыворотки в 100 мкл бессывороточной RPMI (Corning) в течение 4 часов в увлажненном инкубаторе при 37°С с 5% СО2. В качестве положительного контроля добавляли экзогенный рекомбинантный IL-7 человека (10 нг/мл; Miltenyi) в течение последних 30 минут 4-часовой инкубации при нехватке сыворотки. Через 4 часа смесь антител, содержащую BUV395-конъюгированное антитело к CD3 человека (Biolegend) и FITC-конъюгированное моноклональное антитело к метке v5 (Thermo Fisher), добавляли к клеткам и продолжали инкубацию в течение последних 20 минут. Затем клетки фиксировали путем добавления 35 мкл 16% параформальдегида к 100 мкл каждого образца и продолжали инкубацию в течение 15 минут при 37°С. Затем клетки трижды промывали ФСБ и пермеабилизировали в 100% холодном метаноле в течение 1 или 2 ночей при -20°С. В день анализа методом FACS клетки трижды промывали ФСБ, блокировали Fc и окрашивали A1exaFluor647-конъюгированным антителом к Stat5 мыши/человека (pY694) (BD Biosciences), разведенным в ФСБ+1% БСА. После 1 часа инкубации при комнатной температуре в темноте клетки трижды промывали перед анализом методом FACS.
[0138] ФИГ. 6а-6b показывают степень конститутивной передачи цитокиновых сигналов, опосредуемой каждым вариантом ТМ TpoR, которая представлена как процентная доля клеток pStat5+ (ФИГ. 6а) и геометрическое среднее значение интенсивности флуоресценции (gMFI) окрашивания pStat5 (ФИГ. 6b). В то время как одноточечные мутанты ТМ TpoR (TpoR(478-582;S505N) и TpoR(478-582;W515K)) не индуцировали заметной активации Stat5, двойной мутант ТМ TpoR (TpoR(478-582;S505N,W515K) и тройной мутант (TpoR(478-582;H499L,S505N,W515K)) индуцировали сравнительно сильную конститутивную активацию Stat5. CAR-T-клетки, которые были размножены при низкой концентрации IL-2 и стандартной концентрации IL-2, давали сравнимые профили активации Stat. Поскольку Stat5 активировался только CAR-несущими Т-клетками (CAR+), но не Т-клетками, не несущими CAR (CAR"), в той же культуре, это свидетельствует о том, что передача цитокиновых сигналов была специфической для CAR-T-клеток.
Пример 4: Конститутивный цитокиновый рецептор повысил цитотоксическую активность CAR-T-клеток и продлил устойчивость ответа
[0139] Для исследования того, повышает ли конститутивная передача сигналов цитокиновым рецептором цитотоксическую активность CAR-T-клеток, авторы настоящего изобретения использовали U87KO-EGFRvIII-nucGFP в качестве клеток-мишеней. U87KO-EGFRvIII был любезно подарен компанией Cellectis SA (Париж, Франция). U87KO-EGFRvIII получали из исходной линии клеток, U87MG (АТСС), сначала путем подавления эндогенного EGFR дикого типа с использованием нуклеаз на основе эффектора, подобного активатору транскрипции (TALEN), а затем стабильной сверхэкспрессии полноразмерного EGFRvIII человека за счет лентивирусной трансдукции. Для облегчения визуализации целевых Т-клеток с помощью визуализирующей системы для анализа живых клеток «IncuCyte» клетки-мишени U87KO-EGFRvIII-nucGFP получали из U87KO-EGFRvIII с помощью второй лентивирусной трансдукции с использованием реагента IncuCyte NucLight Green Lentivirus (Sartorius). 5000 клеток-мишеней U87KO-EGFRvIII-nucGFP высевали и позволяли им прикрепиться в 96-луночных планшетах с черными стенками и плоским прозрачным дном в 50 мкл RPMI, содержащей 10% ФБС (Hyclone), заменимые аминокислоты, пируват натрия и 20-25 мМ HEPES. EGFRvIII CAR (2173 scFv) Т-клетки, несущие цитокиновые рецепторы с вариантами ТМ TpoR, размораживали и добавляли к высеянным клеткам-мишеням при соотношениях эффектор:мишень (Э:М) 1:8 и 1:2. Для сравнения в анализ включали CAR-Т-клетки, несущие TpoR(478-582) дикого типа, с добавлением экзогенного рекомбинантного IL-7 человека или без него. Где применимо, CAR-Т-клетки подвергали повторной стимуляции в указанный момент времени путем переноса суспензии клеток из исходного планшета в свежий планшет с клетками-мишенями. Для каждого условия лунки были продублированы. Цитотоксичность определяли путем подсчета количества живых клеток-мишеней в каждый момент времени с использованием визуализирующей системы для анализа живых клеток «mcuCyte».
[0140] ФИГ. 7а-7d показывают цитотоксическую активность мутантов ТМ TpoR при соотношении Э:М 1:8. Одноточечные мутанты TpoR(478-582;S505N) (ФИГ. 7а) и TpoR(478-582;W515KN) (ФИГ. 7b) не показали функциональных улучшений по сравнению с их аналогами, несущими контрольный TpoR(478-582) дикого типа, что согласуется с их неспособностью эффективно активировать Stat5 (ФИГ. 6а-6b). ФИГ. 7 с показывает, что CAR-T-клетки с двойным мутантом TpoR, размноженные при стандартных концентрациях IL-2, не проявляли усиление; в то время как CAR-T-клетки с двойным мутантом TpoR, размноженные в условиях низкой концентрации IL-2, были более активными в отношении лизиса клеток-мишеней. ФИГ. 7d показывает, что CAR-T-клетки с тройным мутантом TpoR были более активными в отношении лизиса клеток-мишеней, независимо от концентрации IL-2 во время продукции CAR-T-клеток. Это указывает на то, что конститутивная передача сигналов цитокиновым рецептором повышает активность CAR-T-клеток.
[0141] ФИГ. 8a-8b показывают цитотоксическую активность двойных мутантов (ФИГ. 8а) и тройных мутантов (ФИГ. 8b) ТМ TpoR при соотношении Э:М 1:2. Во время первичного ответа CAR-T-клетки устраняли клетки-мишени с одинаковой эффективностью, вне зависимости от активности цитокинового рецептора. Однако при повторной стимуляции свежими мишенями только CAR-T-клетки, экспрессирующие конститутивно активные химерные цитокиновые рецепторы, оставались функциональными, это указывает на то, что конститутивная передача сигналов цитокиновым рецептором увеличивает устойчивость ответов CAR-T-клеток.
Пример 5: Конститутивный цитокиновый рецептор повышал устойчивость CAR-T-клеток и стимулировал размножение CAR+ Tscm
[0142] Для наблюдения усиливающих эффектов конститутивной передачи сигналов цитокиновым рецептором на устойчивость CAR-T-клеток в отсутствие мишеней или экзогенных цитокинов, выполняли анализ, независимый от фактора роста. В общих чертах, процентную долю CAR-T-клеток во всех образцах нормировали к образцу с наименьшей эффективностью трансдукции (35,7%) путем добавления нетрансдуцированных (NTD) Т-клеток. 0,25×106 CAR-несущих Т-клеток/мл в 4 мл RPMI, содержащей 10% ФБС (Hyclone), заменимые аминокислоты, пируват натрия и 20-25 мМ HEPES. Затем клетки высевали в колбы для тканевых культур Т25. В качестве положительных контролей к CAR-T-клеткам, в которых отсутствует конститутивная передача сигналов цитокиновым рецептором (TpoR(478-582) дикого типа), добавляли экзогенный IL-7 человека (10 нг/мл; Miltenyi). В указанные дни для каждого условия собирали дублированные образцы по 200 мкл и окрашивали с использованием пригодного для фиксации набора для оценки жизнеспособности клеток Zombie NIR™ (Zombie NIR Fixable Viability Kit (Biolegend)). Образцы промывали ФСБ, блокировали Fc, затем окрашивали следующей смесью антител, разведенной в ФСБ + 1% БСА: BUV395-конъюгированное антитело к CD3 человека, BV510-конъюгированное антитело к CD8 человека, BV605-конъюгированное антитело к CD4 человека и FITC-конъюгированное антитело к метке v5 (для детектирования CAR), РЕ/Су7-конъюгированное антитело к CD62L человека (Biolegend) и BV785-конъюгированное антитело к CD45RO человека (Biolegend). В завершение образцы промывали в ФСБ и клеточные осадки ресуспендировали в 130 мкл ФСБ+1% БСА, содержащем счетные микросферы 123count eBeads (Thermo Fisher) (10 мкл счетных микросфер в 120 мкл ФСБ+1% БСА) перед анализом методом FACS.
[0143] ФИГ. 9 показывает обогащение CAR-T-клеток с течением времени в анализе, независимом от фактора роста. В то время как CAR-T-клетки, несущие ТМ TpoR дикого типа (TpoR(478-582) и одноточечные мутанты ТМ TpoR (TpoR(478-582;S505N) и TpoR(478-582;W515KN)), не претерпевали обогащения, CAR-T-клетки, несущие двойной мутант и тройные мутанты ТМ TpoR, обогащались с течением времени, это указывает на то, что выживали преимущественно CAR-несущие Т-клетки, которые получили конститутивную передачу сигналов цитокиновым рецептором.
[0144] ФИГ. 10а-10b показывают кратность размножения CAR-T-клеток с течением времени в анализе, независимом от фактора роста. Кратность размножения определяли путем нормирования абсолютного количества CAR-T-клеток в каждый момент времени к количеству CAR-T-клеток в День 0 анализа. ФИГ. 10а показывает, что одноточечные мутанты ТМ TpoR, которые были неспособны эффективно активировать передачу сигналов цитокиновым рецептором, уменьшались в количестве с той же скоростью, что и CAR-T-клетки, несущие ТМ TpoR дикого типа (TpoR(478-582)). Напротив, ФИГ. 10b показывает, что CAR-T-клетки, несущие двойной мутант или тройной мутант ТМ TpoR, имели длительную выживаемость в отсутствие мишеней и экзогенных цитокинов. CAR-T-клетки с двойным мутантом ТМ TpoR, размноженные в условиях низкой концентрации IL-2, показали повышенную устойчивость по сравнению с их аналогами, которые были размножены в условиях стандартной концентрации IL-2. CAR-T-клетки с тройным мутантом ТМ TpoR, изготовленные в условиях низкой и стандартной концентрации IL-2, показали сравнимое промежуточное повышение устойчивости. Примечательно, что хотя CAR-T-клетки с двойным и тройным мутантом TpoR сохранялись дольше, их количество в конечном итоге уменьшалось, это указывает на то, что конститутивная передача сигналов цитокиновым рецептором маловероятно приводила к иммортализации или трансформации CAR-T-клеток.
[0145] ФИГ. 11 показывает распределение субпопуляции Т-клеток памяти среди CAR+ Т-клеток с течением времени в анализе, независимом от фактора роста. По сравнению с ТМ TpoR дикого типа (TpoR(478-582)) CAR-T-клетки, несущие конститутивно активный цитокиновый рецептор (в данном случае показан тройной мутант ТМ TpoR, размноженный в условиях низкой концентрации IL-2), показали размножение по абсолютному количеству стволовых Т-клеток памяти (Tscm), которые представляют собой субпопуляцию, которая опосредует длительный противоопухолевый иммунитет. Примечательно, что в отношении размножения Tscm CAR-T-клеток конститутивная передача сигналов от тройного мутанта ТМ TpoR была более эффективной, чем добавление экзогенного IL-7 человека.
Пример 6: Конститутивные цитоплазматические хвосты могут быть адаптированы для активации представляющих интерес путей передачи сигналов
[0146] Способность цитокинов регулировать судьбу и функцию CAR-T-клеток обусловлена их способностью вызывать активацию различных последующих путей передачи сигналов. Например, активация STAT5, опосредуемая IL-7/IL-2/IL-15, повышает выживаемость и размножение Т-клеток, в то время как активация STAT4, опосредуемая IL-12, управляет окончательной дифференцировкой в короткоживущие эффекторы. Конструирование доменов привлечения (т.е. цитоплазматического хвоста), которые могут имитировать более широкий диапазон цитокиновых сигналов, может обеспечить гибкость для программируемых пользователем исходов передачи сигналов, что обеспечивает контроль судьбы и функции CAR-T-клеток.
[0147] Для анализа того, могут ли CACCR передавать сигналы, опосредуемые дополнительными цитокиновыми рецепторами, цитоплазматический хвост IL7Ra(316-459) из ФИГ. 3 заменяли альтернативными цитоплазматическими хвостами, происходящими из внутриклеточных сигнальных доменов IL2Rb или IL12Rb2. Затем для оценки способности этих химер передавать сигналы использовали анализ по гену репортеру клеток НЕК293Т. В общих чертах, 20000 клеток НЕК293Т высевали в каждую лунку 96-луночного планшета с плоским дном, покрытым поли-L-лизином, и оставляли для прикрепления на ночь. Конструкцию цитокиновый рецептор-CAR (2,5 нг), элемент ответа Stat, который управляет люциферазой светлячка (100 нг; Promega), и контрольный репортерный вектор люциферазы Renilla (1 нг; Promega) смешивали в конечном объеме 5 мкл в Opti-MEM (Gibco) («смесь ДНК»). В качестве отрицательного контроля клетки трансфицировали либо конструкцией BFP-CAR, в которой отсутствуют все домены передачи цитокиновых сигналов, либо конструкцией TpoR(478-582).IL7Ra(316-459), в которой отсутствуют трансмембранные мутации и, следовательно, она не способна к конститутивной передаче сигналов. 0,3 мкл Липофектамина 2000 (hwitrogen) в 5 мкл Opti-MEM инкубировали при комнатной температуре в течение 5 минут, а затем добавляли к смеси ДНК. Смесь инкубировали при комнатной температуре в течение 20 минут, и общий объем 10 мкл добавляли в каждую лунку, содержащую НЕК-293Т. Через 48 часов после трансфекции активность соответствующих репортеров Stat5 оценивали с использованием системы анализа люциферазы «Dual-Glo» (Promega). Кратность индукции активности репортера Stat5 нормировали к таковой для клеток НЕК293Т, трансфицированных контрольной конструкцией BFP-CAR.
[0148] ФИГ. 12 показывает, что конструкция, несущая разные сигнальные домены, преимущественно активирует разные пути STAT. В частности, IL2Rb(333-551) и IL7Ra(316-459) активировали STAT5, в то время как IL12Rb2(714-862) активировал STAT4, это отражает передачу сигналов, ожидаемую от соответствующих исходных рецепторов. Это демонстрирует, что CACCR могут быть запрограммированы для активации целевых путей передачи сигналов путем слияния с сигнальным доменом, представляющим интерес.Кроме того, в соответствии с ФИГ. 3, CACCR, несущие домен димеризации TpoR(478-582;S505N,W515K), вызывали более сильную передачу сигналов, чем их аналог TpoR(478-582;H499L,S505N,W515K). Сила выходных сигналов CACCR, следовательно, может дополнительно регулироваться путем слияния с любым из этих доменов димеризации.
Пример 7: Сигнальный домен CACCR может быть оптимизирован для модуляции силы сигнала с уменьшением размера целевого груза вектора
[0149] В настоящее время для изготовления CAR-T-клеток обычно используют методы доставки генов на основе вирусов (например, переносы генов, опосредуемые лентивирусами и ретровирусами). По мере увеличения размера целевого груза эффективность трансдукции и выход CAR-T-клеток снижается. Таким образом, уменьшение размера целевого груза будет благоприятным для обеспечения успешного изготовления. Домен привлечения/передачи сигналов оптимизации CACCR обеспечивает средство для достижения этой цели по двум причинам. Во-первых, как и в случае IL2Rb(333-551), сигнальные домены, происходящие из цитокинового рецептора, могут достигать более 200 аминокислот в длину и могут представлять более 650 пар оснований в векторе для переноса. Во-вторых, несмотря на то, что остатки тирозина в сигнальных доменах важны для инициации и распространения последующей передачи сигналов, некоторые из них также могут участвовать в контурах отрицательной обратной связи, которые ограничивают продолжительность и силу передачи сигналов. Таким образом, обрезка сигнального домена цитоплазматического хвоста не только позволяет уменьшить размер целевого груза вектора, но также обеспечивает возможность модуляции передачи сигналов цитоплазматическим хвостом. С этой целью авторы настоящего изобретения идентифицировали остатки тирозина в полноразмерных хвостах IL12Rb2(714-862) и IL2Rb(331-551) и получили варианты для идентификации усеченных конструкций, способных опосредовать передачу сигналов цитоплазматическим хвостом.
[0150] Полноразмерный IL12Rb2(714-862) содержит два фосфорилируемых остатка тирозина, Y767 и Y800, которые могут участвовать в последующей передаче сигналов. Авторы настоящего изобретения получили усеченный хвост IL12Rb2(775-825), содержащий только Y800, и оценили его способность активировать STAT4 с помощью анализа по гену-репортеру клеток НЕК293Т. В общих чертах, 20000 клеток НЕК293Т высевали в каждую лунку 96-луночного планшета с плоским дном, покрытым поли-L-лизином, и оставляли для прикрепления на ночь. Конструкцию CACCR-CAR (2,5 нг), элемент ответа Stat, который управляет люциферазой светлячка (100 нг; Promega), и контрольный репортерный вектор люциферазы Renilla (1 нг; Promega) смешивали в конечном объеме 5 мкл в Opti-MEM (Gibco) («смесь ДНК»). В качестве отрицательного контроля клетки трансфицировали конструкцией BFP-CAR, в которой отсутствуют все домены передачи цитокиновых сигналов. 0,3 мкл Липофектамина 2000 (Invitrogen) в 5 мкл Opti-MEM инкубировали при комнатной температуре в течение 5 минут, а затем добавляли к смеси ДНК. Смесь инкубировали при комнатной температуре в течение 20 минут, и общий объем 10 мкл добавляли в каждую лунку, содержащую НЕК-293Т. Через 48 часов после трансфекции активность репортера Stat4 оценивали с использованием системы анализа люциферазы «Dual-Glo» (Promega). Кратность индукции активности репортера Stat4 нормировали к таковой для клеток НЕК293Т, трансфицированных контрольной конструкцией BFP-CAR.
[0151] ФИГ. 13А-В показывают идентификацию усеченного цитоплазматического хвоста IL12Rb2(775-825), способного к активации STAT4, сравнимой с полноразмерным цитоплазматическим хвостом IL12Rb2(714-862). ФИГ. 13А показывает схематический рисунок полноразмерного хвоста IL12Rb(714-862) и усеченного цитоплазматического хвоста IL12Rb(775-825). Положения остатков тирозина (Y), включенных в каждый хвост, соответствуют указанным. ФИГ. 13 В показывает, что при слиянии с более сильным доменом димеризации TpoR(478-582;S505N,W515K) усеченный цитоплазматический хвост IL12Rb2(775-825) полностью воспроизводил силу передачи сигналов STAT4 полноразмерного цитоплазматического хвоста IL12Rb2(714-862). При слиянии с более слабым доменом димеризации TpoR(478-582;H499L,S505N,W515K) усеченный цитоплазматический хвост IL12Rb2(775-825) частично воспроизводил силу передачи сигналов STAT4 полноразмерного цитоплазматического хвоста IL12Rb2(714-862).
[0152] Полноразмерный цитоплазматический хвост IL2Rb(333-551) содержит шесть остатков тирозина, которые могут участвовать в последующей передаче сигналов. Сообщалось, что из этих остатков Y364 (остаток тирозина, ближайший к транс мембранному домену рецептора) активирует PI3K, для стимуляции дифференцировки и пролиферации Т-клеток, а также реорганизации цитоскелета для индукции интернализации рецептора; таким образом, несмотря на то, что Y364 может стимулировать эффекторные функции Т-клеток, он также может ограничивать силу и продолжительность передачи сигналов IL2Rb. Авторы настоящего изобретения получили усеченные цитоплазматические хвосты IL2Rb, содержащие три (Y364, Y418 и Y436) из шести остатков тирозина или два (Y418 и Y436) из шести остатков тирозина, и оценили их способность активировать STAT5 с помощью анализа по гену-репортеру клеток НЕК293Т. В общих чертах, 20000 клеток НЕК293Т высевали в каждую лунку 96-луночного планшета с плоским дном, покрытым поли-Ь-лизином, и оставляли для прикрепления на ночь. Конструкцию CACCR-CAR (2,5 нг), элемент ответа Stat, который управляет люциферазой светлячка (100 нг; Promega), и контрольный репортерный вектор люциферазы Renilla (1 нг; Promega) смешивали в конечном объеме 5 мкл в Opti-MEM (Gibco) («смесь ДНК»). В качестве отрицательного контроля клетки трансфицировали конструкцией BFP-CAR, в которой отсутствуют все домены передачи цитокиновых сигналов. 0,3 мкл Липофектамина 2000 (Invitrogen) в 5 мкл Opti-MEM инкубировали при комнатной температуре в течение 5 минут, а затем добавляли к смеси ДНК. Смесь инкубировали при комнатной температуре в течение 20 минут, и общий объем 10 мкл добавляли в каждую лунку, содержащую НЕК-293Т. Через 48 часов после трансфекции активность репортера Stat5 оценивали с использованием системы анализа люциферазы «Dual-Glo» (Promega). Кратность индукции активности репортера Stat5 нормировали к таковой для клеток НЕК293Т, трансфицированных контрольной конструкцией BFP-CAR.
[0153] ФИГ. 14А-В показывает идентификацию усеченных хвостов IL2Rb, способных к равной или лучшей активации STAT5 по сравнению с полноразмерным хвостом IL2Rb(333-551). ФИГ. 14А схематически показывает полноразмерный хвост IL2Rb(333-551) и два усеченных хвоста IL2Rb. Положения остатков тирозина (Y), включенных в каждый хвост, соответствуют указанным. Пунктирные линии представляют соединяющие области в полноразмерном хвосте IL2Rb(333-551), которые были удалены из усеченных хвостов. ФИГ. 14В показывает результаты анализа по гену-репортеру клеток НЕК293Т, в котором передача сигналов STAT5 полноразмерного IL2Rb(333-551) полностью воспроизводилась цитоплазматическим хвостом TpoR(478-582;H499L,S505N,W515K)IL2Rb(339-379,393-433,518-551), который содержал Y364, Y418 и Y536. В цитоплазматическом хвосте TpoR(478-582;S505N,W515K).IL2Rb(393-433,518-551) дополнительное удаление Y364, который опосредует интернализацию рецептора, привело к очень значительному улучшению силы передачи сигналов STAT5.
[0154] Анализ на основе клеток НЕК293Т представляет собой быстрый анализ, в котором показатель измеряется в течение 48 часов после трансфекции цитоплазматического хвоста. Несмотря на то, что он обеспечивает эффективную платформу для скрининга активности цитоплазматического хвоста, ограниченная продолжительность этого анализа не отражает сложность контуров отрицательной обратной связи, которые запускаются после долговременной конститутивной передачи сигналов цитокинов и цитоплазматических хвостов. Для более точной оценки долговременной сигнальной активности вариантов уменьшенного хвоста IL2Rb, авторы изобретения получили CACCR CAR-T-клетки с использованием 2-недельного производственного способа и оценили активацию STAT5 с помощью внутриклеточной проточной цитометрии. С этой целью CACCR CAR-T-клетки подвергали нехватке сыворотки в 100 мкл бессывороточной RPMI (Corning) в течение 4 часов в увлажненном инкубаторе при 37°С с 5% СО2. В качестве положительного контроля добавляли экзогенный рекомбинантный IL-2 человека (10 нг/мл; Miltenyi) в течение последних 30 минут 4-часовой инкубации при нехватке сыворотки. Через 4 часа смесь антител, содержащую BUV395-конъюгированное антитело к CD3 человека (Biolegend) и FITC-конъюгированное моноклональное антитело к метке v5 (Thermo Fisher), добавляли к клеткам и продолжали инкубацию в течение последних 20 минут. Затем клетки фиксировали путем добавления 35 мкл 16% параформальдегида к 100 мкл каждого образца и продолжали инкубацию в течение 15 минут при 37°С. Затем клетки трижды промывали ФСБ и пермеабилизировали в 100% холодном метаноле в течение 1 или 2 ночей при -20°С. В день анализа методом FACS клетки трижды промывали ФСБ, блокировали Fc и окрашивали A1exaFluor647-конъюгированным антителом к Stat5 мыши/человека (pY694) (BD Biosciences), разведенным в ФСБ+1% БСА. После 1 часа инкубации при комнатной температуре в темноте клетки трижды промывали перед анализом методом FACS.
[0155] ФИГ. 15 показывает активацию STAT5 в первичных CACCR CAR-Т-клетках, несущих полноразмерные или усеченные цитоплазматические хвосты IL2Rb. Наибольшая активация STAT5 была вызвана CACCR CAR-T-клетками, несущими усеченный цитоплазматический хвост IL2Rb(393-433,518-551), в котором отсутствовал мотив интернализации Y364. Промежуточная активация STAT5 наблюдалась в CACCR CAR-T клетках, несущих усеченный цитоплазматический хвост IL2Rb(339-379,393-433,518-551). Активация STAT5 не наблюдалась в CAR-отрицательных популяциях в одной и той же культуре, это демонстрирует специфический для CAR-T клеток характер передачи сигналов цитоплазматического хвоста. Примечательно, что в CACCR CAR-T-клетках, несущих полноразмерный цитоплазматический хвост IL2Rb(333-551), активность STAT5 была незначительной или не детектировалась; это может быть обусловлено тремя другими остатками тирозина, присутствующими в полноразмерном цитоплазматическом хвосте IL2Rb(333-551), которые могут индуцировать долговременную отрицательную регуляцию. Таким образом, оптимизация сигнальных доменов цитоплазматического хвоста для устранения таких мотивов отрицательной регуляции является благоприятной для того чтобы гарантировать долговременное поддержание конститутивной и эффективной передачи сигналов. Поскольку сильные цитоплазматические хвосты могут вызывать сильную отрицательную обратную связь, слабый цитоплазматический хвост может быть предпочтительным для долговременной стимуляции.
Пример 7: Оптимизированные цитоплазматические хвосты, происходящие из IL2Rb, более точно имитируют передачу сигналов IL-15, но не IL-2
[0156] IL-2 и IL-15 представляют собой два цитокина, которые в естественных условиях передают сигналы посредством гетеродимерного цитокинового рецептора, состоящего из общей гамма-цепи и IL2Rb. Несмотря на использование одних и тех же нативных рецепторов, IL-2 и IL-15 оказывают различные эффекты на дифференцировку и устойчивость Т-клеток. В то время как IL-2 индуцирует дифференцировку короткоживущих эффекторов, IL-15 стимулирует образование долгоживущих Т-клеток памяти. Кроме того, было показано, что повышенные сывороточные концентрации IL-15 положительно коррелируют с ответом пациента на терапию CAR-T-клетками. Таким образом, предпочтительными являются цитоплазматические хвосты, которые имитируют передачу сигналов и эффекты IL-15, но не IL-2. Авторы настоящего изобретения попытались определить, могут ли уменьшенные цитоплазматические хвосты IL2Rb более точно имитировать передачу сигналов IL-2 или IL-15.
[0157] С этой целью авторы настоящего изобретения использовали CAR-T клетки, содержащие примерный CAR, несущий Р5А2 scFv, направленный к ВСМА, связанный с мимотопами ритуксимаба, сигнальными доменами 4-1ВВ и CD3z (см. US 10294304, включенный в данный документ посредством ссылки). Были получены ВСМА-специфичные CAR-T-клетки, коэкспрессирующие усеченные хвосты IL2Rb, и их профили экспрессии генов сравнивали с контрольными CAR-T-клетками, которые подвергались воздействию экзогенного рекомбинантного IL-2 или IL-15 человека. Для получения лентивируса, кодирующего CACCR и CAR, клетки НЕК293Т высевали из расчета 0,45 миллиона клеток на мл в 2 мл DMEM (Gibco) с добавлением 10% ФБС (Hyclone) на лунку 6-луночного планшета за день до трансфекции. В день трансфекции лентивирус получали путем смешивания 1,5 мкг лентивирусных упаковочных векторов psPAX2, 0,5 мкг pMD2G и 0,5 мкг соответствующего вектора для переноса CAR в 250 мкл Opti-MEM (Gibco) на лунку 6-луночного планшета («смесь ДНК»). 10 мкл Липофектамина 2000 (hwitrogen) в 250 мкл Opti-MEM инкубировали при комнатной температуре в течение 5 минут, а затем добавляли к смеси ДНК. Смесь инкубировали при комнатной температуре в течение 20 минут, и общий объем 500 мкл медленно добавляли по бокам лунок, содержащих НЕК293Т. Через один день после трансфекции среды из каждой лунки с клетками НЕК293Т в 6-луночном планшете заменяли 2 мл на лунку сред для трансдукции Т-клеток, т.е. X-Vivo-15 с добавлением 10% ФБС.Через два дня после трансфекции лентивирусные супернатанты от клеток НЕК293Т собирали и пропускали через фильтр с размером пор 0,45 микрон (EMD Millipore) для удаления клеточного дебриса, а неочищенные лентивирусные супернатанты использовали непосредственно для трансдукции Т-клеток. В День 0 очищенные Т-клетки активировали в среде X-Vivo-15 (Lonza) с добавлением 100 МЕ/мл IL-2 человека (Miltenyi Biotec), 10% ФБС (Hyclone) и Т Trans Act человека (Miltenyi Biotec, №по каталогу 130-111-160, разведение 1:100) в планшете Grex-24 (Wilson Wolf, №по каталогу 80192М). В День 2 Т-клетки ресуспендировали из расчета 0,5 миллиона клеток на мл в средах для трансдукции Т-клеток, трансдуцировали равным объемом неочищенного лентивирусного супернатанта с 100 МЕ/мл IL-2 человека в планшете Grex-24. В День 5 CAR-T-клетки, экспрессирующие цитоплазматический хвост, обеспечивали питательными веществами путем замены отработанных сред средами для размножения Т-клеток, т.е. X-Vivo-15 с добавлением 5% сыворотки АВ человека (Gemini Bio) с 100 МЕ/мл IL-2 человека. В это время контрольные CAR-T-клетки, в которых отсутствуют цитоплазматические хвосты, размножали в присутствии либо только 100 ед./мл IL-2 человека, либо 100 ед./мл IL-2 человека и 10 нг/мл IL-15 человека (Miltenyi Biotec). При необходимости клетки размножали в более крупных сосудах G-Rex (Wilson Wolf), используя среды для размножения Т-клеток и соответствующие концентрации рекомбинантных цитокинов. В День 13 клетки окрашивали с помощью пригодного для фиксации набора для оценки жизнеспособности клеток Zombie NIR™ (Zombie NIR Fixable Viability Kit (Biolegend)), метили BUV395-конъюгированным антителом к CD3 (Biolegend) и антиидиотипическим антителом, специфичным в отношении Р5А2 scFv, затем сортировали с помощью FACS для обогащения CAR+ Т-клетками. Отсортированные CAR+ Т-клетки затем культивировали в планшетах Grex-24 в течение следующих 2 дней в средах для размножения Т-клеток, при этом CACCR CAR+ Т-клетки оставили без экзогенных цитокинов, а отсортированные контрольные CAR+ Т-клетки оставили без экзогенных цитокинов, обработали 100 ед./мл IL-2 человека или обработали 10 нг/мл IL-15 человека. В День 15 живые CAR+ Т-клетки обогащали с помощью набора для удаления мертвых клеток Easy Sep™ (Easy Sep™ Dead Cell Removal Kit, StemCell Technologies), и осадки клеток мгновенно замораживали для последующей экстракции РНК и анализа экспрессии генов NanoString (панель CAR-T-клеток человека; NanoString Technologies).
[0158] Данные показывают, что CACCR CAR-T-клетки, несущие усеченные хвосты IL2Rb, более точно имитируют передачу сигналов IL-15, но не IL-2. В качестве примера, авторы настоящего изобретения протестировали цитоплазматические хвосты TpoR(478-582;S505N,W515K).IL2Rb(393-433,518-551) и TpoR(478-582;H499L,S505N,W515K).IL2Rb(339-379,393-433,518-551). ФИГ. 16А представляет собой схематический рисунок экспериментального дизайна и рабочего процесса для подготовки образца. ФИГ. 16В показывает профиль экспрессии генов CACCR CAR-T-клеток по сравнению с таковым контрольных CAR-T-клеток, обработанных IL-2 с Дней 13-15. ФИГ. 16С показывает профиль экспрессии генов CACCR CAR-T-клеток по сравнению с таковым контрольных CAR-T-клеток, обработанных IL-15 с Дней 13-15. Log2-кратное изменение (FC) для каждого образца рассчитывали путем нормирования к контрольным CAR-T-клеткам, которые были оставлены без обработки с Дней 13-15. Значения R2 и линия наилучшего соответствия (сплошная линия), определенные с помощью анализа методом линейной регрессии, показаны на каждом графике. Показанные данные принадлежат одному представителю из двух доноров. Несмотря на то, что профили экспрессии генов CACCR CAR-T-клеток не показали корреляции с образцами, обработанными IL-2 (ФИГ. 16 В), они положительно коррелировали с образцами, обработанными IL-15 (ФИГ. 16С). Это свидетельствует о том, что цитоплазматические хвосты, несущие усеченные хвосты IL2Rb, более точно имитируют последующие сигнальные и транскрипционные ответы IL-15, но не IL-2.
Пример 9: Конститутивные цитоплазматические хвосты могут быть запрограммированы для комбинаторных выходных сигналов
[0159] Как показано на ФИГ. 12, CACCR, несущие сигнальные домены, происходящие из различных цитокиновых рецепторов, могут активировать передачу сигналов, сходную с таковой исходного рецептора. Авторы настоящего иизобретения предположили, что цитоплазматические хвосты могут быть сконструированы так, чтобы имитировать одновременную передачу сигналов от нескольких исходных рецепторов путем слияния более чем одного цитоплазматического хвоста в тандеме, что позволяет достичь комбинаторных выходных сигналов. Для тестирования комбинаторных выходных сигналов от тандемных цитоплазматических хвостов, авторы изобретения получили конститутивный 7.12-хвост путем слияния цитоплазматического хвоста IL7Ra(316-459) с усеченным цитоплазматическим хвостом IL12Rb2(775-825) и оценили передачу сигналов с использованием анализа по гену-репортеру клеток НЕК293Т.
[0160] ФИГ. 17A-D показывают дизайн и сигнальную способность конститутивных тандемных цитоплазматических хвостов, показанных на примере 7.12-хвоста. ФИГ. 17А схематически показывает конститутивный 7.12-хвост. ФИГ. 17В схематически показывает лентивирусные векторы, различающиеся только их TpoR(478-582) димеризационными/JAK-связывающими доменами, использованными для совместной экспрессии вариантов 7.12-хвоста и CAR. ФИГ. 17C-D показывают активность репортера STAT для конструкций, несущих TpoR(478-582;S505N;W515K) и TpoR(478-582;H499L;S505N;W515K) димеризационныеЯАК-связывающие домены, соответственно, слитые с указанными цитоплазматическими хвостами. В то время как цитоплазматический хвост IL7Ra(316-459) сильно активировал STAT5, цитоплазматический хвост IL12Rb2(775-825) сильно активировал STAT4. Однако, согласно наблюдениям для цитоплазматического хвоста IL7Ra(316-459).IL12Rb2(775-825), слияние обоих цитоплазматических хвостов в тандеме привело к одновременной и комбинаторной активации как STAT5, так и STAT4. Это демонстрирует, что несколько путей передачи сигналов, которые обычно потребовали бы двух или более различных нативных цитокиновых рецепторов, могут быть достигнуты с помощью одного цитоплазматического хвоста.
Пример 10: Конститутивные цитоплазматические хвосты могут быть адаптированы с одним или более выходными сигналами для управления фенотипом и функцией CAR-T-клеток
[0161] Затем авторы настоящего изобретения определили, могут ли конститутивные цитоплазматические хвосты, несущие разные выходные сигналы, по-разному влиять на фенотип и функцию первичных CAR-T-клеток человека. В отличие от IL-7, который управляет выживанием Т-клеток и поддержанием клеток памяти, IL-12 является провоспалительным цитокином, который стимулирует дифференцировку Т-клеток. Поэтому авторы настоящего изобретения попытались исследовать, может ли передача сигналов посредством цитоплазматических хвостов, происходящих из IL7Ra или IL12Rb, по-разному управлять указанными дивергентными фенотипами, и оценить общий комбинаторный эффект слияния обоих хвостов в тандеме.
[0162] С этой целью авторы настоящего изобретения получили первичные CAR-T-клетки человека, которые коэкспрессировали либо 7-хвост (т.е. IL7Ra(316-459)), либо варианты 12-хвостов (т.е., IL12Rb2(775-825) или IL12Rb2(714-862)). См. ФИГ. 13А. Для получения лентивируса, кодирующего CACCR и CAR, клетки НЕК293Т высевали из расчета 0,45 миллиона клеток на мл в 2 мл DMEM (Gibco) с добавлением 10% ФБС (Hyclone) на лунку 6-луночного планшета за день до трансфекции. В день трансфекции лентивирус получали путем смешивания 1,5 мкг лентивирусных упаковочных векторов psPAX2, 0,5 мкг pMD2G и 0,5 мкг соответствующего вектора для переноса CAR в 250 мкл Opti-MEM (Gibco) на лунку 6-луночного планшета («смесь ДНК»). 10 мкл Липофектамина 2000 (Invitrogen) в 250 мкл Opti-MEM инкубировали при комнатной температуре в течение 5 минут, а затем добавляли к смеси ДНК. Смесь инкубировали при комнатной температуре в течение 20 минут, и общий объем 500 мкл медленно добавляли по бокам лунок, содержащих НЕК293Т. Через 1 день после трансфекции среды из каждой лунки с клетками НЕК293Т в 6-луночном планшете заменяли 2 мл на лунку сред для трансдукции Т-клеток, т.е. X-Vivo-15 с добавлением 10% ФБС. Через 2 дня после трансфекции лентивирусные супернатанты от клеток НЕК293Т собирали и пропускали через фильтр с размером пор 0,45 микрон (EMD Millipore) для удаления клеточного дебриса, а неочищенные лентивирусные супернатанты использовали непосредственно для трансдукции Т-клеток. В День 0 очищенные Т-клетки активировали в среде X-Vivo-15 (Lonza) с добавлением 100 МЕ/мл IL-2 человека (Miltenyi Biotec), 10% ФБС (Hyclone) и Т Trans Act человека (Miltenyi Biotec, №по каталогу 130-111-160, разведение 1:100) в планшете Grex-24 (Wilson Wolf, № по каталогу 80192М). В День 2 Т-клетки ресуспендировали из расчета 0,5 миллиона клеток на мл в средах для трансдукции Т-клеток, трансдуцировали равным объемом неочищенного лентивирусного супернатанта с 100 МЕ/мл IL-2 человека в планшете Grex-24. В День 5 клетки обеспечивали питательными веществами путем замены отработанных сред средами для размножения Т-клеток, т.е. X-Vivo-15 с добавлением 5% сыворотки АВ человека (Gemini Bio) с 100 МЕ/мл IL-2 человека. При необходимости клетки размножали в более крупных сосудах G-Rex (Wilson Wolf), используя среды для размножения Т-клеток и соответствующие концентрации IL-2 человека. В День 14 выполняли фенотипирование памяти продуктов CAR-T-клеток путем детектирования CAR-трансдуцированных клеток с использованием FITC-конъюгированного моноклонального антитела к метке v5 (Thermo Fisher) с совместным окрашиванием РЕ/Су7-конъюгированным антителом к CD62L (Biolegend) и BV785-конъюгированным антителом к CD45RO (Biolegend) методом проточной цитометрии. В качестве отрицательных контролей, в которых отсутствует передача сигналов CACCR, одновременно с этим получали CAR-T-клетки, коэкспрессирующие BFP или трансмембранный домен TpoR(478-582) дикого типа, связанный с 7-хвостом.
[0163] ФИГ. 18 отображает влияние цитоплазматических хвостов на дифференцировку в клетки памяти продуктов CAR-T-клеток. Показан фенотип клеток памяти продуктов CACCR CAR-T-клеток, полученных от 2 здоровых доноров, на День 14. В то время как CAR-T-клетки, коэкспрессирующие цитоплазматический хвост IL7Ra(316-459), сохраняли популяцию стволовых клеток памяти (Tscm), CAR-T-клетки, несущие цитоплазматические хвосты, происходящие из IL12Rb2, показали заметное уменьшение популяции Tscm, сопровождаемое увеличением популяции клеток центральной памяти (Tcm). Полученные результаты позволяют предположить, что в отсутствие взаимодействия с CAR конститутивная IL12-подобная передача сигналов посредством цитоплазматических хвостов, происходящих из IL12Rb2, управляет прогрессивной дифференцировкой из Tscm в Tcm. Кроме того, CAR-T-клетки, коэкспрессирующие тандемный цитоплазматический хвост IL7Ra(316-459).IL12Rb2(775-825), показали восстановление популяции Tscm и имитировали фенотип CAR-T-клеток, несущих одиночный цитоплазматический хвост IL7Ra(316-459), это свидетельствует о том, что отрицательные эффекты одиночных цитоплазматических хвостов могут быть уменьшены посредством комбинаторной передачи сигналов тандемными цитоплазматическими хвостами.
[0164] Далее авторы настоящего изобретения изучили, может ли передача сигналов CACCR управлять функциональными конечными показателями CAR-T-клеток, включая выживаемость и цитотоксичность. По сравнению с передачей сигналов IL-7, которая стимулирует долговременную выживаемость Т-клеток, напротив, передача сигналов IL-12 управляет дифференцировкой в короткоживущие конечные эффекторы. В подтверждение этого популяция Tscm, которая способна к долговременной выживаемости и, как полагают, опосредует длительную устойчивость CAR-T-клеток, была недостаточной в CAR-T-клетках, несущих хвосты, происходящие из IL12Rb2. Для анализа того, может ли передача сигналов посредством разных цитоплазматических хвостов программировать выживаемость и дифференцировку CAR-T-клеток, авторы настоящего изобретения выполнили независимый от фактора роста анализ, в котором CACCR-коэкспрессирующие CAR-T клетки культивировали в отсутствие клеток-мишеней или экзогенно дополняемых цитокинов. Количество и дифференцировку CAR-T-клеток в клетки памяти в этих условиях отслеживали с течением времени.
[0165] В общих чертах, криоконсервированные CAR-T-клетки размораживали, подсчитывали и процентную долю CAR-T-клеток во всех образцах нормировали к образцу с наименьшей эффективностью трансдукции путем добавления нетрансдуцированных (NTD) Т-клеток. В качестве контроля использовали CAR-T-клетки, коэкспрессирующие BFP (BFP-CAR) вместо цитоплазматического хвоста. 0,25×106 CAR+ Т-клеток/мл в 1,5 мл RPMI, содержащей 10% ФБС (Hyclone), заменимые аминокислоты, пируват натрия и 20-25 мМ HEPES con, затем высевали в 24-луночные планшеты для тканевых культур. В указанные дни для каждого условия собирали дублированные образцы по 100 мкл и окрашивали с использованием пригодного для фиксации набора для оценки жизнеспособности клеток Zombie NIR™ (Zombie NIR Fixable Viability Kit (Biolegend)). Образцы промывали ФСБ, блокировали Fc, затем окрашивали следующей смесью антител, разведенной в ФСБ+1% БСА: BUV395-конъюгированное антитело к CD3 человека, BV510-конъюгированное антитело к CD8 человека, BV605-конъюгированное антитело к CD4 человека и FITC-конъюгированное антитело к метке v5 (для детектирования CAR), РЕ/Су7-конъюгированное антитело к CD62L человека (Biolegend) и BV785-конъюгированное антитело к CD45RO человека (Biolegend). В завершение образцы промывали в ФСБ и клеточные осадки ресуспендировали в 130 мкл ФСБ + 1% БСА, содержащем счетные микросферы 123count eBeads (Thermo Fisher) (10 мкл счетных микросфер в 120 мкл ФСБ + 1% БСА) перед анализом методом FACS.
[0166] ФИГ. 19А-В показывают репрезентативные данные для клеток от 2 доноров. ФИГ. 19А и ФИГ. 19В показывают кратность размножения CAR-T-клеток относительно внесенного количества в начале анализа (День 0) для конструкций, несущих TpoR(478-582;S505NiW515K) и TpoR(478-5 82;H499b;8505^ W515K) димеризационные/JAK-связывающие домены, соответственно, слитые с указанными цитоплазматическими хвостами. По сравнению с контрольными BFP CAR-T-клетками, количество CAR-T-клеток, несущих цитоплазматический хвост IL7Ra(316-459), уменьшалось медленнее, это свидетельствует о том, что конститутивная передача сигналов посредством цитоплазматического хвоста IL7Ra(316-459) улучшила выживаемость CAR-T-клеток. Напротив, количество CAR-T-клеток, несущих цитоплазматические хвосты, происходящие из IL12Rb2, уменьшалось со скоростью, более сопоставимой с таковой для BFP CAR-T-клеток, что указывает на отсутствие преимущества в отношении выживаемости. Примечательно, что CAR-T-клетки, несущие тандемный цитоплазматический хвост IL7Ra(316-459).IL12Rb2(775-825), обеспечивали преимущество в отношении выживаемости, более сопоставимое с таковым для цитоплазматического хвоста IL7Ra(316-459). ФИГ. 19C-D показывают дифференцировку CAR-T-клеток на День 7 в анализе, независимом от фактора роста, для конструкций, несущих TpoR(478-582;S505N;W515K) и TpoR(478-582;H499L;S505N;W515K) димеризационные/JAK-связывающие домены, соответственно, слитые с указанными цитоплазматическими хвостами. По сравнению с контрольными BFP CAR-T-клетками и CAR-T-клетками, несущими цитоплазматические хвосты, происходящие из IL12Rb2, CAR-T-клетки, несущие цитоплазматический хвост IL7Ra(316-459), были не только более многочисленными, но и более обогащенными по популяции Tscm. См. ФИГ. 19C-D. CAR-T-клетки, несущие тандемный цитоплазматический хвост IL7Ra(316-459) IL12Rb2(775-825), улучшили обогащение Tscm. Не ограничиваясь какими-либо конкретными механизмами, результаты позволяют предположить, что слияние с цитоплазматический хвостом IL7Ra(316-459) перекрыло фенотип одиночного цитоплазматического хвоста IL12Rb2(775-825). В совокупности эти данные подтверждают комбинаторные функциональные эффекты передачи сигналов тандемным цитоплазматическим хвостом и демонстрируют регулируемость различных конструкций цитоплазматического хвоста.
[0167] Продукты CAR-T-клеток, обогащенные популяцией Tscm, ассоциированы с улучшенным размножением, устойчивостью и активностью. Однако окончательно дифференцированные CAR-T-клетки являются короткоживущими и обладают ограниченным пролиферативным потенциалом, что приводит к снижению эффективности. Учитывая, что цитоплазматические хвосты, происходящие из IL7Ra(316-459) и IL12Rb2, по-разному влияли на эти характеристики, авторы настоящего изобретения оценили способность этих цитоплазматических хвостов влиять на цитотоксичность CAR-T-клеток.
[0168] С этой целью 5000 клеток-мишеней U87KO-EGFRvIII-nucGFP высевали и позволяли им прикрепиться в 96-луночных планшетах с черными стенками и плоским прозрачным дном в 50 мкл RPMI, содержащей 10% ФБС (Hyclone), заменимые аминокислоты, пируват натрия и 20-25 мМ HEPES. EGFRvIII CAR (2173 scFv) Т-клетки, несущие цитоплазматические хвосты, происходящие из IL7Ra (316-459) или из IL12Rb, размораживали и добавляли к высеянным клеткам-мишеням при соотношении эффектор:мишень (Э:М) 1:3. Поскольку количество клеток-мишеней превышает количество CAR-T-клеток, контроль размножения клеток-мишеней может потребовать от CAR-T-клеток повторного или серийного уничтожения. В качестве контроля использовали CAR-T-клетки, коэкспрессирующие BFP CAR вместо цитоплазматического хвоста. Количество живых клеток-мишеней с течением времени отслеживали с использованием визуализирующей системы для анализа живых клеток «IncuCyte».
[0169] ФИГ. 20А-В отображают цитотоксическую активность CAR-T-клеток, коэкспрессирующих различные CACCR. ФИГ. 20А-В показывают устранение клеток-мишеней CACCR CAR-T-клетками, несущими TpoR(478-582;S505N;W515K) и TpoR(478-582;H499L;S505N;W515K) димеризационные/JAK-связывающие домены, соответственно, слитые с указанными цитоплазматическими хвостами. По сравнению с BFP CAR-T-клетками CAR-T-клетки, несущие цитоплазматические хвосты, происходящие из IL12Rb2, не проявляли или проявляли незначительное улучшение серийной цитолитической активности in vitro, вероятно, из-за их ограниченного пролиферативного потенциала и короткой продолжительности жизни. Напротив, CAR-T-клетки, несущие цитоплазматический хвост IL7Ra(316-459), проявили улучшенную серийную цитолитическую активность, вероятно, вследствие повышенной пролиферации и устойчивости. Примечательно, что CAR-T-клетки, несущие тандемный цитоплазматический хвост IL7Ra(316-459). IL12Rb2(775-825), показали равную или лучшую серийную цитолитическую активность, чем цитоплазматический хвост IL7Ra(316-459), это позволяет предположить, что комбинирование усиливающего устойчивость сигнального домена IL7Ra(316-459) и усиливающего дифференцировку в эффекторы сигнального домена IL12Rb2(775-825) в одном цитоплазматическом хвосте может одновременно увеличивать продолжительность жизни, размножение и немедленные эффекторные функции CAR-T-клеток.
Пример 11: Конститутивные цитокиновые рецепторы повышают цитотоксичность in vitro CAR, направленных к мишени гемобластоза
[0170] Мы продемонстрировали, что CACCR могут повышать активность CAR, направленных к EGFRvIII, мишени для солидной опухоли, например, глиобластомы. Для определения того, могут ли CACCR широко применяться в разных scFv для мишени гемобластоза, авторы настоящего изобретения дополнительно клонировали CACCR в конструкцию CAR, направленную к маркеру гематологического злокачественного новообразования (т.е. ВСМА), и оценили долговременную цитотоксичность против ВСМА-положительной линии клеток-мишеней.
[0171] Клетки-мишени, стабильно экспрессирующие репортеры люциферазу светлячка и GFP, получали с помощью лентивирусной трансдукции. 10000 Luc-GFP-меченых клеток-мишеней высевали в 100 мкл на лунку в белом плоскодонном 96-луночном планшете для культивирования тканей. Криоконсервированные CAR-T-клетки размораживали, подсчитывали и процентную долю CAR-T-клеток во всех образцах нормировали к образцу с наименьшей эффективностью трансдукции путем добавления нетрансдуцированных (NTD) Т-клеток. Затем в каждую лунку с клетками-мишенями добавляли CAR-T-клетки в объеме 100 мкл при указанных соотношениях эффектор:мишень (Э:М) с тремя повторами. В качестве отрицательного контроля «только мишени» к клеткам-мишеням добавляли 100 мкл сред вместо Т-клеток. Через два или три дня содержимое лунок перемешивали путем осторожного пипетирования, и по 100 мкл из каждой лунки, содержащей Т-клетки, переносили в новый белый плоскодонный 96-луночный планшет для культуры ткани, содержащий 10000 свежевысеянных Luc-GFP-меченых клеток-мишеней в 100 мкл. В лунки «только мишени» вместо Т-клеток добавляли свежие среды. Новый планшет инкубировали при 37°С, в то время как количество живых клеток-мишеней, оставшихся в старом 96-луночном планшете, определяли с использованием системы анализа люциферазы «ONE-Glo» (Promega) в соответствии с инструкциями производителя. Процентную долю живых клеток-мишеней рассчитывали путем нормирования сигнала люциферазы к сигналу из лунок «только мишени», а процент цитотоксичности рассчитывали как 100% -% живых клеток-мишеней. Последовательные переносы к свежим клеткам-мишеням и считывание показателей люциферазы выполняли каждые два или три дня до прекращения цитотоксической активности.
[0172] ФИГ. 21 показывает, что CACCR улучшили цитотоксическую активность CAR-T-клеток, направленную против ВСМА, мишени гемобластоза. ФИГ. 21 показывает цитотоксичность ВСМА CAR (Р5А2 scFv) против линии клеток множественной миеломы MM1.S при Э:М=10:1, это указывает на то, что совместная экспрессия CACCR увеличила долговременную цитотоксичность CAR-T-клеток.
Пример 12: CACCR повышают активность CAR-T-клеток in vivo
[0173] Терапевтические средства на основе CAR-T-клеток, например, нацеленные на CD 19 и ВСМА, достигли беспрецедентного клинического успеха в лечении гематологических злокачественных новообразований. Несмотря на то, что была достигнута высокая частота полных ответов, это явление кратковременное, поскольку у большинства пациентов в конечном итоге возникает рецидив. Кроме того, CAR-T-клетки достигли более ограниченного успеха в лечении солидных опухолей. Причины рецидива и отсутствия ответа включают недостаточное размножение и устойчивость CAR-T-клеток, а также функциональное ингибирование CAR-T-клеток иммуносупрессорными микроокружениями. Поскольку наша характеристика CACCR CAR-T-клеток in vitro выявила улучшения в профилях управляемой мишенью пролиферации, устойчивости, активности и истощения, после этого авторы настоящего изобретения изучили, приводят ли эти функциональные улучшения к улучшению противоопухолевой активности in vivo.
[0174] Для исследования активности in vivo CACCR CAR-T-клеток в случае гематологических злокачественных новообразований, авторы настоящего изобретения использовали CAR-T-клетки, несущие ВСМА-специфичный Р5А2 scFv, связанный с сигнальными доменами 4-1ВВ и CD3ζ, в ортотопической ксенотрансплантатной модели множественной миеломы. Дефицитные по Т-клеточным рецепторам (TCR) ВСМА CAR-T-клетки получали с помощью подавления генов, опосредуемого нуклеазами на основе эффектора, подобного активатору транскрипции (TALEN), чтобы избежать потенциальных помех со стороны TCR-управляемой ксенореактивности. Самок мышей NSG в возрасте 8-10 недель облучали при 1 Гр за один день до внутривенной инокуляции 5×106 MM1.S-Luc-GFP. Через 14 дней после имплантации опухоли мышей рандомизировали на основании опухолевой нагрузки и вводили внутривенно 1×106 или 3×106 указанных CAR-T-клеток (n=10 на группу). Прогрессирование опухоли отслеживали с помощью визуализации биолюминесценции. В День 30 после введения дозы Т-клеток у мышей, получавших 3×106 CAR-T-клеток, брали кровь для подсчета ВСМА CAR-T-клеток на периферии. В частности, 50 мкл цельной крови от каждой мыши подвергали лизису эритроцитов с использованием буфера для лизирования АСК (Gibco), блокировали Fc и окрашивали следующей смесью антител, разведенной в ФСБ+1% БСА: FITC-конъюгированное антитело к CD45 мыши (Biolegend), BV21-конъюгированное антитело к CD45 человека (Biolegend) и антиидиотипическое антитело, специфичное в отношении Р5А2 scFv. В завершение образцы промывали в ФСБ и клеточные осадки ресуспендировали в 130 мкл ФСБ+1% БСА, содержащем счетные микросферы 123count eBeads (Thermo Fisher) (10 мкл счетных микросфер в 120 мкл ФСБ+1% БСА) перед анализом методом FACS.
[0175] ФИГ. 22А-С показывают, что CACCR улучшили противоопухолевую активность и устойчивость ВСМА CAR-T-клеток против ортотопической множественной миеломы in vivo. ФИГ. 24А-В показывают прогрессирование опухоли в ответ на лечение с использованием 1×106 или 3×106 указанных CAR-T клеток, соответственно. Несмотря на то, что контрольные ВСМА CAR-T-клетки были способны опосредовать начальную регрессию опухоли, этот ответ был недолгим, поскольку опухоли рецидивировали через 22 дня после инфузии клеток. Однако CACCR-коэкспрессирующие CAR-T-клетки существенно отсрочили рецидив опухоли и улучшили устойчивость ответа. Статистика на ФИГ. 24А-В представляет **р<0,01 и ***р<0,001 на основе однофакторного дисперсионного анализа повторных измерений с критерием Тьюки для множественных сравнений для Дней 6-34 для ФИГ. 22А и Дней 6-44 для ФИГ. 22 В. ФИГ. 22С показывает количество ВСМА CAR-T-клеток, присутствующих в периферической крови мышей, получивших 3×106 CAR-T-клеток, через 30 дней после инфузии Т-клеток. Одновременно с рецидивом опухоли, наблюдаемым у мышей, получивших контрольные ВСМА CAR-T-клетки, контрольные ВСМА CAR-T-клетки больше не поддавались детектированию на периферии. Напротив, CACCR ВСМА CAR-T-клетки, которые лучше предотвращали рецидив опухоли, также были более многочисленны in vivo. Статистика на ФИГ. 24С представляет *р<0,05 и ****р<0,0001 на основе обычного однофакторного дисперсионного анализа с критерием Тьюки для множественных сравнений. Это позволяет предположить, что улучшенная устойчивость CACCR CAR-T-клеток частично опосредовала улучшенный долговременный контроль опухоли и продлила устойчивость ответа.
[0176] Мы дополнительно оценили влияние CACCR на активность CAR-T-клеток в случае солидных опухолей, которые, как известно, устойчивы к терапии CAR-T-клетками, таких как глиобластома. С этой целью авторы настоящего изобретения использовали EGFRvIII-специфичный CAR, несущий 2173 scFv, связанный с сигнальными доменами 4-1ВВ и CD3ζ, а также линию клеток глиобластомы человека LN229, стабильно сверхэкспрессирующую EGFRvIII (LN229-EGFRvIII). Самкам мышей NSG в возрасте 8-10 недель подкожно имплантировали 3×106 LN229-EGFRvIII. Через 25 дней, когда опухоли развились, мышей рандомизировали на основании опухолевой нагрузки и вводили внутривенно 1,5×106 или 3×106 указанных CAR-T-клеток (n=8-10 на группу). Прогрессирование опухоли отслеживали дважды в неделю с помощью измерений штангенциркулем.
[0177] ФИГ. 23 показывает, что CACCR улучшил противоопухолевую активность CAR-T-клеток против развившихся солидных опухолей. Несмотря на то, что обработка контрольными EGFRvIII CAR-T-клетками могла замедлять рост опухолей LN229-EGFRvIII, ответ был кратковременным и субоптимальным, поскольку опухоли в конечном итоге прогрессировали. Напротив, лечение CACCR CAR-Т-клетками привело к полной регрессии опухоли. Примечательно, что даже низкая доза 1,5×106 CACCR CAR-T-клеток была достаточной для устранения опухоли. Статистика представляет **р<0,01 по сравнению с обработкой 3×106 контрольных CAR-T-клеток на основе однофакторного дисперсионного анализа повторных измерений с критерием Тьюки для множественных сравнений для Дней 3-38. Эти результаты подтверждают способность CACCR действовать синергически без чрезмерных эффектов с сигнальными доменами в CAR-T-клетках, для обеспечения повышенной активности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМЕРНЫЕ ЦИТОКИНОВЫЕ РЕЦЕПТОРЫ, НЕСУЩИЕ ЭКТОДОМЕН PD-1 | 2020 |
|
RU2828214C2 |
| ИНДУЦИБЕЛЬНЫЕ ХИМЕРНЫЕ ЦИТОКИНОВЫЕ РЕЦЕПТОРЫ | 2019 |
|
RU2826155C2 |
| ХИМЕРНЫЙ ЦИТОКИНОВЫЙ РЕЦЕПТОР | 2016 |
|
RU2826122C1 |
| ТРАНСГЕННЫЕ ГЕНЕТИЧЕСКИЕ МЕТКИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2822461C1 |
| ТРАНСГЕННЫЕ ГЕНЕТИЧЕСКИЕ МЕТКИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2729112C2 |
| ЭКСПРЕССИЯ НОВЫХ КЛЕТОЧНЫХ МЕТОК | 2018 |
|
RU2796334C2 |
| CD33-СПЕЦИФИЧЕСКИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ИММУНОТЕРАПИИ РАКА | 2015 |
|
RU2701341C2 |
| МАт-НАПРАВЛЯЕМЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРНЫЕ СИСТЕМЫ ДЛЯ СОРТИРОВКИ/ИСТОЩЕНИЯ СКОНСТРУИРОВАННЫХ ИММУННЫХ КЛЕТОК | 2016 |
|
RU2732925C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ТРАНСДУКЦИИ И ЭКСПАНСИИ ЛИМФОЦИТОВ И РЕГУЛЯЦИИ ИХ АКТИВНОСТИ | 2018 |
|
RU2820974C1 |
| КЛЕТКА | 2016 |
|
RU2729158C2 |
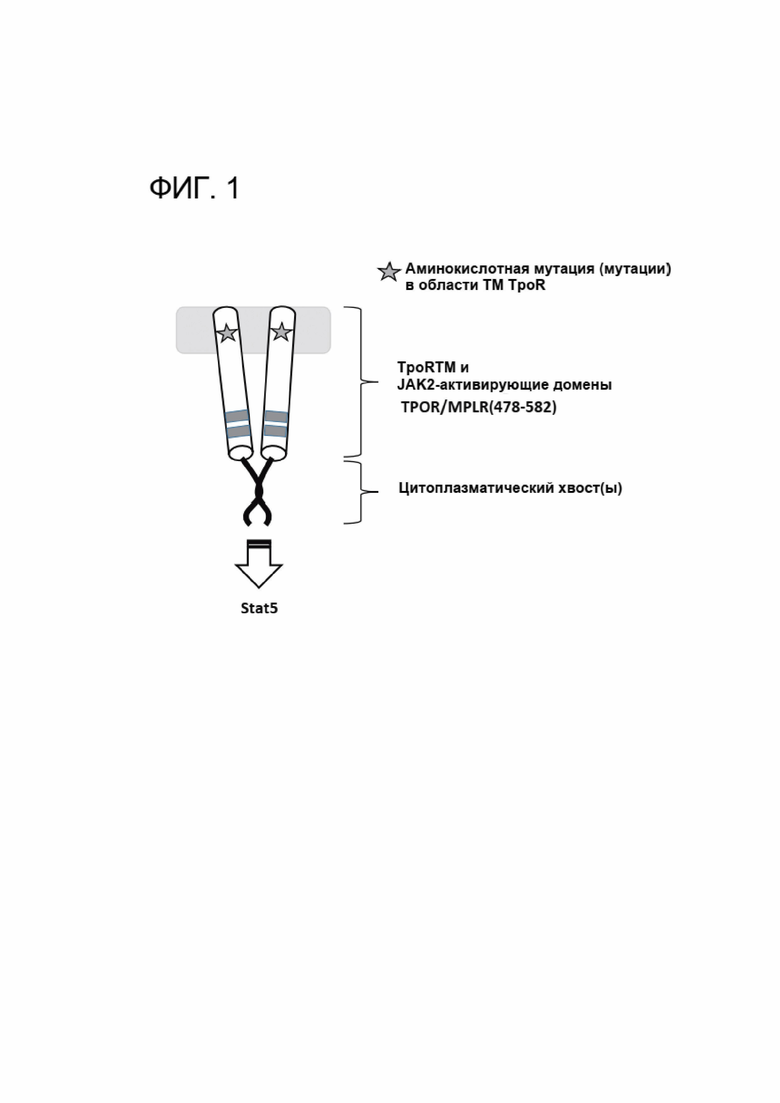
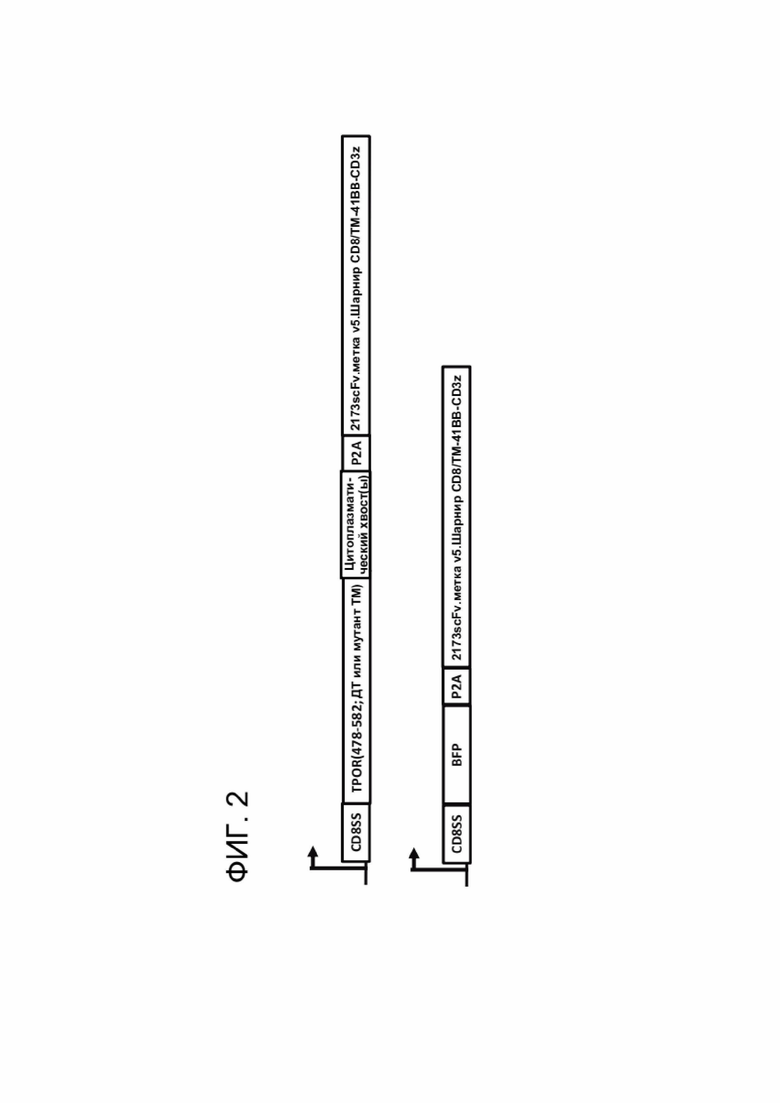
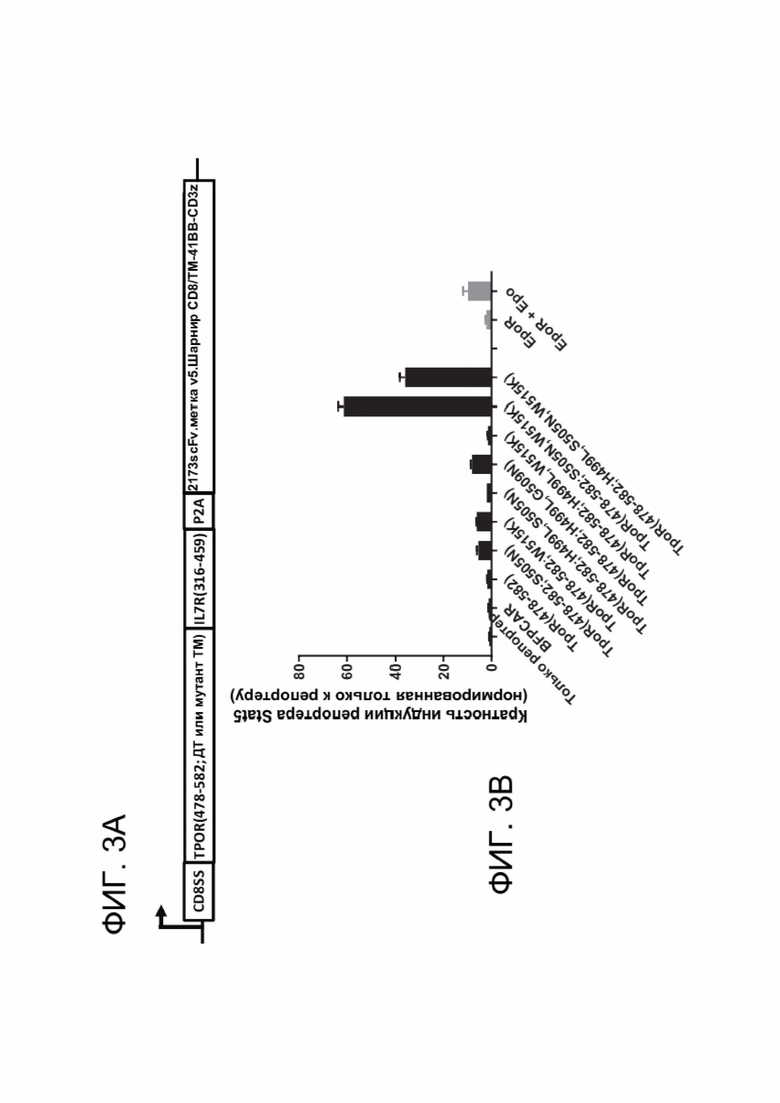
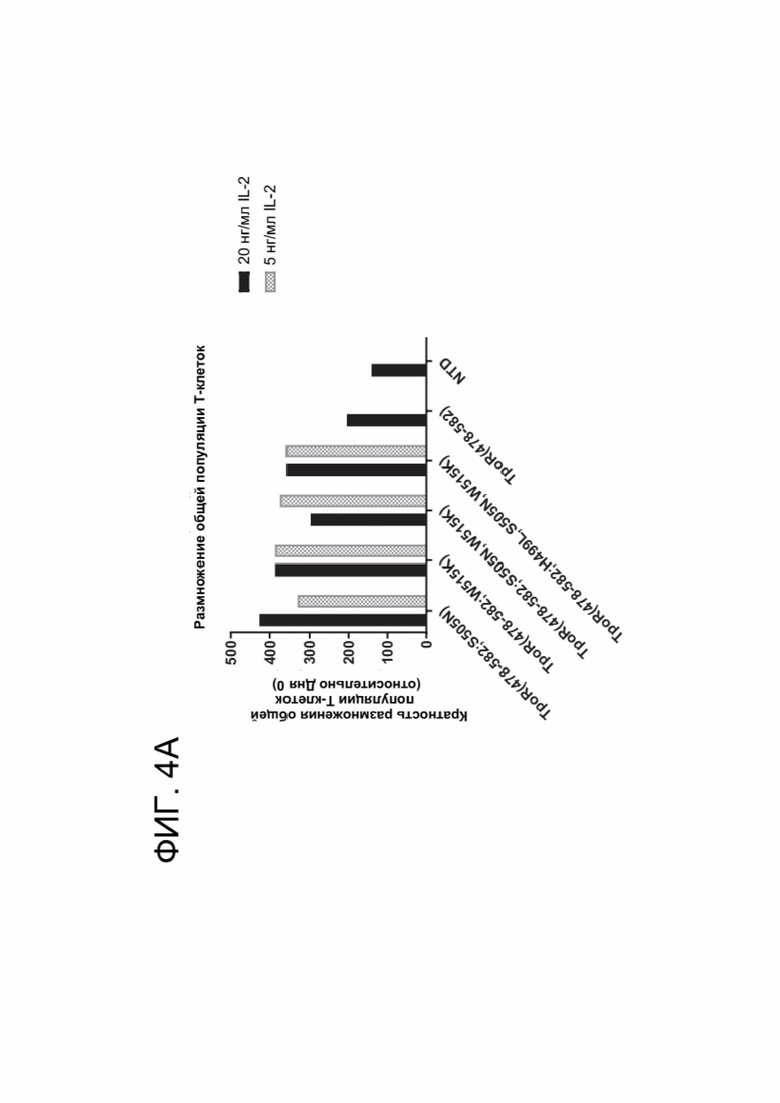
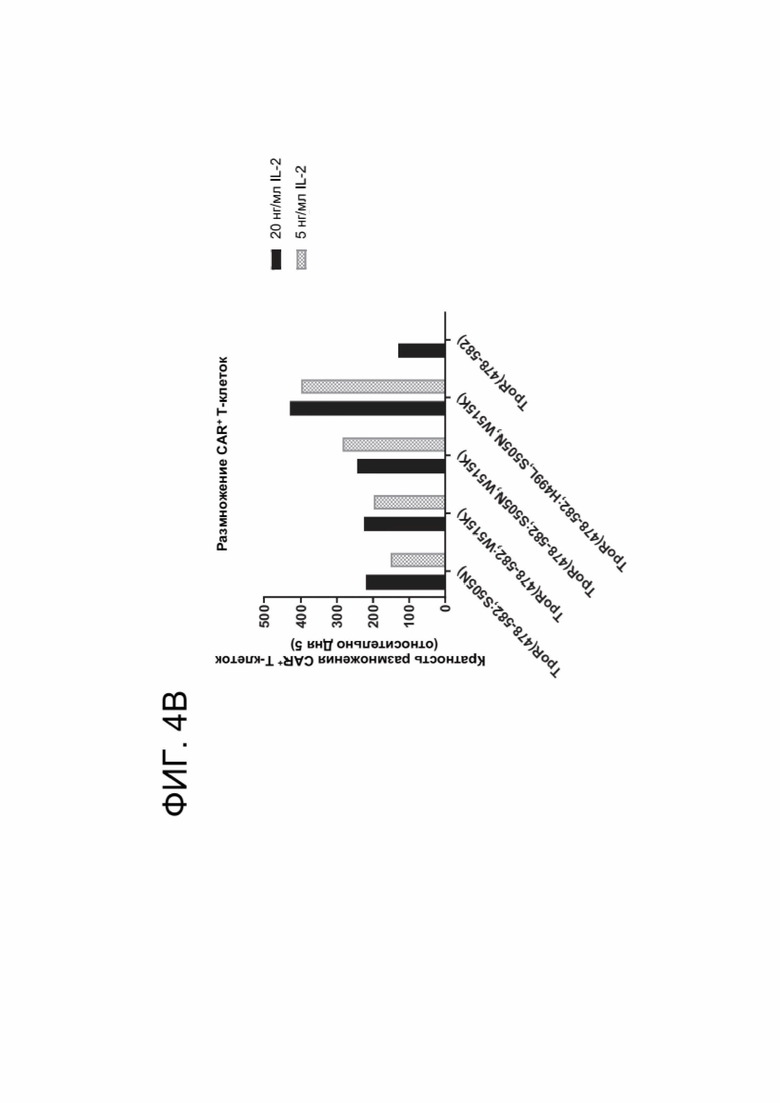
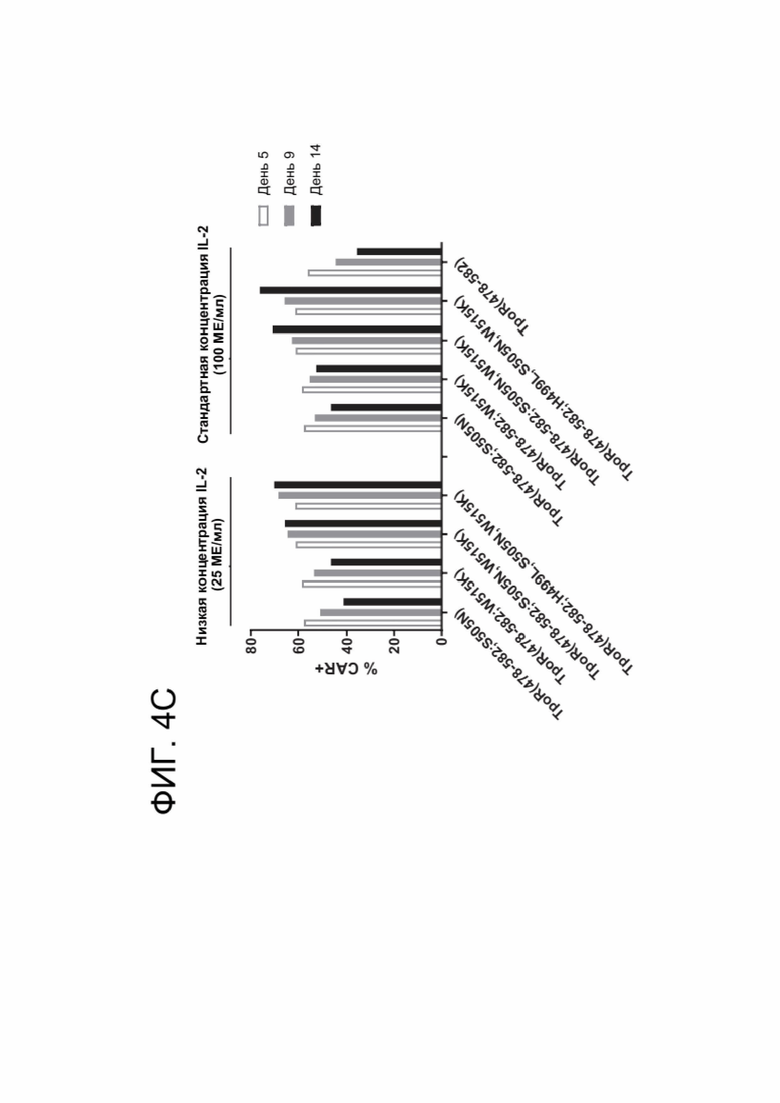
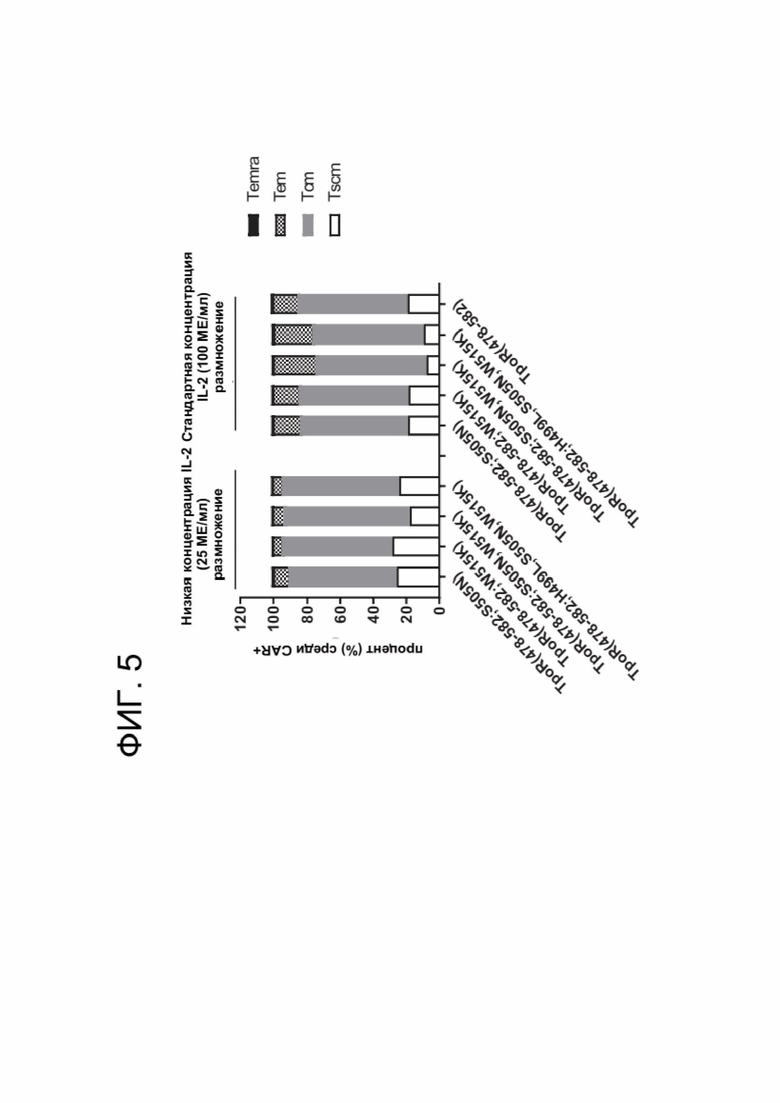
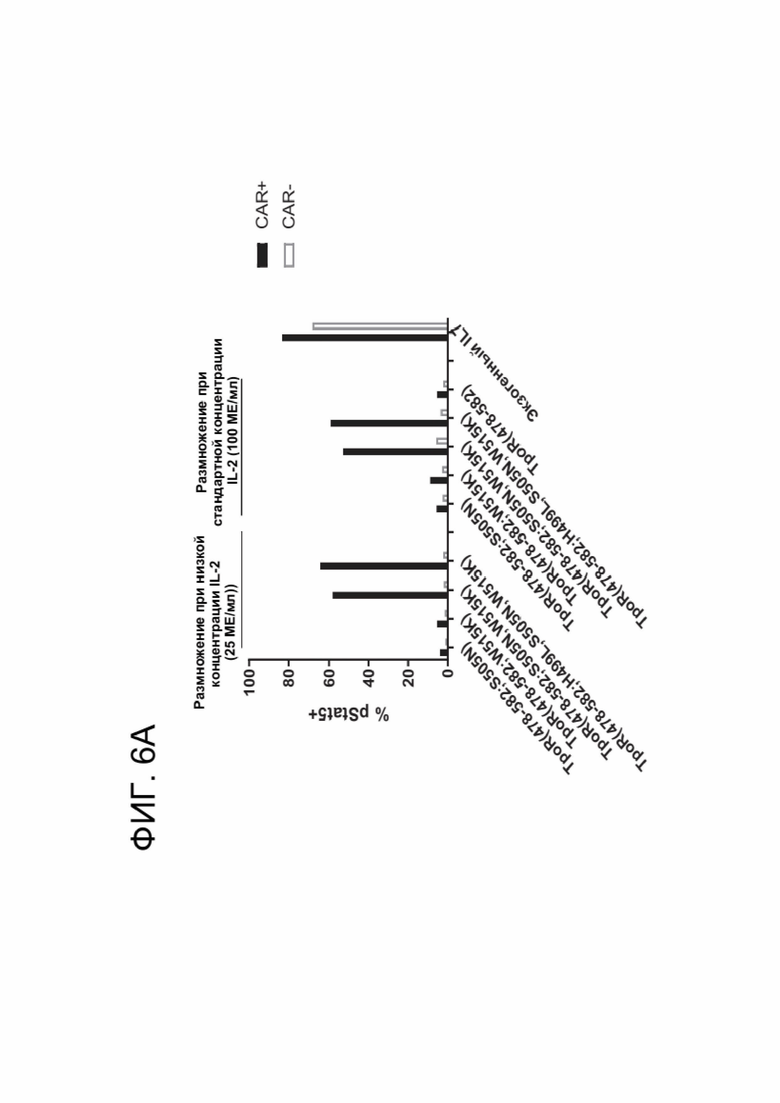
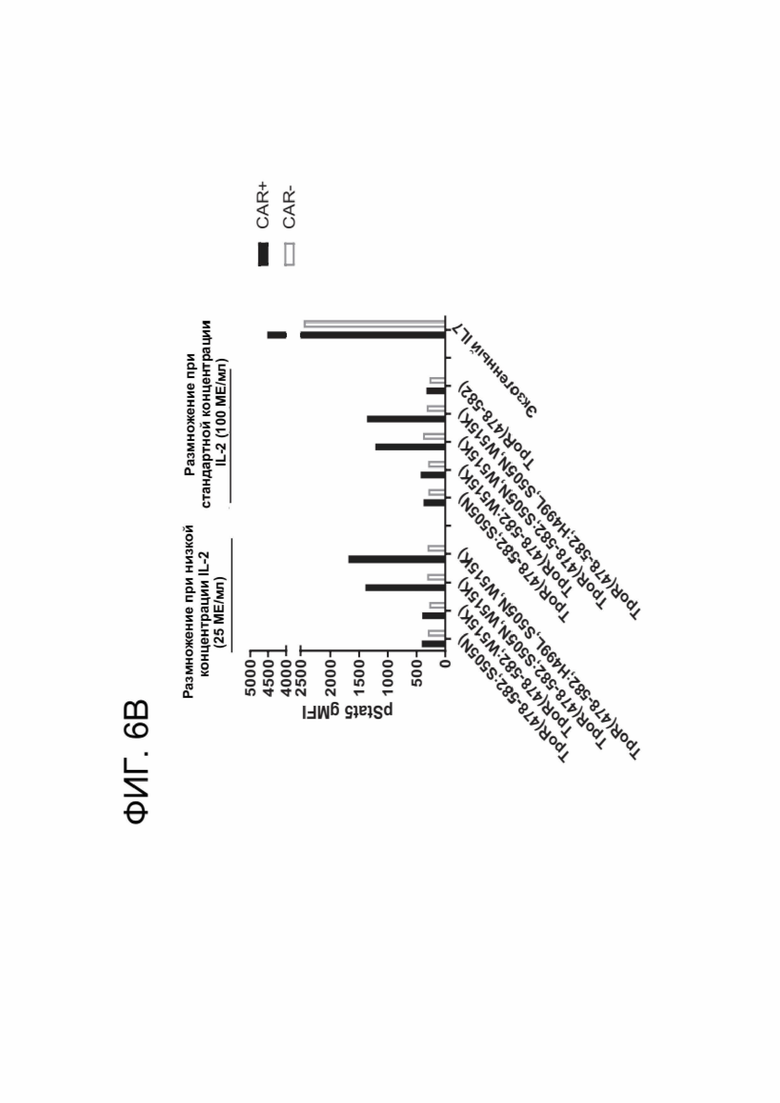
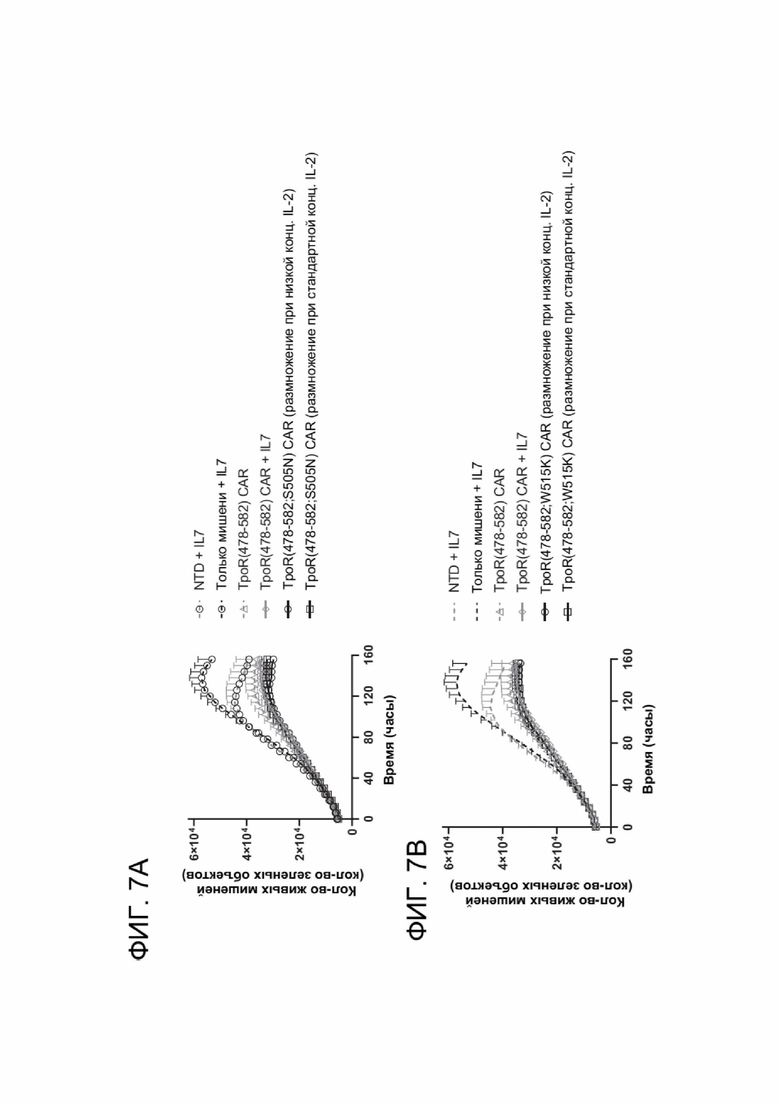
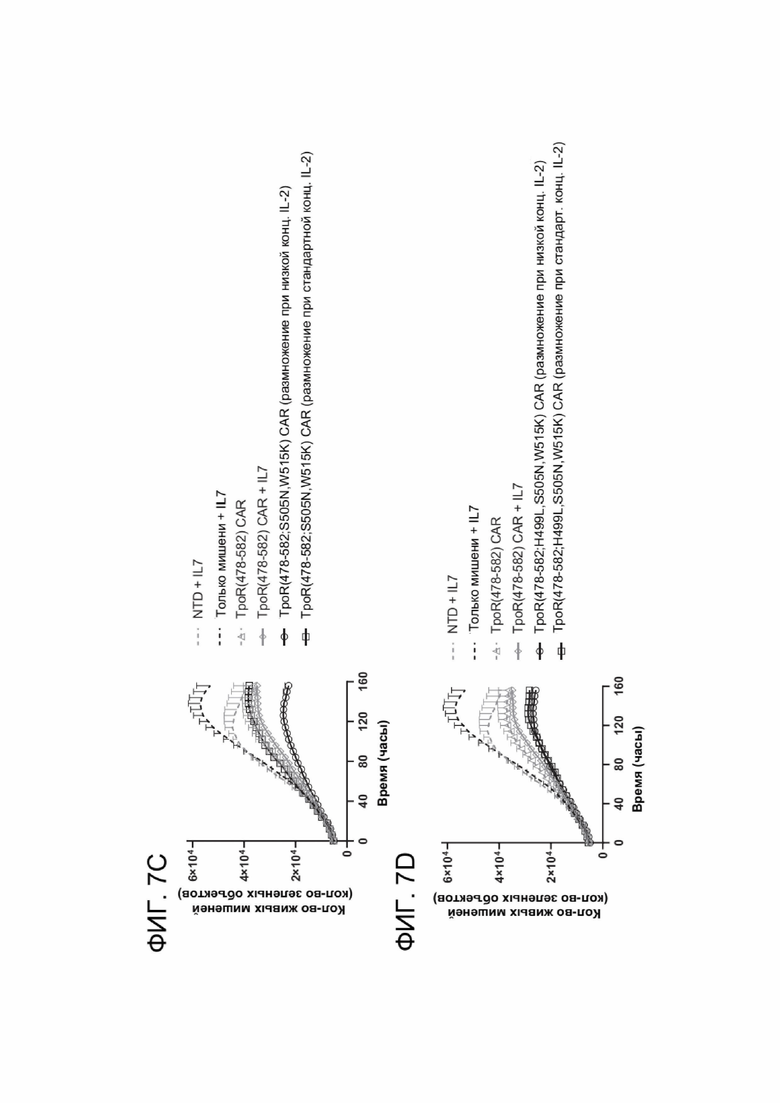
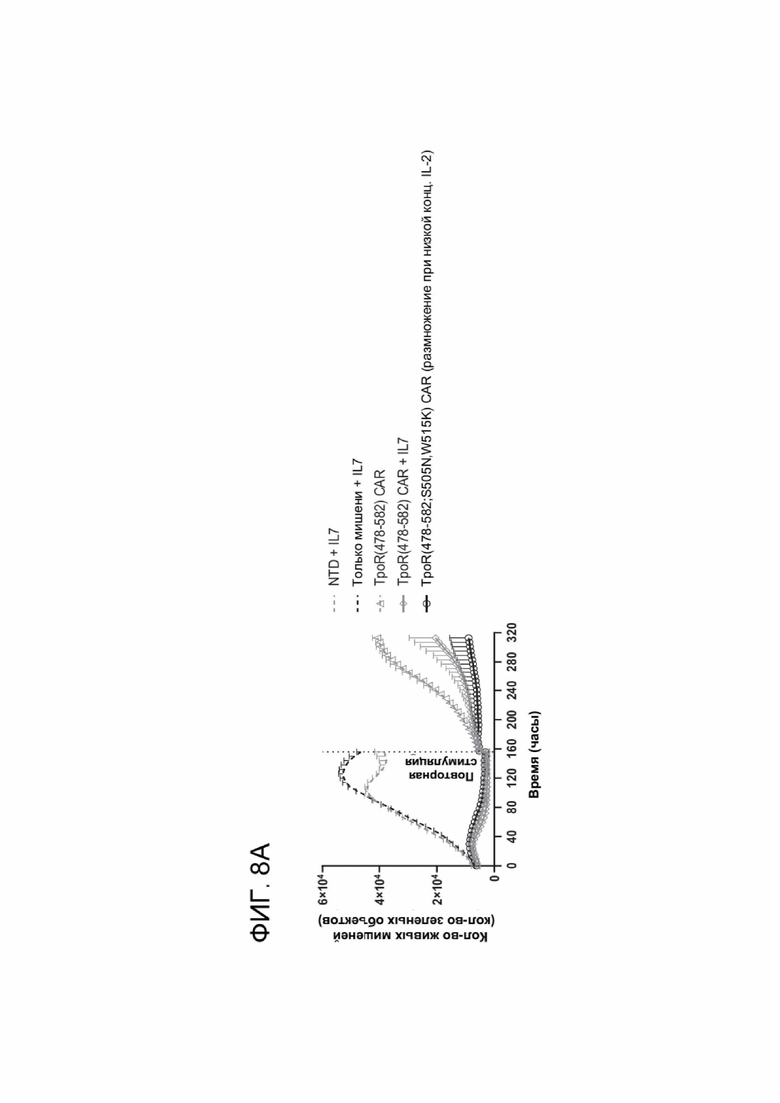
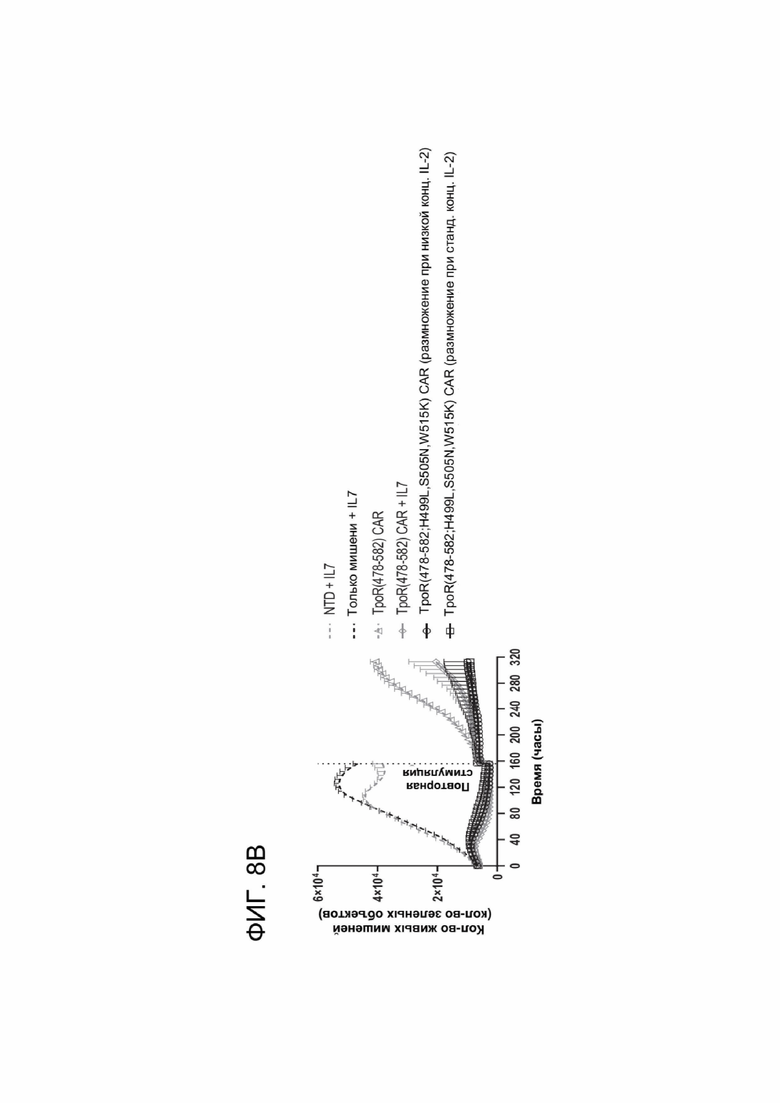
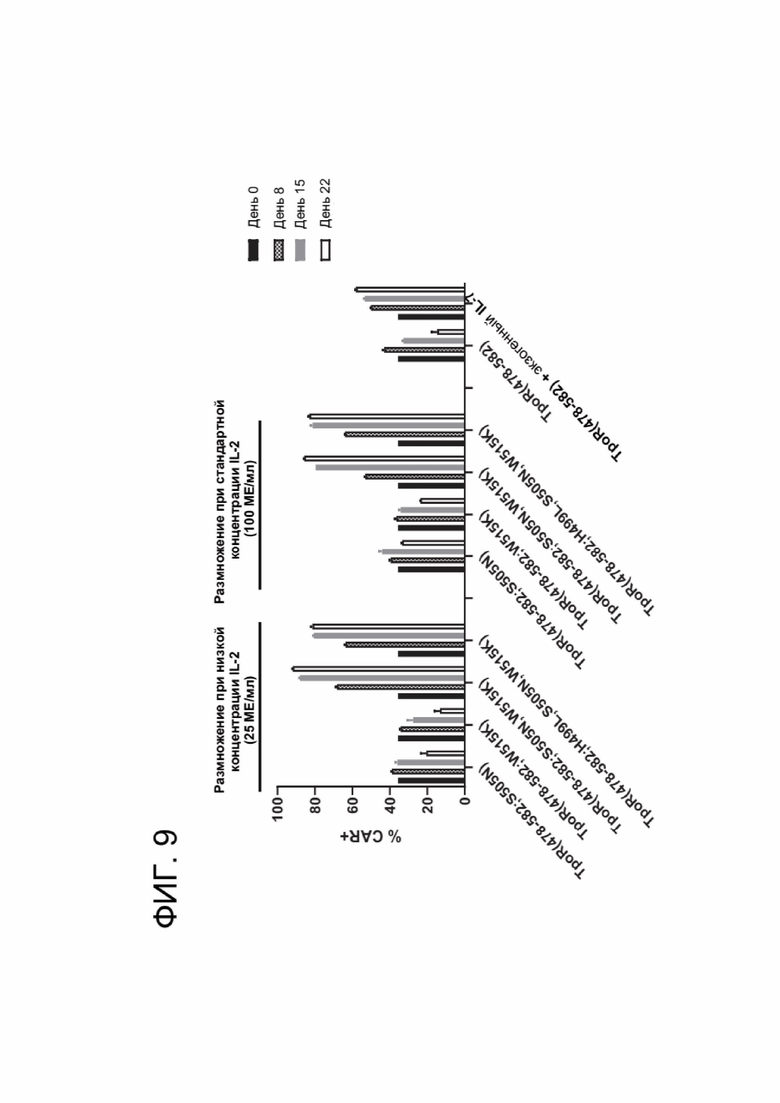
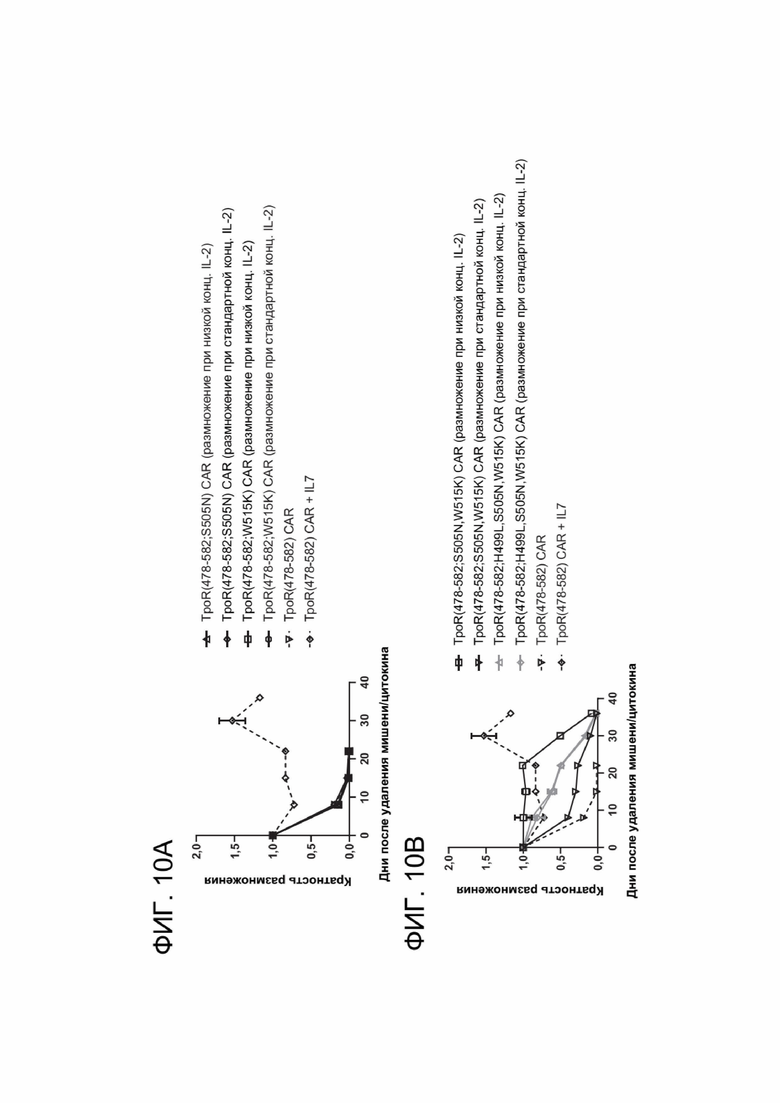
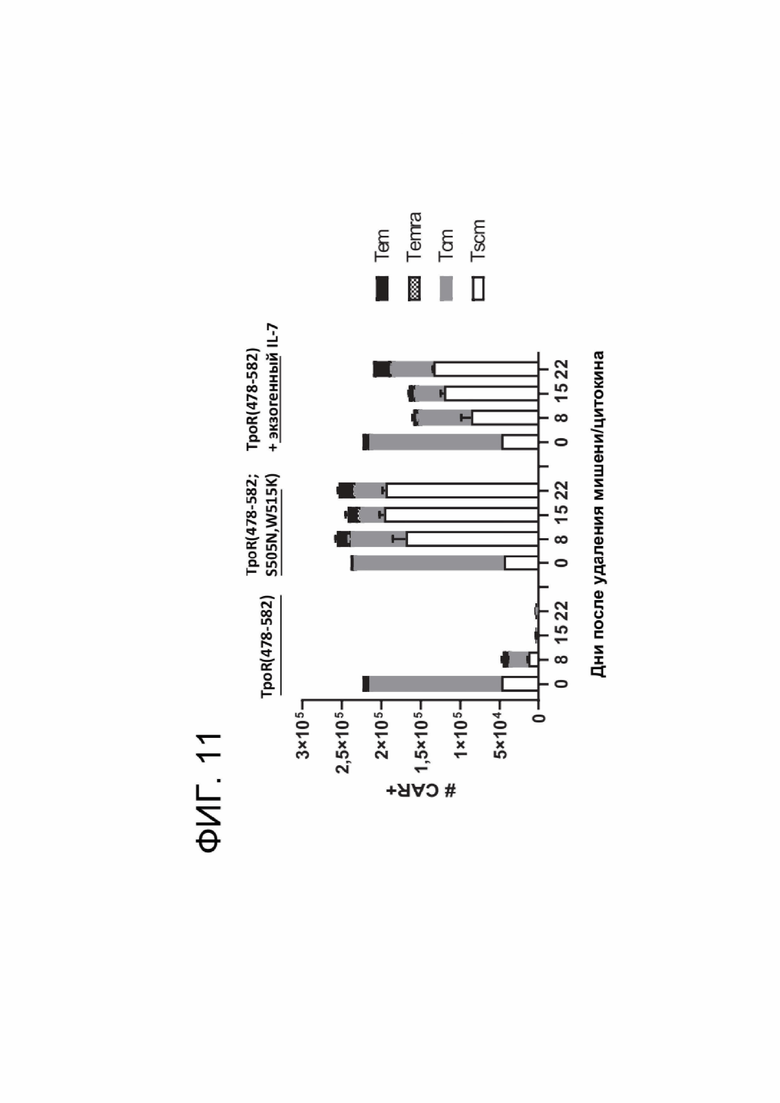
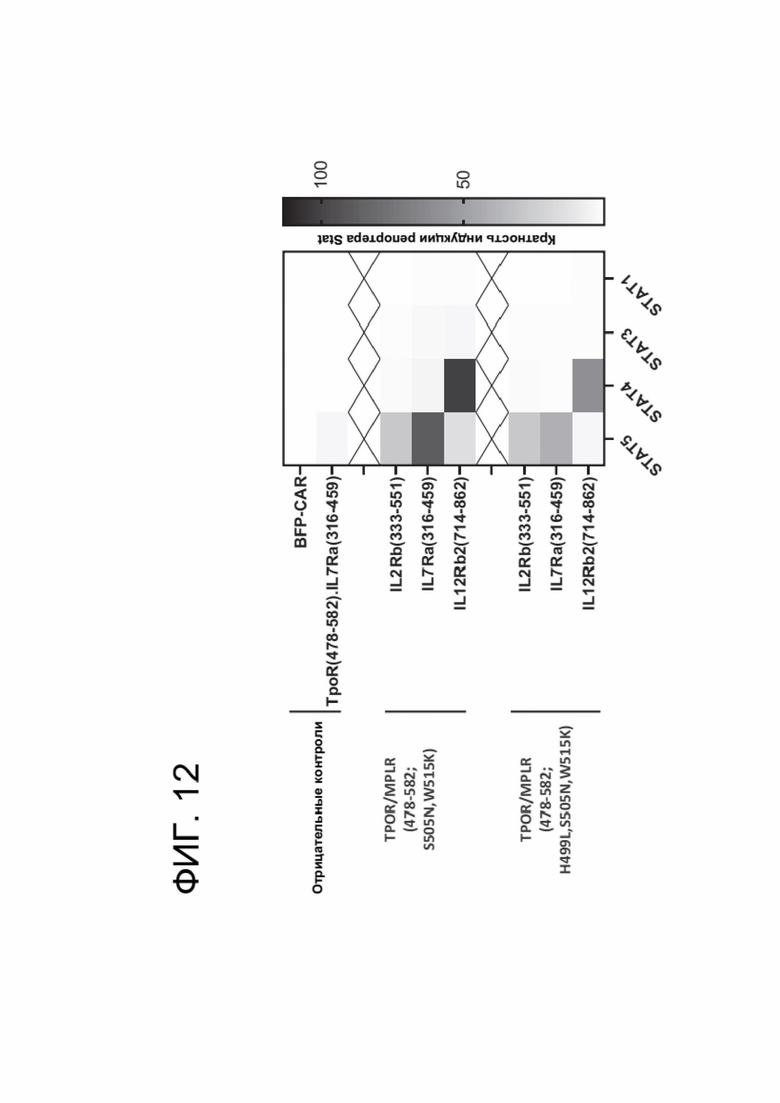
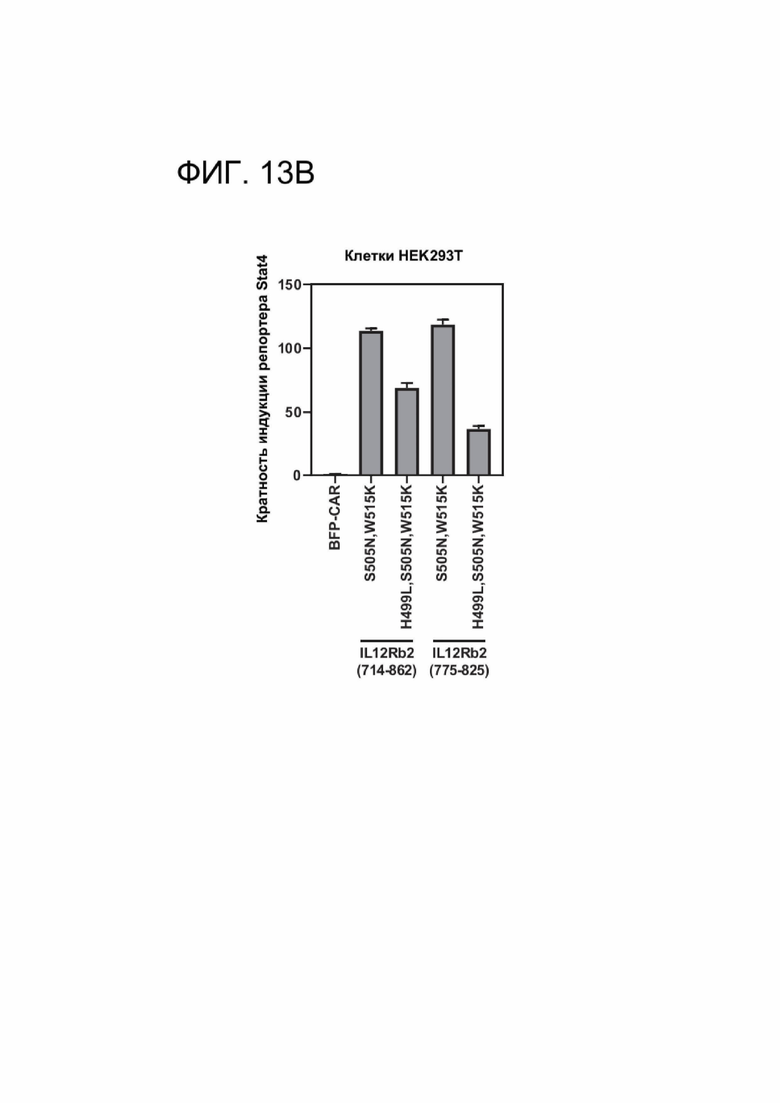
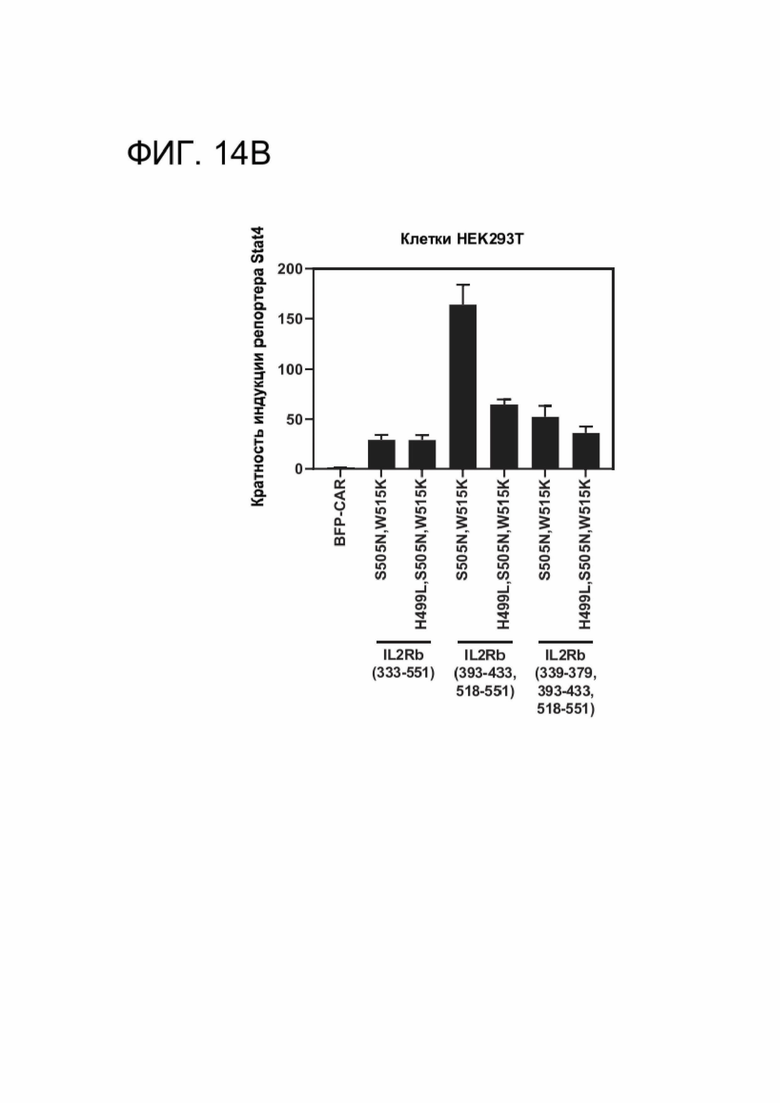
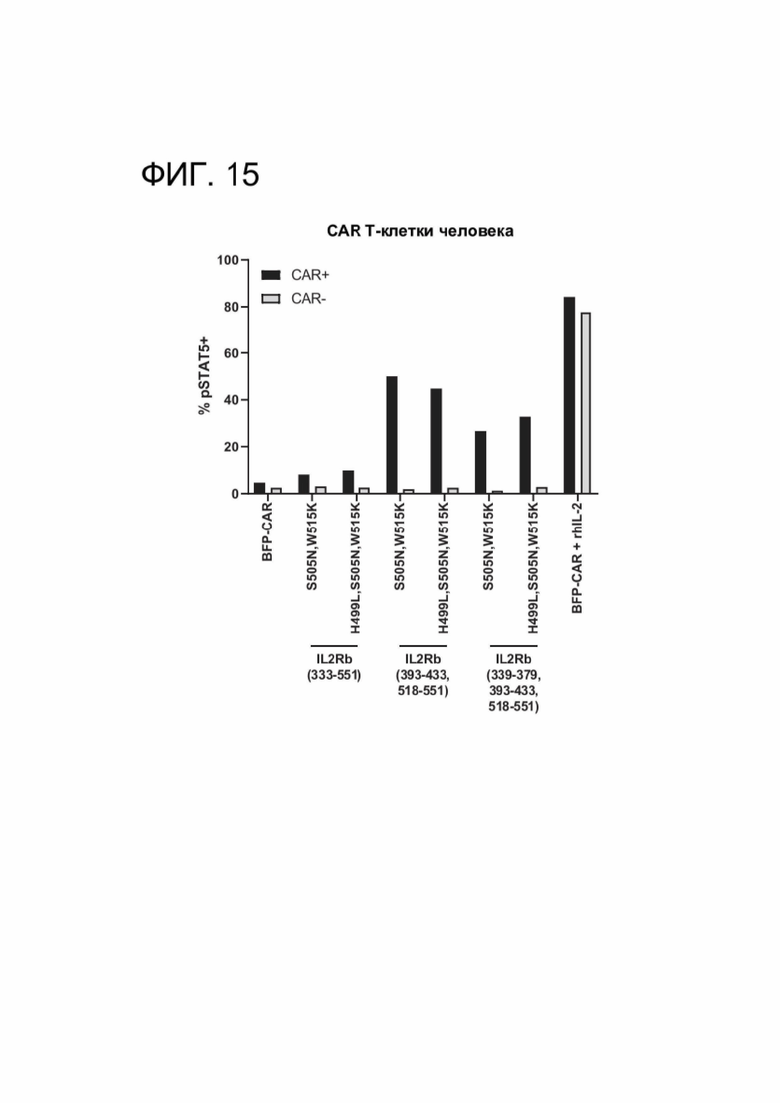
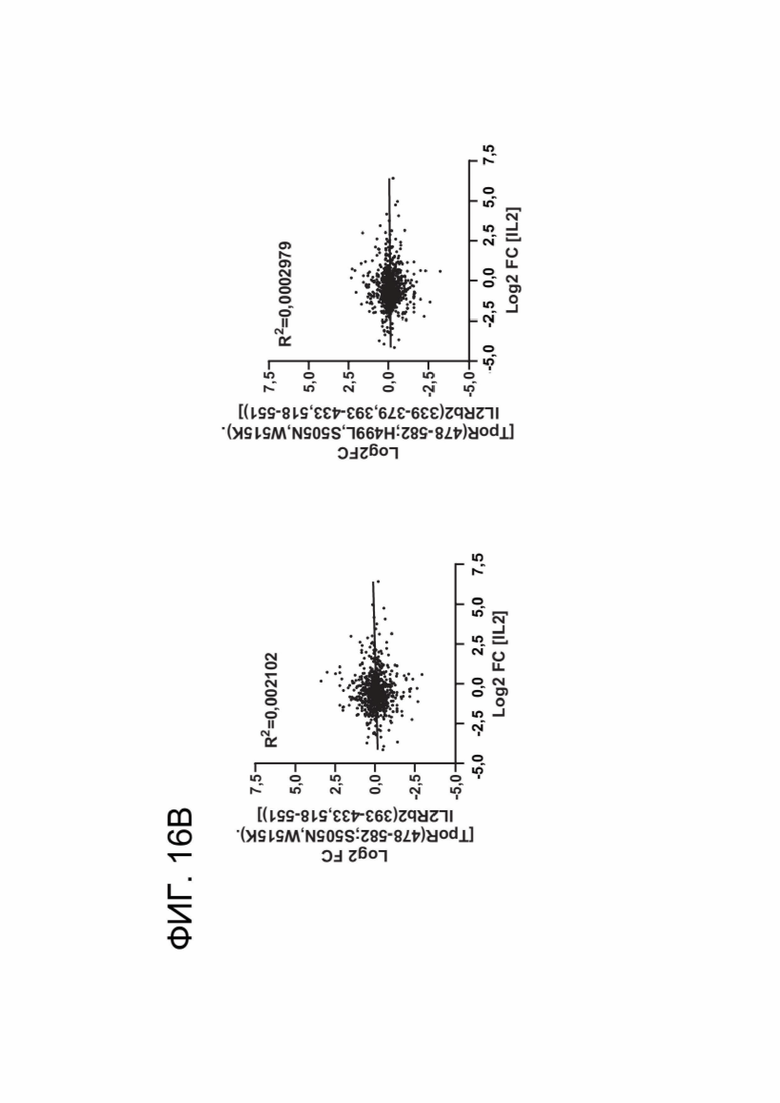
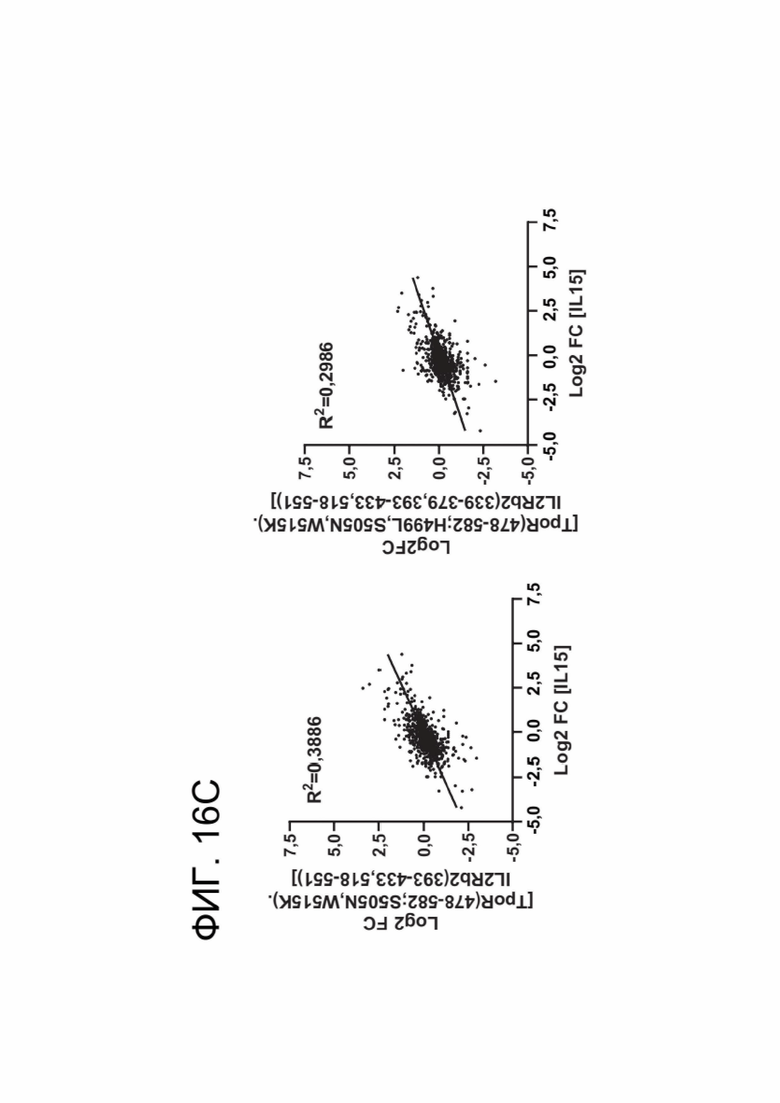
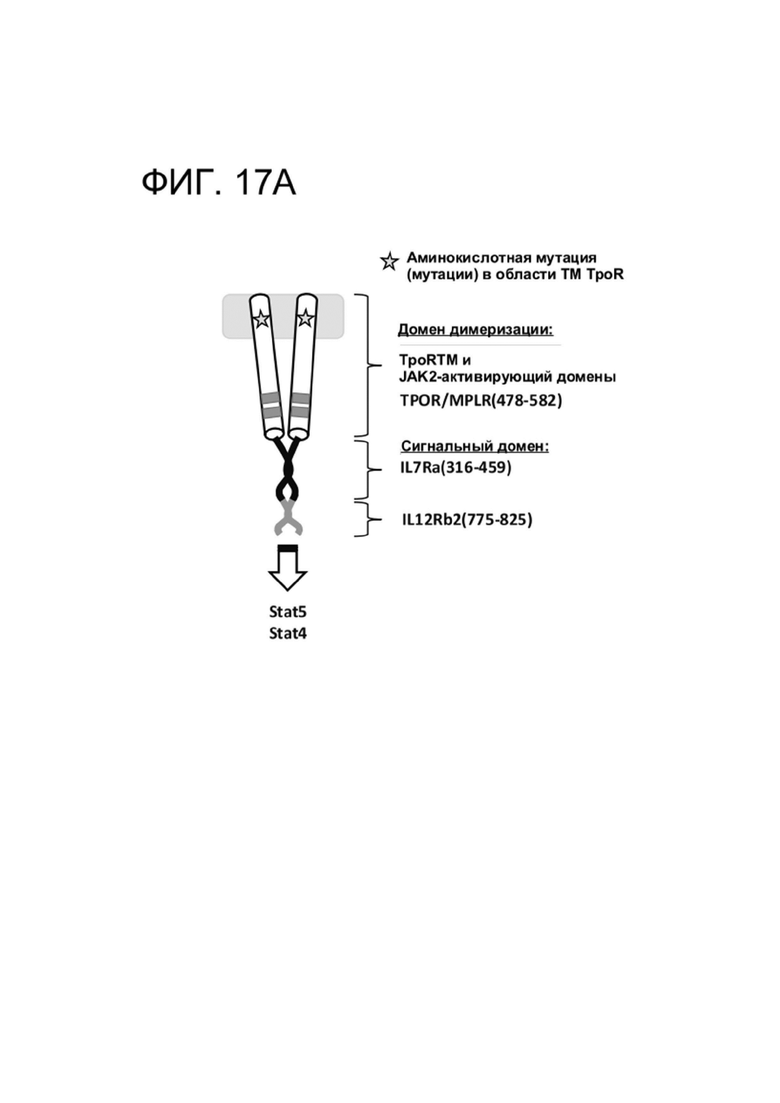
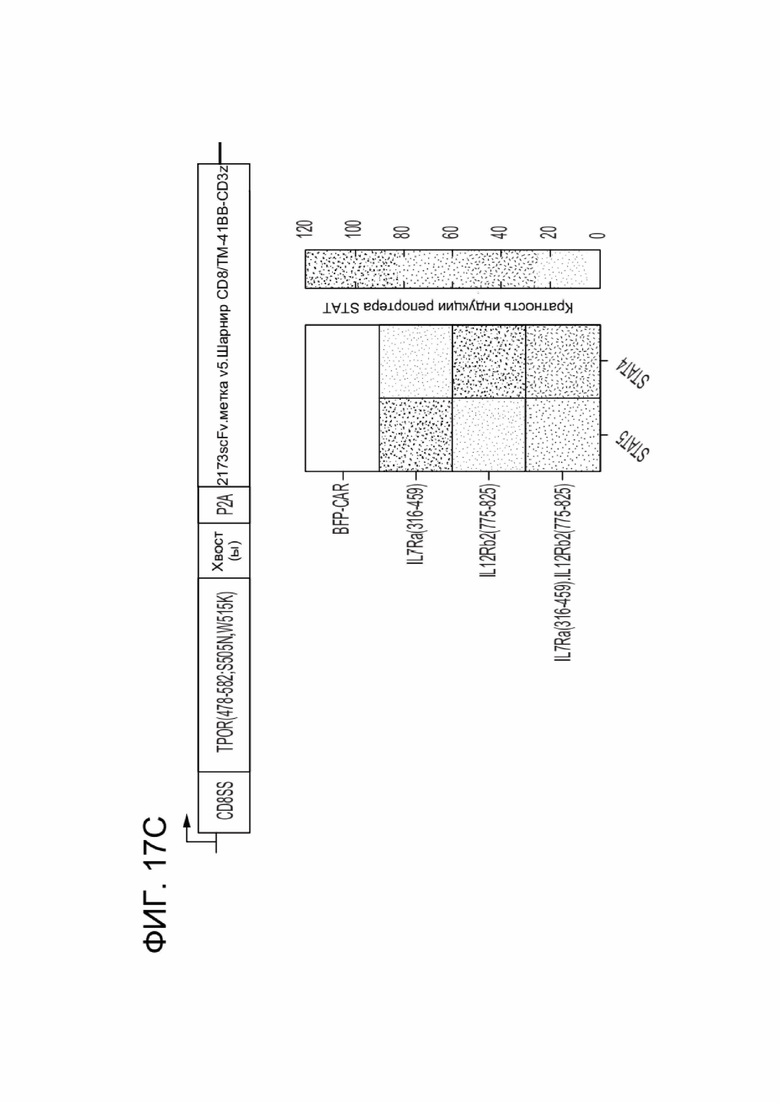
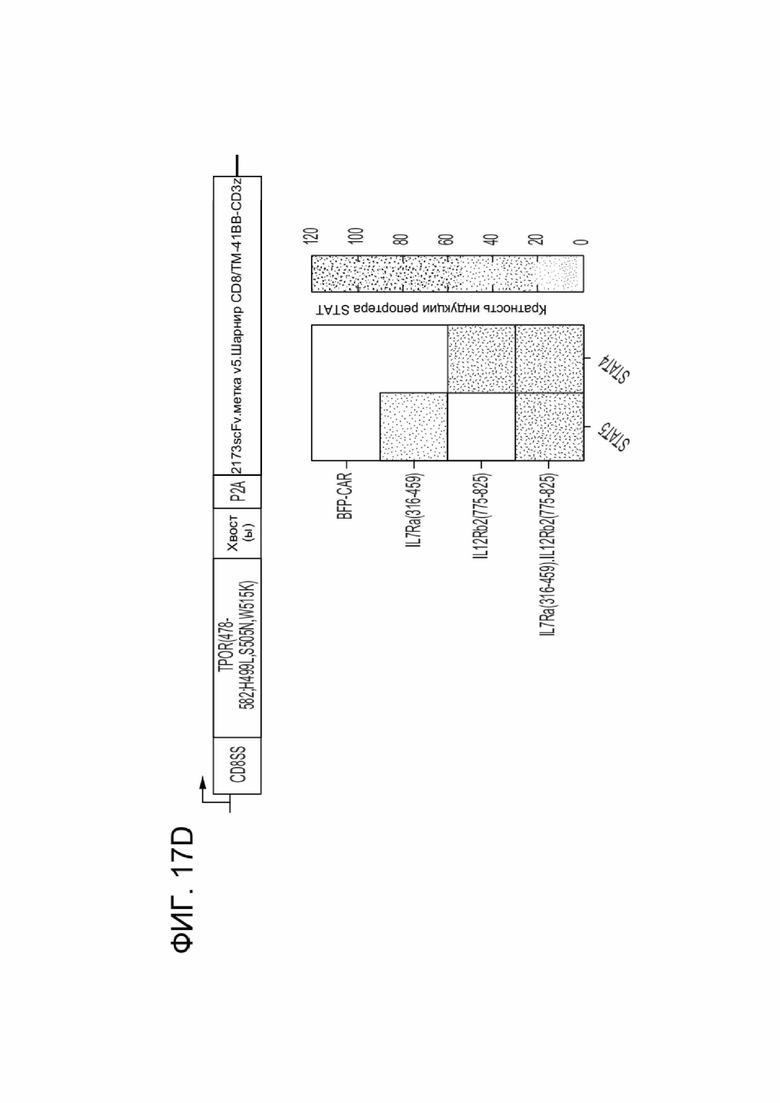
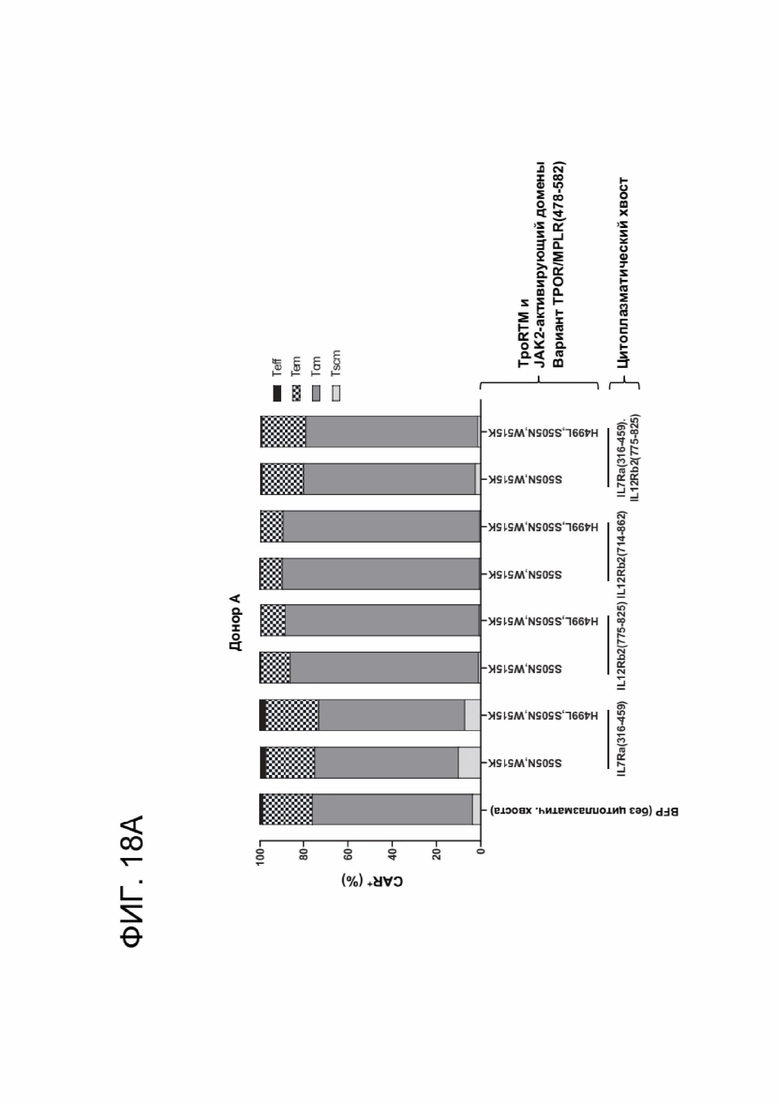
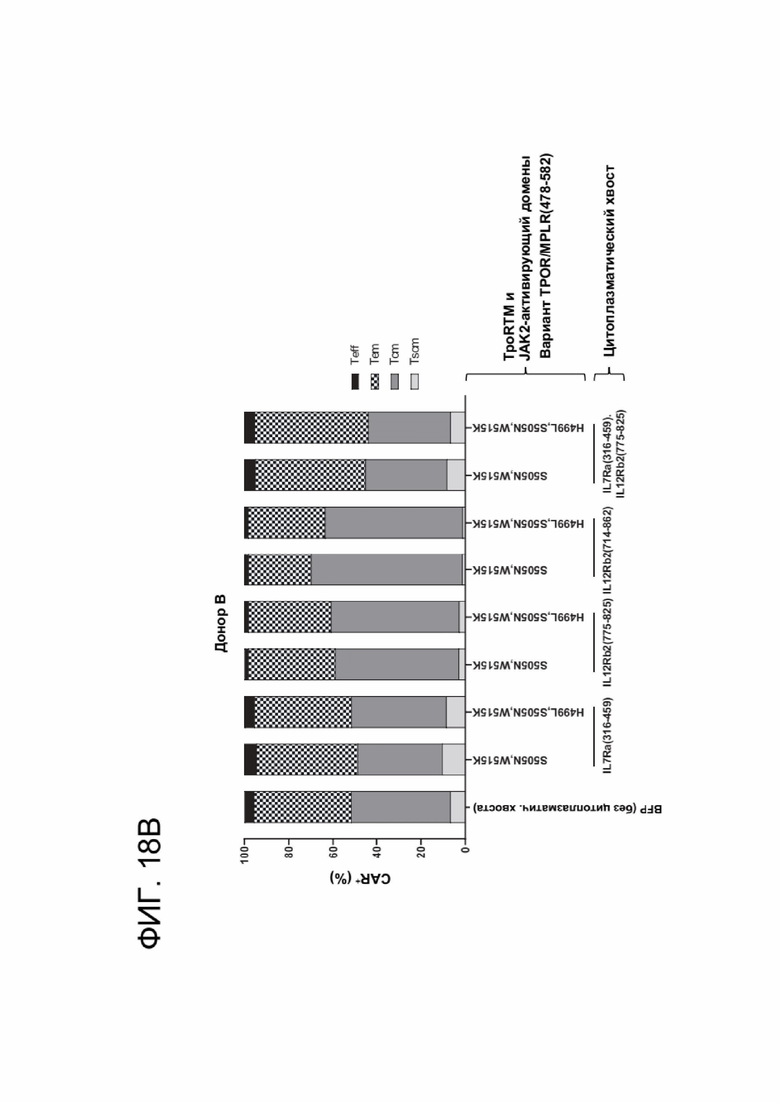
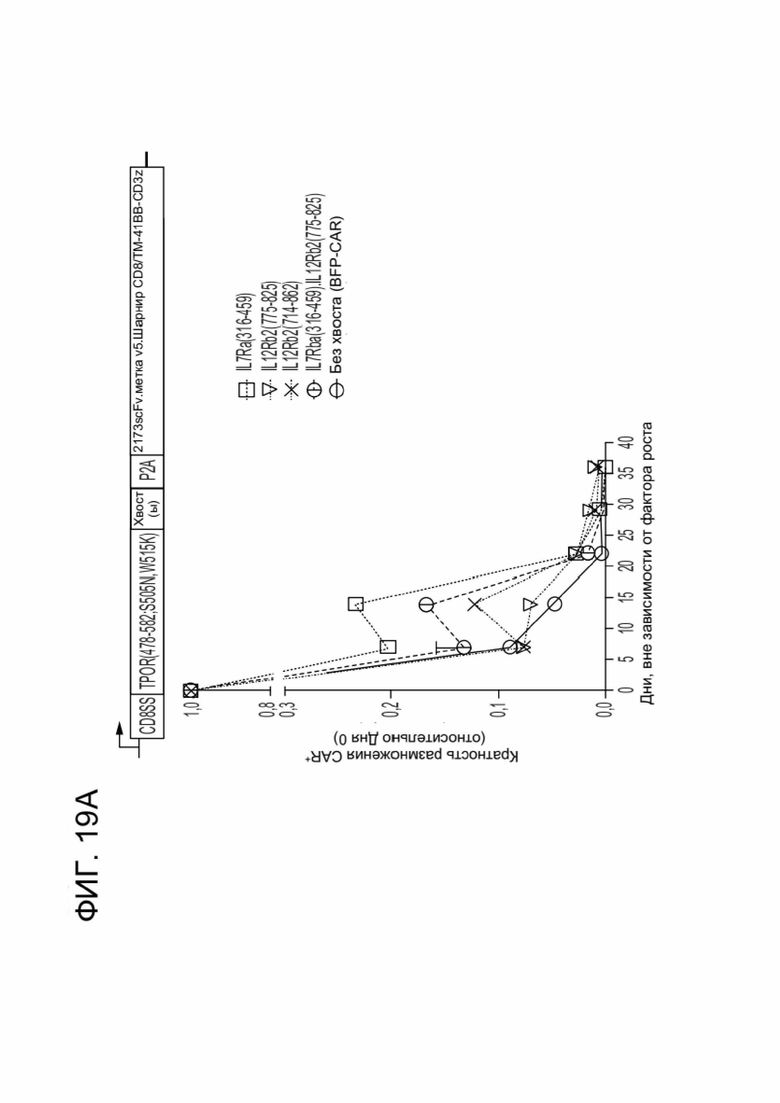
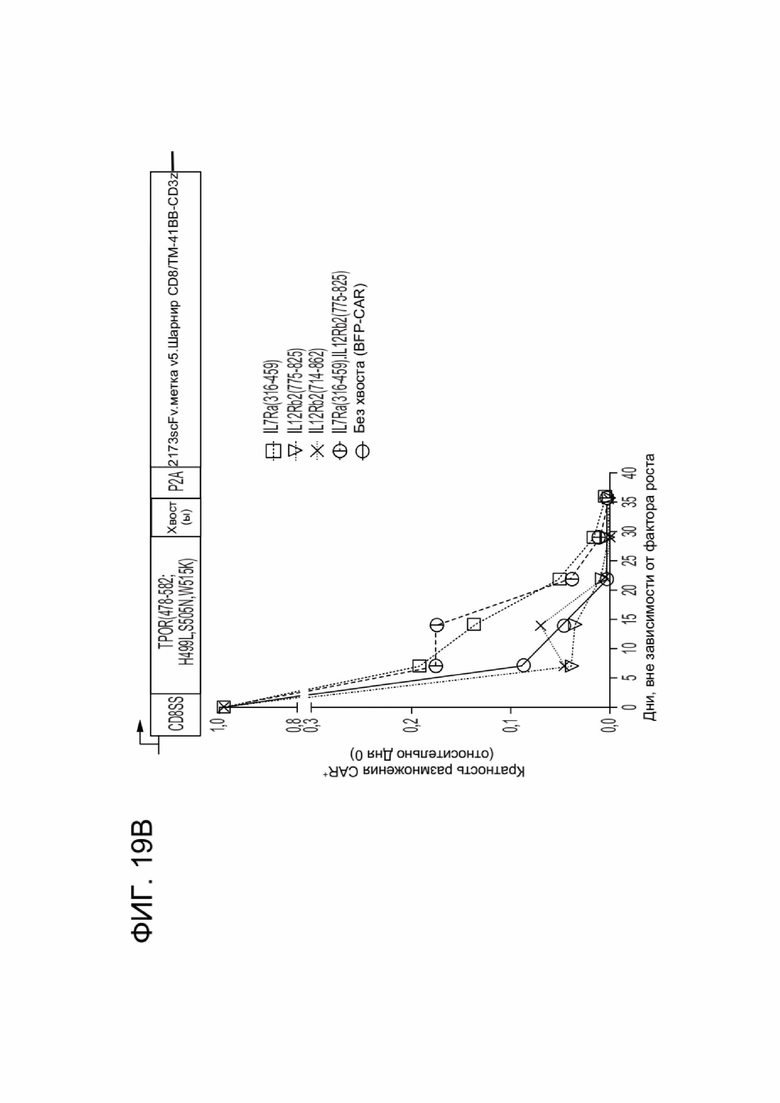
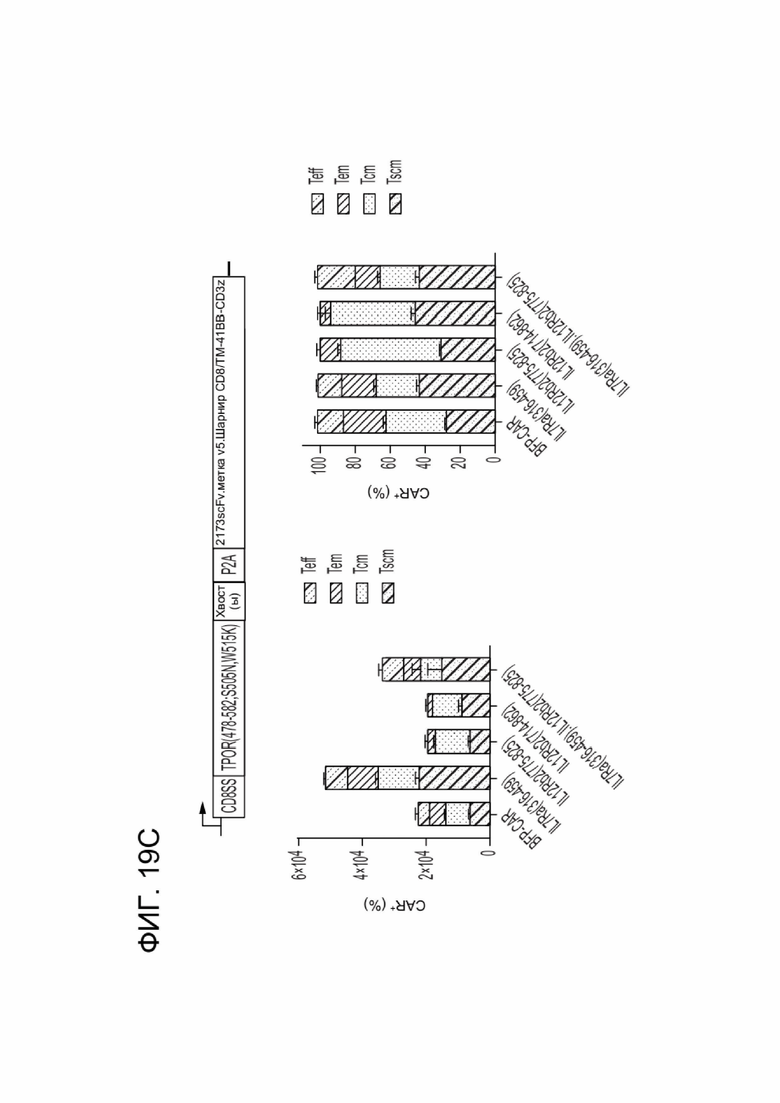
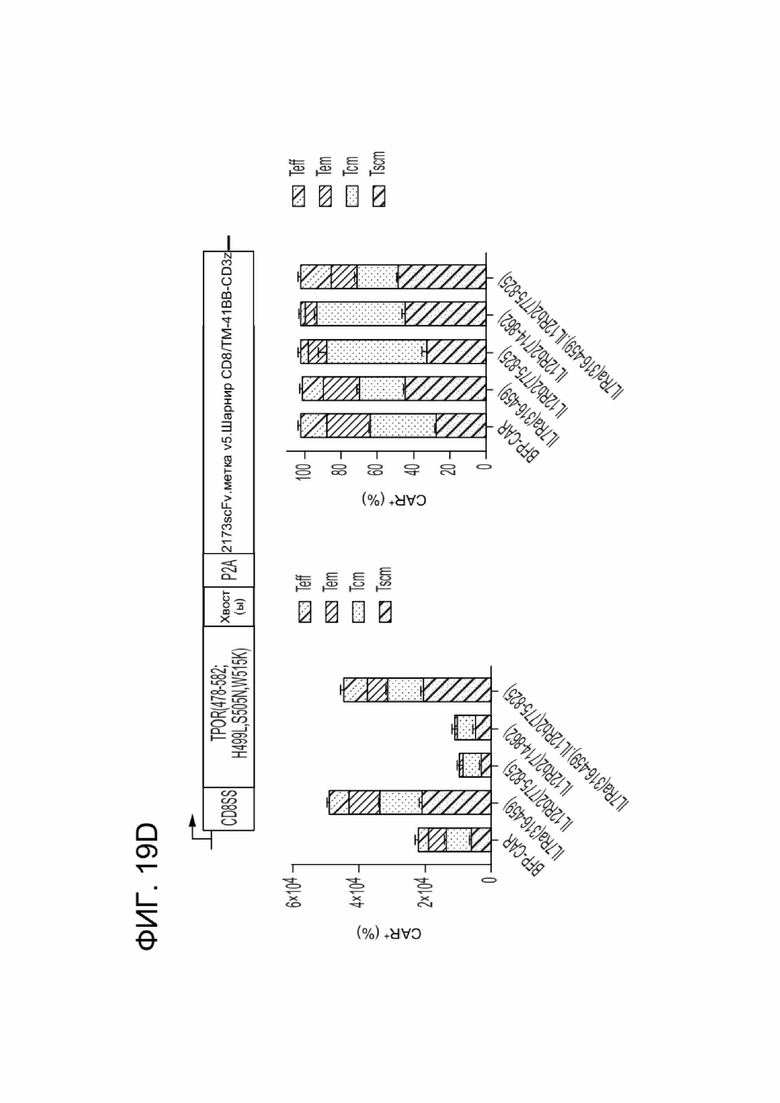
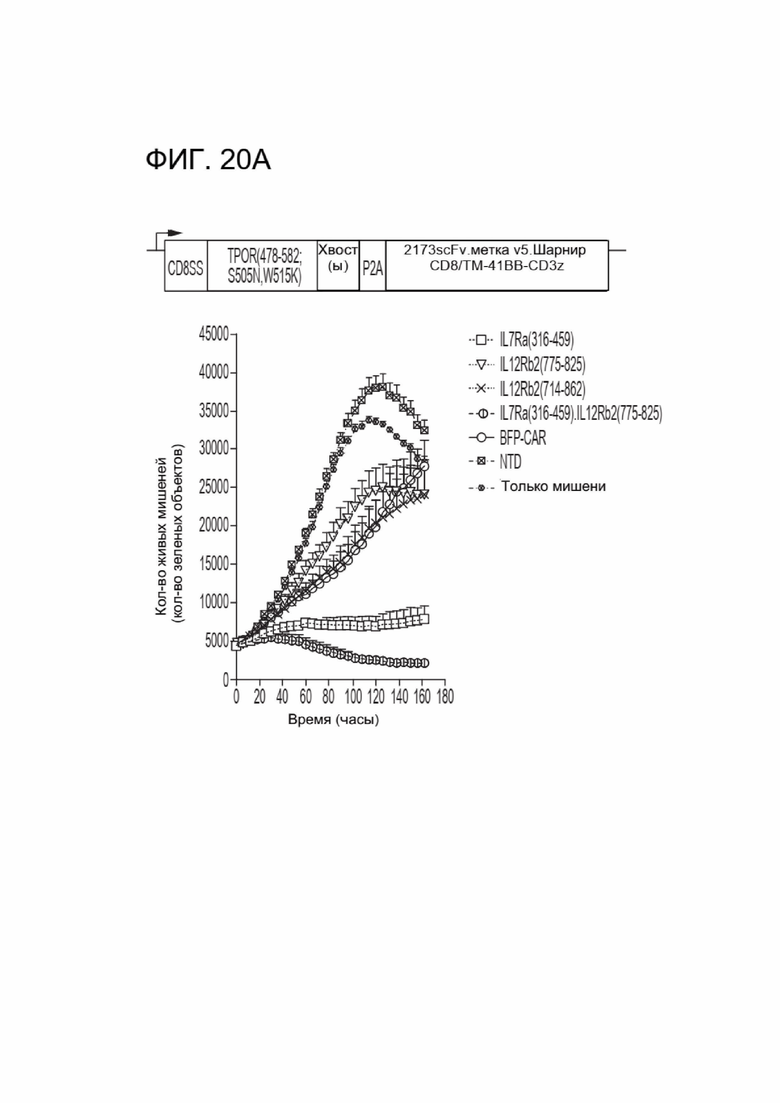
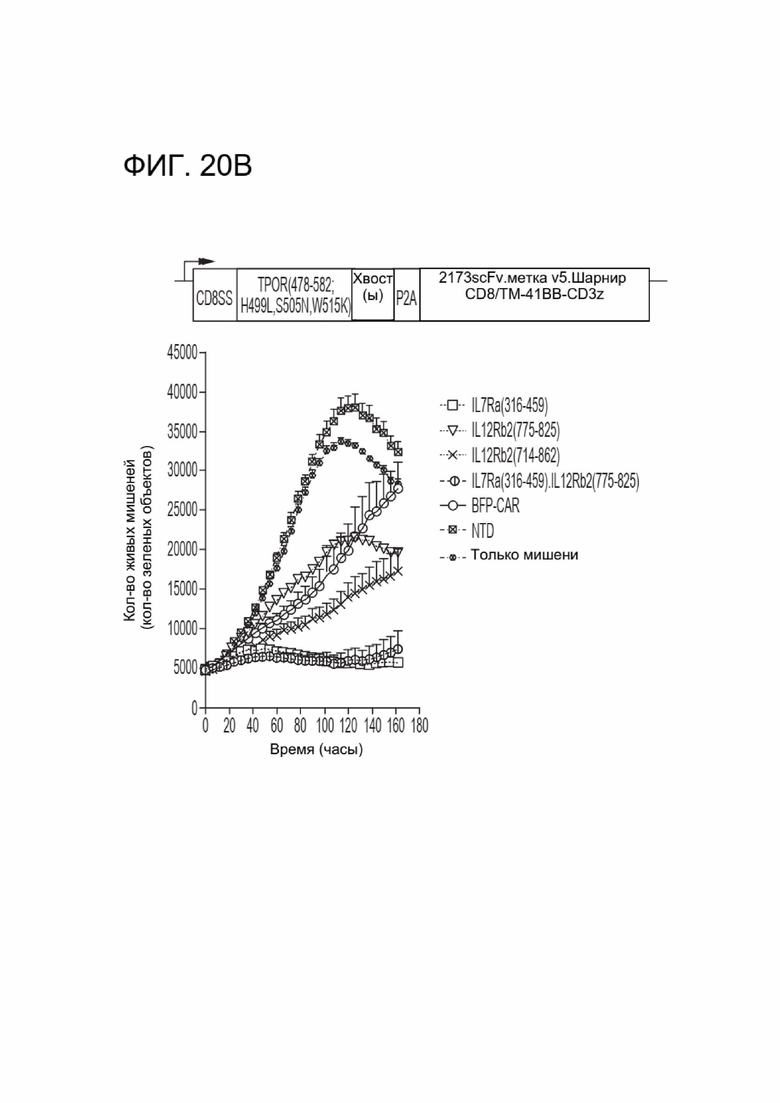
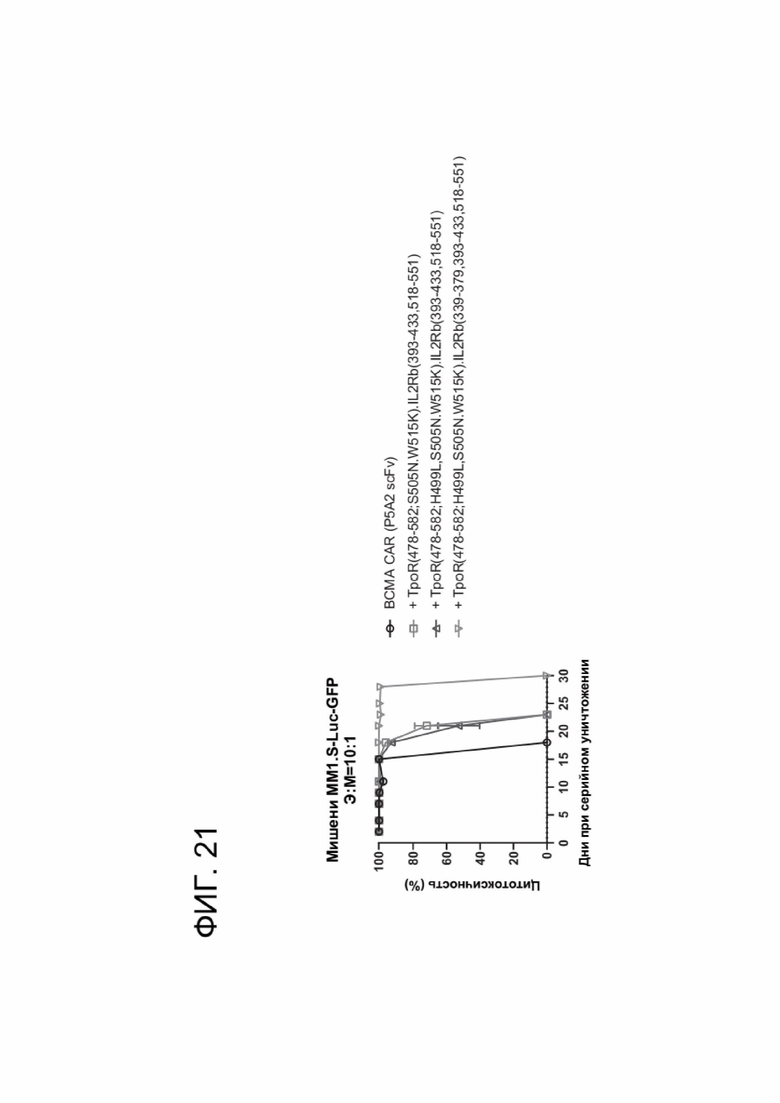
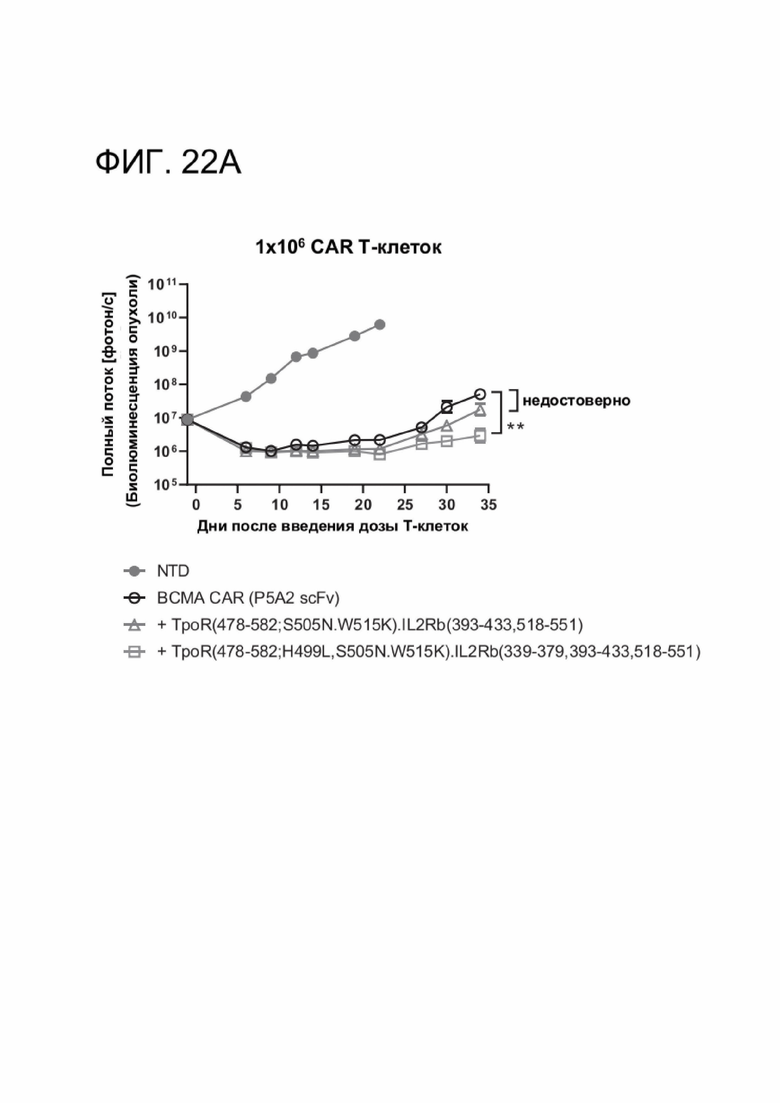
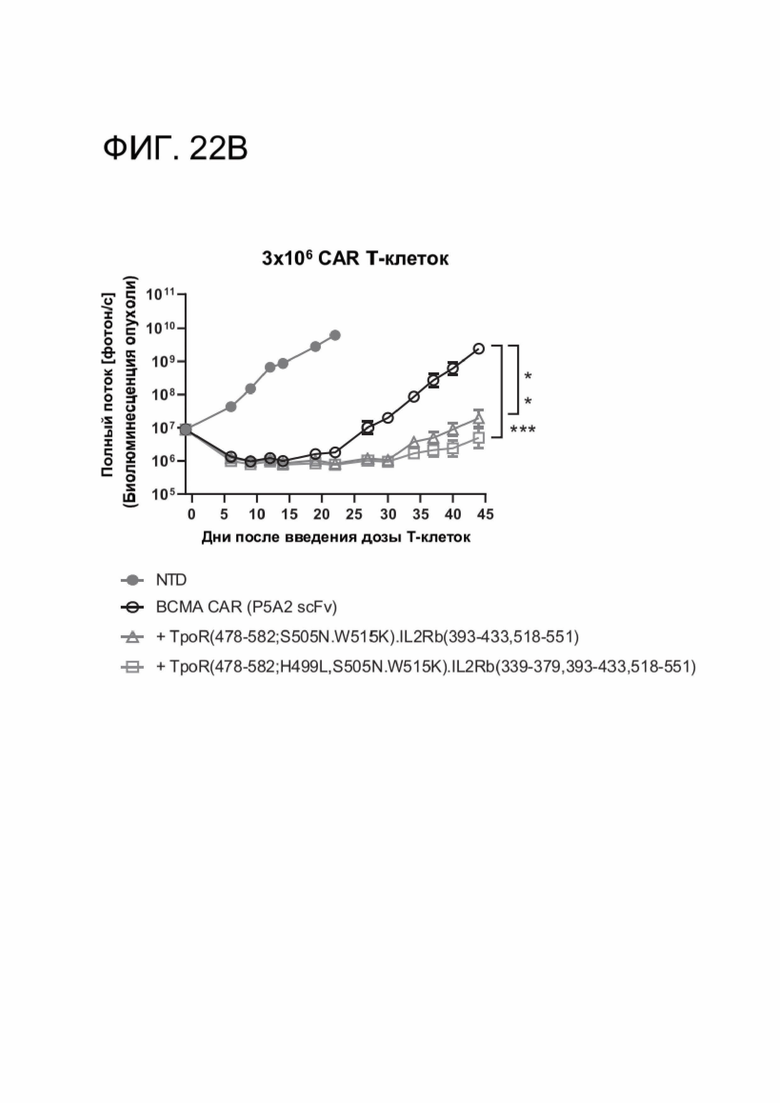
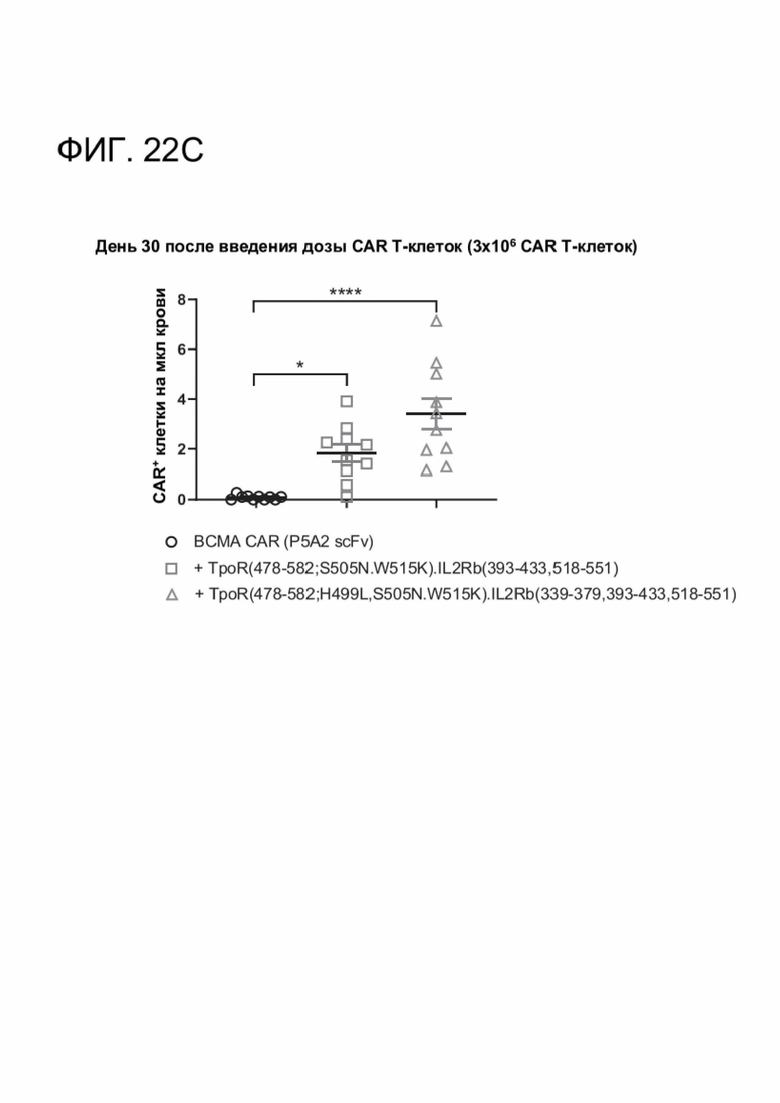
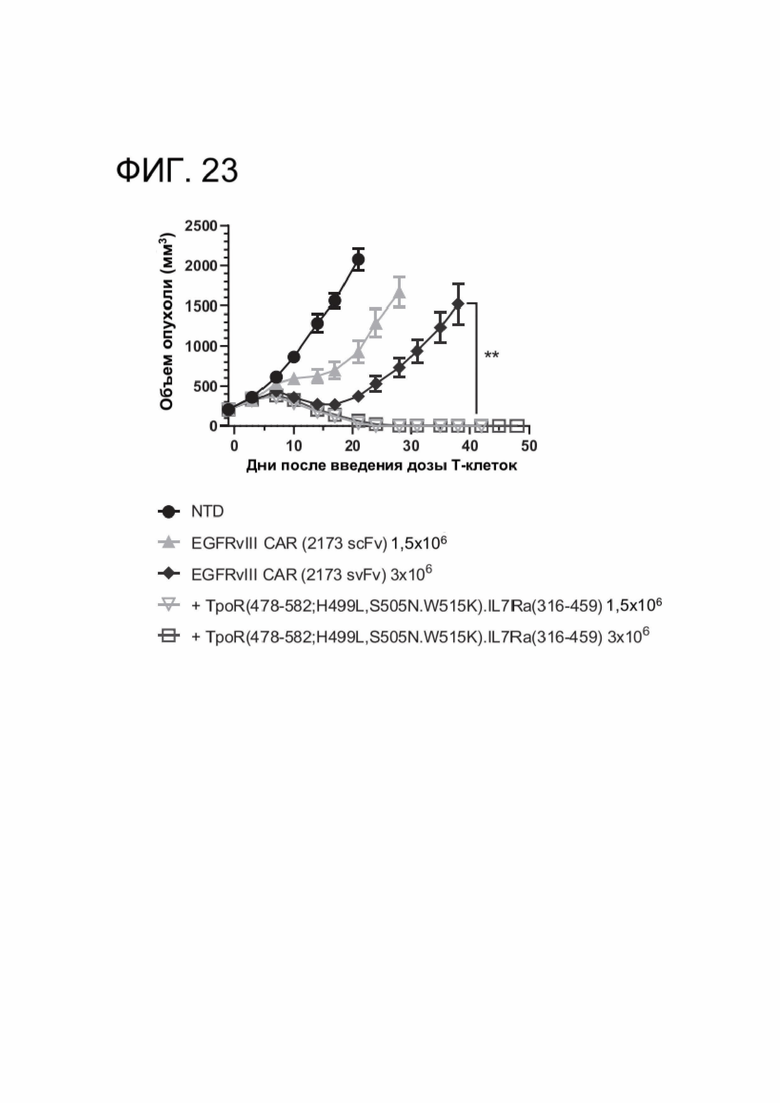
Группа изобретений относится к биотехнологии. Представлен конститутивно активный химерный цитокиновый рецептор (CACCR) для увеличения цитотоксичности сконструированной иммунной клетки, причем CACCR состоит из двух мономеров, где каждый мономер содержит: трансмембранный домен рецептора тромбопоэтина (TpoR), содержащий аминокислоты 478-582 из SEQ ID NO: 6 с аминокислотными заменами S505N и W515K согласно SEQ ID NO: 6, домен, связывающий янус-киназу (JAK) и внутриклеточный домен привлечения STAT. Также раскрыты: полинуклеотид, кодирующий CACCR, вектор экспрессии, сконструированные Т-клетки, обладающие увеличенной цитотоксичностью и способ их получения, фармацевтическая композиция и набор для лечения рака у субъекта. Также раскрыто применение терапевтически эффективного количества сконструированных Т-клеток или фармацевтической композиции для лечения рака у субъекта. Изобретение обеспечивает повышенную активацию, пролиферацию, устойчивость и/или активность иммунных клеток и применяется для лечения рака у субъекта, в частности для лечения солидной опухоли или гемабластоза. 9 н. и 36 з.п. ф-лы, 23 ил., 8 табл., 12 пр.
1. Конститутивно активный химерный цитокиновый рецептор (CACCR) для увеличения цитотоксичности сконструированной иммунной клетки, причем CACCR состоит из двух мономеров, причем каждый мономер содержит:
a. трансмембранный домен рецептора тромбопоэтина (TpoR), содержащий аминокислоты 478-582 из SEQ ID NO: 6 с аминокислотными заменами S505N и W515K согласно SEQ ID NO: 6;
b. домен, связывающий янус-киназу (JAK); и
c. внутриклеточный домен привлечения STAT,
при этом указанные мономеры конститутивно димеризованы.
2. CACCR по п. 1, отличающийся тем, что указанный JAK-связывающий домен содержит JAK1-связывающий домен.
3. CACCR по п. 1, отличающийся тем, что указанный JAK-связывающий домен содержит JAK2-связывающий домен.
4. CACCR по п. 1, отличающийся тем, что указанный JAK-связывающий домен содержит JAK3-связывающий домен.
5. CACCR по п. 1, отличающийся тем, что указанный JAK-связывающий домен содержит TYK2-связывающий домен.
6. CACCR по любому из пп. 1-5, отличающийся тем, что указанный JAK-связывающий домен содержит одну из трансмембранных аминокислотных последовательностей, выбранных из SEQ ID NО: 12 и 13.
7. CACCR по любому из пп. 1-6, отличающийся тем, что указанный домен привлечения STAT содержит домен привлечения STAT, выбранный из домена привлечения STAT-1, STAT-2, STAT-3, STAT-4, STAT-5, STAT-6 или STAT-7 по меньшей мере из одного рецептора.
8. CACCR по любому из пп. 1-7, отличающийся тем, что домен привлечения STAT содержит более чем один из домена привлечения STAT-1, STAT-2, STAT-3, STAT-4, STAT-5, STAT-6 или STAT-7 по меньшей мере из одного рецептора.
9. CACCR по любому из пп. 1-7, отличающийся тем, что указанный трансмембранный домен и JAK-связывающий домен происходит из рецептора TPOR/MPLR.
10. CACCR по п. 1, отличающийся тем, что мономеры способны (i) к спонтанной димеризации или (ii) могут активировать передачу сигналов в отсутствие какой-либо экзогенной стимуляции или лиганда.
11. CACCR по п. 1, отличающийся тем, что указанный трансмембранный домен TPOR/MPLR дополнительно содержит аминокислотную замену H499L.
12. CACCR по п. 1, отличающийся тем, что указанный трансмембранный домен TPOR/MPLR дополнительно содержит аминокислотную замену G509N.
13. CACCR по п. 1, отличающийся тем, что указанный трансмембранный домен TPOR/MPLR дополнительно содержит аминокислотные замены H499L и G509N.
14. CACCR по любому из пп. 11-13, отличающийся тем, что указанные мономеры идентичны.
15. CACCR по любому из пп. 11-14, отличающийся тем, что указанные мономеры отличны друг от друга.
16. CACCR по любому из пп. 1-15, отличающийся тем, что указанный домен привлечения STAT содержит домен привлечения STAT из цитокинового рецептора.
17. CACCR по любому из пп. 1-15, отличающийся тем, что указанный домен привлечения STAT содержит домен привлечения STAT из рецептора, выбранного из группы, состоящей из BLNK, IL2RG, EGFR, EpoR, GHR, IFNAR1, IFNAR2, IFNAR1/2, IFNLR1, IL10R1, IL12Rb1, IL12Rb2, IL21R, IL2Rb, IL2small, IL7R, IL7Ra, IL9R, IL15R и IL21R.
18. CACCR по любому из пп. 1-15, отличающийся тем, что указанный домен привлечения STAT содержит аминокислотную последовательность одной или более из рецепторных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 46-88, 106 и 143.
19. CACCR по любому из пп. 1-18, отличающийся тем, что указанный домен привлечения STAT содержит домен привлечения STAT из IL7Ra.
20. CACCR по п. 19, отличающийся тем, что указанный домен привлечения STAT из IL7Ra содержит SEQ ID NO: 69.
21. CACCR по любому из пп. 1-18, отличающийся тем, что указанный домен привлечения STAT содержит домен привлечения STAT из IL2Rb.
22. CACCR по п. 21, отличающийся тем, что указанный IL2Rb содержит домен привлечения STAT, содержащий домен привлечения STAT из IL7Ra.
23. CACCR по любому из пп. 1-18, отличающийся тем, что указанный домен привлечения STAT содержит домен привлечения STAT из IL12Rb2.
24. CACCR по п. 23, отличающийся тем, что указанный домен привлечения STAT из IL12Rb2 содержит SEQ ID NO: 86 или 67.
25. CACCR по любому из пп. 1-24, отличающийся тем, что указанный домен привлечения STAT содержит домены привлечения STAT из двух рецепторов.
26. CACCR по любому из пп. 1-25, отличающийся тем, что указанный домен привлечения STAT содержит домены привлечения STAT из двух цитокиновых рецепторов.
27. CACCR по п. 26, отличающийся тем, что указанные два цитокиновых рецептора выбраны из группы, состоящей из IL7Ra, IL2Rb и IL12Rb2.
28. Полинуклеотид, кодирующий CACCR по любому из п. 6 или 18.
29. Вектор экспрессии, содержащий полинуклеотид по п. 28.
30. Вектор экспрессии по п. 29, содержащий полинуклеотид по п. 28 и полинуклеотид, экспрессирующий химерный антигенный рецептор (CAR).
31. Вектор экспрессии по п. 30, отличающийся тем, что указанный CAR связывается с BCMA, EGFRvIII, Flt-3, WT-1, CD20, CD23, CD30, CD38, CD70, CD33, CD133, LeY, NKG2D, CS1, CD44v6, ROR1, CD19, клаудином-18.2 (клаудин-18A2 или изоформа 2 клаудина 18), DLL3 (дельта-подобный белок 3, дельта-гомолог 3 дрозофилы, Delta3), Muc17 (муцин17, Muc3, Muc3), FAP альфа (белок активации фибробластов альфа), Ly6G6D (белок локуса G6d лимфоцитарного антигенного комплекса 6, c6orf23, G6D, MEGT1, NG25) и/или RNF43 (RNF43 убиквитинлигазы (E3), белок с RING-пальцем 43).
32. Вектор экспрессии по любому из пп. 29-31, отличающийся тем, что указанный вектор представляет собой лентивирусный вектор.
33. Сконструированная Т-клетка, обладающая увеличенной цитотоксичностью, причем клетка содержит вектор экспрессии по любому из пп. 29-32.
34. Сконструированная Т-клетка, обладающая увеличенной цитотоксичностью, причем клетка содержит химерный антигенный рецептор (CAR) и по меньшей мере один CACCR по любому из пп. 1-27.
35. Сконструированная Т-клетка по п. 34, отличающаяся тем, что указанные CAR и CACCR экспрессируются в стехиометрически равных количествах.
36. Сконструированная Т-клетка по любому из пп. 33-35, отличающаяся тем, что указанный CAR связывается с BCMA, EGFRvIII, Flt-3, WT-1, CD20, CD23, CD30, CD38, CD70, CD33, CD133, LeY, NKG2D, CS1, CD44v6, ROR1, CD19, клаудином-18.2 (клаудин-18A2 или изоформа 2 клаудина 18), DLL3 (дельта-подобный белок 3, дельта-гомолог 3 дрозофилы, Delta3), Muc17 (муцин17, Muc3, Muc3), FAP альфа (белок активации фибробластов альфа), Ly6G6D (белок локуса G6d лимфоцитарного антигенного комплекса 6, c6orf23, G6D, MEGT1, NG25) и/или RNF43 (RNF43 убиквитинлигазы (E3), белок с RING-пальцем 43).
37. Сконструированная Т-клетка по любому из пп. 33-36, отличающаяся тем, что указанная Т-клетка представляет собой аллогенную Т-клетку.
38. Сконструированная Т-клетка по любому из пп. 33-36, отличающаяся тем, что указанная Т-клетка представляет собой аутологичную Т-клетку.
39. Способ получения сконструированной Т-клетки, отличающийся тем, что указанный способ включает введение полинуклеотида по п. 28 или вектора экспрессии по любому из пп. 29-32 в Т-клетку.
40. Способ по п. 39, отличающийся тем, что указанная Т-клетка представляет собой Т-клетку, происходящую из стволовой клетки.
41. Фармацевтическая композиция для лечения рака у субъекта, содержащая сконструированные Т-клетки по любому из пп. 33-38.
42. Набор для лечения рака у субъекта, содержащий сконструированные Т- клетки по любому из пп. 33-38 или фармацевтическую композицию по п. 41.
43. Применение терапевтически эффективного количества сконструированных Т-клеток по любому из пп. 33-38 или фармацевтической композиции по п. 41 для лечения рака у субъекта.
44. Применение по п. 43, отличающееся тем, что указанный рак включает солидную опухоль.
45. Применение по п. 43, отличающееся тем, что указанный рак включает гемобластоз.
| WO 2017029512 A1, 23.02.2017 | |||
| WO 2016168612 Al, 20.10.2016 | |||
| WO 2007075899 A2, 05.07.2007 | |||
| RU 2017123551 A, 14.01.2019 | |||
| WO 2011069004 A1, 09.06.2011. |
Авторы
Даты
2024-08-12—Публикация
2020-02-28—Подача