Перекрестная ссылка на связанные заявки
[1] Настоящая заявка представляет собой частичное продолжение Международной заявки № PCT/US2017/023112, поданной 19 марта 2017 г.; частичное продолжение Международной заявки № PCT/US2017/041277, поданной 8 июля 2017 г.; частичное продолжение заявки США № 15/462,855, поданной 19 марта 2017 г.; и частичное продолжение заявки США № 15/644778, поданной 8 июля 2017 г.; и испрашивает приоритет по предварительной заявке США № 62/467039, поданной 3 марта 2017 г.; по предварительной заявке США № 62/560176, поданной 18 сентября 2017 г.; по предварительной заявке США № 62/564253, поданной 27 сентября 2017 г.; и по предварительной заявке США № 62/564991, поданной 28 сентября 2017 г.; международная заявка № PCT/US2017/023112 испрашивает приоритет по предварительной заявке США № 62/390093, поданной 19 марта 2016 г.; по предварительной заявке США № 62/360041, поданной 8 июля 2016 г.; и по предварительной заявке США № 62/467039, поданной 3 марта 2017 г.; международная заявка № PCT/US2017/041277 испрашивает приоритет по международной заявке № PCT/US2017/023112, поданной 19 марта 2017 г.; по заявке на патент США № 15/462,855, поданной 19 марта 2017 г.; по предварительной заявке США № 62/360041, поданной 8 июля 2016 г.; и по предварительной заявке США № 62/467039, поданной 3 марта 2017 г.; заявка США № 15/462855 испрашивает приоритет по предварительной заявке США № 62/390093, поданной 19 марта 2016 г.; по предварительной заявке США № 62/360041, поданной 8 июля 2016 г.; и по предварительной заявке США № 62/467039, поданной 3 марта 2017 г.; и заявка США № 15/644778 представляет собой частичное продолжение международной заявки № PCT/US2017/023112, поданной 19 марта 2017 г., и частичное продолжение заявки на патент США № 15/462855, поданной 19 марта 2017 г., и испрашивает приоритет по предварительной заявке США № 62/360041, поданной 8 июля 2016 г., и по предварительной заявке США № 62/467039, поданной 3 марта 2017 г. Данные заявки включены в данный документ посредством ссылки в полном объеме.
Перечень последовательностей
[2] Настоящая заявка включает в себя посредством ссылки материалы электронного перечня последовательностей, поданных одновременно с ней. Материалы в электронном перечне последовательностей представлены в виде текстового (.txt) файла под названием «F1_001_WO_03_Sequence_Listing_2018_03_03.txt», созданного 3 марта 2018 г., размер файла которого составляет 526 кБ и включен в данный документ посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
[3] Настоящее изобретение относится к области иммунологии или, более конкретно, к генетической модификации Т-лимфоцитов или других иммунных клеток, а также к способам получения дефектных по репликации рекомбинантных ретровирусных частиц и контроля экспрессии генов в них.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[4] Лимфоциты, выделенные от субъекта (например, пациента), можно активировать in vitro и генетически модифицировать для экспрессии синтетических белков, которые обеспечивают перенаправленное взаимодействие с другими клетками и средами на основе включенных генетических программ. Примером такого синтетического белка является химерный антигенный рецептор (CAR). Один из CAR, который используется в настоящее время, представляет собой слитый продукт внеклеточного домена распознавания (например, антигенсвязывающего домена), трансмембранного домена и одного или нескольких внутриклеточных сигнальных доменов, кодируемых дефектным по репликации рекомбинантным ретровирусом.
[5] В то время как рекомбинантные ретровирусы продемонстрировали эффективность в инфицировании неделящихся клеток, покоящиеся CD4 и CD8 лимфоциты невосприимчивы к генетической трансдукции этими векторами. Для преодоления этой проблемы эти клетки обычно активируют in vitro с использованием стимулирующих реагентов до того, как может произойти генетическая модификация с помощью вектора на основе гена CAR. После стимуляции и трансдукции генетически модифицированные клетки экспандируют in vitro и впоследствии повторно вводят в организм лимфодеплецированного пациента. При взаимодействии антигена in vivo внутриклеточная сигнальная часть CAR может инициировать связанный с активацией ответ в иммунной клетке и высвобождение цитолитических молекул с индуцированием гибели опухолевых клеток.
[6] Такие современные способы требуют обширных манипуляций и производства пролиферирующих Т-клеток вне организма до их реинфузии пациенту, а также лимфодеплетирующей химиотерапии для высвобождения цитокинов и деплеции конкурирующих рецепторов для облегчения привития Т-клеток. Такие лекарственные средства на основе CAR, кроме того, нельзя контролировать по скорости распространения in vivo после введения в организм или безопасно направлять к мишеням, которые также экспрессируются вне опухоли. В результате в настоящее время лекарственные средства на основе CAR обычно инфузируют из клеток, экспандированных ex vivo в течение от 12 до 28 дней с использованием доз от 1 × 105 до 1 × 108 клеток/кг, и направлены на мишени, например, опухолевые мишени, для которых внецелевая опухолевая токсичность в целом является приемлемой. Эти относительно длительные периоды экспансии ex vivo создают проблемы жизнеспособности и стерильности клеток, а также идентичности образцов в дополнение к проблемам масштабируемости. Таким образом, существует значительная потребность в более безопасной и более эффективной масштабируемой терапии на основе Т-клеток или NK-клеток.
[7] Поскольку наше понимание процессов, которые управляют трансдукцией, пролиферацией и выживанием лимфоцитов, является центральным для различных потенциальных коммерческих вариантов применения, которые включают иммунологические процессы, существует потребность в улучшенных способах и композициях для изучения лимфоцитов. Например, было бы полезным определение способов и композиций, которые можно применять для более эффективной характеристики и понимания того, как лимфоциты могут быть генетически модифицированы, а также факторов, влияющих на их выживание и пролиферацию. Кроме того, было бы полезным идентифицировать композиции, которые управляют пролиферацией и выживанием лимфоцитов. Такие композиции можно применять для изучения регуляции таких процессов. Помимо способов и композиций для изучения лимфоцитов, существует потребность в улучшенных линиях клеток, пакующих вирусы, и способах их получения и применения. Например, такие клеточные линии и способы могут быть пригодны при анализе различных компонентов рекомбинантных вирусов, таких как рекомбинантные ретровирусные частицы, и для способов, в которых применяются линии пакующих клеток для получения рекомбинантных ретровирусных частиц.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[8] В данном документе представлены способы, композиции и наборы, которые помогают преодолеть проблемы, связанные с эффективностью и безопасностью способов трансдукции и/или генетической модификации лимфоцитов, таких как Т-клетки и/или NK-клетки. Определенные варианты осуществления таких способов применимы для проведения адоптивной клеточной терапии с помощью этих клеток. Соответственно, в некоторых аспектах в данном документе представлены способы, композиции и наборы для генетической модификации и/или трансдукции лимфоцитов, особенно Т-клеток и/или NK-клеток, и/или для регулирования активности трансдуцированных и/или генетически модифицированных Т-клеток и/или NK-клеток. Такие способы, композиции и наборы обеспечивают улучшенную эффективность и безопасность по сравнению с существующими технологиями, особенно в отношении Т-клеток и/или NK-клеток, которые экспрессируют химерные антигенные рецепторы (CAR), и в иллюстративных вариантах осуществления ограниченных микроокружением биологических CAR. Трансдуцированные и/или генетически модифицированные Т-клетки и/или NK-клетки, которые получают и/или применяют в способах, представленных в данном документе, включают функциональность и комбинации функциональности, в иллюстративных вариантах осуществления доставляются из ретровирусных (например, лентивирусных) геномов с помощью ретровирусных (например, лентивирусных) частиц, которые обеспечивают улучшенные свойства таких клеток и способов, в которых применяются такие клетки, таких как исследовательские способы, способы коммерческого производства и адаптивная клеточная терапия. Например, такие клетки могут быть получены ex vivo за меньшее время, и они обладают улучшенными свойствами роста, которые можно более эффективно регулировать.
[9] В некоторых аспектах в данном документе представлены регуляторные элементы для регуляции экспрессии CAR, mRNA, ингибиторной(ых) РНК и/или лимфопролиферативных элементов, например, химерных лимфопролиферативных элементов, в лимфоцитах, таких как В-клетки, Т-клетки и NK-клетки. Кроме того, в некоторых аспектах в данном документе представлены рекомбинантные ретровирусы, которые экспрессируют различные функциональные элементы и которые несут различные функциональные элементы на своей поверхности, а также способы и линии пакующих клеток для получения рекомбинантных ретровирусов. Эти рекомбинантные ретровирусы, способы и клетки для их получения преодолевают ограничения предшествующего уровня техники в отношении количества и размера в геноме различных функциональных элементов, которые обеспечивают преимущества при доставке в Т-клетки и/или NK-клетки.
[10] В некоторых аспектах представлены способы трансдукции и/или генетической модификации лимфоцитов, таких как Т-клетки и/или NK-клетки, а в иллюстративных вариантах осуществления способы ex vivo трансдукции и/или генетической модификации покоящихся Т-клеток и/или NK-клеток. Некоторые из этих аспектов могут быть выполнены намного быстрее, чем предыдущие способы, что может способствовать более эффективным исследованиям, более эффективному коммерческому производству и улучшенным способам ухода за пациентами. Кроме того, в данном документе представлены способы, в которых в некоторых вариантах осуществления применяют рекомбинантные ретровирусы, представленные в данном документе, в некоторых аспектах вместе с фармакологическими средствами, для обеспечения улучшенных механизмов безопасности, облегчающих модулирование активности трансдуцированных и/или генетически модифицированных лимфоцитов, таких как Т-клетки и/или NK-клетки. Такие способы, композиции и наборы можно применять в качестве инструментов исследования, в коммерческом производстве и в адоптивной клеточной терапии с помощью трансдуцированных и/или генетически модифицированных Т-клеток и/или NK-клеток, экспрессирующих CAR.
[11] Дополнительные подробности, касающиеся аспектов и вариантов осуществления настоящего изобретения, представлены в настоящей патентной заявке. Разделы и заголовки разделов не предназначены для ограничения комбинаций способов, композиций и наборов или функциональных элементов в них.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[12] На Фиг. 1 изображено схематическое изображение иллюстративных композиций, включающих пакующую клетку (100) и не способную к репликации рекомбинантную ретровирусную частицу (200) из одного иллюстративного неограничивающего варианта осуществления настоящего изобретения, полученных с помощью пакующей клетки (100). На Фиг. 1 различные векторы (обозначаемые рекомбинантными полинуклеотидами (110)), способные кодировать аспекты настоящего изобретения, упакованы в рекомбинантную ретровирусную частицу (200), которая содержит в своем геноме первый сконструированный сигнальный полипептид, который содержит один или несколько лимфопролиферативных элементов и в некоторых вариантах осуществления второй сконструированный сигнальный полипептид, который представляет собой химерный антигенный рецептор, или CAR. Не способная к репликации рекомбинантная ретровирусная частица экспрессирует на своей мембране элемент псевдотипирования (в неограничивающем варианте осуществления полипептид гемагглютинина (H) вируса кори и полипептид слияния (F) вируса кори или их варианты с делецией цитоплазматического домена) (240), который позволяет не способной к репликации рекомбинантной ретровирусной частице связываться с целевой клеткой и сливаться с ней; активирующий элемент (в неограничивающих вариантах осуществления активирующий элемент, который имеет полипептид, способный связываться с CD28, и полипептид, способный связываться с CD3) (210 и 220 соответственно), который способен связываться и активировать покоящуюся Т-клетку; и связанный с мембраной цитокин (в неограничивающем варианте осуществления слитый полипептид DAF IL-7) (230). Части, обозначенные как (250), (260), (270), (280) и (290), представляют собой Src-FLAG-Vpx, матрицу gag HIV, капсид gag HIV, РНК и pol HIV соответственно.
[13] На Фиг. 2 изображена схема иллюстративных композиций, содержащих не способную к репликации рекомбинантную ретровирусную частицу (200), продуцируемую пакующей клеткой (100), и покоящуюся Т-клетку (300), трансфицированную не способной к репликации рекомбинантной ретровирусной частицей (200). Элементы на поверхности не способной к репликации рекомбинантной ретровирусной частицы (200) связываются с рецепторами и/или лигандами на поверхности покоящейся Т-клетки. Элемент псевдотипирования может включать в неограничивающих вариантах осуществления связывающий полипептид и слитый полипептид (в неограничивающих вариантах осуществления полипептид гемагглютинина (H) вируса кори и полипептид слияния (F) вируса кори или их варианты с делецией цитоплазматического домена), которые облегчают связывание и слияние не способной к рекомбинации ретровирусной частицы (200) с Т-клеткой. В неограничивающих вариантах осуществления не способная к репликации рекомбинантная ретровирусная частица (200) содержит на своей поверхности активирующий элемент (в неограничивающих вариантах осуществления активирующий элемент, который имеет полипептид, способный связываться с CD28, и полипептид, способный связываться с CD3), который способен активировать покоящуюся Т-клетку путем взаимодействия с Т-клеточным рецепторным комплексом и необязательно корецептором (320). Кроме того, связанные с мембраной цитокины (в неограничивающих вариантах осуществления гибридный полипептид DAF IL-7), присутствующие на поверхности не способной к репликации рекомбинантной ретровирусной частицы (200), связываются с IL-7Rα (310) на поверхности покоящейся Т-клетки. Не способная к репликации рекомбинантная ретровирусная частица (200) сливается с Т-клеткой, и полинуклеотиды, кодирующие первый сконструированный сигнальный полипептид, который содержит лимфопролиферативный элемент (в иллюстративных вариантах осуществления конститутивно активный IL-7Rα) (370), подвергаются обратной транскрипции в цитозоле перед миграцией в ядро для включения в ДНК активированной Т-клетки. Не ограничиваясь теорией, в некоторых неограничивающих вариантах осуществления Src-FLAG-Vpx (250), упакованный вирусом, проникает в цитозоль покоящихся Т-клеток и способствует расщеплению SAMHD1 (350), что приводит к увеличению пула цитоплазматических dNTP, доступных для обратной транскрипции. В некоторых вариантах осуществления полинуклеотиды могут также кодировать второй сконструированный сигнальный полипептид, который содержит CAR (360). В некоторых вариантах осуществления лимфопролиферативный элемент экспрессируется, когда соединение связывается с контрольным элементом, который регулирует его экспрессию (в неограничивающем примере контрольный элемент представляет собой рибопереключатель, который связывает нуклеозидный аналог). В некоторых вариантах осуществления экспрессия CAR также регулируется контрольным элементом. Часть (330) представляет собой SLAM и CD46. Часть (340) представляет собой CD3.
[14] На Фиг. 3A-3E изображены схемы неограничивающих иллюстративных векторных конструкций для трансфекции пакующих клеток с целью получения не способных к рекомбинации ретровирусных частиц, описанных в данном документе. На Фиг. 3А изображена конструкция, содержащая полинуклеотидную последовательность, кодирующую домен FRB, слитый с доменом-активатором p65 NFκB (p65 AD), и ДНК-связывающий домен ZFHD1, слитый с тремя повторами FKBP, которые конститутивно экспрессируются. Конструкция на Фиг. 3A также включает REV HIV1 и Vpx в виде продукта слияния SrcFlagVpx под индуцируемым рапамицином промотором ZFHD1/p65 AD. На Фиг. 3B изображена конструкция, содержащая полинуклеотид, кодирующий последовательность rtTA под контролем промотора ZFHD1/p65 AD. На Фиг. 3С изображена конструкция, содержащая полинуклеотид, кодирующий ген устойчивости к пуромицину, фланкированный сайтами loxP, и внеклеточную метку MYC, фланкированную сайтами lox2272. Оба селектируемых маркера находятся под контролем промотора BiTRE, фланкируемого сайтами FRT. На Фиг. 3D изображена конструкция, которая содержит полинуклеотид, кодирующий RFP, фланкированный сайтами loxP, который находится под контролем промотора TRE, и один сайт FRT между промотором TRE и 5' сайтом loxP RFP. На Фиг. 3E изображена конструкция, содержащая полинуклеотид, кодирующий GFP, фланкированный сайтами loxP, который находится под контролем промотора TRE, и один сайт FRT между промотором TRE и 5' сайтом loxP GFP. Конструкции на Фиг. 3C-3E функционируют в качестве посадочных площадок для других полинуклеотидных последовательностей, которые подлежат вставке в геном линии пакующих клеток.
[15] На Фиг. 4A-4C изображены схемы неограничивающих иллюстративных векторных конструкций для трансфекции пакующих клеток с целью получения не способных к рекомбинации ретровирусных частиц, описанных в данном документе. На Фиг. 4А изображена конструкция, содержащая трицистронный полинуклеотид, кодирующий scFvFc к CD3 (клон UCHT1) с сайтом присоединения GPI-якоря CD14, внеклеточный домен CD80 (ECD), способный связывать CD28 с сайтом присоединения GPI-якоря CD16B, и IL-7, слитый с фактором ускорения распада (DAF) с последовательностями транспозонов, фланкирующими полинуклеотидную область, для интеграции в геном HEK293S. На Фиг. 4В изображена конструкция, содержащая полинуклеотид с промотором BiTRE и полинуклеотидную область, кодирующую полипептиды gag и pol, в одном направлении, и полинуклеотидную область, кодирующую белки FΔx и HΔy вируса кори, в другом направлении. На Фиг. 4C изображена конструкция, содержащая полинуклеотидную последовательность, кодирующую CAR, и лимфопролиферативный элемент IL7Rα-insPPCL под контролем промотора CD3Z, который не активен в клетках HEK293S, при этом CAR и IL7Rα-insPPCL разделены полинуклеотидной последовательностью, кодирующей последовательность с рибосомным проскоком T2A, и IL7Rα-insPPCL имеет рибозим, контролируемый рибопереключателем ацикловира. CAR-содержащая конструкция дополнительно содержит cPPT/CTS, последовательность RRE и полинуклеотидную последовательность, кодирующую Psi HIV-1 (Ψ). Вся полинуклеотидная последовательность CAR-содержащей конструкции, которая должна быть интегрирована в геном, фланкирована сайтами FRT.
[16] На Фиг. 5A-5C изображены молекулярные структуры ацикловира (Фиг. 5А), пенцикловира (Фиг. 5B) и 2'-дезоксигуанонина (Фиг. 5C) в качестве иллюстративных нуклеозидных аналогов для селективного контроля рибопереключателей.
[17] На Фиг. 6 изображена регуляторная область рибопереключателя дезоксигуанозина типа I-A Mesoplasma florum и ассоциированный с ним генный продукт. Последовательность представляет собой обратный комплемент геномной ДНК M. florum L1 (AE017263.1) от нукл. 624396 до нукл. 625670, которая является такой же, как геномная ДНК M. florum W37 (CP006778.1) от нукл. 636277 до нукл. 637550. Последовательность связывающего дезоксигуанозин аптамера, применяемая для начального скрининга, указана жирным шрифтом и подчеркиванием. Нижерасположенный генный продукт (рибонуклеотидредуктаза класса Ib (аэробная), бета-субъединица) указан заглавными буквами.
[18] На Фиг. 7 представлены области аптамера рибопереключателя дезоксигуанозина M. florum типа I-A, нацеленные на стратегию направленной эволюции. Нуклеотиды внутри незаштрихованных овалов выбирали для рандомизации. Нуклеотиды в овалах с полосами нацеливали на вставку/делецию и рандомизацию.
[19] На Фиг. 8A и 8B представлена библиотека для скрининга аптамеров рибопереключателя деоксигуанозина типа I-A M. florum. На Фиг. 8А нуклеотиды в прямоугольниках со сплошными линиями представляют собой области последовательности, нацеленные на рандомизацию, а нуклеотиды в прямоугольниках с пунктирными линиями представляют собой области последовательности, нацеленные на вставку/делецию и рандомизацию. На Фиг. 8B изображены возможные последовательности, полученные в результате мутации («случайные нуклеотиды («N»)») и делеции/вставки.
[20] На Фиг. 9 представлена библиотека олигонуклеотидов аптамера рибопереключателя деоксигуанозина типа I-A M. florum, синтезированных в виде обратного комплемента с дополнительными парами оснований, добавленными для обеспечения возможности ПЦР-амплификации и добавления промотора Т7 для транскрипции in vitro для скрининга библиотеки. Также показаны соответствующий праймер для амплификации промотора Т7 и праймер для обратной амплификации.
[21] На Фиг. 10 представлена регуляторная область рибопереключателя гуанозина xpt Bacillus subtilis и ассоциированный с ним генный продукт. Последовательность является обратным комплементом от нукл. 2319439 до нукл. 2320353 геномной ДНК B. subtilis subsp. subtilis 6051-HGW (CP003329.1). Последовательность связывающего гуанозин аптамера, применяемая для начального скрининга, указана жирным шрифтом и подчеркиванием. Нижерасположенный генный продукт (ксантинфосфорибозилтрансфераза xpt) указан заглавными буквами.
[22] На Фиг. 11 представлены области аптамера рибопереключателя гуанозина xpt B. subtilis, нацеленные на стратегию направленной эволюции. Нуклеотиды внутри незаштрихованных овалов выбирали для рандомизации. Нуклеотиды в овалах с полосами нацеливали на вставку/делецию и рандомизацию.
[23] На Фиг. 12A и 12B представлена библиотека для скрининга аптамеров рибопереключателя гуанозина xpt типа I-A B. subtilis. На Фиг. 12А нуклеотиды в прямоугольниках со сплошными линиями представляют собой области последовательности, нацеленные на рандомизацию, а нуклеотиды в прямоугольниках с пунктирными линиями представляют собой области последовательности, нацеленные на вставку/делецию и рандомизацию. На Фиг. 12B изображены возможные последовательности, полученные в результате мутации («случайные нуклеотиды («N»)») и делеции/вставки.
[24] На Фиг. 13 представлена библиотека олигонуклеотидов аптамера рибопереключателя гуанозина xpt типа I-A B. subtilis, синтезированных в виде обратного комплемента с дополнительными парами оснований, добавленными для обеспечения возможности ПЦР-амплификации и добавления промотора Т7 для транскрипции in vitro для скрининга библиотеки. Также показаны соответствующий праймер для амплификации промотора Т7 и праймер для обратной амплификации.
[25] На Фиг. 14 изображена конструкция селективной библиотеки. Библиотека построена на основе известных гуанозин- и дезоксигуанозин-связывающих РНК (Pikovskaya, 2013).
[26] На Фиг. 15 изображен выбор аптамера из оксида графена (GrO). На стадии (1) РНК транскрибировали и очищали. На стадии (2) очищенную РНК элюировали. На стадии (3) аптамеры инкубировали с контр-мишенями и буфером. На стадии (4) последовательности, связанные с контр-мишенями или компонентами буфера, удаляли с помощью оксида графена. На стадии (5) центрифугирование разделяло неспецифически чувствительные соединения в супернатанте, который затем удаляли. Две дополнительные 5-минутные промывки удаляли большую часть остаточных последовательностей, связывающихся с контр-мишенью и связывающихся с буфером. На стадии (6) раствор ацикловира в 1X буфере для селекции добавляли к библиотеке, связанной с GrO, для положительной селекции, чтобы потенциальные последовательности аптамера десорбировались из GrO посредством взаимодействия с положительной мишенью. На стадии (7) заключительная стадия центрифугирования отделяет связывающие мишень последовательности в супернатанте от нечувствительных последовательностей, все еще адсорбированных к GrO. На стадии (8) отобранные последовательности подвергали обратной транскрипции, затем библиотеку амплифицировали с помощью ПЦР, затем транскрибировали для создания библиотеки для следующего раунда отбора.
[27] На Фиг. 16 изображена иллюстрация параллельной оценки оксида графена. Обогащенные библиотеки, подвергающиеся параллельной оценке, разделяли на четыре равные части. Затем образцы библиотеки добавляли к оксиду графена и оставляли для инкубации для загрузки библиотеки на оксид графена. Для удаления не связывающего материала использовали две 5-минутные промывки. Для положительного образца (ацикловир) и образца специальной мишени (пенцикловир) каждую мишень готовили отдельно в 1X буфере для отбора до достижения 1 мкМ; контр-мишень заменяли положительной мишенью с использованием 10 мкМ каждой контр-мишени в растворе; отрицательный образец заменяли положительной мишенью с равным объемом воды, не содержащей нуклеаз. Затем образцы объединяли с соответствующими препаратами оксида графена и инкубировали. После инкубации образцы центрифугировали для выделения их супернатантов, и восстановление библиотеки определяли по показаниям спектрофотометра NanoDrop-1000 (Thermo Fisher Scientific; Уилмингтон, Делавэр). Оставшийся образец библиотеки анализировали на денатурирующем PAGE. Изображения гелей получали после окрашивания/обесцвечивания Gel-Star. Полосы, соответствующие ожидаемому размеру библиотеки, восстанавливали для последующего раунда параллельной оценки, при этом ацикловир положительной мишени заменяли контр-мишенями для отрицательных мишеней, контр-мишеней и образцов специальных мишеней до инкубации перед загрузкой. Материал, извлеченный из второй параллельной оценки, использовали для секвенирования и анализа.
[28] На Фиг. 17 изображены семь кандидатов в аптамеры против ацикловира. Свободную энергию для каждого аптамера рассчитывли при 37 °C и 1 M Na+ с помощью Quikfold 3.0 (Zuker 2003). Последовательности идентифицировали с использованием запатентованных алгоритмов. Подчеркнутые области в каждой последовательности представляют собой области отжига праймеров для ПЦР.
[29] На Фиг. 18 изображены семь кандидатов в аптамеры против пенцикловира. Свободную энергию для каждого аптамера рассчитывли при 37 °C и 1 M Na+ с помощью Quikfold 3.0 (Zuker 2003). Последовательности идентифицировали с использованием запатентованных алгоритмов. Подчеркнутые области в каждой последовательности представляют собой области отжига праймеров для ПЦР.
[30] На Фиг. 19А схематически представлены варианты IL7Rα, тестированные в отношении лимфопролиферативной активности/активности выживания при экспрессии в PBMC. На Фиг. 19B представлена гистограмма, демонстрирующая процент жизнеспособности PBMC в присутствии и в отсутствие IL-2.
[31] На Фиг. 20 изображена схема лентивирусного вектора экспрессии, кодирующего GFP, химерный антигенный рецептор к CD19 и eTAG, обозначаемый в данном документе как F1-0-03.
[32] На Фиг. 21A и на Фиг. 21B изображена гистограмма процента (%) клеток CD3+GFP+ в общей CD3+ популяции и гистограмма абсолютного количества клеток на лунку CD3+GFP+ популяции соответственно, через 3, 6, 9, 13 и 17 дней после трансдукция свежевыделенных и нестимулированных PBMC от донора 12M в течение 14 ч с помощью указанных лентивирусных частиц. Каждая полоса представляет собой среднее значение +/- SD повторов.
[33] На Фиг. 22A и на Фиг. 22B изображена гистограмма (%) клеток CD3+GFP+ в общей CD3+ популяции и гистограмма абсолютного количества клеток на лунку CD3+GFP+ популяции соответственно, через 3 и 6 дней после трансдукция свежевыделенных и нестимулированных PBMC от донора 13F в течение 14 ч с помощью указанных лентивирусных частиц. Следует обратить внимание, что на «A» изображены результаты с использованием псевдотипированных лентивирусных частиц VSV-G (эксперименты в трех повторах); на «B» изображены результаты с использованием псевдотипированных лентивирусных частиц VSV-G с Ab к OKT3 (1 мкг/мл), добавленных в среду для трансдукции (эксперименты в двух повторах); на «C» изображены результаты с использованием псевдотипированных лентивирусных частиц VSV-G, экспрессирующих GPI-заякоренный UCHT1scFvFc на своей поверхности (эксперименты в трех повторах); и на «D» изображены результаты с использованием псевдотипированных лентивирусных частиц VSV-G, экспрессирующих GPI-заякоренный UCHT1scFvFc и GPI-заякоренный CD80 или его функциональный внеклеточный фрагмент на своей поверхности (эксперименты в двух повторах). Каждая полоса представляет собой среднее значение +/- SD двух или трех повторов, как указано на Фиг. 22A.
[34] На Фиг. 23A и на Фиг. 23B изображена гистограмма процента (%) клеток CD3+GFP+ в общей CD3+ популяции и гистограмма абсолютного количества клеток на лунку CD3+GFP+ популяции соответственно, через 3, 6 и 9 дней после трансдукция свежевыделенных и нестимулированных PBMC от донора 12M в течение указанного времени воздействия (2-20 ч) с помощью указанных лентивирусных частиц. Трансдукцию проводили в планшете или шейкере, как указано. Каждая полоса представляет собой среднее значение +/- SD двух повторов для лентивирусных частиц, псевдотипированных VSV-G («[VSV-G]»); другие эксперименты не имели повторов.
[35] На Фиг. 24A представлено схематическое изображение каркаса лентивирусного вектора F1-0-02, содержащего кассету экспрессии трансгена, управляющую экспрессией GFP и eTag, и синтетический промотор EF-1alpha и интрон A выше GFP. На Фиг. 24B изображена вставка miRNA в интрон A EF1alpha каркаса F1-0-02. «1» представляет собой перекрытие EF1альфа; «2» представляет собой 5' плечо; «3» представляет собой 5' стебель miRNA1; «4» представляет собой петлю; «5» представляет собой 3' стебель miRNA1; «6» представляет собой 3' плечо; «7» представляет собой линкер; «8» представляет собой 5' стебель miRNA2; «9» представляет собой 3' стебель miRNA2, «10» представляет собой 5' стебель miRNA3; «11» представляет собой 3' стебель miRNA3; «12» представляет собой 5' стебель miRNA4; и «13» представляет собой 3' стебель miRNA4.
[36] На Фиг. 25 представлен график, изображающий, что miRNA, нацеленные на CD3zeta, которые находятся в интроне промотора EF-1alpha, способны приводить к нокдауну экспрессии комплекса CD3.
[37] На Фиг. 26 представлена гистограмма, изображающая ΔΔCt образцов, трансдуцированных miR-TCRα, содержащих не способные к репликации лентивирусные частицы. Значения ΔΔCt представляют собой количество обработанной miR-TCRa miRNA в каждом трансдуцированном образце по отношению к нетрансдуцированному контролю.
[38] На Фиг. 27A-C представлены графики, изображающие процент специфического лизиса клеток CHO-Target 1 с обработкой и без обработки pH-модулирующим фармакологическим средством. На Фиг. 27A клетки CHO-Target 1 изначально находились при pH 6,7, и экспериментальные лунки (сплошная линия) и контрольные клетки (пунктирная линия) обрабатывали или не обрабатывали NaHCO3 соответственно во время, указанное стрелкой. На Фиг. 27В клетки CHO-Target 1 изначально находились при pH 6,7, и экспериментальные лунки (сплошная линия) и контрольные клетки (пунктирная линия) обрабатывали или не обрабатывали NaОН соответственно во время, указанное стрелкой. На Фиг. 27С клетки CHO-Target 1 изначально находились при pH 7,4, и экспериментальные лунки (сплошная линия) и контрольные клетки (пунктирная линия) обрабатывали или не обрабатывали HCl соответственно.
[39] На Фиг. 28 представлен график, изображающий зависимость теплового потока от времени для F1A-795 в отсутствие (кружки) или в присутствии (квадраты) ацикловира, измеренную с помощью DSC.
[40] На Фиг. 29 представлен график, изображающий процент RFU для зонда ProSense FAST у мышей, несущих опухоль с ксенотрансплантатом CHO, до и после введения PBS или бикарбоната.
[41] На Фиг. 30 представлена схема неограничивающей иллюстративной кассеты экспрессии трансгена, содержащей полинуклеотидную последовательность, кодирующую CAR и кандидатный химерный лимфопролиферативный элемент (CLE) библиотек 1A, 1.1A и 1.1B.
[42] На Фиг. 31 представлена схема неограничивающей иллюстративной кассеты экспрессии трансгена, содержащей полинуклеотидную последовательность, кодирующую кандидатный CLE библиотек 2B и 2.1B.
[43] На Фиг. 32 представлена схема неограничивающей иллюстративной кассеты экспрессии трансгена, содержащей полинуклеотидную последовательность, кодирующую CAR и кандидатный CLE библиотек 3A, 3B, 3.1A и 3.1B.
[44] На Фиг. 33 представлена схема неограничивающей иллюстративной кассеты экспрессии трансгена, содержащей полинуклеотидную последовательность, кодирующую кандидатный CLE библиотек 4B и 4.1B.
[45] На Фиг. 34 изображена гистограмма процента (%) CD3+GFP+ клеток в живой CD3+ популяции Фиг. 34A, и гистограмма абсолютного количества клеток на мкл общей живой популяции 34B соответственно в день 3 после трансдукции свежевыделенных и нестимулированных PBMC от донора 18 указанными лентивирусными частицами. Каждая полоса представляет собой среднее значение +/- SD повторов.
[46] На Фиг. 35 представлен график, изображающий кратность экспансии РВМС, трансдуцированных лентивирусными частицами, кодирующими индивидуальные CLE, и культивированных в течение 35 дней в отсутствие экзогенных цитокинов.
[47] На Фиг. 36 представлен график, изображающий кратность экспансии РВМС, трансдуцированных лентивирусными частицами, кодирующими конструкцию CAR к CD19 и индивидуальные CLE, и культивированных в течение 35 дней в присутствии совместимых с донором РВМС, но в отсутствие экзогенных цитокинов.
[48] На Фиг. 37 представлен график, изображающий эффективность, с которой указанная лентивирусная частица трансдуцировала покоящиеся PBMC в течение 4 часа. Эффективность трансдукции измеряли в виде % CAR+ PBMC через 6 дней культивирования в отсутствие экзогенных цитокинов, определенного с помощью FACS. Каждая лентивирусная частица кодировала CAR и CLE. Лентивирусные частицы, трансдуцированные F1-1-228U и F1-3-219U, экспонировали на своей поверхности UCHT1scFvFc-GPI.
[49] На Фиг. 38A и на Фиг. 38B представлены графики, изображающие зависимость от времени общего количества жизнеспособных клеток после того, как покоящиеся PBMC трансдуцировали указанной лентивирусной частицей в течение 4 часов и культивировали in vitro в отсутствие экзогенных цитокинов в течение 6 дней. Каждая лентивирусная частица кодировала CAR и CLE. Лентивирусные частицы, трансдуцированные F1-1-228U и F1-3-219U, экспонировали на своей поверхности UCHT1scFvFc-GPI.
[50] На Фиг. 39A, 39B и 39C представлены графики, изображающие зависимость от времени количества копий лентивирусного генома на мкг геномной ДНК из крови опухоль-несущих мышей NSG, которым вводили PBMC человека, трансдуцированные указанной лентивирусной частицей в течение 4 часов и инъецированные внутривенно без экспансии РВМС ex vivo. Каждая лентивирусная частица кодировала CAR. F1-1-228, F1-1-228U, F1-3-219 и F1-3-219U также кодировали CLE. Лентивирусные частицы, трансдуцированные F1-1-228U и F1-3-219U, экспонировали на своей поверхности UCHT1scFvFc-GPI.
[51] На Фиг. 40 представлен график, изображающий количество CAR+ клеток на 200 мкл крови опухольнесущих мышей NSG, которым вводили PBMC человека, трансдуцированные указанной лентивирусной частицей в течение 4 часов и инъецированные внутривенно без экспансии РВМС ex vivo. Образцы крови брали во время умерщвления мышей. Каждая лентивирусная частица кодировала CAR. F1-1-228, F1-1-228U, F1-3-219 и F1-3-219U также кодировали CLE. Лентивирусные частицы, трансдуцированные F1-1-228U и F1-3-219U, экспонировали на своей поверхности UCHT1scFvFc-GPI.
[52] На Фиг. 41A представлен график, изображающий средний объем опухоли опухолей CHO-ROR2 у мышей NSG, которым внутривенно вводили PBS или PBMC человека, трансдуцированные указанными лентивирусными частицами, кодирующими CAR MRB к ROR2 и CLE в течение 4 часов без экспансии PBMC ex vivo. На Фиг. 41В представлен график, изображающий средний объем опухоли опухолей Raji у мышей NSG, которым внутривенно вводили PBS или PBMC человека, трансдуцированные указанными лентивирусными частицами, кодирующими CAR к CD19 и CLE в течение 4 часов без экспансии PBMC ex vivo. Лентивирусные частицы, трансдуцированные F1-1-228U и F1-3-219U, экспонировали на своей поверхности UCHT1scFvFc-GPI.
ОПРЕДЕЛЕНИЯ
[53] Используемый в данном документе термин «химерный антигенный рецептор» или «CAR» или «CAR» (во множественном числе) относится к сконструированным рецепторам, которые прививают антигенную специфичность клеткам, например Т-клеткам, NK-клеткам, макрофагам и стволовым клеткам. CAR по настоящему изобретению содержат по меньшей мере одну антигенспецифическую нацеленную область (ASTR), трансмембранный домен (TM) и внутриклеточный активирующий домен (IAD) и могут содержать стебель и один или несколько костимулирующих доменов (CSD). В другом варианте осуществления CAR представляет собой биспецифический CAR, который специфичен к двум различным антигенам или эпитопам. После того, как ASTR специфически связывается с целевым антигеном, IAD активирует внутриклеточную передачу сигналов. Например, IAD может перенаправлять специфичность и реактивность Т-клеток к выбранной мишени без ограничения MHC, используя антигенсвязывающие свойства антител. Распознавание антигена без рестриктирования по МНС придает Т-клеткам, экспрессирующим CAR, способность распознавать антиген независимо от процессинга антигена, тем самым обходя основной механизм ускользания опухоли. Более того, при экспрессии в Т-клетках CAR преимущественно не димеризуются с альфа- и бета-цепями эндогенного Т-клеточного рецептора (TCR).
[54] Используемый в данном документе термин «микроокружение» означает любую часть или область ткани или тела, которая имеет постоянные или временные, физические или химические отличия от других областей ткани или областей тела. Например, «микроокружение опухоли», как используется в данном документе, относится к окружению, в котором существует опухоль, которая представляет собой неклеточную область внутри опухоли и область непосредственно за пределами опухолевой ткани, но не относится к внутриклеточному компартменту самой раковой клетки. Микроокружение опухоли может относиться к любым и всем состояниям опухолевого окружения, включая условия, которые создают структурное и/или функциональное окружение для выживания и/или экспансии и/или распространения злокачественного процесса. Например, микроокружение опухоли может включать изменения в условиях, таких как без ограничения давление, температура, pH, ионная сила, осмотическое давление, осмоляльность, окислительный стресс, концентрация одного или нескольких растворенных веществ, концентрация электролитов, концентрация глюкозы, концентрация гиалуронана, концентрация молочной кислоты или лактата, концентрация альбумина, уровни аденозина, уровни R-2-гидроксиглутарата, концентрация пирувата, концентрация кислорода и/или присутствие окислителей, восстановителей или кофакторов, а также другие условия, которые будут понятны квалифицированному специалисту.
[55] Как используется в данном документе, термины «полинуклеотид» и «нуклеиновая кислота» относятся к полимерной форме нуклеотидов любой длины, будь то рибонуклеотиды или дезоксирибонуклеотиды. Таким образом, указанный термин включает в себя без ограничения одно-, двух- и многонитевую ДНК или РНК, геномную ДНК, cDNA, гибриды ДНК-РНК или полимер, содержащий пуриновые и пиримидиновые основания, или другие природные, химически или биологически модифицированные, неприродные или дериватизированные нуклеотидные основания.
[56] Используемый в данном документе термин «антитело» включает поликлональные и моноклональные антитела, включая интактные антитела и фрагменты антител, которые сохраняют специфическое связывание с антигеном. Фрагменты антитела могут представлять собой без ограничения фрагменты, связывающие антиген (Fab), фрагменты Fab', фрагменты F(ab')2, фрагменты Fv, фрагменты Fab'-SH, фрагменты (Fab')2 Fv, фрагменты Fd, фрагменты рекомбинантного IgG (rIgG), фрагменты одноцепочечных антител, включая одноцепочечные вариабельные фрагменты (scFv), двухвалентные scFv, трехвалентные scFv и фрагменты однодоменных антител (например, sdAb, sdFv, нанотело). Термин включает генетически сконструированные и/или модифицированные иным образом формы иммуноглобулинов, такие как интратела, пептитела, химерные антитела, одноцепочечные антитела, полностью человеческие антитела, гуманизированные антитела, слитые белки, включая антигенспецифическую нацеленную область антитела и отличный от антитела белок, гетероконъюгированные антитела, мультиспецифические, например, биспецифические антитела, диатела, триатела и тетратела, тандемные ди-scFv и тандемные три-scFv. Если не указано иное, термин «антитело» следует понимать как включающий его функциональные фрагменты антитела. Термин также включает интактные или полноразмерные антитела, включая антитела любого класса или подкласса, включая IgG и их подклассы, IgM, IgE, IgA и IgD.
[57] Используемый в данном документе термин «фрагмент антитела» включает часть интактного антитела, например, антигенсвязывающую или вариабельную область интактного антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела (Zapata et al., Protein Eng. 8(10): 1057-1062 (1995)); одноцепочечные молекулы антител; и мультиспецифические антитела, образованные из фрагментов антител. Переваривание антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых фрагментами «Fab», при этом каждый имеет один антигенсвязывающий сайт, и остаточный фрагмент «Fс», при этом обозначение отражает способность легко кристаллизоваться. Обработка пепсином приводит к образованию фрагмента F(ab')2, который имеет два сайта связывания антигена и все еще способен перекрестно связывать антиген.
[58] Как используется взаимозаменяемо в данном документе термины «одноцепочечный Fv», фрагменты антител «scFv» или «sFv» содержат домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. В некоторых вариантах осуществления полипептид Fv дополнительно содержит полипептидный линкер или спейсер между доменами VH и VL, который позволяет sFv образовывать необходимую структуру для связывания антигена. Для обзора sFv см. Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
[59] Как используется в данном документе «встречающиеся в природе» домены VH и VL относятся к доменам VH и VL, которые были выделены от хозяина без дополнительной молекулярной эволюции для изменения их аффинности при создании в формате scFv в определенных условиях, таких как те, которые описаны в патенте США 8709755 B2 и заявке WO/2016/033331A1.
[60] Используемый в данном документе термин «аффинность» относится к константе равновесия для обратимого связывания двух средств и выражается в виде константы диссоциации (Kd). Аффинность может быть по меньшей мере в 1 раз больше, по меньшей мере в 2 раза больше, по меньшей мере в 3 раза больше, по меньшей мере в 4 раза больше, по меньшей мере в 5 раз больше, по меньшей мере в 6 раз больше, по меньшей мере в 7 раз больше, по меньшей мере в 8 раз больше, по меньшей мере в 9 раз больше, по меньшей мере в 10 раз больше, по меньшей мере в 20 раз больше, по меньшей мере в 30 раз больше, по меньшей мере в 40 раз больше, по меньшей мере в 50 раз больше, по меньшей мере в 60 раз больше, по меньшей мере в 70 раз больше, по меньшей мере в 80 раз больше, по меньшей мере в 90 раз больше, по меньшей мере в 100 раз больше или по меньшей мере в 1000 раз больше или больше, чем аффинность антитела для неродственных аминокислотных последовательностей. Аффинность антитела к целевому белку может составлять, например, от около 100 наномолей (нМ) до около 0,1 нМ, от около 100 нМ до около 1 пикомоля (пМ) или от около 100 нМ до около 1 фемтомоля (пМ) или больше. Используемый в данном документе термин «авидность» относится к устойчивости комплекса двух или более средств к диссоциации после разведения. Термины «иммунореактивный» и «предпочтительно связывается» используются в данном документе взаимозаменяемо по отношению к антителам и/или антигенсвязывающим фрагментам.
[61] Используемый в данном документе термин «связывание» относится к прямой ассоциации между двумя молекулами, например, вследствие ковалентных, электростатических, гидрофобных и ионных и/или водородных взаимодействий, включая такие взаимодействия, как солевые мостики и водные мостики. Неспецифическое связывание будет относиться к связыванию с аффинностью менее чем около 10-7 М, например, связыванию с аффинностью 10-6 M, 10-5 M, 10-4 M и т.д.
[62] Как используется в данном документе, ссылка на «систему экспрессии на поверхности клетки» или «систему экспонирования на поверхности клетки» относится к экспонированию или экспрессии белка или его части на поверхности клетки. Обычно образуется клетка, которая экспрессирует белки, представляющие интерес, слитые с белком клеточной поверхности. Например, белок экспрессируется в виде белка слияния с трансмембранным доменом.
[63] Используемый в данном документе термин «элемент» включает полипептиды, включая слитые продукты полипептидов, области полипептидов и функциональные мутанты или их фрагменты, а также полинуклеотиды, включая микроРНК и shРНК, и их функциональные мутанты или фрагменты.
[64] Используемый в данном документе термин «область» представляет собой любой сегмент полипептида или полинуклеотида.
[65] Используемый в данном документе термин «домен» представляет собой область полипептида или полинуклеотида с функциональным и/или структурным свойством.
[66] Используемые в данном документе термины «стебель» или «стеблевой домен» относятся к гибкой области полипептидного коннектора, обеспечивающей структурную гибкость и расстояние между фланкирующими областями полипептида, и могут состоять из природных или синтетических полипептидов. Стебель может происходить из шарнира или шарнирной области иммуноглобулина (например, IgG1), который обычно определяют как простирающийся от Glu216 до Pro230 IgG1 человека (Burton (1985) Molec. Immunol., 22:161-206). Шарнирные области других изотипов IgG можно выровнять с последовательностью IgG1, поместив первый и последний остатки цистеина, образующие дисульфидные связи между тяжелыми цепями (S-S), в одинаковые положения. Стебель может быть природного происхождения или не встречаюегося в природе происхождения, включая без ограничения измененную шарнирную область, как раскрыто в патенте США № 5677425. Стебель может включать полную шарнирную область, полученную из антител любого класса или подкласса. Стебель может также включать области, происходящие от CD8, CD28 или других рецепторов, которые обеспечивают аналогичную функцию в обеспечении гибкости и расстояния между фланкирующими областями.
[67] Используемый в данном здесь термин «выделенный» означает, что материал удален из своего исходного окружения (например, естественного окружения, если он встречается в природе). Например, встречающийся в природе полинуклеотид или полипептид, присутствующий в живом животном, не выделяется, но выделяется тот же полинуклеотид или полипептид, отделенный от некоторых или всех сосуществующих материалов в естественной системе. Такие полинуклеотиды могут представлять собой часть вектора и/или такие полинуклеотиды или полипептиды могут входить в состав композиции и при этом быть выделенными, поскольку такой вектор или композиция не являются частью его естественного окружения.
[68] Используемый в данном документе термин «полипептид» представляет собой одну цепь аминокислотных остатков, связанных пептидными связями. Полипептид не укладывается в фиксированную структуру и не имеет посттрансляционных модификаций. «Белок» представляет собой полипептид, который укладывается в фиксированную структуру. «Полипептиды» и «белки» используются в данном документе взаимозаменяемо.
[69] Как используется в данном документе полипептид может быть «очищен» с удалением загрязняющих компонентов природного окружения полипептида, например, материалов, которые могут мешать диагностическому или терапевтическому применению полипептида, таких как, например, ферменты, гормоны и другие белковые или небелковые растворенные вещества. Полипептид может быть очищен (1) до более чем 90%, более чем 95% или более чем 98% по массе антитела, как определено с помощью метода Лоури, например, до более чем 99% по массе, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с помощью секвенатора с вращающейся чашей, или (3) до гомогенности с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) в восстанавливающих или невосстанавливающих условиях с помощью кумасси синего или серебристого красителя.
[70] Используемый в данном документе термин «иммунные клетки» обычно включает белые кровяные тельца (лейкоциты), которые происходят из гемопоэтических стволовых клеток (HSC), продуцируемых в костном мозге. «Иммунные клетки» включают, например, лимфоциты (Т-клетки, В-клетки, естественные клетки-киллеры (NK)) и клетки миелоидного происхождения (нейтрофилы, эозинофилы, базофилы, моноциты, макрофаги, дендритные клетки).
[71] Используемый в данном документе термин «Т-клетка» включает все типы иммунных клеток, экспрессирующих CD3, включая Т-клетки-хелперы (CD4+ клетки), цитотоксические Т-клетки (CD8+ клетки), Т-регуляторные клетки (Treg) и гамма-дельта Т-клетки.
[72] Используемый в данном документе термин «цитотоксическая клетка» включает CD8+ T-клетки, естественные клетки-киллеры (NK), NK-T-клетки, γδ T-клетки, субпопуляцию CD4+ клеток и нейтрофилы, которые являются клетками, способными опосредовать цитотоксические ответы.
[73] Используемый в данном документе термин «стволовые клетки» обычно включает плюрипотентные или мультипотентные стволовые клетки. «Стволовые клетки» включают, например, эмбриональные стволовые клетки (ES); мезенхимальные стволовые клетки (MSC); индуцированные плюрипотентные стволовые клетки (iPS); и коммитированные клетки-предшественники (гемопоэтические стволовые клетки (HSC); клетки, полученные из костного мозга и т.д.).
[74] Используемые в данном документе термины «лечение», «осуществление лечения» и т.п. относятся к получению необходимого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предупреждения заболевания или его симптома и/или может быть терапевтическим с точки зрения частичного или полного излечения от заболевания и/или неблагоприятного эффекта, связанного с заболеванием. Термин «лечение», как используется в данном документе, охватывает любое лечение заболевания у млекопитающего, например, человека, и включает: (а) предупреждение возникновения заболевания у субъекта, который может быть предрасположен к заболеванию, но еще не диагностирован как имеющий его; (b) подавление заболевания, т.е. остановку его развития; и (c) облегчение заболевания, т.е. приведение к регрессу заболевания.
[75] Как используется взаимозаменяемо в данном документе, термины «индивидуум», «субъект», «хозяин» и «пациент» относятся к млекопитающему, включая без ограничения людей, мышиных (например, крыс, мышей), зайцеобразных (например, кроликов), отличных от человека приматов, людей, собачьих, кошачьих, копытных (например, лошадей, крупного рогатого скота, овец, свиней, коз) и т.д.
[76] Используемые в данном документе термины «терапевтически эффективное количество» или «эффективное количество» относятся к количеству средства или комбинированным количествам двух средств, которые при введении млекопитающему или другому субъекту для лечения заболевания являются достаточными для воздействия на такое лечение заболевания. «Терапевтически эффективное количество» будет варьироваться в зависимости от средства (средств), заболевания и его тяжести, а также возраста, массы тела и т.д. субъекта, подлежащего лечению.
[77] Используемый в данном документе термин «эволюция» или «эволюционирующий» относится к использованию одного или нескольких методов мутагенеза для создания другого полинуклеотида, кодирующего другой полипептид, который сам по себе является улучшенной биологической молекулой и/или способствует образованию другой улучшенной биологической молекулы. «Физиологические», или «нормальные», или «нормальные физиологические» условия представляют собой условия, такие как без ограничения давление, температура, pH, ионная сила, осмотическое давление, осмоляльность, окислительный стресс, концентрация одного или нескольких растворенных веществ, концентрация электролитов, концентрация глюкозы, концентрация гиалуронана, концентрация молочной кислоты или лактата, концентрация альбумина, уровни аденозина, уровни R-2-гидроксиглутарата, концентрация пирувата, концентрация кислорода и/или присутствие окислителей, восстановителей или кофакторов, а также другие состояния, которые можно рассматривать в пределах нормы в месте введения или в ткани или органе в месте действия, применительно к субъекту.
[78] Используемый в данном документе термин «генетически модифицированная клетка» включает клетки, которые содержат экзогенные нуклеиновые кислоты, независимо от того, интегрированы ли экзогенные нуклеиновые кислоты в геном клетки или нет.
[79] Термин «полипептид», используемый в данном документе, может включать часть или всю молекулу белка, а также любые посттрансляционные или другие модификации.
[80] Элемент псевдотипирования, используемый в данном документе, может включать «связывающий полипептид», который включает один или несколько полипептидов, обычно гликопротеинов, которые идентифицируют и связывают целевую клетку-хозяина, и один или несколько «гибридных полипептидов», которые опосредуют слияние ретровируса и мембран целевой клетки-хозяина, тем самым позволяя ретровирусному геному проникать в целевую клетку-хозяин. Термин «связывающий полипептид», как используется в данном документе, также может обозначаться «полипептид, связывающий Т-клетки и/или NK-клетки» или «элемент взаимодействия с мишенью», а «слитый полипептид» также может обозначаться «слитый элемент».
[81] Термин «покоящийся» лимфоцит, такой как, например, покоящаяся Т-клетка, представляет собой лимфоцит на стадии G0 клеточного цикла, который не экспрессирует маркеры активации, такие как Ki-67. Покоящиеся лимфоциты могут включать наивные Т-клетки, которые никогда не сталкивались со специфическим антигеном, и Т-клетки памяти, которые были изменены в результате предыдущей встречи с антигеном. «Покоящийся» лимфоцит также может обозначаться «спящим» лимфоцитом.
[82] Используемый в данном документе термин «лимфодеплеция» включает способы, которые уменьшают количество лимфоцитов у субъекта, например, путем введения средства для лимфодеплеции. Лимфодеплеции также можно достичь с помощью частичной или фракционной лучевой терапии всего тела. Средство для лимфодеплеции может представлять собой химическое соединение или композицию, способную уменьшать количество функциональных лимфоцитов у млекопитающего при введении млекопитающему. Одним из примеров такого средства является одно или несколько химиотерапевтических средств. Такие средства и дозировки известны и могут быть выбраны лечащим врачом в зависимости от субъекта, который поделжит лечению. Примеры средств для лимфодеплеции включают без ограничения флударабин, циклофосфамид, кладрибин, денилейкин дифтитокс или их комбинации.
[83] РНК-интерференция (RNAi) представляет собой биологический процесс, в котором молекулы РНК подавляют экспрессию или трансляцию генов, нейтрализуя целевые молекулы РНК. Мишень РНК может представлять собой mRNA или любую другую РНК, чувствительную к функциональному ингибированию с помощью RNAi. Используемый в данном документе термин «молекула ингибирующей РНК» относится к молекуле РНК, присутствие которой в клетке приводит к RNAi и приводит к снижению экспрессии транскрипта, на который нацелена молекула ингибирующей РНК. Молекула ингибирующей РНК, как используется в данном документе, имеет 5' стебель и 3' стебель, которые способны образовывать дуплекс РНК. Молекула ингибирующей РНК может представлять собой, например, miRNA (эндогенную или искусственную) или shRNA, предшественник miRNA (т.е. Pri-miRNA или Pre-miRNA) или shRNA, или dsRNA, которая транскрибируется или вводится непосредственно в виде выделенной нуклеиновой кислоты в клетку или в организм субъекта.
[84] Используемые в данном документе термины «двухнитевая РНК», «dsRNA» или «дуплекс РНК» относятся к молекулам РНК, которые состоят из двух нитей. Двухнитевые молекулы включают молекулы, состоящие из двух нитей РНК, которые гибридизуются с образованием дуплексной структуры РНК, или одной ните РНК, которая удваивается сама по себе, образуя дуплексную структуру. Большинство, но не обязательно все основания в дуплексных областях имеют пары оснований. Дуплексная область содержит последовательность, комплементарную целевой РНК. Последовательность, комплементарная целевой РНК, представляет собой антисмысловую последовательность и часто имеет длину от 18 до 29, от 19 до 29, от 19 до 21 или от 25 до 28 нуклеотидов, или в некоторых вариантах осуществления от 18, 19, 20, 21, 22, 23, 24, 25 на нижнем конце и до 21, 22, 23, 24, 25, 26, 27, 28 29 или 30 на верхнем конце, где данный диапазон всегда имеет нижний конец ниже, чем верхний конец. Такие структуры обычно включают 5' стебель, петлю и 3' стебель, соединенные петлей, которая прилегает к каждому стеблею и не является частью дуплекса. В некоторых вариантах осуществления петля содержит по меньшей мере 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов. В других вариантах осуществления петля содержит от 2 до 40, от 3 до 40, от 3 до 21 или от 19 до 21 нуклеотидов, или в некоторых вариантах осуществления от 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 на нижнем конце и до 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35 или 40 на верхнем конце, где данный диапазон всегда имеет нижней конец ниже, чем верхний конец.
[85] Термин «фланкирующая последовательность микроРНК», используемый в данном документе, относится к нуклеотидным последовательностям, включая элементы процессинга микроРНК. Элементы процессинга микроРНК представляют собой минимальные последовательности нуклеиновых кислот, которые способствуют образованию зрелой микроРНК из микроРНК-предшественника. Часто эти элементы расположены внутри 40 нуклеотидной последовательности, фланкирующей структуру стебель-петля микроРНК. В некоторых случаях элементы процессинга микроРНК обнаруживаются внутри участка нуклеотидных последовательностей длиной от 5 до 4000 нуклеотидов, которые фланкируют структуру петли микроРНК.
[86] Термин «линкер» при использовании в отношении мультиплексной ингибирующей молекулы РНК, относится к соединительному средству, которое соединяет две молекулы ингибирующей РНК.
[87] Используемый в данном документе термин «рекомбинантный ретровирус» относится к нереплицируемому или «неспособному к репликации» ретровирусу, если он явно не указан как реплицируемый ретровирус. Термины «рекомбинантный ретровирус» и «рекомбинантная ретровирусная частица» используются в данном документе взаимозаменяемо. Такой ретровирус/ретровирусная частица может представлять собой ретровирусную частицу любого типа, включая, например, гамма-ретровирус и в иллюстративных вариантах осуществления лентивирус. Как известно, такие ретровирусные частицы, например, лентивирусные частицы, обычно образуются в пакующих клетках путем трансфекции пакующих клеток плазмидами, которые содержат упаковочные компоненты, такие как Gag, Pol и Rev, оболочку или псевдотипирующую плазмиду, которая кодирует элемент псевдотипирования, и трансфицируемый, геномный или ретровирусный (например, лентивирусный) вектор экспрессии, который обычно представляет собой плазмиду, в которой кодируется (кодируются) ген (гены) или другая кодирующая последовательность, представляющая интерес. Соответственно, ретровирусный (например, лентивирусный) вектор экспрессии включает последовательности (например, 5' LTR и 3' LTR, фланкирующие, например, пакующий элемент psi и целевую гетерологичную кодирующую последовательность), которые способствуют экспрессии и упаковке после трансфекции в клетку. Термины «лентивирус» и «лентивирусная частица» используются в данном документе взаимозаменяемо.
[88] «Каркас» miRNA состоит из «5' фланкирующей последовательности микроРНК» и/или «3' фланкирующей последовательности микроРНК», окружающей miРНК, и в некоторых случаях петлевой последовательности, которая разделяет стебли структуры стебель-петля в miRNA. В некоторых примерах «каркас» происходит из встречающихся в природе miRNA, таких как, например, miR-155. Термины «5' фланкирующая последовательность микроРНК» и «5' плечо» используются в данном документе взаимозаменяемо. Термины «3' фланкирующая последовательность микроРНК» и «3' плечо» используются в данном документе взаимозаменяемо.
[89] Используемый в данном документе термин «предшественник miRNA» относится к молекуле РНК любой длины, которая может ферментативно процессироваться в miRNA, такую как первичный транскрипт РНК, pri-miRNA или pre-miRNA.
[90] Следует понимать, что настоящее изобретение, а также аспекты и варианты осуществления, представленные в нем, не ограничиваются конкретными раскрытыми примерами, поскольку таковые, конечно, могут варьироваться. Также следует понимать, что используемая в данном документе терминология предназначена только для раскрытия конкретных примеров и вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения.
[91] В случае, когда представлен диапазон значений, необходимо понимать, что каждое промежуточное значение, до десятой единицы измерения нижнего предела, если контекст явно не указывает иное, между верхними и нижними пределами этого диапазона и любое другое указанное или промежуточное значение в указанном диапазоне, охвачено в данном изобретении. Верхние и нижние пределы указанных меньших диапазонов могут быть независимо включены в меньшие диапазоны и также быть охвачены в данном изобретении, за исключением любого особым образом исключенного предела в указанном диапазоне. В случае, когда указанный диапазон включает один или оба из указанных пределов, диапазоны, исключающие один или оба из указанных включенных пределов, также включены в данное изобретение. Когда приведены несколько низких и несколько высоких значений диапазонов, которые перекрываются, специалисту в данной области техники будет понятно, что выбранный диапазон будет включать в себя низкое значение, которое меньше высокого значения. Все заголовки в этом описании предназначены для удобства читателя и не являются ограничивающими.
[92] Если не определено иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, как обычно понимается специалистом в области, к которой принадлежит настоящее изобретение. Хотя любые способы и материалы, аналогичные или эквивалентные тем, которые описаны в данном документе, можно также использовать при практическом осуществлении или испытании настоящего изобретения, ниже описаны предпочтительные способы и материалы. Все публикации, упомянутые в данном документе, включены в данный документ посредством ссылки для раскрытия и описания способов и/или материалов, в связи с которыми цитируются публикации.
[93] Необходимо отметить, что, как используется в данном документе и в прилагаемой формуле изобретения, формы существительного единственного числа включают формы множественного числа, если контекст четко не определяет иное. Таким образом, например, ссылка на «химерный антигенный рецептор» включает множество таких химерных антигенных рецепторов и их эквивалентов, известных специалистам в данной области техники, и так далее. Кроме того, следует отметить, что формула изобретения может быть составлена так, чтобы исключить любой необязательный элемент. Таким образом, данное заявление предполагает выполнять функцию предварительной основы для применения такой исключительной терминологии как «исключительно», «только» и т.п. в связи с цитированием элементов формулы изобретения, или применения отрицательного ограничения.
[94] Будет понятно, что определенные свойства настоящего изобретения, которые для наглядности описаны в контексте отдельных вариантов осуществления, также могут быть предусмотрены в комбинации в одном варианте осуществления. С другой стороны, различные свойства настоящего изобретения, которые для краткости описаны в контексте одного варианта осуществления, также могут быть предусмотрены отдельно или в любой подходящей подкомбинации. Все комбинации вариантов осуществления, относящиеся к настоящему изобретению, конкретно охватываются настоящим изобретением и раскрываются в данном документе так же, как если бы каждая комбинация была раскрыта отдельно и явно. Кроме того, все подкомбинации различных вариантов осуществления и их элементы также конкретно охватываются настоящим изобретением и раскрываются в данном документе, как если бы каждая такая подкомбинация была отдельно и явно раскрыта в данном документе.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[95] Настоящее изобретение преодолевает проблемы предшествующего уровня техники, предоставляя улучшенные способы и композиции для генетической модификации лимфоцитов, например, NK-клеток и в иллюстративных вариантах осуществления T-клеток. Например, некоторые из этих способов не включают предварительную активацию лимфоцитов, и некоторые из этих способов выполняются за меньшее время, чем предшествующие способы. Кроме того, представлены композиции, которые имеют множество вариантов применения, включая их применение в этих улучшенных способах. Некоторые из этих композиций представляют собой генетически модифицированные лимфоциты, которые обладают улучшенными пролиферативными качествами и выживанием, в том числе при культивировании in vitro, например, в отсутствие факторов роста. Такие генетически модифицированные лимфоциты будут пригодны, например, в качестве инструментов исследования для лучшего понимания факторов, влияющих на пролиферацию и выживаемость Т-клеток, а также для коммерческого производства, например, для производства определенных факторов, таких как факторы роста и иммуномодулирующие средства, которые могут быть собраны и протестированы или использованы в коммерческих продуктах.
[96] Некоторые варианты осуществления, представленные в данном документе, представляют собой способы проведения адоптивной клеточной терапии, которая включает трансдукцию Т-клеток и/или NK-клеток, которые требуют гораздо меньше времени ex vivo, например, 24, 12 или 8 часов или меньше, а в некоторых вариантах осуществления без предварительной стимуляция ex vivo. Эти способы хорошо подходят для обработки крови от субъекта ex vivo в замкнутой системе и могут выполняться с субъектом, находящимся в той же комнате, что и и/или в некоторых вариантах осуществления в пределах прямой видимости их крови или их выделенных клеток крови во все моменты во время осуществления способа. Более конкретно, аспекты и варианты осуществления настоящего изобретения преодолевают проблемы, ассоциированные с текущими адоптивными клеточными видами терапии, путем получения способов трансдукции покоящихся Т-клеток и/или покоящихся NK-клеток, которые обычно используют элемент псевдотипирования, который облегчает связывание и слияние не способных к репликации рекомбинантных ретровирусной частицы в покоящуюся Т-клетку и/или покоящуюся NK-клетку, для облегчения генетической модификации покоящихся Т-клеток и/или NK-клеток с помощью не способных к репликации рекомбинантных ретровирусных частиц. Кроме того, способы, представленные в данном документе, преодолевают проблемы уровня техники за счет применения в иллюстративных вариантах осуществления химерного антигенного рецептора и одного или нескольких лимфопролиферативных элементов, экспрессия которых находится под контролем элемента управления, так что воздействие на субъекта соединения, которое связывает контрольный элемент или прекращение такого воздействия способствует экспансии генетически модифицированных Т-клеток и/или NK-клеток in vivo.
[97] В результате этих и других улучшений, подробно раскрытых в данном документе, в одном аспекте в данном документе представлен способ генетической модификации покоящихся Т-клеток и/или покоящихся NK-клеток субъекта, такого как пациент, имеющий заболевание или нарушение, при котором кровь от субъекта собирают; покоящиеся Т-клетки и/или NK-клетки генетически модифицируют путем приведения их в контакт с рекомбинантной ретровирусной частицей, не способной к репликации; и генетически модифицированные клетки повторно вводят субъекту обычно в течение более короткого периода времени, чем в предшествующих способах, например, в течение 24 часов, а в некоторых неограничивающих вариантах осуществления в течение 12 часов и/или без дополнительной экспансии популяции генетически модифицированных Т-клеток и/или NK-клеток ex vivo, например, так, что генетически модифицированные покоящиеся Т-клетки и/или NK-клетки не претерпевают более 4 клеточных делений ex vivo. Таким образом, способы, представленные в данном документе, могут выполняться в течение гораздо меньшего времени, чем в современных видах терапии на основе CAR, за счет чего представлены способы, с помощью которых субъект может оставаться в клинике в течение всего времени проведения стадий ex vivo. Это облегчает осуществление стадий ex vivo в закрытой системе, что снижает вероятность контаминации и смешивания образцов пациентов и может быть более легко выполнено клиническими лабораториями.
[98] Соответственно, на Фиг. 1 и 2 представлены схематические диаграммы иллюстративных композиций, применяемых в способах, представленных в данном документе. На Фиг. 1 представлена диаграмма пакующей клетки (100) и не способной к репликации рекомбинантной ретровирусной частицы, продуцируемой такой пакующей клеткой (200). Пакующая клетка (100) содержит рекомбинантные полинуклеотиды (110), включенные в ее геном, которые включают рекомбинантные транскрипционные элементы, которые экспрессируют ретровирусные белки и различные отличающиеся мембраносвязанные полипептиды под контролем индуцибельных промоторов, которые регулируются трансактиваторами, которые связываются и активируются посредством лигандов. Эти трансактиваторы, индуцибельные промоторы и лиганды применяют для индукции последовательной экспрессии и накопления связанных с клеточной мембраной полипептидов, которые будут включены в мембрану не способной к репликации рекомбинантной ретровирусной частицы, а также ретровирусных компонентов, необходимых для упаковки и сборки не способных к репликации ретровирусных частиц.
[99] В результате последовательной индуцированной экспрессии различных полинуклеотидов, как подробно обсуждается в данном документе ниже, иллюстративная пакующая клетка (100), показанная на Фиг. 1, образуется и ее можно применять в иллюстративных способах получения не способных к репликации рекомбинантных ретровирусных частиц, применяемых в способах трансфекции покоящихся Т-клеток и/или NK-клеток ((300) на Фиг. 2), представленных в данном документе. Пакующая клетка (100) в неограничивающих иллюстративных вариантах осуществления содержит в своем геноме нуклеиновые кислоты, кодирующие упаковываемый геном ретровирусной РНК, который содержит по меньшей мере некоторые элементы ретровирусного генома, необходимые для упаковки и сборки не способной к репликации рекомбинантной ретровирусной частицы (в качестве неограничивающих иллюстративных примеров ретровирусный элемент psi, ретровирусный полипептид gag и ретровирусный полипептид pol).
[100] Некоторые мембраносвязанные полипептиды, включенные или ассоциированные с клеточной мембраной пакующей клетки, будут включены или ассоциированы с не способными к репликации рекомбинантными ретровирусными частицами, но не кодируются ретровирусным геномом. Например, пакующая клетка и образованные из нее не способные к репликации рекомбинантные ретровирусные частицы могут содержать ретровирусный полипептид Vpx (250), который в неограничивающих иллюстративных примерах может быть экспрессирован в виде ассоциированного с мембраной гибридного белка, например, полипептида Src-Flag-Vpx; элемент псевдотипирования, который может включать связывающий полипептид и слитый полипептид (240), который в неограничивающем варианте осуществления содержит полипептид гемагглютинина (H) вируса кори и полипептид слияния (F) вируса кори или их варианты делеции цитоплазматического домена; необязательно один или несколько активирующих элементов (210, 220), которые в неограничивающем варианте осуществления содержат мембраносвязанный полипептид, способный связываться с CD3, и мембраносвязанный полипептид, способный связываться с CD28; и/или необязательно мембраносвязанный с цитокин (230), неограничивающим вариантом осуществления которого является гибридный полипептид, который содержит IL-7, слитый с DAF, или его фрагмент. В данном документе представлены различные другие конкретные типы этих мембраносвязанных полипептидов.
[101] В результате последовательной экспрессии транскрипционных элементов пакующей клеткой образуется не способная к репликации рекомбинантная ретровирусная частица. Ретровирусный геном на основе РНК, находящийся внутри и обычно интегрированный в геном пакующей клетки, который становится геномом не способной к репликации рекомбинантной ретровирусной частицы, содержит ретровирусные компоненты (в качестве неограничивающих иллюстративных примеров ретровирусные полинуклеотиды Gag и Pol), которые необходимы для продуцирования, инфицирования и интеграции ретровирусов в геном клетки-хозяина, которая обычно представляет собой покоящуюся Т-клетку и/или NK-клетку. Кроме того, ретровирусный геном, кроме того, содержит полинуклеотиды, кодирующие один или обычно два сконструированных сигнальных полипептида, представленных в данном документе. Один из сконструированных сигнальных полипептидов обычно кодирует по меньшей мере один лимфопролиферативный элемент (в неограничивающих примерах мутант конститутивного рецептора интерлейкина 7), а другой сконструированный сигнальный полипептид обычно кодирует химерный антигенный рецептор.
[102] Затем не способную к репликации рекомбинантную ретровирусную частицу (200) используют для трансдукции покоящейся Т-клетки и/или покоящейся NK-клетки (300) в способах, представленных в данном документе. Как изображено на Фиг. 2, после того, как покоящуюся Т-клетку и/или NK-клетку (300) приводят в контакт с не способной к репликации рекомбинантной ретровирусной частицей (200), мембранные полипептиды, обсуждаемые выше, на поверхности не способной к репликации рекомбинантной ретровирусной частицы, связываются с рецепторами и/или лигандами на поверхности покоящейся Т-клетки и/или NK-клетки (300). Например, элемент псевдотипирования, который, как указано выше, может содержать связывающий полипептид, который связывается с молекулами на поверхности покоящихся Т-клеток и/или покоящихся NK-клеток, и слитый полипептид, облегчает связывание и слияние не способных к репликации рекомбинантных ретровирусных частиц (200) с Т-клеточной и/или NK-клеточной мембраной. Активирующий (активирующие) элемент (элементы) (210, 220) активирует (активируют) покоящуюся Т-клетку и/или NK-клетку (300) путем взаимодействия с Т-клеточным рецепторным комплексом, процесс, который происходит во времени контакта или последующей инкубации. Кроме того, мембраносвязанные цитокины (230) могут присутствовать на поверхности не способной к репликации рекомбинантной ретровирусной частицы и связывать рецепторы цитокинов (310) на поверхности покоящихся Т-клеток и/или NK-клеток (300), тем самым дополнительно способствуя связыванию и активации. Таким образом, не ограничиваясь теорией, в иллюстративных вариантах осуществления, представленных в данном документе, в качестве одного или нескольких из этих компонентов не способных к репликации рекомбинантных ретровирусных частиц (200), стимуляция ex vivo или активации элементом, который еще не находится внутри или на не способной к репликации рекомбинантной ретровирусной частице (200), не требуется. Это, в свою очередь, способтвует сокращению времени ex vivo, необходимому для завершения способов в этих иллюстративных способах, представленных в данном документе.
[103] После связывания с Т-клеткой и/или NK-клеткой (200) не способная к репликации рекомбинантная ретровирусная частица затем сливается с T-клеткой и/или NK-клеткой (300), и полипептиды и нуклеиновые кислоты в не способной к репликации рекомбинантной ретровирусной частице попадают в Т-клетку и/или NK-клетку (300). Как указано выше, одним из этих полипептидов в не способной к репликации рекомбинантной ретровирусной частице является полипептид Vpx (250). Полипептид Vpx (250) связывается и индуцирует расщепление фактора рестрикции SAMHD1 (350), который расщепляет свободные dNTP в цитоплазме. Таким образом, концентрация свободных dNTP в цитоплазме увеличивается по мере того, как Vpx расщепляет SAMHD1, и увеличивается активность обратной транскрипции, что способствует обратной транскрипции ретровирусного генома и интеграции в геном T-клетки и/или NK-клетки.
[104] После интеграции ретровирусного генома в Т-клетку и/или NK-клетку (200) геном Т-клетки и/или NK-клетки содержит нуклеиновые кислоты, кодирующие сигнальный полипептид, кодирующий лимфопролиферативный элемент (370), и необязательно сигнальный полипептид, кодирующий CAR (360). Экспрессия лимфопролиферативного элемента и, возможно, CAR находится под контролем элемента управления. Воздействие соединения, которое связывает элемент управления, которое может происходить in vitro или in vivo путем введения его субъекту, Т-клетка и/или NK-клетка (300) которого была трансдуцирована, способствует пролиферации Т-клетки и/или NK-клетки ( 300) in vitro или in vivo путем экспрессии лимфопролиферативного элемента и, необязательно в результате экспрессии CAR и связывания CAR с его целевой клеткой. Таким образом, Т-клетки и/или NK-клетки, которые трансдуцируются с помощью не способных к репликации рекомбинантных ретровирусных частиц, описанных в данном документе, имеют один или несколько сигналов, которые управляют пролиферацией и/или ингибируют гибель клеток, что, в свою очередь, в иллюстративных вариантах осуществления позволяет избежать требований к предшествующим способам для лимфодеплеции хозяина перед возвращением трансдуцированных Т-клеток и/или NK-клеток обратно в организм субъекта. Это, в свою очередь, в иллюстративных вариантах осуществления дополнительно снижает потребность в днях обработки перед повторным введением трансдуцированных Т-клеток и/или NK-клеток субъекту. Таким образом, в иллюстративных вариантах осуществления от сбора крови у субъекта до повторного введения крови субъекту требуется не более 36 часов, 24 часов, 12 часов или в некоторых случаях даже 8 часов, что коренным образом изменяет способ на основе CAR-T по сравнению с предшествующими способами. Кроме того, элемент управления также обеспечивает один из предусмотренных в данном документе механизмов безопасности. Например, прекращение введения соединения может подавлять или даже прекращать экспрессию лимфопролиферативного элемента и, необязательно CAR, тем самым прекращая передачу сигнала пролиферации и/или выживания трансдуцированной Т-клетке и/или NK-клетке и ее потомству.
СПОСОБЫ ТРАНСДУКЦИИ И/ИЛИ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ ЛИМФОЦИТОВ
[105] В определенных аспектах в данном документе представлен способ трансдукции и/или генетической модификации лимфоцита, обычно Т-клетки и/или NK-клетки, и обычно покоящейся Т-клетки и/или покоящейся NK-клетки, который включает приведение в контакт лимфоцита с не способной к репликации рекомбинантной ретровирусной частицей, где рекомбинантная ретровирусная частица, не способная к репликации, обычно содержит элемент псевдотипирования на своей поверхности, при этом указанное приведение в контакт (и инкубация в условиях приведения в контакт) облегчает трансдукцию покоящейся Т-клетки и/или NK-клетки с помощью не способных к репликации рекомбинантных ретровирусных частица, за счет чего образуются генетически модифицированная Т-клетка и/или NK-клетка. Элемент псевдотипирования обычно способен связывать покоящуюся Т-клетку и/или NK-клетку и обычно способствует слиянию мембран сам по себе или в сочетании с другим (другими) белком (белками) не способных к репликации рекомбинантных ретровирусных частиц.
[106] В некоторых вариантах осуществления не способная к репликации рекомбинантная ретровирусная частица может дополнительно содержать активирующий элемент, который может представлять собой любой активирующий элемент, представленный в данном документе. В иллюстративных вариантах осуществления активирующим элементом может быть антитело к CD3, такое как scFv к CD3 или scFvFc к CD3. В некоторых вариантах осуществления приведение в контакт может осуществляться в течение от 1 до 24 часов, например, в течение от 1 до 12 часов или в течение от 1 до 6 часов. В некоторых вариантах осуществления приведение в контакт может осуществляться в течение менее чем 24 часов, например, менее чем 12 часов, менее чем 8 часов или менее чем 4 часов. Пакующая клетка и в иллюстративных вариантах осуществления линия пакующих клеток и в особенно иллюстративных вариантах осуществления пакующая клетка, представленная в определенных аспектах данного документа, используются для получения не способной к репликации рекомбинантной ретровирусной частицы. В иллюстративных вариантах осуществления таких способов генетически модифицированная Т-клетка или NK-клетка способна выживать в культуре ex vivo в течение по меньшей мере 7, 14, 21, 28, 35, 42 или 60 дней в отсутствие целевого антигена, распознаваемого CAR и в отсутствие цитокинов, таких как IL-2, IL-15 или IL-7. В иллюстративных вариантах осуществления таких способов генетически модифицированная Т-клетка или NK-клетка способна к привитию in vivo у мышей и/или обогащению in vivo у мышей в течение по меньшей мере 7, 14 или 28 дней. Специалисту в данной области техники будет понятно, что таких мышей можно обрабатывать или иным образом генетически модифицировать, так что любые иммунологические различия между генетически модифицированными Т-клетками и/или NK-клетками не приводят к возникновению иммунного ответа у мышей против любого компонента трансдуцированных лимфоцитов путем репликации не способной к рекомбинации ретровирусной частицы. В некоторых вариантах осуществления линия пакующих клеток может представлять собой линию суспензионных клеток. В иллюстративных вариантах осуществления линию пакующих клеток можно выращивать в бессывороточной среде. В некоторых вариантах осуществления лимфоцит может происходить от субъекта. В иллюстративных вариантах осуществления лимфоцит может происходить из крови субъекта.
[107] Дополнительные варианты осуществления любого из вышеупомянутых аспектов для трансдукции и/или генетической модификации лимфоцита, например, NK-клетки, или в иллюстративных вариантах осуществления T-клетки могут включать любой из вариантов осуществления не способных к репликации рекомбинантных ретровирусных частиц, лимфопролиферативных элементов, CAR, элементов псевдотипирования, рибопереключатели, элементы активации, мембраносвязанные цитокины, miRNA и/или другие элементы, раскрытые в данном документе, и могут быть объединены со способами получения ретровирусных частиц с использованием пакующей клетки. В некоторых иллюстративных вариантах осуществления ретровирусная частица представляет собой лентивирусную частицу. Такой способ трансдукции Т-клетки и/или NK-клетки можно проводить in vitro или ex vivo. Специалисту в данной области техники будет понятно, что детали, представленные в данном документе для трансдукции и/или генетической модификации Т-клетки (Т-клеток) и/или NK-клетки (NK-клеток), могут применяться к любому аспекту, который включает такую (такие) стадию (стадии), включая аспекты, которые относятся к способам для трансдукции и/или генетической модификации лимфоцитов, таких как Т-клетка (Т-клетки) и/или NK-клетка (NK-клетки).
[108] Соответственно, в одном аспекте в данном документе представлен способ трансдукции (и/или генетической модификации) лимфоцитов, обычно покоящихся Т-клеток и/или покоящихся NK-клеток, из выделенной крови, включающий:
A. сбор крови у субъекта;
B. выделение мононуклеарных клеток периферической крови (PBMC), содержащих покоящиеся Т-клетки и/или покоящиеся NK-клетки; и
C. приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат на своей поверхности элемент псевдотипирования, который способен связывать покоящуюся Т-клетку и/или покоящуюся NK-клетку и облегчать слияние мембран не способных к репликации рекомбинантных ретровирусных частиц с ними, при этом указанное приведение в контакт способствует трансдукции по меньшей мере 5% покоящихся Т-клеток и/или покоящихся NK-клеток посредством не способных к репликации рекомбинантных ретровирусных частиц, за счет чего образуются генетически модифицированные T-клетки и/или NK-клетки, за счет чего трансдуцируются покоящиеся Т-клетки и/или NK-клетки.
[109] В некоторых вариантах осуществления любого способа, описанного в данном документе, который включает стадию трансдукции Т-клеток и/или NK-клеток, клетки могут быть приведены в контакт с ретровирусной частицей без предварительной активации. В некоторых вариантах осуществления любого из способов, описанных в данном документе, который включает стадию трансдукции Т-клеток и/или NK-клеток, Т-клетки и/или NK-клетки не инкубировали на субстрате, который прикрепляется к моноцитам, в течение более 4 часов в одном варианте осуществления, или в течение более 6 часов в другом варианте осуществления, или в течение более 8 часов в другом варианте осуществления до трансдукции. В одном иллюстративном варианте осуществления Т-клетки и/или NK-клетки инкубировали в течение ночи на прикрепленном субстрате для удаления моноцитов перед трансдукцией. В другом варианте осуществления способ может включать инкубацию Т-клеток и/или NK-клеток на адгезивном субстрате, который связывает моноциты, в течение не более чем 30 минут, 1 часа или 2 часов перед трансдукцией. В другом варианте осуществления Т-клетки и/или NK-клетки не подвергаются стадии удаления моноцитов путем инкубации на прикрепленном субстрате перед указанной стадией трансдукции. В другом варианте осуществления Т-клетки и/или NK-клетки не инкубируют или не подвергают воздействию бычьей сыворотки, такой как бычья сыворотка для культивирования клеток, например, фетальная бычья сыворотка, до или во время трансдукции.
[110] Соответственно, в другом аспекте в данном документе представлен способ генетической модификации или трансдукции лимфоцита субъекта, в иллюстративных вариантах осуществления Т-клетки и/или NK-клетки или популяции Т-клеток или NK-клеток, который включает приведение в контакт с Т-клеткой (Т-клетками) и/или NK-клеткой (NK-клетками), как правило, субъекта ex vivo, с не способной к репликации рекомбинантной ретровирусной частицей, содержащей в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в T-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует две или несколько молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, а вторая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, при этом указанное приведение в контакт облегчает трансдукцию, или по меньшей мере некоторых из покоящихся Т-клеток и/или NK-клеток посредством не способной к репликации рекомбинантной ретровирусной частицы, за счет чего образуются генетически модифицированные Т-клетки и/или NK-клетки.
[111] В данном документе в другом аспекте представлен способ генетической модификации или трансдукции лимфоцита (например, Т-клетки или NK-клетки) или их популяции субъекта, включающий приведение в контакт лимфоцита (например, Т-клетки или NK-клетки) или их популяции субъекта ex vivo, с не способной к репликации рекомбинантной ретровирусной частицей, содержащей в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в лимфоцитах (например, Т-клетках и/или NK-клетках), при этом первая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует одну или несколько (например, две или несколько) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, а вторая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, при этом указанное приведение в контакт облегчает генетическую модификацию и/или трансдукцию лимфоцита (например, T-клетки или NK-клетки), или по меньшей мере некоторых из лимфоцитов (например, T-клеток и/или NK-клеток) с помощью не способной к репликации рекомбинантной ретровирусной частицы, за счет чего образуется генетически модифицированный и/или трансдуцированный лимфоцит (например, T-клетка и/или NK-клетка).
[112] В некоторых вариантах осуществления способа, представленного непосредственно выше, субъекту вводят генетически модифицированный и/или трансдуцированный лимфоцит (например, Т-клетку и/или NK-клетку) или его популяцию. В некоторых вариантах осуществления генетически модифицированный и/или трансдуцированный лимфоцит (например, Т-клетку и/или NK-клетку) или его популяция претерпевают 4 или меньше клеточных делений ex vivo перед введением или повторным введением субъекту. В некоторых вариантах осуществления лимфоциты представляют собой покоящиеся Т-клетки и/или покоящиеся NK-клетки, которые находятся в контакте с не способными к репликации рекомбинантными ретровирусными частицами в течение от 1 часа до 12 часов. В некоторых вариантах осуществления между моментом взятия крови у субъекта и моментом повторного введения генетически модифицированных Т-клеток и/или NK-клеток в организм субъекта проходит не более 8 часов. В некоторых вариантах осуществления все стадии после сбора крови и до того, как кровь будет повторно введена, выполняют в закрытой системе, в которой человек контролирует закрытую систему на протяжении всей обработки.
[113] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифичную нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, полинуклеотид может дополнительно содержать третью последовательность нуклеиновой кислоты, которая кодирует по меньшей мере один лимфопролиферативный элемент, который не является ингибирующей молекулой РНК. В некоторых вариантах осуществления лимфопролиферативный элемент может представлять собой полипептид цитокина или цитокинового рецептора или его фрагмент, содержащий сигнальный домен. В некоторых вариантах осуществления лимфопролиферативный элемент является конститутивно активным. В некоторых вариантах осуществления лимфопролиферативный элемент может представлять собой рецептор IL-7 или его фрагмент. В иллюстративных вариантах осуществления лимфопролиферативный элемент может представлять собой конститутивно активный рецептор IL-7 или его конститутивно активный фрагмент.
[114] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, молекула ингибирующей РНК может в некоторых вариантах осуществления содержать 5' нить и 3' нить, которые частично или полностью комплементарны друг другу, при этом указанная 5' нить и указанная 3' нить способны образовывать дуплекс РНК из 18-25 нуклеотидов. В некоторых вариантах осуществления 5' нить может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов, а 3' нить может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления 5' нить и 3' нить могут иметь одинаковую или разную длину. В некоторых вариантах осуществления дуплекс РНК может содержать одно или несколько ошибочно спаренных оснований. В альтернативных вариантах осуществления дуплекс РНК не имеет ошибочно спаренных оснований.
[115] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, молекула ингибирующей РНК может представлять собой miRNA или shRNA. В некоторых вариантах осуществления ингибирующая молекула может представлять собой предшественник miRNA, такой как, например, Pri-miRNA или Pre-miRNA, или предшественник shRNA. В некоторых вариантах осуществления ингибирующая молекула может представлять собой искусственно полученную miRNA или shRNA. В других вариантах осуществления молекула ингибирующей РНК может представлять собой dsRNA (транскрибированную или искусственно введенную), которая процессируется в siRNA или представляет собой саму siRNA. В некоторых вариантах осуществления молекула ингибирующей РНК может представлять собой miRNA или shRNA, последовательность которых не встречается в природе, или имеет по меньшей мере один функциональный сегмент, который не встречается в природе, или комбинацию функциональных сегментов, которые не встречаются в природе. В иллюстративных вариантах осуществления по меньшей мере одна или все молекулы ингибирующей РНК представляют собой miR-155.
[116] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, молекула ингибирующей РНК может представлять собой miRNA или shRNA, в некоторых вариантах осуществления может иметь ориентацию от 5' до 3': 5' плечо, 5' стебель, петля, 3' стебель, который частично или полностью комплементарен упомянутому 5' стеблю, и 3' плечо. В некоторых вариантах осуществления по меньшей мере одна из двух или более молекул ингибирующей РНК имеет такое расположение. В других вариантах осуществления все из двух или более ингибирующих молекул имеют такое расположение. В некоторых вариантах осуществления 5' стебель может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления 3' стебель может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления петля может иметь длину 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24,2 5, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба происходят из встречающейся в природе miRNA. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба являются производными встречающейся в природе miRNA, выбранной из группы, состоящей из miR-155, miR-30, miR-17-92, miR-122 и miR-21. В иллюстративных вариантах осуществления 5' плечо, 3' плечо или оба происходят от miR-155. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба происходят от miR-155 Mus musculus или miR-155 Homo sapiens. В некоторых вариантах осуществления 5' плечо имеет последовательность, указанную в SEQ ID NO: 256, или ее функциональный вариант, такой как, например, последовательность, имеющая ту же длину, что и SEQ ID NO: 256, или 95%, 90%, 85%, 80%, 75% или 50% при условии, что SEQ ID NO: 256, или составляет 100 нуклеотидов или меньше, 95 нуклеотидов или меньше, 90 нуклеотидов или меньше, 85 нуклеотидов или меньше, 80 нуклеотидов или меньше, 75 нуклеотидов или меньше, 70 нуклеотидов или меньше, 65 нуклеотидов или меньше, 60 нуклеотидов или меньше, 55 нуклеотидов или меньше, 50 нуклеотидов или меньше, 45 нуклеотидов или меньше, 40 нуклеотидов или меньше, 35 нуклеотидов или меньше, 30 нуклеотидов или меньше, или 25 нуклеотидов или меньше; и по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична SEQ ID NO: 256. В некоторых вариантах осуществления 3' плечо имеет последовательность, указанную в SEQ ID NO: 260, или ее функциональный вариант, такой как, например, той же длины, что и SEQ ID NO: 260, или 95%, 90%, 85%, 80%, 75% или 50% при условии, что SEQ ID NO: 260, или представляет собой последовательность, которая имеет 100 нуклеотидов или меньше, 95 нуклеотидов или меньше, 90 нуклеотидов или меньше, 85 нуклеотидов или меньше, 80 нуклеотидов или меньше, 75 нуклеотидов или меньше, 70 нуклеотидов или меньше, 65 нуклеотидов или меньше, 60 нуклеотидов или меньше, 55 нуклеотидов или меньше, 50 нуклеотидов или меньше, 45 нуклеотидов или меньше, 40 нуклеотидов или меньше, 35 нуклеотидов или меньше, 30 нуклеотидов или меньше, или 25 нуклеотидов или меньше; и по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична SEQ ID NO: 260. В некоторых вариантах осуществления 3' плечо содержит нуклеотиды 221-283 BIC Mus musculus.
[117] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует две или более молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК, две или более молекулы ингибирующей РНК, в некоторых вариантах осуществления могут быть расположены последовательно в первой последовательности нуклеиновой кислоты. В некоторых вариантах осуществления молекулы ингибирующей РНК могут быть присоединены друг к другу прямо или косвенно с помощью нефункциональной (нефункциональных ) линкерной (линкерных) последовательностью (последовательностей). В некоторых вариантах осуществления линкерные последовательности могут иметь длину от 5 до 120 нуклеотидов или от 10 до 40 нуклеотидов.
[118] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует две или более молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК, в некоторых вариантах осуществления первая последовательность нуклеиновой кислоты кодирует от двух до четырех молекул ингибирующей РНК. В иллюстративных вариантах осуществления от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 5, от 2 до 4, от 3 до 5 или от 3 до 6 молекул ингибирующей РНК включены в первую последовательность нуклеиновой кислоты. В иллюстративном варианте осуществления четыре молекулы ингибирующей РНК включены в первую последовательность нуклеиновой кислоты.
[119] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или несколько) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, одна или несколько (например, две или несколько) молекул ингибирующей РНК могут находиться в интроне. В некоторых вариантах осуществления интрон находится в промоторе. В иллюстративных вариантах осуществления интрон представляет собой интрон A EF-1alpha. В некоторых вариантах осуществления интрон находится рядом и ниже промотора, который в иллюстративных вариантах осуществления неактивен в пакующей клетке, используемой для получения не способной к репликации рекомбинантной ретровирусной частицы.
[120] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует две или более молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК, две или более молекулы ингибирующей РНК, в некоторых вариантах осуществления могут быть направлены против различных мишеней. В альтернативном варианте осуществления две или более молекулы ингибирующей РНК направлены против одной и той же мишени. В некоторых вариантах осуществления мишени РНК представляют собой mRNA, транскрибируемые с генов, которые экспрессируются Т-клетками, таких как без ограничения PD-1 (предупреждение инактивации); CTLA4 (предупреждение инактивации); TCRa (безопасность - предупреждение аутоиммунитета); TCRb (безопасность - предупреждение аутоиммунитета); CD3Z (безопасность - предупреждение аутоиммунитета); SOCS1 (предупреждение инактивации); SMAD2 (предупреждение инактивации); мишень miR-155 (способствование активации); IFN гамма (снижение CRS); cCBL (продление передачи сигнала); TRAIL2 (предупреждение гибели); PP2A (продление передачи сигнала); ABCG1 (увеличение содержания микродомена холестерина за счет ограничения клиренса холестерина). В некоторых вариантах осуществления мишени РНК представляют собой mRNA, транскрибируемые с генов, которые кодируют компоненты Т-клеточного рецепторного (TCR) комплекса. В некоторых вариантах осуществления по меньшей мере одна из двух или более молекул ингибирующей РНК может снижать экспрессию рецепторов Т-клеток, в иллюстративных вариантах осуществления одного или нескольких эндогенных Т-клеточных рецепторов Т-клетки. В некоторых вариантах осуществления мишень РНК может представлять собой mRNA, транскрибируемую с эндогенного гена TCRα или TCRβ Т-клетки, геном которой содержит первую последовательность нуклеиновой кислоты, кодирующую одну или несколько miRNA. В иллюстративных вариантах осуществления мишень РНК представляет собой mRNA, транскрибируемую с гена TCRα.
[121] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, в некоторых вариантах осуществления CAR представляет собой ограниченный микроокружением биологический (MRB)-CAR. В других вариантах осуществления ASTR CAR связывается с опухолеассоциированным антигеном. В других вариантах осуществления ASTR CAR представляет собой ограниченный микросредой биологический (MRB)-ASTR.
[122] В любом из аспектов способа, представленных непосредственно выше, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифичную нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, и в некоторых случаях третья последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот, которая кодирует по меньшей мере один лимфопролиферативный элемент, который не является ингибирующей молекулой РНК, в некоторых вариантах осуществления любая или все из первой последовательности нуклеиновой кислоты, второй последовательности нуклеиновой кислоты и третьей последовательности нуклеиновой кислоты функционально связаны с рибопереключателем. В некоторых вариантах осуществления рибопереключатель способен связывать нуклеозидный аналог. В некоторых вариантах осуществления нуклеозидный аналог представляет собой противовирусное лекарственное средство.
[123] В некоторых вариантах осуществления представлены способы активации и/или генетической модификации и, как правило, трансдукции покоящихся Т-клеток или NK-клеток, в иллюстративных вариантах осуществления покоящихся Т-клеток, путем приведения в контакт клеток с ретровирусной частицей, описанной в данном документе, и растворимыми антителами к CD3 при 25-200, 50-150, 75-125 или 100 нг/мл. В иллюстративных вариантах осуществления такие способы выполняются без предварительной активации, и их можно проводить, например, в течение 8 часов или меньше, 4 часов или меньше, или в течение от 2 до 8 часов, в течение от 2 до 4 часов, или в течение от 2 до 3 часов.
[124] В определенных аспектах в данном документе представлены способы осуществления адоптивной клеточной терапии у субъекта. В качестве иллюстративного примера способ может включать в себя следующее:
A. сбор крови у субъекта;
B. выделение мононуклеарных клеток периферической крови (PBMC), содержащих покоящиеся Т-клетки и/или покоящиеся NK-клетки;
C. приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат на своей поверхности элемент псевдотипирования, который способен связывать покоящуюся Т-клетку и/или NK-клетку и облегчать слияние мембран не способных к репликации рекомбинантных ретровирусных частиц с ними, при этом указанное приведение в контакт способствует трансдукции покоящихся Т-клеток и/или NK-клеток посредством не способных к репликации рекомбинантных ретровирусных частиц, за счет чего образуются генетически модифицированные T-клетки и/или NK-клетки;
D. повторное введение генетически модифицированных клеток субъекту в течение 36, 24, 12 или даже 8 часов после сбора крови у субъекта, за счет чего у субъекта осуществляется адоптивная клеточная терапию.
[125] В некоторых аспектах, представленных в данном документе, способы с аналогичными стадиями упоминаются как способы генетической модификации и экспансии лимфоцитов субъекта. Специалисту в данной области техники будет понятно, что обсуждение в данном документе применительно к способам и композициям для проведения адоптивной клеточной терапии также применимо к способам генетической модификации и экспансии лимфоцитов субъекта.
[126] Обычно способы адоптивной клеточной терапии по настоящему изобретению осуществляют путем аутологичного переноса, при котором клетки выделяют и/или иным образом получают от субъекта, который должен получать клеточную терапию, или из образца, полученного от такого субъекта. Таким образом, в некоторых аспектах клетки происходят от субъекта, например пациента, нуждающегося в лечении, и клетки после выделения и обработки вводят тому же субъекту. В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, субъект, имеющий заболевание или нарушение, поступает в медицинское учреждение, при этом у субъекта берут кровь с применением известных способов, таких как венепункция. В некоторых вариантах осуществления объем крови, взятой у субъекта, составляет от 10, 15, 20, 25, 30, 35, 40, 50, 75 или 100 мл на нижнем конце диапазона до 200, 250, 300, 350, 400, 500, 750, 1000, 2000 или 2500 мл на верхнем конце диапазона. В некоторых вариантах осуществления от субъекта берут от 10 до 400 мл. В некоторых вариантах осуществления от субъекта берут от 20 до 250 мл крови. В некоторых вариантах осуществления кровь после обработки остается свежей. В любом из вариантов осуществления, раскрытых в данном документе, свежая кровь может представлять собой кровь, взятую у субъекта менее чем за 15, 30, 45, 60, 90, 120, 150 или 180 минут до этого. В некоторых вариантах осуществления кровь обрабатывают в способах, описанных в данном документе, без хранения.
[127] Контакт между Т-клетками и/или NK-клетками и не способными к репликации рекомбинантными ретровирусными частицами обычно способствует трансдукции Т-клеток и/или NK-клеток с помощью не способных к репликации рекомбинантных ретровирусных частиц. В данном описании трансдуцированная Т-клетка и/или NK-клетка включает потомство трансдуцированных ex vivo клеток, которые сохраняют по меньшей мере некоторые из нуклеиновых кислот или полинуклеотидов, которые включены в клетку во время трансдукции ex vivo. В способах, описанных в данном документе, которые описывают «повторное введение» трансдуцированной клетки, следует понимать, что такая клетка обычно не находится в трансдуцированном состоянии, когда ее собирают из крови субъекта. Субъектом в любом из раскрытых в данном документе аспектов может быть, например, животное, млекопитающее и в иллюстративных вариантах осуществления человек.
[128] Не ограничиваясь теорией, в неограничивающих иллюстративных способах доставка полинуклеотида, кодирующего лимфопролиферативный элемент, такой как конститутивно активный мутант IL7, к покоящимся Т-клеткам и/или NK-клеткам ex vivo, которые могут интегрироваться в геном Т-клетки или NK-клетки, обеспечивает эту клетку драйвером для экспансии in vivo без необходимости лимфодеплеции хозяина. Таким образом, в иллюстративных вариантах осуществления субъект не подвергается воздействию средства для лимфодеплеции в течение 1, 2, 3, 4, 5, 6, 7, 10, 14, 21 или 28 дней или в течение 1 месяца, 2 месяцев, 3 месяцев или 6 месяцев после осуществления контакта, во время контакта и/или в течение 1, 2, 3, 4, 5, 6, 7, 10, 14, 21 или 28 дней, или в течение 1 месяца, 2 месяцев, 3 месяцев или через 6 месяцев после того, как модифицированные Т-клетки и/или NK-клетки повторно введены обратно в организм субъекта. Кроме того, в неограничивающих иллюстративных вариантах осуществления способы, представленные в данном документе, могут быть выполнены без воздействия на субъекта средства лимфодеплеции во время стадии, когда не способная к репликации рекомбинантная ретровирусная частица находится в контакте с покоящимися Т-клетками и/или покоящимися NK-клетками субъекта и/или в течение всего способа ex vivo.
[129] Следовательно, способы экспансии генетически модифицированных Т-клеток и/или NK-клеток у субъекта in vivo являются особенностью некоторых вариантов осуществления настоящего изобретения. В иллюстративных вариантах осуществления такие способы не допускают размножения ex vivo или практически не допускают размножения.
[130] Весь этот способ/процесс от забора крови у субъекта с повторным введением крови обратно субъекту после трансдукции ex vivo Т-клеток и/или NK-клеток, в неограничивающих иллюстративных вариантах осуществления в данном документе может происходить в течение периода времени менее 48 часов, менее 36 часов, менее 24 часов, менее 12 часов, менее 11 часов, менее 10 часов, менее 9 часов, менее 8 часов, менее 7 часов, менее 6 часов, менее 5 часов, менее 4 часов, менее 3 часов, 2 часов или менее 2 часов. В других вариантах осуществления весь способ/процесс от забора/сбора крови от субъекта до повторного введения крови обратно субъекту после трансдукции ex vivo Т-клеток и/или NK-клеток, в неограничивающих иллюстративных вариантах осуществления в данном документе происходит в течение некоторого периода времени от 1 часа до 12 часов, или от 2 часов до 8 часов, или от 1 часа до 3 часов, или от 2 часов до 4 часов, или от 2 часов до 6 часов, или от 4 часов до 12 часов, или от 4 часов до 24 часов, или от 8 часов до 24 часов, или от 8 часов до 36 часов, или от 8 часов до 48 часов, или от 12 часов до 24 часов, или от 12 часов до 36 часов, или от 12 часов и 48 часов, или в течение периода времени от 15, 30, 60, 90, 120, 180 и 240 минут на нижнем конце диапазона до 120, 180 и 240, 300, 360, 420 и 480 минут на верхнем конце диапазона. В других вариантах осуществления весь способ/процесс от забора/сбора крови у субъекта до повторного введения крови обратно субъекту после трансдукции ex vivo Т-клеток и/или NK-клеток происходит в течение периода времени от 1, 2, 3, 4, 6, 8, 10 и 12 часов на нижнем конце диапазона до 8, 9, 10, 11, 12, 18, 24, 36 или 48 часов на верхнем конце диапазона. В некоторых вариантах осуществления генетически модифицированные Т-клетки и/или NK-клетки отделяют от не способных к репликации рекомбинантных ретровирусных частиц по истечении периода времени, в течение которого происходит контакт.
[131] В некоторых вариантах осуществления любого из способов, описанных в данном документе, который включает стадию сбора крови и стадию трансдукции лимфоцитов, в иллюстративных вариантах осуществления Т-клеток и/или NK-клеток, включая покоящиеся Т-клетки и NK-клетки, способ сбора крови посредством трансдукции T-клетки и/или NK-клетки не включает стадию удаления моноцитов путем инкубации на прикрепленном субстрате более 4 часов в одном варианте, более 6 часов в другом варианте или более 8 часов в другом варианте. В одном иллюстративном варианте осуществления способ сбора крови посредством трансдукции Т-клеток и/или NK-клеток не включает инкубацию в течение ночи на прикрепленном субстрате для удаления моноцитов. В другом варианте осуществления способ сбора крови посредством трансдукции Т-клеток и/или NK-клеток включает стадию удаления моноцитов путем инкубации на прикрепленном субстрате в течение не более 30 минут, 1 часа или 2 часов. В другом варианте осуществления способ взятия крови у субъекта посредством трансдукции лимфоцитов, в иллюстративных вариантах осуществления Т-клеток и/или NK-клеток, включая покоящиеся Т-клетки и/или NK-клетки, не включает стадию удаления моноцитов путем инкубации на прикрепленном субстрате. В другом варианте осуществления способ сбора крови у субъекта посредством трансдукции лимфоцитов, в иллюстративных вариантах осуществления Т-клеток и/или NK-клеток, включая покоящиеся Т-клетки и/или NK-клетки, включает то, что Т-клетки и/или NK-клетки не инкубируют или подвергают воздействию бычьей сыворотки, такой как бычья сыворотка для культивирования клеток, например, фетальная бычья сыворотка, во время осуществления способа.
[132] В некоторых вариантах осуществления любого из способов, описанных в данном документе, который включает стадию сбора крови и стадию трансдукции лимфоцитов, в иллюстративных вариантах осуществления Т-клеток и/или NK-клеток, включая покоящиеся Т-клетки и NK-клетки, способ сбора крови от субъекта посредством повторного введения Т-клеток и/или NK-клеток субъекту не включает стадию удаления моноцитов путем инкубации на прикрепленном субстрате более 4 часов в одном варианте, или более 6 часов в другом варианте или более 8 часов в другом варианте. В одном иллюстративном варианте осуществления способ сбора крови у субъекта путем повторного введения Т-клеток и/или NK-клеток субъекту не включает инкубацию в течение ночи на прикрепленном субстрате для удаления моноцитов. В другом варианте осуществления способ сбора крови от субъекта посредством повторного введения Т-клеток и/или NK-клеток субъекту включает стадию удаления моноцитов путем инкубации на прикрепленном субстрате в течение не более 30 минут, 1 часа или 2 часов. В другом варианте осуществления способ сбора крови от субъекта посредством повторного введения Т-клеток и/или NK-клеток субъекту не включает стадию удаления моноцитов путем инкубации на прикрепленном субстрате. В другом варианте осуществления способ сбора крови от субъекта посредством повторного введения Т-клеток и/или NK-клеток субъекту, Т-клетки и/или NK-клетки не инкубируют не подвергают воздействию бычьей сыворотки, такой как бычья сыворотки для культивирования клеток, например, фетальная бычья сыворотка, во время осуществления способа.
[133] Поскольку способы, представленные в данном документе, для адоптивной клеточной терапии и родственные способы модификации покоящихся Т-клеток и/или покоящихся NK-клеток ex vivo перед их экспансией in vivo, могут выполняться за значительно меньшее время, чем в предшествующих способах, фундаментальные улучшения в уходе за пациентами и безопасности, а также возможность изготовления продукта, стали возможными. Таким образом, ожидается, что такие процессы будут благоприятными с точки зрения регулирующих органов, ответственных за одобрение таких способов, когда они осуществляются in vivo в терапевтических целях. Например, субъект в неограничивающих примерах может оставаться в том же здании (например, в инфузионной клинике) или комнате, где находится инструмент, обрабатывающий его кровь или образец, в течение всего времени, пока образец обрабатывается до того, как модифицированные Т-клетки и/или NK-клетки повторно вводят пациенту. В неограничивающих иллюстративных вариантах осуществления субъект остается в пределах линии исследовательского центра и/или в пределах 100, 50, 25 или 12 футов или расстояния руки от своей крови или клеток, которые обрабатываются, в течение всего способа/процесса с момента забора крови/сбора крови от субъекта до повторного введения крови субъекту после трансдукции ex vivo Т-клеток и/или NK-клеток. В других неограничивающих иллюстративных вариантах осуществления субъект остается бодрствующим и/или по меньшей мере один человек может продолжать контролировать кровь или клетки субъекта, которые обрабатываются, на протяжении и/или непрерывно в течение всего способа/процесса забора крови/сбора крови от субъекта для повторного введения крови субъекту после трансдукции ex vivo Т-клеток и/или NK-клеток. В связи с улучшениями, представленными в данном документе, весь способ/процесс адоптивной клеточной терапии и/или трансдукции покоящихся Т-клеток и/или NK-клеток от забора/сбора крови от субъекта до повторного введения крови субъекту после трансдукции ex vivo Т-клеток и/или NK-клеток может выполняться человеком под постоянным контролем. В других неограничивающих иллюстративных вариантах осуществления ни в один момент времени весь способ/процесс от забора/сбора крови от субъекта до повторного введения крови субъекту после трансдукции ex vivo Т-клеток и/или NK-клеток, клетки крови не инкубируют в комнате, в которой нет человека. В других неограничивающих иллюстративных вариантах осуществления весь способ/процесс от забора/сбора крови от субъекта до повторного введения крови субъекту после трансдукции ex vivo Т-клеток и/или NK-клеток, выполняется рядом с субъектом и/или в той же комнате, где находится субъект, и/или рядом с кроватью или стулом субъекта. Таким образом, можно избежать ошибок в идентификации образцов, а также длительных и дорогостоящих инкубаций в течение нескольких дней или недель. Это дополнительно обеспечивается тем фактом, что способы, представленные в данном документе, легко адаптируются к закрытым и автоматизированным системам обработки крови, где образец крови и его компоненты, которые будут повторно введены субъекту, контактируют только с разовыми компонентами для одноразового применения.
[134] Способы проведения адоптивной клеточной терапии, представленные в данном документе, обычно включают 1) способы трансдукции лимфоцитов, таких как Т-клетка (Т-клетки) или NK-клетка (NK-клетки), которые в иллюстративных вариантах осуществления представляют собой покоящуюся (покоящиеся) Т-клетку (Т-клетку) и/или NK-клетку (NK-клетки), и/или включают 2) способы генетической модификации лимфоцитов, таких как Т-клетка (Т-клетки) или NK-клетка (NK-клетки), которые в иллюстративных вариантах осуществления представляют собой покоящуюся (покоящиеся) Т-клетку (Т-клетку) и/или NK-клетку (NK-клетки), каждый из которых (1 и 2) сам по себе составляет отдельные аспекты настоящего изобретения. Такие способы могут выполняться с другими стадиями, указанными в данном документе, или без них, для осуществления адоптивной клеточной терапии. В способах адоптивной клеточной терапии и любом способе, представленном в данном документе, который включает трансдукцию покоящихся Т-клеток и/или покоящихся NK-клеток ex vivo, обычно нейтрофилы/гранулоциты отделяют от клеток крови до того, как клетки приводят в контакт с не способными к репликации рекомбинантными ретровирусными частицами. В некоторых вариантах осуществления мононуклеарные клетки периферической крови (PBMC), включая лимфоциты периферической крови (PBL), такие как Т-клетки и/или NK-клетки, выделяют от других компонентов образца крови с использованием, например, афереза и/или центрифугирования в градиенте плотности. В некоторых вариантах осуществления нейтрофилы удаляют до того, как РВМС, и/или Т-клетки, и/или NK-клетки будут обработаны, приведены в контакт с не способной к репликации рекомбинантной ретровирусной частицей, трансдуцированы или трансфицированы. По отношению к субъекту, подлежащему лечению, клетки могут быть аллогенными и/или аутологичными.
[135] В качестве неограничивающих примеров в некоторых вариантах осуществления способов трансдукции или генетической модификации в данном документе PBMC выделяют с использованием системы обработки клеток Sepax или Sepax 2 (BioSafe). В некоторых вариантах осуществления PBMC выделяют с использованием клеточного процессора CliniMACS Prodigy (Miltenyi Biotec). В некоторых вариантах осуществления используется автоматический сепаратор для афереза, который берет кровь у субъекта, пропускает кровь через устройство, которое сортирует определенный тип клеток (например, PBMC), и возвращает остаток обратно в организм субъекта. Центрифугирование в градиенте плотности можно проводить после афереза. В некоторых вариантах осуществления PBMC выделяют с использованием устройства с лейкоредукционным фильтром. В некоторых вариантах осуществления сортировка клеток, активируемая магнитными гранулами, затем используется для очистки конкретной популяции клеток от PBMC, таких как, например, PBL или их подмножество, в соответствии с клеточным фенотипом (т.е. положительный отбор). Также можно использовать другие способы очистки, такие как, например, адгезия субстрата, при котором используется субстрат, имитирующий среду, с которой сталкиваются Т-клетки во время рекрутинга, способствуя их прилипанию и мигрированию, или отрицательный отбор, в котором нежелательные клетки нацеливают на удаление с помощью комплексов антител, которые нацелены на нежелательные клетки. В некоторых вариантах осуществления розеткообразование эритроцитов можно использовать для очистки клеток.
[136] В некоторых иллюстративных вариантах осуществления любого из соответствующих аспектов в данном документе PBL включают в себя Т-клетки и/или NK-клетки. Т-клетки и/или NK-клетки, которые приводят в контакт посредством не способных к репликации рекомбинантных ретровирусных частиц по настоящему изобретению в определенных вариантах осуществления, описанных в данном документе, например, в способах модификации лимфоцитов и способах проведения адоптивной клеточной терапии, в основном представляют собой покоящиеся Т-клетки. В некоторых вариантах осуществления Т-клетки и/или NK-клетки состоят от 95 до 100% покоящихся клеток (Ki-67-). В некоторых вариантах осуществления Т-клетки и/или NK-клетки, которые приводят в контакт посредством не способных к репликации рекомбинантных ретровирусных частиц, включают от 90, 91, 92, 93, 94 и 95% покоящихся клеток на нижнем конце диапазона до 96, 97, 98, 99 или 100% покоящихйся клеток на верхнем конце диапазона. В некоторых вариантах осуществления Т-клетки и/или NK-клетки включают наивные клетки.
[137] В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, Т-клетки и/или NK-клетки приводят в контакт ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, для генетической модификации Т-клеток и/или NK-клеток, для того, чтобы вызвать целевой иммунный ответ у субъекта при повторном введении в организм субъекта. В течение периода контакта не способные к репликации рекомбинантные ретровирусные частицы идентифицируются и связываются с Т-клетками и/или NK-клетками, и в этот момент мембраны ретровирусов и клеток-хозяев начинают сливаться. Затем в процессе трансдукции генетический материал из не способных к репликации рекомбинантных ретровирусных частиц попадает в Т-клетки и/или NK-клетки и встраивается в ДНК клетки-хозяина. Известны способы лентивирусной трансдукции. Иллюстративные способы описаны, например, в Wang et al. (2012) J. Immunother. 35(9): 689-701; Cooper et al. (2003) Blood. 101:1637-1644; Verhoeyen et al. (2009) Methods Mol Biol. 506: 97-114; и Cavalieri et al. (2003) Blood. 102(2): 497-505.
[138] Многие из способов, представленных в данном документе, включают трансдукцию Т-клеток и/или NK-клеток. В данной области известны способы трансдукции Т-клеток и/или NK-клеток ex vivo с помощью не способных к репликации рекомбинантных ретровирусных частиц, таких как не способные к репликации рекомбинантные лентивирусные частицы. Способы, представленные в данном документе в иллюстративных вариантах осуществления, не требуют стимуляции или активации ex vivo. Таким образом, этой обычной стадии в предшествующих способах можно избежать в настоящем способе, хотя стимулирующие молекулы ex vivo, такие как гранулы на основе антител к CD3 и/или антител к CD28, могут присутствовать во время трансдукции. Однако в иллюстративных способах, представленных в данном документе, стимуляция ex vivo не требуется. В определенных иллюстративных способах можно применять от 3 до 10 множественности заражения (MOI), а в некоторых вариантах осуществления от 5 до 10 единиц MOI не способных к репликации рекомбинантных ретровирусных частиц, например, лентивирусных частиц.
[139] Реакция трансдукции может проводиться в закрытой системе, такой как система Sepax, как обсуждается в данном документе, при этом реакция трансдукции может проводиться в одноразовых пакетах, загруженных в систему. Клетки крови, такие как PBMC, из собранного образца крови от субъекта, могут контактировать с не способными к репликации рекомбинантными ретровирусными частицами, описанными в данном документе, в пакете, как только эти клетки крови отделены, выделены и/или очищены от гранулоцитов, включая нейтрофилы, которые обычно не присутствуют на стадии приведения в контакт (т.е. реакции трансдукции).
[140] Не способные к репликации рекомбинантные ретровирусные частицы могут быть введены в пакет, который содержит выделенные PBMC, таким образом контактируя с PBMC. Время от сбора крови от субъекта до момента, когда клетки крови, такие как PBMC, добавляются в реакционный мешок для трансдукции, может составлять в некоторых примерах от 30 минут до 4 часов, от 30 минут до 2 часов или приблизительно 1 часа. К реакционной смеси для трансдукции могут быть добавлены добавки, такие как среда, человеческий сывороточный альбумин, сыворотка с АВ+ человека и/или сыворотка, полученная от субъекта. Обычно присутствуют среды, такие как среды, известные в данной области техники для способов ex vivo (в качестве неограничивающих примеров, среды X-VIVO 15 (Lonza) или CTS (Thermo Fisher Scientific). К реакционной смеси для трансдукции могут быть добавлены поддерживающие цитокины, такие как IL2, IL7 или IL15, или цитокины, обнаруженные в HSA.
[141] Реакционную смесь для трансдукции можно инкубировать при температуре от 23 до 39 °C, а в некоторых иллюстративных вариантах осуществления при 37 °C. В некоторых вариантах осуществления реакцию трансдукции можно проводить при 37-39 °C для более быстрого слияния/трансдукции. dGTP может быть добавлен в реакцию трансдукции. Смесь для реакции трансдукции можно инкубировать в течение от 1 до 12 часов, а в некоторых вариантах осуществления от 6 до 12 часов до проведения отмывки, независимо от того, будут ли такие клетки изучаться in vitro, ex vivo или введены субъекту. Соответственно, в некоторых вариантах осуществления, где клетки вводят субъекту после трансдукции, до того, как трансдуцированные Т-клетки и/или NK-клетки вводят обратно субъекту, клетки промывают для удаления реакционной смеси для трансдукции перед тем, как снова ввести субъекту. Например, систему, такую как инструмент Sepax, можно использовать для промывки клеток, например, с помощью 10-50 мл промывочного раствора, перед тем как трансдуцированные клетки снова инфузировать в организм субъекта. В некоторых вариантах осуществления нейтрофилы удаляют до того, как РВМС, и/или Т-клетки, и/или NK-клетки будут обработаны, приведены в контакт с не способными к репликации рекомбинантными ретровирусными частицами, трансдуцированы или трансфицированы.
[142] В иллюстративном варианте осуществления адоптивной клеточной терапии кровь у пациента собирают в пакет для крови, и пакет для крови присоединяется к системе обработки клеток, такой как система обработки клеток Sepax. PBMC, выделенные с использованием системы обработки клеток, собирают в пакет, приводят в контакт с не способными к репликации рекомбинантными ретровирусными частицами, в условиях, достаточных для трансдукции Т-клеток и/или NK-клеток, и инкубируют. После инкубации пакет, содержащий смесь РВМС и не способных к репликации рекомбинантных ретровирусных частиц, присоединяют к системе обработки клеток и РВМС промывают. Промытые PBMC собирают в пакет и повторно вводят субъекту. В некоторых вариантах осуществления весь способ, от сбора крови до повторного введения трансдуцированных Т- и/или NK-клеток, осуществляется в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 15, 18 или 24 часов. В иллюстративных вариантах осуществления весь способ осуществляется в течение 12 часов.
[143] В некоторых вариантах осуществления целевые клетки для не способных к репликации рекомбинантных ретровирусных частиц представляют собой PBL. В некоторых вариантах осуществления целевые клетки представляют собой Т-клетки и/или NK-клетки. В некоторых вариантах осуществления Т-клетки представляют собой Т-клетки-хелперы и/или Т-клетки-киллеры.
[144] В некоторых вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы, представленные в данном документе, имеют на своей поверхности элементы псевдотипирования, которые способны связываться с Т-клетками и/или NK-клетками и способствовать слиянию с ними мембран не способных к репликации рекомбинантных ретровирусных частиц. В других вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы имеют на своей поверхности активирующие элементы, которые способны связываться с покоящимися Т-клетками и/или NK-клетками. В других вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы имеют на своей поверхности мембраносвязанные цитокины. В некоторых вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы содержат полинуклеотид, имеющий одну или несколько транскрипционных единиц, кодирующих один или несколько сконструированных сигнальных полипептидов, один или несколько из которых содержат один или несколько лимфопролиферативных элементов. В других вариантах осуществления, когда используются два сигнальных полипептида, один содержит по меньшей мере один лимфопролиферативный элемент, а другой обычно представляет собой химерный антигенный рецептор (CAR), который содержит антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. Как указано в данном документе, активирующий (активирующие) элемент (элементы), который (которые) обычно связан (связаны) с поверхностью не способной к репликации рекомбинантной ретровирусной частицы, представленной в данном документе, способен контактировать и в результате контакта с покоящимися Т-клетками и/или NK-клетками в течение достаточного периода время и в соответствующих условиях активирует покоящиеся Т-клетки и/или NK-клетки. Следует понимать, что такая активация происходит с течением времени во время стадии приведения в контакт способов, описанных в данном документе. Кроме того, будет понятно, что в некоторых вариантах осуществления, где элемент псевдотипирования обнаружен на поверхности не способной к репликации рекомбинантной ретровирусной частицы, которая связывает Т-клетку и/или NK-клетку, в способах, описанных в данном документе, активация может быть индуцирована связыванием элемент псевдотипирования. В этих вариантах осуществления элемент активации является необязательным.
[145] Дополнительные детали, касающиеся элемента псевдотипирования, элемента активации, мембраносвязанного цитокина, сконструированного сигнального полипептида, лимфопролиферативного элемента и CAR, представлены в других разделах данного документа.
[146] В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, трансдуцируется от 5% до 90% общего количества лимфоцитов, собранных из крови. В некоторых вариантах осуществления процент лимфоцитов, которые трансдуцируют, составляет от 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 и 60% на нижнем конце диапазона и до 50, 55, 60, 65, 70, 75, 80, 85 и 90% на верхнем конце диапазона. В некоторых вариантах осуществления процент лимфоцитов, которые трансдуцируют, составляет по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40 %, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55% или по меньшей мере 60%.
[147] В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, генетически модифицированные Т-клетки и/или NK-клетки вводят обратно, вводят повторно или вводят повторно субъекту без дополнительных манипуляций ex vivo, таких как стимуляция и/или активация Т-клеток и/или NK. В способах предшествующего уровня техники манипуляцию ex vivo используют для стимуляции/активации Т-клеток и/или NK-клеток и для экспансии генетически модифицированных Т-клеток и/или NK-клеток перед введением генетически модифицированных Т-клеток и/или NK-клеток в организм субъекта. В способах предшествующего уровня техники это обычно занимает несколько дней или несколько недель и требует, чтобы субъект вернулся в клинику для инфузии крови через несколько дней или несколько недель после первоначального забора крови. В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, Т-клетки и/или NK-клетки не стимулируют ex vivo воздействием твердых подложек к антителу к CD3/антителу к CD28, таких как, например, гранулы, покрытые антителом к CD3/антителом к CD28, перед приведением в контакт Т-клеток и/или NK-клеток с не способными к репликации рекомбинантными ретровирусными частицами. Таким образом, в данном документе представлен способ без размножения ex vivo. В других вариантах осуществления генетически модифицированные Т-клетки и/или NK-клетки не экспандируют ex vivo или экспандируют только для небольшого количества клеточных делений (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раундов деления клеток), но они скорее экспандируются или преимущественно экспанидруются in vivo, т. е. в организме субъекта. В некоторых вариантах осуществления не добавляют никаких дополнительных сред, чтобы обеспечить дальнейшую экспансию клеток. В некоторых вариантах осуществления клеточное производство PBL не происходит, пока PBL приводят в контакт с не способными к репликации рекомбинантными ретровирусными частицами. В иллюстративных вариантах осуществления клеточное производство PBL не происходит, пока PBL существуют ex vivo. В предыдущих способах адоптивной клеточной терапии субъектов подвергали лимфодеплеции перед повторным введением генетически модифицированных Т-клеток и/или NK-клеток. В некоторых вариантах осуществления пациенты или субъекты не подвергаются лимфодеплеции до забора крови. В некоторых вариантах осуществления пациенты или субъекты не подвергаются лимфодеплеции до повторного введения генетически модифицированных Т-клеток и/или NK-клеток.
[148] В любом из вариантов осуществления, раскрытых в данном документе, количество Т-клеток и/или NK-клеток, которые необходимо повторно ввести субъекту, может составлять от 1 x 103, 2,5 x 103, 5 x 103, 1 x 104, 2,5 x 104, 5 x 104, 1 x 105, 2,5 x 105, 5 x 105, 1 x 106, 2,5 x 106, 5 x 106 и 1 x 107 клеток/кг на нижнем конце диапазона до 5 x 104, 1 x 105, 2,5 x 105, 5 x 105, 1 x 106, 2,5 x 106, 5 x 106, 1 x 107, 2,5 x 107, 5 x 107 до 1 x 108 клеток/кг на верхнем конце диапазона. В иллюстративных вариантах осуществления количество Т-клеток и/или NK-клеток, которые необходимо повторно ввести субъекту, может составлять от 1 x 104, 2,5 x 104, 5 x 104 и 1 x 105 клеток/кг на нижнем конце диапазона до 2,5 x 104, 5 x 104, 1 x 105, 2,5 x 105, 5 x 105 и 1 x 106 клеток/кг на верхнем конце диапазона. В некоторых вариантах осуществления количество PBL, которые необходимо повторно ввести субъекту, может составлять менее чем 5 x 105, 1 x 106, 2,5 x 106, 5 x 106, 1 x 107, 2,5 x 107, 5 x 107 и 1 x 108 клеток на нижнем конце диапазона до 2,5 x 106, 5 x 106, 1 x 107, 2,5 x 107, 5 x 107, 1 x 108, 2,5 x 108, 5 x 108 и 1 x 109 клеток на верхнем конце диапазона. В некоторых вариантах осуществления количество Т-клеток и/или NK-клеток, доступных для повторного введения субъекту или пациенту массой 70 кг, составляет от 7 x 105 до 2,5 x 108 клеток. В других вариантах осуществления количество Т-клеток и/или NK-клеток, доступных для трансдукции, составляет примерно 7 x 106 плюс или минус 10%.
[149] В способах, раскрытых в данном документе, вся процедура адоптивной клеточной терапии, от забора крови до повторного введения генетически модифицированных Т-клеток и/или NK-клеток, может преимущественно выполняться за более короткое время, чем в предыдущих способах. В некоторых вариантах осуществления вся процедура адоптивной клеточной терапии может быть выполнена менее чем за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 15, 18 или 24 часа. В иллюстративных вариантах осуществления вся процедура адоптивной клеточной терапии может быть выполнена менее чем за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов. В некоторых вариантах осуществления вся процедура адоптивной клеточной терапии может выполняться в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 15 часов на нижнем конце диапазона и 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 15, 18 или 24 часов на верхнем конце диапазона.
[150] В некоторых вариантах осуществления в данном документе закрытая система используется для обработки PBMC, например, в способах, которые включают генетически модифицирующие PBMC, NK-клетки и, в иллюстративных вариантах осуществления Т-клетки, например, путем трансдукции PBMC или их подгруппы (подгрупп). Такие способы можно применять для генетической модификации лимфоцитов для применения в научных исследованиях, коммерческом производстве или терапевтических способах. Например, такие способы могут включать перенос мононуклеарных клеток периферической крови (PBMC), включая NK-клетки, T-клетки или и то, и другое, и в некоторых вариантах осуществления покоящиеся T-клетки и/или покоящиеся NK-клетки из сосуда в реакционную смесь для трансдукции внутри закрытой системы, которая, таким образом, не подвергается воздействию окружающей среды. Сосуд, например, может представлять собой трубку, пакет, шприц или другой контейнер. В некоторых вариантах осуществления сосуд представляет собой сосуд, которое используется в исследовательском центре. В некоторых вариантах осуществления сосуд представляет собой сосуд, используемый в коммерческом производстве. В других вариантах осуществления сосуд может представлять собой сосуд для сбора крови, используемый в способе сбора крови. Способы генетической модификации в данном документе обычно включают стадию приведения в контакт, на которой лимфоциты приводят в контакт с не способной к репликации рекомбинантной ретровирусной частицей. В некоторых вариантах осуществления приведение в контакт может осуществляться в сосуде, например, в пакете для крови. В других вариантах осуществления PBMC или их подфракция могут быть перенесены из сосуда в другой сосуд (например, из первого сосуда во второй сосуд) в закрытой системе для приведения в контакт. Второй сосуд может представлять собой компартмент для обработки клеток закрытого устройства, такого как устройство G-Rex. В некоторых вариантах осуществления после приведения в контакт генетически модифицированные (например, трансдуцированные) клетки могут быть перенесены в другой сосуд внутри закрытой системы (т.е. без воздействия окружающей среды). Либо до, либо после этого переноса клетки обычно промывают в закрытой системе для удаления практически всех или всех ретровирусных частиц. В некоторых вариантах осуществления способ, описанный в этом абзаце, от переноса PBMC или их фракции в сосуд, в котором будет происходить приведение в контакт (например, трансдукция) посредством промывки клеток после приведения в контакт, выполняется в течение 12 часов. В некоторых вариантах осуществления это выполняется в течение 1, 2, 3 или 4 часов на нижней границе диапазона и 4, 8, 10 или 12 часов на верхней границе диапазона.
[151] В некоторых вариантах осуществления, представленных в данном документе, стадии взятия образца крови от субъекта, приведения в контакт Т-клеток и/или NK-клеток с не способными к репликации рекомбинантными ретровирусными частицами и/или введения генетически модифицированных Т-клеток и/или NK-клеток в организм субъекта, выполняются в закрытой системе. Закрытая система представляет собой способ культивирования, который обычно закрыт или полностью закрыт от контаминации. Таким образом, такая система или способ не подвергает клетки воздействию окружающей среды. Преимущество настоящего изобретения состоит в том, что в нем представлены способы проведения терапии на основе CAR в закрытой системе. Одним из самых больших рисков для безопасности и регулирующего контроля в процедуре обработки клеток является риск контаминации вследствие частого воздействия окружающей среды, как это наблюдается в традиционных открытых системах культивирования клеток. Для снижения этого риска, особенно в отсутствие антибиотиков, были разработаны некоторые коммерческие способы, ориентированные на применение разового (одноразового) оборудования. Однако даже при их применении в асептических условиях всегда существует риск контаминации в результате открытия колб для отбора образцов или добавления дополнительных питательных сред. Для преодоления этой проблемы в данном документе представлен способ с замкнутой системой, при этом способ разработан и может применяться таким образом, чтобы продукт не подвергался воздействию внешней среды. Это важно, поскольку окружающая среда обычно не является стерильной. Перенос материала происходит через стерильные соединения или сварочные соединения труб. Воздух для газообмена проходит через газопроницаемую мембрану или аналогичные другие добавки, через фильтр 0,2 мкм для предупреждения воздействия окружающей среды.
[152] В некоторых вариантах осуществления закрытая система включает систему циркуляции ex vivo, соединенную с системой кровообращения in vivo субъекта так, чтобы кровь отбирали, а затем она циркулировала в систему кровообращения ex vivo перед введением обратно субъекту. В некоторых вариантах осуществления система циркуляции ex vivo включает систему или устройство для выделения PBL и/или систему или устройство для выделения Т-клеток и/или NK-клеток в комбинации с системой или устройством для воздействия на клетки не способных к репликации рекомбинантных ретровирусных частиц. В некоторых вариантах осуществления закрытая система не позволяет Т-клеткам и/или NK-клеткам подвергаться воздействию воздуха.
[153] Такие способы с применением закрытой системы могут быть осуществлены с помощью коммерчески доступных устройств. Например, способ может быть осуществлен в устройствах, адаптированных для получения Т-клеток в закрытой системе. К таким устройствам относятся G-Rex™, WAVE Bioreactor™, пакеты OriGen PermaLife™ и пакеты VueLife®.
[154] В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, генетически модифицированные Т-клетки и/или NK-клетки в организме субъекта подвергаются воздействию соединения, которое связывается с присутствующим в них элементом управления in vivo, в котором этот элемент управления является частью генетического материала, введенного путем репликации не способных к рекомбинации ретровирусных частиц. В некоторых вариантах осуществления элемент управления может представлять собой рибопереключатель, и соединение может связывать аптамерный домен рибопереключателя. В некоторых вариантах осуществления элемент управления может представлять собой молекулярный шаперон. В любом из вариантов осуществления, раскрытых в данном документе, соединение может представлять собой нуклеозидный аналог. В некоторых вариантах осуществления нуклеозидный аналог может представлять собой противовирусное лекарственное средства на основе нуклеозидного аналога, при этом противовирусное лекарственное средство представляет собой соединение, одобренное Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для противовирусного лечения или в качесвте соединения для клинического исследования противовирусных средств в США. В иллюстративных вариантах осуществления соединение может представлять собой ацикловир или пенцикловир. В некоторых вариантах осуществления соединение может представлять собой фамцикловир, пероральное пролекарственное средство на основе пенцикловира или валацикловира, пероральное пролекарственное средство на основе ацикловира. Связывание соединения с элементом управления влияет на экспрессию введенного генетического материала и, следовательно, на размножение генетически модифицированных Т-клеток и/или NK-клеток.
[155] В некоторых вариантах осуществления противовирусное лекарственное средство или пролекарственное средство на основе нуклеозидного аналога, например, ацикловир, валацикловир, пенцикловир или фамцикловир, вводят субъекту до, одновременно и/или после выделения PBL из крови субъекта и до того, как Т-клетки и/или NK-клетки приводят в контакт с не способными к репликации рекомбинации ретровирусными частицами. В некоторых вариантах осуществления лекарственное средство или пролекарственное средство на основе нуклеозидного аналога вводят субъекту в течение от 5, 10, 15, 30 и 60 минут на нижнем конце диапазона до 1,5, 2, 3, 4, 5, 6, 8, 12 или 24 часов на верхнем конце диапазона до выделения PBL из крови или до того, как Т-клетки и/или NK-клетки приводят в контакт с неспособными к репликации рекомбинантными ретровирусными частицами. В других вариантах осуществления лекарственное средство или пролекарственное средство на основе нуклеозидного аналога вводят субъекту в течение от 1,5, 2, 3, 4, 5, 6, 8, 12 или 24 часов на нижнем конце диапазона и до 1/2, 1, 2, 3, 4, 5, 6, 7, 10, 14, 21 или 28 дней на верхнем конце диапазона после выделения PBL из крови и приведения в контакт Т-клеток и/или NK-клеток с неспособными к репликации рекомбинантными ретровирусными частицами в способах, представленных в данном документе. В некоторых вариантах осуществления лекарственное средство или пролекарственное средство на основе нуклеозидного аналога вводят субъекту в течение по меньшей мере 1,5, 2, 3, 4, 5, 6, 8, 12 или 24 часов или по меньшей мере 2, 3, 4, 5, 6, 7, 10, 14, 21 или 28 дней после выделения PBL из крови и приведения в контакт Т-клеток и/или NK-клеток с неспособными к репликации рекомбинантными ретровирусными частицами в способах, представленных в данном документе. В некоторых вариантах осуществления лекарственное средство или пролекарственное средство на основе нуклеозидного аналога вводят субъекту в течение по меньшей мере 1, 2, 3, 4, 5, 7, 10, 14, 21, 28, 30, 60, 90 или 120 дней или 5, 6, 9, 12, 24, 36, 48, 60, 72, 84, 96, 120 месяцев или неопределенно долго после того, как PBL были повторно введены субъекту. В любом из вариантов осуществления, раскрытых в данном документе, лекарственное средство или пролекарственное средство на основе нуклеозидного аналога, можно вводить до и/или во время повторного введения PBL и/или после повторного введения PBL.
[156] В некоторых вариантах осуществления соединение, которое связывается с элементом управления, вводят субъекту один, два, три или четыре раза в день. В некоторых вариантах осуществления суточные дозы соединения предоставляются в течение 1 недели, 2 недель, 4 недель, 3 месяцев, 6 месяцев, 1 года до тех пор, пока субъект не избавится от заболевания, например, рака, или в течение неопределенного срока. Лекарственное средство в иллюстративных вариантах осуществления представляет собой противовирусное лекарственное средство на основе нуклеозидного аналога, который связывается с нуклеозидным аналогом, таким как рибопереключатель, как более подробно раскрыто в данном документе.
[157] Способы доставки лекарственных средств, в независимости от того, являются ли они малыми молекулами или биопрепаратами, известны в данной области техники, и их можно применять в способах, представленных в данном документе. Любые такие способы можно применять для доставки лекарственных средств или кандидатных соединений или антител для применения в способах по настоящему изобретению. Например, обычные пути введения включают неинвазивный пероральный (через рот), местный (кожа), трансмукозальный (назальный, буккальный/сублингвальный, вагинальный, глазной и ректальный) и ингаляционный пути. Многие белковые и пептидные лекарственные средства, такие как моноклональные антитела, необходимо доставлять путем инъекции или с помощью набора наноигл. Например, многие иммунизации основаны на доставке белковых лекарственных средств и часто проводятся путем инъекции.
Сконструированный (сконструированные) сигнальный (сигнальный) полипептид (полипептиды)
[158] В некоторых вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы, используемые для контакта с Т-клетками и/или NK-клетками, содержат полинуклеотид, содержащий одну или несколько транскрипционных единиц, которые кодируют один или несколько сконструированных сигнальных полипептидов. В некоторых вариантах осуществления сконструированный сигнальный полипептид содержит любую комбинацию внеклеточного домена (например, антигенспецифическую нацеленную область или ASTR), необязательного стебля и трансмембранного домена, в сочетании с одним или несколькими внутриклеточными активирующими доменами, одним или несколькими модулирующими доменами (например, костимулирующим доменом) и один или несколько мотивов выживания Т-клеток. В иллюстративных вариантах осуществления по меньшей мере один, два или все сконструированные сигнальные полипептиды представляют собой химерный антигенный рецептор (CAR) или лимфопролиферативный элемент, включая химерный лимфопролиферативный элемент (CLE). В некоторых вариантах осуществления, когда используются два сигнальных полипептида, один кодирует лимфопролиферативный элемент, а другой кодирует химерный антигенный рецептор (CAR), который содержит антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. Специалист в данной области сможет выполнить конфигурацию системы для помещения лимфопролиферативного элемента и CAR на разные полинуклеотиды с аналогичными или разными элементами управления для способов и композиций, раскрытых в данном документе. Специалисту в данной области техники будет понятно, что такие сконструированные полипептиды также могут обозначаться рекомбинантными полипептидами.
Внеклеточный домен
[159] В некоторых вариантах осуществления сконструированный сигнальный полипептид содержит внеклеточный домен, который является представителем пары специфического связывания. Например, в некоторых вариантах осуществления внеклеточный домен может представлять собой внеклеточный домен цитокинового рецептора или его мутанта, или гормонального рецептора или его мутанта. Сообщалось, что такие мутантные внеклеточные домены в некоторых вариантах осуществления являются конститутивно активными при экспрессии по меньшей мере в некоторых типах клеток. В иллюстративных вариантах осуществления такие внеклеточные и трансмембранные домены не содержат область связывания лиганда. Считается, что такие домены не связывают лиганд, если они присутствуют в сконструированном сигнальном полипептиде и экспрессируются в В-клетках, Т-клетках и/или NK-клетках. Мутации в таких мутантах рецептора могут происходить во внеклеточной области околостебельной мембраны. Не ограничиваясь теорией, мутации по меньшйе мере в некоторых внеклеточных доменах (и некоторых внеклеточных трансмембранных доменах) сконструированных сигнальных полипептидов, представленных в данном документе, ответчают за передачу сигналов сконструированного сигнального полипептида в отсутствие лиганда путем объединения активирующих цепей, которые обычно не находятся вместе. Дополнительные варианты осуществления, касающиеся внеклеточных доменов, которые содержат мутации во внеклеточных доменах, можно найти, например, в разделе «Лимфопролиферативный элемент» в данном документе.
[160] В определенных иллюстративных вариантах осуществления внеклеточный домен содержит димеризующийся мотив. В иллюстративном варианте осуществления димеризующийся мотив содержит лейциновую молнию. В некоторых вариантах осуществления лейциновая молния происходит из полипептида jun, например, c-jun. Дополнительные варианты осуществления, касающиеся внеклеточных доменов, которые содержат димеризующийся мотив, можно найти, например, в разделе «Лимфопролиферативный элемент» в данном документе.
[161] В определенных вариантах осуществления внеклеточный домен представляет собой антигенспецифическую нацеленную область (ASTR), иногда называемую в данном документе антигенсвязывающим доменом. Специфические пары связывания включают без ограничения пары связывания антиген-антитело; пары связывания лиганд-рецептор; и тому подобное. Таким образом, представитель пары специфического связывания, подходящей для применения в сконструированном сигнальном полипептиде по настоящему изобретению, содержит ASTR, который представляет собой антитело, антиген, лиганд, рецептор-связывающий домен лиганда, рецептор, лиганд-связывающий домен рецептора и аффитело.
[162] ASTR, подходящий для применения в сконструированном сигнальном полипептиде по настоящему изобретению, может представлять собой любой антигенсвязывающий полипептид. В определенных вариантах осуществления ASTR представляет собой антитело, такое как полноразмерное антитело, одноцепочечное антитело, фрагмент Fab, фрагмент Fab', фрагмент (Fab')2, фрагмент Fv и двухвалентное одноцепочечный антитело или диатело.
[163] В некоторых вариантах осуществления ASTR представляет собой одноцепочечный Fv (scFv). В некоторых вариантах осуществления тяжелая цепь расположена на N-конце легкой цепи в сконструированном сигнальном полипептиде. В других вариантах осуществления легкая цепь расположена на N-конце тяжелой цепи в сконструированном сигнальном полипептиде. В любом из раскрытых вариантов осуществления тяжелая и легкая цепи могут быть разделены линкером, как более подробно обсуждается в данном документе. В любом из раскрытых вариантов осуществления тяжелая или легкая цепь может находиться на N-конце сконструированного сигнального полипептида и обычно является С-концом другого домена, такого как сигнальная последовательность или пептид.
[164] Другие домены распознавания на основе антител (VHH cAb (вариабельные домены верблюжьих антител) и гуманизированные версии, VH IgNAR (вариабельные домены акульих антител) и гуманизированные версии, VH sdAb (однодоменные вариабельные домены антител) и вариабельные домены «верблюжьих» антител подходят для применения со сконструированными сигнальными полипептидами и способами, применяющими сконструированные сигнальные полипептиды по настоящему изобретению. В некоторых случаях домены распознавания на основе Т-клеточного рецептора (TCR), такие как одноцепочечный TCR (scTv, одноцепочечный двухдоменный TCR, содержащий VαVβ), также подходят для применения.
[165] В некоторых вариантах осуществления ASTR может представлять собой мультиспецифические, например, биспецифические антитела. Мультиспецифические антитела обладают специфичностью связывания по меньшей мере с двумя разными сайтами. В определенных вариантах осуществления одна из специфичностей связывания относится к одному целевому антигену, а другая относится к другому целевому антигену. В определенных вариантах осуществления биспецифические антитела могут связываться с двумя разными эпитопами целевого антигена. Биспецифические антитела также можно применять для локализации цитотоксических средств в клетках, которые экспрессируют целевой антиген. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
[166] ASTR, подходящий для применения в сконструированном сигнальном полипептиде по настоящему изобретению, может иметь множество антигенсвязывающих специфичностей. В некоторых случаях антигенсвязывающий домен специфичен для эпитопа, присутствующего в антигене, который экспрессируется (синтезируется) целевой клеткой. В одном примере целевая клетка представляет собой антиген, ассоциированный с раковой клеткой. Антиген, ассоциированный с раковой клеткой, может представлять собой антиген, ассоциированный, например, с клеткой рака молочной железы, клеткой B-клеточной лимфомы, клеткой лимфомы Ходжкина, клеткой рака яичника, клеткой рака предстательной железы, клеткой мезотелиомы, клеткой рака легкого (например, клеткой мелкоклеточного рака легкого), клеткой неходжкинской B-клеточной лимфомы (B-NHL), клеткой рака яичника, клеткой рака предстательной железы, клеткой мезотелиомы, клеткой рака легкого (например, клеткой мелкоклеточного рака легкого), клеткой меланомы, клеткой хронического лимфоцитарного лейкоза, клеткой острого лимфоцитарного лейкоза, клеткой нейробластомы, клеткой глиомы, клеткой глиобластомы, клеткой медуллобластомы, клеткой колоректального рака и т.д. Антиген, ассоциированный с раковой клеткой, также может экспрессироваться незлокачественной клеткой.
[167] Неограничивающие примеры антигенов, с которыми может связываться ASTR сконструированного сигнального полипептида, включают, например, CD19, CD20, CD38, CD30, ERBB2, CA125, MUC-1, простатоспецифический мембранный антиген (PSMA), молекулу поверхностной адгезии CD44, мезотелин, карциноэмбриональный антиген (CEA), рецептор эпидермального фактора роста (EGFR), EGFRvIII, рецептор-2 фактора роста эндотелия сосудов (VEGFR2), антиген, ассоциированный с высокомолекулярной меланомой (HMW-MAA), MAGE-Al, IL-13R-a2, GD2, Axl, Ror2 и тому подобное.
[168] В некоторых случаях представителем пары специфического связывания, подходящей для применения в сконструированном сигнальном полипептиде, является ASTR, который представляет собой лиганд для рецептора. Лиганды включают без ограничения гормоны (например, эритропоэтин, гормон роста, лептин и т.д.); цитокины (например, интерфероны, интерлейкины, некоторые гормоны и т.д.); факторы роста (например, херегулин; фактор роста эндотелия сосудов (VEGF) и тому подобное); интегрин-связывающий пептид (например, пептид, содержащий последовательность Arg-Gly-Asp); и тому подобное.
[169] Если представитель пары специфического связывания в сконструированном сигнальном полипептиде является лигандом, сконструированный сигнальный полипептид может быть активирован в присутствии второго представителя пары специфического связывания, где второй представитель пары специфического связывания является рецептором для лиганда. Например, если лиганд представляет собой VEGF, второй представитель пары специфического связывания может представлять собой рецептор VEGF, включая растворимый рецептор VEGF.
[170] Как отмечалось выше, в некоторых случаях представителем пары специфического связывания, которая включена в сконструированный сигнальный полипептид, является ASTR, который представляет собой рецептор, например, рецептор для лиганда, корецептор и т.д. Рецептором может быть лиганд-связывающий фрагмент рецептора. Подходящие рецепторы включают без ограничения рецептор фактора роста (например, рецептор VEGF); лектин-подобный рецептор подсемейства K клеток-киллеров, полипептид представителя 1 (NKG2D) (рецептор для MICA, MICB и ULB6); рецептор цитокина (например, рецептор IL-13; рецептор IL-2 и т. д.); CD27; рецептор естественной цитотоксичности (NCR) (например, полипептид NKP30 (NCR3/CD337) (рецептор для HLA-B-ассоциированного транскрипта 3 (BAT3) и B7-H6) и т.д.); и т.д.
[171] В некоторых вариантах осуществления любого из представленных в данном документе аспектов, которые включают ASTR, ASTR может быть направлен на промежуточный белок, который связывает ASTR с целевой молекулой, экспрессируемой на целевой клетке. Промежуточный белок может экспрессироваться эндогенно или вводиться экзогенно и может быть природным, сконструированным или химически модифицированным. В определенных вариантах осуществления ASTR может представлять собой антитело-метку на основе ASTR, так что по меньшей мере один меченый промежуточный продукт, обычно конъюгат антитело-метка, включен между меткой, распознаваемой ASTR, и целевой молекулой, обычно целевым белком, экспрессируемым на целевой клетке. Соответственно, в таких вариантах осуществления ASTR связывает метку, и эта метка конъюгирована с антителом, направленным против антигена на целевой клетке, такой как раковая клетка. Неограничивающие примеры меток включают флюоресцеинизотиоцианат (FITC), стрептавидин, биотин, гистидин, динитрофенол, перидинин-хлорофилловый белковый комплекс, зеленый флуоресцентный белок, фикоэритрин (PE), пероксидазу хрена, пальмитоилирование, нитрозилирование, щелочную фосфатазу, окисление глюкозы и белок, связывающий мальтозу. По сути, ASTR содержит молекулу, которая связывает метку.
Ствол
[172] В некоторых вариантах осуществления сконструированный сигнальный полипептид включает ствол, который расположен в части сконструированного сигнального полипептида, лежащей вне клетки и расположенной между ASTR и трансмембранным доменом. В некоторых случаях ствол имеет на по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичен области ствола CD8 дикого типа (TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGG AVHTRGLDFA (SEQ ID NO: 79), на по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичен области ствола CD28 дикого типа (FCKIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKP (SEQ ID NO: 80)) или на по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичен области ствола тяжелой цепи иммуноглобулина дикого типа. В сконструированном сигнальном полипептиде используемый ствол позволяет антигенспецифической нацеленной области и обычно всему сконструированному сигнальному полипептиду сохранять повышенное связывание с целевым антигеном.
[173] Область стебля может иметь длину от около 4 аминокислот до около 50 а.к., например, от около 4 а.к. до около 10 а.к., от около 10 а.к. до около 15 а.к., от около 15 а.к. до около 20 а.к., от около 20 а.к. до около 25 а.к., от около 25 до около 30 а.к., от около 30 а.к. до около 40 а.к. или от около 40 а.к. до около 50 а.к.
[174] В некоторых случаях ствол сконструированного сигнального полипептида содержит по меньшей мере один цистеин. Например, в некоторых случаях ствол может содержать последовательность Cys-Pro-Pro-Cys (SEQ ID NO: 62). При наличии цистеин в стволе первого сконструированного сигнального полипептида может быть доступен для образования дисульфидной связи со стволом второго сконструированного сигнального полипептида.
[175] Стволы могут содержать аминокислотные последовательности шарнирной области иммуноглобулина, известные в данной области техники; см., например, Tan et al. (1990) Proc. Natl. Acad. Sci. USA 87:162; и Huck et al. (1986) Nucl. Acids Res. 14:1779. В качестве неограничивающих примеров шарнирная область иммуноглобулина может содержать домен, на по меньшей мере 50, 60, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% идентичный последовательности для участка длиной по меньшей мере 10, 15, 20 или всех аминокислот любой из следующих аминокислотных последовательностей: DKTHT (SEQ ID NO:63); CPPC (SEQ ID NO:62); CPEPKSCDTPPPCPR (SEQ ID NO:64) (см., например, Glaser et al. (2005) J. Biol. Chem. 280:41494); ELKTPLGDTTHT (SEQ ID NO:65); KSCDKTHTCP (SEQ ID NO:66); KCCVDCP (SEQ ID NO:67); KYGPPCP (SEQ ID NO:68); EPKSCDKTHTCPPCP (SEQ ID NO:69) (шарнир IgGl человека); ERKCCVECPPCP (SEQ ID NO:70) (шарнир IgG2 человека); ELKTPLGDTTHTCPRCP (SEQ ID NO:71) (шарнир IgG3 человека); SPNMVPHAHHAQ (SEQ ID NO:72) (шарнир IgG4 человека); и тому подобное. Ствол может содержать шарнирную область с аминокислотной последовательностью шарнирной области IgG1, IgG2, IgG3 или IgG4 человека. Ствол может содержать одну или несколько аминокислотных замен, и/или вставок, и/или делеций по сравнению с шарнирной областью дикого типа (встречающейся в природе). Например, His229 шарнира IgG1 человека может быть заменен на Tyr таким образом, что ствол содержит последовательность EPKSCDKTYTCPPCP (см., например, Yan et al. (2012) J. Biol. Chem. 287:5891). Ствол может содержать аминокислотную последовательность, полученную из CD8 человека; например, ствол может содержать аминокислотную последовательность: TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD (SEQ ID NO:73) или ее вариант.
Трансмембранный домен
[176] Сконструированный сигнальный полипептид по настоящему изобретению может содержать трансмембранные домены для встраивания в мембрану эукариотической клетки. Трансмембранный домен может располагаться между ASTR и костимулирующим доменом. Трансмембранный домен может быть расположен между стволом и костимулирующим доменом таким образом, что химерный антигенный рецептор содержит в порядке от аминоконца (N-конца) до карбоксильного конца (C-конца): ASTR; ствол; трансмембранный домен; и активирующий домен.
[177] Любой трансмембранный (TM) домен, который обеспечивает вставку полипептида в клеточную мембрану эукариотической клетки (например, клетки млекопитающего), является подходящим для применения в аспектах и вариантах осуществления, раскрытых в данном документе. Неограничивающие примеры доменов TM, подходящих для любого из аспектов или вариантов осуществления, представленных в данном документе, включают домен, на по меньшей мере 50, 60, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот любого из следующих доменов TM или комбинации доменов ствола и доменов TM: a) CD8 альфа TM (SEQ ID NO: 46); b) CD8 бета TM (SEQ ID NO: 47); с) CD4 ствола (SEQ ID NO: 48); г) CD3Z TM (SEQ ID NO: 49); е) CD28 TM (SEQ ID NO: 50); f) CD134 (OX40) TM: (SEQ ID NO:51); g) CD7 TM (SEQ ID NO:52); h) CD8 ствола и TM (SEQ ID NO:75); и i) CD28 ствола и TM (SEQ ID NO:76).
[178] В качестве неограничивающих примеров трансмембранный домен в одном аспекте настоящего изобретения может быть на по меньшей мере 80, 90 или 95% идентичен последовательности трансмембранного домена SEQ ID NO: 46, трансмембранного домена CD8 бета, трансмембранного домена CD4, трансмембранного домена CD3 дзета, трансмембранного домена CD28, трансмембранного домена CD134 или трансмембранного домена CD7.
Внутриклеточный активирующий домен
[179] Внутриклеточные активирующие домены, подходящие для применения в сконструированном сигнальном полипептиде по настоящему изобретению, при активации обычно индуцируют продуцирование одного или нескольких цитокинов; повышенную гибель клеток; и/или повышеную пролиферацию CD8+ T-клеток, CD4+ T-клеток, NKT-клеток, γδ T-клеток и /или нейтрофилов. Активирующие домены также могут обозначаться в данном документе доменами активации. Активирующие домены можно применять в CAR или в лимфопролиферативных элементах, представленных в данном документе.
[180] В некоторых вариантах осуществления внутриклеточный активирующий домен содержит по меньшей мере один (например, один, два, три, четыре, пять, шесть и т.д.) мотивов ITAM, как описано ниже. В некоторых вариантах осуществления внутриклеточный активирующий домен по одному аспекту настоящего изобретения может быть на по меньшей мере 80%, 90% или 95% идентичен последовательности CD3Z, CD3D, CD3E, CD3G, CD79A, CD79B, DAP12, FCER1G, FCGR2A, FCGR2C, DAP10/CD28 или ZAP70, как описано ниже.
[181] Внутриклеточные активирующие домены, подходящие для применения в сконструированном сигнальном полипептиде по настоящему изобретению, содержат внутриклеточные сигнальные полипептиды, содержащие иммунорецепторный мотив активации на основе тирозина (ITAM). Мотив ITAM представляет собой YX1X2L/I, где X1 и X2 независимо представляют собой любую аминокислоту. В некоторых случаях внутриклеточный активирующий домен сконструированного сигнального полипептида содержит 1, 2, 3, 4 или 5 мотивов ITAM. В некоторых случаях мотив ITAM повторяется дважды во внутриклеточном активирующем домене, где первый и второй примеры мотива ITAM отделены друг от друга от 6 до 8 аминокислот, например, (YX1X2L/I)(X3)n(YX1X2L/I), где n представляет собой целое число от 6 до 8, и каждый из 6-8 X3 может представлять собой любую аминокислоту. В некоторых случаях внутриклеточный активирующий домен сконструированного сигнального полипептида содержит 3 мотива ITAM.
[182] Подходящим внутриклеточным активирующим доменом может быть часть, содержащая мотив ITAM, которая получена из полипептида, содержащего мотив ITAM. Например, подходящий внутриклеточный активирующий домен может представлять собой домен, содержащий мотив ITAM, из любого белка, содержащего мотив ITAM. Таким образом, подходящий внутриклеточный активирующий домен не обязательно должен содержать всю последовательность всего белка, из которого он получен. Примеры подходящих полипептидов, содержащих мотив ITAM, включают без ограничения: CD3Z (CD3 дзета); CD3D (CD3 дельта); CD3E (CD3 эпсилон); CD3G (CD3 гамма); CD79A (альфа-цепь белка, ассоциированного с комплексом антигенного рецептора); DAP12; и FCER1G (гамма-цепь рецептора I Fc-эпсилон).
[183] В некоторых случаях внутриклеточный активирующий домен происходит из дзета-цепи CD3 гликопротеина Т-клеточной поверхности (также известной как CD3Z, дзета-цепь Т-клеточного рецептора, CD247, CD3-ZETA, CD3H, CD3Q, T3Z, TCRZ и т.д.). Например, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 100 аминокислот до около 110 аминокислот (а.к.), от около 110 а.к. до около 115 а.к., от около 115 а.к. до около 120 а.к., от около 120 а.к. до около 130 а.к., от около 130 а.к. до около 140 а.к., от около 140 а.к. до около 150 а.к. или от около 150 а.к. до около 160 а.к., любой из следующих аминокислотных последовательностей (2 изоформы):
MKWKALFTAAILQAQLPITEAQSFGLLDPKLCYLLDGILFIYGVILTALFLRVKFSRSADAPAY QQGQNQL[YNELNLGRREEYDVL]DKRRGRDPEMGGKPRRKNPQEGL[YNELQKDKMAEAY SEI]GMKGERRRGKGHDGL[YQGLSTATKDTYDAL]HMQALPPR (SEQ ID NO:11) или
MKWKALFTAAILQAQLPITEAQSFGLLDPKLCYLLDGILFIYGVILTALFLRVKFSRSADAPAY QQGQNQL[YNELNLGRREEYDVL]DKRRGRDPEMGGKPQRRKNPQEGL[YNELQKDKMAEA YSEI]GMKGERRRGKGHDGL[YQGLSTATKDTYDAL]HMQALPPR (SEQ ID NO:12), где мотивы ITAM представлены в квадратных скобках.
[184] Аналогичным образом, подходящий полипептид внутриклеточного активирующего домена может включать мотив ITAM, содержащий часть полноразмерной аминокислотной последовательности CD3 дзета. Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 100 аминокислот до около 110 аминокислот (а.к.), от около 110 а.к. до около 115 а.к., от около 115 а.к. до около 120 а.к., от около 120 а.к. до около 130 а.к., от около 130 а.к. до около 140 а.к., от около 140 а.к. до около 150 а.к. или от около 150 а.к. до около 160 а.к., любой из следующих аминокислотных последовательностей: RVKFSRSADAPAYQQGQNQL[YNELNLGRREEYDVL]DKRRGRDPEMGGKPRRKNPQEGL[YNELQKDKMAEAYSEI]GMKGERRRGKGHDGL[YQGLSTATKDTYDAL]HMQALPPR (SEQ ID NO:13); RVKFSRSADAPAYQQGQNQL[YNELNLGRREEYDVL]DKRRGRDPEMGGKPQRRKNPQEGL[YNELQKDKMAEAYSEI]GMKGERRRGKGHDGL[YQGLSTATKDTYDAL]HMQALPPR (SEQ ID NO:81); NQL[YNELNLGRREEYDVL]DKR SEQ ID NO:14); EGL[YNELQKDKMAEAYSEI]GMK (SEQ ID NO:15); или DGL[YQGLSTATKDTYDAL]HMQ (SEQ ID NO:16), где мотивы ITAM представлены в квадратных скобках.
[185] В некоторых случаях внутриклеточный активирующий домен происходит из дельта-цепи CD3 гликопротеина Т-клеточной поверхностности (также известной как CD3D; CD3-DELTA; T3D; антиген CD3, дельта-субъединица; дельта CD3; антиген CD3d, дельта-полипептид (комплекс TiT3); OKT3, дельта-цепь; дельта-цепь Т3 рецептора Т3; дельта-цепь CD3 гликопротеина Т-клеточной поверхности и т.д.). Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 100 аминокислот до около 110 аминокислот (а.к.), от около 110 а.к. до около 115 а.к., от около 115 а.к. до около 120 а.к., от около 120 а.к. до около 130 а.к., от около 130 а.к. до около 140 а.к., от около 140 а.к. до около 150 а.к. или от около 150 а.к. до около 160 а.к., любой из следующих аминокислотных последовательностей:
MEHSTFLSGLVLATLLSQVSPFKIPIEELEDRVFVNCNTSITWVEGTVGTLLSDITRLDLGKRIL DPRGIYRCNGTDIYKDKESTVQVHYRMCQSCVELDPATVAGIIVTDVIATLLLALGVFCFAGH ETGRLSGAADTQALLRNDQV[YQPLRDRDDAQYSHL]GGNWARNK (SEQ ID NO:17) или
MEHSTFLSGLVLATLLSQVSPFKIPIEELEDRVFVNCNTSITWVEGTVGTLLSDITRLDLGKRIL DPRGIYRCNGTDIYKDKESTVQVHYRTADTQALLRNDQV[YQPLRDRDDAQYSHL]GGNWAR NK (SEQ ID NO:18), где мотивы ITAM представлены в квадратных скобках.
[186] Аналогичным образом, подходящий полипептид внутриклеточного активирующего домена может включать мотив ITAM, содержащий часть полноразмерной аминокислотной последовательности CD3 дельта. Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности по меньшей мере из 10, 15, 20 или всех аминокислот в следующей последовательности: DQV [YQPLRDRDDAQYSHL] GGN (SEQ ID NO: 19), где мотивы ITAM представлены в квадратных скобках.
[187] В некоторых случаях внутриклеточный активирующий домен происходит от эпсилон-цепи CD3 гликопротеина Т-клеточной поверхности (также известной как CD3e, эпсилон-цепь антигена Т-клеточной поверхностности Т3/Leu-4, эпсилон-цепь CD3-гликопротеина Т-клеточной поверхности, AI504783, CD3, CD3-эпсилон, T3e и др.). Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 100 аминокислот до около 110 аминокислот (а.к.), от около 110 а.к. до около 115 а.к., от около 115 а.к. до около 120 а.к., от около 120 а.к. до около 130 а.к., от около 130 а.к. до около 140 а.к., от около 140 а.к. до около 150 а.к. или от около 150 а.к. до около 160 а.к., из следующей аминокислотной последовательности:
MQSGTHWRVLGLCLLSVGVWGQDGNEEMGGITQTPYKVSISGTTVILTCPQYPGSEILWQHN DKNIGGDEDDKNIGSDEDHLSLKEFSELEQSGYYVCYPRGSKPEDANFYLYLRARVCENCME MDMSVATIVIVDICITGGLLLLVYYWSKNRKAKAKPVTRGAGAGGRQRGQNKERPPPVPNPD [YEPIRKGQRDLYSGL]NQRRI (SEQ ID NO:20), где мотивы ITAM представлены в квадратных скобках.
[188] Аналогичным образом, подходящий полипептид внутриклеточного активирующего домена может включать мотив ITAM, содержащий часть полноразмерной аминокислотной последовательности CD3 эпсилон. Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности по меньшей мере из 10, 15, 20 или всех аминокислот в следующей последовательности: NPD[YEPIRKGQRDLYSGL]NQR (SEQ ID NO:21), где мотивы ITAM представлены в квадратных скобках.
[189] В некоторых случаях внутриклеточный активирующий домен происходит из гамма-цепи CD3 гликопротеина Т-клеточной поверхности (также известной как CD3G, гамма-цепь Т-клеточного рецептора, CD3-GAMMA, T3G, полипептид гамма (комплекс TiT3) и т.д.). Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 100 аминокислот до около 110 аминокислот (а.к.), от около 110 а.к. до около 115 а.к., от около 115 а.к. до около 120 а.к., от около 120 а.к. до около 130 а.к., от около 130 а.к. до около 140 а.к., от около 140 а.к. до около 150 а.к. или от около 150 а.к. до около 160 а.к., из следующей аминокислотной последовательности:
MEQGKGLAVLILAIILLQGTLAQSIKGNHLVKVYDYQEDGSVLLTCDAEAKNITWFKDGKMI GFLTEDKKKWNLGSNAKDPRGMYQCKGSQNKSKPLQVYYRMCQNCIELNAATISGFLFAEIV SIFVLAVGVYFIAGQDGVRQSRASDKQTLLPNDQL[YQPLKDREDDQYSHL]QGNQLRRN (SEQ ID NO:22), где мотивы ITAM представлены в квадратных скобках.
[190] Аналогичным образом, подходящий полипептид внутриклеточного активирующего домена может включать мотив ITAM, содержащий часть полноразмерной аминокислотной последовательности CD3 гамма. Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности по меньшей мере из 10, 15, 20 или всех аминокислот в следующей последовательности: DQL[YQPLKDREDDQYSHL]QGN (SEQ ID NO:23), где мотивы ITAM представлены в квадратных скобках.
[191] В некоторых случаях внутриклеточный активирующий домен происходит из CD79A (также известной как альфа-цепь белка, ассоциированного с B-клеточным антигенным рецепторным комплексом; антиген CD79a (ассоциированный с иммуноглобулином альфа); мембранного гликопротеина MB-1; Ig-альфа; мембраносвязанного ассоциированного с иммуноглобулином белка; поверхностного IgM-ассоциированного белка; и т.д.). Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 100 аминокислот до около 110 аминокислот (а.к.), от около 110 а.к. до около 115 а.к., от около 115 а.к. до около 120 а.к., от около 120 а.к. до около 130 а.к., от около 130 а.к. до около 140 а.к., от около 140 а.к. до около 150 а.к. или от около 150 а.к. до около 160 а.к., любой из следующих аминокислотных последовательностей:
MPGGPGVLQALPATIFLLFLLSAVYLGPGCQALWMHKVPASLMVSLGEDAHFQCPHNSSNNA NVTWWRVLHGNYTWPPEFLGPGEDPNGTLIIQNVNKSHGGIYVCRVQEGNESYQQSCGTYLR VRQPPPRPFLDMGEGTKNRIITAEGIILLFCAVVPGTLLLFRKRWQNEKLGLDAGDEYEDENL [YEGLNLDDCSMYEDI]SRGLQGTYQDVGSLNIGDVQLEKP (SEQ ID NO:24) или
MPGGPGVLQALPATIFLLFLLSAVYLGPGCQALWMHKVPASLMVSLGEDAHFQCPHNSSNNA NVTWWRVLHGNYTWPPEFLGPGEDPNEPPPRPFLDMGEGTKNRIITAEGIILLFCAVVPGTLLL FRKRWQNEKLGLDAGDEYEDENL[YEGLNLDDCSMYEDI]SRGLQGTYQDVGSLNIGDVQLEKP (SEQ ID NO:25), где мотивы ITAM представлены в квадратных скобках.
[192] Аналогичным образом, подходящий полипептид внутриклеточного активирующего домена может включать мотив ITAM, содержащий часть полноразмерной аминокислотной последовательности CD79A. Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности по меньшей мере из 10, 15, 20 или всех аминокислот в следующей последовательности: ENL[YEGLNLDDCSMYEDI]SRG (SEQ ID NO:26), где мотивы ITAM представлены в квадратных скобках.
[193] В некоторых случаях внутриклеточный активирующий домен происходит из DAP12 (также известного как TYROBP; белка, связывающего тирозинкиназу белка TYRO; KARAP; PLOSL; белка активации DNAX 12; KAR-ассоциированного белка; белка TYRO, связывающего тирозинкиназу; белка, ассоциированного с рецептором, активирующим клетки-киллеры; белка, ассоциированного с киллер-активирующим рецептором, и т.д.). Например, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 100 аминокислот до около 110 аминокислот (а.к.), от около 110 а.к. до около 115 а.к., от около 115 а.к. до около 120 а.к., от около 120 а.к. до около 130 а.к., от около 130 а.к. до около 140 а.к., от около 140 а.к. до около 150 а.к. или от около 150 а.к. до около 160 а.к., любой из следующих аминокислотных последовательностей (4 изоформы):
MGGLEPCSRLLLLPLLLAVSGLRPVQAQAQSDCSCSTVSPGVLAGIVMGDLVLTVLIALAVYF LGRLVPRGRGAAEAATRKQRITETESP[YQELQGQRSDVYSDL]NTQRPYYK (SEQ ID NO:27),
MGGLEPCSRLLLLPLLLAVSGLRPVQAQAQSDCSCSTVSPGVLAGIVMGDLVLTVLIALAVYF LGRLVPRGRGAAEATRKQRITETESP[YQELQGQRSDVYSDL]NTQ (SEQ ID NO:28),
MGGLEPCSRLLLLPLLLAVSDCSCSTVSPGVLAGIVMGDLVLTVLIALAVYFLGRLVPRGRGA AEAATRKQRITETESP[YQELQGQRSDVYSDL]NTQRPYYK (SEQ ID NO:29) или
MGGLEPCSRLLLLPLLLAVSDCSCSTVSPGVLAGIVMGDLVLTVLIALAVYFLGRLVPRGRGA AEATRKQRITETESP[YQELQGQRSDVYSDL]NTQRPYYK (SEQ ID NO:30), где мотивы ITAM представлены в квадратных скобках.
[194] Аналогичным образом, подходящий полипептид внутриклеточного активирующего домена может включать мотив ITAM, содержащий часть полноразмерной аминокислотной последовательности DAP12. Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности по меньшей мере из 10, 15, 20 или всех аминокислот в следующей последовательности: ESP[YQELQGQRSDVYSDL]NTQ (SEQ ID NO:31), где мотивы ITAM представлены в квадратных скобках.
[195] В некоторых случаях внутриклеточный активирующий домен происходит из FCER1G (также известного как FCRG; гамма-цепь рецептора I Fc-эпсилон; гамма-цепь рецептора Fc; fc-эпсилон RI-гамма; fcRgamma; fceRI гамма; высокоаффинная субъединица рецептора эпсилона иммуноглобулина гамма; рецептор иммуноглобулина E, высокоаффинный, гамма-цепь и т.д.). Например, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 50 аминокислот до около 60 аминокислот (а.к.), от около 60 а.к. до около 70 а.к., от около 70 а.к. до около 80 а.к. или от около 80 а.к. до около 88 а.к., следующей аминокислотной последовательности: MIPAVVLLLLLLVEQAAALGEPQLCYILDAILFLYGIVLTLLYCRLKIQVRKAAITSYEKSDGV[YTGLSTRNQETYETL]KHEKPPQ (SEQ ID NO:32), где мотивы ITAM представлены в квадратных скобках.
[196] Аналогичным образом, подходящий полипептид внутриклеточного активирующего домена может включать мотив ITAM, содержащий часть полноразмерной аминокислотной последовательности FCER1G. Таким образом, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности по меньшей мере из 10, 15, 20 или всех аминокислот в следующей последовательности: DGV[YTGLSTRNQETYETL]KHE (SEQ ID NO:33), где мотивы ITAM представлены в квадратных скобках.
[197] Внутриклеточные активирующие домены, подходящие для применения в сконструированном сигнальном полипептиде по настоящему изобретению, содержат сигнальную цепь типа DAP10/CD28. Примером сигнальной цепи DAP10 является аминокислота SEQ ID NO: 34. В некоторых вариантах осуществления подходящий внутриклеточный активирующий домен включает домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в SEQ ID NO: 34.
[198] Примером сигнальной цепи CD28 является аминокислотная последовательность SEQ ID NO: 35. В некоторых вариантах осуществления подходящий внутриклеточный домен включает домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в SEQ ID NO: 35.
[199] Внутриклеточные активирующие домены, подходящие для применения в сконструированном сигнальном полипептиде по настоящему изобретению, содержат полипептид ZAP70. Например, подходящий внутриклеточный активирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере 10, 15, 20 или всех аминокислот в следующих последовательностях или непрерывного участка от около 300 аминокислот до около 400 аминокислот, от около 400 аминокислот до около 500 аминокислот или от около 500 аминокислот до 619 аминокислот SEQ ID NO:36.
Модулирующие домены
[200] Модулирующие домены могут изменять эффект внутриклеточного активирующего домена в сконструированном сигнальном полипептиде, включая усиление или ослабление нисходящих эффектов активирующего домена или изменение характера ответа. Модулирующие домены, подходящие для применения в сконструированном сигнальном полипептиде по настоящему изобретению, включают костимулирующие домены. Модулирующий домен, подходящий для включения в сконструированный сигнальный полипептид, может иметь длину от около 30 аминокислот до около 70 аминокислот (а.к.), например, модулирующий домен может иметь длину от около 30 а.к. до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 а.к. до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к. или от около 65 а.к. до около 70 а.к. В других случаях модулирующий домен может иметь длину от около 70 а.к. до около 100 а.к., от около 100 а.к. до около 200 а.к. или более 200 а.к.
[201] Костимулирующие домены обычно усиливают и/или изменяют характер ответа на домен активации. Костимулирующие домены, подходящие для применения в сконструированном сигнальном полипептиде по настоящему изобретению, обычно представляют собой полипептиды, происходящие из рецепторов. В некоторых вариантах осуществления костимулирующие домены гомодимеризуются. Рассматриваемый костимулирующий домен может представлять собой внутриклеточную часть трансмембранного белка (т.е. костимулирующий домен может происходить из трансмембранного белка). Неограничивающие примеры подходящих костимулирующих полипептидов включают без ограничения 4-lBB (CD137), CD27, CD28, CD28 с делецией по связыванию Lck (ICΔ), ICOS, OX40, BTLA, CD27, CD30, GITR и HVEM. Например, костимулирующий домен по одному аспекту настоящего изобретения может иметь последовательность, на по меньшей мере 80%, 90% или 95% идентичную костимулирующему домену 4-lBB (CD137), CD27, CD28, CD28 с делецией по связыванию Lck (ICΔ), ICOS, OX40, BTLA, CD27, CD30, GITR или HVEM. Например, костимулирующий домен по одному аспекту настоящего изобретения может иметь последовательность, на по меньшей мере 80%, 90% или 95% идентичную костимулирующему домену неограничивающих примеров подходящих костимулирующих полипептидов, включая без ограничения 4-lBB (CD137), CD27, CD28, CD28 с делецией по связыванию Lck (ICΔ), ICOS, OX40, BTLA, CD27, CD30, GITR и HVEM. Например, костимулирующий домен по одному аспекту настоящего изобретения может иметь последовательность, на по меньшей мере 80%, 90% или 95% идентичную костимулирующему домену 4-lBB (CD137), CD27, CD28, CD28 с делецией по связыванию Lck (ICΔ), ICOS, OX40, BTLA, CD27, CD30, GITR или HVEM.
[202] Костимулирующий домен, подходящий для включения в сконструированный сигнальный полипептид, может иметь длину от около 30 аминокислот до около 70 аминокислот (а.к.), например, костимулирующий домен может иметь длину от около 30 а.к. до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 а.к. до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к. или от около 65 а.к. до около 70 а.к. В других случаях костимулирующий домен может иметь длину от около 70 а.к. до около 100 а.к., от около 100 а.к. до около 200 а.к. или более 200 а.к.
[203] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка CD137 (также известного как TNFRSF9; CD137; 4-lBB; CDwl37; ILA и т.д.). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 1. В некоторых из этих вариантов осуществления костимулирующий домен имеет длину от около 30 до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к., или от около 65 а.к. до около 70 а.к.
[204] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка CD28 (также известного как Tp44). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 2. В некоторых из этих вариантов осуществления костимулирующий домен имеет длину от около 30 до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к., или от около 65 а.к. до около 70 а.к.
[205] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка CD28 с делецией по связыванию Lck (ICΔ). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 3. В некоторых из этих вариантов осуществления костимулирующий домен имеет длину от около 30 до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к., или от около 65 а.к. до около 70 а.к.
[206] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка ICOS (также известного как AILIM, CD278 и CVIDl). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 4. В некоторых из этих вариантов осуществления костимулирующий домен имеет длину от около 30 до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к., или от около 65 а.к. до около 70 а.к.
[207] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка OX40 (также известного как TNFRSF4, RP5-902P8.3, ACT35, CD134, OX-40, TXGPlL). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 5. В некоторых из этих вариантов осуществления костимулирующий домен имеет длину от около 30 до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к., или от около 65 а.к. до около 70 а.к.
[208] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка CD27 (также известного как S 152, T 14, TNFRSF7 и Tp55). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 6. В некоторых из этих вариантов осуществления костимулирующий домен имеет длину от около 30 до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 до около 45 а.к. или от около 45 а.к. до около 50 а.к.
[209] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка BTLA (также известного как BTLA и CD272). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 7.
[210] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка CD30 (также известного как TNFRSF8, DlS166E и Ki-1). Например, подходящий костимулирующий домен может включать в себя домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка от около 100 аминокислот до около 110 аминокислот (а.к.), от около 110 а.к. до около 115 а.к., от около 115 а.к. до около 120 а.к., от около 120 а.к. до около 130 а.к., от около 130 а.к. до около 140 а.к., от около 140 а.к. до около 150 а.к., от около 150 а.к. до около 160 а.к. или от около 160 а.к. до около 185 а.к. SEQ ID NO: 8.
[211] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка GITR (также известного как TNFRSF18, RP5-902P8.2, AITR, CD357 и GITR-D). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 9. В некоторых из этих вариантов осуществления костимулирующий домен имеет длину от около 30 до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к., или от около 65 а.к. до около 70 а.к.
[212] В некоторых случаях костимулирующий домен происходит из внутриклеточной части трансмембранного белка HVEM (также известного как TNFRSF14, RP3-395M20.6, ATAR, CD270, HVEA, HVEM, LIGHTR и TR2). Например, подходящий костимулирующий домен может включать домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности участка из по меньшей мере из 10, 15, 20 или всех аминокислот в SEQ ID NO: 10. В некоторых из этих вариантов осуществления костимулирующий домен как первого, так и второго полипептида имеет длину от около 30 до около 35 а.к., от около 35 а.к. до около 40 а.к., от около 40 до около 45 а.к., от около 45 а.к. до около 50 а.к., от около 50 а.к. до около 55 а.к., от около 55 а.к. до около 60 а.к., от около 60 а.к. до около 65 а.к., или от около 65 а.к. до около 70 а.к.
Линкер
[213] В некоторых случаях сконструированный сигнальный полипептид содержит линкер между любыми двумя соседними доменами. Например, линкер может находиться между трансмембранным доменом и первым костимулирующим доменом. В качестве другого примера ASTR может представлять собой антитело, а линкер может находиться между тяжелой цепью и легкой цепью. В качестве другого примера линкер может находиться между ASTR и трансмембранным доменом и костимулирующим доменом. В качестве другого примера линкер может находиться между костимулирующим доменом и внутриклеточным активирующим доменом второго полипептида. В качестве другого примера линкер может находиться между ASTR и внутриклеточным сигнальным доменом.
[214] Линкерный пептид может иметь любую из множества аминокислотных последовательностей. Белки могут быть соединены с помощью спейсерного пептида, как правило, гибкого характера, хотя не исключены и другие химические связи. Линкер может представлять собой пептид длиной от около 1 до около 100 аминокислот или от около 1 до около 25 аминокислот в длину. Эти линкеры могут быть получены с использованием синтетических олигонуклеотидов, кодирующих линкер, для связывания белков. Можно применять пептидные линкеры с определенной степенью гибкости. Связывающие пептиды могут иметь практически любую аминокислотную последовательность, при этом имеется в виду, что подходящие линкеры будут иметь последовательность, которая приводит к образованию в целом гибкого пептида. Применение небольших аминокислот, таких как глицин и аланин, применимо для создания гибкого пептида. Создание таких последовательностей является стандартным для специалистов в данной области техники.
[215] Подходящие линкеры могут быть легко выбраны и могут иметь любую подходящую длину, например, от 1 аминокислоты (например, Gly) до 20 аминокислот, от 2 аминокислот до 15 аминокислот, от 3 аминокислот до 12 аминокислот, в том числе от 4 аминокислот до 10 аминокислот, от 5 аминокислот до 9 аминокислот, от 6 аминокислот до 8 аминокислот или от 7 аминокислот до 8 аминокислот, и могут иметь 1, 2, 3, 4, 5, 6 или 7 аминокислот.
[216] Примеры гибких линкеров включают полимеры глицина (G)n, полимеры глицин-серин (включая, например, (GS)n, GSGGSn, GGGSn и GGGGSn, где n представляет собой целое число, составляющее по меньшей мере один), полимеры глицин-аланин, полимеры аланин-серин и другие гибкие линкеры, известные в данной области техники. Глицин и полимеры глицин-серин представляют интерес, поскольку обе эти аминокислоты относительно неструктурированы и поэтому могут выступать в качестве нейтральной связи между компонентами. Полимеры глицина представляют особый интерес, поскольку глицин имеет доступ к значительно большему пространству phi-psi, чем даже аланин, и гораздо менее ограничен, чем остатки с более длинными боковыми цепями (см. Scheraga, Rev. Computational Chem. 11173-142 (1992)). Иллюстративные гибкие линкеры включают без ограничения GGGGSGGGGSGGGGS (SEQ ID NO:53), GGGGSGGGGSGGGGSGGGGSGGGGSGGGGS (SEQ ID NO:54), GGGGSGGGSGGGGS (SEQ ID NO:55), GGSG (SEQ ID NO:56), GGSGG (SEQ ID NO:57), GSGSG (SEQ ID NO:58), GSGGG (SEQ ID NO:59), GGGSG (SEQ ID NO:60), GSSSG (SEQ ID NO:61) и тому подобное. Специалисту в данном области техники будет понятно, что конструкция пептида, конъюгированного с любыми элементами, описанными выше, может содержать линкеры, которые являются полностью или частично гибкими, так что линкер может включать гибкий линкер, а также одну или несколько частей, которые придают менее гибкую структуру.
Комбинации
[217] В некоторых вариантах осуществления полинуклеотид, образуемый с помощью не способных к репликации рекомбинантных ретровирусных частиц, имеет одну или несколько транскрипционных единиц, которые кодируют определенные комбинации одного или нескольких сконструированных сигнальных полипептидов. В некоторых способах и композициях, представленных в данном документе, генетически модифицированные Т-клетки включают комбинации одного или нескольких сконструированных сигнальных полипептидов после трансдукции Т-клеток с помощью не способных к репликации рекомбинантных ретровирусных частиц. Следует понимать, что ссылка на первый полипептид, второй полипептид, третий полипептид и т.д. предназначена для удобства, а элементы на «первом полипептиде» и элементы на «втором полипептиде» означают, что элементы находятся на разных полипептидах, которые обозначены как первый или второй только для ссылки и соглашения, обычно в дополнительных элементах или стадиях к этому конкретному полипептиду.
[218] В некоторых вариантах осуществления первый сконструированный сигнальный полипептид включает внеклеточный антигенсвязывающий домен, который способен связывать антиген, и внутриклеточный сигнальный домен. В других вариантах осуществления первый сконструированный сигнальный полипептид также содержит мотив выживания Т-клеток и/или трансмембранный домен. В некоторых вариантах осуществления первый сконструированный сигнальный полипептид не содержит костимулирующий домен, тогда как в других вариантах осуществления первый сконструированный сигнальный полипептид содержит костимулирующий домен.
[219] В некоторых вариантах осуществления второй сконструированный сигнальный полипептид содержит продукт лимфопролиферативного гена и, необязательно, внеклеточный антигенсвязывающий домен. В некоторых вариантах осуществления второй сконструированный сигнальный полипептид также содержит одно или несколько из следующего: мотив выживания Т-клеток, внутриклеточный сигнальный домен и один или несколько костимулирующих доменов. В других вариантах осуществления, при применении двух сконструированных сигнальных полипептидов, по меньшей мере один представляет собой CAR.
[220] В одном варианте осуществления один или несколько сконструированных сигнальных полипептидов экспрессируются под специфическим для Т-клеток промотором или общим промотором под тем же транскриптом, при этом в транскрипте нуклеиновые кислоты, кодирующие сконструированные сигнальные полипептиды, разделены нуклеиновыми кислотами, которые кодируют один или несколько внутренних сайтов связывания рибосомы (IRE) или один или несколько пептидов для расщепления протеазой.
[221] В определенных вариантах осуществления полинуклеотид кодирует два сконструированных сигнальных полипептида, при этом первый сконструированный сигнальный полипептид содержит первый внеклеточный антигенсвязывающий домен, который способен связываться с первым антигеном, и первый внутриклеточный сигнальный домен, но не костимулирующий домен, и второй полипептид содержит второй внеклеточный антигенсвязывающий домен, который способен связывать VEGF, и второй внутриклеточный сигнальный домен, такой как, например, сигнальный домен костимулирующей молекулы. В определенном варианте осуществления первый антиген представляет собой PSCA, PSMA или BCMA. В определенном варианте осуществления первый внеклеточный антигенсвязывающий домен содержит антитело или его фрагмент (например, scFv), например, антитело или его фрагмент, специфичные к PSCA, PSMA или BCMA. В определенном варианте осуществления второй внеклеточный антигенсвязывающий домен, который связывает VEGF, представляет собой рецептор VEGF, т.е. VEGFR. В определенных вариантах осуществления VEGFR представляет собой VEGFR1, VEGFR2 или VEGFR3. В определенном варианте осуществления VEGFR представляет собой VEGFR2.
[222] В определенных вариантах осуществления полинуклеотид кодирует два сконструированных сигнальных полипептида, при этом первый сконструированный сигнальный полипептид содержит внеклеточный опухолевый антигенсвязывающий домен и сигнальный домен CD3ζ, а второй сконструированный сигнальный полипептид включает антигенсвязывающий домен, при этом антиген представляет собой ангиогенный или васкулогенный фактор, и один или несколько сигнальных доменов костимулирующей молекулы. Ангиогенный фактор может представлять собой, например, VEGF. Один или несколько сигнальных мотивов костимулирующей молекулы могут содержать, например, костимулирующие сигнальные домены от каждого из CD27, CD28, OX40, ICOS и 4-1BB.
[223] В определенных вариантах осуществления полинуклеотид кодирует два сконструированных сигнальных полипептида, при этом первый сконструированный сигнальный полипептид содержит внеклеточный опухолевый антигенсвязывающий домен и сигнальный домен CD3ζ, второй полипептид содержит антигенсвязывающий домен, который способен связываться с VEGF, и костимулирующие сигнальные домены от каждого из CD27, CD28, OX40, ICOS и 4-1BB. В дополнительном варианте осуществления первый сигнальный полипептид или второй сигнальный полипептид также имеет мотив выживания Т-клеток. В некоторых вариантах осуществления мотив выживания Т-клеток представляет собой или происходит из внутриклеточного сигнального домена рецептора IL-7 (IL-7R), внутриклеточного сигнального домена рецептора IL-12, внутриклеточного сигнального домена рецептора IL-15, внутриклеточного сигнального домена рецептора IL-21 или внутриклеточного сигнального домена рецептора трансформирующего фактора роста β (TGFβ), или рецептора-ловушки TGFβ (TGF-β - доминантно-негативный рецептор II (DNRII)).
[224] В определенных вариантах осуществления полинуклеотид кодирует два сконструированных сигнальных полипептида, при этом первый сконструированный сигнальный полипептид содержит внеклеточный опухолевый антигенсвязывающий домен и сигнальный домен CD3ζ, а второй сконструированный сигнальный полипептид содержит антигенсвязывающий домен, который способен связываться с VEGF, внутриклеточный мотив выживания Т-клеток рецептора IL-7 и костимулирующие сигнальные домены от каждого из CD27, CD28, OX40, ICOS и 4-1BB.
[225] В некоторых вариантах осуществления полинуклеотидом кодируется более двух сигнальных полипептидов. В определенных вариантах осуществления только один из сконструированных сигнальных полипептидов содержит антигенсвязывающий домен, который связывается с опухолеассоциированным антигеном или опухолеспецифическим антигеном; каждый из оставшихся сконструированных сигнальных полипептидов содержит антигенсвязывающий домен, который связывается с антигеном, который не представляет собой опухолеассоциированный антиген или опухолеспецифический антиген. В других вариантах осуществления два или более сконструированных сигнальных полипептида содержат антигенсвязывающие домены, которые связываются с одним или более опухолеспецифическими антигенами или опухолеспецифическими антигенами, при этом по меньшей мере один из сконструированных сигнальных полипептидов содержит антигенсвязывающий домен, который не связывается с опухолеассоциированным антигеном или опухолеспецифическим антигеном.
[226] В некоторых вариантах осуществления опухолеассоциированный антиген или опухолеспецифический антиген представляет собой Her2, антиген стволовых клеток предстательной железы (PSCA), PSMA (простатоспецифический мембранный антиген), антиген созревания B-клеток (BCMA), альфа-фетопротеин (AFP), карциноэмбриональный антиген (CEA), раковый антиген-125 (CA-125), CA19-9, кальретинин, MUC-1, эпителиальный мембранный белок (EMA), эпителиальный опухолевый антиген (ETA), тирозиназу, антиген, ассоциированный с меланомой (MAGE), CD34, CD45, CD99, CD117, хромогранин, цитокератин, десмин, глиальный фибриллярный кислый белок (GFAP), жидкостный белок макроскопического поликистоза (GCDFP-15), антиген HMB-45, белок мелан-A (антиген меланомы, распознаваемый Т-лимфоцитами; MART-1), myo-D1, мышечно-специфический актин (MSA), нейрофиламент, нейрон-специфическую енолазу (NSE), плацентарную щелочную фосфатазу, синаптофизин, тиреоглобулин, фактор транскрипции щитовидной железы-1, димерную форму изофермента пируваткиназы типа M2 (опухоль M2-PK), CD19, CD22, CD27, CD30, CD70, GD2 (ганглиозид G2), EphA2, CSPG4, CD138, FAP (белок активации фибробластов), CD171, каппа, лямбда, 5T4, интегрин αvβ6, интегрин ανβ3 (CD61), галактин, K-Ras (вирусный онкоген саркомы крысы V-Ki-ras2 Кирстен), Ral-B, B7-H3, B7-H6, CAIX, CD20, CD33, CD44, CD44v6, CD44v7/8, CD123, EGFR, EGP2, EGP40, EpCAM, AchR плода, лиганды FRα, GD3, HLA-A1+MAGE1, HLA-A1+NY-ESO-1, IL-11Rα, IL-13Rα2, Lewis-Y, Muc16, NCAM, NKG2D, NY-ESO-1, PRAME, ROR1, сурвивин, TAG72, TEM, VEGFR2, EGFRvIII (вариант III эпидермального фактора роста), белок сперматозоидов 17 (Sp17), мезотелин, PAP (простатическая кислая фосфатаза), простеин, TARP (белок альтернативной рамки считывания гамма-рецептора Т-лимфоцитов), Trp-p8, STEAP1 (шестистрансмембранный эпителиальный антиген простаты 1), аномальный белок ras или аномальный p53 белок.
[227] В некоторых вариантах осуществления первый сконструированный сигнальный полипептид содержит первый внеклеточный антигенсвязывающий домен, который связывает первый антиген, и первый внутриклеточный сигнальный домен; и второй сконструированный сигнальный полипептид включает второй внеклеточный антигенсвязывающий домен, который связывает второй антиген, или рецептор, который связывает второй антиген; и второй внутриклеточный сигнальный домен, при этом второй сконструированный сигнальный полипептид не содержит костимулирующий домен. В определенном варианте осуществления первый антигенсвязывающий домен и второй антигенсвязывающий домен независимо представляют собой антигенсвязывающую часть рецептора или антигенсвязывающую часть антитела. В определенном варианте осуществления один или оба из первого антигенсвязывающего домена или второго антигенсвязывающего домена являются фрагментами антитела scFv. В определенных вариантах осуществления первый сконструированный сигнальный полипептид и/или второй сконструированный сигнальный полипептид дополнительно содержит трансмембранный домен. В определенном варианте осуществления первый сконструированный сигнальный полипептид или второй сконструированный сигнальный полипептид содержит мотив выживания Т-клеток, например, любой из мотивов выживания Т-клеток, описанных в данном документе.
[228] В другом варианте осуществления первый сконструированный сигнальный полипептид содержит первый внеклеточный антигенсвязывающий домен, который связывает HER2, а второй сконструированный сигнальный полипептид содержит второй внеклеточный антигенсвязывающий домен, который связывает MUC-1.
[229] В другом варианте осуществления второй внеклеточный антигенсвязывающий домен второго сконструированного сигнального полипептида связывает интерлейкин.
[230] В другом варианте осуществления второй внеклеточный антигенсвязывающий домен второго сконструированного сигнального полипептида связывает молекулу молекулярного паттерна, ассоциированную с повреждением (DAMP; также известный как алармин). В других вариантах осуществления DAMP представляет собой белок теплового шока, бокс 1 ассоциированного с хроматином белка из группы с высокой подвижностью (HMGB1), S100A8 (также известный как MRP8 или кальгранулин A), S100A9 (также известный как MRP14 или кальгранулин B), сывороточный амилоид A (SAA), дезоксирибонуклеиновую кислоту, аденозинтрифосфат, мочевую кислоту или гепарина сульфат.
[231] В определенных вариантах осуществления указанный второй антиген представляет собой антиген на антителе, который связывается с антигеном, представленным опухолевой клеткой.
[232] В некоторых вариантах осуществления активация передачи сигнала через второй сконструированный сигнальный полипептид является неантигенной, но ассоциирована с гипоксией. В определенных вариантах осуществления гипоксия индуцируется активацией индуцируемого гипоксией фактора-1α (HIF-1α), HIF-1β, HIF-2α, HIF-2β, HIF-3α или HIF-3β.
[233] В некоторых вариантах осуществления экспрессия одного или нескольких сконструированных сигнальных полипептидов регулируется элементом управления, который более подробно раскрыт в данном документе.
Дополнительные последовательности
[234] Сконструированные сигнальные полипептиды, такие как CAR, могут дополнительно содержать один или несколько дополнительных полипептидных доменов, при этом такие домены содержать без ограничения сигнальную последовательность; метку эпитопа; аффинный домен; и полипептид, присутствие или активность которого могут быть обнаружены (детектируемый маркер), например, с помощью анализа на антитела или поскольку он представляет собой полипептид, который дает детектируемый сигнал. Неограничивающие примеры дополнительных доменов для любого из аспектов или вариантов осуществления, представленных в данном документе, включают домен, на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичный последовательности любой из следующих последовательностей, как описано ниже: сигнальной последовательности, эпитопной метке, аффинному домену или полипептиду, который дает детектируемый сигнал.
[235] Сигнальные последовательности, которые подходят для применения в рассматриваемом CAR, например, в первом полипептиде рассматриваемого CAR, включают любую эукариотическую сигнальную последовательность, включая природную сигнальную последовательность, синтетическую (например, созданную человеком) сигнальную последовательность и т.д. В некоторых вариантах осуществления, например, сигнальная последовательность может представлять собой сигнальную последовательность CD8 MALPVTALLLPLALLLHAARP (SEQ ID NO: 74).
[236] Подходящие метки эпитопа включают без ограничения гемагглютинин (HA; например, YPYDVPDYA; SEQ ID NO: 37); FLAG (например, DYKDDDDK; SEQ ID NO: 38); c-myc (например, EQKLISEEDL; SEQ ID NO: 39) и тому подобное.
[237] Аффинные домены включают пептидные последовательности, которые могут взаимодействовать с партнером по связыванию, например, таким как партнер, иммобилизованный на твердой подложке, пригодной для идентификации или очистки. Последовательности ДНК, кодирующие несколько последовательных одиночных аминокислот, таких как гистидин, при слиянии с экспрессируемым белком, могут применяться для одностадийной очистки рекомбинантного белка путем связывания с высокой аффинностью с колонкой со смолой, такой как никель-сефароза. Иллюстративные аффинные домены включают His5 (HHHHH; SEQ ID NO: 40), HisX6 (HHHHHH; SEQ ID NO: 41), c-myc (EQKLISEEDL; SEQ ID NO: 39), Flag (DYKDDDDK; SEQ ID NO: 38), метку Strep (WSHPQFEK; SEQ ID NO: 42), гемагглютинин, например, метку HA (YPYDVPDYA; SEQ ID NO: 37), GST, тиоредоксин, домен связывания целлюлозы, RYIRS (SEQ ID NO: 43), Phe-His-His-Thr (SEQ ID NO: 44), хитинсвязывающий домен, S-пептид, пептид T7, домен SH2, C-концевую РНК-метку, WEAAAREACCRECCARA (SEQ ID NO: 45), домены связывания металлов, например, цинксвязыващие домены или кальцийсвязывающие домены, такие как кальцийсвязывающие белки, например, кальмодулин, тропонин С, кальциневрин B, легкая цепь миозина, рековерин, S-модулин, визинин, VILIP, нейрокальцин, гиппокальцин, фреквенин, кальтрактин, большая субъединица кальпаина, белки S100, парвальбумин, кальбиндин D9K, кальбиндин D28K и кальретинин, интеины, биотин, стрептавидин, MyoD, Id, последовательности лейциновой молнии и мальтозосвязывающий белок.
[238] Подходящие детектируемые белки, продуцирующие сигнал, включают, например, флуоресцентные белки; ферменты, которые катализируют реакцию, генерирующую детектируемый сигнал в виде продукта; и тому подобное.
[239] Подходящие флуоресцентные белки включают без ограничения зеленый флуоресцентный белок (GFP) или его варианты, синий флуоресцентный вариант GFP (BFP), голубой флуоресцентный вариант GFP (CFP), желтый флуоресцентный вариант GFP (YFP), усиленный GFP (EGFP), усиленный CFP (ECFP), усиленный YFP (EYFP), GFPS65T, Emerald, Topaz (TYFP), Venus, Citrine, mCitrine, GFPuv, дестабилизированный EGFP (dEGFP), дестабилизированный ECFP (dECFP), дестабилизированный EYFP (dEYFP), mCFPm, Cerulean, T-Sapphire, CyPet, YPet, mKO, HcRed, t-HcRed, DsRed, DsRed2, DsRed-мономер, J-Red, димер-2, t-димер-2 (12), mRFP1, поциллопорин, GFP Renilla, GFP Monster, paGFP, белок Kaede и белок kindling, фикобилипротеины и конъюгаты фикобилипротеинов, включая B-фикоэритрин, R-фикоэритрин и аллофикоцианин. Другие примеры флуоресцентных белков включают mHoneydew, mBanana, mOrange, dTomato, tdTomato, mTangerine, mStrawberry, mCherry, mGrapel, mRaspberry, mGrape2, mPlum (Shaner et al. (2005) Nat. Methods 2:905-909) и тому подобное. Любой из множества флуоресцентных и окрашенных белков видов Anthozoan, как описано, например, в Matz et al. (1999) Nature Biotechnol. 17: 969-973, является подходящим для применения.
[240] Подходящие ферменты включают без ограничения пероксидазу хрена (HRP), щелочную фосфатазу (AP), бета-галактозидазу (GAL), глюкозо-6-фосфатдегидрогеназу, бета-N-ацетилглюкозаминидазу, β-глюкуронидазу, инвертазу, ксантиноксидазу, люциферазу светлячков, глюкозооксидазу (GO) и тому подобное.
Домен распознавания и/или элиминации
[241] Любая из не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, может включать нуклеиновые кислоты, которые кодируют домен распознавания или элиминации в виде части нуклеиновых кислот, кодирующих любой из сконструированных сигнальных полипептидов, представленных в данном документе, или отдельно от них. Таким образом, любой из сконструированных сигнальных полипептидов, представленных в данном документе, может содержать домен распознавания или элиминации. Например, любой из CAR, раскрытых в данном документе, может содержать домен распознавания или элиминации. Более того, домен распознавания или элиминации может быть экспрессирован вместе с любым из лимфопролиферативных элементов, раскрытых в данном документе, или даже сливаться с ними. Домены распознавания или элиминации экспрессируются на Т-клетке и/или NK-клетке, но не экспрессируются на не способных к репликации рекомбинантных ретровирусных частицах.
[242] В некоторых вариантах осуществления домен распознавания или элиминации может происходить из фермента тимидинкиназы, происхоящей от вируса простого герпеса (HSV-tk), или индуцибельной каспазы-9. В некоторых вариантах осуществления домен распознавания или элиминации может содержать модифицированную молекулу эндогенной клеточной поверхности, например, как описано в патенте США 8802374. Модифицированная эндогенная молекула клеточной поверхности может представлять собой любой модифицированный рецептор, лиганд, гликопротеин, молекулу клеточной адгезии, антиген, интегрин или кластер дифференцировки (CD), связанные с клеточной поверхностью. В некоторых вариантах осуществления модифицированная эндогенная молекула клеточной поверхности представляет собой усеченный рецептор тирозинкиназы. В одном аспекте рецептор усеченной тирозинкиназы представляет собой представителя семейства рецепторов эпидермального фактора роста (EGFR) (например, ErbB1, ErbB2, ErbB3 и ErbB4). В некоторых вариантах осуществления домен распознавания может представлять собой полипептид, который распознается антителом, которое распознает внеклеточный домен представителя EGFR. В некоторых вариантах осуществления домен распознавания может представлять собой по меньшей мере 20 смежных аминокислот представителя семейства EGFR или, например, от 20 до 50 смежных аминокислот представителя семейства EGFR. Например, SEQ ID NO: 78 представляет собой иллюстративный полипептид, который распознается и в соответствующих условиях связывается с антителом, которое распознает внеклеточный домен представителя EGFR. Такие внеклеточные эпитопы EGFR иногда обозначаются в данном документе eTag. В иллюстративных вариантах осуществления такие эпитопы распознаются коммерчески доступными моноклональными антителами к EGFR.
[243] Рецептор эпидермального фактора роста, также известный как EGFR, ErbB1 и HER1, представляет собой рецептор клеточной поверхности для представителя семейства внеклеточных лигандов эпидермального фактора роста. Изменения активности EGFR связаны с некоторыми видами рака. В некоторых вариантах осуществления ген, кодирующий полипептид EGFR, включая рецептор эпидермального фактора роста человека (EGFR), конструируется путем удаления последовательностей нуклеиновых кислот, которые кодируют полипептиды, включая дистальный EGF-связывающий домен мембраны и цитоплазматический сигнальный хвост, но сохраняет проксимальный эпитоп внеклеточной мембраны, распознаваемый антителом к EGFR. Предпочтительно антитело представляет собой известное коммерчески доступное моноклональное антитело к EGFR, такое как цетуксимаб, матузумаб, нецитумумаб или панитумумаб.
[244] Другие продемонстрировали, что применение биотинилированного цетуксимаба для иммуномагнитной селекции в сочетании с микрогранулами против биотина успешно обогащает Т-клетки, которые были лентивирусно трансдуцированы конструкциями, содержащими EGFRt, от 2% популяции до более 90% чистоты без видимой токсичности в отношении клеточного препарата. Кроме того, другие продемонстрировали, что конститутивная экспрессия этой инертной молекулы EGFR не влияет на фенотип или эффекторную функцию Т-клеток, как это направлено координированно экспрессируемым химерным антигенным рецептором (CAR), CD19R. Также другие продемонстрировали, что с помощью проточного цитометрического анализа EGFR успешно использовался в качестве маркера отслеживания in vivo для приживления Т-клеток у мышей. Кроме того, было продемонстрировано, что EGFR обладает потенциалом суицидного гена посредством антителозависимой клеточной цитотоксичности (ADCC), опосредованной Erbitux®. Авторы настоящего изобретения успешно экспрессировали eTag в PBMC с использованием лентивирусных векторов и обнаружили, что экспрессия eTag in vitro с помощью PBMC, подвергнутых воздействию цетуксимаба, обеспечивает эффективный механизм элиминации для PBMC. Таким образом, EGFR можно применять в качестве неиммуногенного инструмента отбора, маркера отслеживания и суицидного гена для трансдуцированных Т-клеток, которые обладают иммунотерапевтическим потенциалом. Нуклеиновая кислота EGFR также может быть обнаружена с помощью способов, хорошо известных в данной области техники.
[245] В некоторых вариантах осуществления, представленных в данном документе, EGFR экспрессируется в виде части одного полипептида, который также содержит CAR, или в виде части одного полипептида, который содержит лимфопролиферативный элемент. В некоторых вариантах осуществления аминокислотная последовательность, кодирующая домен распознавания EGFR, может быть отделена от аминокислотной последовательности, кодирующей химерный антигенный рецептор, с помощью сигнала расщепления и/или последовательности с рибосомным проскоком. Сигнал с рибосомным проскоком и/или расщепления может представлять собой любой сигнал с рибосомным проскоком и/или расщепления, известный в данной области техники. Не ограничиваясь теорией, последовательность с рибосомным проскоком может представлять собой, например, Т2А (также обозначаемый в данном документе как 2А-1) с аминокислотной последовательностью GSGEGRGSLLTCGDVEENPGP (SEQ ID NO: 77). Не ограничиваясь теорией, другие примеры сигналов расщепления и последовательностей с рибосомным проскоком включают последовательности FMDV 2A (F2A); вируса ринита А лошадей 2А (сокращенно Е2А); тешовируса свиньи-1 2A (P2A); и вируса Thoseaasigna 2А (Т2А). В некоторых вариантах осуществления полинуклеотидная последовательность, кодирующая домен распознавания, может находиться в том же транскрипте, что и CAR или лимфопролиферативный элемент, но отделена от полинуклеотидной последовательности, кодирующей CAR или лимфопролиферативный элемент, внутренним сайтом связывания рибосомы.
[246] В других вариантах осуществления, как эмпирически проиллюстрировано в данном документе, домен распознавания может быть экспрессирован в виде части слитого полипептида, слитого с лимфопролиферативным элементом. Такие конструкции обеспечивают преимущество, особенно в комбинации с другими элементами «экономии пространства», представленными в данном документе, в том, что они занимают меньше места в геноме в геноме РНК по сравнению с отдельными полипептидами. В одном иллюстративном варианте осуществления eTag экспрессируется в виде гибридного полипептида, слитого с мутантом IL7Rα, как экспериментально продемонстрировано в данном документе.
Химерный антигенный рецептор
[247] В некоторых аспектах настоящего изобретения сконструированный сигнальный полипептид представляет собой химерный антигенный рецептор (CAR) или полинуклеотид, кодирующий CAR, который для простоты обозначается в данном документе как «CAR». CAR по настоящему изобретению содержит: а) по меньшей мере одну антигенспецифическую нацеленную область (ASTR); b) трансмембранный домен; и c) внутриклеточный активирующий домен. В иллюстративных вариантах осуществления антигенспецифическая нацеленная область CAR представляет собой часть scFv антитела в отношении целевого антигена. В иллюстративных вариантах осуществления внутриклеточный активирующий домен происходит от CD3z.
[248] CAR по настоящему изобретению может присутствовать в цитоплазматической мембране эукариотической клетки, например, клетки млекопитающего, при этом подходящие клетки млекопитающих включают без ограничения цитотоксическую клетку, Т-лимфоцит, стволовую клетку, потомство стволовой клетки, клетку-предшественник, потомство клетки-предшественника, а также NK-клетку, NK-T-клетку и макрофаг. Находясь в цитоплазматической мембране эукариотической клетки, CAR по настоящему изобретению активен в присутствии одного или нескольких целевых антигенов, которые в определенных условиях связывают ASTR. Целевой антиген является вторым представителем пары специфического связывания. Целевой антиген из пары специфического связывания может быть растворимым (например, не связанным с клеткой) фактором; фактором, присутствующим на поверхности клетки, такой как целевая клетка; фактором, представленным на твердой поверхности; фактором, присутствующим в липидном бислое; и тому подобное. Когда ASTR представляет собой антитело, а второй представитель пары специфического связывания представляет собой антиген, антиген может быть растворимым (например, не связанным с клеткой) антигеном; антигеном, присутствующим на поверхности клетки, такой как целевая клетка; антигеном, представленным на твердой поверхности; антигеном, присутствующим в липидном бислое; и тому подобное.
[249] В некоторых случаях CAR по настоящему изобретению при наличии в цитоплазматической мембране эукариотической клетки и при активации одним или несколькими целевыми антигенами, повышает экспрессию по меньшей мере одной нуклеиновой кислоты в клетке. Например, в некоторых случаях CAR по настоящему изобретению при наличии в цитоплазматической мембране эукариотической клетки и при активации одним или несколькими целевыми антигенами повышает экспрессию по меньшей мере одной нуклеиновой кислоты в клетке по на меньшей мере около 10%, на по меньшей мере около 15%, на по меньшей мере около 20%, на по меньшей мере около 25%, на по меньшей мере около 30%, на по меньшей мере около 40%, на по меньшей мере около 50%, на по меньшей мере около 75%, по меньшей мере в около 2 раза, по меньшей мере в около 2,5 раза, по меньшей мере в около 5 раз, по меньшей мере в около 10 раз или более чем в 10 раз по сравнению с уровнем транскрипции нуклеиновой кислоты в отсутствие одного или нескольких целевых антигенов.
[250] В качестве примера CAR по настоящему изобретению может содержать иммунорецепторный мотив активации на основе тирозина (ITAM), содержащий внутриклеточный сигнальный полипептид.
[251] CAR по настоящему изобретению при наличии в цитоплазматической мембране эукариотической клетки и при активации одним или несколькими целевыми антигенами может в некоторых случаях приводить к повышенному продуцированию одного или нескольких цитокинов клеткой. Например, CAR по настоящему изобретению при наличии в цитоплазматической мембране эукариотической клетки и при активации одним или несколькими целевыми антигенами может повышать продуцирование цитокина клеткой по меньшей мере на около 10%, на по меньшей мере около 15%, на по меньшей мере около 20%, на по меньшей мере около 25%, на по меньшей мере около 30%, на по меньшей мере около 40%, на по меньшей мере около 50%, на по меньшей мере около 75%, по меньшей мере в около 2 раза, по меньшей мере в около 2,5 раза, по меньшей мере в около 5 раз, по меньшей мере в около 10 раз или более чем в 10 раз по сравнению с количеством цитокинов, продуцируемых клеткой в отсутствие одного или нескольких целевых антигенов. Цитокины, продуцирование которых может быть повышено, включают без ограничения гамма-интерферон (IFN-γ), фактор некроза опухоли-альфа (TNF-a), IL-2, IL-15, IL-12, IL-4, IL-5, IL-10; хемокин; фактор роста; и тому подобное.
[252] В некоторых случаях CAR по настоящему изобретению при наличии в цитоплазматической мембране эукариотической клетки и при активации одним или несколькими целевыми антигенами может приводить как к повышению транскрипции нуклеиновой кислоты в клетке, так и к повышению продуцирования цитокинов клеткой.
[253] В некоторых случаях CAR по настоящему изобретению при наличии в цитоплазматической мембране эукариотической клетки и при активации одним или несколькими целевыми антигенами приводит к цитотоксической активности клетки по отношению к целевой клетке, которая экспрессирует на своей клеточной поверхности антиген, с которым связывается антигенсвязывающий домен первого полипептида CAR. Например, если эукариотическая клетка представляет собой цитотоксическую клетку (например, NK-клетку или цитотоксический Т-лимфоцит), CAR по настоящему изобретению при наличии в цитоплазматической мембране клетки и при активации одной или несколькими целевыми антигенами повышает цитотоксическую активность клетки по отношению к целевой клетке, которая экспрессирует на своей клеточной поверхности один или несколько целевых антигенов. Например, если эукариотическая клетка представляет собой NK-клетку или Т-лимфоцит, CAR по настоящему изобретению при наличии в цитоплазматической мембране клетки и при активации одним или несколькими целевыми антигенами повышает цитотоксическую активность клетки на меньшей мере около 10%, на по меньшей мере около 15%, на по меньшей мере около 20%, на по меньшей мере около 25%, на по меньшей мере около 30%, на по меньшей мере около 40%, на по меньшей мере около 50%, на по меньшей мере около 75%, по меньшей мере в около 2 раза, по меньшей мере в около 2,5 раза, по меньшей мере в около 5 раз, по меньшей мере в около 10 раз или более чем в 10 раз по сравнению с цитотоксической активностью клетки в отсутствие одного или нескольких целевых антигенов.
[254] В некоторых случаях CAR по настоящему изобретению при наличи в цитоплазматической мембране эукариотической клетки и при активации одним или несколькими целевыми антигенами может приводить к другим событиям, связанным с активацией CAR, таким как пролиферация и экспансия (либо вследствие увеличения деления клеток или антиапоптотических ответов).
[255] В некоторых случаях CAR по настоящему изобретению при наличи в цитоплазматической мембране эукариотической клетки и при активации одним или несколькими целевыми антигенами может приводить к другим событиям, связанным с активацией CAR, таким как модуляция внутриклеточной передачи сигналов, клеточная дифференцировка или клеточная смерть.
[256] В некоторых вариантах осуществления CAR по настоящему изобретению ограничены микроокружением. Это свойство обычно является результатом ограниченной микроокружением природы домена ASTR в CAR. Таким образом, CAR по настоящему изобретению могут иметь более низкую аффинность связывания или в иллюстративных вариантах осуществления могут иметь более высокую аффинность связывания с одним или несколькими целевыми антигенами в условии (условиях) в микроокружении, чем в условии нормального физиологического окружения.
Лимфопролиферативные элементы
[257] Число периферических Т-лимфоцитов поддерживается на удивительно стабильном уровне в течение всего взрослого возраста, несмотря на продолжающееся добавление клеток вследствие эмиграции из тимуса и пролиферации в ответ на встречу с антигеном, а также потери клеток вследствие удаления антигенспецифических эффекторов после клиренса антигена (Marrak, P. et al. 2000. Nat Immunol 1:107-111; Freitas, A.A. et al. 2000. Annu Rev Immunol 18:83-111). Размер периферического компартмента Т-клеток регулируется множеством факторов, которые влияют как на пролиферацию, так и на выживаемость. Однако в лимфопеническом окружении Т-лимфоциты делятся независимо от когнатного антигена вследствие механизмов «острой гомеостатической пролиферации», которые поддерживают размер периферического компартмента Т-клеток. Условия для лимфопении были созданы у субъектов или пациентов во время адоптивной клеточной терапии путем пролиферации Т-клеток in vitro и введения их в лимфодеплецированных субъектов, что привело к усилению приживления и противоопухолевой функции перенесенных Т-клеток. Однако лимфодеплеция у субъекта нежелательна, поскольку она может вызвать серьезные побочные эффекты, включая иммунную дисфункцию и смерть.
[258] Исследования показали, что лимфодеплеция удаляет эндогенные лимфоциты, функционирующие в качесте клеточных приемников для гомеостатических цитокинов, тем самым высвобождая цитокины, чтобы вызвать выживание и пролиферацию адоптивно перенесенных клеток. Некоторые цитокины, такие как, например, IL-7 и IL-15, как известно, опосредуют антигеннезависимую пролиферацию Т-клеток и, таким образом, способны вызывать гомеостатическую пролиферацию в нелимфопеническом окружении. Однако эти цитокины и их рецепторы обладают внутренними механизмами контроля, которые предупрежают лимфопролиферативные нарушения гомеостаза.
[259] Многие из аспектов, представленных в данном документе, включают лимфопролиферативный элемент или нуклеиновую кислоту, кодирующую его, обычно как часть сконструированного сигнального полипептида. Соответственно, в некоторых аспектах настоящего изобретения сконструированный сигнальный полипептид представляет собой лимфопролиферативный элемент, такой как химерный лимфопролиферативный элемент (CLE). Обычно CLE содержит внеклеточный домен, трансмембранный домен и по меньшей мере один внутриклеточный сигнальный домен, который управляет пролиферацией. CLE не содержит ASTR и домен активации. В иллюстративных вариантах осуществления в данном документе один или несколько лимфопролиферативных элементов вводят в покоящуюся Т-клетку и/или покоящуюся NK-клетку, обычно путем трансдукции покоящейся Т-клетки и/или покоящейся NK-клетки с помощью не способных к репликации рекомбинантных ретровирусных частиц, геном которых кодирует лимфопролиферативный элемент, как часть сконструированного сигнального полипептида. Лимфопролиферативный элемент может содержать один внутриклеточный домен или может содержать более одного внутриклеточного домена. В определенных иллюстративных вариантах осуществления лимфопролиферативный элемент содержит два внутриклеточных домена. В Табл. 7-23, представленных в данном документе и обсуждаемых в Примерах 17 и 18, представлены CLE с одним внутриклеточным доменом и CLE с двумя внутриклеточными доменами, которые были идентифицированы с использованием экспериментальных способов, предоставленных в них, в которых тестировались кандидатные химерные полипептиды, которые содержали различные комбинации внеклеточных доменов и внутриклеточных доменов, которые идентифицированы в Табл. 6.
[260] В некоторых иллюстративных вариантах осуществления лимфопролиферативный элемент может представлять собой или может содержать цитокин или в дополнительных иллюстративных вариантах осуществления рецептор цитокина или фрагмент, который содержит его сигнальный домен, который активирует путь STAT3, путь STAT4 или даже в дополнительных иллюстративных вариантах осуществления путь Jak/STAT5. Таким образом, лимфопролиферативный элемент может представлят собой в неограничивающем примере рецептор цитокина или активный фрагмент, который содержит его сигнальный домен, такой как рецептор интерлейкина или активный фрагмент, который содержит его сигнальный домен, который активирует SТАТ5. Таким образом, лимфопролиферативный элемент представляет собой полипептид, который способствует пролиферации и, необязательно, выживанию (антиапоптоз) и, возможно, обеспечивает костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость лимфоцита к клеточной смерти. В определенных иллюстративных вариантах осуществления лимфопролиферативный элемент представляет собой полипептид, который индуцирует пролиферацию Т-клетки и/или NK-клетки. Иллюстративные лимфопролиферативные элементы вызывают пролиферацию, активируя STAT5. Таким образом, фрагменты таких лимфопролиферативных элементов сохраняют способность индуцировать пролиферацию Т-клеток и/или NK-клеток в иллюстративных вариантах осуществления путем активации STAT5.
[261] В иллюстративных вариантах осуществления лимфопролиферативные элементы при наличии в генетически модифицированных PBMC, лимфоцитах или генетически модифицированных Т-клетках и/или NK-клетках способны стимулировать пролиферацию/экспансию лимфоцитов и, возможно, выживание ex vivo или in vitro в культуре в отсутствие воздействия клетки к цитокинам, таким как IL-15, IL-7, и в иллюстративных вариантах осуществления IL-2 и мишени для ASTR CAR, экспрессируемой клетками во время культивирования в течение 6, 7, 14, 21 или 35 дней.
[262] В некоторых способах и композициях, представленных в данном документе, лимфопролиферативный элемент используется для стимулирования пролиферации или экспансии генетически модифицированных Т-клеток in vivo без необходимости лимфодеплеции субъектов. Таким образом, неограничивающие иллюстративные варианты осуществления способов, представленных в данном документе, которые включают вставку лимфопролиферативного элемента в покоящуюся Т-клетку и/или NK-клетку субъекта, обычно путем трансдукции такой Т-клетки и/или NK-клетки, могут выполняться без лимфодеплеции субъекта до, во время и/или после осуществления способа, или без лимфодеплиции субъекта до, во время и/или после сбора крови у субъекта перед осуществления такого способа, или без лимфодеплеции у субъекта до, во время и/или после генетической модификации Т-клеток или NK-клеток ex vivo от субъекта и/или до, во время или после повторного введения генетически модифицированных Т-клеток и/или NK-клеток субъекту. Факторы, которые способствуют пролиферации Т-клеток in vivo, включают цитокины и их рецепторы, в которых рецептор обычно включает лиганд-связывающий домен и сигнальный домен. В некоторых вариантах осуществления лимфопролиферативный элемент, применяемый в способах и композициях, раскрытых в данном документе, представляет собой цитокин и/или цитокиноый рецептор. Цитокин может представлять собой интерлейкин, а цитокиновый рецептор может представлять собой рецептор интерлейкина. Лимфопролиферативный элемент может представлять собой функциональный фрагмент цитокина и/или функциональный фрагмент цитокинового рецептора, такой как его сигнальный домен, при этом этот фрагмент способен стимулировать пролиферацию Т-клеток, например, путем активации STAT5.
[263] В некоторых вариантах осуществления цитокиновый лимфопролиферативный элемент в способах и композициях, описанных в данном документе, содерижт одно или несколько из следующего: интерлейкин-7 (IL-7) или его рецептор (IL-7R) или его сигнальный домен; интерлейкин-12 (IL-12) или его рецептор (IL-12R) или его сигнальный домен; интерлейкин-23 (IL-23) или его рецептор, состоящий из IL-12R β1 и IL-23R, или их сигнальный домен; интерлейкин-27 (IL-27) или его рецептор (IL-27R) или его сигнальный домен; интерлейкин-15 (IL-15) или его рецептор (IL-15R) или его сигнальный домен; интерлейкин-21 (IL-21) или его рецептор (IL-21R) или его сигнальный домен; или трансформирующий фактор роста β (TGFβ) или его рецептор (TGFβR) или его сигнальный домен; или рецептор-ловушку TGF-β (TGF-β - доминантно-негативный рецептор II (DNRII)). В некоторых вариантах осуществления лимфопролиферативный элемент представляет собой IL-12R или рецептор-ловушку TGFβ (TGF-β - доминантно-негативный рецептор II (DNRII)).
[264] IL-7 связывается с рецептором IL-7, гетеродимером, состоящим из IL-7R альфа и общего рецептора гамма-цепи. Связывание приводит к возникновению каскада сигналов, важных для развития Т-клеток в тимусе и выживания на периферии. Известно, что связывание IL-7 с рецептором IL-7 активирует путь Jak/STAT5.
[265] IL-12 участвует в дифференцировке наивных Т-клеток в клетки Th1 (Hsieh CS et al. 1993. Science. 260(5107):547-9) и известен как фактор, стимулирующий Т-клетки. IL-12 связывается с рецептором IL-12, который представляет собой гетеродимерный рецептор, образованный IL-12R-β1 и IL-12R-β2. IL12 может действовать, активируя STAT4, но было продемонстрировано, что он также активирует STAT5 в Т-клетках (Ahn, H., et al. 1998. J. Immun. 161:5893-5900). Семейство IL-12 состоит из цитокинов IL-12, IL-23 и IL-27. Рецептор IL-23 состоит из IL-12R β1 и IL-23R. IL-27 представляет собой гетеродимерный цитокин, который состоит из двух отдельных генов: гена 3, индуцированного вирусом Эпштейна-Барра (EBI3), и IL-27p28. IL-27 взаимодействует с рецептором IL-27.
[266] IL-15 представляет собой фактор стимуляции Т- и NK-клеток, сходный по структуре и функциям с IL-2. Оба цитокина вызывают пролиферацию Т-клеток; и их общие функции, как полагают, являются результатом обоих рецепторов, использующих IL-2/IL-15Rβ и общие цепи γ. Сигнальный путь IL-15 начинается со связывания с рецептором IL-15Rα с последующей презентацией окружающим клеткам, несущим комплекс IL-15Rβγc на своей клеточной поверхности. При связывании субъединица IL-15β активирует киназу 1 Janus (Jak1) и субъединицу γc Janus киназу 3 (Jak3), что приводит к фосфорилированию и активации STAT3 и STAT5.
[267] IL-21 экспрессируется в активированных CD4+ Т-клетках и в NKT-клетках человека, а экспрессия IL-21 повышается в подгруппах Th2 и Th17 Т-хелперных клеток. Рецептор IL-21 (IL-21R) экспрессируется на поверхности T, B и NK-клеток и подобен по структуре рецепторам для других цитокинов типа I, таких как IL-2R или IL-15. IL-21R требует димеризации с общей гамма-цепью (γc) для связывания IL-21. При связывании с IL-21 рецептор IL-21 действует через путь Jak/STAT, активируя STAT1, STAT3 и STAT5.
[268] Рецепторы-ловушки TGFβ (TGF-β - доминантно-негативный рецептор II (DNRII)) блокируют передачу сигналов TGFβ, конкурируя с естественными рецепторами за связывание TGFβ. TGFβ-DNRII представляет собой усеченную киназой форму RII, которая содержит внеклеточный TGFβ-связывающий домен и трансмембранный домен RII. TGFβ-DNRII связывает лиганд, но не фосфорилирует и не активирует RI, тем самым уменьшая или устраняя фосфорилирование Smad.
[269] Мутации с усилением функции в IL-7Rα были идентифицированы у субъектов с острым лимфобластным лейкозом B- и T-клеток (B-ALL и T-ALL) (Zenatti PP, et al. 2011. Nat Genet 43:932-939; Snochat, C. et al. 2011. J Exp Med 208:901-908; McElroy, C.A. et al. 2012. PNAS 109(7):2503-2508). Мутации включали вставки и делеции в N-концевой области IL-7Rα TMD, при этом почти все последовательности содержали дополнительный остаток Cys, а также мутацию с S165 на C165. Цистеин вызывает конститутивную активацию рецептора. Некоторые мутации в группе T-all активировали JAK1. Эти мутанты IL-7R с усилением функции можно использовать в любом из аспектов, представленных в данном документе, в качестве одного из лимфопролиферативных элементов.
[270] Соответственно, в некоторых вариантах осуществления лимфопролиферативный элемент представляет собой мутантный рецептор IL-7. В других вариантах осуществления мутантный рецептор IL-7 является конститутивно активным, активируя путь JAK-STAT5 в отсутствие цитокинового лиганда. В других вариантах осуществления мутантный рецептор IL-7 содержит вставку от 1 до 10 аминокислот в положении между 237 и 254, которая включает остаток цистеина, который включает способность конститутивно активировать путь STAT5. В некоторых вариантах осуществления мутантный рецептор IL-7 представляет собой IL-7Rα-insPPCL (представленный в виде SEQ ID NO: 82). Кроме того, в некоторых вариантах осуществления химерного лимфопролиферативного элемента (CLE), представленных в данном документе, один или несколько, но не все домены происходят из IL-7Rα-insPPCL.
[271] В некоторых вариантах осуществления лимфопролиферативный элемент представляет собой химерный цитокиновый рецептор, такой как без ограничения цитокин, связанный с его рецептором, который обычно конститутивно активирует тот же путь STAT, что и соответствующий активированный рецептор цитокина дикого типа, такой как STAT3, STAT4, и в иллюстративных варианты осуществления STAT5. В некоторых вариантах осуществления химерный цитокиновый рецептор представляет собой интерлейкин или его фрагмент, связанный или ковалентно связанный с его когнатным рецептором или его фрагментом с помощью линкера. В некоторых вариантах осуществления химерный цитокиновый рецептор представляет собой IL-7, связанный с IL-7Rα. В других вариантах осуществления химерный цитокиновый рецептор представляет собой IL-7, связанный с доменом IL-7Rα, таким как, например, внеклеточный домен IL-7Rα и/или трансмембранный домен IL-7Rα. В некоторых вариантах осуществления лимфопролиферативный элемент представляет собой цитокиновый рецептор, который не связан с цитокином, и фактически в иллюстративных вариантах осуществления, представленных в данном документе, лимфопролиферативный элемент представляет собой конститутивно активный цитокиновый рецептор, который не связан с цитокином. Эти химерные рецепторы IL-7 обычно конститутивно активируют STAT5 при экспрессии.
[272] В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают лимфопролиферативный элемент, при этом лимфопролиферативный элемент представляет собой цитокин или полипептид цитокинового рецептора или его фрагмент, содержащий сигнальный домен, лимфопролиферативный элемент может содержать полипептид интерлейкина, ковалентно связанный с частью его когнатного полипептида рецептора интерлейкина с помощью линкера. Обычно эта часть когнатного рецептора интерлейкина включает функциональную часть внеклеточного домена, способную связывать цитокин интерлейкина и трансмембранный домен. В некоторых вариантах осуществления внутриклеточный домен представляет собой внутриклеточную часть когнатного рецептора интерлейкина. В некоторых вариантах осуществления внутриклеточный домен представляет собой внутриклеточную часть другого цитокинового рецептора, который способен стимулировать пролиферацию лимфоцитов. В некоторых вариантах осуществления лимфопролиферативный элемент представляет собой полипептид интерлейкина, ковалентно связанный с его полноразмерным когнатным полипептидом рецептора интерлейкина с помощью линкера.
[273] В некоторых вариантах осуществления лимфопролиферативный элемент может содержать рецептор цитокина или фрагмент, который содержит его сигнальный домен. В некоторых вариантах осуществления цитокиновый рецептор может представлять собой CD40, CRLF2, CSF2RA, CSF2RB, CSF3R, EPOR, GHR, IFNAR1, IFNAR2, IFNGR1, IFNGR2, IFNLR1, IL1R1, IL1RAP, IL1RL1, IL1RL2, IL2RA, IL2RG, IL2RB, IL3RA, IL4R, IL5RA, IL6R, IL6ST, IL7RA, IL9R, IL10RA, IL10RB, IL12RB1, IL13RA2, IL15RA, IL17RA, IL17RB, IL17RC, IL17RE, IL18R1, IL18RAP, IL20RA, IL20RB, IL21R, IL22RA1, IL23R, IL27R, IL31RA, LEPR, LIFR, MPL, OSMR, PRLR, TNFRSF4, TNFRSF8, TNFRSF9, TNFRSF14 или TNFRSF18. Иллюстративные варианты осуществления химерных цитокиновых рецепторов, которые содержат функциональные внутриклеточные домены перечисленных выше цитокиновых рецепторов, тестировали в Примерах 17 и 18 для подтверждения того, что химерные рецепторы цитокинов, которые содержат эти функциональные внутриклеточные домены, могут функционировать как лимфопролиферативные элементы.
[274] В определенных иллюстративных вариантах осуществления лимфопролиферативный элемент содержит цитокиновый рецептор или его фрагмент, который содержит сигнальный домен, который активирует путь Jak/STAT5. Например, такой лимфопролиферативный элемент может содержать внутриклеточный домен IL21R, IL27R, IL31RA, LIFR и OSMR. Как продемонстрировано в экспериментах Примеров 17 и 18 и Табл. 7-17, химерные лимфопролиферативные элементы, которые содержат внутриклеточные домены этих генов, были обнаружены среди химерных кандидатных полипептидов, которые индуцировали наивысшую степень пролиферации в PBMC, культивируемых в отсутствие экзогенных цитокинов, таких как как IL-2.
[275] В некоторых вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен, который представляет собой интерлейкин или рецептор интерлейкина, и который представлял собой часть наболее эффективной конструкции, идентифицированной в библиотеках 1A, 1.1A, 2B, 2.1B, 3A, 3.1A, 3B, 3.1. B, 4B и/или 4.1B Примеров 17 и 18 (Табл. с 7 по 17). В некоторых вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен, который представляет собой цитокиновый рецептор, и который представлял собой часть наболее эффективной конструкции, идентифицированной в библиотеках 1A, 1.1A, 2B, 2.1B, 3A, 3.1A, 3B, 3.1. B, 4B и/или 4.1B Примеров 17 и 18 (Табл. с 7 по 17). В некоторых вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен, который содержит по меньшей мере один мотив ITAM, и который представлял собой часть наболее эффективной конструкции, идентифицированной в библиотеках 1A, 1.1A, 2B, 2.1B, 3A, 3.1A, 3B, 3.1. B, 4B и/или 4.1B Примеров 17 и 18 (Табл. с 7 по 17).
[276] В иллюстративных вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен из IL7R, IL12RB1, IL15RA или IL27RA, которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) при начальном и повторном скрининге, как подробно описано в Примерах 17 и 18 (Табл. с 19 по 23).
[277] В иллюстративных вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен из цитокиновых рецепторов CD27, CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCER1G, FCGR2A, FCGR2C, GHR, IFNAR1, IFNAR2, IFNGR2, IL1R1, IL1RL1, IL2RA, IL2RG, IL3RA, IL5RA, IL6R, IL7R, IL9R, IL10RB, IL11RA, IL12RB1, IL13RA1, IL13RA2, IL15RA, IL17RB, IL18R1, IL18RAP, IL20RB, IL22RA1, IL27RA, IL31RA, LEPR, MPL, OSMR, PRLR, TNFRSF4, TNFRSF8, TNFRSF9, TNFRSF14 или TNFRSF18, которые присутствовали в конструкциях, которые продемонстрировали особенно заметное обогащение (т.е. вызвали наивышую величину пролиферации) при начальном и повторном скрининге, как подробно описано в Примерах 17 и 18 (Табл. с 19 по 23).
[278] В иллюстративных вариантах осуществления лимфопролиферативный элемент содержит внутриклеточный домен из CD3D, CD3E, CD3G, CD79A, CD79B, FCER1G, FCGR2A или FCGR2C, которые содержат по меньшей мере один мотив ITAM и присутствуют в конструкциях, которые продемонстрировали особенно заметное обогащение (т.е. вызвали наивышую величину пролиферации) при начальном скрининге и повторном скрининге, как подробно описано в Примерах 17 и 18 (Табл. с 19 по 23).
[279] В некоторых вариантах осуществления лимфопролиферативный элемент в этом абзаце, который, как было продемонстрировано в Примерах 17 и 18, активен в конструкциях только с одним внутриклеточным доменом, может представлять собой внутриклеточный домен лимфопролиферативного элемента с двумя или более внутриклеточными доменами или в иллюстративных вариантах осуществления единственный внутриклеточный домен, т.е. лимфопролиферативный элемент не содержит двух или более внутриклеточных доменов. В иллюстративных вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе содержит домен из CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2A, IFNAR2, IFNGR2, IL1R1, IL3RA, IL7R, IL10RB, IL11RA, IL12RB1, IL13RA2, IL18RAP, IL31RA, MPL, MYD88, TNFRSF14 или TNFRSF18, которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) при начальном и повторном скрининге, как подробно описано в Примере 18, как отдельные домены внутриклеточной передачи сигналов (Табл. 22 и 23). В иллюстративных вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе содержит домен из IL7R или IL12RB1, которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую величину пролиферации) при начальном и повторном скрининге, как подробно описано в Примере 18. (Табл. 22 и 23). В некоторых вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе с единственным внутриклеточным доменом может представлять собой цитокиновый рецептор. В иллюстративных вариантах осуществления цитокиновый рецептор в лимфопролиферативном элементе с одним внутриклеточным доменом содержит домен из CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2A, IFNAR2, IFNGR2, IL1R1, IL3RA, IL7R, IL10RB, IL11RA, IL12RB1, IL13RA2, IL18RAP, IL31RA, MPL, TNFRSF14 или TNFRSF18, которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую величину пролиферации) при начальном и повторном скрининге, как подробно описано в Примере 18 (Табл. 22 и 23). В некоторых вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе может содержать по меньшей мере один мотив ITAM. В иллюстративных вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе, который содержит по меньшей мере один мотив ITAM, содержит домен из FCGR2A, который присутствовал в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую величину пролиферации) при начальном и повторном скрининге. как подробно описано в Примере 18 (Табл. 22).
[280] В иллюстративных вариантах осуществления лимфопролиферативный элемент может содержать костимулирующий домен из CD27, CD28, OX40 (также обозначаемый как TNFRSF4), GITR (также обозначаемый как TNFRSF18) или HVEM (также обозначаемый как TNFRSF14), которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) при начальном и повторном скрининге, как подробно описано в Примерах 17 и 18 (Таблицы с 19 по 23).
[281] В некоторых вариантах осуществления лимфопролиферативный элемент может представлять собой одну из конструкций M024-S190-S047, M025-S050-S197, M036-S170-S047, M012-S045-S048, M049-S194-S064, M025-S190-S050, M025-S190-S05, E013-T041-S186-S051, E013-T028-S186-S051, E014-T015-S186-S051, E011-T016-S186-S050, E011-T073-S186-S050 или E013-T011-S186-S211, все из которых стимулировали пролиферацию лимфоцитов в состоянии покояпосле трансдукции, как продемонстрировано в Примере 21 (Фиг. 35 и 36). В определенных вариантах осуществления лимфопролиферативные элементы содержат внеклеточный домен из CSF3R, IL3RA, ICOS, CRLF, CSF2RA, LIFR или CD40; первый внутриклеточный домен из MyD88, CD40 или MPL и/или второй внутриклеточный домен из CD27 или MyD88.
[282] В некоторых вариантах осуществления лимфопролиферативный элемент может представлять собой конструкцию E013-T041-S186-S051, которая стимулировала пролиферацию лимфоцитов в состоянии покоя после трансдукции не способной к репликации рекомбинантной ретровирусной частицей, отображающей UCHT1scFvFc-GPI, как продемонстрировано и проанализировано в Примере 22 (Фиг. 38A и В). В других вариантах осуществления лимфопролиферативный элемент представляет собой IL7-IL7RA-IL2RB, как продменстрировано и проанализировано в Примере 22.
[283] Как подробно описано в Примере 17, для библиотек 1A и 1.1A конструкции с доменами цитокиновых рецепторов CD27, IL1RL1, IL6R, IL31RA, TNFRSF4 или TNFRSF18 продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) в обеих библиотеках 1A и 1.1A (Табл. 19).
[284] Как подробно описано в Примере 17, для библиотек 2B и 2.1B конструкции с доменами цитокиновых рецепторов CD40, FCER1G, FCGR2C, IFNGR2, GHR, IL10RB, IL11RA, IL13RA2, IL17RB, IL22RA1, TNFRSF14 или TNFRSF9 продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) в библиотеках 2B и 2.1B (Табл. 20).
[285] Как подробно описано в Примере 18, для библиотек 3A и 3.1A конструкции с доменами цитокиновых рецепторов CD27, CD40, CSF2RA, FCGR2A, MPL, OSMR, TNFRSF4 или TNFRSF18 продемонстрировали особенно заметное обогащение (т.е. вызвали наивысшую степень пролиферации) в обеих библиотеках 3A и 3.1A (Табл. 21).
[286] Как подробно описано в Примере 18, для библиотек 3B и 3.1B конструкции с доменами из цитокиновых рецепторов CD27, CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCER1G, FCGR2A, FCGR2C, IFNAR1, IFNAR2, IFNGR2, IL1RL1, IL2RG, IL3RA, IL5RA, IL6R, IL7R, IL9R, IL10RB, IL11RA, IL12RB1, IL13RA1, IL13RA2, IL15RA, IL18RAP, IL20RB, IL27RA, IL31RA, LEPR, MPL, OSMR, PRLR, TNFRSF4, TNFRSF8, TNFRSF9, TNFRSF14 или TNFRSF18 продемонстрировали особенно заметное обогащение (т.е. вызвали наивысшую степень пролиферации) в обеих библиотеках 3B и 3.1B (Табл. 22).
[287] Как подробно описано в Примере 18, для библиотек 4B и 4.1B конструкции с доменами цитокиновых рецепторов CD27, CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2A, FCGR2C, IFNAR2, IFNGR2, IL1R1, IL2RA, IL3RA, IL2RG, IL6R, IL7R, IL10RB, IL11RA, IL31RA, IL13RA1, IL13RA2, IL18R1, MPL, OSMR, TNFRSF4, TNFRSF9 или TNFRSF18 продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) в обеих библиотеках 4B и 4.1B (Табл. 23).
[288] В определенных иллюстративных вариантах осуществления лимфопролиферативный элемент содержит внутриклеточный домен CD40, MPL и IL2Rb, которые, как продемонстрировано в Примерах, представленных в данном документе, способствуют пролиферации PBMC.
[289] В некоторых вариантах осуществления лимфопролиферативный элемент может отличаться от цитокинового рецептора. В некоторых вариантах осуществления лимфопролиферативный элемент, отличный от цитокинового рецептора, может содержать внутриклеточный сигнальный домен из CD2, CD3D, CD3G, CD3Z, CD4, CD8RA, CD8RB, CD28, CD79A, CD79B, FCER1G, FCGR2A, FCGR2C или ICOS. Иллюстративные варианты осуществления химерных лимфопролиферативных элементов, которые содержат указанные перечисленные гены, представлены в Примерах 17 и 18 и в таблицах, цитируемых в них.
[290] В некоторых вариантах осуществления CLE отличается от IL-15, связанного с рецептором IL-2/IL-15.
[291] В некоторых способах и композициях, раскрытых в данном документе, экспрессия лимфопролиферативного элемента индуцируется и может даже зависеть от связывания соединения с элементом управления (как обсуждается в другом месте в данном документе), который в неограничивающих вариантах осуществления представляет собой рибопереключатель. В некоторых вариантах осуществления лимфопролиферативный элемент экспрессируется промотором, активным в Т-клетке и/или NK-клетке. Для способов и композиций, представленных в данном документе, специалисту в данной области техники будет понятно, что известны промоторы, которые активны в Т-клетках и/или NK-клетках и могут использоваться для экспрессии первого сконструированного сигнального полипептида или второго сконструированного сигнального полипептида или любого их компонента. В иллюстративных вариантах осуществления такой промотор не активен в линии пакующих клеток, такой как пакующие линии, раскрытые в данном документе. В некоторых вариантах осуществления промотор представляет собой промотор EF1a или промотор вируса стволовых клеток мыши (MSCV) (Jones et al., Human Gene Therapy (2009) 20: 630-40). В иллюстративных вариантах осуществления промотор представляет собой дзета-промотор CD3, специфичный для Т-клеток.
[292] В некоторых вариантах осуществления лимфопролиферативный элемент ограничен микроокружением. Например, лимфопролиферативный элемент может представлять собой мутантный рецептор, который по-разному связывает соответствующий цитокин в аберрантных и физиологических условиях. Например, можно использовать IL-7R, который может связывать IL7 сильнее в опухолевом окружении, чем в нормальном физиологическом окружении.
[293] В некоторых вариантах осуществления лимфопролиферативный элемент слит с доменом распознавания или элиминации. Такие домены распознавания или элиминации раскрыты в данном документе более подробно. Такое слияние обеспечивает преимущество, особенно при использовании усеченного или другого мутантного лимфопролиферативного элемента, в том, что требуется меньше полинуклеотидов в ретровирусном геноме. Это важно в иллюстративных вариантах осуществления, представленных в данном документе, поскольку это помогает разрешить включение большего количества нуклеиновых кислот, кодирующих функциональные элементы, в ретровирусный геном и поскольку это добавляет механизм, с помощью которого клетки, экспрессирующие лимфопролиферативный элемент, могут быть уничтожены, если их пролиферация больше не требуется или вредна для организма.
[294] В некоторых вариантах осуществления лимфопролиферативный элемент, включая CLE, содержит внутриклеточный активирующий домен, как раскрыто выше. В некоторых иллюстративных вариантах осуществления лимфопролиферативный элемент представляет собой CLE, содержащий внутриклеточный активирующий домен, содержащий ITAM-содержащий домен. По сути, CLE может содержать внутриклеточный активирующий домен, на по меньшей мере 80%, 90%, 95%, 98% или 100% идентичный последовательности доменов CD3Z, CD3D, CD3E, CD3G, CD79A, CD79B, DAP12, FCER1G, FCGR2A, FCGR2C, DAP10/CD28 или ZAP70 представленных в данном документе. В определенных иллюстративных вариантах осуществления внутриклеточный активирующий домен представляет собой ITAM-содержащий домен из CD3D, CD3G, CD3Z, CD79A, CD79B, FCER1G, FCGR2A или FCGR2C. CLE, содержащие эти внутриклеточные активирующие домены, продемонстрированы в Примерах 17 и 18 в данном документе и в связанных Табл. 18-23 как эффективные при стимулировании пролиферации PBMC ex vivo в культурах в отсутствие экзогенных цитокинов, таких как экзогенный IL-2. В некоторых вариантах осуществления в данном документе представлены CLE, содержащие внутриклеточный домен из CD3D, CD3G, CD3Z, CD79A, FCER1G.
[295] В некоторых вариантах осуществления один или несколько доменов лимфопролиферативного элемента слиты с костимулирующим доменом и/или внутриклеточным активирующим доменом CAR. Химерный лимфопролиферативный элемент, раскрытый в данном документе, не является химерным антигенным рецептором (CAR), поскольку он не содержит ASTR. Однако в некоторых вариантах осуществления один или несколько внутриклеточных доменов лимфопролиферативного элемента могут быть частью того же полипептида, что и CAR, или могут быть слиты и необязательно функционально связаны с некоторыми компонентами CAR. Например, лимфопролиферативный элемент может быть слит с антигенспецифической нацеленной областью (ASTR) и активирован путем связывания ASTR с его антигеном. В других вариантах осуществления сконструированный сигнальный полипептид может содержать ASTR, внутриклеточный домен активации (такой как сигнальный домен CD3 дзета), костимулирующий домен и лимфопролиферативный домен. Дополнительные подробности, касающиеся костимулирующих доменов, внутриклеточных активирующих доменов, ASTR и других CAR-доменов, раскрыты в других разделах в данном документе.
[296] В иллюстративных вариантах осуществления в данном документе элемент выживания Т-клетки и/или NK-клетки вводится в покоящуюся Т-клетку и/или покоящуюся NK-клетку, как правило, путем трансдукции покоящейся Т-клетки и/или покоящейся NK-клетки с помощью не способной к репликации рекомбинантной ретровирусной частицы, геном которой кодирует элемент выживания Т-клеток и/или NK-клеток как часть сконструированного сигнального полипептида. В некоторых вариантах осуществления лимфопролиферативный элемент также представляет собой элемент выживания Т-клеток и/или NK-клеток. Как обсуждалось выше, некоторые из лимфопролиферативных элементов не только способствуют пролиферации, но также способствуют выживанию клеток. В некоторых вариантах осуществления мотив выживания Т-клеток и/или NK-клеток не является лимфопролиферативным элементом. В некоторых вариантах осуществления мотив выживания Т-клеток и/или NK-клеток может представлять собой мотив выживания CD28 Т-клеток или мотивом выживания CD137 клеток. Такие мотивы выживания Т-клеток можно найти на сконструированных сигнальных полипептидах, которые включают ASTR, например, scFv. В иллюстративном варианте осуществления мотив выживания Т-клеток представляет собой мотив выживания CD28 Т-клеток или мотив CD137, связанный с scFv с помощью трансмембранного домена CD8a или трансмембранного домена CD28. В определенных вариантах осуществления указанный внутриклеточный сигнальный домен содержит полипептидную последовательность, содержащую иммунорецепторный мотив активации на основе тирозина (ITAM). В определенном варианте осуществления указанная полипептидная последовательность представляет собой сигнальный домен CD3ζ.
[297] В некоторых вариантах осуществления лимфопролиферативный элемент не является полипептидом, а скорее содержит ингибирующую РНК. В некоторых вариантах осуществления способы, варианты применения, композиции и продукты способов согласно любому аспекту в данном документе включают как лимфопролиферативный элемент, содержащий ингибирующую РНК, так и лимфопролиферативный элемент, который представляет собой сконструированный сигнальный полипептид. В вариантах осуществления, в которых лимфопролиферативный элемент представляет собой ингибирующую РНК, эта ингибирующая РНК может представлять собой miRNA, которая стимулирует путь STAT5, обычно за счет усиления активации STAT5 путем расщепления или снижения регуляции отрицательного регулятора пути SOCS. В некоторых вариантах осуществления miRNA направлена на белки, кодирующие mRNA, которые влияют на пролиферацию, такие как без ограничения ABCG1, SOCS1, TGFbR2, SMAD2, cCBL и PD1. В иллюстративных вариантах осуществления, как показано в данном документе, такая ингибирующая РНК (например, miRNA) может быть расположена в интронах в пакующих клетках и/или геноме не способных к репликации рекомбинантных ретровирусных частиц и/или ретровирусном векторе, обычно с экспрессией, управляемой активным промотором в Т-клетке и/или NK-клетке. Не ограничиваясь теорией, считается, что включение интронов в транскрипционные единицы приводит к более высокой экспрессии и/или стабильности транскриптов. По сути, возможность размещать miRNA в интронах ретровирусного генома дополняет идеи настоящего раскрытия, которые преодолевают проблемы предшествующего уровня техники, связанные с попытками добиться максимальной активности в ограничениях по размеру ретровируса, такого как геном лентивируса. В некоторых вариантах осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 miRNA, в иллюстративных вариантах осуществления от 2 до 5, например, 4 miRNA, одна или несколько из которых связывают нуклеиновые кислоты, кодирующие одну или несколько из ABCG1, SOCS1, TGFbR2, SMAD2, cCBL и PD1, могут быть включены в рекомбинантный ретровирусный геном и доставлены в целевую клетку, например, Т-клетки и/или NK-клетки, с использованием способов, представленных в данном документе. Фактически, как представлено в данном документе, 1, 2, 3 или 4 miRNA могут быть доставлены в одном интроне, таком как интрон EF1a.
[298] ABCG1 представляет собой переносчик АТФ-связывающих кассет, который отрицательное регулирует пролиферацию тимоцитов и периферических лимфоцитов (Armstrong et al. 2010. J Immunol 184(1):173-183).
[299] SOCS1 представляет собой представителя семейства отрицательных регуляторов передачи сигналов с участием цитокинов SOCS (супрессор передачи сигналов с участием цитокинов), которые ингибируют путь Jak/Stat, такого как STAT5. SOCS1 также известен как JAB (белок, связывающий киназу Janus), SSI-1 (статический ингибитор-1, индуцированный Stat) и TIP3 (белок, взаимодействующий с Tec).
[300] TGFbR2 представляет собой представителя семейства серин/треониновых протеинкиназ, который связывает TGF-β, образуя комплекс, который фосфорилирует белки, которые затем проникают в ядро и регулируют транскрипцию генов, связанных с пролиферацией.
[301] SMAD2 опосредует сигнал трансформирующего фактора роста (TGF)-β и регулирует множество клеточных процессов, таких как пролиферация, апоптоз и дифференцировка клеток.
[302] cCBL представляет собой убиквитинлигазу E3, которая ингибирует передачу сигналов с участием TCR за счет дефосфорилирования и инактивации ZAP-70 и за счет интернализации TCR.
[303] PD1 (CD279) представляет собой рецептор клеточной поверхности, экспрессируемый на Т-клетках и клетках ProB. PD-1 связывает два лиганда, PD-L1 и PD-L2. Передача сигналов с помощью PD-1 предупреждает активацию клеток.
[304] В некоторых вариантах осуществления в данном документе лимфопролиферативный элемент представляет собой полипептид, содержащий внутриклеточную область любого из генов, указанных в Табл. 18. В некоторых вариантах осуществления лимфопролиферативный элемент содержит или является внутриклеточным доменом, идентифицированным в химерных полипептидах в Табл. 18. В этих вариантах осуществления лимфопролиферативный элемент может представлять собой полипептид, который представляет собой химерный полипептид (см. CLE ниже), или не является CLE, но содержит или является внутриклеточным доменом гена, идентифицированного в положении P3 (первый внутриклеточный домен) в Табл. 18. В Табл. 18 идентифицированы конструкции CLE, которые способствовали пролиферации клеток PBMC между днем 7 и последним днем, когда второй внутриклеточный домен не присутствовал в конструкции. В некоторых подвариантах осуществления этого варианта осуществления лимфопролиферативный элемент представляет собой химерный полипептид (т.е. CLE - см. ниже), который содержит комбинацию трансмембранного домена и внутриклеточного домена с внеклеточным доменом, содержащим димеризующий мотив, или без него.
[305] В некоторых вариантах осуществления лимфопролиферативный элемент содержит MPL, или представляет собой MPL, или его вариант и/или фрагмент, включая вариант и/или фрагмент, который на по меньшей мере 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% идентичен последовательности внутриклеточного домена MPL с трансмембранным и/или внеклеточным доменом MPL или без него, и/или на по меньшей мере 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% идентичен последовательности внутриклеточного домена MPL с трансмембранным и/или внеклеточным доменом MPL или без него, при этом вариант и/или фрагмент сохраняет способность стимулировать пролиферацию клеток PBMC, и в некоторых вариантах осуществления Т-клеток. В некоторых вариантах осуществления фрагмент MPL, включенный в композиции и способы, описанные в данном документе, имеет и/или сохраняет связывающий домен JAK-2. В некоторых вариантах осуществления фрагмент MPL, включенный в данный документе, имеет или сохраняет способность активировать STAT. Полный внутриклеточный домен MPL представляет собой SEQ ID NO: 491 (часть S186 в Табл. с 7 по 18). MPL представляет собой рецептор тромбопоэтина. Некоторые цитокины, такие как тромбопоэтин и EPO, упоминаются в литературе и в данном документе либо как гормон, либо как цитокин.
[306] В некоторых вариантах осуществления, которые представляют отдельные аспекты настоящего изобратения, в данном документе представлены химерные полипептиды, которые являются химерными лимфопролиферативными элементами (CLE), а также выделенные полинуклеотиды и последовательности нуклеиновых кислот, которые их кодируют. Иллюстративные CLE изображены на Фиг. 30-33. CLE, описанные в данном документе, способствуют пролиферации Т-клеток и/или NK-клеток и необязательно также могут способствовать выживанию Т-клеток и/или NK-клеток. Некоторые CLE способствуют пролиферации и, возможно, также выживанию других типов PBMC, например, B-клеток. Варианты осуществления, представленные в данном документе, которые включают последовательности нуклеиновых кислот, которые кодируют CLE и CAR, для удобства составления могут обозначаться в данном документе вариантами полинуклеотидов CLE CAR. В некоторых вариантах осуществления CLE могут содержать трансмембранный домен и первый внутриклеточный домен. Кроме того, в иллюстративных вариантах осуществления, как показано на Фиг. 30-33, CLE содержат внеклеточный домен и/или второй внутриклеточный домен (и в дополнительных вариантах осуществления третий, четвертый и т.д. внутриклеточные домены). Химерные полипептиды в данном документе являются химерными, поскольку по меньшей мере один домен происходит от другого полипептида, чем по меньшей мере один из других доменов, и такие химеры не обнаруживаются в природе в организме без вмешательства человека. Некоторые CLE содержат лиганд рецептора, а некоторые CLE не содержат лиганд рецептора.
[307] Не ограничиваясь теорией, такие CLE были разработаны для стимулирования пролиферации и, возможно, выживания клеток в B-клетках, NK-клетках и/или T-клетках конститутивным образом (т.е. без необходимости связывания лиганда для активации). Ни один из CLE не встречается в природе, и многие из CLE имеют компоненты, которые обычно не экспрессируются в B-клетках, T-клетках и/или NK-клетках in vivo, и/или некоторые кандидатные CLE, как правило, не известны как специфически способствующие пролиферации клеток и/или передаче сигналов выживания клеток в В-клетках, Т-клетках и/или NK-клетках. Например, MPL обычно не экспрессируется в B-клетках, T-клетках и/или NK-клетках. Неожиданным образом было обнаружено, что новые CLE были идентифицированы путем скрининга большого количества кандидатных химерных полипептидов, как изложено в Примерах 17 и 18, которые способствовали пролиферации клеток PBMC. Такие CLE способствуют удовлетворению давно назревшей потребности в выявлении механизмов для стимуляции пролиферации и, возможно, выживания, а также В-клеток, Т-клеток и/или NK-клеток, что может быть полезно для важных клинически значимых технологий, таких как CAR-Т и Т-клетки, которые генетически сконструированы для экспрессии определенного TCR. Таким образом, считается, что некоторые CLE будут обеспечивать Т-клеткам и/или NK-клеткам способность экспандироваться in vivo без необходимости лимфодеплеции хозяина.
[308] Химерные лимфопролиферативные элементы, представленные в данном документе, и выделенные полинуклеотиды и нуклеиновые кислоты, кодирующие их, могут быть включены в любой аспект, представленный в данном документе, который включает лимфопролиферативный элемент. Например, первый сконструированный сигнальный полипептид может представлять собой или может содержать CLE в аспектах, представленных в данном документе, которые включают одну или несколько транскрипционных единиц, которые кодируют первый сконструированный сигнальный полипептид, регулируемый элементом управления. Кроме того, представлены отдельные аспекты настоящего изобретения, которые конкретно включают CLE. Например, такие аспекты включают выделенные химерные лимфопролиферативные полипептиды, выделенные полинуклеотиды и последовательности нуклеиновых кислот, кодирующие их, и векторы, включая плазмиды, вирусные и ретровирусные векторы, включая такие последовательности нуклеиновых кислот или выделенные полинуклеотиды. Такие аспекты дополнительно включают способы трансдукции или трансфекции PBMC, таких как B-клетки, или особенно T-клетки и NK-клетки, выделенными полинуклеотидами и векторами, содержащими их. Такие клетки могут быть выделенными неизмененными клетками или они могут быть модифицированными клетками, такими как клетки, которые генетически модифицированы, например, чтобы экспрессировать определенный TCR, или CAR-T-клетки.
[309] В некоторых вариантах осуществления CLE содержат как внеклеточную часть, так и трансмембранную часть, которая происходит из одного и того же белка, в иллюстративных вариантах осуществления одного и того же рецептора, любой из которых в иллюстративных вариантах осуществления является мутантом, образуя таким образом внеклеточный и трансмембранный домен. Эти домены могут происходить из цитокинового рецептора или его мутанта, или рецептора гормона, или его мутанта в некоторых вариантах осуществления, которые, как сообщается, являются конститутивно активными при экспрессии, по меньшей мере, в некоторых типах клеток. В иллюстративных вариантах осуществления такие внеклеточные и трансмембранные домены не содержат область связывания лиганда. Считается, что такие домены не связывают лиганд, если они присутствуют в CLE и экспрессируются в В-клетках, Т-клетках и/или NK-клетках. Мутации в таких мутантах рецептора могут происходить в трансмембранной области или во внеклеточной области околостебельной мембраны. Не ограничиваясь теорией, мутации, по меньшей мере, в некоторых внеклеточных - трансмембранных доменах CLE, представленных в данном документе, ответственны за передачу сигналов с участием CLE в отсутствие лиганда за счет объединения активирующих цепей, которые в норме не соединены, или за счет изменения подтверждение наличия связанного трансмембранного и/или внутриклеточного домена.
[310] Один аспект, в котором используются такие трансмембранные домены мутантов рецептора, представленные в данном документе, представляет собой выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
(a) внеклеточный и трансмембранный домен цитокинового рецептора или рецептора гормона, где по меньшей мере один из внеклеточного домена и трансмембранного домена содержит мутацию, которая обнаруживается на конститутивно активном мутанте цитокинового рецептора, и при этом внеклеточная последовательность не связывает лиганд цитокинового рецептора; и
(b) первый внутриклеточный домен, выбранный из внутриклеточного домена гена, имеющего первый внутриклеточный домен и, необязательно, второй домен выбранного полипептида, идентифицированного в Табл. 7-11, при этом указанный химерный полипептид способствует пролиферации В-клеток, Т-клеток и/или NK-клеток.
[311] Внеклеточная область таких внеклеточных и трансмембранных доменов в этих вариантах осуществления обычно является достаточно длинной для образования линкера, в иллюстративных вариантах осуществления гибкий линкер между трансмембранным доменом и другой функциональной пептидной областью, такой как домен клиренса, который в некоторых вариантах осуществления является связанным с аминоконцом внеклеточной области. Соответственно, внеклеточная область, когда она присутствует для образования внеклеточного и трансмембранного домена, может содержать от 1 до 1000 аминокислот, а обычно от 4 до 400 аминокислот, от 4 до 200 аминокислот, от 4 до 100 аминокислот, от 4 до 50 аминокислот, от 4 до 25 или от 4 до 20 аминокислот в длину. В одном варианте внеклеточная область представляет собой GGGS для внеклеточного и трансмембранного домена по этому аспекту настоящего изобретения.
[312] Трансмембранный домен, как часть вариантов осуществления, которые включают внеклеточный и трансмембранный домен как одну часть, например, как показано в библиотеках 1A, 1.1A, 1.1B, 2B и 2.1B в Примере 17, или как часть вариантов осуществления, которые включают внеклеточный димеризующийся мотив, как показано в библиотеках 3A, 3B, 3.1A, 3.1B, 4B и 4.1B из Примера 18, как более подробно обсуждается ниже, обычно по меньшей мере достаточно длинные, чтобы проходить через цитоплазматическую мембрану. Соответственно, трансмембранные домены или трансмембранные области внеклеточных и трансмембранных доменов могут иметь длину от 10 до 250 аминокислот, а более типично, по меньшей мере, 15 аминокислот в длину и могут составлять, например, от 15 до 100, от 15 до 75, 15 и 50, 15 и 40 или 15 и 30 аминокислот.
[313] Иллюстративные внеклеточные и трансмембранные домены для CLE вариантов осуществления, которые включают такие домены, в иллюстративных вариантах осуществления представляют собой внеклеточные области, обычно менее 30 аминокислот проксимальных к мембране внеклеточных доменов вместе с трансмембранными доменами мутантных рецепторов, которые, как сообщается, являются конститутивными, это не требует связывания лиганда для активации ассоциированного внутриклеточного домена. В иллюстративных вариантах осуществления такие внеклеточные и трансмембранные домены содержат IL7RA Ins PPCL, CRLF2 F232C, CSF2RB V449E, CSF3R T640N, EPOR L251C I252C, GHR E260C I270C, IL27RA F523C и MPL S505N. Дополнительные неограничивающие примеры таких внеклеточных и трансмембранных доменов представлены в Табл. 6 и проиллюстрированы в Примере 17 и соответствующих таблицах. В некоторых вариантах осуществления внеклеточный и трансмембранный домен не содержит более 10, 20, 25, 30 или 50 последовательных аминокислот, которые идентичны по последовательности части внеклеточного и/или трансмембранного домена IL7RA или его мутанта. В некоторых вариантах осуществления внеклеточный и трансмембранный домен отличается от IL7RA Ins PPCL. В некоторых вариантах осуществления внеклеточный и трансмембранный не содержит более 10, 20, 25, 30 или 50 последовательных аминокислот, которые идентичны по последовательности части внеклеточного и/или трансмембранного домена IL15R.
[314] Дополнительные иллюстративные трансмембранные домены представлены в Примере 18. Эти трансмембранные домены в иллюстративных вариантах осуществления происходят из трансмембранных белков типа I.
[315] В соответствии с этим в данном документе в одном аспекте представлен выделеннй полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
a) трансмембранный домен трансмембранного белка типа I; и
b) первый внутриклеточный домен, выбранный из внутриклеточного домена гена, имеющего первый внутриклеточный домен выбранного полипептида, идентифицированного в Табл. 12-17, при этом указанный химерный полипептид способствует клеточной пролиферации В-клеток, Т-клеток и/или NK-клеток.
[316] В иллюстративных вариантах осуществления указанный химерный полипептид способствует пролиферации клеток PBMC, например, B-клеток и/или NK-клеток, и/или в иллюстративных вариантах осуществления T-клеток. Как показано в Примере 18, такие химерные полипептиды способны стимулировать пролиферацию клеток PBMC в отсутствие воздействия на PBMC экзогенных цитокинов, таких как IL-2, IL-15 или IL-7, во время культивирования, например, в отсутствие добавления IL-2 к культуральной среде PBMC (например, B-клеток, T-клеток или NK-клеток), которые экспрессируют нуклеиновую кислоту, кодирующую химерный полипептид. Как показано в Примере 18, для таких вариантов осуществления IL-2 может быть добавлен во время трансдукции PBMC, но не при последующем культивировании. Например, химерные полипептиды, описанные в данном документе, являются лимфопролиферативными элементами, поскольку они способны стимулировать пролиферацию клеток и, возможно, выживание клеток PBMC, и в иллюстративных вариантах осуществления Т-клеток без добавления IL-2 во время культивирования PBMC (например, Т-клеток) после через 1, 2, 3, 4, 5 или 7 дней культивирования, необязательно после трансдукции PBMC нуклеиновой кислотой, кодирующей химерный лимфопролиферативный элемент. В Примере 21 представлен еще один пример способа, который можно применять для идентификации и анализа лимфопролиферативных элементов. Такой анализ может включать, например, измерение относительной лимфопролиферативной активности таких лимфопролиферативных элементов, например, путем анализа величины обогащения, обеспечиваемого генетически модифицированными лимфоцитами, экспрессирующими такие лимфопролиферативные элементы, по сравнению с контрольными лимфоцитами, которые не экспрессируют такие лимфопролиферативные элементы.
[317] В одном варианте осуществления этого аспекта первая последовательность нуклеиновой кислоты дополнительно кодирует внеклеточный домен, и в иллюстративных вариантах осуществления внеклеточный домен содержит димеризующийся мотив. В иллюстративных вариантах осуществления этого аспекта внеклеточный домен содержит лейциновую молнию. В некоторых вариантах осуществления лейциновая молния происходит из полипептида jun, например, c-jun. В некоторых вариантах осуществления полипептид c-jun представляет собой область полипептида c-jun ECD-11.
[318] В вариантах осуществления любого из этих аспектов и вариантов осуществления, где трансмембранный домен представляет собой трансмембранный белок типа I, трансмембранный домен может быть рецептором фактора роста типа I, рецептором гормона, рецептором Т-клеток или рецептором семейства TNF. В варианте осуществления любого из аспектов и вариантов осуществления, где химерный полипептид содержит внеклеточный домен и где внеклеточный домен содержит димеризующийся мотив, трансмембранный домен может быть рецептором цитокина типа I, рецептором гормона, рецептором Т-клеток или рецептором семейства TNF.
[319] Иллюстративные трансмембранные домены включают любой трансмембранный домен, который использовался в Примере 18. В некоторых вариантах осуществления трансмембранный домен происходит из CD4, CD8RB, CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2C, GHR, ICOS, IFNAR1, IFNGR1, IFNGR2, IL1R1, IL1RAP, IL2RG, IL3RA, IL5RA, IL6ST, IL7RA, IL10RB, IL11RA, IL13RA2, IL17RA, IL17RB, IL17RC, IL17RE, IL18R1, IL18RAP, IL20RA, IL22RA1, IL31RA, LEPR, PRLR и TNFRSF8 или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, если такие мутанты присутствуют в конструкциях, представленных в Примере 18. В некоторых вариантах осуществления трансмембранный домен происходит из CD40, ICOS, FCGR2C, PRLR, IL3RA или IL6ST. В некоторых вариантах осуществления трансмембранный домен представляет собой специфический трансмембранный домен, представленный для этих генов в конструкциях любой одной или нескольких Табл. 12-17, или трансмембранный домен из любой из конструкций в первых 50, 25 или 10 перечисленных конструкциях этих таблиц. В иллюстративных вариантах осуществления трансмембранный домен происходит из CD40 или ICOS, в качестве неограничивающих примеров трансмембранные домены для этих генов, представленные в Табл. 6, или их фрагмент, который сохраняет способность быть трансмембранным, и/или их мутанты, которые, как известно, способствуют конститутивной сигнальной активности в определенных типах клеток.
[320] Иллюстративные трансмембранные домены из этого аспекта показаны как P2 в Табл. 12-17. Для библиотеки 3A трансмембранные домены (P2) из CD40, CD8B, CRLF2, CSF2RA, GCGR2C, ICOS, IFNAR1, IFNGR1, IL10RB, IL18R1, IL18RAP, IL3RA, LEPR и PRLR или их мутантов, которые, как известно, способствуют конститутивной сигнальной активности. в некоторых типах клеток, если такие мутанты присутствуют в конструкциях, представленных в Примере 18, при обнаружении в положении трансмембранного домена (P2) кандидатных элементов химерных полипептидов, описанных в данном документе, способствовали пролиферации PBMC между днем 7 и последним днем, когда данные рассматривают комбинированным образом для всех конструкций с трансмембранным доменом, происходящим из этого гена. В скринингах, представленных в Примерах 17 и 18, клетки трансдуцировали не способными к репликации рекомбинантными ретровирусными частицами, содержащими библиотеку, и затем либо подпитывали PBMC, либо не подпитывали PBMC, как обсуждается в Примерах 17 и 18. Скрининги, в которых клетки подпитывали PBMC, помечены буквой «A» после номера библиотеки, например библиотека 1A и скрининги, в которых клетки не подпитывали PBMC, обозначены буквой «B» после номера библиотеки, например, библиотека 1.1B. Кроме того, скрининги, идентифицированные как библиотеки, содержащие «.1», например, библиотека 1.1A, были выполнены таким же образом, как скрининги соответствующей библиотеки без «.1», например, библиотека 1.1A была повторением скрининга библиотеки 1A. Для библиотеки 3B трансмембранные домены из CD40, ICOS, CSF2RA, IL18R1, IL3RA и TNFRSF14 или их мутантов, которые, как известно, способствуют конститутивной сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в Примере 18, были наиболее способны способствовать пролиферации клеток. Для библиотеки 4B трансмембранные домены из IL3RA, CSFR2RA, IL18R1, CD8B, CD40, ICOS или их мутантов, которые, как известно, стимулируют конститутивную сигнальную активность в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в Примере 18, были наиболее способны стимулировать пролиферации клеток. В иллюстративных вариантах осуществления трансмембранный домен в CLE, представленный в данном документе, представляет собой трансмембранный домен из CD40 и ICOS. Примеры трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали пролиферации клеток для библиотек 3A, 3B, 3,1A, 3,1B, 4B и 4.1B, представлены в таблицах, представленных в Примере 18.
[321] В некоторых вариантах осуществления любого аспекта в данном документе химерный полипептид содержит трансмембранный домен, идентифицированный в любой из конструкций, показанных в Табл. 12-17, кроме мутанта трансмембранного домена V449E CSF2RB.
[322] В некоторых вариантах осуществления внеклеточный и трансмембранный домен представляет собой вирусный белок LMP1 или его мутант и/или фрагмент. LMP1 представляет собой многопролетный трансмембранный белок, который, как известно, активирует передачу клеточных сигналов независимо от лиганда при нацеливании на липидные рафты или при слиянии с CD40 (Kaykas et al. EMBO J. 20: 2641 (2001)). Фрагмент LMP1 обычно достаточно длинный, чтобы охватить цитоплазматическую мембрану и активировать связанный (связанные) внутриклеточный (внутриклеточные) домен (домены). Например, LMP1 может составлять от 15 до 386, от 15 до 200, от 15 до 150, от 15 до 100, от 18 до 50, от 18 до 30, от 20 до 200, от 20 до 150, от 20 до 50, от 20 до 30, от 20 до 100, от 20 до 40 или от 20 до 25 аминокислот. Мутант и/или фрагмент LMP1 при включении в CLE, представленный в данном документе, сохраняет свою способность активировать внутриклеточный домен. Кроме того, внеклеточный домен, когда он присутствует, содержит по меньшей мере 1, но обычно по меньшей мере 4 аминокислоты и обычно связан с другим функциональным полипептидом, таким как домен клиренса, например, eTag.
[323] В других вариантах осуществления CLE, представленных в данном документе, внеклеточный домен содержит димеризующий фрагмент. Для этих вариантов осуществления можно применять множество различных димеризующихся фрагментов, раскрытых в данном документе. В иллюстративных вариантах осуществления димеризующиеся части способны гомодимеризоваться. Не ограничиваясь теорией, димеризующиеся части могут обеспечивать активирующую функцию внутриклеточных доменов, связанных с ними через трансмембранные домены. Такая активация может быть обеспечена, например, при димеризации димеризующейся части, которая может вызывать изменение ориентации внутриклеточных доменов, связанных с ними через трансмембранный домен, или которая может вызывать сближение внутриклеточных доменов. Внеклеточный домен с димеризующейся частью также может выполнять функцию соединения метки распознавания с клеткой, экспрессирующей CLE. В некоторых вариантах осуществления димеризующее средство может располагаться внутриклеточно, а не внеклеточно. В некоторых вариантах осуществления можно использовать более одного или нескольких димеризующихся доменов.
[324] Внеклеточные домены для вариантов осуществления, в которых внеклеточные домены имеют мотив димеризации, являются достаточно длинными для образования димеров, таких как димеры лейциновой молнии. Таким образом, внеклеточные домены, которые содежрат димеризующийся фрагмент, могут содержать от 15 до 100, от 20 до 50, от 30 до 45 или от 35 до 40 аминокислот, в иллюстративных вариантах осуществления это часть c-Jun внеклеточного домена c-Jun, предоставленная в Табл. 6. Внеклеточные домены полипептидов, которые содержат димеризующийся фрагмент, могут не сохранять другие функциональные возможности. Например, в вариантах осуществления лейциновых молний такие лейциновые молнии способны образовывать димеры, поскольку они сохраняют мотив лейцина, расположенный на расстоянии 7 остатков друг от друга вдоль альфа-спирали. Однако фрагменты лейциновой молнии некоторых вариантов осуществления CLE, представленных в данном документе, могут сохранять или не сохранять свою ДНК-связывающую функцию.
[325] Одним из примеров внеклеточного домена этого типа является домен лейциновой молнии из белка Jun, такого как c-Jun. Например, внеклеточный домен может быть вариантом c-Jun, обнаруженным в NM_002228_3 (Табл. 6). Такой внеклеточный домен использовали в конструкциях, обсуждаемых в Примере 18.
[326] Спейсер из 1-4 остатков аланина может быть включен в CLE между внеклеточным доменом, который имеет димеризующий фрагмент, и трансмембранным доменом. Не ограничиваясь теорией, считается, что аланиновый спейсер влияет на передачу сигналов внутриклеточных доменов, связанных с внеклеточной областью лейциновой молнии через трансмембранный домен, путем изменения ориентации внутриклеточных доменов.
[327] Первый и второй внутриклеточные домены CLE, представленные в данном документе, представляют собой внутриклеточные сигнальные домены генов, которые известны по меньшей мере для некоторых типов клеток, способствующие пролиферации, выживанию (антиапоптотические) и/или обеспечивающие костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к гибели клеток. По сути, эти внутриклеточные домены могут быть внутриклеточными доменами лимфопролиферативных элементов и костимулирующими доменами, представленными в данном документе. Известно, что некоторые из внутриклеточных доменов кандидатных химерных полипептидов активируют передачу сигналов с участием JAK1/JAK2 и STAT5. Гены и их внутриклеточные домены, которые находятся в первом внутриклеточном домене, такие же, как и во втором внутриклеточном домене, за исключением того, что если первый и второй внутриклеточные домены идентичны, то по меньшей мере один, а обычно и трансмембранный домен, и внеклеточный домен не происходят из одного и того же гена.
[328] Иллюстративные внутриклеточные домены включают домены из конструкций, перечисленных в Табл. 7-11. Иллюстративные внутриклеточные домены этих генов, которые были эмпирически определены как активные в эксперименте Примера 17, представлены в положениях первого внутриклеточного домена (P3) и второго внутриклеточного домена (P4) таблиц, представленных в Примере 17 и как дополнительно приведено в этом разделе ниже. Иллюстративные внутриклеточные домены, идентифицированные в наиболее эффективных результатах скрининга из Примера 17, включали CD40, CSF2RA, IFNAR1, IL1RAP, IL4R, IL6ST, IL11RA, IL12RB2, IL17RA, IL17RD, IL17RE, IL18R1, IL21R, IL23R, MPL и MyD88. Иллюстративные внутриклеточные домены, идентифицированные в наиболее эффективных результатах скрининга из Примера 18, включали CD40, LEPR, MyD88, IFNAR2, MPL, IL18R1, IL13RA2, IL10RB, IL23R или CSF2RA. В определенных иллюстративных вариантах осуществления первый внутриклеточный домен представляет собой MPL, LEPR, MyD88 или IFNAR2. Для этих определенных иллюстративных вариантов осуществления неограничивающие иллюстративные домены второго внутриклеточного домена (P4) представляют собой те из генов, которые связаны с соответствующим первым внутриклеточным доменом (P3) MPL, LEPR, MyD88, IFNAR2, CD40, CD79B или CD27, представленными в Табл. 12-17, включая в некоторых неограничивающих примерах первый и/или второй внутриклеточные домены для тех генов, которые представлены в этих таблицах. Для этих определенных иллюстративных вариантов осуществления другие неограничивающие иллюстративные вторые внутриклеточные (P4) домены представляют собой те из генов, которые связаны с соответствующим первым внутриклеточным доменом MPL, LEPR, MYD88, IFNAR2, CD40, CD79B или CD27 в таблицах, приведенных в Примере 18, включая в качестве неограничивающих примеров первый и/или второй внутриклеточные домены тех генов, которые представлены в этих таблицах. В некоторых вариантах осуществления химерный лимфопролиферативный элемент может представлять собой любой из полипептидов в Табл. 19-23 из Примеров 17 и 18.
[329] В определенных иллюстративных вариантах осуществления второй внутриклеточный домен происходит из CD3D, CD3G, CD27, CD40, CD79A, CD79B, FCER1G, FCGRA2, ICOS, TNFRSF4 и TNFRSF8 или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, если такие мутанты присутствуют в конструкциях, представленных в Примере 18. В определенных иллюстративных вариантах осуществления второй внутриклеточный домен представляет собой CD40, CD79B, TNFRSF4, TNFRSF9, TNFRSF14, FCGRA2, CD3G или CD27, включая в иллюстративных примерах внутриклеточный домен CD40, CD79B, и CD27. Для этих определенных иллюстративных вариантов осуществления неограничивающие иллюстративные первые внутриклеточные домены (P3) представляют собой те из генов, которые связаны с CD40, CD79B, TNFRSF4, TNFRSF9, TNFRSF14, FCGRA2, CD3G или CD27, включая в иллюстративных примерах внутриклеточный домен CD40, CD79B или CD27 в Табл. 12-17, включая в качестве неограничивающих примеров первый и/или второй внутриклеточные домены тех генов, которые представлены в этих таблицах. Для этих определенных иллюстративных вариантов осуществления другие неограничивающие иллюстративные первые внутриклеточные (P3) домены представляют собой те из генов, которые связаны с CD40, CD79B, TNFRSF4, TNFRSF9, TNFRSF14, FCGRA2, CD3G или CD27, включая в иллюстративных примерах внутриклеточный домен вторых внутриклеточных доменов CD40, CD79B и CD27 в таблицах для этих генов в виде P3, представленного в Примере 18, включая в качестве неограничивающих примеров первый и/или второй внутриклеточные домены тех генов, которые представлены в этих таблицах.
[330] Подробная информация, включая информацию о последовательностях, об иллюстративных внутриклеточных доменах вышеуказанных генов, которые были идентифицированы в Примерах 17 и 18 в конструкциях, которые способствовали выживанию и пролиферации клеток, представленав Табл. 6. Внутриклеточные домены, которые могут быть включены в варианты осуществления CLE, представленные в данном документе, включают мутанты и/или фрагменты внутриклеточных доменов перечисленных генов при условии, что такие мутанты и/или фрагменты сохраняют способность способствовать пролиферации, выживанию (антиапоптотические) и/или обеспечивают костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти. По сути, внутриклеточные домены могут состоять, например, из 10 и 1000, 10 и 750, 10 и 500, 10 и 250, 10 и 100 аминокислот.
[331] В некоторых вариантах осуществления все домены CLE отличаются от рецептора IL-7 или его мутанта и/или его фрагмента, который имеет по меньшей мере 10, 15, 20 или 25 смежных аминокислот рецептора IL-7, или отличается от рецептора IL-15, или его мутанта, и/или его фрагмента, который имеет по меньшей мере 10, 15, 20 или 25 смежных аминокислот рецептора IL-15. В некоторых вариантах осуществления CLE не содержит комбинацию первого внутриклеточного домена и второго внутриклеточного домена CD40 и MyD88.
[332] В иллюстративных вариантах осуществления CLE содержит домен распознавания и/или элиминации. Подробная информация о доменах распознавания и/или элиминации представлена в других разделах данного документа. Любой из доменов распознавания и/или элиминации, представленных в данном документе, может быть частью CLE. Обычно домен распознавания связан с N-концом внеклеточного домена. Не ограничиваясь теорией, в некоторых вариантах осуществления внеклеточный домен включает в себя функцию обеспечения линкера, в иллюстративных вариантах осуществления гибкого линкера, связывающего домен распознавания с клеткой, которая экспрессирует CLE.
[333] В иллюстративных вариантах осуществления, как показано на Фиг. 30 и Фиг. 32, CLE, представленный в данном документе, экспрессируется совместно с CAR, который может быть сконструирован в соответствии с любым из вариантов осуществления CAR, представленных в данном документе, или иным образом известным в данной области техники.
[334] Некоторые варианты осуществления, представленные в данном документе, представляют собой выделенные золированные полинуклеотиды и последовательности нуклеиновых кислот, кодирующие любые из CLE, представленных в данном документе, как проиллюстрировано на Фиг. 30-33. Такие выделенные полинуклеотиды могут содержать любые элементы, известные в данной области техники, для обеспечения экспрессии транскрипта, например транскрипта, кодирующего CLE. Например, выделенный полинуклеотид может содержать промоторный элемент, который активен в В-клетках, Т-клетках и/или NK-клетках. Такие промоторы, которые подходят для этих вариантов осуществления, известны в данной области техники, некоторые из которых указаны в других разделах настоящего изобретения. Специалисту в данной области техники будет понятно, как описано более подробно в Примерах 17 и 18, например, как сконструировать выделенные полинуклеотиды и векторы, содержащие их, для экспрессии любого из вариантов осуществления CLE, представленных в данном документе. Например, в некоторых вариантах осуществления последовательность Козак представлена в пределах 10 нуклеотидов перед стартовым сайтом ATG, кодирующим аминоконцевую кислоту CLE или CAR, расположенную перед CLE в той же транскрипционной единице. Соответственно, в вариантах осуществления полинуклеотидов, содержащих нуклеиновую кислоту, кодирующую CLE, представленный в данном документе, полинуклеотид может дополнительно содержать одну или несколько из последовательности Козак, элемента WPRE и множественной стоп-последовательности, например, двойной стоп-последовательности или тройной стоп-последовательности.
[335] Кроме того, полинуклеотиды, которые содержат последовательность нуклеиновой кислоты, кодирующую CLE, представленную в данном документе, также обычно содержат сигнальную последовательность для направления экспрессии на цитоплазматическую мембрану. Иллюстративные сигнальные последовательности представлены в данном документе в других разделах. В транскрипте могут быть предусмотрены элементы, так что и CAR, и CLE экспрессируеются из одного и того же транскрипта. Такая конструкция выгодна тем, что требует меньше нуклеиновых кислот, чем если бы эти элементы были экспрессированы из разных транскриптов, что является важной особенностью, позволяющей таким конструкциям присутствовать в векторах, таких как ретровирусные геномы, используемых для трансфекции или трансдукции В-клеток, Т-клеток и/или, например, NK-клеток.
[336] Многочисленные химерные полипептидные кандидаты были сконструированы и идентифицированы как лимфопролиферативные элементы в Примерах 17 и 18 в данном документе. Для библиотеки 1A, которая включала конструкции, кодирующие химерные полипептиды и CAR, было идентифицировано 172 наиболее эффективных химерных полипептида (см. Табл. 7), которые способствовали пролиферации PBMC между днем 7 и последним днем при культивировании в отсутствие IL-2. Для библиотеки 2В, которая включала конструкции, кодирующие химерные полипептиды, но не включала CAR, было идентифицировано 167 наиболее эффективных химерных полипептида (см. Табл. 8), которые способствовали пролиферации PBMC между днем 7 и последним днем при культивировании в отсутствие IL-2. Определенные иллюстративные CLE, а также полинуклеотиды и последовательности нуклеиновых кислот, кодирующие их, и способы, которые включают любой из них, включают внутриклеточные домены из генов, имеющих совпадающие домены (например, трансмембранный ген и первый внутриклеточный ген и, возможно, второй внутриклеточный ген) в конструкциях, представленных в Табл. 7-11, а также в неограничивающих примерах конкретные совпадающие домены, представленные в этих таблицах, некоторые из которых изложены в разделе «Иллюстративные варианты осуществления» в данном документе. В иллюстративных вариантах осуществления внутриклеточные домены из CLE, имеющие совпадающие домены (например, трансмембранный ген и первый внутриклеточный ген и, необязательно, второй внутриклеточный ген) в конструкциях, которые имели особенно заметные обогащения при первом скрининге и повторном скрининге с теми же доменами P1-P2, P3 и P4, например, библиотеки 1A и 1.1A, можно использовать, как показано в Табл. 7-11. Для библиотек 1A и 1.1A конструкции M001-S116-S044, M024-S192-S045, M001-S047-S102, M048-S195-S043, M012-S216-S211 и M030-S170-S194 имели особенно заметные обогащения при обоих скринингах.
[337] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 1А, так и библиотеки 1.1А представлена в Табл. 19, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Как показано в Примере 17, конструкции с внутриклеточными доменами из IL6R, MYD88, CD27, MYD88, TNFRSF18 или IL31RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD8B, IL1RL1, CD8A, TNFRSF4 или MYD88, когда они присутствуют во втором внутриклеточном домене (P4), демонстрировали особенно заметные обогащения в библиотеках 1A и 1.1A (Табл. 19). Конструкции с доменами цитокиновых рецепторов IL6R, CD27, TNFRSF18 или IL31RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов IL1RL1 или TNFRSF4, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметные обогащения в библиотеках 1A и 1.1A (Табл. 19).
[338] Для библиотек 2B и 2.1B конструкции M007-S049-S051, M007-S050-S039, M012-S050-S043, M012-S161-S213, M030-S142-S049, M001-S145-S130, M018-S085-S039, M018-S075-S053, M012-S135-S074 и M007-S214-S077 имели особенно заметные обогащения при обоих скринингах. Для целей повторных скринингов конструкциями с особенно заметными обогащением были те, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2.
[339] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 2В, так и библиотеки 2.1В представлена в Табл. 20, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из CD28, CD40, IL22RA1, IL13RA2, IL17RB, IFNGR2, FCGR2C, IL11RA или TNFRSF14, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD40, CD3G, CD8A, TNFRSF9, CD28, IL10RB, CD79B, FCER1G или GHR, когда они присутствуют во втором внутриклеточном домене (P4), демонстрировали особенно заметные обогащения в библиотеках 2В и 2.1В (Табл. 20). Конструкции с доменами цитокиновых рецепторов CD40, IL22RA1, IL13RA2, IL17RB, IFNGR2, FCGR2C, IL11RA или TNFRSF14, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов TNFRSF9, IL10RB, FCER1G, GHR или CD40, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметные обогащения в библиотеках 2В и 2.1В (Табл. 20). Конструкции с доменами, содержащими мотивы ITAM из FCGR2C, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами, содержащими мотивы ITAM из CD3G, CD79B или FCER1G, когда они присутствуют во втором внутриклеточном домене (P4), демонстрировали особенно заметные обогащения в обеих библиотеках 2B и 2.1B (Табл. 20).
[340] В первоначальном промежуточном анализе для библиотеки 3A, которая включала конструкции, кодирующие химерные полипептиды и CAR, было идентифицировано 126 наиболее эффективных химерных полипептида (см. Табл. 12), которые способствовали пролиферации PBMC между днем 7 и последним днем в трансдуцированных PBMC, стимулированных с помощью нетрансдуцированные PBMC, как указано в Примере 18, при культивировании в отсутствие IL-2. Для первоначального промежуточного анализа библиотеки 3В, которая включала конструкции, кодирующие химерные полипептиды и CAR, было идентифицировано 127 наиболее эффективных химерных полипептида (см. Табл. 13), которые способствовали пролиферации PBMC между днем 7 и последним днем в трансдуцированных PBMC, которые не были стимулированы с помощью нетрансдуцированные PBMC, как указано в Примере 18, при культивировании в отсутствие IL-2. Для библиотеки 4В, которая включала конструкции, кодирующие химерные полипептиды, но не включала CAR, было идентифицировано 154 наиболее эффективных химерных полипептида (см. Табл. 16), которые способствовали пролиферации PBMC между днем 7 и последним днем в трансдуцированных PBMC, которые не были стимулированы с помощью нетрансдуцированные PBMC, как указано в Примере 18, при культивировании в отсутствие IL-2.
[341] После дополнительного декодирования, которое обеспечивало глубокое декодирование, в библиотеках 3A и 3B, которые включали конструкции, кодирующие химерные полипептиды и CAR и трансдуцированные PBMC, которые были дополнены (библиотека 3A) или не дополнены (библиотека 3B) свежими нетрансдуцированными PBMC, 134 наиболее эффективных кандидата идентифицировали для библиотеки 3A в день 21, 124 наиболее эффективных кандидата идентифицировали для библиотеки 3A в день 35 и 131 наиболее эффективный кандидат идентифицировали для библиотеки 3B в день 21 (см. Табл. 12 и 13 соответственно), которые способствовали пролиферации PBMC между днем 7 и и последним днем культивирования в отсутствие IL-2 (т.е. IL-2 не добавляли в культуральную среду во время культивирования после начальной трансдукции), IL-7 или любого другого экзогенного цитокина.
[342] Определенные иллюстративные CLE, а также полинуклеотиды и последовательности нуклеиновых кислот, кодирующие их, и способы, которые включают любой из них, включают внутриклеточные домены из генов, имеющих совпадающие домены (например, трансмембранный ген и первый внутриклеточный ген и, возможно, второй внутриклеточный ген) в конструкциях, представленных в Табл. 12-17, или их мутантах, которые сохраняют сигнальную активность, а также в неограничивающих примерах конкретные совпадающие домены, представленные в этих таблицах, некоторые из которых изложены в разделе «Иллюстративные варианты осуществления» в данном документе. Внутриклеточные домены, которые идентифицированы в данных, представленных в Примере 17 и Примере 18, либо из положения первого внутриклеточного домена, либо из второго домена, рассматриваются в иллюстративных вариантах осуществления CLE, взаимозаменяемо как первый или второй внутриклеточный домен. В иллюстративных вариантах осуществления можно использовать внутриклеточные домены из генов, имеющие совпадающие домены (например, трансмембранный ген и первый внутриклеточный ген и, необязательно, второй внутриклеточный ген) в конструкциях, которые имели особенно заметные обогащения при первом скрининге и повторном скрининге с теми же доменами Р1, P2, P3 и P4, например, библиотеки 3A и 3.1A. Для библиотек 3A и 3.1A конструкции E008/E013-T041-S186-S050, E006/E011-T077-S186-S211, E007/E012-T021-S186-S051, E009/E014-T041-S186-S053, E007/E012-T073-S186-S053, E006/E011-T017-S186-S051, E006/E011-T031-S186-S211, E006/E011-T011-S186-S050, E006/E011-T011-S186-S047, E007/E012-T001-S186-S050, E006/E011-T041-S186-S051, E008/E013-T028-S186-S076, E009/E014-T029-S199-S053, E009/E014-T062-S186-S216, E007/E012-T006-S058-S051, E009/E014-T076-S186-S211 и E007/E012-T001-S186-S047 были особенно заметны обогащения в обоих скринингах, где части P1, разделенные косой чертой, в данном документе включали разные метки для библиотек 3A и 3.1A, как показано в Табл. 6, 12 и 14. Для целей повторных скринингов конструкциями с особенно заметными обогащением были те, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2.
[343] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 3A, так и библиотеки 3.1A представлена в Табл. 21, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из MPL, OSMR или CSF2RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD40, TNFRSF4, CD79B, CD27, FCGR2A или TNFRSF18, когда они присутствуют во втором внутриклеточном домене (P4), демонстрировали особенно заметные обогащения в библиотеках 3A и 3.1A (Табл. 21). Конструкции с доменами цитокиновых рецепторов MPL, OSMR или CSF2RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов CD40, TNFRSF4, CD27, FCGR2A или TNFRSF18, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в библиотеках 3A и 3.1A (Табл. 21). Конструкции с доменами, содержащими мотивы ITAM из MPL или OSMR, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в библиотеках 3A и 3.1A (Табл. 21).
[344] Для библиотек 3B и 3.1B конструкции E007/E012-T017-S186-S051, E007/E012-T073-S186-S053, E008/E013-T028-S186-S047, E006/E011-T011-S186-S047, E007/E012-T082-S176-S214, E006/E011-T046-S186-S052, E008/E013-T029-S186-S052, E009/E014-T011-S186-S053, E008/E013-T032-S186-S039, E007/E012-T034-S186-S051, E007/E012-T041-S192-S213, E006/E011-T014-S069-S213, E006/E011-T022-S186-S053, E006/E011-T023-S115-S075, E006/E011-T029-S106-S213, E006/E011-T032-S155-S080, E006/E011-T041-S186-S216, E006/E011-T057-S135-S080, E006/E011-T072-S191-X002, E006/E011-T077-S186-S216, E006/E011-T080-S141-S080, E007/E012-T001-X001-S214, E007/E012-T007-S059-S211, E007/E012-T016-S186-S052, E007/E012-T031-S186-S053, E007/E012-T044-S102-S052, E007/E012-T044-S142-X002, E007/E012-T055-S069-S053, E007/E012-T063-S176-S216, E007/E012-T065-S157-S075, E008/E013-T008-S085-X002, E008/E013-T011-S085-S048, E008/E013-T021-S109-X002, E008/E013-T021-S168-S211, E008/E013-T032-S064-S214, E008/E013-T037-S170-S215, E008/E013-T038-S176-S048, E008/E013-T039-S137-S216, E008/E013-T041-S141-S053, E008/E013-T045-S177-S048, E008/E013-T048-S109-S074, E008/E013-T073-S199-S075, E009/E014-T001-S157-S074, E009/E014-T005-S196-S049, E009/E014-T011-S130-X002, E009/E014-T013-S155-X002, E009/E014-T017-S186-S076, E009/E014-T021-S142-S080, E009/E014-T023-S082-S076, E009/E014-T038-S196-S037, E009/E014-T055-S186-S052, E009/E014-T060-S175-S053, E009/E014-T070-S085-S212, E008/E013-T026-S054-S213, E009/E014-T007-S120-S053, E007/E012-T045-S186-S211, E008/E013-T073-S186-X002, E008/E013-T074-S186-X002, E007/E012-T055-S186-S053, E008/E013-T036-S186-S053, E007/E012-T017-S058-S053, E008/E013-T030-S189-S080, E006/E011-T029-S081-S047, E009/E014-T044-S194-S050, E006/E011-T028-S121-X002, E008/E013-T028-S186-S053, E009/E014-T078-S142-S213, E009/E014-T041-S186-S051, E008/E013-T006-S186-S050, E006/E011-T028-S186-S075, E006/E011-T040-S120-S038, E007/E012-T044-S115-S211, E009/E014-T039-S176-S075, E007/E012-T028-S186-S050, E008/E013-T031-S202-S050, E007/E012-T072-S192-S053, E006/E011-T065-X001-S051, E007/E012-T030-S062-X002, E007/E012-T073-S186-X002, E009/E014-T056-S186-S053, E008/E013-T046-S137-X002, E006/E011-T016-S136-S076, E007/E012-T032-S142-S037, E007/E012-T065-S120-S215, E009/E014-T077-S186-S047, E009/E014-T001-S126-S051, E006/E011-T030-S121-S039, E008/E013-T006-S176-S213, E009/E014-T032-S130-S215, E008/E013-T041-S186-S039, E009/E014-T021-S186-S047, E008/E013-T026-S137-S214, E007/E012-T029-S116-S075, E008/E013-T026-S106-S049 и E007/E012-T032-S168-S075 имели особенно заметные обогащения при обоих скринингах, где части P1, разделенные косой чертой, в данном случае включали разные метки для библиотек 3B и 3.1B, как продемонстрировано в Табл. 6, 13 и 15. Для целей повторных скринингов конструкциями с особенно заметными обогащением были те, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2.
[345] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 3В, так и библиотеки 3.1В представлена в Табл. 22, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из MPL, LEPR, MYD88, EPOR, IL5RA, IL2RG, IL18RAP, IL11RA, IL13RA1, CSF2RA, IL1RL1, IL13RA2, IL20RB, IFNGR2, IL3RA, IL27RA, CSF3R, IL31RA, IL12RB1, OSM, IL7R, IFNAR1, PRLR, IL9R, IL6R или IL15RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD40, CD79B, CD27, TNFRSF14, CD79A, CD3G, TNFRSF9, FCGR2C, ICOS, TNFRSF18 TNFRSF4, CD28, FCER1G, FCGR2A, CD3D, TNFRSF8 или CD3E, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 3B и 3.1B (Табл. 22). Конструкции с доменами из цитокиновых рецепторовов MPL, LEPR, EPOR, IL5RA, IL2RG, IL18RAP, IL11RA, IL13RA1, CSF2RA, IL1RL1, IL13RA2, IL20RB, IFNGR2, IL3RA, IL27RA, CSF3R, IL31RA, IL12RB2, OSMR, IL31RA, IL12RB1, OSM, IL7R, IFNAR1, PRLR, IL9R, IL6R или IL15RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов CD40, CD27, TNFRSF14, TNFRSF9, FCGR2C, TNFRSF18, TNFRSF4, FCER1G, FCGRA или TNFRSF8, когда он присутствует во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 3B и 3.1B (Табл. 22). Конструкции с доменами, содержащими мотивы ITAM из CD79B, CD79A, CD3G, FCGR2C, FCER1G, FCGR2A, CD3D или CD3E, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 3B и 3.1B (Табл. 22).
[346] Для библиотек 4B и 4.1B конструкции E007/E012-T078-S154-S047, E008/E013-T062-S186-X002, E008/E013-T055-S186-S050, E009/E014-T057-S186-S050, E007/E012-T077-S054-S053, E007/E012-T034-S135-S211, E009/E014-T071-X001-S216, E009/E014-T011-S141-S037, E008/E013-T041-S186-S037, E006/E011-T038-S106-S039, E006/E011-T011-S121-X002, E007/E012-T007-S085-S215, E006/E011-T041-S186-S050, E007/E012-T008-S064-S051, E006/E011-T041-S186-S047, E008/E013-T045-S186-S051, E008/E013-T003-S104-S216, E006/E011-T019-S186-S053, E008/E013-T071-S064-S080, E006/E011-T021-S054-X002, E006/E011-T003-S135-X002, E009/E014-T020-S199-S213, E008/E013-T027-S121-S211, E009/E014-T032-S195-X002, E009/E014-T050-S171-X002, E008/E013-T069-S083-X002, E008/E013-T026-S116-S038, E009/E014-T072-S195-X002, E007/E012-T047-S058-S211, E008/E013-T046-S142-S080, E006/E011-T065-S186-S076, E006/E011-T062-S069-X002, E007/E012-T047-S098-X002, E009/E014-T069-S099-S048, E008/E013-T039-S141-S050, E006/E011-T052-S130-S052, E008/E013-T041-S186-X002, E007/E012-T019-S120-X002, E008/E013-T045-S186-S053, E006/E011-T003-S170-S039, E007/E012-T047-S058-S051, E007/E012-T069-S109-X002, E009/E014-T019-S130-S075 и E006/E011-T047-S054-S053 имели особенно заметные обогащения при обоих скринингах, где части P1, разделенные косой чертой, в данном документе включали разные метки для библиотек 4B и 4.1B, как показано в Табл. 6, 16 и 17. Для целей повторных скринингов конструкциями с особенно заметными обогащениями были конструкции, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2. Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением при скринингах как библиотеки 4B, так и библиотеки 4.1B представлена в Табл. 23, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеют ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из IL18R1, MPL, CRLF2, IL11RA, IL13RA1, IL2RG, IL7R, IFNGR2, CSF3R, IL2RA, OSMR, MYD88, IL31RA, IFNAR2, IL6R, CSF2RA, IL13RA2, EPOR, IL1R1 или IL10RA, когда они присутствуют, в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD27, CD40, CD79B, TNFRSF4, TNFRSF18, CD3D, CD3G, CD27, ICOS, TNFRSF9, CD3E, FCGR2A, CD28, CD79A или FCGR2C, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в библиотеках 4B и 4.1B (Табл. 23). Конструкции с доменами цитокиновых рецепторов IL18R1, MPL, CRLF2, IL11RA, IL13RA1, IL2RG, IL7R, IFNGR2, CSF3R, IL2RA, OSMR, IL31RA, IFNAR2, IL6R, CSF2RA, IL13RA2, EPOR, IL1R1, или IL10RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов CD27, CD40, TNFRSF4, TNFRSF18, TNFRSF9, FCGR2A или FCGR2C, когда присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 4B и 4.1B (Табл. 23). Конструкции с доменами, содержащими мотивы ITAM из CD79B, CD3D, CD3G, CD3E, FCGR2A, CD79A или FCGR2C, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 4B и 4.1В (Табл. 23).
[347] В некоторых иллюстративных вариантах осуществления CLE содержит внутриклеточный домен цитокинового рецептора в любой из конструкций Табл. 19-23. В некоторых иллюстративных вариантах осуществления CLE содержит внутриклеточный домен из любой из конструкций Табл. 19-23 только с одним внутриклеточным доменом (другой P3 или P4 представлял собой линкер или стоп-кодон).
[348] Информация о различных иллюстративных доменах CLE, представленных в данном документе, находится в Табл. 6. Например, первый CLE, указанный в Табл. 7, представляет собой M008-S212-S075. Для этого CLE внеклеточный и трансмембранный домен (P1-2) представляет собой M008, первый внутриклеточный домен (P3) представляет собой S212, а второй внутриклеточный домен (P4) представляет собой S075. Подробная информация об идентичности этих доменов или модулей при рассмотрении нуклеиновых кислот, кодирующих их, например, M008, находится в Табл. 6. В Табл. 6 показано, что M008 представляет собой ECDTM-8 и, более конкретно, что мутант рецептора интерлейкина 7 альфа (IL7RA) со вставкой PPCL и что конструкция содержит eTag.
[349] Для библиотеки 1A внутриклеточные домены из CD3D, CD3E, CD8A, CD27, CD40, CD79B, IFNAR1, IL2RA, IL3RA, IL13RA2, TNFRSF8 и TNFRSF9 или их мутантов, которые, как известно, обладают сигнальной активностью, при обнаружении в положении первого внутриклеточного домена (P3) кандидатных химерных полипептидов способствовали пролиферации PBMC между днем 7 и последним днем, когда данные рассматривали комбинированным образом для всех конструкций с первыми внутриклеточными доменами (P3), происходящими из этого гена. Соответственно, иллюстративные варианты осуществления CLE, представленные в данном документе, содержат внутриклеточные домены из CD3D, CD3E, CD8A, CD27, CD40, CD79B, IFNAR1, IL2RA, IL3RA, IL13RA2, TNFRSF8 и TNFRSF9, включая их мутанты, которые сохраняют сигнальную активность, как и второй внутриклеточной домен, или в иллюстративных вариантах осуществления первый внутриклеточный домен.
[350] Для библиотеки 1A внутриклеточные домены из CD3D, CD3G, CD8A, CD8B, CD27, CD40, CD79B, CRLF2, FCGR2C, ICOS, IL2RA, IL13RA1, IL13RA2, IL15RA, TNFRSF9 и TNFRSF18 или их мутанты, которые, как известно, обладают сигнальной активностью, при обнаружении в положении второго внутриклеточного домена (P3) кандидатных химерных полипептидов способствовали пролиферации PBMC между днем 7 и последним днем, когда данные рассматривали комбинированным образом для всех конструкций с вторыми внутриклеточными доменами (P3), происходящими из этого гена. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали клеточной пролиферации, представлены в таблицах в Примере 17. Соответственно, иллюстративные варианты осуществления CLE, представленные в данном документе, содержат внутриклеточные домены из CD3D, CD3G, CD8A, CD8B, CD27, CD40, CD79B, CRLF2, FCGR2C, ICOS, IL2RA, IL13RA1, IL13RA2, IL15RA, TNFRSF9 и TNFRSF18, включая их мутанты, которые сохраняют сигнальную активность, как и первый внутриклеточной домен, или в иллюстративных вариантах осуществления второй внутриклеточный домен.
[351] Для библиотеки 3А первые внутриклеточные (P3) домены из CSF2RA, IFNAR1, IL1RAP, IL4R, IL6ST, IL11RA, IL12RB2, IL17RA, IL17RD, IL17RE, IL18R1, IL21R, IL23R, MPL и MyD88, или их мутанты, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в Примере 18, при обнаружении в первом внутриклеточном домене (P3) кандидатных элементов химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и последним днем или между днем 7 и днем 21, когда данные рассматриваются комбинированным образом для всех конструкций с первым внутриклеточным доменом, происходящим из этого гена. Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в последний день, указанный в таблице, плюс один, и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 3А, при объединении результатов для всех конструкций для гена. Для библиотеки 3B первые внутриклеточные домены из CSF2RB, IL4R и MPL или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в Примере 18, были лучшими показателями при анализе подобным образом. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали пролиферации клеток для библиотек 3A, 3B, 3.1A и 3.1B, представлены в Табл. 12-15.
[352] Для библиотеки 3А вторые внутриклеточные (P4) домены из CD3D, CD3G, CD27, CD40, CD79A, CD79B, FCER1G, FCGRA2, ICOS, TNFRSF4 и TNFRSF8 или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, при обнаружении во втором внутриклеточном домене (P4) кандидатных элементов химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и днем 21 или между днем 7 и последним днем, указанным в Примере 18, когда данные рассматриваются комбинированным образом для всех конструкций со вторым внутриклеточным доменом, происходящим из этого гена. Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в последний день, указанный в таблице, плюс один, и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 3А, при объединении результатов для всех конструкций для гена. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали пролиферации клеток для библиотек 3A и 3B, представлены в Табл. 12-17.
[353] После первоначального промежуточного анализа декодирования для библиотеки 3A первые внутриклеточные (P3) домены из IL17RD, IL17RE, IL1RAP, IL23R и MPL или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда обнаружены в первом внутриклеточном домене (P3) кандидатных элементов химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и днем 21, когда данные рассматриваются комбинированным образом для всех конструкций с первым внутриклеточным доменом, полученным из этого гена. Для библиотеки 3B первые внутриклеточные домены из IL21R, MPL и OSMR или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, были лучшими показателями при анализе подобным образом. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали пролиферации клеток для библиотек 3A и 3B, представлены в таблицах в Примере 18. Соответственно, иллюстративные варианты осуществления CLE, представленные в данном документе, содержат внутриклеточные домены из IL17RD, IL17RE, IL1RAP, IL23R и MPL F9, включая их мутанты, которые сохраняют сигнальную активность, как и второй внутриклеточной домен, или в иллюстративных вариантах осуществления первый внутриклеточный домен.
[354] После первоначального анализа декодирования для библиотеки 3A вторые внутриклеточные (P4) домены из CD27, CD3G, CD40 и CE79B или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда обнаружены во втором внутриклеточном домене (P4) кандидатных элементов химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и последним днем, указанной в таблице, когда данные рассматриваются комбинированным образом для всех конструкций с вторым внутриклеточным доменом, полученным из этого гена. Для библиотеки 3B вторые внутриклеточные домены из CD40 или его мутанта, которые, как известно, способствуют сигнальной активности в определенных типах клеток, были лучшими показателями при анализе подобным образом. Соответственно, иллюстративные варианты осуществления CLE, представленные в данном документе, содержат внутриклеточные домены из CD27, CD3G, CD40 и CE79B, включая их мутанты, которые сохраняют сигнальную активность, как и первый внутриклеточной домен, или в иллюстративных вариантах осуществления второй внутриклеточный домен.
[355] Как показано в Табл. 12-17, первые внутриклеточные (P3) домены из MPL, LEPR, MYD88, IFNAR2 или в некоторых случаях их мутантов, которые сохраняют сигнальную активность, при обнаружении в первом внутриклеточном домене (P3) кандидатных химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и концом эксперимента при рассмотрении первых внутриклеточных доменов, которые наиболее часто встречаются в наиболее эффективных кандидатных конструкциях. Примеры первых внутриклеточных доменов или их частей и/или их мутантов, которые присутствовали в конструкциях, которые способствовали пролиферации клеток для библиотек 3A, 3B, 3.1A, 3,1B, 4B и 4.1B, представлены в таблицах в Примере 18. Соответственно, иллюстративные варианты осуществления CLE, представленные в данном документе, содержат внутриклеточные домены из MPL, LEPR, MYD88, IFNAR2, включая их мутанты, которые сохраняют сигнальную активность, как и второй внутриклеточной домен, или в иллюстративных вариантах осуществления первый внутриклеточный домен.
[356] Как показано в Табл. 12-17, вторые внутриклеточные (P4) домены из CD40, CD79B, CD27 или в некоторых случаях их мутантов, которые сохраняют сигнальную активность, при обнаружении во втором внутриклеточном домене (P4) кандидатных химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и последним днем, указанным в таблице, при рассмотрении первых внутриклеточных доменов, которые наиболее часто встречаются в наиболее эффективных кандидатных конструкциях. Примеры первых внутриклеточных доменов или их частей и/или их мутантов, которые присутствовали в конструкциях, которые способствовали пролиферации клеток для библиотек 3A, 3B, 3.1A, 3,1B, 4B и 4.1B, представлены в таблицах в Примере 18. Соответственно, иллюстративные варианты осуществления CLE, представленные в данном документе, содержат внутриклеточные домены из CD40, CD79B, CD27, включая их мутанты, которые сохраняют сигнальную активность, как и первый внутриклеточной домен, или в иллюстративных вариантах осуществления второй внутриклеточный домен.
[357] В заслуживающих внимания вариантах осуществления любого из аспектов и вариантов выделенного полинуклеотида или вектора, представленных в данном документе, которые содержат первую последовательность нуклеиновой кислоты, которая кодирует химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток (т.е. CLE ), и вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты могут быть разделенными последовательностью с рибосомным проскоком. В некоторых вариантах осуществления последовательность с рибосомным проскоком представляет собой F2A, E2A, P2A или T2A.
[358] Как раскрыто в данном документе, лимфопролиферативные элементы, как проиллюстрировано в данном документе с помощью CLE, в некоторых иллюстративных вариантах осуществления могут содержать мотив димеризации, чтобы способствовать усилению и/или регуляции его активности, например, чтобы воздействовать на сигналы в клетке, такие как сигналы, которые влияют на активность белка или экспрессию гена. Такой димеризующийся мотив обычно представляет собой часть или весь внеклеточный домен. В некоторых вариантах осуществления димеризующийся фрагмент может быть присоединен к последовательности распознавания и клиренса во внеклеточном домене CLE, описанном в данном документе. Фактически, в некоторых вариантах осуществления лимфопролиферативный элемент может содержать весь лимфопролиферативный элемент из одного белка, за исключением того, что внеклеточный домен содержит димеризующий фрагмент.
[359] В некоторых вариантах осуществления лимфопролиферативных элементов и CLE, которые содержат димеризирующие средства, и последовательности полинуклеотидов и нуклеиновых кислот, кодирующие их, димеризующийся мотив может содержать аминокислотную последовательность из трансмембранных гомодимерных полипептидов, которые в природе существуют в виде гомодимеров. Например, димеризующийся мотив может представлять собой полипептид лейциновой молнии, например, полипептид Jun, как проиллюстрировано в Примере 18 в данном документе. В некоторых вариантах осуществления эти трансмембранные гомодимерные полипептиды могут включать антиген ранней активации CD69 (CD69), белок рецептора трансферрина 1 (CD71), антиген дифференцировки В-клеток (CD72), тактильный белок Т-клеточной поверхности (CD96), эндоглин (Cd105), представитель 1 подсемейства лектин-подобных рецепторов клеток-киллеров (Cd161), лиганд гликопротеина 1 P-селектина (Cd162), глутамиламинопептидазу (Cd249), представитель суперсемейства рецепторов фактора некроза опухоли 16 (CD271), кадгерин-1 (E-кадгерин) (Cd324) или их активные фрагменты. В некоторых вариантах осуществления димеризующийся мотив может содержать аминокислотную последовательность из трансмембранных белков, которые димеризуются при связывании лиганда (также обозначаемого в данном документе димеризатором или димеризующим средством). В некоторых вариантах осущетсвления димеризующийся мотив и димеризатор могут включать (в случае, когда димеризатор указан в скобках после пары связывания димеризатора): FKBP и FKBP (рапамицин); GyrB и GyrB (кумермицин); DHFR и DHFR (метотрексат); или DmrB и DmrB (AP20187). Как отмечалось выше, рапамицин может выступать в качестве димеризатора. В качестве альтернативы можно использовать производное или аналог рапамицина (см., например, WO 96/41865; WO 99/36553; WO 01/14387; и Ye et al (1999) Science 283: 88-91). Например, аналоги, гомологи, производные и другие соединения, структурно родственные рапамицину («рапалоги»), включают, среди прочего, варианты рапамицина, имеющие одну или несколько из следующих модификаций по отношению к рапамицину: деметилирование, отщепление или замена метокси в C7, C42 и/или C29; отщепление, дериватизацию или замену гидрокси в C13, C43 и/или C28; восстановление, отщепление или дериватизацию кетона в C14, C24 и/или C30; замену 6-членного пипеколатного кольца на 5-членное пролильное кольцо; и альтернативное замещение в циклогексильном кольце или замену циклогексильного кольца замещенным циклопентильным кольцом. Дополнительная информация представлена, например, в патентах США №№ 5525610; 5310903, 5362718; и 5527907. Описана селективная эпимеризация гидроксильной группы C-28 (см., например, WO 01/14387). Дополнительные синтетические димеризующие средства, подходящие для использования в качестве альтернативы рапамицину, включают средства, описанные в публикации патента США № 2012/0130076. Как отмечалось выше, кумермицин может служить димеризующим средством. В качестве альтернативы можно использовать аналог кумермицина (см., например, Farrar et al. (1996) Nature 383:178-181; и патент США № 6916846). Как отмечалось выше, в некоторых случаях димеризующим средством является метотрексат, например, нецитотоксический гомобифункциональный димер метотрексата (см., например, патент США № 8 236 925).
[360] В некоторых вариантах осуществления, при наличии в цитоплазматической мембране эукариотической клетки, лимфопролиферативный элемен, в иллюстративных вариантах осуществления CLE, включая димеризующий мотив, может быть активным в отсутствие димеризующего средства. Например, лимфопролиферативные элементы, которые содержат мотив димеризации, содержащий лейциновую молиню, или которые включают мотив димеризации трансмембранных гомодимерных полипептидов, включая CD69, CD71, CD72, CD96, Cd105, Cd161, Cd162, Cd249, CD271, Cd324, их активные мутанты и/или их активные фрагменты могут быть активными в отсутствие димеризующего средства. В некоторых вариантах осуществления, при наличии в цитоплазматической мембране эукариотической клетки, лимфопролиферативный элемент, включая димеризующий мотив, может быть активным в присутствии димеризующего средства. Например, лимфопролиферативные элементы, включая мотив димеризации из FKBP, GyrB, DHFR или DmrB, могут быть активными в присутствии соответствующих димеризующих средств или их аналогов, например рапамицина, кумермицина, метотрексата и AP20187 соответственно.
[361] В вариантах осуществления способа, включающих лимфопролиферативные элементы, например, CLE, которые включают димеризатор для димеризации полипептида, содержащего димеризующийся мотив, димеризатор можно вводить хозяину (субъекту) с использованием любых удобных средств, способных приводить к желаемому эффекту. Таким образом, димеризатор можно включать в различные составы для введения. Более конкретно, димеризатор может быть включен в фармацевтические композиции путем комбинации с подходящими фармацевтически приемлемыми носителями или разбавителями и может быть включен в препараты в твердых, полутвердых, жидких или газообразных форм, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, свечи, инъекции, ингаляторы и аэрозоли.
[362] Специалисты в данном области техники легко поймут, что уровни доз могут варьироваться в зависимости от конкретного димеризатора, тяжести симптомов и восприимчивости субъекта к побочным эффектам. Предпочтительные дозировки для данного соединения легко могут быть определены специалистами в данной области техники различными способами.
[363] Димеризатор вводят индивиду с использованием любого доступного метода и пути, подходящего для доставки лекарственного средства, включая способы in vivo и ex vivo, а также системные и локальные пути введения.
[364] В любых аспектах или вариантах осуществления, где внеклеточный домен CLE содержит димеризующийся мотив, димеризующийся мотив может быть выбран из группы, состоящей из полипептида, содержащего мотив лейциновой застежки, CD69, CD71, CD72, CD96, Cd105, Cd161, Cd162, Cd249, CD271 и Cd324, а также их мутанты и/или активные фрагменты, которые сохраняют способность к димеризации. В любом из аспектов и вариантов осуществления в данном документе, где внеклеточный домен CLE содержит димеризующий мотив, димеризующий мотив может потребовать димеризующего средства, и димеризующий мотив и связанный димеризующее средство могут быть выбраны из группы, состоящей из: FKBP и рапамицина или их аналогов, GyrB и кумермицина или их аналогов, DHFR и метотрексата или их аналогов, или DmrB и AP20187 или их аналогов, а также мутантов и/или активных фрагментов перечисленных димеризующихся белков, которые сохраняют способность димеризоваться.
[365] В иллюстративных вариантах осуществления любых аспектов или вариантов осуществления в данном документе, где внеклеточный домен CLE содержит мотив димеризации, внеклеточный домен может содержать мотив лейциновой молнии. В некоторых вариантах осуществления лейциновая молния происходит из полипептида jun, например, c-jun. В некоторых вариантах осуществления полипептид c-jun представляет собой область полипептида c-jun ECD-11.
[366] В любом из аспектов и вариантов осуществления, представленных в данном документе, которые включают лимфопролиферативный элемент, лимфопролиферативный элемент может быть полипептидом, содержащим нацеливающуюся на мембрану область, димеризующий (или мультимеризирующий) домен, первый внутриклеточный домен и, необязательно, второй внутриклеточный домен, и, кроме того, необязательно третий внутриклеточный домен и, возможно, четвертый внутриклеточный домен, где по меньшей мере один из первого и необязательного второго, третьего и четвертого внутриклеточных доменов происходит от любого гена с внутриклеточным доменом, идентифицированным в Табл. 7-17, или выбран из любого из первого или второго внутриклеточных доменов, идентифицированных в Табл. 7-17, и где указанный внутренне димеризующий и/или мультимеризующий лимфопролиферативный элемент способствует пролиферации клеток PBMC и, в иллюстративных вариантах осуществления, B-клеток, T-клеток и/или NK-клеток. Такой полипептид может называться в данном документе внутренне димеризирующимся и/или мультимеризирующимся лимфопролиферативным элементом. В определенных вариантах осуществления линкеры могут быть добавлены между любыми доменами. В определенных вариантах осуществления первый и второй внутриклеточные домены отличны от MyD88 и CD40. В некоторых вариантах осуществления внутриклеточный домен представляет собой MPL или его внутриклеточный фрагмент, который сохраняет способность стимулировать пролиферацию клеток PBMC. В некоторых вариантах осуществления внутриклеточный домен представляет собой отличный от MPL или его внутриклеточного фрагмента, который сохраняет способность стимулировать пролиферацию клеток PBMC. В некоторых вариантах осуществления внутриклеточный домен представляет собой отличный от MyD88 или его внутриклеточного фрагмента, который сохраняет способность стимулировать пролиферацию клеток PBMC.
[367] Димеризующийся домен таких внутренне димеризующихся и/или мультимеризующихся полипептидных лимфопролиферативных элементов в иллюстративных вариантах осуществления расположен между областью нацеливания на мембрану и первым внутриклеточным доменом. В некоторых вариантах осуществления димеризующийся (или мультимеризующийся) домен содержит сайты связывания мультимеризующихся или димеризующихся лигандов, такие как, например, область FKBP, например, FKBP12. В некоторых вариантах осуществления полипептид может содержать внеклеточный домен, такой как любой из внеклеточных доменов, представленных в данном документе, например, в Табл. 7-11 Примера 17 или в Табл. 12-17 Примера 18, с доменом распознавания и клиренса или без него. В определенных вариантах осуществления область нацеливания на мембрану выбрана из группы, состоящей из области миристоилирования, области пальмитоилирования, области пренилирования и трансмембранных последовательностей рецепторов. В определенных вариантах осуществления область нацеливания на мембрану представляет собой область миристоилирования. Внутренне димеризующийся и/или мультимеризующийся лимфопролиферативный элемент обычно привязан к цитоплазматической мембране через область нацеливания на мембрану, например, привязан к мембране с помощью N-концевого миристата. В иллюстративных вариантах осуществления область FKBP связывает FK506.
[368] Внутренне димеризующиеся и/или мультимеризующиеся лимфопролиферативные элементы в одном варианте осуществления являются неотъемлемой частью системы, в которой используется димерный аналог липидопроницаемого иммунодепрессанта, FK506, который теряет свою нормальную биоактивность, приобретая способность сшивать молекулы, генетически слитые с FK506-связывающим белком, FKBP12. Путем слияния одного или нескольких FKBP и последовательности миристоилирования с цитоплазматическим сигнальным доменом целевого рецептора можно стимулировать передачу сигналов димеризатором лекарственно-зависимым, но независимым от лиганда и эктодомена образом. Это обеспечивает системе временный контроль, обратимость с использованием мономерных аналогов лекарственных средств и повышенную специфичность. Высокоая аффинность димеризаторов AP20187/AP1903 третьего поколения к их связывающему домену, FKBP12, позволяет специфически активировать рекомбинантный рецептор in vivo без индукции неспецифических побочных эффектов через эндогенный FKBP12. Также можно использовать варианты FKBP12, имеющие аминокислотные замены и делеции, такие как FKBP12V36, которые связываются с лекарственным средством на основе димеризатора. Кроме того, синтетические лиганды устойчивы к расщеплению протеазами, что делает их более эффективными при активации рецепторов in vivo, чем большинство доставляемых белковых средств.
ЭЛЕМЕНТЫ ПСЕВДОТИПИРОВАНИЯ
[369] Многие из представленных в данном документе способов и композиций включают элементы псевдотипирования. Псевдотипирование некомпетентных к репликации рекомбинантных ретровирусных частиц с помощью гетерологичных гликопротеинов оболочки обычно изменяет тропизм вируса и облегчает трансдукцию клеток-хозяев. Элемент псевдотипирования, используемый в данном документе, может включать «связывающий полипептид», который включает один или несколько полипептидов, обычно гликопротеинов, которые идентифицируют и связывают целевую клетку-хозяина, и один или несколько «гибридных полипептидов», которые опосредуют слияние ретровируса и мембран целевой клетки-хозяина, тем самым позволяя ретровирусному геному проникать в целевую клетку-хозяин. В некоторых вариантах осуществления, представленных в данном документе, элементы псевдотипирования представлены в виде полипептида (полипептидовов)/белка (белков) или в виде последовательностей нуклеиновых кислот, кодирующих полипептид (полипептиды)/белок (белкки).
[370] В некоторых вариантах осуществления элемент псевдотипирования представляет собой белок оболочки эндогенного вируса кошек (RD114), белок амфотропной оболочки онкоретровирусов, белок экотропной оболочки онкоретровирусов, белок оболочки вируса везикулярного стоматита (VSV-G) и/или белки оболочки парамиксовируса кори H и F.
[371] В некоторых вариантах осуществления элементы псевдотипирования включают связывающий полипептид и слитый полипептид, происходящий из различных белков. Например, не способные к репликации рекомбинантные ретровирусные частицы способов и композиций, раскрытых в данном документе, могут быть псевдотипированы гибридным (F) и гемагглютининовым (H) полипептидами вируса кори (MV), в качестве неограничивающих примеров, клиническими штаммами MV дикого типа и штаммами вакцинии, включая штамм Эдмонстона (MV-Edm) или его фрагменты. Не ограничиваясь теорией, предполагается, что как гемагглютинин (H), так и гибридный (F) полипептиды играют роль в проникновении в клетки-хозяева, где белок H связывает MV с рецепторами CD46, SLAM и нектина-4 на целевых клетках и F опосредует слияние мембран ретровирусов и клеток-хозяев. В иллюстративном варианте осуществления, особенно когда целевая клетка представляет собой Т-клетку и/или NK-клетку, связывающий полипептид представляет собой полипептид вируса кори H, а полипептид слияния представляет собой полипептид вируса кори F.
[372] В некоторых исследованиях лентивирусные частицы, псевдотипированные укороченными полипептидами F и H, имели значительное увеличение титров и эффективности трансдукции (Funke et al. 2008. Molecular Therapy. 16(8):1427-1436), (Frecha et al. 2008. Blood. 112(13):4843-4852). Наивысшие титры были получены, когда цитоплазматический хвост F был усечен на 30 остатков (обозначенных как MV (Ed) -FΔ30 (SEQ ID NO: 105)). Для вариантов H оптимальное усечение происходило при удалении 18 или 19 остатков (MV(Ed)-HΔ18 (SEQ ID NO: 106) или MV(Ed)-HΔ19), хотя варианты с усечением 24 остатков с заменой и без нее остатков с удаленными аланином (MV(Ed)-HΔ24 (SEQ ID NO: 235) и MV(Ed)-HΔ24+A) также приводили к оптимальным титрам.
[373] В некоторых вариантах осуществления, включая те, которые направлены на трансдукцию Т-клеток и/или NK-клеток, не способные к репликации рекомбинантные ретровирусные частицы способов и композиций, описанных в данном документе, псевдотипированы мутированными или вариантными версиями слияния вируса кори (F) и гемагглютинина (H). полипептиды, в иллюстративных примерах вариантами с делецией цитоплазматического домена полипептидов F и H вируса кори. В некоторых вариантах осуществления мутированные полипептиды F и H представляют собой полипептиды «усеченного H» или «усеченного F», цитоплазматическая часть которых усечена, т.е. аминокислотные остатки (или кодирующие нуклеиновые кислоты соответствующей молекулы нуклеиновой кислоты, кодирующей белок) были делетированы. «HΔY» и «FΔX» обозначают такие усеченные полипептиды H и F соответственно, где «Y» относится к 1-34 остаткам, которые были делетированы с аминоконцев, а «X» относится к 1-35 остаткам, которые были делетированы с карбоксиконцов цитоплазматических доменов. В другом варианте осуществления «усеченный полипептид F» представляет собой FΔ24 или FΔ30 и/или «усеченный белок H» выбран из группы, состоящей из HΔ14, HΔ15, HΔ16, HΔ17, HΔ18, HΔ19, HΔ20, HΔ21+A, HΔ24 и HΔ24+4A, более предпочтительно HΔ18 или HΔ24. В иллюстративном варианте осуществления усеченный полипептид F представляет собой MV(Ed)-FΔ30, а усеченный полипептид H представляет собой MV(Ed)-HΔ18.
[374] В некоторых вариантах осуществления слитый полипептид включает несколько элементов, экспрессируемых как один полипептид. В некоторых вариантах осуществления связывающий полипептид и слитый полипептид транслируются с одного и того же транскрипта, но с разных сайтов связывания рибосомы; в других вариантах осуществления связывающий полипептид и слитый полипептид разделены сайтом пептида расщепления, который не должен быть связан теорией, расщепляется после трансляции, как это принято в литературе, или последовательностью с рибосомным проскоком. В некоторых вариантах осуществления трансляция связывающего полипептида и слитого полипептида с отдельных сайтов связывания рибосом приводит к большему количеству слитого полипептида по сравнению со связывающим полипептидом. В некоторых вариантах осуществления соотношение слитого полипептида к связывающему полипептиду составляет по меньшей мере 2:1, по меньшей мере 3:1, по меньшей мере 4:1, по меньшей мере 5:1, по меньшей мере 6:1, по меньшей мере 7:1 или по меньшей мере 8:1. В некоторых вариантах осуществления отношение слитого полипептида к связывающему полипептиду составляет от 1,5:1, 2:1 или 3:1 на нижнем конце диапазона до 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 на верхнем конце диапазона.
ЭЛЕМЕНТЫ АКТИВАЦИИ
[375] Многие из способов и аспектов композиции по настоящему изобретению включают активирующий элемент, также называемый в данном документе как активирующий элемент Т-клетки, или нуклеиновую кислоту, кодирующую активирующий элемент. Ограничения, связанные с трансдукцией лентивирусов (LV) в покоящиеся Т-клетки, объясняются рядом пре-входных и пост-входных барьеров, а также клеточными ограничивающими факторами (Strebel et al 2009. BMC Medicine 7:48). Одним из ограничений является неспособность частиц псевдотипированного LV оболочки распознавать потенциальные рецепторы и опосредовать слияние с клеточной мембраной. Однако при определенных условиях трансдукция покоящихся Т-клеток лентивирусными векторами на основе ВИЧ-1 возможна в основном при помощи комплекса CD3 рецептора Т-клеток (TCR) и совместной стимуляции CD28 (Korin & Zack. 1998. Journal of Virology. 72:3161-8, Maurice et al. 2002. Blood 99:2342-50), а также через воздействие цитокинов (Cavalieri et al 2003).
[376] Клетки иммунной системы, такие как Т-лимфоциты, распознают специфические антигены и взаимодействуют с ними через рецепторы или рецепторные комплексы, которые при распознавании или взаимодействии с такими антигенами вызывают активацию клетки и распространение в организме. Примером такого рецептора является комплекс рецепторов антигенспецифических Т-лимфоцитов (TCR/CD3). Рецептор Т-клеток (TCR) экспрессируется на поверхности Т-лимфоцитов. Один компонент, CD3, отвечает за внутриклеточную передачу сигналов после занятия TCR лигандом. Рецептор Т-лимфоцитов для комплекса антиген-CD3 (TCR/CD3) распознает антигенные пептиды, которые представлены ему белками главного комплекса гистосовместимости (MHC). Комплексы MHC и пептида экспрессируются на поверхности антигенпрезентирующих клеток и других мишеней Т-лимфоцитов. Стимуляция комплекса TCR/CD3 приводит к активации Т-лимфоцитов и последующему антигенспецифическому иммунному ответу. Комплекс TCR/CD3 играет центральную роль в эффекторной функции и регуляции иммунной системы. Таким образом, приведенные в данном документе активирующие элементы активируют Т-клетки путем связывания с одним или несколькими компонентами комплекса, ассоциированного с Т-клеточным рецептором, например, путем связывания с CD3. В некоторых случаях элемент активации может активироваться отдельно. В других случаях активация требует активации через рецепторный комплекс TCR для дальнейшей активации клеток.
[377] Т-лимфоцитам также требуется второй, костимулирующий сигнал, чтобы стать полностью активными. Без такого сигнала Т-лимфоциты либо не реагируют на связывание антигена с TCR, либо становятся анергическими. Такой костимулирующий сигнал, например, обеспечивается CD28, белком Т-лимфоцитов, который взаимодействует с CD80 и CD86 на антигенпродуцирующих клетках. Используемый в данном документе функциональный внеклеточный фрагмент CD80 сохраняет способность взаимодействовать с CD28. ICOS (Inducible COStimulator), другой белок Т-лимфоцитов, обеспечивает костимуляторный сигнал при связывании с лигандом ICOS.
[378] Активация комплекса CD3 рецептора Т-клеток (TCR) и костимуляция CD28 могут происходить путем воздействия ex vivo на твердые поверхности (например, гранулы), покрытые антителом к CD3 и антителом к CD28. В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, покоящиеся Т-клетки активируются воздействием на твердые поверхности, покрытые антителом к CD3 и антителом к CD28 ex vivo. В других вариантах осуществления покоящиеся Т-клетки или NK-клетки, в иллюстративных вариантах осуществления Т-клетки, активируются воздействием растворимых антител к CD3 (например, при 50-150, или 75-125, или 100 нг/мл). В таких вариантах осуществления, которые могут быть частью способов генетической модификации или трансдукции, в иллюстративных вариантах осуществления без предварительной активации такая активация и/или приведение в контакт могут осуществляться, например, в течение 8 часов или меньше, 4 часов или меньше или в течение от 2 до 8 часов, в течение от 2 до 4 часов или от 2 до 3 часов.
[379] В некоторых иллюстративных вариантах осуществления способов и композиций, представленных в данном документе, полипептиды, которые способны связывать CD3 и / или CD28, представлены как «активирующие элементы» на поверхности некомпетентных к репликации рекомбинантных ретровирусных частиц способов и композиций, раскрытых в данном документе, которые являются также аспектами настоящего изобретения. Полипептиды, связывающие CD3 и/или CD28, называют «элементами активации» из-за их способности активировать покоящиеся Т-клетки.
[380] В некоторых вариантах осуществления элемент активации представляет собой полипептид, способный связываться с CD3. В некоторых вариантах осуществления полипептид, способный связываться с CD3, представляет собой антитело к CD3 или его фрагмент, который сохраняет способность связываться с CD3. В иллюстративных вариантах осуществления антитело к CD3 или его фрагмент представляет собой одноцепочечное антитело к CD3, такое как без ограничения scFv к CD3. В другом иллюстративном варианте осуществления полипептид, способный связываться с CD3, представляет собой scFvFc к CD3.
[381] Доступен ряд моноклональных антител к CD3 человека и их фрагментов антител, которые можно использовать в данном изобретении, включая без ограничения UCHT1, OKT-3, HIT3A, TRX4, X35-3, VIT3, BMA030 (BW264/56), CLB-T3/3, CRIS7, YTH12.5, F111409, CLB-T3.4.2, TR-66, WT31, WT32, SPv-T3b, 11D8, XIII-141, XIII46, XIII-87, 12F6, T3/RW2-8C8, T3/RW24B6, OKT3D, M-T301, SMC2 и F101.01.
[382] В некоторых вариантах осуществления элемент активации представляет собой полипептид, способный связываться с CD28. В некоторых вариантах осуществления полипептид, способный связываться с CD28, представляет собой антитело к CD28 или его фрагмент, который сохраняет способность связываться с CD28. В других вариантах осуществления полипептид, способный связываться с CD28, представляет собой CD80, CD86 или их функциональный фрагмент, который способен связывать CD28 и индуцировать опосредованную CD28 активацию Akt, например, внешний фрагмент CD80. В некоторых аспектах данного документа внешний фрагмент CD80 означает фрагмент, который обычно присутствует вне клетки в нормальном клеточном местоположении CD80, который сохраняет способность связываться с CD28. В иллюстративных вариантах осуществления антитело к CD28 или его фрагмент представляет собой одноцепочечное антитело к CD28, такое как без ограничения scFv к CD28. В другом иллюстративном варианте осуществления полипептид, способный связываться с CD28, представляет собой CD80 или фрагмент CD80, такой как внешний фрагмент CD80.
[383] Антитела к CD28 известны в данной области техники и могут включать, в качестве неограничивающих примеров, моноклональное антитело 9.3, антитело IgG2a (доктор Джеффри Ледбеттер, Bristol Myers Squibb Corporation, Сиэтл, Вашингтон), моноклональное антитело KOLT-2, антитело к IgG1, 15E8, антитело к IgG1, 248.23.2, антитело к IgM и EX5.3D10, антитело к IgG2a.
[384] В иллюстративном варианте осуществления элемент активации включает два полипептида, полипептид, способный связываться с CD3, и полипептид, способный связываться с CD28.
[385] В определенных вариантах осуществления полипептид, способный связываться с CD3 или CD28, представляет собой антитело, одноцепочечное моноклональное антитело или фрагмент антитела, например, одноцепочечный фрагмент антитела. Соответственно, фрагмент антитела может представлять собой, например, вариабельную область одноцепочечного фрагмента (scFv), связывающий антитело (Fab) фрагмент антитела, одноцепочечный антигенсвязывающий фрагмент (scFab), одноцепочечный антигенсвязывающий фрагмент. без цистеинов (scFabΔC), вариабельной области фрагмента (Fv), конструкции, специфичной для соседних эпитопов антигена (CRAb), или однодоменного антитела (VH или VL).
[386] В любом из вариантов осуществления, раскрытых в данном документе, элемент активации или кодирующая его нуклеиновая кислота может включать димеризующийся мотив или мотив мультимеризации более высокого порядка. Димеризующиеся и мультимеризующиеся мотивы хорошо известны в данной области техники, и специалист в данной области техники поймет, как включить их в полипептиды для эффективной димеризации или мультимеризации. Например, в некоторых вариантах осуществления элемент активации, который включает димеризующийся мотив, может представлять собой один или несколько полипептидов, способных связываться с CD3 и/или CD28. В некоторых вариантах осуществления полипептид, способный связываться с CD3, представляет собой антитело к CD3 или его фрагмент, который сохраняет способность связываться с CD3. В иллюстративных вариантах осуществления антитело к CD3 или его фрагмент представляет собой одноцепочечное антитело к CD3, такое как без ограничения scFv к CD3. В другом иллюстративном варианте осуществления полипептид, способный связываться с CD3, представляет собой scFvFc к CD3, который в некоторых вариантах осуществления считается антителом к CD3 с димеризирующимся мотивом без какого-либо дополнительного димеризующего мотива, поскольку известно, что конструкции scFvFc к CD3 способны димеризоваться без необходимости отдельного димеризующего мотива.
[387] В некоторых вариантах осуществления димеризующийся или мультимеризующийся мотив или последовательность нуклеиновой кислоты, кодирующая его, может быть аминокислотной последовательностью трансмембранных полипептидов, которые в природе существуют в виде гомодимеров или мультимеров. В некоторых вариантах осуществления димеризующийся или мультимеризующийся мотив или последовательность нуклеиновой кислоты, кодирующая его, может быть аминокислотной последовательностью из фрагмента природного белка или сконструированного белка. В одном варианте осуществления гомодимерный полипептид представляет собой полипептид, содержащий мотив лейциновой молнии (полипептид лейциновой молнии). Например, полипептид лейциновой молнии, полученный из c-JUN, неограничивающие примеры которого раскрыты, относится к химерным лимфопролиферативным элементам (CLE) в данном документе.
[388] В некоторых вариантах осуществления эти трансмембранные гомодимерные полипептиды могут включать антиген ранней активации CD69 (CD69), белок рецептора трансферрина 1 (CD71), антиген дифференцировки В-клеток (CD72), тактильный белок Т-клеточной поверхности (CD96), эндоглин (Cd105), представитель 1 подсемейства лектин-подобных рецепторов клеток-киллеров (Cd161), лиганд гликопротеина 1 P-селектина (Cd162), глутамиламинопептидазу (Cd249), представитель суперсемейства рецепторов фактора некроза опухоли 16 (CD271), кадгерин-1 (E-кадгерин) (Cd324) или их активные фрагменты. В некоторых вариантах осуществления димеризующийся мотив и нуклеиновая кислота, кодирующая его, может содержать аминокислотную последовательность из трансмембранных белков, которые димеризуются при связывании лиганда (также обозначаемого в данном документе димеризатором или димеризующим средством). В некоторых вариантах осущетсвления димеризующийся мотив и димеризатор могут включать (в случае, когда димеризатор указан в скобках после пары связывания димеризатора): FKBP и FKBP (рапамицин); GyrB и GyrB (кумермицин); DHFR и DHFR (метотрексат); или DmrB и DmrB (AP20187). Как отмечалось выше, рапамицин может выступать в качестве димеризатора. В качестве альтернативы можно использовать производное или аналог рапамицина (см., например, WO 96/41865; WO 99/36553; WO 01/14387; и Ye et al (1999) Science 283: 88-91). Например, аналоги, гомологи, производные и другие соединения, структурно родственные рапамицину («рапалоги»), включают, среди прочего, варианты рапамицина, имеющие одну или несколько из следующих модификаций по отношению к рапамицину: деметилирование, отщепление или замена метокси в C7, C42 и/или C29; отщепление, дериватизацию или замену гидрокси в C13, C43 и/или C28; восстановление, отщепление или дериватизацию кетона в C14, C24 и/или C30; замену 6-членного пипеколатного кольца на 5-членное пролильное кольцо; и альтернативное замещение в циклогексильном кольце или замену циклогексильного кольца замещенным циклопентильным кольцом. Дополнительная информация представлена, например, в патентах США №№ 5525610; 5310903, 5362718; и 5527907. Описана селективная эпимеризация гидроксильной группы C-28 (см., например, WO 01/14387). Дополнительные синтетические димеризующие средства, подходящие для использования в качестве альтернативы рапамицину, включают средства, описанные в публикации патента США № 2012/0130076. Как отмечалось выше, кумермицин может служить димеризующим средством. В качестве альтернативы можно использовать аналог кумермицина (см., например, Farrar et al. (1996) Nature 383:178-181; и патент США № 6916846). Как отмечалось выше, в некоторых случаях димеризующим средством является метотрексат, например, нецитотоксический гомобифункциональный димер метотрексата (см., например, патент США № 8 236 925).
[389] В некоторых вариантах осуществления, когда он присутствует на поверхности не способных к репликации рекомбинантных ретровирусных частиц, активирующий элемент, включающий димеризующий мотив, может быть активным в отсутствие димеризующего средства. Например, элементы активации, включая димеризующий мотив из трансмембранных гомодимерных полипептидов, включая CD69, CD71, CD72, CD96, Cd105, Cd161, Cd162, Cd249, CD271, Cd324, их активные мутанты и/или их активные фрагменты, могут быть активными в отсутствие димеризующего средства. В некоторых вариантах осуществления активирующий элемент может представлять собой одноцепочечный фрагмент антитела к CD3 и включать димеризующий мотив, выбранный из группы, состоящей из CD69, CD71, CD72, CD96, Cd105, Cd161, Cd162, Cd249, CD271, Cd324, их активных мутантов и/или их активных фрагментов.
[390] В некоторых вариантах осуществления, когда он присутствует на поверхности не способных к репликации рекомбинантных ретровирусных частиц, активирующий элемент, включающий димеризующий мотив, может быть активным в присутствии димеризующего средства. Например, элементы активации, включая мотив димеризации из FKBP, GyrB, DHFR или DmrB, могут быть активными в присутствии соответствующих димеризующих средств или их аналогов, например рапамицина, кумермицина, метотрексата и AP20187 соответственно. В некоторых вариантах осуществления элемент активации может представлять собой одноцепочечный фрагмент антитела к к CD3 или антитела к CD28, или другую молекулу, которая связывает CD3 или CD28, и димеризующий мотив и димеризующее средство могут быть выбраны из группы, состоящей из FKBP и рапамицина или их аналогов, GyrB и кумермицина или их аналогов, DHFR и метотрексата или их аналогов, или DmrB и AP20187 или их аналогов.
[391] В некоторых вариантах осуществления элемент активации слит с гетерологичной сигнальной последовательностью и/или гетерологичной последовательностью прикрепления к мембране, обе из которых помогают направлять элемент активации к мембране. Гетерологичная сигнальная последовательность направляет элемент активации в эндоплазматический ретикулум, где последовательность присоединения гетерологичной мембраны ковалентно присоединяется к одной или нескольким жирным кислотам (также известная как посттрансляционная модификация липидов), так что элементы активации, слитые с последовательностью присоединения гетерологичной мембраны, являются закрепленными в липидных рафтах цитоплазматической мембраны. В некоторых вариантах осуществления посттрансляционная модификация липидов может происходить посредством миристоилирования, пальмитоилирования или GPI-заякорения. Миристоилирование представляет собой посттрансляционную модификацию белка, которая соответствует ковалентному связыванию 14-углеродной насыщенной жирной кислоты, миристиновой кислоты, с N-концевым глицином эукариотического или вирусного белка. Пальмитоилирование представляет собой посттрансляционную модификацию белка, которая соответствует ковалентному связыванию ацильной цепи C16 с цистеинами и, реже, с остатками серина и треонина белков. GPI-заякорение относится к прикреплению гликозилфосфатидилинозитола или GPI к С-концу белка во время посттрансляционной модификации.
[392] В некоторых вариантах осуществления гетерологичная последовательность прикрепления к мембране представляет собой последовательность присоединения GPI-якоря. Гетерологичная последовательность присоединения GPI-якоря может быть получена из любого известного GPI-заякоренного белка (см. обзор Ferguson MAJ, Kinoshita T, Hart GW. Glycosylphosphatidylinositol Anchors. In: Varki A, Cummings RD, Esko JD, et al., editors. Essentials of Glycobiology. 2nd edition. Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press; 2009. Chapter 11). В некоторых вариантах осуществления гетерологичная последовательность присоединения GPI-якоря представляет собой последовательность присоединения GPI-якоря из CD14, CD16, CD48, CD55 (DAF), CD59, CD80 и CD87. В некоторых вариантах осуществления гетерологичная последовательность присоединения GPI-якоря происходит от CD16. В иллюстративных вариантах осуществления гетерологичная последовательность присоединения GPI-якоря происходит от Fc-рецептора FcγRIIIb (CD16b) или фактора ускорения распада (DAF), иначе известного как фактор ускорения распада комплемента или CD55.
[393] В некоторых вариантах осуществления один или оба элемента активации включают гетерологичную сигнальную последовательность, которая помогает направить экспрессию элемента активации на клеточную мембрану. Можно использовать любую сигнальную последовательность, которая активна в линии пакующих клеток. В некоторых вариантах осуществления сигнальная последовательность представляет собой сигнальную последовательность DAF. В иллюстративных вариантах осуществления элемент активации слит с сигнальной последовательностью DAF на своем N-конце и последовательностью присоединения GPI-якоря на своем С-конце.
[394] В иллюстративном варианте осуществления активирующий элемент включает scFvFc к CD3, слитый с последовательностью присоединения якоря GPI, полученной из CD14, и CD80, слитый с последовательностью присоединения GPI-якоря, полученной из CD16b; и оба экспрессируются на поверхности некомпетентной к репликации рекомбинантной ретровирусной частицы, представленной в данном документе. В некоторых вариантах осуществления scFvFc к CD3 слит с сигнальной последовательностью DAF на своем N-конце и последовательностью присоединения GPI-якоря, полученной из CD14 на его C-конце, а CD80 слит с сигнальной последовательностью DAF на своем N-конце и последовательностью присоединения GPI-якоря, происходящей от CD16b на его С-конце; и оба экспрессируются на поверхности не способной к репликации рекомбинантной ретровирусной частицы, представленной в данном документе. В некоторых вариантах осуществления сигнальная последовательность DAF включает аминокислотные остатки 1-30 белка DAF.
МЕМБРАНОСВЯЗАННЫЕ ЦИТОКИНЫ
[395] Некоторые варианты осуществления аспектов способа и композиции представленных, в данном документе, включают мембраносвязанный цитокин или полинуклеотиды, кодирующие мембраносвязанный цитокин. Цитокины обычно, но не всегда, представляют собой секретируемые белки. Цитокины, которые секретируются естественным путем, могут быть сконструированы как слитые белки, связывающиеся с мембраной. Мембраносвязанные слитые с цитокинами полипептиды включены в способы и композиции, раскрытые в данном документе, и также являются аспектом настоящего изобретения. В некоторых вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы имеют на своей поверхности мембраносвязанный полипептид слияния цитокинов, который способен связывать Т-клетку и/или NK-клетку и способствовать их пролиферации и/или выживанию. Обычно мембраносвязанные полипептиды включаются в мембраны не способных к репликации рекомбинантных ретровирусных частиц, и когда клетка трансдуцируется не способными к репликации рекомбинантными ретровирусными частицами, слияние мембран ретровируса и клетки-хозяина приводит к тому, что полипептид связывается с мембраной трансдуцированной клетки.
[396] В некоторых вариантах осуществления слитый с цитокином полипептид включает IL-7, IL-15 или их активный фрагмент. Мембраносвязанные слитые с цитокинами полипептиды обычно представляют собой цитокин, слитый с гетерологичной сигнальной последовательностью и/или гетерологичной последовательностью прикрепления к мембране. В некоторых вариантах осуществления гетерологичная последовательность прикрепления к мембране представляет собой последовательность присоединения GPI-якоря. Гетерологичная последовательность присоединения GPI-якоря может быть получена из любого известного GPI-заякоренного белка (см. обзор Ferguson MAJ, Kinoshita T, Hart GW. Glycosylphosphatidylinositol Anchors. In: Varki A, Cummings RD, Esko JD, et al., editors. Essentials of Glycobiology. 2nd edition. Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press; 2009. Chapter 11). В некоторых вариантах осуществления гетерологичная последовательность присоединения GPI-якоря представляет собой последовательность присоединения GPI-якоря из CD14, CD16, CD48, CD55 (DAF), CD59, CD80 и CD87. В некоторых вариантах осуществления гетерологичная последовательность присоединения GPI-якоря происходит от CD16. В иллюстративном варианте осуществления гетерологичная последовательность присоединения GPI-якоря происходит из рецептора Fc FcγRIIIb (CD16b). В некоторых вариантах осуществления GPI-якорь является GPI-якорем DAF.
[397] В иллюстративных вариантах осуществления мембраносвязанный цитокин представляет собой слитый полипептид цитокина, слитого с DAF. Известно, что DAF накапливается в липидных рафтах, которые включены в мембраны не способных к репликации рекомбинантных ретровирусных частиц, отпочковывающихся из пакующих клеток. Соответственно, не ограничиваясь теорией, считается, что слитые белки DAF предпочтительно нацелены на части мембран пакующих клеток, которые станут частью рекомбинантной ретровирусной мембраны.
[398] В неограничивающих иллюстративных вариантах осуществления слитый с цитокином полипептид представляет собой IL-7 или его активный фрагмент, слитый с DAF. В конкретном неограничивающем иллюстративном варианте осуществления слитый с цитокином полипептид включает в себя по порядку: сигнальную последовательность DAF (остатки 1-31 DAF), IL-7 без его сигнальной последовательности и остатки 36-525 DAF.
ЭЛЕМЕНТ РИБОПЕРЕКЛЮЧАТЕЛЯ
Рибопереключатели
[399] Некоторые из композиций и способов, представленных в данном документе, включают один или несколько рибопереключателей или полинуклеотидов, которые включают один или несколько рибопереключателей, которые сами по себе составляют отдельные аспекты настоящего изобретения. Рибопереключатели представляют собой обычное явление для бактерий, регулирующее экспрессию генов, и средство достижения РНК-контроля биологических функций. Рибопереключатели представляют собой полинуклеотиды, которые могут присутствовать в 5'-нетранслируемой области mRNA и обеспечивают регуляторный контроль над экспрессией генов посредством связывания низкомолекулярного лиганда, который индуцирует или подавляет активность рибопереключателя. Обычно рибопереключатель контролирует продукт гена, участвующий в генерации низкомолекулярного лиганда, образуя таким образом петлю обратной связи. Рибопереключатели обычно действуют цис-способом, хотя были идентифицированы рибопереключатели, которые действуют транс-способом. Природные рибопереключатели состоят из двух доменов: домена аптамера, который связывает лиганд посредством трехмерной свернутой структуры РНК, и домена переключения функций, который индуцирует или подавляет активность рибопереключателя в зависимости от отсутствия или присутствия лиганда. Таким образом, с помощью рибопереключателя достигаются две чувствительные к лиганду конформации, представляющие состояния включения и выключения (Garst et al., 2011). Домен переключения функций может влиять на экспрессию полинуклеотида путем регулирования: внутреннего сайта входа в рибосомы, доступности донора сплайсинга pre-mRNA в конструкции ретровирусного гена, сплайсинга pre-mRNA, трансляции, терминации транскрипции, деградации транскрипта, экспрессии miRNA или экспрессии shRNA (Dambach and Winkler 2009). Аптамеры и домены переключения функций могут использоваться в качестве модульных компонентов, позволяющих синтетическим РНК-устройствам контролировать экспрессию генов либо в виде нативных аптамеров, либо в виде мутировавших/эволюционировавших нативных аптамеров, либо полностью синтетических аптамеров, которые идентифицируются при скрининге случайных библиотек РНК (McKeague et al, 2016).
[400] Семейство пуриновых рибопереключателей представляет собой одно из крупнейших семейств, в котором обнаружено более 500 последовательностей (Mandal et al, 2003; US20080269258; и WO2006055351). Пуриновые рибопереключатели имеют аналогичную структуру, состоящую из трех консервативных спиральных элементов/стеблевых структур (P1, P2, P3) с промежуточными элементами петель/соединений (J1-2, L2, J2-3, L3, J3-1). Аптамерные домены пуринового семейства рибопереключателей естественно различаются по своей аффинности/регуляции различными пуриновыми соединениями, такими как аденин, гуанин, аденозин, гуанозин, дезоксиаденозин, дезоксигуанозин (Фиг. 5) и т.д. Из-за вариации последовательности (Kim et al. 2007).
[401] В одном аспекте в данном документе предлагается выделенный полинуклеотид для регуляции экспрессии целевого полинуклеотида, включая: полинуклеотид, кодирующий целевой полинуклеотид, функционально связанный с промотором и рибопереключателем, при этом рибопереключатель включает: a.) аптамерный домен, способный связывать противовирусное лекарственное средство на основе нуклеозидного аналога и имеющее пониженное связывание с гуанином или 2'-дезоксигуанозином по сравнению с противовирусным лекарственным средством на основе нуклеозидного аналога; и b.) домен переключения функций, способный регулировать экспрессию целевого полинуклеотида, где связывание нуклеозидного аналога аптамерным доменом индуцирует или подавляет активность, регулирующую экспрессию домена переключения функций, тем самым регулируя экспрессию целевого гена. В некоторых вариантах осуществления целевой полинуклеотид может представлять собой область, кодирующую полипептид, miRNA или shRNA. В неограничивающем примере рибопереключатель функционально связан с нуклеиновой кислотой, кодирующей полипептид, miRNA или shRNA с активностью in vivo, например, которая эффективна при лечении заболевания. Например, в таком неограничивающем примере рибопереключатель функционально связан с нуклеиновой кислотой, кодирующей химерный антигенный рецептор. В неограничивающих иллюстративных примерах, представленных в данном документе, целевой полинуклеотид кодирует один или несколько сконструированных сигнальных полипептидов, включенных в различные другие аспекты настоящего изобретения. В этих неограничивающих иллюстративных примерах рибопереключатель и целевой полинуклеотид, кодирующий один или несколько сконструированных сигнальных полипептидов, можно найти в геноме пакующей клетки, в не способной к репликации рекомбинантной ретровирусной частице, в Т-клетке и/или в NK-клетке.
[402] В некоторых вариантах осуществления изобретения аптамерный домен может иметь длину от 30, 35, 40, 45, 50, 55, 60, 65 и 70 нуклеотидов на нижнем конце диапазона и от 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 и 100 нуклеотидов в длину на верхнем конце диапазона, например, от 45 до 80 нуклеотидов в длину, от 45 до 60 нуклеотидов в длину или от 45 до 58 нуклеотидов в длину. В иллюстративных вариантах осуществления противовирусное лекарственное средство на основе нуклеозидного аналог может представлять собой фармацевтический лиганд ацикловир (также известный как ацикловир и ациклогуанозин) или пенцикловир (Фиг. 5). В некоторых вариантах осуществления аптамерный домен может иметь аффинность связывания с противовирусным лекарственным средством на основе нуклеозидного аналогом выше, например, по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз больше, чем аффинность связывания с нуклеозидом или нуклеотидом.
[403] Элемент управления, например, рибопереключатель, в некоторых вариантах осуществления функционально связан с целевым геном и может контролировать экспрессию целевого гена in vitro и/или in vivo, способствует экспансии трансдуцированных Т-клеток in vivo. В некоторых вариантах осуществления экспансия зависит от наличия элемента управления.Однако в других вариантах осуществления экспансия трансдуцированных Т-клеток может быть, по меньшей мере, частично вызвана другими факторами, такими как присутствие интерлейкинов у субъекта и связывание ASTR CAR на рекомбинантной Т-клетке с ее лигандом. Однако в других вариантах осуществления экспансия трансдуцированных Т-клеток может быть, по меньшей мере, частично вызвана другими факторами, такими как присутствие интерлейкинов у субъекта и связывание ASTR CAR на рекомбинантной Т-клетке с ее лигандом.
[404] В некоторых вариантах осуществления противовирусное лекарственное средство на основе нуклеозидного аналога, например ацикловир или пенцикловир, вводится субъекту до, во время и/или после выделения PBL из крови и до того, как Т-клетки и/или NK-клетки войдут в контакт с не способной к репликации рекомбинантной ретровирусной частицей, которая включает элемент управления, который в иллюстративных неограничивающих примерах представляет собой рибопереключатель, который связывается с противовирусным лекарственным средством на основе нуклеозидного аналога и регулирует экспрессию одного или нескольких целевых полинуклеотидов. Один или несколько целевых полинуклеотидов могут кодировать один или несколько полипептидов, которые в неограничивающих иллюстративных примерах представляют собой один или несколько сконструированных сигнальных полипептидов, по меньшей мере один из которых кодирует по меньшей мере один лимфопролиферативный элемент. В некоторых вариантах осуществления противовирусное лекарственное средство на основе нуклеозидного аналога, например, ацикловир или пенцикловир, вводится субъекту в течение 5, 10, 15, 30 и 60 минут на нижнем конце диапазона и 1,5, 2, 3, 4, 5, 6, 8, 12, 24, 48 или 72 часа на верхнем конце диапазона, до выделения PBL из крови или до того, как Т-клетки и/или NK-клетки контактируют с неспособными к репликации рекомбинантными ретровирусными частицами. В некоторых вариантах осуществления противовирусное лекарственное средство на основе нуклеозидного аналога, например, ацикловир или пенцикловир, вводится субъекту в течение от 1,5, 2, 3, 4, 5, 6, 8, 12 или 24 часов на нижнем конце диапазона, до ½, 1, 2, 3, 4, 5, 6, 7, 10, 14, 21 или 28 дней на верхнем конце диапазона, после выделения PBL из крови или после того, как Т-клетки и/или NK-клетки приводили в контакт с не способными к репликации рекомбинантными ретровирусными частицами, в способах, представленных в данном документе. В некоторых вариантах осуществления лекарственное средство или пролекарственное средство на основе нуклеозидного аналога, например, ацикловир или пенцикловир, вводят субъекту в течение по меньшей мере 1,5, 2, 3, 4, 5, 6, 8, 12 или 24 часов или по меньшей мере 2, 3, 4, 5, 6, 7, 10, 14, 21 или 28 дней после выделения PBL из крови и/или приведения в контакт Т-клеток и/или NK-клеток с неспособными к репликации рекомбинантными ретровирусными частицами в способах, представленных в данном документе. В некоторых вариантах осуществления лекарственное средство или пролекарственное средство на основе нуклеозидного аналога, например, ацикловир или пенцикловир, вводят субъекту в течение по меньшей мере 1, 2, 3, 4, 5, 7, 10, 14, 21, 28, 30, 60, 90 или 120 дней или 5, 6, 9, 12, 24, 36, 48, 60, 72, 84, 96, 120 месяцев или неопределенно долго после того, как PBL были повторно введены субъекту. В любом из вариантов осуществления, раскрытых в данном документе, лекарственное средство на основе нуклеозидного аналога, можно вводить до и/или во время повторного введения PBL и/или после повторного введения PBL. В некоторых вариантах осуществления противовирусное лекарственное средство на основе нуклеозидного аналога вводят до тех пор, пока субъект не перестанет испытывать симптомы или заболеет заболеванием, с которым связан целевой полинуклеотид.
[405] В некоторых вариантах осуществления изобретения домен аптамера может предпочтительно связывать пенцикловир по сравнению с ацикловиром или, альтернативно, другим противовирусным средством, так что сопутствующая противовирусная терапия может использоваться без воздействия на рибопереключатель. В некоторых вариантах осуществления изобретения домен аптамера может связывать пенцикловир с аффинностью связывания, превышающей, например, по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз, чем аптамерный домен, связывает ацикловир или другое противовирусное средство. В некоторых вариантах осуществления изобретения домен аптамера может предпочтительно связывать ацикловир по сравнению с пенцикловиром или, альтернативно, другим противовирусным средством, так что сопутствующая противовирусная терапия может использоваться без воздействия на рибопереключатель. В некоторых вариантах осуществления изобретения домен аптамера может связывать ацикловир с аффинностью связывания, превышающей, например, по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз, чем аптамерный домен, связывает пенцикловир или другое противовирусное средство. В некоторых вариантах осуществления субъекту можно вводить пероральные пролекарства пенцикловира (фамцикловира) и ацикловира (валацикловира).
[406] В некоторых вариантах осуществления в аптамерном домене выделенного полинуклеотида может быть по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательностей или он может быть идентичным любой из последовательностей SEQ ID NO: 87-93 и сохранять способность связывать ацикловир и пониженную способность связываться с гуанином или 2'-дезоксигуанозином по сравнению с противовирусным лекарственным средством на основе нуклеозидного аналога, и где домен аптамера сохраняет способность индуцировать или подавлять активность, регулирующую экспрессию, домена переключения функций при связывании с ацикловиром. В некоторых вариантах осуществления в аптамерном домене выделенного полинуклеотида может быть по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности или он может быть идентичным домену аптамера SEQ ID NO: 94-100 и сохранять способность связывать пенцикловир и пониженную способность связываться с гуанином или 2'-дезоксигуанозином по сравнению с антивирусным лекарственным средством, аналогичным нуклеозидному аналогу, и где аптамер домен сохраняет способность индуцировать или подавлять активность, регулирующую экспрессию, домена переключения функций при связывании с пенцикловиром. В некоторых вариантах осуществления область выделенного полинуклеотида или область рибопереключателя может быть на по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности или быть идентичной любой из последовательностей SEQ ID NO: 87-100.
[407] В некоторых вариантах осуществления последовательность ДНК, содержащая область аптамерного домена изолированного полинуклеотида, может быть на по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97 %, 98% или 99% идентичности последовательностей или быть идентичной любой из последовательностей SEQ ID NO: 108-221. В некоторых вариантах осуществления область выделенного полинуклеотида может быть на по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности или быть идентичной любой из последовательностей SEQ ID NO: 108-221.
[408] В некоторых вариантах осуществления последовательность ДНК, содержащая область аптамерного домена выделенного полинуклеотида, может быть на по меньшей мере 80%, 85%, 90%, 91%, 91,84%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности или быть идентичной SEQ ID NO: 108. В некоторых вариантах осуществления последовательность ДНК, содержащая область аптамерного домена выделенного полинуклеотида, может быть на по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 95,83%, 96%, 97%, 98% или 99% идентичной последовательности или быть идентичной SEQ ID NO: 147. В некоторых вариантах осуществления последовательность ДНК, содержащая область аптамерного домена выделенного полинуклеотида, может быть на по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 93,88%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности или быть идентичной SEQ ID NO: 164. В некоторых вариантах осуществления последовательность ДНК, содержащая область аптамерного домена выделенного полинуклеотида, может быть на по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 95,83%, 96%, 97%, 98% или 99% идентичной последовательности или быть идентичной SEQ ID NO: 183. В некоторых вариантах осуществления последовательность ДНК, содержащая область аптамерного домена выделенного полинуклеотида, может быть на по меньшей мере 80%, 85%, 90%, 91%, 91,84%, 92%, 93%, 94%, 95%, 95,83%, 96%, 97%, 98% или 99% идентичной последовательности или быть идентичной SEQ ID NO: 198.
[409] В некоторых вариантах осуществления область выделенного полинуклеотида может включать любую из консенсусных последовательностей SEQ ID NO: 222-226. В некоторых вариантах осуществления область выделенного полинуклеотида может быть на по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 95,83%, 96%, 97%, 98% или 99% идентичной последовательности или быть идентичной любой из последовательностей SEQ ID NO: 222-226.
[410] В любом из раскрытых в данном документе вариантов осуществления выделенный полинуклеотид может сохранять способность связывать ацикловир и/или пенцикловир. В любом из раскрытых в данном документе вариантов осуществления выделенный полинуклеотид может быть обратным комплементом любой одной из последовательностей SEQ ID NO: 87-100 или SEQ ID NO:108-221. В любом из раскрытых в данном документе вариантов осуществления выделенный полинуклеотид может быть транскрипционной или РНК-версией либо последовательностей ДНК SEQ ID NO: 108-221, либо последовательностей ДНК, комплементарных SEQ ID NO: 108-221. В любом из раскрытых в данном документе вариантов осуществления выделенный полинуклеотид может быть обратной транскрипцией или версией ДНК любой одной из последовательностей РНК SEQ ID NO: 87-100 или цепью ДНК, комплементарной обратной транскрипции любой из последовательностей РНК SEQ ID NO: 87-100.
[411] В некоторых вариантах осуществления, представленных в настоящем документе, каркасы рибопереключателей можно использовать для анализа мутаций или молекулярной эволюции. Рибопереключатели, выбранные для мутационного анализа или молекулярной эволюции, могут происходить из любого известного организма, например, из бактерий. В некоторых вариантах осуществления рибопереключатель дезоксигуанозина типа I-A из Mesoplasma florum можно использовать для молекулярной эволюции. В некоторых вариантах осуществления производный домен аптамера может быть по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95% идентичен домену аптамера из дезоксигуанозинового рибопереключателя типа I-A из Mesoplasma florum (SEQ ID NO: 237). В других вариантах осуществления можно использовать рибопереключатель xpt из Bacillus subtilis. В некоторых вариантах осуществления производный домен аптамера может быть по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95% идентичен домену аптамера из рибопереключателя xpt из Bacillus subtilis (SEQ ID NO: 243).
[412] Домены аптамеров можно использовать в качестве модульных компонентов и комбинировать с любыми доменами переключения функций для воздействия на транскрипт РНК. В любом из вариантов осуществления, раскрытых в настоящем документе, рибопереключатель может влиять на транскрипт РНК, регулируя любую из следующих активностей: внутренний сайт входа в рибосомы (IRES), доступность сплайсинг-донора pre-mRNA, сплайсинг mRNA, трансляция, терминация транскрипции, транскрипция, деградация, экспрессия miRNA или экспрессия shRNA. В некоторых вариантах осуществления домен переключения функций может контролировать связывание антитела к IRES с IRES (см., например, Ogawa, RNA (2011), 17:478-488, раскрытие которого полностью включено в настоящий документ посредством ссылки). В любом из вариантов осуществления, раскрытых в данном документе, присутствие или отсутствие низкомолекулярного лиганда может вызывать воздействие рибопереключателя на транскрипт РНК. В некоторых вариантах осуществления рибопереключатель может включать рибозим. Рибопереключатели с рибозимами могут ингибировать или усиливать расщепление транскриптов целевых полинуклеотидов в присутствии низкомолекулярного лиганда. В некоторых вариантах осуществления рибозим может быть рибозимом пистолетного класса, рибозимом из класса «головка молотка», изогнутым классом рибозима, классом рибозима «топорик» или рибозимом HDV (вирус гепатита дельта).
[413] В любом из вариантов осуществления, раскрытых в данном документе, рибопереключатель может располагаться в различных положениях относительно целевого полинуклеотида, как это обычно известно для рибопереключателей. В некоторых вариантах осуществления рибопереключатель может регулировать доступность сплайсинг-донора pre-mRNA или сплайсинг pre-mRNA и располагаться перед целевым полинуклеотидом. В некоторых вариантах осуществления рибопереключатель может регулировать включение поли (A)-хвоста и располагаться после целевого полинуклеотида. В некоторых вариантах осуществления рибопереключатель может регулировать антитело к IRES и располагаться перед IRES. В неограничивающих иллюстративных вариантах осуществления рибопереключатель, представленный в настоящем документе, может быть расположен в любом из этих положений относительно нуклеиновой кислоты, кодирующей один или несколько сконструированных сигнальных полипептидов, представленных в настоящем документе.
[414] В любом из раскрытых в данном документе вариантов осуществления, которые включают полинуклеотид, включающий рибопереключатель, полинуклеотид может дополнительно включать одно или несколько из последовательности типа Козак, элемента WPRE и двойного стоп-кодона или тройного стоп-кодона, где один или несколько из стоп-кодонов двойного стоп-кодона или тройного стоп-кодона определяют завершение считывания по меньшей мере одной из одной или нескольких транскрипционных единиц. В некоторых вариантах осуществления полинуклеотид включает последовательность типа Козак, выбранную из CCACCAUG(G) (SEQ ID NO:515), CCGCCAT/UG(G) (SEQ ID NO:516), GCCGCCGCCAT/UG(G) (SEQ ID NO:517) или GCCGCCGCCAT/UG. В определенных вариантах осуществления как -3, так и +4 нуклеотиды относительно стартового кодона первой последовательности нуклеиновой кислоты включают G. В другом варианте осуществления, который может быть объединен с предыдущим вариантом осуществления, который включает последовательность типа Козак и/или в следующем варианте осуществления, который включает тройной стоп-кодон, полинуклеотид включает элемент WPRE. В некоторых вариантах осуществления элемент WPRE расположен с 3' конца стоп-кодона одной или нескольких транскрипционных единиц и от 5' к 3' LTR полинуклеотида. В другом варианте осуществления, который можно комбинировать с одним или обоими из предшествующих вариантов (т.е. с вариантом осуществления, в котором полинуклеотид включает последовательность типа Козак, и/или с вариантом осуществления, в котором полинуклеотид включал WPRE), одна или несколько транскрипционных единиц оканчиваются одним или несколькими стоп-кодонами двойного стоп-кодона или тройного стоп-кодона.
[415] В некоторых вариантах осуществления рибопереключатель можно дестабилизировать при температурах выше 37,5 °C, 38 °C, 38,5 °C, 39 °C, 39,5 °C или 40 °C, так что рибопереключатель больше не реагирует на лиганд. В некоторых вариантах осуществления можно использовать молекулярную эволюцию для выбора рибопереключателей, которые дестабилизируются при температурах выше 37,5 °C, 38 °C, 38,5 °C, 39 °C, 39,5 °C или 40 °C.
[416] В некоторых вариантах осуществления целевой полинуклеотид может кодировать miRNA, shRNA и/или полипептид, где целевой полинуклеотид функционально связан с промотором. В некоторых вариантах осуществления целевой полинуклеотид может кодировать лимфопролиферативный элемент. В некоторых вариантах осуществления целевой полинуклеотид может представлять собой miRNA или shRNA. В некоторых вариантах осуществления miRNA или shRNA могут усиливать путь STAT5 или ингибировать путь SOCS. В некоторых вариантах осуществления miRNA или shRNA могут нацеливаться на транскрипты из SOCS1, SMAD2, TGFb или PD-1. В некоторых вариантах осуществления miRNA представляет собой miR-155. В некоторых вариантах осуществления целевой полинуклеотид кодирует полипептид, и полипептид может включать CAR, включая антигенспецифическую нацеленную область, трансмембранный домен и внутриклеточный активирующий домен.
[417] В другом аспекте в данном документе предлагается выделенный полинуклеотид для регуляции экспрессии целевого полинуклеотида, включая: полинуклеотид, кодирующий целевой полинуклеотид, функционально связанный с промотором и рибопереключателем, при этом рибопереключатель включает: a.) аптамерный домен, способный связывать противовирусное лекарственное средство на основе нуклеозидного аналога с аффинностью связывания, по меньшей мере в два раза большей аффинностью, чем аптамерный домен связывает гуанин или 2'-дезоксигуанозин; и b.) домен переключения функций, способный регулировать экспрессию целевого полинуклеотида, где связывание нуклеозидного аналога с помощью аптамерного домена индуцирует или подавляет активность регуляции экспрессии домена переключения функций. В некоторых вариантах осуществления изобретения домен аптамера может связываться с антивирусным лекарственным средством на основе нуклеозидного аналога с аффинностью связывания по меньшей мере в 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз большее аффинности, чем аптамерный домен связывает гуанин или 2'-дезоксигуанозин. В некоторых вариантах осуществления изобретения аптамерный домен может иметь длину от 30, 35, 40, 45, 50, 55, 60, 65 и 70 нуклеотидов на нижнем конце диапазона и 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 и 100 нуклеотидов в длину на верхнем конце диапазона, например, от 45 до 80 нуклеотов в длину или от 45 до 58 нуклеотидов в длину. В иллюстративных вариантах осуществления противовирусное лекарственное средство на основе нуклеозидного аналог может представлять собой фармацевтический лиганд ацикловир (также известный как ацикловир и ациклогуанозин) или пенцикловир. В некоторых вариантах осуществления аптамерный домен может иметь аффинность связывания с противовирусным лекарственным средством на основе нуклеозидного аналогом, которая выше, например, по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз больше, чем аффинность связывания с нуклеозидом или нуклеотидом. В некоторых вариантах осуществления связывание аналога нуклеозида аптамерным доменом может индуцировать активность рибопереключателя.
[418] В некоторых вариантах осуществления аптамерный домен может быть специфическим для пенцикловира и не обладать реактивностью к ацикловиру или, альтернативно, другому противовирусному средству, так что сопутствующая противовирусная терапия может использоваться без воздействия на рибопереключатель. В некоторых вариантах осуществления домен аптамера может связывать пенцикловир с аффинностью связывания по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, или в 100 раз больше, чем аптамерный домен связывает ацикловир или другое противовирусное средство. В некоторых вариантах осуществления аптамерный домен может быть специфическим для ацикловира и не обладать реактивностью к пенцикловиру или, альтернативно, другому противовирусному средству, так что сопутствующая противовирусная терапия может использоваться без воздействия на рибопереключатель. В некоторых вариантах осуществления домен аптамера может связывать ацикловир с аффинностью связывания по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, или в 100 раз больше, чем аптамерный домен связывает пенцикловир или другое противовирусное средство. В некоторых вариантах осуществления субъекту можно вводить пероральные пролекарства пенцикловира (фамцикловира) и ацикловира (валацикловира). В некоторых вариантах осуществления производный домен аптамера может быть по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95% идентичен домену аптамера из дезоксигуанозинового рибопереключателя типа I-A из Mesoplasma florum. В некоторых вариантах осуществления производный домен аптамера может быть по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95% идентичен домену аптамера из рибопереключателя xpt из Bacillus subtilis. В любом из вариантов осуществления, раскрытых в данном документе, рибопереключатель может влиять на транскрипт РНК, регулируя любую из следующих активностей: внутренний сайт входа в рибосомы, доступность сплайсинг-донора pre-mRNA в конструкции ретровирусного гена, сплайсинг mRNA, трансляция, терминация транскрипции, транскрипция, деградация, экспрессия miRNA или экспрессия shRNA. В некоторых вариантах осуществления домен переключения функций может контролировать связывание антитела к IRES с IRES. В любом из вариантов осуществления, раскрытых в данном документе, присутствие или отсутствие низкомолекулярного лиганда может вызывать воздействие рибопереключателя на транскрипт РНК. В некоторых вариантах осуществления рибопереключатель может включать рибозим. Рибопереключатели с рибозимами могут ингибировать или усиливать расщепление транскриптов генов, представляющих интерес, в присутствии низкомолекулярного лиганда. В некоторых вариантах осуществления рибозим может быть рибозимом пистолетного класса, рибозимом из класса «головка молотка», изогнутым классом рибозима, классом рибозима «топорик» или рибозимом HDV (вирус гепатита дельта). В некоторых вариантах осуществления рибопереключатель можно дестабилизировать при температурах выше 37,5 °C, 38 °C, 38,5 °C, 39 °C, 39,5 °C или 40 °C, так что рибопереключатель больше не реагирует на лиганд. В некоторых вариантах осуществления можно использовать молекулярную эволюцию для выбора рибопереключателей, которые дестабилизируются при температурах выше 37,5 °C, 38 °C, 38,5 °C, 39 °C, 39,5 °C или 40 °C. В некоторых вариантах осуществления целевой полинуклеотид может кодировать miRNA, shRNA и/или полипептид, где целевой полинуклеотид функционально связан с промотором. В некоторых вариантах осуществления целевой полинуклеотид может кодировать лимфопролиферативный элемент. В некоторых вариантах осуществления целевой полинуклеотид может представлять собой miRNA и, необязательно, miRNA может стимулировать путь STAT5 или ингибировать путь SOCS. В некоторых вариантах осуществления miRNA может нацеливаться на транскрипты из SOCS1, SHP, SMAD2, TGFb или PD-1. В этих вариантах осуществления miRNA может представлять собой miR-155. В некоторых вариантах осуществления целевой полинуклеотид кодирует полипептид, и полипептид может включать CAR, включая антигенспецифическую нацеленную область, трансмембранный домен и внутриклеточный активирующий домен. Дополнительные варианты осуществления CAR раскрыты в другом месте в данном документе.
[419] В некоторых вариантах осуществления эволюция аптамеров может быть выполнена посредством отбора аптамеров из рандомизированных библиотек нативных пуриновых или гуаниновых аптамеров с использованием методов SELEX (систематическая эволюция лигандов путем экспоненциального обогащения), включая, помимо прочего, те методы, которые используют оксид графена в способе выбора и скрининге. В других вариантах осуществления методология случайного мутагенеза, такая как подверженная ошибкам ПЦР, может быть использована для развития конструкций аптамеров или конструкций рибопереключателя, где аптамер включен в контексте любой из активностей рибопереключателя, описанных в данном документе, путем скрининга in vitro или в клетках млекопитающих. В других вариантах осуществления в эволюции рибопереключателя можно использовать случайные библиотеки нуклеотидов. В любом из вариантов осуществления, раскрытых в данном документе, рибопереключатели можно идентифицировать путем скрининга таких библиотек in vitro или в клетках млекопитающих.
[420] В некоторых вариантах осуществления полученный или производный домен аптамера может иметь повышенное связывание с аналогами нативного лиганда и пониженное связывание с нативным лигандом. В некоторых вариантах осуществления домен аптамера может быть сконфигурирован так, чтобы иметь повышенное связывание с аналогами нативного лиганда и пониженное связывание с нативным лигандом. В некоторых вариантах осуществления домен аптамера может происходить из семейства пуриновых рибопереключателей. В некоторых вариантах осуществления нативный лиганд может быть нуклеозидом или нуклеотидом, а аналог может быть нуклеозидным аналогом или нуклеотидным аналогом. В некоторых вариантах осуществления нуклеозидный аналог представляет собой противовирусное лекарственное средство. В иллюстративных вариантах осуществления изобретения домены аптамеров могут происходить из каркасов рибопереключателей 2'-дезоксигуанозина и гуанина, и полученные домены аптамеров могут демонстрировать пониженное связывание с 2'-дезоксигуанозином и гуанином по сравнению с рибопереключателем дикого типа.
[421] В некоторых вариантах осуществления рибопереключатель может регулировать доступность сплайсинг-донора pre-mRNA в конструкции ретровирусного гена, при этом ретровирусная конструкция управляет генами CAR или другими интересующими генами с обратной цепи под общим промотором или промотором, специфичным для Т-клеток. В других вариантах осуществления рибопереключатель может регулировать IRES в конструкции ретровирусного гена, при этом ретровирусная конструкция управляет трансляцией генов CAR или других представляющих интерес генов. В других вариантах осуществления рибопереключатель может контролировать терминацию транскрипции РНК, miRNA или транскриптов гена или может контролировать трансляцию транскрипта. В других вариантах осуществления рибопереключатель нуклеозидного аналога может быть интегрирован с рибозимом для ингибирования или усиления расщепления транскрипта генов CAR или других представляющих интерес генов в присутствии нуклеозидного аналога.
[422] В некоторых вариантах осуществления выделенный полинуклеотид для регуляции экспрессии целевого полинуклеотида, который включает полинуклеотид, кодирующий целевой полинуклеотид, функционально связанный с промотором, и рибопереключатель, который связывает противовирусный препарат, аналог нуклеозида, представляет собой вектор молекулярного клонирования. Вектор молекулярного клонирования может быть вектором молекулярного клонирования любого типа, известным в данной области техники. В качестве неограничивающих примеров вектор может представлять собой плазмиду, вирус, не способную к репликации вирусную частицу, ретровирус или не способную к репликации рекомбинантную ретровирусную частицу, любая из которых может представлять собой вектор экспрессии. Такой вектор экспрессии может кодировать любой из целевых полинуклеотидов, указанных выше. Один или несколько сайтов рестрикции и/или множественных сайтов клонирования могут быть включены в вектор молекулярного клонирования 5' или 3' к рибопереключателю, предусмотренному в данном документе, так что рибопереключатель функционально связан с целевым полинуклеотидом, вставленным в сайт рестрикции и/или множественного клонирования.
Молекулярные шапероны
[423] В одном аспекте в данном документе предоставляется способ генетической модификации и экспансии лимфоцитов субъекта, включающий:
A. приведение в контакт покоящихся Т-клеток и/или NK-клеток субъекта ex vivo, обычно без необходимости предварительной стимуляции ex vivo, с не способными к репликации рекомбинантными ретровирусными частицами, содержащими:
i. элемент псевдотипирования на своей поверхности, который способен связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембран с ними не способных к репликации рекомбинантных ретровирусных частиц; и
ii. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первого сконструированного сигнального полипептида, регулируемого элементом управления, при этом указанный первый сконструированный сигнальный полипептид содержит: по меньшей мере один лимфопролиферативный элемент и/или химерный антигенный рецептор,
где указанное приведение в контакт облегчает трансдукцию по меньшей мере некоторых из покоящихся Т-клеток и/или NK-клеток с помощью не способных к репликации рекомбинантных ретровирусных частиц, тем самым продуцируя генетически модифицированные Т-клетки и/или NK-клетки;
B. введение генетически модифицированных Т-клеток и/или NK-клеток субъекту; и
C. воздействие на генетически модифицированные Т-клетки и/или NK-клетки in vivo соединения, которое действует как элемент управления, влияя на экспрессию первого сконструированного сигнального полипептида и способствуя экспансии лимфоцитов in vivo, тем самым генетически модифицируя и экспандируя лимфоциты субъекта.
[424] В иллюстративных вариантах осуществления трансдукцию проводят без стимуляции ex vivo. В иллюстративных вариантах осуществления соединение представляет собой молекулярный шаперон, такой как низкомолекулярный молекулярный шаперон. В иллюстративных вариантах осуществления связывание молекулярного шаперона с лимфопролиферативным элементом и/или компонентом CAR увеличивает пролиферативную активность лимфопролиферативного элемента и/или CAR. Молекулярный шаперон можно вводить субъекту до сбора крови, во время контакта и/или после введения субъекту Т-клеток и/или NK-клеток. Некоторые варианты осуществления этого аспекта включают сбор крови у субъекта. В этих вариантах осуществления введение представляет собой повторное введение клеток, которые были собраны и генетически модифицированы перед повторным введением. Весь способ в иллюстративных вариантах осуществления является более коротким способом, чем способы предшествующего уровня техники, что касается других аспектов в данном документе. Например, весь способ может быть завершен менее чем за 48 часов, менее чем за 24 часа или менее чем за 12 часов. В других вариантах осуществления весь способ может быть завершен за 2, 4, 6 или 8 часов на нижней границе диапазона и за 12, 24, 36 или 48 часов на верхней границе диапазона.
[425] Соответственно, в некоторых вариантах осуществления способов и композиций, представленных в данном документе, элемент управления представляет собой молекулярный шаперон. По сравнению с другими вариантами осуществления в данном документе с другими элементами управления in vivo, такими как рибопереключатели, которые обычно связывают соединение, чтобы влиять на экспрессию лимфопролиферативного элемента или другого компонента первого или второго сконструированного сигнального полипептида, описанного в данном документе, молекулярные шапероны представляют собой соединения, которые являются контрольными. элементы и, как таковые, непосредственно влияют на активность, обычно путем связывания с лимфопролиферативным элементом или другим компонентом первого или второго сконструированного в данном документе сигнального полипептида. В иллюстративных примерах таких вариантов осуществления способов в данном документе, которые включают введение молекулярных шаперонов, лимфопролиферативный элемент, мембраносвязанный цитокин и/или компонент CAR может быть менее активным или неактивным лимфопролиферативным элементом, мембраносвязанным цитокином и/или компонент CAR, связанным с молекулярным шапероном для увеличения его активности. Таким образом, мишень, связанная с молекулярным шапероном, обычно является целевым полипептидом. В некоторых вариантах осуществления, как указано, полипептид может быть первым и/или вторым сконструированным сигнальным полипептидом или его полипептидным компонентом, на активность которого влияет связывание с молекулярным шапероном, который в иллюстративных вариантах осуществления является низкомолекулярным молекулярным шапероном. В некоторых вариантах осуществления полипептид может включать лимфопролиферативный элемент, активность которого регулируется, в иллюстративных вариантах осуществления повышается с помощью молекулярного шаперона, предпочтительно низкомолекулярного молекулярного шаперона. Молекулярный шаперон в способах, представленных в данном документе, может быть соединением, которое связывается с мутантным лимфопролиферативным элементом и/или неактивным компонентом CAR, тем самым делая их активными.
[426] В других вариантах осуществления лимфопролиферативный элемент или другой сигнальный домен был мутирован, чтобы обеспечить транзит к плазматической мембране только в присутствии низкомолекулярного синтетического шаперона. В других вариантах осуществления шаперон способствует стабильности лимфопролиферативного элемента или другого сигнального домена или белка и полужизни в качестве потенциатора.
[427] Будет понятно, что аспекты и варианты осуществления настоящего изобретения включают многие из тех же этапов и композиций, подробно описанных в данном документе. Соответственно, будет понятно, что идеи во всем этом описании, которые относятся к этим общим элементам, применимы к аспектам и вариантам осуществления, которые используют молекулярный шаперон в качестве элемента управления, который обычно напрямую связывает лимфопролиферативный элемент или другую целевую молекулу в дополнение к или вместо других элементов контроля in vivo, предусмотренных в данном документе, таких как рибопереключатели, которые обычно используют молекулу, такую как лекарственное средство, которое связывает рибопереключатель.
[428] В некоторых вариантах осуществления молекулярный шаперон представляет собой соединение, которое может регулировать субклеточную локализацию мишени, например, правильную укладку и транзит целевого белка, такого как лимфопролиферативный элемент и/или компонент CAR, от эндоплазматический ретикулум к плазматической мембране или период его полужизни на поверхности. В других вариантах осуществления молекулярный шаперон может способствовать функциональной конформации дисфункциональной мишени, таким образом действуя как потенциатор. Примеры молекул, которые действуют как шапероны или потенциаторы по отношению к естественно мутировавшим белкам, включают люмакафтор и ивакафтор. Эти белки действуют на мутантные варианты хлоридных каналов CFTR, такие как G551D или F508del. Ивакафтор усиливает активность мутантного ионного канала G551D или F508del, тогда как люмакафтор способствует стабилизации мутантных хлоридных каналов и последующему усилению действием ивакафтора. Такие шаперон-зависимые белки могут быть получены из естественно функциональных белков и проверяться на функциональную активность только в присутствии молекулярных шаперонов. Таким образом, такие белки активны только при наличии шаперона. Примеры таких молекул, которые могут быть подвергнуты скринингу на предмет специфической активности шаперонов, включают низкомолекулярные противовирусные или противоинфекционные средства, которые не проявляют активности по отношению к нормальным белкам человека. Соответственно, в одном варианте осуществления молекулярный шаперон, используемый в способах, описанных в данном документе, представляет собой низкомолекулярное противовирусное или противоинфекционное соединение, которое не проявляет активности по отношению к нормальным человеческим белкам.
[429] В некоторых вариантах осуществления могут подвергаться воздействию генетически модифицированные лимфоциты и/или субъекту может быть введен молекулярный шаперон. В некоторых вариантах осуществления соединение вводят субъекту до, во время и/или после выделения PBL из крови и до того, как Т-клетки и/или NK-клетки контактируют с неспособной к репликации рекомбинантной ретровирусной частицей. Не способная к репликации рекомбинантная ретровирусная частица в таких вариантах осуществления включает менее активный или неактивный лимфопролиферативный элемент и/или компонент CAR, который связывается с молекулярным шапероновым соединением и регулируется им.
[430] Для любого из вариантов осуществления, представленных в данном документе для модификации и увеличения лимфоцитов, которые могут быть частью методов адоптивной клеточной терапии, соединение можно вводить субъекту в течение 5, 10, 15, 30 и 60 минут на нижнем конце диапазона, и 1,5, 2, 3, 4, 5, 6, 8, 12 или 24 часа на верхнем конце диапазона, до выделения PBL из крови или до того, как Т-клетки и/или NK-клетки контактируют с не способной к репликации рекомбинантной ретровирусной частицей. В некоторых вариантах осуществления соединение вводят субъекту в течение 1,5, 2, 3, 4, 5, 6, 8, 12 или 24 часов на нижнем конце диапазона, ½, 1, 2, 3, 4, 5, 6, 7, 10, 14, 21 или 28 дней на верхнем конце диапазона, после выделения PBL из крови или после того, как Т-клетки и/или NK-клетки контактируют с не способной к репликации рекомбинантной ретровирусной частицей в способах, представленных в данном документе. В некоторых вариантах осуществления соединение вводят субъекту в течение по меньшей мере 1,5, 2, 3, 4, 5, 6, 8, 12 или 24 часов, или по меньшей мере 2, 3, 4, 5, 6, 7, 10, 14, 21 или 28 дней после выделения PBL из крови или после того, как Т-клетки и/или NK-клетки контактируют с не способной к репликации рекомбинантной ретровирусной частицей в способах, представленных в данном документе. В некоторых вариантах осуществления соединение вводят субъекту в течение по меньшей мере 1, 2, 3, 4, 5, 7, 10, 14, 21, 28, 30, 60, 90 или 120 дней или 5, 6, 9, 12, 24, 36, 48, 60, 72, 84, 96, 120 месяцев или неопределенно долго после повторного введения PBL в организм субъекта. В любом из вариантов осуществления, раскрытых в данном документе, соединение можно вводить до и/или во время повторного введения PBL и/или после повторного введения PBL.
[431] Для любого из вариантов осуществления настоящего изобретения молекулярные шапероны не входят в состав контрольных элементов, которые связаны соединениями, которые их регулируют и/или активируют. Молекулярные шапероны представляют собой соединения, предпочтительно низкомолекулярные соединения, которые являются контрольными элементами и регулируют активность лимфопролиферативных элементов и/или функциональных компонентов CAR.
ЛИНИИ ПАКУЮЩИХ КЛЕТОК/СПОСОБЫ ИЗГОТОВЛЕНИЯ РЕКОМБИНАНТНЫХ ВИРУСНЫХ ЧАСТИЦ
[432] Настоящее изобретение относится к пакующим клеткам млекопитающих и линиям пакующих клеток, которые продуцируют не способные к репликации рекомбинантные ретровирусные частицы. Линии клеток, которые продуцируют не способные к репликации рекомбинантные ретровирусные частицы, также называются в данном документе линиями пакующих клеток. Неограничивающий пример такого способа представлен в Примере 7 в данном документе. Клетки пакующйе клеточной линии могут представлять собой адгезивные или суспензионные клетки. В иллюстративных вариантах осуществления линия пакующих клеток может быть линией клеток суспензии, то есть линией клеток, которая не прикрепляется к поверхности во время роста. Клетки можно выращивать в среде определенного химического состава и/или в бессывороточной среде. В некоторых вариантах осуществления линия пакующих клеток может быть суспензионной клеточной линией, полученной из адгезивной клеточной линии, например, клеточная линия HEK293 может быть выращена в условиях для создания адаптированной к суспензии клеточной линии HEK293 в соответствии со способами, известными в данной области техники. Линия пакующих клеток обычно выращивается в среде с определенным химическим составом. В некоторых вариантах осуществления среда для линии пакующих клеток линии может включать сыворотку. В некоторых вариантах осуществления среда для линии пакующих клеток линий может включать заменитель сыворотки, как известно в данной области техники. В иллюстративных вариантах осуществления среда для линии пакующих клеток может представлять собой бессывороточную среду. Такая среда может быть химически определенным бессывороточным составом, произведенным в соответствии с действующими правилами надлежащей производственной практики (CGMP) Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Среда для линии пакующих клеток может не содержать ксенобиотиков и быть полной. В некоторых вариантах осуществления среда для линии пакующих клеток была одобрена регулирующими органами для использования в процессинге клеток ex vivo, например, одобренное FDA устройство 510(k). В данном документе будет понятно, где указано, что среда включает композицию базальной среды с дополнением к среде с каталожным номером, таким как A1048501 или A1048503, которое включает дополнение среды, что указанная композиция предназначена для обозначения композиции среды с добавленным добавкой. Как правило, при изготовлении носителя и добавки имеются инструкции по количеству добавляемой добавки.
[433] Соответственно, в одном аспекте в данном документе представлен способ создания не способной к репликации рекомбинантной ретровирусной частицы, включающий: A. Культивирование пакующей клетки в суспензии в бессывороточной среде, где пакующая клетка содержит последовательности нуклеиновых кислот, кодирующие упаковываемый геном РНК не способной к репликации ретровирусной частицы, белок REV, полипептид gag, полипептид pol и элемент псевдотипирования; и B. сбор не способных к репликации рекомбинантных ретровирусных частиц из бессывороточной среды. В другом аспекте в данном документе предусмотрен способ трансдукции лимфоцита не способной к репликации рекомбинантной ретровирусной частицей, включающий: А. культивирование пакующей клетки в суспензии в бессывороточной среде, где пакующая клетка содержит последовательности нуклеиновой кислоты, кодирующие упаковываемый геном РНК не способной к репликации ретровирусной частицы, белок REV, полипептид gag, полипептид pol и элемент псевдотипирования; B. сбор рекомбинантных ретровирусных частиц, не способных к репликации, из бессывороточной среды; и C. приведение в контакт лимфоцита с рекомбинантной ретровирусной частицей, не способной к репликации, при этом приведение в контакт осуществляется в течение менее 24 часов, 20 часов, 18 часов, 12 часов, 8 часов, 4 часов или 2 часов (или от 1, 2, 3 или 4 часов на нижнем конце диапазона до 4, 6, 8, 12, 18, 20 или 24 часов на верхнем конце диапазона), тем самым трансдуцируя лимфоцит.
[434] В другом аспекте в данном документе представлена ретровирусная пакующая система, включающая: клетку млекопитающего, содержащую: а) первый трансактиватор, экспрессируемый с конститутивного промотора и способный связывать первый лиганд, и первый индуцибельный промотор для воздействия на экспрессию функционально связанной последовательности с ним нуклеиновой кислоты в присутствии или отсутствии первого лиганда; b) второй трансактиватор, способный связывать второй лиганд и второй индуцибельный промотор и влиять на экспрессию функционально связанной с ним последовательности нуклеиновой кислоты в присутствии второго лиганда по сравнению с отсутствием; и c) упаковываемый геном РНК для ретровирусной частицы, где первый трансактиватор регулирует экспрессию второго трансактиватора, и где второй трансактиватор регулирует экспрессию ретровирусных полипептидов, участвующих в вирусной упаковке, таких как, например, полипептид gag, pol полипептид, и/или элемент псевдотипирования, и, возможно, другие полипептиды, которые будут включены в не способную к репликации рекомбинантную ретровирусную частицу или на нее и считаются токсичными для линий пакующих клеток, таких как, например, HEK-293. В некоторых аспектах второй трансактиватор сам по себе цитотоксичен для линий пакующих клеток. Элементы псевдотипирования обычно способны связываться с клеточной мембраной целевой клетки и способствовать слиянию с ней, как подробно обсуждается в данном документе. Таким образом, не ограничиваясь теорией, система обеспечивает способность накапливать определенные полипептиды/белки, которые не ингибируют, или существенно не ингибируют, или, как полагают, не ингибируют пролиферацию или выживание клеток млекопитающих, например, нетоксичных белков, при культивировании популяции клеток млекопитающих в течение нескольких дней или на неопределенный срок и контроле индукции полипептидов, которые желательны для ретровирусного продукта, но которые являются ингибирующими или могут быть ингибирующими, или, как сообщалось, ингибируют выживание и/или пролиферацию клетки млекопитающих, например, токсичные полипептиды, до более позднего времени, более близкого к тому времени, когда не способные к репликации рекомбинантные ретровирусные частицы будут продуцированы и собраны. Геном упаковываемой РНК обычно кодируется полинуклеотидом, функционально связанным с промотором, иногда для удобства называемым в данном документе третьим промотором, при этом указанный третий промотор обычно индуцируется либо первым трансактиватором, либо вторым трансактиватором. В иллюстративных вариантах осуществления геном упаковываемой РНК кодируется полинуклеотидом, функционально связанным с третьим промотором, при этом указанный третий промотор индуцируется вторым трансактиватором. Таким образом, упакованный геном РНК может быть получен в более поздний момент времени, ближе к тому времени, когда будут собраны не способные к репликации рекомбинантные ретровирусные частицы.
[435] Специалисту в данной области техники будет понятно, что в системе упаковки ретровирусов можно использовать множество различных трансактиваторов, лигандов и индуцибельных промоторов. Такие индуцибельные промоторы могут быть выделены и получены из многих организмов, например, эукариот и прокариот. Модификация индуцибельных промоторов, полученных из первого организма, для использования во втором организме, например, в первом прокариоте и втором эукариоте, первом эукариоте и втором прокариоте и т.д., хорошо известна в данной области техники. Такие индуцибельные промоторы и системы, основанные на таких индуцибельных промоторах, но также включающие дополнительные контрольные белки, включают без ограничения промоторы, регулируемые спиртом (например, промотор гена алкогольдегидрогеназы I (alcA), промоторы, реагирующие на белки-трансактиваторы алкоголя (AlcR) и т.д.), промоторы, регулируемые тетрациклином (например, промоторные системы, включая TetActivators, TetON, TetOFF и т.д.), промоторы, регулируемые стероидами (например, промоторные системы рецепторов глюкокортикоидов крыс, системы промоторов рецепторов эстрогенов человека, системы промоторов ретиноидов, системы промоторов щитовидной железы , промоторные системы экдизона, промоторные системы мифепристона и т.д.), промоторы, регулируемые металлами (например, промоторные системы металлотионеина и т.д.), регулируемые промоторы, связанные с патогенезом (например, промоторы, регулируемые салициловой кислотой, промоторы, регулируемые этиленом, промоторы, регулируемые бензотиадиазолом и т.д.), терморегулируемые промоторы (например, промоторы, индуцируемые тепловым шоком (например, HSP-70, HSP-90, промоторы теплового шока сои и др.), светорегулируемые промоторы, синтетические индуцибельные промоторы и тому подобное. В некоторых вариантах осуществления можно использовать систему, регулируемую мифепристоном. В некоторых вариантах осуществления можно использовать индуцируемую мифепристоном систему с ауторегуляторной петлей обратной связи. В некоторых вариантах осуществления регуляторный слитый белок GAL4 экспрессируется из одной конструкции, которая также содержит концевые повторы транспозона и сайты lox и FRT. В некоторых вариантах осуществления регуляторный слитый белок GAL4 контролирует экспрессию обратного тетрансактиватора (rtTA) и BiTRE. В некоторых вариантах осуществления другая конструкция с сайтами lox и FRT содержит восходящие активирующие последовательности GAL4 (UAS) и промотор E1b TATA-бокса, управляющий репортером, таким как mCherry. В некоторых вариантах осуществления регуляторный слитый белок GAL4 связывается с активирующими последовательностями (UAS) выше GAL4 как в промоторе, контролирующем экспрессию регуляторного слитого белка GAL4, так и в промоторе, контролирующем экспрессию целевого полинуклеотида. В некоторых вариантах осуществления мифепристон, доксициклин и пуромицин будут использоваться для индукции и отбора линии пакующих клеток.
[436] В некоторых вариантах осуществления один или оба трансактиватора можно разделить на два или более полипептидов. В некоторых вариантах осуществления два или более полипептида могут включать ДНК-связывающий домен и домена ктивации, способный стимулировать транскрипцию отдельных полипептидов. Этот «домен активации» не следует путать с «активирующим элементом», таким как полипептид, который связывает CD3, который способен активировать Т-клетку и/или NK-клетку, и обычно действительно активирует такие T-клетки и/или NK. ячейка при контакте с ней, как подробно обсуждается в данном документе. Отдельные полипептиды могут дополнительно включать слияния с полипептидами, способными к димеризации посредством добавления лиганда. В некоторых вариантах осуществления домен активации может представлять собой домен активации p65 или его функциональный фрагмент. В иллюстративных вариантах осуществления пакующих систем в данном документе ДНК-связывающий домен может быть ДНК-связывающим доменом из ZFHD1 или его функциональным фрагментом. В некоторых вариантах осуществления один полипептид может представлять собой слияние с FKBP или его функциональными мутантами и/или фрагментами, или несколько FKBP, и другой полипептид может представлять собой слияние с доменом FRB mTOR или функциональными мутантами и/или их фрагментами, и лиганд может представлять собой рапамицин или функциональный рапалог. В некоторых вариантах осуществления FRB содержит мутации K2095P, T2098L и/или W2101F. В некоторых вариантах осуществления отдельные полипептиды могут представлять собой FKBP или его функциональные фрагменты и кальценеврин A или его функциональные фрагменты, а димеризующим средством может быть FK506. В некоторых вариантах осуществления отдельные полипептиды могут представлять собой FKBP или его функциональные фрагменты и CyP-Fas или его функциональные фрагменты, а димеризующим средством может быть FKCsA. В некоторых вариантах осуществления отдельные полипептиды могут представлять собой GAI или его функциональные фрагменты и GID1 или его функциональные фрагменты, а димеризующим средством может быть гиббереллин. В некоторых вариантах осуществления отдельные полипептиды могут представлять собой Snap-tag и HaloTag или их функциональные фрагменты, а димеризующим средством может быть HaXS. В некоторых вариантах осуществления отдельные полипептиды могут включать один и тот же полипептид. Например, домен связывания ДНК и домен активации могут быть экспрессированы в виде слитых белков с FKBP или GyrB, а димеризующее средство может представлять собой FK1012 или кумермицин соответственно. В некоторых вариантах осуществления индуцибельный промотор может представлять собой последовательность ДНК, с которой обычно связывается ДНК-связывающий домен. В некоторых вариантах осуществления индуцибельный промотор может отличаться от последовательности ДНК, с которой обычно связывается ДНК-связывающий домен. В некоторых вариантах осуществления трансактиватор может представлять собой rtTA, лиганд может представлять собой тетрациклин или доксициклин, а индуцибельный промотор может представлять собой TRE. В иллюстративных вариантах осуществления первый трансактиватор представляет собой домен активации p65, слитый с FRB, и ДНК-связывающий домен ZFHD1, слитый с тремя полипептидами FKBP, и первый лиганд представляет собой рапамицин. В дополнительных иллюстративных вариантах осуществления второй трансактиватор может представлять собой rtTA, второй лиганд может представлять собой тетрациклин или доксициклин, а индуцибельный промотор может представлять собой TRE.
[437] В некоторых вариантах осуществления первый трансактиватор может регулировать экспрессию элемента, чтобы контролировать ядерный экспорт транскриптов, содержащих консенсусную последовательность, такую как HIV Rev, и консенсусная последовательность может быть элементом ответа Rev. В иллюстративных вариантах осуществления целевая клетка представляет собой Т-клетку.
[438] В некоторых вариантах осуществления элемент псевдотипирования представляет собой полипептид ретровирусной оболочки. Элемент псевдотипирования обычно включает связывающий полипептид и слитый полипептид для связывания и облегчения слияния мембран целевой клетки и вирусных мембран, как более подробно обсуждается в данном документе. В некоторых вариантах осуществления элемент псевдотипирования представляет собой оболочечный белок эндогенного вируса кошек (RD114), белок амфотропной оболочки онкоретровирусов, белок экотропной оболочки онкоретровирусов и/или оболочечный белок вируса везикулярного стоматита (VSV-G). В иллюстративных вариантах осуществления элемент псевдотипирования включает связывающий полипептид и слитый полипептид, происходящий из различных белков, как более подробно обсуждается в данном документе. Например, в иллюстративном варианте осуществления, особенно когда целевая клетка представляет собой Т-клетку и/или NK-клетку, связывающий полипептид представляет собой полипептид гемагглютинина (H) вируса кори (такого как штамм вируса кори Эдмонстона), или его вариант с делецией цитоплазматического домена и другой слитый полипептид представляет собой слитый (F) полипептид вируса кори (такого как штамм вируса кори Эдмонстона) или его вариант с делецией цитоплазматического домена. В некоторых вариантах осуществления слитый полипептид может включать несколько элементов, экспрессируемых как один полипептид. В некоторых вариантах осуществления связывающий полипептид и слитый полипептид можно транслировать с одного и того же транскрипта, но с разных сайтов связывания рибосом, или полипептид расщепляется после трансляции с использованием сигнала расщепления пептида или последовательности с рибосомным проскоком, как описано в другом месте в данном документе, для создания связывающего полипептида и слитого полипептида. В некоторых вариантах осуществления, когда связывающий полипептид представляет собой полипептид H вируса кори или его делецию цитоплазматического домена, а слитый полипептид представляет собой полипептид вируса кори F или его делецию цитоплазматического домена, трансляция полипептидов F и H из отдельной рибосомы сайты связывания приводят к большему количеству полипептида F по сравнению с полипептидом Н. В некоторых вариантах осуществления соотношение полипептидов F (или их делеций цитоплазматического домена) к полипептидам H (или их делеций цитоплазматического домена) составляет по меньшей мере 2:1, по меньшей мере 3:1, по меньшей мере 4:1, по меньшей мере 5:1, не менее 6:1, по меньшей мере 7:1 или по меньшей мере 8:1.
[439] В некоторых вариантах осуществления первый трансактиватор может регулировать экспрессию активационного элемента, способного связываться с целевой клеткой, такой как Т-клетка или NK-клетка, и активировать ее. Любой из активирующих элементов, раскрытых в данном документе, может быть экспрессирован. Например, в этих вариантах осуществления активирующий элемент может включать: а.) мембраносвязанный полипептид, способный связываться с CD3 и активировать его; и/или b.) мембраносвязанный полипептид, способный связываться с CD28 и активировать его. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связываться с CD3 и активировать его, может быть антителом к CD3. В дополнительных вариантах осуществления антитело к CD3 может представлять собой scFvFc к CD3. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связываться с CD28 и активировать его, представляет собой CD80, CD86 или их функциональные фрагменты, такие как внеклеточный домен CD80.
[440] В некоторых вариантах осуществления второй трансактиватор может регулировать экспрессию упаковываемого генома РНК, который может включать РНК, кодирующую один или несколько целевых полипептидов, включая в качестве неограничивающего примера любой из сконструированных сигнальных полипептидов, раскрытых в данном документе, и/или один или больше (например, две или более) ингибирующих молекул РНК. Следует отметить, что предполагается, что аспект ретровирусной пакующей системы и способ создания не способной к репликации рекомбинантной ретровирусной частицы не ограничиваются созданием не способных к репликации рекомбинантных ретровирусных частиц для трансдукции Т-клеток и/или NK-клеток, но скорее для любого типа клеток, которые могут быть трансдуцированы путем репликации не способных рекомбинантных ретровирусных частиц. Геном упаковываемой РНК, в некоторых иллюстративных вариантах осуществления, предназначен для экспрессии одного или нескольких целевых полипептидов, включая в качестве неограничивающего примера любой из сконструированных сигнальных полипептидов, раскрытых в данном документе, и/или одну или несколько (например, две или более) ингибирующих РНК. молекулы в противоположной ориентации (например, кодирующие на противоположной цепи и в противоположной ориентации) из ретровирусных компонентов, таких как gag и pol. Например, упакованный геном РНК может включать от 5' до 3': 5' длинный концевой повтор или его активный усеченный фрагмент; последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК; последовательность нуклеиновой кислоты, кодирующая первый и, необязательно, второй целевой полипептид, такой как, но без ограничения сконструированный (сконструированные) сигнальный (сигнальные) полипептид (полипептиды) в противоположной ориентации, который может отводиться от промотора в этой противоположной ориентации по отношению к длине 5' концевой повтор и цис-действующий упаковывающий элемент РНК, который в некоторых вариантах осуществления называется «четвертым» промотором только для удобства (и иногда упоминается в данном документе как промотор, активный в Т-клетках и/или NK-клетках), который активен в целевой клетке, такой как Т-клетка и/или NK-клетка, но в иллюстративных примерах не активен в упаковывающей клетке или только индуцибельно или минимально активен в упаковывающей клетке; и 3' длинный концевой повтор или его активный усеченный фрагмент. В некоторых вариантах осуществления упакованный геном РНК может включать элемент центрального полипуринового тракта (cPPT)/центральной терминирующей последовательности (CTS). В некоторых вариантах осуществления цис-действующий пакующий элемент РНК ретровируса может представлять собой HIV Psi. В некоторых вариантах осуществления пакующий элемент цис-действующей РНК ретровируса может представлять собой элемент ответа Rev. Сконструированный сигнальный полипептид, управляемый промотором в противоположной ориентации от 5' длинного концевого повтора, в иллюстративных вариантах осуществления представляет собой один или несколько сконструированных сигнальных полипептидов, описанных в данном документе, и может необязательно экспрессировать одну или несколько молекул ингибирующей РНК, как описано более подробно в данном документе.
[441] Следует понимать, что номер промотора, такой как первый, второй, третий, четвертый и т.д. промотор, дан только для удобства. Промотор, который называется «четвертым» промотором, не следует понимать как подразумевающий наличие каких-либо дополнительных промоторов, таких как первый, второй или третий промоторы, если только такие другие промоторы не указаны явно. Следует отметить, что каждый из промоторов способен управлять экспрессией транскрипта в клетках соответствующего типа, и такой транскрипт образует транскрипционную единицу.
[442] В некоторых вариантах осуществления сконструированный сигнальный полипептид может включать первый лимфопролиферативный элемент. Подходящие лимфопролиферативные элементы раскрыты в других разделах данного документа. В качестве неограничивающего примера лимфопролиферативный элемент может быть выражен как слияние с доменом распознавания, таким как eTag, как раскрыто в данном документе. В некоторых вариантах осуществления упакованный геном РНК может дополнительно включать последовательность нуклеиновой кислоты, кодирующую второй сконструированный полипептид, включающий рецептор химерного антигена, кодирующий любой вариант CAR, представленный в данном документе. Например, второй сконструированный полипептид может включать первую антиген-специфическую нацеленную область, первый трансмембранный домен и первый внутриклеточный активирующий домен. Примеры антигенспецифических нацеленных областей, трансмембранных доменов и внутриклеточных активирующих доменов раскрыты в других местах в данном документе. В некоторых вариантах осуществления, где целевая клетка представляет собой Т-клетку, промотор, который активен в целевой клетке, активен в Т-клетке, как раскрыто в другом месте в данном документе.
[443] В некоторых вариантах осуществления сконструированный сигнальный полипептид может включать CAR, а последовательность нуклеиновой кислоты может кодировать любой вариант осуществления CAR, представленный в данном документе. Например, сконструированный полипептид может включать первую антигенспецифическую нацеленную область, первый трансмембранный домен и первый внутриклеточный активирующий домен. Примеры антигенспецифических нацеленных областей, трансмембранных доменов и внутриклеточных активирующих доменов раскрыты в других местах в данном документе. В некоторых вариантах осуществления геном упаковываемой РНК может дополнительно включать последовательность нуклеиновой кислоты, кодирующую второй сконструированный полипептид. В некоторых вариантах осуществления второй сконструированный полипептид может быть лимфопролиферативным элементом. В некоторых вариантах осуществления, где целевая клетка представляет собой Т-клетку или NK-клетку, промотор, который активен в целевой клетке, активен в Т-клетке или NK-клетке, как раскрыто в другом месте в данном документе.
[444] В некоторых вариантах осуществления геном упаковываемой РНК может дополнительно включать рибопереключатель, как обсуждается в других разделах данного документа. В некоторых вариантах осуществления последовательность нуклеиновой кислоты, кодирующая сконструированный сигнальный полипептид, может иметь обратную ориентацию. В дополнительных вариантах осуществления геном упаковываемой РНК может дополнительно включать рибопереключатель и, необязательно, рибопереключатель может иметь обратную ориентацию. В любом из вариантов осуществления, раскрытых в данном документе, полинуклеотид, включающий любой из элементов, может включать сайт связывания праймера. В иллюстративных вариантах осуществления блокаторы транскрипции или последовательности полиА-хвоста могут быть размещены рядом с генами для предотвращения или уменьшения нерегулируемой транскрипции. В любом из раскрытых в данном документе вариантов осуществления последовательность нуклеиновой кислоты, кодирующая Vpx, может находиться на второй или необязательной третьей транскрипционной единице или на дополнительной транскрипционной единице, которая функционально связана с первым индуцибельным промотором.
[445] В другом аспекте в данном документе представлена линия пакующих клеток млекопитающих, содержащая упаковываемый геном РНК для не способной к репликации ретровирусной частицы, при этом указанный упаковываемый геном РНК содержит:
a. 5' длинный концевой повтор или его активный фрагмент;
b. последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК;
c. полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, где первая последовательность нуклеиновой кислоты одной или нескольких нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК направлена против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен; и
d. 3' длинный концевой повтор или его активный фрагмент.
[446] Молекулы ингибирующей РНК в вышеуказанном аспекте могут включать любую из молекул ингибирующей РНК, в качестве неограничивающих примеров, shRNA или miRNA, представленные в других разделах настоящего изобретения.
[447] В некоторых вариантах осуществления аспекта линии пакующих клеток млекопитающих полинуклеотид по (c) может иметь обратную ориентацию по отношению к последовательности нуклеиновой кислоты, кодирующей ретровирусный цис-действующий упаковывающий элемент РНК (b), 5' длинный концевой повтор (a) и/или трехкратный конец терминального повтора (d).
[448] В некоторых вариантах осуществления аспекта линии пакующих клеток млекопитающих экспрессия генома упаковываемой РНК управляется индуцибельным промотором, активным в линии пакующих клеток млекопитающих.
[449] Промотор, активный в Т-клетках и/или NK-клетках, который управляет экспрессией индуцибельной РНК и CAR в этих аспектах, представленных непосредственно выше, в иллюстративных вариантах осуществления не активен или является минимально или индуцибельно активным в линии пакующих клеток. Этот промотор, активный в Т-клетках и/или NK-клетках в иллюстративных вариантах осуществления, расположен в геноме упаковываемой РНК между нуклеиновыми кислотами, кодирующими одну (например, две) или несколько индуцибельных РНК, и CAR и 3' LTR.
[450] В любом из аспектов, относящихся к упаковываемым клеткам или клеточным линиям в данном документе, которые кодируют одну или несколько молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, по меньшей мере одна, а в некоторых вариантах осуществления все молекулы ингибиторной РНК могут включать 5' нить и 3' нить, которые частично или полностью комплементарны друг другу, при этом указанная 5' нить и указанная 3' нить способны образовывать дуплекс РНК из 18-25 нуклеотидов. В некоторых вариантах осуществления 5' нить может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов, а 3' нить может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления 5' нить и 3' нить могут иметь одинаковую или разную длину. В некоторых вариантах осуществления дуплекс РНК может содержать одно или несколько ошибочно спаренных оснований. В альтернативных вариантах осуществления дуплекс РНК не имеет ошибочно спаренных оснований.
[451] В любом из аспектов, представленных непосредственно выше, направленных на упаковываемые клетки или клеточные линии в данном документе, которые кодируют молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК, молекула ингибирующей РНК может представлять собой miRNA или shRNA. В некоторых вариантах осуществления ингибирующая молекула может представлять собой предшественник miRNA, такой как, например, Pri-miRNA или Pre-miRNA, или предшественник shRNA. В некоторых вариантах осуществления одна или несколько ингибирующих молекул РНК могут представлять собой искусственно полученную miRNA или shRNA. В других вариантах осуществления молекула ингибирующей РНК может представлять собой dsRNA (транскрибированную или искусственно введенную), которая процессируется в siRNA или представляет собой саму siRNA. В некоторых вариантах осуществления молекула ингибирующей РНК может представлять собой miRNA или shRNA, последовательность которых не встречается в природе, или имеет по меньшей мере один функциональный сегмент, который не встречается в природе, или комбинацию функциональных сегментов, которые не встречаются в природе. В иллюстративных вариантах осуществления по меньшей мере одна или все молекулы ингибирующей РНК представляют собой miR-155.
[452] В любом из аспектов, представленных непосредственно выше, направленных на упаковываемые клетки или клеточные линии в данном документе, которые кодируют молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК, одна или несколько молекул ингибирующей РНК, в некоторых вариантах осуществления, могут включать ориентацию от 5' до 3': 5' плечо, 5' стебель, петля, 3' стебель, который частично или полностью дополняет упомянутый 5' стебель, и 3' стебель. В некоторых вариантах осуществления по меньшей мере одна из двух или более молекул ингибирующей РНК имеет такое расположение. В других вариантах осуществления все из двух или более ингибирующих молекул РНК имеют такое расположение. В некоторых вариантах осуществления 5' стебель может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления 3' стебель может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления петля может иметь длину 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24,2 5, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба происходят из встречающейся в природе miRNA. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба являются производными встречающейся в природе miRNA, выбранной из группы, состоящей из miR-155, miR-30, miR-17-92, miR-122 и miR-21. В иллюстративных вариантах осуществления 5' плечо, 3' плечо или оба происходят от miR-155. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба происходят от miR-155 Mus musculus или miR-155 Homo sapiens. В некоторых вариантах осуществления 5' плечо имеет последовательность, указанную в SEQ ID NO: 256, или ее функциональный вариант, такой как, например, последовательность, имеющая ту же длину, что и SEQ ID NO: 256, или 95%, 90%, 85%, 80%, 75% или 50% при условии, что SEQ ID NO: 256, или составляет 100 нуклеотидов или меньше, 95 нуклеотидов или меньше, 90 нуклеотидов или меньше, 85 нуклеотидов или меньше, 80 нуклеотидов или меньше, 75 нуклеотидов или меньше, 70 нуклеотидов или меньше, 65 нуклеотидов или меньше, 60 нуклеотидов или меньше, 55 нуклеотидов или меньше, 50 нуклеотидов или меньше, 45 нуклеотидов или меньше, 40 нуклеотидов или меньше, 35 нуклеотидов или меньше, 30 нуклеотидов или меньше, или 25 нуклеотидов или меньше; и по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична SEQ ID NO: 256. В некоторых вариантах осуществления 3' плечо имеет последовательность, указанную в SEQ ID NO: 260, или ее функциональный вариант, такой как, например, той же длины, что и SEQ ID NO: 260, или 95%, 90%, 85%, 80%, 75% или 50% при условии, что SEQ ID NO: 260, или представляет собой последовательность, которая имеет 100 нуклеотидов или меньше, 95 нуклеотидов или меньше, 90 нуклеотидов или меньше, 85 нуклеотидов или меньше, 80 нуклеотидов или меньше, 75 нуклеотидов или меньше, 70 нуклеотидов или меньше, 65 нуклеотидов или меньше, 60 нуклеотидов или меньше, 55 нуклеотидов или меньше, 50 нуклеотидов или меньше, 45 нуклеотидов или меньше, 40 нуклеотидов или меньше, 35 нуклеотидов или меньше, 30 нуклеотидов или меньше, или 25 нуклеотидов или меньше; и по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична SEQ ID NO: 260. В некоторых вариантах осуществления 3' плечо содержит нуклеотиды 221-283 BIC Mus musculus.
[453] В другом аспекте в данном документе представлен способ создания не способных к репликации рекомбинантных ретровирусных частиц, включая: культивирование популяции пакующих клеток для накопления первого трансактиватора, при этом пакующие клетки включают первый трансактиватор, экспрессируемый с конститутивного промотора, при этом первый трансактиватор представляет собой способность связывать первый лиганд и первый индуцибельный промотор для воздействия на экспрессию функционально связанной с ним последовательности нуклеиновой кислоты в присутствии или отсутствии первого лиганда, и при этом экспрессия второго трансактиватора регулируется первым трансактиватором; инкубация популяции пакующих клеток, включая накопленный первый трансактиватор, в присутствии первого лиганда для накопления второго трансактиватора, при этом второй трансактиватор способен связывать второй лиганд и второй индуцибельный промотор для воздействия на экспрессию функционально связанной с ним последовательности нуклеиновой кислоты в присутствии или отсутствии второго лиганда; и инкубацию популяции упаковывающих клеток, включая накопленный второй трансактиватор, в присутствии второго лиганда, тем самым вызывая экспрессию ретровирусных полипептидов, участвующих в вирусной упаковке, таких как, например, полипептид gag, полипептид pol и/или элемент псевдотипирования, и, возможно, другие полипептиды, которые, как считается, ингибируют пролиферацию или выживание клеток млекопитающих, которые будут включены в не способную к репликации рекомбинантную ретровирусную частицу или на нее, тем самым получая не способную к репликации рекомбинантную ретровирусную частицу. В иллюстративных вариантах осуществления упаковываемый геном РНК кодируется полинуклеотидом, функционально связанным с промотором, иногда называемым для удобства «третьим» промотором, где указанный третий промотор либо конститутивно активен, либо индуцируется либо первым трансактиватором, либо, в иллюстративных вариантах осуществления, второй трансактиватор, тем самым получая не способную к репликации рекомбинантную ретровирусную частицу. Элементы псевдотипирования обычно способны связываться с клеточной мембраной целевой клетки и способствовать слиянию мембраны целевой клетки с мембраной не способной к репликации рекомбинантной ретровирусной частицы. Элементами псевдотипирования могут быть любые белки оболочки, известные в данной области техники.. В некоторых вариантах осуществления белок оболочки может представлять собой белок оболочки вируса везикулярного стоматита (VSV-G), белок оболочки эндогенного вируса кошек (RD114), белок амфотропной оболочки онкоретровирусов и/или белок экотропной оболочки онкоретровирусов. Специалисту в данном области техники будет понятно, что в способе создания не способной к репликации рекомбинантной ретровирусной частицы можно использовать множество различных трансактиваторов, лигандов и индуцибельных промоторов. Подходящие трансактиваторы, лиганды и индуцибельные промоторы раскрыты в других местах в данном документе, в том числе выше. Специалисту в данной области техники далее будет понятно, что вышеизложенные идеи, относящиеся к аспекту ретровирусной упаковочной системы, предоставленному в данном документе, также применимы к способу создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, и наоборот.
[454] В некоторых вариантах осуществления первый трансактиватор может регулировать экспрессию элемента, чтобы контролировать ядерный экспорт транскриптов, содержащих консенсусную последовательность, такую как HIV Rev, и консенсусная последовательность может быть элементом ответа Rev (RRE). В иллюстративных вариантах осуществления целевая клетка обычно представляет собой Т-клетку. В некоторых вариантах осуществления RRE HIV и полинуклеотидная область, кодирующая Rev HIV, могут быть заменены RRE HIV-2 и полинуклеотидной областью, кодирующей HIV-2 Rev соответственно. В некоторых вариантах осуществления RRE HIV и полинуклеотидная область, кодирующая Rev HIV, могут быть заменены на RRE SIV и полинуклеотидную область, кодирующую Rev SIV соответственно. В некоторых вариантах осуществления RRE HIV и полинуклеотидная область, кодирующая Rev HIV, могут быть заменены RemRE и полинуклеотидной областью, кодирующей бета-ретровирус Rem соответственно. В некоторых вариантах осуществления RRE HIV и полинуклеотидная область, кодирующая Rev HIV, могут быть заменены дельтаретровирусом RexRRE и полинуклеотидной областью, кодирующей дельтаретровирус Rex соответственно. В некоторых вариантах осуществления Rev-подобный белок не требуется, и RRE могут быть заменены цис-действующими элементами РНК, такими как конститутивный транспортный элемент (CTE).
[455] В некоторых вариантах осуществления элемент псевдотипирования представляет собой белок оболочки вируса. Элемент псевдотипирования обычно включает связывающий полипептид и слитый полипептид для связывания и облегчения слияния мембран вирусных и целевых клеточных мембран. В некоторых вариантах осуществления элемент псевдотипирования может представлять собой оболочечный белок эндогенного вируса кошек (RD114), белок амфотропной оболочки онкоретровирусов, белок экотропной оболочки онкоретровирусов и/или оболочечный белок вируса везикулярного стоматита (VSV-G). В иллюстративных вариантах осуществления элемент псевдотипирования включает связывающий полипептид и слитый полипептид, происходящий из различных белков, как более подробно обсуждается в данном документе. Например, в иллюстративном варианте осуществления, особенно когда клетка-мишень представляет собой Т-клетку и/или NK-клетку, связывающий полипептид может представлять собой вариант делеции цитоплазматического домена полипептида вируса кори H, а слитый полипептид может быть вариантом делеции цитоплазматического домена. полипептида вируса кори F. В некоторых вариантах осуществления слитый полипептид может включать несколько элементов, экспрессируемых как один полипептид. В некоторых вариантах осуществления связывающий полипептид и слитый полипептид можно транслировать с одного и того же транскрипта и транслировать с разных сайтов связывания рибосом, или полипептид может расщепляться после трансляции с использованием сигнала расщепления пептида или последовательности с рибосомным проскоком, как описано в другом месте в данном документе, для создания связывающего полипептида и слитого полипептида. В некоторых вариантах осуществления трансляция связывающего полипептида и слитого полипептида с отдельных сайтов связывания рибосом приводит к большему количеству слитого полипептида по сравнению со связывающим полипептидом. В некоторых вариантах осуществления соотношение слитого полипептида к связывающему полипептиду составляет по меньшей мере 2:1, по меньшей мере 3:1, по меньшей мере 4:1, по меньшей мере 5:1, по меньшей мере 6:1, по меньшей мере 7:1 или по меньшей мере 8:1.
[456] В некоторых вариантах осуществления первый трансактиватор может регулировать экспрессию активационного элемента, способного связываться с целевой клеткой, такой как Т-клетка, и активировать ее. В этих вариантах осуществления активирующий элемент может включать: а.) мембраносвязанный полипептид, способный связываться с CD3 и активировать его; и/или b.) мембраносвязанный полипептид, способный связываться с CD28 и активировать его. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связываться с CD28 и активировать его, представляет собой CD80, CD86 или их функциональные фрагменты. В некоторых вариантах осуществления не способная к репликации рекомбинантная ретровирусная частица может включать активирующий элемент на ретровирусной мембране и ретровирусную РНК внутри нуклеокапсида, тем самым получая не способные к репликации рекомбинантные ретровирусные частицы.
[457] В некоторых вариантах осуществления второй трансактиватор может регулировать экспрессию РНК, включая от 5' до 3': 5' длинный концевой повтор или его активный усеченный фрагмент; последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК; последовательность нуклеиновой кислоты, кодирующую первый целевой полипептид и необязательный второй целевой полипептид, в качестве неограничивающего примера один или два сконструированных сигнальных полипептида; промотор, активный в целевой клетке; и 3' длинный концевой повтор или его активный усеченный фрагмент. В некоторых вариантах осуществления РНК может включать элемент cPPT/CTS. В некоторых вариантах осуществления РНК может включать сайт связывания праймера. В некоторых вариантах осуществления цис-действующий упаковывающий элемент РНК ретровируса может представлять собой Psi HIV. В некоторых вариантах осуществления пакующий элемент цис-действующей РНК ретровируса может представлять собой элемент ответа Rev. В любом из вариантов осуществления, раскрытых в данном документе, ретровирусные компоненты на РНК, включая RRE и Psi, могут быть расположены в любом положении, как поймет квалифицированный специалист. Сконструированный сигнальный полипептид в иллюстративных вариантах осуществления представляет собой один или несколько сконструированных сигнальных полипептидов, описанных в данном документе.
[458] В некоторых вариантах осуществления сконструированный сигнальный полипептид может включать первый лимфопролиферативный элемент. Подходящие лимфопролиферативные элементы раскрыты в других разделах данного документа. В некоторых иллюстративных вариантах осуществления лимфопролиферативный элемент представляет собой мутант рецептора IL-7, слитый с доменом распознавания, таким как eTag. В некоторых вариантах осуществления упакованный геном РНК может дополнительно включать последовательность нуклеиновой кислоты, кодирующую второй сконструированный полипептид, включающий рецептор химерного антигена, кодирующий любой вариант CAR, представленный в данном документе. Например, второй сконструированный полипептид может включать первую антиген-специфическую нацеленную область, первый трансмембранный домен и первый внутриклеточный активирующий домен. Примеры антигенспецифических нацеленных областей, трансмембранных доменов и внутриклеточных активирующих доменов раскрыты в других местах в данном документе. В некоторых вариантах осуществления, где целевая клетка представляет собой Т-клетку, промотор, который активен в целевой клетке, активен в Т-клетке, как раскрыто в другом месте в данном документе.
[459] В некоторых вариантах осуществления геном упаковываемой РНК может дополнительно включать рибопереключатель, как обсуждается в других разделах данного документа. В некоторых вариантах осуществления последовательность нуклеиновой кислоты, кодирующая сконструированный сигнальный полипептид, может иметь обратную ориентацию. В дополнительных вариантах осуществления геном упаковываемой РНК может дополнительно включать рибопереключатель и, необязательно, рибопереключатель может иметь обратную ориентацию. В любом из вариантов осуществления, раскрытых в данном документе, полинуклеотид, включающий любой из элементов, может включать сайт связывания праймера. В иллюстративных вариантах осуществления блокаторы транскрипции или последовательности полиА-хвоста могут быть размещены рядом с генами для предотвращения или уменьшения нерегулируемой транскрипции. В любом из раскрытых в данном документе вариантов осуществления последовательность нуклеиновой кислоты, кодирующая Vpx, может находиться на второй или необязательной третьей транскрипционной единице или на дополнительной транскрипционной единице, которая функционально связана с первым индуцибельным промотором.
[460] В некоторых вариантах осуществления упаковочной системы или способов создания аспектов не способных к репликации рекомбинантных ретровирусных частиц, кодируемая РНК может включать интрон, который может быть транскрибирован, например, с того же промотора для экспрессии целевого (целевых) полипептида (полипептидов). Такой интрон может кодировать 1, 2, 3 или 4 miRNA в некоторых иллюстративных вариантах осуществления. В этих и других вариантах осуществления упаковочной системы или способов создания аспектов не способных к репликации рекомбинантных ретровирусных частиц размер упаковываемого генома РНК составляет 11000 KB или меньше, а в некоторых случаях 10000 KB или меньше.
[461] В некоторых вариантах осуществления первый трансактиватор может влиять на экспрессию одного или нескольких нетоксичных полипептидов. В некоторых вариантах осуществления второй трансактиватор может влиять на экспрессию одного или нескольких токсичных полипептидов. Например, первый трансактиватор может индуцировать экспрессию ретровирусных белков Rev и Vpx в дополнение к полипептидам, которые будут транспортироваться к клеточной мембране пакующей клетки, а второй трансактиватор может индуцировать экспрессию ретровирусных белков GAG, POL, MV(Ed)-FΔ30, и либо MV(Ed)-HΔ18 либо MV(Ed)-HΔ24, и экспрессию лентивирусного генома. В некоторых вариантах осуществления первый трансактиватор может влиять на экспрессию одного или нескольких полипептидов, которые являются токсичными, и/или второй трансактиватор может влиять на экспрессию одного или нескольких нетоксичных полипептидов.
[462] В другом аспекте в данном документе представлена пакующая клетка млекопитающего, содержащая: a.) первую транскрипционную единицу в геноме пакующей клетки млекопитающего, включая последовательность нуклеиновой кислоты, кодирующую первый трансактиватор, при этом указанная первая транскрипционная единица функционально связана с конститутивный промотор, и при этом указанный трансактиватор способен связывать первый индуцибельный промотор и влиять на экспрессию функционально связанной с ним последовательности нуклеиновой кислоты в присутствии первого лиганда по сравнению с отсутствием, и где указанный первый трансактиватор способен связывать указанный первый лиганд; b.) вторую и необязательную третью транскрипционную единицу в геноме пакующей клетки млекопитающего, включая последовательность нуклеиновой кислоты, кодирующую ретровирусный белок REV, и последовательность нуклеиновой кислоты, кодирующую второй трансактиватор, способный связывать второй индуцибельный промотор и влиять на экспрессию последовательность нуклеиновой кислоты, функционально связанная с ней в присутствии или отсутствии второго лиганда, где второй трансактиватор способен связывать второй лиганд, и где вторая и необязательная третья транскрипционные единицы функционально связаны с первым индуцибельным промотором; c.) четвертую и необязательную пятую транскрипционную единицу в геноме пакующей клетки млекопитающего, включая последовательность нуклеиновой кислоты, кодирующую ретровирусный полипептид gag и ретровирусный полипептид pol, а также связывающий полипептид и фузогенный полипептид, которые способны связываться с и облегчение слияния мембраны клетки-мишени и ретровирусной мембраны, где четвертая и необязательная пятая транскрипционная единица функционально связаны со вторым индуцибельным промотором; и d) шестую транскрипционную единицу в геноме упаковывающей клетки млекопитающего, включая от 5' до 3', 5'-LTR или его активный усеченный фрагмент, последовательность нуклеиновой кислоты, кодирующую цис-действующий ретровирусный упаковывающий элемент РНК, элемент cPPT/CTS, обратный комплемент последовательности нуклеиновой кислоты, кодирующей сконструированный сигнальный полипептид, интрон, промотор, который активен в целевой клетке, и его 3' LTR или его активный усеченный фрагмент, при этом шестая транскрипционная единица функционально связан со вторым индуцибельным промотором.
[463] В другом аспекте в данном документе предоставляется способ создания не способной к репликации рекомбинантной ретровирусной частицы, включающий: 1.) культивирование популяции упаковывающих клеток для накопления первого трансактиватора, при этом пакующие клетки содержат: a.) первую транскрипционную единицу в геноме упаковывающей клетки млекопитающего, включая последовательность нуклеиновой кислоты, кодирующую первый трансактиватор, где указанная первая транскрипционная единица функционально связана с конститутивным промотором, и указанный трансактиватор способен связывать первый индуцибельный промотор и влиять на экспрессию функционально связанной с ним последовательности нуклеиновой кислоты в присутствии первого лиганда по сравнению с отсутствием, и где указанный первый трансактиватор способен к связывание указанного первого лиганда; b) вторую и необязательную третью транскрипционную единицу в геноме пакующей клетки млекопитающего, включая последовательность нуклеиновой кислоты, кодирующую ретровирусный белок REV, и последовательность нуклеиновой кислоты, кодирующую второй трансактиватор, способный связывать второй индуцибельный промотор и влиять на экспрессию последовательность нуклеиновой кислоты, функционально связанная с ней в присутствии или отсутствии второго лиганда, где второй трансактиватор способен связывать второй лиганд, и где вторая и необязательная третья транскрипционные единицы функционально связаны с первым индуцибельным промотором; c.) четвертую и необязательную пятую транскрипционную единицу в геноме упаковывающей клетки млекопитающего, включая последовательность нуклеиновой кислоты, кодирующую ретровирусный полипептид gag и ретровирусный полипептид pol, а также связывающий полипептид и фузогенный полипептид, которые способны связываться с и облегчение слияния ретровирусной мембраны с мембраной клетки-мишени, где четвертая и необязательная пятая транскрипционная единица функционально связаны со вторым индуцибельным промотором; и d.) шестую транскрипционную единицу в геноме пакующей клетки млекопитающего, включая от 5' до 3' 5' LTR или его активный усеченный фрагмент, сайт связывания праймера (PBS), последовательность нуклеиновой кислоты, кодирующую ретровирусный цис-действующий упаковывающий элемент РНК, элемент cPPT/CTS, обратный комплемент последовательности нуклеиновой кислоты, кодирующей сконструированный сигнальный полипептид, интрон, промотор целеовой клетки, который активен в целевой клетке, 3' LTR или активный его укороченный фрагмент, в котором пятая транскрипционная единица функционально связана со вторым индуцибельным промотором; и 2) инкубацию популяции пакующих клеток, включая первый трансактиватор, в присутствии первого лиганда для накопления второго трансактиватора и ретровирусного белка REV; и 3.) инкубацию популяции пакующих клеток, включая второй трансактиватор и ретровирусный белок REV, в присутствии второго лиганда, тем самым индуцируя экспрессию ретровирусного полипептида gag, ретровирусного полипептида pol, связывающего полипептида, слитого полипептида и ретровирусная РНК, включая от 5' до 3', 5' LTR или его активный фрагмент, PBS, ретровирусный цис-действующий упаковывающий элемент РНК, обратный комплемент последовательности нуклеиновой кислоты, кодирующей сконструированный сигнальный полипептид, промотор целевой клетки и 3'-LTR, или его активный усеченный фрагмент, где не способные к репликации рекомбинантные ретровирусные частицы образуются и высвобождаются из пакующих клеток, и где не способные к репликации рекомбинантные ретровирусные частицы включают связывающий полипептид и/или слитый полипептид на ретровирусной мембране. и ретровирусная РНК в нуклеокапсиде, тем самым получая не способную к репликаци рекомбинантную ретровирусную частицу.
[464] В одном из аспектов, представленных в данном документе, ретровирусная упаковочная система может включать в себя клетку млекопитающего, в том числе: 1.) первый трансактиватор, экспрессируемый конститутивным промотором и способный связывать первый лиганд и первый индуцибельный промотор для воздействия на экспрессию функционально связанной с ним последовательности нуклеиновой кислоты в присутствии первого лиганда по сравнению с отсутствием; 2) второй трансактиватор, способный связывать второй лиганд и второй индуцибельный промотор и влиять на экспрессию функционально связанной с ним последовательности нуклеиновой кислоты в присутствии второго лиганда по сравнению с отсутствием; и 3.) упакованный геном РНК для ретровирусной частицы, где первый трансактиватор регулирует экспрессию второго трансактиватора, HIV REV, IL7 GPI DAF и активационного элемента, и где второй трансактиватор регулирует экспрессию полипептида gag, a полипептид pol, ретровирусный цис-действующий упаковывающий элемент РНК и один или несколько полипептидов оболочки. В иллюстративных вариантах осуществления первый трансактиватор может представлять собой домен FRB, слитый с доменом активации p65, и один или несколько доменов FKBP, слитых с ДНК-связывающим доменом ZFHD1, первый лиганд может быть рапамицином, а первый индуцибельный промотор может быть одним или несколькими сайтами связывания ZFHD1. В иллюстративных вариантах осуществления второй трансактиватор может быть белком rtTA, второй лиганд может быть тетрациклином или доксициклином, а второй индуцибельный промотор может быть промотором TRE или двунаправленным промотором TRE. В иллюстративных вариантах осуществления цис-действующий упаковывающий элемент РНК ретровируса может представлять собой Psi HIV. В иллюстративных вариантах осуществления один или несколько белков оболочки включают варианты с делецией цитоплазматического домена полипептидов F и H вируса кори. В иллюстративных вариантах осуществления блокаторы транскрипции или последовательности полиА-хвоста могут быть размещены рядом с генами для предотвращения или уменьшения нерегулируемой транскрипции. В некоторых вариантах осуществления можно использовать индуцируемый рапамицин-доксициклином лентивирусный геном с рибопереключателем (SEQ ID NO: 83). В некоторых вариантах осуществления можно использовать GAG POL ENV, индуцируемый рапамицином-доксициклином (SEQ ID NO: 84). В некоторых вариантах осуществления можно использовать активатор ТЕТ, индуцируемый рапамицином (SEQ ID NO: 85). В некоторых вариантах осуществления можно использовать индуцируемый индуктором рапамицина REV srcVpx (SEQ ID NO: 86).
[465] Некоторые аспекты настоящего изобретения включают или являются клетками, в иллюстративных примерах, клетками млекопитающих, которые используются в качестве пакующих клеток для создания неспособных к репликации рекомбинантных ретровирусных частиц, таких как лентивирусы, для трансдукции Т-клеток и/или NK-клеток. Для получения вируса или вирусной частицы in vitro, например перенаправленной рекомбинантной ретровирусной частицы, в соответствии с изобретением можно выбрать любую из широкого разнообразия клеток. Обычно используются эукариотические клетки, в частности клетки млекопитающих, включая клетки человека, обезьяны, собак, кошек, лошадей и грызунов. В иллюстративных примерах клетки представляют собой клетки человека. В дополнительных иллюстративных вариантах осуществления клетки воспроизводятся бесконечно и поэтому иммортальными. Примеры клеток, которые могут быть успешно использованы в настоящем изобретении, включают клетки NIH 3T3, клетки COS, клетки почек собак Madin-Darby, эмбриональные клетки 293T человека и любые клетки, полученные из таких клеток, такие как клетки gpnlslacZ ϕNX, которые происходят из клеток 293T. Можно использовать высокотрансфицируемые клетки, такие как клетки 293Т эмбриональной почки человека. Под «высокотрансфицируемым» подразумевается, что по меньшей мере около 50%, более предпочтительно по меньшей мере около 70% и наиболее предпочтительно по меньшей мере около 80% клеток могут экспрессировать гены введенной ДНК.
[466] Подходящие клетки млекопитающих включают первичные клетки и иммортализованные клеточные линии. Подходящие линии клеток млекопитающих включают линии клеток человека, линии клеток приматов, отличных от человека, линии клеток грызунов (например, мыши, крысы) и т.п. Подходящие линии клеток млекопитающих включают без ограничения клетки HeLa (например, Американскую коллекцию типовых культур (ATCC) № CCL-2), клетки CHO (например, ATCC № CRL9618, CCL61, CRL9096), клетки 293 (например, ATCC № CRL-1573), клетки Vero, клетки NIH 3T3 (например, ATCC № CRL-1658), клетки Huh-7, клетки BHK (например, ATCC № CCL10), клетки PC12 (ATCC № CRL1721), клетки COS, клетки COS-7 (ATCC № CRL1651), клетки RAT1, L-клетки мыши (ATCC № CCLI.3), клетки эмбриональной почки человека (HEK) (ATCC № CRL1573), клетки HLHepG2, Hut-78, Jurkat, HL-60, линии клеток NK (например, NKL, NK92 и YTS) и т.п.
[467] В любом из вариантов осуществления, раскрытых в данном документе, способы создания рекомбинантной ретровирусной частицы, неспособной к репликации, могут включать выращивание пакующих клеток млекопитающих до 50%, 60%, 70%, 80%, 90% или 95% слияния или слияния или до 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% пиковой плотности клеток или пиковой плотности клеток с последующим разделением или разбавлением клеток. В некоторых вариантах осуществления для выращивания клеток можно использовать реактор с мешалкой. В некоторых вариантах осуществления клетки могут быть разделены по меньшей мере по около 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:12, 1:15 или 1:20, используя способы, понятные квалифицированному специалисту. В некоторых вариантах осуществления клетки можно разбавить до 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% пиковой плотности клеток. В некоторых вариантах осуществления после разделения или разбавления клеток клетки можно выращивать в течение 1, 2, 3, 4, 5, 6, 7, 8, 10 или 16 часов или 1, 2, 3, 4, 5, 6, или за 7 дней до добавления первого лиганда. В некоторых вариантах осуществления клетки выращивают в присутствии первого лиганда в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 21 или 28 дней в наличие первого лиганда, которым в иллюстративных вариантах осуществления может быть рапамицин или рапалог. В некоторых вариантах осуществления второй лиганд может быть добавлен, и клетки можно выращивать по меньшей мере в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 21 или 28 дней, которые в иллюстративных вариантах осуществления могут быть тетрациклином или доксицилином. Условия культивирования будут зависеть от используемых клеток и лигандов, а способы известны в данной области техники. Конкретный пример условий для культивирования и индукции клеток HEK293S показан в Примере 8.
[468] Как раскрывается в данном документе, не способные к репликации рекомбинантные ретровирусные частицы являются обычным инструментом для доставки генов (Miller, Nature (1992) 357:455-460). Способность не способных к репликации рекомбинантных ретровирусных частиц доставлять нереаранжированную последовательность нуклеиновой кислоты в широкий круг соматических клеток грызунов, приматов и человека делает рекомбинантные ретровирусные частицы, не способные к репликации, хорошо пригодными для переноса генов в клетку. В некоторых вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы могут происходить из рода Alpharetrovirus, рода Betaretrovirus, рода Gammaretrovirus, рода Deltaretrovirus, рода Epsilonretrovirus, рода Lentivirus или рода Spumavirus. Существует множество ретровирусов, подходящих для использования в способах, раскрытых в данном документе. Например, можно использовать вирус лейкоза мышей (MLV), вирус иммунодефицита человека (HIV), вирус инфекционной анемии лошадей (EIAV), вирус опухоли молочной железы мыши (MMTV), вирус саркомы Рауса (RSV), вирус саркомы Фудзинами (FuSV), вирус лейкоз мышей Молони (Mo-MLV), вирус остеосаркомы мыши FBR (FBR MSV), вирус саркомы мышей Молони (Mo-MSV), вирус лейкоза мышей Абельсона (A-MLV), вирус миелоцитоматоза птиц-29 (MC29) и вирус эритробластоза птиц (AEV). Подробный перечень ретровирусов можно найти в Coffin et al (“Retroviruses” 1997 Cold Spring Harbor Laboratory Press Eds: J M Coffin, S M Hughes, H E Varmus pp 758-763). Подробности о геномной структуре некоторых ретровирусов можно найти в данной области техники. В качестве примера подробности о HIV можно найти в NCBI Genbank (т.е. под номером доступа к геному AF033819).
[469] В иллюстративных вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы могут происходить из рода Lentivirus. В некоторых вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы могут происходить из HIV, SIV или FIV. В дополнительных иллюстративных вариантах осуществления неспособные к репликации рекомбинантные ретровирусные частицы могут происходить из вируса иммунодефицита человека (HIV) из рода Lentivirus. Лентивирусы представляют собой сложные ретровирусы, которые, помимо обычных ретровирусных генов gag, pol и env, содержат другие гены с регуляторной или структурной функцией. Более высокая сложность позволяет лентивирусу модулировать свой жизненный цикл, как в ходе латентной инфекции. Типичный лентивирус представляет собой вирус иммунодефицита человека (HIV), этиологический агент СПИДа. In vivo HIV может инфицировать терминально дифференцированные клетки, которые редко делятся, например, лимфоциты и макрофаги.
[470] В иллюстративных вариантах осуществления предложенные в данном документе не способные к репликации рекомбинантные ретровирусные частицы содержат полипептид Vpx. Полипептид Vpx может быть экспрессирован в пакующей клеточной линии после интеграции кодирующей Vpx нуклеиновой кислоты в его геном, например, как белок, связанный с клеточной мембраной, который включается в мембрану ретровируса (Durand et al., J. Virol. (2013) 87: 234-242). Связанный с ретровирусной мембраной Vpx может быть сконструирован с последовательностью процессинга для вирусной протеазы, так что свободный Vpx высвобождается после включения в вирусную частицу. Таким примером слияния Vpx с этой функциональностью является Src-Flag-Vpx, который включает нацеливающийся на мембрану домен (MGSSKSKPKDP) (SEQ ID NO: 227) из первых 11 аминокислот c-Src с последующим расщеплением вирусной протеазой домен KARVLAEA (SEQ ID NO: 228), за которым следует помеченный Flag Vpx.
[471] Не ограничиваясь теорией, полипептид Vpx способствует трансдукции покоящихся клеток, стимулируя эффективность процесса обратной транскрипции за счет разрушения фактора рестрикции SAMHD1. Соответственно, считается, что в способах, представленных в данном документе, где Vpx присутствует в не способных к репликации рекомбинантных ретровирусных частицах, используемых для трансдукции Т-клеток и/или NK-клеток, Vpx высвобождается в цитоплазму покоящихся Т-клеток или покоящихся NK-клеток при трансдукция клетки рекомбинантной ретровирусной частицей, не способной к репликации, которая содержит Vpx. Затем Vpx разрушает SAMHD1, что вызывает увеличение свободных dNTP, что, в свою очередь, стимулирует обратную транскрипцию ретровирусного генома.
[472] В некоторых вариантах осуществления не способные к репликации рекомбинантные ретровирусные частицы, предложенные в данном документе, содержат и/или включают полипептид Vpu. Полипептид Vpu может быть экспрессирован из плазмиды или в линии пакующих клеток после интеграции кодирующей Vpu нуклеиновой кислоты в его геном, например, как вирусный мембранный белок, который включается в мембрану ретровируса. Рекомбинантная форма Vpu с кодоном последовательности, оптимизированным для экспрессии у людей, может быть сконструирована и экспрессирована таким образом, чтобы свободный Vpu мог включаться в вирусные частицы. Vpu является дополнительным белком, обнаруженным в HIV-1 и некоторых изолятах вируса обезьяньего иммунодефицита (SIV), связанных с HIV-1, таких как SIVcpz, SIVgsn и SIVmon, но не в HIV-2 или большинстве изолятов SIV. Белок Vpu участвует в подавлении CD4 и антагонизме тезерина в отношении высвобождения частиц. Что еще более важно, Vpu имеет структурное сходство с виропоринами, и особенно с белком виропорина M2 из вируса гриппа A (IAV). Таким образом, было показано, что Vpu формирует катион-селективные ионные каналы и проницаемость мембран на различных моделях. Было показано, что IAV-M2 помогает подкислять частицы и, таким образом, способствует раннему высвобождению из эндосомного пути, используемого для входа, уменьшая количество продуктов тупикового транзита.
[473] Пример 20 в данном документе демонстрирует, что трансдукция покоящихся PBMC ретровирусными частицами усиливается за счет присутствия Vpu в ретровирусных частицах. Не ограничиваясь теорией, полипептид Vpu способствует трансдукции покоящихся клеток за счет ускорения подкисления лентивирусных псевдотипов, позволяя большему количеству капсидов быстрее достигать цитоплазмы. Подкисление внутренней части вируса приводит к ослаблению электростатического взаимодействия между структурными белками вируса и, таким образом, способствует диссоциации комплексов капсида и вирусного рибонуклеопротеина (RNP). Соответственно, считается, что в способах, представленных в данном документе, где Vpu присутствует в мембране не спобных к репликации рекомбинантных ретровирусных частиц, используемой для трансдукции Т-клеток и/или NK-клеток, Vpu ускоряет подкисление лентивирусных частиц в эндосомном пути и способствует высвобождение капсидов в цитоплазму покоящихся Т-клеток или покоящихся NK-клеток при трансдукции клеток не спосбной к репликации рекомбинантной ретровирусной частицей, содержащей Vpu. Соответственно, в некоторых вариантах осуществления в него включен полипептид Vpu, который содержит или является фрагментом Vpu, который сохраняет способность стимулировать трансдукцию покоящихся PBMC и, в некоторых вариантах осуществления, покоящихся Т-клеток. Фрагмент может содержать фрагмент 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% Vpu, который имеет не менее 75, 80, 85, 90, 95, 98, 99 или 100%. идентичность дикому типу Vpu. В некоторых вариантах осуществления полипептид Vpu включает фрагмент Vpu, который сохраняет способность ускорять подкисление лентивирусной частицы в эндосомном пути.
РАЗМЕР РЕТРОВИРУСНОГО ГЕНОМА
[474] В способах и композициях, представленных в данном документе, рекомбинантные ретровирусные геномы, в неограничивающих иллюстративных примерах, лентивирусные геномы, имеют ограничение на количество полинуклеотидов, которые могут быть упакованы в вирусную частицу. В некоторых вариантах осуществления, представленных в данном документе, полипептиды, кодируемые областью, кодирующей полинуклеотид, могут быть усеченными или другими делециями, которые сохраняют функциональную активность, так что область, кодирующая полинуклеотид, кодируется меньшим количеством нуклеотидов, чем область, кодирующая полинуклеотид для полипептида дикого типа. В некоторых вариантах осуществления полипептиды, кодируемые областью, кодирующей полинуклеотид, могут быть полипептидами слияния, которые могут экспрессироваться с одного промотора. В некоторых вариантах осуществления гибридный полипептид может иметь сигнал расщепления для образования двух или более функциональных полипептидов из одного гибридного полипептида и одного промотора. Кроме того, некоторые функции, которые не требуются после начальной трансдукции ex vivo, не включены в геном ретровируса, а скорее присутствуют на поверхности не способных к репликации рекомбинантных ретровирусных частиц через мембрану пакующей клетки. Эти различные стратегии используются в данном документе для максимизации функциональных элементов, которые упакованы в не способные к репликации рекомбинантные ретровирусные частицы.
[475] В некоторых вариантах осуществления рекомбинантный ретровирусный геном, который должен быть упакован, может содержать от 1000, 2000, 3000, 4000, 5000, 6000, 7000 и 8000 нуклеотидов на нижнем конце диапазона до 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000 и 11000 нуклеотидов на верхнем конце диапазона. Ретровирусный геном, который должен быть упакован, включает одну или несколько полинуклеотидных областей, кодирующих первый и второй инженерный сигнальный полипептид, как подробно раскрыто в данном документе. В некоторых вариантах осуществления рекомбинантный ретровирусный геном, который должен быть упакован, может содержать менее 5000, 6000, 7000, 8000, 9000, 10000 или 11000 нуклеотидов. Функции, обсуждаемые в другом месте в данном документе, которые могут быть упакованы, включают необходимые ретровирусные последовательности для сборки и упаковки ретровируса, такие как кодирующие области ретровируса rev, gag и pol, а также 5' LTR и 3' LTR или их активный усеченный фрагмент, последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК, и элемент cPPT/CTS. Кроме того, в иллюстративных вариантах осуществления не способная к репликации рекомбинантная ретровирусная частица в данном документе может включать любой один или несколько или все из следующих, в некоторых вариантах осуществления в обратной ориентации этих функциональных областей ретровируса: одна или несколько областей полинуклеотидов, кодирующих первый и второй инженерный сигнальный полипептид, по меньшей мере один из которых включает по меньшей мере один лимфопролиферативный элемент и может дополнительно включать ASTR; второй сконструированный сигнальный полипептид, который может включать рецептор химерного антигена; элемент управления, такой как рибопереключатель, который обычно регулирует экспрессию первого и/или второго инженерного сигнального полипептида; домен распознавания, интрон, промотор, который активен в целевой клетке, такой как Т-клетка, сигнал расщепления 2А и/или IRES.
РЕКОМБИНАНТНЫЕ РЕТРОВИРУСНЫЕ ЧАСТИЦЫ
[476] Рекомбинантные ретровирусные частицы раскрыты в способах и композициях, представленных в данном документе, например, для трансдукции Т-клеток и/или NK-клеток с целью создания генетически модифицированных T-клеток и/или NK-клеток. Рекомбинантные ретровирусные частицы сами по себе являются аспектами настоящего изобретения. Обычно рекомбинантные ретровирусные частицы, включенные в аспекты, представленные в данном документе, неспособны к репликации, что означает, что рекомбинантная ретровирусная частица не может реплицироваться после того, как она покидает пакующую клетку. В иллюстративных вариантах осуществления рекомбинантные ретровирусные частицы представляют собой лентивирусные частицы.
[477] В некоторых аспектах в данном документе представлены не способные к репликации рекомбинантные ретровирусные частицы для использования в трансдуцирующих клетках, обычно лимфоцитах, и иллюстративные варианты осуществления Т-клетки и/или NK-клетки. Не способные к репликации рекомбинантные ретровирусные частицы могут включать любые элементы псевдотипирования, обсуждаемые в другом месте в данном документе. В некоторых вариантах осуществления рекомбинантные ретровирусные частицы, не способные к репликации, могут включать в себя любой из элементов активации, обсуждаемых в другом месте в данном документе. В одном аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, включающая полинуклеотид, содержащий: A. одна или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют рецептор химерного антигена (CAR); и B. элемент псевдотипирования и элемент активации Т-клетки на его поверхности, причем элемент активации Т-клетки не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице. В некоторых вариантах осуществления элемент активации Т-клеток может быть любым из элементов активации, обсуждаемых в другом месте в данном документе. В иллюстративных вариантах осуществления элементом активации Т-клеток может представлять собой scFvFc к CD3. В другом аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, включающая полинуклеотид, включающий одну или несколько транскрипционных единиц, оперативно связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый полипептид, включая рецептор химерного антигена (CAR) и второй полипептид, включающий лимфопролиферативный элемент. В некоторых вариантах осуществления лимфопролиферативный элемент может быть химерным лимфопролиферативным элементом. В иллюстративных вариантах осуществления лимфопролиферативный элемент не содержит IL-7, связанный с альфа-цепью рецептора IL-7, или ее фрагментом. В некоторых вариантах осуществления лимфопролиферативный элемент не содержит IL-15, связанный с бета-цепью рецептора IL-2/IL-15.
[478] В некоторых аспектах в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, содержащая полинуклеотид, содержащий одну или несколько транскрипционных единиц, оперативно связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый полипептид, содержащий химерный антигенный рецептор (CAR) и второй полипептид, содержащий химерный лимфопролиферативный элемент, например, конститутивно активный химерный лимфопролиферативный элемент. В иллюстративных вариантах осуществления химерный лимфопролиферативный элемент не содержит цитокин, связанный с его когнатным рецептором или связанный с фрагментом его когнатного рецептора.
[479] В некоторых аспектах в данном документе представлена рекомбинантная ретровирусная частица, которая включает (i) элемент псевдотипирования, способный связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембран рекомбинантной ретровирусной частицы с ней; (ii) полинуклеотид, имеющий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, где одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, имеющий рецептор химерного антигена, который включает антигенспецифический нацеливающую область, трансмембранный домен и внутриклеточный активирующий домен и второй сконструированный сигнальный полипептид, который включает по меньшей мере один лимфопролиферативный элемент; где экспрессия первого сконструированного сигнального полипептида и/или второго сконструированного сигнального полипептида регулируется элементом контроля in vivo; и (iii) активирующий элемент на своей поверхности, причем активирующий элемент способен связываться с Т-клеткой и/или NK-клеткой и не кодируется полинуклеотидом в рекомбинантной ретровирусной частице. В некоторых вариантах осуществления промотор, активный в Т-клетках и/или NK-клетках, не активен в линии пакующих клеток или активен только в линии пакующих клеток индуцибельным образом. В любом из вариантов осуществления, раскрытых в данном документе, любой из первого и второго сконструированных сигнальных полипептидов может иметь химерный антигенный рецептор, а другой сконструированный сигнальный полипептид может иметь по меньшей мере один лимфопролиферативный элемент.
[480] В этом изобратении представлены различные элементы и комбинации элементов, которые включены в не способные к репликации рекомбинантные ретровирусные частицы, такие как, например, элементы псевдотипирования, активирующие элементы и связанные с мембраной цитокины, а также последовательности нуклеиновых кислот, которые включены в геном не способной к репликации рекомбинантной ретровирусной частицы, такой как, но не ограничиваясь этим, нуклеиновая кислота, кодирующая CAR; нуклеиновая кислота, кодирующая лимфопролиферативный элемент; нуклеиновая кислота, кодирующая элемент управления, такой как рибопереключатель; промотор, особенно промотор, который является конститутивно активным или индуцибельным в Т-клетке; и нуклеиновая кислота, кодирующая ингибирующую молекулу РНК. Кроме того, различные аспекты, представленные в данном документе, такие как способы получения рекомбинантных ретровирусных частиц, способы проведения адоптивной клеточной терапии и способы трансдукции Т-клеток, продуцируют и/или включают не способные к репликации рекомбинантные ретровирусные частицы. Не способные к репликации рекомбинантные ретровирусы, которые продуцируются и/или включаются в такие способы, сами составляют отдельные аспекты настоящего изобретения как композиции рекомбинантных ретровирусных частиц, неспособных к репликации, которые могут находиться в выделенной форме. Такие композиции могут быть в высушенной (например, лиофилизированной) форме или могут быть в подходящем растворе или среде, известной в данной области для хранения и использования ретровирусных частиц.
[481] Соответственно, в качестве неограничивающего примера, представленного в данном документе в другом аспекте, выступает не способная к репликации рекомбинантная ретровирусная частица имеющая в своем геноме полинуклеотид, имеющий одну или несколько последовательностей нуклеиновых кислот, оперативно связанных с промотором, активным в Т-клетках и/или NK-клетках, которые в некоторых случаях включает первую последовательность нуклеиновой кислоты, которая кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторую последовательность нуклеиновой кислоты, которая кодирует рецептор химерного антигена, или CAR, как описано в данном документе. В других вариантах осуществления присутствует третья последовательность нуклеиновой кислоты, которая кодирует по меньшей мере один лимфопролиферативный элемент, описанный ранее в данном документе, который не является ингибирующей молекулой РНК. В некоторых вариантах осуществления полинуклеотид включает один или несколько рибопереключателей, как представлено в данном документе, функционально связанных с первой последовательностью нуклеиновой кислоты, второй последовательностью нуклеиновой кислоты и/или третьей последовательностью нуклеиновой кислоты, если она присутствует. В такой конструкции экспрессия одной или нескольких ингибирующих РНК, CAR и/или одного или нескольких лимфопролиферативных элементов, которые не являются ингибирующими РНК, контролируется рибопереключателем. В некоторых вариантах осуществления от двух до 10 молекул ингибирующей РНК кодируются первой последовательностью нуклеиновой кислоты. В дополнительных вариантах осуществления от двух до шести молекул ингибирующей РНК кодируются первой последовательностью нуклеиновой кислоты. В иллюстративных вариантах осуществления 4 молекулы ингибирующей РНК кодируются первой последовательностью нуклеиновой кислоты. В некоторых вариантах осуществления первая последовательность нуклеиновой кислоты кодирует одну или несколько молекул ингибирующей РНК и расположена внутри интрона. В некоторых вариантах осуществления интрон включает весь промотор или его часть. Промотор может быть промотором Pol I, Pol II или Pol III. В некоторых иллюстративных вариантах осуществления промотор представляет собой промотор Pol II. В некоторых вариантах осуществления интрон находится рядом с промотором, активным в Т-клетке и/или NK-клетке, и ниже него. В некоторых вариантах осуществления интрон представляет собой интрон A EF1-α.
[482] Варианты осуществления рекомбинантных ретровирусных частиц в данном документе включают те, в которых ретровирусная частица содержит геном, который включает одну или несколько нуклеиновых кислот, кодирующих одну или несколько молекул ингибирующей РНК. Различные альтернативные варианты таких нуклеиновых кислот, которые кодируют молекулы ингибирующей РНК, которые могут быть включены в геном ретровирусной частицы, включая комбинации таких нуклеиновых кислот с другими нуклеиновыми кислотами, которые кодируют CAR или лимфопролиферативный элемент, отличный от молекулы ингибирующей РНК, включают включены, например, в раздел ингибирующей РНК, представленный в данном документе, а также в различные другие параграфы, которые объединяют эти варианты осуществления. Кроме того, различные альтернативы таких не способных к репликации рекомбинантных ретровирусов могут быть идентифицированы с помощью типичных нуклеиновых кислот, которые раскрыты в аспектах пакующих клеточных линий, раскрытых в данном документе. Квалифицированный специалист поймет, что раскрытие в этом разделе рекомбинантной ретровирусной частицы, которая включает геном, кодирующий одну или несколько (например, две или более) молекул ингибирующей РНК, может быть объединено с различными альтернативами для таких нуклеиновых кислот, кодирующих молекулы ингибирующей РНК, представленные в других разделах в данном документе. Кроме того, квалифицированный специалист поймет, что такие нуклеиновые кислоты, кодирующие одну или несколько молекул ингибирующей РНК, могут быть объединены с различными другими функциональными элементами нуклеиновой кислоты, представленными в данном документе, как, например, раскрыто в разделе настоящего документа, который посвящен молекулам ингибиторной РНК и кодированию нуклеиновых кислот. эти молекулы. Кроме того, различные варианты конкретных ингибирующих молекул РНК, представленные в других разделах, могут быть использованы в аспектах настоящего раскрытия с рекомбинантными ретровирусными частицами.
[483] Необходимые элементы рекомбинантных ретровирусных векторов, такие как лентивирусные векторы, известны в данной области. Эти элементы включены в раздел упаковывающих клеточных линий и подробно описаны в разделе «Примеры» для создания не способных к репликации рекомбинантных ретровирусных частиц. Например, лентивирусные частицы обычно включают упаковочные элементы REV, GAG и POL, которые могут быть доставлены к линиям пакующим клеток через одну или несколько упаковывающих плазмид, элемент псевдотипирования, различные примеры, которые представлены в данном документе, которые могут быть доставлены в линию пакующих клеток через плазмиду псевдотипирования и геном, который продуцируется полинуклеотидом, который доставляется в клетку-хозяина через плазмиду переноса. Этот полинуклеотид обычно включает вирусные LTR и сигнал упаковки psi. 5' LTR может представлять собой химерный 5' LTR, слитый с гетерологичным промотором, который включает 5' LTR, которые не зависят от трансактивации Tat. Плазмида переноса может быть самоинактивирующейся, например, путем удаления области U3 3' LTR. В некоторых неограничивающих вариантах осуществления Vpu, такой как полипептид, содержащий Vpu (иногда называемый в данном документе «полипептидом Vpu»), включая без ограничения Src-FLAG-Vpu, упакован внутри ретровирусной частицы для любого аспекта композиции или способа и предложенный в данном документе вариант осуществления, который включает ретровирусную частицу. В некоторых неограничивающих вариантах осуществления Vpx, например Src-FLAG-Vpx, упакован внутри ретровирусной частицы. Не ограничиваясь теорией, при трансдукции Т-клеток Vpx проникает в цитозоль клеток и способствует деградации SAMHD1, что приводит к увеличению пула цитоплазматических dNTP, доступных для обратной транскрипции. В некоторых неограничивающих вариантах осуществления Vpu и Vpx упакованы внутри ретровирусной частицы для любой композиции или аспекта способа и варианта осуществления, которые включают ретровирусную частицу, представленную в данном документе.
[484] Ретровирусные частицы (например, лентивирусные частицы), включенные в различные аспекты настоящего изобретения, в иллюстративных вариантах осуществления неспособны к репликации, особенно по соображениям безопасности для вариантов осуществления, которые включают введение клеток, трансдуцированных такими ретровирусными частицами, субъекту. Когда для трансдукции клетки используются неспособные к репликации ретровирусные частицы, ретровирусные частицы не образуются из трансдуцированной клетки. Модификации ретровирусного генома известны в данной области, чтобы гарантировать, что ретровирусные частицы, которые включают геном, не способны к репликации. Однако следует понимать, что в некоторых вариантах осуществления любого из аспектов, представленных в данном документе, могут использоваться рекомбинантные ретровирусные частицы, способные к репликации.
[485] Квалифицированный специалист поймет, что описанные в данном документе функциональные элементы могут быть доставлены к пакующим вывающим клеткам и/или Т-клеткам с использованием различных типов векторов, таких как векторы экспрессии. В иллюстративных аспектах настоящего изобретения используются ретровирусные векторы, а в некоторых особенно иллюстративных вариантах осуществления лентивирусные векторы. Другие подходящие векторы экспрессии можно использовать для достижения определенных вариантов осуществления в данном документе. Такие векторы экспрессии включают без ограничения вирусные векторы (например, вирусные векторы на основе вируса осповакцины; полиовируса; аденовируса (см., например, Li et al., Invest Opthalmol Vis Sci 35:2543 2549, 1994; Borras et al., Gene Ther 6:515 524, 1999; Li and Davidson, PNAS 92:7700 7704, 1995; Sakamoto et al., H Gene Ther 5:1088 1097, 1999; WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655); аденоассоциированного вируса (см., например, Ali et al., Hum Gene Ther 9:81 86, 1998, Flannery et al., PNAS 94:6916 6921, 1997; Bennett et al., Invest Opthalmol Vis Sci 38:2857 2863, 1997; Jomary et al., Gene Ther 4:683 690, 1997, Rolling et al., Hum Gene Ther 10:641 648, 1999; Ali et al., Hum Mol Genet 5:591 594, 1996; Srivastava in WO 93/09239, Samulski et al., J. Vir. (1989) 63:3822-3828; Mendelson et al., Virol. (1988) 166:154-165; и Flotte et al., PNAS (1993) 90: 10613-10617); SV40; вируса простого герпеса; или ретровирусный вектор (например, вирус лейкоза мышей, вирус некроза селезенки и векторы, полученные из ретровирусов, таких как вирус саркомы Рауса, вирус саркомы Харви, вирус лейкоза птиц, вирус иммунодефицита человека, вирус миелопролиферативной саркомы и вирус опухоли молочной железы), например гамма-ретровирус; или вирус иммунодефицита человека (см., например, Miyoshi et al., PNAS 94:10319 23, 1997; Takahashi et al., J Virol 73:7812 7816, 1999); и тому подобное.
[486] В иллюстративных вариантах осуществления ретровирусная частица представляет собой лентивирусную частицу. Такая ретровирусная частица обычно включает ретровирусный геном внутри капсида, который расположен внутри вирусной оболочки.
[487] В некоторых вариантах осуществления ДНК-содержащие вирусные частицы используются вместо рекомбинантных ретровирусных частиц. Такие вирусные частицы могут быть аденовирусами, аденоассоциированными вирусами, герпесвирусами, цитомегаловирусами, поксвирусами, вирусами авипокс, вирусами гриппа, вирусом везикулярного стоматита (VSV) или вирусом Синдбис. Квалифицированный специалист поймет, как модифицировать раскрытые в данном документе способы для использования с различными вирусами и ретровирусами или ретровирусными частицами. Если используются вирусные частицы, которые включают геном ДНК, квалифицированный специалист поймет, что в такие геномы могут быть включены функциональные единицы для индукции интеграции всего или части генома ДНК вирусной частицы в геном Т-клетки, трансдуцированной с помощью такого вируса.
[488] В некоторых вариантах осуществления RRE HIV и полинуклеотидная область, кодирующая Rev HIV, могут быть заменены N-концевыми мотивами связывания РНК-бокса RGG и полинуклеотидной областью, кодирующей ICP27. В некоторых вариантах осуществления полинуклеотидная область, кодирующая HIV Rev, может быть заменена одной или несколькими полинуклеотидными областями, кодирующими аденовирус E1B 55-кДа и E4 Orf6.
[489] В одном аспекте в данном документе предложен контейнер, такой как коммерческий контейнер или упаковка, или набор, содержащий их, содержащий выделенные рекомбинантные ретровирусные частицы, неспособные к репликации, в соответствии с любым из аспектов не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе. Кроме того, в данном документе в другом аспекте предоставлен контейнер, такой как коммерческий контейнер или упаковка, или набор, содержащий их, содержащий выделенные пакующие клетки, в иллюстративных вариантах осуществления выделенные пакующие клетки из линии упаковывающих клеток, в соответствии с любой из пакующих клеток и/или аспекты упаковки клеточной линии, представленные в данном документе. В некоторых вариантах осуществления набор включает дополнительные контейнеры, которые включают дополнительные реагенты, такие как буферы или реагенты, используемые в способах, представленных в данном документе. Кроме того, в определенных аспектах настоящего документа представлено использование любой не способной к репликации рекомбинантной ретровирусной частицы, представленной в данном документе, в любом аспекте при производстве набора для генетической модификации Т-клетки или NK-клетки в соответствии с любым аспектом, представленным в данном документе. Кроме того, в определенных аспектах в данном документе предусмотрено использование любой пакующейклетки или линии пакующих клеток, представленных в данном документе, в любом аспекте при производстве набора для получения не способных к репликации рекомбинантных ретровирусных частиц в соответствии с любым аспектом, представленным в данном документе, таким как коммерческий контейнер или упаковка, или набор, содержащий их, содержащий выделенные рекомбинантные ретровирусные частицы, неспособные к репликации, в соответствии с любым из аспектов не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе.
[490] В одном аспекте в данном документе представлен коммерческий контейнер, содержащий не способную к репликации рекомбинантную ретровирусную частицу и инструкции по ее применению для лечения роста опухоли у субъекта, при этом не способная к репликации рекомбинантная ретровирусная частица содержит в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках. В некоторых вариантах осуществления последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты может кодировать химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В некоторых вариантах осуществления последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты может кодировать две или несколько молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК.
[491] Контейнер, который содержит рекомбинантные ретровирусные частицы, может представлять собой пробирку, флакон, лунку планшета или другой сосуд для хранения рекомбинантной ретровирусной частицы. Набор может включать два или более контейнеров, где второй или другой контейнер может включать, например, раствор или среду для трансдукции Т-клеток и/или NK-клеток, и/или второй или другой контейнер может включать в себя pH-модулирующее фармакологическое средство. Любой из этих контейнеров может быть промышленной прочности и качества. Частица не способного к репликации рекомбинантного ретровируса в таких аспектах, которые включают набор и нуклеиновую кислоту, кодирующую молекулу ингибирующей РНК, может быть любым из вариантов осуществления таких не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, которые включают любой из вариантов осуществления ингибирующей РНК, представленных в данном документе.
[492] В другом аспекте в данном документе представлено применение не способной к репликации рекомбинантной ретровирусной частицы при производстве набора для генетической модификации Т-клетки или NK-клетки, где использование набора включает: приведение в контакт T-клетки или NK-клетки ex vivo с не способной к репликации рекомбинантной ретровирусной частицей, где рекомбинантная ретровирусная частица, неспособная к репликации, включает элемент псевдотипирования на поверхности и элемент активации Т-клеток на поверхности, при этом указанное приведение в контакт облегчает трансдукцию Т-клетки или NK-клетки с помощью не способной к репликации рекомбинантной ретровирусной частицы, тем самым производя генетически модифицированные Т-клетки или NK-клетки. В некоторых вариантах осуществления Т-клетка или NK-клетка может происходить от субъекта. В некоторых вариантах осуществления элемент активации Т-клеток может быть мембраносвязанным. В некоторых вариантах осуществления приведение в контакт может выполняться от 1, 2, 3, 4, 5, 6, 7 или 8 часов на нижнем конце диапазона и 4, 5, 6, 7, 8, 10, 12, 15, 18, 21 и до 24 часа на верхнем конце диапазона, например, от 1 до 12 часов. Не способная к репликации рекомбинантная ретровирусная частица для использования в производстве набора может включать любой из аспектов, вариантов или подвариантов, обсуждаемых в другом месте в данном документе.
ГЕНЕТИЧЕСКИЕ МОДИФИЦИРОВАННЫЕ T-КЛЕТКИ И NK-КЛЕТКИ
[493] В вариантах осуществления способов и композиций, описанных в данном документе, продуцируются генетически модифицированные лимфоциты, которые сами по себе являются отдельным аспектом изобретения. Такие генетически модифицированные лимфоциты могут быть преобразованы в лимфоциты. В одном аспекте в данном документе представлена генетически модифицированная Т-клетка или NK-клетка, в которой Т-клетка или NK-клетка были генетически модифицированы для экспрессии первого сконструированного сигнального полипептида. В некоторых вариантах осуществления первый сконструированный сигнальный полипептид может представлять собой лимфопролиферативный элемент или CAR, который включает антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В некоторых вариантах осуществления Т-клетка или NK-клетка может дополнительно включать второй сконструированный сигнальный полипептид, который может быть CAR или лимфопролиферативным элементом. В некоторых вариантах осуществления лимфопролиферативный элемент может быть химерным лимфопролиферативным элементом. В некоторых вариантах осуществления Т-клетка или NK-клетка может дополнительно включать элемент псевдотипирования на поверхности. В некоторых вариантах осуществления Т-клетка или NK-клетка может дополнительно включать элемент активации на поверхности. CAR, лимфопролиферативный элемент, элемент псевдотипирования и элемент активации генетически модифицированной Т-клетки или NK-клетки могут включать в себя любой из аспектов, вариантов осуществления или подвариантов, раскрытых в данном документе. В иллюстративных вариантах осуществления активирующим элементом может быть scFvFc к CD3.
[494] Некоторые аспекты, представленные в данном документе, включают генетически модифицированные Т-клетки или NK-клетки, полученные путем трансдукции покоящихся Т-клеток и/или покоящихся NK-клеток в соответствии со способом, включающим приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, где не способные к репликации рекомбинантные ретровирусные частицы содержат элемент псевдотипирования на своей поверхности и связанный с мембраной элемент активации Т-клеток на своей поверхности, причем указанное приведение в контакт облегчает трансдукцию покоящихся Т-клеток и/или NK-клеток посредством не способных к репликации рекомбинантных ретровирусных частиц, тем самым продуцируя генетически модифицированные Т-клетки и/или NK-клетки, и при этом приведение в контакт выполняется от 1, 2, 3, 4 или 6 часа на нижнем конце диапазона до 4, 6, 8, 10, 12, 18, 20 или 24 часа на верхнем пределе диапазона, например, от 1 часа до 12 часов.
[495] В некоторых вариантах осуществления генетически модифицированные лимфоциты представляют собой лимфоциты, такие как Т-клетки или NK-клетки, которые были генетически модифицированы для экспрессии первого сконструированного сигнального полипептида, содержащего по меньшей мере один лимфопролиферативный элемент и/или второй сконструированный сигнальный полипептид, содержащий рецептор химерного антигена, который включает антигенспецифическая нацеленная область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В некоторых вариантах осуществления любого из аспектов в данном документе NK-клетки являются NKT-клетками. NKT-клетки представляют собой подмножество Т-клеток, которые экспрессируют CD3 и обычно коэкспрессируют Т-клеточный рецептор αβ, но также экспрессируют множество молекулярных маркеров, которые обычно связаны с NK-клетками (например, NK1.1 или CD56).
[496] Генетически модифицированные лимфоциты по настоящему изобретению обладают гетерологичной последовательностью нуклеиновой кислоты, которая была введена в лимфоцит методом рекомбинантной ДНК. Например, гетерологичная последовательность в иллюстративных вариантах осуществления вставляется в лимфоцит во время способа трансдукции лимфоцита, представленного в данном документе. Гетерологичная нуклеиновая кислота находится внутри лимфоцита и в некоторых вариантах осуществления интегрирована или не интегрирована в геном генетически модифицированного лимфоцита.
[497] В иллюстративных вариантах осуществления гетерологичная нуклеиновая кислота интегрирована в геном генетически модифицированного лимфоцита. Такие лимфоциты продуцируются в иллюстративных вариантах осуществления с использованием способа трансдукции лимфоцитов, представленного в данном документе, который использует рекомбинантную ретровирусную частицу. Такая рекомбинантная ретровирусная частица может включать полинуклеотид, кодирующий рецептор химерного антигена, который обычно включает, по меньшей мере, антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В других разделах настоящего описания представлены различные варианты осуществления не способных к репликации рекомбинантных ретровирусных частиц и полинуклеотидов, кодируемых в геноме не способных к репликации ретровирусных частиц, которые можно использовать для получения генетически модифицированных лимфоцитов, которые сами по себе составляют другой аспект настоящего изобретения.
[498] Генетически модифицированные лимфоциты настоящего раскрытия могут быть выделены вне организма. Например, такие лимфоциты можно найти в средах и других растворах, которые используются для трансдукции ex vivo, как предусмотрено в данном документе. Лимфоциты могут присутствовать в генетически немодифицированной форме в крови, которая собирается у субъекта способами, представленными в данном документе, а затем генетически модифицирована во время способа трансдукции. Генетически модифицированные лимфоциты могут быть обнаружены внутри субъекта после их введения или повторно введены субъекту после того, как они были генетически модифицированы. Генетически модифицированные лимфоциты могут быть покоящимися Т-клетками или покоящимися NK-клетками, или генетически модифицированные Т-клетки или NK-клетки могут активно делиться, особенно после того, как они экспрессируют некоторые из функциональных элементов, содержащихся в нуклеиновых кислотах, которые вставлены в Т-клетку. или NK-клетка после трансдукции, как раскрыто в данном документе.
[499] В одном аспекте в данном документе предложена трансдуцированная и/или генетически модифицированная Т-клетка или NK-клетка, содержащая рекомбинантный полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках в его геноме, который экспрессирует один или несколько функциональных элементов, предусмотренных в любом из аспектов и вариантов осуществления настоящего изобретения. Например, одна или несколько транскрипционных единиц могут экспрессировать CAR, который может включать в себя любой из элементов CAR, представленных в данном документе, таких как ASTR, в качестве неограничивающего примера MBR-ASTR, трансмембранный домен и внутриклеточный сигнальный домен. и может дополнительно включать в качестве неограничивающего примера модуляторный домен. Кроме того, функциональный элемент (ы), экспрессируемый в трансдуцированной и/или генетически модифицированной Т-клетке или NK-клетке, один или несколько лимфопролиферативных элементов, представленных в данном документе, например, конститутивно активный мутант рецептора IL-7 или другой лимфопролиферативный элемент, который не является молекула ингибирующей РНК (например, miRNA или shRNA), домен распознавания и/или элиминации.
[500] В одном аспекте в данном документе предусмотрена генетически модифицированная Т-клетка или NK-клетка, содержащая:
a. одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК; и
b. химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен,
и/или нуклеиновые кислоты, кодирующие молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК и CAR, причем указанная одна (например, две) или несколько молекул ингибирующей РНК и CAR, или нуклеиновые кислоты, кодирующие их, кодируются нуклеиновыми кислотами или являются кислотные последовательности, которые являются генетическими модификациями Т-клетки и/или NK-клетки.
[501] Генетически модифицированная Т-клетка или NK-клетка может представлять собой популяцию генетически модифицированных Т-клеток и/или NK-клеток, которые включают одну (например, две) или несколько ингибирующих молекул РНК, направленных против одной или нескольких мишеней РНК; и CAR.
[502] В некоторых вариантах осуществления аспекта непосредственно выше, где Т-клетка или NK-клетка содержит одну или несколько (например, две или более) молекул ингибирующей РНК и CAR или нуклеиновые кислоты, кодирующие их, любой из конкретных вариантов осуществления, представленных в данном документе для элементов, которые могут может быть включен как часть CAR или может экспрессироваться вместе с лимфопролиферативным элементом или использоваться для контроля лимфопролиферативного элемента.
[503] В некоторых вариантах осуществления аспекта непосредственно выше, где Т-клетка или NK-клетка содержит одну или несколько (например, две или более) молекул ингибирующей РНК и CAR или нуклеиновые кислоты, кодирующие их, CAR представляет собой биологический препарат, ограниченный микроокружением (MRB)-CAR, и/или генетически модифицированная Т-клетка или NK-клетка могут дополнительно включать по меньшей мере один лимфопролиферативный элемент, который не является ингибирующей молекулой РНК, и/или нуклеиновую кислоту, кодирующую лимфопролиферативный элемент. В таких вариантах осуществления лимфопролиферативный элемент кодируется последовательностями нуклеиновых кислот, которые являются генетическими модификациями Т-клетки и/или NK-клетки. Любой из раскрытых в данном документе лимфопролиферативных элементов может быть использован и/или закодирован в таких вариантах осуществления. Например, по меньшей мере один лимфопролиферативный элемент может быть конститутивно активным рецептором IL-7.
[504] В некоторых вариантах осуществления аспекта непосредственно выше, где Т-клетка или NK-клетка содержит одну или несколько (например, две или более) молекул ингибирующей РНК и CAR или нуклеиновые кислоты, кодирующие их, молекула ингибирующей РНК является предшественником miRNA или shRNA. В некоторых вариантах осуществления этого аспекта одна (например, две) или несколько молекул ингибирующей РНК являются полицистронными. В некоторых вариантах осуществления этого аспекта одна (например, две) или несколько молекул ингибирующей РНК направлены против одних и тех же или, в иллюстративных вариантах осуществления, различных мишеней РНК. В некоторых вариантах осуществления этого аспекта одна, большая часть или все из одной (например, двух) или более молекул ингибирующей РНК снижает экспрессию эндогенного TCR.
[505] В некоторых вариантах осуществления аспекта непосредственно выше, где Т-клетка или NK-клетка содержит одну или несколько (например, две или более) молекул ингибирующей РНК и CAR или нуклеиновые кислоты, кодирующие их, мишень РНК представляет собой mRNA, транскрибируемую из гена, выбранного из группы, состоящей из: PD-1, CTLA4, TCR альфа, TCR бета, CD3 дзета, SOCS, SMAD2, мишени miR-155, IFN гамма, cCBL, TRAIL2, PP2A и ABCG1. В некоторых вариантах осуществления этого аспекта по меньшей мере одна из одной (например, двух) или более молекул ингибирующей РНК представляет собой miR-155.
[506] В некоторых вариантах осуществления аспекта непосредственно выше, где Т-клетка или NK-клетка содержит одну или несколько (например, две или более) молекул ингибирующей РНК и CAR или нуклеиновые кислоты, кодирующие их, ASTR CAR представляет собой MRB ASTR и/или ASTR CAR связывается с опухолеассоциированным антигеном. Кроме того, в некоторых вариантах осуществления указанного выше аспекта первая последовательность нуклеиновой кислоты функционально связана с рибопереключателем, который, например, способен связывать аналог нуклеозида, и в иллюстративных вариантах осуществления представляет собой противовирусное лекарственное средство, такое как ацикловир.
[507] В способах и композициях, раскрытых в данном документе, экспрессия сконструированных сигнальных полипептидов регулируется элементом управления, и в некоторых вариантах осуществления элемент управления представляет собой полинуклеотид, содержащий рибопереключатель. В некоторых вариантах осуществления рибопереключатель способен связывать аналог нуклеозида, и когда аналог нуклеозида присутствует, экспрессируются один или оба сконструированных сигнальных полипептида.
[508] Генетически модифицированные лимфоциты, раскрытые в данном документе, также могут иметь полипептиды на своей поверхности, которые являются остатками слияния не способной к репликации рекомбинантной ретровирусной частицы во время способа трансдукции, предусмотренного в данном документе. Такие полипептиды могут включать элемент активации, элемент псевдотипирования и/или один или несколько слитых полипептидов, которые включают цитокин.
[509] В одном аспекте в данном документе представлена генетически модифицированная Т-клетка и/или NK-клетка, которая экспрессирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК и химерного антигенного рецептора, или CAR, как раскрыто в данном документе. В некоторых вариантах осуществления генетически модифицированная Т-клетка и/или NK-клетка дополнительно экспрессирует по меньшей мере один лимфопролиферативный элемент, как раскрыто в данном документе, который не является ингибирующей молекулой РНК. В некоторых вариантах осуществления генетически модифицированная Т-клетка и/или NK-клетка также экспрессируют один или несколько рибопереключателей, которые контролируют экспрессию одной или нескольких молекул ингибирующей РНК, CAR и/или по меньшей мере одного лимфопролиферативного элемента, который не является ингибирующей
молекулой РНК. В некоторых вариантах осуществления генетически модифицированная Т-клетка и/или NK-клетка экспрессирует от двух до 10 ингибирующих молекул РНК. В дополнительных вариантах осуществления генетически модифицированная Т-клетка и/или NK-клетка экспрессирует от двух до шести молекул ингибирующей РНК. В иллюстративных вариантах осуществления генетически модифицированная Т-клетка и/или NK-клетка экспрессируют четыре ингибирующие молекулы РНК.
НУКЛЕИНОВЫЕ КИСЛОТЫ
[510] В настоящем описании представлены полипептиды, кодирующие нуклеиновые кислоты, в соответствии с настоящим раскрытием. Нуклеиновая кислота в некоторых вариантах осуществления будет ДНК, включая, например, рекомбинантный вектор экспрессии. Нуклеиновая кислота в некоторых вариантах осуществления будет РНК, например, синтезированной in vitro РНК.
[511] В некоторых случаях нуклеиновая кислота обеспечивает продукцию полипептида по настоящему изобретению, например, в клетке млекопитающего. В других случаях рассматриваемая нуклеиновая кислота обеспечивает амплификацию нуклеиновой кислоты, кодирующей полипептид по настоящему изобретению.
[512] Нуклеотидная последовательность, кодирующая полипептид по настоящему изобретению, может быть функционально связана с элементом контроля транскрипции, например, промотором, энхансером и т.д.
[513] Подходящие промоторные и энхансерные элементы известны в данной области. Для экспрессии в бактериальной клетке подходящие промоторы включают, но не ограничиваются ими, lacl, lacZ, T3, T7, gpt, lambda P и trc. Для экспрессии в эукариотической клетке подходящие промоторы включают, но без ограничения, промотор и элементы энхансера гена иммуноглобулина легкой и/или тяжелой цепи; предранний промотор цитомегаловируса; промотор тимидинкиназы вируса простого герпеса; ранние и поздние промоторы SV40; промотор, присутствующий в длинных концевых повторах ретровируса; промотор мышиного металлотионеина-I; и различные тканеспецифичные промоторы, известные в данной области.
[514] Подходящие обратимые промоторы, включая обратимые индуцируемые промоторы, известны в данной области. Такие обратимые промоторы могут быть выделены и получены из многих организмов, например эукариот и прокариот. Модификация обратимых промоторов, полученных из первого организма, для использования во втором организме, например, в первом прокариоте и втором эукариоте, первом эукариоте и втором прокариоте и т.д., хорошо известна в данной области. Такие обратимые промоторы и системы, основанные на таких обратимых промоторах, но также включающие дополнительные контрольные белки, включают без ограничения промоторы, регулируемые спиртом (например, промотор гена алкогольдегидрогеназы I (alcA), промоторы, реагирующие на белки-трансактиваторы алкоголя (AlcR) и т.д.), промоторы, регулируемые тетрациклином (например, промоторные системы, включая TetActivators, TetON, TetOFF и т.д.), промоторы, регулируемые стероидами (например, промоторные системы рецепторов глюкокортикоидов крыс, системы промоторов рецепторов эстрогенов человека, системы промоторов ретиноидов, системы промоторов щитовидной железы , промоторные системы экдизона, промоторные системы мифепристона и т.д.), промоторы, регулируемые металлами (например, промоторные системы металлотионеина и т.д.), регулируемые промоторы, связанные с патогенезом (например, промоторы, регулируемые салициловой кислотой, промоторы, регулируемые этиленом, промоторы, регулируемые бензотиадиазолом и т.д.), терморегулируемые промоторы (например, промоторы, индуцируемые тепловым шоком (например, HSP-70, HSP-90, промоторы теплового шока сои и др.), светорегулируемые промоторы, синтетические индуцибельные промоторы и тому подобное.
[515] В некоторых случаях локус, конструкция или транс-ген, содержащие подходящий промотор, необратимо переключаются посредством индукции индуцибельной системы. Подходящие системы для индукции необратимого переключения хорошо известны в данной области, например, для индукции необратимого переключения может использоваться Cre-lox-опосредованная рекомбинация (см., например, Fuhrmann-Benzakein, et al., PNAS (2000)) 28: e99, раскрытие которого включено в настоящий документ посредством ссылки). Любая подходящая комбинация рекомбиназы, эндонуклеазы, лигазы, сайтов рекомбинации и т.д., известная в данной области, может быть использована для создания необратимо переключаемого промотора. Способы, механизмы и требования для выполнения сайт-специфической рекомбинации, описанные в другом месте в данном документе, находят применение при создании необратимо переключаемых промоторов и хорошо известны в данной области, см., Например, Grindley et al. (2006) Annual Review of Biochemistry, 567-605, и Tropp (2012) Molecular Biology (Jones & Bartlett Publishers, Sudbury, MA), описания которых включены в настоящий документ посредством ссылки.
[516] В некоторых случаях промотор представляет собой промотор, специфичный для клеток CD8, промотор, специфичный для клеток CD4, промотор, специфичный для нейтрофилов, или промотор, специфичный для NK. Например, можно использовать промотор гена CD4; см., например, Salmon et al. (1993) Proc. Natl. Acad. Sci. USA 90:7739; и Marodon et al. (2003) Blood 101:3416. В качестве другого примера можно использовать промотор гена CD8. Экспрессия, специфичная для NK-клеток, может быть достигнута с помощью промотора Neri (p46); см., например, Eckelhart et al. (2011) Blood 117:1565.
[517] В некоторых вариантах осуществления, например, для экспрессии в дрожжевой клетке, подходящий промотор представляет собой конститутивный промотор, такой как промотор ADH1, промотор PGK1, промотор ENO, промотор PYK1 и тому подобное; или регулируемый промотор, такой как промотор GALI, промотор GAL10, промотор ADH2, промотор PH05, промотор CUP1, промотор GAL7, промотор MET25, промотор MET3, промотор CYCl, промотор HIS3, промотор ADH1, промотор PGK, промотор GAPDH, промотор ADCl, промотор TRP1, промотор URA3, промотор LEU2, промотор ENO, промотор TP1 и AOX1 (например, для использования в Pichia). Выбор подходящего вектора и промотора находится в пределах компетенции среднего специалиста в данной области.
[518] Подходящие промоторы для использования в прокариотических клетках-хозяевах включают, но не ограничиваются ими, промотор РНК-полимеразы бактериофага Т7; промотор trp; промотор lac-оперона; гибридный промотор, например, гибридный промотор lac/tac, гибридный промотор tac/trc, промотор trp/lac, промотор T7/lac; промоутер trc; промотор tac и т.п .; промотор araBAD; промоторы, регулируемые in vivo, такие как промотор ssaG или родственный промотор (см., например, публикацию патента США № 20040131637), промотор pagC (Pulkkinen and Miller, J. Bacterial., 1991: 173(1): 86-93; Alpuche-Aranda et al., PNAS, 1992; 89(21): 10079-83), промотор nirB (Harborne et al. (1992) Mal. Micro. 6:2805-2813) и тому подобное (см., например, Dunstan et al. (1999) Infect. Immun. 67:5133-5141; McKelvie et al. (2004) Vaccine 22:3243-3255; и Chatfield et al. (1992) Biotechnol. 10:888-892); промотор sigma70, например консенсусный промотор sigma70 (см., например, регистрационные номера в GenBank AX798980, AX798961 и AX798183); промотор стационарной фазы, например промотор dps, промотор spv и т.п.; промотор, происходящий от острова патогенности SPI-2 (см., например, W096/17951); промотор actA (см., например, Shetron-Rama et al. (2002) Infect. Immun. 70: 1087-1096); промотор rpsM (см., например, Valdivia and Falkow (1996). Mal. Microbial. 22: 367); промотор tet (см., например, Hillen, W. and Wissmann, A. (1989) In Saenger,W. and Heinemann,U. (eds), Topics in Molecular and Structural Biology, Protein-Nucleic Acid Interaction. Macmillan, London, UK, Vol. 10, pp. 143-162); промотор SP6 (см., например, Melton et al. (1984) Nucl. Acids Res. 12:7035); и тому подобное. Подходящие сильные промоторы для использования в прокариотах, таких как Escherichia coli, включают, но не ограничиваются ими, Trc, Tac, T5, T7 и PLambda. Неограничивающие примеры операторов для использования в бактериальных клетках-хозяевах включают оператор промотора лактозы (белок-репрессор Laci изменяет конформацию при контакте с лактозой, тем самым препятствуя связыванию белка-репрессора Laci с оператором), оператор промотора триптофана (в комплексе с триптофаном), Репрессорный белок TrpR имеет конформацию, которая связывает оператора; в отсутствие триптофана репрессорный белок TrpR имеет конформацию, которая не связывается с оператором), и оператор промотора tac (см., например, deBoer et al. (1983) Proc. Natl. Acad. Sci. U.S.A. 80:21-25).
[519] Нуклеотидная последовательность, кодирующая полипептид по настоящему описанию, может присутствовать в векторе экспрессии и/или векторе клонирования. Нуклеотидные последовательности, кодирующие два отдельных полипептида, можно клонировать в одном и том же или в разных векторах. Вектор экспрессии может включать селектируемый маркер, точку начала репликации и другие особенности, которые обеспечивают репликацию и/или поддержание вектора. Подходящие векторы экспрессии включают, например, плазмиды, вирусные векторы и тому подобное.
[520] Специалистам в данной области известно большое количество подходящих векторов и промоторов; многие из них коммерчески доступны для создания рассматриваемых рекомбинантных конструкций. Следующие бактериальные векторы представлены в качестве примера: pBs, phagescript, PsiXl74, pBluescript SK, pBs KS, pNH8a, pNH16a, pNH18a, pNH46a (Stratagene, La Jolla, CA, USA); pTrc99A, pKK223-3, pKK233-3, pDR540 и pRIT5 (Pharmacia, Упсала, Швеция). В качестве примера представлены следующие эукариотические векторы: pWLneo, pSV2cat, pOG44, PXR1, pSG (Stratagene), pSVK3, pBPV, pMSG и pSVL (Pharmacia).
[521] Векторы экспрессии обычно имеют удобные сайты рестрикции, расположенные рядом с промоторной последовательностью, чтобы обеспечить встраивание последовательностей нуклеиновых кислот, кодирующих гетерологичные белки. Может присутствовать селектируемый маркер, действующий в экспрессирующем хозяине.
[522] Как отмечено выше, в некоторых вариантах осуществления нуклеиновая кислота, кодирующая полипептид по настоящему изобретению, в некоторых вариантах осуществления будет РНК, например, РНК, синтезированной in vitro. Способы синтеза РНК in vitro известны в данной области; любой известный метод может быть использован для синтеза РНК, включая нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению. Способы введения РНК в клетку-хозяина известны в данной области. См., например, Zhao et al. (2010) Cancer Res. 15:9053. Введение РНК, включающей нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению, в клетку-хозяин можно проводить in vitro, ex vivo или in vivo. Например, клетка-хозяин (например, NK-клетка, цитотоксический Т-лимфоцит и т.д.) может быть подвергнута электропорации in vitro или ex vivo с РНК, содержащей нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению.
[523] Различные аспекты и варианты осуществления, которые включают полинуклеотид, последовательность нуклеиновой кислоты и/или транскрипционную единицу, и/или вектор, включающий их, дополнительно включают одну или несколько последовательностей типа Козак, посттранскрипционной регуляторной последовательности вируса гепатита сурка. элемент (WPRE) и двойной стоп-кодон или тройной стоп-кодон, где один или несколько стоп-кодонов двойного стоп-кодона или тройного стоп-кодона определяют завершение считывания по меньшей мере одной из одной или нескольких транскрипционных единиц. В некоторых вариантах осуществления полинуклеотид, последовательность нуклеиновой кислоты, и/или транскрипционная единица, и/или вектор, включающий их, дополнительно включает последовательность типа Козак, имеющую 5' нуклеотид в пределах 10 нуклеотидов перед стартовым кодоном по меньшей мере одна из одной или нескольких транскрипционных единиц. В одном варианте осуществления последовательность типа Козак представляет собой или включает CCACCAT/UG (G) (SEQ ID NO: 515), CCGCCAT/UG (G) (SEQ ID NO: 516), GCCGCCGCCAT/UG (G) (SEQ ID NO: 517) или GCCGCCACCAT/UG (G) (SEQ ID NO: 515) (с нуклеотидами в скобках, представляющими необязательные нуклеотиды, и нуклеотиды, разделенные косой чертой, указывают разные возможные нуклеотиды в этом положении, например, в зависимости от того, является ли нуклеиновая кислота ДНК или РНК. В этих вариантах осуществления, которые включают стартовый кодон AU/TG, A можно рассматривать как положение 0. В некоторых иллюстративных вариантах осуществления нуклеотиды в -3 и +4 идентичны, например, -3 и +4 нуклеотиды могут быть G. В другом варианте осуществления последовательность типа Козак включает A или G в 3-м положении выше ATG, где ATG представляет собой старт-кодон. В другом варианте осуществления последовательность типа Козака включает A или G в 3-м положении выше AUG, где AUG представляет собой старт-кодон. В иллюстративном варианте осуществления последовательность Козака представляет собой (GCC) GCCRCCATG, где R представляет собой пурин (A или G). В иллюстративном варианте осуществления последовательность типа Козака представляет собой GCCGCCACCAUG (SEQ ID NO: 518). В другом варианте осуществления, который может быть объединен с предыдущим вариантом осуществления, который включает последовательность типа Козак и/или в следующем варианте осуществления, который включает тройной стоп-кодон, полинуклеотид включает элемент WPRE. WPRE были охарактеризованы в данной области (см., например, (Higashimoto et al., Gene Ther. 2007; 14: 1298)) и проиллюстрировано в данном документе Примерами 17 и 18. В некоторых вариантах осуществления элемент WPRE расположен с 3' конца стоп-кодона одной или нескольких транскрипционных единиц и от 5' к 3' LTR полинуклеотида. В другом варианте осуществления, который можно комбинировать с одним или обоими из предшествующих вариантов (т.е. с вариантом, в котором полинуклеотид включает последовательность типа Козак, и/или с вариантом осуществления, в котором полинуклеотид включает WPRE), одна или несколько транскрипционных единиц оканчиваются одним или несколькими стоп-кодонами двойного стоп-кодона или тройного стоп-кодона, при этом двойной стоп-кодон включает в себя первый стоп-кодон в первой рамке считывания и второй стоп-кодон во второй рамке считывания, или первый стоп-кодон в рамке считывания со вторым стоп-кодоном, и где тройной стоп-кодон включает в себя первый стоп-кодон в первой рамке считывания, второй стоп-кодон во второй рамке считывания и третий стоп-кодон в третьей рамке считывания, или первый стоп-кодон в кадре со вторым стоп-кодоном и третьим стоп-кодоном.
[524] В данном документе тройной стоп-кодон включает три стоп-кодона, по одному в каждой рамке считывания, в пределах 10 нуклеотидов друг от друга и предпочтительно имеющие перекрывающуюся последовательность, или три стоп-кодона в одной и той же рамке считывания, предпочтительно в последовательных кодонах. Двойной стоп-кодон означает два стоп-кодона, каждый в разной рамке считывания, в пределах 10 нуклеотидов друг от друга и предпочтительно имеющих перекрывающиеся последовательности, или два стоп-кодона в одной и той же рамке считывания, предпочтительно в последовательных кодонах.
[525] В некоторых раскрытых в данном документе методах и композициях введение ДНК в PBMC, B-клетки, T-клетки и/или NK-клетки и, необязательно, включение ДНК в геном клетки-хозяина, осуществляется с использованием методов, которые не используют не способные к репликации рекомбинантные ретровирусные частицы. Например, можно использовать другие вирусные векторы, такие как векторы, полученные из аденовируса, аденоассоциированного вируса или вируса простого герпеса-1, в качестве неограничивающих примеров.
[526] В некоторых вариантах осуществления способы, представленные в данном документе, могут включать трансфекцию и/или трансдукцию целевых клеток невирусными векторами. В любом из раскрытых в данном документе вариантов осуществления, в которых используются невирусные векторы для трансфекции целевых клеток, невирусные векторы, включая голую ДНК, могут быть введены в целевые клетки, такие как, например, PBMC, B-клетки, T-клетки и/или NK-клетки с использованием способов, которые включают электропорацию, нуклеофекцию, липосомные препараты, липиды, дендримеры, катионные полимеры, такие как поли (этиленимин) (PEI) и поли (l-лизин) (PLL), наночастицы, проникающие в клетки пептиды, микроинъекции и/или неинтегрирующие лентивирусные векторы. В некоторых вариантах осуществления ДНК может быть введена в целевые клетки, такие как PBMC, B-клетки, T-клетки и/или NK-клетки, в комплексе с липосомами и протамином. Другие способы трансфекции и/или трансдукции Т-клеток и/или NK-клеток ex vivo, которые можно использовать в вариантах осуществления способов, представленных в данном документе, известны в данной области (см., например, Morgan and Boyerinas, Biomedicines. 2016 Apr 20;4(2). pii: E9, включенная в настоящий документ посредством ссылки в полном объеме).
[527] В некоторых вариантах осуществления способа, представленного в данном документе, ДНК может быть интегрирована в геном с использованием систем-носителей на основе транспозонов путем котрансфекции, совместной нуклеофекции или совместной электропорации целевой ДНК в виде плазмиды, содержащей ITR-фрагменты транспозона на 5'- и 3'-концах. представляющего интерес гена и системы носителя транспозазы в виде ДНК, или мРНК, или протеина, или сайт-специфичных сериновых рекомбиназ, таких как phiC31, которая интегрирует интересующий ген в сайты псевдо-attP в геноме человека, в этом случае ДНК-вектор содержит от 34 до 40 п.н. attB сайт, который является последовательностью распознавания для фермента рекомбиназы (Bhaskar Thyagarajan et al. Site-Specific Genomic Integration in Mammalian Cells Mediated by Phage ϕC31 Integrase, Mol Cell Biol. 2001 Jun; 21(12): 3926-3934) и котрансфицирован рекомбиназой. Для Т-клеток и/или NK-клеток системы на основе транспозонов, которые можно использовать в определенных способах, представленных в данном документе, используют систему-носитель ДНК Sleeping Beauty (см., например, патент США № 6489458 и заявку на патент США № 15/434595, включенную в настоящий документ посредством ссылки), система-носитель ДНК PiggyBac (см., например, Manuri et al., Hum Gene Ther. 2010 Apr; 21 (4):427-37, включенная в настоящий документ посредством ссылки в полном объеме), или систему транспозона Tol2 (см., например, Tsukahara et al., Gene Ther. 2015 Feb; 22(2): 209-215, включенный в настоящий документ посредством ссылки) в форме ДНК, mRNA или белка. В некоторых вариантах осуществления транспозон и/или транспозаза векторных систем на основе транспозонов можно получить в виде мини-кольцевого ДНК-вектора перед введением в Т-клетки и/или NK-клетки (см., например, Hudecek et al., Recent Results Cancer Res. 2016;209:37-50, и Monjezi et al., Leukemia. 2017 Jan;31(1):186-194, включено в настоящий документ посредством ссылки в полном объеме). CAR или лимфопролиферативный элемент также можно интегрировать в определенные и специфические сайты в геноме с помощью интеграции, опосредованной CRISPR или TALEN, путем добавления плеч гомологии 50-1000 п.н., гомологичных интеграции 5' и 3' целевого сайта (Jae Seong Lee et al. Scientific Reports 5, Article number: 8572 (2015), Site-specific integration in CHO cells mediated by CRISPR/Cas9 and homology-directed DNA repair pathway). CRISPR или TALEN обеспечивают специфичность и геномно-целевое расщепление, и конструкция будет интегрирована посредством гомологически опосредованного соединения концов (Yao X at al. Cell Res. 2017 Jun;27(6):801-814. doi: 10.1038/cr.2017.76. Epub 2017 May 19). CRISPR или TALEN можно котрансфицировать целевой плазмидой в виде ДНК, mRNA или белка.
ПАКУЮЩИЕ КЛЕТКИ
[528] В настоящем изобретении представлены пакующие клетки и линии клеток млекопитающих, которые представляют собой линии упаковывающих клеток, которые продуцируют не способные к репликации рекомбинантные ретровирусные частицы, которые генетически модифицируют целевые клетки млекопитающих и сами целевые клетки млекопитающих. В иллюстративных вариантах осуществления пакующая клетка содержит последовательности нуклеиновых кислот, кодирующие упаковываемый геном РНК не способной к репликации ретровирусной частицы, белок REV, полипептид gag, полипептид pol и элемент псевдотипирования;
[529] Подходящие клетки млекопитающих включают первичные клетки и иммортализованные клеточные линии. Подходящие линии клеток млекопитающих включают линии клеток человека, линии клеток приматов, отличных от человека, линии клеток грызунов (например, мыши, крысы) и т.п. Подходящие линии клеток млекопитающих включают без ограничения клетки HeLa (например, Американскую коллекцию типовых культур (ATCC) № CCL-2), клетки CHO (например, ATCC № CRL9618, CCL61, CRL9096), клетки HEK293 (например, ATCC № CRL-1573), адаптированные к суспензии клетки HEK293, клетки Vero, клетки NIH 3T3 (например, ATCC № CRL-1658), клетки Huh-7, клетки BHK (например, ATCC № CCL10), клетки PC12 (ATCC № CRL1721), клетки COS, клетки COS-7 (ATCC № CRL1651), клетки RAT1, L-клетки мыши (ATCC № CCLI.3), клетки эмбриональной почки человека (HEK) (ATCC № CRL1573), клетки HLHepG2, Hut-78, Jurkat, HL-60, линии клеток NK (например, NKL, NK92 и YTS) и т.п.
[530] В некоторых случаях клетка не является иммортализованной клеточной линией, а вместо этого является клеткой (например, первичной клеткой), полученной от индивидуума или клетки ex vivo. Например, в некоторых случаях клетка представляет собой иммунную клетку, полученную от человека. В качестве другого примера клетка представляет собой стволовую клетку или клетку-предшественницу, полученную от индивидуума. В любом из вариантов осуществления и аспектов, представленных в данном документе, которые включают B-клетку, T-клетку или NK-клетку, клетка может быть аутологичной клеткой или может быть аллогенной клеткой (также называемой в данном документе аллогенной клеткой). В некоторых вариантах осуществления аллогенная клетка может представлять собой аллогенную клетку, полученную с помощью генной инженерии. Аллогенные клетки, такие как аллогенные Т-клетки, и способы генетической инженерии аллогенных клеток известны в данной области. В некоторых вариантах осуществления аллогенная клетка может быть иммортализованной клеткой. В некоторых вариантах осуществления, где аллогенная клетка представляет собой Т-клетку, Т-клетка была генетически сконструирована таким образом, что по меньшей мере одна из ее рецепторных цепей Т-клетки не функционирует и/или по меньшей мере частично удалена. В некоторых вариантах осуществления аллогенная клетка может быть модифицирована таким образом, что в ней полностью или частично отсутствует ген микроглобулина В2. В некоторых вариантах осуществления, где аллогенные клетки используются в способах, описанных в данном документе, лимфопролиферативные элементы и/или CLE могут функционировать для уменьшения количества клеток, которые необходимы для практического осуществления настоящего изобретения, и могут способствовать производству клеток Т-клеток, В-клеток или NK-клеток от субъекта.
СПОСОБЫ АКТИВАЦИИ ИММУННОЙ КЛЕТКИ
[531] В настоящем раскрытии представлены способы активации иммунной клетки, в иллюстративных вариантах осуществления лимфоцита, in vitro, in vivo или ex vivo. Способы обычно включают приведение в контакт иммунной клетки (in vitro, in vivo или ex vivo) с активирующим элементом или с одним или несколькими целевыми антигенами, где иммунная клетка была генетически модифицирована для получения CAR, ограниченного микроокружением, согласно настоящему изобретению. В присутствии одного или нескольких целевых антигенов CAR, ограниченный микроокружением, активирует иммунную клетку, тем самым производя активированную иммунную клетку. Иммунные клетки включают, например, цитотоксический T-лимфоцит, NK-клетку, CD4+ T-клетку, T-регуляторную (Treg) -клетку, γδ T-клетку, NK-T-клетку, нейтрофилы и т.д. В других вариантах осуществления приведения в контакт Т-клетки со средством, активирующим Т-клетки, активирует Т-клетку. Такие способы представлены в данном документе и обсуждаются в разделе «Элемент активации».
[532] Контакт генетически модифицированной иммунной клетки (например, Т-лимфоцита, NK-клетки) с одним или несколькими целевыми антигенами может увеличить выработку цитокина иммунной клеткой по меньшей мере на около 10%, на по меньшей мере около 15%, на по меньшей мере около 20%, на по меньшей мере около 25%, на по меньшей мере около 30%, на по меньшей мере около 40%, на по меньшей мере около 50%, на по меньшей мере около 75%, по меньшей мере в около 2 раза, по меньшей мере в около 2,5 раза, по меньшей мере в около 5 раз, по меньшей мере в около 10 раз или более чем в 10 раз по сравнению с количеством цитокинов, продуцируемых иммунной клеткой в отсутствие одного или нескольких целевых антигенов. Цитокины, продуцирование которых может быть увеличено, включают, помимо прочего, IL-2 и IFN-γ.
[533] Контакт генетически модифицированной цитотоксической клетки (например, цитотоксического Т-лимфоцита) с AAR может повысить цитотоксическую активность цитотоксической клетки по меньшей мере на около 10%, на по меньшей мере около 15%, на по меньшей мере около 20%, на по меньшей мере около 25%, на по меньшей мере около 30%, на по меньшей мере около 40%, на по меньшей мере около 50%, на по меньшей мере около 75%, по меньшей мере в около 2 раза, по меньшей мере в около 2,5 раза, по меньшей мере в около 5 раз, по меньшей мере в около 10 раз или более чем в 10 раз по сравнению с активностью цитотоксической клетки в отсутствие одного или нескольких целевых антигенов.
[534] Контакт генетически модифицированной цитотоксической клетки (например, цитотоксического Т-лимфоцита) с одним или несколькими антигенами может повысить цитотоксическую активность цитотоксической клетки по меньшей мере на около 10%, на по меньшей мере около 15%, на по меньшей мере около 20%, на по меньшей мере около 25%, на по меньшей мере около 30%, на по меньшей мере около 40%, на по меньшей мере около 50%, на по меньшей мере около 75%, по меньшей мере в около 2 раза, по меньшей мере в около 2,5 раза, по меньшей мере в около 5 раз, по меньшей мере в около 10 раз или более чем в 10 раз по сравнению с активностью цитотоксической клетки в отсутствие одного или нескольких целевых антигенов.
[535] В других вариантах осуществления, например, в зависимости от иммунной клетки-хозяина, приведение в контакт генетически модифицированной клетки-хозяина с антигеном может увеличивать или уменьшать пролиферацию клеток, выживаемость клеток, гибель клеток и т.п.
СПОСОБЫ ПОЛУЧЕНИЯ ОГРАНИЧЕННОГО МИКРООКРУЖЕНИЕМ АНТИГЕНСПЕЦИФИЧЕСКОЙ НАЦЕЛЕННОЙ ОБЛАСТИ
[536] В некоторых вариантах осуществления антигенсвязывающие домены (также называемые в данном документе «антигенспецифическими целевыми областями» или «ASTR») CAR конститутивно связывают свои когнатные антигены. В других вариантах осуществления ASTR могут быть ограничены микроокружением, предпочтительно или связываются только с их когнатным антигеном в определенных аберрантных условиях, таких как те, которые существуют в микроокружении опухоли, как более подробно раскрыто в данном документе. Ограниченные микроокружением ASTR, которые связываются преимущественно или исключительно в аберрантных условиях микроокружения опухоли, могут обеспечивать снижение воздействия на мишень вне опухоли, поскольку связывание с антигеном в нормальных физиологических условиях снижается, в некоторых ситуациях до уровней ниже уровня обнаружения с помощью иммуноанализов. В некоторых аспектах CAR, представленные в данном документе, включают ASTR, ограниченный микроокружением, который специфически связывается с целевым белком, где ASTR представляет собой scFv-фрагмент, который включает вариабельную область тяжелой цепи и вариабельную область легкой цепи.
[537] Определенные иллюстративные варианты осуществления аспектов, раскрытых в данном документе, например, способы, клетки, клеточные линии, не способные к репликации рекомбинантные ретровирусные частицы, полинуклеотиды или векторы, раскрытые в данном документе, включают CAR, которые включают ограниченные микроокружением антигенспецифические целевые области.
[538] Соответственно, в одном аспекте в данном документе предусмотрен антигенный химерный рецептор для связывания целевого антигена, который содержит:
а) ограниченную микроокружением антигенспецифическую нацеленную область, которая демонстрирует увеличение связывания с целевым антигеном в аберрантном состоянии по сравнению с нормальной физиологической средой, где антигенспецифическая нацеленная область связывается с мишенью;
b) трансмембранный домен; и
c) внутриклеточный активирующий домен.
[539] В другом аспекте в данном документе предусмотрен антигенный химерный рецептор для связывания целевого антигена, который содержит:
а) по меньшей мере одну ограниченную микроокружением антигенспецифическую целевую область, выбранную путем панорамирования полипептидной библиотеки и имеющую повышенную активность в анализе связывания целевого антигена в аберрантном состоянии по сравнению с нормальным физиологическим состоянием;
b) трансмембранный домен; и
c) внутриклеточный активирующий домен.
[540] В некоторых вариантах осуществления любого аспекта, раскрытого в данном документе, любой из рецепторов химерного антигена может быть ограничен микроокружением, так что они проявляют увеличение связывающей активности в аберрантном состоянии по сравнению с нормальным физиологическим состоянием. В некоторых иллюстративных вариантах осуществления любого аспекта, раскрытого в данном документе, ASTR, ограниченный микроокружением, идентифицируется из исходной полипептидной библиотеки без мутации/эволюции представителей библиотеки перед скринингом/эволюцией и/или без мутации во время или между необязательными повторными раундами скрининга. Иллюстративные трансмембранные домены и внутриклеточные активирующие домены могут быть любыми из раскрытых в данном документе для CAR.
[541] В одном аспекте в данном документе представлен способ выбора ASTR, ограниченного микроокружением, включающий панорамирование библиотеки отображения полипептидов с помощью:
а. воздействие на полипептиды библиотеки полипептидного дисплея анализа связывания целевого антигена в нормальных физиологических условиях и анализа связывания целевого антигена в аберрантных условиях; и
b. отбор полипептида, который проявляет увеличение активности связывания целевого антигена в аберрантном состоянии по сравнению с физиологическим состоянием, тем самым выбирая антигенспецифичную целевую область, ограниченную микроокружением.
[542] В другом аспекте в данном документе предоставляется способ выделения ASTR, ограниченного микроокружением, который включает панорамирование библиотеки полипептидов с помощью:
приведения в контакт библиотеки полипептидов в аберрантных условиях с целевым антигеном, связанным с твердой подложкой, при этом клоны, экспрессирующие полипептиды, которые связывают целевой антиген, остаются связанными с твердой подложкой через целевой антиген;
инкубирование твердых носителей со связанными полипептидами в физиологических условиях; и
сбор клонов, которые элюируются с твердой подложки в физиологических условиях, тем самым выделяя ограниченную микроокружением антигенспецифическую целевую область.
[543] В некоторых иллюстративных вариантах осуществления любого аспекта, раскрытого в данном документе, антигенспецифическая нацеленная область, ограниченная микроокружением, идентифицируется из начального скрининга библиотеки полипептидов без мутации/эволюции членов библиотеки перед скринингом и/или без мутации/эволюции во время или между необязательными повторными раундами скрининга или панорамирования.
[544] Нормальные физиологические условия могут включать температуру, pH, осмотическое давление, осмоляльность, окислительный стресс и концентрацию электролитов, которые можно рассматривать в пределах нормального диапазона в месте введения или в ткани или органе в месте воздействия субъекту. Аберрантное состояние представляет собой состояние, которое отклоняется от обычно приемлемого диапазона для этого состояния. В одном аспекте ограниченная микроокружением антигенспецифическая нацеленная область (т.е. полипептид) фактически неактивна в нормальных условиях, но активна в отличных от нормальных условий на уровне, который равен или лучше, чем в нормальных условиях. Например, в одном аспекте антигенспецифическая нацеленная область, ограниченная микроокружением, фактически неактивна при температуре тела, но активна при более низких температурах. В другом аспекте антигенспецифическая нацеленная область, ограниченная микроокружением, обратимо или необратимо инактивируется в нормальных условиях. В дополнительном аспекте антигенспецифическая нацеленная область, ограниченная микроокружением, представляет собой терапевтический белок. В другом аспекте антигенспецифическая нацеленная область, ограниченная микроокружением, используется в качестве лекарственного средства или терапевтического средства. В еще одном аспекте антигенспецифическая нацеленная область, ограниченная микроокружением, более или менее активна в сильно насыщенной кислородом крови, такой как, например, после прохождения через легкие или в средах с более низким pH, обнаруживаемых в почках.
[545] В некоторых вариантах осуществления выполняется один раунд отбора для получения антигенспецифической целевой области, ограниченной микроокружением. В некоторых вариантах осуществления способ скрининга или панорамирования повторяется после идентификации свободных полипептидов, которые связываются с антигеном в аберрантных условиях и не связываются в физиологических условиях, или клеток, экспрессирующих тестируемый полипептид, который обладал этими свойствами, или фага, покрытого тестируемым полипептидом, который имеет такие свойства в начальном или предыдущем раунде. В некоторых способах собранные фаги используются для инфицирования клеток, которые также могут быть инфицированы фагом-помощником, чтобы амплифицировать собранный фаг. В других способах, где тестируются полипептиды на поверхности клеток, собранные клетки можно выращивать для «амплификации» полипептидов, экспрессируемых клетками, путем амплификации полинуклеотидов в клетках, которые кодируют полипептиды. В некоторых вариантах осуществления амплификацию проводят путем выращивания клеток, которые экспрессируют идентифицированные полипептиды, без выполнения процесса мутирования полинуклеотидов, кодирующих идентифицированные полипептиды, между раундами. Таким образом, полипептиды, которые были собраны в предыдущем раунде, обогащаются амплифицирующими клетками, которые содержат полинуклеотиды, кодирующие эти собранные полипептиды.
[546] Способ панорамирования или скрининга может выполняться один раз или повторяться от 1 до 1000 раз. В иллюстративных вариантах осуществления панорамирование повторяется от 1 до 20 раз, от 2 до 10 раз или от 2 до 5 раз.
[547] В других способах ASTR, ограниченные микроокружением, против интересующего антигена (то есть целевого антигена) выполняются с использованием одного или нескольких раундов мутации/эволюции между раундами панорамирования. В одном способе белок дикого типа идентифицируют, например, путем создания библиотеки полипептида или белков и скрининга полипептида или библиотеки белков на полипептид или белок с желаемой аффинностью связывания с целевым антигеном. В некоторых вариантах осуществления, где белки дикого типа являются антителами, антитела дикого типа могут быть обнаружены путем создания и скрининга библиотек поликлональных или моноклональных антител, включая библиотеки антител фагового дисплея, например библиотеки гуманизированных антител фагового дисплея.
[548] Эволюционировавшие ASTR можно получить, подвергая белок дикого типа или последовательность нуклеиновой кислоты, кодирующую белок дикого типа, процессу мутагенеза с целью получения популяции мутантных полипептидов, которые можно подвергнуть скринингу для идентификации мутантного ASTR с повышенной активностью. (например, повышенная аффинность связывания с целевым антигеном) в среде опухоли и/или в условиях анализа суррогата опухоли in vitro по сравнению с нормальной физиологической средой. Примеры таких способов представлены в WO2016033331 («УСЛОВНО АКТИВНЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ МОДИФИЦИРОВАННЫХ Т-КЛЕТОК») или в патенте США № 8709755, оба включены в настоящее описание в качестве ссылки в их полном объеме. Этот способ получения антитела, ограниченного микроокружением, полностью включен в данный документ посредством ссылки.
[549] В других вариантах осуществления антигенспецифические полипептиды, ограниченные микроокружением (т.е. нацеленные области, например, антитела), могут быть идентифицированы путем скрининга исходной полипептидной библиотеки в аберрантных по сравнению с физиологическими условиями и идентификации тестируемого полипептида из исходной полипептидной библиотеки, который связывается преимущественно или исключительно в аберрантных условиях по сравнению с физиологическими условиями. В некоторых примерах идентифицированные и выделенные антигенспецифические полипептиды, ограниченные микроокружением (т.е. нацеленные области, например, антитела), идентифицированные из исходной полипептидной библиотеки при начальном скрининге библиотеки полипептидов, связывают свой когнатные антиген предпочтительно или исключительно в аберрантных по сравнению с физиологическими условиями. В таких случаях раунды мутации/эволюции не выполняются. Соответственно способ в иллюстративных вариантах осуществления выполняется без мутирующих полинуклеотидов, кодирующих выделенную ограниченную микроокружением антигенспецифическую целевую область между раундами скрининга (например, раунды панорамирования), или выполняется только для одного анализа связывания в аберрантных по сравнению с физиологическими условиями для выделения и идентификации антигенспецифического полипептида, ограниченного микроокружением (т.е. нацеленная область, например, антитело). Способ может быть осуществлен путем культивирования, высокоточной амплификации и/или разбавления полинуклеотидов, кодирующих антигенспецифические нацеленные области, или организмов-хозяев, включая их, между раундами скрининга и/или панорамирования, без каких-либо мутаций/эволюции. Кроме того, способ может выполняться без повторения скрининга и/или пэннинга и может выполняться без мутации/эволюции полинуклеотида, кодирующего выделенную ограниченную микроокружением антигенспецифичную целевую область, после того, как ограниченная микросредой антигенспецифический полипептид (т.е. целевая область, например антитело) выделен.
[550] Анализы для применения в способах, представленных в данном документе, для обнаружения связывания полипептида с когнатным связывающим партнером, включают анализы на основе клеток и, в частности, анализы, выполняемые с использованием систем отображения на клеточной поверхности, таких как системы отображения на поверхности клеток млекопитающих. В иллюстративном способе нуклеиновые кислоты, кодирующие полипептид или библиотеку вариантных полипептидов, включая библиотеку модифицированных полипептидов, можно ввести в вектор, подходящий для экспрессии в клетках, таких как клетки млекопитающих. Затем клетки трансфицируют вектором, и полипептиды экспрессируются клетками. Библиотека клеток, содержащих поверхностно экспрессируемые полипептиды, может контактировать с раствором, содержащим растворимый или связанный с поверхностью родственный связывающий партнер. Активность связывания можно определить с помощью любого анализа, который может обнаружить связывание с поверхностью клеток. Активность также можно оценить путем оценки функциональной активности полипептида или полипептида. Любой анализ на основе клеток, известный специалисту в данной области, рассматривается для использования в способах, представленных в данном документе, включая анализы пролиферации клеток, анализы гибели клеток, проточную цитометрию, методы разделения клеток, сортировку активируемых флуоресценцией клеток (FACS), фазовую микроскопию, флуоресцентную микроскопию, рецептор анализы связывания, анализы клеточной сигнализации, иммуноцитохимические анализы и анализы репортерных генов. В некоторых примерах анализы представляют собой анализы сортировки клеток с активацией флуоресценции (FACS).
[551] Полипептиды или белки могут экспрессироваться клетками млекопитающих в виде секретируемых растворимых молекул, молекул клеточной поверхности или внутриклеточных антител. В типичном способе клетки можно трансфицировать библиотекой белков в условиях, при которых большая часть или все клетки отображают представителя библиотеки белков, закрепленного на поверхности клетки. Необязательно, может использоваться система экспрессии, в которой большинство трансфектантов клеток млекопитающих имеют только одну плазмиду, интегрированную в их геном. Следовательно, большинство (т.е. по меньшей мере около 70%, или около 80%, или около 90%) трансфектантов экспрессируют одну или несколько молекул одного полипептида. Это можно проверить, например, путем выделения и культивирования индивидуальных трансфектантов; и амплификацию и секвенирование экспрессированных последовательностей, чтобы определить, имеют ли они единственную последовательность.
[552] В некоторых примерах способов, представленных в данном документе, полипептиды представляют собой антитела, отображаемые на поверхности клеток млекопитающих. Любое антитело, описанное здесь, может быть экспрессировано на поверхности клеток млекопитающих, включая полноразмерные, двухвалентные, функциональные антитела, такие как антитела IgG. Антитело может представлять собой фрагмент, например, фрагмент Fab или фрагмент scFv. Антитела могут включать Fc-область, такую как scFv-Fc, или полноразмерное антитело, которое содержит две тяжелые и две легкие цепи. Квалифицированный специалист может выбрать подходящий фрагмент антитела. Например, ScFv-Fc и полноразмерные антитела, полученные в клетках млекопитающих, могут иметь несколько преимуществ перед фрагментами scFv или Fab.
[553] Твердые подложки, которые можно использовать в анализах связывания, представленных в данном документе, включают любой носитель, который может быть прикреплен к партнеру связывания полипептида, такому как лиганд, рецептор или антиген. Обычно для облегчения высокопроизводительного скрининга когнатный партнер по связыванию прикрепляется к твердой подложке. Примеры носителей для использования в качестве твердых носителей в способах, представленных в данном документе, включают без ограничения стекло, полистирол, полипропилен, полиэтилен, декстран, нейлон, амилозы, природные и модифицированные целлюлозы, полиакриламиды, агарозы и твердые магнитные носители, такие как твердые опоры, в состав которых входит магнетит. Твердая подложка может представлять собой одну или несколько гранул или частиц, микросфер, поверхность трубки или пластины, фильтрующую мембрану и другие твердые подложки, известные в данной области. Иллюстративные системы твердой подложки включают без ограничения плоскую поверхность, построенную, например, из стекла, кремния, металла, нейлона, целлюлозы, пластмассы или композита, включая многолуночные планшеты или мембраны; или может иметь форму гранулы, такой как силикагель, стекла с регулируемыми порами, магнитной или целлюлозной гранулы. Кроме того, такие способы можно адаптировать для использования в суспензии или в форме колонки. В некоторых вариантах осуществления антигенспецифический полипептид, ограниченный микроокружением (т.е. целевая область, например, антитело), идентифицируется и выделяется путем биопанорамирования фагового дисплея или дисплея на поверхности дрожжей (Colby et al., "Engineering Antibody Affinity by Yeast Surface Display," Meth. Enzym. 388, 26 (2004)) библиотеки антител (например, гуманизированных антител) с иммобилизованным целевым антигеном. Например, либо библиотеку наивных гуманизированных антител, либо библиотеку синтетических гуманизированных антител можно проанализировать с использованием способов фагового дисплея или дисплея на поверхности дрожжей, описанных в данном документе. В некоторых вариантах осуществления способа начального фагового дисплея клоны фагов могут быть перенесены в вектор млекопитающего и использованы в способе скрининга поверхности клеток млекопитающих (см., например, Yoon et al., BMC Biotechnology 12:62; 1472-6750 (2012)). Иллюстративный способ выполнения фагового дисплея для выделения антигенспецифической целевой области, ограниченной микроокружением, представлен в Примере 2.
[554] ASTR, ограниченный микроокружением, идентифицированный с использованием представленных в данном документе способов, может быть антителом, антигеном, лигандом, рецепторсвязывающим доменом лиганда, рецептором, лигандсвязывающим доменом рецептора или аффителом. В вариантах осуществления, где ASTR с ограниченным микроокружением представляет собой антитело, это может быть антитело полной длины, одноцепочечное антитело, фрагмент Fab, фрагмент Fab', фрагмент (Fab')2, фрагмент Fv и бивалентное одноцепочечное антитело или диатело. где антигенспецифическая нацеленная область включает тяжелую цепь и легкую цепь антитела. В некоторых вариантах осуществления ASTR, ограниченный микроокружением, представляет собой одноцепочечный вариабельный фрагмент. Такой одноцепочечный вариабельный фрагмент может иметь тяжелую и легкую цепи, разделенные линкером, при этом линкер имеет длину от 6 до 100 аминокислот. В некоторых вариантах осуществления тяжелая цепь расположена на N-конце легкой цепи химерного антигенного рецептора. В других вариантах осуществления легкая цепь расположена на N-конце тяжелой цепи. ASTR, ограниченный микроокружением, может представлять собой биспецифическую ASTR.
[555] ASTR, ограниченные микроокружением, идентифицированные с использованием способов, представленных в данном документе, обычно представляют собой полипептиды и, более конкретно, полипептидные антитела, а в иллюстративных вариантах осуществления одноцепочечные антитела. Эти полипептиды могут связываться со своими когнатными антигенами с более высокой или более низкой аффинностью в аберрантных условиях по сравнению с нормальными условиями, но в иллюстративных вариантах осуществления связываются с более высокой аффинностью в аберрантных условиях, чем нормальных условиях. В некоторых вариантах осуществления эти полипептиды могут связываться со своим когнатным антигеном с на 10%, 20%, 25%, 50%, 75%, 90%, 95% или 99% большей аффинностью в аберрантных условиях, чем в физиологических (т.е. нормальных) условиях. В некоторых вариантах осуществления ASTR, идентифицируемые с использованием представленных в данном документе способов, не связываются со своими когнатными антигенами в нормальных физиологических условиях до любого детектируемого уровня, превышающего исходные уровни, полученные с использованием отрицательных контролей, таких как антитела отрицательного контроля.
[556] Нуклеотидная последовательность, кодирующая ASTR, ограниченная микроокружением, выделенная способом, представленным в данном документе, может быть определена путем секвенирования нуклеотидов собранной клетки, экспрессирующей ограниченное микроокружением антигенспецифическое нацеливание. Эту информацию о нуклеотидной последовательности затем можно использовать для создания биологического химерного антигенного рецептора, ограниченного микроокружением (MRB-CAR), путем создания полинуклеотида, который кодирует полипептид, содержащий антигенспецифическую нацеленную область, ограниченную микроокружением (MRB-ASTR), трансмембранный домен и внутриклеточный активирующий домен. Ограниченные микроокружением антигенспецифические целевые области могут быть клонированы в систему экспрессии конструкции CAR, которая может быть использована для создания рекомбинантных лентивирусов, которые включают CAR в свой геном, а затем рекомбинантные лентивирусы могут быть использованы для трансдукции Т-клеток для тестирования на CAR-опосредованный опухолевый антиген, экспрессирующий уничтожение целевых клеток в селективной для опухоли среде по сравнению с физиологическими условиями.
УСЛОВИЯ ДЛЯ УСЛОВНОЙ АКТИВНОСТИ
[557] В способах, представленных в данном документе, активность одного или нескольких полипептидов, таких как, например, одноцепочечные антитела, проверяется или тестируется в двух различных наборах условий, которые имитируют состояние или условия в двух разных физиологических средах, таких как, например, патологическое микроокружение и нормальное физиологическое состояние непатологического микроокружения. Обычно условия представляют собой условия, которые можно моделировать или воспроизводить in vitro. Набор условий может включать в себя одно или несколько условий для имитации микроокружения, ассоциированного с заболеванием. Заболевание может изменять внутриклеточный и внеклеточный гомеостаз. Например, патологическое микроокружение может имитировать одно или несколько состояний в микроокружении опухоли или микроокружении рака. Обычно разница или различия в активности при двух наборах условий могут привести к условной активности молекулы. Таким образом, молекула, которая проявляет большую активность в первом наборе условий (например, моделирование условий в микроокружении опухоли) по сравнению со вторым набором условий (например, моделирование условий в нормальном или непатологическом окружении), идентифицируется как кандидатная молекула, которая ограничена микроокружением.
[558] Два набора условий могут быть выбраны для изменения одним или несколькими параметрами, которые различаются в двух физиологических средах, например, как описано в данном документе или известно специалисту в данной области техники, включая без ограничения химические условия, биологические условия или физические условия. Параметры, которые могут варьироваться между двумя наборами условий, могут включать одно или несколько условий, выбранных из следующих: давление, температура, pH, ионная сила, осмотическое давление, осмоляльность, окислительный стресс, мутность, воздействие света (включая УФ, инфракрасный или видимый свет), концентрация одного или нескольких растворенных веществ, таких как электролиты, концентрация глюкозы, концентрация гиалуронана, концентрация молочной кислоты или лактата, концентрация альбумина, уровни аденозина, уровни R-2-гидроксиглутарата, концентрация пирувата, концентрация кислород и/или присутствие окислителей, восстановителей или кофакторов. Варьируя электролит и буферные системы в калибровочных растворах, физиологические условия, такие как pH, буферная емкость, ионная среда, температура, концентрация глюкозы и ионная сила, могут быть скорректированы в соответствии с биологическим окружением, которое будет моделироваться. Набор условий, которые имитируют нормальное физиологическое окружение, может быть выбрано так, чтобы оно отличалось от набора условий, которые моделируют патологическое микроокружение, такое как микроокружение опухоли, одним или несколькими условиями, описанными в данном документе.
[559] Например, как обсуждается ниже, различные параметры микроокружения опухоли отличаются по сравнению с микроокружением, не связанным с опухолью, включая без ограничения концентрацию кислорода, давление, присутствие кофакторов, pH, концентрацию гиалуронана, концентрацию лактата, концентрацию альбумина, уровни аденозина, уровни R-2-гидроксиглутарата и концентрацию пирувата. Любой из этих параметров может быть воспроизведен in vitro для моделирования одного или нескольких условий, существующих в опухолевой или раковой среде, по сравнению с условиями, которые существуют в неопухолевом или нормальном окружении. Нормальные физиологические условия, которые можно моделировать, включают окружения, обнаруженные в здоровой или непатологической ткани в любом месте тела, например, в желудочно-кишечном тракте, коже, сосудистой сети, крови и внеклеточном матриксе. Обычно в анализах, описанных в данном документе, физиологические условия можно моделировать in vitro путем выбора буфера, который используется для оценки активности белка. Например, любое одно или несколько состояний патологического микроокружения (такого как микроокружение опухоли) и непатологического окружения можно моделировать с помощью различий в буфере для анализа, используемом для оценки активности в анализе. Следовательно, в способах, описанных в данном документе для идентификации полипептида, ограниченного микроокружением, компонент или компоненты, или характеристика, или характеристики буфера для анализа изменяются или делаются другими в первом анализе для проверки активности в первом состоянии и во втором анализе для тестирования активности при втором условии. Например, как обсуждается в данном документе, различные параметры микроокружения опухоли отличаются по сравнению с неопухолевым окружением, включая без ограничений кислород, давление, присутствие кофакторов, pH, концентрацию гиалуронана (например, повышенную или пониженную концентрацию гиалуронана), концентрацию лактата (например, повышенную или пониженную концентрацию лактата), концентрацию альбумина (например, повышенную или пониженную концентрацию альбумина), уровни аденозина (например, повышенные или пониженные уровни аденозина), уровни R-2-гидроксиглутарата (например, повышенные или пониженные уровни R-2-гидроксиглутарата) и концентрацию пирувата (включая повышенную или пониженную концентрацию пирувата). Более конкретно, условия в микроокружении опухоли могут включать более низкий pH, более высокие концентрации гиалуронана, более высокие концентрации лактата и пирувата, более высокие концентрации альбумина, повышенные уровни аденозина, повышенные уровни R-2-гидроксиглутарата, гипоксию, более низкую концентрацию глюкозы, и несколько более высокую температуру по сравнению с неопухолевым микроокружением. Например, ASTR, ограниченная микроокружением, практически неактивна при нормальной температуре тела, но активна при более высокой температуре в микроокружении опухоли. В еще одном аспекте ограниченное микроокружением антитело менее активно в нормальной оксигенированной крови, но более активно в менее оксигенированном окружении, которое существует в опухоли. В еще одном аспекте ограниченное микроокружением антитело менее активно при нормальном физиологическом pH 7,2-7,8, но более активно при кислом pH 5,8-7,0 или 6,0-6,8, которое существует в микроокружении опухоли. Например, ограниченное микроокружением антитело более активно при pH 6,7, чем при pH 7,4. Существуют и другие состояния в микроокружении опухоли, известные специалисту в данной области техники, которые также могут использоваться в качестве состояния в настоящем изобретении, при котором условно активные ASTR имеют различную аффинность связывания. Условия анализа in vitro, которые имитируют эти состояния опухоли in vivo, называются в данном документе условиями суррогатного анализа опухоли in vitro.
[560] Любое одно или несколько из этих условий можно моделировать in vitro путем выбора конкретного буфера для анализа. Состав аналитического буфера, который имитирует патологическое микроокружение, может быть выбран таким, чтобы он был идентичен составу аналитического буфера, который имитирует нормальное окружение, за исключением одного или нескольких состояний, известных или описанных в данном документе, которые изменяются в патологическом микроокружении. Кроме того, при скрининге или идентификации активности одного или нескольких полипептидов в двух различных наборах условий, как правило, единственные условия, которые варьируются в анализе, относятся к условиям буфера, имитирующим микроокружение in vivo. Другие условия анализа, такие как время, температура и условия инкубации, могут быть одинаковыми для обоих наборов условий. Обычно один и тот же основной буфер используется в наборе условий, имитирующих патологическую микросреду, и условий, которые моделируют нормальное микроокружение, но конструкция буферной композиции может быть изменена по одному или нескольким параметрам, таким как pH, кислород, давление, наличие кофакторов, pH, концентрация гиалуронана (например, повышенная или пониженная концентрация гиалуронана), концентрация лактата (например, повышенная или пониженная концентрация лактата), концентрация альбумина (например, повышенная или пониженная концентрация гиалуронана) и/или концентрация пирувата (включая повышенную или пониженную концентрацию пирувата). В условиях, имитирующих патологическое микроокружение, и условиях, имитирующих нормальное микроокружение, можно использовать любой базовый буфер, известный специалисту в данной области техники.
СПОСОБЫ СОЗДАНИЯ ОГРАНИЧЕННОЙ МИКРООКРУЖЕНИЕМ КЛЕТКИ
[561] Настоящее изобретение представляет собой способ создания ограниченной микроокружением клетки. Способ обычно включает генетическую модификацию клетки млекопитающего с помощью вектора экспрессии (например, плазмиды или ретровирусного вектора) или РНК (например, РНК, транскрибируемой in vitro), включая нуклеотидные последовательности, кодирующие ограниченные микроокружением CAR по настоящему изобретению. Микроокружение генетически модифицированной клетки ограничено наличием одного или нескольких целевых антигенов. Генетическая модификация может быть проведена in vivo, in vitro или ex vivo. Клетка может представлять собой иммунную клетку (например, Т-лимфоцит, Т-клетку-хелпер или NK-клетку), стволовую клетку, клетку-предшественник и т.д.
[562] В некоторых случаях генетическая модификация осуществляется ex vivo. Например, Т-лимфоцит, стволовая клетка, Т-клетку-хелпер или NK-клетку получают от индивидуума; и клетку, полученная от индивидуума, генетически модифицируют для экспрессии CAR по настоящему изобретению. Микроокружение генетически модифицированной клетки ограничено наличием одного или нескольких целевых антигенов. В некоторых случаях генетически модифицированная клетка активируется ex vivo. В других случаях генетически модифицированная клетка вводится индивиду (например, индивиду, от которого была получена клетка); и генетически модифицированная клетка активируется in vivo. Например, если один или несколько целевх антигенов присутствуют на поверхности клетки индивидуума, необходимость вводить антиген отсутствует. Генетически модифицированная клетка вступает в контакт с антигеном, присутствующим на поверхности клетки индивидуума, и генетически модифицированная клетка активируется. Например, если генетически модифицированная клетка представляет собой Т-лимфоцит, генетически модифицированная клетка может проявлять цитотоксичность по отношению к клетке, которая экспрессирует один или несколько целевых антигенов на своей поверхности, с которой связывается CAR.
СПОСОБЫ МОДУЛЯЦИИ АКТИВНОСТИ T-КЛЕТКИ И/ИЛИ NK-КЛЕТКИ, ЭКСПРЕССИРУЮЩЕЙ MRB CAR, ПУТЕМ ИЗМЕНЕНИЯ PH
[563] В определенных аспектах в данном документе представлены способы модуляции связывания и результирующего лизиса/уничтожения целевой клетки Т-клеткой и/или NK-клеткой, экспрессирующей MRB CAR, путем изменения или сдвига pH в микроокружении, которое включает целевую клетку либо в целевой ткани либо в одной или нескольких нецелевых (например, здоровых/нормальных) тканях путем модуляции связывания MRB-CAR с его когнатным антигеном на целевой (целевых) клетке (клетках). Такие методы обычно включают приведение в контакт целевой клетки, такой как клетка млекопитающего (например, человеческая клетка), с Т-клеткой и/или NK-клеткой, экспрессирующей MRB CAR-в микроокружении, а затем изменение pH микроокружения путем уменьшения или более обычно повышения pH. Микроокружение может представлять собой целевое микрокружение, например, опухоль, или нецелевое микроокружение, где нецелевое связывание может вызывать побочные эффекты. В некоторых вариантах осуществления такие способы могут обеспечить временное снижение связывания мишени CAR-T, чувствительной к микроокружению опухоли.
[564] Соответственно, в одном аспекте в данном документе представлен способ модуляции связывания ограниченного микроокружением биологического химерного антигенного рецептора (MRB-CAR), экспрессирующего Т-клетку или NK-клетку, с клеткой, экспрессирующей когнатный антиген MRB-CAR, у субъекта, который включает следующее:
а. введение Т-клетки и/или NK-клетки, содержащей нуклеиновую кислоту, кодирующую MRB-CAR, в организм субъекта, при этом после (и необязательно и/или во время) введения Т-клетка и/или NK-клетка, содержащая нуклеиновую кислоту, кодирующую MRB-CAR, экспрессирует MRB-CAR и связывается с клеткой, экспрессирующей когнатный антиген у субъекта; и
b. введение фармакологического средства субъекту в количестве, достаточном для увеличения pH крови и/или pH ткани и/или pH микроокружения, при этом введение проводят до, во время или после введения, и при этом повышенный pH кровь, ткань и/или микроокружение модулирует связывание Т-клетки и/или NK-клетки, экспрессирующих MRB-CAR, с клеткой, экспрессирующей когнатный антиген, в крови, ткани или микроокружении с повышенным pH.
[565] Изменение/сдвиг pH в аспектах, которые включают стадию введения pH-модулирующего фармакологического средства по настоящему изобретению, может быть достигнуто путем воздействия на целевые или нецелевые клетки/ткань воздействием pH-модулирующего фармакологического средства, например, путем введения pH-модулирующего фармакологического средства субъекту. В данном документе представлены неограничивающие примеры pH-модулирующих фармакологических средств. В определенных аспектах в данном документе представлено фармакологическое средство для применения в способе модуляции связывания MRB-CAR с его когнатным антигеном или для модулирования связывания Т-клетки, экспрессирующей MRB CAR, и/или NK-клетки с клеткой, которая экспрессирует ее когнатный антиген или для снижения или облегчения токсичности опухоли у субъекта. Такие аспекты в некоторых вариантах осуществления относятся к лечению роста опухоли, рака, гиперплазии или нарушений клеточной пролиферации.
[566] В других аспектах в данном документе предусмотрено использование pH-модулирующего фармакологического средства для использования в производстве лекарственного средства или набора для контроля связывания генно-инженерной Т-клетки и/или NK-клетки с целевой клеткой млекопитающего у субъекта in vivo. В других аспектах в данном документе представлен набор, который включает контейнер, содержащий не способную к репликации рекомбинантную ретровирусную частицу, и инструкции по ее применению для выполнения способа лечения роста опухоли, где инструкции содержат инструкции по способу контроля связывания Т-клетки и/или NK-клетки в целевую клетку млекопитающего путем регулирования pH. Таким способом может быть любой из способов, представленных в данном разделе, для модулирования связывания и/или активности Т-клеток и/или NK-клеток, экспрессирующих MRB CAR, путем изменения pH. Контейнер, содержащий рекомбинантные ретровирусные частицы, может представлять собой пробирку, флакон, лунку планшета или другой сосуд для хранения рекомбинантных ретровирусных частиц и/или рН-модулирующего фармакологического средства. Любой из них может быть промышленного класса и типа. В определенных вариантах осуществления набор может включать два или более контейнера. Один контейнер/сосуд может включать рекомбинантные ретровирусные частицы, а другой контейнер/сосуд может включать рН-регулирующее фармакологическое средство. В таких способах фармакологическое средство доставляется/вводится в количестве, достаточном для повышения pH крови, и/или pH ткани, и/или pH микроокружения, чтобы модулировать связывание MRB-CAR модифицированных/рекомбинантных Т-клеток и/или NK-клеток, экспрессирующих MRB CAR с его когнатным антигеном в крови и/или ткани с повышенным pH. В данном документе представлены неограничивающие иллюстративные подробности для введения рН-модулирующего фармакологического средства, в достаточном количестве и в течение достаточного времени.
[567] Целевые клетки, целевые или нецелевые по отношению к ткани, могут контактировать с рН-модулирующим средством, таким как рН-модулирующее фармакологическое средство, после введения MRB-CAR субъекту. Соответственно, иллюстративные аспекты, представленные в данном документе для модулирования связывающей и/или цитотоксической активности Т-клетки, экспрессирующей MRB CAR, например, для уменьшения активности целевой опухоли и/или для ингибирования пролиферации целевых клеток, такой как пролиферация опухолевых клеток, могут включать следующие стадии:
а. введение Т-клетки и/или NK-клетки, содержащей нуклеиновую кислоту, кодирующую MRB-CAR, в организм субъекта, при этом после введения Т-клетка и/или NK-клетка, содержащая нуклеиновую кислоту, кодирующую MRB-CAR, экспрессирует MRB-CAR, и необязательно связывается с клеткой, экспрессирующей когнатный антиген у субъекта; и
b. введение фармакологического средства субъекту в количестве, достаточном для повышения pH крови и/или pH ткани и/или pH микроокружения, чтобы модулировать связывание MRB CAR-экспрессирующих Т-клеток и/или NK-клеток с клетками, экспрессирующими когнатный антиген MRB CAR в крови, ткани или микроокружении с повышенным pH. Следует понимать, что в зависимости от конкретного способа, используемого для введения нуклеиновой кислоты, кодирующей MRB-CAR, в Т-клетку и/или NK-клетку, Т-клетка и/или NK-клетка может экспрессировать или не экспрессировать MRB-CAR до ее введения субъекту. Однако в некоторый момент времени после введения субъекту, например, через 2 часа, 4 часа, 8 часов, 12 часов, 1 день, 2 дня, 4 дня и/или 7 дней или дольше, Т-клетка и/или NK-клетка, которые включают нуклеиновую кислоту, кодирующую MRB-CAR, экспрессируют MRB-CAR. Затем такие клетки обычно связываются с целевой клеткой, экспрессирующей когнатный антиген MRB-CAR.
[568] Способы, представленные в данном документе, для генетической модификации и необязательно экспансии лимфоцитов субъекта могут быть использованы для введения последовательности нуклеиновой кислоты, которая кодирует MRB-CAR, в геном Т-клетки и/или NK-клетки субъекта для получения Т-клетки и/или NK-клетка, способной экспрессировать MRB CAR, а затем введения Т-клетку и/или NK-клетку, способной экспрессировать MRB CAR, субъекту, при этом после введения Т-клетки и/или NK-клетки экспрессируют MRB CAR, чтобы контактировать MRB-CAR с целевой клеткой/тканью. В настоящем изобретении представлены подробности того, как осуществлять такие способы, наряду с различными альтернативами для модификации и экспансии лимфоцитов, любой из которых может быть использован в аспектах настоящего изобретения, которые включают изменение pH для модуляции связывания Т-клетки, экспрессирующей MRB CAR, и/или от NK-клетки к целевой клетке, экспрессирующей когнатный антиген MRB-CAR.
[569] Такие способы генетической модификации и экспансии лимфоцитов обычно включают приведение в контакт Т-клеток и/или NK-клеток, которые могут быть покоящимися клетками в иллюстративных вариантах осуществления, с не способной к репликации рекомбинантной ретровирусной частицей для трансдукции Т-клеток и/или NK-клеток. Такой контакт обычно происходит ex vivo после удаления лимфоцитов у субъекта. Затем Т-клетки и/или NK-клетки вводятся/повторно вводятся субъекту, обычно у которого они были удалены. Не способная к репликации рекомбинантная ретровирусная частица включает геном с полинуклеотидом, кодирующим MRB-CAR. Многие альтернативные варианты осуществления и дополнительные подробности, касающиеся такой не способной к репликации рекомбинантной ретровирусной частицы, представлены в других разделах данного документа и могут применяться в способах, представленных в данном документе, для регулирования связывания и результирующего лизиса/уничтожения MRB-CAR путем модуляции pH в микроокружении клетки, экспрессирующей когнатный целевой полипептид, распознаваемый MRB-CAR в зависимости от pH.
[570] В частности, иллюстративные аспекты, которые включают такие комбинации, могут включать другие элементы для регулирования связывания, активности уничтожения клеток и/или выживания Т-клеток, экспрессирующих MRB CAR, которые представлены в других разделах данного документа. Такие элементы управления, которые можно комбинировать с экспрессией MRB CAR в способах, которые включают изменение pH, а также в других вариантах осуществления, представленных в данном документе, включают в себя рибопереключатели и домены элиминации. Таким образом, комбинация таких способов и композиций, представленных в данном документе, образует мощный многогранный подход к обеспечению безопасности субъекта после введения субъекту CAR-экспрессирующих Т-клеток, включая Т-клетки, экспрессирующие MRB CAR.
[571] Такие способы модулирования связывания целевой клетки Т-клеткой и/или NK-клеткой, экспрессирующими MRB CAR, можно применять, например, для снижения целевой, нецелевой токсичности путем повышения pH крови и/или неопухолевой (неопухолевых) ткани (тканей) в организме субъекта. Например, в ситуации, когда «нормальный» pH ткани в огранизме субъекта становится временно ниже, рН-модулирующее средство может быть доставлено таким образом, чтобы pH нормальной ткани повышалось, в то время как pH опухоли оставалось более низким и все еще было на уровне pH, когда Т-клетка и/или NK-клетка, экспрессирующие MRB-CAR, связываются с целевой опухолевой клеткой. В этих вариантах осуществления pH-модулирующее средство может быть доставлено в более низкой концентрации или целенаправленно в нормальную ткань.
[572] В некоторых вариантах осуществления это может быть достигнуто, позволяя pH в микроокружении опухоли оставаться достаточно низким для связывания MRB-CAR T-клетки и/или NK-клетки с клетками, экспрессирующими ее когнатую мишень, внутри опухоли. В иллюстративных аспектах способов, представленных в данном документе, pH ткани остается на уровне pH, при котором Т-клетка, экспрессирующая MRB CAR и/или NK-клетка, связывается со своей мишенью в течение периода времени, достаточного для Т-клетки, экспрессирующей MRB CAR, и/или NK-клетка для контакта и связывания с клеткой, экспрессирующей свой когнатный антиген (например, 2, 4, 8, 12 или 24 часа, или 2, 4, 7, 14, 28 или 30 дней, или 1, 2, 3, 4, 5, 6, 12, 24 месяца или дольше), а затем pH сдвигается/изменяется, например, путем повышения pH ткани до такой величины, влияющей на связывание Т-клетки и/или NK-клетки, экспрессирующей MRB CAR, с целевой клеткой.
[573] Соответственно, в данном документе в одном аспекте предложен способ временного снижения связывания мишеней CAR-T-клеток, чувствительных к микроокружению опухоли, посредством фармакологической модификации pH сосудов и тканей. Части связывания мишени CAR-T-клетки, чувствительной к микроокружению опухоли, с различным связыванием в различных условиях, также называются ограниченными микроокружением биологическими, ограниченными микроокружением, контролируемыми микроокружением или условно активными, и могут относиться ко всему CAR или любому его целевому домену связывания, например, ASTR, scFv или scFvFc. Эти контролируемые микроокружением ASTR в CAR-T-клетках обеспечивают дополнительный уровень защиты от целевой внеопухолевой токсичности, требуя местных условий окружения для опухоли, чтобы обеспечить рекрутинг Т-клеток. Хотя адоптивная клеточная терапия является привлекательной для некоторых видов терапии с использованием моноклональных антител, она может создавать локальную среду, которая временно пермиссивна для их мишеней CAR-T. Например, CAR-T-клетки, активированные в тканях с низким pH, могут дополнительно снижать pH микроокружения, в зависимости от цитоплазматических доменов, присутствующих в конструкции CAR. В других случаях синдром высвобождения цитокинов и другие заболевания, связанные с адоптивной клеточной терапией, могут приводить к потере буферной способности крови к бикарбонатам, что приводит к лактоацидозу. Было установлено, что адоптивная клеточная терапия, вводимая путем внутривенной инфузии, приводит к временному сжатию легких. Для некоторых клеточных видов терапии скорость инфузии требует постоянного контроля растворенного кислорода (Fischer et al. Stem Cells Dev. 2009 Jun; 18(5): 683-691). Степень сжатия легких зависит от размера клеток, состояния активации, дозы клеток и скорости введения. Cruz et al (Cytotherapy. 2010 Oct; 12(6): 743-749) сообщают о неблагоприятных результатах более 300 инфузий Т-лимфоцитов, согласно которым низкие дозы и медленная инфузия могут уменьшить сжатие в легких. Однако с некоторыми высокоактивными CAR-T-клетками мишени присутствуют даже в низких уровнях в эндотелии легких, например Her2 (Morgan et al. Mol Ther. 2010 Apr; 18(4): 843-851), может привести к немедленной токсичности, которую невозможно контролировать, и к быстрому ухудшению состояния пациента из-за начальной высокой концентрации клеток CAR-T в легких после инфузии и присутствия Т-клеток-мишеней в этих тканях. В других случаях присутствие мишеней Т-клеток в других нецелевых тканях, таких как желчный проток, может вызывать токсичность опухоли, которую невозможно контролировать (Lamers Mol Ther. 2013 Apr;21(4):904-12) и приводят к тяжелой органной токсичности до того, как можно будет использовать другие средства, такие как стероиды или эпитопы, устраняющие клетки. В то время как венозная и артериальная плазма обладают сильной буферной способностью против ацидоза, состояния респираторного ацидоза, шока, метаболического ацидоза и ишемического ацидоза могут возникать у пациентов с раком, получавших адоптивную клеточную терапию.
[574] В некоторых аспектах, представленных в данном документе, связывание MRB-CAR у субъекта можно модулировать путем введения субъекту фармакологического средства для увеличения или уменьшения pH крови, ткани и/или микроокружения. В некоторых аспектах целевая внеопухолевая токсичность может быть уменьшена у субъекта путем введения субъекту фармакологического средства для повышения или уменьшения pH крови и/или pH ткани и/или pH микроокружения. В некоторых аспектах связывание Т-клетки и/или NK-клетки с целевой клеткой млекопитающего можно контролировать путем введения фармакологического средства для увеличения или уменьшения pH крови и/или pH ткани и/или pH микрокружения. В некоторых аспектах связывание генно-инженерной Т-клетки и/или NK-клетки с целевой клеткой млекопитающего у субъекта in vivo можно контролировать путем введения субъекту рН-модулирующего фармакологического средства. В иллюстративных вариантах осуществления фармакологическое средство может повышать pH крови и/или pH ткани и/или pH микроокружения. В некоторых вариантах осуществления микроокружение может представлять собой микрокружение in vivo. В иллюстративных вариантах осуществления микрокружение может представлять собой микроокружение опухоли. В некоторых вариантах осуществления микроокружение может включать целевую клетку млекопитающего, где эта целевая клетка экспрессирует целевой антиген на своей поверхности. В некоторых вариантах осуществления введение фармакологического средства субъекту может повысить pH крови, ткани и/или микроокружения с pH менее 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8 или 6,9 до pH по меньшей мере 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5 или 7,6, при этом pH крови, ткани и/или микроокружения ниже перед введением фармакологического средства, чем после введения фармакологического средства. В некоторых вариантах осуществления введение фармакологического средства субъекту может снизить pH крови, ткани или микроокружения с pH более 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, или от 7,6 до pH менее 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0, при этом pH крови, ткани и/или микроокружения выше перед введением фармакологического средства, чем после введения фармакологического средства. В некоторых вариантах осуществления введение фармакологического средства субъекту может вызвать сдвиг pH у субъекта в крови, ткани и/или микроокружении. В некоторых вариантах осуществления сдвиг pH может составлять по меньшей мере 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7 или 1,8 единиц pH в любом направлении, т.е. увеличение или уменьшение pH после введения фармакологического средства относительно pH перед введением фармакологического средства. В иллюстративных вариантах осуществления сдвиг pH представляет собой повышение pH.
[575] MRB-CAR по настоящему изобретению могут иметь пониженное связывание со своим когнатным антигеном при одном pH, чем при другом pH. В иллюстративных вариантах осуществления, где иллюстративные значения pH для дифференциального связывания MRB-CAR еще не предоставлены в самом широком аспекте, и в качестве альтернативы для других вариантов осуществления вместо этих значений для таких аспектов MRB-CAR может иметь пониженное связывание при более высоком pH, чем при более низком pH. Например, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при pH выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5, чем при pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0. В других вариантах осуществления MRB-CAR может иметь пониженное связывание при более высоком pH, чем при более низком pH. Например, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0, чем при pH выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5. В некоторых иллюстративных вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH от 6,5 до 6,7 по сравнению с pH от 7,4 до 7,6. В других иллюстративных вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH 6,7 по сравнению с pH 7,4. В других вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH опухоли по сравнению с pH крови. В некоторых вариантах осуществления MRB-CAR может включать антигенспецифическую нацеленную область, ствол и внутриклеточный активирующий домен. В некоторых вариантах осуществления MRB-CAR может также включать костимулирующий домен. В некоторых вариантах осуществления MRB-CAR может связываться с опухолессоциированным антигеном.
[576] В способах, которые включают регулирование pH крови, ткани или микроокружения, pH микроокружения может быть увеличен с pH ниже 7,0 до pH выше 7,0. Например, pH может быть повышен с pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0 до pH выше 7,0, 7,1, 7,2, 7,3 или 7,4. В некоторых вариантах осуществления MRB-CAR может связываться с когнатным антигеном при повышенном pH, но не при pH микроокружения перед введением фармакологического средства. В некоторых вариантах осуществления pH может быть повышен с ниже 7,0 до pH от 7,1 до 8,0 или до pH от 7,1 до 7,8, или до pH от 7,2 до 7,8, или pH от 7,2 до 7,6, или pH от 7,3 до 7,6, или до pH от 7,4 до 7,8 или до pH от 7,4 до 7,6. Такое повышение pH может происходить в течение менее 1, 2, 4, 6, 8, 12 или 24 часов или более 1, 2, 4, 6, 8, 12 или 24 часов в зависимости от типа и дозы введенное фармакологического средства. В некоторых вариантах осуществления фармакологическое средство вводят так, чтобы pH оставался выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5; или между 7,0, 7,1, 7,2, 7,3 на нижней конце диапазона и 7,4, 7,5, 7,6, 7,7 или 7,8 на верхнем конце диапазона в целевой ткани, такой как опухоль, и, например, по меньшей мере, в поверхности микроокружения целевой ткани (например, опухоли), по меньшей мере, в части микроокружения целевой ткани (например, опухоли), и в иллюстративных вариантах осуществления во всем микроокружении целевой ткани (например, опухоли). Микроокружение может представлять собой микроокружение in vivo, например, опухоль, ткань, неопухолевую ткань, нормальную ткань или ткань, которая претерпела временное изменение pH. Например, ткани, которые обычно претерпевают временные сдвиги pH, включают мышечную ткань в анаэробных условиях или мышечную ткань, подвергающуюся физической нагрузке, или воспаленную ткань, или ткань, испытывающую воспаление. В некоторых вариантах осуществления, которые включают целевую клетку млекопитающего, целевая клетка может представлять собой опухолевую клетку, неопухолевую или нормальную клетку.
[577] В некоторых аспектах предоставлены способы временного увеличения pH сосудов для снижения аффинности MRB-CAR, контролируемых микроокружением, к их антигенам. Сдвиг pH крови на 0,4 Ед. может снизить аффинность некоторых scFv, которые образуют часть MRB-CAR, к их когнатному антигену более чем в 10 раз. В некоторых вариантах осуществления терапевтический контроль pH может быть достигнут путем внутривенного или перорального введения различных фармакологических средств. Например, в некоторых вариантах осуществления инактивация аффинности связывания может быть достигнута с помощью бикарбоната или бикарбоната натрия. В других вариантах осуществления Tris-гидроксиметиламинометан (также известный как трометамин, трометамол и THAM) и/или Carbicarb™ (эквимолярный гипертонический раствор бикарбоната натрия и карбоната натрия) можно использовать для повышения pH крови в достаточном количестве для уменьшения целевой внеопухолевой токсичности. В других вариантах осуществления низкомолекулярные ингибиторы протонной помпы можно использовать для повышения pH крови и/или pH ткани в достаточном количестве для уменьшения целевой внеопухолевой токсичности. Ингибиторы протонной помпы, которые можно использовать в способах, которые включают регулирование pH, включают без ограничения эзомепразол (Nexium), эзомепразол и напроксен (Vimovo), лансопразол (Prevacid), омепразол (Prilosec и Zegerid) и рабепразол (Aciphex). Введение ингибиторов протонной помпы можно эффективно использовать в течение более длительных периодов времени для модуляции аффинности связывания антигенсвязывающего домена с его когнатным антигеном в течение дней, недель, месяцев или лет. В других вариантах осуществления аффинность антигенсвязывающего домена к его когнатному антигену можно модулировать путем изменения pH крови и/или pH ткани, контролируя транскрипцию, трансляцию, экспрессию на мембране и стабильность переносчиков и насосов. Примеры таких транспортеров и насосов, измененная экспрессия которых может модулировать pH, включают без ограничения протонные насосы, члены семейства протонообменных веществ натрия (NHE), семейства переносчиков бикарбоната (BCT) и семейства переносчиков монокарбоксилатов.
[578] В некоторых вариантах осуществления фармакологическое средство, регулирующее pH, такое как, например, бикарбонат, THAM или CaricarbTM, вводят до или одновременно с введением CAR-T-клеток пациента, экспрессирующих ограниченные микроокружением биологические ASTR (например, scFv или scFvFc). Такое лечение снизит немедленную цитотоксичность, которая в противном случае связана с временным сжатием легких при введениях CAR-T-клеток. Соответственно, в определенных аспектах в данном документе предоставлен способ снижения цитотоксичности, вызываемой нормальной здоровой тканью субъекта, путем введения субъекту фармакологического средства в количестве, достаточном для повышения рН крови, и/или рН ткани, и/или рН микроокружения; и либо одновременно, либо после (например, через 1, 2, 4, 6, 8, 12 или 24 часа, или через 1, 2, 3, 4 или 7 дней спустя) введения Т-клетки или NK-клетки, экспрессирующей MRB CAR, в организм субъекта. В некоторых вариантах осуществления в заданное время такое введение (например, через 1, 2, 4, 6, 8, 12 или 24 часа, или через 1, 2, 3, 4 или 7 дней спустя) фармакологического средства прекращается на период времени или на неопределенный срок, чтобы изменить pH крови, ткани или микроокружения субъекта и модулировать связывание/активность Т-клетки, экспрессирующей MRB CAR.
[579] Как будет понятно квалифицированному специалисту, могут использоваться различные эффективные режимы введения дозы для введения фармакологических средств, способных изменять pH (например, увеличивать pH крови и/или pH ткани и/или pH микроокружения у субъекта). В данном документе введение может относиться к введению фармакологического средства субъекту, включая введение фармакологического средства через внутривенное введение субъекту или предоставление пероральной дозы фармакологического средства субъекту или субъекту, принимающему фармакологическое средство. Фармакологические средства можно вводить субъекту или пациенту в течение различных периодов времени, например, по меньшей мере, 1, 2, 3, 4, 5 или 6 дней; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 недель; 3, 4, 5, 6, 7, 8, 9, 10, 12, 15 или 18 месяцев; или 2, 2,5, 3, 3,5, 4, 4,5, или 5 лет или бессрочно. В некоторых вариантах осуществления фармакологическое средство может представлять собой бикарбонат, бикарбонат натрия (NaHCO3) или раствор бикарбоната натрия и карбоната натрия, а парентеральная или внутривенная доза может составлять: 0,2 × вес субъекта (кг) × дефицит оснований субъекта; требуемый HCO3 (мэкв.) = 0,5 × вес (кг) × [24 - HCO3 в сыворотке крови (мэкв./л)]; или от 2 до 5 мэкв./кг IV инфузии в течение 4-8 часов. В некоторых вариантах осуществления могут использоваться стандартные режимы дозирования бикарбоната, бикарбоната натрия или раствора бикарбоната натрия в зависимости от тяжести ацидоза. Например, от 50 до 150 мэкв. бикарбоната, разведенного в 1 л 5% раствора декстрозы в воде, можно вводить внутривенно со скоростью от 1 до 1,5 л/час. В другом неограничивающем примере от 90 до 180 мэкв. бикарбоната, разведенного в 1 л 5% декстрозы в воде, можно вводить внутривенно со скоростью от 1 до 1,5 л/час. В некоторых вариантах осуществления, когда фармакологическим средством является бикарбонат или бикарбонат натрия (NaHCO3), энтеральная или пероральная доза может составлять, например, от 325 до 2000 мг бикарбоната натрия, вводимого субъекту от 1 до 4 раз/день.
[580] В некоторых вариантах осуществления фармакологическое средство может представлять собой Тris-гидроксиметиламинометан (также известный как трометамин, трометамол и THAM), и парентеральная или IV дозировка может быть оценена как: требуемый раствор трометамина (0,3 M мл) = вес тела (кг) x × дефицит оснований (мэкв./л) × 1,1. В некоторых вариантах осуществления внутривенная дозировка Тris-гидроксиметиламинометана может быть оценена по дефициту буферного основания внеклеточной жидкости в мэкв./л, как определено с помощью номограммы Сиггаарда-Андерсена. В некоторых вариантах осуществления начальная доза может составлять 500 мл (150 мэкв.) Тris-гидроксиметиламинометана, вводимого медленной внутривенной инфузией до 1000 мл, при этом максимальная доза составляет 500 мг/кг (227 мг/фунт) в течение периода не менее одного часа.
[581] В некоторых вариантах осуществления фармакологическое средство может быть низкомолекулярным ингибитором протонной помпы и может вводиться в течение длительного периода лечения. Например, низкомолекулярный ингибитор протонной помпы можно вводить в течение по меньшей мере 1, 2, 3, 4, 5 или 6 дней; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 недель; 3, 4, 5, 6, 7, 8, 9, 10, 12, 15 или 18 месяцев; или 2, 2,5, 3, 3,5, 4, 4,5, или 5 лет или бессрочно. В некоторых вариантах осуществления ингибитор протонной помпы может представлять собой эзомепразол (Nexium), и 20 мг или 40 мг эзомепразола можно вводить перорально один или два раза в день. В некоторых вариантах осуществления ингибитор протонной помпы может представлять собой комбинацию эзомепразола и напроксена (Vimovo), и 20 мг эзомепразола с 375 или 500 мг напроксена можно вводить перорально дважды в день. В некоторых вариантах осуществления ингибитор протонной помпы может представлять собой лансопразол (Prevacid), и 15, 30 или 60 мг лансопразола можно вводить перорально один или два раза в день. В некоторых вариантах осуществления лансопразол можно вводить IV с 30 мг лансопразола, вводимым в течение 30 минут один раз в день в течение до 7 дней. Затем субъект может перейти на пероральный лансопразол и продолжить лечение. В некоторых вариантах осуществления ингибитор протонной помпы может представлять собой омепразол (Prilosec и Zegerid), и 10, 20 или 40 мг омепразола можно вводить перорально один или два раза в день. В некоторых вариантах осуществления ингибитор протонной помпы может представлять собой рабепразол (Aciphex), и 20 или 60 мг рабепразола можно вводить перорально один или два раза в день или 100 мг рабепразола можно вводить перорально один раз в день. В любом из вариантов осуществления, раскрытых в данном документе, фармакологические средства можно использовать в комбинации друг с другом.
[582] В любом из раскрытых в данном документе вариантов осуществления pH крови, ткани и/или микроокружения субъекта можно измерить до, во время или после введения фармакологического средства. В некоторых вариантах осуществления решение о введении или продолжении введения субъекту фармакологического средства для увеличения или уменьшения pH может быть основано на измерении pH крови, ткани и/или микроокружения субъекта. Способы измерения pH крови и/или уровней бикарбоната в крови субъекта хорошо известны в данной области техники. В некоторых вариантах осуществления позитронно-эмиссионная томография (PET), магнитно-резонансная спектроскопия (MRS), магнитно-резонансная томография (MRI) и оптическая визуализация могут использоваться для измерения pH in vivo в микроокружениях, например, в опухолях (для получения подробной информации об измерении опухоли pH, см.: Zhang X, Lin Y, Gillies RJ. Tumor pH and its measurement. J Nucl Med. 2010 Aug;51(8):1167-70).
[583] В другом аспекте в данном документе представлен способ снижения токсичности опухоли у субъекта, который включает следующее:
а. введение полинуклеотида, кодирующего биологический химерный антигенный рецептор с ограниченным микроокружением (MRB-CAR), в Т-клетку или NK-клетку субъекта для получения Т-клетки и/или NK-клетки, способной экспрессировать MRB-CAR;
b. введение Т-клетки и/или NK-клетки, способной экспрессировать MRB-CAR, субъекту, при этом Т-клетка и/или NK-клетка экспрессируют MRB-CAR у субъекта; и
c. введение субъекту фармакологического средства в количестве, достаточном для увеличения pH крови и/или pH ткани и/или pH микроокружения, чтобы модулировать связывание MRB-CAR с его когнатным антигеном в крови, ткани и/или микроокружение с повышенным pH, тем самым снижая токсичность опухоли у субъекта.
[584] На стадии введения Т-клетка или NK-клетка способна экспрессировать MRB-CAR, поскольку она генетически модифицирована, чтобы содержать нуклеиновую кислоту, кодирующую MRB-CAR. Эта генетическая модификация может заключаться в наличии кодирующей последовательности MRB-CAR в векторе, который был введен внутрь Т-клетки или NK-клетки путем трансфекции или трансдукции. В иллюстративных вариантах осуществления нуклеиновая кислота, кодирующая MRB-CAR, интегрирована в геном Т-клетки или NK-клетки.
[585] Предполагается, что различные способы, известные в данной области для введения полинуклеотида в Т-клетку и/или NK-клетку, могут быть использованы со способами, представленными в данном документе для аспектов, которые включают изменение pH, чтобы повлиять на связывание MRB-CAR T-клетки или NK-клетки с его родственный антиген на клетке с использованием средства, такого как pH-модулирующее фармакологическее средство (иногда называемое в данном документе «Аспекты переключения pH»). Обычно вектор, в иллюстративных примерах вектор экспрессии, используется для доставки полинуклеотида. Такие векторы могут включать различные векторы, известные в данной области техники для доставки нуклеиновых кислот в Т-клетки и/или NK-клетки. В иллюстративных аспектах настоящего изобретения используются ретровирусные векторы и ретровирусные частицы, а в некоторых особенно иллюстративных вариантах осуществления лентивирусные векторы и в иллюстративных вариантах рекомбинантные лентивирусные частицы.
[586] Другие подходящие векторы экспрессии можно использовать в аспектах переключения pH, представленных в данном документе. Такие векторы экспрессии включают без ограничения вирусные векторы (например, вирусные векторы на основе вируса осповакцины; полиовируса; аденовируса (см., например, Li et al., Invest Opthalmol Vis Sci 35:2543 2549, 1994; Borras et al., Gene Ther 6:515 524, 1999; Li and Davidson, PNAS 92:7700 7704, 1995; Sakamoto et al., H Gene Ther 5:1088 1097, 1999; WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655); аденоассоциированного вируса (см., например, Ali et al., Hum Gene Ther 9:81 86, 1998, Flannery et al., PNAS 94:6916 6921, 1997; Bennett et al., Invest Opthalmol Vis Sci 38:2857 2863, 1997; Jomary et al., Gene Ther 4:683 690, 1997, Rolling et al., Hum Gene Ther 10:641 648, 1999; Ali et al., Hum Mol Genet 5:591 594, 1996; Srivastava in WO 93/09239, Samulski et al., J. Vir. (1989) 63:3822-3828; Mendelson et al., Virol. (1988) 166:154-165; и Flotte et al., PNAS (1993) 90: 10613-10617); SV40; вируса простого герпеса; или ретровирусный вектор (например, вирус лейкоза мышей, вирус некроза селезенки и векторы, полученные из ретровирусов, таких как вирус саркомы Рауса, вирус саркомы Харви, вирус лейкоза птиц, вирус иммунодефицита человека, вирус миелопролиферативной саркомы и вирус опухоли молочной железы), например гамма-ретровирус; или вирус иммунодефицита человека (см., например, Miyoshi et al., PNAS 94:10319 23, 1997; Takahashi et al., J Virol 73:7812 7816, 1999); и тому подобное.
[587] В некоторых вариантах осуществления ДНК-содержащие вирусные частицы используются вместо рекомбинантных ретровирусных частиц. Такие вирусные частицы могут быть аденовирусами, аденоассоциированными вирусами, герпесвирусами, цитомегаловирусами, поксвирусами, вирусами авипокс, вирусами гриппа, вирусом везикулярного стоматита (VSV) или вирусом Синдбис. Квалифицированный специалист поймет, как модифицировать раскрытые в данном документе способы для использования с различными вирусами и ретровирусами или ретровирусными частицами. Если используются вирусные частицы, которые включают геном ДНК, квалифицированный специалист поймет, что в такие геномы могут быть включены функциональные единицы для индукции интеграции всего или части генома ДНК вирусной частицы в геном Т-клетки и/или NK-клетки, трансдуцированной с помощью такого вируса. В качестве альтернативы функциональная ДНК может быть доставлена в Т-клетку и/или NK-клетку, которая экспрессируется в клетке, но не интегрирована в геном Т-клетки и/или NK-клетки.
[588] В иллюстративных вариантах осуществления вектор, используемый в аспекте переключения pH настоящего изобретения, представляет собой рекомбинантную ретровирусную частицу, а в некоторых вариантах осуществления рекомбинантную лентивирусную частицу. Такая ретровирусная частица обычно включает ретровирусный геном внутри капсида, который расположен внутри вирусной оболочки. В различных разделах настоящего изобретения представлены различные варианты осуществления рекомбинантных ретровирусных частиц, которые раскрывают элементы, которые могут быть включены на поверхность, внутри и/или в геном рекомбинантной ретровирусной частицы. Любой из этих вариантов осуществления рекомбинантных ретровирусных частиц можно использовать в аспектах переключения pH, представленных в данном документе.
МОЛЕКУЛЫ ИНГИБИРУЮЩЕЙ РНК
[589] В некоторых вариантах осуществления способы, представленные в данном документе для настоящего изобретения, включают ингибирование экспрессии одного или нескольких эндогенных генов, экспрессируемых в Т-клетках и/или NK-клетках. Способы, представленные в данном документе, иллюстрируют способность создавать рекомбинантные ретровирусные частицы, которые экспрессируют одну или несколько, а в иллюстративных вариантах осуществления две или несколько молекул ингибирующей РНК, такие как, например, miRNA или shRNA, которые можно использовать для таких способов. Фактически, способы, представленные в данном документе, показывают, что такие молекулы ингибирующей РНК могут кодироваться внутри интронов, включая, например, интрон Ef1a. Это позволяет использовать преимущества настоящих способов для максимального увеличения функциональных элементов, которые могут быть включены в упаковываемый ретровирусный геном, чтобы преодолеть недостатки предшествующих уровней знаний и максимизировать эффективность таких рекомбинантных ретровирусных частиц при адоптивной Т-клеточной терапии.
[590] В некоторых вариантах осуществления молекула ингибирующей РНК включает 5' нить и 3' нить (в некоторых примерах, смысловую нить и антисмысловую нить), которые частично или полностью комплементарны друг другу, так что две нити способны образовывать дуплекс из 18-25-нуклеотидной РНК в клеточном окружении. 5' нить может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов, а 3' нить может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. 5' нить и 3' нить могут иметь одинаковую или разную длину, а дуплекс РНК может включать одно или несколько ошибочно спаренных оснований. В качестве альтернативы, дуплекс РНК не имеет ошибочно спаренных оснований.
[591] Молекулы ингибирующей РНК, включенные в композиции и способы, представленные в данном документе, в некоторых иллюстративных примерах, не существуют и/или не экспрессируются в естественных условиях в Т-клетках, в геном которых они вставлены. В некоторых вариантах осуществления молекула ингибирующей РНК представляет собой miRNA или shRNA. В некоторых вариантах осуществления, когда в данном документе или в приоритетных заявках сделана ссылка на нуклеиновую кислоту, кодирующую siRNA, особенно в контексте, когда нуклеиновая кислота является частью генома, следует понимать, что такая нуклеиновая кислота способна образовывать предшественник siRNA, такой как miRNA или shRNA, в клетке, который обрабатывается DICER с образованием двухцепочечной РНК, которая обычно взаимодействует с комплексом RISK или становится его частью. В некоторых вариантах осуществления ингибирующая молекула одного варианта осуществления настоящего изобретения представляет собой предшественник miRNA, такой как, например, Pri-miRNA или Pre-miRNA, или предшественник shRNA. В некоторых вариантах осуществления miRNA или shRNA получены искусственно (т.е. искусственные miRNA или siRNA). В других вариантах осуществления молекула ингибирующей РНК представляет собой dsRNA (транскрибированную или искусственно введенную), которая процессируется в siRNA или представляет собой саму siRNA. В некоторых вариантах осуществления miRNA или shRNA имеет последовательность, которая не встречается в природе, или имеет по меньшей мере один функциональный сегмент, который не встречается в природе, или комбинацию функциональных сегментов, которые не встречаются в природе.
[592] В некоторых вариантах осуществления молекулы ингибирующей РНК расположены в первой молекуле нуклеиновой кислоты в последовательном или множественном расположении, так что несколько последовательностей miRNA одновременно экспрессируются из одного полицистронного транскрипта miRNA. В некоторых вариантах осуществления молекулы ингибирующей РНК могут быть присоединены друг к другу прямо или косвенно с помощью нефункциональной (нефункциональных) линкерной (линкерных) последовательностью (последовательностей). Линкерная последовательность в некоторых вариантах осуществления имеет длину от 5 до 120 нуклеотидов, а в некоторых вариантах осуществления может иметь длину от 10 до 40 нуклеотидов в качестве неограничивающих примеров. В иллюстративных вариантах осуществления первая последовательность нуклеиновой кислоты, кодирующая одну или несколько (например, две или более) ингибирующих РНК, и вторая последовательность нуклеиновой кислоты, кодирующая CAR (например, MRB-CAR), функционально связаны с промотором, который является конститутивно активным или который может быть индуцируется в Т-клетке или NK-клетке. По сути, молекула (молекулы) ингибирующей РНК (например, miRNA), а также CAR экспрессируются полицистронным образом. Кроме того, функциональные последовательности могут быть экспрессированы из одного и того же транскрипта. Например, любой из представленных в данном документе лимфопролиферативных элементов, которые не являются молекулами ингибирующей РНК, может экспрессироваться из того же транскрипта, что и CAR, и одной или нескольких (например, двух или более) молекул ингибирующей РНК.
[593] В некоторых вариантах осуществления молекула ингибирующей РНК представляет собой встречающуюся в природе miRNA, такую как miR-155, но без ограничения ею. В качестве альтернативы могут быть получены искусственные miRNA, в которых последовательности, способные образовывать гибридизирующую/комплементарную стволовую структуру и направленные против мишени РНК, помещаются в каркас miRNA, который включает фланкирующие последовательности микроРНК для процессинга микроРНК и петлю, которая необязательно может быть получена из та же самая встречающаяся в природе miRNA, что и фланкирующие последовательности между последовательностями стебля. Таким образом, в некоторых вариантах осуществления молекула ингибирующей РНК включает ориентацию от 5' до 3': 5' фланкирующую последовательность микроРНК, 5' стебель, петлю, 3' стебель, который частично или полностью комплементарен указанному 5' стеблю, и 3' стебель, который частично или полностью комплементарен указанному 5' стеблю, и 3' фланкирующую последовательность микроРНК. В некоторых вариантах осуществления 5' стебель (также обозначаемый в данном документе 5' плечо) имеет длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления 5' стебель (также обозначаемый в данном документе 5' плечо) имеет длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления длина петли составляет от 3 до 40, от 10 до 40, от 20 до 40 или от 20 до 30 нуклеотидов, а в иллюстративных вариантах осуществления длина петли может составлять 18, 19, 20, 21 или 22 нуклеотида. В некоторых вариантах осуществления один стебель на два нуклеотида длиннее другого стебля. Более длинный стебель может представлять собой 5' или 3' стебель.
[594] В некоторых вариантах осуществления фланкирующая последовательность 5' микроРНК, 3' фланкирующая последовательность микроРНК или и то и другое происходят из встречающейся в природе miRNA, такой как без ограничения miR-155, miR-30, miR-17-92, miR- 122 и miR-21. В некоторых вариантах осуществления 5' фланкирующая последовательность микроРНК, 3' фланкирующая последовательность микроРНК или и то, и другое происходят от miR-155, такой как, например, miR-155 от Mus musculus или Homo sapiens. Вставка синтетической структуры стебель-петля miRNA в каркас miR-155 (т.е. фланкирующую последовательность 5' микроРНК, фланкирующую последовательность 3' микроРНК и петлю между 5' и 3' стеблями miRNA) известна специалисту в данной области техники (Chung, K. et al. 2006. Nucleic Acids Research. 34(7):e53; US 7,387,896). Последовательность SIBR (синтетическая ингибирующая РНК, производная от BIC) (Chung et al. 2006 выше), например, имеет 5' фланкирующую последовательность микроРНК, состоящую из нуклеотидов 134-161 (SEQ ID NO: 256) некодирующей mRNA Mus musculus BIC (Genbank ID AY096003.1) и 3' фланкирующую последовательность микроРНК, состоящую из 223-283 нуклеотидовнекодирующей mRNA Mus musculus BIC (идентификатор Genbank AY096003.1). В одном исследовании последовательность SIBR была модифицирована (eSIBR) для усиления экспрессии miRNA (Fowler, D.K. et al. 2015. Nucleic acids Research 44(5):e48). В некоторых вариантах осуществления настоящего раскрытия miRNA могут быть помещены в каркас miR-155 SIBR или eSIBR. В иллюстративных вариантах осуществления в данном документе miRNA помещены в каркас miR-155, который включает фланкирующую последовательность 5' микроРНК miR-155, представленную SEQ ID NO: 256, фланкирующую последовательность 3' микроРНК, представленную SEQ ID NO: 260 (нуклеотиды 221-265 некодирующей mRNA Mus musculus BIC); и модифицированную петлю miR-155 (SEQ ID NO: 258). Таким образом, в некоторых вариантах осуществления 5' фланкирующая последовательность микроРНК miR-155 представляет собой SEQ ID NO: 256 или ее функциональный вариант, такой как, например, последовательность, которая имеет ту же длину, что и SEQ ID NO: 256 или 95%, 90%, 85%, 80%, 75% или 50% при условии, что SEQ ID NO: 256, или составляет 100 нуклеотидов или меньше, 95 нуклеотидов или меньше, 90 нуклеотидов или меньше, 85 нуклеотидов или меньше, 80 нуклеотидов или меньше, 75 нуклеотидов или меньше, 70 нуклеотидов или меньше, 65 нуклеотидов или меньше, 60 нуклеотидов или меньше, 55 нуклеотидов или меньше, 50 нуклеотидов или меньше, 45 нуклеотидов или меньше, 40 нуклеотидов или меньше, 35 нуклеотидов или меньше, 30 нуклеотидов или меньше, или 25 нуклеотидов или меньше; и по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична SEQ ID NO: 256. В некоторых вариантах осуществления 3' фланкирующая последовательность микроРНК miR-155 представляет собой SEQ ID NO: 260 или ее функциональный вариант, такой как, например, той же длины, что и SEQ ID NO: 260 или 95%, 90%, 85%, 80%, 75% или 50% при условии, что SEQ ID NO: 260, или представляет собой последовательность, которая имеет 100 нуклеотидов или меньше, 95 нуклеотидов или меньше, 90 нуклеотидов или меньше, 85 нуклеотидов или меньше, 80 нуклеотидов или меньше, 75 нуклеотидов или меньше, 70 нуклеотидов или меньше, 65 нуклеотидов или меньше, 60 нуклеотидов или меньше, 55 нуклеотидов или меньше, 50 нуклеотидов или меньше, 45 нуклеотидов или меньше, 40 нуклеотидов или меньше, 35 нуклеотидов или меньше, 30 нуклеотидов или меньше, или 25 нуклеотидов или меньше; и по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична SEQ ID NO: 260. Однако в рамках настоящего изобретения рассматривается любая известная каркасная область микроРНК, которая функциональна для обеспечения надлежащего процессинга в клетке встроенных в нее miRNA с образованием зрелой miRNA, способной ингибировать экспрессию целевой mRNA, с которой они связываются.
[595] В некоторых вариантах осуществления по меньшей мере одна, по меньшей мере две, по меньшей мере три или по меньшей мере четыре молекулы ингибирующей РНК, кодируемые последовательностью нуклеиновой кислоты в полинуклеотиде не способной к репликации рекомбинантной ретровирусной частицы, имеют следующее расположение от 5' до 3 ориентации: 5' фланкирующая последовательность микроРНК, 5' стебель, петля, 3' стебель, который частично или полностью комплементарен указанному 5' стеблю, и 3' фланкирующая последовательность микроРНК. В некоторых вариантах осуществления все молекулы ингибирующей РНК имеют следующее расположение в ориентации от 5' до 3': 5' фланкирующая последовательность микроРНК, 5' стебель, петля, 3' стебель, который частично или полностью комплементарен указанному 5' стеблю и 3' фланкирующая последовательность микроРНК. Как раскрыто в данном документе, молекулы ингибирующей РНК могут быть разделены одной или несколькими линкерными последовательностями, которые в некоторых вариантах осуществления не имеют никакой функции, кроме как действовать в качестве спейсеров между молекулами ингибирующей РНК.
[596] В некоторых вариантах осуществления, где включены две или более молекулы ингибирующей РНК (в некоторых примерах 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 молекул ингибирующей РНК), эти молекулы ингибирующей РНК направлены против одинаковые или разные мишени РНК (например, mRNA, транскрибируемые с интересующих генов). В иллюстративных вариантах осуществления от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 5, от 3 до 5 или от 3 до 6 молекул ингибирующей РНК включены в первую последовательность нуклеиновой кислоты. В иллюстративном варианте осуществления четыре молекулы ингибирующей РНК включены в первую последовательность нуклеиновой кислоты.
[597] В некоторых вариантах осуществления мишени РНК представляют собой mRNA, транскрибируемые с генов, которые экспрессируются Т-клетками, таких как без ограничения PD-1 (предупреждение инактивации); CTLA4 (предупреждение инактивации); TCRa (безопасность - предупреждение аутоиммунитета); TCRb (безопасность - предупреждение аутоиммунитета); CD3Z (безопасность - предупреждение аутоиммунитета); SOCS1 (предупреждение инактивации); SMAD2 (предупреждение инактивации); мишень miR-155 (способствование активации); IFN гамма (снижение CRS); cCBL (продление передачи сигнала); TRAIL2 (предупреждение гибели); PP2A (продление передачи сигнала); ABCG1 (увеличение содержания микродомена холестерина за счет ограничения клиренса холестерина). В иллюстративных примерах miRNA, вставленные в геном Т-клеток в способах, представленных в данном документе, направлены на такие мишени, что индуцируется и/или усиливается пролиферация Т-клеток и/или подавляется апоптоз.
[598] В некоторых вариантах осуществления РНК-мишени включают mRNA, которые кодируют компоненты Т-клеточного рецепторного комплекса (TCR). Такие компоненты могут включать компоненты для создания и/или образования Т-клеточного рецепторного комплекса и/или компоненты для правильного функционирования Т-клеточного рецепторного комплекса. Соответственно, в одном варианте осуществления по меньшей мере одна из двух или более молекул ингибирующей РНК вызывает снижение образования и/или функции комплекса TCR, в иллюстративных вариантах осуществления один или несколько эндогенных комплексов TCR Т-клетки. Т-клеточный рецепторный комплекс включает TCRa, TCRb, CD3d, CD3e, CD3g и CD3z. Известно, что существует сложная взаимозависимость этих компонентов, так что снижение экспрессии любой одной субъединицы приведет к снижению экспрессии и функции комплекса. Соответственно, в одном варианте осуществления мишень РНК представляет собой mRNA , экспрессирующую один или несколько из TCRa, TCRb, CD3d, CD3e, CD3g и CD3z, эндогенных трансдуцированной Т-клетке. В некоторых вариантах осуществления мишень РНК представляет собой mRNA, транскрибируемую с эндогенного гена TCRα или TCRβ Т-клетки, геном которой содержит первую последовательность нуклеиновой кислоты, кодирующую одну или несколько miRNA. В иллюстративных вариантах осуществления мишень РНК представляет собой mRNA, транскрибируемую с гена TCRα. В определенных вариантах осуществления молекулы ингибирующей РНК, направленные против mRNA, транскрибируемых из целевых генов с аналогичной ожидаемой пригодностью, могут быть объединены. В других вариантах осуществления молекулы ингибирующей РНК, направленные против целевых mRNA, транскрибируемых из целевых генов с дополнительными функциями, могут быть объединены. В некоторых вариантах осуществления две или более молекулы ингибирующей РНК направлены против mRNA, транскрибируемой из целевых генов CD3Z, PD1, SOCS1 и/или IFN гамма.
[599] В некоторых вариантах осуществления, представленных в данном документе, две или более молекулы ингибирующей РНК могут быть доставлены в одном интроне, таком как без ограничения интрон A EF1-αa. Последовательности интронов, которые можно использовать для укрытия miRNA для настоящего изобретения, включают любой интрон, который подлежит процессингу в Т-клетке. Как указано в данном документе, одно из преимуществ такой компоновки состоит в том, что это помогает максимизировать возможность включения последовательностей miRNA в пределах ограничений по размеру ретровирусного генома, используемого для доставки таких последовательностей в Т-клетку в способах, представленных в данном документе. Это особенно верно, когда интрон первой последовательности нуклеиновой кислоты включает всю или часть промоторной последовательности, используемой для экспрессии этого интрона, последовательности CAR и других функциональных последовательностей, представленных в данном документе, таких как лимфопролиферативный (лимфопролиферативные) элемент (элементы), которые не являются ингибирующими молекулами РНК полицистронным образом. Требования к последовательности интронов известны в данной области техники. В некоторых вариантах осуществления такой процессинг интрона функционально связан с рибопереключателем, таким как любой рибопереключатель, описанный в данном документе. Таким образом, рибопереключатель может обеспечивать регуляторный элемент для контроля экспрессии одной или нескольких последовательностей miRNA на первой последовательности нуклеиновой кислоты. Соответственно, в иллюстративных вариантах осуществления в данном документе представлена комбинация miRNA, направленная против субъединицы эндогенного Т-клеточного рецептора, где экспрессия miRNA регулируется рибопереключателем, которым может быть любой из рибопереключателей, обсуждаемых в данном документе.
[600] В некоторых вариантах осуществления молекулы ингибирующей РНК могут быть обеспечены на нескольких последовательностях нуклеиновых кислот, которые могут быть включены в одну и ту же или другую транскрипционную единицу. Например, первая последовательность нуклеиновой кислоты может кодировать одну или несколько молекул ингибирующей РНК и экспрессироваться с первого промотора, а вторая последовательность нуклеиновой кислоты может кодировать одну или несколько молекул ингибирующей РНК и экспрессироваться со второго промотора. В иллюстративных вариантах осуществления две или более молекулы ингибирующей РНК расположены на первой последовательности нуклеиновой кислоты, которая экспрессируется с одного промотора. Промотор, используемый для экспрессии таких miRNA, обычно представляет собой промоторы, которые неактивны в пакующей клетке, используемой для экспрессии ретровирусной частицы, которая будет доставлять miRNA в своем геноме к целевой T-клетке, но такой промотор является активным либо конститутивно, либо в индуцируемой образом, внутри Т-клетки. Промотор может быть промотором Pol I, Pol II или Pol III. В некоторых иллюстративных вариантах осуществления промотор представляет собой промотор Pol II.
ХАРАКТЕРИСТИКА И СПОСОБЫ КОММЕРЧЕСКОГО ПРОИЗВОДСТВА
[601] В настоящем изобретении представлены различные способы и композиции, которые можно использовать в качестве исследовательских реагентов в научных экспериментах и для коммерческого производства. Такие научные эксперименты могут включать методы характеристики лимфоцитов, таких как NK-клетки, и в иллюстративных вариантах осуществления T-клетки с использованием способов генетической модификации, например, трансдукции лимфоцитов, представленных в данном документе. Такие методы, например, можно использовать для изучения активации лимфоцитов и подробных молекулярных механизмов, с помощью которых активация делает такие клетки трансдуцируемыми. Кроме того, в данном документе представлены генетически модифицированные лимфоциты, которые будут полезны, например, в качестве инструментов исследования для лучшего понимания факторов, влияющих на пролиферацию и выживаемость Т-клеток. Такие генетически модифицированные лимфоциты, такие как NK-клетки и в иллюстративных вариантах осуществления T-клетки, могут, кроме того, использоваться для коммерческого производства, например, для продукции определенных факторов, таких как факторы роста и иммуномодулирующие средства, которые можно собирать и тестировать или использовать в производстве коммерческих продуктов.
[602] Научные эксперименты и/или характеристика лимфоцитов могут включать любой из аспектов, вариантов или подвариантов, представленных в данном документе, пригодных для анализа или сравнения лимфоцитов. В некоторых вариантах осуществления Т-клетки и/или NK-клетки могут быть трансдуцированы с помощью не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, которые включают полинуклеотиды. В некоторых вариантах осуществления трансдукция Т-клеток и/или NK-клеток может включать полинуклеотиды, которые включают полинуклеотиды, кодирующие полипептиды по настоящему изобретению, например CAR, лимфопролиферативные элементы и/или активирующие элементы. В некоторых вариантах осуществления полинуклеотиды могут включать молекулы ингибирующей РНК, как обсуждается в другом месте в данном документе. В некоторых вариантах осуществления лимфопролиферативные элементы могут представлять собой химерные лимфопролиферативные элементы.
СПОСОБЫ ЛЕЧЕНИЯ
[603] В настоящем раскрытии представлены различные способы лечения с использованием CAR. CAR по настоящему изобретению, когда он присутствует в Т-лимфоците или NK-клетке, может опосредовать цитотоксичность по отношению к целевой клетке. CAR по настоящему изобретению связывается с антигеном, присутствующим на целевой клетке, таким образом опосредуя уничтожение целевой клетки Т-лимфоцитом или NK-клеткой, генетически модифицированной для продуцирования CAR. ASTR CAR связывается с антигеном, присутствующим на поверхности целевой клетки.
[604] В настоящем изобретении представлены способы уничтожения или ингибирования роста целевой клетки, при этом способ включает приведение в контакт с цитотоксической иммунной эффекторной клеткой (например, цитотоксической Т-клеткой или NK-клеткой), которая генетически модифицирована для получения рассматриваемого CAR, так что Т-лимфоцит или NK-клетка распознает антиген, присутствующий на поверхности целевой клетки, и опосредует уничтожение целевой клетки.
[605] В настоящем изобретении предложен способ лечения заболевания или нарушения у индивидуума, страдающего этим заболеванием или нарушением, включающий в себя: a. введение вектора экспрессии, включающего полинуклеотидную последовательность, кодирующую CAR, в клетки периферической крови, полученные от субъекта, для получения генно-инженерной цитотоксической клетки; и b. введение субъекту генно-инженерной цитотоксической клетки.
[606] В способах, представленных в данном документе, которые включают введение генетически модифицированных Т-клеток и/или NK-клеток субъекту, особенно если субъект болен или подозревается в наличии рака, при этом способы могут дополнительно включать доставку субъекту эффективной дозы ингибитора иммунных контрольных точек. Эта доставка ингибитора контрольной точки может происходить до, после или одновременно с введением генетически модифицированных Т-клеток и/или NK-клеток. Ингибиторы иммунных контрольных точек известны, и различные соединения одобрены и находятся в стадии клинической разработки. Молекулы контрольных точек, многие из которых являются мишенью для соединений ингибиторов контрольных точек, включают следующие, с некоторыми отмеченными ингибиторами контрольных точек:
[607] CD27. Эта молекула поддерживает антигенспецифическую экспансию наивных Т-клеток и жизненно важна для создания Т-клеточной памяти. Celldex Therapeutics работает над CDX-1127, агонистическим моноклональным антителом к CD27.
[608] CD28. Эта молекула конститутивно экспрессируется почти на всех CD4+ Т-клетках человека и на приблизительно половине всех CD8 Т-лимфоцитов. CD28 представлял собой мишень суперантагониста TGN1412 .
[609] CD40. Эта молекула, обнаруженная на множестве клеток иммунной системы, включая антигенпрезентирующие клетки, имеет CD40L, иначе известный как CD154, и временно экспрессируется на поверхности активированных CD4+ Т-клеток в качестве лиганда. Моноклональное антитело к агонисту CD40 было лицензировано Roche.
[610] CD122. Эта молекула, которая является субъединицей бета-рецептора интерлейкина-2, как известно, увеличивает пролиферацию эффекторных CD8+ Т-клеток. Nektar Therapeutics разработала NKTR-214, иммуностимулирующий цитокин, связанный с CD122.
[611] CD137. Когда эта молекула, также обозначаемая 4-1BB, связывается лигандом CD137, результатом является пролиферация Т-клеток. Pieris Pharmaceuticals разработала модифицированный липокалин, который является биспецифичным в отношении CD137 и HER2.
[612] OX40. Эта молекула, также называемая CD134, имеет OX40L или CD252 в качестве лиганда. Подобно CD27, OX40 способствует экспансии эффекторных Т-клеток и Т-клеток памяти, однако он также известен своей способностью подавлять дифференцировку и активность Т-регуляторных клеток, а также регулировать выработку цитокинов. AstraZeneca разрабатывает три препарата, нацеленных на OX40: MEDI0562 представляет собой гуманизированный агонист OX40; MEDI6469, мышиный агонист OX4; и MEDI6383, агонист OX40.
[613] GITR, сокращение от индуцированного глюкокортикоидами гена семейства TNFR, вызывает экспансию Т-клеток, включая экспансию Treg. TG Therapeutics работает над антителами к GITR.
[614] ICOS. Эта молекула, сокращенно от Inducible T-cell costimulator, также называемая CD278, экспрессируется на активированных Т-клетках. Jounce Therapeutics разрабатывает агонист ICOS.
[615] A2AR. Рецептор аденозина A2A считается важной контрольной точкой в терапии рака, поскольку аденозин в иммунном микроокружении, приводящий к активации рецептора A2a, представляет собой петлю отрицательной иммунной обратной связи, а в микроокружении опухоли имеются относительно высокие концентрации аденозина.
[616] B7-H3, также называемый CD276, первоначально считался костимулирующей молекулой, но в настоящее время рассматривается как коингибирующая молекула. MacroGenics работает над MGA271, оптимизированным для Fc моноклональным антителом, нацеленным на B7-H3.
[617] B7-H4, B7-H4, также называемый VTCN1, экспрессируется опухолевыми клетками и опухолеассоциированными макрофагами и играет роль в ускользании от опухоли.
[618] BTLA. Эта молекула, сокращение от B и T Lymphocyte Attenuator, также называемая CD272, имеет HVEM (Herpesvirus Entry Mediator) в качестве лиганда.
[619] CTLA-4, сокращение от Cytotoxic T-Lymphocyte-Associated protein 4 и также называемый CD152, является мишенью для соединения Yervoy из Bristol-Myers Squibb.
[620] IDO, сокращение от индолеамин-2,3-диоксигеназа, представляет собой катаболический фермент триптофана с иммуноингибирующими свойствами. Другой важной молекулой является TDO, триптофан-2,3-диоксигеназа. IDO. Newlink Genetics и Incyte идентифицировали ингибиторы пути IDO.
[621] KIR, сокращение от Killer-cell Immunoglobulin-like Receptor, является рецептором молекул MHC класса I на естественных клетках-киллерах. Bristol-Myers Squibb разработала Lirilumab, моноклональное антитело к KIR.
[622] LAG3, сокращение от Lymphocyte Activation Gene-3, работает для подавления иммунного ответа путем воздействия на Treg, а также прямого воздействия на CD8+ T-клетки. Bristol-Myers Squibb разработала моноклональное антитело к LAG3 под названием BMS-986016.
[623] PD-1, сокращение от рецептора Programmed Death 1 (PD-1), имеет два лиганда, PD-L1 и PD-L2. Эта контрольная точка представляет собой мишень для лекарственного средства от меланомы Keytruda от Merck & Co.
[624] TIM-3, сокращение от Т-клеточного домена иммуноглобулина и муцинового домена 3, экспрессируется на активированных человеческих CD4+ Т-клетках и регулирует цитокины Th1 и Th17.
[625] VISTA (белок), сокращение от V-domain Ig suppressor of T cell activation, в первую очередь экспрессируется на гемопоэтических клетках.
СУБЪЕКТЫ, ПОДХОДЯЩИЕ ДЛЯ ЛЕЧЕНИЯ
[626] Для лечения с помощью способов и композиций, представленных в данном документе, подходят самые разные субъекты. Подходящие субъекты включают любого индивидуума, например, человека или отличного от человека животного, у которого имеется заболевание или нарушение, у которого было диагностировано заболевание или нарушение, у которого имеется риск развития заболевания или нарушения, у кого было заболевание или нарушением и который находится в группе риска рецидива заболевания или нарушения, которого лечили средством от заболевания или нарушения и не отвечал на такое лечение, или которого лечили средством от заболевания или нарушения, но рецидивировал после первоначального ответа к такому лечению.
[627] Субъекты, подходящие для лечения иммуномодулирующим способом, включают индивидуумов, страдающих аутоиммунным заболеванием; индивидуумы, которые являются реципиентами трансплантатов органов или тканей; и тому подобное; индивидуумы с ослабленным иммунитетом; и индивидуумы, инфицированные патогеном.
ИЛЛЮСТРАТИВНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[628] В этом разделе «Иллюстративные варианты осуществления» представлены иллюстративные аспекты и варианты осуществления, представленные в данном документе и дополнительно обсуждаемые в настоящем описании. Для краткости и удобства все раскрытые аспекты и варианты осуществления и все возможные комбинации раскрытых аспектов и вариантов осуществления не перечислены в этом разделе. Следует понимать, что представлены варианты осуществления, которые являются конкретными вариантами осуществления для многих аспектов, как обсуждается во всем настоящем изобретении. С учетом полного раскрытия в данном документе подразумевается, что любой индивидуальный вариант осуществления, изложенный ниже или в этом полном изобретении, может быть объединен с любым аспектом, изложенным ниже или в этом полном изобретении, где он представляет собой дополнительный элемент, который может быть добавлен к аспекту или поскольку он является более узким элементом для элемента, уже присутствующего в аспекте. Такие комбинации более подробно обсуждаются в других разделах этого подробного описания.
[629] В одном аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, включающая полинуклеотид, содержащий: A. одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют рецептор химерного антигена (CAR); и B. элемент псевдотипирования и элемент активации (например, элемент активации NK-клетки или в иллюстративных вариантах осуществления элемент активации T-клетки) на его поверхности, причем элемент активации Т-клетки не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице.
[630] В другом аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, включающая полинуклеотид, включающий одну или несколько транскрипционных единиц, оперативно связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый полипептид, включая рецептор химерного антигена (CAR) и второй полипептид, включающий лимфопролиферативный элемент. Различные варианты осуществления такой частицы, такие как без ограничения лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, элементы управления, CAR и другие элементы, представлены в данном разделе и в настоящем изобретении.
[631] В другом аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, содержащая полинуклеотид, содержащий одну или несколько транскрипционных единиц, оперативно связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый полипептид, содержащий химерный антигенный рецептор (CAR) и второй полипептид, содержащий химерный лимфопролиферативный элемент, например, конститутивно активный химерный лимфопролиферативный элемент. В иллюстративных вариантах осуществления химерный лимфопролиферативный элемент не содержит цитокин, связанный с его когнатным рецептором или связанный с фрагментом его когнатного рецептора. Различные варианты осуществления такой частицы, такие как без ограничения лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, элементы управления, CAR и другие элементы, представлены в данном разделе и в настоящем изобретении.
[632] В другом аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, содежращая:
А. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют химерный антигенный рецептор (CAR); и
B. элемент псевдотипирования и элемент активации Т-клеток на своей поверхности, при этом элемент активации Т-клеток не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице, и при этом элемент активации Т-клеток представляет собой антитело на основе scFvFc к CD3. Различные варианты осуществления такой частицы, такие как без ограничения лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, элементы управления, CAR и другие элементы, представлены в данном разделе и в настоящем изобретении.
[633] В другом аспекте в данном документе представлены не способные к репликации рекомбинантные ретровирусные частицы, содержащие:
A. один или несколько элементов псевдотипирования на своей поверхности, способных связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембран с ними не способных к репликации рекомбинантных ретровирусных частиц;
B. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, где одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область, a трансмембранный домен, и внутриклеточный активирующий домен, и второй сконструированный сигнальный полипептид, содержащий по меньшей мере один лимфопролиферативный элемент; где экспрессия первого сконструированного сигнального полипептида и/или второго сконструированного сигнального полипептида регулируется контрольным элементом; и
C. элемент активации на своей поверхности, при этом элемент активации способен связываться с Т-клеткой и/или NK-клеткой и не кодируется полинуклеотидом в не способных к репликации рекомбинантных ретровирусных частицах. Различные варианты осуществления такой частицы, такие как без ограничения лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, элементы управления, CAR и другие элементы, представлены в данном разделе и в настоящем изобретении.
[634] В некоторых аспектах в данном документе представлен генетически модифицированный лимфоцит, такой как Т-клетка или NK-клетка, полученная путем трансдукции покоящихся Т-клеток и/или покоящихся NK-клеток в соответствии со способом, включающим приведение в контакт с покоящимися Т-клетками и/или покоящимися NK-клетками ex vivo, с любой из не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, при этом указанное приведение в контакт облегчает трансдукцию покоящихся Т-клеток и/или NK-клеток с помощью не способных к репликации рекомбинантных ретровирусных частиц, тем самым продуцируя генетически модифицированные Т-клетки и/или NK-клетки. В одном варианте осуществления не способные к репликации рекомбинантные ретровирусные частицы содержат элемент псевдотипирования на своей поверхности и связанный с мембраной элемент активации Т-клеток на своей поверхности. Различные варианты осуществления такой клетки, такие как, помимо прочего, время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, элементы управления и другие элементы, представлены в данном разделе и в настоящем изобретении.
[635] В другом аспекте в данном документе представлено применение любой не способной к репликации рекомбинантной ретровирусной частицы в производстве набора для генетической модификации Т-клетки или NK-клетки, где использование набора включает стадии любого из аспектов и вариантов способов, представленных в данном документе. Например, в другом аспекте в данном документе представлено применение не способной к репликации рекомбинантной ретровирусной частицы при производстве набора для генетической модификации Т-клетки или NK-клетки, где использование набора включает: приведение в контакт T-клетки или NK-клетки ex vivo с не способной к репликации рекомбинантной ретровирусной частицей, где рекомбинантная ретровирусная частица, неспособная к репликации, включает элемент псевдотипирования на поверхности и элемент активации Т-клеток на поверхности, при этом указанное приведение в контакт облегчает трансдукцию Т-клетки или NK-клетки с помощью не способной к репликации рекомбинантной ретровирусной частицы, тем самым производя генетически модифицированные Т-клетки или NK-клетки. В некоторых вариантах осуществления элемент активации Т-клеток может быть мембраносвязанным. В иллюстративных вариантах осуществления Т-клеточный активирующий элемент активирует Т-клетку через рецепторный комплекс, связанный с Т-клеточным рецептором. В некоторых вариантах осуществления приведение в контакт может выполняться от 1, 2, 3, 4, 5, 6, 7 или 8 часов на нижнем конце диапазона и 4, 5, 6, 7, 8, 10, 12, 15, 18, 21 и до 24 часа на верхнем конце диапазона, например, от 1 до 12 часов или от 1 до 5 часов. В этом аспекте применения и других аспектах применения в данном документе, не способная к репликации рекомбинантная ретровирусная частица для применения в производстве набора может включать любой из аспектов и вариантов осуществления не способной к репликации рекомбинантной ретровирусной частицы, представленных в данном документе. В данном документе представлены различные другие варианты осуществления таких способов, такие как без ограничения другое время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, процент трансфицированных/генетически модифицированных клеток, элементы управления и другие элементы.
[636] В другом аспекте в данном документе представлен способ трансдукции и/или генетической модификации лимфоцита, обычно Т-клетки и/или NK-клетки, и обычно покоящейся Т-клетки и/или покоящейся NK-клетки, который включает приведение в контакт лимфоцита с не способной к репликации рекомбинантной ретровирусной частицей, где рекомбинантная ретровирусная частица, не способная к репликации, обычно содержит элемент псевдотипирования на своей поверхности, при этом указанное приведение в контакт (которое также может считаться инкубацией в условиях приведения в контакт) облегчает трансдукцию покоящейся Т-клетки и/или NK-клетки с помощью не способных к репликации рекомбинантных ретровирусных частица, за счет чего образуются генетически модифицированная Т-клетка и/или NK-клетка. Элемент псевдотипирования обычно способен связывать покоящуюся Т-клетку и/или NK-клетку и обычно способствует слиянию мембран сам по себе или в сочетании с другим (другими) белком (белками) не способных к репликации рекомбинантных ретровирусных частиц. В некоторых вариантах осуществления способа рекомбинантная ретровирусная частица, не способная к репликации, содержит активирующий элемент, такой как Т-клеточный активирующий элемент, который активирует Т-клетку через комплекс, связанный с Т-клеточным рецептором. Таким активирующим элементом может быть антитело к CD3, например, scFv кCD3 или scFvFc к CD3. В данном документе представлены различные примерные и иллюстративные времена контакта. В данном документе представлены различные другие варианты осуществления таких способов, такие как без ограничения время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, процент трансфицированных/генетически модифицированных клеток, элементы управления и другие элементы.
[637] В другом аспекте в данном документе представлен способ генетической модификации и/или трансдукции лимфоцита, включающий приведение в контакт лимфоцита ex vivo с не способной к репликации рекомбинантной ретровирусной частицей, при этом не способная к репликации рекомбинантная ретровирусная частица содержит элемент псевдотипирования на своей поверхности и мембраносвязанный активирующий элемент Т-клетки на его поверхности, при этом указанное приведение в контакт облегчает трансдукцию лимфоцита не способными к репликации рекомбинантными ретровирусными частицами, тем самым продуцируя генетически модифицированный лимфоцит. В некоторых вариантах осуществления мембраносвязанный элемент Т-клеточной активации представляет собой антитело к CD3, например, scFv к CD3 или scFvFc к CD3. В данном документе представлены различные другие варианты осуществления таких способов, такие как без ограничения время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, процент трансфицированных/генетически модифицированных клеток, элементы управления и другие элементы.
[638] В другом аспекте в данном документе представлен способ трансдукции покоящихся лимфоцитов субъекта, включающий приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат на своей поверхности элемент псевдотипирования, который способен связывать покоящуюся Т-клетку и/или NK-клетку и облегчать слияние мембран не способных к репликации рекомбинантных ретровирусных частиц с ними, при этом указанное приведение в контакт способствует трансдукции покоящихся Т-клеток и/или NK-клеток посредством не способных к репликации рекомбинантных ретровирусных частиц, за счет чего образуются генетически модифицированные T-клетки и/или NK-клетки. В иллюстративных вариантах осуществления этого аспекта по меньшей мере 10%, 20% или 25% покоящихся Т-клеток и/или NK-клеток, или от 10% до 70%, от 10% до 50%, или от 20% до 50%. % Т-клеток и/или NK-клеток трансдуцируются в результате этого способа. В данном документе представлены различные другие варианты осуществления таких способов, такие как без ограничения время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, процент трансфицированных/генетически модифицированных клеток, элементы управления и другие элементы.
[639] В другом аспекте в данном документе представлен способ трансдукции покоящихся Т-клеток и/или покоящихся NK-клеток, из выделенной крови, включающий:
A. сбор крови у субъекта;
B. выделение мононуклеарных клеток периферической крови (PBMC), содержащих покоящиеся Т-клетки и/или покоящиеся NK-клетки;
C. приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат на своей поверхности элемент псевдотипирования, который способен связывать покоящуюся Т-клетку и/или покоящуюся NK-клетку и облегчать слияние мембран не способных к репликации рекомбинантных ретровирусных частиц с ними, при этом указанное приведение в контакт способствует трансдукции по меньшей мере 5% покоящихся Т-клеток и/или покоящихся NK-клеток посредством не способных к репликации рекомбинантных ретровирусных частиц, за счет чего образуются генетически модифицированные T-клетки и/или NK-клетки, за счет чего трансдуцируются покоящиеся Т-клетки и/или NK-клетки. В данном документе представлены различные другие варианты осуществления таких способов, такие как без ограничения время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, процент трансфицированных/генетически модифицированных клеток, элементы управления и другие элементы.
[640] Обычно линию пакующих клеток используют для получения рекомбинантных ретровирусных частиц, не способных к репликации, как обсуждается в другом месте в данном документе. В некоторых вариантах осуществления линия пакующих клеток может представлять собой линию суспензионных клеток. В иллюстративных вариантах осуществления линию пакующих клеток можно выращивать в бессывороточной среде. В некоторых вариантах осуществления лимфоцит может происходить от субъекта. В иллюстративных вариантах осуществления лимфоцит может происходить из крови субъекта. В данном документе представлены различные другие варианты осуществления таких способов, такие как без ограничения время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, процент трансфицированных/генетически модифицированных клеток, элементы управления и другие элементы.
[641] В другом аспекте в данном документе предусмотрен способ трансдукции лимфоцита не способной к репликации рекомбинантной ретровирусной частицей, включающий:
A. трансфекция пакующей клетки группой векторов, содержащих компоненты не способной к репликации рекомбинантной ретровирусной частицы, при этом пакующая клетка выращивается в суспензии в бессывороточной среде;
B. сбор не способной к репликации рекомбинантной ретровирусной частицы из бессывороточной среды; и
C. приведение в контакт лимфоцита с не способной к репликации рекомбинантной ретровирусной частицей. В данном документе представлены различные варианты осуществления таких способов, такие как без ограничения время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, процент трансфицированных/генетически модифицированных клеток, элементы управления и другие элементы.
[642] В другом аспекте в данном документе предусмотрен способ трансдукции лимфоцита не способной к репликации рекомбинантной ретровирусной частицей, включающий:
A. Культивирование пакующей клетки в суспензии в бессывороточной среде, где пакующая клетка содержит последовательности нуклеиновых кислот, кодирующие упаковываемый геном РНК не способной к репликации ретровирусной частицы, белок REV, полипептид gag, полипептид pol и элемент псевдотипирования;
B. сбор не способной к репликации рекомбинантной ретровирусной частицы из бессывороточной среды; и
C. приведение в контакт лимфоцита с не способной к репликации рекомбинантной ретровирусной частицей, при этом приведение в контакт осуществляют в течение менее чем 12 часов, за счет чего трансдуцируется лимфоцит. В данном документе представлены различные другие варианты осуществления таких способов, такие как без ограничения другое время контакта, лимфопролиферативные элементы, элементы активации, элементы псевдотипирования, процент трансфицированных/генетически модифицированных клеток, элементы управления и другие элементы.
[643] За исключением случаев, когда она несовместима или уже не заявлена в аспекте в иллюстративных вариантах осуществления, пакующая клетка представляет собой иммортализованную клетку, содержащую стабильно интегрированные в нее нуклеиновые кислоты ДНК, которые кодируют геном упаковываемой РНК. В некоторых вариантах осуществления полипептид gag и полипептид pol экспрессируются из одного или нескольких индуцибельных промоторов, и при этом способ дополнительно включает во время культивирования добавление трансактиватора для индукции экспрессии полипептида gag и полипептида pol из одного или больше индуцибельных промоторов. В данном документе представлены различные варианты осуществления таких способов, такие как без ограничения время контакта, лимфопролиферативные элементы, элементы активации, элементы управления и другие элементы.
[644] Если это не несовместимо или уже не указано в аспекте, в иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и/или трансдукции лимфоцитов, например Т-лимфоцитов, для генетической модификации и увеличения лимфоцитов, например Т-лимфоцитов, или для выполнения клеточных в данном документе или аналогичные методы, приведение в контакт можно проводить в течение 15, 30 или 45 минут или 1, 2, 3, 4, 5, 6, 7 или 8 часов на нижнем конце диапазона и в течение 2, 4, 6, 8, 10, 12, 18, 24, 36, 48 и 72 часов на верхнем конце диапазона. Например, в иллюстративных вариантах осуществления приведение в контакт осуществляется в течение от 2 до 24 часов, от 2 до 20 часов, от 2 до 6 часов, от 1 до 20 часов, от 1 до 12 часов, от 1 до 4 часов, от 4 до 12 часов или от 4 до 8 часов. В некоторых вариантах осуществления приведение в контакт PBMC, NK-клетки и в иллюстративных вариантах осуществления Т-клетки с рекомбинантной ретровирусной частицей, не способной к репликации, любым из способов, процессов для производства продуктов или их использования, если не указано или не указано иное в самом широком аспекте, представленном в данном документе, может выполняться в течение от 1 до 24 часов, например, от 1 до 12 часов, от 1 до 6 часов. В некоторых вариантах осуществления приведение в контакт может осуществляться в течение менее чем 24 часов, например, менее чем 12 часов, менее чем 8 часов или менее чем 4 часов. В иллюстративных вариантах осуществления приведение в контакт выполняется в течение от 1 до 14 часов, от 1 до 12 часов, от 1 до 6 часов, от 1 до 4 часов или от 2 до 14 часов. Такие методы можно выполнять без предварительной активации.
[645] Если они не являются несовместимыми или уже заявленными в одном аспекте, дальнейшие варианты осуществления любого из вышеуказанных способов, применения или продуктов в аспектах способа трансдукции и/или генетической модификации лимфоцита, например, NK-клетки или, в иллюстративных вариантах осуществления, T-клетки, может включать любой из вариантов осуществления не способных к репликации рекомбинантных ретровирусных частиц, лимфопролиферативных элементов, CAR, элементов псевдотипирования, рибопереключателей, активирующих элементов, мембраносвязанных цитокинов, miRNA и/или других элементов, описанных в данном документе. В некоторых иллюстративных вариантах осуществления ретровирусная частица представляет собой лентивирусную частицу.
[646] За исключением случаев несовместимости или уже заявленного в аспекте любого из способов, наборов, применений или композиций (например, полинуклеотидов, пакующих клеток или не способных к репликации ретровирусных частиц), представленных в данном документе, не способные к репликации рекомбинантные ретровирусные частицы включают или дополнительно содержат элемент активации на своей поверхности, который способен активировать покоящуюся Т-клетку и/или покоящуюся NK-клетку. Обычно элемент активации, такой как Т-клеточный элемент активации, не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице.
[647] За исключением случаев, когда они несовместимы или уже заявлены в каком-либо аспекте, в любом из способов, наборов, применений или композиций (например, полинуклеотиды, пакующие клетки или не способные к репликации рекомбинантные ретровирусные частицы), представленных в данном документе, которые содержат Т-клетку и/или NK-клетку или покоящуюся Т-клетку или покоящуюся NK-клетку, в некоторых иллюстративных вариантах осуществления клетка представляет собой Т-клетку.
[648] Если рекомбинантная ретровирусная частица не является несовместимой или уже заявленной в каком-либо аспекте, как правило, в любом из способов, наборов, применений или композиций (например, полинуклеотиды, упаковочные клетки или ретровирусные частицы с неспособной к репликации рекомбинации), представленных в данном документе, она не способна к репликации, т.е. не может реплицироваться. В иллюстративных вариантах осуществления ретровирус представляет собой лентивирус, такой как не способный к репликации или дефектный по репликации лентивирус HIV. В иллюстративных вариантах осуществления ретровирусная частица представляет собой лентивирусную частицу, такую как не способная к репликации или дефектная по репликации лентивирусная частица HIV. Таким образом, в иллюстративных вариантах осуществления любого из способов, наборов, применений или композиций (например, полинуклеотидов, пакующих клеток или не способных к репликации рекомбинантых ретровирусных частиц ), представленных в данном документе, если они еще не изложены или еще не указаны иным образом, не способная к репликации рекомбинантная ретровирусная частица представляет собой лентивирусную частицу и/или генетически модифицированная клетка представляет собой генетически модифицированную Т-клетку.
[649] Лимфоциты могут быть Т-клетками и/или NK-клетками, если они не являются несовместимыми или уже заявленными в аспекте, в иллюстративных вариантах осуществления любого из аспектов, предоставленных в данном документе. В дополнительных иллюстративных вариантах осуществления T-клетки и/или NK-клетки могут быть покоящимися T-клетками и/или NK-клетками.
[650] Если это не является несовместимым или уже заявленным в аспекте, в иллюстративных вариантах осуществления любого из аспектов способов трансдукции, генетической модификации и экспансии лимфоцитов или для выполнения адоптивной клеточной терапии в данном документе или аналогичных способов, от 10% до 75%, или 10% и 70%, или 10% и 60%, или 10% и 50%, или 10% и 25%, или 20% и 75%, или 20% и 50%, или по крайней мере 10%, 20% или 25% покоящихся Т-клеток являются трансдуцированными и от 0% до 75% NK-клеток являются трансдуцированными. В других вариантах осуществления от 5% до 80%, или от 10% до 80%, или от 10% до 70%, или от 10% до 60%, или от 10% до 50%, или от 10% до 25%, или от 10% 20% или 20% до 50% покоящихся NK-клеток являются трансдуцированными.
[651] Экспрессия указанного второго сконструированного сигнального полипептида, если это не является несовместимым или уже заявленным в аспекте, в иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и увеличения лимфоцитов или для проведения адоптивной клеточной терапии в данном документе, или аналогичных способов или любых композиций, представленных в данном документе регулируется элементом управления.
[652] Если это не несовместимо или уже не указано в каком-либо аспекте, в любом из аспектов способа, применения, продукта с помощью способа или состава в данном документе, которые включают генетически модифицированные Т-клетки или NK-клетки или не способные к репликации рекомбинантные ретровирусные частицы, такие генетически модифицированные Т-клетки или NK-клетка, или не способная к репликации рекомбинантная ретровирусная частица, может включать полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в T-клетках и/или NK-клетках, где одна или несколько транскрипционных единиц кодируют первый полипептид, содержащий химерный антигенный рецептор (CAR) и/или второй полипептид, содержащий лимфопролиферативный элемент Т-клетки. В некоторых вариантах осуществления экспрессия CAR и/или лимфопролиферативного элемента находится под контролем элемента управления или различных элементов управления для каждого из них. В некоторых вариантах осуществления CAR и лимфопролиферативный элемент могут экспрессироваться в одном полипептиде, а в иллюстративных вариантах осуществления CAR и лимфопролиферативный элемент экспрессируются как отдельные полипептиды. В некоторых вариантах осуществления CAR представляет собой MRB CAR. В некоторых вариантах осуществления химерный лимфопролиферативный элемент является конститутивно активным, например, конститутивно активным химерного цитокиновым рецептором. В таких вариантах осуществления конститутивно активный химерный цитокиновый рецептор может находиться под контролем элемента управления.
[653] Если не является несовместимым или уже заявленным в аспекте, в любом из аспектов в данном документе, который включает полинуклеотид, содержащий одну или несколько транскрипционных единиц, оперативно связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый полипептид, содержащий химерный антигенный рецептор (CAR), и/или второй полипептид, содержащий лимфопролиферативный элемент Т-клетки, полинуклеотид может дополнительно содержать одну или несколько из последовательности Козак, элемента WPRE и множественной стоп-последовательности, такой как как двойной стоп-кодон или тройной стоп-кодон, где один или несколько стоп-кодонов двойного стоп-кодона или тройного стоп-кодона определяют завершение считывания по меньшей мере одной из одной или нескольких транскрипционных единиц. В некоторых вариантах осуществления полинуклеотид содержит последовательность типа Козак, выбранную из CCACCAT/UG(G), CCGCCAT/UG(G), GCCGCCGCCAT/UG(G) или GCCGCCACCAT/U(G). В определенных вариантах осуществления как -3, так и +4 нуклеотиды относительно стартового кодона первой последовательности нуклеиновой кислоты содержит G. В другом варианте осуществления, который может быть объединен с предыдущим вариантом осуществления, который содержит последовательность типа Козак и/или в следующем варианте осуществления, который содержит тройной стоп-кодон, полинуклеотид включает элемент WPRE. В некоторых вариантах осуществления элемент WPRE расположен с 3' конца стоп-кодона одной или нескольких транскрипционных единиц и от 5' к 3' LTR полинуклеотида. В другом варианте осуществления, который можно комбинировать с одним или обоими из предшествующих вариантов (т.е. с вариантом, в котором полинуклеотид содержит последовательность типа Козак, и/или с вариантом осуществления, в котором полинуклеотид содержит WPRE), одна или несколько транскрипционных единиц оканчиваются одним или несколькими стоп-кодонами двойного стоп-кодона или тройного стоп-кодона.
[654] Если он несовместим или уже не заявлен в аспекте, в иллюстративных вариантах осуществления любого из способов, применений и композиций, представленных в данном документе, которые включают лимфопролиферативный элемент, лимфопролиферативный элемент может быть химерным лимфопролиферативным элементом. В любом из вариантов осуществления настоящего изобретения, которые включают химерный лимфопролиферативный элемент, химерный лимфопролиферативный элемент может быть химерным цитокиновым рецептором. В любом из вариантов осуществления в данном документе, которые включают химерный лимфопролиферативный элемент, химерный лимфопролиферативный элемент может быть IL-7, связанным с рецептором IL-7 альфа, или отличаться от IL-7, связанного с рецептором IL-7 альфа. В некоторых вариантах осуществления химерный цитокиновый рецептор содержит IL-7, связанный с рецептором IL-7 альфа, или его фрагмент, который сохраняет способность стимулировать пролиферацию Т-клеток и/или NK-клеток, и при этом химерный цитокиновый рецептор является конститутивно активным. В некоторых вариантах осуществления указанный химерный цитокиновый рецептор содержит IL-7, ковалентно связанный с функциональным внеклеточным фрагментом рецептора IL-7, способным связываться с IL-7, трансмембранным доменом IL-7 и сигнальным доменом IL-7.
[655] Если он несовместим или уже не заявлен в аспекте, в любом из аспектов и вариантов осуществления в данном документе, которые включают химерный лимфопролиферативный элемент, химерный лимфопролиферативный элемент может отличаться от химерного цитокинового рецептора. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают лимфопролиферативный элемент, химерный лимфопролиферативный элемент может быть химерным цитокиновым рецептором. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают химерный цитокиновый рецептор, химерный цитокиновый рецептор включает внутриклеточный сигнальный домен рецептора IL-7, внутриклеточный сигнальный домен рецептора IL-12, внутриклеточный сигнальный домен рецептора IL-15/IL-2, такого как бета-рецептор IL-15/IL-2, внутриклеточный сигнальный домен рецептора IL-21, внутриклеточный сигнальный домен рецептора IL-23, внутриклеточный сигнальный домен рецептор IL-27, внутриклеточный сигнальный домен рецептора-ловушки трансформирующего фактора роста β (TGFβ) или CD28. В некоторых вариантах осуществления химерный цитокиновый рецептор включает IL-7, слитый с рецептором IL-7.
[656] Если не указано иное или уже не указано в самом широком аспекте, в иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают лимфопролиферативный элемент, лимфопролиферативный элемент может содержать мотив выживания Т-клеток. Мотив выживания Т-клеток может включать весь или функциональный фрагмент рецептора IL-7, рецептора IL-15 или CD28. В других вариантах осуществления лимфопролиферативный элемент может включать полипептид цитокина или цитокинового рецептора или его фрагмент, содержащий сигнальный домен. Например, лимфопролиферативный элемент может содержать полипептид интерлейкина, а лимфопролиферативный элемент может дополнительно включать часть своего когнатного полипептида рецептора интерлейкина, ковалентно присоединенного через линкер. Обычно эта часть когнатного рецептора интерлейкина включает функциональную часть внеклеточного домена, способную связывать цитокин интерлейкина и трансмембранный домен. В некоторых вариантах осуществления внутриклеточный домен представляет собой внутриклеточную часть когнатного рецептора интерлейкина. В некоторых вариантах осуществления внутриклеточный домен представляет собой внутриклеточную часть рецептора другого цитокина, который способен стимулировать пролиферацию лимфоцитов и, возможно, выживание ex vivo или in vitro в культуре в отсутствие воздействия на лимфоцит экзогенных цитокинов, таких как IL-15, IL-7, и в иллюстративных вариантах осуществления IL-2 и в отсутствие мишени для ASTR CAR, экспрессируемого лимфоцитами, во время культивирования в течение 6, 7, 14, 21 или 35 дней или дольше.
[657] В некоторых вариантах осуществления лимфопролиферативный элемент, если он не является несовместимым с ним или уже не заявлен в каком-либо аспекте, представляет собой полипептид интерлейкина, ковалентно связанный с его полноразмерным родственным полипептидом рецептора интерлейкина через линкер. В качестве альтернативы лимфопролиферативный элемент может быть внутриклеточным сигнальным доменом рецептора IL-7, внутриклеточным сигнальным доменом рецептора IL-12, внутриклеточным сигнальным доменом IL-23, внутриклеточным сигнальным доменом IL-27, внутриклеточным сигнальным доменом рецептора IL-15, внутриклеточным сигнальным доменом рецептора IL-21 или внутриклеточным сигнальным домена рецептора-ловушки трансформирующего фактора роста β (TGFβ).
[658] Если не является несовместимым с каким-либо аспектом или уже не заявлено в нем, в некоторых иллюстративных вариантах осуществления лимфопролиферативный элемент является конститутивно активным. Кроме того, лимфопролиферативный элемент может включать мутантный рецептор IL-7 или его фрагмент, который может дополнительно включать конститутивно активный мутантный рецептор IL-7 или его конститутивно активный фрагмент. В некоторых вариантах осуществления лимфопролиферативный элемент или рецептор химерного цитокина содержит мутант IL7 InsPPCL. Если он несовместим или уже не заявлен в аспекте, в любом из аспектов в данном документе, который включает лимфопролиферативный элемент, лимфопролиферативный элемент может быть любым из CLE, перечисленных в разделе «Лимфопролиферативный элемент» в данном документе. Например, в иллюстративных вариантах осуществления CLE содержат домены из генов, специально обозначенных как особо примечательные и/или главные конструкции в отношении приведенных в данном документе примеров.
[659] В определенных иллюстративных вариантах осуществления лимфопролиферативный элемент содержит цитокиновый рецептор или его фрагмент, который содержит сигнальный домен, который активирует путь Jak/STAT5. Например, такой лимфопролиферативный элемент может содержать внутриклеточный домен IL21R, IL27R, IL31RA, LIFR и OSMR. Как продемонстрировано в экспериментах Примеров 17 и 18 и Табл. 7-17, химерные лимфопролиферативные элементы, которые содержат внутриклеточные домены этих генов, были обнаружены среди химерных кандидатных полипептидов, которые индуцировали наивысшую степень пролиферации в PBMC, культивируемых в отсутствие экзогенных цитокинов, таких как как IL-2.
[660] В некоторых вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен, который представляет собой интерлейкин или рецептор интерлейкина, и который представлял собой часть наболее эффективной конструкции, идентифицированной в библиотеках 1A, 1.1A, 2B, 2.1B, 3A, 3.1A, 3B, 3.1. B, 4B и/или 4.1B Примеров 17 и 18 (Табл. с 7 по 17). В некоторых вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен, который представляет собой цитокиновый рецептор, и который представлял собой часть наболее эффективной конструкции, идентифицированной в библиотеках 1A, 1.1A, 2B, 2.1B, 3A, 3.1A, 3B, 3.1. B, 4B и/или 4.1B Примеров 17 и 18 (Табл. с 7 по 17). В некоторых вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен, который содержит по меньшей мере один мотив ITAM, и который представлял собой часть наболее эффективной конструкции, идентифицированной в библиотеках 1A, 1.1A, 2B, 2.1B, 3A, 3.1A, 3B, 3.1. B, 4B и/или 4.1B Примеров 17 и 18 (Табл. с 7 по 17).
[661] В иллюстративных вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен из IL7R, IL12RB1, IL15RA или IL27RA, которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) при начальном и повторном скрининге, как подробно описано в Примерах 17 и 18 (Табл. с 19 по 23).
[662] В иллюстративных вариантах осуществления лимфопролиферативный элемент может содержать внутриклеточный домен из цитокиновых рецепторов CD27, CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCER1G, FCGR2A, FCGR2C, GHR, IFNAR1, IFNAR2, IFNGR2, IL1R1, IL1RL1, IL2RA, IL2RG, IL3RA, IL5RA, IL6R, IL7R, IL9R, IL10RB, IL11RA, IL12RB1, IL13RA1, IL13RA2, IL15RA, IL17RB, IL18R1, IL18RAP, IL20RB, IL22RA1, IL27RA, IL31RA, LEPR, MPL, OSMR, PRLR, TNFRSF4, TNFRSF8, TNFRSF9, TNFRSF14 или TNFRSF18, которые присутствовали в конструкциях, которые продемонстрировали особенно заметное обогащение (т.е. вызвали наивысшую величину пролиферации) при начальном и повторном скрининге, как подробно описано в Примерах 17 и 18 (Табл. с 19 по 23).
[663] В иллюстративных вариантах осуществления лимфопролиферативный элемент содержит внутриклеточный домен из CD3D, CD3E, CD3G, CD79A, CD79B, FCER1G, FCGR2A или FCGR2C, которые содержат по меньшей мере один мотив ITAM и присутствуют в конструкциях, которые продемонстрировали особенно заметное обогащение (т.е. вызвали наивысшую величину пролиферации) при начальном скрининге и повторном скрининге, как подробно описано в Примерах 17 и 18 (Табл. с 19 по 23).
[664] В некоторых вариантах осуществления лимфопролиферативный элемент в этом абзаце, который, как было продемонстрировано в Примерах 17 и 18, активен в конструкциях только с одним внутриклеточным доменом, может представлять собой внутриклеточный домен лимфопролиферативного элемента с двумя или более внутриклеточными доменами или в иллюстративных вариантах осуществления единственный внутриклеточный домен, т.е. лимфопролиферативный элемент не содержит двух или более внутриклеточных доменов. В иллюстративных вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе содержит домен из CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2A, IFNAR2, IFNGR2, IL1R1, IL3RA, IL7R, IL10RB, IL11RA, IL12RB1, IL13RA2, IL18RAP, IL31RA, MPL, MYD88, TNFRSF14 или TNFRSF18, которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) при начальном и повторном скрининге, как подробно описано в Примере 18, как отдельные домены внутриклеточной передачи сигналов (Табл. 22 и 23). В иллюстративных вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе содержит домен из IL7R или IL12RB1, которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую величину пролиферации) при начальном и повторном скрининге, как подробно описано в Примере 18. (Табл. 22 и 23). В некоторых вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе с единственным внутриклеточным доменом может представлять собой цитокиновый рецептор. В иллюстративных вариантах осуществления цитокиновый рецептор в лимфопролиферативном элементе с одним внутриклеточным доменом содержит домен из CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2A, IFNAR2, IFNGR2, IL1R1, IL3RA, IL7R, IL10RB, IL11RA, IL12RB1, IL13RA2, IL18RAP, IL31RA, MPL, TNFRSF14 или TNFRSF18, которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую величину пролиферации) при начальном и повторном скрининге, как подробно описано в Примере 18 (Табл. 22 и 23). В некоторых вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе может содержать по меньшей мере один мотив ITAM. В иллюстративных вариантах осуществления внутриклеточный домен в лимфопролиферативном элементе, который содержит по меньшей мере один мотив ITAM, содержит домен из FCGR2A, который присутствовал в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую величину пролиферации) при начальном и повторном скрининге. как подробно описано в Примере 18 (Табл. 22).
[665] В иллюстративных вариантах осуществления лимфопролиферативный элемент может содержать костимулирующий домен из CD27, CD28, OX40 (также обозначаемый как TNFRSF4), GITR (также обозначаемый как TNFRSF18) или HVEM (также обозначаемый как TNFRSF14), которые присутствовали в конструкциях, которые продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) при начальном и повторном скрининге, как подробно описано в Примерах 17 и 18 (Таблицы с 19 по 23).
[666] В некоторых вариантах осуществления лимфопролиферативный элемент может представлять собой одну из конструкций M024-S190-S047, M025-S050-S197, M036-S170-S047, M012-S045-S048, M049-S194-S064, M025-S190-S050, M025-S190-S05, E013-T041-S186-S051, E013-T028-S186-S051, E014-T015-S186-S051, E011-T016-S186-S050, E011-T073-S186-S050 или E013-T011-S186-S211, все из которых стимулировали пролиферацию лимфоцитов в состоянии покоя после трансдукции, как продемонстрировано в Примере 21 (Фиг. 35 и 36). В определенных вариантах осуществления лимфопролиферативные элементы содержат внеклеточный домен из CSF3R, IL3RA, ICOS, CRLF, CSF2RA, LIFR или CD40; первый внутриклеточный домен из MyD88, CD40 или MPL и/или второй внутриклеточный домен из CD27 или MyD88.
[667] В некоторых вариантах осуществления лимфопролиферативный элемент может представлять собой конструкцию E013-T041-S186-S051, которая стимулировала пролиферацию лимфоцитов в состоянии покоя после трансдукции не способной к репликации рекомбинантной ретровирусной частицей, отображающей UCHT1scFvFc-GPI, как продемонстрировано и проанализировано в Примере 22 (Фиг. 38A и В). В других вариантах осуществления лимфопролиферативный элемент представляет собой IL7-IL7RA-IL2RB, как продменстрировано и проанализировано в Примере 22.
[668] Как подробно описано в Примере 17, для библиотек 1A и 1.1A конструкции с доменами цитокиновых рецепторов CD27, IL1RL1, IL6R, IL31RA, TNFRSF4 или TNFRSF18 продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) в обеих библиотеках 1A и 1.1A (Табл. 19).
[669] Как подробно описано в Примере 17, для библиотек 2B и 2.1B конструкции с доменами цитокиновых рецепторов CD40, FCER1G, FCGR2C, IFNGR2, GHR, IL10RB, IL11RA, IL13RA2, IL17RB, IL22RA1, TNFRSF14 или TNFRSF9 продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) в библиотеках 2B и 2.1B (Табл. 20).
[670] Как подробно описано в Примере 18, для библиотек 3A и 3.1A конструкции с доменами цитокиновых рецепторов CD27, CD40, CSF2RA, FCGR2A, MPL, OSMR, TNFRSF4 или TNFRSF18 продемонстрировали особенно заметное обогащение (т.е. вызвали наивысшую степень пролиферации) в обеих библиотеках 3A и 3.1A (Табл. 21).
[671] Как подробно описано в Примере 18, для библиотек 3B и 3.1B конструкции с доменами из цитокиновых рецепторов CD27, CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCER1G, FCGR2A, FCGR2C, IFNAR1, IFNAR2, IFNGR2, IL1RL1, IL2RG, IL3RA, IL5RA, IL6R, IL7R, IL9R, IL10RB, IL11RA, IL12RB1, IL13RA1, IL13RA2, IL15RA, IL18RAP, IL20RB, IL27RA, IL31RA, LEPR, MPL, OSMR, PRLR, TNFRSF4, TNFRSF8, TNFRSF9, TNFRSF14 или TNFRSF18 продемонстрировали особенно заметное обогащение (т.е. вызвали наивысшую степень пролиферации) в обеих библиотеках 3B и 3.1B (Табл. 22).
[672] Как подробно описано в Примере 18, для библиотек 4B и 4.1B конструкции с доменами цитокиновых рецепторов CD27, CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2A, FCGR2C, IFNAR2, IFNGR2, IL1R1, IL2RA, IL3RA, IL2RG, IL6R, IL7R, IL10RB, IL11RA, IL31RA, IL13RA1, IL13RA2, IL18R1, MPL, OSMR, TNFRSF4, TNFRSF9 или TNFRSF18 продемонстрировали особенно заметные обогащения (т.е. вызвали наивысшую степень пролиферации) в обеих библиотеках 4B и 4.1B (Табл. 23).
[673] Если это не является несовместимым или уже заявленным в аспекте, в любом из аспектов и вариантов осуществления, раскрытых в данном документе, таких как способ, применение, композиции и продукт в аспектах способа, которые включают лимфопролиферативный элемент, в иллюстративных вариантах осуществления генетически модифицированные PBMC, лимфоциты, или генетически модифицированные Т-клетки и/или NK-клетки способны способствовать пролиферации/экспансии лимфоцитов и, возможно, выживанию ex vivo или in vitro в культуре в отсутствие воздействия на клетки цитокинов, таких как IL-15, IL-7 и в иллюстративных вариантов осуществления IL-2 и мишени для ASTR CAR, экспрессируемого клетками во время культивирования в течение 6, 7, 14, 21 или 35 дней или дольше. В любом из вариантов осуществления, раскрытых в данном документе, включая CAR и лимфопролиферативный элемент, генетически модифицированные Т-клетки и/или NK-клетки могут быть способны приживаться in vivo у мышей без воздействия на мишень, распознаваемую CAR.
[674] Если это не является несовместимым или уже заявленным в аспекте, в иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают не способную (не способные) к репликации рекомбинантную (рекомбинантные) ретровирусную (ретровирусную) частицу (частицы), не способные к репликации рекомбинантные ретровирусные частицы могут содержать на своей поверхности активирующий элемент. В иллюстративных вариантах осуществления элемент активации активирует Т-клетку через комплекс, связанный с Т-клеточным рецептором. В некоторых случаях элемент активации может активировать только Т-лимфоциты. В других случаях элемент активации требует активации через рецепторный комплекс TCR для дальнейшей активации Т-клеток. Соответственно, в некоторых вариантах осуществления элемент активации содержит:
A. мембраносвязанный полипептид, способный связываться с CD3; и/или
B. мембраносвязанный полипептид, способный связываться с CD28.
[675] Кроме того, мембраносвязанный полипептид, способный связываться с CD3, представляет собой полипептид, способный связываться с CD3, который может быть слит с последовательностью присоединения гетерологичного GPI-якоря, а мембраносвязанный полипептид, способный связываться с CD28, может быть полипептидом, способным связываться с CD28, который слит с гетерологичной последовательностью присоединения GPI-якоря. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связываться с CD28, представляет собой CD80, CD86 или их функциональный фрагмент, который способен индуцировать опосредованную CD28 активацию Akt, например внеклеточный домен CD80.
[676] Если он несовместим или уже не заявлен в аспекте, в иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые являются или включают не способные к репликации рекомбинантные ретровирусные частицы, активирующий элемент может быть мембранносвязанным полипептидом, способным связывать CD3, например, как scFv к CD3 или scFvFc к CD3. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают не способную к репликации рекомбинантную ретровирусную частицу и антитело к CD3, антитело к CD3 может представлять собой scFvFc к CD3, слитый с гетерологичной последовательностью присоединения GPI-якоря. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают не способную к репликации рекомбинантную ретровирусную частицу, мембраносвязанный полипептид, способный связывать CD3, может представлять собой scFv к CD3, связанный с последовательностью присоединения GPI-якоря CD14, а мембранносвязанный полипептид, способный связываться с CD28, может быть CD80 или его внеклеточным доменом, связанным с последовательностью присоединения GPI-якоря CD16B. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают не способные к репликации рекомбинантные ретровирусные частицы, не способные к репликации рекомбинантные ретровирусные частицы могут содержать на своей поверхности scFv к CD3 , связанный с последовательностью присоединения GPI-якоря CD14, CD80 или его внеклеточный домен, связанный с последовательностью присоединения GPI-якоря CD16B, и слитый полипептид IL-7 или его активный фрагмент, и DAF, содержащий последовательность присоединения GPI-якоря. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают не способную к репликации рекомбинантную ретровирусную частицу, IL-7 или его активный фрагмент и слияние DAF, каждый из scFV к CD3 и CD80 или его внеклеточный домен содержит сигнальную последовательность DAF.
[677] Если не указано иное или уже не указано в самом широком аспекте, в иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые являются или включают не способные к репликации рекомбинантные ретровирусные частицы, не способные к репликации рекомбинантные ретровирусные частицы могут содержать на своей поверхности мембраносвязанный цитокин. Мембраносвязанный цитокин может представлять собой IL-7, IL-15 или их активный фрагмент. В других вариантах осуществления мембраносвязанный цитокин представляет собой слитый полипептид IL-7 или его активный фрагмент и DAF. Например, слитый полипептид может содержать сигнальную последовательность DAF (нуклеотиды 1-34 SEQ ID NO: 286), IL-7 без его сигнальной последовательности (нуклеотиды 35-186 SEQ ID NO: 286) и фрагмент DAF, который включает его последовательность присоединения GPI-якоря (нуклеотиды 187-532 SEQ ID NO: 286).
[678] Если он не является несовместимым или уже заявленным в одном аспекте, иллюстративные варианты осуществления любого из аспектов способа и состава, представленных в данном документе, элемент псевдотипирования может содержать один или несколько гетерологичных белков оболочки. В других примерах элемент псевдотипирования может включать один или несколько вирусных полипептидов, распознаваемых Т-клетками. Один или несколько элементов псевдотипирования могут включать полипептид вируса кори F, полипептид вируса кори H и/или их фрагмент. Один или несколько элементов псевдотипирования могут представлять собой варианты с делецией цитоплазматического домена полипептида F вируса кори и/или полипептида H вируса кори.
[679] За исключением случаев несовместимости или уже заявленного в аспекте, в иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают элемент управления, контрольный элемент может регулировать лимфопролиферативный элемент, при этом лимфопролиферативный элемент неактивен или менее активен в отношении стимуляции пролиферации. Т-клеток и/или NK-клеток в отсутствие соединения, и при этом соединение представляет собой молекулярный шаперон, который связывает лимфопролиферативный элемент и индуцирует активность лимфопролиферативного элемента.
[680] Если он несовместим или уже не заявлен в аспекте, в иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают элемент управления, элемент управления может быть полинуклеотидом, содержащим рибопереключатель. Рибопереключатель может быть способен связывать нуклеозидный аналог, а соединение, которое связывает элемент управления, является нуклеозидным аналогом. Нуклеозидный аналог может представлять собой противовирусное средство. Противовирусным средством может быть ацикловир или пенцикловир.
[681] Если они несовместимы или уже заявлены в аспекте, в иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают сконструированный сигнальный полипептид, который включает ASTR, ASTR одного или обоих сконструированных сигнальных полипептидов может связываться с опухолеассоциированным антигеном. В некоторых иллюстративных вариантах осуществления антигенспецифическая нацеленная область второго сконструированного полипептида представляет собой ограниченную микроокружением антигенспецифическую нацеленную область.
[682] За исключением случаев несовместимости или уже заявленного в аспекте, в иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают не способные к репликации рекомбинантные ретровирусные частицы, если не указано явно в самом широком аспекте, не способные к репликации рекомбинантные ретровирусные частицы могут кодировать домен распознавания для одобренного биопрепарата на основе моноклональных антител. В некоторых вариантах осуществления домен распознавания экспрессируется в том же транскрипте, что и химерный антигенный рецептор, и при этом домен распознавания отделен от химерного антигенного рецептора сигналом с рибосомным проскоком и/или сигналом расщепления. Сигнал с рибосомных проскоком и/или расщепления рибосомы может представлять собой 2A-1. Домен распознавания может включать полипептид, который распознается антителом, распознающим EGFR, или его эпитоп. Домен распознавания может быть мутантом EGFR, который распознается антителом EGFR и экспрессируется на поверхности трансдуцированных Т-клеток и/или NK-клеток в качестве другого механизма контроля, предусмотренного в данном документе. В связанных вариантах осуществления домен распознавания может включать полипептид, который распознается антителом, распознающим EGFR, или его эпитоп.
[683] Если не является несовместимым с любым способом, применением, продуктом с помощью способа или уже не заявлен в каком-либо аспекте, способ может дополнительно включать сбор крови у субъекта. Способ может дополнительно включать после контакта с покоящимися Т-клетками и/или покоящимися NK-клетками субъекта ex vivo повторное введение генетически модифицированных Т-клеток и/или NK-клеток субъекту. В некоторых вариантах осуществления покоящиеся Т-клетки и/или покоящиеся NK-клетки, с которыми контактируют, берутся из крови субъекта, и при этом экспансия генетически модифицированных Т-клеток и/или NK-клеток происходит in vivo внутри субъекта. В некоторых вариантах осуществления стадии между сбором крови и повторным введением генетически модифицированных Т-клеток и/или NK-клеток выполняются не более чем за 24 часа, 18 часов, 12 часов, 8 часов, 6 часов или 4 часа. Другие временные промежутки указаны в данном документе. В некоторых вариантах осуществления субъект не подвергается воздействию средства для лимфодеплеции в течение 7 дней после выполнения контакта, во время контакта и/или в течение 7 дней после повторного введения генетически модифицированных Т-клеток и/или NK-клеток субъекту.
[684] В одном аспекте в данном документе предложен способ трансдукции и/или генетической модификации лимфоцитов (например, Т-клеток и/или NK-клеток), в иллюстративных вариантах осуществления покоящихся лимфоцитов (покоящихся T-клеток и/или NK-клеток) субъекта, включающий приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат элемент псевдотипирования на своей поверхности и мембраносвязанное антитело на основе scFvFc к CD3 на своей поверхности, которое способно связывать покоящуюся Т-клетку и/или покоящуюся NK-клетку и способствовать слиянию мембран с ней не способной к репликации рекомбинантной ретровирусной частицы, при этом указанное приведение в контакт облегчает трансдукцию покоящихся Т-клеток и/или NK-клеток посредством не способных к репликации рекомбинантных ретровирусных частиц, тем самым получая генетически модифицированные Т-клетки и/или NK-клетки.
[685] В одном аспекте в данном документе предложен способ трансдукции и/или генетической модификации покоящихся Т-клеток и/или покоящихся NK-клеток из выделенной крови, включающий: сбор крови от субъекта; выделение мононуклеарных клеток периферической крови (PBMC), содержащих покоящиеся Т-клетки и/или покоящиеся NK-клетки; и приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo в течение эффективного времени с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат элемент псевдотипирования на своей поверхности и мембраносвязанное антитело на основе scFvFc к CD3 на своей поверхности, тем самым получая генетически модифицированные Т-клетки и/или NK-клетки, тем самым трансдуцируся покоящиеся Т-клетки и/или NK-клетки.
[686] В аспектах настоящего документа для трансдукции и/или генетической модификации Т-лимфоцитов (например, Т-лимфоцитов и/или NK-клеток), которые включают мембраносвязанное антитело scFvFc к CD3, элемент псевдотипирования в некоторых вариантах осуществления представляет собой белок оболочки вируса везикулярного стоматита (VSV-G). В некоторых вариантах осуществления не способные к репликации ретровирусные частицы дополнительно содержат мембраносвязанный полипептид, способный связываться с CD28, который может включать, например, внеклеточный домен CD80, CD86 или их функциональные фрагменты, которые сохраняют способность связывать CD28. В некоторых вариантах осуществления антитело на основе scFvFc к CD3 слито с гетерологичной последовательностью присоединения GPI-якоря. В некоторых вариантах осуществления антитело на основе scFvFc к CD3 не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице.
[687] В аспектах данного документа для трансдукции и/или генетической модификации Т-лимфоцитов (например, Т-лимфоцитов и/или NK-клеток), которые включают мембраносвязанное антитело на основе scFvFc к CD3, рекомбинантная ретровирусная частица может дополнительно включать полинуклеотид, содержащий одну или несколько транскрипционных единиц. оперативно связан с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют химерный антигенный рецептор. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связываться с CD3, не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице. В некоторых вариантах осуществления антитело на основе scFvFc к CD3 не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице.
[688] В другом аспекте в данном документе предусмотрен способ трансдукции и/или генетической модификации покоящихся лимфоцитов субъекта, включающий приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат элемент псевдотипирования на своей поверхности и мембраносвязанный полипептид, способный связываться с CD3 на своей поверхности, но не мембраносвязанный полипептид, способный связываться с CD28 и активировать его на своей поверхности, при этом указанное приведение в контакт облегчает трансдукцию покоящихся Т-клеток/или NK-клеток путем репликации не способных к рекомбинации ретровирусных частиц, тем самым получая генетически модифицированные Т-клетки и/или NK-клетки.
[689] В другом аспекте в данном документе представлен способ трансдукции и/или генетической модификации покоящихся Т-клеток и/или покоящихся NK-клеток из изолированной крови, включающий: сбор крови от субъекта; выделение мононуклеарных клеток периферической крови (PBMC), содержащих покоящиеся Т-клетки и/или покоящиеся NK-клетки; и приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo в течение эффективного времени с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат элемент псевдотипирования на своей поверхности и мембраносвязанный полипептид, способный связываться с CD3 на своей поверхности, но не с мембраносвязанным полипептидом, способным связываться и активировать CD28 на своей поверхности, тем самым получая генетически модифицированные Т-клетки и/или NK-клетки, тем самым трансдуцируя покоящиеся Т-клетки и/или NK-клетки.
[690] В аспектах настоящего документа для трансдукции и/или генетической модификации покоящихся Т-лимфоцитов, которые включают мембраносвязанный полипептид, способный связываться с CD3 на своей поверхности, но не связанный с мембраной полипептид, способный связываться с CD28 и активировать его на своей поверхности, псевдотипирование элементом может быть, например, белок оболочки вируса везикулярного стоматита (VSV-G). В иллюстративных вариантах осуществления мембраносвязанный полипептид, способный связываться с CD3, представляет собой антитело на основе scFvFc к CD3, которое в некоторых вариантах осуществления слито с гетерологичной последовательностью присоединения GPI-якоря. В некоторых вариантах осуществления этого аспекта приведение в контакт осуществляется в течение по меньшей мере 2 часов, или от 2 часов до 24 часов, или от 2 часов до 6 часов. В некоторых вариантах осуществления детектируемый маркер кодируется геномом не способной к репликации рекомбинантной ретровирусной частицы и обнаруживается в Т-клетках и/или NK-клетках после трансдукции. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связываться с CD3, не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице. В некоторых вариантах осуществления детектируемый маркер кодируется геномом не способными к репликации рекомбинантными ретровирусными частицами и обнаруживается в Т-клетках и/или NK-клетках после трансдукции.
[691] В другом аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, содержащая: один или несколько элементов псевдотипирования; полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют рецептор химерного антигена; и элемент псевдотипирования на своей поверхности и элемент активации на своей поверхности, при этом элемент активации способен связываться с Т-клеткой и/или NK-клеткой и не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице, и при этом элемент активации представляет собой антитело на основе scFvFc к CD3.
[692] В другом аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, содержащая: один или несколько элементов псевдотипирования, способных связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембран с ней не способной к репликации рекомбинантной ретровирусной частицы;
[693] полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют рецептор химерного антигена; и элемент псевдотипирования на своей поверхности и элемент активации на своей поверхности, при этом элемент активации способен связываться с Т-клеткой и/или NK-клеткой и не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице, и при этом элемент активации представляет собой мембраносвязанный полипептид, способный связываться с CD3 на своей поверхности, но не мембраносвязанный полипептид, способный связываться и активировать CD28 на своей поверхности.
[694] В некоторых вариантах осуществления аспектов не способных к репликации рекомбинантных ретровирусных частиц в данном документе рекомбинантная ретровирусная частица дополнительно содержит полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют химерный антигенный рецептор. В некоторых вариантах осуществления в этих аспектах мембраносвязанный полипептид, способный связываться с CD3, не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице. В некоторых вариантах осуществления в этих аспектах антитело на основе scFvFc к CD3 не кодируется полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице.
[695] В любом из аспектов и вариантов осуществления в данном документе, таких как те, которые включают полипептид или кодирующую его нуклеиновую кислоту, которые включают элемент активации, например, присутствующий на поверхности не способных к репликации рекомбинантных ретровирусных частиц, элемент активации может дополнительно включать, например, в виде слитого полипептида с полипептидом, способным связывать CD28, или в иллюстративных вариантах осуществления, CD3, димеризующий мотив, который может быть активным в отсутствие димеризующего средства. В некоторых вариантах осуществления элемент активации может быть одноцепочечным антителом к CD3, и димеризующий мотив может быть выбран из группы, состоящей из полипептида лейциновой молнии, CD69, CD71, CD72, CD96, Cd105, Cd161, Cd162, Cd249, CD271 и Cd324, а также их мутантов и/или их активных фрагментов, которые сохраняют способность к димеризации.
[696] В любом из аспектов и вариантов осуществления в данном документе, таких как те, которые включают полипептид или кодирующую его нуклеиновую кислоту, которые включают элемент активации, например, присутствующий на поверхности не способных к репликации рекомбинантных ретровирусных частиц, элемент активации может дополнительно включать, например, в виде слитого полипептида с полипептидом, способным связывать CD28, или в иллюстративных вариантах осуществления, CD3, димеризующий мотив, который может быть активным в присутствии димеризующего средства. В некоторых вариантах осуществления элемент активации может быть одноцепочечным антителом к CD3, и димеризующийся мотив может быть выбран из группы, состоящей из: FKBP и рапамицина или их аналогов, GyrB и кумермицина или их аналогов, DHFR и метотрексата или их аналогов, или DmrB и AP20187 или их аналогов, а также мутантов и/или активных фрагментов перечисленных димеризующихся белков, которые сохраняют способность димеризоваться.
[697] В любом из аспектов и вариантов осуществления в данном документе, таких как те, которые включают полипептид или кодирующую его нуклеиновую кислоту, которые включают элемент активации, например, присутствующий на поверхности не способных к репликации рекомбинантных ретровирусных частиц, элемент активации может дополнительно включать фрагмент антитела к scFvFc-GPI (UCHT1) и, необязательно, VSV-G.
[698] В одном варианте осуществления вышеуказанного аспекта указанный полинуклеотид дополнительно содержит одно или несколько из последовательности типа Козак, элемента WPRE и двойного стоп-кодона или тройного стоп-кодона, при этом один или несколько стоп-кодонов двойного стоп-кодона или тройной стоп-кодон определяет завершение считывания по меньшей мере одной из одной или нескольких транскрипционных единиц. В некоторых вариантах осуществления полинуклеотид содержит последовательность типа Козак, выбранную из CCACCAT/UG(G), CCGCCAT/UG(G), GCCGCCGCCAT/UG(G) или GCCGCCACCAT/U(G). В определенных вариантах осуществления как -3, так и +4 нуклеотиды относительно стартового кодона первой последовательности нуклеиновой кислоты содержит G. В другом варианте осуществления, который может быть объединен с предыдущим вариантом осуществления, который содержит последовательность типа Козак и/или в следующем варианте осуществления, который содержит тройной стоп-кодон, полинуклеотид включает элемент WPRE. В некоторых вариантах осуществления элемент WPRE расположен с 3' конца стоп-кодона одной или нескольких транскрипционных единиц и от 5' к 3' LTR полинуклеотида. В другом варианте осуществления, который можно комбинировать с одним или обоими из предшествующих вариантов (т.е. с вариантом, в котором полинуклеотид содержит последовательность типа Козак, и/или с вариантом осуществления, в котором полинуклеотид содержит WPRE), одна или несколько транскрипционных единиц оканчиваются одним или несколькими стоп-кодонами двойного стоп-кодона или тройного стоп-кодона.
[699] В определенных вариантах осуществления любого из аспектов, представленных в данном документе, которые включают ASTR, ASTR может представлять собой ASTR к метке. Такие способы могут дополнительно включать, например, антитело, конъюгированное с меткой, которое связывается с целевой молекулой, такой как целевой белок, на целевой клетке.
[700] В любом из вариантов осуществления и аспектов, представленных в данном документе, которые включают B-клетку, T-клетку или NK-клетку, клетка может быть аллогенной клеткой или может быть отличной от аллогенной клетки.
[701] В любом из аспектов и вариантов осуществления, раскрытых в данном документе методах и композициях введение ДНК в PBMC, B-клетки, T-клетки и/или NK-клетки и, необязательно, включение ДНК в геном клетки-хозяина, может осуществляться с использованием методов, которые не используют не способные к репликации рекомбинантные ретровирусные частицы. Например, можно использовать другие вирусные векторы, такие как векторы, полученные из аденовируса, аденоассоциированного вируса или вируса простого герпеса-1, в качестве неограничивающих примеров. В других вариантах осуществления эти аспекты и варианты осуществления могут включать трансфекцию и/или трансдукцию целевых клеток невирусными векторами. В любом из этих раскрытых в данном документе вариантов осуществления, в которых используются невирусные векторы для трансфекции целевых клеток, невирусные векторы, включая голую ДНК, могут быть введены в целевые клетки, такие как, например, PBMC, B-клетки, T-клетки и/или NK-клетки с использованием способов, которые включают электропорацию, нуклеофекцию, липосомные препараты, липиды, дендримеры, катионные полимеры, такие как поли (этиленимин) (PEI) и поли (l-лизин) (PLL), наночастицы, проникающие в клетки пептиды, микроинъекции и/или неинтегрирующие лентивирусные векторы. В некоторых вариантах осуществления способов и композиций, представленных в данном документе, ДНК может быть интегрирована в геном с использованием систем-носителей на основе транспозонов путем котрансфекции, совместной нуклеофекции или совместной электропорации целевой ДНК в виде плазмиды, содержащей фрагменты ITR транспозона в 5' и 3' концы представляющего интерес гена и системы-носителя транспозазы. Транспозаза или другой фермент, например CRISPR или TALEN, используемый в этих способах, можно котрансфицировать с целевой плазмидой в виде ДНК, mRNA или белка.
[702] В другом аспекте в данном документе представлены не способные к репликации рекомбинантные ретровирусные частицы, каждая из которых содержит:
A. элемент псевдотипирования на своей поверхности, который способен связываться с Т-клеткой и/или NK-клеткой и способствовать слиянию с ней не способной к репликации рекомбинантной ретровирусной частицы, при этом указанный элемент псевдотипирования включает варианты с делецией цитоплазматического домена полипептида F вируса кори и/или полипептид H вируса кори;
B. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область, a трансмембранный домен, и внутриклеточный активирующий домен, и второй сконструированный сигнальный полипептид, содержащий конститутивно активный мутант рецептора IL-7; при этом экспрессия мутанта рецептора IL-7 регулируется рибопереключателем, который связывает противовирусное лекарственное средство на основе нуклеозидного аналога; и
C. полипептид, способный связываться с CD3, и полипептид, способный связываться с CD28, при этом указанные полипептиды экспрессируются на поверхности не способной к репликации рекомбинантной ретровирусной частицы; способны связываться с Т-клеткой и/или NK-клеткой; и не кодируются полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице. В иллюстративных вариантах осуществления этого аспекта связывание противовирусного лекарственного средства на основе нуклеозидного аналога с рибопереключателем повышает экспрессию мутанта рецептора IL-7.
[703] В одном аспекте в данном документе предоставляется способ генетической модификации и экспансии лимфоцитов субъекта, включающий:
A. приведение в контакт покоящихся Т-клеток и/или NK-клеток субъекта ex vivo, без необходимости предварительной стимуляции ex vivo, с не способными к репликации рекомбинантными ретровирусными частицами, содержащими:
i. элемент псевдотипирования на своей поверхности, который способен связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембран с ними не способными к репликации рекомбинантными ретровирусными частицами; и
ii. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первого сконструированного сигнального полипептида, регулируемого элементом управления, при этом указанный первый сконструированный сигнальный полипептид содержит: по меньшей мере один лимфопролиферативный элемент,
при этом указанное приведение в контакт облегчает трансдукцию по меньшей мере некоторых из покоящихся Т-клеток и/или NK-клеток с помощью не способных к репликации рекомбинантных ретровирусных частиц, тем самым продуцируя генетически модифицированные Т-клетки и/или NK-клетки;
B. введение генетически модифицированных Т-клеток и/или NK-клеток субъекту; и
C. воздействие на генетически модифицированные Т-клетки и/или NK-клетки in vivo соединения, которое связывает элемент управления, влияя на экспрессию первого сконструированного сигнального полипептида и способствуя и/или потенцируя экспансию, приживление и/или сохранение лимфоцитов in vivo, тем самым генетически модифицируя и экспандируя лимфоциты субъекта. В иллюстративных вариантах осуществления трансдукцию проводят без стимуляции ex vivo.
[704] В вышеупомянутом аспекте и в любом из аспектов способа генетической модификации и экспансии лимфоцитов или для проведения в данном документе клеточной терапии, если он не указан или несовместим с аспектом, в некоторых вариантах осуществления полинуклеотид дополнительно содержит транскрипционную единицу, которая кодирует второй сконструированный сигнальный полипептид, содержащий первый химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[705] В другом аспекте в данном документе представлен способ проведения адоптивной клеточной терапии у субъекта, включающий:
A. сбор крови у объекта;
B. приведение в контакт покоящихся Т-клеток и/или NK-клеток из крови субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат
i. элемент псевдотипирования на своей поверхности, который способен связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембран с ними не способных к репликации рекомбинантных ретровирусных частиц; и
ii. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, содержащий по меньшей мере один лимфопролиферативный элемент, экспрессия которого регулируется элементом управления и второй сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен,
при этом указанное приведение в контакт приводит к тому, что по меньшей мере некоторые из покоящихся Т-клеток и/или NK-клеток становятся генетически модифицированными; и
C. повторное введение генетически модифицированных Т-клеток и/или NK-клеток субъекту, при этом экспансия, приживление и/или сохранение генетически модифицированных Т-клеток и/или NK-клеток происходит in vivo внутри субъекта, и при этом способ между сбором крови и повторное введение генетически модифицированных Т-клеток и/или NK-клеток выполняется не более чем через 24 часа, тем самым выполняя адоптивную клеточную терапию для субъекта.
[706] В другом аспекте в данном документе представлен способ проведения адоптивной клеточной терапии у субъекта, включающий:
A. сбор крови у субъекта;
B. выделение мононуклеарных клеток периферической крови (PBMC), содержащих покоящиеся Т-клетки и/или покоящиеся NK-клетки;
C. приведение в контакт покоящихся Т-клеток и/или покоящихся NK-клеток субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, при этом не способные к репликации рекомбинантные ретровирусные частицы содержат на своей поверхности элемент псевдотипирования, который способен связывать покоящуюся Т-клетку и/или NK-клетку и облегчать слияние мембран не способных к репликации рекомбинантных ретровирусных частиц с ними, при этом указанное приведение в контакт способствует трансдукции покоящихся Т-клеток и/или NK-клеток посредством не способных к репликации рекомбинантных ретровирусных частиц, за счет чего образуются генетически модифицированные T-клетки и/или NK-клетки;
D. повторное введение генетически модифицированных клеток субъекту в течение 24 часов после сбора крови у субъекта, за счет чего у субъекта осуществляется адоптивная клеточная терапию.
[707] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для выполнения адоптивной клеточной терапии в данном документе или аналогичных способов, если это явно не указано в самом широком аспекте, способ может дополнительно включать воздействие на генетически модифицированные Т-клетки и/или NK-клетки in vivo соединения, которое связывает элемент управления, чтобы влиять на экспрессию первого сконструированного сигнального полипептида и, необязательно, второго сконструированного сигнального полипептида, и для ускорения экспансии, приживления и/или устойчивости лимфоцитов in vivo.
[708] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для выполнения адоптивной клеточной терапии в данном документе или аналогичных способов, если это явно не указано в самом широком аспекте, генетически модифицированные Т-клетки и/или NK-клетки подвергаются 8, 7, 6, 5, 4, 3 или меньше клеточных делений ex vivo перед введением или повторным введением субъекту.
[709] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для проведения клеточной терапии в данном документе или аналогичных способов, если они явно не изложены в самом широком аспекте, экспансия, приживление и/или сохранение генетически модифицированных Т-клеток и/или NK-клетки in vivo зависит либо от присутствия, либо от отсутствия соединения, которое связывает элемент управления, и в иллюстративных вариантах осуществления зависит от присутствия соединения, которое связывает элемент управления.
[710] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для выполнения адоптивной клеточной терапии в данном документе или аналогичных способов, если они явно не изложены в самом широком аспекте, субъект не подвергается воздействию средства для лимфодеплеции в пределах 7, 14, или 21 день после приведения в контакт, во время контакта и/или в течение 7, 14 или 21 дня после того, как модифицированные Т-клетки и/или NK-клетки вводятся субъекту. В других вариантах осуществления субъект не подвергается воздействию средства для лимфодеплеции во время приведения в контакт.
[711] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для проведения клеточной терапии в данном документе, или аналогичных способов, если они явно не изложены в самом широком аспекте, покоящиеся Т-клетки и/или покоящиеся NK-клетки находятся в контакте с не способными к репликации рекомбинантными ретровирусными частицами в течение от 15 минут до 12 часов.
[712] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для выполнения адоптивной клеточной терапии в данном документе или аналогичных способов, если они явно не изложены в самом широком аспекте, способ дополнительно включает стадию отделения не способных к репликации рекомбинантных ретровирусных частиц от Т-клеток и/или NK-клеток после приведения в контакт. В способах, которые включают введение или повторное введение, разделение выполняется перед введением. В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для проведения в данном документе клеточной терапии или аналогичных способов, если они явно не изложены в самом широком аспекте, указанная стадия воздействия включает введение дозы соединения субъекту до или во время контакта, и/или после того, как генетически модифицированные Т-клетки и/или NK-клетки были введены субъекту.
[713] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и увеличения лимфоцитов или для проведения адоптивной клеточной терапии в данном документе или аналогичных методов, если они явно не изложены в самом широком аспекте, способ включает сбор крови, содержащей Т-клетки и/или NK. клетки от субъекта до контакта Т-клеток и/или NK-клеток ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, и при этом введение происходит повторно. Например, у субъекта берут от 20 до 250 мл крови.
[714] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для проведения клеточной терапии в данном документе или аналогичных способов, если они явно не изложены в самом широком аспекте, проходит не более 8, 12, 24 или 48 часов между временем взятия крови у субъекта и временем повторного введения модифицированных Т-клеток и/или NK-клеток в организм субъекта.
[715] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для проведения клеточной терапии в данном документе, или аналогичных способов, если они явно не изложены в самом широком аспекте, от 4 или 8 часов на нижнем конце и до 12, 24, 36 или 48 часов на верхнем конце диапазона проходят между временем взятия крови у субъекта и временем повторного введения модифицированных Т-клеток и/или NK-клеток в организм субъекта.
[716] В аспектах и вариантах осуществления, представленных в данном документе, которые включают введение генетически модифицированных Т-клеток и/или NK-клеток субъекту, особенно если субъект болен или подозревается в наличии рака, при этом способы могут дополнительно включать доставку субъекту эффективного количества ингибитора иммунных контрольных точек.
[717] В иллюстративных вариантах осуществления любого из аспектов способов генетической модификации и экспансии лимфоцитов или для выполнения адоптивной клеточной терапии в данном документе или аналогичных способов, если они явно не изложены в самом широком аспекте, все стадии после сбора крови и до повторного введения крови, выполняются в закрытой системе, в которой человек контролирует закрытую систему на протяжении всей обработки. В другом варианте осуществления после сбора крови и до того, как кровь будет повторно введена, они выполняются в закрытой системе, которая остается в одной комнате с субъектом.
[718] В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают одну или несколько транскрипционных единиц или один или несколько сконструированных сигнальных полипептидов, если они не указаны в самом широком аспекте, одна из транскрипционных единиц или один из сконструированных сигнальных полипептидов может кодировать или содержат или дополнительно содержат антигенспецифическую нацеленную область (ASTR) и трансмембранный домен, соединяющий ASTR с лимфопролиферативным элементом. ASTR этого сконструированного сигнального полипептида способен связываться с первым опухолевым антигеном, и, если он присутствует, ASTR второго сконструированного сигнального полипептида способен связываться со вторым опухолевым антигеном. В иллюстративных вариантах осуществления первый сконструированный сигнальный полипептид и/или второй сконструированный сигнальный полипептид дополнительно содержат костимулирующий домен. Кроме того, первый сконструированный сигнальный полипептид и/или второй сконструированный сигнальный полипептид дополнительно содержат ствол. Кроме того, первый сконструированный сигнальный полипептид дополнительно содержит внутриклеточный активирующий домен. Внутриклеточный активирующий домен на первом сконструированном сигнальном полипептиде и/или втором сконструированном сигнальном полипептиде может происходить из CD3 дзета. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают лимфопролиферативный элемент, лимфопролиферативный элемент может содержать MPL или может представлять собой MPL, или его вариант и/или фрагмент, включая вариант и/или фрагмент, который на по меньшей мере 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% идентичен последовательности внутриклеточного домена MPL с трансмембранным и/или внеклеточным доменом MPL или без него, и/или на по меньшей мере 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% идентичен последовательности внутриклеточного домена MPL с трансмембранным и/или внеклеточным доменом MPL или без него, при этом вариант и/или фрагмент сохраняет способность стимулировать пролиферацию клеток PBMC, и в некоторых вариантах осуществления Т-клеток.
[719] В любом из способов или композиций, представленных в данном документе, которые включают лимфопролиферативный элемент, лимфопролиферативный элемент может включать ингибирующую молекулу РНК, такую как, например, miRNA или shRNA, которая стимулирует путь STAT5 или ингибирует путь SOCS. Например, ингибирующая молекула РНК может связываться с нуклеиновой кислотой, кодирующей белок, выбранный из группы, состоящей из: ABCG1, SOCS, TGFbR2, SMAD2, cCBL и PD1. В иллюстративных вариантах осуществления для любых не способных к репликации рекомбинантных ретровирусных частиц или трансдуцированных клеток, представленных в данном документе, или способов, включающих то же самое, такие не способные к репликации рекомбинантные ретровирусные частицы или трансдуцированные клетки могут кодировать две или более молекулы ингибирующей РНК, такие как, например, miRNA или shRNA внутри интрона, в некоторых вариантах осуществления, 1, 2, 3 или 4 молекулы ингибирующей РНК, которые связывают нуклеиновые кислоты, кодирующие один или несколько из следующих генов, экспрессируемых эндогенными целевыми Т-клетками: PD-1; CTLA4; TCR альфа; TCR бета; CD3 дзета; SOCS; SMAD2; miR-155; IFN гамма; cCBL; TRAIL2; PP2A; или ABCG1. Например, в одном варианте осуществления комбинация miRNA, нацеленная на любое из следующего, может быть включена в геном не способной к репликации рекомбинантной ретровирусной частицы или трансдуцированной клетки: TCR альфа, CD3 дзета, IFN гамма и PD-1; и в другом варианте осуществления SOCS 1, IFN гамма, TCR альфа и CD3 дзета.
[720] В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, не способные к репликации рекомбинантные ретровирусные частицы, клетки млекопитающих и/или упаковывающие клетки, могут содержать полипептид Vpu. Полипептид Vpu может представлять собой, например, слитый полипептид и в некоторых примерах, особенно в пакующих клетках, мембраносвязанным полипептидом Vpu. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, не способные к репликации рекомбинантные ретровирусные частицы, клетки млекопитающих и/или пакующие клетки могут содержать как полипептид Vpu, так и полипептид Vpx.
[721] В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, не способные к репликации рекомбинантные ретровирусные частицы, клетки млекопитающих и/или упаковывающие клетки, могут содержать полипептид Vpx. Полипептид Vpx может представлять собой, например, слитый полипептид и в некоторых примерах, особенно в пакующих клетках, мембраносвязанным полипептидом Vpx.
[722] В любом из способов или композиций, представленных в данном документе, один или несколько элементов псевдотипирования могут включать белок оболочки вируса везикулярного стоматита (VSV-G), белок оболочки эндогенного вируса кошек (RD114), белок амфотропной оболочки онкоретровируса или экотропный белок онкоретровируса. белок оболочки или его функциональные фрагменты.
[723] В одном аспекте в данном документе представлена генетически модифицированная Т-клетка или NK-клетка, при этом Т-клетка или NK-клетка были генетически модифицированы для экспрессии первого сконструированного сигнального полипептида, содержащего лимфопролиферативный элемент, и второго сконструированного сигнального полипептида, содержащего CAR, который включает антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[724] В другом аспекте в данном документе представлена генетически модифицированная Т-клетка или NK-клетка, содержащая элемент псевдотипирования на поверхности T-клетки или NK-клетки и активирующий элемент на поверхности T-клетки или NK-клетки, при этом T-клетка или NK клетка была генетически модифицирована для экспрессии первого сконструированного сигнального полипептида, содержащего лимфопролиферативный элемент, и второго сконструированного сигнального полипептида, содержащего химерный антигенный рецептор, который включает антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[725] В другом аспекте в данном документе представлена генетически модифицированная Т-клетка и/или NK-клетка, содержащая:
A. первый сконструированный сигнальный полипептид, содержащий по меньшей мере один лимфопролиферативный элемент; и
B. второй сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[726] В некоторых вариантах осуществления генетически модифицированные Т-клетки и/или NK-клетки способны выживать в культуре ex vivo в отсутствие IL-2. В некоторых вариантах осуществления генетически модифицированные Т-клетки и/или NK-клетки содержат химерный цитокиновый рецептор. В некоторых вариантах осуществления генетически модифицированные Т-клетки и/или NK-клетки не содержат химерный цитокиновый рецептор.
[727] В любом из способов, представленных в данном документе, которые включают пакующую клетку млекопитающего, включая аспект системы упаковки не способных к репликации рекомбинантных ретровирусных частиц, или способ создания не способных к репликации рекомбинантных ретровирусных частиц, например, геном упаковываемой РНК кодируется полинуклеотидом, функционально связан с промотором, при этом указанный промотор либо конститутивно активен, либо индуцируется либо первым трансактиватором, либо вторым трансактиватором. Геном упаковываемой РНК может кодироваться полинуклеотидом, функционально связанным с промотором, при этом указанный промотор индуцируется вторым трансактиватором. Промотор, используемый в данном документе для управления экспрессией первого и/или второго сконструированного сигнального полипептида, обычно активен в целевых клетках, например, лимфоцитах, PBL, T-клетках и/или NK-клетках, но в иллюстративных вариантах осуществления не активен в линии пакующих клеток. Второй трансактиватор может регулировать экспрессию элемента активации, способного связываться с целевой клеткой и активировать ее. В любом из способов, представленных в данном документе, которые включают пакующую клетку млекопитающего, включая аспект системы упаковки не способных к репликации рекомбинантных ретровирусных частиц, или способ создания не способной к репликации рекомбинантной ретровирусной частицы, например, геном упаковываемой РНК, в некоторых вариантах осуществления, экспрессия генома упаковываемой РНК может регулироваться вторым трансактиватором.
[728] Кроме того, геном упаковываемой РНК может содержать от 5' до 3':
1.) 5' длинный концевой повтор или его активный фрагмент;
2.) последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК;
3.) последовательность нуклеиновой кислоты, кодирующую первый целевой полипептид, и/или последовательность нуклеиновой кислоты, кодирующую одну или несколько (например, две или более) молекул ингибирующей РНК;
4.) промотор, активный в целевой клетке; и
5.) 3' длинный концевой повтор или его активный фрагмент.
[729] В некоторых вариантах осуществления последовательность нуклеиновой кислоты, кодирующая первый целевой полипептид, находится в обратной ориентации по отношению к РНК, кодирующей ретровирусные компоненты для упаковки и сборки, и 5' LTR.
[730] В любом способов, представленных в данном документе, которые включают пакующую клетку млекопитающего, включая аспект системы упаковки не способных к репликации рекомбинантных ретровирусных частиц, или способ получения не способных к репликации рекомбинантных ретровирусных частиц, например, первый целевой полипептид содержит первый сконструированный сигнальный полипептид, и при этом указанный первый сконструированный сигнальный полипептид содержит по меньшей мере один лимфопролиферативный элемент. Геном упаковываемой РНК может дополнительно содержать последовательность нуклеиновой кислоты, кодирующую второй целевой полипептид. Второй целевой полипептид может содержать второй сконструированный сигнальный полипептид, включающий химерный антигенный рецептор, содержащий:
1.) первую антигенспецифическую нацеленную область;
2.) первый трансмембранный домен; и
3.) первый внутриклеточный активирующий домен.
[731] В любом из способов, представленных в данном документе, которые включают пакующую клетку млекопитающего, включая аспект системы упаковки не способных к репликации рекомбинантных ретровирусных частиц, или способ создания не способных к репликации рекомбинантных ретровирусных частиц, например, клетка млекопитающего, например, пакующая клетка может включают последовательность нуклеиновой кислоты, кодирующую полипептид Vpu, например, на второй или необязательной третьей транскрипционной единице или на дополнительной транскрипционной единице, которая функционально связана с первым индуцибельным промотором. В любом из способов, представленных в данном документе, которые включают пакующую клетку млекопитающего, включая аспект системы упаковки не способных к репликации рекомбинантных ретровирусных частиц, или способ создания не способных к репликации рекомбинантных ретровирусных частиц, например, клетка млекопитающего, например, пакующая клетка может включают последовательность нуклеиновой кислоты, кодирующую как полипептид Vpx, так и полипептид Vpu, например, на второй или необязательной третьей транскрипционной единице или на дополнительной транскрипционной единице, которая функционально связана с первым индуцибельным промотором. Клетка млекопитающего, которая может представлять собой пакующую клетку, может представлять собой клетку 293.
[732] В любом из способов, представленных в данном документе, которые включают пакующую клетку млекопитающего, включая аспект системы упаковки не способных к репликации рекомбинантных ретровирусных частиц, или способ создания не способных к репликации рекомбинантных ретровирусных частиц, например, клетка млекопитающего, например, пакующая клетка может включают последовательность нуклеиновой кислоты, кодирующую Vpx, например, на второй или необязательной третьей транскрипционной единице или на дополнительной транскрипционной единице, которая функционально связана с первым индуцибельным промотором. Клетка млекопитающего, которая может представлять собой пакующую клетку, может представлять собой клетку 293.
[733] В любом из способов, представленных в данном документе, которые включают пакующую клетку млекопитающего, включая аспект системы упаковки не способных к репликации рекомбинантных ретровирусных частиц, или способ получения не способных к репликации рекомбинантных ретровирусных частиц, первым лигандом может быть рапамицин, а вторым лигандом может быть тетрациклин или доксорубицин, или первым лигандом может быть тетрациклин или доксорубицин, а вторым лигандом может быть рапамицин.
[734] В некоторых аспектах в данном документе представлена клетка, трансдуцированная любой из не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе. Клетка может представлять собой, например, лимфоцит, такой как Т-клетку или NK-клетку. Клетка в иллюстративных вариантах осуществления представляет собой клетку человека.
[735] В одном аспекте, в данном документе представлен способ экспансии модифицированных Т-клеток и/или NK-клеток у субъекта, при этом указанный способ включает:
A. приведение в контакт выделенных покоящихся Т-клеток и/или покоящихся NK-клеток, полученных от указанного субъекта, с не способной к репликации рекомбинантной ретровирусной частицей любого из вариантов осуществления, раскрытых в данном документе;
B. введение генетически модифицированных Т-клеток и/или NK-клеток субъекту; и
C. введение эффективного количества ацикловира, пролекарства ацикловира, пенцикловира или пролекарства пенцикловира указанному субъекту, при этом указанные модифицированные Т-клетки и/или NK-клетки пролиферируют у указанного субъекта при введении ацикловира, пролекарства ацикловира, пенцикловира или пролекарство пенцикловира, тем самым экспандируя модифицированные Т-клетки и/или NK-клетки у субъекта.
[736] В другом аспекте в данном документе представлен способ остановки экспансии, приживления и/или сохранения модифицированных Т-клеток и/или NK-клеток у субъекта, при этом указанный способ включает:
A. приведение в контакт выделенных покоящихся Т-клеток и/или NK-клеток, полученных от указанного субъекта, с не способными к репликации рекомбинантными ретровирусными частицами, по любому из вариантов осуществления, раскрытых в данном документе;
B. введение модифицированных Т-клеток и/или NK-клеток субъекту;
C. введение эффективного количества ацикловира, пролекарства ацикловира, пенцикловира или пролекарства пенцикловира указанному субъекту для экспансии модифицированных Т-клеток и/или NK-клеток у субъекта, при этом указанные модифицированные Т-клетки и/или NK-клетки пролиферируют в указанном субъекту после введения ацикловира, пролекарства ацикловира, пенцикловира или пролекарства пенцикловира, тем самым экспандируя модифицированные PBL у субъекта; и
D. прекращение введения ацикловира, пролекарства ацикловира, пенцикловира или пролекарства пенцикловира, при этом указанные модифицированные Т-клетки и/или NK-клетки прекращают пролиферировать у указанного субъекта после прекращения введения ацикловира, пролекарства ацикловира, пенцикловира или пролекарства пенцикловира. тем самым управляя экспансией, приживлением и/или сохранением модифицированных Т-клеток и/или NK-клеток у субъекта.
[737] В другом аспекте в данном документе представлен способ лечения рака у субъекта, при этом указанный способ включает:
A. приведение в контакт выделенных покоящихся Т-клеток и/или NK-клеток, полученных от указанного субъекта, с не способными к репликации рекомбинантными ретровирусными частицами, согласно любому из вариантов осуществления, раскрытых в данном документе;
B. введение генетически модифицированных Т-клеток и/или NK-клеток субъекту; и
C. введение эффективного количества ацикловира, пролекарства ацикловира, пенцикловира или пролекарства пенцикловира указанному субъекту для экспансии модифицированных Т-клеток и/или NK-клеток у субъекта, при этом указанные модифицированные Т-клетки и/или NK-клетки пролиферируют в указанном субъекту после введения ацикловира, пролекарства ацикловира, пенцикловира или пролекарства пенцикловира, и при этом химерный антигенный рецептор в указанных модифицированных Т-клетках и/или NK-клетках связывает раковые клетки у указанного субъекта, тем самым осуществляя лечение рака у субъекта.
[738] В другом аспекте в данном документе представлена трансдуцированная Т-клетка и/или NK-клетка, содержащая рекомбинантный полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, регулируемый элементом управления, при этом указанный первый сконструированный сигнальный полипептид включает конститутивно активный мутант рецептора IL-7, и при этом элемент управления способен связываться и/или разработан и/или выполнен с возможностью связывания с соединением in vivo.
[739] В другом аспекте в данном документе представлена ретровирусная система упаковки, содержащая:
клетку млекопитающего, содержащую:
A. первый трансактиватор, экспрессируемый конститутивным промотором и способный связывать первый лиганд и первый индуцибельный промотор для воздействия на экспрессию последовательности нуклеиновой кислоты, функционально связанной с ним, в присутствии первого лиганда по сравнению с отсутствием;
B. второй трансактиватор, способный связывать второй лиганд и второй индуцибельный промотор и влиять на экспрессию функционально связанной с ним последовательности нуклеиновой кислоты в присутствии второго лиганда по сравнению с отсутствием; и
C. упаковываемый геном РНК для ретровирусной частицы,
при этом первый трансактиватор регулирует экспрессию второго трансактиватора и ретровирусного белка REV, при этом второй трансактиватор регулирует экспрессию полипептида gag, полипептида pol и одного или нескольких элементов псевдотипа, способных связываться с целевой клеткой и способствовать слиянию с ней мембран, и при этом ретровирусные белки происходят из ретровируса. Варианты осуществления этого аспекта могут включать в себя любой из вариантов осуществления, представленных в данном документе для перечисленных элементов в других аспектах.
[740] В другом аспекте в данном документе предоставляется способ получения рекомбинантной ретровирусной частицы, неспособной к репликации, включающий:
A. культивирование популяции пакующих клеток для накопления первого трансактиватора, при этом пакующие клетки содержат первый трансактиватор, экспрессируемый с первого конститутивного промотора, при этом первый трансактиватор способен связывать первый лиганд и первый индуцибельный промотор для воздействия на экспрессию нуклеиновой кислоты последовательности, функционально связанной с ней в присутствии или отсутствии первого лиганда, и при этом экспрессия второго трансактиватора и ретровирусного белка REV регулируется первым трансактиватором;
B. инкубирование популяции пакующих клеток, содержащих накопленный первый трансактиватор в присутствии первого лиганда для накопления второго трансактиватора и ретровирусного белка REV, при этом второй трансактиватор способен связывать второй лиганд и второй индуцибельный промотор для воздействия на экспрессию последовательности нуклеиновой кислоты, функционально связанной с ней, в присутствии или отсутствии второго лиганда; и
C. инкубирование популяции пакующих клеток, содержащих накопленный второй трансактиватор и ретровирусный белок REV, в присутствии второго лиганда, тем самым вызывая экспрессию полипептида gag, полипептида pol и одного или нескольких элементов псевдотипирования, тем самым делая рекомбинантную ретровирусную частицу не способной к репликации,
при этом упаковываемый геном РНК кодируется полинуклеотидом, функционально связанным с третьим промотором, при этом указанный третий промотор является либо конститутивно активным, либо индуцируемым либо первым трансактиватором, либо вторым трансактиватором, и при этом один или несколько элементов псевдотипирования способны связываться с целевой клеткой и/или способствующей слиянию мембран не способной к репликации рекомбинантной ретровирусной частицы с ней.
[741] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, клетка млекопитающего дополнительно содержит элемент активации, способный связываться с целевой клеткой и активировать ее, обычно лимфоцит, такой как NK-клетка, или в иллюстративных вариантах осуществления Т-клетка и первый трансактиватор регулируют экспрессию элемента активации. Элемент активации находится на поверхности не способной к репликации рекомбинантной ретровирусной частицы, и при этом элемент активации может включать: мембраносвязанный полипептид, способный связываться с CD3; и/или мембраносвязанный полипептид, способный связываться с CD28. Мембраносвязанный полипептид, способный связываться с CD3, представляет собой полипептид, способный связываться с CD3, который слит с последовательностью присоединения гетерологичного GPI-якоря, а мембраносвязанный полипептид, способный связываться с CD28, является полипептидом, способным связываться с CD28, который слит с гетерологичной последовательностью присоединения GPI-якоря. Мембраносвязанный полипептид, способный связываться с CD28, в некоторых вариантах осуществления представляет собой CD80, CD86 или их функциональный фрагмент, который способен индуцировать опосредованную CD28 активацию Akt, например внеклеточный домен CD80. В других вариантах осуществления мембраносвязанный полипептид, способный связывать CD3, представляет собой scFv к CD3 или scFvFc к CD3, связанный с последовательностью присоединения CD14-якоря GPI, и при этом мембраносвязанный полипептид, способный связываться с CD28, представляет собой CD80 или его внеклеточный фрагмент, связанный с последовательностью присоединения GPI-якоря CD16B.
[742] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, представленных в данном документе, клетка млекопитающего дополнительно содержит мембраносвязанный цитокин, и первый трансактиватор регулирует экспрессию мембраносвязанного цитокина. Мембраносвязанный цитокин может представлять собой, например, IL-7, IL-15 или их активный фрагмент. Мембраносвязанный цитокин в вариантах осуществления может быть полипептидом слияния IL-7 или его активным фрагментом и DAF. Например, слитый полипептид может содержать сигнальную последовательность DAF и IL-7 без его сигнальной последовательности, за которыми следуют остатки 36-525 DAF.
[743] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания аспектов не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, клетка млекопитающего содержит мембраносвязанный элемент активации, содержащий scFV к CD3 или scFvFc к CD3, связанный с последовательностью присоединения GPI-якоря CD14, и связанный с CD80, или его внеклеточный фрагмент, связанный с последовательностью присоединения GPI-якоря CD16B; и мембраносвязанный цитокин, содержащий слитый полипептид IL-7 или его активный фрагмент, и DAF, содержащий последовательность прикрепления GPI-якоря, и при этом первый трансактиватор регулирует экспрессию каждого из элемента активацит и мембраносвязанного цитокина. В некоторых вариантах осуществления IL-7 или его активный фрагмент и слияние DAF, каждый из scFV к CD3 или scFvFc к CD3 и CD80 или его внеклеточный фрагмент содержит сигнальную последовательность DAF.
[744] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, представленных в данном документе, клетка млекопитающего дополнительно содержит полипептид Vpu. В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, представленных в данном документе, клетка млекопитающего дополнительно содержит полипептид Vpu и полипептид Vpx. В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, представленных в данном документе, клетка млекопитающего дополнительно содержит полипептид Vpx. В этих или других вариантах осуществления один или несколько элементов псевдотипирования содержат один или несколько вирусных полипептидов, распознаваемых Т-клетками. Один или несколько элементов псевдотипирования могут включать полипептид вируса кори F, полипептид вируса кори H и/или их фрагмент. В определенных иллюстративных вариантах осуществления один или несколько элементов псевдотипирования представляют собой варианты с делецией цитоплазматического домена полипептида F вируса кори и/или полипептида H вируса кори.
[745] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания аспектов не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, упаковываемый геном РНК кодируется полинуклеотидом, функционально связанным с третьим промотором, при этом указанный третий промотор является либо конститутивно активным, либо индуцируемым либо первым трансактиватором или вторым трансактиватором. В иллюстративных вариантах осуществления геном упаковываемой РНК кодируется полинуклеотидом, функционально связанным с третьим промотором, при этом указанный третий промотор индуцируется вторым трансактиватором.
[746] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, представленных в данном документе, геном упаковываемой РНК дополнительно содержит от 5' до 3':
a) 5' длинный концевой повтор или его активный фрагмент;
b) последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК;
c) последовательность нуклеиновой кислоты, кодирующую первый целевой полипептид и необязательный второй целевой полипептид;
d) четвертый промотор, функционально связанный с первым целевым полипептидом и необязательным вторым полипептидом, при этом указанный четвертый промотор активен в целевой клетке, но не активен в линии пакующих клеток; и
e) 3' длинный концевой повтор или его активный фрагмент.
[747] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, представленных в данном документе, включая конструкцию, приведенную непосредственно выше, третий промотор способствует транскрипции или экспрессии в направлении, противоположном транскрипции или экспрессии, направляемой с четвертого промотора.
[748] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания аспектов не способной к репликации рекомбинантной ретровирусной частицы, представленных в данном документе, упаковываемый геном РНК кодирует не способную к репликации рекомбинантную ретровирусную частицу любого варианта осуществления, раскрытого в настоящем изобретении, при этом первый целевой полипептид и второй целевой полипептид представляет собой первый сконструированный сигнальный полипептид и второй сконструированный сигнальный полипептид соответственно. В некоторых вариантах осуществления, например, геном упаковываемой РНК дополнительно содержит элемент управления, функционально связанный с нуклеиновой кислотой, кодирующей первый сконструированный сигнальный полипептид или второй сконструированный сигнальный полипептид. Элементом управления в иллюстративных вариантах осуществления является рибопереключатель. Рибопереключатель в иллюстративных вариантах осуществления способен связывать соединение, и соединение, которое связывает элемент управления, представляет собой нуклеозидный аналог, и нуклеозидный аналог может представлять собой противовирусное лекарственное средство, например, ацикловир или пенцикливир.
[749] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания аспектов не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, упаковываемый геном РНК дополнительно содержит интрон, содержащий полинуклеотид, кодирующий молекулы ингибирующей РНК, такой как, например, miRNA или shRNA. Интрон может находиться рядом с четвертым промотором и ниже него.
[750] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания аспектов не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, целевая клетка может представлять собой Т-клетку и/или NK-клетку.
[751] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, представленных в данном документе, один или несколько элементов псевдотипирования включают белок оболочки вируса везикулярного стоматита (VSV-G), белок оболочки эндогенного вируса кошек (RD114). , онкоретровирусный амфотропный белок оболочки, или онкоретровирусный экотропный белок оболочки, или их функциональные фрагменты.
[752] В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания не способных к репликации аспектов рекомбинантных ретровирусных частиц, представленных в данном документе, геном упаковываемой РНК составляет 11000 КБ или меньше или 10000 КБ или меньше. В некоторых вариантах осуществления ретровирусной системы упаковки и способа создания аспектов не способных к репликации рекомбинантных ретровирусных частиц, представленных в данном документе, первый целевой полипептид содержит первый сконструированный сигнальный полипептид, и указанный первый сконструированный сигнальный полипептид содержит по меньшей мере один лимфопролиферативный элемент, а второй целевой полипептид содержит второй сконструированный сигнальный полипептид, включающий CAR.
[753] В одном аспекте в данном документе представлен выделенный полинуклеотид для регуляции экспрессии целевой полинуклеотида, содержащий:
полинуклеотид, кодирующий целевой полинуклеотид, функционально связанный с промотором и рибопереключателем, при этом рибопереключатель содержит:
a.) аптамерный домен, способный связывать противовирусное лекарственное средство на основе нуклеозидного аналог и имеющий пониженное связывание с гуанином или 2'-дезоксигуанозином по сравнению с противовирусным лекарственным средством на основе нуклеозидного аналога; и
b.) домен переключения функций, способный регулировать экспрессию целевого полинуклеотида, при этом связывание нуклеозидного аналога с помощью домена аптамера индуцирует или подавляет активность, регулирующую экспрессию домена переключения функций, тем самым регулируя экспрессию целевого полинуклеотида.
[754] В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, который включает элемент управления, может присутствовать полинуклеотид, содержащий рибопереключатель. Рибопереключатель может быть способен связывать нуклеозидный аналог, а соединение, которое связывает элемент управления, является нуклеозидным аналогом. Нуклеозидный аналог может представлять собой противовирусное средство. Противовирусным средством может быть ацикловир или пенцикловир. Рибопереключатель может предпочтительно связывать ацикловир по сравнению с пенцикловиром или предпочтительно связывать пенцикловир по сравнению с ацикловиром. Рибопереключатель может иметь сниженное связывание с противовирусным лекарственным средством на основе нуклеозидного аналогом при температурах выше 37 °C, 37,5 °C, 38 °C, 38,5 °C или 39 °C, например, выше 39 °C. Рибопереключатель может иметь длину от 35, 40, 45 и 50 нуклеотидов на нижнем конце диапазона и 60, 65, 70, 75, 80, 85, 90, 95 и 100 нуклеотидов на верхнем конце диапазона, например, между 45 и 80 нуклеотидами в длину. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают рибопереключатель, целевой полинуклеотид, который регулируется рибопереключателем, может включать область, кодирующую miRNA, an shRNA и/или полипептид. Целевой полинуклеотид может кодировать лимфопролиферативный элемент. Целевой полинуклеотид может быть функционально связан с промотором. Целевой полинуклеотид может включать область, кодирующую полипептид, и полипептид может включать химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область, трансмембранный домен и внутриклеточный активирующий домен. В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают рибопереключатель, домен переключения функций может регулировать внутренний сайт входа в рибосому, доступность сплайсинг-донора pre-mRNA в конструкции вирусного гена, трансляцию, терминацию транскрипции, деградацию транскрипта, экспрессию miRNA или экспрессию shRNA, тем самым регулируя экспрессию целевого полинуклеотида. Рибопереключатель может включать рибозим. В иллюстративных вариантах осуществления любого из представленных в данном документе способов и композиций, которые включают рибопереключатель, выделенный полинуклеотид может быть вектором молекулярного клонирования или вектором экспрессии. В иллюстративных вариантах осуществления любого из представленных в данном документе способов и композиций, которые включают рибопереключатель, выделенный полинуклеотид может быть интегрирован в ретровирусный геном или в хромосому млекопитающего или их фрагмент. В некоторых вариантах осуществления этого и любого из аспектов и вариантов осуществления настоящего изобретения, которые включают рибопереключатель, рибопереключатель регулирует сплайсинг pre-mRNA. Например, рибопереключатель может содержать последовательность точки ветвления, обычно между двумя экзонами полинуклеотида и/или транскрипционной единицы в данном документе. Таким образом, связывание противовирусного соединения или лекарственного средства на основе нуклеозидного аналога с рибопереключателем регулирует сплайсинг экзонов. Такие варианты осуществления могут включать полинуклеотид, содержащий первый экзон, второй экзон и рибопереключатель между первым экзоном и вторым экзоном, при этом рибопереключатель содержит последовательность точки ветвления, и при этом связывание противовирусного соединения или лекарственного средства на основе нуклеозидного аналога (например, ацикловира) с рибопереключателем регулирует сплайсинг экзонов первого и второго экзона. В других вариантах осуществления этого и любого из аспектов и вариантов осуществления в данном документе, которые включают рибопереключатель, этот рибопереключатель может контролировать экспрессию гена, регулируя транспликацию pre-mRNA. В таких вариантах осуществления рибопереключатель расположен внутри трансплайсированного интрона. Например, один аспект может включать полинуклеотид, который содержит первый экзон, второй экзон и рибопереключатель между первым экзоном и вторым экзоном, при этом рибопереключатель содержит последовательность точки ветвления, и при этом связывание ацикловира с рибопереключателем регулирует сплайсинг экзонов первого и второго экзона.
[755] Другой аспект, представленный в данном документе, представляет собой способ генетической модификации и экспансии лимфоцитов субъекта, включающий:
A. сбор крови у субъекта;
B. приведение в контакт Т-клеток и/или NK-клеток из крови субъекта ex vivo с не способными к репликации рекомбинантными ретровирусными частицами, содержащими:
i. элемент псевдотипирования на своей поверхности, который способен связываться с Т-клеткой и/или NK-клеткой и способствовать слиянию с ней не способной к репликации рекомбинантной ретровирусной частицы, при этом указанный элемент псевдотипирования включает варианты с делецией цитоплазматического домена полипептида F вируса кори и/или полипептид H вируса кори;
ii. полипептид, способный связываться с CD3, и полипептид, способный связываться с CD28, при этом указанные полипептиды экспрессируются на поверхности не способной к репликации рекомбинантной ретровирусной частицы; и способны связываться с Т-клеткой и/или NK-клеткой, и при этом дополнительно указанные полипептиды не кодируются полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице.
iii. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках,
при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, содержащий конститутивно активный мутант рецептора IL-7, и второй сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен,
при этом экспрессия мутанта рецептора IL-7 регулируется рибопереключателем, который связывает противовирусное средство на основе нуклеозидного аналога, при этом связывание противовирусного средства на основе нуклеозидного аналога с рибопереключателем повышает экспрессию мутанта рецептора IL-7, и
при этом указанное приведение в контакт приводит к тому, что по меньшей мере некоторые из покоящихся Т-клеток и/или NK-клеток становятся генетически модифицированными;
C. повторное введение генетически модифицированных Т-клеток и/или NK-клеток субъекту; и
D. Воздействие на генетически модифицированные Т-клетки и/или NK-клетки in vivo противовирусного средства на основе нуклеозидного аналога для стимулирования экспансии Т-клеток и/или NK-клеток, при этом способ между сбором крови и повторным введением генетически модифицированных Т-клеток и/или NK-клетки обрабатываются не более чем за 24 часа и/или без необходимости предварительной стимуляции ex vivo, тем самым генетически модифицируя и экспандируя лимфоциты субъекта.
[756] В иллюстративных вариантах осуществления этого аспекта способа ретровирусная частица представляет собой лентивирусную частицу. В другом иллюстративном варианте осуществления не способная к репликации рекомбинантная ретровирусная частица генетически модифицирует Т-клетку. В другом иллюстративном варианте осуществления полипептид, способный связываться с CD3, и полипептид, способный связываться с CD28, слиты с гетерологичной последовательностью присоединения GPI-якоря. В некоторых случаях полипептид, способный связываться с CD3, может представлять собой scFvFc к CD3 или scFv к CD3, а полипептид, способный связываться с CD28, может представлять собой CD80. Каждый из scFvFc к CD3 или scFv к CD3 и CD80 может быть дополнительно слит с сигнальной последовательностью DAF. В другом иллюстративном варианте осуществления не способные к репликации рекомбинантные ретровирусные частицы дополнительно содержат на своей поверхности слитый полипептид, содержащий цитокин, ковалентно связанный с DAF. В некоторых случаях цитокин может представлять собой IL-7 или IL-15, а слитый полипептид может содержать сигнальную последовательность DAF, IL-7 без его сигнальной последовательности и фрагмент DAF, содержащий последовательность прикрепления GPI-якоря.
[757] В другом иллюстративном варианте осуществления этого аспекта способа непосредственно выше, рибопереключатель дополнительно контролирует экспрессию химерного антигенного рецептора способом, регулируемым связыванием рибопереключателя с антивирусным лекарственным средством на основе нуклеозидного аналога, которым в некоторых случаях является ацикловир и/или пенцикловир. В другом варианте осуществления конститутивно активный IL-7 может быть заменен miRNA или shRNA или могут присутствовать нуклеиновые кислоты, кодирующие miRNA или shRNA и IL-7. В некоторых случаях miRNA или shRNA могут кодироваться нуклеиновыми кислотами внутри интрона.
[758] В другом аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, содержащая:
А. элемент псевдотипирования на своей поверхности, который способен связываться с Т-клеткой и/или NK-клеткой и способствовать слиянию с ней не способной к репликации рекомбинантной ретровирусной частицы, при этом указанный элемент псевдотипирования включает варианты с делецией цитоплазматического домена полипептида F вируса кори и/или полипептид H вируса кори;
В. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область, a трансмембранный домен, и внутриклеточный активирующий домен, и второй сконструированный сигнальный полипептид, содержащий конститутивно активный мутант рецептора IL-7; при этом экспрессия мутанта рецептора IL-7 регулируется рибопереключателем, который связывает противовирусное лекарственное средство на основе нуклеозидного аналога, при этом связывание противовирусного лекарственного средства на основе нуклеозидного аналога с рибопереключателем повышает экспрессию мутанта рецептора IL-7; и
С. полипептид, способный связываться с CD3, и полипептид, способный связываться с CD28, при этом указанные полипептиды экспрессируются на поверхности не способной к репликации рекомбинантной ретровирусной частицы; способны связываться с Т-клеткой и/или NK-клеткой; и не кодируются полинуклеотидом в не способной к репликации рекомбинантной ретровирусной частице.
[759] В иллюстративных вариантах осуществления любого аспекта не способных к репликации рекомбинантных ретровирусных частиц, ретровирусная частица представляет собой лентивирусную частицу. В других иллюстративных вариантах осуществления способа полипептид, способный связываться с CD3, и полипептид, способный связываться с CD28, слиты с гетерологичной последовательностью присоединения GPI-якоря. В некоторых случаях полипептид, способный связываться с CD3, может представлять собой scFvFc к CD3 или scFv к CD3, а полипептид, способный связываться с CD28, может представлять собой CD80. Каждый из scFvFc к CD3 или scFv к CD3 и CD80 может быть дополнительно слит с сигнальной последовательностью DAF. В другом иллюстративном варианте осуществления не способные к репликации рекомбинантные ретровирусные частицы дополнительно содержат на своей поверхности слитый полипептид, содержащий цитокин, ковалентно связанный с DAF. В некоторых случаях цитокин может представлять собой IL-7 или IL-15, а слитый полипептид может содержать сигнальную последовательность DAF, IL-7 без его сигнальной последовательности и фрагмент DAF, содержащий последовательность прикрепления GPI-якоря.
[760] В другом иллюстративном варианте осуществления любого аспекта не способных к репликации рекомбинантных ретровирусных частиц в данном документе, рибопереключатель дополнительно контролирует экспрессию химерного антигенного рецептора способом, регулируемым связыванием рибопереключателя с антивирусным лекарственным средством на основе нуклеозидного аналога, которым в некоторых случаях является ацикловир и/или пенцикловир. В другом варианте осуществления конститутивно активный IL-7 может быть заменен miRNA или shRNA или могут присутствовать нуклеиновые кислоты, кодирующие miRNA или shRNA и IL-7. miRNA или shRNA могут кодироваться нуклеиновыми кислотами внутри интрона.
[761] В другом аспекте в данном документе предоставляется способ получения рекомбинантной ретровирусной частицы, неспособной к репликации, включающий:
A. культивирование популяции пакующих клеток для накопления первого трансактиватора, при этом пакующие клетки содержат первый трансактиватор, экспрессируемый с конститутивного промотора, при этом первый трансактиватор способен связывать первый лиганд и первый индуцибельный промотор для воздействия на экспрессию нуклеиновой кислоты последовательности, функционально связанной с ней в присутствии или отсутствии первого лиганда, и при этом экспрессия второго трансактиватора и ретровирусного белка REV регулируется первым трансактиватором;
В. инкубирование популяции пакующих клеток, содержащих накопленный первый трансактиватор в присутствии первого лиганда для накопления второго трансактиватора и ретровирусного белка REV, и активирующего элемента, обычно на их поверхности, содержащего полипептид, способный связываться с CD3, и полипептид, способный связываться с CD28, при этом второй трансактиватор способен связывать второй лиганд и второй индуцибельный промотор для воздействия на экспрессию последовательности нуклеиновой кислоты, функционально связанной с ней, в присутствии или отсутствии второго лиганда; и
C. инкубирование популяции пакующих клеток, содержащих накопленный второй трансактиватор и ретровирусный белок REV, в присутствии второго лиганда, тем самым вызывая экспрессию полипептида gag, полипептида pol и элемента псевдотипирования, способного связываться с Т-клеткой и/или NK-клеткой, и облегчение мембранного слияния с ней не способной к репликации рекомбинантной ретровирусной частицы, при этом указанный элемент псевдотипирования включает варианты с делецией цитоплазматического домена полипептида F вируса кори и/или полипептида H вируса кори,
при этом геном упаковываемой РНК кодируется полинуклеотидом, функционально связанным с третьим промотором, и указанный промотор индуцируется вторым трансактиватором,
при этом геном упаковываемой РНК включает от 5' до 3':
i. 5' длинный концевой повтор или его активный фрагмент;
ii. последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК;
iii. последовательность нуклеиновой кислоты, кодирующую первый сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, и второй сконструированный сигнальный полипептид, содержащий конститутивно активный мутант рецептора IL-7, разделенный сигналом расщепления;
iv. четвертый промотор, активный в Т-клетке и/или NK-клетке; и
v. 3' длинный концевой повтор или его активный фрагмент, и
при этом геном упаковываемая РНК дополнительно содержит рибопереключатель, который связывает противовирусное средство на основе нуклеозидного аналога, при этом связывание рибопереключателя с противовирусным лекарственным средством на основе нуклеозидного аналога повышает экспрессию мутанта рецептора IL-7,
тем самым образуя неспособную к репликации рекомбинантную ретровирусную частицу.
[762] В иллюстративном варианте осуществления способа рибопереключатель дополнительно контролирует экспрессию химерного антигенного рецептора способом, регулируемым связыванием рибопереключателя с противовирусным лекарственным средством на основе нуклеозидного аналога. В другом иллюстративном варианте осуществления противовирусное лекарственное средство на основе нуклеозидного аналога представляет собой ацикловир и/или пенцикловир. В другом иллюстративном варианте осуществления геном упаковываемой РНК дополнительно содержит домен распознавания, при этом домен распознавания включает полипептид, который распознается антителом, которое распознает EGFR или его эпитоп. В другом иллюстративном варианте осуществления первый лиганд представляет собой рапамицин, а второй лиганд представляет собой тетрациклин или доксорубицин, или первый лиганд представляет собой тетрациклин или доксорубицин, а второй лиганд представляет собой рапамицин. В другом иллюстративном варианте осуществления пакующая клетка дополнительно содержит последовательность нуклеиновой кислоты, кодирующую Vpu на второй или необязательной третьей транскрипционной единице или на дополнительной транскрипционной единице, которая функционально связана с первым индуцибельным промотором. В другом иллюстративном варианте осуществления пакующая клетка дополнительно содержит последовательность нуклеиновой кислоты, кодирующую Vpu и необязательно полипептид Vpx на второй или необязательной третьей транскрипционной единице или на дополнительной транскрипционной единице, которая функционально связана с первым индуцибельным промотором. В другом иллюстративном варианте осуществления пакующая клетка дополнительно содержит последовательность нуклеиновой кислоты, кодирующую Vpx на второй или необязательной третьей транскрипционной единице или на дополнительной транскрипционной единице, которая функционально связана с первым индуцибельным промотором. В другом иллюстративном варианте осуществления полипептид, способный связываться с CD3, и полипептид, способный связываться с CD28, слиты с гетерологичной последовательностью присоединения GPI-якоря. В некоторых случаях полипептид, способный связываться с CD3, может представлять собой scFvFc к CD3 или scFv к CD3, а полипептид, способный связываться с CD28, может представлять собой CD80. Каждый из scFvFc к CD3 или scFv к CD3 и CD80 может быть дополнительно слит с сигнальной последовательностью DAF. В другом иллюстративном варианте осуществления также индуцируется экспрессия слитого полипептида, содержащего цитокин, ковалентно связанный с DAF. В некоторых случаях цитокин может представлять собой IL-7 или IL-15, а слитый полипептид может содержать сигнальную последовательность DAF, IL-7 без его сигнальной последовательности и фрагмент DAF, содержащий последовательность прикрепления GPI-якоря. В другом иллюстративном варианте осуществления рибопереключатель дополнительно контролирует экспрессию химерного антигенного рецептора способом, регулируемым связыванием рибопереключателя с антивирусным лекарственным средством на основе нуклеозидного аналога, которым в некоторых случаях является ацикловир и/или пенцикловир. В другом варианте осуществления конститутивно активный IL-7 может быть заменен miRNA или shRNA или могут присутствовать нуклеиновые кислоты, кодирующие miRNA или shRNA и IL-7. miRNA или shRNA могут кодироваться нуклеиновыми кислотами внутри интрона. В одном иллюстративном варианте осуществления ретровирусная частица представляет собой лентивирусную частицу.
[763] В другом аспекте в данном документе предложен генетически модифицированный лимфоцит, содержащий:
A. первый сконструированный сигнальный полипептид, содержащий конститутивно активный мутант рецептора IL-7; и
B. второй сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[764] В иллюстративных вариантах осуществления вышеупомянутого аспекта генетически модифицированных лимфоцитов генетически модифицированный лимфоцит представляет собой Т-клетку и/или NK-клетку. В некоторых вариантах осуществления лимфоцит представляет собой Т-клетку. В другом иллюстративном варианте осуществления экспрессия указанного первого сконструированного сигнального полипептида и/или указанного второго сконструированного сигнального полипептида регулируется рибопереключателем, который связывает противовирусное лекарственное средство на основе нуклеозидного аналога, при этом связывание противовирусного лекарственного средства на основе нуклеозидного аналога с рибопереключателем повышает экспрессию мутанта рецептора IL-7. В другом варианте осуществления генетически модифицированные лимфоциты экспрессируют по меньшей мере одну (например, две) молекулы ингибирующей РНК, такие как, например, miRNA или shRNA. Молекулы ингибирующей РНК могут дополнительно кодироваться нуклеиновыми кислотами внутри интрона.
[765] В другом аспекте в данном документе представлена генетически модифицированная Т-клетка и/или NK-клетка, содержащая:
a. первый сконструированный сигнальный полипептид, содержащий по меньшей мере один лимфопролиферативный элемент; и
b. второй сконструированный сигнальный полипептид, содержащий химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[766] В иллюстративных вариантах осуществления аспекта генетически модифицированных Т-клеток и/или NK-клеток лимфопролиферативный элемент является конститутивно активным и в некоторых случаях является конститутивно активным мутантным рецептором IL-7 или его фрагментом. В другом иллюстративном варианте осуществления экспрессия первого сконструированного сигнального полипептида и/или второго сконструированного сигнального полипептида регулируется элементом управления. В некоторых случаях элемент управления представляет собой полинуклеотид, содержащий рибопереключатель. В некоторых случаях рибопереключатель способен связывать нуклеозидный аналог, и когда нуклеозидный аналог присутствует, экспрессируется первый сконструированный сигнальный полипептид и/или второй сконструированный полипептид. В других иллюстративных вариантах осуществления генетически модифицированная Т-клетка и/или NK-клетка имеет на своей поверхности активирующий элемент, элемент псевдотипирования и/или мембраносвязанный цитокин. В некоторых случаях элемент активации включает мембраносвязанный полипептид, способный связываться с CD3; и/или мембраносвязанный полипептид, способный связываться с CD28. В определенном варианте осуществления элемент активации содержит scFV к CD3 или scFvFc к CD3, слитый с гетерологичной последовательностью присоединения GPI-якоря, и/или CD80, слитый с гетерологичной последовательностью присоединения GPI-якоря. В иллюстративном варианте осуществления элемент псевдотипирования включает полипептид F вируса кори, полипептид H вируса кори и/или варианты делеции цитоплазматического домена полипептида F вируса кори и/или полипептида H вируса кори. В других вариантах осуществления мембраносвязанный цитокин представляет собой слитый полипептид, содержащий IL-7 или его фрагмент, слитый с DAF, или его фрагмент, содержащий последовательность присоединения GPI-якоря.
[767] В одном аспекте в данном документе предоставляется способ генетической модификации и экспансии лимфоцитов субъекта, включающий:
A. приведение в контакт покоящихся Т-клеток и/или NK-клеток субъекта ex vivo, обычно без необходимости предварительной стимуляции ex vivo, с не способными к репликации рекомбинантными ретровирусными частицами, содержащими:
i. элемент псевдотипирования на своей поверхности, который способен связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембран с ними не способной к репликации рекомбинантной ретровирусной частицы; и
ii. полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, регулируемый контрольным элементом, при этом указанный первый сконструированный сигнальный полипептид содержит: по меньшей мере, один лимфопролиферативный элемент и, необязательно, кодирует второй сконструированный сигнальный полипептид, необязательно регулируемый элементом управления, при этом второй сконструированный сигнальный полипептид содержит внутриклеточный активирующий домен и необязательно другие компоненты CAR,
при этом указанное приведение в контакт облегчает трансдукцию по меньшей мере некоторых из покоящихся Т-клеток и/или NK-клеток с помощью не способных к репликации рекомбинантных ретровирусных частиц, тем самым продуцируя генетически модифицированные Т-клетки и/или NK-клетки;
B. введение генетически модифицированных Т-клеток и/или NK-клеток субъекту; и
воздействие на генетически модифицированные Т-клетки и/или NK-клетки in vivo соединения, которое выступает в качестве элемента управления, влияя на экспрессию первого сконструированного сигнального полипептида и способствуя экспансии, приживлению и/или сохранению лимфоцитов in vivo, тем самым генетически модифицируя и экспандируя лимфоциты субъекта.
[768] В иллюстративных вариантах осуществления трансдукцию проводят без стимуляции ex vivo. В иллюстративных вариантах осуществления соединение представляет собой молекулярный шаперон, такой как низкомолекулярный шаперон. В иллюстративных вариантах осуществления связывание молекулярного шаперона с лимфопролиферативным элементом увеличивает пролиферативную активность лимфопролиферативного элемента. Молекулярный шаперон можно вводить субъекту до сбора крови, во время контакта и/или после введения субъекту Т-клеток и/или NK-клеток. В этом аспекте, при этом соединение является элементом управления, будет понятно, что такое соединение обычно способно связываться с лимфопролиферативным элементом и/или компонентом CAR и действительно связывается с таким лимфопролиферативным элементом или компонентом CAR во время осуществления способа. Другие варианты осуществления и инструкции, относящиеся к способам, представленным в данном документе, которые включают трансфекцию Т-клетки и/или NK-клетки не способной к репликации рекомбинантной ретровирусной частицей, применимы к этому аспекту, включая также вариант осуществления молекулярного шаперона.
[769] В другом аспекте в данном документе представлен способ выбора ограниченной микроокружением антигенспецифической целевой области, включающий панорамирование библиотеки полипептидного дисплея с помощью:
а. воздействие на полипептиды библиотеки полипептидного дисплея анализа связывания в нормальных физиологических условиях и анализа связывания в аберрантных условиях; и
b. отбор полипептида, который проявляет увеличение активности связывания в аберрантном состоянии по сравнению с физиологическим состоянием, тем самым выбирая антигенспецифичную целевую область, ограниченную микроокружением.
[770] В другом аспекте в данном документе представлен способ выделения ограниченной микроокружением антигенспецифической целевой области, включающий:
панорамирование библиотеки пептидов с помощью:
a) приведения в контакт библиотеки полипептидов в аберрантных условиях с целевым антигеном, связанным с твердой подложкой, при этом клоны, экспрессирующие полипептиды, которые связывают целевой антиген, остаются связанными с твердой подложкой через целевой антиген;
b) инкубирование твердых носителей со связанными полипептидами в физиологических условиях; и
c) сбор клонов, которые элюируются с твердой подложки в физиологических условиях, тем самым выделяя ограниченную микроокружением антигенспецифическую целевую область.
[771] В другом аспекте в данном документе предусмотрен антигенный химерный рецептор для связывания целевого антигена, содержащий:
а) по меньшей мере одну ограниченную микроокружением антигенспецифическую целевую область, выбранную путем панорамирования полипептидной библиотеки и имеющую повышенную активность в анализе связывания в аберрантном состоянии по сравнению с нормальным физиологическим состоянием;
b) трансмембранный домен; и
c) внутриклеточный активирующий домен.
[772] В другом аспекте в данном документе предусмотрен антигенный химерный рецептор для связывания целевого антигена, содержащий:
а) ограниченную микроокружением антигенспецифическую нацеленную область, которая демонстрирует увеличение связывания с целевым антигеном в аберрантном состоянии по сравнению с нормальной физиологической средой, при этом антигенспецифическая нацеленная область связывается с мишенью;
b) трансмембранный домен; и
c) внутриклеточный активирующий домен.
[773] В иллюстративных вариантах осуществления любого из способов и композиций, представленных в данном документе, которые включают ограниченную микроокружением антигенспецифическую нацеленную область (ASTR), при этом ASTR может иметь по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% увеличение аффинности связывания с целевым антигеном в анализе в аберрантных условиях по сравнению с нормальными условиями. Аберрантными условиями могут быть гипоксия, кислый pH, более высокая концентрация молочной кислоты, более высокая концентрация гиалуронана, более высокая концентрация альбумина, более высокая концентрация аденозина, более высокая концентрация R-2-гидроксиглутарата, более высокая концентрация ферментов PAD, более высокое давление, более высокая степень окисления и более низкая доступность питательных веществ. Ограниченная микроокружением ASTR может демонстрировать увеличение связывания антигена при pH 6,7 по сравнению с pH 7,4. Ограниченная микроокружением ASTR может демонстрировать увеличение связывания антигена в опухолевой среде и/или в условиях суррогатного анализа опухоли in vitro по сравнению с соответствующим физиологическим состоянием. Мишенью может быть 4-1BB, ST4, антиген аденокарциномы, альфа-фетопротеин, AXL, BAFF, клетка B-лимфомы, антиген C242, CA-125, карбоангидраза 9 (CA-IX), C-MET, CCR4, CD 152, CD 19, CD20, CD200, CD22, CD221, CD23 (рецептор IgE), CD28, CD30 (TNFRSF8), CD33, CD4, CD40, CD44 v6, CD51, CD52, CD56, CD74, CD80, CEA, CNT0888, CTLA-4, DRS, EGFR, EpCAM, CD3, FAP, дополнительный домен B фибронектина, рецептор фолиевой кислоты 1, GD2, ганглиозид GD3, гликопротеин 75, GPNMB, HER2/neu, HGF, киназа рецептора фактора рассеяния человека, рецептор IGF-1, IGF-I, IgG1, L1-CAM, IL-13, IL-6, рецептор инсулиноподобного фактора роста I, интегрин nSP1, интегрин nvP3, MORAb-009, MS4A1, MUC1, муцин CanAg, N-гликолинейраминовая кислота, NPC-1C, PDGF-R a, PDL192, фосфатидилсерин, клетки карциномы предстательной железы, RANKL, RON, ROR1, ROR2 SCH 900105, SDC1, SLAMF7, TAG-72, тенасцин C, TGF бета 2, TGF-P, TRAIL-R1, TRAIL-R2, опухолевый антиген CTAA16, 88, VEGF-A, VEGFR-1, VEGFR2 и виментин. ASTR может быть антителом, антигеном, лигандом, рецепторсвязывающим доменом лиганда, рецептором, лигандсвязывающим доменом рецептора или аффителом. ASTR может представлять собой антитело, такое как полноразмерное антитело, одноцепочечное антитело, фрагмент Fab, фрагмент Fab', фрагмент (Fab')2, фрагмент Fv и двухвалентное одноцепочечный антитело или диатело. ASTR может содержать тяжелую цепь и легкую цепь антитела. Антитело может представлять собой одноцепочечный вариабельный фрагмент. В некоторых вариантах осуществления тяжелая и легкая цепи могут быть разделены линкером, длина которого составляет от 6 до 100 аминокислот. В некоторых вариантах осуществления тяжелая цепь может быть расположена на N-конце легкой цепи на рецепторе химерного антигена, а в некоторых вариантах осуществления легкая цепь может быть расположена на N-конце тяжелой цепи на химерного антигенного рецептора.
[774] В иллюстративных вариантах осуществления любого из способов, которые включают библиотеку полипептидного дисплея, библиотека полипептидного дисплея может быть библиотекой фагового дисплея или библиотекой дрожжевого дисплея. Библиотека дисплея полипептидов может представлять собой библиотеку дисплея антител. Библиотека дисплея антител может быть библиотекой дисплея человеческих или гуманизированных антител. Библиотека отображения антител может быть простой библиотекой. Способы могут включать инфицирование бактериальных клеток собранным фагом для создания усовершенствованной библиотеки фагового дисплея и повторение приведения в контакт, инкубации и сбора в течение от 1 до 1000 циклов с использованием усовершенствованной библиотеки фагового дисплея, созданной из предыдущего цикла.
[775] В иллюстративных вариантах осуществления любого из представленных в данном документе способов, которые включают выделение или выбор ограниченной микроокружением ASTR способ может включать определение нуклеотидной последовательности полинуклеотида, кодирующего ограниченную микроокружением антигенспецифическую целевую область, тем самым определяя полипептидную последовательность ограниченной микроокружением ASTR. Способы могут включать создание ограниченным микроокружением биологического химерного антигенного рецептора путем создания полинуклеотида, который кодирует полипептид, содержащий ограниченную микроокружением ASTR, трансмембранный домен и внутриклеточный активирующий домен. Библиотека может представлять собой библиотеку одноцепочечных антител.
[776] Способы выделения ограниченной микроокружением ASTR, могут включать повторение панорамирования от 1 до 1000 раз. Способы выделения ограниченной микроокружением ASTR могут быть выполнены без мутации полинуклеотидов, кодирующих выделенную ограниченную микроокружением антигенспецифическую целевую область между раундами панорамирования. Способы выделения ограниченной микроокружением ASTR могут быть выполнены путем культивирования, высокоточной амплификации и/или разбавления полинуклеотидов, кодирующих антигенспецифические нацеленные области, или организмов-хозяев, включая их, между раундами панорамирования. Способы могут включать перед повторением мутагенизацию выбранного и/или выделенного микроокружения, ограниченного антигенспецифической нацеленной областью. Способы могут включать определение последовательности выбранной и/или выделенной ограниченной микроокружением антигенспецифической нацеливающей области и/или полинуклеотида, кодирующего ее, после одного или нескольких раундов панорамирования посредством секвенирования ДНК с длинным считыванием. Способы могут включать определение последовательности до и после экспансии выделенной ограниченной микроокружением ASTR. Способы выделения ограниченной микроокружением ASTR можно выполнять без повторения панорамирования. Способы выделения ограниченной микроокружением ASTR могут быть выполнены без мутации полинуклеотида, кодирующего выделенную ограниченной микроокружением ASTR, после выделения ограниченной микроокружением ASTR.
[777] В иллюстративных вариантах осуществления любой из представленных в данном документе композиций, которые включают химерного антигенный рецептор с ограниченной микроокружением ASTR, ограниченную микроокружением ASTR можно идентифицировать путем панорамирования библиотеки антител. В некоторых вариантах осуществления ограниченная микроокружением ASTR идентифицируется путем панорамирования фагового дисплея или библиотеки дрожжевого дисплея. В некоторых вариантах осуществления химерный антигенный рецептор содержит биспецифический ASTR.
[778] В данном документе в другом аспекте представлена трансдуцированная Т-клетка и/или NK-клетка, содержащая рекомбинантный полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, регулируемый элементом управления, при этом указанный первый сконструированный сигнальный полипептид включает конститутивно активный мутант рецептора IL-7, и при этом элемент управления способен связываться с соединением in vitro или in vivo или выполнен с возможностью связывания соединения in vivo.
[779] В данном документе в другом аспекте представлена неспособная к репликации рекомбинантная ретровирусная частица, содержащая рекомбинантный полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, регулируемый элементом управления, который может представлять собой элемент управления in vivo, при этом указанный первый сконструированный сигнальный полипептид включает конститутивно активный мутант рецептора IL-7, и при этом элемент управления способен связываться с соединением in vivo или выполнен с возможностью связывания соединения in vivo.
[780] В другом аспекте в данном документе предложен способ трансдукции Т-клетки и/или NK-клетки, включающий приведение в контакт Т-клетки и/или NK-клетки с не способной к репликации рекомбинантной ретровирусной частицей, содержащей рекомбинантный полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом одна или несколько транскрипционных единиц кодируют первый сконструированный сигнальный полипептид, регулируемый элементом управления, при этом указанный первый сконструированный сигнальный полипептид включает конститутивно активный мутант рецептора IL-7, и при этом элемент управления in vivo способен связываться с соединением in vivo или in vitro в условиях трансдукции, тем самым трансдуцируя Т-клетку и/или NK-клетку.
[781] В иллюстративных вариантах осуществления аспектов трансдуцированных Т-клеток и/или NK-клеток, аспектов не способных к репликации рекомбинантных ретровирусных частиц и аспектов способа, представленных в предыдущих параграфах, рекомбинантный полинуклеотид дополнительно содержит транскрипционную единицу, которая кодирует второй сконструированный сигнальный полипептид, содержащий первый химерный антигенный рецептор, содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В других иллюстративных вариантах осуществления лимфопролиферативный элемент содержит мутантный рецептор IL-7 или его фрагмент. В других иллюстративных вариантах осуществления элемент управления представляет собой полинуклеотид, содержащий рибопереключатель. В некоторых случаях рибопереключатель способен связывать нуклеозидный аналог, а соединение, которое связывает элемент управления, является нуклеозидным аналогом. В некоторых случаях нуклеозидный аналог представляет собой противовирусное средство, такое как, например, ацикловир или пенцикловир. В некоторых вариантах осуществления противовирусное средство представляет собой ацикловир. В других иллюстративных вариантах осуществления конститутивно активный мутант рецептора IL-7 слит с EGFR или его эпитопом. В других иллюстративных вариантах осуществления конститутивно активный мутант рецептора IL-7 содержит eTag. В других иллюстративных вариантах осуществления конститутивно активный мутант рецептора IL-7 содержит вставку PPCL. В других иллюстративных вариантах осуществления конститутивно активный мутант рецептора IL-7 содержит вставку PPCL в положении, эквивалентном положению 243 в рецепторе IL-8 человека дикого типа. В других иллюстративных вариантах осуществления трансдуцированная Т-клетка или NK-клетка представляет собой трансдуцированную Т-клетку.
[782] В другом аспекте в данном документе представлен способ модуляции связывания ограниченного микроокружением биологического химерного антигенного рецептора (MRB-CAR), экспрессирующего Т-клетку или NK-клетку, с клеткой, экспрессирующей когнатный антиген MRB-CAR, у субъекта, включающий:
а. введение Т-клетки и/или NK-клетки, содержащей нуклеиновую кислоту, кодирующую MRB-CAR, в организм субъекта, при этом после введения Т-клетка и/или NK-клетка, содержащая нуклеиновую кислоту, кодирующую MRB-CAR, экспрессирует MRB-CAR, и связывается с клеткой, экспрессирующей когнатный антиген у субъекта; и
b. введение фармакологического средства субъекту в количестве, достаточном для увеличения pH крови и/или pH ткани и/или pH микроокружения, при этом введение проводят до, во время или после введения, и при этом повышенный pH кровь, ткань и/или микроокружение модулирует связывание Т-клетки и/или NK-клетки, экспрессирующих MRB-CAR, с клеткой, экспрессирующей когнатный антиген, в крови, ткани или микроокружении с повышенным pH.
[783] В другом аспекте в данном документе представлен способ снижения токсичности опухоли у субъекта, включающий:
а. введение нуклеиновой кислоты, кодирующей биологический химерный антигенный рецептор с ограниченным микроокружением (MRB-CAR), в Т-клетку или NK-клетку субъекта для получения Т-клетки и/или NK-клетки, содержащей нуклеиновую кислоту, кодирующую MRB-CAR;
b. введение Т-клетки и/или NK-клетки, содержащей нуклеиновую кислоту, кодирующую MRB-CAR, в организм субъекта, при этом после введения Т-клетка и/или NK-клетка, содержащая нуклеиновую кислоту, кодирующую MRB-CAR, экспрессирует MRB-CAR, и связывается с клеткой, экспрессирующей когнатный антиген у субъекта; и
c. введение субъекту фармакологического средства в количестве, достаточном для увеличения pH крови и/или pH ткани и/или pH микроокружения, чтобы модулировать связывание MRB-CAR с его когнатным антигеном в крови, ткани и/или микроокружение с повышенным pH, тем самым снижая токсичность опухоли у субъекта.
[784] В некоторых вариантах осуществления нуклеиновая кислота может представлять собой вектор. В иллюстративных вариантах осуществления вектор представляет собой ретровирусную частицу.
[785] В другом аспекте в данном документе представлен способ контроля связывания Т-клетки и/или NK-клетки с целевой клеткой млекопитающего, включающий:
а. приведение в контакт целевой клетки млекопитающего с Т-клеткой и/или NK-клеткой в микроокружении, при этом целевая клетка млекопитающего экспрессирует когнатный антиген, а Т-клетка и/или NK-клетка экспрессирует ограниченный микроокружением биологический химерный антигенный рецептор (MRB-CAR), который дифференциально связывается с когнатным антигеном при pH 6,7 по сравнению с pH 7,4; и
b. повышение pH микроокружения путем введения фармакологического средства в микроокружение в достаточном количестве, тем самым контролируя связывание Т-клетки и/или NK-клетки с целевой клеткой млекопитающего.
[786] В другом аспекте в данном документе представлен способ контроля связывания Т-клетки и/или NK-клетки, экспрессирующей ограниченный микроокружением биологический химерный антигенный рецептор (MRB-CAR), с целевой клеткой у субъекта in vivo, включая введение pH-модулирующего фармакологического средства для субъекта посредством эффективного режима дозирования, который увеличивает pH микроокружения внутри субъекта, при этом субъект включает Т-клетку и/или NK-клетку, экспрессирующую MRB-CAR, при этом MRB-CAR связывается со своим когнатным антигеном дифференциально при pH 6,7 по сравнению с pH 7,4, при этом микроокружение включает целевую клетку млекопитающего, при этом целевая клетка экспрессирует когнатный антиген на своей поверхности, и при этом Т-клетка и/или NK-клетка связывается с целевой клеткой млекопитающего дифференциально до и после повышения pH микроокружения, тем самым контролируя связывание Т-клетки и/или NK-клетки с целевой клеткой млекопитающего у субъекта in vivo.
[787] В любом из аспектов, представленных в данном документе, которые включают фармакологическое средство и MRB-CAR, MRB-CAR может иметь сниженное связывание со своим когнатным антигеном при одном pH, чем при другом pH. В иллюстративных вариантах осуществления, при этом иллюстративные значения pH для дифференциального связывания MRB-CAR еще не предоставлены в самом широком аспекте, и в качестве альтернативы для других вариантов осуществления вместо этих значений для таких аспектов MRB-CAR может иметь пониженное связывание при более высоком pH, чем при более низком pH. Например, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при pH выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5, чем при pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0. В других вариантах осуществления MRB-CAR может иметь пониженное связывание при более высоком pH, чем при более низком pH. Например, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0, чем при pH выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5. В некоторых иллюстративных вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH от 6,5 до 6,7 по сравнению с pH от 7,4 до 7,6. В других иллюстративных вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH 6,7 по сравнению с pH 7,4. В других вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH опухоли по сравнению с pH крови. В некоторых вариантах осуществления MRB-CAR может включать антигенспецифическую нацеленную область, ствол и внутриклеточный активирующий домен. В некоторых вариантах осуществления MRB-CAR может также включать костимулирующий домен. В некоторых вариантах осуществления MRB-CAR может связываться с опухолессоциированным антигеном.
[788] В любом из аспектов, представленных в данном документе, которые включают фармакологическое средство и MRB-CAR, pH микроокружения может быть увеличен с pH ниже 7,0 до pH выше 7,0. Например, pH может быть повышен с pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0 до pH выше 7,0, 7,1, 7,2, 7,3 или 7,4. В некоторых вариантах осуществления MRB-CAR может связываться с когнатным антигеном при повышенном pH, но не при pH микроокружения перед введением фармакологического средства. В некоторых вариантах осуществления pH может быть повышен с ниже 7,0 до pH от 7,1 до 8,0 или до pH от 7,1 до 7,8, или до pH от 7,2 до 7,8, или pH от 7,2 до 7,6, или pH от 7,3 до 7,6, или до pH от 7,4 до 7,8 или до pH от 7,4 до 7,6. Такое повышение pH может происходить в течение менее 1, 2, 4, 6, 8, 12 или 24 часов или более 1, 2, 4, 6, 8, 12 или 24 часов в зависимости от типа и дозы введенное фармакологического средства. В некоторых вариантах осуществления фармакологическое средство вводят так, чтобы pH оставался выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5; или между 7,0, 7,1, 7,2, 7,3 на нижней конце диапазона и 7,4, 7,5, 7,6, 7,7 или 7,8 на верхнем конце диапазона в целевой ткани, такой как опухоль, и, например, по меньшей мере, в поверхности микроокружения целевой ткани (например, опухоли), по меньшей мере, в части микроокружения целевой ткани (например, опухоли), и в иллюстративных вариантах осуществления во всем микроокружении целевой ткани (например, опухоли).
[789] В любом из аспектов, представленных в данном документе, которые включают фармакологическое средство и MRB-CAR, микроокружение может представлять собой микроокружение in vivo, например, опухоль, ткань, неопухолевую ткань, нормальную ткань или ткань, которая претерпела временное изменение pH. Например, ткани, которые обычно претерпевают временные сдвиги pH, включают мышечную ткань в анаэробных условиях или мышечную ткань, подвергающуюся физической нагрузке, или воспаленную ткань, или ткань, испытывающую воспаление. В некоторых вариантах осуществления, которые включают целевую клетку млекопитающего, целевая клетка может представлять собой опухолевую клетку, неопухолевую или нормальную клетку.
[790] В любом из аспектов, представленных в данном документе, которые включают фармакологическое средство и MRB-CAR, фармакологическое средство может представлять собой бикарбонат натрия, Тris-гидроксилметиламинометан, эквимолярный гипертонический раствор бикарбоната натрия и карбоната натрия или ингибиторы протонной помпы, такие как эзомепразол и напроксен, лансопразол, омепразол и рабепразол.
[791] Нуклеиновые кислоты, кодирующие MRB-CAR по настоящему изобретению, можно вводить различными способами в Т-клетки и/или NK-клетки. В любом из аспектов, представленных в данном документе, которые включают фармакологическое средство и MRB-CAR, стадия или стадии введения могут быть выполнены с помощью
a. приведения в контакт покоящихся Т-клеток и/или NK-клеток субъекта ex vivo, без необходимости предварительной стимуляции ex vivo, с не способной к репликации рекомбинантной ретровирусной частицей, содержащей:
i. один или несколько элементов псевдотипирования на своей поверхности, который способен связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембран с ними не способной к репликации рекомбинантной ретровирусной частицей; и
ii. полинуклеотид, включающий транскрипционную единицу, функционально связанную с промотором, активным в Т-клетках и/или NK-клетках, который кодирует MRB-CAR,
при этом указанное приведение в контакт облегчает трансдукцию по меньшей мере некоторых из покоящихся Т-клеток и/или NK-клеток с помощью не способной к репликации рекомбинантной ретровирусной частицы, тем самым продуцируя Т-клетки и/или NK-клетки, способные экспрессировать MRB-CAR, обычно потому, что они теперь включают полинуклеотид, который включает транскрипционную единицу, функционально связанную с промотором, активным в Т-клетках и/или NK-клетках, который кодирует MRB-CAR; и
b. введения субъекту Т-клеток и/или NK-клеток, способных экспрессировать MRB-CAR.
[792] В некоторых вариантах осуществления Т-клетки и/или NK-клетки могут претерпевать 2, 3, 4, 5, 6, 7, 8, 9 или 10 или меньше клеточных делений ex vivo перед введением. В некоторых вариантах осуществления покоящиеся Т-клетки и/или покоящиеся NK-клетки могут находиться в контакте с не способной к репликации рекомбинантной ретровирусной частицей в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов на нижнем конце диапазона и в течение 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 часов на верхнем конце диапазона, при этом для данного диапазона нижнее значение ниже верхнего значения. В некоторых вариантах осуществления покоящиеся Т-клетки и/или покоящиеся NK-клетки могут быть происходить из крови, взятой у субъекта. В иллюстративных вариантах не более 12, 15, 16, 18, 21, 24, 30, 36, 42 или 48 часов может пройти между моментом взятия крови у субъекта и моментом введения Т-клеток и/или покоящихся NK-клеток, способных экспрессировать MRB-CAR в организме субъекта. В некоторых вариантах осуществления все стадии после сбора крови и перед введением Т-клеток и/или покоящихся NK-клеток, способных экспрессировать MRB-CAR, можно выполнять в закрытой системе.
[793] В любом варианте осуществления, представленном в данном документе, который включает не способную к репликации рекомбинантную ретровирусную частицу в способе, который включает MRB-CAR и фармакологическое средство, полинуклеотид, который включает транскрипционную единицу, функционально связанную с промотором, активным в Т-клетках и/или NK-клетках, который кодирует MRB-CAR захватывается Т-клеткой (Т-клетками) и/или NK-клеткой (NK-клетками), так что такая (такие) клетка (клетки) способна (способны) экспрессировать MRB-CAR. В иллюстративных вариантах осуществления Т-клетки и/или NK-клетки интегрируют полинуклеотид в свой геном.
[794] В любом варианте осуществления, представленном в данном документе, который включает не способную к репликации рекомбинантную ретровирусную частицу в способе, который включает MRB-CAR и фармакологическое средство, не способная к репликации рекомбинантная ретровирусная частица может дополнительно включать активирующий элемент на своей поверхности, такой как активирующий элемент, который способен активировать покоящуюся Т-клетку и/или покоящуюся NK-клетку. В некоторых вариантах осуществления элемент активации может включать в себя любой элемент активации, представленный в настоящем изобретении. В иллюстративных вариантах осуществления элемент активации может включать мембраносвязанный полипептид, способный связываться с CD3; и/или мембраносвязанный полипептид, способный связываться с CD28. В любом из вариантов осуществления, который включает элемент активации на поверхности не способной к репликации рекомбинантной ретровирусной частицы в способе, который включает MRB-CAR и фармакологическое средство, один или несколько мембраносвязанных полипептидов могут быть слиты с гетерологичной последовательностью присоединения GPI-якоря. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связывать CD3, и/или мембраносвязанный полипептид, способный связывать CD28, может быть scFv или scFvFc, который связывает CD3 или CD28 соответственно. В иллюстративных вариантах осуществления мембраносвязанный полипептид, способный связывать CD3, может представлять собой scFv или scFvFc, который связывает CD3. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связывать CD28, может представлять собой внеклеточные домены CD80, CD86 или их функциональный фрагмент, который способен индуцировать опосредованную CD28 активацию Akt.
[795] В любом варианте осуществления, представленном в данном документе, который включает не способную к репликации рекомбинантную ретровирусную частицу в способе, который включает MRB-CAR и фармакологическое средство, полинуклеотид, кодирующий MRB-CAR, может быть функционально связан с рибопереключателем. В некоторых вариантах осуществления рибопереключатель может быть способен связывать нуклеозидный аналог. В некоторых вариантах осуществления нуклеозидный аналог может представлять собой противовирусное лекарственное средство, такое как ацикловир или пенцикловир.
[796] В любом варианте осуществления, представленном в данном документе, который включает не способную к репликации рекомбинантную ретровирусную частицу в способе, который включает MRB-CAR и фармакологическое средство, не способная к репликации рекомбинантная ретровирусная частица может включать на своей поверхности домен распознавания одобренного биопрепарата на основании моноклонального антитела. Например, домен распознавания может включать полипептид, который распознается антителом, распознающим EGFR, или его эпитоп.
[797] В любом варианте осуществления, представленном в данном документе, который включает не способную к репликации рекомбинантную ретровирусную частицу в способе, который включает MRB-CAR и фармакологическое средство, один или несколько элементов псевдотипирования могут включать полипептид вируса кори F, полипептид вируса кори H и/или его фрагмент, который сохраняет способность связываться с покоящимися Т-клетками и/или покоящимися NK-клетками. В некоторых вариантах осуществления один или несколько элементов псевдотипирования могут включать полипептид VSV-G. В некоторых вариантах осуществления не способная к репликации рекомбинантная ретровирусная частица может включать на своей поверхности слитый полипептид IL-7 или его активный фрагмент, и DAF, содержащий последовательность присоединения GPI-якоря.
[798] В любом варианте осуществления, представленном в данном документе, который включает не способную к репликации рекомбинантную ретровирусную частицу в способе, который включает MRB-CAR и фармакологическое средство, геном не способной к репликации рекомбинантной ретровирусной частицы может кодировать одну или несколько молекул ингибирующей РНК, например две или более, три или более, четыре или более, пять или более или шесть или более молекул ингибирующей РНК. В некоторых вариантах осуществления молекулы ингибирующей РНК могут быть направлены против различных мишеней РНК. В некоторых вариантах осуществления молекулы ингибирующей РНК могут быть расположены внутри интрона. В некоторых вариантах осуществления молекулы ингибирующей РНК способны образовывать 5' стебель и 3' стебель, которые образуют дуплекс РНК из 18-25 нуклеотидов. В некоторых вариантах осуществления по меньшей мере одна из ингибирующих молекул РНК может включать ориентацию от 5' до 3': фланкирующую последовательность 5' микроРНК, 5' стебель, петлю, 3' стебель и 3' фланкирующую последовательность микроРНК, при этом 5' стебель или 3' стебель способны связываться с мишенью РНК. В дополнительных вариантах осуществления 5' стебель может иметь длину от 18 до 25 нуклеотидов, при этом указанный 3' стебель имеет длину от 18 до 25 нуклеотидов, а указанная петля имеет длину от 3 до 40 нуклеотидов. В некоторых вариантах осуществления одна или несколько из фланкирующих последовательностей 5' микроРНК и фланкирующих последовательностей 3' микроРНК могут быть получены из встречающейся в природе miRNA, такой как mIR-155.
[799] В другом аспекте в данном документе предложено pH-модулирующее фармакологическое средство для применения в способе контроля связывания Т-клетки и/или NK-клетки с целевой клеткой у субъекта in vivo, включая введение pH-модулирующего фармакологического средства субъекту посредством эффективного режима дозирования, который увеличивает pH микроокружения внутри субъекта, при этом субъект содержит Т-клетку и/или NK-клетку, при этом Т-клетка и/или NK-клетка экспрессируют ограниченный микроокружением биологический химерный антигенный рецептор (MRB-CAR), который дифференциально связывается со своим когнатным антигеном при pH 6,7 по сравнению с pH 7,4, при этом Т-клетка и/или NK-клетка экспрессирует MRB-CAR, при этом микроокружение включает целевую клетку млекопитающего, при этом целевая клетка экспрессирует когнатный антиген на своей поверхности, и при этом Т-клетка и/или NK-клетка дифференциально связывается с целевой клеткой млекопитающего до и после того, как pH микроокружения увеличивается при введении применение рН-модулирующего фармакологического средства, тем самым контролируя связывание Т-клетки и/или NK-клетки с целевой клеткой млекопитающего у субъекта in vivo.
[800] В другом аспекте в данном документе предложено фармакологическое средство для применения в способе модуляции связывания ограниченного микроокружением биологического химерного антигенного рецептора (MRB-CAR), экспрессирующего Т-клетку или NK-клетку, с клеткой, экспрессирующей когнатный антиген MRB-CAR у субъекта для лечения роста опухоли, при этом способ включает:
а. введение Т-клетки и/или NK-клетки, способной экспрессировать MRB-CAR, в организм субъекта, при этом MRB-CAR связывается с клеткой, экспрессирующей когнатный антиген у субъекта, при этом после введения T-клетка и/или NK клетка, включающая нуклеиновую кислоту, кодирующую MRB-CAR, экспрессирует MRB-CAR и связывается с клеткой, экспрессирующей когнатный антиген у субъекта; и
b. введение фармакологического средства субъекту в количестве, достаточном для повышения pH крови, и/или pH ткани, и/или pH микроокружения, чтобы модулировать связывание Т-клетку и/или NK-клетку, экспрессирующих MRB-CAR, с клеткой, экспрессирующей когнатный антиген в крови, ткани или микроокружением с повышенным pH.
[801] В другом аспекте в данном документе предложено фармакологическое средство для применения в способе снижения токсичности опухоли у субъекта, при этом указанный способ включает:
а. введение нуклеиновой кислоты, кодирующей биологический химерный антигенный рецептор с ограниченным микроокружением (MRB-CAR), в Т-клетку или NK-клетку субъекта для получения Т-клетки и/или NK-клетки, способной экспрессировать MRB-CAR;
b. введение Т-клетки и/или NK-клетки, способной экспрессировать MRB-CAR, в организм субъекта, при этом после введения Т-клетка и/или NK-клетка, содержащая нуклеиновую кислоту, кодирующую MRB-CAR, экспрессирует MRB-CAR, и связывается с клеткой, экспрессирующей когнатный антиген у субъекта; и
c. введение субъекту фармакологического средства в количестве, достаточном для увеличения pH крови и/или pH ткани и/или pH микроокружения, чтобы модулировать связывание MRB-CAR с его когнатным антигеном в крови, ткани и/или микроокружение с повышенным pH, тем самым снижая токсичность опухоли у субъекта.
[802] В другом аспекте в данном документе предложено фармакологическое средство для применения в способе контроля связывания Т-клетки и/или NK-клетки, экспрессирующей ограниченный микроокружением биологический химерный антигенный рецептор (MRB-CAR), с целевой клеткой млекопитающего для лечения роста опухоли, при этом способ включает:
а. приведение в контакт целевой клетки млекопитающего с Т-клеткой и/или NK-клеткой, экспрессирующей MRB-CAR, в микроокружении, при этом целевая клетка млекопитающего экспрессирует когнатный антиген, а Т-клетка и/или NK-клетка экспрессирует MRB-CAR, который дифференциально связывается с когнатным антигеном при pH 6,7 по сравнению с pH 7,4; и
b. повышение pH микроокружения путем введения фармакологического средства в микроокружение в достаточном количестве, тем самым контролируя связывание Т-клетки и/или NK-клетки, экспрессирующей MRB-CAR, с целевой клеткой млекопитающего.
[803] В другом аспекте в данном документе представлено фармакологическое средство для применения в способе контроля связывания Т-клетки и/или NK-клетки, экспрессирующей ограниченный микроокружением биологический химерный антигенный рецептор (MRB-CAR), с целевой клеткой млекопитающего у субъекта в vivo, для лечения роста опухоли, при этом фармакологическое средство представляет собой pH-модулирующее фармакологическое средство, и при этом способ включает введение pH-модулирующего фармакологического средства субъекту посредством эффективного режима дозирования, который увеличивает pH микроокружения в организме субъекта, при этом субъект содержит Т-клетку и/или NK-клетку, экспрессирующую MRB-CAR, при этом MRB-CAR дифференциально связывается со своим когнатным антигеном при pH 6,7 по сравнению с pH 7,4, при этом микроокружение включает целевую клетку млекопитающего, при этом целевая клетка млекопитающего экспрессирует когнатный антиген на своей поверхности, и при этом Т-клетка и/или NK-клетка связывается с целевой клеткой млекопитающего дифференциально до и после повышения pH микроокружения.
[804] В другом аспекте в данном документе представлено рН-модулирующее фармакологическое средство для применения в способе контроля связывания Т-клетки и/или NK-клетки, экспрессирующей ограниченный микроокружением биологический химерный антигенный рецептор (MRB-CAR), с целевой клеткой млекопитающего у субъекта в vivo, для лечения роста опухоли, при этом способ включает введение pH-модулирующего фармакологического средства субъекту посредством эффективного режима дозирования, который увеличивает pH микроокружения в организме субъекта, при этом субъект содержит Т-клетку и/или NK-клетку, экспрессирующую MRB-CAR, при этом MRB-CAR дифференциально связывается со своим когнатным антигеном при pH 6,7 по сравнению с pH 7,4, при этом микроокружение включает целевую клетку млекопитающего, при этом целевая клетка млекопитающего экспрессирует когнатный антиген на своей поверхности, и при этом Т-клетка и/или NK-клетка связывается с целевой клеткой млекопитающего дифференциально до и после повышения pH микроокружения путем введения pH-модулирующего фармакологического средства.
[805] В другом аспекте в данном документе представлено применение рН-модулирующего фармакологического средства для применения при изготовлении лекарственного средства для контроля связывания Т-клетки и/или NK-клетки, экспрессирующей ограниченный микроокружением биологический химерный антигенный рецептор (MRB-CAR), с целевой клеткой млекопитающего у субъекта в vivo, при этом рН-модулирующее фармакологическое средство подлежит ведению субъекту посредством эффективного режима дозирования, который увеличивает pH микроокружения в организме субъекта, при этом субъект содержит Т-клетку и/или NK-клетку, экспрессирующую MRB-CAR, при этом MRB-CAR дифференциально связывается со своим когнатным антигеном при pH 6,7 по сравнению с pH 7,4, при этом микроокружение включает целевую клетку млекопитающего, при этом целевая клетка млекопитающего экспрессирует когнатный антиген на своей поверхности, и при этом Т-клетка связывается с целевой клеткой млекопитающего дифференциально до и после повышения pH микроокружения путем введения pH-модулирующего фармакологического средства.
[806] В любом из аспектов, представленных в данном документе, которые включают pH-модулирующее фармакологическое средство или фармакологическое средство для применения в способе и MRB-CAR, или включают применение pH-модулирующего фармакологического средства и MRB-CAR, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при одном pH, чем при другом pH. В иллюстративных вариантах осуществления, при этом иллюстративные значения pH для дифференциального связывания MRB-CAR еще не предоставлены в самом широком аспекте, и в качестве альтернативы для других вариантов осуществления вместо этих значений для таких аспектов MRB-CAR может иметь пониженное связывание при более высоком pH, чем при более низком pH. Например, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при pH выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5, чем при pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0. В других вариантах осуществления MRB-CAR может иметь пониженное связывание при более высоком pH, чем при более низком pH. Например, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0, чем при pH выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5. В некоторых иллюстративных вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH от 6,5 до 6,7 по сравнению с pH от 7,4 до 7,6. В других иллюстративных вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH 6,7 по сравнению с pH 7,4. В других вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH опухоли по сравнению с pH крови. В некоторых вариантах осуществления MRB-CAR может включать антигенспецифическую нацеленную область, ствол и внутриклеточный активирующий домен. В некоторых вариантах осуществления MRB-CAR может также включать костимулирующий домен. В некоторых вариантах осуществления MRB-CAR может связываться с опухолессоциированным антигеном.
[807] В любом из аспектов, представленных в данном документе, которые включают pH-модулирующее фармакологическое средство или фармакологическое средство для применения в способе и MRB-CAR, или включают применение pH-модулирующего фармакологического средства и MRB-CAR, pH микроокружения может быть увеличен с pH ниже 7,0 до pH выше 7,0. Например, pH может быть повышен с pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0 до pH выше 7,0, 7,1, 7,2, 7,3 или 7,4. В некоторых вариантах осуществления MRB-CAR может связываться с когнатным антигеном при повышенном pH, но не при pH микроокружения перед введением фармакологического средства. В некоторых вариантах осуществления pH может быть повышен с ниже 7,0 до pH от 7,1 до 8,0 или до pH от 7,1 до 7,8, или до pH от 7,2 до 7,8, или pH от 7,2 до 7,6, или pH от 7,3 до 7,6, или до pH от 7,4 до 7,8 или до pH от 7,4 до 7,6. Такое повышение pH может происходить в течение менее 1, 2, 4, 6, 8, 12 или 24 часов или более 1, 2, 4, 6, 8, 12 или 24 часов в зависимости от типа и дозы введенное фармакологического средства. В некоторых вариантах осуществления фармакологическое средство вводят так, чтобы pH оставался выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5; или между 7,0, 7,1, 7,2, 7,3 на нижней конце диапазона и 7,4, 7,5, 7,6, 7,7 или 7,8 на верхнем конце диапазона в целевой ткани, такой как опухоль, и, например, по меньшей мере, в поверхности микроокружения целевой ткани (например, опухоли), по меньшей мере, в части микроокружения целевой ткани (например, опухоли), и в иллюстративных вариантах осуществления во всем микроокружении целевой ткани (например, опухоли).
[808] В любом из аспектов, представленных в данном документе, которые включают pH-модулирующее фармакологическое средство или фармакологическое средство для применения в способе и MRB-CAR, или включают применение pH-модулирующего фармакологического средства и MRB-CAR, микроокружение может представлять собой микроокружение in vivo, например, опухоль, ткань, неопухолевую ткань, нормальную ткань или ткань, которая претерпела временное изменение pH. Например, ткани, которые обычно претерпевают временные сдвиги pH, включают мышечную ткань в анаэробных условиях или мышечную ткань, подвергающуюся физической нагрузке, или воспаленную ткань, или ткань, испытывающую воспаление. В некоторых вариантах осуществления, которые включают целевую клетку млекопитающего, целевая клетка может представлять собой опухолевую клетку, неопухолевую или нормальную клетку.
[809] В любом из аспектов, предоставленных в данном документе, которые включают pH-модулирующее фармакологическое средство или фармакологическое средство для применения в способе и MRB-CAR, или включают применение pH-модулирующего фармакологического средства и MRB-CAR, фармакологическое средство может представлять собой бикарбонат натрия, Тris-гидроксилметиламинометан, эквимолярный гипертонический раствор бикарбоната натрия и карбоната натрия или ингибиторы протонной помпы, такие как эзомепразол и напроксен, лансопразол, омепразол и рабепразол.
[810] В любом из аспектов, представленных в данном документе, которые включают pH-модулирующее фармакологическое средство или фармакологическое средство для применения в способе и MRB-CAR, или включают применение pH-модулирующего фармакологического средства и MRB-CAR, фармакологическое средство может может применяться в способе лечения рака, опухолей, роста опухоли или нарушения пролиферации клеток.
[811] В другом аспекте в данном документе представлен набор, содержащий контейнер, содержащий не способную к репликации рекомбинантную ретровирусную частицу, и инструкции по ее применению для лечения роста опухоли, при этом инструкции содержат инструкции по способу контроля связывания Т-клетки и/или NK-клетки с целевой клеткой млекопитающего, в способе, включающем:
а. трансдукцию Т-клетки и/или NK-клетки с помощью не способной к репликации рекомбинантной ретровирусной частицы, включающей в своем геноме ограниченный микроокружением биологический химерный антигенный рецептор (MRB-CAR), который дифференцированно связывается с когнатным антигеном при pH 6,7 по сравнению с pH 7,4, для получения Т-клетки и/или NK-клетки, способной экспрессировать MRB-CAR;
b. введение Т-клетки и/или NK-клетки, способной экспрессировать MRB-CAR, в организм субъекта, при этом после введения Т-клетка и/или NK-клетка, содержащая нуклеиновую кислоту, кодирующую MRB-CAR, экспрессирует MRB-CAR, и связывается с клеткой, экспрессирующей когнатный антиген у субъекта;
а. приведение в контакт целевой клетки млекопитающего с Т-клеткой и/или NK-клеткой, экспрессирующей MRB-CAR, в микроокружении, при этом целевая клетка млекопитающего экспрессирует когнатный антиген, а Т-клетка и/или NK-клетка экспрессирует MRB-CAR; и
d. повышение pH микроокружения путем введения рН-модулирующего фармакологического средства в микроокружение в достаточном количестве, тем самым влияя на связывание целевой клеткой млекопитающего с Т-клеткой и/или NK-клеткой.
В некоторых вариантах осуществления набор может дополнительно содержать рН-модулирующее фармакологическое средство.
[812] В некоторых вариантах осуществления набора MRB-CAR может иметь пониженное связывание со своим когнатным антигеном при одном pH, чем при другом pH. В иллюстративных вариантах осуществления, при этом иллюстративные значения pH для дифференциального связывания MRB-CAR еще не предоставлены в самом широком аспекте, и в качестве альтернативы для других вариантов осуществления вместо этих значений для таких аспектов MRB-CAR может иметь пониженное связывание при более высоком pH, чем при более низком pH. Например, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при pH выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5, чем при pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0. В других вариантах осуществления MRB-CAR может иметь пониженное связывание при более высоком pH, чем при более низком pH. Например, MRB-CAR может иметь меньшее связывание со своим когнатным антигеном при pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0, чем при pH выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5. В некоторых иллюстративных вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH от 6,5 до 6,7 по сравнению с pH от 7,4 до 7,6. В других иллюстративных вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH 6,7 по сравнению с pH 7,4. В других вариантах осуществления MRB-CAR демонстрирует повышенное связывание при pH опухоли по сравнению с pH крови. В некоторых вариантах осуществления MRB-CAR может включать антигенспецифическую нацеленную область, ствол и внутриклеточный активирующий домен. В некоторых вариантах осуществления MRB-CAR может также включать костимулирующий домен. В некоторых вариантах осуществления MRB-CAR может связываться с опухолессоциированным антигеном.
[813] В некоторых вариантах осуществления набора pH микроокружения может быть увеличен с pH ниже 7,0 до pH выше 7,0. Например, pH может быть повышен с pH ниже 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0 до pH выше 7,0, 7,1, 7,2, 7,3 или 7,4. В некоторых вариантах осуществления MRB-CAR может связываться с когнатным антигеном при повышенном pH, но не при pH микроокружения перед введением фармакологического средства. В некоторых вариантах осуществления pH может быть повышен с ниже 7,0 до pH от 7,1 до 8,0 или до pH от 7,1 до 7,8, или до pH от 7,2 до 7,8, или pH от 7,2 до 7,6, или pH от 7,3 до 7,6, или до pH от 7,4 до 7,8 или до pH от 7,4 до 7,6. Такое повышение pH может происходить в течение менее 1, 2, 4, 6, 8, 12 или 24 часов или более 1, 2, 4, 6, 8, 12 или 24 часов в зависимости от типа и дозы введенное фармакологического средства. В некоторых вариантах осуществления фармакологическое средство вводят так, чтобы pH оставался выше 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5; или между 7,0, 7,1, 7,2, 7,3 на нижней конце диапазона и 7,4, 7,5, 7,6, 7,7 или 7,8 на верхнем конце диапазона в целевой ткани, такой как опухоль, и, например, по меньшей мере, в поверхности микроокружения целевой ткани (например, опухоли), по меньшей мере, в части микроокружения целевой ткани (например, опухоли), и в иллюстративных вариантах осуществления во всем микроокружении целевой ткани (например, опухоли). В некоторых вариантах осуществления микроокружение может представлять собой микроокружение in vivo, например, опухоль, ткань, неопухолевую ткань, нормальную ткань или ткань, которая претерпела временное изменение pH. Например, ткани, которые обычно претерпевают временные сдвиги pH, включают мышечную ткань в анаэробных условиях или мышечную ткань, подвергающуюся физической нагрузке, или воспаленную ткань, или ткань, испытывающую воспаление. В некоторых вариантах осуществления, которые включают целевую клетку млекопитающего, целевая клетка может представлять собой опухолевую клетку, неопухолевую или нормальную клетку.
[814] В некоторых вариантах осуществления набора фармакологическое средство и MRB-CAR, фармакологическое средство может представлять собой бикарбонат натрия, Тris-гидроксилметиламинометан, эквимолярный гипертонический раствор бикарбоната натрия и карбоната натрия или ингибиторы протонной помпы, такие как эзомепразол и напроксен, лансопразол, омепразол и рабепразол.
[815] В одном аспекте в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, содержащая в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом:
a. первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует одну или несколько (например, две или несколько) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и
b. вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[816] В другом аспекте в данном документе представлена линия пакующих клеток млекопитающих, содержащая упаковываемый геном РНК для не способной к репликации ретровирусной частицы, при этом указанный упаковываемый геном РНК содержит:
a. 5' длинный концевой повтор или его активный фрагмент;
b. последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК;
c. полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты одной или нескольких нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК направлена против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен; и
d. 3' длинный концевой повтор или его активный фрагмент.
[817] В некоторых вариантах осуществления аспекта линии пакующих клеток млекопитающих полинуклеотид по (c) может иметь обратную ориентацию по отношению к последовательности нуклеиновой кислоты, кодирующей ретровирусный цис-действующий упаковывающий элемент РНК (b), 5' длинный концевой повтор (a) и/или трехкратный конец терминального повтора (d).
[818] В некоторых вариантах осуществления аспекта линии пакующих клеток млекопитающих экспрессия генома упаковываемой РНК управляется индуцибельным промотором, активным в линии пакующих клеток млекопитающих.
[819] В некоторых вариантах осуществления аспекта линии пакующих клеток млекопитающих, ретровирусный цис-действующий упаковывающий элемент РНК может включать центральный полипуриновый тракт (cPPT)/центральную последовательность терминации, Psi HIV или их комбинацию.
[820] В другом аспекте в данном документе представлен ретровирусный вектор, содержащий упаковываемый геном РНК для не способной к репликации ретровирусной частицы, при этом указанный упаковываемый геном РНК содержит:
a. 5' длинный концевой повтор или его активный фрагмент;
b. последовательность нуклеиновой кислоты, кодирующая ретровирусный цис-действующий упаковывающий элемент РНК;
c. полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты одной или нескольких нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК направлена против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен; и
d. 3' длинный концевой повтор или его активный фрагмент.
[821] В некоторых вариантах осуществления аспекта ретровирусного вектора полинуклеотид по (c) может иметь обратную ориентацию по отношению к последовательности нуклеиновой кислоты, кодирующей ретровирусный цис-действующий упаковывающий элемент РНК (b), 5' длинный концевой повтор (a) и/или трехкратный конец терминального повтора (d).
[822] В некоторых вариантах осуществления аспекта ректровирусного вектора экспрессия генома упаковываемой РНК управляется индуцибельным промотором, активным в линии пакующих клеток млекопитающих.
[823] В некоторых вариантах осуществления аспекта ретровирусного вектора ретровирусный цис-действующий упаковывающий элемент РНК может включать центральный полипуриновый тракт (cPPT)/центральную последовательность терминации, Psi HIV или их комбинацию. Ретровирусный вектор может необязательно включать ген устойчивости к антибиотикам и/или детектируемый маркер.
[824] В данном документе в другом аспекте представлен способ генетической модификации или трансдукции лимфоцита (например, Т-клетки или NK-клетки) или их популяции субъекта, включающий приведение в контакт лимфоцита (например, Т-клетки или NK-клетки) или их популяции субъекта ex vivo, с не способной к репликации рекомбинантной ретровирусной частицей, содержащей в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в лимфоцитах (например, Т-клетках и/или NK-клетках), при этом первая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует одну или несколько (например, две или несколько) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, а вторая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, при этом указанное приведение в контакт облегчает генетическую модификацию и/или трансдукцию лимфоцита (например, T-клетки или NK-клетки), или по меньшей мере некоторых из лимфоцитов (например, T-клеток и/или NK-клеток) с помощью не способной к репликации рекомбинантной ретровирусной частицы, за счет чего образуется генетически модифицированный и/или трансдуцированный лимфоцит (например, T-клетка и/или NK-клетка).
[825] В некоторых вариантах осуществления способа, представленного непосредственно выше, субъекту вводят генетически модифицированный и/или трансдуцированный лимфоцит (например, Т-клетку и/или NK-клетку) или его популяцию. В некоторых вариантах осуществления генетически модифицированный и/или трансдуцированный лимфоцит (например, Т-клетку и/или NK-клетку) или его популяция претерпевают 4 или меньше клеточных делений ex vivo перед введением или повторным введением субъекту. В некоторых вариантах осуществления лимфоциты представляют собой покоящиеся Т-клетки и/или покоящиеся NK-клетки, которые находятся в контакте с не способными к репликации рекомбинантными ретровирусными частицами в течение от 1 часа до 12 часов. В некоторых вариантах осуществления между моментом взятия крови у субъекта и моментом повторного введения генетически модифицированных Т-клеток и/или NK-клеток в организм субъекта проходит не более 8 часов. В некоторых вариантах осуществления все стадии после сбора крови и до того, как кровь будет повторно введена, выполняют в закрытой системе, в которой человек контролирует закрытую систему на протяжении всей обработки.
[826] В другом аспекте в данном документе представлена генетически модифицированная Т-клетка и/или NK-клетка, содержащая:
a. одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК; и
b. химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, при этом указанная одна или несколько (например, две или более) молекул ингибирующей РНК и CAR кодируются нуклеиновой кислотой последовательности, которые являются генетическими модификациями Т-клетки и/или NK-клетки.
[827] В некоторых вариантах осуществления аспекта генетически модифицированных Т-лимфоцитов и/или NK-клеток генетически модифицированные Т-клетки и/или NK-клетки также содержат по меньшей мере один лимфопролиферативный элемент, который не является ингибирующей молекулой РНК, при этом указанный лимфопролиферативный элемент кодируется нуклеиновой кислотой. кислота, которая является генетической модификацией Т-клетки и/или NK-клетки. В некоторых вариантах осуществления молекулы ингибирующей РНК, CAR и/или по меньшей мере один лимфопролиферативный элемент экспрессируются полицистронным образом. В иллюстративных вариантах осуществления молекулы ингибирующей РНК экспрессируются из одного полицистронного транскрипта.
[828] в данном документе в другом аспекте представлена не способная к репликации рекомбинантная ретровирусная частица для применения в способе генетической модификации лимфоцита субъекта для лечения роста опухоли, при этом не способная к репликации рекомбинантная ретровирусная частица содержит в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанные с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, при этом способ включает приведение в контакт T клетки и/или NK-клетки субъекта ex vivo, и указанный контакт способствует трансдукции по меньшей мере некоторых из покояющихся Т-клеток и/или NK-клеток с помощью не способных к репликации рекомбинантных ретровирусных частиц, тем самым получая генетически модифицированные Т-клетки и/или NK-клетки.
[829] В способе генетической модификации лимфоцита указанного аспекта, представленного непосредственно выше, в некоторых вариантах осуществления в способе используется фармакологическое средство, который дополнительно включает введение генно-инженерной Т-клетки и/или NK-клетки субъекту.
[830] в данном документе в другом аспекте представлена не способная к репликации рекомбинантная ретровирусная частица для применения в способе генетической модификации Т-клетки и/или NK-клетки субъекта для лечения роста опухоли, при этом способ включает:
a. приведение в контакт Т-клетки и/или NK-клетки субъекта ex vivo с не способной к репликации рекомбинантной ретровирусной частицей, содержащей в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в T-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или несколько) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, а вторая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, при этом указанное приведение в контакт облегчает трансдукцию по меньшей мере некоторых из покоящихся Т-клеток и/или NK-клеток за счет не способных к репликации рекомбинантных ретровирусных частиц, получая генетически модифицированные Т-клетки и/или NK-клетки; и
b. введение генетически модифицированной Т-клетки и/или NK-клетки субъекту, тем самым генетически модифицируя Т-клетку и/или NK-клетку субъекта.
[831] В аспекте, представленном непосредственно выше, в некоторых вариантах осуществления популяцию Т-клеток и/или NK-клеток приводят в контакт на стадии приведения в контакт и вводят субъекту на стадии введения.
[832] в данном документе в другом аспекте представлено применение не способной к репликации рекомбинантной ретровирусной частицы при изготовлении набора для генетической модификации Т-клетки и/или NK-клетки субъекта, при этом применение набора включает:
1. приведение в контакт Т-клетки и/или NK-клетки субъекта ex vivo с не способной к репликации рекомбинантной ретровирусной частицей, содержащей в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в T-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или несколько) молекул ингибирующей РНК, направленных против одной или нескольких мишеней, а вторая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, при этом указанное приведение в контакт облегчает трансдукцию по меньшей мере некоторых из покоящихся Т-клеток и/или NK-клеток за счет не способных к репликации рекомбинантных ретровирусных частиц, получая генетически модифицированные Т-клетки и/или NK-клетки; и
2. введение генетически модифицированной Т-клетки и/или NK-клетки субъекту, тем самым генетически модифицируя Т-клетку и/или NK-клетку субъекта.
[833] в данном документе в другом аспекте представлено применение не способной к репликации рекомбинантной ретровирусной частицы при изготовлении лекарственного средства для генетической модификации Т-клетки и/или NK-клетки субъекта, при этом применение лекарственного средства включает:
A) приведение в контакт Т-клетки и/или NK-клетки субъекта ex vivo с не способной к репликации рекомбинантной ретровирусной частицей, содержащей в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в T-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или несколько) молекул ингибирующей РНК, направленных против одной или нескольких мишеней, а вторая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, при этом указанное приведение в контакт облегчает трансдукцию по меньшей мере некоторых из покоящихся Т-клеток и/или NK-клеток за счет не способных к репликации рекомбинантных ретровирусных частиц, получая генетически модифицированные Т-клетки и/или NK-клетки; и
B) введение генетически модифицированной Т-клетки и/или NK-клетки субъекту, тем самым генетически модифицируя Т-клетку и/или NK-клетку субъекта.
[834] В другом аспекте в данном документе предложен коммерческий контейнер, содержащий не способную к репликации рекомбинантную ретровирусную частицу и инструкции по ее применению для лечения роста опухоли у субъекта, при этом не способная к репликации рекомбинантная ретровирусная частица содержит в своем геноме полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[835] В некоторых вариантах осуществления в аспектах коммерческого контейнера инструкции инструктируют пользователя осуществить контакт с Т-клеткой и/или NK-клеткой субъекта ex vivo, чтобы облегчить трансдукцию по меньшей мере одной покоящейся Т-клетки и/или NK-клетки субъекта путем репликации не способных к рекомбинации ретровирусных частиц, тем самым получая генетически модифицированную Т-клетку и/или NK-клетку.
[836] В любом из аспектов, представленных в данном документе, который включает полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифичную нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, полинуклеотид может дополнительно содержать третью последовательность нуклеиновой кислоты, которая кодирует по меньшей мере один лимфопролиферативный элемент, который не является ингибирующей молекулой РНК. В некоторых вариантах осуществления лимфопролиферативный элемент может представлять собой полипептид цитокина или цитокинового рецептора или его фрагмент, содержащий сигнальный домен. В некоторых вариантах осуществления лимфопролиферативный элемент является конститутивно активным. В некоторых вариантах осуществления лимфопролиферативный элемент может представлять собой рецептор IL-7 или его фрагмент. В иллюстративных вариантах осуществления лимфопролиферативный элемент может представлять собой конститутивно активный рецептор IL-7 или его конститутивно активный фрагмент.
[837] В любом из аспектов, представленных в данном документе, которыей включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, молекула ингибирующей РНК может в некоторых вариантах осуществления содержать 5' нить и 3' нить, которые частично или полностью комплементарны друг другу, при этом указанная 5' нить и указанная 3' нить способны образовывать дуплекс РНК из 18-25 нуклеотидов. В некоторых вариантах осуществления 5' нить может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов, а 3' нить может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления 5' нить и 3' нить могут иметь одинаковую или разную длину. В некоторых вариантах осуществления дуплекс РНК может содержать одно или несколько ошибочно спаренных оснований. В альтернативных вариантах осуществления дуплекс РНК не имеет ошибочно спаренных оснований.
[838] В любом из аспектов, представленных в данном документе, которые включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, молекула ингибирующей РНК может представлять собой miRNA или shRNA. В некоторых вариантах осуществления ингибирующая молекула может представлять собой предшественник miRNA, такой как, например, Pri-miRNA или Pre-miRNA, или предшественник shRNA. В некоторых вариантах осуществления ингибирующая молекула может представлять собой искусственно полученную miRNA или shRNA. В других вариантах осуществления молекула ингибирующей РНК может представлять собой dsRNA (транскрибированную или искусственно введенную), которая процессируется в siRNA или представляет собой саму siRNA. В некоторых вариантах осуществления молекула ингибирующей РНК может представлять собой miRNA или shRNA, последовательность которых не встречается в природе, или имеет по меньшей мере один функциональный сегмент, который не встречается в природе, или комбинацию функциональных сегментов, которые не встречаются в природе. В иллюстративных вариантах осуществления по меньшей мере одна или все молекулы ингибирующей РНК представляют собой miR-155.
[839] В любом из аспектов, представленных в данном документе, которые включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, молекула ингибирующей РНК может представлять собой miRNA или shRNA, в некоторых вариантах осуществления может иметь ориентацию от 5' до 3': 5' плечо, 5' стебель, петля, 3' стебель, который частично или полностью комплементарен упомянутому 5' стеблю, и 3' плечо. В некоторых вариантах осуществления по меньшей мере одна из двух или более молекул ингибирующей РНК имеет такое расположение. В других вариантах осуществления все из двух или более ингибирующих молекул РНК имеют такое расположение. В некоторых вариантах осуществления 5' стебель может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления 3' стебель может иметь длину 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления петля может иметь длину 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24,2 5, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба происходят из встречающейся в природе miRNA. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба являются производными встречающейся в природе miRNA, выбранной из группы, состоящей из miR-155, miR-30, miR-17-92, miR-122 и miR-21. В иллюстративных вариантах осуществления 5' плечо, 3' плечо или оба происходят от miR-155. В некоторых вариантах осуществления 5' плечо, 3' плечо или оба происходят от miR-155 Mus musculus или miR-155 Homo sapiens. В некоторых вариантах осуществления 5' плечо имеет последовательность, указанную в SEQ ID NO: 256, или ее функциональный вариант, такой как, например, последовательность, имеющая ту же длину, что и SEQ ID NO: 256, или 95%, 90%, 85%, 80%, 75% или 50% при условии, что SEQ ID NO: 256, или составляет 100 нуклеотидов или меньше, 95 нуклеотидов или меньше, 90 нуклеотидов или меньше, 85 нуклеотидов или меньше, 80 нуклеотидов или меньше, 75 нуклеотидов или меньше, 70 нуклеотидов или меньше, 65 нуклеотидов или меньше, 60 нуклеотидов или меньше, 55 нуклеотидов или меньше, 50 нуклеотидов или меньше, 45 нуклеотидов или меньше, 40 нуклеотидов или меньше, 35 нуклеотидов или меньше, 30 нуклеотидов или меньше, или 25 нуклеотидов или меньше; и по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична SEQ ID NO: 256. В некоторых вариантах осуществления 3' плечо имеет последовательность, указанную в SEQ ID NO: 260, или ее функциональный вариант, такой как, например, той же длины, что и SEQ ID NO: 260, или 95%, 90%, 85%, 80%, 75% или 50% при условии, что SEQ ID NO: 260, или представляет собой последовательность, которая имеет 100 нуклеотидов или меньше, 95 нуклеотидов или меньше, 90 нуклеотидов или меньше, 85 нуклеотидов или меньше, 80 нуклеотидов или меньше, 75 нуклеотидов или меньше, 70 нуклеотидов или меньше, 65 нуклеотидов или меньше, 60 нуклеотидов или меньше, 55 нуклеотидов или меньше, 50 нуклеотидов или меньше, 45 нуклеотидов или меньше, 40 нуклеотидов или меньше, 35 нуклеотидов или меньше, 30 нуклеотидов или меньше, или 25 нуклеотидов или меньше; и по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична SEQ ID NO: 260. В некоторых вариантах осуществления 3' плечо содержит нуклеотиды 221-283 BIC Mus musculus.
[840] В любом из аспектов, представленных в данном документе, которые включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует две или более молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК, две или более молекулы ингибирующей РНК, в некоторых вариантах осуществления могут быть расположены последовательно в первой последовательности нуклеиновой кислоты. В некоторых вариантах осуществления молекулы ингибирующей РНК могут быть присоединены друг к другу прямо или косвенно с помощью нефункциональной (нефункциональных ) линкерной (линкерных) последовательностью (последовательностей). В некоторых вариантах осуществления линкерные последовательности могут иметь длину от 5 до 120 нуклеотидов или от 10 до 40 нуклеотидов.
[841] В любом из аспектов, представленных в данном документе, которые включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует две или более молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК, в некоторых вариантах осуществления первая последовательность нуклеиновой кислоты кодирует от двух до четырех молекул ингибирующей РНК. В иллюстративных вариантах осуществления от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 5, от 2 до 4, от 3 до 5 или от 3 до 6 молекул ингибирующей РНК включены в первую последовательность нуклеиновой кислоты. В иллюстративном варианте осуществления четыре молекулы ингибирующей РНК включены в первую последовательность нуклеиновой кислоты.
[842] В любом из аспектов, представленных в данном документе, которые включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или несколько) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, одна или несколько (например, две или несколько) молекул ингибирующей РНК могут находиться в интроне. В некоторых вариантах осуществления интрон находится в промоторе. В иллюстративных вариантах осуществления интрон представляет собой интрон A EF-1alpha. В некоторых вариантах осуществления интрон находится рядом и ниже промотора, который в иллюстративных вариантах осуществления неактивен в пакующей клетке, используемой для получения не способной к репликации рекомбинантной ретровирусной частицы.
[843] В любом из аспектов, представленных в данном документе, которые включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует две или более молекулы ингибирующей РНК, направленные против одной или нескольких мишеней РНК, две или более молекулы ингибирующей РНК, в некоторых вариантах осуществления могут быть направлены против различных мишеней. В альтернативном варианте осуществления две или более молекулы ингибирующей РНК направлены против одной и той же мишени. В некоторых вариантах осуществления мишени РНК представляют собой mRNA, транскрибируемые с генов, которые экспрессируются Т-клетками, таких как без ограничения PD-1 (предупреждение инактивации); CTLA4 (предупреждение инактивации); TCRa (безопасность - предупреждение аутоиммунитета); TCRb (безопасность - предупреждение аутоиммунитета); CD3Z (безопасность - предупреждение аутоиммунитета); SOCS1 (предупреждение инактивации); SMAD2 (предупреждение инактивации); мишень miR-155 (способствование активации); IFN гамма (снижение CRS); cCBL (продление передачи сигнала); TRAIL2 (предупреждение гибели); PP2A (продление передачи сигнала); ABCG1 (увеличение содержания микродомена холестерина за счет ограничения клиренса холестерина). В некоторых вариантах осуществления мишени РНК представляют собой mRNA, транскрибируемые с генов, которые кодируют компоненты Т-клеточного рецепторного (TCR) комплекса. В некоторых вариантах осуществления по меньшей мере одна из двух или более молекул ингибирующей РНК может снижать экспрессию рецепторов Т-клеток, в иллюстративных вариантах осуществления одного или нескольких эндогенных Т-клеточных рецепторов Т-клетки. В некоторых вариантах осуществления мишень РНК может представлять собой mRNA, транскрибируемую с эндогенного гена TCRα или TCRβ Т-клетки, геном которой содержит первую последовательность нуклеиновой кислоты, кодирующую одну или несколько miRNA. В иллюстративных вариантах осуществления мишень РНК представляет собой mRNA, транскрибируемую с гена TCRα.
[844] В любом из аспектов, представленных в данном документе, которые включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, в некоторых вариантах осуществления CAR представляет собой ограниченный микроокружением биологический (MRB)-CAR. В других вариантах осуществления ASTR CAR связывается с опухолеассоциированным антигеном. В других вариантах осуществления ASTR CAR представляет собой ограниченный микросредой биологический (MRB)-ASTR.
[845] В любом из аспектов, представленных в данном документе, которые включают полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, функционально связанных с промотором, активным в Т-клетках и/или NK-клетках, при этом первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот кодирует одну или несколько (например, две или более) молекул ингибирующей РНК, направленных против одной или нескольких мишеней РНК, и вторая последовательность нуклеиновой кислоты одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифичную нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, и в некоторых случаях третья последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновых кислот, которая кодирует по меньшей мере один лимфопролиферативный элемент, который не является ингибирующей молекулой РНК, в некоторых вариантах осуществления любая или все из первой последовательности нуклеиновой кислоты, второй последовательности нуклеиновой кислоты и третьей последовательности нуклеиновой кислоты функционально связаны с рибопереключателем. В некоторых вариантах осуществления рибопереключатель способен связывать нуклеозидный аналог. В некоторых вариантах осуществления нуклеозидный аналог представляет собой противовирусное лекарственное средство.
[846] В любом из аспектов, представленных в данном документе, которые включают не способную к репликации рекомбинантную ретровирусную частицу, в некоторых вариантах осуществления не способная к репликации рекомбинантная ретровирусная частица содержит на своей поверхности элемент псевдотипирования, который способен связываться с Т-клеткой и/или NK-клеткой и облегчать слияние мембраны не способной к репликации рекомбинантной ретровирусной частицы с ними. В некоторых вариантах осуществления элемент псевдотипирования может представлять собой полипептид вируса кори F, полипептид вируса кори H, полипептид VSV-G или фрагмент любого из них, который сохраняет способность связываться с покоящимися Т-клетками и/или покоящимися NK-клетками. В иллюстративных вариантах осуществления элемент псевдотипирования представляет собой VSV-G.
[847] В любом из аспектов, представленных в данном документе, которые включают не способную к репликации рекомбинантную ретровирусную частицу, в некоторых вариантах осуществления не способная к репликации рекомбинантная ретровирусная частица содержит на своей поверхности элемент активации, который включает мембраносвязанный полипептид, способный связываться с CD3; и/или мембраносвязанный полипептид, способный связываться с CD28. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связываться с CD3, слит с последовательностью присоединения гетерологичного GPI-якоря и/или мембраносвязанный полипептид, способный связываться с CD28, слит с гетерологичной последовательностью присоединения GPI-якоря. В некоторых вариантах осуществления мембраносвязанный полипептид, способный связывать CD3, представляет собой scFV к CD3 или scFvFc к CD3. В иллюстративных вариантах осуществления мембраносвязанный полипептид, способный связываться с CD3, представляет собой scFvFc к CD3. В иллюстративных вариантах осуществления мембраносвязанный полипептид, способный связываться с CD28, представляет собой CD80 или его внеклеточный домен, связанный с последовательностью присоединения GPI-якоря CD16B.
[848] В любом из аспектов, представленных в данном документе, которые включают не способную к репликации рекомбинантную ретровирусную частицу, в некоторых вариантах осуществления не способная к репликации рекомбинантная ретровирусная частица содержит на своей поверхности нуклеиновую кислоту, кодирующую домен, распознаваемый одобренным биопрепаратом на основе моноклонального антитела.
[849] Химерные полипептиды в аспектах, представленных ниже, которые включают химерный полипептид, который способствует пролиферации клеток PBMC, например, B-клеток, T-клеток и/или NK-клеток, могут упоминаться в данном документе как химерные лимфопролиферативные элементы (CLE). Варианты осуществления, представленные ниже в данном документе, которые включают последовательности нуклеиновых кислот, которые кодируют CLE и CAR, упоминаются в данном документе как варианты осуществления полинуклеотидов CLE CAR.
[850] В вариантах осуществления и подвариантах осуществления любого из аспектов и вариантов осуществления, представленных в данном документе, которые включают лимфопролиферативный элемент, включая те, что указаны в параграфах выше в этом разделе, лимфопролиферативный элемент может быть любым из химерных лимфопролиферативных элементов, представленных в данном документе, в том числе ниже в этом разделе. В других вариантах и подвариантах осуществления любого из аспектов и вариантов осуществления в данном документе, которые включают CAR, лимфопролиферативный элемент в некоторых иллюстративных вариантах осуществления представляет собой любой из химерных лимфопролиферативных элементов, кодируемых нуклеиновыми кислотами в вариантах осуществления полинуклеотида CLE CAR (и связанного полипептида), представленных в данном документе, например, как изложено ниже в этом разделе.
[851] В одном аспекте в данном документе представлен выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
а) внеклеточный и трансмембранный домен цитокинового рецептора или рецептора гормона, при этом по меньшей мере один из внеклеточного домена и трансмембранного домена содержит
a. мутацию, которая обнаруживается на конститутивно активном мутанте цитокинового рецептора и при этом внеклеточная последовательность не связывает лиганд цитокинового рецептора, или
b. внеклеточный домен и трансмембранный домен от LMP1; и
b) первый внутриклеточный домен, выбранный из внутриклеточного домена гена, имеющего первый внутриклеточный домен выбранного полипептида, идентифицированного в Табл. 7-10, при этом указанный химерный полипептид способствует клеточной пролиферации В-клеток, Т-клеток и/или NK-клеток.
[852] В одном варианте осуществления аспекта в параграфе непосредственно выше первая последовательность нуклеиновой кислоты дополнительно кодирует второй внутриклеточный домен, при этом второй внутриклеточный домен может располагаться выше (т.е. 5') от первого внутриклеточного домена, или в иллюстративных вариантах осуществления второй внутриклеточный домен находится ниже от первого внутриклеточного домена. В подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточных доменов содержат первый внутриклеточный домен и вторую комбинацию внутриклеточных доменов выбранного полипептида. Соответственно, для пояснения, в неограничивающем иллюстративном варианте осуществления выбранный полипептид представляет собой M008-S212-S075. В таком варианте осуществления первый внутриклеточный домен химерного полипептида содержит или представляет собой вариант 1 транскрипта TNFRSF8 (NM_001243_4) (S212), а второй полипептид содержит или представляет собой FCGR2C (NM_201563_5) (S075).
[853] В одном варианте этого аспекта химерный полипептид включает трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида. В одном варианте этого аспекта химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида. Соответственно, для пояснения, в неограничивающем иллюстративном варианте осуществления выбранный полипептид представляет собой M008-S212-S075. В таком варианте осуществления внеклеточный и трансмембранный домен химерного полипептида включает Myc LMP1 (NC_007605_1) (M008) или представляет собой Myc LMP1 (NC_007605_1) (M008), первый внутриклеточный домен химерного полипептида содержит или представляет собой вариант 1 транскрипта TNFRSF8 (NM_001243_4) (S212), а второй внутриклеточный домен химерного полипептида содержит или представляет собой FCGR2C (NM_201563_5) (S075). В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен необязательно содержит домен распознавания или элиминации или не содержит домен распознавания или элиминации. В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен содержит домен распознавания или элиминации выбранного полипептида или другую метку клиренса. В другом варианте осуществления аспекта, представленного в параграфе выше, первый внутриклеточный домен и вторая комбинация внутриклеточного домена включает первый внутриклеточный домен выбранного полипептида с любым внутриклеточным доменом любого гена, идентифицированного во вторых внутриклеточных доменах любого кандидатного полипептида в Табл. 7-10.
[854] В другом варианте осуществления этого аспекта полинуклеотид дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В подварианте осуществления этого аспекта первый внутриклеточный домен и вторая комбинация внутриклеточных доменов представляют собой первый внутриклеточный домен и вторую комбинацию внутриклеточных доменов выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 7-10. В другом подварианте осуществления этого варианта осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 7-10. В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен необязательно содержит домен распознавания или элиминации, и при этом домен распознавания или элиминации представляет собой домен распознавания или элиминации внеклеточного домена выбранного полипептида или другого домена распознавания или элиминации, и при этом выбранный полипептид указан в Табл. 7-10.
[855] В другом аспекте в данном документе представлен выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
a) внеклеточный и трансмембранный домен цитокинового рецептора или гормона, при этом по меньшей мере один из внеклеточного домена и трансмембранного домена содержит
c. мутацию, которая обнаруживается на конститутивно активном мутанте цитокинового рецептора и при этом внеклеточная последовательность не связывает лиганд цитокинового рецептора, или
d. внеклеточный домен и трансмембранный домен от LMP1; и
b) первый внутриклеточный домен, выбранный из внутриклеточного домена CD3D, CD3E, CD8A, CD27, CD40, CD79B, IFNAR1, IL2RA, IL3RA, IL13RA2, TNFRSF8, TNFRSF9, IL31RA или MyD88, при этом указанный химерный полипептид способствует пролиферации клеток PBMC, и в иллюстративных вариантах осуществления, B-клеток, T-клеток и/или NK-клеток.
[856] В одном варианте осуществления аспекта в параграфе непосредственно выше первая последовательность нуклеиновой кислоты дополнительно кодирует второй внутриклеточный домен, при этом второй внутриклеточный домен может располагаться выше (т.е. 5') от первого внутриклеточного домена, или в иллюстративных вариантах осуществления второй внутриклеточный домен находится ниже от первого внутриклеточного домена. В подварианте осуществления этого варианта осуществления второй внутриклеточный домен происходит от гена второго внутриклеточного домена в выбранном полипептиде, идентифицированном в любой Табл. Примера 17 как обеспечивающий обогащение в день 35 по сравнению с днем 7 выше 0, 1 или 2, при этом первый внутриклеточный домен происходит от гена первого внутриклеточного домена выбранного полипептида. В дополнительном подварианте осуществления этого подварианта осуществления или варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена представляют собой первый внутриклеточный домен и второй внутриклеточный домен из выбранного химерного полипептида, идентифицированного в любой таблице Примера 17 как обеспечивающий обогащение в день 35 по сравнению с днем 7 выше 0, 1 или 2. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит от первого гена выбранного первого внутриклеточного домена выбранного полипептида в Табл. 7-10, а второй внутриклеточный домен происходит от второго гена выбранного второго внутриклеточного домена выбранного полипептида. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит из выбранного полипептида в Табл. 7-10, а второй внутриклеточный домен происходит из выбранного полипептида в Табл. 7-10.
[857] В другом подварианте осуществления указанных непосредственно выше вариантов осуществления, при этом первая последовательность нуклеиновой кислоты дополнительно кодирует второй внутриклеточный домен, второй внутриклеточный домен выбран из второго внутриклеточного домена, идентифицированного в любой из таблиц Примера 17 как обеспечивающий обогащение в день 35 по сравнению с днем 7 выше 0, 1 или 2 для соответствующего первого внутриклеточного домена. В подвариантах осуществления этих вариантов осуществления первый внутриклеточный домен выбран из внутриклеточного домена CD27, CD40 или CD79B. В других подвариантах осуществления этого варианта осуществления первый внутриклеточный домен выбран из внутриклеточного домена CD3D, CD3E, CD8A, CD27, CD40, CD79B, IFNAR1, IL2RA, IL3RA, IL13RA2, TNFRSF8, TNFRSF9, IL31RA или MyD88, идентифицированных в любой из таблиц Примера 17, как обеспечивающий обогащение в день 35 по сравнению с днем 7 выше 0, 1 или 2. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит от первого гена выбранного химерного полипептида в Табл. 7-10, а второй внутриклеточный домен происходит от второго гена выбранного химерного полипептида в Табл. 7-10. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит из первого гена выбранного химерного полипептида в Табл. 7-10, а второй внутриклеточный домен происходит из внутриклеточного домена CD3D, CD3G, CD8A, CD8B, CD27, CD40, CD79B, CRLF2, FCGR2C, ICOS, IL2RA, IL13RA1, IL13RA2, IL15RA, TNFRSF9 и TNFRSF18. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит из выбранного полипептида, идентифицированного в Табл. 7-10, а второй внутриклеточный домен происходит из выбранного полипептида, идентифицированного в Табл. 7-10. В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домены необязательно содержат метку клиренса или не содержат метку клиренса, и при этом выбранный полипептид указан в Табл. 7-10. В родственном подварианте осуществления химерный полипептид содержит внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен содержит домен распознавания или элиминации выбранного полипептида или другой домен распознавания или элиминации, и при этом выбранный полипептид указан в Табл. 7-10.
[858] В другом варианте осуществления этого аспекта первый внутриклеточный домен выбран из внутриклеточного домена CD3D, CD3E, CD8A, CD27, CD40, CD79B, IFNAR1, IL2RA, IL3RA, IL13RA2, TNFRSF8 или TNFRSF9, полинуклеотид дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В подварианте этого аспекта первый внутриклеточный домен происходит от гена первого внутриклеточного домена выбранного полипептида, а второй внутриклеточный домен происходит от гена второго внутриклеточного домена выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 7-10. В подварианте осуществления этого аспекта первый внутриклеточный домен и вторая комбинация внутриклеточных доменов представляют собой первый внутриклеточный домен и вторую комбинацию внутриклеточных доменов выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 7-10. В другом подварианте осуществления этого варианта осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 7-10. В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен необязательно содержит домен распознавания или элиминации, и при этом домен распознавания или элиминации представляет собой домен распознавания или элиминации внеклеточного домена выбранного полипептида или другого домена распознавания или элиминации, и при этом выбранный полипептид указан в Табл. 7-10.
[859] В другом аспекте в данном документе представлен выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
(a) внеклеточный и трансмембранный домен цитокинового рецептора или гормона, при этом по меньшей мере один из внеклеточного домена и трансмембранного домена содержит
i. мутацию, которая обнаруживается на конститутивно активном мутанте цитокинового рецептора и при этом внеклеточная последовательность не связывает лиганд цитокинового рецептора, или
ii. внеклеточный домен и трансмембранный домен от LMP1; и
(b) первый внутриклеточный домен, выбранный из внутриклеточного домена CD3D, CD3G, CD8A, CD8B, CD27, CD40, CD79B, CRLF2, FCGR2C, ICOS, IL2RA, IL13RA1, IL13RA2, IL15RA, TNFRSF9 и TNFRSF18, при этом указанный химерный полипептид способствует пролиферации клеток PBMC, и в иллюстративных вариантах осуществления, B-клеток, T-клеток и/или NK-клеток.
[860] В Примере 17 внутриклеточные домены, указанные в непосредственно вышеупомянутом аспекте, были идентифицированы как заслуживающие внимания вторые внутриклеточные домены. Однако следует понимать, что в некоторых вариантах осуществления внутриклеточные домены, идентифицированные как заслуживающие внимания вторые внутриклеточные домены, являются первыми внутриклеточными доменами химерных полипептидов этих вариантов осуществления.
[861] В другом аспекте в данном документе представлен выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
a) внеклеточный и трансмембранный домен цитокинового рецептора или гормона, при этом по меньшей мере один из внеклеточного домена и трансмембранного домена содержит
а. мутацию, которая обнаруживается на конститутивно активном мутанте цитокинового рецептора и при этом внеклеточная последовательность не связывает лиганд цитокинового рецептора, или
b. внеклеточный домен и трансмембранный домен от LMP1; и
b) первый внутриклеточный домен, выбранный из внутриклеточного домена CD3D, CD3E, CD8A, CD27, CD40, CD79B, IFNAR1, IL2RA, IL3RA, IL13RA2, TNFRSF8, TNFRSF9, IL31RA или MyD88,
при этом указанный химерный полипептид способствует пролиферации клеток PBMC и, в иллюстративных вариантах осуществления, B-клеток, T-клеток и/или NK-клеток, и при этом внеклеточный и трансмембранный домен выбран из внеклеточного домена и трансмембранного домена IL7RA Ins PPCL, LMP1, CRLF2 F232C, CSF2RB V449E, CSF3R T640N, EPOR L251C I252C, GHR E260C I270C, IL27RA F523C и MPL S505N.
[862] В некоторых вариантах осуществления любого из вышеуказанных аспектов, направленных на полинуклеотид, кодирующий химерный полипептид, при этом указанный химерный полипептид способствует пролиферации клеток PBMC, и в иллюстративных вариантах осуществления B-клеток, T-клеток и/или NK-клеток, внеклеточный домен и трансмембранный домен выбран из CSF3R T640N и MPL S505N. В иллюстративных вариантах осуществления внеклеточный домен и трансмембранный домен происходят из CSF3R T640N, и в некоторых подвариантах осуществления выделенный полинуклеотид не содержит CAR. В некоторых вариантах осуществления внеклеточный домен и трансмембранный домен представляют собой CSF3R T640N, представленные в Табл. 6, за исключением того, что домен узнавания и элиминации является необязательным. В определенных вариантах осуществления первый внутриклеточный домен и второй внутриклеточный домен происходят из любого из полипептидов, представленных в Примере 17 и таблицах в нем, которые включают указанные внутриклеточный и внеклеточный домен и указанный первый внутриклеточный домен. В других вариантах осуществления внеклеточный и трансмембранный домен происходят из MPL S505N, а в некоторых вариантах осуществления внеклеточный домен и трансмембранный домен MPL S505N представлены в Табл. 6, за исключением того, что домен распознавания и элиминации является необязательным.
[863] В другом аспекте в данном документе представлен выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
a) трансмембранный домен трансмембранного белка типа I; и
b) первый внутриклеточный домен, выбранный из внутриклеточного домена гена, имеющего первый внутриклеточный домен выбранного полипептида, идентифицированного в Табл. 11-16, при этом указанный химерный полипептид способствует клеточной пролиферации В-клеток, Т-клеток и/или NK-клеток,
при этом указанный химерный полипептид способствует пролиферации клеток PBMC и, в иллюстративных вариантах осуществления, B-клеток, T-клеток и/или NK-клеток. Как показано в прилагаемом Примере 18, такие химерные полипептиды способны стимулировать пролиферацию клеток PBMC в отсутствие воздействия на PBMC IL-2 во время культивирования, например, в отсутствие добавления IL-2 к культуральной среде PBMC (например, В-клеток, Т-клеток или NK-клеток), которые экспрессируют нуклеиновую кислоту, кодирующую химерный полипептид.
[864] В одном варианте осуществления аспекта в параграфе непосредственно выше и любом варианте осуществления этого аспекта в данном документе ниже в этом разделе первый внутриклеточный домен представляет собой внутриклеточный домен гена, имеющего первый внутриклеточный домен в Табл. 11-16 и в других иллюстративных вариантах осуществления одна из первых 50, 25 или 10 конструкций, перечисленных в Табл. 11-16, и в дополнительных иллюстративных вариантах осуществления одна из первых 50, 25 или 10 конструкций, перечисленных в двух, трех, четырех или пяти из шести таблиц, или все из Табл. 11-16. В одном варианте осуществления первый внутриклеточный домен представляет собой внутриклеточный домен, идентифицированный в Табл. 17. В Табл. 17 идентифицированы конструкции, которые способствовали пролиферации PBMC между днем 7 и днем 21 или днем 35, когда второй внутриклеточный домен не присутствовал в конструкции. В некоторых подвариантах этого варианта осуществления химерный полипептид включает комбинацию трансмембранного домена и внутриклеточного домена с внеклеточным доменом, содержащим димеризующийся мотив, или без него, из Табл. 17.
[865] В одном варианте осуществления аспекта в параграфе непосредственно выше и любом варианте осуществления этого аспекта в данном документе ниже в этом разделе первая последовательность нуклеиновой кислоты дополнительно кодирует внеклеточный домен, и в иллюстративных вариантах осуществления внеклеточный домен содержит димеризующийся мотив. В любых аспектах или вариантах осуществления, при этом внеклеточный домен CLE содержит димеризующийся мотив, димеризующийся мотив может быть выбран из группы, состоящей из полипептида, содержащего мотив лейциновой застежки, CD69, CD71, CD72, CD96, Cd105, Cd161, Cd162 , Cd249, CD271 и Cd324, а также их мутанты и/или активные фрагменты, которые сохраняют способность к димеризации. В любом из аспектов и вариантов осуществления в данном документе, при этом внеклеточный домен CLE содержит димеризующий мотив, димеризующий мотив может потребовать димеризующего средства, и димеризующий мотив и связанный димеризующее средство могут быть выбраны из группы, состоящей из: FKBP и рапамицина или их аналогов, GyrB и кумермицина или их аналогов, DHFR и метотрексата или их аналогов, или DmrB и AP20187 или их аналогов, а также мутантов и/или активных фрагментов перечисленных димеризующихся белков, которые сохраняют способность димеризоваться.
[866] В иллюстративных вариантах осуществления любых аспектов или вариантов осуществления в данном документе, при этом внеклеточный домен CLE содержит мотив димеризации, внеклеточный домен может содержать мотив лейциновой молнии. В некоторых вариантах осуществления лейциновая молния происходит из полипептида jun, например, c-jun. В некоторых вариантах осуществления полипептид c-jun представляет собой область полипептида c-jun ECD-11.
[867] В одном варианте осуществления этого аспекта первая последовательность нуклеиновой кислоты дополнительно кодирует второй внутриклеточный домен, при этом второй внутриклеточный домен может располагаться выше (т.е. 5') от первого внутриклеточного домена, или в иллюстративных вариантах осуществления второй внутриклеточный домен находится ниже от первого внутриклеточного домена. В подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена включает первый внутриклеточный домен выбранного полипептида с любым внутриклеточным доменом любого гена, идентифицированного во вторых внутриклеточных доменах любого кандидатного полипептида в Табл. 11-16, и в иллюстративных вариантах осуществления в Табл. 11-16 и в других иллюстративных вариантах осуществления одна из первых 50, 25 или 10 конструкций, перечисленных в Табл. 11-16, и в дополнительных иллюстративных вариантах осуществления одна из первых 50, 25 или 10 перечисленных конструкций в двух, трех, четырех или пяти таблицах или во всех Табл. 11-16. В подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточных доменов содержат первый внутриклеточный домен и вторую комбинацию внутриклеточных доменов выбранного полипептида.
[868] В одном варианте этого аспекта химерный полипептид включает трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида. В одном варианте этого аспекта химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, при этом внеклеточный домен необязательно включает домен распознавания или элиминации.
[869] В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен необязательно содержит домен распознавания или элиминации или не содержит домен распознавания или элиминации. В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен содержит домен распознавания или элиминации выбранного полипептида или другой домен распознавания или элиминации.
[870] В другом варианте осуществления этого аспекта полинуклеотид дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В подварианте осуществления этого аспекта первый внутриклеточный домен и вторая комбинация внутриклеточного домена представляют собой комбинацию первого внутриклеточного домена и второго внутриклеточного домена выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 11-16 и в других иллюстративных вариантах осуществления одна из первых 50, 25 или 10 конструкций, перечисленных в таблицах 11-16, и в дополнительных иллюстративных вариантах осуществления одна из первых 50, 25 или 10 конструкций, перечисленных в двух, трех, четырех или пяти таблицах, или во всех Табл. 11-16. В другом подварианте этого варианта осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 11-16 или в иллюстративных вариантах осуществления в одном из первых 50, 25 или 10 конструкций, перечисленных в Табл. 11-16, а в дополнительных иллюстративных вариантах осуществления одна из первых 50, 25 или 10 конструкций, перечисленных в двух, трех, четырех или пяти таблицах, или во всех Табл. 11-16. В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен необязательно содержит домен распознавания и элиминации, и при этом домен распознавания или элиминации представляет собой домен распознавания или элиминации внеклеточного домена выбранного полипептида или другого домена распознавания или элиминации, и при этом выбранный полипептид указан в Табл. 11-16.
[871] В другом аспекте в данном документе представлен выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
a) трансмембранный домен трансмембранного белка типа I; и
b) первый внутриклеточный домен, выбранный из внутриклеточного домена LEPR, MYD88, IFNAR2, MPL, IL18R1, IL13RA2, IL10RB, IL23R или CSF2RA,
при этом указанный химерный полипептид способствует пролиферации клеток PBMC и, в иллюстративных вариантах осуществления, B-клеток, T-клеток и/или NK-клеток.
[872] В одном варианте осуществления аспекта в параграфе непосредственно выше и любом варианте осуществления этого аспекта в данном документе ниже в этом разделе первая последовательность нуклеиновой кислоты дополнительно кодирует внеклеточный домен, и в иллюстративных вариантах осуществления внеклеточный домен содержит димеризующийся мотив. В иллюстративных вариантах осуществления этого аспекта внеклеточный домен содержит лейциновую молнию. В некоторых вариантах осуществления лейциновая молния происходит из полипептида jun, например, c-jun. В некоторых вариантах осуществления полипептид c-jun представляет собой область полипептида c-jun ECD-11.
[873] В другом варианте осуществления этого аспекта, при этом первый внутриклеточный домен выбран из внутриклеточного домена LEPR, MYD88, IFNAR2, MPL, IL18R1, IL13RA2, IL10RB, IL23R или CSF2RA, первая последовательность нуклеиновой кислоты дополнительно кодирует второй внутриклеточный домен, при этом второй внутриклеточный домен может располагаться выше (т.е. 5') от первого внутриклеточного домена, или в иллюстративных вариантах осуществления второй внутриклеточный домен расположен ниже от первого внутриклеточного домена. В подварианте осуществления этого варианта осуществления второй внутриклеточный домен происходит от гена второго внутриклеточного домена в выбранном полипептиде, идентифицированном в любой Табл. Примера 18 как обеспечивающий обогащение в день 21 по сравнению с днем 7 выше 0, 1 или 2, при этом первый внутриклеточный домен происходит от гена первого внутриклеточного домена выбранного полипептида. В дополнительном подварианте осуществления этого подварианта осуществления или варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена представляют собой первый внутриклеточный домен и второй внутриклеточный домен из выбранного химерного полипептида, идентифицированного в любой таблице Примера 18 как обеспечивающий обогащение в день 21 по сравнению с днем 7 выше 0, 1 или 2. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит от первого гена выбранного первого внутриклеточного домена выбранного полипептида в Табл. 11-16, а второй внутриклеточный домен происходит от второго гена выбранного второго внутриклеточного домена выбранного полипептида. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит из выбранного полипептида в Табл. 11-16, а второй внутриклеточный домен происходит из выбранного полипептида. В другом варианте осуществления этого аспекта или любом варианте осуществления в данном документе полинуклеотид дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[874] В одном варианте осуществления этого аспекта и одном подварианте осуществления или дополнительном подварианте осуществления вариантов осуществления и подвариантах осуществления в непосредственно предшествующем параграфе, которые содержат второй внутриклеточный домен, первый внутриклеточный домен представляет собой внутриклеточный домен LEPR, MYD88, IFNAR2 и MPL. В другом варианте осуществления первый внутриклеточный домен представляет собой внутриклеточный домен из LEPR, IFNAR2 и MPL. В другом варианте осуществления первый внутриклеточный домен отличается от MyD88. В другом варианте осуществления первый внутриклеточный домен отличается от MyD88, а второй внутриклеточный домен отличается от CD40. В подварианте осуществления этих вариантов осуществления в этом параграфе полинуклеотид дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[875] В одном варианте осуществления этого аспекта настоящего изобретения MPL представляет собой первый внутриклеточный домен, а второй внутриклеточный домен происходит от гена второго внутриклеточного домена в выбранном полипептиде, идентифицированном в Табл. 11-16. В дополнительном подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена содержат первый внутриклеточный домен и второй внутриклеточный домен из выбранного химерного полипептида, идентифицированного в Табл. 11-16. В некоторых подвариантах этих вариантов осуществления ориентация первого внутриклеточного домена и второго внутриклеточного домена обращена так, что карбокси-концевой остаток второго домена связан с первым доменом или спейсером между вторым доменом и первым доменом.
[876] В одном варианте осуществления этого аспекта настоящего изобретения LEPR представляет собой первый внутриклеточный домен, а второй внутриклеточный домен происходит от гена второго внутриклеточного домена в выбранном полипептиде, идентифицированном в Табл. 11-16. В дополнительном подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена содержат первый внутриклеточный домен и второй внутриклеточный домен из выбранного химерного полипептида, идентифицированного в Табл. 11-16. В некоторых подвариантах этих вариантов осуществления ориентация первого внутриклеточного домена и второго внутриклеточного домена обращена так, что карбокси-концевой остаток второго домена связан с первым доменом или спейсером между вторым доменом и первым доменом.
[877] В одном варианте осуществления этого аспекта настоящего изобретения IFNAR2 представляет собой первый внутриклеточный домен, а второй внутриклеточный домен происходит от гена второго внутриклеточного домена в выбранном полипептиде, идентифицированном в Табл. 11-16. В дополнительном подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена содержат первый внутриклеточный домен и второй внутриклеточный домен из выбранного химерного полипептида, идентифицированного в Табл. 11-16. В некоторых подвариантах этих вариантов осуществления ориентация первого внутриклеточного домена и второго внутриклеточного домена обращена так, что карбокси-концевой остаток второго домена связан с первым доменом или спейсером между вторым доменом и первым доменом.
[878] В одном варианте осуществления этого аспекта настоящего изобретения MyD88 представляет собой первый внутриклеточный домен, а второй внутриклеточный домен происходит от гена второго внутриклеточного домена в выбранном полипептиде, идентифицированном в Табл. 11-16. В дополнительном подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена содержат первый внутриклеточный домен и второй внутриклеточный домен из выбранного химерного полипептида, идентифицированного в Табл. 11-16. В некоторых подвариантах этих вариантов осуществления ориентация первого внутриклеточного домена и второго внутриклеточного домена обращена так, что карбокси-концевой остаток второго домена связан с первым доменом или спейсером между вторым доменом и первым доменом.
В некоторых вариантах осуществления аспектов выделенных полинуклеотидов выше, при этом первый внутриклеточный домен выбран из внутриклеточного домена LEPR, MYD88, IFNAR2, IL17RD, IL17RE, IL1RAP, IL23R и MPL, трансмембранный домен выбран из трансмембранного домена CD40, CD8B, CRLF2, CSF2RA, GCGR2C, ICOS, IFNAR1, IFNGR1, IL10RB, IL18R1, IL18RAP, IL3RA и PRLR. В некоторых иллюстративных вариантах осуществления трансмембранный домен представляет собой трансмембранный домен CD40 или ICOS. В некоторых вариантах осуществления первый внутриклеточный домен происходит от LEPR, MYD88, IFNAR2 и MPL. Например, в некоторых вариантах осуществления трансмембранный домен представляет собой трансмембранный домен из CD40, а первый внутриклеточный домен представляет собой внутриклеточный домен из MPL.
[879] В некоторых вариантах осуществления аспектов выделенных полинуклеотидов выше, при этом первый внутриклеточный домен выбран из внутриклеточного домена LEPR, MYD88, IFNAR2, IL17RD, IL17RE, IL1RAP, IL23R и MPL, второй внутриклеточный домен выбирают из CD40, CD79B или CD27. В некоторых вариантах осуществления первый внутриклеточный домен происходит от LEPR, MYD88, IFNAR2 и MPL. Например, в некоторых вариантах осуществления первый внутриклеточный домен представляет собой MPL, а второй внутриклеточный домен представляет собой CD40. Во всех вариантах осуществления в этом параграфе порядок первого внутриклеточного домена и второго внутриклеточного домена в полипептиде может быть обратным.
[880] В другом аспекте в данном документе представлен выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
a) трансмембранный домен трансмембранного белка типа I; и
b) первый внутриклеточный домен, выбранный из внутриклеточного домена гена, имеющего первый внутриклеточный домен выбранного полипептида, идентифицированного в Табл. 11-16, при этом указанный химерный полипептид способствует клеточной пролиферации В-клеток, Т-клеток и/или NK-клеток,
при этом указанный химерный полипептид способствует пролиферации клеток PBMC и, в иллюстративных вариантах осуществления, B-клеток, T-клеток и/или NK-клеток. В некоторых вариантах осуществления NK-клетки представляют собой NKT-клетки.
[881] В одном варианте осуществления аспекта в параграфе непосредственно выше и любом варианте осуществления этого аспекта в данном документе ниже в этом разделе первая последовательность нуклеиновой кислоты дополнительно кодирует внеклеточный домен, и в иллюстративных вариантах осуществления внеклеточный домен содержит димеризующийся мотив. В любых аспектах или вариантах осуществления, при этом внеклеточный домен CLE содержит димеризующийся мотив, димеризующийся мотив может быть выбран из группы, состоящей из полипептида, содержащего мотив лейциновой застежки, CD69, CD71, CD72, CD96, Cd105, Cd161, Cd162 , Cd249, CD271 и Cd324, а также их мутанты и/или активные фрагменты, которые сохраняют способность к димеризации. В любом из аспектов и вариантов осуществления в данном документе, при этом внеклеточный домен CLE содержит димеризующий мотив, димеризующий мотив может потребовать димеризующего средства, и димеризующий мотив и связанный димеризующее средство могут быть выбраны из группы, состоящей из: FKBP и рапамицина или их аналогов, GyrB и кумермицина или их аналогов, DHFR и метотрексата или их аналогов, или DmrB и AP20187 или их аналогов, а также мутантов и/или активных фрагментов перечисленных димеризующихся белков, которые сохраняют способность димеризоваться.
[882] В иллюстративных вариантах осуществления любых аспектов или вариантов осуществления в данном документе, при этом внеклеточный домен CLE содержит мотив димеризации, внеклеточный домен может содержать мотив лейциновой молнии. В некоторых вариантах осуществления лейциновая молния происходит из полипептида jun, например, c-jun. В некоторых вариантах осуществления полипептид c-jun представляет собой область полипептида c-jun ECD-11.
[883] В одном варианте осуществления этого аспекта первая последовательность нуклеиновой кислоты дополнительно кодирует второй внутриклеточный домен, при этом второй внутриклеточный домен может располагаться выше (т.е. 5') от первого внутриклеточного домена, или в иллюстративных вариантах осуществления второй внутриклеточный домен находится ниже от первого внутриклеточного домена. В подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена включает первый внутриклеточный домен выбранного полипептида с любым внутриклеточным доменом любого гена, идентифицированного во вторых внутриклеточных доменах любого кандидатного полипептида в Табл. 11-16. В подварианте осуществления этого варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточных доменов содержат первый внутриклеточный домен и вторую комбинацию внутриклеточных доменов выбранного полипептида.
[884] В одном варианте этого аспекта химерный полипептид включает трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида. В одном варианте этого аспекта химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, при этом внеклеточный домен необязательно включает домен распознавания или элиминации.
[885] В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен необязательно содержит домен распознавания или элиминации или не содержит домен распознавания или элиминации. В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен содержит домен распознавания или элиминации выбранного полипептида или другой домен распознавания или элиминации.
[886] В другом варианте осуществления этого аспекта полинуклеотид дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В подварианте осуществления этого аспекта первый внутриклеточный домен и вторая комбинация внутриклеточных доменов представляют собой первый внутриклеточный домен и вторую комбинацию внутриклеточных доменов выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 11-16. В другом подварианте осуществления этого варианта осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, и выбранный полипептид идентифицирован в Табл. 11-16. В связанном подварианте осуществления химерный полипептид включает внеклеточный и трансмембранный домен, первый внутриклеточный домен и второй внутриклеточный домен выбранного полипептида, за исключением того, что внеклеточный и трансмембранный домен необязательно содержит домен распознавания и элиминации, и при этом домен распознавания или элиминации представляет собой домен распознавания или элиминации внеклеточного домена выбранного полипептида или другого домена распознавания или элиминации, и при этом выбранный полипептид указан в Табл. 11-16.
[887] В другом аспекте в данном документе представлен выделенный полинуклеотид, содержащий одну или несколько последовательностей нуклеиновых кислот, при этом:
первая последовательность нуклеиновой кислоты из одной или нескольких последовательностей нуклеиновой кислоты кодирует химерный полипептид, имеющий ориентацию от амино до карбокси,
c) трансмембранный домен трансмембранного белка типа I; и
d) первый внутриклеточный домен, выбранный из внутриклеточного домена LEPR, MYD88, IFNAR2, IL17RD, IL17RE, IL1RAP, IL23R и MPL,
при этом указанный химерный полипептид способствует пролиферации клеток PBMC и, в иллюстративных вариантах осуществления, B-клеток, T-клеток и/или NK-клеток.
[888] В одном варианте осуществления аспекта в параграфе непосредственно выше и любом варианте осуществления этого аспекта в данном документе ниже в этом разделе первая последовательность нуклеиновой кислоты дополнительно кодирует внеклеточный домен, и в иллюстративных вариантах осуществления внеклеточный домен содержит димеризующийся мотив. В иллюстративных вариантах осуществления этого аспекта внеклеточный домен содержит лейциновую молнию. В некоторых вариантах осуществления лейциновая молния происходит из полипептида jun, например, c-jun. В некоторых вариантах осуществления полипептид c-jun представляет собой область полипептида c-jun ECD-11.
[889] В другом варианте осуществления этого аспекта, при этом первый внутриклеточный домен выбран из внутриклеточного домена LEPR, MYD88, IFNAR2, IL17RD, IL17RE, IL1RAP, IL23R и MPL, первая последовательность нуклеиновой кислоты дополнительно кодирует второй внутриклеточный домен, при этом второй внутриклеточный домен может располагаться выше (т.е. 5') от первого внутриклеточного домена, или в иллюстративных вариантах осуществления второй внутриклеточный домен расположен ниже от первого внутриклеточного домена. В подварианте осуществления этого варианта осуществления второй внутриклеточный домен происходит от гена второго внутриклеточного домена в выбранном полипептиде, идентифицированном в любой Табл. Примера 18 как обеспечивающий обогащение в день 21 по сравнению с днем 7 выше 0, 1 или 2, при этом первый внутриклеточный домен происходит от гена первого внутриклеточного домена выбранного полипептида. В дополнительном подварианте осуществления этого подварианта осуществления или варианта осуществления первый внутриклеточный домен и вторая комбинация внутриклеточного домена представляют собой первый внутриклеточный домен и второй внутриклеточный домен из выбранного химерного полипептида, идентифицированного в любой таблице Примера 18 как обеспечивающий обогащение в день 21 по сравнению с днем 7 выше 0, 1 или 2. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит от первого гена выбранного первого внутриклеточного домена выбранного полипептида в Табл. 11-16, а второй внутриклеточный домен происходит от второго гена выбранного второго внутриклеточного домена выбранного полипептида. В другом подварианте осуществления варианта осуществления или подвариантов осуществления в этом параграфе первый внутриклеточный домен происходит из выбранного полипептида в Табл. 11-16, а второй внутриклеточный домен происходит из выбранного полипептида. В другом варианте осуществления этого аспекта или любом варианте осуществления в данном документе полинуклеотид дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен.
[890] В определенных вариантах осуществления любого из способов или вариантов осуществления выделенного полинуклеотида в данном документе, которые включают химерный полипептид, при этом указанный химерный полипептид способствует пролиферации клеток PBMC, и в иллюстративных вариантах осуществления B-клеток, T-клеток и/или NK-клеток, первый и/или второй внутриклеточный домен, в иллюстративных вариантах осуществления первый внутриклеточный домен представляет собой внутриклеточный домен из LEPR, MYD88, IFNAR2, MPL, IL18R1, IL13RA2, IL10RB, IL23R или CSF2RA. В некоторых вариантах осуществления первый внутриклеточный домен происходит из MPL. В иллюстративных подвариантах осуществления химерный полипептид включает внеклеточный домен, содержащий димеризующийся мотив, представленный в данном документе.
[891] В некоторых вариантах осуществления любого из способов или вариантов осуществления выделенного полинуклеотида в данном документе, которые включают химерный полипептид, при этом указанный химерный полипептид способствует пролиферации клеток PBMC, и в иллюстративных вариантах осуществления B-клеток, T-клеток и/или NK-клеток трансмембранный домен происходит из CD40, ICOS, FCGR2C, PRLR, IL3RA или IL6ST. В некоторых иллюстративных вариантах осуществления трансмембранный домен происходит из CD40 или ICOS. В иллюстративных подвариантах осуществления химерный полипептид включает внеклеточный домен, содержащий димеризующийся мотив, представленный в данном документе.
[892] В определенных вариантах осуществления любого из способов или вариантов осуществления выделенного полинуклеотида в данном документе, которые включают химерный полипептид, при этом указанный химерный полипептид способствует пролиферации клеток PBMC, и в иллюстративных вариантах осуществления B-клеток, T-клеток и/или NK-клеток, первый и/или второй внутриклеточный домен, в иллюстративных вариантах осуществления второй внутриклеточный домен представляет собой внутриклеточный домен из CD40, CD79B, TNFRSF4, TNFRSF9, TNFRSF14, FCGRA2, CD3G или CD27. В некоторых иллюстративных вариантах осуществления второй внутриклеточный домен происходит из CD40, CD79B или CD27. В иллюстративных подвариантах осуществления химерный полипептид включает внеклеточный домен, содержащий димеризующийся мотив, представленный в данном документе.
[893] В определенных вариантах осуществления любого из способов или вариантов осуществления выделенного полинуклеотида в данном документе, которые включают химерный полипептид, при этом указанный химерный полипептид способствует пролиферации клеток PBMC, и в иллюстративных вариантах осуществления B-клеток, T-клеток и/или NK-клеток, первый и/или второй внутриклеточный домен представляет собой внутриклеточный домен (элемент P3 или P4) любого из химерных полипептидов в Табл. 11-16. В некоторых вариантах осуществления химерный полипептид включает любую комбинацию P2, P3 и P4 любого из химерных полипептидов, указанных в Табл. 11-16.
[894] В варианте осуществления любого из аспектов и вариантов осуществления, при этом трансмембранный домен представляет собой трансмембранный белок типа I, трансмембранный домен может быть рецептором цитокина типа I, рецептором гормона, рецептором Т-клеток или рецептором семейства TNF. В варианте осуществления любого из аспектов и вариантов осуществления, при этом химерный полипептид содержит внеклеточный домен и при этом внеклеточный домен содержит димеризующийся мотив, трансмембранный домен может быть рецептором цитокина типа I, рецептором гормона, рецептором Т-клеток или рецептором семейства TNF. В иллюстративных вариантах осуществления любого из этих вариантов осуществления в этом параграфе первый внутриклеточный домен выбран из внутриклеточного домена LEPR, MYD88, IFNAR2, IL17RD, IL17RE, IL1RAP, IL23R и MPL.
[895] В варианте осуществления любого из аспектов и вариантов осуществления, направленных на полинуклеотиды, содержащие последовательность нуклеиновой кислоты, кодирующую химерный полипептид, который содержит внеклеточный домен, внеклеточный домен может содержать спейсер из 1, 2, 3 или 4 аминокислот в пределах 20 аминокислот от карбокси-конец внеклеточного домена и в иллюстративных вариантах осуществления на карбокси-конце внеклеточного домена, так что спейсер разделяет внеклеточный домен и трансмембранный домен. В некоторых вариантах осуществления спейсер из 1, 2, 3 или 4 аминокислот содержит остаток аланина, а в некоторых случаях только остатки аланина. В иллюстративных подвариантах осуществления вариантов осуществления, которые содержат указанный спейсер, внеклеточный домен содержит мотив димеризации, например, мотив лейциновой молнии.
[896] Будет понятно, что первый внутриклеточный домен и второй внутриклеточный домен для любого аспекта и варианта осуществления, представленных в данном документе, который включает химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток, может включать мутанты и/или фрагменты перечисленных генов при условии, что химерный полипептид сохраняет свою способность способствовать пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток. Эти мутанты и/или фрагменты обычно сохраняют сигнальную активность, так что химерный полипептид сохраняет свою активность, способствующую выживанию и пролиферации. Будет понятно, что первый внутриклеточный домен и второй внутриклеточный домен могут быть обращены в соответствии с любым аспектом и вариантом осуществления, представленным в данном документе, который включает химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток. Таким образом, в этих вариантах осуществления будет понятно, что первый внутриклеточный домен является вторым внутриклеточным доменом и наоборот.
[897] В любом из аспектов и вариантов осуществления, представленных в данном документе, которые содержат полинуклеотиды, которые включают последовательность нуклеиновой кислоты, кодирующую химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток, последовательность нуклеиновой кислоты может дополнительно кодировать домен распознавания или элиминации. В некоторых вариантах осуществления домен распознавания или элиминации представляет собой домен распознавания одобренного биопрепарата на основе моноклонального антитела. В некоторых вариантах осуществления домен распознавания или элиминации включает полипептид, который распознается антителом, распознающим EGFR, или его эпитопом. В некоторых вариантах осуществления домен распознавания или элиминации включает полипептид, который распознается антителом, распознающим MYC, или его эпитопом.
[898] В любом из аспектов и вариантов осуществления, представленных в данном документе, который содержит полинуклеотиды, которые включают последовательность нуклеиновой кислоты, кодирующую химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток, первая последовательность нуклеиновой кислоты и/или вторая последовательность нуклеиновой кислоты может быть функционально связана с первым промотором, активным в В-клетках, Т-клетках и/или NK-клетках. В некоторых иллюстративных вариантах осуществления первый промотор активен в Т-клетках и/или NK-клетках.
[899] В варианте осуществления любого из аспектов и вариантов выделенного полинуклеотида, представленных в данном документе, имеющих последовательность нуклеиновой кислоты, которая кодирует химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток, линкер может присутствовать между трансмембранным доменом и первым внутриклеточным доменом и/или между первым внутриклеточным доменом и вторым внутриклеточным доменом для вариантов полинуклеотидов, которые содержат второй внутриклеточный домен. В некоторых вариантах осуществления линкер, содержащий от 1 до 4 аланинов, присутствует между внеклеточным доменом и трансмембранным доменом для вариантов осуществления, включающих внеклеточный домен.
[900] В одном варианте осуществления любого из аспектов и вариантов выделенного полинуклеотида или вектора, представленных в данном документе, который содержит первую последовательность нуклеиновой кислоты, которая кодирует химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток, и вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен, первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты могут быть разделенными последовательностью с рибосомным проскоком. В некоторых вариантах осуществления последовательность с рибосомным проскоком представляет собой F2A, E2A, P2A или T2A.
[901] В варианте осуществления любого из аспектов выделенного полинуклеотида и вариантов осуществления, представленных в данном документе, которые кодируют химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток, указанный полинуклеотид дополнительно содержит одно или несколько из последовательности типа Козак, элемента WPRE и двойного стоп-кодона или тройного стоп-кодона, при этом один или несколько стоп-кодонов двойного стоп-кодона или тройного стоп-кодона определяют завершение считывания по меньшей мере одного из одной или больше транскрипционных единиц. В некоторых вариантах осуществления полинуклеотид дополнительно содержит последовательность типа Козак, выбранную из CCACCAUG(G), CCGCCAT/UG(G), GCCGCCGCCAT/UG(G) или GCCGCCGCCAT/UG. В определенных вариантах осуществления как -3, так и +4 нуклеотиды относительно стартового кодона первой последовательности нуклеиновой кислоты содержит G. В другом варианте осуществления, который может быть объединен с предыдущим вариантом осуществления, который содержит последовательность типа Козак и/или в следующем варианте осуществления, который содержит тройной стоп-кодон, полинуклеотид включает элемент WPRE. В некоторых вариантах осуществления элемент WPRE расположен с 3' конца стоп-кодона одной или нескольких транскрипционных единиц и от 5' к 3' LTR полинуклеотида. В другом варианте осуществления, который можно комбинировать с одним или обоими из предшествующих вариантов (т.е. с вариантом, в котором полинуклеотид содержит последовательность типа Козак, и/или с вариантом осуществления, в котором полинуклеотид содержит WPRE), одна или несколько единиц транскрипции оканчиваются одним или несколькими стоп-кодонами двойного стоп-кодона или тройного стоп-кодона.
[902] В одном аспекте в данном документе представлен вектор нуклеиновой кислоты, содержащий
выделенный полинуклеотид любого из аспектов и вариантов выделенного полинуклеотида, представленных в данном документе, который кодирует химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток,
a. точку начала репликации;
b. ген устойчивости к антибиотикам; и/или
c. одну или несколько вирусных и/или ретровирусных последовательностей, выбранных из ретровирусного длинного концевого повтора (LTR) или его активного фрагмента, ретровирусного цис-действующего элемента упаковки РНК и/или элемента ретровирусного центрального полипуринового тракта/центральной терминирующей последовательности (CTS).
[903] В некоторых вариантах осуществления этого аспекта вектор представляет собой плазмиду. В других вариантах осуществления вектор представляет собой не способный к репликации вирусный вектор, например, не способный к репликации ретровирусный вектор или частицу. В этих вариантах осуществления не способный к репликации ретровирусный вектор или частица может содержать 5' ретровирусный LTR или его активный фрагмент, ретровирусный цис-действующий упаковывающий элемент РНК и 3' ретровирусный LTR или его активный фрагмент, при этом 5' фрагмент ретровирусный LTR и 3' ретровирусный LTR фланкируют выделенный полинуклеотид. В некоторых вариантах осуществления указанный выделенный полинуклеотид имеет обратную ориентацию по отношению к последовательности нуклеиновой кислоты, кодирующей ретровирусный цис-действующий упаковывающий элемент РНК, 5' длинный концевой повтор и/или трехкратный конец терминального повтора.
[904] В некоторых аспектах в данном документе представлена не способная к репликации рекомбинантная ретровирусная частица, содержащая ретровирусный геном, включающий любой из аспектов и вариантов осуществления в данном документе, который содержит выделенный полинуклеотид, который содержит первую последовательность нуклеиновой кислоты, которая кодирует химерный полипептид, который способствует пролиферации клеток PBMC, B клетки, Т-клетки и/или NK-клетки, и дополнительно содержащие капсид и оболочку. Ретровирусная частица может дополнительно содержать любой из ретровирусных элементов, изложенных в настоящем изобретении. В одном варианте осуществления ретровирусный геном дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В некоторых вариантах осуществления первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты могут быть разделены последовательностью с рибосомным проскоком. В некоторых вариантах осуществления последовательность с рибосомным проскоком представляет собой F2A, E2A, P2A или T2A. В этих вариантах осуществления первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты обычно находятся в одной и той же транскрипционной единице.
[905] В другом аспекте в данном документе представлена клетка млекопитающего, при этом указанная клетка млекопитающего, например, клетка человека, представляет собой В-клетку, Т-клетку или NK-клетку, содержащую выделенный полинуклеотид, который необязательно может быть интегрирован в геном клетки, в соответствии с любым аспектов и вариантов осуществления в данном документе, которые содержат выделенный полинуклеотид, который содержит первую последовательность нуклеиновой кислоты, кодирующую химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток. В некоторых вариантах осуществления выделенный полинуклеотид в клетке млекопитающего дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В некоторых вариантах осуществления первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты могут быть разделены последовательностью с рибосомным проскоком. В некоторых вариантах осуществления последовательность с рибосомным проскоком представляет собой F2A, E2A, P2A или T2A. В этих вариантах осуществления первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты обычно находятся в одной и той же транскрипционной единице. В некоторых вариантах осуществления клетка представляет собой Т-клетку или NK-клетку, а в некоторых иллюстративных вариантах осуществления клетка представляет собой человеческую Т-клетку.
[906] В другом аспекте в данном документе представлена пакующая клетка, содержащая выделенный полинуклеотид согласно любому из аспектов и вариантов осуществления в данном документе, который включает выделенный полинуклеотид, который необязательно может быть интегрирован в геном клетки, который содержит первую последовательность нуклеиновой кислоты, которая кодирует химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, T-клеток и/или NK-клеток. В некоторых вариантах осуществления выделенный полинуклеотид в клетке дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. В некоторых вариантах осуществления первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты могут быть разделены последовательностью с рибосомным проскоком. В некоторых вариантах осуществления последовательность с рибосомным проскоком представляет собой F2A, E2A, P2A или T2A. В этих вариантах осуществления первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты обычно находятся в одной и той же транскрипционной единице. В некоторых вариантах осуществления клетка представляет собой клетку, представленную в данном документе для создания ретровирусных частиц.
[907] В одном аспекте в данном документе представлен способ стимулирования пролиферации клеток PBMC, например, B-клетки, T-клетки и/или NK-клетки, включающий трансдукцию и/или генетическую модификацию клетки вектором, кодирующим элемент лимфопролиферации, и в иллюстративных вариантах осуществления химерный полипептид согласно любому из вариантов осуществления, представленных в данном документе, при этом химерный полипептид способствует пролиферации PBMC. Способ может включать культивирование клетки в течение по меньшей мере 7, 14, 21, 28, 35, 42 или 60 дней. Обычно это культивирование проводят в отсутствие IL-2, например, после трансдукции средой, которая может включать IL-2 в некоторых вариантах осуществления.
[908] В одном аспекте в данном документе представлен способ трансфекции, трансдукции и/или генетической модификации В-клетки, Т-клетки и/или NK-клетки, которые в некоторых неограничивающих вариантах осуществления могут быть аллогенной клеткой, аутологичной клеткой или клетой, отличной от аллогенной клетки, включающий приведение в контакт клетки с выделенным полинуклеотидом в соответствии с любым из аспектов и вариантов осуществления в данном документе, который содержит выделенный полинуклеотид, который содержит первую последовательность нуклеиновой кислоты, которая кодирует химерный полипептид, который способствует пролиферации клеток PBMC, B-клеток, Т-клетки и/или NK-клетки (аспекты и варианты осуществления CLE). В некоторых вариантах осуществления этого аспекта способа клетка представляет собой Т-клетку, и выделенный полинуклеотид дополнительно содержит вторую последовательность нуклеиновой кислоты, которая кодирует химерный антигенный рецептор (CAR), содержащий антигенспецифическую нацеленную область (ASTR), трансмембранный домен и внутриклеточный активирующий домен. Другими словами, способ трансфекции, трансдукции и/или генетической модификации В-клетки, Т-клетки и/или NK-клетки может включать приведение в контакт клетки с выделенными полинуклеотидами согласно любому из вариантов осуществления CLE или CLE CAR в данном документе. В некоторых вариантах осуществления первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты могут быть разделены последовательностью с рибосомным проскоком. В некоторых вариантах осуществления последовательность с рибосомным проскоком представляет собой F2A, E2A, P2A или T2A. В этих вариантах осуществления первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты обычно находятся в одной и той же транскрипционной единице. В некоторых вариантах осуществления клетка представляет собой Т-клетку или NK-клетку, а в некоторых иллюстративных вариантах осуществления клетка представляет собой человеческую Т-клетку. Приведение в контакт осуществляется в эффективных условиях для трансфекции, трансдукции и/или генетической модификации клетки. В некоторых вариантах осуществления выделенный полинуклеотид во время приведения в контакт находится внутри вектора согласно любому аспекту вектора и вариантам осуществления, представленным в данном документе. В некоторых вариантах осуществления выделенный полинуклеотид находится в не способной к репликации ретровирусной частице во время контакта.
[909] В некоторых вариантах осуществления любого из аспектов в данном документе NK-клетки являются NKT-клетками.
[910] Следующие ниже неограничивающие примеры представлены исключительно для иллюстрации иллюстративных вариантов осуществления и никоим образом не ограничивают объем и сущность настоящего изобретения. Кроме того, следует понимать, что любые изобретения, раскрытые или заявленные в данном документе, охватывают все варианты, комбинации и перестановки любого одного или нескольких признаков, описанных в данном документе. Любая одна или несколько характеристик могут быть явно исключены из формулы изобретения, даже если конкретное исключение явно не изложено в данном документе. Также следует понимать, что раскрытие реагента для применения в способе должно быть синонимом (и обеспечивать поддержку) этого способа, включающего применение этого реагента, либо в соответствии с конкретными способами, раскрытыми в данном документе, либо другими способами, известными в данной области, если обычный специалист в данной области не поймет иначе. Кроме того, если описание и/или формула настоящего изобретения раскрывают способ, в способе могут быть использованы любой один или несколько реагентов, раскрытых в данном документе, если только специалист в данной области не поймет иначе.
ПРИМЕРЫ
Пример 1. Создание рибопереключателей, которые специфически реагируют на противовирусные лекарственные средства на основе нуклеозидных аналогов
[911] В этом примере представлен способ скрининга библиотек на основе естественных структурных рибопереключателей, связывающих гуанозин и дезоксигуанозин. Эти рибопереключатели использовали в качестве каркаса для разработки смещенных библиотек для отбора аптамеров, которые специфически связываются с нуклеозидым аналогом лиганда. Ранее калориметрию изотермического титрования использовали, чтобы показать, что эти природные рибопереключатели связываются со своими природными лигандами. Дополнительные тесты показали, что переключатель дезоксигуанозина также слабо взаимодействует с нуклеозидными аналогами ацикловиром и пенцикловиром, что привело к повторному дизайну этой последовательности в новую библиотеку. Одноцепочечные области рибопереключателя нацеливали на мутации, и выбирали варианты последовательностей, которые специфически реагируют на ацикловир или пенцикловир.
Материалы
[912] Компоненты для селекции гуанина, гуанозина, дезоксигуанозина, ацикловира и пенцикловира заказывали в компании Sigma-Aldrich (Сент-Луис, Миссури). Первоначальной целью был ацикловир, в то время как пенцикловир представлял особый интерес как аналит, используемый в последних раундах, а гуанин, гуанозин и дезоксигуанозин использовали в качестве контр-мишеней. Оксид графена (GrO), который будет использоваться в качестве разделяющей среды, приобретали в Angstron Materials (Дейтон, Огайо). HEPES (pH 7,3) и MgCl2 приобретали в Amersco LLC. (Солон, Огайо). KCl приобретали в Teknova (Холлистер, Калифорния). Буфер для отбора готовили при 5X (1X как 50 мМ HEPES, 100 мМ KCl, 20 мМ MgCl2, pH 7,3). Мишени, контр-мишени и олигонуклеотиды восстанавливали в воде, свободной от нуклеаз, для предварительного анализа и скрининга аптамеров. Для всех мишеней готовили аликвоты и хранили при -20 °C для максимального увеличения срока годности.
Создание библиотеки аптамеров
[913] Исходную матрицу библиотеки аптамеров синтезировали IBA GmbH (Геттинген, Германия) как обратный комплемент последовательностей на Фиг. 14. На Фиг. 14 нуклеотиды в прямоугольниках являются одноцепочечными в известных последовательностях с «мутациями», введенными во время синтеза, чтобы обеспечить лучшее связывание с аналогами исходных мишеней. Для нуклеотидов в прямоугольниках, обведенных сплошными линиями, допускали заменяющие мутации; для нуклеотидов в прямоугольниках, обведенных пунктирными линиями, допускали заменяющие мутации, а также вставки или делеции. Праймеры синтезировали IDT (Коралвилл, Айова) в виде одноцепочечной ДНК. Праймер Т7 (SEQ ID NO: 240) объединяли с матричными последовательностями библиотеки для удлинения праймера с помощью ДНК-полимеразы Titanium Taq (Clontech; Маунтин-Вью, Калифорния). Материал с удлиненным праймером транскрибировали с использованием набора для транскрипции Ampliscribe T7 High Yield Transcription Kit (Epicenter; Мадисон, Висконтин), а затем очищали электрофорезом в 10% денатурирующем полиакриламидном геле (PAGE) с 8 М мочевиной перед использованием в селекции. Во время отбора библиотеку подвергали обратной транскрипции с использованием обратной транскриптазы SuperScript IV (Invitrogen; Карлсбад, Калифорния) с использованием обратного праймера (SEQ ID NO: 241) и амплифицировали с использованием ДНК-полимеразы Titanium Taq (Clontech; Маунтин-Вью, Калифорния). Аптамер с SEQ ID NO: 248 имел вариацию петли J2-3 от -3 до -1 и разнообразие ~ 2,25 × 1010. Аптамер с SEQ ID NO: 250 имел вариацию петли J2-3 от 0 (нативная) до +5 и разнообразие ~ 9,38 × 1410. Два олигонуклеотида (SEQ ID NO: 249 и 250) смешивали в соотношении 1:4160 для получения эквимолярного разнообразия в объединенном пуле библиотеки с общим разнообразием ~ ~ 9,38 × 1013.
Скрининг библиотеки
[914] Скрининг библиотеки проводили с использованием подхода на основе систематической эволюции лигандов с использованием оксида графена путем экспоненциального обогащения (GO-SELEX) (Фиг. 15) (Park et al., 2012), используя преимущество π-π взаимодействия, которое придает оксиду графена высокую аффинность к одноцепочечным нуклеиновым кислотам (Zeng et al., 2015). Цель состояла в том, чтобы выбрать последовательности, которые не взаимодействовали с 1X-селективным буфером или контр-мишенями (гуанин, гуанозин и дезоксигуанозин), но связывались с положительной мишенью ацикловиром.
[915] Для каждого раунда заданное количество библиотеки сначала повторно укладывали в 1X буфере для отбора (5-минутная денатурация при 90 °C, 5 минут при 4 °C, затем комнатная температура). Затем контр-мишени добавляли в повторно свернутые библиотеки и инкубировали в течение 30 минут при 37 °C. Исключением были раунды 1 и 2, в которых контр-мишени включали только на короткое время (<1 минуты), чтобы помочь загрузить библиотеку в GrO. После того, как библиотека могла взаимодействовать с контр-мишенями и компонентами буфера, несвязанную библиотеку загружали в GrO (масса, равная 100-кратной массе библиотеки в начале цикла) в течение 10-минутной инкубации при 37 °C. Затем раствор центрифугировали при 7000 x g для осаждения GrO. Супернатант, который содержал последовательности, связанные с контр-мишенями и/или с буфером, удаляли. Осадок затем дважды промывали 200 мкл 1X буфера для отбора, центрифугировали при 7000 x g и удаляли супернатант после каждой промывки. Затем добавляли раствор, содержащий положительную мишень, и позволяли элюировать библиотеку из GrO в условиях, указанных в Табл. 1, в течение до 60 минут при 37 °C, по сути позволяя мишени конкурировать с оксидом графена за связывание библиотеки. Последовательности, которые более прочно связаны с мишенью, десорбируются с оксида графена и остаются связанными с мишенью в конце инкубации. На заключительной стадии центрифугирования выделившийся материал, расположенный в супернатанте, отделился от нечувствительной библиотеки, которая осталась связанной с оксидом графена.
[916] После положительного отбора выделенную РНК, очищенную с использованием 10% денатурирующего PAGE с 8 М мочевиной, затем количественно определяли с использованием считывания спектрофотометра (Табл. 1), подверглали обратной транскрипции с помощью SuperScript IV и амплифицировали с использованием ПЦР с ДНК-полимеразой Titanium Taq. Продукты амплификации транскрибировали в РНК для следующего раунда отбора.
[917] В ходе отбора реализовывали три уровня строгости (Табл. 1). Первые два раунда отбора не включали скрининг против контр-мишеней, чтобы максимизировать загрузку библиотеки на GrO. Кроме того, при положительных инкубациях использовали большой избыток ацикловира, чтобы максимизировать восстановление библиотеки, поэтому это обозначение низкой строгости. Инкубации контр-мишеней проводили после восстановления библиотеки в виде условий средней строгости. Отношение ацикловира к библиотеке также снижали в течение этих трех раундов, чтобы повысить конкуренцию библиотек за связывание с мишенью. После достижения более 10% извлечения проводили заключительные раунды отбора с высокой степенью строгости. Соотношение контр-мишени/библиотеки оставалось высоким, а соотношение положительная мишень/библиотека доводили до 1:1, в то время как положительное время инкубации сокращали для отбора последовательностей более быстрого связывания. Когда было показано, что восстановление библиотеки остается более 10% после более чем двух раундов условий высокой строгости, проводили параллельные оценки.
(строгость)
(30-мин. инкубация)
инкубации (мин.)
Таблица 1. Условия отбора и оценки. Условия, используемые для каждого цикла отбора или инкубации, с восстановлением в виде соотношения между восстановленным образцом и входной библиотекой для каждого раунда. Пополнение библиотеки контролировали в процессе отбора. *Контр-мишени используются для загрузки, а не для продолжительной инкубации. †Инкубация перед загрузкой проводится с объединенными контр-мишенями. ‡ Инкубация перед загрузкой проводилась с положительной мишенью ацикловиром. Это было сделано, чтобы свести к минимуму извлечение перекрестно-реактивных частиц. В этой таблице используются следующие сокращения: «X-мишени» представляют собой контр-мишени; «(+) мишень» представляет собой ацикловир или пенцикловир; «(+) время инкубации (мин.)» представляет собой время, в течение которого раствор «библиотека:(+) мишень» инкубировали на GrO. G0 представляет собой поколение 0 и так далее; R1 представляет собой раунд 1 и так далее. Для параллельной оценки (параллель 1 и параллель 2) инкубации проводили с: только (-) 1X буфер для отбора, (X) контр-мишени в 1X буфере для отбора, (+) ацикловир в 1X буфере для отбора и (P) пенцикловир в 1X буфере для отбора.
[918] Для двух параллельных оценок оцениваемую библиотеку разделяли на четыре равные части для подготовки и повторной укладки, как указано выше (Фиг. 16). Для каждого условия 50 пмолей библиотеки объединяли с 1Х буфером для отбора, повторно сворачивали (90 °C в течение 5 минут, 4 °C в течение 5 минут), а затем инкубированы с 200 мкл 10 мкМ объединенных контр-мишеней в 1Х буфере для отбора в течение 30 минут при 37 °C. Затем эти образцы загружали в количество оксида графена, в 100 раз превышающее массу библиотеки в образце, и инкубировали в течение 10 минут при 37 °C, а затем дважды промывали 200 мкл 1Х буфера для отбора, как и раньше. Затем загруженные образцы оксида графена инкубировали параллельно с 200 мкл соответствующего условия оценки (только 1X буфер для отбора, 10 мкМ объединенных контр-мишеней, 1 мкМ пенцикловира, 1 мкМ ацикловира для первой параллельной оценки или 0,5 мкМ ацикловира для второй параллельной оценки; в Табл. 1 эти условия показаны как: (-); (X); (P); (+); и (+) соответственно) в 1X буфере для отбора в течение 30 минут при 37 °C. На заключительной стадии центрифугирования десорбированную чувствительную библиотеку отделяли от невосприимчивой библиотеки, связанной с оксидом графена. Чувствительные библиотеки количественно определяли с использованием спектрофотометрического считывания (Таблица 1), проверяли с использованием 10% денатурирующего PAGE с 8 М мочевиной и подготовливали для второй параллельной оценки. Эту последующая оценка продолжала использовать контр-мишени для предварительной инкубации положительного образца, но использовала положительную мишень ацикловир для предварительной инкубации образцов друг с другом. Это делали для того, чтобы свести к минимуму представление перекрестно-реактивных последовательностей в данном образце (т.е. восприимчивые к контр-мишеням в положительном образце, восприимчивые к ацикловиру в отрицательном образце, контр-мишеням или пенцикловиру). Материал, извлеченный из второй параллельной оценки, количественно определяли с использованием спектрофотометрического считывания (Табл. 1), проверяли с использованием 10% денатурирующего PAGE с 8 М мочевиной и подготовливали для секвенирования с помощью обратной транскрипции и ПЦР для получения двухнитевой ДНК.
Секвенирование
[919] Исходную библиотеку подвергали более чем 10 раундам отбора и параллельной оценки на основе GrO (Табл. 1). Процесс GO-SELEX разрабатывли для обогащения последовательностей в течение нескольких раундов отбора, которые связываются с заданными мишенями, представляющими интерес, и удаляют последовательности, которые связываются с нецелевыми соединениями или компонентами буфера. В результате ожидается, что популяции, подлежащие секвенированию, будут содержать несколько копий потенциальных кандидатов в аптамеры.
[920] Систему Illumina MiSeq (Сан-Диего, Калифорния) применяли для секвенирования библиотек аптамеров после параллельной оценки с использованием методики одностороннего чтения. Глубокое секвенирование и последующий анализ данных сокращают количество раундов скрининга, которые требует традиционный SELEX, что может привести к ошибкам и систематической ошибке из-за процесса скрининга (Schütze et al., 2011). Были секвенированы пять образцов: библиотека последнего поколения, которая отвечала на ацикловир, библиотека последнего поколения, которая отвечала на контр-мишени, библиотека последнего поколения, которая отвечала на 1X буфер для отбора (отрицательное состояние), библиотека предпоследнего поколения, которая отвечала на ацикловир, и библиотека последнего поколения, которая отвечала на дополнительную мишень, представляющую интерес, пенцикловир. Из этих наборов данных строили семейства последовательностей с 95% гомологией (сходство последовательностей с учетом мутаций, делеций и вставок) для идентификации кандидата в аптамер. Имелось 1711535 первичных последовательностей (124600 уникальных последовательностей) из библиотеки, которые отвечали на ацикловир, и 2074832 первичных последовательности (110149 уникальных последовательностей) из библиотеки, которые отвечали на пенцикловир.
Выбор кандидатов в аптамеры
[921] Конструирование семейств последовательностей сосредоточено в первую очередь на сходстве последовательностей. Это означает, что частота последовательности в популяции положительной мишени была учтена, но больший акцент был сделан на степени вариации между схожими последовательностями, при этом 95% гомологии является минимальным требованием (100% совпадение по всей последовательности не обязательно для присоединения к семейству, до 2 оснований могут быть ошибочно спарены, вставлены или удалены). Следовательно, можно было бы ожидать, что семейства с наибольшим числом представителей будут высоко ранжироваться как кандидаты в аптамеры. После создания семейств можно рассмотреть относительное присутствие семейства в данной популяции - семейства, которые часто встречаются в отрицательных популяциях и популяциях контр-мишеней, считаются более слабыми кандидатами, поскольку они демонстрируют степень неспецифического взаимодействия при связывании с буферными компонентами или компонентами контр-мишеней. Кроме того, семейства, которые демонстрируют высокий уровень обогащения (т.е. большое соотношение между конечной положительной популяцией и предпоследней положительной популяцией), повышают свою кандидатуру, поскольку уровень обогащения был связан с аффинностью связывания кандидата по отношению к остальной части популяции (Levay et al., 2015; Wang et al., 2014). В этих условиях несколько семейств кандидатов оказались сильными кандидатами на связывание ацикловира (Табл. 2) и пенцикловира.
где N в положении 5 может представлять собой C, G или отсутствие нуклеотида, N в положении 6 может представлять собой A, C, G, T или отсутствие нуклеотида, и N в положении 45 может представлять собой A или отсутствие нуклеотида.
где N в положении 5 может представлять собой C или отсутствие нуклеотида, N в положении 40 может представлять собой T или отсутствие нуклеотида, и N в положении 44 может представлять собой C, G, T или отсутствие нуклеотида.
где N в положении 43 может представлять собой G, T или отсутствие нуклеотида.
где N в положении 4 может представлять собой G или отсутствие нуклеотида, N в положении 5 может представлять собой C, G, T или отсутствие нуклеотида, и N в положении 44 может представлять собой A, C, G или отсутствие нуклеотида.
Таблица 2. Кандидаты на связывание ацикловира и пенцикловира. Последовательности ДНК, соответствующие не стволовым областям рибопереключателей РНК, связывающих ацикловир. При скрининге идентифицировали семь семейств: 582, 769, 795, 935, 946, 961 и 996 с 1-39 последовательностями в каждом семействе. Процент идентичности для каждой последовательности в семействе сравнивали с наиболее распространенной последовательностью в каждом семействе (582-1, 769-1, 795-1, 935-1, 946-1, 961-1 и 996-1). Процент идентичности для каждой последовательности в семействе также сравнивали с последовательностью дикого типа.
[922] Положительная мишень ацикловир приводила к образованию семи сильных кандидатов (SEQ ID NO: 87-93; последовательности РНК, включая участки стебля), соответствующие 582-1 (SEQ ID NO: 108), 769-1 (SEQ ID NO: 147), 795-1 ( SEQ ID NO: 164), 935-1 (SEQ ID NO: 183), 946-1 (SEQ ID NO: 198), 961-1 (SEQ ID NO: 220) и 996-1 (SEQ ID NO: 221), каждая из которых обозначена как F1A (Фиг. 17). Эти последовательности были наиболее распространенными последовательностями в каждом семействе (последовательности ДНК всех представителей каждого семейства: 582 (SEQ ID NO: 108-146); 769 (SEQ ID NO: 147-163); 795 (SEQ ID NO: 164-182); 935 (SEQ ID NO: 183-197); 946 (SEQ ID NO: 198-219); 961 (SEQ ID NO: 220); и 996 (SEQ ID NO: 221)). Консенсусные последовательности показывают все возможные замены или гэпы в каждом положении нуклеотида для каждого семейства (SEQ ID NO: 222-226). Поскольку цель состояла в том, чтобы идентифицировать аптамеры из библиотеки на основе РНК, которая, как известно, связывается с дезоксигуанозином, сильные кандидаты должны были иметь минимальное присутствие в популяции контр-мишеней. Кандидаты F1A-795, F1A-935 и F1A-946 очень хорошо отвечали этому критерию, поскольку они не были обнаружены в популяции контр-мишеней. F1A-996 и F1A-961 считаются следующими наиболее эффективными кандидатами в этом отношении, хотя они в незначительной степени проявляются в популяции контр-мишеней. Кроме того, кандидаты должны минимально появляться в отрицательной популяции, поскольку эти последовательности десорбируются из GrO без влияния ацикловира и могут представлять собой ложноположительные результаты. F1A-935 и F1A-946 также идеально функционировали по этому критерию, поскольку их не обнаруживали в отрицательной популяции. Кандидата F1A-769 минимально обнаруживали в отрицательной популяции, кандидаты F1A-961, F1A-795 и F1A-996 функционировали менее эффективно. Степень обогащения была последним условием, которое необходимо было рассмотреть для адекватного функционирования F1A-935, F1A-946 и F1A-769. Кандидата F1A-582 включали, поскольку он демонстрировал самый высокий уровень обогащения, хотя он не функционировал эффективно по другим критериям. Остальные кандидаты не продемонстрировали хороших результатов по сравнению с этими четырьмя, но продемонстрировали приемлемые характеристики.
[923] Дополнительная мишень пенцикловир приводила к образованию семи сильных кандидатов (SEQ ID NO: 94-100), каждый из которых обозначен как F1P (Фиг. 18). Как и прежде, цель состояла в том, чтобы идентифицировать аптамеры из библиотеки на основе РНК, которая, как известно, связывается с дезоксигуанозином, в отличие от библиотек, обогащенных для связывания с ацикловиром (ацикловира) после раунда 10. Сильные кандидаты должны иметь минимальное присутствие как в ацикловире, так и в популяции контр-мишеней, чтобы свести к минимуму перекрестную реактивность. Кандидат F1P-923 отвечал первому критерию, кандидат F1P-710 отвечал второму критерию, а кандидат F1P-584 в определенной степени соответствовал обоим критериям. Кандидат F1P-584 также продемонстрировал умеренное предпочтение пенцикловира по сравнению с отрицательным условием, а также умеренное обогащение по сравнению с реакцией предыдущего поколения на ацикловир. Остальные кандидаты продемонстрировали либо минимальное предпочтение пенцикловира по сравнению с ацикловиром, либо минимальное предпочтение пенцикловира по сравнению с контр-мишенями (F1P-837 и F1P-932; F1P-991 и F1P-718; соответственно). Эти четыре кандидата продемонстрировали некоторое предпочтение пенцикловира по сравнению с отрицательным условием, что сводит к минимуму вероятность ложноположительного результата, хотя этот критерий не так важен, если кандидат не демонстрирует селективность в отношении пенцикловира по сравнению с его аналогами. Степень обогащения была последним условием, которое необходимо было рассмотреть для адекватного функционирования F1P-923, F1P-932 и F1P-584.
[924] Проводили качественную оценку выбранных аптамеров с помощью PAGE. Индивидуально синтезированные и транскрибируемые аптамеры подвергали селекции на оксиде графена (GrO) в условиях физиологического Mg++ (0,5 мМ) и элюции ацикловиром (+) или контр-мишенями (x). Специально элюированные фракции аптамера для каждого образца подвергали PAGE для анализа.
[925] 100 пмолей каждого кандидата в аптамер (на испытание/дорожку) ресуспендировали в 1X модифицированном буфере для отбора (50 мМ HEPES, 100 мМ KCl, 0,5 мМ MgCl2, pH 7,3) и повторно укладывали (90 °C в течение 5 минут, затем 4 °C в течение 5 минут), затем инкубировали при 37 °C в течение 30 минут с 200 пмолями (каждого) из объединенных контр-мишеней или мишеней. Конечная концентрация библиотеки составляла 0,5 мкМ, концентрация мишени/контр-мишени составляла 1 мкМ (инкубационный объем составлял 200 мкл).
[926] После инкубации мишени/контр-мишени 250 мкг GrO (Angstron Materials (Дейтон, Огайо)) добавляли для адсорбции несвязанного кандидата (10-минутная инкубация при 37 °C).
[927] Образцы центрифугировали в течение 5 минут при 7000 x g. Супернатант собирали, денатурировали, используя 2X формамид с 40 мМ EDTA, и проводили 10% денатурирующий PAGE с 8 M мочевиной (поставщик: American Bioanalytical; каталожный № AB13022-01000). Рабочий буфер представлял собой 1X TBE (поставщик: Amresco/VWR; каталожный № 0658-20L, разведенный деионизированной водой). Лестница ДНК представляла собой лестницу ДНК 20/100 (IDT). Гели окрашивали Gel Star (Lonza, 50535) и отображали на трансиллюминаторе синего света.
[928] Кандидаты F1A-769, F1A-795, F1A-946 и F1A-996, по-видимому, демонстрируют селективный положительный ответ в этой качественной оценке PAGE (хорошее элюирование аптамера из GrO с помощью мишени ацикловира и относительно более низкое или минимальное элюирование с контр-мишенями).
Вывод
[929] Сильных кандидатов в отношении ацикловира выявляли после двенадцати раундов итеративного скрининга и параллельной оценки; подходящих кандидатов в отношении пенцикловира определяли после двух раундов скрининга и параллельной оценки.
Пример 2. Выделение условных scFv
[930] Потенциальные сайты сплайсинга удаляют, и scFv, специфичные к опухолевому антигену, синтезируют путем перекрывающегося синтеза олигонуклеотидов и клонируют в конструкцию челнока CAR, содержащую чувствительный к ацикловиру элемент и промотор CD3ζ приматов. В качестве начального прототипа используют антитело к ECD EPCAM или ERBB2scFv с сигнальным пептидом CD8-альфа, стеблем и трансмембранным доменом. Продукты CAR с ограниченным микроокружением солидной опухоли получают либо с использованием способов, описанных в патенте США № 8709755 и публикации РСТ № WO/2016/033331A1, либо путем прямого отбора из фаговых библиотек человека в допустимых и недопустимых условиях. Вкратце, человеческая библиотека VH x VL от Creative Biolabs (Ширли, Нью-Йорк) подвергается панорамированию в следующих условиях, допускающих опухоль: 100 мкг/мл гиалуронана, фракция 100 кДа (Lifecore Biomedical, Часка, Миннесота), 20 мг/мл рекомбинантного HSA (Cyagen, Санта-Клара, Калифорния), 200 нг/мл рекомбинантного человеческого VEGF в 25 мМ натрий-бикарбонатном буфере, 2 мкМ аденозина, 10 мМ лактата натрия, pH 6,7, после очистки от стрептавидиновых магнитных гранул (ThermoFisher, Карлсбад, Калифорния), связанных с биотинилированным человеческим IgG. Связывание с ECD биотинилированного рецептора-мишени гранул, конъюгированных с EPCAM и ERBB2, при 37 °C проводят в допустимых условиях с последующими последовательными отмывками в допустимых условиях. Фаг высвобождается в физиологических условиях (1 мкг/мл гиалуронана, 20 мг/мл HSA, 25 мМ бикарбоната, 1 мМ лактата натрия, pH 7,2) с последующей элюцией плотных вариантов кислотной элюцией и быстрой нейтрализацией 1 М Tris. Фаги размножают, а геномную ДНК расщепляют для глубокого анализа последовательностей цепей VH x VL с использованием длинного секвенирования (PacBio, Менло-Парк, Калифорния). Панорамирование можно повторять для обогащения. Последовательности VH x VL, демонстрирующие преимущественную амплификацию считываний во время процесса культивирования фага по сравнению с обогащением до мишени, исключаются для дальнейшего анализа. Фаг с селективным связыванием с мишенью, который обогащали в условиях, допускающих опухоль, но высвобождающийся в физиологических условиях, выбирают для дальнейшей характеристики путем клонирования в систему экспрессии конструкции CAR, образования лентивируса и трансдукции в Т-клетки для тестирования экспрессии CAR-опосредованного уничтожения целевых клеток, экспрессирующих опухолевый антиген, в селективной для опухоли среде по сравнению с физиологическими условиями.
Пример 3. Создание MRB-CAR с использованием ограниченных микроокружением scFv
[931] Получали ограниченные микроокружением ASTR, которые создавали путем воздействия на последовательности VH и VL низкой селективности в отношении микроокружения с низким pH путем эволюции, как описано в заявке WO/2016/033331A1. Химерные антигенные рецепторы (CAR) для связывания одного из двух когнатных опухолевых антигенов, Target 1 или Target 2, с повышенной активностью при пониженном pH микроокружения опухоли по сравнению с микроокружением нормальной ткани MRB-CARs создавали путем включения тяжелых цепей и легких цепей микроокружения, ограниченного одноцепочечными антитела, в лентивирусные векторы экспрессии вместе с другими доменами CAR для создания серии кандидатов MRB-CAR. Эти MRB-CAR включали в себя различные комбинации модулей. MRB-CAR включают от аминоконца до карбоксиконца в положениях с 1 по 9 сигнальный пептид CD8 (sp) (P1) (SEQ ID NO: 74); ограниченную микроокружением ASTR к Target 1 или ASTR к Target 2 (P2-P4); стебель и трансмембранный (TM) домен от CD8 (SEQ ID NO: 75) (P5) и костимулирующий домен от CD137 (P6) (SEQ ID NO: 1) в случаях T2A и T2B или стебель и трансмембранный (TM) домен из CD28 (SEQ ID NO: 76) (P5) и костимулирующий домен из ICΔ (SEQ ID NO: 3) (P6) в случае T1A; домен активации из CD3Z (SEQ ID NO: 13) (P7); последовательность с рибосомным проскоком 2A-1 (SEQ ID NO: 77) (P8); и иллюстративный eTAG (SEQ ID NO: 78) (P9).
[932] Все T-клетки (AllCells, Аламида, Калифорния) трансдуцировали рекомбинантными лентивирусными частицами для экспрессии серии кандидатов MRB-CAR, и процент трансдуцированных клеток рассчитывали путем определения процента клеток, экспрессирующих eTag, с использованием FACS. Все Т-клетки успешно трансдуцировали рекомбинантными лентивирусными частицами, кодирующими кандидаты MRB-CAR.
[933] Цитотоксическую активность кандидатов MRB-CAR против целевых клеток, экспрессирующих либо Тarget 1, либо Target 2 (СНО-Тarget 1 и СНО-Тarget 2 соответственно), анализировали при pH 7,4 (нормальная ткань) или pH 6,7 (сниженная pH микроокружения опухоли) с помощью системы xCELLigence (ACEA). Вкратце, целевые клетки, экспрессирующие Target 1 или Target 2, высевали в 96-луночный E-планшет из расчета 20000 клеток/лунк с условной для опухоли или нормальной средой за день до эксперимента. Эффекторные клетки выдерживали в течение двух дней в среде Т-клеток человека, содержащей 100 МЕ/мл IL-2, и добавляли в экспериментальные лунки, содержащие целевые клетки при соотношении эффекторные клетки/целевые клетки (E/T) 3:1, 1:1 и 0,3:1.
[934] Показания импеданса снимали каждые 5 минут в течение примерно 40 часов после добавления эффекторных клеток, а импеданс регистрировали как клеточный индекс (CI). Процент специфического цитолиза рассчитывали следующим образом ((CI мишень + контрольные трансдуцированные вирусом эффекторные Т-клетки) - (CI мишень + эффекторные Т-клетки, трансдуцированные CAR, направленные на Target 1 или Target 2))/(CI мишень + контрольные трансдуцированные вирусом эффекторные Т-клетки) × 100.
Результаты
[935] Многие из кандидатов MRB-CAR обладали более высокой цитотоксической активностью в отношении целевых клеток при pH 6,7, чем при pH 7,4. Иллюстративные MRB-CAR, которые были более эффективны при лизировании целевых клеток при pH 6,7, чем при pH 7,4, включали MRB-CAR T1A, MRB-CAR T2A и MRB-CAR T2B. ASTR MRB-CAR T1A включала от 5' до 3' VH MRB Target 1 (SEQ ID NO: 281) и VL MRB Target 1 (SEQ ID NO: 282), разделенные линкером 1 (SEQ ID NO: 283). ASTR MRB-CAR T2A включала от 5' до 3' VH MRB Target 2 (SEQ ID NO: 289) и VL MRB Target 2 (SEQ ID NO: 290), разделенные линкером 2 (SEQ ID NO: 291). ASTR MRB-CAR T2B была такой же, как и для MRB-CAR T2A, за исключением того, что положения VH и VL меняли местами.
Пример 4. Конструирование индуцируемых лигандами рибопереключателей
[936] Дезоксигуанозиновый рибопереключатель и аптамеры гуанинового рибопереключателя (Pikovskaya, 2014; Kim, 2007) или другие пуриновые рибопереключатели синтезируют в виде олигонуклеотидов. В одном примере дезоксигуанозиновый рибопереключатель IA из Mesoplasma florum (подчеркнут и выделен жирным шрифтом на Фиг. 6; Фиг. 7) выбирают для эволюции с целью создания чувствительного к ацикловиру рибопереключателя. В другом примере гуаниновый рибопереключатель xpt из Bacillus subtilis (подчеркнут и выделен жирным шрифтом на Фиг. 10; Фиг. 11) выбирают для эволюции с целью создания чувствительного к ацикловиру рибопереключателя. Для каждого из этих двух примеров генерируется случайная библиотека РНК с альтернативными нуклеотидами в положениях целевой последовательности в сегментах P2, P3, J1-2 и J2-3 (Фиг. 7 и 11). Каждый сегмент допускает наличие 3 альтернативных нуклеиновых кислот в каждом положении целевой последовательности или, в качестве альтернативы, делецию оснований и вставку 4 нуклеотидов в сайт +1 в каждом положении целевой последовательности для насыщающего мутагенеза, как показано на Фиг. 8A-8B и 9 (M. florum IA) и на Фиг. 12A-12B и 13 (B. subtilis xpt). Удлинение праймера и подготовка реагента сопровождаются транскрипцией РНК. Полученную библиотеку РНК отрицательно отбирают на оксиде графена в присутствии гуанина, гуанозина и дезоксигуанозина с последующим положительным отбором с ацикловиром или пенцикловиром. Во время процессов отрицательного и положительного отбора используют физиологические уровни магния в клетках человека (от 0,5 до 1,2 мМ), а температуру поддерживают на уровне 37 °C. Выделенные аптамеры подвергают обратной транскрипции и амплифицируют с помощью ПЦР с последующей транскрипцией и последующим скринингом по меньшей мере в течение 8 последовательных раундов отбора. При параллельном подходе аптамеры подвергают скринингу с помощью дополнительного отрицательного скриринга при 40 °C. Результирующие положительные пулы исследуют с помощью секвенирования и анализа NextGen. Индивидуальные аптамеры синтезируют и исследуют в отношении аффинности с помощью изотермической калориметрии при 35-40 °C при физиологических уровнях магния в клетках человека. После отбора на положительные аптамеры, специфичные для ацикловира и пенцикловира, аптамеры интегрируют с рибозимными рибозимами в форме головки молотка и пистолета. Положительные селективные аптамеры ацикловира комбинируют с рибозимами в форме пистолета для идентификации рибозимов, регулируемых ацикловиром. (Harris KA RNA. 2015 Nov;21(11):1852-8. doi: 10.1261/rna). Варианты подвергают очистке в PAGE на основе сдвига геля в присутствии ацикловира и в отсутствие пенцикловира. Кроме того, ациклогуанозиновый селективный рибопереключатель помещают сразу 3' в петлю к акцептору сплайсинга перед конструкцией CAR/IL-7. В отсутствие ацикловира положение сайта сплайсинга связано в комплексе рибопереключателя, но в присутствии ацикловира становится доступным, образуя функциональный транскрипт CAR.
Пример 5. Конструирование доменов размножения in vivo
[937] Серия трансмембранных мутантов конститутивно активного рецептора IL7 (IL7R) из Т-клеточных лимфобластных лейкозов (243 InsPPCL (SEQ ID NO: 82); 246 InsKCH (SEQ ID NO: 101); 241 InsFSCGP (SEQ ID NO: 102); 244 InsCHL (SEQ ID NO: 103); и 244 InsPPVCSVT (SEQ ID NO: 104); все из Shochat et al, 2011, J. Exp. Med. Vol. 208 No. 5 901-908) синтезируют путем перекрывающегося синтеза олигонуклеотидов (DNA2.0, Ньюарк, Калифорния). Синтезированные конститутивно активные трансмембранные мутанты IL7R вставляются в основную цепь конститутивно экспрессирующего лентивирусного вектора непосредственно за последовательностью с рибосомным проскоком 2A, за которой следует последовательность с рибосомным проскоком 2A, затем кассета экспрессии на основе CD3ζ к CD19, которая включает ствол снову CD8A (SEQ ID NO: 79) и лидерный пептид (SEQ ID NO: 74). Пакующие клетки HEK293 трансфицируют трансмембранными мутантными лентивирусными векторами IL7R и лентивирусными упаковывающими конструкциями, выращивают и собирают вирусные супернатанты с использованием способов, известных в данной области техники. CD3/CD28-стимулированные Т-клетки трансдуцируют вирусными супернатантами и выращивают в среде AIM V с дефицитом IL2, SFM CTS OpTmizer T Cell Expansion или X-VIVO 15 в течение 4 недель, еженедельно дополняя замороженными PBMC от того же донора. Полученные в результате размноженные трансдуцированные Т-клетки, экспрессирующие варианты IL7R, клонируют с помощью сортировки FACS, и последовательности конструкций IL7R идентифицируют путем секвенирования продуктов RT-PCR. Вариант 243 InsPPCL (PPCL) (SEQ ID NO: 82) выбирают для дальнейшей эволюции с целью создания условно активного CAR.
Пример 6. Скрининг дополнительных компонентов для активации и размножения CAR-T
[938] Серии кодирующих белок доменов (ABCG1, SOCS1, SMAD2, TGFBR2, cCBL и PD1) и последовательностей miRNA конструируют для включения в синтетический интрон на обратной цепи кассеты CAR, управляемой CD3-промотором. Каждая конструкция, содержащая кассету CAR, управляемую CD3-промотором, и белок-кодирующий домен или последовательность miRNA, включает уникальный баркод для глубокого секвенирования и собирается с использованием сборки Гибсона с последующей трансформацией и экспансией библиотеки в E. coli. Вирусные исходные материалы производят и используют для трансдукции CD3/CD28-стимулированных Т-клеток в среде AIM V, CTS OpTmizer T Cell Expansion SFM или X-VIVO 15 без IL2 и дают возможность расти в течение 4 недель в культуре с последовательным отбором образцов ДНК для амплификации и глубокого секвенирования для идентификации кода. Библиотеку также подвергают полноразмерному секвенированию PACBio для определения разнообразия библиотек и декодирования компонентов баркода. Последовательности miRNA и домены, кодирующие белок, тестируют в отношении синергетической активации доменов CD3ζ CAR.
Пример 7. Разработка системы упаковки и трансдукции ретровирусов для нацеливания на покоящиеся Т-клетки для селективной интеграции и экспрессии Т-клеток из PBMC
[939] Хотя получение лентивирусных векторов с высоким титром с помощью временной трансфекции возможно, этот способ несет в себе риск создания репликационно-компетентных ретровирусов (RCR) и не масштабируется для клинических вариантов применения. В данном случае стабильную линию ретровирусных пакующих клеток создают путем одновременного введения множества конструкций, кодирующих индуцибельные промоторы и их регуляторы, в адаптированные к суспензии клетки HEK293 (HEK293S) для стабильного продуцирования вирусных компонентов, генов CAR и их регуляторных компонентов. Две различные индуцибельные системы можно использовать для временного контроля экспрессии генов. Одна система основана на димеризации двух факторов транскрипции, вызванной рапамицином или рапалогом. Один фактор транскрипции состоит из трех копий белка FKPB, слитых с ДНК-связывающим доменом ZFHD1, а другой фактор транскрипции состоит из белка FRB, слитого с доменом активации p65. Рапамицин или рапалог димеризует факторы транскрипции с образованием ZFHD1/p65 AD и может активировать транскрипцию гена на сайтах связывания 12xZFHD1.
[940] Серию векторов, изображенных на Фиг. 3A-3E, создрают с фланкирующими последовательностями транспозонов для интеграции в геном HEK293S. После интеграции в геном клетки эти последовательности функционируют как регуляторные компоненты и сайты lox и/или FRT для последующей интеграции с использованием рекомбиназ Cre и/или flp, называемых в данном документе посадочными площадками. Первоначальные 5 конструкций содержат полинуклеотидные последовательности, кодирующие устойчивость к пуромицину, GFP, RFP и внеклеточную метку MYC, которая нацелена на клеточную мембрану с помощью N-концевого PLss (сигнальный пептид пролактина крупного рогатого скота) и закреплена на клеточной мембране с помощью С-концевого трансмембранного домен заякоривания рецептора тромбоцитарного фактора роста (PDGFR). Первоначальные 5 конструкций могут также включать конститутивные минимальные промоторы CMV и минимальные IL-2, промотор на основе ZFHD1, регулируемый рапамицином, промотор тетрациклин-чувствительного элемента (TRE) или двунаправленный промотор TRE (BiTRE). Конструкция на Фиг. 3А содержит полинуклеотидную последовательность, кодирующую домен FRB, слитый с доменом-активатором p65 NFκB (p65 AD), и ДНК-связывающий домен ZFHD1, слитый с тремя повторами FKBP, которые конститутивно экспрессируются. Конструкция на Фиг. 3A также содержит домен SrcFlagVpx REV HIV1 и VP65 HSV под индуцируемым рапамицином промотором ZFHD1/p65 AD. Конструкция на Фиг. 3B содержит полинуклеотид, кодирующий последовательность rtTA под контролем промотора ZFHD1/p65 AD. Конструкция на Фиг. 3С содержит полинуклеотид, кодирующий ген устойчивости к пуромицину, фланкированный сайтами loxP, и внеклеточную метку MYC, фланкированную сайтами lox2272. Оба из этих селектируемых маркеров находятся под контролем промотора BiTRE, фланкируемого сайтами FRT. Конструкция на Фиг. 3D содержит полинуклеотид, кодирующий GFP, фланкированный сайтами loxP, который находится под контролем промотора TRE. Конструкция на Фиг. 3D также включает один сайт FRT между промотором TRE и 5' сайтом loxP GFP. Конструкция на Фиг. 3E содержит полинуклеотид, кодирующий RFP, фланкированный сайтами loxP, который находится под контролем промотора ZFHD1/p65 AD. Конструкция на Фиг. 3E также содержит один сайт FRT между промотором AD ZFHD1/p65 и 5 -сайтом loxP RFP. Конструкции на Фиг. 3C-3E функционируют в качестве посадочных площадок для других полинуклеотидных последовательностей, которые подлежат вставке в геном линии пакующих клеток. Встраиваемые полинуклеотидные последовательности могут быть фланкированы сайтами lox и вставлены в геном с использованием рекомбиназы Cre и сайтов loxP. Это приводит к вставке и одновременному удалению геномных областей, кодирующих устойчивость к пуромицину, внеклеточную метку MYC, GFP и RFP. В качестве альтернативы полинуклеотидные последовательности могут быть фланкированы сайтами FRT и вставлены в геном с использованием рекомбиназы flp и сайтов FRT с последующим удалением полинуклеотидных последовательностей, кодирующих устойчивость к пуромицину, внеклеточную метку MYC, GFP и RFP с использованием рекомбиназы Cre.
[941] Для создания линии пакующих клеток с посадочными площадками, интегрированными в геном, клетки HEK293S котрансфицируют эквимолярными концентрациями 5 плазмид (Фиг. 3A-3E) плюс 5 мкг транскрибированной in vitro mRNA транспозазы piggybac или 5 мкг плазмиды с промотором для экспрессии транспозазы piggybac в присутствии PEI в соотношении 2:1 или 3:1 PEI к ДНК (мас./мас.) или 2-5 мкг белка транспозазы piggybac с использованием смеси катионных пептидов. Трансфицированные клетки отбирают пуромицином в присутствии 100 нМ рапамицина и 1 мкг/мл доксициклина в течение 2-5 дней с последующей сортировкой клеток, активируемой флуоресценцией, для сбора клеток, экспрессирующих GFP и RFP. Отсортированные клетки выращивают в течение 5 дней в отсутствие пуромицина, рапамицина и доксициклина, и клетки, экспрессирующие GFP и RFP, удаляют, а также удаляют положительные в отношении myc клетки с помощью гранул myc. Затем отдельные клоны из отрицательно отсортированных клеток подвергают скринингу в отношении предмет индукции GFP и RFP рапамицином и доксициклином и клонируют отдельные клетки. ДНК из клонов собирают и секвенируют для интегративного анализа. Клоны, положительные в отношении сильной индуцибельной экспрессии GFP и RFP в присутствии рапамицина и доксициклина с ограниченной фоновой экспрессией в отсутствие рапамицина и доксициклина, экспандируют и помещают в банки.
[942] Клетки HEK293S с конструкциями из Фиг. 3A-3E, интегрированные в геном, затем трансфицируют конструкцией, содержащей трицистронный полинуклеотид, кодирующий сигнальную последовательность DAF/scFvFc к CD3 (UCHT1)/сайт присоединения GPI-якоря CD14 (SEQ ID NO: 287), сигнальную последовательность DAF/CD80. внеклеточный домен, способный связывать сайт присоединения GPI-якоря CD28/CD16B (SEQ ID NO: 286), а также сигнальную последовательность DAF/IL-7/DAF (SEQ ID NO: 286) и последовательности транспозонов, фланкирующие полинуклеотидную область для интеграции в геном HEK293S (Фиг. 4A). После трансфекции клетки экспандируют в течение 2 дней в отсутствие рапамицина и доксициклина, и отбирают колонии, которые постоянно имеют красный цвет. Затем положительные колонии временно трансфицируют конструкцией для экспрессии рекомбиназы Cre для удаления оставшейся геномной ДНК и кодирующей RFP области. Другая конструкция (Фиг. 4B), содержащая полинуклеотид с промотором BiTRE и полинуклеотидную область, кодирующую полипептиды gag и pol в одном направлении, и полинуклеотидную область, кодирующую белки F и H вируса кори в другом направлении, трансфицируют одновременно. Рекомбиназа Cre интегрирует конструкцию в геном для создания интегрированной последовательности, показанной на Фиг. 4B. Полученные в результате колонии оценивают в отношении экспрессии белка в присутствии доксициклина и рапамицина и анализируют путем глубокого секвенирования в отношении геномной интеграции. Оставшийся TRE-чувствительный сайт GFP сохраняется для вставки лентивирусного генома.
Пример 8. Создание лентивирусного вектора и упаковка ретровирусов
[943] Линию ретровирусных пакующих стабильных клеток, полученную в Примере 7, трансфицируют конструкцией (Фиг. 4C) для экспрессии рекомбиназы Flp и конструкцией, содержащей полинуклеотидную последовательность, кодирующую CAR, и лимфопролиферативный элемент IL7Rα-insPPCL под контролем промотора CD3Z, который не активен в клетках HEK293S, при этом CAR и IL7Rα-insPPCL разделены полинуклеотидной последовательностью, кодирующей последовательность с рибосомным проскоком T2A, и IL7Rα-insPPCL имеет рибозим, контролируемый рибопереключателем ацикловира. CAR-содержащая конструкция дополнительно содержит cPPT/CTS и последовательности RRE и полинуклеотидную последовательность, кодирующую Psi HIV-1. Вся полинуклеотидная последовательность CAR-содержащей конструкции, которая должна быть интегрирована в геном, фланкирована сайтами FRT. Успешная интеграция конструкции, содержащей CAR, вызывает конститутивную экспрессию GFP, которая затем удаляют с помощью временной трансфекции конструкцией для экспрессии рекомбиназы Cre. Линию HEK293S выращивают в бессывороточной среде. После роста до максимальной плотности клеток в реакторе с мешалкой клетки разбавляют до 70% пиковой плотности клеток и обрабатывают 100 нМ рапамицином в течение 2 дней для индукции экспрессии ранних генов REV, Vpx и aCD3 scFv CD16B GPI, aCD28 scFv CD16B GPI и IL-7 SD GPI DAF с последующим добавлением 1 мкг/мл доксициклина в среду для индукции экспрессии структурных элементов, таких как Gag Pol, MV(Ed)-FΔ30, MV(Ed)-HΔ18 и лентивирусного генома, включающего терапевтическую мишень. Уровни продуцирования вируса исследуют с помощью количественной ПЦР последовательности упаковки и p24 ELISA. Вирус собирают глубокой фильтрацией клеток и концентрацией/диафильтрацией с использованием картриджа TFF с последующим мгновенным замораживанием для наполнения флаконов.
Пример 9. Выделение, трансдукция и экспансия мононуклеарных клеток периферической крови (PBMC)
[944] Следующий пример иллюстрирует использование закрытой системы для обработки ex vivo PBMC перед экспансией in vivo. Например, от 30 до 200 мл человеческой крови отбирают у субъекта с помощью раствора кислой цитрат-декстрозы (ACD) в качестве антикоагулянта в пакет для сбора крови. В качестве альтернативы кровь набирают в пробирки Vacutainer, шприц или аналог и переносят в пустой сборник крови или пакет для IV вливания. Цельную кровь обрабатывают с использованием набора Neat Cell (каталожный № CS-900.2, Omniamed) в системе обработки клеток Sepax 2 (BioSafe) в соответствии с инструкциями производителя. Мононуклеарные клетки периферической крови (PBMC) собирают либо в пакет для культуры, либо в шприц. В асептических условиях берут аликвоту для подсчета клеток с определением количества жизнеспособных клеток. PBMC переносят в устройство для газопроницаемой системы культивирования клеток G-Rex100MCS (Wilson Wolf) с конечной концентрацией 0,1 - 1,0 × 106 жизнеспособных клеток/мл в X-VIVO 15 (каталожный № 08-879H, Lonza) или CTS OpTmizer Cell Expansion SFM (каталожный № A1048501, Thermo Fisher Scientific) с 10-300 МЕ/мл IL-2 (каталожный № 202-IL-010, R&D Systems) в конечном объеме до 200 мл. Помимо IL-2, в среду можно добавить CTS Immune Cell SR (каталожный № A2596101, Thermo Fisher Scientific). Закрытое устройство G-Rex для газопроницаемой системы культивирования клеток может быть предварительно покрыто ретронектином (каталожный номер CH-296, Takara) или аналогичным эквивалентом, производным от фибронектина, в соответствии с инструкциями производителя.
[945] PBMC, выделенные из периферической крови, загружают на фильтр PALL PBMC, один раз промывают через фильтр 10 мл среды AIM V (Thermo Fisher Scientific) или X-VIVO 15 с последующей перфузией 10-60 мл исходного раствора лентивируса (как приготовлено в Примере 8) при 37 °C со скоростью 5 мл/час. Затем PBMC снова промывают средой AIM V, CTS OpTmizer T Cell Expansion SFM или X-VIVO 15, содержащей рекомбинантную человеческую ДНКазу (Pulmozyme, Genentech), с последующей промывкой лактатным раствором Рингера, не содержащим ДНКазу (каталожный № L7500, Braun). Затем PBMC подвергают обратной перфузии через фильтр в шприц. Клетки (целевые уровни клеток составляют от 5 × 105 до 1 × 106 клеток/кг) затем повторно вводят субъекту посредством внутривенной инфузии.
[946] В зависимости от рибопереключателя, содержащегося в ретровирусном геноме, субъекту вводят соответствующее противовирусное лекарственное средство на основе нуклеозного аналога или противовирусное пролекарство на основе нуклеозидного аналога (ацикловир, валацикловир, пенцикловир или фамцикловир). Субъектам можно вводить любую терапевтически эффективную дозу, такую как 500 мг противовирусного лекарственного средства или пролекарства на основе нуклеозидного аналога перорально три раза в день. Лечение противовирусным лекарственным средством или пролекарством на основе нуклеозидного аналога предпочтительно начинается до повторного введения, например, за 2 часа до этого, а также может начинаться во время повторного введения или через некоторое время после повторного введения. Лечение может продолжаться в течение по меньшей мере 1, 2, 3, 4, 5, 7, 10, 14, 21, 28, 30, 60, 90, 120 дней или 5, 6, 9, 12, 24, 36 или 48 месяцев или дольше. Лечение может включать введение противовирусного лекарственного средства или пролекарства на основе нуклеозидного аналога один, два, три или четыре раза в день. После начала повторного введения и начала лечения количество инфицированных клеток определяют путем анализа крови в дни 2, 5, 7, 11, 13, 18, 28 и 56 после повторного введения с использованием qPCR для количественного определения количества вирусного генома. У субъекта, страдающего лихорадкой или синдромом высвобождения цитокинов, может быть снижена или прекращена доза или частота приема противовирусного лекарственного средства или пролекарства на основе нуклеозидного аналога. Если инфицированные Т-клетки не могут амплифицироваться в 10000-100000 раз к дню 18, доза или частота приема противовирусного лекарственного средства или пролекарства на основе нуклеозидного аналога может быть увеличена. Клинический ответ субъекта можно измерить с помощью PET-визуализации FDG и серийной CT. Пероральное введение дозы противовирусного лекарственного средства или пролекарства на основе нуклеозидного аналога может быть уменьшено или остановлено после продолжительной ремиссии или в случае чрезмерного размножения Т-клеток, превышающего 30% от общего числа периферических Т-клеток.
Пример 10. Терапевтическое вмешательство для повышения pH сосудов или тканей
[947] Чтобы уменьшить связывание антигенсвязывающего домена с его когнатным антигеном, NaHCO3 вводят в виде IV болюса или путем IV инфузии. Стандартная доза составляет 1 мг/кг массы тела в качестве начальной дозы, а затем 0,5 мг/кг каждые 10 минут. 50-миллилитровый болюс NaHCO3 повысит pH сыворотки на примерно 0,1 единицы pH. Если pH равен 7,0, для корректировки pH до 7,40 требуется четыре ампулы NaHCO3 по 50 мг-экв.
Пример 11. Тестирование активности лимфопролиферативных элементов /элементов выживания рецептора IL-7 в PBMC
[948] Для тестирования вариантов IL-7Rα в отношении их способности опосредовать цитокин-независимую выживаемость Т-клеток, в пробирки Vacutainer отбирали тридцать миллилитров крови человека с кислой цитрат-декстрозой (ACD) в качестве антикоагулянта. Цельную кровь обрабатывали центрифугированием в градиенте плотности с Ficoll-Pacque™ (General Electric) в соответствии с инструкциями производителя для получения мононуклеарных клеток периферической крови (PBMC). Аликвоты PBMC асептически переносили в лунки 12-луночного планшета для тканевых культур вместе со средой X-Vivo™ 15 (Lonza) до конечной концентрации 0,5 миллиона жизнеспособных клеток/мл в конечном объеме 1 мл. Рекомбинантный человеческий интерлейкин-2 (IL-2) (Novoprotein) также добавляли до концентрации 100 МЕ/мл в некоторых образцах. Активирующие Ab к CD3 (OKT3, Novoprotein) добавляли в концентрации 50 нг/мл для активации PBMC для вирусной трансдукции. Планшеты инкубировали в течение ночи в стандартном увлажненной инкубаторе для тканевых культур при 37 °C и 5% углекислом газе. После инкубации в течение ночи препараты частиц лентивируса, содержащие желаемые тестовые конструкции (Фиг. 19A) добавляли в отдельные лунки при множественности заражения (MOI) 5. Планшет инкубировали в течение ночи в стандартном увлажненной инкубаторе для тканевых культур при 37 °C и 5% углекислом газе. После инкубации в течение ночи содержимое каждой лунки 12-луночного планшета собирали и центрифугировали для получения осадка. Образцы промывали один раз D-PBS + 2% раствором сывороточного альбумина человека (HSA), ресуспендировали в среде X-Vivo15™ и переносили в лунки 6-луночных газопроницаемых устройств для культивирования клеток G-Rex® (Wilson Wolf). Добавляли дополнительную среду X-Vivo™ 15, чтобы довести конечный объем каждой лунки до 30 мл. Соответствующие контрольные образцы для каждой из конструкций переносили в лунки 6-луночных газопроницаемых устройств для культивирования клеток G-Rex® (Wilson Wolf) и добавляли дополнительную среду для доведения конечного объема до 30 мл со 100 МЕ/мл IL-2 для некоторых контрольных образцов. Устройство G-Rex® инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% углекислом газе в течение 7 дней. Свежий IL-2 -2 добавляли к контрольным образцам, содержащим IL-2, во время культивирования каждые 2-3 дня. Соответствующие тестовые образцы без IL-2 не дополняли. Образцы удаляли для отслеживания количества клеток и их жизнеспособности во время экспансии (Countess, Thermo Fisher) в день 7.
[949] На Фиг. 19А представлена схема тестированных конструкций IL7Rα. Эти конструкции вставляли в рекомбинантный лентивирусный геном. Не способные к репликации рекомбинантные ретровирусные частицы использовали для трансдукции PBMC. На Фиг. 19A схематически изображен IL7Rα дикого типа (SEQ ID NO: 229), который состоит из сигнальной последовательности (SS), внеклеточного домена (ECD), трансмембранного (TM) и внутриклеточного домена (ICD). «1» указывает сайт домена фибронектина типа III; «2» указывает сайт мотива WSXWS; «3» указывает сайт Box 1, «4» указывает сайт фосфорилирования протеинкиназы C (PKC), а «5» указывает сайт Box 2.
[950] Вариант «A» представляет собой IL-7Rα с InsPPCL в положении 243 (Shochat et al, 2011, J. Exp. Med. Vol. 208 No. 5 901-908), но без мутации S185C, экспрессируемой на транскрипте с полипептидом GFP, линкером GSG и последовательностью с рибосомным проскоком P2A, слитой с его N-концом. Вариант «B» представляет собой IL-7Rα InsPPCL с полипептидом GFP, линкером GSG и последовательностью с рибосомным проскоком P2A, слитой с его N-концом, а также меткой Myc между сигнальной последовательностью и внеклеточным доменом. Вариант «С» подобен варианту «В», за исключением того, что его внутриклеточный домен усечен в положении 292. Вариант «D» подобен варианту «А», за исключением того, что его внутриклеточный домен усечен в положении 292. Вариант «E» представляет собой вариант IL-7Rα InsPPCL, усеченный на своем N-конце, так что сигнальная последовательность и большая часть внеклеточного домена (остатки 1-228) отсутствуют; вариант «E» также имеет полипептид GFP, линкер GSG, последовательность с рибосомным проскоком P2A и eTag, слитый с N-концом в указанном порядке от аминоконца. Нумерация аминокислотных остатков основана на IL7Rα (№ в NCBI GI 002176.2). Т-клетки, содержащие каждый из вариантов, тестировали в отношении жизнеспособности в присутствии или в отсутствие IL-2 с использованием исключения с помощью трипанового синего.
[951] Как изображено на Фиг. 19B, PBMC нуждаются в IL-2 для выживания in vitro. Как изображено на Фиг. 19B, нетрансфицированные PBMC имеют около 80% жизнеспособность в присутствии IL-2 и 0% жизнеспособность в отсутствие IL-2 через 7 дней после трансдукции. PBMC, содержащие полноразмерные версии IL-7Rα InsPPCL (варианты A и B IL-7Rα на Фиг. 19A), имели более 20% жизнеспособность в отсутствие IL-2 через 7 дней после трансдукции, что указывает на то, что экспрессия конститутивно активного рецептора IL-7Rα InsPPCL имеет активность выживания в этих клетках. Кроме того, Т-клетки, экспрессирующие варианты IL-7Rα InsPPCL с усеченным внутриклеточным доменом (ICD) (варианты C и D IL-7Rα на Фиг. 19A) имел повышенную жизнеспособность через 7 дней после трансдукции по сравнению с рецептором IL-7 дикого типа. Наконец, мутант N-концевого рецептора IL-7 (вариант E IL-7Rα на Фиг. 19A), как изображено на Фиг. 19B, имел активность выживания в этих клетках. Соответственно, этот пример показывает, что рецептор IL-7 обладает активностью выживания при экспрессии в PBMC.
Пример 12. Эффективность трансдукции свежевыделенных и нестимулированных Т-клеток человека ретровирусными частицами, псевдотипированными VSV-G и экспрессирующими scFvFc к CD3 на своих поверхностях
[952] Рекомбинантные лентивирусные частицы получали путем временной трансфекции клеток 293T (Lenti-X ™ 293T, Clontech) отдельными паковывающими лентивирус плазмидами, кодирующими gag/pol и rev, и плазмидой псевдотипирования, кодирующей VSV-G. Вектор лентивирусной экспрессии третьего поколения (содержащий делецию в 3'LTR, приводящую к самоинактивации), кодирующий GFP, рецептор химерного антигена против CD19 и eTAG, обозначаемый в данном документе как F1-0-03 (Фиг. 20) котрансфицировали пакующими плазмидами. Клетки адаптировали к суспензионной культуре путем серийного выращивания в Freestyle™ 293 Expression Medium (ThermoFisher Scientific). Клетки в суспензии высевали при концентрации 1 × 106 клеток/мл (30 мл) в колбу Эрленмейера на 125 мл и сразу же трансфицировали полиэтиленимином (PEI) (Polysciences), растворенным в слабой кислоте.
[953] Плазмидную ДНК разводили в 1,5 мл среды Gibco™ Opti-MEM™ для 30 мл клеток. Для получения лентивирусных частиц, псевдотипированных VSV-G, использованная общая ДНК (1 мкг/мл объема культуры) представляла собой смесь 4 плазмид со следующими молярными отношениями: 2x геномная плазмида (F1-0-03), 1x Rev-содержащая плазмида, 1x VSV-G-содержащая плазмида и 1x gag/pol-содержащая плазмида. Для получения лентивирусных частиц, псевдотипированных VSV-G и экспрессирующих scFvFc к CD3-GPI на своей поверхности, использованная общая ДНК (1 мкг/мл объема культуры) представляла собой смесь 5 плазмид со следующими молярными отношениями: 2x геномная плазмида (F1-0-03), 1x Rev-содержащая плазмида, 1x VSV-G-содержащая плазмида, 1x scFvFc к CD3-GPI-содержащая плазмида и 1x gag/pol-содержащая плазмида. Для получения лентивирусных частиц, псевдотипированных VSV-G и экспрессирующих scFvFc к CD3-GPI и CD80-GPI на своей поверхности, использованная общая ДНК (1 мкг/мл объема культуры) представляла собой смесь 6 плазмид со следующими молярными отношениями: 2x геномная плазмида (F1-0-03), 1x Rev-содержащая плазмида, 1x VSV-G-содержащая плазмида, 1x scFvFc к CD3-содержащая плазмида, 1x CD80-содержащая плазмида и 1x gag/pol-содержащая плазмида. Отдельно PEI разбавляли в 1,5 мл Gibco™ Opti-MEM™ до 2 мкг/мл (объем культуры, отношение к ДНК 2:1). После 5-минутной инкубации при комнатной температуре два раствора тщательно смешали и инкубировали при комнатной температуре в течение еще 20 минут. К клеткам добавляли конечный объем (3 мл). Затем клетки инкубировали при 37 °C в течение 72 часов при вращении со скоростью 125 об./мин. и с 8% CO2. Плазмиды, содержащие scFvFc к CD3-GPI, включали scFv, происходящие от OKT3 или UCHT1, и последовательность присоединения GPI-якоря. Вектор UCHT1scFvFc-GPI кодирует пептид (SEQ ID NO: 278), который содежрит сигнальный пептид человеческого Ig каппа (аминокислоты 1-22 № в NCBI GI CAA45494.1), слитый с scFv UCHT1 (аминокислоты 21-264 № в NCBI GI CAH69219.1), слитый с человеческим Fc IgG1 (аминокислоты 1-231 № NCBI GI в AEV43323.1), с заменой A на T в положении 115, слитый с последовательностью прикрепления GPI-якоря DAF человека (аминокислоты 345-381 № в NCBI GI NP_000565). Вектор OKT3scFvFc-GPI кодирует пептид (SEQ ID NO: 279), который содежрит сигнальный пептид человеческого Ig каппа (аминокислоты 1-22 № в NCBI GI CAA45494.1), слитый с scFv OKT3 (SEQ ID NO: 285), слитый с человеческим Fc IgG1 (аминокислоты 1-231 № NCBI GI в AEV43323.1), слитый с последовательностью прикрепления GPI-якоря DAF человека (аминокислоты 345-381 № в NCBI GI NP_000565). Вектор CD80-GPI кодирует пептид (SEQ ID NO: 280), который включает сигнальный пептид CD80 человека и внеклеточный домен (аминокислоты 1-242 NCBI GI No. NP_005182), слитый с последовательностью присоединения GPI-якоря CD16b человека (аминокислоты 196-233, № в NCBI GI NP_000561).
[954] Через 72 часа супернатанты собирали и осветляли центрифугированием при 1200 g в течение 10 минут. Осветленные супернатанты переливали в новую пробирку. Лентивирусные частицы осаждали центрифугированием в течение ночи при 3300 g и 4 °C. Супернатант отбрасывали, и осадки лентивирусных частиц ресуспендировали в 1:100 от начального объема среды X-Vivo™ 15 (Lonza). Лентивирусные частицы титровали последовательным разведением и анализировали экспрессию GFP в клетках 293T и Jurkat через 72 часа после трансдукции с помощью проточной цитометрии.
[955] Мононуклеарные клетки периферической крови (PBMC) сначала выделяли либо из свежей крови в пробирках с ACD (кислой цитрат-декстрозой) для доноров 12F и 12M, либо из лейкоцитарной пленки для донора 13F, собранных и распределенных San Diego Blood Bank, Калифорния. Разделение PBMC на основе градиента плотности SepMate™ 50 (Stemcell™) на Ficoll-Paque PLUS® (GE Healthcare Life Sciences) выполняли в соответствии с инструкциями производителя. 30 мл крови или лейкоцитарной пленки, разведенных в PBS-2% HIFCS (инактивированной нагреванием фетальной телячьей сыворотке), наслаивали на каждую пробирку SepMate™. После центрифугирования при комнатной температуре, при 1200 g в течение 20 минут, слои PBMC собирали, объединяли и трижды промывали 45 мл PBS-2%HIFCS и центрифугировали при 400 g в течение 10 минут при комнатной температуре. Затем осадки инкубировали при комнатной температуре в течение 10 минут в 10 мл буфера для лизиса эритроцитов (Alfa Aesar) и дополнительно дважды промывали 45 мл PBS-2%HIFCS и центрифугировали при 400 g в течение 10 минут при комнатной температуре. Заключительную промывку проводили в трансдуцированной и культуральной средах: X-Vivo ™ 15 для донора 13F или RPMI-1640+10% HIFCS для доноров 12F и 12M. Никаких дополнительных стадий для удаления моноцитов не предпринимали. После выделения свежие и нестимулированные PBMC ресуспендировали до конечной концентрации 1 × 106/мл в их соответствующей среде и трансдуцировали в двух повторах или трех повторах лентивирусными частицами, описанными ранее. Трансдукции проводили в течение 14 часов при 37 °C, 5% CO2, в среде X-Vivo™ 15 для донора 13F или в RPMI-1640+10% HIFCS для доноров 12F и 12M. Трансдукции обычно проводили при MOI 1 в формате 12-луночного планшета, 1 мл/лунка. Для кинетического эксперимента 0,5 × 106 PBMC/мл трансдуцировали в конечную 7 мл, при MOI 1, во встряхиваемой колбе объемом 125 мл, инкубированной при 37 °C в течение 2-20 часов с вращением при 125 об./мин. и с 8% CO2. После инкубации с ретровирусными частицами в течение выбранного времени клетки промывали трижды средой X-Vivo™ 15 для донора 13F или PBS+2% HIFCS для доноров 12F и 12M и, наконец, инкубировали при плотности клеток 1 × 106/мл в среде X-Vivo™ 15 для донора 13F или RPMI-1640+10% HIFCS для доноров 12F и 12M, при 37 °C, 5% CO2. Начиная с дня 3 после трансдукции и каждые 2-3 дня с этого момента объем среды удваивали и дополняли IL-2 до конечной концентрации 100 Ед./мл. Образцы собирали в различные дни после трансдукции (дни 3-17) для оценки по уровням экспрессии GFP эффективности трансдукции каждого типа генерированного лентивируса.
[956] В различные дни после трансдукции для лентивирусных частиц, псевдотипированных VSV-G, с антителом OKT3 (Biolegend) или без него в концентрации 1 μмкг/мл; лентивирусные частицы, псевдотипированные VSV-G и экспрессирующие на своей поверхности scFvFc к CD3-GPI; или лентивирусные частицы, псевдотипированные VSV-G и экспрессирующие на своей поверхности scFvF к CD3-GPI и CD80-GPI; собирали 100 μмкл клеток и анализировали проточной цитометрией в отношении экспрессии GFP в популяции CD3+ клеток.
[957] На Фиг. 21A и на Фиг. 21B изображена гистограмма процента (%) клеток CD3+GFP+ в общей CD3+ популяции и гистограмма абсолютного количества клеток на лунку CD3+GFP+ популяции соответственно, через 3, 6, 9, 13 и 17 дней после трансдукция свежевыделенных и нестимулированных PBMC от донора 12M в течение 14 ч с помощью указанных лентивирусных частиц. Каждая полоса представляет собой среднее значение +/- SD повторов. На Фиг. 21A и 21B изображено, что псевдотипирование лентивирусных частиц с помощью VSV-G и экспрессия scFvFc к CD3 на поверхности лентивирусных частиц эффективно трансдуцирует свежевыделенные и нестимулированные PBMC. ScFv к CD3, происходящие от OKT3 или UCHT1, когда они находятся в форме scFvFc-GPI, были эффективными.
[958] На Фиг. 22A и на Фиг. 22B изображена гистограмма процента (%) клеток CD3+GFP+ в общей CD3+ популяции и гистограмма абсолютного количества клеток на лунку CD3+GFP+ популяции соответственно, через 3 и 6 дней после трансдукция свежевыделенных и нестимулированных PBMC от донора 13F в течение 14 ч с помощью указанных лентивирусных частиц. Следует обратить внимание, что «A» представляют собой результаты с использованием псевдотипированных лентивирусных частиц VSV-G (эксперименты в трех повторах); «B» представляют собой результаты с использованием псевдотипированных лентивирусных частиц VSV-G с антителом к OKT3 (1 мкг/мл), добавленных в среду для трансдукции (эксперименты в двух повторах); «C» представляют собой результаты с использованием псевдотипированных лентивирусных частиц VSV-G, экспрессирующих GPI-заякоренный UCHT1scFvFc на своей поверхности (эксперименты в трех повторах); и «D» представляют собой результаты с использованием псевдотипированных лентивирусных частиц VSV-G, экспрессирующих GPI-заякоренный UCHT1scFvFc и GPI-заякоренный CD80 на своей поверхности (эксперименты в двух повторах). Каждая полоса представляет собой среднее значение +/- SD двух или трех повторов, как указано на Фиг. 22A. На Фиг. 22A и 22B изображено, что псевдотипирование лентивирусных частиц с помощью VSV-G и экспрессия scFvFc к CD3-GPI и CD80-GPI на своих поверхностях также эффективно трансдуцирует свежевыделенные и нестимулированные PBMC, когда трансдукцию осуществляют в течение 14 часов.
[959] На Фиг. 23B изображена гистограмма процента (%) клеток CD3+GFP+ в общей CD3+ популяции и гистограмма абсолютного количества клеток на лунку CD3+GFP+ популяции соответственно, через 3, 6 и 9 дней после трансдукция свежевыделенных и нестимулированных PBMC от донора 12M в течение указанного времени воздействия (2-20 ч) (т.е. приведения в контакт клеток с лентивирусными частицами в реакционной смеси трансдукции), с помощью указанных лентивирусных частиц. Трансдукцию проводили в планшете или шейкере, как указано. Каждая полоса представляет собой среднее значение +/- SD двух повторов для лентивирусных частиц, псевдотипированных VSV-G («[VSV-G]»); другие эксперименты не имели повторов. На Фиг. 23A и 23B изображено, что свежевыделенные и нестимулированные PMBC можно эффективно трансдуцировать всего за 2 часа с помощью лентивирусных частиц, псевдотипированных VSV-G и экспрессирующих scFvFc к CD3 и CD80 на своих поверхностях.
[960] Примечательно, что последующие эксперименты выполняли с использованием лентивирусных частиц, полученных с использованием только Rev, VSV-G, gag/pol и F1-0-03 (а не вектора, кодирующего антитело к CD3 или CD80) для трансдукции свежевыделенных покоящихся PBMC в присутствии растворимых антител к CD3 (100 нг/мл) в течение 2,5 часов. Трансдукцию достигали с использованием 3 различных клонов растворимых антител к CD3. Эффективность трансдукции, измеренная с помощью CD3+GFP+ клеток в день 6, составляла 4,31%, 3,27% и 0,52% для клонов антитела к CD3 HIT3A, OKT3 и UCHT1 соответственно. Исходная эффективность трансдукции в отсутствие растворимых антител составляла 0,06%.
Пример 13. Функциональность miRNA, встроенных в интрон промотора EF-1alpha
[961] Конструировали четыре отдельных фрагмента гена gBlocks®, каждый из которых содержал каркас miR-155, включая 5' фланкирующую последовательность miR-155 или «5' плечо» (SEQ ID NO: 256) и 3' фланкирующую последовательность miR-155 или «3' плечо» (SEQ ID NO: 260). Для каждого gBlock® уникальный фрагмент miRNA, нацеленный на транскрипт мРНК CD3 дзета, использовали для замены предшественника структуры стебель-петли miR-155. Каждый gBlock® содержал перекрывающуюся последовательность размером 40 п.н., предназначенную для облегчения сборки всех четырех gBlocks® в виде единой цепи в интроне промотора EF-1alpha. GBlocks® собирали с использованием коммерческого набора для выполнения сборки Gibson® ultra (NEBuilder, New England Biolabs, Inc.).
[962] Синтетический промотор EF-1alpha и интрон A, содержащий miRNA (в SEQ ID NO: 255), были частью кассеты экспрессии трансгена, управляющей экспрессией GFP и eTag, содержащихся в каркасе лентивирусного вектора (каркас лентивирусного вектора с GFP и иллюстративный eTag, распознаваемый цетуксимабом, обозначается в данном документе как F1-0-02; Фиг. 24A и 24B). Положения нуклеотидов каждого gBlock® и его соответствующих компонентов в SEQ ID NO: 255 обозначены в Табл. 3, как и положения каждого «признака» на Фиг. 24B. Правильную сборку четырех miRNA в основной цепи лентивирусного вектора подтверждали комплексным секвенированием модифицированного промотора EF-1alpha и интронной области.
CTGGAGGCTTGCTGAAGGCTGTATGCTG
ACATGGTACAGTTCAATGGTG
GTTTTGGCCACTGACTGAC
CACCATTGCTGTACCATGT
TCAGTCTGTTCATCTTCTGGC
GCCAGAAGGAACAGACTGA
AAGCGTGAAGTGAATCAACGG
CCGTTGATACTTCACGCTT
GCAGTATCCTAGTACATTGAC
GTCAATGTTAGGATACTGC
Таблица 3. Нуклеотидные положения признаков в SEQ ID NO:255
[963] Неспособные к репликации лентивирусные частицы, содержащие нуклеиновую кислоту, кодирующую четыре miRNA, направленные против CD3 дзета в их геноме, получали путем временной котрансфекции четырех плазмид в суспензии клеток HEK293: плазмиды, содержащей нуклеиновую кислоту, кодирующую F1-0-02, модифицированную для включения четырех miRNA, нацеленных на транскрипт mRNA CD3 дзета, плазмиды, кодирующей VSV-G, плазмиды, кодирующей REV, и плазмиды, кодирующей GAG-POL. Супернатант лентивирусных частиц собирали через 48 часов и осаждали PEG в течение 24 часов. Супернатанты центрифугировали, и осажденные частицы лентивируса ресуспендировали в полной среде для выращивания РВМС без IL-2. Титры лентивирусных частиц рассчитывали путем 48-часовой трансдукции клеток Jurkat.
[964] Для трансдукции PBMC размораживали в день 0 и инкубировали в течение 24 часов с 100 ед./мл hrIL-2. В день 1 PBMC активировали с помощью гранул, конъюгированных с CD3/CD28. В день 2 активированные PBMC трансдуцировали лентивирусными частицами, содержащими геном с последовательностью нуклеиновой кислоты, кодирующей miRNA, с MOI 10. Клетки увеличивали до дня 11, добавляя свежий hrIL-2 каждые два дня. В дни 7, 9 и 11 для анализа FACS собирали 1 миллион клеток.
[965] Клетки окрашивали в отношении поверхностной экспрессии CD3 Epsilon, используя PE-конъюгированное антитело OKT-3 (Biolegend). Уровни экспрессии определяли по средней интенсивности флуоресценции (MF) PE в GFP-положительной популяции (трансдуцированные клетки). Уровни экспрессии трансдуцированных клеток сравнивали между ретровирусными частицами, полученными из F1-0-02, и ретровирусными частицами, полученными из F1-0-02, в которых последовательность нуклеиновой кислоты, кодирующая miRNA CD3z, расположенные последовательно, вставляли в промотор EF-1alpha и интрон А.
[966] Результаты изображены на Фиг. 25. Эти данные показывают, что серийные miRNA, нацеленные на CD3 дзета, кодируемые последовательностью нуклеиновой кислоты в интроне A промотора EF-1alpha, эффективны при подавлении экспрессии комплекса CD3.
Пример 14. Независимость положения серийных ингибирующих РНК, вставленных в интрон промотора EF-1alpha
Клонирование
[967] Четыре лентивирусных векторных конструкции, экспрессирующих miRNA, конструировали для тестирования процессинга отдельных предшественников miRNA в структуре, содержащей 4 последовательных предшественника miRNA. В Табл. 4 показаны названия отдельных конструкций и положение miR-TCRα в каждой конструкции.
Таблица 4. Конструкции, содержащие полицистронные miRNA
[968] Каждая miRNA содержала каркас miR-155, использованный в примере 13, т.е. 5' плечо miR-155 (SEQ ID NO: 256), 3' плечо miR-155 (SEQ ID NO: 260), петлю (SEQ ID NO: 258 ) и конкретный порядок последовательностей стеблей, как показано в Табл. 5. Способ сборки типа II использовали для достижения сборки четырех фрагментов miRNA в их соответствующие положения в интроне EF-1alpha лентивирусной векторной конструкции (F1-0-02; приведен в Примере 13 и показан на Фиг. 24A).
где:
SEQ ID NO:267 = стебель 1 miRNA TCRalpha; ATATGTACTTGGCTGGACAGC
SEQ ID NO:268 = стебель 2 miRNA TCRalpha; GCTGTCCACAAGTACATAT
SEQ ID NO:269 = линкер ; CACATTGGTGCCGGATGAAGCTCTTATGTTGCCGGTCAT
SEQ ID NO:270 = mir-155 стебель 1; CTGTTAATGCTAATCGTGATA
SEQ ID NO:271 = mir-155 стебель 2; TATCACGATTATTAACAG
SEQ ID NO:272 = линкер 2; GTTGCCGGAGTCTTGGCAGCGAGAGATCACTATCAACTAA
SEQ ID NO:273 = PD-1 miRNA стебель 1; TACCAGTTTAGCACGAAGCTC
SEQ ID NO:274 = стебель miRNA PD-1; GAGCTTCGCTAAACTGGTA
SEQ ID NO:275 = линкер 3; GTGTTAATTGTCCATGTAGCGAGGCATCCTTATGGCGTGG
SEQ ID NO:276 = стебель 1 miRNA CTLA-4; TGCCGCTGAAATCCAAGGCAA
SEQ ID NO:277 = стебель 2 miRNA CTLA-4; TTGCCTTGTTTCAGCGGCA
Таблица 5: Последовательности в конструкциях miRNA
Получение лентивирусных частиц
[969] Четыре конструкции и контрольный F1-0-02, который не включает последовательность нуклеиновой кислоты, кодирующую miRNA, использовали для получения лентивирусных частиц в 30 мл суспензионных культур клеток 293Т. Лентивирусные частицы собирали и концентрировали осаждением PEG. Титры функциональных лентивирусных частиц получали путем трансдукции клеток Jurkat в нескольких разведениях (1:1000, 1:10000, 1:100000), инкубации лентивирусных частиц и клеток в течение 2 дней при 37 °C, промывки клеток 2X буфером FACS и анализа на GFP с помощью проточной цитометрии. Другие подробности, касающиеся получения лентивирусных частиц, представлены в Примере 13 в данном документе.
Трансдукция
[970] Для трансдукции PBMC размораживали и восстанавливали в течение ночи в полной среде, содержащей 100 Ед./мл hrIL-2. 1 × 105 PBMC активировали воздействием гранул, конъюгированных с CD3/CD28, в течение 24 часов. Клетки трансдуцировали в двух повторах в лунках каждой из четырех конструкций miRNA или контрольной ретровирусной частицей F1-0-02 при MOI 10. Клеткам давали 100 Ед./мл hrIL-2 каждые 3 дня и экспандировали до дня 10.
FACS
[971] Клетки собирали для анализа FACS, который подтвердил, что клетки трансдуцировали не способными к репликации лентивирусными векторами. Результаты продемонстрировали, что примерно эквивалентные количества вируса, содержащего miRNA, доставлены в каждую лунку в эксперименте.
RT-qPCR и анализ miRNA клеток по отношению к ct
[972] Анализ RT-qPCR разрабатывали для обнаружения экспрессии и процессинга предшественников miRNA в зрелые процессированные miR. Анализ выполняли сначала путем нормализации всех значений miR-TCRa ct по отношению к внутреннему контролю RNU48 для получения значений ΔCt. Затем значения ΔCt каждого преобразованного образца вычитали из ΔCt непреобразованного контроля для получения ΔΔCt. Это значение представляет количество обработанной miR-TCRa miRNA в каждом трансдуцированном образце по сравнению с нетрансдуцированным контролем.
[973] Как изображено на Фиг. 26, анализ RT-qPCR успешно обнаружил процессированный miR-TCRα в образцах, трансдуцированных miR-TCRα, содержащими не способные к репликации лентивирусные частицы. Более того, результаты ясно указывают на то, что заметные различия в процессинге miRNA TCRα в любом из четырех тестированных положений отсутствуют.
Пример 15. Цитотоксическую активность ограниченных микроокружением биологических CAR-экспрессирующих Т-клеток можно контролировать путем изменения pH
[974] В следующем примере показано, как цитотоксическая активность трансдуцированных Т-клеток (также называемых эффекторными клетками), экспрессирующих MRB-CAR, может модулироваться изменениями pH микроокружения. В этом примере нуклеиновые кислоты, кодирующие MRB-CAR, способные связывать когнатный антиген Target 1 (антитело к Target 1), использовали для создания не способных к репликации рекомбинантных лентивирусных частиц. Все Т-клетки трансдуцировали лентивирусными частицами, и цитотоксическую активность эффекторных клеток сравнивали с использованием анализа клеток в реальном времени (RTCA) до и после изменения pH среды.
Получение не способных к репликации рекомбинантных лентивирусных частиц
[975] Тестировали нуклеиновую кислоту, кодирующую T1B, MRB-CAR к Target 1 из серии кандидатов MRB-CAR в Примере 3. Не способные к репликации рекомбинантные лентивирусные частицы получали путем временной трансфекции клеток Lenti-X 293T (Clontech, Маунтин-Вью, Калифорния) лентивирусными векторами экспрессии и нуклеиновыми кислотами, которые включали сегменты, кодирующие MRB-CAR или контроль, C1, который содержал GMCFsp. и eTAG (SEQ ID NO: 284), но не включал MRB-CAR к Target 1. Клетки адаптировали к суспензионной культуре путем серийного выращивания в экспрессионной среде Freestyle 293 (ThermoFisher Scientific, Уолтем, Массачусетс). Клетки в суспензии трансфицировали с использованием PEI (Polysciences, Верминстер, Пенсильвания), растворенного в слабой кислоте. Клетки (30 мл) выращивали до 1 × 106 клеток/мл в колбе Эрленмейера на 125 мл.
[976] Общую ДНК разводили в 1,5 мл среды Optimem на 30 мл клеток. Тотальная ДНК (1 мкг/мл объема культуры) представляла собой смесь 4 плазмид со следующими молярными отношениями: 2x геномная плазмида, которая включала лентивирусные упаковочные элементы, LTR и нуклеиновую кислоту, кодирующую T1B, 1x плазмиду, кодирующую Rev, 1x плазмиду, кодирующую VSVg, и 1x плазмиду, кодирующую Gagpol. Отдельно PEI разбавляли в 1,5 мл Optimem до 2 мкг/мл (объем культуры, отношение к ДНК 2:1). После 5-минутной инкубации при комнатной температуре два раствора тщательно смешали и инкубировали при комнатной температуре в течение еще 20 минут. К клеткам добавляли конечный объем (3 мл). Затем клетки инкубировали при 37 °C в течение 72 часов при вращении со скоростью 120 об./мин. и с -8% CO2.
[977] Через 72 часа супернатанты собирали центрифугированием при 1000g в течение 10 минут. Супернатант сливали в свежую пробирку и добавляли ¼ объема супернатанта в растворе PEG (PEG-IT, System Biosciences). Не способные к репликации рекомбинантные лентивирусные частицы осаждали инкубацией в течение ночи при 4 °C с последующим центрифугированием при 1500 g в течение 20 минут при 4 °C. Супернатант удаляли, и вирус ресуспендировали в объеме 1:100 среды X-VIVO 15. Вирусы титровали по экспрессии eTAG в клетках Jurkat.
Трансдукция/экспансия Т-клеток
[978] Все Т-клетки получали от AllCells. Не способные к репликации рекомбинантные лентивирусные частицы, MRB-CAR к Target 1, получали, как описано выше. За два дня до лентивирусной трансдукции клетки размораживали и культивировали в среде X-VIVO 15 (Lonza, Базель, Швейцария) с 5% сывороткой AB человека (Valley Biomedical Inc., Винчестер, Вирджиния) и 10 мМ N-ацетил L-цистеина. (Sigma-Aldrich, Сент-Луис, Миссури). Рекомбинантный человеческий IL-2 (R&D Systems, Миннеаполис, Миннесота) добавляли до конечной концентрации 100 МЕ/мл. За 24 часа до вирусной трансдукции первичные человеческие Т-клетки высевали в 12-луночный планшет в количестве 0,5 × 106 клеток/лунка и активировали с использованием Dynabeads Human T-Activator CD3/CD28 (ThermoFisher Scientific) в соотношении 1:3 клетки:гранулы. В день трансдукции раствор лентивирусных частиц добавляли в лунки при MOI 5. Трансдуцированные все T-клетки поддерживали при ~ 106/мл в среде X-VIVO 15 в течение 3 дней, затем переносили в 6-луночный планшет G-Rex с 30 мл/лунка среды X-VIVO 15 с 100 МЕ/мл IL-2. Перед проведением экспериментов клетки культивировали в течение по меньшей мере 10 дней, и через день добавляли IL-2.
Анализ цитотоксичности при сдвиге pH
[979] Цитотоксическую активность трансдуцированных Т-клеток до и после изменения pH путем добавления NaHCO3 или NaOH измеряли с помощью системы xCELLigence. Вкратце, за день до эксперимента целевые клетки (клетки СНО, стабильно трансфицированные конструкцией для экспрессии Target 1 на поверхности клеток (СНО-Target 1 клетки)) высевали в 96-луночный E-планшет (ACEA; Сан-Диего, CA) по 10000 клеток/лунка со средой X-VIVO 15, содержащей 40 мМ HEPES и 40 мМ PIPES, pH 6,7. Криоконсервированные эффекторные клетки, ранее трансдуцированные либо лентивирусными частицами, содержащими нуклеиновую кислоту, кодирующую T1B, либо C1 (T1BVP и C1VP, соответственно), полученные, как описано выше, размораживали и культивировали в течение двух дней в среде X-VIVO 15, содержащей 100 МЕ/мл IL- 2 (R&D Systems, Миннеаполис, Миннесота). В день эксперимента клетки, трансдуцированные T1BVP или C1VP, промывали и ресуспендировали в среде X-VIVO 15, содержащей 40 мМ HEPES и 40 мМ PIPES, pH 6,7, а затем добавляли в экспериментальные лунки при соотношении эффекторные клетки/целевых клетк (E/Т) 1:1.
[980] Показания импеданса, измеренные на системе xCELLigence (ACEA), снимали каждые 5 минут и фиксировали в виде индекса клеток (CI) для количественного определения слияния клеток как показателя пролиферации/лизиса клеток. Примерно через 3 часа после добавления эффекторных клеток 8 мкл 7,5% раствор NaHCO3 или 14 мкл 0,5 М NaOH добавляли в лунки со средой X-VIVO 15, содержащей 40 мМ HEPES и 40 мМ PIPES, pH 6,7 для повышения pH с 6,7 до 7.4. Измерения импеданса продолжали приблизительно в течение 20 часов после добавления эффекторных клеток. Процент специфического цитолиза рассчитывали следующим образом ((CI мишень + трансдуцированные C1VP эффекторные Т-клетки) - (CI мишень + T1BVP-трансдуцированные эффекторные Т-клетки))/(CI мишень + трансдуцированные C1VP эффекторные Т-клетки) × 100.
Переключение HCl для анализа уничтожения RTCA
[981] Цитотоксическую активность трансдуцированных Т-клеток до и после изменения pH путем добавления HCl измеряли с помощью системы xCELLigence. Вкратце, за день до эксперимента целевые клетки СНО-Target 1 клетки высевали в 96-луночный E-планшет по 10000 клеток/лунка со средой X-VIVO 15, содержащей 40 мМ HEPES и 40 мМ PIPES, pH 7,4. Криоконсервированные эффекторные клетки, ранее трансдуцированные либо C1VP, либо T1BVP, размораживали и культивировали в течение двух дней в среде X-VIVO 15, содержащей 100 МЕ/мл IL-2. В день эксперимента клетки, трансдуцированные T1BVP или C1VP, промывали и ресуспендировали в среде X-VIVO 15, содержащей 40 мМ HEPES и 40 мМ PIPES, pH 7,4, а затем добавляли в экспериментальные лунки при соотношении эффекторные клетки/целевых клетк (E/Т) 1:1.
[982] Показания импеданса снимали каждые 5 минут и представляли в виде индекса клеток (CI). Примерно через 3 часа после добавления эффекторных клеток 8 мкл 1 М HCl добавляли в лунки со средой X-VIVO 15, содержащей 40 мМ HEPES и 40 мМ PIPES, pH 7,4, для переключения pH с 7,4 на 6,7. Измерения импеданса продолжали приблизительно в течение 20 часов после добавления эффекторных клеток. Процент специфического цитолиза рассчитывали следующим образом ((CI мишень + трансдуцированные C1VP эффекторные Т-клетки) - (CI мишень + T1BVP-трансдуцированные эффекторные Т-клетки))/(CI мишень C1VP) × 100.
Результаты
[983] Цитотоксическую активность MRB-CAR, способного связывать когнатный антиген Target 1 с повышенной активностью при пониженном pH, сравнивали при pH 6,7 и pH 7,4. Т-клетки, которые трансдуцировали лентивирусными частицами, кодирующими MRB-CAR к Target 1, использовали для уничтожения клеток СНО, экспрессирующих мишень 1, а затем pH повышали, чтобы определить, может ли цитотоксическая активность подавляться сдвигом pH. Как изображено на Фиг. 27A и 27B, добавление NaHCO3 или NaOH к микроокружению активных CAR-T-клеток для повышения pH среды ингибировало цитотоксическую активность T-клеток, экспрессирующих MRB-CAR. Эти результаты демонстрируют, что активные Т-клетки, экспрессирующие MRB-CAR, могут уничтожать клетки, экспрессирующие мишень, и затем эту активность уничтожения можно ингибировать путем повышения pH микроокружения.
[984] Также определяли способность цитотоксической активности Т-клеток, экспрессирующих MRB-CAR, активироваться при изменении pH. Как изображено на Фиг. 27C, цитотоксическая активность Т-клеток, экспрессирующих MRB-CAR к Target 1, на CHO-Target 1 клетках была низкой при pH 7,4 и повышалась при добавлении HCl для снижения pH микроокружения. В совокупности эти результаты демонстрируют, что цитотоксическая активность Т-клеток, экспрессирующих MRB-CAR, может регулироваться сдвигом pH в микроокружении, как за счет снижения цитотоксической активности после повышения pH, так и за счет увеличения цитотоксической активности после снижения pH. В этом неограничивающем примере pH был повышен с 6,7 и понижен с 7,4.
Пример 16. Введение бикарбоната может повысить pH микроокружения опухоли у мышей
[985] Следующий пример демонстрирует, что pH микроокружения опухоли in vivo можно регулировать путем введения фармакологического средства. В этом примере фармакологическим средством является бикарбонат натрия, а микроокружение опухоли представляет собой опухоль ксенотрансплантата CHO у мышей. Пример включает два способа измерения pH микроокружения опухоли, как in vivo, так и ex vivo.
[986] Внеклеточное микроокружение большинства солидных опухолей кислое, с pH обычно от 6,5 до 6,9. В отличие от этого, pH нормальной ткани является основным, обычно от 7,2 до 7,5. Однако прямое измерение pH в микроокружении опухоли in vivo может быть затруднено. К счастью, относительная протеазная активность катепсина является более высокой при более низком pH и является более низкой при более высоком pH. Следовательно, измерение внутриопухолевой активности катепсина может служить суррогатным показателем pH микроокружения опухоли. Для измерения активности катепсина B, L, S, K, V и D in vivo использовали зонд ProSense 750 FAST (PerkinElmer) в ближнем инфракрасном диапазоне. Для дополнительной модуляции pH в микроокружении опухоли путем введения бикарбоната натрия, иссеченные опухоли обрабатывали феноловым красным и отмечали окраску. Феноловый красный представляет собой индикатор pH, который претерпевает изменение цвета в зависимости от pH. Натриевая соль фенолового красного широко используется в средах для культивирования клеток для определения значений pH. Раствор фенолового красного имеет желтый цвет при pH 6,4 или ниже, оранжевый цвет при pH 7,0, красный цвет при pH 7,4 и пурпурный цвет при pH выше 7,8.
[987] С мышами обращались в соответствии с протоколами, утвержденными Комитетом по уходу и использованию животных. Подкожные (sc) ксенотрансплантаты опухоли яичника китайского хомячка (CHO) устанавливали в задний бок самок мышей B-NSG в возрасте 12-14 недель (NOD-PrkdcscidIl2rgtm1/Bcgen (Beijing Biocytogen Co. Ltd.). Вкратце, культивированные клетки СНО (АТСС, Манассас, Вирджиния) промывали DPBS (ThermoFisher), подсчитывали, ресуспендировали в холодном DPBS и смешивали с соответствующим объемом Matrigel ECM (Corning; конечная концентрация 5 мг/мл) в концентрации 1,5 × 106 клеток/200 мкл на льду.
[988] Животных готовили к инъекции с использованием стандартной одобренной анестезии с удалением волос (Nair) перед инъекцией. 200 мкл клеточной суспензии в ЕСМ вводили подкожно в задние бока мышей. После пальпации опухоли их измеряли штангенциркулем 2 раза в неделю. Объем опухоли рассчитывали с использованием следующего уравнения: (наибольший диаметр * наименьший диаметр2)/2. Когда средний объем опухоли достигал 200 мм3, мышей случайным образом распределяли в соответствующие группы обработки.
[989] За два дня до введения бикарбоната питьевую воду для мышей B-NSG меняли с кислой на очищенную в автоклаве воду с обычным pH. На следующий день зонд 750 ProSense FAST вводили 6 мышам, несущим опухоль с ксенотрансплантатом CHO, посредством инъекции 100 мкл в хвостовую вену (зонд ProSense 750 FAST 4 нмоль/100 мкл PBS). Отдельную группу мышей с опухолью CHO-ксенотрансплантата оставили без обработки. На следующий день вводили бикарбонат натрия и выполняли визуализацию мышей, получавших зонд ProSense 750 FAST, с помощью Caliper IVIS Lumina XR. Вкратце, мышей анестезировали с использованием изофлурана 3% O2 2 л/мин в газе-носителе O2 со скоростью 2 л/мин., а затем помещали в носовые конусы, доставляющие 1,5% изофлурана анестезированным мышам во время визуализации. Получение изображений состояло из 5-секундной экспозиции для зондов в ближнем инфракрасном диапазоне (длина волны возбуждения/излучения 745/810 нм). Изображения флуоресценции накладывались на изображения мышей в нормальном свете. Изображения времени 0 (предварительная обработка) получали перед введением либо PBS (контроль), либо бикарбоната натрия. Затем мышам вводили либо 1 мл/мышь PBS (контроль, ThermoFisher), либо 1 мл/мышь 1 М бикарбоната натрия (Shanghai Experiment Reagent Co., LTD) посредством внутрибрюшинной инъекции (ip). Затем мышей визуализировали через 30 минут после введения PBS или бикарбоната. Собранные флуоресцентные изображения корректировали так, чтобы иметь идентичные минимальные, максимальные и пороговые значения. Подсчет фотонов определяли в этом исследовании как относительные единицы флуоресценции (RFU). RFU рассчитывали путем нормализации количества фотонов от 30-минутной временной точки до временной точки до обработки (время 0; 100%) для каждой мыши. Из-за вариабельности между значениями флуоресценции у каждой мыши в момент времени 0 значение предварительной обработки, наблюдаемые значения интенсивности флуоресценции в различные моменты времени нормализовали только для отдельной мыши, а не до среднего значения до обработки.
[990] В отдельной группе эксперимента 6 мышей, которые не получали катепсиновый зонд NIR, умерщвляли путем смещения шейного позвонка через 1,5 часа после внутрибрюшинного введения PBS или бикарбоната натрия. Опухоль ксенотрансплантата СНО вырезали из каждой мыши. Опухоли ксенотрансплантата разделили на две половины с помощью скальпеля и поместили на чашку Петри. Затем половинки опухолевой ткани многократно разрезали/нарезали с помощью скальпеля. К каждой половине опухоли по каплям добавляли воду или 0,05% раствор фенолового красного (50 мг фенолового красного/100 мл воды) соответственно. Отмечали цвет и получали изображения обработанных ксенотрансплантатов опухоли и раствора фенолового красного, оставшегося на чашке Петри после удаления образцов ксенотрансплантата опухоли.
Результаты
[991] На Фиг. 29 изображены результаты RFU (среднее значение вычислено с SEM) визуализации активности внутриопухолевого катепсина у мышей с опухолью CHO-ксенотрансплантата до и после введения PBS (контроль; n = 3) или бикарбоната (n = 3). Эти результаты предполагают, что введение бикарбоната натрия может повышать pH микроокружения опухоли in vivo, о чем свидетельствует снижение активности катепсина, наблюдаемое после внутрибрюшинного введения бикарбоната натрия.
[992] Изменение цвета индикатора фенолового красного с желтого/оранжевого на красный наблюдали с использованием опухолевой ткани, вырезанной у мышей, обработанных бикарбонатом натрия (n = 3), по сравнению с мышами, обработанными PBS (n = 3). Эти результаты предполагают, что введение бикарбоната натрия повышало pH микроокружения опухоли in vivo после внутрибрюшинного введения, о чем свидетельствует изменение цвета индикатора фенолового красного с желтого/оранжевого на красный.
Пример 17. Идентификация кандидатных химерных полипептидных лимфопролиферативных элементов
[993] В этом примере две библиотеки химерных полипептидов (библиотека 1 и библиотека 2) кандидатеых (предполагаемых) химерных лимфопролиферативных элементов собирали в вирусные векторы из пулов внеклеточных трансмембранных блочных последовательностей, внутриклеточных блочных последовательностей и библиотеки баркодов в соответствии с конструкциями, кодирующимий химерный полипептид, представленной на Фиг. 30 и 31. За пролиферацией трансдуцированных библиотекой PBMC наблюдали с течением времени: геномную ДНК экстрагировали из PBMC с интервалом в одну неделю, и область баркода амплифицировали для секвенирования ДНК, чтобы оценить количество клеток в этих смешанных культурах PBMC, содержащих каждый из химерных тестируемых лимфопролиферативных элементов. Таким образом, в ходе скрининга проверяли способность кандидатных химерных лимфопролиферативных элементов стимулировать пролиферацию клеток PBMC в отсутствие IL-2 или любого другого экзогенного цитокина.
[994] В этом исследовании создавали и анализировали две библиотеки: конструкции библиотеки 1 (которую использовали в скринингах, идентифицированных как библиотеки 1A, 1.1A и 1.1B) фланкировали CAR на 5' конце кандидатного химерного полипептида, в то время как конструкции библиотеки 2 (которую использовали в скринингах, идентифицированных как библиотеки 2B и 2.1B) не включали CAR (Фиг.. 30 и 31). На Фиг. 30 представлена схема неограничивающей иллюстративной кассеты экспрессии трансгена, содержащей полинуклеотидную последовательность, кодирующую CAR, и кандидатный химерный лимфопролиферативный элемент (CLE) библиотеки 1, управляемый промотором EF-1 альфа и последовательностью типа Козак (GCCGCCACC (SEQ ID NO: 519)) в каркасе лентивирусного вектора. CAR помечали FLAG и он содержал ASTR, направленный на CD19, ствол и трансмембранную часть CD8, а также внутриклеточный активирующий домен от CD3z. Каждый кандидатный лимфопролиферативный элемент библиотеки 1 включал 3 модуля; внеклеточный/трансмембранный модуль (P1-2) и 2 внутриклеточных модуля (P3 и P4). Модуль P1-2 также кодировал домен распознавания и/или элиминации (TAG). Тройная стоп-последовательность (TAATAGTGA (SEQ ID NO: 520)) отделяла P4 от баркода ДНК (P5). WPRE (GTCCTTTCCATGGCTGCTCGCCTGTGTTGCCACCTGGATTCTGCGCGGGACGTCCTTCTGCTACGTCCCTTCGGCCCTCAATCCAGCGGACCTTCCTTCCCGCGGCCTGCTGCCGGCTCTGCGGCCTCTTCCGCGTCTTCGCCTTCGCCCTCAGACGAGTCGGATCTCCCTTTGGGCCGCCTCCCCGCCTG (SEQ ID NO:521)) присутствовал между последним стоп-кодоном (начинающимся через 4 п.н. после последнего нуклеотида последнего стоп-кодона) и 3' LTR (который начинался через 83 нуклеотида после последнего нуклеотида WPRE).
[995] CAR и P1-2 библиотеки 1 разделяли полинуклеотидной последовательностью, кодирующей последовательность с рибосомным проскоком T2A.
[996] На Фиг. 31 представлена схема неограничивающей иллюстративной кассеты экспрессии трансгена, содержащей полинуклеотидную последовательность, кодирующую кандидатный CLE библиотеки 2, управляемый промотором EF-1 альфа и последовательностью типа Козак (GCCGCCACC (SEQ ID NO: 519)) в каркасе лентивирусного вектора. Каждый кандидатный лимфопролиферативный элемент библиотеки 2 включал 3 модуля; внеклеточный/трансмембранный модуль (P1-2) и 2 внутриклеточных модуля (P3 и P4). Модуль P1-2 также кодировал домен распознавания и/или элиминации (TAG). Тройная стоп-последовательность (TAATAGTGA (SEQ ID NO: 520)) отделяла P4 от баркода ДНК (P5). WPRE (GTCCTTTCCATGGCTGCTCGCCTGTGTTGCCACCTGGATTCTGCGCGGGACGTCCTTCTGCTACGTCCCTTCGGCCCTCAATCCAGCGGACCTTCCTTCCCGCGGCCTGCTGCCGGCTCTGCGGCCTCTTCCGCGTCTTCGCCTTCGCCCTCAGACGAGTCGGATCTCCCTTTGGGCCGCCTCCCCGCCTG (SEQ ID NO:521)) присутствовал между последним стоп-кодоном (начинающимся через 4 п.н. после последнего нуклеотида последнего стоп-кодона) и 3' LTR (который начинался через 83 нуклеотида после последнего нуклеотида WPRE).
[997] Собранная часть кандадитного химерного полипептида обеих библиотек соответствовали точно такой же конструкции с 3 положениями (1 внеклеточный модуль/трансмембранный модуль (P1-2) и 2 внутриклеточных модуля (P3 и P4), одна из которых может представлять собой сигнал ранней терминации). Линкеры GGS, кодируемые последовательностями нуклеиновых кислот между каждым из доменов, включены как продукт сборки конструкции. Нуклеиновые кислоты, кодирующие полные или вариантные версии Myc или домена распознавания и/или элиминации eTAG (обозначенных в Табл. 6 как «eTAG» или «метка Myc»), вставляли в направлении 5' во внеклеточный домен каждого усеченного цитокинового рецептора (или выбранной конструкции LMP1) как часть модулей P1-2, так чтобы кодируемые химерные кандидатные полипептиды включали домен распознавания и/или элиминации в рамке с внеклеточным доменом. Сигнальную последовательность вставляли на 5' конце последовательностей, кодирующих CAR в библиотеке 1, и на 5' конце последовательностей, кодирующих домен узнавания и/или элиминации, в библиотеке 2. Последовательность типа Козак (GCCGCCACC (SEQ ID NO: 519)), которая также является усиленной последовательностью типа Козак, вставляли в пределах 10 нуклеотидов перед старт-кодоном ATG, который находился на 5' конце кодирующих последовательностей сигнальной последовательности в библиотеке 1 и на 5' конце последовательностей, кодирующих домен распознавания и/или элиминации (или выбранных конструкций LMP1) в библиотеке 2. Четвертый модуль содержал случайный баркод, сгенерированный случайной сборкой ПЦР из ~ 10000 × ~ 10000 подбаркодов (~ 100 миллионов комбинаций). Кодирующие последовательности CAR для конструкций из библиотеки 1 кодировали сигнальную последовательность, метку FLAG, ASTR scFv к CD19, ствол CD8a, трансмембранный домен CD8a и внутриклеточный активирующий домен CD3 дзета. Экспрессию CAR (только библиотека 1) и CLE (библиотека 1 и библиотека 2) управляли промотором EF1 альфа. В конструкциях библиотеки 1 сайт T2A располагался между CAR и последовательностями, кодирующими химерный полипептид. В библиотеках 1 и 2 тройной стоп-кодон присутствует на 3' конце P4.
Синтез вирусных векторов
[998] Отдельные части для сборки библиотеки конструировали и синтезировали в виде блоков ДНК с выступами и коннекторами совместимого фермента типа II (AarI), кодирующими последовательность глицин-глицин-серин на 5' и 3' концах каждой части. Затем эти части индивидуально клонировали в универсальные плазмидные векторы. Сборку для каждой части выполняли в виде сборки из одной пробирки, в которой 0,04 пмоль части, 0,04 пмоль смеси баркода и 0,04 пмоль каркаса плазмидного вектора добавляли в 10 мкл реакционной смеси с последующим добавлением 1 единицы фермента AarI, 10 единиц ДНК-лигазы Т4 и 1X лигазного буфера (50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ АТФ, 10 мМ DTT) для оптимальной активности лигазы. Циклы переваривания и лигирования проводили с использованием термоциклера следующим образом: 55 циклов при 37 °C в течение 2 минут и при 16 °C в течение 5 минут; инкубация в течение 5 минут при 50 °C для окончательного переваривания; 10 минут инкубации при 80 °C для инактивации AarI; и окончательная выдержка при 4 °C. Затем собранные векторы очищали стандартным осаждением этанолом. Полученные очищенные векторы электропорировали (Electro Micropulser, Bio-rad) в электрокомпетентные клетки Top10 (Thermo Fisher Scientific) и непосредственно восстанавливали в жидких культурах, содержащих антибиотик канамицин, для отбора и экспансии. Культуры инкубировали при 37 °C в течение 10-12 часов, а затем собирали и очищали плазмиды с использованием набора ZymoPURE-EndoZero™ Plasmid Gigaprep.
Получение лентивирусных частиц
[999] Рекомбинантные лентивирусные частицы получали путем временной трансфекции клеток 293T (Lenti-X™ 293T, Clontech) отдельными лентивирусными упаковывающими плазмидами, кодирующими gag/pol и rev, и плазмидой псевдотипирования, кодирующей VSV-G. Синтезированные вирусные векторы, кодирующие химерные кандидатные полипептиды с коэкспрессируемым рецептором химерного антигена или без него, котрансфицировали упаковывающими плазмидами. Клетки адаптировали к суспензионной культуре путем серийного выращивания в Freestyle™ 293 Expression Medium (ThermoFisher Scientific). Клетки в суспензии высевали при концентрации 1 × 106 клеток/мл (200 мл) в колбу Эрленмейера на 1 мл и сразу же трансфицировали полиэтиленимином (PEI) (Polysciences), растворенным в слабой кислоте.
[1000] Плазмидную ДНК разводили в 10 мл среды Gibco™ Opti-MEM™ для 200 мл клеток. Для получения лентивирусных частиц, псевдотипированных VSV-G, использованная общая ДНК (1 мкг/мл объема культуры) представляла собой смесь 4 плазмид со следующими молярными отношениями: 2x комбинированные вирусные векторы, 1x Rev-содержащая плазмида, 1x VSV-G-содержащая плазмида и 1x gag/pol-содержащая плазмида. Отдельно PEI разбавляли в 10 мл Gibco™ Opti-MEM™ до 2 мкг/мл (объем культуры, отношение к ДНК 2:1). После 5-минутной инкубации при комнатной температуре два раствора тщательно смешали и инкубировали при комнатной температуре в течение еще 20 минут. К клеткам добавляли конечный объем (20 мл). Затем клетки инкубировали при 37 °C в течение 48 часов при вращении со скоростью 125 об./мин. и с 8% CO2.
[1001] Через 48 часа супернатанты собирали и осветляли центрифугированием при 1000g в течение 10 минут. Затем вирусный супернатант фильтровали через фильтры PVDF Millex-HV 0,45 мкм с низким связыванием белка (Millipore, каталожный № SLHVR25LS). Осветленные супернатанты сливали в новую пробирку, 1 объем Lenti-X PEG (Takara, 4x) смешивали с 3 объемами осветленного супернатанта и инкубировали при 4 °C в течение ночи. Затем лентивирусные частицы осаждали центрифугированием в течение 90 минут при 1500 g и 4 °C. Супернатант отбрасывали, а осадки лентивирусных частиц ресуспендировали в 1:100 от начального объема полной среды для выращивания РВМС без IL-2. Лентивирусные частицы титровали с использованием набора для анализа p24 ELISA от Takara (№ 632200).
Трансдукция и культивирование PBMC
[1002] Цельную человеческую кровь от здорового донора (101 мл) собирали в пакет для крови на 200 мл, содержащий антикоагулянт CDP (Nanger; S-200). Кровь обрабатывали центрифугированием в градиенте плотности с Ficoll-Pacque™ (General Electric) с использованием устройства Sepax 2 S-100 (Biosafe; 14000) в соответствии с инструкциями производителя и набора CS900.2 (BioSafe; 1008) для получения мононуклеарных клеток периферической крови (PBMC). Выход жизнеспособных РВМС составил 7,3 × 107 клеток. 1,5 × 107 PBMC добавляли в каждое из двух устройств для культивирования клеток G-Rex 100M (Wilson Wolf, 81100S) до конечной концентрации 0,5 × 106 жизнеспособных клеток/мл в конечном объеме 30 мл Complete OpTmizerTM CTSTM T-Cell Expansion SFM (OpTmizerTM CTSTM T-Cell Expansion Basal Medium 1 L (Thermo Fisher, A10221) с 26 мл добавки OpTmizerTM CTSTM для экспансии Т-клеток (Thermo Fisher, A10484-02), 25 мл CTS™ Immune Cell SR (Thermo Fisher, A2596101) и 10 мл добавки CTS™ GlutaMAX™-I (Thermo Fisher, A1286001) в соответствии с инструкциями производителя. Рекомбинантный интерлейкин-2 человека (IL-2) (Novoprotein) также добавляли до концентрации 100 МЕ/мл вместе с активирующими Ab к CD3 (OKT3, Novoprotein), добавленными в концентрации 50 нг/мл, для активации PBMC для трансдукции вирусов. Устройства G-Rex инкубировали в течение ночи в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. После инкубации в течение ночи препараты лентивирусных частиц, содержащие желаемые тестируемые конструкции, кодирующие химерный полипептид (библиотека 1 или библиотека 2), добавляли в индивидуальные устройства G-Rex при множественности заражения (MOI) 5. Устройства G-Rex (библиотека 1 и библиотека 2) инкубировали в течение ночи в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. После инкубации в течение ночи добавляли дополнительное количество Complete OpTmizer™ CTS™ T-Cell Expansion SFM для доведения конечного объема каждого устройства G-Rex до 500 мл. Никаких дополнительных IL-2 или других экзогенных цитокинов не добавляли на этой или следующих стадиях культивирования клеток. Устройство G-Rex® инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2 в течение 7 дней после выделения PBMC. В день 7 клетки из двух устройств G-Rex, трансдуцированные библиотекой 1 или библиотекой 2, собирали центрифугированием и ресуспендировали в свежей Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. 1,25 × 107 клеток библиотеки 1 и 2,54 × 107 клеток библиотеки 2 помещали в новое устройство G-Rex 100M, содержащее 500 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. Один флакон с размороженными в день 0 замороженными РВМС, совместимыми по донору (1,46 × 107 РВМС), добавляли к устройствам G-Rex, содержащим клетки, трансдуцированные библиотекой 1, чтобы обеспечить активацию CD19+ B-клетками CD19 ASTR. В этих скринингах клетки, в которые вводили PBMC, обозначали буквой A после номера библиотеки, например, скрининг, проведенный с клетками, трансдуцированными с помощью библиотеки 1 и подпитываемыми PBMC, в данном документе обозначаются как библиотека 1A. Библиотека 2 не получала PBMC дня 0. В этих скринингах клетки, в которые не вводили PBMC, обозначали буквой В после номера библиотеки, например, скрининг, проведенный с клетками, трансдуцированными с помощью библиотеки 2 и не подпитываемыми PBMC, в данном документе обозначаются как библиотека 2В. Устройства G-Rex инкубировали в течение ночи в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. В день 14 клетки из двух устройств G-Rex (библиотека 1A и библиотека 2B) собирали центрифугированием и ресуспендировали в свежей Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. Каждую из них помещали в отдельные лунки 6-луночных планшетов G-Rex (Wilson-Wolf; 80240M), содержащих 30 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. Один флакон с размороженными в день 0 замороженными РВМС, совместимыми по донору, добавляли к лунке, содержащей клетки библиотеки 1А, чтобы обеспечить активацию CD19+ B-клетками CD19 ASTR. Устройства G-Rex инкубировали в течение ночи в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. В день 21 клетки собирали из лунок 6-луночных планшетов G-rex, и способ, выполненный в день 14, повторяли. Образцы (от 1 × 105 до ~ 4-5 × 106 клеток) собирали в различные дни после трансдукции (дни 7, 21, 28 и/или 35), и геномную ДНК очищали с использованием GenElute™ Genomic DNA Miniprep в соответствии с протоколом наборов. В некоторых случаях образцы очищали с использованием центрифугирования в градиенте плотности с Ficoll-Pacque™ (General Electric) для удаления мертвых клеток перед экстракцией геномной ДНК. Очищенную геномную ДНК секвенировали с использованием Illumina HiSeq, получая считывания парных концов длиной 150 п.н. Обычно подгруппу из 10 миллионов считываний извлекали из каждого индексированного файла fastq и обрабатывали для анализа с помощью barcode_reader, специального сценария R, разработанного для извлечения последовательностей баркодов на основе наличия константной области. Очищенную геномную ДНК также секвенировали в системе секвенирования PacBio с получением длин с более длинными считываниями для связывания баркодов с конструкциями. Эти скрининги повторяли, и библиотеки обозначали 1.1A, 1.1B и 2.1B, где A и B указывали, были ли клетки подпитаны PBMC, как обсуждалось выше.
Анализ данных
[1003] После получения данных HiSeq для всех временных точек таблицы подсчета баркодов объединяли на основе ID баркода. Количество нормализовали до «количество на миллион» по формуле: 1 × 106 * исходное количество/сумма (исходное количество всех баркодов в образце), которое называется значениями распространенности. Баркоды со средней распространенностью 0,33 копий в минуту в момент времени или меньше отбрасывали. Ассоциации полноразмерной конструкции с баркадом, полученные с помощью SMRT-секвенирования (Pacific Biosciences) в выбранные моменты времени, использовали для идентификации представляющих интерес сборок. Неполные конструкции, не имеющие трех частей, или неоднозначные конструкции, содержащие более одного вызова конструкции, отфильтровывали. Значения обогащения для каждой сборки рассчитывали как (нормализованное количество в конечной временной точке + 1)/(нормализованное количество в начальной временной точке + 1). Гены кандидатных химерных полипептидов идентифицировали ы как конструкции с обогащением выше порогового значения, специфичного для каждой библиотеки.
Результаты
[1004] Химерные полипептидные кандидаты конструировали так, чтобы иметь 3 тестовых домена, которые включали внеклеточный и трансмембранный домен (P1-2), первый внутриклеточный домен (P3) и второй внутриклеточный домен (P4) (Фиг. 30 и 31). Кроме того, конструкции включали баркод ДНК, чтобы облегчить анализ и идентификацию конструкции с использованием секвенирования следующего поколения. Кроме того, большинство конструкций, как показано в Табл 6, включали последовательности нуклеиновых кислот, кодирующие домен узнавания и/или элиминации в рамке с внеклеточным и трансмембранным доменом. Однако домены распознавания и/или элиминации этих конструкций, кодирующих внеклеточный или трансмембранный фрагмент LMP1, были внутриклеточными для тех конструкций, которые содержали такой домен распознавания и/или элиминации. Конструкции библиотеки 1 кодировали CAR перед химерным полипептидным кандидатом. Всего разрабатывали 226840 концептуальных возможных комбинаций на основе 20 различных внеклеточных-трансмембранных доменов, 106 возможных доменов P3 и 107 возможных доменов P4, один из которых предсталял собой стоп-кодон. Не все концептуальные конструкции обнаруживали после сборки вирусного вектора, продуцирования лентивирусных частиц, трансдукции PMBC и 7 дней культивирования. Для библиотеки 1A после трансдукции PBMC и 7 дней культивирования присутствовала 57815 конструкции. Для библиотеки 2В после трансдукции PBMC и 7 дней культивирования присутствовала 69578 конструкции. Подробная информация о проанализированных кандидатах, а также подробные результаты представлены в Табл. 7-11. Подробная информация о различных кандидатных частях представлена в Табл. 6. Заголовки Табл. 7-11 следующие: блочная последовательность представляет собой код доменов P1-P2, P3 и P4 из Табл. 6, используемый в каждой конструкции; Norm_D7 представляет собой нормализованное содержание в день 7; Enrich_DXX представляет собой обогащение в день XX по сравнению с днем 7, где XX представляет собой день, указанный в таблице, например, Enrich _D21 представляет собой обогащение в день 21 по сравнению с днем 7, а Enrich_D35 представляет собой обогащение в день 35 по сравнению с днем 7. Данные для конструкции отображаются в непосредственных правых столбцах конструкции. В каждой строке показаны данные для двух конструкций. Например, первый кандидат, указанный в Табл. 7, представляет собой M008-S212-S075. Для этого кандидата внеклеточный и трансмембранный домен (P1-2) представляет собой M008, первый внутриклеточный домен (P3) представляет собой S212, а второй внутриклеточный домен (P4) представляет собой S075. Подробная информация об идентичности этих модулей, например, M008, находится в Табл. 6. В Табл. 6 раскрыто, что M008 представляет собой LMP1 и что конструкция включает метку Myc. Аминокислотные последовательности кандидатных доменов представлены в Табл. 6. Для пояснения идентификатор GenBank в Табл. 6 представляет последовательность нуклеиновой кислоты, которая кодирует полипептидный домен. В некоторых случаях последовательность нуклеиновой кислоты модифицировали для облегчения клонирования или для оптимизации кодонов, но кодирует тот же полипептид, что и последовательность GenBank. В некоторых случаях, как будет очевидно из аминокислотной последовательности, представленной в Табл. 6, использовали часть полипептида, кодируемую последовательностью GenBank.
[1005] Кандидатуры внеклеточных и трансмембранных доменов выбирали из известных мутантных рецепторов, таких как цитокиновые рецепторы или гормоны, которые, как сообщается, являются конститутивно активными при экспрессии, по меньшей мере, в некоторых типах клеток. Области связывания лиганда не включали в кандидатные внеклеточные и трансмембранные домены. Мутации в таких мутантах рецептора происходят в трансмембранной области или околомембранной области. Иллюстративные кандидатные внеклеточные и трансмембранные домены содержали IL7RA Ins PPCL, LMP1, CRLF2 F232C, CSF2RB V449E, CSF3R T640N, EPOR L251C I252C, GHR E260C I270C, IL27RA F523C и MPL S505N. Кандидатные внеклеточные и трансмембранные домены включали вирусный белок дикого типа LMP1, который представляет собой многопролетный трансмембранный белок, который, как известно, активирует передачу клеточных сигналов независимо от лиганда при нацеливании на липидные рафты или при слиянии с CD40 (Kaykas et al. EMBO J. 20: 2641 (2001)).
[1006] Идентичности потенциальных полипептидов, выбранных для оккупации первого и второго внутриклеточных доменов кандидатных химерных полипептидов, были одинаковыми. Эти кандидатные внутриклеточные домены представляли собой внутриклеточные сигнальные домены генов, которые известны по меньшей мере для некоторых типов клеток, способствующие пролиферации, выживанию (антиапоптотические) и/или обеспечивающие костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к гибели клеток. Известно, что некоторые из внутриклеточных доменов кандидатных химерных полипептидов активируют передачу сигналов с участием JAK1/JAK2 и STAT5. В библиотеку включали внутриклеточные домены некоторых генов, перечисленных в Табл. 6. Иллюстративные внутриклеточные домены этих генов представлены в положениях P3 и P4 в Табл. 7-11. Подробная информация об этих доменах P3 и P4 представлена в Табл. 6.
[1007] Для библиотеки 1A, которая включала конструкции, кодирующие химерные полипептиды и CAR, идентифицировали 172 наиболее вероятных химерных полипептида (см. Табл. 7, в которой обогащение рассчитывали как log2 (нормализованное количество в последний день, указанное в таблице + 1) - log2 (нормализованное количество в день 7 + 1)), который способствовал пролиферации PBMC в наибольшей степени (и также вероятной выживаемости) между днем7 и последним днем, указанным в таблице, при культивировании в отсутствие IL-2. Примечательно, что этот и все скрининговые эксперименты Примеров 17 и 18 являются конкурентными. Таким образом, отрицательный результат не означает, что конструкция не способствует пролиферации Т-клеток в отсутствие факторов роста, таких как IL-2. Это означает только то, что по сравнению с другими тестированными конструкциями, он был лучше в отношении пролиферации.
[1008] Для библиотеки 1A некоторые из химерных полипептидных конструкций способствовали пролиферации клеток между днем 7 и последним днем, указанным в таблице для каждого внеклеточного и трансмембранного мутантного домена, тестированного в положении P1-2. Кроме того, когда все результаты для всех конструкций, полученных из одного и того же положения P1-2 мутанта, объединяли, все тестированные внеклеточные и трансмембранные домены давали обогащение клеток более чем 1 (т.е. усиление пролиферации клеток) между днем 7 и последним днем, указанным в таблице. Примеры внеклеточных и/или трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали пролиферации клеток, представлены в Табл. 7. Примеры внеклеточных и/или трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 1.1А, которые способствовали пролиферации клеток, представлены в Табл. 9. Примеры внеклеточных и/или трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 1.1В, которая включала клетки, трансдуцированный библиотекой 1, которые не подпитывали PBMC, которые способствовали пролиферации клеток, представлены в Табл. 10.
[1009] Для библиотеки 1A внутриклеточные домены из CD3D, CD3E, CD8A, CD27, CD40, CD79B, IFNAR1, IL2RA, IL3RA, IL13RA2, TNFRSF8 и TNFRSF9 или их мутантов, которые, как известно, обладают сигнальной активностью, если такие мутанты присутствуют в конструкциях, представленных в таблицах, при обнаружении в положении первого внутриклеточного домена (P3) кандидатных химерных полипептидов способствовали пролиферации PBMC между днем 7 и последним днем, указанным в таблице, когда данные рассматривали комбинированным образом для всех конструкций с первыми внутриклеточными доменами (P3), происходящими из этого гена. Этот вывод основан на подсчетах обогащения последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что по меньшей мере в 3 раза больше подсчетов для такого домена присутствовало в последний день, указанный в таблице, чем в день 7 для библиотеки 1А, когда результаты для всех конструкций для гена объединяются. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 7. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 1.1B, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 9. Примеры первых внеклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 1.1В, которая включала клетки, трансдуцированный библиотекой 1, которые не подпитывали PBMC, которые способствовали пролиферации клеток, представлены в Табл. 10.
[1010] Для библиотеки 1A внутриклеточные домены из CD3D, CD3G, CD8A, CD8B, CD27, CD40, CD79B, CRLF2, FCGR2C, ICOS, IL2RA, IL13RA1, IL13RA2, IL15RA, TNFRSF9 и TNFRSF18 или их мутанты, которые, как известно, обладают сигнальной активностью, если такие мутанты присутствуют в таблицах, при обнаружении в положении второго внутриклеточного домена (P3) кандидатных химерных полипептидов способствовали пролиферации PBMC между днем 7 и последним днем, указанным в таблице, когда данные рассматривали комбинированным образом для всех конструкций с вторыми внутриклеточными доменами (P3), происходящими из этого гена. Этот вывод основан на подсчетах обогащения последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что по меньшей мере в 2,9 раза больше подсчетов для такого домена присутствовало в день 35, чем в день 7, для библиотеки 1А, когда результаты для всех конструкций для гена объединяются. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 7. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 1.1А, которые способствовали пролиферации клеток, представлены в Табл. 9. Примеры вторых внеклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 1.1В, которая включала клетки, трансдуцированный библиотекой 1, которые не подпитывали PBMC, которые способствовали пролиферации клеток, представлены в Табл. 10.
[1011] Более конкретно для библиотеки 1A из 5996 конструкций с MPL S505N (протоонкоген MPL, рецептор тромбопоэтина с серином 505, мутированным в аспарагин) в качестве модуля P1-P2, 165 были положительными, которые определяли как конструкции с обогащением более двух для библиотеки 1А. Из 436 конструкций с CD3D (молекула CD3d) в качестве модуля P3 24 были положительными. Из 528 конструкций с CD3E (молекула CD3e) в качестве модуля P3 17 были положительными. Из 261 конструкций с CD8A (молекула CD8a) в качестве модуля P3 14 были положительными. Из 1022 конструкций с CD40 (молекула CD40) в качестве модуля P3 50 были положительными. Из 568 конструкций с IL3RA (субъединица рецептора интерлейкина 3 альфа) в качестве модуля P3 26 были положительными. Из 556 конструкций с CD79B (молекула CD79b) в качестве модуля P3 27 были положительными. Из 131 конструкций с IFNAR1 (интерферон альфа и субъединица 1 бета рецептора) в качестве модуля P3 7 были положительными. Из 519 конструкций с IL13RA2 (субъединица рецептора интерлейкина 13 альфа 2) в качестве модуля P3 33 были положительными. Из 571 конструкций с IL2RA (субъединица рецептора интерлейкина 2 альфа) в качестве модуля P3 28 были положительными. Из 618 конструкций с CD27 (молекула CD27) в качестве модуля P3 30 были положительными. Из 573 конструкций с TNFRSF8 (представитель 8 суперсемейства рецепторов TNF) в качестве модуля P3 15 были положительными. Из 573 конструкций с TNFRSF9 (представитель 9 суперсемейства рецепторов TNF) в качестве модуля P3 25 были положительными. Из 360 конструкций с IL13RA2 (субъединица рецептора интерлейкина 13 альфа 2) в качестве модуля P4 25 были положительными. Из 490 конструкций с IL2RA (субъединица рецептора интерлейкина 2 альфа) в качестве модуля P4 28 были положительными. Из 489 конструкций с IL15RA (субъединица рецептора интерлейкина 15 альфа) в качестве модуля P4 22 были положительными. Из 590 конструкций с CD8A (молекула CD8a) в качестве модуля P4 25 были положительными. Из 619 конструкций с IL13RA1 (субъединица рецептора интерлейкина 13 альфа 1) в качестве модуля P4 25 были положительными. Из 637 конструкций с CD3G (молекула CD3g) в качестве модуля P4 30 были положительными. Из 618 конструкций с CD3D (молекула CD3d) в качестве модуля P4 37 были положительными. Из 673 конструкций с CD27 (молекула CD27) в качестве модуля P4 29 были положительными. Из 654 конструкций с CD79B (молекула CD79b) в качестве модуля P4 33 были положительными. Из 728 конструкций с TNFRSF9 (представитель 9 суперсемейства рецепторов TNF) в качестве модуля P4 30 были положительными. Из 1169 конструкций с CD40 (молекула CD40) в качестве модуля P4 53 были положительными. Из 1324 конструкций с TNFRSF18 (представитель 18 суперсемейства рецепторов TNF) в качестве модуля P4 54 были положительными. Из 1739 конструкций с CD8D в качестве модуля P4 73 были положительными. Из 286 конструкций с CRLF2 в качестве модуля P4 8 были положительными. Из 725 конструкций с FCGR2C в качестве модуля P4 29 были положительными. Из 602 конструкций с ICOS в качестве модуля P4 24 были положительными.
[1012] Для библиотек 1A и 1.1A конструкции M001-S116-S044, M024-S192-S045, M001-S047-S102, M048-S195-S043, M012-S216-S211 и M030-S170-S194 имели особенно заметные обогащения при обоих скринингах. Для целей повторных скринингов конструкциями с особенно заметными обогащением были те, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2.
[1013] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 1А, так и библиотеки 1.1А представлена в Табл. 19, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из IL6R, MYD88, CD27, MYD88, TNFRSF18 или IL31RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD8B, IL1RL1, CD8A, TNFRSF4 или MYD88, когда они присутствуют во втором внутриклеточном домене (P4), демонстрировали особенно заметные обогащения в библиотеках 1A и 1.1A (Табл. 19). Конструкции с доменами цитокиновых рецепторов IL6R, CD27, TNFRSF18 или IL31RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов IL1RL1 или TNFRSF4, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметные обогащения в библиотеках 1A и 1.1A (Табл. 19).
[1014] В библиотеке 1A, которая включала конструкции, кодирующие химерные полипептиды и не кодирующие CAR, идентифицировали 167 наиболее эффективных кандидатов (см. Табл. 8, в которой обогащение рассчитывали как log2 (нормализованное количество в последний день, указанное в таблице + 1) - log2 (нормализованное количество в день 7 + 1)), который способствовал пролиферации PBMC между днем 7 и последним днем, указанным в таблице, при культивировании в отсутствие IL-2. Примечательно, что в целом обогащение было меньше, чем обнаруженное для конструкций из библиотеки 1A, которая включала CAR.
[1015] Для библиотеки 2B CSF3R T640N в положении P1-2 способствовал пролиферации клеток между днем 7 и последним днем, указанным в таблице, более эффективно, чем другие тестированные внеклеточные и трансмембранные (P1-2) домены, когда все результаты для всех конструкций, полученных на основе внеклеточных и трансмембранных доменов объединяли, что приводило к коэффициенту обогащения более 2,5. Примеры внеклеточных и/или трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 8. Примеры первых внеклеточных и/или трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 2.1B, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 11.
[1016] Для библиотеки 2В внутриклеточные домены из CD8A, CD40, IFNAR1, IL31RA и MyD88 или их мутантов, которые, как известно, обладают сигнальной активностью, если такие мутанты присутствуют в таблицах, при обнаружении в положении первого внутриклеточного домена (P3) кандидатных химерных полипептидов способствовали клеточной пролиферации PBMC между днем 7 и последним днем, указанным в таблице, когда данные рассматривали комбинированным образом для всех конструкций с первыми внутриклеточными доменами (P3), происходящими из этого гена. Этот вывод основан на подсчетах обогащения последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что по меньшей мере в 2 раза больше подсчетов для такого домена присутствовало в день 28, чем в день 7, для библиотеки 2В, когда результаты для всех конструкций для гена объединяются. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 8. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 2.1B, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 11.
[1017] Для библиотеки 2B внутриклеточные домены из CD27 или его мутантов, которые, как известно, обладают сигнальной активностью, если такие мутанты присутствуют в конструкциях, представленных в таблицах, при обнаружении во втором положении внутриклеточного домена (P4) химерных полипептидных кандидатов, когда данные рассматриваются в совокупности для всех конструкций со вторыми внутриклеточными доменами (P4), полученными из этого гена, способствовали пролиферации PBMC между днем 7 и последним днем, указанным в таблице. Этот вывод основан на подсчетах обогащения последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что в 11 раз больше подсчетов для такого домена присутствовало в день 28, чем в день 7, для библиотеки 2В, когда результаты для всех конструкций для гена объединяются. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 8. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 2.1B, которые способствовали наибольшей степени пролиферации клеток, представлены в Табл. 11.
[1018] Более конкретно для библиотеки 2В из 6909 конструкций с CSF3R T640N (рецептор колониестимулирующего фактора 3 с треонином 640, мутированным в аспарагин) в качестве модуля Р1/P2 для библиотеки 2В, 59 были положительными, которые определяли как конструкции с обогащением более двух для библиотеки 2В. Из 184 конструкций с IFNAR1 (интерферон альфа и субъединица 1 бета рецептора) в качестве модуля P3 3 для библиотеки 2В были положительными. Из 1258 конструкций с CD40 (молекула CD40) в качестве модуля P3 для библиотеки 2В 17 были положительными. Из 851 конструкций с CD27 (молекула CD27) в качестве модуля P4 для библиотеки 2В 11 были положительными. Из 418 конструкций с CD8A в качестве модуля P3 для библиотеки 2В 10 были положительными. Из 1385 конструкций с IL31RA в качестве модуля P3 для библиотеки 2В 12 были положительными. Из 5757 конструкций с MyD88 в качестве модуля P3 для библиотеки 2В 56 были положительными.
[1019] Для библиотек 2B и 2.1B конструкции M007-S049-S051, M007-S050-S039, M012-S050-S043, M012-S161-S213, M030-S142-S049, M001-S145-S130, M018-S085-S039, M018-S075-S053, M012-S135-S074 и M007-S214-S077 имели особенно заметные обогащения при обоих скринингах. Для целей повторных скринингов конструкциями с особенно заметными обогащением были те, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2.
[1020] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 2В, так и библиотеки 2.1В представлена в Табл. 20, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из CD28, CD40, IL22RA1, IL13RA2, IL17RB, IFNGR2, FCGR2C, IL11RA или TNFRSF14, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD40, CD3G, CD8A, TNFRSF9, CD28, IL10RB, CD79B, FCER1G или GHR, когда они присутствуют во втором внутриклеточном домене (P4), демонстрировали особенно заметные обогащения в библиотеках 2В и 2.1В (Табл. 20). Конструкции с доменами цитокиновых рецепторов CD40, IL22RA1, IL13RA2, IL17RB, IFNGR2, FCGR2C, IL11RA или TNFRSF14, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов TNFRSF9, IL10RB, FCER1G, GHR или CD40, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметные обогащения в библиотеках 2В и 2.1В (Табл. 20). Конструкции с доменами, содержащими мотивы ITAM из FCGR2C, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами, содержащими мотивы ITAM из CD3G, CD79B или FCER1G, когда они присутствуют во втором внутриклеточном домене (P4), демонстрировали особенно заметные обогащения в обеих библиотеках 2B и 2.1B (Табл. 20).
Пример 18. Идентификация кандидатных химерных полипептидных лимфопролиферативных элементов
[1021] В этом примере две библиотеки химерных полипептидов (библиотека 3 и библиотека 4) кандидатеых (предполагаемых) химерных лимфопролиферативных элементов собирали в вирусные векторы из пулов внеклеточных трансмембранных блочных последовательностей, внутриклеточных блочных последовательностей и библиотеки баркодов в соответствии с конструкцией, кодирующей химерный полипептид, представленной на Фиг. 32 и 33. За пролиферацией трансдуцированных библиотекой PBMC наблюдали с течением времени: геномную ДНК экстрагировали из PBMC с интервалом в одну неделю, и область баркода амплифицировали для секвенирования ДНК, чтобы оценить количество клеток в этих смешанных культурах PBMC, содержащих каждый из химерных тестируемых кандидатных полипептидов. Таким образом, в ходе скрининга проверяли способность кандидатных химерных полипептидов стимулировать пролиферацию клеток PBMC в отсутствие экзогенно добавленного IL-2 или любого другого экзогенного цитокина.
[1022] В этом исследовании создавали и анализировали две библиотеки: библиотеку 3 (которую использовали в скринингах, идентифицированных как библиотеки 3A, 3B, 3.1A и 3.1B) фланкировали CAR на 5' конце химерного полипептида, в то время как библиотека 4 (которую использовали в скринингах, идентифицированных как библиотеки 4B и 4.1B) не включала CAR. На Фиг. 32 представлена схема неограничивающей иллюстративной кассеты экспрессии трансгена, содержащей полинуклеотидную последовательность, кодирующую CAR, и кандидатный CLE библиотеки 3, управляемый промотором EF-1 альфа и последовательностью типа Козак (GCCGCCACC (SEQ ID NO: 519)) в каркасе лентивирусного вектора. CAR помечали FLAG и он содержал ASTR, направленный на CD19, ствол и трансмембранную часть CD8, а также внутриклеточный активирующий домен от CD3z. Каждый кандидатный лимфопролиферативный элемент библиотеки 3 включал 4 модуля; внеклеточный модуль (P1), трансмембранный модуль (P2) и 2 внутриклеточных модуля (P3 и P4). Модуль P1 также кодировал домен распознавания и/или элиминации Myc. Тройная стоп-последовательность (TAATAGTGA (SEQ ID NO: 520)) отделяла P4 от баркода ДНК (P5). WPRE (GTCCTTTCCATGGCTGCTCGCCTGTGTTGCCACCTGGATTCTGCGCGGGACGTCCTTCTGCTACGTCCCTTCGGCCCTCAATCCAGCGGACCTTCCTTCCCGCGGCCTGCTGCCGGCTCTGCGGCCTCTTCCGCGTCTTCGCCTTCGCCCTCAGACGAGTCGGATCTCCCTTTGGGCCGCCTCCCCGCCTG (SEQ ID NO:521)) присутствовал между последним стоп-кодоном (начинающимся через 4 п.н. после последнего нуклеотида последнего стоп-кодона) и 3' LTR (который начинался через 83 нуклеотида после последнего нуклеотида WPRE).
[1023] CAR и P1 библиотеки 3 разделяли полинуклеотидной последовательностью, кодирующей последовательность с рибосомным проскоком T2A.
[1024] На Фиг. 33 представлена схема неограничивающей иллюстративной кассеты экспрессии трансгена, содержащей полинуклеотидную последовательность и кандидатный CLE библиотеки 4, управляемый промотором EF-1 альфа и последовательностью типа Козак (GCCGCCACC (SEQ ID NO: 519)) в каркасе лентивирусного вектора. Каждый кандидатный лимфопролиферативный элемент библиотеки 4 включал 4 модуля; внеклеточный модуль (P1), трансмембранный модуль (P2) и 2 внутриклеточных модуля (P3 и P4). Модуль P1 также кодировал домен распознавания и/или элиминации Myc. Тройная стоп-последовательность (TAATAGTGA (SEQ ID NO: 520)) отделяла P4 от баркода ДНК (P5). WPRE (GTCCTTTCCATGGCTGCTCGCCTGTGTTGCCACCTGGATTCTGCGCGGGACGTCCTTCTGCTACGTCCCTTCGGCCCTCAATCCAGCGGACCTTCCTTCCCGCGGCCTGCTGCCGGCTCTGCGGCCTCTTCCGCGTCTTCGCCTTCGCCCTCAGACGAGTCGGATCTCCCTTTGGGCCGCCTCCCCGCCTG (SEQ ID NO:521)) присутствовал между последним стоп-кодоном (начинающимся через 4 п.н. после последнего нуклеотида последнего стоп-кодона) и 3' LTR (который начинался через 83 нуклеотида после последнего нуклеотида WPRE).
[1025] Собранные части химерного полипептида обеих библиотек соответствовали точно такой же конструкции с 4 положениями (1 внеклеточный модуль (P1), 1 трансмембранный модуль (P2) и 2 внутриклеточные части (P3 и P4), одна из которых может представлять собой сигнал ранней терминации) (Фиг. 32 и 33). Нуклеиновые кислоты, кодирующие полные или вариантные версии домена распознавания и/или элиминации либо метки Myc либо eTAG (обозначенных в Таблице 6 как «eTAG» или «метка Myc»), вставляли на 5' конце последовательностей, кодирующей CAR, в библиотеке 3 и на 5' конце домена c-Jun в P1 в библиотеке 4. Сигнальную последовательность вставляли на 5' конце последовательностей, кодирующих CAR в библиотеке 3, и на 5' конце последовательностей, кодирующих домен распознавания и/или элиминации, в библиотеке 4. Общий дизайн и конструкция библиотеки, включая баркод, были такими, как раскрыто в Примере 17 в данном документе, за исключением доменов P1 и P2, как изложено более подробно далее в этом примере. Кроме того, домен клиренса присутствовал в некоторых конструкциях, как показано в Табл. 6, и при его наличии он представлял собой вариант eTag или метку Myc.
Синтез вирусных векторов и получение лентивирусов
[1026] Синтезировали векторы и получали лентивирусные частицы для каждой библиотеки, как описано в Примере 17.
Трансдукция и культивирование PBMC
[1027] Для библиотеки 3A цельную человеческую кровь от здорового донора (89,1 мл) собирали в пакет для крови на 200 мл, содержащий антикоагулянт CDP (Nanger; S-200). Кровь обрабатывали центрифугированием в градиенте плотности с Ficoll-Pacque™ (General Electric) с использованием устройства Sepax 2 S-100 (Biosafe; 14000) в соответствии с инструкциями производителя и набора CS900.2 (BioSafe; 1008) для получения мононуклеарных клеток периферической крови (PBMC). Выход жизнеспособных РВМС составил 8,4 × 107 клеток. Десять флаконов с клетками по 5 × 106 PBMC на флакон замораживали для последующего использования в подпитке CD19+ B-клеток для CD19-CAR, содержащих образцы библиотеки 3A. 3 × 107 PBMC добавляли в одно устройство для культивирования клеток G-Rex 100M (Wilson Wolf, 81100S) до конечной концентрации 0,5 × 106 жизнеспособных клеток/мл в конечном объеме 60 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM (OpTmizer™ CTS™ T-Cell Expansion Basal Medium 1 L (Thermo Fisher, A10221) с 26 мл добавки OpTmizer™ CTS™ для экспансии Т-клеток (Thermo Fisher, A10484-02), 25 мл CTS™ Immune Cell SR (Thermo Fisher, A2596101) и 10 мл добавки CTS™ GlutaMAX™-I (Thermo Fisher, A1286001) в соответствии с инструкциями производителя. Рекомбинантный интерлейкин-2 человека (IL-2) (Novoprotein) также добавляли до концентрации 100 МЕ/мл вместе с активирующими Ab к CD3 (OKT3, Novoprotein), добавленными в концентрации 50 нг/мл, для активации PBMC для трансдукции вирусов. Устройство G-Rex инкубировали в течение ночи в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. После инкубации в течение ночи препараты лентивирусных частиц, содержащие желаемые тестируемые конструкции, кодирующие химерный полипептид (библиотека 3), добавляли в устройство G-Rex при множественности заражения (MOI) 5. Устройство G-Rex инкубировали в течение ночи в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. После инкубации в течение ночи добавляли дополнительное количество Complete OpTmizer™ CTS™ T-Cell Expansion SFM для доведения конечного объема до 500 мл. Никаких дополнительных IL-2 или других экзогенных цитокинов не добавляли на этой или следующих стадиях культивирования клеток. Устройство G-Rex® инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2 в течение 7 дней после выделения PBMC. В день 7 клетки из устройства G-Rex, трансдуцированные библиотекой 3, собирали центрифугированием и ресуспендировали в свежей Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. 5 × 107 клеток библиотеки 3 помещали в новое устройство G-Rex 100M, содержащее 500 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2 и помеченный как библиотека 3A. 1,1 × 108 клеток библиотеки 3 помещали в новое устройство G-Rex 100M, содержащее 500 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2 и помеченный как библиотека 3В. В этих скринингах клетки, в которые вводили PBMC, обозначали буквой A после номера библиотеки, например, скрининг, проведенный с клетками, трансдуцированными с помощью библиотеки 3 и подпитываемыми PBMC, в данном документе обозначаются как библиотека 3A. Четыре флакона с размороженными в день 0 замороженными РВМС, совместимыми по донору (2 × 107 РВМС), добавляли к устройствам G-Rex, содержащим клетки, трансдуцированные библиотекой 3A, чтобы обеспечить активацию CD19+ B-клетками CD19 ASTR. Библиотека 3B не получала PBMC дня 0. В этих скринингах клетки, в которые не вводили PBMC, обозначали буквой B после номера библиотеки. Например, скрининги, выполненные с клетками, трансдуцированными с помощью библиотеки 3 и не подпитываемыми PBMC, в данном документе обозначаются как библиотека 3B. Устройства G-Rex инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. В день 14 клетки из двух устройств G-Rex (библиотека 3A, библиотека 3B) собирали центрифугированием и ресуспендировали в свежей Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. Каждую из них помещали в отдельные лунки 6-луночных планшетов G-Rex (Wilson-Wolf; 80240M), содержащих 30 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. Один флакон размороженных в день 0 замороженных РВМС, совместимых по донору (5 × 106 РВМС), добавляли в библиотеку 3A G-Rex для обеспечения активации CD19+ B-клетками CD19 ASTR. Устройства G-Rex инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. Этот процесс повторяли в день 21, день 28, день 35 и день 42, за исключением того, что два флакона с замороженными РВМС дня 0 добавляли в библиотеку 3A в день 21 и один флакон в дни 28, 35 и 42. Библиотеку 3B не культивировали после дня 21. Эти скрининги повторяли, за исключением того, что метку Myc в части P1 заменяли на eTag, как показано в Табл. 6, 14 и 15, и обозначали как библиотеки 3.1A и 3.1B, где A и B указывали, подпитывали ли клетки PBMC, как обсуждалось выше.
[1028] Клетки из библиотеки 3A готовили для анализа с помощью проточной цитометрии в день 49. Клетки собирали центрифугированием (400 г, 5 минут) и наносили на Ficoll (Ficoll-Paque Premium (GE, каталожный № 17-5442-02) в соответствии с инструкциями производителя. 1,7 × 106 клеток ресуспендировали в 450 мкл буфера для окрашивания FAC (554656, BD). Ресуспендированные клетки помещали в 9 пробирок Эппендорфа, каждая из которых содержала 50 мкл или 1,8 × 105 клеток. 2,5 мкл блокатора Fc человека (564220, BD) добавляли в каждую пробирку и инкубировали при комнатной температуре в течение 10 минут. Следующий состав антител добавляли к 50 мкл образцов для окрашивания в отношении CD3, CD4, CD8, CD56, CD19, FLAG Tag (CAR+): 2,5 мкл антитела к CD3-BV421 (клон OKT3,317344, Biolegend), 2,5 мкл антитела к CD8-BV510 (клон RPA-T8 (301048, Biolegend), 2,5 мкл антитела к CD4-PE-Cy7 (клон OKT4 ( 317412, Biolegend), 2,5 мкл антитела к CD56-BV785 (362550, Biolegend) и 0,5 мкл меченого PE антитела к метке FLAG (антитело к DYKDDDDK, клон L5, 637310, Biolegend) для 5 окрашенных образцов. 2,5 мкл антитела BB515 к CD19 (клон HIB19, 564456, BD) и 0,5 мкл меченого PE антитела к метке FLAG добавляли для 2 окрашенных образцов. Образцы, однократно окрашенные в отношении CD3, CD4, CD8, CD56 или метки FLAG, также готовили с использованием антител и объемов, указанных выше. 2,5 мкл BV421 IgG (мышиный IgG2a, 400259, Biolegend), 2,5 мкл PE/CY5 IgG (мышиный IgG2b, 400317, Biolegend), 2,5 мкл BV510 IgG (мышиный IgG1,400171, Biolegend), 2,5 мкл BV785 IgG (мышиный IgG1, 400169, Biolegend) и 10 мкл PE IgG (мышиный IgG1, 555749, BD) добавляли для окрашенных образцов контрольного IgG. Для неокрашенного контроля антитела не добавляли. Образцы инкубировали 30 минут на льду. Образцы центрифугировали (400 g, 5 минут) и супернатант удаляли. Образцы дважды промывали 0,5 мл буфера для окрашивания для FACS. Осадки окрашенных клеток ресуспендировали в 125 мкл буфера для окрашивания для FACS и затем фиксировали, добавляя 125 мкл буфера BD Fixative (554655 BD). Образцы инкубировали с буфером для фиксации в течение 15 минут при 4 °C. Образцы дважды промывали 500 мкл буфера для окрашивания для FACS и ресуспендировали в 0,4 мл буфера для окрашивания для FACS. Анализ FACS образцов выполняли на проточном цитометре Novocyte (ACEA Biosciences) и анализировали с использованием гейтирования лимфоцитарного на основе прямого и бокового рассеяния.
[1029] Для библиотеки 4A цельную человеческую кровь от здорового донора (70 мл) собирали в пакет для крови на 200 мл, содержащий антикоагулянт CDP (Nanger; S-200). Кровь обрабатывали центрифугированием в градиенте плотности с Ficoll-Pacque™ (General Electric) с использованием устройства Sepax 2 S-100 (Biosafe; 14000) в соответствии с инструкциями производителя и набора CS900.2 (BioSafe; 1008) для получения мононуклеарных клеток периферической крови (PBMC). Выход жизнеспособных РВМС составил 4,9 × 107 клеток. 4,9 × 107 PBMC добавляли в одно устройство для культивирования клеток G-Rex 100M (Wilson Wolf, 81100S) до конечной концентрации 0,5 × 106 жизнеспособных клеток/мл в конечном объеме 98 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM. Рекомбинантный интерлейкин-2 человека (IL-2) (Novoprotein) также добавляли до концентрации 100 МЕ/мл вместе с активирующими Ab к CD3 (OKT3, Novoprotein), добавленными в концентрации 50 нг/мл, для активации PBMC для трансдукции вирусов. Устройство G-Rex инкубировали в течение ночи в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. После инкубации в течение ночи препараты лентивирусных частиц, содержащие желаемые тестируемые конструкции, кодирующие химерный полипептид (библиотека 4), добавляли в устройство G-Rex при множественности заражения (MOI) 5. Устройство G-Rex инкубировали в течение ночи в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. После инкубации в течение ночи добавляли дополнительное количество Complete OpTmizer™ CTS™ T-Cell Expansion SFM для доведения конечного объема до 500 мл. Никаких дополнительных IL-2 не добавляли на этой или следующих стадиях культивирования клеток. Устройство G-Rex® инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2 в течение 7 дней после выделения PBMC. В день 7 клетки из устройства G-Rex, трансдуцированные библиотекой 4, собирали центрифугированием и ресуспендировали в свежей Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. 1,63 × 108 клеток библиотеки 4 помещали в новое устройство G-Rex 100M, содержащее 500 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2 и помеченный как библиотека 4. Библиотека 4 не получала PBMC дня 0. Таким образом, в этих скринингах библиотеки обозначали буквой В после номера библиотеки, например, скрининг, проведенный с клетками, трансдуцированными с помощью библиотеки 4 и не подпитываемыми PBMC, в данном документе обозначаются как библиотека 4В. Устройство G-Rex инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. В день 14 клетки из устройства G-Rex, (библиотека 4) собирали центрифугированием и ресуспендировали в свежей Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. Каждую из этих клеток помещали в отдельную лунку 6-луночных планшетов G-Rex (Wilson-Wolf; 80240M), содержащих 30 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM без IL-2. Устройство G-Rex инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. Образцы из библиотеки 4 не культивировались после дня 21. Эти скрининги повторяли, за исключением того, что метку Myc в части P1 заменяли на eTag, как показано в Табл. 6 и 16, и обозначали как библиотеку 4.1B, где B указывала, что клетки не подпитывали PBMC, как обсуждалось выше.
[1030] Образцы (от 7 × 104 до ~ 4-8 × 106 клеток) собирали в различные дни после трансдукции (дни 7 и 21), и геномную ДНК очищали с использованием GenElute™ Genomic DNA Miniprep в соответствии с протоколом наборов. В некоторых случаях образцы очищали с использованием центрифугирования в градиенте плотности с Ficoll-Pacque™ (General Electric) для удаления мертвых клеток перед экстракцией геномной ДНК. Очищенную геномную ДНК секвенировали с использованием Illumina HiSeq, получая считывания парных концов длиной 150 п.н. Обычно подгруппу из 10 миллионов считываний извлекали из каждого индексированного файла fastq и обрабатывали для анализа с помощью barcode_reader, специального сценария R, разработанного для извлечения последовательностей баркодов на основе наличия константной области. Очищенную геномную ДНК также секвенировали в системе секвенирования PacBio для связывания баркодов с конструкциями.
Анализ данных
[1031] Анализ данных выполняли, как раскрыто в Примере 17, за исключением того, что временные точки различались.
Результаты
[1032] В этом эксперименте химерные полипептидные кандидаты конструировали так, чтобы иметь 4 тестовых домена, которые включали внеклеточный домен (P1), трансмембранный домен (P2), первый внутриклеточный домен (P3) и второй внутриклеточный домен (P4) (Фиг. 32 и 33). Как объяснено в Примере 17, конструкции включали баркод ДНК, чтобы облегчить анализ и идентификацию конструкции с использованием секвенирования следующего поколения. Кроме того, все конструкции включали последовательности нуклеиновых кислот, кодирующие домен распознавания и/или элиминации в рамке с внеклеточным доменом. Конструкции в библиотеке 3, но не в библиотеке 4. кодировали CAR выше химерного полипептидного кандидата, который был идентичен по структуре CAR, используемому в библиотеке 1 (Пример 17).
[1033] Внеклеточный домен, используемый для библиотеки 3 и библиотеки 4, представлял собой вариант c-Jun, который включал мотив лейциновой молнии (NM_002228_3), известный как димеризующий мотив (см., например, Chinenov and Kerppola, Oncogen. 2001 Apr 30;20(19):2438-52). Спейсер из 0-4 остатков аланина включали в кандидатные химерные полипептиды между внеклеточным доменом c-Jun и трансмембранным доменом. Не ограничиваясь теорией, считается, что аланиновый спейсер может влиять на передачу сигналов внутриклеточных доменов, связанных с внеклеточной областью лейциновой молнии через трансмембранный домен, путем изменения ориентации связанных трансмембранных доменов и/или внутриклеточных доменов.
[1034] Кандидатные трансмембранные домены выбирали из известных одинарных трансмембранных доменов из рецепторов дикого типа и мутантных рецепторов I типа, таких как цитокиновые, гормональные, костимулирующие или активирующие рецепторы, которые, как сообщается, являются конститутивно активными при экспрессии по меньшей мере в некоторых типах клеток. Мутации в таких мутантах рецептора, выбранных для библиотеки 3 и библиотеки 4, происходят в трансмембранной области. Иллюстративные трансмембранные домены для библиотек 3A, 3B, 3.1A, 3.1B, 4B и 4.1B могут быть идентифицированы в Табл. 12-17. Заголовки Табл. 12-17 следующие: блочная последовательность представляет собой код доменов P1, P2, P3 и P4 из Табл. 6, используемый в каждой конструкции; Norm_D7 представляет собой нормализованное содержание в день 7; Enrich_DXX представляет собой обогащение в день XX по сравнению с днем 7, где XX представляет собой день, указанный в таблице, например, Enrich _D21 представляет собой обогащение в день 21 по сравнению с днем 7, а Enrich_D35 представляет собой обогащение в день 35 по сравнению с днем 7. Данные для конструкции отображаются в непосредственных правых столбцах конструкции. В каждой строке показаны данные для двух конструкций. Например, первая конструкция, которая идентифицирована в Табл. 12, представляет собой E013-T047-S158-S080, которая соответствует P1-P2-P3-P4. В этой конструкции трансмембранный домен (P2) представляет собой T047, который является трансмембранным доменом IL7RA Ins PPCL (рецептор интерлейкина 7), как показано в Табл. 6, наряду с аминокислотной последовательностью этого домена, который включали в эту конструкцию. Те же самые первые внутриклеточные домены (P3) и вторые внутриклеточные домены (P4), включенные в Пример 17, включали в библиотеки в этом примере, за исключением того, что одна из частей P3 представляла собой спейсер (см. ниже).
[1035] Всего разработали 5 концептуальных возможных комбинаций на основе внеклеточного домена Jun с лейциновой застежкой с 0-4 аланиновыми спейсерами, отделяющими его от 82 различных трансмембранных доменов, 81 возможного домена P3, один из которых представлял собой спейсер из 23 аминокислот, и 21 возможного домена P4, один из которых представлял собой стоп-кодон. Не все концептуальные конструкции обнаруживали после сборки вирусного вектора, продуцирования лентивирусных частиц, трансдукции PMBC и 7 дней культивирования. Для библиотек 3A и 3B после трансдукции PBMC и 7 дней культивирования присутствовала 68951 конструкция. Для библиотеки 4A после трансдукции PBMC и 7 дней культивирования присутствовала 50652 конструкции. Подробную информацию об проанализированных кандидатах можно найти в Табл. 6 и 12-17. Система кодирования конструкций такая же, как объяснена в Примере 17, как изложено в предыдущем абзаце.
[1036] Для библиотек 3A, 3B, 3.1A, 3.1B, 4B и 4.1B идентифицировали конструкции, которые способствовали пролиферации клеток PBMC между днем 7 и последним днем, указанным в таблице. Определенные полипептиды в определенных модулях CLE были одними из самых эффективных среди библиотек 3A, 3B и 4. Эти CLE способствовали наивысшей степени. Например, иллюстративные конструкции, содержащие CD40 или ICOS в положении P2; MPL, MyD88, LEPR или IFNAR2 в положении P3; и/или CD40, CD79B или CD27 в положении P4 входили в пять наиболее часто встречающихся химерных полипептидов по меньшей мере в 2 из 3 библиотек 3A, 3B и 4B (см. Табл. 12, 13 и 16). Удивительным является то, что MPL был наиболее часто встречающимся химерным полипептидом в P3 с большим отрывом для всех 3 библиотек. Следует обратить внимание, что основные совпадения из P3 (MPL, MyD88, LEPR и IFNAR2) не включали в положение P4 для этих конструкций.
[1037] В библиотеках 3A и 3B, которые включали конструкции, кодирующие химерные полипептиды и CAR и трансдуцированные PBMC, которые дополняли (библиотека 3A) или не дополняли (библиотека 3B) свежими нетрансдуцированными PBMC, идентифицировали 126 и 127 наиболее эффективных кандидатов соответственно (см. Табл. 12 и 13), которые способствовали пролиферации PBMC между днем 7 и последним днем, указанным в таблице, при культивировании в отсутствие IL-2. Перечни наиболее эффективных кандидатов в Табл. 12 и 13 генерировали путем объединения 100 наиболее распространенных кандидатов в день 21 на основе первоначального анализа промежуточных данных и 100 наиболее обогащенных кандидатных конструкций между днем 21 и днем 7 на основе анализа исходных промежуточных данных. Исходные промежуточные данные генерировали путем декодирования части закодированной библиотеки, так что 66 из 100 наиболее эффективных конструкций и 538 из 1000 наиболее эффективных конструкций декодировали для библиотеки 3A; и 77 из 100 наиболее эффективных конструкций, и 464 из 1000 наиболее эффективных конструкций декодировали для библиотеки 3B.
[1038] Для библиотеки 3A трансмембранные домены (P2) из CD40, CD8B, CRLF2, CSF2RA, FCGR2C, ICOS, IFNAR1, IFNGR1, IL10RB, IL18R1, IL18RAP, IL3RA, LEPR и PRLR или их мутантов, которые, как известно, способствуют сигнальной активности в определенные типы клеток, если такие мутанты присутствуют в конструкциях, представленных в таблицах, способствовали пролиферации PBMC между днем 7 и днем 21, когда данные рассматриваются комбинированным образом для всех конструкций с трансмембранным доменом, полученным из этого гена (данные не показаны). Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в день 21 плюс один и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 3A, при объединении результатов для всех конструкций для гена. Для библиотеки 3B трансмембранные домены из CD40, ICOS, CSF2RA, IL18R1, IL3RA и TNFRSF14 продемонстрировали наилучшие результаты при таком анализе. Примеры трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали пролиферации клеток для библиотек 3A и 3B в день 35 и день 21 соответственно, представлены в Табл. 12 и 13. Примеры трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторных скринингах, называемых библиотеками 3.1A и 3.1B, которые способствовали пролиферации клеток, представлены в Табл. 14 и 15.
[1039] Для библиотеки 3A первые внутриклеточные (P3) домены из IL17RD, IL17RE, IL1RAP, IL23R и MPL или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, если такие мутанты присутствуют в конструкциях, представленных в таблицах, когда обнаружены в первом внутриклеточном домене (P3) кандидатных элементов химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и днем 21, когда данные рассматриваются комбинированным образом для всех конструкций с первым внутриклеточным доменом, полученным из этого гена (данные не показаны). Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в день 21 плюс один и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 3A, при объединении результатов для всех конструкций для гена. Для библиотеки 3B первые внутриклеточные домены из IL21R, MPL и IL2RB или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, если такие мутанты присутствуют в таблицах, были лучшими показателями при анализе подобным образом. Примеры первых внутриклеточных доменов или их частей и/или их мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток для библиотек 3A и 3B в течение в дни 35 и 21 соответственно, представлены в Табл. 12 и 13. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторных скринингах, называемых библиотеками 3.1A и 3.1B, которые способствовали пролиферации клеток, представлены в Табл. 14 и 15.
[1040] Для библиотеки 3A вторые внутриклеточные (P4) домены из CD27, CD3G, CD40 и CD79B или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, если такие мутанты присутствуют в таблицах, когда обнаруженный во втором внутриклеточном домене (P4) кандидатных элементов химерных полипептидов в данном документе, способствовал клеточной пролиферации PBMC между днем 7 и днем 21, когда данные рассматриваются комбинированным образом для всех конструкций со вторым внутриклеточным доменом, полученным из этого гена (данные не показаны). Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в день 21 плюс один и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 3A, при объединении результатов для всех конструкций для гена. Для библиотеки 3B вторые внутриклеточные домены из CD40 или его мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, если такие мутанты присутствуют в таблицах, были лучшими показателями при анализе подобным образом. Примеры вторых внутриклеточных доменов или их частей и/или их мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток для библиотек 3A и 3B в течение в дни 35 и 21 соответственно, представлены в Табл. 12 и 13. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторных скринингах, называемых библиотеками 3.1A и 3.1B, которые способствовали пролиферации клеток в наивысшей степени, представлены в Табл. 14 и 15.
[1041] Касательно конкретных генов, из 798 конструкций с CD8B (молекула CD8b) в качестве части P2, 111 были положительными, что было определено как конструкции, имеющие обогащение более двух (log2) для библиотек 3A или 3B в день 21. Из 1032 конструкций с CD40 (молекула CD40) в качестве части P2 159 были положительными. Из 1339 конструкций с CRLF2 (цитокиновый рецептор, подобный фактору 2) в качестве части P2 175 были положительными. Из 593 конструкций с CSF2RA (альфа-субъединица рецептора колониестимулирующего фактора 2) в качестве части P2 108 были положительными. Из 714 конструкций с FCGR2C (Fc-фрагмент рецептора IgG IIc (ген/псевдоген)) в качестве части P2 88 были положительными. Из 788 конструкций с ICOS (индуцибельный костимулятор Т-клеток) в качестве части P2 108 были положительными. Из 882 конструкций с IFNAR1 (интерферон альфа и субъединица 1 бета рецептора) в качестве части P2 106 были положительными. Из 806 конструкций с IFNGR1 (рецептор гамма-интерферона 1) в качестве части P2 104 были положительными. Из 938 конструкций с IL3RA (субъединица рецептора интерлейкина 3 альфа) в качестве части P2 132 были положительными. Из 746 конструкций с IL10RB (субъединица бета-рецептора интерлейкина 10) в качестве части P2 99 были положительными. Из 814 конструкций с IL18R1 (рецептор 1 интерлейкина 18) в качестве части P2 131 были положительными. Из 552 конструкций с IL18RAP (дополнительный белок рецептора интерлейкина 18) в качестве части P2 83 были положительными. Из 1390 конструкций с LEPR (рецептор лептина) в качестве части P2 184 были положительными. Из 795 конструкций с PRLR (рецептор пролактина) в качестве части P2 123 были положительными.
[1042] Из 1259 конструкций с IL1RAP (дополнительный белок рецептора интерлейкина 1) в качестве части P3 158 были положительными, что было определено как конструкции, имеющие обогащение более двух для библиотек 3A или 3B в день 21. Из 200 конструкций с IL17RD (рецептор интерлейкина 17 D) в качестве части P3 31 были положительными. Из 11 конструкций с IL17RE (рецептор интерлейкина 17 E) в качестве части P3 3 были положительными. Из 538 конструкций с IL23R (рецептор интерлейкина 23) в качестве части P3 86 были положительными. Из 1531 конструкции с MPL (протоонкоген MPL, рецептор тромбопоэтина) в качестве части P3, 509 были положительными.
[1043] Из 3124 конструкций с CD3G (молекула CD3g) в качестве части P4 458 были положительными, что было определено как конструкции, имеющие обогащение более двух для библиотек 3A или 3B в день 21. Из 3293 конструкций с CD27 (молекула CD27) в качестве части P4 443 были положительными. Из 5163 конструкций с CD40 (молекула CD40) в качестве части P4 724 были положительными. Из 4486 конструкций с CD79B (молекула CD79b) в качестве части P4 663 были положительными. Примечательно, что для любой конструкции, поскольку это конкурентный анализ, «отрицательный» означает, что конструкция была вне конкуренции в отношении стимулирования пролиферации, но не то, что конструкция не способна стимулировать пролиферацию.
[1044] Для библиотек 3A и 3.1A конструкции E008/E013-T041-S186-S050, E006/E011-T077-S186-S211, E007/E012-T021-S186-S051, E009/E014-T041-S186-S053, E007/E012-T073-S186-S053, E006/E011-T017-S186-S051, E006/E011-T031-S186-S211, E006/E011-T011-S186-S050, E006/E011-T011-S186-S047, E007/E012-T001-S186-S050, E006/E011-T041-S186-S051, E008/E013-T028-S186-S076, E009/E014-T029-S199-S053, E009/E014-T062-S186-S216, E007/E012-T006-S058-S051, E009/E014-T076-S186-S211 и E007/E012-T001-S186-S047 были особенно заметны обогащения в обоих скринингах, где части P1, разделенные косой чертой, в данном документе включали разные метки для библиотек 3A и 3A.1, как показано в Табл. 6, 12 и 14. Для целей повторных скринингов конструкциями с особенно заметными обогащением были те, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2.
[1045] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 3A, так и библиотеки 3.1A представлена в Табл. 21, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из MPL, OSMR или CSF2RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD40, TNFRSF4, CD79B, CD27, FCGR2A или TNFRSF18, когда они присутствуют во втором внутриклеточном домене (P4), демонстрировали особенно заметные обогащения в библиотеках 3A и 3.1A (Табл. 21). Конструкции с доменами цитокиновых рецепторов MPL, OSMR или CSF2RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов CD40, TNFRSF4, CD27, FCGR2A или TNFRSF18, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в библиотеках 3A и 3.1A (Табл. 21). Конструкции с доменами, содержащими мотивы ITAM из MPL или OSMR, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в библиотеках 3A и 3.1A (Табл. 21).
[1046] Для библиотек 3B и 3.1B конструкции E007/E012-T017-S186-S051, E007/E012-T073-S186-S053, E008/E013-T028-S186-S047, E006/E011-T011-S186-S047, E007/E012-T082-S176-S214, E006/E011-T046-S186-S052, E008/E013-T029-S186-S052, E009/E014-T011-S186-S053, E008/E013-T032-S186-S039, E007/E012-T034-S186-S051, E007/E012-T041-S192-S213, E006/E011-T014-S069-S213, E006/E011-T022-S186-S053, E006/E011-T023-S115-S075, E006/E011-T029-S106-S213, E006/E011-T032-S155-S080, E006/E011-T041-S186-S216, E006/E011-T057-S135-S080, E006/E011-T072-S191-X002, E006/E011-T077-S186-S216, E006/E011-T080-S141-S080, E007/E012-T001-X001-S214, E007/E012-T007-S059-S211, E007/E012-T016-S186-S052, E007/E012-T031-S186-S053, E007/E012-T044-S102-S052, E007/E012-T044-S142-X002, E007/E012-T055-S069-S053, E007/E012-T063-S176-S216, E007/E012-T065-S157-S075, E008/E013-T008-S085-X002, E008/E013-T011-S085-S048, E008/E013-T021-S109-X002, E008/E013-T021-S168-S211, E008/E013-T032-S064-S214, E008/E013-T037-S170-S215, E008/E013-T038-S176-S048, E008/E013-T039-S137-S216, E008/E013-T041-S141-S053, E008/E013-T045-S177-S048, E008/E013-T048-S109-S074, E008/E013-T073-S199-S075, E009/E014-T001-S157-S074, E009/E014-T005-S196-S049, E009/E014-T011-S130-X002, E009/E014-T013-S155-X002, E009/E014-T017-S186-S076, E009/E014-T021-S142-S080, E009/E014-T023-S082-S076, E009/E014-T038-S196-S037, E009/E014-T055-S186-S052, E009/E014-T060-S175-S053, E009/E014-T070-S085-S212, E008/E013-T026-S054-S213, E009/E014-T007-S120-S053, E007/E012-T045-S186-S211, E008/E013-T073-S186-X002, E008/E013-T074-S186-X002, E007/E012-T055-S186-S053, E008/E013-T036-S186-S053, E007/E012-T017-S058-S053, E008/E013-T030-S189-S080, E006/E011-T029-S081-S047, E009/E014-T044-S194-S050, E006/E011-T028-S121-X002, E008/E013-T028-S186-S053, E009/E014-T078-S142-S213, E009/E014-T041-S186-S051, E008/E013-T006-S186-S050, E006/E011-T028-S186-S075, E006/E011-T040-S120-S038, E007/E012-T044-S115-S211, E009/E014-T039-S176-S075, E007/E012-T028-S186-S050, E008/E013-T031-S202-S050, E007/E012-T072-S192-S053, E006/E011-T065-X001-S051, E007/E012-T030-S062-X002, E007/E012-T073-S186-X002, E009/E014-T056-S186-S053, E008/E013-T046-S137-X002, E006/E011-T016-S136-S076, E007/E012-T032-S142-S037, E007/E012-T065-S120-S215, E009/E014-T077-S186-S047, E009/E014-T001-S126-S051, E006/E011-T030-S121-S039, E008/E013-T006-S176-S213, E009/E014-T032-S130-S215, E008/E013-T041-S186-S039, E009/E014-T021-S186-S047, E008/E013-T026-S137-S214, E007/E012-T029-S116-S075, E008/E013-T026-S106-S049 и E007/E012-T032-S168-S075 имели особенно заметные обогащения при обоих скринингах, где части P1, разделенные косой чертой, в данном случае включали разные метки для библиотек 3B и 3.1B, как продемонстрировано в Табл. 6, 13 и 15. Для целей повторных скринингов конструкциями с особенно заметными обогащением были те, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2.
[1047] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 3В, так и библиотеки 3.1В представлена в Табл. 22, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из MPL, LEPR, MYD88, EPOR, IL5RA, IL2RG, IL18RAP, IL11RA, IL13RA1, CSF2RA, IL1RL1, IL13RA2, IL20RB, IFNGR2, IL3RA, IL27RA, CSF3R, IL31RA, IL12RB1, OSM, IL7R, IFNAR1, PRLR, IL9R, IL6R или IL15RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD40, CD79B, CD27, TNFRSF14, CD79A, CD3G, TNFRSF9, FCGR2C, ICOS, TNFRSF18 TNFRSF4, CD28, FCER1G, FCGR2A, CD3D, TNFRSF8 или CD3E, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 3B и 3.1B (Табл. 22). Конструкции с доменами из цитокиновых рецепторовов MPL, LEPR, EPOR, IL5RA, IL2RG, IL18RAP, IL11RA, IL13RA1, CSF2RA, IL1RL1, IL13RA2, IL20RB, IFNGR2, IL3RA, IL27RA, CSF3R, IL31RA, IL12RB2, OSMR, IL31RA, IL12RB1, OSM, IL7R, IFNAR1, PRLR, IL9R, IL6R или IL15RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов CD40, CD27, TNFRSF14, TNFRSF9, FCGR2C, TNFRSF18, TNFRSF4, FCER1G, FCGRA или TNFRSF8, когда он присутствует во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 3B и 3.1B (Табл. 22). Конструкции с доменами, содержащими мотивы ITAM из CD79B, CD79A, CD3G, FCGR2C, FCER1G, FCGR2A, CD3D или CD3E, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 3B и 3.1B (Табл. 22).
[1048] Анализ FACS показал, что экспандированные клетки библиотеки 3A дня 49 представляли собой в основном CD3+, CD8+, CD56+ и FLAG-Tag+. В таблице ниже показан процент лимфоцитов, которые дали положительную окраску для указанных маркеров и комбинаций маркеров. Эти данные демонстрируют, что драйверы, идентифицированные на основе этого скрининга библиотеки, в первую очередь экспандировали CD3+ Т-клеточный компонент.
[1049] Для библиотеки 4B, которая включала конструкции, кодирующие химерные полипептиды, но без CAR, и трансдуцированные PBMC, которые не дополняли свежими нетрансдуцированными PBMC, идентифицировали 154 наиболее эфективных кандидата (см. Табл. 16), которые способствовали наивысшей степени пролиферации PBMC между днем 7 и последним днем, указанным в таблице, при культивировании в отсутствие IL-2.
[1050] Для библиотеки 4B трансмембранные домены (P2) из CD40, CD8B, CSF2RA, IL18R1 и IL3RA или их мутантов, которые, как известно, способствуют конститутивной сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, когда обнаружены в положении трансмембранного домена (P2) кандидатных элементов химерных полипептидов в данном документе, способствовали пролиферации клеток PBMC между днем 7 и последним днем, указанным в таблице, когда данные рассматриваются комбинированным образом для всех конструкций с трансмембранным доменом, происходящим из этого гена. Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в последний день, указанный в таблице, плюс один, и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 4В, при объединении результатов для всех конструкций для гена. Примеры трансмембранных доменов или их частей и/или мутантов, которые присутствовали в библиотеке 4B в конструкциях, которые способствовали пролиферации клеток, представлены в Табл. 16. Примеры трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 4.1B, которые способствовали пролиферации клеток, представлены в Табл. 17.
[1051] Для библиотеки 4B первые внутриклеточные (P3) домены из CRLF2, CSF2RA, IFNGR2, IL4R, MPL и OSMR или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, при обнаружении в первом внутриклеточном домене (P3) кандидатных элементов химерных полипептидов в данном документе, способствовали клеточной пролиферации PBMC между днем 7 и последним днем, указанным в таблице, когда данные рассматриваются комбинированным образом для всех конструкций с первым внутриклеточным доменом, происходящим из этого гена. Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в последний день, указанный в таблице, плюс один, и нормализованным количеством в день 7 плюс один, было выше 0 для библиотеки 4В, при объединении результатов для всех конструкций для гена. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях в библиотеке 4B, которые способствовали клеточной пролиферации, представлены в Табл. 16. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 4.1B, которые способствовали пролиферации клеток, представлены в Табл. 17.
[1052] Для библиотеки 4 вторые внутриклеточные (P4) домены из CD27, CD40 и CD79B или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, при обнаружении во втором внутриклеточном домене (P4) кандидатных элементов химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и последним днем, указанным в таблице, когда данные рассматриваются комбинированным образом для всех конструкций со вторым внутриклеточным доменом, происходящим из этого гена. Этот вывод основан на подсчетах обогащения последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что в последний день присутствовало больше подсчетов для таких доменов, чем в день 7 для библиотеки 4B, когда результаты для всех конструкций для гена объединяются. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях в библиотеке 4B, которые способствовали клеточной пролиферации, представлены в Табл. 16. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторном скрининге, называемом библиотекой 4.1B, которые способствовали пролиферации клеток, представлены в Табл. 17.
[1053] Для библиотек 4B и 4.1B конструкции E007/E012-T078-S154-S047, E008/E013-T062-S186-X002, E008/E013-T055-S186-S050, E009/E014-T057-S186-S050, E007/E012-T077-S054-S053, E007/E012-T034-S135-S211, E009/E014-T071-X001-S216, E009/E014-T011-S141-S037, E008/E013-T041-S186-S037, E006/E011-T038-S106-S039, E006/E011-T011-S121-X002, E007/E012-T007-S085-S215, E006/E011-T041-S186-S050, E007/E012-T008-S064-S051, E006/E011-T041-S186-S047, E008/E013-T045-S186-S051, E008/E013-T003-S104-S216, E006/E011-T019-S186-S053, E008/E013-T071-S064-S080, E006/E011-T021-S054-X002, E006/E011-T003-S135-X002, E009/E014-T020-S199-S213, E008/E013-T027-S121-S211, E009/E014-T032-S195-X002, E009/E014-T050-S171-X002, E008/E013-T069-S083-X002, E008/E013-T026-S116-S038, E009/E014-T072-S195-X002, E007/E012-T047-S058-S211, E008/E013-T046-S142-S080, E006/E011-T065-S186-S076, E006/E011-T062-S069-X002, E007/E012-T047-S098-X002, E009/E014-T069-S099-S048, E008/E013-T039-S141-S050, E006/E011-T052-S130-S052, E008/E013-T041-S186-X002, E007/E012-T019-S120-X002, E008/E013-T045-S186-S053, E006/E011-T003-S170-S039, E007/E012-T047-S058-S051, E007/E012-T069-S109-X002, E009/E014-T019-S130-S075 и E006/E011-T047-S054-S053 имели особенно заметные обогащения при обоих скринингах, где части P1, разделенные косой чертой, в данном документе включали разные метки для библиотек 4B и 4.1B, как показано в Табл. 6, 16 и 17. Для целей повторных скринингов конструкциями с особенно заметными обогащением были те, которые имели значение log2 ((нормализованные данные подсчета в последний день + 1)/(нормализованные данные подсчета в день 7 + 1)) выше 2.
[1054] Дополнительная информация о первом и втором внутриклеточных доменах в конструкциях с особенно заметным обогащением в скринингах как библиотеки 4В, так и библиотеки 4.1В представлена в Табл. 23, включая ген (гены), из которого (которых) происходят первый и второй внутриклеточные домены, независимо от того, являются ли первый и/или второй внутриклеточный домен цитокиновыми рецепторами, и имеет ли первый и/или второй внутриклеточный домен по меньшей мере один мотив ITAM. Конструкции с внутриклеточными доменами из IL18R1, MPL, CRLF2, IL11RA, IL13RA1, IL2RG, IL7R, IFNGR2, CSF3R, IL2RA, OSMR, MYD88, IL31RA, IFNAR2, IL6R, CSF2RA, IL13RA2, EPOR, IL1R1 или IL10RA, когда они присутствуют, в первом внутриклеточном домене (P3), и конструкции с внутриклеточными доменами из CD27, CD40, CD79B, TNFRSF4, TNFRSF18, CD3D, CD3G, CD27, ICOS, TNFRSF9, CD3E, FCGR2A, CD28, CD79A или FCGR2C, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в библиотеках 4B и 4.1B (Табл. 23). Конструкции с доменами цитокиновых рецепторов IL18R1, MPL, CRLF2, IL11RA, IL13RA1, IL2RG, IL7R, IFNGR2, CSF3R, IL2RA, OSMR, IL31RA, IFNAR2, IL6R, CSF2RA, IL13RA2, EPOR, IL1R1, или IL10RA, когда они присутствуют в первом внутриклеточном домене (P3), и конструкции с доменами цитокиновых рецепторов CD27, CD40, TNFRSF4, TNFRSF18, TNFRSF9, FCGR2A или FCGR2C, когда присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 4B и 4.1B (Табл. 23). Конструкции с доменами, содержащими мотивы ITAM из CD79B, CD3D, CD3G, CD3E, FCGR2A, CD79A или FCGR2C, когда они присутствуют во втором внутриклеточном домене (P4), продемонстрировали особенно заметное обогащение в обеих библиотеках 4B и 4.1В (Табл. 23).
[1055] Для библиотеки 4В из 572 конструкций с CD8B (молекула CD8b) в качестве части P2 21 были положительными, что было определено как конструкции, имеющие обогащение более двух для библиотеки 4B. Из 897 конструкций с CD40 (молекула CD40) в качестве части P2 50 были положительными. Из 551 конструкций с CSF2RA (альфа-субъединица рецептора колониестимулирующего фактора 2) в качестве части P2 25 были положительными. Из 732 конструкций с IL3RA (субъединица рецептора интерлейкина 3 альфа) в качестве части P2 47 были положительными. Из 738 конструкций с IL18R1 (рецептор 1 интерлейкина 18) в качестве части P2 44 были положительными. Из 1683 конструкции с MPL (протоонкоген MPL, рецептор тромбопоэтина) в качестве части P3, 305 были положительными.
[1056] В первоначальном промежуточном анализе библиотеки 3A в день 21 декодировали 66 из 100 наиболее эффективных совпадений и 538 из 1000 наиболее эффективных совпадений. Дальнейшее декодирование обеспечило глубокое декодирование и идентификацию 99 из 100 наиболее эффективных совпадений и 992 из 1000 наиболее эффективных совпадений библиотеки 3A, данные собирали в день 35, а анализ обновляли в день 21. При первоначальном анализе библиотеки 3B в день 21 77 из 100 наиболее эффективных совпадений и 464 из 1000 наиболее эффективных совпадений декодировали в первоначальном промежуточном анализе. Дальнейшее декодирование обеспечило глубокое декодирование и идентификацию 100 из 100 наиболее эффективных совпадений и 708 из 1000 наиболее эффективных совпадений библиотеки 3В. Наиболее эффективные конструкции для библиотек 3A и 3B с данными в день 35 для библиотеки 3A и данными в день 21 для библиотеки 3B показаны в Табл. 12 и 13 соответственно.
[1057] В библиотеках 3A и 3B, которые включали конструкции, кодирующие химерные полипептиды и CAR и трансдуцированные PBMC, которые дополняли (библиотека 3A) или не дополняли (библиотека 3B) свежими нетрансдуцированными PBMC, после глубокого декодирования 124 наиболее эффективных кандидатов идентифицировали для библиотеки 3A в день 35, и 131 наиболее эффективный кандидат идентифицировали для библиотеки 3B в день 21 (см. Табл. 12 и 13 соответственно), которые способствовали наивысшей степени пролиферации PBMC между днем 7 и последним днем, указанным в таблице, при культивировании в отсутствие IL-2 (т.е. IL-2 не добавляли в культуральную среду во время культивирования после начальной трансдукции). Перечни наиболее эффективных кандидатов Табл. 12 (библиотека 3A, день 35) и 13 (библиотека 3B, день 21) генерировали путем объединения 100 наиболее распространенных кандидатов в день 21 (библиотека 3B) или 21 или в день 35 (библиотека 3A) и наиболее эффективные 100 наиболее обогащенных кандидатных конструкций между днем 21 и днем 7 (библиотека 3B) или между днем 21 и днем 7 или днем 35 и днем 7 (библиотека 3A) после глубокого декодирования.
[1058] Таблицы наиболее эффективных результатов с использованием результатов с глубоким декодированием определенных полипептидов в конкретных модулях CLE были среди лучших совпадений по меньшей мере в одной из библиотек 3A и 3B и по меньшей мере для одной из временных точек дня 21 и дня 35 (библиотека 3A) или дня 21 (библиотека 3B). Например, иллюстративные конструкции, содержащие CD40 (в частности, например, трансмембранный домен с кодом T011), ICOS (в частности, например, трансмембранный домен с кодом T028), FCGR2C (в частности, например, трансмембранный домен с кодом T024), PRLR (в частности, например, трансмембранный домен с кодом T077), IL3RA (в частности, например, трансмембранный домен с кодом T041), IL6ST (в частности, например, трансмембранный домен с кодом T045) в положении P2, IL18R1 (в частности, например, трансмембранный домен с кодом T062) в положнеии P2; MPL (в частности, например, внутриклеточный домен с кодом S186), IL18R1 (в частности, например, внутриклеточный домен с кодом S154), IL13RA2 (в частности, например, внутриклеточный домен с кодом S142), IL10RB (в частности, например, внутриклеточный домен с кодом S130), LEPR (в частности, например, внутриклеточный домен с кодом S176), IFNAR2 (в частности, например, внутриклеточный домен с кодом S083), IL23R (в частности, например, внутриклеточный домен с кодом S165), MyD88 (в частности, например, внутриклеточный домен с кодом S194) и CSF2RA (в частности, например, внутриклеточный домен с кодом S058)), в положении P3; и/или CD40 (в частности, внутриклеточный домен с кодом S050 или S051), CD79B (в частности, например, внутриклеточный домен с кодом S053), TNFRSF4, в частности, например, внутриклеточный домен с кодом S211), TNFRSF9 (в частности, например, внутриклеточный домен с кодом S213), TNFRSF14 (в частности, например, внутриклеточный домен с кодом S214), FCGRA2 (в частности, например, внутриклеточный домен с кодом S076), CD3G (в частности, например, внутриклеточный домен с кодом S039) или CD27 (в частности, внутриклеточный домен с кодом S047) в положении P4 входили в 5 наиболее часто встречающихся химерных полипептидов (см. Табл. 12 и 13). Удивительным является то, что MPL был наиболее часто встречающимся химерным полипептидом в P3 с большим отрывом для обеих библиотек 3A и 3B. Следует обратить внимание на то, что части P3 не попали в положение P4 для этих конструкций в библиотеке 3A или 3B.
[1059] Следует отметить следующие дополнительные наблюдения: P2_CD40, P2_ICOS, P3_MPL, P4_CD40 и P4_CD79B P2_CD40, P2_ICOS, P3_MPL, P4_CD40 и P4_CD79B являлись наиболее частыми частями среди наиболее эффективных в каждой из Табл. 12 и 13. P4_CD27 являлась наиболее частой частью в Табл. 12 и 13. CSF2RB встречался в 4 раза чаще в 123 наиболее обогащенных и наиболее репрезентативных в P2, но мутантный мутант V449E не встречался в этих наиболее эффективных конструкциях (Таб. 12). Соответственно, в некоторых вариантах осуществления настоящего изобретения химерный полипептид содержит трансмембранный домен, идентифицированный в любой из конструкций, показанных в Табл. 12 и 13, кроме мутанта трансмембранного домена V449E CSF2RB. Восемь вариантов MyD88 встречались в положении P3 по меньшей мере один раз в библиотеке 3A 123 наиболее эффективных конструкций (Табл. 12). Оба варианта CD40, тестированные в библиотеке, по меньшей мере один раз встречались в положении P4 в перечне 123 наиболее эффективных конструкций для библиотеки 3A (Табл. 12). Комбинацию MPL в P3 и CD40 в P4 демонстрировали в 26 конструкциях в перечне из 123 наиболее эффектинвхы конструкций библиотеки 3A (Табл. 12).
[1060] Для генного анализа для библиотеки 3A трансмембранные домены (P2) изCD4, CD8B, CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2C, GHR, ICOS, IFNAR1, IFNGR1, IFNGR2, IL1R1, IL1RAP, IL2RG, IL3RA, IL5RA, IL6ST, IL7RA, IL10RB, IL11RA, IL13RA2, IL17RA, IL17RB, IL17RC, IL17RE, IL18R1, IL18RAP, IL20RA, IL22RA1, IL31RA, LEPR, PRLR и TNFRSF8 или их мутанты, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, способствовали пролиферации PBMC между днем 7 и последним днем, указанным в таблице, когда данные рассматриваются комбинированным образом для всех конструкций с трансмембранным доменом, происходящим из этого гена (Табл. 12). Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в последний день, указанный в таблице, плюс один, и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 3А, при объединении результатов для всех конструкций для гена. Для библиотеки 3B (Табл. 13) трансмембранные домены из CD40, ICOS и IL18R1 или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, были лучшими показателями при анализе подобным образом. Примеры трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток для библиотеки 3A и 3B, представлены в Табл. 12 и 13. Примеры трансмембранных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторных скринингах, называемых библиотеками 3.1A и 3.1B, которые способствовали пролиферации клеток, представлены в Табл. 14 и 15.
[1061] Для библиотеки 3А первые внутриклеточные (P3) домены из CSF2RA, IFNAR1, IL1RAP, IL4R, IL6ST, IL11RA, IL12RB2, IL17RA, IL17RD, IL17RE, IL18R1, IL21R, IL23R, MPL и MyD88, или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, при обнаружении в первом внутриклеточном домене (P3) кандидатных элементов химерных полипептидов в данном документе, способствовали клеточной пролиферации PBMC между днем 7 и последним днем, указанным в таблице, когда данные рассматриваются комбинированным образом для всех конструкций с первым внутриклеточным доменом, происходящим из этого гена. Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в последний день, указанный в таблице, плюс один, и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 3А, при объединении результатов для всех конструкций для гена. Для библиотеки 3B первые внутриклеточные домены из CSF2RB, IL4R и MPL или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, были лучшими показателями при анализе подобным образом. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток для библиотек 3A и 3B, представлены в Табл. 12 и 13. Примеры первых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторных скринингах, называемых библиотеками 3.1A и 3.1B, которые способствовали пролиферации клеток, представлены в Табл. 14 и 15.
[1062] Для библиотеки 3А вторые внутриклеточные (P4) домены из CD3D, CD3G, CD27, CD40, CD79A, CD79B, FCER1G, FCGRA2, ICOS, TNFRSF4 и TNFRSF8 или их мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, когда такие мутанты присутствуют в конструкциях, представленных в таблицах, при обнаружении во втором внутриклеточном домене (P4) кандидатных элементов химерных полипептидов в данном документе, способствовали пролиферации PBMC между днем 7 и днем 21 или между днем 7 и последним днем, указанным в таблице, когда данные рассматриваются комбинированным образом для всех конструкций со вторым внутриклеточным доменом, происходящим из этого гена. Этот вывод основан на увеличении количества последовательностей конструкций в смешанных культивируемых популяциях клеток PBMC, так что обогащение, рассчитанное как логарифм по основанию 2 отношения между нормализованным количеством в последний день, указанный в таблице, плюс один, и нормализованным количеством в день 7 плюс один, было не менее 2 для библиотеки 3А, при объединении результатов для всех конструкций для гена. Для библиотеки 3B вторые внутриклеточные домены из CD40 или его мутантов, которые, как известно, способствуют сигнальной активности в определенных типах клеток, если такие мутанты присутствуют в таблицах, хотя и без достижения 2-кратного log2 обогащения, были лучшими показателями при анализе подобным образом. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях, которые способствовали наибольшей степени пролиферации клеток для библиотек 3A и 3B, представлены в Табл. 12 и 13. Примеры вторых внутриклеточных доменов или их частей и/или мутантов, которые присутствовали в конструкциях при повторных скринингах, называемых библиотеками 3.1A и 3.1B, которые способствовали пролиферации клеток, представлены в Табл. 14 и 15.
Пример 19. Термическая денатурация F1A-795 в отсутствие и в присутствии ацикловира с помощью дифференциальной сканирующей калориметрии (DSC)
[1063] В этом примере связывание противовирусного лекарственного средства на основе нуклеозидного аналога с доменом аптамера рибопереключателя (SEQ ID NO: 87) демонстрировали путем сравнения термической денатурации домена аптамера в отсутствие и в присутствии противовирусного лекарственного средства на основе нуклеозидного аналога ацикловира.
Приготовление аптамера
[1064] Праймер Т7 (SEQ ID NO: 246), а также матрицу (обратный комплемент) идентифицированной кандидатной последовательности синтезировали IDT (Коралвилл, Айова) в виде одноцепочечной ДНК. Кандидаты удлиняли с помощью праймеров путем объединения компонентов до 1 мкМ матрицы, 2 мкМ праймера T7, 200 мкМ dNTP, 1X Titanium Taq ДНК-полимеразы и 1X буфера Titanium Taq (Clontech Laboratories; Маунтин-Вью, Калифорния), затем нагревания в течение 3 минут при 95 °C, 1 минуту при 55 °C и 2 минут при 68 °C (без осуществления циклов). 42 пмоль двухцепочечной ДНК использовали для двенадцати 20 мкл реакционных смесей с набором для транскрипции Ampliscribe T7 High Yield Transcription Kit (Lucigen; Миддлтон, Висконсин) в соответствии со стандартными инструкциями набора (1X реакционный буфер, 7,5 мМ каждого NTP, 10 мМ DTT, 1X ингибитор РНКазы RiboGuard, раствор фермента 1X Ampliscribe T7). Реакционные смеси инкубировали при 42 °C в течение ночи, затем останавливали добавлением 1 мкл ДНКазы I и инкубировали в течение 15 минут при 37 °C. Продукты транскрипции очищали на 10% денатурирующем PAGE с 8 использованием М мочевины. По меньшей мере 10 нмоль каждого кандидата лиофилизировали и ресуспендировали в 1X буфере для связывания (50 мМ HEPES, 100 мМ KCl, 0,5 мМ MgCl2, pH 7,3) в день оценки связывания.
[1065] Вкратце, DSC использовали для анализа F1A-795 (7,2 мкМ) в отсутствие ацикловира или F1A-795 (2,77 мкМ) в присутствии ацикловира (29,4 мкМ). Все анализы проводили в 1X буфере для связывания, и всю использованную воду обработывали DEPC. Все аналиты сначала ресуспендировали в воде, обработанной DEPC, затем разбавляли до их конечной указанной концентрации в 1X буфере для связывания. Перед загрузкой DSC (GE Healthcare MicroCal VP-DSC) образцы дегазировали при 25 °C в течение 10 минут. Образец без ацикловира сканировали от 10 °C до 115 °C со скоростью 1 °C в минуту. Образец с ацикловиром сканировали от 10 °C до 105 °C со скоростью 1 °C в минуту.
Результаты
[1066] Термическая денатурация F1A-795 в отсутствие ацикловира, измеренная с помощью DSC, имеет переход с центром приблизительно при 60 °C (Фиг. 28). Этот переход предполагает, что домен аптамера структурирован в отсутствие ацикловира. В присутствии ацикловира F1A-795 имеет переход с центром при около 75 °C (Фиг. 28). Этот стабилизирующий эффект указывает на то, что противовирусное лекарственное средство на основе нуклеозидного аналога ацикловир связывается с аптамерным доменом F1A-795. Таким образом, этот эксперимент подтвердил, что F1A-795 связывается ацикловиром.
[1067] Пример 20. Эффективность трансдукции свежевыделенных и нестимулированных Т-клеток человека ретровирусными частицами, содержащими элемент псевдотипирования VSV-G и мембраносвязанный элемент активации, и необязательно содержащие белок Vpu
[1068] Рекомбинантные лентивирусные частицы получали путем временной трансфекции клеток 293T (Lenti-X ™ 293T, Clontech) отдельными паковывающими лентивирус плазмидами, кодирующими gag/pol и rev, и плазмидой псевдотипирования, кодирующей VSV-G. Вектор лентивирусной экспрессии третьего поколения, кодирующий GFP, рецептор химерного антигена против CD19 и eTAG, обозначаемый в данном документе как F1-0-03 (Фиг. 20) котрансфицировали пакующими плазмидами. Клетки адаптировали к суспензионной культуре путем серийного выращивания в Freestyle™ 293 Expression Medium (ThermoFisher Scientific). Клетки в суспензии высевали при концентрации 1 × 106 клеток/мл (30 мл) в колбу Эрленмейера на 125 мл и сразу же трансфицировали полиэтиленимином (PEI) (Polysciences), растворенным в слабой кислоте.
[1069] Плазмидную ДНК разводили в 1,5 мл среды Gibco™ Opti-MEM™ для 30 мл клеток. Для получения лентивирусных частиц, псевдотипированных VSV-G, использованная общая ДНК (1 мкг/мл объема культуры) представляла собой смесь 4 плазмид со следующими молярными отношениями: 2x геномная плазмида (F1-0-03), 1x Rev-содержащая плазмида, 1x VSV-G-содержащая плазмида и 1x gag/pol-содержащая плазмида. Для получения лентивирусных частиц, псевдотипированных VSV-G и отображающих антитело к CD3-scFvFc-GPI на своей поверхности, использованная общая ДНК (1 мкг/мл объема культуры) представляла собой смесь 5 плазмид со следующими молярными отношениями: 2x геномная плазмида (F1-0-03), 1x Rev-содержащая плазмида, 1x VSV-G-содержащая плазмида, 1x антитело к CD3-scFvFc-GPI-содержащая плазмида и 1x gag/pol-содержащая плазмида. Для получения лентивирусных частиц, псевдотипированных VSV-G, отображающих антитело к CD3-scFvFc-GPI и содержащих дополнительный белок Vpu, использованная общая ДНК (1 мкг/мл объема культуры) представляла собой смесь 6 плазмид со следующими молярными отношениями: 2x геномная плазмида (F1-0-03), 1x Rev-содержащая плазмида, 1x VSV-G-содержащая плазмида, 1x антитело к CD3-scFvFc-GPI-содержащая плазмида, 1x Vpu-CH-содержащая плазмида и 1x gag/pol-содержащая плазмида. Отдельно PEI разбавляли в 1,5 мл Gibco™ Opti-MEM™ до 2 мкг/мл (объем культуры, отношение к ДНК 2:1). После 5-минутной инкубации при комнатной температуре два раствора тщательно смешали и инкубировали при комнатной температуре в течение еще 20 минут. К клеткам добавляли конечный объем (3 мл). Затем клетки инкубировали при 37 °C в течение 72 часов при вращении со скоростью 125 об./мин. и с 8% CO2. Плазмида, содержащая антитело к CD3-scFvFc-GPI, включает scFv, полученный из UCHT1, и последовательность присоединения GPI-якоря, полученную из DAF (CD55). Вектор UCHT1scFvFc-GPI кодирует пептид (SEQ ID NO: 278), который содежрит сигнальный пептид человеческого Ig каппа (аминокислоты 1-22 № в NCBI GI CAA45494.1), слитый с scFv UCHT1 (аминокислоты 21-264 № в NCBI GI CAH69219.1), слитый с человеческим Fc IgG1 (аминокислоты 1-231 № NCBI GI в AEV43323.1), слитый с последовательностью присоединения GPI-якоря DAF человека (аминокислоты 345-381 № в NCBI GI NP_000565). Плазмида, содержащая Vpu-CH, кодирует пептид (MFDFIARVDYRVGVVALVVALIIAIIVWSIVYIEYRKLLKQRKIDWLIKRIRERAEDSGNESDG EIEELSTMVDMEHLRLLDDL*), который содержит последовательность Vpu из изолята HIV-1 M CH167-CC (аминокислоты 1-84, GenBank: AGF30946.1).
[1070] Через 72 часа супернатанты собирали и осветляли центрифугированием при 1200 g в течение 10 минут. Осветленные супернатанты переливали в новую пробирку. Лентивирусные частицы осаждали центрифугированием в течение ночи при 3300 g и 4 °C. Супернатант отбрасывали, и осадки лентивирусных частиц ресуспендировали в 1:100 от начального объема среды X-Vivo™ 15 (Lonza). Лентивирусные частицы титровали последовательным разведением и анализировали экспрессию GFP в клетках 293T и Jurkat через 72 часа после трансдукции с помощью проточной цитометрии.
[1071] Мононуклеарные клетки периферической крови (PBMC) выделяли из лейкоцитарной пленки, собирали и распространяли в San Diego Blood Bank, Калифорния. Разделение PBMC на основе градиента плотности SepMate™ 50 (Stemcell™) на Ficoll-Paque PLUS® (GE Healthcare Life Sciences) выполняли в соответствии с инструкциями производителя. В каждую пробирку SepMate™ наносили 30 мл лейкоцитарной пленки, разведенной в среде X-Vivo™ 15. После центрифугирования при комнатной температуре, при 1200 g в течение 20 минут, слои PBMC собирали, объединяли и трижды промывали 45 мл среды X-Vivo™ 15 и центрифугировали при 400 g в течение 10 минут при комнатной температуре. Затем осадки инкубировали при комнатной температуре в течение 10 минут в 10 мл буфера для лизиса эритроцитов (Alfa Aesar) и дополнительно дважды промывали 45 мл среды X-Vivo™ 15 и центрифугировали при 400 g в течение 10 минут при комнатной температуре. Никаких дополнительных стадий для удаления моноцитов не предпринимали. После выделения свежие и нестимулированные PBMC ресуспендировали до конечной концентрации 1 × 106/мл в среде X-Vivo™ 15 и трансдуцировали в двух повторах лентивирусными частицами, описанными ранее. Трансдукции проводили в течение 3 дней при 37 °C, 5% CO2 в среде X-Vivo™ 15. Трансдукции проводили при MOI 10 для [VSV-g] pp и MOI 1 для [VSV-G + UCHT1]pp и [VSV-G + UCHT1 + Vpu-CH]pp, в формате 12-луночного планшета, 1 мл/лунка, в двух повторах. Через 3 дня трансдукции образцы собирали и анализировали с помощью FACS в отношении абсолютного количества клеток и уровней экспрессии GFP в CD3+ популяции.
[1072] На Фиг. 34A и на Фиг. 34B изображены гистограммы процента (%) CD3+GFP+ клеток в общей CD3+ популяции (Фиг. 34A) и гистограмма абсолютного количества клеток на лунку живой CD3+ популяции (Фиг. 34B) соответственно, через 3 дня после трансдукции свежевыделенных и нестимулированных PBMC указанными лентивирусными частицами. Каждая полоса представляет собой среднее значение +/- SD повторов. На Фиг. 34A изображено, что добавление фрагмента антитела к CD3-scFvFc-GPI (UCHT1) к псевдотипированным лентивирусным частицам VSV-G приводит к более высокой эффективности трансдукции свежевыделенных и нестимулированных PBMC по сравнению с [VSV-G]pp в отдельности. На Фиг. 34A также изображено, что добавление Vpu-CH может дополнительно улучшить эффективность трансдукции дважды псевдотипированного вектора [VSV-G + UCHT1]pp. На Фиг. 34B изображено, что фрагмент UCHT1 усиливает стимуляцию клеток за счет абсолютного количества клеток на мкл по сравнению с VSV-G в отдельности. Добавление Vpu и UCHT1 аналогичным образом усиливает стимуляцию клеток за счет абсолютного количества клеток по сравнению с VSV-G в отдельности.
Пример 21. Характеристика отдельных лимфопролиферативных элементов
[1073] В этом примере выбранные химерные лимфопролиферативные элементы (CLE), идентифицированные при скрининге библиотеки, описанной в Примере 17 и Примере 18, оценивали индивидуально. Для дальнейшего анализа CLE, идентифицированных при скринингах библиотеки 2B, активированные PBMC трансдуцировали в течение ночи лентивирусными частицами, кодирующими только CLE, и культивировали в отсутствие экзогенных цитокинов. Для дальнейшего анализа CLE, идентифицированных при скринингах библиотеки 3A, активированные PBMC трансдуцировали в течение ночи лентивирусными
частицами, кодирующими CLE, фланкированный CAR антитело к CD19 на 5' конце и культивируемые в присутствии совместимых по донору CD19+ B-клеток, добавляемых в культуру каждые 7 дней, но в отсутствие экзогенных цитокинов. Клетки культивировали до 35 дней для оценки способности CLE стимулировать пролиферацию PBMC. В этом примере также представлены способы, с помощью которых можно охарактеризовать любой индивидуальный предполагаемый лимфопролиферативный элемент и дополнительно подтвердить идентичность нескольких высокоактивных CLE.
[1074] Рекомбинантные лентивирусные частицы получали в клетках 293T (Lenti-X™ 293T, Clontech), которые адаптировали для суспензионной культуры в бессывороточной среде определенного химического состава Freestyle™ 293 Expression Medium (Thermo Fisher Scientific). Клетки временно трансфицировали с использованием PEI геномной плазмидой и 3 отдельными лентивирусными пакующими плазмидами, кодирующими gag/pol, rev, и плазмидой псевдотипирования, кодирующей VSV-G, как объяснено в Примере 20. Выбранные CLE, идентифицированные при скрининге библиотеки, описанной в Примерах 17 и 18, регенерировали индивидуально из их частей (P1-2, P3 и P4 или P1, P2, P3 и P4) и вставляли в те же кассеты экспрессии трансгена, что и библиотека, из которой они были впервые идентифицированы. Модульные части каждого из выбранных CLE показаны на Фиг. 35 и 36, а названия генов и аминокислотные последовательности показаны в Табл. 6. На Фиг. 31 и 32 показаны кассеты для библиотек 2 и 3 соответственно. Клетки, трансдуцированные лентивирусными частицами, содержащими конструкции, идентифицированные посредством скрининга библиотек, обозначаются как «DL», за которым следует номер библиотеки. Например, клетки, трансдуцированные лентивирусными частицами, содержащими конструкции из библиотеки 2, обозначаются как DL2. Таким образом, CLE с префиксом «DL2» и «DL3» конструировали в кассете, показанной на Фиг. 31 и 32 соответственно. Аналогично, «DC1-5» и «DC1-6» содержат CLE, вставленные в кассету экспрессии трансгена, используемую для библиотеки 1, как показано на Фиг. 30. Химерный лимфопролиферативный элемент DC1-5, кодируемый от амино до карбоксильного конца, человеческий IL-7 (SEQ ID NO: 511), гибкий линкер (SEQ ID NO: 53) и остатки 21-458 человеческого IL-7Rα ( SEQ ID NO: 229), который представляет собой полноразмерный IL-7Rα без его сигнального пептида. CLE DC1-6, кодируемый от амино до карбоксиконца, IL-7 (SEQ ID NO: 511), гибкий линкер (SEQ ID NO: 53), внеклеточная и трансмембранная части IL-7Rα (CD127) (SEQ ID NO: 513) и внутриклеточный домен IL-2Rβ (CD122) (SEQ ID NO: 514). Химерные белки IL-7 - IL-7Rα и IL-7 - IL-7Rα - IL-2Rβ были описаны ранее (Hunter et al. Molecular Immunology 56(2013):1-11). «DC2-5» и «DC2-6» IL-7 содержат CLE, вставленные в кассету экспрессии трансгена, используемую для библиотеки 2, как показано на Фиг. 31. CLE в DC2-5 и DC2-6 были такими же CLE, что и DC1-5 и DC1-6 соответственно. Нетрансдуцированные PBMC (NT), PMBC, трансдуцированные вектором, кодирующим eTag, но не CLE (F1-0-01), и PMBC, трансдуцированные вектором, кодирующим CAR к CD19 и eTag, но не CLE (F1-3-23), включали в качестве отрицательных контролей.
[1075] В этом примере использовали следующие конструкции из библиотеки 2B: DL2-1 (M024-S190-S047), DL2-2 (M025-S050-S197), DL2-3 (M036-S170-S047), DL2-4 (M012-S045-S048), DL2-5 (M049-S194-S064), DL2-6 (M025-S190-S050) и DL2-7 (M025-S190-S051).
[1076] В этом примере использовали следующие конструкции из библиотеки 3А: DL3A-1 (E013-T047-S158-S080), DL3A-2 (E011-T024-S194-S039), DL3A-3 (E014-T040-S135-S076), DL3A-4 (E013-T041-S186-S051), DL3A-5 (E013-T064-S058-S212), DL3A-6 (E013-T028-S186-S051), DL3A-7 (E014-T015-S186-S051), DL3A-8 (E011-T016-S186-S050), DL3A-9 (E011-T073-S186-S050) и DL3A-10 (E013-T011-S186-S211).
[1077] В день 0 PBMC обогащали из лейкоцитов (San Diego Blood Bank) центрифугированием в градиенте плотности с Ficoll-Paque PREMIUM® (GE Healthcare Life Sciences) в соответствии с инструкциями производителя с последующим лизисом эритроцитов. 1,5 × 106 жизнеспособных PBMC засевали в лунки 6-луночных планшетов G-Rex (Wilson Wolf, 80240M) в 3 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM с добавлением 100 МЕ/мл (IL-2) и 50 нг/мл антитела к CD3 (317326, Biolegend) для активации PBMC для вирусной трансдукции. После инкубации в течение ночи при 37 °C и 5% CO2, лентивирусные частицы, кодирующие конструкции, описанные выше, добавляли непосредственно к активированным PBMC при MOI 5 и инкубировали в течение ночи при 37 °C и 5% CO2. На следующий день объем среды в каждой лунке доводили до 30 мл с помощью Complete OpTmizer™ CTS™ T-Cell Expansion SFM, и планшеты возвращали в инкубатор. На этой или последующих стадиях культивирования клеток не добавляли IL-2, IL-7 или другие экзогенные цитокины. Клетки из каждой лунки собирали в день 7 для определения количества клеток, процента жизнеспособности и процента трансдуцированных клеток, который определяли как процент FLAG-Tag+ или E-Tag+ клеток с помощью анализа FACS. Затем клетки центрифугировали, ресуспендировали в свежей Complete OpTmizer™ CTS™ T-Cell Expansion SFM, и 0,5 × 106 клеток для каждого образца повторно засевали в лунку 6-луночного планшета G-Rex в 30 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM. Ранее криоконсервированные в день 0 совместимые по донору PBMC, содержащие 0,5 × 106 CD19+ B-клеток (как определено FACS в день 0), добавляли к культурам «DL3A-», чтобы обеспечить активацию CD19+ B-клетками CD19 ASTR. Этот процесс повторяли в дни 14, 20 и 28 перед сбором клеток в день 35.
Результаты
[1078] PBMC, трансдуцированные лентивирусными частицами, кодирующими CLE, культивировали в отсутствие экзогенных цитокинов в течение 35 дней. Пролиферация представлена как кратное увеличение, которое рассчитывали путем деления общего количества клеток на количество клеток, засеянных для этого момента времени. РВМС, трансдуцированные каждым индивидуально выбранным CLE, изображенным на Фиг. 35, пролиферировали больше, чем отрицательные контроли, которые включали нетрансдуцированные PBMC и PMBC, трансдуцированные вектором, кодирующим eTag, но не CLE (Фиг. 35). Кроме того, следующие CLE продемонстрировали увеличение кратности более 23 в дни 14, 21, 28 и 35, в то время как кратность отрицательного контроля была близка к 0 для этих временных точек: DL2-7, DC2-6, DL2-6, DL2-2, DL2-1 и DC2-5. РВМС, трансдуцированные конструкциями, кодирующими CAR к CD19 и различными CLE (показаны на Фиг. 36) и культивировали в присутствии свежих совсместимых по донору PBMC, добавляемых каждые 7 дней, но в отсутствие экзогенных цитокинов, пролиферировали больше, чем отрицательные контроли, которые включали нетрансдуцированные PBMC и PMBC, трансдуцированные вектором, кодирующим CAR к CD19 и eTag, но не CLE. Все CLE, показанные на Фиг. 36, демонстрирует увеличение кратности более 23 в день 35, в то время как кратность увеличения отрицательных контролей была близка к 0 в день 35. Пролиферация PBMC, трансдуцированных лентивирусными частицами, содержащими полинуклеотиды, кодирующие DL3A-1 (E013-T047-S158-S080), DL3A-2 (E011-T024-S194-S039), DL3A-3 (E014-T040-S135-S076), и DL3A-5 (E013-T064-S058-S212) была сопоставима с отрицательными контролями и не показана на Фиг. 36.
Пример 22. Подтверждение концепции для различных иллюстративных способов, представленных в данном документе, включая экспансию in vivo генетически модифицированных лимфоцитов
[1079] В этом примере представлены иллюстративные способы трансдукции PBMC, включая Т-клетки, ex vivo и экспансии этих трансдуцированных PBMC, включая Т-клетки, in vivo. Такие способы включают иллюстративный способ 4-часовой трансдукции с иллюстративными рекомбинантными лентивирусными векторами, которые экспрессируют некоторые иллюстративные химерные лимфопролиферативные элементы. Кроме того, такие способы обеспечивают дополнительные иллюстративные способы трансдукции PBMC, которые в иллюстративных вариантах осуществления обычно представляют собой Т-клетки, с не способными к репликации рекомбинантными ретровирусными частицами в течение 4 часов, при этом не способные к репликации рекомбинантные ретровирусные частицы получали путем трансфекции пакующих клеток векторами, кодирующими различные компоненты репликация не способных рекомбинантных ретровирусных частиц в суспензии в бессывороточной среде определенного химического состава.
Материалы и способы
[1080] Рекомбинантные лентивирусные частицы получали в клетках 293T (Lenti-X™ 293T, Clontech), которые адаптировали для суспензионной культуры в бессывороточной среде определенного химического состава Freestyle™ 293 Expression Medium (Thermo Fisher Scientific). Клетки временно трансфицировали с использованием PEI 1-3 геномными плазмидами (подробно ниже) и 3 отдельными лентивирусными пакующими плазмидами, кодирующими gag/pol, rev, и плазмидой псевдотипирования, кодирующей VSV-G, как объяснено в Примере 20. Для получения ретровирусных частиц, которые также отображают мембраносвязанный элемент активации, четвертую пакующую плазмиду, кодирующую мембраносвязанный полипептид, способный связываться с CD3 (UCHT1scFvFc-GPI), котрансфицировали, как описано в Примере 20. Геномные плазмиды представляли собой лентивирусные векторы экспрессии третьего поколения, содержащие делецию в 3' LTR, приводящую к самоинактивации, при этом плазмиды кодировали следующее:
(1) CAR к ROR2 MRB:T2A:eTag (F1-1-27): Эта геномная плазмида идентична плазмиде, показанной на Фиг. 20, за исключением того, что последовательность, кодирующая CAR к CD19, заменяли на MRB-ASTR, который имеет scFv, который распознает человеческий ROR2, стебель CD8 и трансмембранную последовательность (SEQ ID NO: 75), CD137 (SEQ ID NO: 1) и CD3z ( SEQ ID NO: 13). Рекомбинантные лентивирусные частицы, кодирующие эту конструкцию, обозначают F1-1-27;
(2) Flag-CAR к ROR2 MRB:T2A:CLE (F1-1-228 и F1-1-228U): Эта геномная плазмида идентична плазмиде, показанной на Фиг. 20, за исключением того, что последовательность, кодирующая антитело к CD19, заменяли на метку Flag, ковалентно связанную с CAR к ROR2 MRB, описанным в (1) выше, а GMCSFR ss:eTag заменяли на CLE. CLE представлял собой трансмембранный белок типа I, содержащий модуль внеклеточной димеризации (P1), трансмембранный модуль (P2) и 2 внутриклеточных модуля (P3 и P4). Гены в положениях P1-P2-P3-P4 представляли собой метку Myc 2A Jun-IL13RA-MPL-CD40. Коды для этих модулей: E013-T041-S186-S051 (см. Табл. 6). Этот CLE впервые идентифицировали в библиотеках 3A, 3B и 4B и он был 6-м наиболее обогащенным CLE между днями 7 и 35 в библиотеке 3A. Рекомбинантные лентивирусные частицы, кодирующие эту конструкцию, обозначаются F1-1-228, а рекомбинантные лентивирусные частицы, кодирующие эту конструкцию и отображающие UCHT1scFvFc-GPI, обозначаются F1-1-228U; или
(3) Flag-CAR к CD19:T2A:CLE (F1-3-219 и F1-3-219U): Эта геномная плазмида идентична CAR к CD19 человека, показанному на Фиг. 20, за исключением того, что метку Flag вставляли между CD8ss и CAR, а последовательность, кодирующую GMCSFRss:eTag, заменяли на CLE. CLE представлял собой трансмембранный белок типа I, содержащий полипептид интерлейкина, ковалентно связанный через гибкий линкер с внеклеточным и трансмембранным доменами его когнатного рецептора интерлейкина и ковалентно связанный с внутриклеточным доменом рецептора отличающегося цитокина. В частности, от амино до карбоксиконца плазмида, кодирующая IL-7 (SEQ ID NO: 511), гибкий линкер (SEQ ID NO: 53), внеклеточные и трансмембранные части IL-7Rα (CD127) (SEQ ID NO: 513) и внутриклеточный домен IL-2Rβ (CD122) (SEQ ID NO: 514). Рекомбинантные лентивирусные частицы, кодирующие эту конструкцию, обозначаются F1-3-219, а рекомбинантные лентивирусные частицы, кодирующие эту конструкцию и отображающие UCHT1scFvFc-GPI, обозначаются F1-3-219U.
Выделение PBMC, трансдукция PBMC в течение ночи после стимуляции ex vivo с последующим 15-дневной экспансией ex vivo сконструированных лимфоцитов
[1081] В день 0 PBMC выделяли из периферической крови ACD от здорового добровольца с информированного согласия путем центрифугирования в градиенте плотности с Ficoll-Pacque™ (General Electric) с использованием набора CS-900.2 (BioSafe; 1008) на устройстве Sepax 2 S-100 (Biosafe; 14000) в соответствии с инструкциями производителя. 3,0 × 107 жизнеспособных PBMC засевали в 1 л G-Rex (Wilson-Wolf), и объем доводили до 60 мл с помощью Complete OpTmizer™ CTS™ T-Cell Expansion SFM с добавлением 100 МЕ/мл IL-2 (Novoprotein, GMP-CD66), 10 нг/мл IL-7 (Novoprotein, GMP-CD47) и 50 нг/мл антитела к CD3 (OKT3, Novoprotein) для активации PBMC, которые включали Т-клетки и NK-клетки, для вирусной трансдукции. После инкубации в течение ночи при 37 °C и 5% CO2 лентивирусные частицы, кодирующие CAR к ROR2 MRB, F1-1-27, добавляли непосредственно к активированным PBMC с MOI 5 (440 мкл) и инкубировали в течение ночи при 37 °C и 5% CO2. После инкубации в течение ночи клетки подпитывали, доводя общий объем среды в G-Rex до 100 мл с помощью Complete OpTmizer™ CTS™ T-Cell Expansion SFM с добавлением NAC (Sigma) для увеличения конечной концентрации на 10 мМ вместе с 100 МЕ/мл рекомбинантного человеческого IL-2 и 10 нг/мл рекомбинантного человеческого IL-7. Устройство G-Rex инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2 с добавлением 100 МЕ/мл раствора рекомбинантного человеческого IL-2 и 10 нг/мл раствора рекомбинантного человеческого IL-7 каждые 48 часов. Клетки экспандировали до дня 15 день перед сбором. Эти трансдуцированные клетки промывали в замораживающей среде (70% RPMI 1640, 20% инактивированный нагреванием FBS, 10% DMSO) и криоконсервировали в аликвотах по 1 мл при концентрации 5,0 × 107 клеток/мл для последующего применения. За два дня до использования в группе A экспериментов в этом примере ниже 8 флаконов (4,0 × 108) этих криоконсервированных трансдуцированных F1-1-27 PBMC размораживали и оставляли в покое в течение 2 дней в G-Rex100M, содержащем 377 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM (OpTmizer™ CTS™ T-Cell Expansion Basal Medium 1 L (Thermo Fisher, A10221) с добавлением 26 мл OpTmizer™ CTS™ T-Cell Expansion Supplement (Thermo Fisher, A10484-02), 25 мл CTS™ Immune Cell SR (Thermo Fisher, A2596101) и 10 мл CTS™ GlutaMAX™-I Supplement (Thermo Fisher, A1286001) в соответствии с инструкциями производителя) с добавлением 100 МЕ/мл IL-2 (Novoprotein), 10 нг/мл IL-7 (Novoprotein) и достаточного количество NAC для увеличения конечной концентрации до 10 мМ.
Выделение PBMC и преимущественно быстрая трансдукция покоящихся лимфоцитов без предварительной стимуляции ex vivo и без экспансии клеток ex vivo
[1082] Цельную человеческую кровь от 2 здоровых добровольцев с информированного согласия собирали в несколько пробирок Vacutainer диаметром 100 мм (Becton Dickenson; 364606), содержащих 1,5 мл антикоагулянта Acid Citrate Dextrose Solution A (ACD, периферическая кровь). Для каждого добровольца кровь из пробирок Vacutainer объединяли (185,2 мл для группы B, 182,5 мл для группы C) и распределяли в 2 стандартных пакета для сбора крови объемом 500 мл. Следующие стадии обогащения PBMC посредством трансдукции выполняли в закрытой системе.
[1083] Кровь в 2 пакетах для крови от каждого добровольца обрабатывали последовательно с использованием центрифугирования в градиенте плотности с Ficoll-Paque™ (General Electric) с использованием набора CS-900.2 (BioSafe; 1008) на устройстве Sepax 2 S-100 (Biosafe; 14000). используя 2 цикла промывки в соответствии с инструкциями производителя, чтобы получить 45 мл выделенных PBMC из каждого цикла. Промывочный раствор, используемый в процессе Sepax 2, представлял собой физиологический раствор (Chenixin Pharm) + 2% сывороточного альбумина человека (HSA) (Sichuan Yuanda Shuyang Pharmaceutical). Конечный раствор для ресуспендирования клеток представлял собой 45 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM (OpTmizer™ CTS™ T-Cell Expansion Basal Medium 1 L (Thermo Fisher, A10221-03) с добавлением 26 мл OpTmizer™ CTS™ T-Cell Expansion Supplement (Thermo Fisher, A10484-02), 25 ml CTS™ Immune Cell SR (Thermo Fisher, A2596101) и 10 мл CTS™ GlutaMAX™-I Supplement (Thermo Fisher, A1286001)). Каждая стадия обработки на устройстве Sepax 2 составляла приблизительно 1 час 12 минут. Обогащенные РВМС, полученные из 2 циклов обработки, объединяли отдельно для группы B и группы C и подсчитывали клетки.
[1084] 5,5 × 107 свежеобогащенных жизнеспособных PBMC засевали в каждый из 4 стандартных пакетов для сбора крови для группы B, и объем доводили до 55 мл с помощью Complete OpTmizer™ CTS™ T-Cell Expansion SFM таким образом, чтобы клетки имели плотность 1,0 × 106/мл. 1,12 × 108 свежеобогащенных жизнеспособных PBMC засевали в каждый из 2 стандартных пакетов для сбора крови для группы С, и объем доводили до 110 мл с помощью Complete OpTmizer™ CTS™ T-Cell Expansion SFM таким образом, чтобы клетки имели плотность 1,0 × 106/мл. Перед трансдукцией не добавляли антитело к CD3, антитело к CD28, IL-2, IL-7 или другие экзогенные цитокины для активации или иной стимуляции лимфоцитов ex vivo. Лентивирусные частицы добавляли непосредственно к нестимулированным PBMC в пакетах для сбора крови при MOI, равном 1, следующим образом: 0,779 мл F1-1-228 добавляли в один пакет и 3,11 мл F1-1-228U добавляли в другой пакет PBMC группы B; 0,362 мл F1-3-219 добавляли в один пакет и 3,52 мл F1-3-219U добавляли в другой пакет PBMC группы C. Смеси для реакции трансдукции осторожно массировали для перемешивания содержимого, затем инкубировали в течение четырех (4) часов в пакетах для сбора крови в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2. Затем PBMC из каждого пакета переносили в коническую пробирку объемом 50 мл (таким образом удаляя клетки из закрытой системы в этом эксперименте, подтверждающем концепцию) и промывали 3 раза в DPBS + 2% HSA перед ресуспендированием в 5 мл DPBS + 2% HSA и подсчетом. В таблице ниже показана продолжительность каждой стадии способа и общее время, прошедшее с начала. Никакой дополнительной обработки этих PBMC не выполняли до их использования в экспериментах в этом примере.
Таблица 24. Время, прошедшее для стадий после взятия и объединения пулов крови.
Эффективность трансдукции и цитокин-независимая выживаемость/пролиферация in vitro PBMC, трансдуцированных описанными выше способами
[1085] 2,0 × 106 PBMC, которые включали Т-клетки и NK-клетки, высевали в двух или трех повторах в лунки 6-луночного планшета для тканевых культур для каждого образца. Планшеты центрифугировали, и каждый образец ресуспендировали в 2 мл Complete OpTmizer™ CTS™ T-Cell Expansion SFM. Цитокины не добавляли. Планшеты инкубировали в стандартном увлажненном инкубаторе для тканевых культур при 37 °C и 5% CO2 в течение 6 дней. Половину (1 мл) клеточной суспензии из каждой лунки удаляли в день 3, а оставшиеся клетки удаляли в день 6 для определения количества клеток, процента жизнеспособности и процента трансдуцированных клеток, который определяли как процент метка FLAG+ клеток с помощью анализа FACS. Общее количество клеток в день 6 удваивали, чтобы учесть удаление половины клеток в день 3.
Пролиферация/выживаемость и целевое уничтожение опухолей in vivo эффекторными РВМС, трансдуцированными описанными выше способами
[1086] Модель ксенотрансплантата с использованием мышей NSG или NOD Scid Gamma выбирали для исследования способности PBMC человека, трансдуцированных с помощью F1-1-27, F1-1-228, F1-1-228U, F1-3-219 и F1-3-219U, к выживанию, пролиферации и уничтожению когнатных антиген-экспрессирующих опухолей in vivo. NSG представляла собой линию мышей, у которой отсутствуют зрелые Т-клетки, NK-клетки и В-клетки, и она является одной из наиболее иммунодефицитных линий мышей, описанных в настоящее время. Удаление этих клеточных компонентов иммунной системы обычно выполняется для обеспечения возможности приживления PBMC человека без врожденных, гуморальных или адаптивных иммунных реакций со стороны хозяина. Концентрации гомеостатических цитокинов, обычно присутствующие у людей, достигаются только после лучевой или лимфодеплецирующей химиотерапии из-за отсутствия общей внеклеточной гамма-цепи мыши, которая позволяет адоптивно перенесенным клеткам человека получать такие цитокины. В то же время, этих животных можно также использовать для приживления мишеней ксенотрансплантата опухоли, чтобы исследовать эффективность CAR для уничтожения опухолей, экспрессирующих мишень. Хотя присутствие антигенов ксенореактивных Т-клеточных рецепторов в эффекторном клеточном продукте в конечном итоге приводит к реакции «трансплантат против хозяина», эти модели позволяют в краткосрочной перспективе оценить фармакологию и острую переносимость у животных.
[1087] Клетки Raji (ATCC, Манассас, Вирджиния), которые экспрессируют эндогенный CD19 человека, и клетки CHO (ATCC, Манассас, Вирджиния), трансфицированные для стабильной экспрессии ROR2 человека (CHO-ROR2), использовали для обеспечения антигена для стимуляции эффекторных клеток с CAR и для генерации однородных целевых опухолей для определения эффективности эффекторных клеток с CAR по уничтожению когнатных антиген-экспрессирующих опухолей. Клетки Raji и трансгенные варианты CHO быстро росли с диссеминированной злокачественной опухолью после подкожного введения мышам NSG в сочетании с искусственной базальной мембраной Matrigel.
[1088] С мышами обращались в соответствии с протоколами, утвержденными Комитетом по уходу и использованию животных. Подкожные (sc) опухолевые ксенотрансплантаты устанавливали на заднем боку самок мышей NOD-PrkdcscidIl2rgtm1/Begen (B-NSG) (Beijing Biocytogen Co. Ltd.). Вкратце, культивируемые клетки Raji и культивированные клетки CHO-ROR2 отдельно промывали в DPBS (Thermo Fisher), подсчитывали, ресуспендировали в холодном DPBS и смешивали с соответствующим объемом Matrigel ECM (Corning; конечная концентрация 5 мг/мл) при концентрации 0,5 × 106 клеток/200 мкл на льду. Животных готовили к инъекции с использованием стандартной одобренной анестезии с удалением волос (Nair) перед инъекцией. 200 мкл любой клеточной суспензии в ЕСМ вводили подкожно в задние бока 9 или 10-недельных мышей для клеток Raji и CHO-ROR2 соответственно.
[1089] Через 5 дней после инокуляции опухоли мышам с опухолями CHO-ROR2, средний объем которых составлял 77 мм3, вводили внутривенно (IV) инъекцию в хвостовую вену следующим образом: Мыши NSG в группе A получали 1 × 107 PBMC, трансдуцированных лентивирусными частицами F1-1-27 в 200 мкл DPBS (n = 4) или 200 мкл только DPBS (n = 2); мыши NSG в группе B получали 0,85 × 107 PBMC, трансдуцированных лентивирусными частицами F1-1-228 в 200 мкл DPBS (n = 2), 0,85 × 107 PBMC, трансдуцированных лентивирусными частицами F1-1-228U в 200 мкл DPBS (n = 2), или 200 мкл одного DPBS (n = 2). Аналогично через 5 дней после инокуляции опухоли мышам в группе C, несущим опухоли Raji, которые в среднем составляли 76 мм3 в объеме, вводили внутривенно (IV) инъекцию в хвостовую вену только 200 мкл DPBS (n = 4) или 1 × 107 PBMC, трансдуцированных любым из лентивирусных частиц F1-3-219 в 200 мкл DPBS (n = 3) или лентивирусных частиц F1-3-219U в 200 мкл DPBS (n = 3). Следует обратить внимание, что протокол для преимущественно быстрой трансдукции покоящихся лимфоцитов до активации ex vivo и без экспансии клеток ex vivo использовали для трансдукции PBMC с помощью F1-1-228, F1-1-228U, F1-3-219 и F1-3-219U использовали для введения дозы у этих мышей. Общее время, прошедшее от сбора цельной крови человека до внутривенного введения мышам трансдуцированных РВМС, составляло 14,5 часов для F1-1-228 и F1-1-228U и 11,5 часов для F1-3-219 и F1-3-219U.
[1090] Опухоли измеряли штангенциркулем 2 раза в неделю, и объем опухоли рассчитывали по следующему уравнению: (наибольший диаметр * наименьший диаметр2)/2. Примерно 100 мкл крови собирали у каждой мыши в день 7, 14 и 21 для анализа с помощью FACS и qPCR. Кровь, селезенку и опухоль также собирали, когда мышей умерщвляли в соответствии с рекомендациями по аутопсии от опухолевой нагрузки.
Проточная цитометрия
[1091] Для клеток, собранных из культуры in vitro, клетки центрифугировали и ресуспендировали в 0,5 мл буфера для окрашивания FACS (554656, BD). К каждому образцу добавляли 2,5 мкл блока Fc человека (BD, 564220) и инкубировали при комнатной температуре в течение 10 минут. Клетки окрашивали 0,5 мкл меченым PE антителом к метке FLAG ((anti-DYKDDDDK) 637310, Biolegend) и 0,5 мкл фиксируемых живых/мертвых зеленых мертвых клеток (L34970, Thermo Fisher) в течение 30 минут на льду. Клетки дважды промывали в буфере FACS, фиксировали в смеси 1:1 буфера FACS и BD Cytofix (554655, BD), обрабатывали Novocyte (ACEA), и полученные данные анализировали с помощью программного обеспечения NovoExpress (ACEA) с использованием живых гейтов на основе прямого и бокового рассеивания и живого мертвого пятна. Трансдуцированные лимфоциты измеряли как метка FLAG+ клетки.
[1092] Для клеток, полученных из крови, эритроциты в свежесобранной крови лизировали с использованием лизирующего буфера (555899, BD), а оставшиеся клетки ресуспендировали в 100 мкл буфера для окрашивания для FACS. К каждому образцу добавляли 2,5 мкл блока Fc человека (BD, 564220) и инкубировали при комнатной температуре в течение 10 минут. Клетки окрашивали биотинилированным цетуксимабом в течение 30 минут на льду. Окрашенные клетки промывали буфером FACS и дополнительно окрашивали 5 мкл антитела к CD45-PE-Cy7 человека и 0,5 мкл антитела к CD45-FITC мыши. 0,4 мкл SA-PE добавляли к образцам от мышей, которым вводили дозы клеток, трансдуцированных контрольными F1-1-27, F1-1-228, F1-1-228U и PBS для этих групп. 1 мкл меченого РЕ антитела к метке FLAG ((антитело к DYKDDDDK) 637310, Biolegend) добавляли к образцам от мышей, которым вводили дозы клеток, трансдуцированных F1-3-219 и F1-3-219U и контрольными PBS для этой группы. Клетки инкубировали в течение 30 минут на льду, дважды промывали в буфере FACS и ресуспендировали в 100 мкл буфера для окрашивания FACS с 1 мкл 7-AAD (420404, Biolegend). Свежеокрашенные образцы обрабатывали Novocyte (ACEA), и полученные данные анализировали с помощью программного обеспечения NovoExpress (ACEA) с использованием живых гейтов на основе прямого и бокового рассеяния, живых гейтов на основе 7-AAD, человеческого CD45+ и исследовали на экспрессию FLAG или eTag.
qPCR
[1093] Геномную ДНК (gDNA), выделенную из образцов крови, оценивали на наличие трансдуцированных лимфоцитов с помощью биоаналитической qPCR. Геномную ДНК выделяли из 50 мкл образцов крови с использованием набора QIAamp DNA Blood Mini (Qiagen 51106), и ДНК дополнительно очищали с помощью набора QIAamp DNA Micro Kit (56304). Анализ TaqMan (Thermo Fisher) проводили на выделенной геномной ДНК с использованием набора праймеров и зондов, специфичных для 5' LTR лентивируса, для обнаружения трансдуцированных клеток.
РЕЗУЛЬТАТЫ
[1094] В этом эксперименте использовали лентивирусные частицы, псевдотипированные VSV-G и кодирующие CAR и лимфопролиферативный элемент. Лентивирусные частицы F1-1-228 и F1-1-228U кодировали MRB-CAR к ROR2, а лентивирусные частицы F1-2-219 и F1-3-219U кодировали CAR к CD19. Лентивирусные частицы F1-1-228U и F1-3-219U также отображали на своей поверхности UCHT1scFvFc-GPI. PBMC выделяли из крови человека центрифугированием в градиенте плотности с Ficoll-Paque™. Свежие PBMC трансдуцировали лентивирусными частицами в стандартных пакетах для крови без предварительной активации клеток ex vivo. После 4-часовой трансдукции клетки промывали и использовали в экспериментах ниже. Специалист в данной области техники поймет, что весь процесс от сбора крови до промытых клеток может быть выполнен в закрытой системе. В качестве контроля PBMC активировали в течение ночи, трансдуцировали лентивирусными частицами, кодирующими CAR без лимфопролиферативного элемента или UCHT1scFvFc-GPI, и экспандировали ex vivo в течение 15 дней (F1-1-27).
[1095] Трансдуцированные PBMC культивировали in vitro в отсутствие цитокинов. На Фиг. 37 показана эффективность трансдукции в день 6. UCHT1scFvFc-GPI увеличивал эффективность трансдукции как F1-1-228, так и F1-3-219. Покоящиеся РВМС при воздействии F1-1-228U или F1-3-219U в течение 4 часов имели эффективность трансдукции 34% и 73% соответственно. На Фиг. 38 показано общее количество жизнеспособных клеток в этих культурах между днями 3 и 6. Покоящиеся РВМС, трансдуцированные либо F1-1-228U, либо F1-3-219U, выживали и даже пролиферировали между днем 3 и днем 6 в отсутствие экзогенных цитокинов, в то время как РВМС, трансдуцированные либо F1-1-228, либо F1-3-219, не выживали. Эти результаты демонстрируют, что ретровирусные частицы, отображающие активирующий элемент и кодирующие лимфопролиферативный элемент, могут трансдуцировать покоящиеся PBMC за 4 часа и что эти трансдуцированные PMBC могут пролиферировать и выживать in vitro при культивировании в течение 6 дней в отсутствие экзогенных цитокинов.
[1096] Мышам с иммунодефицитом, несущим опухоли ROR2 или CD19, внутривенно вводили 1 × 107 PBMC, которые экспрессируют CAR к ROR2 или CD19 соответственно. Способность трансдуцированных PBMC выживать и пролиферировать in vivo исследовали с течением времени. На Фиг. 39A-C показано количество лентивирусных копий на мкг геномной ДНК при qPCR в качестве считывания для трансдуцированных клеток. На Фиг. 39A показано, что количество копий лентивируса на мкг геномной ДНК для F1-1-27, который не кодирует лимфопролиферативный элемент, снизилось в среднем с 884 в день 7 до уровня ниже нижнего предела количественного определения (LLOQ) в день 21. На Фиг. 39B показано, что количество лентивирусных копий для F1-1-228U было ниже LLOQ в дни 7 и 14, но увеличилось выше LLOQ в день 21 и увеличилось в среднем до 1939 в день 25. На Фиг. 39C показано, что количество лентивирусных копий для F1-3-219U увеличивалось с нижнего предела LLOQ в день 7 до 20430 в день 14, когда мышей умерщвляли. Количество лентивирусных копий в контрольных образцах, F1-1-228 и F1-3-219, оставалось ниже LLOQ. На Фиг. 40 показано количество трансдуцированных клеток на 200 мкл крови на момент умерщвления мышей (последние временные точки показаны на Фиг. 39), как определено анализом FACS для eTag или метки FLAG конструкции CAR. Значительное количество CAR+ клеток обнаруживали в 200 мкл крови мышей, которым вводили дозы клеток, трансдуцированных F1-1-228U (5857) и F1-3-219U (121324). Лимфоциты, трансдуцированные F1-1-228U или F1-3-219U, уничтожали опухоли, экспрессирующие их целевой антиген in vivo (Фиг. 41A и В). В обоих случаях лимфоциты замедленно уменьшали объем опухоли. Не ограничиваясь теорией, эта задержка согласуется с необходимостью экспансии введенных клеток, что, как показывает qPCR, требует времени. Более поздние временные точки не могли быть изучены в этом эксперименте, поскольку мыши с опухолями ROR2 достигли рекомендаций по эвтаназии для опухолевой нагрузки, а у мышей с опухолями Raji развилась реакция трансплантат против хозяина, вызванное значительным количеством трансдуцированных и экспандированных лимфоцитов у мышей. Вместе эти данные демонстрируют, что ретровирусные частицы, отображающие активирующий элемент и кодирующие лимфопролиферативный элемент, могут трансдуктировать покоящиеся PBMC за 4 часа и что эти трансдуцированные PMBC могут пролиферировать и выживать in vivo. Оба лимфопролиферативных элемента, протестированные в этом эксперименте, MycTag 2A Jun-IL13Ra-MPL-CD40 и IL-7-IL-7Rα- IL-2Rβ, продемонстрировали способность стимулировать выживание и пролиферацию in vivo. Кроме того, эти лимфоциты, трансдуцированные таким образом с экспрессией MRB-CAR (F1-1-228U) или традиционного CAR (F1-3-219U), были способны распознавать и уничтожать опухолевые клетки in vivo.
[1097] Раскрытые варианты осуществления, примеры и эксперименты не предназначены для ограничения объема раскрытия или для представления того, что эксперименты ниже являются всеми или единственными выполненными экспериментами. Были предприняты усилия для обеспечения точности используемых чисел (например, количества, температуры и т.д.), однако следует учитывать некоторые экспериментальные ошибки и отклонения. Следует понимать, что изменения в описанных способах могут быть сделаны без изменения фундаментальных аспектов, которые эксперименты призваны проиллюстрировать.
[1098] Специалисты в данной области техники могут разработать множество модификаций и других вариантов осуществления в пределах объема и сущности настоящего изобретения. Действительно, вариации в описанных материалах, способах, чертежах, экспериментах, примерах и вариантах осуществления могут быть сделаны специалистами в данной области техники без изменения фундаментальных аспектов настоящего изобретения. Любой из раскрытых вариантов осуществления может применяться в сочетании с любым другим раскрытым вариантом осуществления.
[1099] В некоторых случаях некоторые концепции были описаны со ссылкой на конкретные варианты осуществления. Однако специалист в данной области техники понимает, что различные модификации и изменения могут быть выполнены без выхода за пределы объема настоящего изобретения, изложенного в формуле изобретения ниже. Соответственно, описание и фигуры следует рассматривать в иллюстративном, а не ограничительном смысле, и все такие модификации предназначены для включения в объем настоящего изобретения.
Таблица 6. Коды, названия, цитокиновые рецепторы, мотив ITAM и аминокислотные последовательности для частей P1-P2, P1, P2, P3 и P4
Таблица 7. Наиболее эффективные конструкции библиотеки 1A
Таблица 8. Наиболее эффективные конструкции библиотеки 2В
Таблица 9. Наиболее эффективные конструкции библиотеки 1,1A
Таблица 10. Наиболее эффективные конструкции библиотеки 1.1B
Таблица 11. Наиболее эффективные конструкции библиотеки 2.1B
Таблица 12. Наиболее эффективные конструкции библиотеки 3A
Таблица 13. Наиболее эффективные конструкции библиотеки 3B
Таблица 14. Наиболее эффективные конструкции библиотеки 3.1A
Таблица 15. Наиболее эффективные конструкции библиотеки 3.1B
Таблица 16. Наиболее эффективные конструкции библиотеки 4B
Таблица 17. Наиболее эффективные конструкции библиотеки 4.1B
Таблица 18. Lib3 P4_STOP
Таблица 19. Конструкции с особенно значительными улучшениями в библиотеках 1A и 1.1A
Таблица 20. Конструкции с особенно значительными улучшениями в библиотеках 2B и 2.1B
Таблица 21. Конструкции с особенно значительными улучшениями в библиотеках 3A и 3.1A
Таблица 22. Конструкции с особенно значительными улучшениями в библиотеках 3B и 3.1B
Таблица 23. Конструкции с особенно значительными улучшениями в библиотеках 4B и 4.1B
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> F1 Oncology, Inc.
<120> СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ТРАНСДУКЦИИ И ЭКСПАНСИИ ЛИМФОЦИТОВ И РЕГУЛЯЦИИ
ИХ АКТИВНОСТИ
<130> F1.001.WO.03
<150> 62/467039
<151> 3 марта 2017 г.
<150> PCT/US2017/023112
<151> 19 марта 2017 г.
<150> 62/560176
<151> 18 марта 2017 г.
<150> 62/564253
<151> 27 сентября 2017 г.
<150> 62/564991
<151> 2017-09-28
<150> 15/462855
<151> 28 сентября 2017 г.
<150> 15/644778
<151> 8 июля 2017 г.
<150> PCT/US2017/041277
<151> 8 июля 2017 г.
<160> 521
<170> PatentIn версия 3.5
<210> 1
<211> 42
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 2
<211> 41
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 3
<211> 41
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Ala Tyr Ala Ala
20 25 30
Ala Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 4
<211> 35
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Thr Lys Lys Lys Tyr Ser Ser Ser Val His Asp Pro Asn Gly Glu Tyr
1 5 10 15
Met Phe Met Arg Ala Val Asn Thr Ala Lys Lys Ser Arg Leu Thr Asp
20 25 30
Val Thr Leu
35
<210> 5
<211> 37
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His Lys Pro Pro Gly Gly
1 5 10 15
Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp Ala His Ser
20 25 30
Thr Leu Ala Lys Ile
35
<210> 6
<211> 49
<212> БЕЛОК
<213> Homo sapiens
<400> 6
His Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu
1 5 10 15
Pro Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser
20 25 30
Thr Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser
35 40 45
Pro
<210> 7
<211> 114
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Cys Cys Leu Arg Arg His Gln Gly Lys Gln Asn Glu Leu Ser Asp Thr
1 5 10 15
Ala Gly Arg Glu Ile Asn Leu Val Asp Ala His Leu Lys Ser Glu Gln
20 25 30
Thr Glu Ala Ser Thr Arg Gln Asn Ser Gln Val Leu Leu Ser Glu Thr
35 40 45
Gly Ile Tyr Asp Asn Asp Pro Asp Leu Cys Phe Arg Met Gln Glu Gly
50 55 60
Ser Glu Val Tyr Ser Asn Pro Cys Leu Glu Glu Asn Lys Pro Gly Ile
65 70 75 80
Val Tyr Ala Ser Leu Asn His Ser Val Ile Gly Pro Asn Ser Arg Leu
85 90 95
Ala Arg Asn Val Lys Glu Ala Pro Thr Glu Tyr Ala Ser Ile Cys Val
100 105 110
Arg Ser
<210> 8
<211> 187
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Arg Arg Ala Cys Arg Lys Arg Ile Arg Gln Lys Leu His Leu Cys Tyr
1 5 10 15
Pro Val Gln Thr Ser Gln Pro Lys Leu Glu Leu Val Asp Ser Arg Pro
20 25 30
Arg Arg Ser Ser Thr Gln Leu Arg Ser Gly Ala Ser Val Thr Glu Pro
35 40 45
Val Ala Glu Glu Arg Gly Leu Met Ser Gln Pro Leu Met Glu Thr Cys
50 55 60
His Ser Val Gly Ala Ala Tyr Leu Glu Ser Leu Pro Leu Gln Asp Ala
65 70 75 80
Ser Pro Ala Gly Gly Pro Ser Ser Pro Arg Asp Leu Pro Glu Pro Arg
85 90 95
Val Ser Thr Glu His Thr Asn Asn Lys Ile Glu Lys Ile Tyr Ile Met
100 105 110
Lys Ala Asp Thr Val Ile Val Gly Thr Val Lys Ala Glu Leu Pro Glu
115 120 125
Gly Arg Gly Leu Ala Gly Pro Ala Glu Pro Glu Leu Glu Glu Glu Leu
130 135 140
Glu Ala Asp His Thr Pro His Tyr Pro Glu Gln Glu Thr Glu Pro Pro
145 150 155 160
Leu Gly Ser Cys Ser Asp Val Met Leu Ser Val Glu Glu Glu Gly Lys
165 170 175
Glu Asp Pro Leu Pro Thr Ala Ala Ser Gly Lys
180 185
<210> 9
<211> 54
<212> БЕЛОК
<213> Homo sapiens
<400> 9
His Ile Trp Gln Leu Arg Ser Gln Cys Met Trp Pro Arg Glu Thr Gln
1 5 10 15
Leu Leu Leu Glu Val Pro Pro Ser Thr Glu Asp Ala Arg Ser Cys Gln
20 25 30
Phe Pro Glu Glu Glu Arg Gly Glu Arg Ser Ala Glu Glu Lys Gly Arg
35 40 45
Leu Gly Asp Leu Trp Val
50
<210> 10
<211> 60
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Cys Val Lys Arg Arg Lys Pro Arg Gly Asp Val Val Lys Val Ile Val
1 5 10 15
Ser Val Gln Arg Lys Arg Gln Glu Ala Glu Gly Glu Ala Thr Val Ile
20 25 30
Glu Ala Leu Gln Ala Pro Pro Asp Val Thr Thr Val Ala Val Glu Glu
35 40 45
Thr Ile Pro Ser Phe Thr Gly Arg Ser Pro Asn His
50 55 60
<210> 11
<211> 163
<212> БЕЛОК
<213> Homo sapiens
<400> 11
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys
20 25 30
Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala
35 40 45
Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
50 55 60
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
65 70 75 80
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
85 90 95
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
100 105 110
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
115 120 125
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
130 135 140
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
145 150 155 160
Pro Pro Arg
<210> 12
<211> 164
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys
20 25 30
Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala
35 40 45
Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
50 55 60
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
65 70 75 80
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
85 90 95
Gly Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
100 105 110
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
115 120 125
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
130 135 140
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
145 150 155 160
Leu Pro Pro Arg
<210> 13
<211> 112
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 14
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
1 5 10 15
Val Leu Asp Lys Arg
20
<210> 15
<211> 22
<212> БЕЛОК
<213> Homo sapiens
<400> 15
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
1 5 10 15
Ser Glu Ile Gly Met Lys
20
<210> 16
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 16
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
1 5 10 15
Ala Leu His Met Gln
20
<210> 17
<211> 171
<212> БЕЛОК
<213> Homo sapiens
<400> 17
Met Glu His Ser Thr Phe Leu Ser Gly Leu Val Leu Ala Thr Leu Leu
1 5 10 15
Ser Gln Val Ser Pro Phe Lys Ile Pro Ile Glu Glu Leu Glu Asp Arg
20 25 30
Val Phe Val Asn Cys Asn Thr Ser Ile Thr Trp Val Glu Gly Thr Val
35 40 45
Gly Thr Leu Leu Ser Asp Ile Thr Arg Leu Asp Leu Gly Lys Arg Ile
50 55 60
Leu Asp Pro Arg Gly Ile Tyr Arg Cys Asn Gly Thr Asp Ile Tyr Lys
65 70 75 80
Asp Lys Glu Ser Thr Val Gln Val His Tyr Arg Met Cys Gln Ser Cys
85 90 95
Val Glu Leu Asp Pro Ala Thr Val Ala Gly Ile Ile Val Thr Asp Val
100 105 110
Ile Ala Thr Leu Leu Leu Ala Leu Gly Val Phe Cys Phe Ala Gly His
115 120 125
Glu Thr Gly Arg Leu Ser Gly Ala Ala Asp Thr Gln Ala Leu Leu Arg
130 135 140
Asn Asp Gln Val Tyr Gln Pro Leu Arg Asp Arg Asp Asp Ala Gln Tyr
145 150 155 160
Ser His Leu Gly Gly Asn Trp Ala Arg Asn Lys
165 170
<210> 18
<211> 127
<212> БЕЛОК
<213> Homo sapiens
<400> 18
Met Glu His Ser Thr Phe Leu Ser Gly Leu Val Leu Ala Thr Leu Leu
1 5 10 15
Ser Gln Val Ser Pro Phe Lys Ile Pro Ile Glu Glu Leu Glu Asp Arg
20 25 30
Val Phe Val Asn Cys Asn Thr Ser Ile Thr Trp Val Glu Gly Thr Val
35 40 45
Gly Thr Leu Leu Ser Asp Ile Thr Arg Leu Asp Leu Gly Lys Arg Ile
50 55 60
Leu Asp Pro Arg Gly Ile Tyr Arg Cys Asn Gly Thr Asp Ile Tyr Lys
65 70 75 80
Asp Lys Glu Ser Thr Val Gln Val His Tyr Arg Thr Ala Asp Thr Gln
85 90 95
Ala Leu Leu Arg Asn Asp Gln Val Tyr Gln Pro Leu Arg Asp Arg Asp
100 105 110
Asp Ala Gln Tyr Ser His Leu Gly Gly Asn Trp Ala Arg Asn Lys
115 120 125
<210> 19
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 19
Asp Gln Val Tyr Gln Pro Leu Arg Asp Arg Asp Asp Ala Gln Tyr Ser
1 5 10 15
His Leu Gly Gly Asn
20
<210> 20
<211> 206
<212> БЕЛОК
<213> Homo sapiens
<400> 20
Met Gln Ser Gly Thr His Trp Arg Val Leu Gly Leu Cys Leu Leu Ser
1 5 10 15
Val Gly Val Trp Gly Gln Asp Gly Asn Glu Glu Met Gly Gly Ile Thr
20 25 30
Gln Thr Pro Tyr Lys Val Ser Ile Ser Gly Thr Thr Val Ile Leu Thr
35 40 45
Cys Pro Gln Tyr Pro Gly Ser Glu Ile Leu Trp Gln His Asn Asp Lys
50 55 60
Asn Ile Gly Gly Asp Glu Asp Asp Lys Asn Ile Gly Ser Asp Glu Asp
65 70 75 80
His Leu Ser Leu Lys Glu Phe Ser Glu Leu Glu Gln Ser Gly Tyr Tyr
85 90 95
Val Cys Tyr Pro Arg Gly Ser Lys Pro Glu Asp Ala Asn Phe Tyr Leu
100 105 110
Tyr Leu Arg Ala Arg Val Cys Glu Asn Cys Met Glu Met Asp Met Ser
115 120 125
Val Ala Thr Ile Val Ile Val Asp Ile Cys Ile Thr Gly Gly Leu Leu
130 135 140
Leu Leu Val Tyr Tyr Trp Ser Lys Asn Arg Lys Ala Lys Ala Lys Pro
145 150 155 160
Val Thr Arg Gly Ala Gly Ala Gly Gly Arg Gln Arg Gly Gln Asn Lys
165 170 175
Glu Arg Pro Pro Pro Val Pro Asn Pro Asp Tyr Glu Pro Ile Arg Lys
180 185 190
Gly Gln Arg Asp Leu Tyr Ser Gly Leu Asn Gln Arg Arg Ile
195 200 205
<210> 21
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 21
Asn Pro Asp Tyr Glu Pro Ile Arg Lys Gly Gln Arg Asp Leu Tyr Ser
1 5 10 15
Gly Leu Asn Gln Arg
20
<210> 22
<211> 182
<212> БЕЛОК
<213> Homo sapiens
<400> 22
Met Glu Gln Gly Lys Gly Leu Ala Val Leu Ile Leu Ala Ile Ile Leu
1 5 10 15
Leu Gln Gly Thr Leu Ala Gln Ser Ile Lys Gly Asn His Leu Val Lys
20 25 30
Val Tyr Asp Tyr Gln Glu Asp Gly Ser Val Leu Leu Thr Cys Asp Ala
35 40 45
Glu Ala Lys Asn Ile Thr Trp Phe Lys Asp Gly Lys Met Ile Gly Phe
50 55 60
Leu Thr Glu Asp Lys Lys Lys Trp Asn Leu Gly Ser Asn Ala Lys Asp
65 70 75 80
Pro Arg Gly Met Tyr Gln Cys Lys Gly Ser Gln Asn Lys Ser Lys Pro
85 90 95
Leu Gln Val Tyr Tyr Arg Met Cys Gln Asn Cys Ile Glu Leu Asn Ala
100 105 110
Ala Thr Ile Ser Gly Phe Leu Phe Ala Glu Ile Val Ser Ile Phe Val
115 120 125
Leu Ala Val Gly Val Tyr Phe Ile Ala Gly Gln Asp Gly Val Arg Gln
130 135 140
Ser Arg Ala Ser Asp Lys Gln Thr Leu Leu Pro Asn Asp Gln Leu Tyr
145 150 155 160
Gln Pro Leu Lys Asp Arg Glu Asp Asp Gln Tyr Ser His Leu Gln Gly
165 170 175
Asn Gln Leu Arg Arg Asn
180
<210> 23
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 23
Asp Gln Leu Tyr Gln Pro Leu Lys Asp Arg Glu Asp Asp Gln Tyr Ser
1 5 10 15
His Leu Gln Gly Asn
20
<210> 24
<211> 226
<212> БЕЛОК
<213> Homo sapiens
<400> 24
Met Pro Gly Gly Pro Gly Val Leu Gln Ala Leu Pro Ala Thr Ile Phe
1 5 10 15
Leu Leu Phe Leu Leu Ser Ala Val Tyr Leu Gly Pro Gly Cys Gln Ala
20 25 30
Leu Trp Met His Lys Val Pro Ala Ser Leu Met Val Ser Leu Gly Glu
35 40 45
Asp Ala His Phe Gln Cys Pro His Asn Ser Ser Asn Asn Ala Asn Val
50 55 60
Thr Trp Trp Arg Val Leu His Gly Asn Tyr Thr Trp Pro Pro Glu Phe
65 70 75 80
Leu Gly Pro Gly Glu Asp Pro Asn Gly Thr Leu Ile Ile Gln Asn Val
85 90 95
Asn Lys Ser His Gly Gly Ile Tyr Val Cys Arg Val Gln Glu Gly Asn
100 105 110
Glu Ser Tyr Gln Gln Ser Cys Gly Thr Tyr Leu Arg Val Arg Gln Pro
115 120 125
Pro Pro Arg Pro Phe Leu Asp Met Gly Glu Gly Thr Lys Asn Arg Ile
130 135 140
Ile Thr Ala Glu Gly Ile Ile Leu Leu Phe Cys Ala Val Val Pro Gly
145 150 155 160
Thr Leu Leu Leu Phe Arg Lys Arg Trp Gln Asn Glu Lys Leu Gly Leu
165 170 175
Asp Ala Gly Asp Glu Tyr Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn
180 185 190
Leu Asp Asp Cys Ser Met Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly
195 200 205
Thr Tyr Gln Asp Val Gly Ser Leu Asn Ile Gly Asp Val Gln Leu Glu
210 215 220
Lys Pro
225
<210> 25
<211> 188
<212> БЕЛОК
<213> Homo sapiens
<400> 25
Met Pro Gly Gly Pro Gly Val Leu Gln Ala Leu Pro Ala Thr Ile Phe
1 5 10 15
Leu Leu Phe Leu Leu Ser Ala Val Tyr Leu Gly Pro Gly Cys Gln Ala
20 25 30
Leu Trp Met His Lys Val Pro Ala Ser Leu Met Val Ser Leu Gly Glu
35 40 45
Asp Ala His Phe Gln Cys Pro His Asn Ser Ser Asn Asn Ala Asn Val
50 55 60
Thr Trp Trp Arg Val Leu His Gly Asn Tyr Thr Trp Pro Pro Glu Phe
65 70 75 80
Leu Gly Pro Gly Glu Asp Pro Asn Glu Pro Pro Pro Arg Pro Phe Leu
85 90 95
Asp Met Gly Glu Gly Thr Lys Asn Arg Ile Ile Thr Ala Glu Gly Ile
100 105 110
Ile Leu Leu Phe Cys Ala Val Val Pro Gly Thr Leu Leu Leu Phe Arg
115 120 125
Lys Arg Trp Gln Asn Glu Lys Leu Gly Leu Asp Ala Gly Asp Glu Tyr
130 135 140
Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn Leu Asp Asp Cys Ser Met
145 150 155 160
Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly Thr Tyr Gln Asp Val Gly
165 170 175
Ser Leu Asn Ile Gly Asp Val Gln Leu Glu Lys Pro
180 185
<210> 26
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 26
Glu Asn Leu Tyr Glu Gly Leu Asn Leu Asp Asp Cys Ser Met Tyr Glu
1 5 10 15
Asp Ile Ser Arg Gly
20
<210> 27
<211> 113
<212> БЕЛОК
<213> Homo sapiens
<400> 27
Met Gly Gly Leu Glu Pro Cys Ser Arg Leu Leu Leu Leu Pro Leu Leu
1 5 10 15
Leu Ala Val Ser Gly Leu Arg Pro Val Gln Ala Gln Ala Gln Ser Asp
20 25 30
Cys Ser Cys Ser Thr Val Ser Pro Gly Val Leu Ala Gly Ile Val Met
35 40 45
Gly Asp Leu Val Leu Thr Val Leu Ile Ala Leu Ala Val Tyr Phe Leu
50 55 60
Gly Arg Leu Val Pro Arg Gly Arg Gly Ala Ala Glu Ala Ala Thr Arg
65 70 75 80
Lys Gln Arg Ile Thr Glu Thr Glu Ser Pro Tyr Gln Glu Leu Gln Gly
85 90 95
Gln Arg Ser Asp Val Tyr Ser Asp Leu Asn Thr Gln Arg Pro Tyr Tyr
100 105 110
Lys
<210> 28
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 28
Met Gly Gly Leu Glu Pro Cys Ser Arg Leu Leu Leu Leu Pro Leu Leu
1 5 10 15
Leu Ala Val Ser Gly Leu Arg Pro Val Gln Ala Gln Ala Gln Ser Asp
20 25 30
Cys Ser Cys Ser Thr Val Ser Pro Gly Val Leu Ala Gly Ile Val Met
35 40 45
Gly Asp Leu Val Leu Thr Val Leu Ile Ala Leu Ala Val Tyr Phe Leu
50 55 60
Gly Arg Leu Val Pro Arg Gly Arg Gly Ala Ala Glu Ala Thr Arg Lys
65 70 75 80
Gln Arg Ile Thr Glu Thr Glu Ser Pro Tyr Gln Glu Leu Gln Gly Gln
85 90 95
Arg Ser Asp Val Tyr Ser Asp Leu Asn Thr Gln
100 105
<210> 29
<211> 102
<212> БЕЛОК
<213> Homo sapiens
<400> 29
Met Gly Gly Leu Glu Pro Cys Ser Arg Leu Leu Leu Leu Pro Leu Leu
1 5 10 15
Leu Ala Val Ser Asp Cys Ser Cys Ser Thr Val Ser Pro Gly Val Leu
20 25 30
Ala Gly Ile Val Met Gly Asp Leu Val Leu Thr Val Leu Ile Ala Leu
35 40 45
Ala Val Tyr Phe Leu Gly Arg Leu Val Pro Arg Gly Arg Gly Ala Ala
50 55 60
Glu Ala Ala Thr Arg Lys Gln Arg Ile Thr Glu Thr Glu Ser Pro Tyr
65 70 75 80
Gln Glu Leu Gln Gly Gln Arg Ser Asp Val Tyr Ser Asp Leu Asn Thr
85 90 95
Gln Arg Pro Tyr Tyr Lys
100
<210> 30
<211> 101
<212> БЕЛОК
<213> Homo sapiens
<400> 30
Met Gly Gly Leu Glu Pro Cys Ser Arg Leu Leu Leu Leu Pro Leu Leu
1 5 10 15
Leu Ala Val Ser Asp Cys Ser Cys Ser Thr Val Ser Pro Gly Val Leu
20 25 30
Ala Gly Ile Val Met Gly Asp Leu Val Leu Thr Val Leu Ile Ala Leu
35 40 45
Ala Val Tyr Phe Leu Gly Arg Leu Val Pro Arg Gly Arg Gly Ala Ala
50 55 60
Glu Ala Thr Arg Lys Gln Arg Ile Thr Glu Thr Glu Ser Pro Tyr Gln
65 70 75 80
Glu Leu Gln Gly Gln Arg Ser Asp Val Tyr Ser Asp Leu Asn Thr Gln
85 90 95
Arg Pro Tyr Tyr Lys
100
<210> 31
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 31
Glu Ser Pro Tyr Gln Glu Leu Gln Gly Gln Arg Ser Asp Val Tyr Ser
1 5 10 15
Asp Leu Asn Thr Gln
20
<210> 32
<211> 86
<212> БЕЛОК
<213> Homo sapiens
<400> 32
Met Ile Pro Ala Val Val Leu Leu Leu Leu Leu Leu Val Glu Gln Ala
1 5 10 15
Ala Ala Leu Gly Glu Pro Gln Leu Cys Tyr Ile Leu Asp Ala Ile Leu
20 25 30
Phe Leu Tyr Gly Ile Val Leu Thr Leu Leu Tyr Cys Arg Leu Lys Ile
35 40 45
Gln Val Arg Lys Ala Ala Ile Thr Ser Tyr Glu Lys Ser Asp Gly Val
50 55 60
Tyr Thr Gly Leu Ser Thr Arg Asn Gln Glu Thr Tyr Glu Thr Leu Lys
65 70 75 80
His Glu Lys Pro Pro Gln
85
<210> 33
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 33
Asp Gly Val Tyr Thr Gly Leu Ser Thr Arg Asn Gln Glu Thr Tyr Glu
1 5 10 15
Thr Leu Lys His Glu
20
<210> 34
<211> 20
<212> БЕЛОК
<213> Homo sapiens
<400> 34
Arg Pro Arg Arg Ser Pro Ala Gln Asp Gly Lys Val Tyr Ile Asn Met
1 5 10 15
Pro Gly Arg Gly
20
<210> 35
<211> 68
<212> БЕЛОК
<213> Homo sapiens
<400> 35
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
20 25 30
Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
35 40 45
Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala
50 55 60
Ala Tyr Arg Ser
65
<210> 36
<211> 619
<212> БЕЛОК
<213> Homo sapiens
<400> 36
Met Pro Asp Pro Ala Ala His Leu Pro Phe Phe Tyr Gly Ser Ile Ser
1 5 10 15
Arg Ala Glu Ala Glu Glu His Leu Lys Leu Ala Gly Met Ala Asp Gly
20 25 30
Leu Phe Leu Leu Arg Gln Cys Leu Arg Ser Leu Gly Gly Tyr Val Leu
35 40 45
Ser Leu Val His Asp Val Arg Phe His His Phe Pro Ile Glu Arg Gln
50 55 60
Leu Asn Gly Thr Tyr Ala Ile Ala Gly Gly Lys Ala His Cys Gly Pro
65 70 75 80
Ala Glu Leu Cys Glu Phe Tyr Ser Arg Asp Pro Asp Gly Leu Pro Cys
85 90 95
Asn Leu Arg Lys Pro Cys Asn Arg Pro Ser Gly Leu Glu Pro Gln Pro
100 105 110
Gly Val Phe Asp Cys Leu Arg Asp Ala Met Val Arg Asp Tyr Val Arg
115 120 125
Gln Thr Trp Lys Leu Glu Gly Glu Ala Leu Glu Gln Ala Ile Ile Ser
130 135 140
Gln Ala Pro Gln Val Glu Lys Leu Ile Ala Thr Thr Ala His Glu Arg
145 150 155 160
Met Pro Trp Tyr His Ser Ser Leu Thr Arg Glu Glu Ala Glu Arg Lys
165 170 175
Leu Tyr Ser Gly Ala Gln Thr Asp Gly Lys Phe Leu Leu Arg Pro Arg
180 185 190
Lys Glu Gln Gly Thr Tyr Ala Leu Ser Leu Ile Tyr Gly Lys Thr Val
195 200 205
Tyr His Tyr Leu Ile Ser Gln Asp Lys Ala Gly Lys Tyr Cys Ile Pro
210 215 220
Glu Gly Thr Lys Phe Asp Thr Leu Trp Gln Leu Val Glu Tyr Leu Lys
225 230 235 240
Leu Lys Ala Asp Gly Leu Ile Tyr Cys Leu Lys Glu Ala Cys Pro Asn
245 250 255
Ser Ser Ala Ser Asn Ala Ser Gly Ala Ala Ala Pro Thr Leu Pro Ala
260 265 270
His Pro Ser Thr Leu Thr His Pro Gln Arg Arg Ile Asp Thr Leu Asn
275 280 285
Ser Asp Gly Tyr Thr Pro Glu Pro Ala Arg Ile Thr Ser Pro Asp Lys
290 295 300
Pro Arg Pro Met Pro Met Asp Thr Ser Val Tyr Glu Ser Pro Tyr Ser
305 310 315 320
Asp Pro Glu Glu Leu Lys Asp Lys Lys Leu Phe Leu Lys Arg Asp Asn
325 330 335
Leu Leu Ile Ala Asp Ile Glu Leu Gly Cys Gly Asn Phe Gly Ser Val
340 345 350
Arg Gln Gly Val Tyr Arg Met Arg Lys Lys Gln Ile Asp Val Ala Ile
355 360 365
Lys Val Leu Lys Gln Gly Thr Glu Lys Ala Asp Thr Glu Glu Met Met
370 375 380
Arg Glu Ala Gln Ile Met His Gln Leu Asp Asn Pro Tyr Ile Val Arg
385 390 395 400
Leu Ile Gly Val Cys Gln Ala Glu Ala Leu Met Leu Val Met Glu Met
405 410 415
Ala Gly Gly Gly Pro Leu His Lys Phe Leu Val Gly Lys Arg Glu Glu
420 425 430
Ile Pro Val Ser Asn Val Ala Glu Leu Leu His Gln Val Ser Met Gly
435 440 445
Met Lys Tyr Leu Glu Glu Lys Asn Phe Val His Arg Asp Leu Ala Ala
450 455 460
Arg Asn Val Leu Leu Val Asn Arg His Tyr Ala Lys Ile Ser Asp Phe
465 470 475 480
Gly Leu Ser Lys Ala Leu Gly Ala Asp Asp Ser Tyr Tyr Thr Ala Arg
485 490 495
Ser Ala Gly Lys Trp Pro Leu Lys Trp Tyr Ala Pro Glu Cys Ile Asn
500 505 510
Phe Arg Lys Phe Ser Ser Arg Ser Asp Val Trp Ser Tyr Gly Val Thr
515 520 525
Met Trp Glu Ala Leu Ser Tyr Gly Gln Lys Pro Tyr Lys Lys Met Lys
530 535 540
Gly Pro Glu Val Met Ala Phe Ile Glu Gln Gly Lys Arg Met Glu Cys
545 550 555 560
Pro Pro Glu Cys Pro Pro Glu Leu Tyr Ala Leu Met Ser Asp Cys Trp
565 570 575
Ile Tyr Lys Trp Glu Asp Arg Pro Asp Phe Leu Thr Val Glu Gln Arg
580 585 590
Met Arg Ala Cys Tyr Tyr Ser Leu Ala Ser Lys Val Glu Gly Pro Pro
595 600 605
Gly Ser Thr Gln Lys Ala Glu Ala Ala Cys Ala
610 615
<210> 37
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический эпитоп HA
<400> 37
Tyr Pro Tyr Asp Val Pro Asp Tyr Ala
1 5
<210> 38
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический эпитоп FLAG
<400> 38
Asp Tyr Lys Asp Asp Asp Asp Lys
1 5
<210> 39
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический эпитоп c-myc
<400> 39
Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu
1 5 10
<210> 40
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая метка аффинности His5
<400> 40
His His His His His
1 5
<210> 41
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая метка аффинности HisX6
<400> 41
His His His His His His
1 5
<210> 42
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая метка аффинности Strep
<400> 42
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 43
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая метка аффинности HisX6
<400> 43
Arg Tyr Ile Arg Ser
1 5
<210> 44
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая метка аффинности
<400> 44
Phe His His Thr
1
<210> 45
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая метка аффинности
<400> 45
Trp Glu Ala Ala Ala Arg Glu Ala Cys Cys Arg Glu Cys Cys Ala Arg
1 5 10 15
Ala
<210> 46
<211> 24
<212> БЕЛОК
<213> Homo sapiens
<400> 46
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 47
<211> 23
<212> БЕЛОК
<213> Homo sapiens
<400> 47
Leu Gly Leu Leu Val Ala Gly Val Leu Val Leu Leu Val Ser Leu Gly
1 5 10 15
Val Ala Ile His Leu Cys Cys
20
<210> 48
<211> 25
<212> БЕЛОК
<213> Homo sapiens
<400> 48
Ala Leu Ile Val Leu Gly Gly Val Ala Gly Leu Leu Leu Phe Ile Gly
1 5 10 15
Leu Gly Ile Phe Phe Cys Val Arg Cys
20 25
<210> 49
<211> 23
<212> БЕЛОК
<213> Homo sapiens
<400> 49
Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu
1 5 10 15
Thr Ala Leu Phe Leu Arg Val
20
<210> 50
<211> 27
<212> БЕЛОК
<213> Homo sapiens
<400> 50
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 51
<211> 26
<212> БЕЛОК
<213> Homo sapiens
<400> 51
Val Ala Ala Ile Leu Gly Leu Gly Leu Val Leu Gly Leu Leu Gly Pro
1 5 10 15
Leu Ala Ile Leu Leu Ala Leu Tyr Leu Leu
20 25
<210> 52
<211> 24
<212> БЕЛОК
<213> Homo sapiens
<400> 52
Ala Leu Pro Ala Ala Leu Ala Val Ile Ser Phe Leu Leu Gly Leu Gly
1 5 10 15
Leu Gly Val Ala Cys Val Leu Ala
20
<210> 53
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 1
<400> 53
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 54
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 2
<400> 54
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 55
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 3
<400> 55
Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 56
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 4
<400> 56
Gly Gly Ser Gly
1
<210> 57
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 5
<400> 57
Gly Gly Ser Gly Gly
1 5
<210> 58
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 6
<400> 58
Gly Ser Gly Ser Gly
1 5
<210> 59
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 7
<400> 59
Gly Ser Gly Gly Gly
1 5
<210> 60
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 8
<400> 60
Gly Gly Gly Ser Gly
1 5
<210> 61
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 9
<400> 61
Gly Ser Ser Ser Gly
1 5
<210> 62
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 1
<400> 62
Cys Pro Pro Cys
1
<210> 63
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 2
<400> 63
Asp Lys Thr His Thr
1 5
<210> 64
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 3
<400> 64
Cys Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg
1 5 10 15
<210> 65
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 4
<400> 65
Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr
1 5 10
<210> 66
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 5
<400> 66
Lys Ser Cys Asp Lys Thr His Thr Cys Pro
1 5 10
<210> 67
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 6
<400> 67
Lys Cys Cys Val Asp Cys Pro
1 5
<210> 68
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 7
<400> 68
Lys Tyr Gly Pro Pro Cys Pro
1 5
<210> 69
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 8
<400> 69
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 70
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 9
<400> 70
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro
1 5 10
<210> 71
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 10
<400> 71
Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr Cys Pro Arg Cys
1 5 10 15
Pro
<210> 72
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 11
<400> 72
Ser Pro Asn Met Val Pro His Ala His His Ala Gln
1 5 10
<210> 73
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический шарнир 12
<400> 73
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 74
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<400> 74
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 75
<211> 69
<212> БЕЛОК
<213> Homo sapiens
<400> 75
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Leu Tyr Cys
65
<210> 76
<211> 66
<212> БЕЛОК
<213> Homo sapiens
<400> 76
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly Gly
35 40 45
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
50 55 60
Trp Val
65
<210> 77
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический сигнал расщепления 2A-1
<400> 77
Gly Ser Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
1 5 10 15
Glu Asn Pro Gly Pro
20
<210> 78
<211> 357
<212> БЕЛОК
<213> Homo sapiens
<400> 78
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala
325 330 335
Thr Gly Met Val Gly Ala Leu Leu Leu Leu Leu Val Val Ala Leu Gly
340 345 350
Ile Gly Leu Phe Met
355
<210> 79
<211> 45
<212> БЕЛОК
<213> Homo sapiens
<400> 79
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 80
<211> 39
<212> БЕЛОК
<213> Homo sapiens
<400> 80
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro
35
<210> 81
<211> 113
<212> БЕЛОК
<213> Homo sapiens
<400> 81
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
50 55 60
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
65 70 75 80
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
85 90 95
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
100 105 110
Arg
<210> 82
<211> 463
<212> БЕЛОК
<213> Homo sapiens
<400> 82
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp
20 25 30
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val
35 40 45
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val
50 55 60
Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val
65 70 75 80
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
85 90 95
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly
100 105 110
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys
115 120 125
Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn
130 135 140
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val
145 150 155 160
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn
165 170 175
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln
180 185 190
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile
195 200 205
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr
210 215 220
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro
225 230 235 240
Ile Leu Leu Pro Pro Cys Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser
245 250 255
Val Ala Leu Leu Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile
260 265 270
Lys Pro Ile Val Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu
275 280 285
His Leu Cys Lys Lys Pro Arg Lys Asn Leu Asn Val Ser Phe Asn Pro
290 295 300
Glu Ser Phe Leu Asp Cys Gln Ile His Arg Val Asp Asp Ile Gln Ala
305 310 315 320
Arg Asp Glu Val Glu Gly Phe Leu Gln Asp Thr Phe Pro Gln Gln Leu
325 330 335
Glu Glu Ser Glu Lys Gln Arg Leu Gly Gly Asp Val Gln Ser Pro Asn
340 345 350
Cys Pro Ser Glu Asp Val Val Val Thr Pro Glu Ser Phe Gly Arg Asp
355 360 365
Ser Ser Leu Thr Cys Leu Ala Gly Asn Val Ser Ala Cys Asp Ala Pro
370 375 380
Ile Leu Ser Ser Ser Arg Ser Leu Asp Cys Arg Glu Ser Gly Lys Asn
385 390 395 400
Gly Pro His Val Tyr Gln Asp Leu Leu Leu Ser Leu Gly Thr Thr Asn
405 410 415
Ser Thr Leu Pro Pro Pro Phe Ser Leu Gln Ser Gly Ile Leu Thr Leu
420 425 430
Asn Pro Val Ala Gln Gly Gln Pro Ile Leu Thr Ser Leu Gly Ser Asn
435 440 445
Gln Glu Glu Ala Tyr Val Thr Met Ser Ser Phe Tyr Gln Asn Gln
450 455 460
<210> 83
<211> 13673
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический индуцируемый Dox-рапамицином лентивирусный геном
с рибопереключателем
<400> 83
gatatctata acaagaaaat atatatataa taagttatca cgtaagtaga acatgaaata 60
acaatataat tatcgtatga gttaaatctt aaaagtcacg taaaagataa tcatgcgtca 120
ttttgactca cgcggtcgtt atagttcaaa atcagtgaca cttaccgcat tgacaagcac 180
gcctcacggg agctccaagc ggcgactgag atgtcctaaa tgcacagcga cggattcgcg 240
ctatttagaa agagagagca atatttcaag aatgcatgcg tcaattttac gcagactatc 300
tttctagggt taagacggat cgggagatct cccgatcccc tatggtgcac tctcagtaca 360
atctgctctg atgccgcata gttaagccag tatctgctcc ctgcttgtgt gttggaggtc 420
gctgagtagt gcgcgagcaa aatttaagct acaacaaggc aaggcttgac cgacaattgc 480
atgaagaatc tgcttagggt taggcgtttt gcgctgcttc gcgatgtacg ggccagatat 540
acgcgttgac attgattatt gactagttat taatagtaat caattacggg gtcattagtt 600
catagcccat atatggagtt ccgcgttaca taacttacgg taaatggccc gcctggctga 660
ccgcccaacg acccccgccc attgacgtca ataatgacgt atgttcccat agtaacgcca 720
atagggactt tccattgacg tcaatgggtg gagtatttac ggtaaactgc ccacttggca 780
gtacatcaag tgtatcatat gccaagtacg ccccctattg acgtcaatga cggtaaatgg 840
cccgcctggc attatgccca gtacatgacc ttatgggact ttcctacttg gcagtacatc 900
tacgtattag tcatcgctat taccatggtg atgcggtttt ggcagtacat caatgggcgt 960
ggatagcggt ttgactcacg gggatttcca agtctccacc ccattgacgt caatgggagt 1020
ttgttttgga accaaaatca acgggacttt ccaaaatgtc gtaacaactc cgccccattg 1080
acgcaaatgg gcggtaggcg tgtacggtgg gaggtctata taagcagagc tctccctatc 1140
agtgatagag atctccctat cagtgataga gatcgtcgac gagctcgttt agtgaaccgt 1200
cagatcgcct ggagacgccc tcgaagccgc ggtgcgggtg ccagggcgtg ccctgggtct 1260
ctctggttag accagatctg agcctgggag ctctctggct aactagggaa cccactgctt 1320
aagcctcaat aaagcttgcc ttgagtgctt caagtagtgt gtgcccgtct gttgtgtgac 1380
tctggtaact agagatccct cagacccttt tagtcagtgt ggaaaatctc tagcagtggc 1440
gcccgaacag ggacttgaaa gcgaaaggga aaccagagga gctctctcga cgcaggactc 1500
ggcttgctga agcgcgcacg gcaagaggcg aggggcggcg actggtgagt acgccaaaaa 1560
ttttgactag cggaggctag aaggagagag atgggtgcga gagcgtcagt attaagcggg 1620
ggagaattag atcgcgatgg gaaaaaattc ggttaaggcc agggggaaag aaaaaatata 1680
aattaaaaca tatagtatgg gcaagcaggg agctagaacg attcgcagtt aatcctggcc 1740
tgttagaaac atcagaaggc tgtagacaaa tactgggaca gctacaacca tcccttcaga 1800
caggatcaga agaacttaga tcattatata atacagtagc aaccctctat tgtgtgcatc 1860
aaaggataga gataaaagac accaaggaag ctttagacaa gatagaggaa gagcaaaaca 1920
aaagtaagac caccgcacag caagcggccg ctgatcttca gacctggagg aggagatatg 1980
agggacaatt ggagaagtga attatataaa tataaagtag taaaaattga accattagga 2040
gtagcaccca ccaaggcaaa gagaagagtg gtgcagagag aaaaaagagc agtgggaata 2100
ggagctttgt tccttgggtt cttgggagca gcaggaagca ctatgggcgc agcgtcaatg 2160
acgctgacgg tacaggccag acaattattg tctggtatag tgcagcagca gaacaatttg 2220
ctgagggcta ttgaggcgca acagcatctg ttgcaactca cagtctgggg catcaagcag 2280
ctccaggcaa gaatcctggc tgtggaaaga tacctaaagg atcaacagct cctggggatt 2340
tggggttgct ctggaaaact catttgcacc actgctgtgc cttggaatgc tagttggagt 2400
aataaatctc tggaacagat ttggaatcac acgacctgga tggagtggga cagagaaatt 2460
aacaattaca caagcttaat acactcctta attgaagaat cgcaaaacca gcaagaaaag 2520
aatgaacaag aattattgga attagataaa tgggcaagtt tgtggaattg gtttaacata 2580
acaaattggc tgtggtatat aaaattattc ataatgatag taggaggctt ggtaggttta 2640
agaatagttt ttgctgtact ttctatagtg aatagagtta ggcagggata ttcaccatta 2700
tcgtttcaga cccacctccc aaccccgagg ggacccgaca ggcccgaagg aatagaagaa 2760
gaaggtggag agagagacag agacagatcc attcgattag tgaacggatc tcgacggtat 2820
cgattagact gtagcccagg aatatggcag ctagattgta cacatttaga aggaaaagtt 2880
atcttggtag cagttcatgt agccagtgga tatatagaag cagaagtaat tccagcagag 2940
acagggcaag aaacagcata cttcctctta aaattagcag gaagatggcc agtaaaaaca 3000
gtacatacag acaatggcag caatttcacc agtactacag ttaaggccgc ctgttggtgg 3060
gcggggatca agcaggaatt tggcattccc tacaatcccc aaagtcaagg agtaatagaa 3120
tctatgaata aagaattaaa gaaaattata ggacaggtaa gagatcaggc tgaacatctt 3180
aagacagcag tacaaatggc agtattcatc cacaatttta aaagaaaagg ggggattggg 3240
gggtacagtg caggggaaag aatagtagac ataatagcaa cagacataca aactaaagaa 3300
ttacaaaaac aaattacaaa aattcaaaat tttcgggttt attacaggga cagcagagat 3360
ccagtttggc tgcattgatc acgtgagggg ctctagactc tagacacaca aaaaaccaac 3420
acacagatct aatgaaaata aagatctttt attgagaaac ttatacaggg tagcataatg 3480
ggctactgac cccgccttca aacctatttg gagactataa gtgaaaatta tcactggttt 3540
tggtagaagc tggacatggt gacatatgct tcttcttgat ttgatcccag ggaagtaaga 3600
atgggctgac cctgagcaac tgggttcaat gtcaggattc cagattggag agaaaatgga 3660
gggggcagcg tgctgtttgt agtcccaagg ctaagcagga ggtcctggta cacatgaggc 3720
ccattcttgc cactctccct gcagtctagg gacctggaag aggagagaat aggggcgtca 3780
catgcactga cattcccagc caggcatgtg agggatgaat ctcttccaaa gctttctgga 3840
gtgacgacta catcctcaga tgggcagttg gggctctgca catcccctcc aagcctctgc 3900
ttctcagatt cttctagttg ctgaggaaac gtatcttgca gaaaaccttc cacttcatct 3960
ctagcttgaa tgtcatccac cctatgaatc tggcagtcca ggaaactttc aggattgaaa 4020
ctcacattta aattttttct tggtttctta caaagatgtt ccagagtctt cttatgatcg 4080
gggagactgg gccatacgat aggcttaatc ctttttttcc ataacacaca ggccaagatg 4140
accaacagag cgacagagaa aaaactcaaa atgctgatgg tcaggcatgg tggtagtaag 4200
ataggatcca tctcccctga gctattattg atctctggag ttctgaagta ataacttgga 4260
ctccattcac tccagaagcc tttaaaatag tgatcaggga tggatcgaac tttaatctca 4320
tacattgctg ccggttggag ctttctctgc aggagtgtca gctttgtgct ggataaattc 4380
acatgcgtcc atttgttttc atccttttcc tggcggtaag ctacatcatg cattaaaact 4440
tttacatact tcttttgcaa gtgtgatgta ttaaatgtca ccacaaagtc attggctcct 4500
tcccgataga tgacactcag gtcaaaagga gcctcaggtt taactatagt ggttaggtct 4560
atttttttgc aggttagact cttttctcca accttcacac atatattgct ctttccaatc 4620
agtaagaatt tctttgtctc gatgaaatat atctcttgta gtttcctgaa attcaggcac 4680
tttacctcca cgagggcccc acatatttca aattccagat tggtggtgtt gacatctggg 4740
tcctcaaaag cacatgtcag tgaatgctgc gatccattca cttccaactg gctatagcat 4800
gagaatgagt agtcatccag ttctgcatct tccaagtctc cattttgagc atagccactt 4860
tctccagaaa cgacttgaag taaagaaaaa accatgccaa aagttgtacc tagaattgtc 4920
attgggccgg gattttcctc cacgtccccg catgttagta gacttcccct gccctcgccg 4980
gagcgagggg gcagggcctg catgtgaagg gcgtcgtagg tgtccttggt ggctgtactg 5040
agaccctggt aaaggccatc gtgccccttg cccctccggc gctcgccttt catcccaatc 5100
tcactgtagg cctccgccat cttatctttc tgcagttcat tgtacaggcc ttcctgaggg 5160
ttcttccttc tcggctttcc ccccatctca gggtcccggc cacgtctctt gtccaaaaca 5220
tcgtactcct ctcttcgtcc tagattgagc tcgttataga gctggttctg gccctgcttg 5280
tacgcggggg cgtctgcgct cctgctgaac ttcactctca gttcacatcc tccttcttct 5340
tcttctggaa atcggcagct acagccatct tcctcttgag tagtttgtac tggtctcata 5400
aatggttgtt tgaatatata caggagtttc tttctgcccc gtttgcagta aagggtgata 5460
accagtgaca ggagaaggac cccacaagtc ccggccaagg gcgcccagat gtagatatca 5520
caggcgaagt ccagccccct cgtgtgcact gcgccccccg ccgctggccg gcacgcctct 5580
gggcgcaggg acaggggctg cgacgcgatg gtgggcgccg gtgttggtgg tcgcggcgct 5640
ggcgtcgtgg ttgaggagac ggtgactgag gttccttggc cccagtagtc catagcatag 5700
ctaccaccgt agtaataatg tttggcacag tagtaaatgg ctgtgtcatc agtttgcaga 5760
ctgttcattt ttaagaaaac ttggctcttg gagttgtcct tgatgatggt cagtctggat 5820
ttgagagctg aattatagta tgtggtttca ctaccccata ttactcccag ccactccaga 5880
ccctttcgtg gaggctggcg aatccagctt acaccatagt cgggtaatga gacccctgag 5940
acagtgcatg tgacggacag gctctgtgag ggcgccacca ggccaggtcc tgactcctgc 6000
agtttcacct cagatccgcc gccacccgac ccaccaccgc ccgagccacc gccacctgtg 6060
atctccagct tggtcccccc tccgaacgtg tacggaagcg tattaccctg ttggcgaagt 6120
aggtggcaat atcttcttgc tccaggttgc taattgtcag agaataatct gttccagacc 6180
cactgccact gaaccttgat gggactcctg agtgtaatct tgatgtatgg tagatcagga 6240
gtttaacagt tccatctggt ttctgctgat accaatttaa atatttacta atgtcctgac 6300
ttgccctgca actgatggtg actctgtctc ccagagaggc agacagggag gatgtagtct 6360
gtgtcatctg gatgtccggc ctggcggcgt ggagcagcaa ggccagcggc aggagcaagg 6420
cggtcactgg taaggccatg gatcctctag atcacgacac ctgaaatgga agaaaaaaac 6480
tttgaaccac tgtctgaggc ttgagaatga accaagatcc aaactcaaaa agggcaaatt 6540
ccaaggagaa ttacatcaag tgccaagctg gcctaacttc agtctccacc cactcagtgt 6600
ggggaaactc catcgcataa aacccctccc cccaacctaa agacgacgta ctccaaaagc 6660
tcgagaacta atcgaggtgc ctggacggcg cccggtactc agtggagtca catgaagcga 6720
cggctgagga cggaaaggcc cttttccttt gtgtgggaga aacttataca gggtagcata 6780
atgggctact gaccccgcct tcaaacctat ttggagacta taagtgaaaa tgactcaccc 6840
gcccgctctc ccggcacctt catcttgtcc tttccctcag aaagaggctg ggaggcagag 6900
gctgaggcag cggtggccgg gacggttagg agaaaaggag tctctgctgg ttttattctg 6960
cagctacctc cccaggaagt ggaggactgt ggggcctttg agaagcacct gccgacaggg 7020
ccaagaaatt cgcactcccc ctttcggttc acaggcagga agccctggag gtttgagggt 7080
ttggggtgtg tgtatgtatc tgtctgtctg aattttgctt tttctctcat ttgaccattg 7140
ttttaatgct ccttttttta aaaaaaataa ttcttatcta attcctatct tgattggtaa 7200
agtccatctc taggcaaata caagttctcg atggaaaaca ataagtaatg taaaatacag 7260
catagcaaaa ctttaacctc caaatcaagc ctctacttga atccttttct gagggatgaa 7320
taaggcatag gcatcagggg ctgttgccaa tgtgcattag ctgtttgcag cctcaccttc 7380
tttcatggag tttaagatat agtgtatttt cccaaggttt gaactagctc ttcatttctt 7440
tatgttttaa atgcactgac ctcccacatt ccctttttag taaaatattc agaaataatt 7500
taaatacatc attgcaatga aaataaatgt tttttattag gcagaatcca gatgctcaag 7560
gcccttcata atatccccca gtttagtagt tggacttagg gaacaaagga acctttaata 7620
gaaattggac agcaagaaag cgagcttagt gatacttgtg atcctctaga tcacgacacc 7680
tgaaatggaa gaaaaaaact gcaccttcat cttgtccttt ccctcagaaa gaggctggga 7740
ggcagaggct gaggcagcgg tggccgggac ggttaggaga aaaggagtct ctgctggttt 7800
tattctgcag ctacctcccc aggaagtgga ggactgtggg gcctttgaga agcacctgcc 7860
gacagggcca agaaattcgc actccccctt tcggttcaca ggcaggaagc cctggaggtt 7920
tgagggtttg gggtgtgtgt atgtatctgt ctgtctgaat tttgcttttt ctctcatttg 7980
accattgttt taatgctcct ttttttaaaa aaaataattc ttatctaatt cctatcttga 8040
ttggtaaagt ccatctctag gcaaatacaa gttctcgatg gaaaacaata agtaatgtaa 8100
aatacagcat agcaaaactt taacctccaa atcaagcctc tacttgaatc cttttctgag 8160
ggatgaataa ggcataggca tcaggggctg ttgccaatgt gcattagctg tttgcagcct 8220
caccttcttt catggagttt aagatatagt gtattttccc aaggtttgaa ctagctcttc 8280
atttctttat gttttaaatg cactgacctc ccacattccc tttttagtaa aatattcaga 8340
aataatttaa atacatcatt gcaatgaaaa taaatgtttt ttattaggca gaatccagat 8400
gctcaaggcc cttcataata tcccccagtt tagtagttgg acttagggaa caaaggaacc 8460
tttaatagaa attggacagc aagaaagcga gcttagtgat acttgtaaaa agagacgcgt 8520
ctctaaaagt cctttccatg gctgctcgcc tgtgttgcca cctggattct gcgcgggacg 8580
tccttctgct acgtcccttc ggccctcaat ccagcggacc ttccttcccg cggcctgctg 8640
ccggctctgc ggcctcttcc gcgtcttcgc cttcgccctc agacgagtcg gatctccctt 8700
tgggccgcct ccccgcctgg aattcgagct cggtaccttt aagaccaatg acttacaagg 8760
cagctgtaga tcttagccac tttttaaaag aaaagggggg actggaaggg ctaattcact 8820
cccaacgaag acaagatctg ctttttgctt gtactgggtc tctctggtta gaccagatct 8880
gagcctggga gctctctggc taactaggga acccactgct taagcctcaa taaagcttgc 8940
cttgagtgct tcaagtagtg tgtgcccgtc tgttgtgtga ctctggtaac tagagatccc 9000
tcagaccctt ttagtcagtg tggaaaatct ctagcagtag tagttcatgt catcttatta 9060
ttcagtattt ataacttgca aagaaatgaa tatcagagag tgagaggaac ttgtttattg 9120
cagcttataa tggttacaaa taaagcaata gcatcacaaa tttcacaaat aaagcatttt 9180
tttcactgca ttctagttgt ggtttgtcca aactcatcaa tgtatcttat catgtctggc 9240
tctagctatc ccgcccctaa ctccgcccat cccgccccta actccgccca gttccgccca 9300
ttctccgccc catggctgac taattttttt tatttatgca gaggccgagg ccgcctcggc 9360
ctctgagcta ttccagaagt agtgaggagg cttttttgga ggcctaggga cgtatggcca 9420
caacctgggc tccccgggcg cgtactccac ctcacccatc atccacgctg ttttatgagt 9480
aaaggagaag aacttttcac tggagttgtc ccaattcttg ttgaattaga tggtgatgtt 9540
aatgggcaca aattttctgt cagtggagag ggtgaaggtg atgcaacata cggaaaactt 9600
acccttaaat ttatttgcac tactggaaaa ctacctgttc catggccaac acttgtcact 9660
actttctctt atggtgttca atgcttttca agatacccag atcatatgaa acggcatgac 9720
tttttcaaga gtgccatgcc cgaaggttat gtacaggaaa gaactatatt tttcaaagat 9780
gacgggaact acaagacacg tgctgaagtc aagtttgaag gtgataccct tgttaataga 9840
atcgagttaa aaggtattga ttttaaagaa gatggaaaca ttcttggaca caaattggaa 9900
tacaactata actcacacaa tgtatacatc atggcagaca aacaaaagaa tggaatcaaa 9960
gttaacttca aaattagaca caacattgaa gatggaagcg ttcaactagc agaccattat 10020
caacaaaata ctccaattgg cgatggccct gtccttttac cagacaacca ttacctgtcc 10080
acacaatctg ccctttcgaa agatcccaac gaaaagagag accacatggt ccttcttgag 10140
tttgtaacag ctgctgggat tacacatggc atggatgaac tatacaaata ggacctccat 10200
agaagacacc gggaccgatc caataacttc gtatagcata cattatacga agttatgcct 10260
ccggactcta gcgtttaaac ttaagcttgg gaagttccta ttccgaagtt cctattctct 10320
agaaagtata ggaacttcta ccgagctcgg atccactagt ccagtgtggt ggaattctgc 10380
agatatccag cacagtggcg gccgctcgag tctagagggc ccgtttaaac ccgctgatca 10440
gcctcgactg tgccttctag ttgccagcca tctgttgttt gcccctcccc cgtgccttcc 10500
ttgaccctgg aaggtgccac tcccactgtc ctttcctaat aaaatgagga aattgcatcg 10560
cattgtctga gtaggtgtca ttctattctg gggggtgggg tggggcagga cagcaagggg 10620
gaggattggg aagacaatag caggcatgct ggggatgcgg tgggctctat ggcttctgag 10680
gcggaaagtt aaccctagaa agataatcat attgtgacgt acgttaaaga taatcatgcg 10740
taaaattgac gcatgtgttt tatcggtctg tatatcgagg tttatttatt aatttgaata 10800
gatattaagt tttattatat ttacacttac atactaataa taaattcaac aaacaattta 10860
tttatgttta tttatttatt aaaaaaaaac aaaaactcaa aatttcttct ataaagtaac 10920
aaaaaccagc tggggctcga agttcctata ctttctagag aataggaact tctatagtga 10980
gtcgaataag ggcgacacaa aatttattct aaatgcataa taaatactga taacatctta 11040
tagtttgtat tatattttgt attatcgttg acatgtataa ttttgatatc aaaaactgat 11100
tttcccttta ttattttcga gatttatttt cttaattctc tttaacaaac tagaaatatt 11160
gtatatacaa aaaatcataa ataatagatg aatagtttaa ttataggtgt tcatcaatcg 11220
aaaaagcaac gtatcttatt taaagtgcgt tgcttttttc tcatttataa ggttaaataa 11280
ttctcatata tcaagcaaag tgacaggcgc ccttaaatat tctgacaaat gctctttccc 11340
taaactcccc ccataaaaaa acccgccgaa gcgggttttt acgttatttg cggattaacg 11400
attactcgtt atcagaaccg cccagggggc ccgagcttaa gactggccgt cgttttacaa 11460
cacagaaaga gtttgtagaa acgcaaaaag gccatccgtc aggggccttc tgcttagttt 11520
gatgcctggc agttccctac tctcgccttc cgcttcctcg ctcactgact cgctgcgctc 11580
ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac 11640
agaatcaggg gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa 11700
ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca 11760
caaaaatcga cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc 11820
gtttccccct ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata 11880
cctgtccgcc tttctccctt cgggaagcgt ggcgctttct catagctcac gctgtaggta 11940
tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca 12000
gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga 12060
cttatcgcca ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg 12120
tgctacagag ttcttgaagt ggtgggctaa ctacggctac actagaagaa cagtatttgg 12180
tatctgcgct ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg 12240
caaacaaacc accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag 12300
aaaaaaagga tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa 12360
cgacgcgcgc gtaactcacg ttaagggatt ttggtcatga gcttgcgccg tcccgtcaag 12420
tcagcgtaat gctctgcttt tagaaaaact catcgagcat caaatgaaac tgcaatttat 12480
tcatatcagg attatcaata ccatattttt gaaaaagccg tttctgtaat gaaggagaaa 12540
actcaccgag gcagttccat aggatggcaa gatcctggta tcggtctgcg attccgactc 12600
gtccaacatc aatacaacct attaatttcc cctcgtcaaa aataaggtta tcaagtgaga 12660
aatcaccatg agtgacgact gaatccggtg agaatggcaa aagtttatgc atttctttcc 12720
agacttgttc aacaggccag ccattacgct cgtcatcaaa atcactcgca tcaaccaaac 12780
cgttattcat tcgtgattgc gcctgagcga ggcgaaatac gcgatcgctg ttaaaaggac 12840
aattacaaac aggaatcgag tgcaaccggc gcaggaacac tgccagcgca tcaacaatat 12900
tttcacctga atcaggatat tcttctaata cctggaacgc tgtttttccg gggatcgcag 12960
tggtgagtaa ccatgcatca tcaggagtac ggataaaatg cttgatggtc ggaagtggca 13020
taaattccgt cagccagttt agtctgacca tctcatctgt aacatcattg gcaacgctac 13080
ctttgccatg tttcagaaac aactctggcg catcgggctt cccatacaag cgatagattg 13140
tcgcacctga ttgcccgaca ttatcgcgag cccatttata cccatataaa tcagcatcca 13200
tgttggaatt taatcgcggc ctcgacgttt cccgttgaat atggctcata ttcttccttt 13260
ttcaatatta ttgaagcatt tatcagggtt attgtctcat gagcggatac atatttgaat 13320
gtatttagaa aaataaacaa ataggggtca gtgttacaac caattaacca attctgaaca 13380
ttatcgcgag cccatttata cctgaatatg gctcataaca ccccttgttt gcctggcggc 13440
agtagcgcgg tggtcccacc tgaccccatg ccgaactcag aagtgaaacg ccgtagcgcc 13500
gatggtagtg tggggactcc ccatgcgaga gtagggaact gccaggcatc aaataaaacg 13560
aaaggctcag tcgaaagact gggcctttcg cccgggctaa ttagggggtg tcgcccttat 13620
tcgactctat agtgaagttc ctattctcta gaaagtatag gaacttctga agt 13673
<210> 84
<211> 15025
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический индуцируемый Dox-рапамицином GAG POL ENV
<400> 84
gatatctata acaagaaaat atatatataa taagttatca cgtaagtaga acatgaaata 60
acaatataat tatcgtatga gttaaatctt aaaagtcacg taaaagataa tcatgcgtca 120
ttttgactca cgcggtcgtt atagttcaaa atcagtgaca cttaccgcat tgacaagcac 180
gcctcacggg agctccaagc ggcgactgag atgtcctaaa tgcacagcga cggattcgcg 240
ctatttagaa agagagagca atatttcaag aatgcatgcg tcaattttac gcagactatc 300
tttctagggt taagacggat cgggagatct cccgatcccc tatggtgcac tctcagtaca 360
atctgctctg atgccgcata gttaagccag tatctgctcc ctgcttgtgt gttggaggtc 420
gctgagtagt gcgcgagcaa aatttaagct acaacaaggc aaggcttgac cgacaattgc 480
atgaagaatc tgcttagggt taggcgtttt gaagttccta tactttctag agaataggaa 540
cttcggaata ggaacttcgg atgcaatttc ctcattttat taggaaagga cagtgggagt 600
ggcaccttcc agggtcaagg aaggcacggg ggaggggcaa acaacagatg gctggcaact 660
agaaggcaca gcgttagtga tacttgtggg ccagggcatt agccacacca gccaccactt 720
tctgataggc agcctgcact ggtggggtga attccgcgga agcttgtgta attgttaatt 780
tctctgtccc actccatcca ggtcgtgtga ttccaaatct gttccagaga tttattactc 840
caactagcat tccaaggcac agcagtggtg caaatgagtt ttccagagca accccaaatc 900
cccaggagct gttgatcctt taggtatctt tccacagcca ggattcttgc ctggagctgc 960
ttgatgcccc agactgtgag ttgcaacaga tgctgttgcg cctcaatagc cctcagcaaa 1020
ttgttctgct gctgcactat accagacaat aattgtctgg cctgtaccgt cagcgtcatt 1080
gacgctgcgc ccatagtgct tcctgctgct cccaagaacc caaggaacaa agctcctgcg 1140
gccgctccgg aattccatgt gttaatcctc atcctgtcta cttgccacac aatcatcacc 1200
tgccatctgt tttccataat ccctgatgat ctttgctttt cttcttggca ctacttttat 1260
gtcactatta tcttgtatta ctactgcccc ttcacctttc cagaggagct ttgctggtcc 1320
tttccaaact ggatctctgc tgtccctgta ataaacccga aaattttgaa tttttgtaat 1380
ttgtttttgt aattctttag tttgtatgtc tgttgctatt atgtctacta ttctttcccc 1440
tgcactgtac cccccaatcc ccccttttct tttaaaattg tggatgaata ctgccatttg 1500
tactgctgtc ttaagatgtt cagcctgatc tcttacctgt cctataattt tctttaattc 1560
tttattcata gattctatta ctccttgact ttggggattg tagggaatgc caaattcctg 1620
cttgatcccc gcccaccaac aggcggcctt aactgtagta ctggtgaaat tgctgccatt 1680
gtctgtatgt actgttttta ctggccatct tcctgctaat tttaagagga agtatgctgt 1740
ttcttgccct gtctctgctg gaattacttc tgcttctata tatccactgg ctacatgaac 1800
tgctaccaag ataacttttc cttctaaatg tgtacaatct agctgccata ttcctgggct 1860
acagtctact tgtccatgca tggcttcccc ttttagctga catttatcac agctggctac 1920
tatttctttt gctactacag gtggtaggtt aaaatcacta gccattgctc tccaattact 1980
gtgatatttc tcatgttctt cttgggcctt atctattcca tctaaaaata gtactttcct 2040
gattccagca ctgaccaatt tatctacttg ttcatttcct ccaattcctt tgtgtgctgg 2100
tacccatgcc aggtagactt tttccttttt tattaactgc tctattattt gactgactaa 2160
ctctgattca ctcttatctg gttgtgcttg aatgattccc aatgcatatt gtgagtctgt 2220
cactatgttt acttctaatc ccgaatcctg caaagctaga tgaattgctt gtaactcagt 2280
cttctgattt gttgtgtccg ttagggggac aactttttgt cttcctctgt cagttacata 2340
tcctgctttt cctaatttag tttccctatt ggctgcccca tctacataga aagtttctgc 2400
tcctattatg ggttctttct ctaactggta ccataacttc actaagggag gggtattgac 2460
aaactcccac tcaggaatcc aggtggcttg ccaatactct gtccaccatg cttcccatgt 2520
ttccttttgt atgggtaatt taaatttagg agtctttccc catattacta tgctttctgt 2580
ggctattttt tgtactgcct ctgttaattg tttcacatca ttagtgtggg cacccttcat 2640
tcttgcatac tttcctgttt tcagattttt aaatggctct tgataaattt gatatgtcca 2700
ttggccttgc ccctgcttct gtatttctgc tattaagtct tttgatgggt cataatacac 2760
tccatgtacc ggttctttta gaatctccct gttttctgcc agttctagct ctgcttcttc 2820
tgttagtggt actacttctg ttagtgcttt ggttccccta agaagtttac ataattgcct 2880
tactttaatc cctgcataaa tctgacttgc ccaattcaat tttcccacta atttctgtat 2940
gtcattgaca gtccagctgt ccttttctgg cagcactata ggctgtactg tccatttatc 3000
aggatggagt tcataaccca tccaaaggaa tggaggttct ttctgatgtt ttttgtctgg 3060
tgtggtaaat ccccacctca acagatgttg tctcagttcc tctatttttg ttctatgctg 3120
ccctatttct aagtcagatc ctacatacaa atcatccatg tattgataga tgactatgtc 3180
tggattttgt tttctaaaag gctctaagat ttttgtcatg ctacactgga atattgctgg 3240
tgatcctttc catccctgtg gaagcacatt gtactgatat ctaatccctg gtgtctcatt 3300
gtttatacta ggtatggtaa atgcagtata cttcctgaag tctttatcta agggaactga 3360
aaaatatgca tcgcccacat ccagtactgt tactgatttt ttctgtttta accctgcagg 3420
atgtggtatt cctaattgaa cttcccagaa atcttgagtt ctcttattaa gttctctgaa 3480
atctactaat tttctccatt tagtactgtc ttttttcttt atggcaaata ctggagtatt 3540
gtatggattt tcaggcccaa tttttgaaat ttttccttcc ttttccattt ctgtacaaat 3600
ttctactaat gcttttattt tttcttctgt caatggccat tgtttaactt ttgggccatc 3660
cattcctggc tttaatttta ctggtacagt ctcaatagga ctaatgggaa aatttaaagt 3720
gcagccaatc tgagtcaaca gatttcttcc aattatgttg acaggtgtag gtcctactaa 3780
tactgtacct atagctttat gtccgcagat ttctatgagt atctgatcat actgtcttac 3840
tttgataaaa cctccaattc cccctatcat ttttggtttc catcttcctg gcaaattcat 3900
ttcttctaat actgtatcat ctgctcctgt atctaataga gcttccttta attgcccccc 3960
tatctttatt gtgacgaggg gtcgctgcca aagagtgatc tgagggaagc taaaggatac 4020
agttccttgt ctatcggctc ctgcttctga gagggagttg ttgtctcttc cccaaacctg 4080
aagctctctt ctggtggggc tgttggctct ggtctgctct gaagaaaatt ccctggcctt 4140
cccttgtggg aaggccagat cttccctaaa aaattagcct gtctctcagt acaatctttc 4200
atttggtgtc cttcctttcc acatttccaa cagccctttt tcctaggggc cctgcaattt 4260
ttggctatgt gcccttcttt gccacaattg aaacacttaa cagtctttct ttggttccta 4320
aaattgcctt tctgtatcat tatggtagct ggatttgtta cttggctcat tgcttcagcc 4380
aaaactcttg ctttatggcc gggtcccccc actccctgac atgctgtcat catttcttct 4440
agtgtcgctc ctggtcccaa tgcttttaaa atagtcttac aatctgggtt cgcattttgg 4500
accaacaagg tttctgtcat ccaatttttt acctcttgtg aagcttgctc ggctcttaga 4560
gttttataga atcggtctac atagtctcta aagggttcct ttggtccttg tcttatgtcc 4620
agaatgctgg tagggctata cattcttact attttattta atcccaggat tatccatctt 4680
ttatagattt ctcctactgg gataggtgga ttatgtgtca tccatcctat ttgttcctga 4740
agggtactag tagttcctgc tatgtcactt ccccttggtt ctctcatctg gcctggtgca 4800
ataggccctg catgcactgg atgcactcta tcccattctg cagcttcctc attgatggtc 4860
tcttttaaca tttgcatggc tgcttgatgt ccccccactg tgtttagcat ggtgtttaaa 4920
tcttgtgggg tggctccttc tgataatgct gaaaacatgg gtatcacttc tgggctgaaa 4980
gccttctctt ctactacttt tacccatgca tttaaagttc taggtgatat ggcctgatgt 5040
accatttgcc cctggatgtt ctgcactata gggtaatttt ggctgacctg attgctgtgt 5100
cctgtgtcag ctgctgcttg ctgtgctttt ttcttacttt tgttttgctc ttcctctatc 5160
ttgtctaaag cttccttggt gtcttttatc tctatccttt gatgcacaca atagagggtt 5220
gctactgtat tatataatga tctaagttct tctgatcctg tctgaaggga tggttgtagc 5280
tgtcccagta tttgtctaca gccttctgat gtttctaaca ggccaggatt aactgcgaat 5340
cgttctagct ccctgcttgc ccatactata tgttttaatt tatatttttt ctttccccct 5400
ggccttaacc gaattttttc ccatcgatct aattctcccc cgcttaatac tgacgctctc 5460
gcacccatgg cggcggcaga tctcgaattc agatctcacg tgctttgcca aagtgatggg 5520
ccagcacaca gaccagcacg ttgcccagga gctgtgggag gaagataaga ggtatgaaca 5580
tgattagcaa aagggcctag cttggactca gaataatcca gccttatccc aaccataaaa 5640
taaaagcaga atggtagctg gattgtagct gctattagca atatgaaacc tcttacatca 5700
gttacaattt atatgcagaa atatttatat gcagaaatat tgctattgcc ttaacccaga 5760
aattatcact gttattcttt agaatggtgc aaagaggcat gatacattgt atcattattg 5820
ccctgaaaga aagagattag ggaaagtatt agaaataaga taaacaaaaa agtatattaa 5880
aagaagaaag cattttttaa aattacaaat gcaaaattac cctgatttgg tcaatatgtg 5940
taccctgtta cttctcccct tcctatgaca tgaacttaac catagaaaag aaggggaaag 6000
aaaacatcaa gggtcccata gactcaccct gaagttctca ggatccgagc tcggtaccac 6060
atgtaagctt cgaggggagg ctggatcggt cccggtgtct tctatggagg tcaaaacagc 6120
gtggatggcg tctccaggcg atctgacggt tcactaaacg ctgcttcgcg atgtacgggc 6180
cagatatacg cgttgcgatc tgacggttca ctaaacgagc tctgcttata taggcctccc 6240
accgtacacg ccacctcgac atactcgagt ttactcccta tcagtgatag agaacgtatg 6300
aagagtttac tccctatcag tgatagagaa cgtatgcaga ctttactccc tatcagtgat 6360
agagaacgta taaggagttt actccctatc agtgatagag aacgtatgac cagtttactc 6420
cctatcagtg atagagaacg tatctacagt ttactcccta tcagtgatag agaacgtata 6480
tccagtttac tccctatcag tgatagagaa cgtataagct ttaggcgtgt acggtgggcg 6540
cctataaaag cagagctcgt ttagtgaacc gtcagatcgc ctggagcaat tccacaacac 6600
ttttgtctta taccaacttt ccgtaccact tcctaccctc gtaaatcgtc gacgagctcg 6660
tttagtgaac cgtcagatcg cctggagacg ccctcgaagc cgcggtgcgg gtgccagggc 6720
gtgcccttgg gctccatgtc catcatgggt ctcaaggtga acgtctctgc catattcatg 6780
gcagtactgt taactctcca aacacccacc ggtcaaatcc attggggcaa tctctctaag 6840
ataggggtgg taggaatagg aagtgcaagc tacaaagtta tgactcgttc cagccatcaa 6900
tcattagtca taaaattaat gcccaatata actctcctca ataactgcac gagggtagag 6960
attgcagaat acaggagact actgagaaca gttttggaac caattagaga tgcacttaat 7020
gcaatgaccc agaatataag accggttcag agtgtagctt caagtaggag acacaagaga 7080
tttgcgggag tagtcctggc aggtgcggcc ctaggcgttg ccacagctgc tcagataaca 7140
gccggcattg cacttcacca gtccatgctg aactctcaag ccatcgacaa tctgagagcg 7200
agcctggaaa ctactaatca ggcaattgag gcaatcagac aagcagggca ggagatgata 7260
ttggctgttc agggtgtcca agactacatc aataatgagc tgataccgtc tatgaaccaa 7320
ctatcttgtg atttaatcgg ccagaagctc gggctcaaat tgctcagata ctatacagaa 7380
atcctgtcat tatttggccc cagcttacgg gaccccatat ctgcggagat atctatccag 7440
gctttgagct atgcgcttgg aggagacatc aataaggtgt tagaaaagct cggatacagt 7500
ggaggtgatt tactgggcat cttagagagc agaggaataa aggcccggat aactcacgtc 7560
gacacagagt cctacttcat tgtcctcagt atagcctatc cgacgctgtc cgagattaag 7620
ggggtgattg tccaccggct agagggggtc tcgtacaaca taggctctca agagtggtat 7680
accactgtgc ccaagtatgt tgcaacccaa gggtacctta tctcgaattt tgatgagtca 7740
tcgtgtactt tcatgccaga ggggactgtg tgcagccaaa atgccttgta cccgatgagt 7800
cctctgctcc aagaatgcct ccgggggtcc accaagtcct gtgctcgtac actcgtatcc 7860
gggtcttttg ggaaccggtt cattttatca caagggaacc taatagccaa ttgtgcatca 7920
atcctttgca agtgttacac aacaggaacg atcattaatc aagaccctga caagatccta 7980
acatacattg ctgccgatca ctgcccggta gtcgaggtga acggcgtgac catccaagtc 8040
gggagcagga ggtatccaga cgctgtgtac ttgcacagaa ttgacctcgg tcctcccata 8100
tcattggaga ggttggacgt agggacaaat ctggggaatg caattgctaa gttggaggat 8160
gccaaggaat tgttggagtc atcggaccag atattgagga gtatgaaagg tttatcgagc 8220
actagcatag tctacatcct gattgcagtg tgtcttggag ggttgatagg gatccccgct 8280
ttaatatgtt gctgcagggg gcgttgaccc ctctccctcc ccccccccta acgttactgg 8340
ccgaagccgc ttggaataag gccggtgtgc gtttgtctat atgttatttt ccaccatatt 8400
gccgtctttt ggcaatgtga gggcccggaa acctggccct gtcttcttga cgagcattcc 8460
taggggtctt tcccctctcg ccaaaggaat gcaaggtctg ttgaatgtcg tgaaggaagc 8520
agttcctctg gaagcttctt gaagacaaac aacgtctgta gcgacccttt gcaggcagcg 8580
gaacccccca cctggcgaca ggtgcctctg cggccaaaag ccacgtgtat aagatacacc 8640
tgcaaaggcg gcacaacccc agtgccacgt tgtgagttgg atagttgtgg aaagagtcaa 8700
atggctctcc tcaagcgtat tcaacaaggg gctgaaggat gcccagaagg taccccattg 8760
tatgggatct gatctggggc ctcggtacac atgctttaca tgtgtttagt cgaggttaaa 8820
aaaacgtcta ggccccccga accacgggga cgtggttttc ctttgaaaaa cacgatgata 8880
atatggccac aaccatggga agtaggatag tcattaacag agaacatctt atgattgata 8940
gaccttatgt tttgctggct gttctgtttg tcatgtttct gagcttgatc gggttgctag 9000
ccattgcagg cattagactt catcgggcag ccatctacac cgcagagatc cataaaagcc 9060
tcagcaccaa tctagatgta actaactcaa tcgagcatca ggtcaaggac gtgctgacac 9120
cactcttcaa aatcatcggt gatgaagtgg gcctgaggac acctcagaga ttcactgacc 9180
tagtgaaatt catctctgac aagattaaat tccttaatcc ggatagggag tacgacttca 9240
gagatctcac ttggtgtatc aacccgccag agagaatcaa attggattat gatcaatact 9300
gtgcagatgt ggctgctgaa gagctcatga atgcattggt gaactcaact ctactggaga 9360
ccagaacaac caatcagttc ctagctgtct caaagggaaa ctgctcaggg cccactacaa 9420
tcagaggtca attctcaaac atgtcgctgt ccctgttaga cttgtattta ggtcgaggtt 9480
acaatgtgtc atctatagtc actatgacat cccagggaat gtatggggga acttacctag 9540
tggaaaagcc taatctgagc agcaaaaggt cagagttgtc acaactgagc atgtaccgag 9600
tgtttgaagt aggtgttatc agaaatccgg gtttgggggc tccggtgttc catatgacaa 9660
actatcttga gcaaccagtc agtaatgatc tcagcaactg tatggtggct ttgggggagc 9720
tcaaactcgc agccctttgt cacggggaag attctatcac aattccctat cagggatcag 9780
ggaaaggtgt cagcttccag ctcgtcaagc taggtgtctg gaaatcccca accgacatgc 9840
aatcctgggt ccccttatca acggatgatc cagtgataga caggctttac ctctcatctc 9900
acagaggtgt tatcgctgac aaycaagcaa aatgggctgt cccgacaaca cgaacagatg 9960
acaagttgcg aatggagaca tgcttccaac aggcgtgtaa gggtaaaatc caagcactct 10020
gcgagaatcc cgagtgggca ccattgaagg ataacaggat tccttcatac ggggtcttgt 10080
ctgttgatct gagtctgaca gttgagctta aaatcaaaat tgcttcggga ttcgggccat 10140
tgatcacaca cggttcaggg atggacctat acaaatccaa ccacaacaat gtgtattggc 10200
tgactatccc rccaatgaag aacctagcct taggtgtaat caacacattg gagtggatac 10260
cgagattcaa ggttagtccc tacctcttca mtgtcccaat taaggaagca ggcgaagact 10320
gccatgcccc aacataccta cctgcggagg tggatggtga tgtcaaactc agttccaatc 10380
tggtgattct acctggtcaa gatctccaat atgttttggc aacctacgat acttccaggg 10440
ttgaacatgc tgtggtttat tacgtttaca gcccaagccg ctcattttct tacttttatc 10500
cttttaggtt gcctataaag ggggtcccca tcgaattaca agtggaatgc ttcacatggg 10560
accaaaaact ctggtgccgt cacttctgtg tgcttgcgga ctcagaatct ggtggacata 10620
tcactcactc tgggatggtg ggcatgggag tcagctgcac agtcacccgg gaagatggaa 10680
ccaatcgcag atagggctgc tagtgaacya atcwcatgat gtcacccaga catcaggcat 10740
acccactagt gtgaaataga catcagaatt aagaaaaatg ggctccccgg gcgcgtactc 10800
cacctcaccc atcatccacg ctcggcaata aaaagacaga ataaaacgca cgggtgttgg 10860
gtcgtttgtt cgccgggcgc gtactccacc tcacccatca tccacgctgt tttatggata 10920
gcactgagaa cgtcatcaag cccttcatgc gcttcaaggt gcacatggag ggctccgtga 10980
acggccacga gttcgagatc gagggcgagg gcgagggcaa gccctacgag ggcacccaga 11040
ccgccaagct gcaggtgacc aagggcggcc ccctgccctt cgcctgggac atcctgtccc 11100
cccagttcca gtacggctcc aaggtgtacg tgaagcaccc cgccgacatc cccgactaca 11160
agaagctgtc cttccccgag ggcttcaagt gggagcgcgt gatgaacttc gaggacggcg 11220
gcgtggtgac cgtgacccag gactcctccc tgcaggacgg caccttcatc taccacgtga 11280
agttcatcgg cgtgaacttc ccctccgacg gccccgtaat gcagaagaag actctgggct 11340
gggagccctc caccgagcgc ctgtaccccc gcgacggcgt gctgaagggc gagatccaca 11400
aggcgctgaa gctgaagggc ggcggccact acctggtgga gttcaagtca atctacatgg 11460
ccaagaagcc cgtgaagctg cccggctact actacgtgga ctccaagctg gacatcacct 11520
cccacaacga ggactacacc gtggtggagc agtacgagcg cgccgaggcc cgccaccacc 11580
tgttccagta ggacctccat agaagacacc gggaccgatc caataacttc gtatagcata 11640
cattatacga agttatgcct ccggactcta gcgtttaaac ttaagcttgg taccgagctc 11700
ggatccacta gtccagtgtg gtggaattct gcagatatcc agcacagtgg cggccgctcg 11760
agtctagagg gcccgtttaa acccgctgat cagcctcgac tgtgccttct agttgccagc 11820
catctgttgt ttgcccctcc cccgtgcctt ccttgaccct ggaaggtgcc actcccactg 11880
tcctttccta ataaaatgag gaaattgcat cgcattgtct gagtaggtgt cattctattc 11940
tggggggtgg ggtggggcag gacagcaagg gggaggattg ggaagacaat agcaggcatg 12000
ctggggatgc ggtgggctct atggcttctg aggcggaaag ttaaccctag aaagataatc 12060
atattgtgac gtacgttaaa gataatcatg cgtaaaattg acgcatgtgt tttatcggtc 12120
tgtatatcga ggtttattta ttaatttgaa tagatattaa gttttattat atttacactt 12180
acatactaat aataaattca acaaacaatt tatttatgtt tatttattta ttaaaaaaaa 12240
acaaaaactc aaaatttctt ctataaagta acaaaaacca gctggggctc gaagttccta 12300
tactttctag agaataggaa cttctatagt gagtcgaata agggcgacac aaaatttatt 12360
ctaaatgcat aataaatact gataacatct tatagtttgt attatatttt gtattatcgt 12420
tgacatgtat aattttgata tcaaaaactg attttccctt tattattttc gagatttatt 12480
ttcttaattc tctttaacaa actagaaata ttgtatatac aaaaaatcat aaataataga 12540
tgaatagttt aattataggt gttcatcaat cgaaaaagca acgtatctta tttaaagtgc 12600
gttgcttttt tctcatttat aaggttaaat aattctcata tatcaagcaa agtgacaggc 12660
gcccttaaat attctgacaa atgctctttc cctaaactcc ccccataaaa aaacccgccg 12720
aagcgggttt ttacgttatt tgcggattaa cgattactcg ttatcagaac cgcccagggg 12780
gcccgagctt aagactggcc gtcgttttac aacacagaaa gagtttgtag aaacgcaaaa 12840
aggccatccg tcaggggcct tctgcttagt ttgatgcctg gcagttccct actctcgcct 12900
tccgcttcct cgctcactga ctcgctgcgc tcggtcgttc ggctgcggcg agcggtatca 12960
gctcactcaa aggcggtaat acggttatcc acagaatcag gggataacgc aggaaagaac 13020
atgtgagcaa aaggccagca aaaggccagg aaccgtaaaa aggccgcgtt gctggcgttt 13080
ttccataggc tccgcccccc tgacgagcat cacaaaaatc gacgctcaag tcagaggtgg 13140
cgaaacccga caggactata aagataccag gcgtttcccc ctggaagctc cctcgtgcgc 13200
tctcctgttc cgaccctgcc gcttaccgga tacctgtccg cctttctccc ttcgggaagc 13260
gtggcgcttt ctcatagctc acgctgtagg tatctcagtt cggtgtaggt cgttcgctcc 13320
aagctgggct gtgtgcacga accccccgtt cagcccgacc gctgcgcctt atccggtaac 13380
tatcgtcttg agtccaaccc ggtaagacac gacttatcgc cactggcagc agccactggt 13440
aacaggatta gcagagcgag gtatgtaggc ggtgctacag agttcttgaa gtggtgggct 13500
aactacggct acactagaag aacagtattt ggtatctgcg ctctgctgaa gccagttacc 13560
ttcggaaaaa gagttggtag ctcttgatcc ggcaaacaaa ccaccgctgg tagcggtggt 13620
ttttttgttt gcaagcagca gattacgcgc agaaaaaaag gatctcaaga agatcctttg 13680
atcttttcta cggggtctga cgctcagtgg aacgacgcgc gcgtaactca cgttaaggga 13740
ttttggtcat gagcttgcgc cgtcccgtca agtcagcgta atgctctgct tttagaaaaa 13800
ctcatcgagc atcaaatgaa actgcaattt attcatatca ggattatcaa taccatattt 13860
ttgaaaaagc cgtttctgta atgaaggaga aaactcaccg aggcagttcc ataggatggc 13920
aagatcctgg tatcggtctg cgattccgac tcgtccaaca tcaatacaac ctattaattt 13980
cccctcgtca aaaataaggt tatcaagtga gaaatcacca tgagtgacga ctgaatccgg 14040
tgagaatggc aaaagtttat gcatttcttt ccagacttgt tcaacaggcc agccattacg 14100
ctcgtcatca aaatcactcg catcaaccaa accgttattc attcgtgatt gcgcctgagc 14160
gaggcgaaat acgcgatcgc tgttaaaagg acaattacaa acaggaatcg agtgcaaccg 14220
gcgcaggaac actgccagcg catcaacaat attttcacct gaatcaggat attcttctaa 14280
tacctggaac gctgtttttc cggggatcgc agtggtgagt aaccatgcat catcaggagt 14340
acggataaaa tgcttgatgg tcggaagtgg cataaattcc gtcagccagt ttagtctgac 14400
catctcatct gtaacatcat tggcaacgct acctttgcca tgtttcagaa acaactctgg 14460
cgcatcgggc ttcccataca agcgatagat tgtcgcacct gattgcccga cattatcgcg 14520
agcccattta tacccatata aatcagcatc catgttggaa tttaatcgcg gcctcgacgt 14580
ttcccgttga atatggctca tattcttcct ttttcaatat tattgaagca tttatcaggg 14640
ttattgtctc atgagcggat acatatttga atgtatttag aaaaataaac aaataggggt 14700
cagtgttaca accaattaac caattctgaa cattatcgcg agcccattta tacctgaata 14760
tggctcataa caccccttgt ttgcctggcg gcagtagcgc ggtggtccca cctgacccca 14820
tgccgaactc agaagtgaaa cgccgtagcg ccgatggtag tgtggggact ccccatgcga 14880
gagtagggaa ctgccaggca tcaaataaaa cgaaaggctc agtcgaaaga ctgggccttt 14940
cgcccgggct aattaggggg tgtcgccctt attcgactct atagtgaagt tcctattctc 15000
tagaaagtat aggaacttct gaagt 15025
<210> 85
<211> 6584
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический индуцируемый рапамицином активатор TET
<400> 85
gatatctata acaagaaaat atatatataa taagttatca cgtaagtaga acatgaaata 60
acaatataat tatcgtatga gttaaatctt aaaagtcacg taaaagataa tcatgcgtca 120
ttttgactca cgcggtcgtt atagttcaaa atcagtgaca cttaccgcat tgacaagcac 180
gcctcacggg agctccaagc ggcgactgag atgtcctaaa tgcacagcga cggattcgcg 240
ctatttagaa agagagagca atatttcaag aatgcatgcg tcaattttac gcagactatc 300
tttctagggt taagacggat cgggagatct cccgatcccc tatggtgcac tctcagtaca 360
atctgctctg atgccgcata gttaagccag tatctgctcc ctgcttgtgt gttggaggtc 420
gctgagtagt gcgcgagcaa aatttaagct acaacaaggc aaggcttgac cgacaattgc 480
atgaagaatc tgcttagggt taggcgtttt gcgctgcttc gcgatgtacg ggccagatat 540
acgcgttctc catagaagac accgaataaa atatctttat tttcattaca tctgtgtgtt 600
ggttttttgt gtgaatcgat agtactaaca tacgctctcc atcaaaacaa aacgaaacaa 660
aacaaactag caaaataggc tgtccccagt gcaagtgcag gtgccagaac atttctctgg 720
accgatccaa taacttcgta tagcatacat tatacgaagt tatgcctccg gactctagcg 780
ttttagttat tactagcgct accggactca gatctcgagc tcaagcttcg aattctgcag 840
tcgacggtac cgcggcttac gcgtgctagc taatgatggg cgctcgagta atgatgggcg 900
gtcgactaat gatgggcgct cgagtaatga tgggcgtcta gctaatgatg ggcgctcgag 960
taatgatggg cggtcgacta atgatgggcg ctcgagtaat gatgggcgtc tagctaatga 1020
tgggcgctcg agtaatgatg ggcggtcgac taatgatggg cgctcgagta atgatgggcg 1080
tctagaacgc gaattaattc aacattttga cacccccata atatttttcc agaattaaca 1140
gtataaattg catctcttgt tcaagagttc cctatcactc tctttaatca ctactcacag 1200
taacctcaac tcctgccaca agcttgccct gcagcgggaa ttccaaactt aagcttggta 1260
ccgagctcgg atccactagt ccagtgtggt ggaattctgc agatatccag cacagtggcg 1320
gccgctcgag tctagagggc ccgtttaaac ccgctgatca atgtctagac tggacaagag 1380
caaagtcata aactctgctc tggaattact caatggagtc ggtatcgaag gcctgacgac 1440
aaggaaactc gctcaaaagc tgggagttga gcagcctacc ctgtactggc acgtgaagaa 1500
caagcgggcc ctgctcgatg ccctgccaat cgagatgctg gacaggcatc atacccactc 1560
ctgccccctg gaaggcgagt catggcaaga ctttctgcgg aacaacgcca agtcataccg 1620
ctgtgctctc ctctcacatc gcgacggggc taaagtgcat ctcggcaccc gcccaacaga 1680
gaaacagtac gaaaccctgg aaaatcagct cgcgttcctg tgtcagcaag gcttctccct 1740
ggagaacgca ctgtacgctc tgtccgccgt gggccacttt acactgggct gcgtattgga 1800
ggaacaggag catcaagtag caaaagagga aagagagaca cctaccaccg attctatgcc 1860
cccacttctg aaacaagcaa ttgagctgtt cgaccggcag ggagccgaac ctgccttcct 1920
tttcggcctg gaactaatca tatgtggcct ggagaaacag ctaaagtgcg aaagcggcgg 1980
gccgaccgac gcccttgacg attttgactt agacatgctc ccagccgatg cccttgacga 2040
ctttgacctt gatatgctgc ctgctgacgc tcttgacgat tttgaccttg acatgctccc 2100
cgggtaagtc cctccccccc ccctaacgtt actggccgaa gccgcttgga ataaggccgg 2160
tgtgcgtttg tctatatgtt attttccacc atattgccgt cttttggcaa tgtgagggcc 2220
cggaaacctg gccctgtctt cttgacgagc attcctaggg gtctttcccc tctcgccaaa 2280
ggaatgcaag gtctgttgaa tgtcgtgaag gaagcagttc ctctggaagc ttcttgaaga 2340
caaacaacgt ctgtagcgac cctttgcagg cagcggaacc ccccacctgg cgacaggtgc 2400
ctctgcggcc aaaagccacg tgtataagat acacctgcaa aggcggcaca accccagtgc 2460
cacgttgtga gttggatagt tgtggaaaga gtcaaatggc tctcctcaag cgtattcaac 2520
aaggggctga aggatgccca gaaggtaccc cattgtatgg gatctgatct ggggcctcgg 2580
tgcacatgct ttacatgtgt ttagtcgagg ttaaaaaacg tctaggcccc ccgaaccacg 2640
gggacgtggt tttcctttga aaaacacgat gataaatgga tagcactgag aacgtcatca 2700
agcccttcat gcgcttcaag gtgcacatgg agggctccgt gaacggccac gagttcgaga 2760
tcgagggcga gggcgagggc aagccctacg agggcaccca gaccgccaag ctgcaggtga 2820
ccaagggcgg ccccctgccc ttcgcctggg acatcctgtc cccccagttc cagtacggct 2880
ccaaggtgta cgtgaagcac cccgccgaca tccccgacta caagaagctg tccttccccg 2940
agggcttcaa gtgggagcgc gtgatgaact tcgaggacgg cggcgtggtg accgtgaccc 3000
aggactcctc cctgcaggac ggcaccttca tctaccacgt gaagttcatc ggcgtgaact 3060
tcccctccga cggccccgta atgcagaaga agactctggg ctgggagccc tccaccgagc 3120
gcctgtaccc ccgcgacggc gtgctgaagg gcgagatcca caaggcgctg aagctgaagg 3180
gcggcggcca ctacctggtg gagttcaagt caatctacat ggccaagaag cccgtgaagc 3240
tgcccggcta ctactacgtg gactccaagc tggacatcac ctcccacaac gaggactaca 3300
ccgtggtgga gcagtacgag cgcgccgagg cccgccacca cctgttccag tagctcgact 3360
gtgccttcta gttgccagcc atctgttgtt tgcccctccc ccgtgccttc cttgaccctg 3420
gaaggtgcca ctcccactgt cctttcctaa taaaatgagg aaattgcatc gcattgtctg 3480
agtaggtgtc attctattct ggggggtggg gtggggcagg acagcaaggg ggaggattgg 3540
gaagacaata gcaggcatgc tggggatgcg gtgggctcta tggcttctga ggcggaaagt 3600
taaccctaga aagataatca tattgtgacg tacgttaaag ataatcatgc gtaaaattga 3660
cgcatgtgtt ttatcggtct gtatatcgag gtttatttat taatttgaat agatattaag 3720
ttttattata tttacactta catactaata ataaattcaa caaacaattt atttatgttt 3780
atttatttat taaaaaaaaa caaaaactca aaatttcttc tataaagtaa caaaaaccag 3840
ctggggctcg aagttcctat actttctaga gaataggaac ttctatagtg agtcgaataa 3900
gggcgacaca aaatttattc taaatgcata ataaatactg ataacatctt atagtttgta 3960
ttatattttg tattatcgtt gacatgtata attttgatat caaaaactga ttttcccttt 4020
attattttcg agatttattt tcttaattct ctttaacaaa ctagaaatat tgtatataca 4080
aaaaatcata aataatagat gaatagttta attataggtg ttcatcaatc gaaaaagcaa 4140
cgtatcttat ttaaagtgcg ttgctttttt ctcatttata aggttaaata attctcatat 4200
atcaagcaaa gtgacaggcg cccttaaata ttctgacaaa tgctctttcc ctaaactccc 4260
cccataaaaa aacccgccga agcgggtttt tacgttattt gcggattaac gattactcgt 4320
tatcagaacc gcccaggggg cccgagctta agactggccg tcgttttaca acacagaaag 4380
agtttgtaga aacgcaaaaa ggccatccgt caggggcctt ctgcttagtt tgatgcctgg 4440
cagttcccta ctctcgcctt ccgcttcctc gctcactgac tcgctgcgct cggtcgttcg 4500
gctgcggcga gcggtatcag ctcactcaaa ggcggtaata cggttatcca cagaatcagg 4560
ggataacgca ggaaagaaca tgtgagcaaa aggccagcaa aaggccagga accgtaaaaa 4620
ggccgcgttg ctggcgtttt tccataggct ccgcccccct gacgagcatc acaaaaatcg 4680
acgctcaagt cagaggtggc gaaacccgac aggactataa agataccagg cgtttccccc 4740
tggaagctcc ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat acctgtccgc 4800
ctttctccct tcgggaagcg tggcgctttc tcatagctca cgctgtaggt atctcagttc 4860
ggtgtaggtc gttcgctcca agctgggctg tgtgcacgaa ccccccgttc agcccgaccg 4920
ctgcgcctta tccggtaact atcgtcttga gtccaacccg gtaagacacg acttatcgcc 4980
actggcagca gccactggta acaggattag cagagcgagg tatgtaggcg gtgctacaga 5040
gttcttgaag tggtgggcta actacggcta cactagaaga acagtatttg gtatctgcgc 5100
tctgctgaag ccagttacct tcggaaaaag agttggtagc tcttgatccg gcaaacaaac 5160
caccgctggt agcggtggtt tttttgtttg caagcagcag attacgcgca gaaaaaaagg 5220
atctcaagaa gatcctttga tcttttctac ggggtctgac gctcagtgga acgacgcgcg 5280
cgtaactcac gttaagggat tttggtcatg agcttgcgcc gtcccgtcaa gtcagcgtaa 5340
tgctctgctt ttagaaaaac tcatcgagca tcaaatgaaa ctgcaattta ttcatatcag 5400
gattatcaat accatatttt tgaaaaagcc gtttctgtaa tgaaggagaa aactcaccga 5460
ggcagttcca taggatggca agatcctggt atcggtctgc gattccgact cgtccaacat 5520
caatacaacc tattaatttc ccctcgtcaa aaataaggtt atcaagtgag aaatcaccat 5580
gagtgacgac tgaatccggt gagaatggca aaagtttatg catttctttc cagacttgtt 5640
caacaggcca gccattacgc tcgtcatcaa aatcactcgc atcaaccaaa ccgttattca 5700
ttcgtgattg cgcctgagcg aggcgaaata cgcgatcgct gttaaaagga caattacaaa 5760
caggaatcga gtgcaaccgg cgcaggaaca ctgccagcgc atcaacaata ttttcacctg 5820
aatcaggata ttcttctaat acctggaacg ctgtttttcc ggggatcgca gtggtgagta 5880
accatgcatc atcaggagta cggataaaat gcttgatggt cggaagtggc ataaattccg 5940
tcagccagtt tagtctgacc atctcatctg taacatcatt ggcaacgcta cctttgccat 6000
gtttcagaaa caactctggc gcatcgggct tcccatacaa gcgatagatt gtcgcacctg 6060
attgcccgac attatcgcga gcccatttat acccatataa atcagcatcc atgttggaat 6120
ttaatcgcgg cctcgacgtt tcccgttgaa tatggctcat attcttcctt tttcaatatt 6180
attgaagcat ttatcagggt tattgtctca tgagcggata catatttgaa tgtatttaga 6240
aaaataaaca aataggggtc agtgttacaa ccaattaacc aattctgaac attatcgcga 6300
gcccatttat acctgaatat ggctcataac accccttgtt tgcctggcgg cagtagcgcg 6360
gtggtcccac ctgaccccat gccgaactca gaagtgaaac gccgtagcgc cgatggtagt 6420
gtggggactc cccatgcgag agtagggaac tgccaggcat caaataaaac gaaaggctca 6480
gtcgaaagac tgggcctttc gcccgggcta attagggggt gtcgccctta ttcgactcta 6540
tagtgaagtt cctattctct agaaagtata ggaacttctg aagt 6584
<210> 86
<211> 11528
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический индуцируемый рапамицином индуктор REV srcVpx
<400> 86
gatatctata acaagaaaat atatatataa taagttatca cgtaagtaga acatgaaata 60
acaatataat tatcgtatga gttaaatctt aaaagtcacg taaaagataa tcatgcgtca 120
ttttgactca cgcggtcgtt atagttcaaa atcagtgaca cttaccgcat tgacaagcac 180
gcctcacggg agctccaagc ggcgactgag atgtcctaaa tgcacagcga cggattcgcg 240
ctatttagaa agagagagca atatttcaag aatgcatgcg tcaattttac gcagactatc 300
tttctagggt taagacggat cgggagatct cccgatcccc tatggtgcac tctcagtaca 360
atctgctctg atgccgcata gttaagccag tatctgctcc ctgcttgtgt gttggaggtc 420
gctgagtagt gcgcgagcaa aatttaagct acaacaaggc aaggcttgac cgacaattgc 480
atgaagaatc tgcttagggt taggcgtttt gcgctgcttc gcgatgtacg ggccagatat 540
acgcgttgac attgattatt gactagttat taatagtaat caattacggg gtcattagtt 600
catagcccat atatggagtt ccgcgttaca taacttacgg taaatggccc gcctggctga 660
ccgcccaacg acccccgccc attgacgtca ataatgacgt atgttcccat agtaacgcca 720
atagggactt tccattgacg tcaatgggtg gagtatttac ggtaaactgc ccacttggca 780
gtacatcaag tgtatcatat gccaagtacg ccccctattg acgtcaatga cggtaaatgg 840
cccgcctggc attatgccca gtacatgacc ttatgggact ttcctacttg gcagtacatc 900
tacgtattag tcatcgctat taccatggtg atgcggtttt ggcagtacat caatgggcgt 960
ggatagcggt ttgactcacg gggatttcca agtctccacc ccattgacgt caatgggagt 1020
ttgttttgga accaaaatca acgggacttt ccaaaatgtc gtaacaactc cgccccattg 1080
acgcaaatgg gcggtaggcg tgtacggtgg gaggtctata taagcagagc tcggcattga 1140
ttattgacta gttattaata gtaatcaatt acggggtcat tagttcatag cccatatatg 1200
gagttccgcg ttacataact tacggtaaat ggcccgcctg gctgaccgcc caacgacccc 1260
cgcccattga cgtcaataat gacgtatgtt cccatagtaa cgccaatagg gactttccat 1320
tgacgtcaat gggtggagta tttacggtaa actgcccact tggcagtaca tcaagtgtat 1380
catatgccaa gtccgccccc tattgacgtc aatgacggta aatggcccgc ctggcattat 1440
gcccagtaca tgaccttacg ggactttcct acttggcagt acatctacgt attagtcatc 1500
gctattacca tggtgatgcg gttttggcag tacaccaatg ggcgtggata gcggtttgac 1560
tcacggggat ttccaagtct ccaccccatt gacgtcaatg ggagtttgtt ttggcaccaa 1620
aatcaacggg actttccaaa atgtcgtaac aactgcgatc gcccgccccg ttgacgcaaa 1680
tgggcggtag gcgtgtacgg tgggaggtct atataagcag agctcgttta gtgaaccgtc 1740
agatcactag aagctttatt gcggtagttt atcacagtta aattgctaac gcagtcagtg 1800
cttctgacac aacagtctcg aacttaagct gcagtgactc tcttaaggta gccttgcaga 1860
agttggtcgt gaggcactgg gcaggtaagt atcaaggtta caagacaggt ttaaggagac 1920
caatagaaac tgggcttgtc gagacagaga agactcttgc gtttctgata ggcacctatt 1980
ggtcttactg acatccactt tgcctttctc tccacaggtg tccactccca gttcaattac 2040
agctcttaag gctagagtac ttaatacgac tcactatagg ctagcctcga gaattcatgg 2100
cttctagaat cctctggcat gagatgtggc atgaaggcct ggaagaggca tctcgtttgt 2160
actttgggga aaggaacgtg aaaggcatgt ttgaggtgct ggagcccttg catgctatga 2220
tggaacgggg cccccagact ctgaaggaaa catcctttaa tcaggcctat ggtcgagatt 2280
taatggaggc ccaagagtgg tgcaggaagt acatgaaatc agggaatgtc aaggacctcc 2340
tccaagcctg ggacctctat tatcatgtgt tccgacgaat ctcaaagact agagatgagt 2400
ttcccaccat ggtgtttcct tctgggcaga tcagccaggc ctcggccttg gccccggccc 2460
ctccccaagt cctgccccag gctccagccc ctgcccctgc tccagccatg gtatcagctc 2520
tggcccaggc cccagcccct gtcccagtcc tagccccagg ccctcctcag gctgtggccc 2580
cacctgcccc caagcccacc caggctgggg aaggaacgct gtcagaggcc ctgctgcagc 2640
tgcagtttga tgatgaagac ctgggggcct tgcttggcaa cagcacagac ccagctgtgt 2700
tcacagacct ggcatccgtc gacaactccg agtttcagca gctgctgaac cagggcatac 2760
ctgtggcccc ccacacaact gagcccatgc tgatggagta ccctgaggct ataactcgcc 2820
tagtgacagg ggcccagagg ccccccgacc cagctcctgc tccactgggg gccccggggc 2880
tccccaatgg cctcctttca ggagatgaag acttctcctc cattgcggac atggacttct 2940
cagccctgct gagtcagatc agctccacta gttattaaga attcacgcgt cgagcatgca 3000
tctagggcgg ccaattccgc ccctctcccc cccccccctc tccctccccc ccccctaacg 3060
ttactggccg aagccgcttg gaataaggcc ggtgtgcgtt tgtctatatg ttattttcca 3120
ccatattgcc gtcttttggc aatgtgaggg cccggaaacc tggccctgtc ttcttgacga 3180
gcattcctag gggtctttcc cctctcgcca aaggaatgca aggtctgttg aatgtcgtga 3240
aggaagcagt tcctctggaa gcttcttgaa gacaaacaac gtctgtagcg accctttgca 3300
ggcagcggaa ccccccacct ggcgacaggt gcctctgcgg ccaaaagcca cgtgtataag 3360
atacacctgc aaaggcggca caaccccagt gccacgttgt gagttggata gttgtggaaa 3420
gagtcaaatg gctctcctca agcgtattca acaaggggct gaaggatgcc cagaaggtac 3480
cccattgtat gggatctgat ctggggcctc ggtgcacatg ctttacatgt gtttagtcga 3540
ggttaaaaaa acgtctaggc cccccgaacc acggggacgt ggttttcctt tgaaaaacac 3600
gatgataagc ttgccacaac ccgggatcct ctagagtcga catggactat cctgctgcca 3660
agagggtcaa gttggactct agagaacgcc catatgcttg ccctgtcgag tcctgcgatc 3720
gccgcttttc tcgctcggat gagcttaccc gccatatccg catccacaca ggccagaagc 3780
ccttccagtg tcgaatctgc atgcgtaact tcagtcgtag tgaccacctt accacccaca 3840
tccgcaccca cacaggcggc ggccgcagga ggaagaaacg caccagcata gagaccaaca 3900
tccgtgtggc cttagagaag agtttcttgg agaatcaaaa gcctacctcg gaagagatca 3960
ctatgattgc tgatcagctc aatatggaaa aagaggtgat tcgtgtttgg ttctgtaacc 4020
gccgccagaa agaaaaaaga atcaacacta gaggagtgca ggtggaaacc atctccccgg 4080
gagacgggcg caccttcccc aagcgcggcc agacctgcgt ggtgcactac accgggatgc 4140
ttgaagatgg aaagaaattt gattcctccc gggacagaaa caagcccttt aagtttatgc 4200
taggcaagca ggaggtgatc cgaggctggg aagaaggggt tgcccagatg agtgtgggtc 4260
agagagccaa actgactata tctccagatt atgcctatgg tgccactggg cacccaggca 4320
tcatcccacc acatgccact ctcgtcttcg atgtggagct tctaaaactg gaagtcgagg 4380
gcgtgcaggt ggaaaccatc tccccaggag acgggcgcac cttccccaag cgcggccaga 4440
cctgcgtggt gcactacacc gggatgcttg aagatggaaa gaaatttgat tcctcccggg 4500
acagaaacaa gccctttaag tttatgctag gcaagcagga ggtgatccga ggctgggaag 4560
aaggggttgc ccagatgagt gtgggtcaga gagccaaact gactatatct ccagattatg 4620
cctatggtgc cactgggcac ccaggcatca tcccaccaca tgccactctc gtcttcgatg 4680
tggagcttct aaaactggaa actagaggag tgcaggtgga aaccatctcc ccaggagacg 4740
ggcgcacctt ccccaagcgc ggccagacct gcgtggtgca ctacaccggg atgcttgaag 4800
atggaaagaa atttgattcc tcccgggaca gaaacaagcc ctttaagttt atgctaggca 4860
agcaggaggt gatccgaggc tgggaagaag gggttgccca gatgagtgtg ggtcagagag 4920
ccaaactgac tatatctcca gattatgcct atggtgccac tgggcaccca ggcatcatcc 4980
caccacatgc cactctcgtc ttcgatgtgg agcttctaaa actggaaact agttattaag 5040
tcgacccggg cggccgcttc cctttagtga gggttaatgc ttcgagcaga catgataaga 5100
tacattgatg agtttggaca aaccacaact agaatgcagt gaaaaaaatg ctttatttgt 5160
gaaatttgtg atgctattgc tttatttgta accattataa gctgcaataa acaagttaac 5220
ctccatagaa gacaccggga ccgatccaat aacttcgtat agcatacatt atacgaagtt 5280
atggctgcta gtgaacyaat cwcatgatgt cacccagaca tcaggcatac ccactagtgt 5340
gaaatagaca tcagaattaa gaaaaatggg ctccccgggc gcgtactcca cctcacccat 5400
catccacgct cggcaataaa aagacagaat aaaacgcacg ggtgttgggt cgtttgttcg 5460
ttttatggat agcactgaga acgtcatcaa gcccttcatg cgcttcaagg tgcacatgga 5520
gggctccgtg aacggccacg agttcgagat cgagggcgag ggcgagggca agccctacga 5580
gggcacccag accgccaagc tgcaggtgac caagggcggc cccctgccct tcgcctggga 5640
catcctgtcc ccccagttcc agtacggctc caaggtgtac gtgaagcacc ccgccgacat 5700
ccccgactac aagaagctgt ccttccccga gggcttcaag tgggagcgcg tgatgaactt 5760
cgaggacggc ggcgtggtga ccgtgaccca ggactcctcc ctgcaggacg gcaccttcat 5820
ctaccacgtg aagttcatcg gcgtgaactt cccctccgac ggccccgtaa tgcagaagaa 5880
gactctgggc tgggagccct ccaccgagcg cctgtacccc cgcgacggcg tgctgaaggg 5940
cgagatccac aaggcgctga agctgaaggg cggcggccac tacctggtgg agttcaagtc 6000
aatctacatg gccaagaagc ccgtgaagct gcccggctac tactacgtgg actccaagct 6060
ggacatcacc tcccacaacg aggactacac cgtggtggag cagtacgagc gcgccgaggc 6120
ccgccaccac ctgttccagt aggacctcca tagaagacac cgaataaaat atctttattt 6180
tcattacatc tgtgtgttgg ttttttgtgt gaatcgatag tactaacata cgctctccat 6240
caaaacaaaa cgaaacaaaa caaactagca aaataggctg tccccagtgc aagtgcaggt 6300
gccagaacat ttctctggac cgatccaata acttcgtata gcatacatta tacgaagtta 6360
tgcctccgga ctctagcgtt ttagttatta ctagcgctac cggactcaga tctcgagctc 6420
aagcttcgaa ttctgcagtc gacggtaccg cggcttacgc gtgctagcta atgatgggcg 6480
ctcgagtaat gatgggcggt cgactaatga tgggcgctcg agtaatgatg ggcgtctagc 6540
taatgatggg cgctcgagta atgatgggcg gtcgactaat gatgggcgct cgagtaatga 6600
tgggcgtcta gctaatgatg ggcgctcgag taatgatggg cggtcgacta atgatgggcg 6660
ctcgagtaat gatgggcgtc tagaacgcga attaattcaa cattttgaca cccccataat 6720
atttttccag aattaacagt ataaattgca tctcttgttc aagagttccc tatcactctc 6780
tttaatcact actcacagta acctcaactc ctgccacaag cttgccctgc agcgggaatt 6840
ccaaacttaa gcttggtacc gagctcggat ccactagtcc agtgtggtgg aattctgcag 6900
atatccagca cagtggcggc cgctcgagtc tagagggccc gtttaaaccc gctgatcaga 6960
tggcaggaag aagcggagac agcgacgaag acctcctcaa ggcagtcaga ctcatcaagt 7020
ttctctatca aagcaaccca cctcccaacc ccgaggggac ccgacaggcc cgaaggaata 7080
gaagaagaag gtggagagag agacagagac agatccattc gattagtgaa cggatcctta 7140
gcacttattt gggacgatct gcggacgctg tgcctcttca gctaccaccg cttgagagac 7200
ttactcttga ttgtgacgag gattgtggaa cttctgggac gcagggggtg ggaagccctc 7260
aaatattggt ggaatctcct acaatattgg agtcaggagc taaagaatag tccctccccc 7320
ccccctaacg ttactggccg aagccgcttg gaataaggcc ggtgtgcgtt tgtctatatg 7380
ttattttcca ccatattgcc gtcttttggc aatgtgaggg cccggaaacc tggccctgtc 7440
ttcttgacga gcattcctag gggtctttcc cctctcgcca aaggaatgca aggtctgttg 7500
aatgtcgtga aggaagcagt tcctctggaa gcttcttgaa gacaaacaac gtctgtagcg 7560
accctttgca ggcagcggaa ccccccacct ggcgacaggt gcctctgcgg ccaaaagcca 7620
cgtgtataag atacacctgc aaaggcggca caaccccagt gccacgttgt gagttggata 7680
gttgtggaaa gagtcaaatg gctctcctca agcgtattca acaaggggct gaaggatgcc 7740
cagaaggtac cccattgtat gggatctgat ctggggcctc ggtgcacatg ctttacatgt 7800
gtttagtcga ggttaaaaaa cgtctaggcc ccccgaacca cggggacgtg gttttccttt 7860
gaaaaacacg atgataatgg ggaggaggaa gaggaagccg aaggatccga aggcgagggt 7920
gttggcggag gcggattaca aggacgacga tgacaagatg tcagatccca gggagagaat 7980
cccacctgga aacagtggag aagagacaat aggagaggcc ttcgaatggc taaacagaac 8040
agtagaggag ataaacagag aggcagtaaa ccacctacca agggagctga ttttccaggt 8100
ttggcaaagg tcttgggaat actggcatga tgaacaaggg atgtcacaaa gctatgtaaa 8160
atacagatac ttgtgtttaa tgcaaaaggc tttatttatg cattgcaaga aaggctgtag 8220
atgtctaggg gaaggacacg gggcaggagg atggagacca ggacctcctc ctcctccccc 8280
tccaggacta gcataacctc gactgtgcct tctagttgcc agccatctgt tgtttgcccc 8340
tcccccgtgc cttccttgac cctggaaggt gccactccca ctgtcctttc ctaataaaat 8400
gaggaaattg catcgcattg tctgagtagg tgtcattcta ttctgggggg tggggtgggg 8460
caggacagca agggggagga ttgggaagac aatagcaggc atgctgggga tgcggtgggc 8520
tctatggctt ctgaggcgga aagttaaccc tagaaagata atcatattgt gacgtacgtt 8580
aaagataatc atgcgtaaaa ttgacgcatg tgttttatcg gtctgtatat cgaggtttat 8640
ttattaattt gaatagatat taagttttat tatatttaca cttacatact aataataaat 8700
tcaacaaaca atttatttat gtttatttat ttattaaaaa aaaacaaaaa ctcaaaattt 8760
cttctataaa gtaacaaaaa ccagctgggg ctcgaagttc ctatactttc tagagaatag 8820
gaacttctat agtgagtcga ataagggcga cacaaaattt attctaaatg cataataaat 8880
actgataaca tcttatagtt tgtattatat tttgtattat cgttgacatg tataattttg 8940
atatcaaaaa ctgattttcc ctttattatt ttcgagattt attttcttaa ttctctttaa 9000
caaactagaa atattgtata tacaaaaaat cataaataat agatgaatag tttaattata 9060
ggtgttcatc aatcgaaaaa gcaacgtatc ttatttaaag tgcgttgctt ttttctcatt 9120
tataaggtta aataattctc atatatcaag caaagtgaca ggcgccctta aatattctga 9180
caaatgctct ttccctaaac tccccccata aaaaaacccg ccgaagcggg tttttacgtt 9240
atttgcggat taacgattac tcgttatcag aaccgcccag ggggcccgag cttaagactg 9300
gccgtcgttt tacaacacag aaagagtttg tagaaacgca aaaaggccat ccgtcagggg 9360
ccttctgctt agtttgatgc ctggcagttc cctactctcg ccttccgctt cctcgctcac 9420
tgactcgctg cgctcggtcg ttcggctgcg gcgagcggta tcagctcact caaaggcggt 9480
aatacggtta tccacagaat caggggataa cgcaggaaag aacatgtgag caaaaggcca 9540
gcaaaaggcc aggaaccgta aaaaggccgc gttgctggcg tttttccata ggctccgccc 9600
ccctgacgag catcacaaaa atcgacgctc aagtcagagg tggcgaaacc cgacaggact 9660
ataaagatac caggcgtttc cccctggaag ctccctcgtg cgctctcctg ttccgaccct 9720
gccgcttacc ggatacctgt ccgcctttct cccttcggga agcgtggcgc tttctcatag 9780
ctcacgctgt aggtatctca gttcggtgta ggtcgttcgc tccaagctgg gctgtgtgca 9840
cgaacccccc gttcagcccg accgctgcgc cttatccggt aactatcgtc ttgagtccaa 9900
cccggtaaga cacgacttat cgccactggc agcagccact ggtaacagga ttagcagagc 9960
gaggtatgta ggcggtgcta cagagttctt gaagtggtgg gctaactacg gctacactag 10020
aagaacagta tttggtatct gcgctctgct gaagccagtt accttcggaa aaagagttgg 10080
tagctcttga tccggcaaac aaaccaccgc tggtagcggt ggtttttttg tttgcaagca 10140
gcagattacg cgcagaaaaa aaggatctca agaagatcct ttgatctttt ctacggggtc 10200
tgacgctcag tggaacgacg cgcgcgtaac tcacgttaag ggattttggt catgagcttg 10260
cgccgtcccg tcaagtcagc gtaatgctct gcttttagaa aaactcatcg agcatcaaat 10320
gaaactgcaa tttattcata tcaggattat caataccata tttttgaaaa agccgtttct 10380
gtaatgaagg agaaaactca ccgaggcagt tccataggat ggcaagatcc tggtatcggt 10440
ctgcgattcc gactcgtcca acatcaatac aacctattaa tttcccctcg tcaaaaataa 10500
ggttatcaag tgagaaatca ccatgagtga cgactgaatc cggtgagaat ggcaaaagtt 10560
tatgcatttc tttccagact tgttcaacag gccagccatt acgctcgtca tcaaaatcac 10620
tcgcatcaac caaaccgtta ttcattcgtg attgcgcctg agcgaggcga aatacgcgat 10680
cgctgttaaa aggacaatta caaacaggaa tcgagtgcaa ccggcgcagg aacactgcca 10740
gcgcatcaac aatattttca cctgaatcag gatattcttc taatacctgg aacgctgttt 10800
ttccggggat cgcagtggtg agtaaccatg catcatcagg agtacggata aaatgcttga 10860
tggtcggaag tggcataaat tccgtcagcc agtttagtct gaccatctca tctgtaacat 10920
cattggcaac gctacctttg ccatgtttca gaaacaactc tggcgcatcg ggcttcccat 10980
acaagcgata gattgtcgca cctgattgcc cgacattatc gcgagcccat ttatacccat 11040
ataaatcagc atccatgttg gaatttaatc gcggcctcga cgtttcccgt tgaatatggc 11100
tcatattctt cctttttcaa tattattgaa gcatttatca gggttattgt ctcatgagcg 11160
gatacatatt tgaatgtatt tagaaaaata aacaaatagg ggtcagtgtt acaaccaatt 11220
aaccaattct gaacattatc gcgagcccat ttatacctga atatggctca taacacccct 11280
tgtttgcctg gcggcagtag cgcggtggtc ccacctgacc ccatgccgaa ctcagaagtg 11340
aaacgccgta gcgccgatgg tagtgtgggg actccccatg cgagagtagg gaactgccag 11400
gcatcaaata aaacgaaagg ctcagtcgaa agactgggcc tttcgcccgg gctaattagg 11460
gggtgtcgcc cttattcgac tctatagtga agttcctatt ctctagaaag tataggaact 11520
tctgaagt 11528
<210> 87
<211> 76
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 87
gggcggcacu uauacagcga agcauaaugg cuacugacgc ccucaaaccc uauuugcaga 60
cuauaagugu cgcgcg 76
<210> 88
<211> 73
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 88
gggcggcacu uauacagggu agcauaaugg cuuaggacgc cuucaaaccu aucaagacua 60
uaagugucgc gcg 73
<210> 89
<211> 75
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 89
gggcggcacu uauacagggu agcauaaugg gcuacuugac gccuucaccu auuuguagac 60
uauaaguguc gcgcg 75
<210> 90
<211> 76
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 90
gggcggcacu uauacagcgu agcauaaugg gcugcagacg ccgucaaacc uauuugcaga 60
cuauaagugu cgcgcg 76
<210> 91
<211> 74
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 91
gggcggcacu uauacaccgu agcauaaugg gcuacugccg ccgucgaccu uuuggagacu 60
auaagugucg cgcg 74
<210> 92
<211> 75
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 92
gggcggcacu uauacagguc agcauaaugu gcuagugcgc cuucaaaccu auuuagagac 60
uauaaguguc gcgcg 75
<210> 93
<211> 76
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 93
gggcggcacu uauacagcuu agcguaaugg cuacugacgc cguccaaacc uauuuacaga 60
cuauaagugu cgcgcg 76
<210> 94
<211> 76
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 94
gggcggcacu uauacagggg agcauaaugg gcuacugacg ccuuuaaacc uauuugagga 60
cuauaagugu cgcgcg 76
<210> 95
<211> 74
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 95
gggcggcacu uauacaugga agcauaaugg gcugccgacg gcccuuaacc uuuggagacu 60
auaagugucg cgcg 74
<210> 96
<211> 79
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 96
gggcggcacu uauacagauu agcauaaugg gcuacugacc ccgccggcaa accuauuuga 60
agacuauaag ugucgcgcg 79
<210> 97
<211> 75
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 97
gggcggcacu uauacagugu agcauaaugg gcuacugucg caucaaaccu auuuggagac 60
uauaaguguc gcgcg 75
<210> 98
<211> 76
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 98
gggcggcacu uauacaguga agcauaaugg gcuacugaca cccuuaaacc uauuugcaga 60
cuauaagugu cgcgcg 76
<210> 99
<211> 76
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 99
gggcggcacu uauacagagu agcauaaugg gcuacagacg ccgucaaacc uauuuaccga 60
cuauaagugu cgcgcg 76
<210> 100
<211> 75
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетический эволюционировавший аптамер
<400> 100
gggcggcacu uauacagggu gcauaauggg cuagugacgc cuucaaaccu auuuguagac 60
uauaaguguc gcgcg 75
<210> 101
<211> 461
<212> БЕЛОК
<213> Homo sapiens
<400> 101
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp
20 25 30
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val
35 40 45
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val
50 55 60
Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val
65 70 75 80
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
85 90 95
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly
100 105 110
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys
115 120 125
Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn
130 135 140
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val
145 150 155 160
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn
165 170 175
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln
180 185 190
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile
195 200 205
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr
210 215 220
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro
225 230 235 240
Ile Leu Leu Thr Ile Ser Lys Cys His Leu Ser Phe Phe Ser Val Ala
245 250 255
Leu Leu Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile Lys Pro
260 265 270
Ile Val Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu His Leu
275 280 285
Cys Lys Lys Pro Arg Lys Asn Leu Asn Val Ser Phe Asn Pro Glu Ser
290 295 300
Phe Leu Asp Cys Gln Ile His Arg Val Asp Asp Ile Gln Ala Arg Asp
305 310 315 320
Glu Val Glu Gly Phe Leu Gln Asp Thr Phe Pro Gln Gln Leu Glu Glu
325 330 335
Ser Glu Lys Gln Arg Leu Gly Gly Asp Val Gln Ser Pro Asn Cys Pro
340 345 350
Ser Glu Asp Val Val Val Thr Pro Glu Ser Phe Gly Arg Asp Ser Ser
355 360 365
Leu Thr Cys Leu Ala Gly Asn Val Ser Ala Cys Asp Ala Pro Ile Leu
370 375 380
Ser Ser Ser Arg Ser Leu Asp Cys Arg Glu Ser Gly Lys Asn Gly Pro
385 390 395 400
His Val Tyr Gln Asp Leu Leu Leu Ser Leu Gly Thr Thr Asn Ser Thr
405 410 415
Leu Pro Pro Pro Phe Ser Leu Gln Ser Gly Ile Leu Thr Leu Asn Pro
420 425 430
Val Ala Gln Gly Gln Pro Ile Leu Thr Ser Leu Gly Ser Asn Gln Glu
435 440 445
Glu Ala Tyr Val Thr Met Ser Ser Phe Tyr Gln Asn Gln
450 455 460
<210> 102
<211> 463
<212> БЕЛОК
<213> Homo sapiens
<400> 102
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp
20 25 30
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val
35 40 45
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val
50 55 60
Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val
65 70 75 80
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
85 90 95
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly
100 105 110
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys
115 120 125
Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn
130 135 140
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val
145 150 155 160
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn
165 170 175
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln
180 185 190
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile
195 200 205
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr
210 215 220
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro
225 230 235 240
Ile Phe Ser Cys Gly Pro Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser
245 250 255
Val Ala Leu Leu Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile
260 265 270
Lys Pro Ile Val Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu
275 280 285
His Leu Cys Lys Lys Pro Arg Lys Asn Leu Asn Val Ser Phe Asn Pro
290 295 300
Glu Ser Phe Leu Asp Cys Gln Ile His Arg Val Asp Asp Ile Gln Ala
305 310 315 320
Arg Asp Glu Val Glu Gly Phe Leu Gln Asp Thr Phe Pro Gln Gln Leu
325 330 335
Glu Glu Ser Glu Lys Gln Arg Leu Gly Gly Asp Val Gln Ser Pro Asn
340 345 350
Cys Pro Ser Glu Asp Val Val Val Thr Pro Glu Ser Phe Gly Arg Asp
355 360 365
Ser Ser Leu Thr Cys Leu Ala Gly Asn Val Ser Ala Cys Asp Ala Pro
370 375 380
Ile Leu Ser Ser Ser Arg Ser Leu Asp Cys Arg Glu Ser Gly Lys Asn
385 390 395 400
Gly Pro His Val Tyr Gln Asp Leu Leu Leu Ser Leu Gly Thr Thr Asn
405 410 415
Ser Thr Leu Pro Pro Pro Phe Ser Leu Gln Ser Gly Ile Leu Thr Leu
420 425 430
Asn Pro Val Ala Gln Gly Gln Pro Ile Leu Thr Ser Leu Gly Ser Asn
435 440 445
Gln Glu Glu Ala Tyr Val Thr Met Ser Ser Phe Tyr Gln Asn Gln
450 455 460
<210> 103
<211> 462
<212> БЕЛОК
<213> Homo sapiens
<400> 103
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp
20 25 30
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val
35 40 45
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val
50 55 60
Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val
65 70 75 80
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
85 90 95
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly
100 105 110
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys
115 120 125
Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn
130 135 140
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val
145 150 155 160
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn
165 170 175
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln
180 185 190
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile
195 200 205
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr
210 215 220
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro
225 230 235 240
Ile Leu Leu Thr Cys His Leu Ile Ser Ile Leu Ser Phe Phe Ser Val
245 250 255
Ala Leu Leu Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile Lys
260 265 270
Pro Ile Val Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu His
275 280 285
Leu Cys Lys Lys Pro Arg Lys Asn Leu Asn Val Ser Phe Asn Pro Glu
290 295 300
Ser Phe Leu Asp Cys Gln Ile His Arg Val Asp Asp Ile Gln Ala Arg
305 310 315 320
Asp Glu Val Glu Gly Phe Leu Gln Asp Thr Phe Pro Gln Gln Leu Glu
325 330 335
Glu Ser Glu Lys Gln Arg Leu Gly Gly Asp Val Gln Ser Pro Asn Cys
340 345 350
Pro Ser Glu Asp Val Val Val Thr Pro Glu Ser Phe Gly Arg Asp Ser
355 360 365
Ser Leu Thr Cys Leu Ala Gly Asn Val Ser Ala Cys Asp Ala Pro Ile
370 375 380
Leu Ser Ser Ser Arg Ser Leu Asp Cys Arg Glu Ser Gly Lys Asn Gly
385 390 395 400
Pro His Val Tyr Gln Asp Leu Leu Leu Ser Leu Gly Thr Thr Asn Ser
405 410 415
Thr Leu Pro Pro Pro Phe Ser Leu Gln Ser Gly Ile Leu Thr Leu Asn
420 425 430
Pro Val Ala Gln Gly Gln Pro Ile Leu Thr Ser Leu Gly Ser Asn Gln
435 440 445
Glu Glu Ala Tyr Val Thr Met Ser Ser Phe Tyr Gln Asn Gln
450 455 460
<210> 104
<211> 466
<212> БЕЛОК
<213> Homo sapiens
<400> 104
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp
20 25 30
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val
35 40 45
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val
50 55 60
Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val
65 70 75 80
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
85 90 95
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly
100 105 110
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys
115 120 125
Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn
130 135 140
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val
145 150 155 160
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn
165 170 175
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln
180 185 190
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile
195 200 205
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr
210 215 220
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro
225 230 235 240
Ile Leu Leu Thr Pro Pro Val Cys Ser Val Thr Ile Ser Ile Leu Ser
245 250 255
Phe Phe Ser Val Ala Leu Leu Val Ile Leu Ala Cys Val Leu Trp Lys
260 265 270
Lys Arg Ile Lys Pro Ile Val Trp Pro Ser Leu Pro Asp His Lys Lys
275 280 285
Thr Leu Glu His Leu Cys Lys Lys Pro Arg Lys Asn Leu Asn Val Ser
290 295 300
Phe Asn Pro Glu Ser Phe Leu Asp Cys Gln Ile His Arg Val Asp Asp
305 310 315 320
Ile Gln Ala Arg Asp Glu Val Glu Gly Phe Leu Gln Asp Thr Phe Pro
325 330 335
Gln Gln Leu Glu Glu Ser Glu Lys Gln Arg Leu Gly Gly Asp Val Gln
340 345 350
Ser Pro Asn Cys Pro Ser Glu Asp Val Val Val Thr Pro Glu Ser Phe
355 360 365
Gly Arg Asp Ser Ser Leu Thr Cys Leu Ala Gly Asn Val Ser Ala Cys
370 375 380
Asp Ala Pro Ile Leu Ser Ser Ser Arg Ser Leu Asp Cys Arg Glu Ser
385 390 395 400
Gly Lys Asn Gly Pro His Val Tyr Gln Asp Leu Leu Leu Ser Leu Gly
405 410 415
Thr Thr Asn Ser Thr Leu Pro Pro Pro Phe Ser Leu Gln Ser Gly Ile
420 425 430
Leu Thr Leu Asn Pro Val Ala Gln Gly Gln Pro Ile Leu Thr Ser Leu
435 440 445
Gly Ser Asn Gln Glu Glu Ala Tyr Val Thr Met Ser Ser Phe Tyr Gln
450 455 460
Asn Gln
465
<210> 105
<211> 523
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность Fc-delta-30
<400> 105
Met Ser Ile Met Gly Leu Lys Val Asn Val Ser Ala Ile Phe Met Ala
1 5 10 15
Val Leu Leu Thr Leu Gln Thr Pro Thr Gly Gln Ile His Trp Gly Asn
20 25 30
Leu Ser Lys Ile Gly Val Val Gly Ile Gly Ser Ala Ser Tyr Lys Val
35 40 45
Met Thr Arg Ser Ser His Gln Ser Leu Val Ile Lys Leu Met Pro Asn
50 55 60
Ile Thr Leu Leu Asn Asn Cys Thr Arg Val Glu Ile Ala Glu Tyr Arg
65 70 75 80
Arg Leu Leu Arg Thr Val Leu Glu Pro Ile Arg Asp Ala Leu Asn Ala
85 90 95
Met Thr Gln Asn Ile Arg Pro Val Gln Ser Val Ala Ser Ser Arg Arg
100 105 110
His Lys Arg Phe Ala Gly Val Val Leu Ala Gly Ala Ala Leu Gly Val
115 120 125
Ala Thr Ala Ala Gln Ile Thr Ala Gly Ile Ala Leu His Gln Ser Met
130 135 140
Leu Asn Ser Gln Ala Ile Asp Asn Leu Arg Ala Ser Leu Glu Thr Thr
145 150 155 160
Asn Gln Ala Ile Glu Ala Ile Arg Gln Ala Gly Gln Glu Met Ile Leu
165 170 175
Ala Val Gln Gly Val Gln Asp Tyr Ile Asn Asn Glu Leu Ile Pro Ser
180 185 190
Met Asn Gln Leu Ser Cys Asp Leu Ile Gly Gln Lys Leu Gly Leu Lys
195 200 205
Leu Leu Arg Tyr Tyr Thr Glu Ile Leu Ser Leu Phe Gly Pro Ser Leu
210 215 220
Arg Asp Pro Ile Ser Ala Glu Ile Ser Ile Gln Ala Leu Ser Tyr Ala
225 230 235 240
Leu Gly Gly Asp Ile Asn Lys Val Leu Glu Lys Leu Gly Tyr Ser Gly
245 250 255
Gly Asp Leu Leu Gly Ile Leu Glu Ser Arg Gly Ile Lys Ala Arg Ile
260 265 270
Thr His Val Asp Thr Glu Ser Tyr Phe Ile Val Leu Ser Ile Ala Tyr
275 280 285
Pro Thr Leu Ser Glu Ile Lys Gly Val Ile Val His Arg Leu Glu Gly
290 295 300
Val Ser Tyr Asn Ile Gly Ser Gln Glu Trp Tyr Thr Thr Val Pro Lys
305 310 315 320
Tyr Val Ala Thr Gln Gly Tyr Leu Ile Ser Asn Phe Asp Glu Ser Ser
325 330 335
Cys Thr Phe Met Pro Glu Gly Thr Val Cys Ser Gln Asn Ala Leu Tyr
340 345 350
Pro Met Ser Pro Leu Leu Gln Glu Cys Leu Arg Gly Ser Thr Lys Ser
355 360 365
Cys Ala Arg Thr Leu Val Ser Gly Ser Phe Gly Asn Arg Phe Ile Leu
370 375 380
Ser Gln Gly Asn Leu Ile Ala Asn Cys Ala Ser Ile Leu Cys Lys Cys
385 390 395 400
Tyr Thr Thr Gly Thr Ile Ile Asn Gln Asp Pro Asp Lys Ile Leu Thr
405 410 415
Tyr Ile Ala Ala Asp His Cys Pro Val Val Glu Val Asn Gly Val Thr
420 425 430
Ile Gln Val Gly Ser Arg Arg Tyr Pro Asp Ala Val Tyr Leu His Arg
435 440 445
Ile Asp Leu Gly Pro Pro Ile Ser Leu Glu Arg Leu Asp Val Gly Thr
450 455 460
Asn Leu Gly Asn Ala Ile Ala Lys Leu Glu Asp Ala Lys Glu Leu Leu
465 470 475 480
Glu Ser Ser Asp Gln Ile Leu Arg Ser Met Lys Gly Leu Ser Ser Thr
485 490 495
Ser Ile Val Tyr Ile Leu Ile Ala Val Cys Leu Gly Gly Leu Ile Gly
500 505 510
Ile Pro Ala Leu Ile Cys Cys Cys Arg Gly Arg
515 520
<210> 106
<211> 599
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность Hc-delta-18
<400> 106
Met Gly Ser Arg Ile Val Ile Asn Arg Glu His Leu Met Ile Asp Arg
1 5 10 15
Pro Tyr Val Leu Leu Ala Val Leu Phe Val Met Ser Leu Ser Leu Ile
20 25 30
Gly Leu Leu Ala Ile Ala Gly Ile Arg Leu His Arg Ala Ala Ile Tyr
35 40 45
Thr Ala Glu Ile His Lys Ser Leu Ser Thr Asn Leu Asp Val Thr Asn
50 55 60
Ser Ile Glu His Gln Val Lys Asp Val Leu Thr Pro Leu Phe Lys Ile
65 70 75 80
Ile Gly Asp Glu Val Gly Leu Arg Thr Pro Gln Arg Phe Thr Asp Leu
85 90 95
Val Lys Phe Ile Ser Asp Lys Ile Lys Phe Leu Asn Pro Asp Arg Glu
100 105 110
Tyr Asp Phe Arg Asp Leu Thr Trp Cys Ile Asn Pro Pro Glu Arg Ile
115 120 125
Lys Leu Asp Tyr Asp Gln Tyr Cys Ala Asp Val Ala Ala Glu Glu Leu
130 135 140
Met Asn Ala Leu Val Asn Ser Thr Leu Leu Glu Thr Arg Thr Thr Asn
145 150 155 160
Gln Phe Leu Ala Val Ser Lys Gly Asn Cys Ser Gly Pro Thr Thr Ile
165 170 175
Arg Gly Gln Phe Ser Asn Met Ser Leu Ser Leu Leu Asp Leu Tyr Leu
180 185 190
Ser Arg Gly Tyr Asn Val Ser Ser Ile Val Thr Met Thr Ser Gln Gly
195 200 205
Met Tyr Gly Gly Thr Tyr Leu Val Glu Lys Pro Asn Leu Ser Ser Lys
210 215 220
Arg Ser Glu Leu Ser Gln Leu Ser Met Tyr Arg Val Phe Glu Val Gly
225 230 235 240
Val Ile Arg Asn Pro Gly Leu Gly Ala Pro Val Phe His Met Thr Asn
245 250 255
Tyr Leu Glu Gln Pro Val Ser Asn Asp Leu Ser Asn Cys Met Val Ala
260 265 270
Leu Gly Glu Leu Lys Leu Ala Ala Leu Cys His Gly Glu Asp Ser Ile
275 280 285
Thr Ile Pro Tyr Gln Gly Ser Gly Lys Gly Val Ser Phe Gln Leu Val
290 295 300
Lys Leu Gly Val Trp Lys Ser Pro Thr Asp Met Gln Ser Trp Val Pro
305 310 315 320
Leu Ser Thr Asp Asp Pro Val Ile Asp Arg Leu Tyr Leu Ser Ser His
325 330 335
Arg Gly Val Ile Ala Asp Asn Gln Ala Lys Trp Ala Val Pro Thr Thr
340 345 350
Arg Thr Asp Asp Lys Leu Arg Met Glu Thr Cys Phe Gln Gln Ala Cys
355 360 365
Lys Gly Lys Ile Gln Ala Leu Cys Glu Asn Pro Glu Trp Ala Pro Leu
370 375 380
Lys Asp Asn Arg Ile Pro Ser Tyr Gly Val Leu Ser Val Asp Leu Ser
385 390 395 400
Leu Thr Val Glu Leu Lys Ile Lys Ile Ala Ser Gly Phe Gly Pro Leu
405 410 415
Ile Thr His Gly Ser Gly Met Asp Leu Tyr Lys Ser Asn His Asn Asn
420 425 430
Val Tyr Trp Leu Thr Ile Pro Pro Met Lys Asn Leu Ala Leu Gly Val
435 440 445
Ile Asn Thr Leu Glu Trp Ile Pro Arg Phe Lys Val Ser Pro Asn Leu
450 455 460
Phe Thr Val Pro Ile Lys Glu Ala Gly Glu Asp Cys His Ala Pro Thr
465 470 475 480
Tyr Leu Pro Ala Glu Val Asp Gly Asp Val Lys Leu Ser Ser Asn Leu
485 490 495
Val Ile Leu Pro Gly Gln Asp Leu Gln Tyr Val Leu Ala Thr Tyr Asp
500 505 510
Thr Ser Arg Val Glu His Ala Val Val Tyr Tyr Val Tyr Ser Pro Gly
515 520 525
Arg Ser Phe Ser Tyr Phe Tyr Pro Phe Arg Leu Pro Ile Lys Gly Val
530 535 540
Pro Ile Glu Leu Gln Val Glu Cys Phe Thr Trp Asp Gln Lys Leu Trp
545 550 555 560
Cys Arg His Phe Cys Val Leu Ala Asp Ser Glu Ser Gly Gly His Ile
565 570 575
Thr His Ser Gly Met Val Gly Met Gly Val Ser Cys Thr Val Thr Arg
580 585 590
Glu Asp Gly Thr Asn Arg Arg
595
<210> 107
<211> 529
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность слияния DAFss-IL7-DAF
<400> 107
Met Thr Val Ala Arg Pro Ser Val Pro Ala Ala Leu Pro Leu Leu Gly
1 5 10 15
Glu Leu Pro Arg Leu Leu Leu Leu Val Leu Leu Cys Leu Pro Ala Asp
20 25 30
Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser Val Leu Met
35 40 45
Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile Gly Ser Asn
50 55 60
Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile Cys Asp Ala
65 70 75 80
Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys Leu Arg Gln
85 90 95
Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His Leu Leu Lys
100 105 110
Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly Gln Val Lys
115 120 125
Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr Lys Ser Leu
130 135 140
Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn Asp Leu Cys
145 150 155 160
Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp Asn Lys Ile
165 170 175
Leu Met Gly Thr Lys Glu His Cys Gly Leu Pro Pro Asp Val Pro Asn
180 185 190
Ala Gln Pro Ala Leu Glu Gly Arg Thr Ser Phe Pro Glu Asp Thr Val
195 200 205
Ile Thr Tyr Lys Cys Glu Glu Ser Phe Val Lys Ile Pro Gly Glu Lys
210 215 220
Asp Ser Val Ile Cys Leu Lys Gly Ser Gln Trp Ser Asp Ile Glu Glu
225 230 235 240
Phe Cys Asn Arg Ser Cys Glu Val Pro Thr Arg Leu Asn Ser Ala Ser
245 250 255
Leu Lys Gln Pro Tyr Ile Thr Gln Asn Tyr Phe Pro Val Gly Thr Val
260 265 270
Val Glu Tyr Glu Cys Arg Pro Gly Tyr Arg Arg Glu Pro Ser Leu Ser
275 280 285
Pro Lys Leu Thr Cys Leu Gln Asn Leu Lys Trp Ser Thr Ala Val Glu
290 295 300
Phe Cys Lys Lys Lys Ser Cys Pro Asn Pro Gly Glu Ile Arg Asn Gly
305 310 315 320
Gln Ile Asp Val Pro Gly Gly Ile Leu Phe Gly Ala Thr Ile Ser Phe
325 330 335
Ser Cys Asn Thr Gly Tyr Lys Leu Phe Gly Ser Thr Ser Ser Phe Cys
340 345 350
Leu Ile Ser Gly Ser Ser Val Gln Trp Ser Asp Pro Leu Pro Glu Cys
355 360 365
Arg Glu Ile Tyr Cys Pro Ala Pro Pro Gln Ile Asp Asn Gly Ile Ile
370 375 380
Gln Gly Glu Arg Asp His Tyr Gly Tyr Arg Gln Ser Val Thr Tyr Ala
385 390 395 400
Cys Asn Lys Gly Phe Thr Met Ile Gly Glu His Ser Ile Tyr Cys Thr
405 410 415
Val Asn Asn Asp Glu Gly Glu Trp Ser Gly Pro Pro Pro Glu Cys Arg
420 425 430
Gly Lys Ser Leu Thr Ser Lys Val Pro Pro Thr Val Gln Lys Pro Thr
435 440 445
Thr Val Asn Val Pro Thr Thr Glu Val Ser Pro Thr Ser Gln Lys Thr
450 455 460
Thr Thr Lys Thr Thr Thr Pro Asn Ala Gln Ala Thr Arg Ser Thr Pro
465 470 475 480
Val Ser Arg Thr Thr Lys His Phe His Glu Thr Thr Pro Asn Lys Gly
485 490 495
Ser Gly Thr Thr Ser Gly Thr Thr Arg Leu Leu Ser Gly His Thr Cys
500 505 510
Phe Thr Leu Thr Gly Leu Leu Gly Thr Leu Val Thr Met Gly Leu Leu
515 520 525
Thr
<210> 108
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-1
<400> 108
acagcttagc gtaatggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 109
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-2
<400> 109
acagcttagg ataatggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 110
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-3
<400> 110
acagcttagc ataatggcta ctgacgccgt ccaaacctat tcacagact 49
<210> 111
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-4
<400> 111
acagcttagc ataatggcta ctgacgccgt ccaaacctat tgacagact 49
<210> 112
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-5
<400> 112
acagcatagc ataatggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 113
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-6
<400> 113
acagcttagc ataatggcta ctgacgccgt ccaaacctat gtacagact 49
<210> 114
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-7
<400> 114
acagctagcg taatggctac tgacgccgtc caaacctatt tacagact 48
<210> 115
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-8
<400> 115
acagcttagc attatggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 116
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-9
<400> 116
acagttagca taatggctac tgacgccgtc caaacctatt tacagact 48
<210> 117
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-10
<400> 117
acagcttagc ataatggcta ctgacgcggt ccaaacctat ttacagact 49
<210> 118
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-11
<400> 118
acagcttagc ttaatggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 119
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-12
<400> 119
acagcttagc ataatggcta ctgacgccgt ccaaacccat ttacagact 49
<210> 120
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-13
<400> 120
acagcttagc ataatggcta ctgacgccgt ccaaaccaat ttacagact 49
<210> 121
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-14
<400> 121
acagcttagc ataatggata ctgacgccgt ccaaacctat ttacagact 49
<210> 122
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-15
<400> 122
acagcttagc attgtggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 123
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-16
<400> 123
acaggttagc ataatggcta ccgacgccgt ccaaacctat ttacagact 49
<210> 124
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-17
<400> 124
acagcttagc gtaatggcta ctgacgccgc ccaaacctat ttacagact 49
<210> 125
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-18
<400> 125
acagcttagc ataatggcta ctgacgccgt ccaaaactat ttccagact 49
<210> 126
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-19
<400> 126
acagcctagc ataagggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 127
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-20
<400> 127
acagcttagc ataatggcta ctgaggccgt ccaaacctat ttacagact 49
<210> 128
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-21
<400> 128
acagcttacc ttaatggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 129
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-22
<400> 129
acagcttagc ataatggcta ccgacgctgt ccaaacctat ttacagact 49
<210> 130
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-23
<400> 130
acagcttagc gtaatggcta ctggcgccgt ccaaacctat ttacagact 49
<210> 131
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-24
<400> 131
acagcttagc atactggcta ctgacgccgc ccaaacctat ttacagact 49
<210> 132
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-25
<400> 132
acagcttagc ataatggcta ctgacgccgt cctaacctat ttacagact 49
<210> 133
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-26
<400> 133
acaggttagc ataatgccta ctgacgccgt ccaaacctat ttacagact 49
<210> 134
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-27
<400> 134
acagcttagc ataattgcta ctgacgccgt tcaaacctat ttacagact 49
<210> 135
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-28
<400> 135
acagcttagc ataaaggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 136
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-29
<400> 136
acagcttagc gtaatggcta ctgacgccgt ctaaacctat ttccagact 49
<210> 137
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-30
<400> 137
acaggttagc ataatggcta ctgacgccgt ccaaacctat ttagagact 49
<210> 138
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-31
<400> 138
acagggtagc gtaatggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 139
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-32
<400> 139
acagcgtagc ataatggcta ctgacgccgt tcaaacctat ttacagact 49
<210> 140
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-33
<400> 140
acagcttagc ataatggcta ctgacgccgt ccaaactcat ttacagact 49
<210> 141
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-34
<400> 141
acagcgtagc atagtggcta ctgacgccgt ccaaacctat ttacagact 49
<210> 142
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-35
<400> 142
acagcttagt gtaatggcta ctgacgctgt ccaaacctat ttacagact 49
<210> 143
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-36
<400> 143
acagcttagc ataatggcta ctgacggcgt tcaaacctat ttacagact 49
<210> 144
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-37
<400> 144
acaggttagc ataatggcta ctgacgccgt ccaaacctat ttatagact 49
<210> 145
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-38
<400> 145
acagcttagc ataatggcta ctgacgccgt ccaaacctat tgtcgact 48
<210> 146
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 582-39
<400> 146
acagcttagc ataatggcta ctgacgccgt ccaaacctat ttacgact 48
<210> 147
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-1
<400> 147
acaggtcagc ataatgtgct agtgcgcctt caaacctatt tagagact 48
<210> 148
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-2
<400> 148
acaggtcagc ataatgtgct agtgcgccct caaacctatt tagagact 48
<210> 149
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-3
<400> 149
acaggttagc ataatgtgct attgcgcctt caaacctatt tagagact 48
<210> 150
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-4
<400> 150
acaggtcagc ataatgtgct agtgcgcatt caaacctatt tagagact 48
<210> 151
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-5
<400> 151
acaggttagc ataatgtgct agtgcgcctt caaacctatt ttgagact 48
<210> 152
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-6
<400> 152
acaggttatc ataatgtgct agtgcgcctt caaacctatt tagagact 48
<210> 153
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-7
<400> 153
acaggttagc atgatgtgct agtgcgcctt caaacctatt tagagact 48
<210> 154
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-8
<400> 154
acaggttagc ataatgggct agtgcgcctt caaacctatt tagagact 48
<210> 155
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-9
<400> 155
acaggtcagc aaaatgtgca agtgcgcctt caaacctatt tagagact 48
<210> 156
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-10
<400> 156
acaggtcagc ataatgtgct agtgcgcctt caaacctatc tggagact 48
<210> 157
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-11
<400> 157
acagcttagc ataatgtgct agtgcgcctt caaacctatt tagagact 48
<210> 158
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-12
<400> 158
acaggtcagc ataatgtgct agtgcgcctt caaacctatt tacagact 48
<210> 159
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-13
<400> 159
acaggtcagc ataatgtgct agtgcgcctt caaacatatt tagagact 48
<210> 160
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-14
<400> 160
acagggtagc ataatgtgct agtgcgcctt caaacctatt tagagact 48
<210> 161
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-15
<400> 161
acaggttagc ataatgtgct agtgcgccct caaacctatt tagagact 48
<210> 162
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-16
<400> 162
acaggttagc ataatgtgcc agtgcgcctt caaacctatt tagagact 48
<210> 163
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 769-17
<400> 163
acaggtcagc ataatgggct agtgcgcctt caaacctatt tagagact 48
<210> 164
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-1
<400> 164
acagcgaagc ataatggcta ctgacgccct caaaccctat ttgcagact 49
<210> 165
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-2
<400> 165
acagcgaagc ataatggcta ctgacgccct caaaccctat ttacagact 49
<210> 166
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-3
<400> 166
acagcgaagc ataatggctt ctgacgccct caaaccctat ttgcagact 49
<210> 167
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-4
<400> 167
acagccaagc atactggcta ctgacgccct caaaccctat ttgcagact 49
<210> 168
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-5
<400> 168
acagcgaagc ataatggcta ctgacgcccg caaaccctat ttgcagact 49
<210> 169
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-6
<400> 169
acagcgaagc ataatggcta ctgacggcct caaaccctat ttgcagact 49
<210> 170
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-7
<400> 170
acagcgaggc ataatggcta ctgacgccct caaaccctat ttgcagact 49
<210> 171
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-8
<400> 171
acagcgaagc ataatggcta ctgacgcctt caaaccctat ttgcagact 49
<210> 172
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-9
<400> 172
acagcgaagc ataatggcta cagacgccct caaaacctat ttgcagact 49
<210> 173
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-10
<400> 173
acagcgaagc ataatggcta ctgacgccct caaaccctat ttgagact 48
<210> 174
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-11
<400> 174
acagcgaagc ataatggcta ctgacgccct caaaccctat tgtcgact 48
<210> 175
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-12
<400> 175
acagccaagc ataatggcta ctgacgccct caaaccctat ttgcagact 49
<210> 176
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-13
<400> 176
acagcgaagc ataatggcta ctgacgccct caaaccctat ttggcgact 49
<210> 177
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-14
<400> 177
acagcgaagc ataatgtcta ctgacgccct caaaccctat ttgcagact 49
<210> 178
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-15
<400> 178
acagcgaagc ataatggcta ctgacgccgt caaaccctat ttgtagact 49
<210> 179
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-16
<400> 179
acagcgaagc ataatggcta ctgacgccct caaaccttat ttgcagact 49
<210> 180
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-17
<400> 180
acaggtagca taatggctac tgacgccctc aaaccctatt tgcagact 48
<210> 181
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-18
<400> 181
acagcgaagc ataatggcta ctgacgccct caaaccctat ttctagact 49
<210> 182
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 795-19
<400> 182
acagcgaagc ataatggcta ctgacgccct caaaccctat ttgtagact 49
<210> 183
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-1
<400> 183
acagggtagc ataatgggct acttgacgcc ttcacctatt tgtagact 48
<210> 184
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-2
<400> 184
acagggtagc ataatgggct acttgacgcc ttcacctatt tgagact 47
<210> 185
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-3
<400> 185
acagggtagc ataatgggct actttacgcc ttcacctatt tgtagact 48
<210> 186
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-4
<400> 186
acagggtagc ataatgggct acttgacgcc ttcacctatt tctagact 48
<210> 187
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-5
<400> 187
acagggtagc ataatgggct acttgacgcc ttcacctatt tggagact 48
<210> 188
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-6
<400> 188
acagggtagc atagtgggct acttgacgcc ttcacctatt tgtagact 48
<210> 189
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-7
<400> 189
acagggtagc atgatgggct acttgacgcc ttcacctatt tgtagact 48
<210> 190
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-8
<400> 190
acagggtagc ataatgggct acttgacgcc ttcacctatt agtagact 48
<210> 191
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-9
<400> 191
acagggtagc ataatgggct atttgacgcc ttcacctatt tgtagact 48
<210> 192
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-10
<400> 192
acagggtagc ataatgggct acttgccgcc ttcacctatt tgtagact 48
<210> 193
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-11
<400> 193
acagtgtagc ataattggct acttgacgcc ttcacctatt tgtagact 48
<210> 194
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-12
<400> 194
acagggtagc ataatgggct acttgacgct ttcacctttt tgtagact 48
<210> 195
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-13
<400> 195
acagggtagc ataaggggct acttgacgcc ttcacctatt tgtagact 48
<210> 196
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-14
<400> 196
acagggtagc ataatggact acttgacgcc tccacctatt tgtagact 48
<210> 197
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 935-15
<400> 197
acagggtagc ataatgggct acttgtcgcc ttcacctatt tgtagact 48
<210> 198
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-1
<400> 198
acagcgtagc ataatgggct gcagacgccg tcaaacctat ttgcagact 49
<210> 199
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-2
<400> 199
acagcgtagc ataatgggct gcagacgcag tcaaacctat ttgcagact 49
<210> 200
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-3
<400> 200
acatgtagca taatgggcta ctgacgccgt caaacctatt tgcagact 48
<210> 201
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-4
<400> 201
acagcgtagc atagtgggct gcagacgccg tcaaacctat ttgcagact 49
<210> 202
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-5
<400> 202
acagtgtagc ataatgggct gcagacgcct tcaaacctat ttggagact 49
<210> 203
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-6
<400> 203
acagtgtagc ataatgggct gctgacgccg tcaaacctat ttgaagact 49
<210> 204
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-7
<400> 204
acagcgtagc ataatgggct acaggcgccg tcaaacctat ttgcagact 49
<210> 205
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-8
<400> 205
acagcgtagc ataatgggct actggcgccg tcaaacctat ttgcagact 49
<210> 206
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-9
<400> 206
acagcgtagc ataatgggct gcagacgccg tcaaacctat ttgagact 48
<210> 207
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-10
<400> 207
acaggtagca taatgggctg cagacgccgt caaacctatt tgcagact 48
<210> 208
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-11
<400> 208
acaggtagca taatgggctg ctgacgccgt caaacctatt tacagact 48
<210> 209
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-12
<400> 209
acagcgtagc atattgggct gcagacgccg tcaaacctat ttgcagact 49
<210> 210
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-13
<400> 210
acagcgtagc ataatgggct gcagacgcct tcaaacctat ttggagact 49
<210> 211
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-14
<400> 211
acagtgtagc ataatgggct gcagacgccg tcaaacctat ttgagact 48
<210> 212
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-15
<400> 212
acagcgtagc ataatgggct gctgacgccg tcaaacctat ttggagact 49
<210> 213
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-16
<400> 213
acagcgtagc ataatgggct gcagacgccg tcaaacctat ttacagact 49
<210> 214
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-17
<400> 214
acagcgtagc ataatgggct gctgacgccg tcaaacctat ttgcagact 49
<210> 215
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-18
<400> 215
acagggtagc ataatgggct gcagacgccg tcaaacctat ttggagact 49
<210> 216
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-19
<400> 216
acagcgtagc ataatgggct acagacgccg tcaaacctat ttgcagact 49
<210> 217
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-20
<400> 217
acagcgtcgc ataatgggct gcagacgccg tcaaatctat ttgcagact 49
<210> 218
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-21
<400> 218
acagcgtagc ataatgggct tcagacgccg tcaaacctat ttgcagact 49
<210> 219
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 946-22
<400> 219
acatgtagca taatgggctg cagacgccgt caaacctatt tggagact 48
<210> 220
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 961-1
<400> 220
acaccgtagc ataatgggct actgccgccg tcgacctttt ggagact 47
<210> 221
<211> 46
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность 996-1
<400> 221
acagggtagc ataatggctt aggacgcctt caaacctatc aagact 46
<210> 222
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая консенсусная последовательность семейства 582
<220>
<221> misc_feature
<222> (5)..(5)
<223> n в положении 5 может представлять собой C, G или не нуклеотид
<220>
<221> misc_feature
<222> (6)..(6)
<223> n в положении 6 может представлять собой A, C, G, T или не нуклеотид
<220>
<221> misc_feature
<222> (45)..(45)
<223> n в положении 45 может представлять собой A или не нуклеотид
<400> 222
acagnntasb dtwvdksmta cygrsgsbgy yywaamyhat kbhbngact 49
<210> 223
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая консенсусная последовательность семейства 769
<400> 223
acagskyakc awratgkgch aktgcgcmyt caaacmtaty tdsagact 48
<210> 224
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая консенсусная последовательность семейства 795
<220>
<221> misc_feature
<222> (5)..(5)
<223> n в положении 5 может представлять собой C или не нуклеотид
<220>
<221> misc_feature
<222> (40)..(40)
<223> n в положении 40 может представлять собой T или не нуклеотид
<220>
<221> misc_feature
<222> (44)..(44)
<223> n в положении 44 может представлять собой C, G, T или не нуклеотид
<400> 224
acagnswrgc atamtgkctw cwgacgscbk caaamcytan ttvnmgact 49
<210> 225
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая консенсусная последовательность семейства 935
<220>
<221> misc_feature
<222> (43)..(43)
<223> n в положении 43 может представлять собой G, T, или не нуклеотид
<400> 225
acagkgtcgc atrrkkgrct ayttkhcgcy tycacctwtt wsnagact 48
<210> 226
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая консенсусная последовательность семейства 946
<220>
<221> misc_feature
<222> (4)..(4)
<223> n в положении 4 может представлять собой G или не нуклеотид
<220>
<221> misc_feature
<222> (5)..(5)
<223> n в положении 5 может представлять собой C, G, T, или не нуклеотид
<220>
<221> misc_feature
<222> (44)..(44)
<223> n в положении 44 может представлять собой A, C, G, или не нуклеотид
<400> 226
acanngtmgc atadtgggct dcwgrcgcmk tcaaayctat ttРНКgact 49
<210> 227
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический нацеленный на мембрану домен Src-Flag-Vpx
<400> 227
Met Gly Ser Ser Lys Ser Lys Pro Lys Asp Pro
1 5 10
<210> 228
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический вирусный домен расщепления протеазой
<400> 228
Lys Ala Arg Val Leu Ala Glu Ala
1 5
<210> 229
<211> 458
<212> БЕЛОК
<213> Homo sapiens
<400> 229
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp
20 25 30
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val
35 40 45
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val
50 55 60
Asn Ile Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val
65 70 75 80
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
85 90 95
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly
100 105 110
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys
115 120 125
Pro Glu Ala Pro Phe Asp Leu Ser Val Val Tyr Arg Glu Gly Ala Asn
130 135 140
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val
145 150 155 160
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn
165 170 175
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln
180 185 190
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile
195 200 205
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr
210 215 220
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro
225 230 235 240
Ile Leu Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser Val Ala Leu Leu
245 250 255
Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile Lys Pro Ile Val
260 265 270
Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu His Leu Cys Lys
275 280 285
Lys Pro Arg Lys Asn Leu Asn Val Ser Phe Asn Pro Glu Ser Phe Leu
290 295 300
Asp Cys Gln Ile His Arg Val Asp Asp Ile Gln Ala Arg Asp Glu Val
305 310 315 320
Glu Gly Phe Leu Gln Asp Thr Phe Pro Gln Gln Leu Glu Glu Ser Glu
325 330 335
Lys Gln Arg Leu Gly Gly Asp Val Gln Ser Pro Asn Cys Pro Ser Glu
340 345 350
Asp Val Val Ile Thr Pro Glu Ser Phe Gly Arg Asp Ser Ser Leu Thr
355 360 365
Cys Leu Ala Gly Asn Val Ser Ala Cys Asp Ala Pro Ile Leu Ser Ser
370 375 380
Ser Arg Ser Leu Asp Cys Arg Glu Ser Gly Lys Asn Gly Pro His Val
385 390 395 400
Tyr Gln Asp Leu Leu Leu Ser Leu Gly Thr Thr Asn Ser Thr Leu Pro
405 410 415
Pro Pro Phe Ser Leu Gln Ser Gly Ile Leu Thr Leu Asn Pro Val Ala
420 425 430
Gln Gly Gln Pro Ile Leu Thr Ser Leu Gly Ser Asn Gln Glu Glu Ala
435 440 445
Tyr Val Thr Met Ser Ser Phe Tyr Gln Asn
450 455
<210> 230
<211> 723
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический GFP - линкер - P2A - кодон IL7Ra IncPPCL (за исключением P2A) и сплайсинг-оптимизированный
<400> 230
Met Ser Gly Gly Glu Glu Leu Phe Ala Gly Ile Val Pro Val Leu Ile
1 5 10 15
Glu Leu Asp Gly Asp Val His Gly His Lys Phe Ser Val Arg Gly Glu
20 25 30
Gly Glu Gly Asp Ala Asp Tyr Gly Lys Leu Glu Ile Lys Phe Ile Cys
35 40 45
Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr Leu
50 55 60
Cys Tyr Gly Ile Gln Cys Phe Ala Arg Tyr Pro Glu His Met Lys Met
65 70 75 80
Asn Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Ile Gln Glu Arg
85 90 95
Thr Ile Gln Phe Gln Asp Asp Gly Lys Tyr Lys Thr Arg Gly Glu Val
100 105 110
Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly Lys
115 120 125
Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr Ser
130 135 140
Phe Asn Ser His Asn Val Tyr Ile Arg Pro Asp Lys Ala Asn Asn Gly
145 150 155 160
Leu Glu Ala Asn Phe Lys Thr Arg His Asn Ile Glu Gly Gly Gly Val
165 170 175
Gln Leu Ala Asp His Tyr Gln Thr Asn Val Pro Leu Gly Asp Gly Pro
180 185 190
Val Leu Ile Pro Ile Asn His Tyr Leu Ser Thr Gln Thr Lys Ile Ser
195 200 205
Lys Asp Arg Asn Glu Ala Arg Asp His Met Val Leu Leu Glu Ser Phe
210 215 220
Ser Ala Cys Cys His Thr His Gly Met Asp Glu Leu Tyr Arg Gly Ser
225 230 235 240
Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu
245 250 255
Asn Pro Gly Pro Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe
260 265 270
Ser Leu Leu Gln Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly
275 280 285
Asp Leu Glu Asp Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser
290 295 300
Gln Leu Glu Val Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu
305 310 315 320
Asp Pro Asp Val Asn Ile Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala
325 330 335
Leu Val Glu Val Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr
340 345 350
Phe Ile Glu Thr Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys
355 360 365
Val Lys Val Gly Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr
370 375 380
Thr Ile Val Lys Pro Glu Ala Pro Phe Asp Leu Ser Val Val Tyr Arg
385 390 395 400
Glu Gly Ala Asn Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln
405 410 415
Lys Lys Tyr Val Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu
420 425 430
Lys Asp Glu Asn Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu
435 440 445
Thr Leu Leu Gln Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys
450 455 460
Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp
465 470 475 480
Ser Pro Ser Tyr Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly
485 490 495
Glu Met Asp Pro Ile Leu Leu Pro Pro Cys Leu Thr Ile Ser Ile Leu
500 505 510
Ser Phe Phe Ser Val Ala Leu Leu Val Ile Leu Ala Cys Val Leu Trp
515 520 525
Lys Lys Arg Ile Lys Pro Ile Val Trp Pro Ser Leu Pro Asp His Lys
530 535 540
Lys Thr Leu Glu His Leu Cys Lys Lys Pro Arg Lys Asn Leu Asn Val
545 550 555 560
Ser Phe Asn Pro Glu Ser Phe Leu Asp Cys Gln Ile His Arg Val Asp
565 570 575
Asp Ile Gln Ala Arg Asp Glu Val Glu Gly Phe Leu Gln Asp Thr Phe
580 585 590
Pro Gln Gln Leu Glu Glu Ser Glu Lys Gln Arg Leu Gly Gly Asp Val
595 600 605
Gln Ser Pro Asn Cys Pro Ser Glu Asp Val Val Ile Thr Pro Glu Ser
610 615 620
Phe Gly Arg Asp Ser Ser Leu Thr Cys Leu Ala Gly Asn Val Ser Ala
625 630 635 640
Cys Asp Ala Pro Ile Leu Ser Ser Ser Arg Ser Leu Asp Cys Arg Glu
645 650 655
Ser Gly Lys Asn Gly Pro His Val Tyr Gln Asp Leu Leu Leu Ser Leu
660 665 670
Gly Thr Thr Asn Ser Thr Leu Pro Pro Pro Phe Ser Leu Gln Ser Gly
675 680 685
Ile Leu Thr Leu Asn Pro Val Ala Gln Gly Gln Pro Ile Leu Thr Ser
690 695 700
Leu Gly Ser Asn Gln Glu Glu Ala Tyr Val Thr Met Ser Ser Phe Tyr
705 710 715 720
Gln Asn Gln
<210> 231
<211> 733
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический GFP - линкер - P2A - метка Myc - кодон IL7Ra IncPPCL (за исключением P2A) и сплайсинг-оптимизированный
<400> 231
Met Ser Gly Gly Glu Glu Leu Phe Ala Gly Ile Val Pro Val Leu Ile
1 5 10 15
Glu Leu Asp Gly Asp Val His Gly His Lys Phe Ser Val Arg Gly Glu
20 25 30
Gly Glu Gly Asp Ala Asp Tyr Gly Lys Leu Glu Ile Lys Phe Ile Cys
35 40 45
Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr Leu
50 55 60
Cys Tyr Gly Ile Gln Cys Phe Ala Arg Tyr Pro Glu His Met Lys Met
65 70 75 80
Asn Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Ile Gln Glu Arg
85 90 95
Thr Ile Gln Phe Gln Asp Asp Gly Lys Tyr Lys Thr Arg Gly Glu Val
100 105 110
Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly Lys
115 120 125
Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr Ser
130 135 140
Phe Asn Ser His Asn Val Tyr Ile Arg Pro Asp Lys Ala Asn Asn Gly
145 150 155 160
Leu Glu Ala Asn Phe Lys Thr Arg His Asn Ile Glu Gly Gly Gly Val
165 170 175
Gln Leu Ala Asp His Tyr Gln Thr Asn Val Pro Leu Gly Asp Gly Pro
180 185 190
Val Leu Ile Pro Ile Asn His Tyr Leu Ser Thr Gln Thr Lys Ile Ser
195 200 205
Lys Asp Arg Asn Glu Ala Arg Asp His Met Val Leu Leu Glu Ser Phe
210 215 220
Ser Ala Cys Cys His Thr His Gly Met Asp Glu Leu Tyr Arg Gly Ser
225 230 235 240
Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu
245 250 255
Asn Pro Gly Pro Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe
260 265 270
Ser Leu Leu Gln Val Val Ser Gly Glu Gln Lys Leu Ile Ser Glu Glu
275 280 285
Asp Leu Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp Ala Glu
290 295 300
Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val Asn Gly
305 310 315 320
Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val Asn Ile
325 330 335
Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val Lys Cys
340 345 350
Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys
355 360 365
Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly Glu Lys
370 375 380
Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys Pro Glu
385 390 395 400
Ala Pro Phe Asp Leu Ser Val Val Tyr Arg Glu Gly Ala Asn Asp Phe
405 410 415
Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val Lys Val
420 425 430
Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn Lys Trp
435 440 445
Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln Arg Lys
450 455 460
Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp
465 470 475 480
His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe
485 490 495
Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro Ile Leu
500 505 510
Leu Pro Pro Cys Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser Val Ala
515 520 525
Leu Leu Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile Lys Pro
530 535 540
Ile Val Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu His Leu
545 550 555 560
Cys Lys Lys Pro Arg Lys Asn Leu Asn Val Ser Phe Asn Pro Glu Ser
565 570 575
Phe Leu Asp Cys Gln Ile His Arg Val Asp Asp Ile Gln Ala Arg Asp
580 585 590
Glu Val Glu Gly Phe Leu Gln Asp Thr Phe Pro Gln Gln Leu Glu Glu
595 600 605
Ser Glu Lys Gln Arg Leu Gly Gly Asp Val Gln Ser Pro Asn Cys Pro
610 615 620
Ser Glu Asp Val Val Ile Thr Pro Glu Ser Phe Gly Arg Asp Ser Ser
625 630 635 640
Leu Thr Cys Leu Ala Gly Asn Val Ser Ala Cys Asp Ala Pro Ile Leu
645 650 655
Ser Ser Ser Arg Ser Leu Asp Cys Arg Glu Ser Gly Lys Asn Gly Pro
660 665 670
His Val Tyr Gln Asp Leu Leu Leu Ser Leu Gly Thr Thr Asn Ser Thr
675 680 685
Leu Pro Pro Pro Phe Ser Leu Gln Ser Gly Ile Leu Thr Leu Asn Pro
690 695 700
Val Ala Gln Gly Gln Pro Ile Leu Thr Ser Leu Gly Ser Asn Gln Glu
705 710 715 720
Glu Ala Tyr Val Thr Met Ser Ser Phe Tyr Gln Asn Gln
725 730
<210> 232
<211> 572
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический GFP - линкер - P2A - IL7RaSP - метка Myc - IL7RaIncPPCL C-концевой кодон усечения (за исключением P2A) и сплайсинг-оптимизированный
<400> 232
Met Ser Gly Gly Glu Glu Leu Phe Ala Gly Ile Val Pro Val Leu Ile
1 5 10 15
Glu Leu Asp Gly Asp Val His Gly His Lys Phe Ser Val Arg Gly Glu
20 25 30
Gly Glu Gly Asp Ala Asp Tyr Gly Lys Leu Glu Ile Lys Phe Ile Cys
35 40 45
Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr Leu
50 55 60
Cys Tyr Gly Ile Gln Cys Phe Ala Arg Tyr Pro Glu His Met Lys Met
65 70 75 80
Asn Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Ile Gln Glu Arg
85 90 95
Thr Ile Gln Phe Gln Asp Asp Gly Lys Tyr Lys Thr Arg Gly Glu Val
100 105 110
Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly Lys
115 120 125
Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr Ser
130 135 140
Phe Asn Ser His Asn Val Tyr Ile Arg Pro Asp Lys Ala Asn Asn Gly
145 150 155 160
Leu Glu Ala Asn Phe Lys Thr Arg His Asn Ile Glu Gly Gly Gly Val
165 170 175
Gln Leu Ala Asp His Tyr Gln Thr Asn Val Pro Leu Gly Asp Gly Pro
180 185 190
Val Leu Ile Pro Ile Asn His Tyr Leu Ser Thr Gln Thr Lys Ile Ser
195 200 205
Lys Asp Arg Asn Glu Ala Arg Asp His Met Val Leu Leu Glu Ser Phe
210 215 220
Ser Ala Cys Cys His Thr His Gly Met Asp Glu Leu Tyr Arg Gly Ser
225 230 235 240
Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu
245 250 255
Asn Pro Gly Pro Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe
260 265 270
Ser Leu Leu Gln Val Val Ser Gly Glu Gln Lys Leu Ile Ser Glu Glu
275 280 285
Asp Leu Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp Ala Glu
290 295 300
Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val Asn Gly
305 310 315 320
Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val Asn Ile
325 330 335
Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val Lys Cys
340 345 350
Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys
355 360 365
Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly Glu Lys
370 375 380
Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys Pro Glu
385 390 395 400
Ala Pro Phe Asp Leu Ser Val Val Tyr Arg Glu Gly Ala Asn Asp Phe
405 410 415
Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val Lys Val
420 425 430
Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn Lys Trp
435 440 445
Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln Arg Lys
450 455 460
Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp
465 470 475 480
His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe
485 490 495
Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro Ile Leu
500 505 510
Leu Pro Pro Cys Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser Val Ala
515 520 525
Leu Leu Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile Lys Pro
530 535 540
Ile Val Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu His Leu
545 550 555 560
Cys Lys Lys Pro Arg Lys Val Ser Val Phe Gly Ala
565 570
<210> 233
<211> 562
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический GFP - линкер - P2A - IL7RaSP - IL7RaIncPPCL C-концевой усеченный кодон (за исключением P2A) и сплайсинг-оптимизированный
<400> 233
Met Ser Gly Gly Glu Glu Leu Phe Ala Gly Ile Val Pro Val Leu Ile
1 5 10 15
Glu Leu Asp Gly Asp Val His Gly His Lys Phe Ser Val Arg Gly Glu
20 25 30
Gly Glu Gly Asp Ala Asp Tyr Gly Lys Leu Glu Ile Lys Phe Ile Cys
35 40 45
Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr Leu
50 55 60
Cys Tyr Gly Ile Gln Cys Phe Ala Arg Tyr Pro Glu His Met Lys Met
65 70 75 80
Asn Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Ile Gln Glu Arg
85 90 95
Thr Ile Gln Phe Gln Asp Asp Gly Lys Tyr Lys Thr Arg Gly Glu Val
100 105 110
Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly Lys
115 120 125
Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr Ser
130 135 140
Phe Asn Ser His Asn Val Tyr Ile Arg Pro Asp Lys Ala Asn Asn Gly
145 150 155 160
Leu Glu Ala Asn Phe Lys Thr Arg His Asn Ile Glu Gly Gly Gly Val
165 170 175
Gln Leu Ala Asp His Tyr Gln Thr Asn Val Pro Leu Gly Asp Gly Pro
180 185 190
Val Leu Ile Pro Ile Asn His Tyr Leu Ser Thr Gln Thr Lys Ile Ser
195 200 205
Lys Asp Arg Asn Glu Ala Arg Asp His Met Val Leu Leu Glu Ser Phe
210 215 220
Ser Ala Cys Cys His Thr His Gly Met Asp Glu Leu Tyr Arg Gly Ser
225 230 235 240
Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu
245 250 255
Asn Pro Gly Pro Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe
260 265 270
Ser Leu Leu Gln Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly
275 280 285
Asp Leu Glu Asp Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser
290 295 300
Gln Leu Glu Val Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu
305 310 315 320
Asp Pro Asp Val Asn Ile Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala
325 330 335
Leu Val Glu Val Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr
340 345 350
Phe Ile Glu Thr Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys
355 360 365
Val Lys Val Gly Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr
370 375 380
Thr Ile Val Lys Pro Glu Ala Pro Phe Asp Leu Ser Val Val Tyr Arg
385 390 395 400
Glu Gly Ala Asn Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln
405 410 415
Lys Lys Tyr Val Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu
420 425 430
Lys Asp Glu Asn Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu
435 440 445
Thr Leu Leu Gln Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys
450 455 460
Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp
465 470 475 480
Ser Pro Ser Tyr Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly
485 490 495
Glu Met Asp Pro Ile Leu Leu Pro Pro Cys Leu Thr Ile Ser Ile Leu
500 505 510
Ser Phe Phe Ser Val Ala Leu Leu Val Ile Leu Ala Cys Val Leu Trp
515 520 525
Lys Lys Arg Ile Lys Pro Ile Val Trp Pro Ser Leu Pro Asp His Lys
530 535 540
Lys Thr Leu Glu His Leu Cys Lys Lys Pro Arg Lys Val Ser Val Phe
545 550 555 560
Gly Ala
<210> 234
<211> 824
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический GFP - линкер - P2A - eTag - IL7RaIncPPCL N-концевой кодон делеции (за исключением P2A) и сплайсинг-оптимизированный
<400> 234
Met Ser Gly Gly Glu Glu Leu Phe Ala Gly Ile Val Pro Val Leu Ile
1 5 10 15
Glu Leu Asp Gly Asp Val His Gly His Lys Phe Ser Val Arg Gly Glu
20 25 30
Gly Glu Gly Asp Ala Asp Tyr Gly Lys Leu Glu Ile Lys Phe Ile Cys
35 40 45
Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr Leu
50 55 60
Cys Tyr Gly Ile Gln Cys Phe Ala Arg Tyr Pro Glu His Met Lys Met
65 70 75 80
Asn Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Ile Gln Glu Arg
85 90 95
Thr Ile Gln Phe Gln Asp Asp Gly Lys Tyr Lys Thr Arg Gly Glu Val
100 105 110
Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly Lys
115 120 125
Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr Ser
130 135 140
Phe Asn Ser His Asn Val Tyr Ile Arg Pro Asp Lys Ala Asn Asn Gly
145 150 155 160
Leu Glu Ala Asn Phe Lys Thr Arg His Asn Ile Glu Gly Gly Gly Val
165 170 175
Gln Leu Ala Asp His Tyr Gln Thr Asn Val Pro Leu Gly Asp Gly Pro
180 185 190
Val Leu Ile Pro Ile Asn His Tyr Leu Ser Thr Gln Thr Lys Ile Ser
195 200 205
Lys Asp Arg Asn Glu Ala Arg Asp His Met Val Leu Leu Glu Ser Phe
210 215 220
Ser Ala Cys Cys His Thr His Gly Met Asp Glu Leu Tyr Arg Gly Ser
225 230 235 240
Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu
245 250 255
Asn Pro Gly Pro Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu
260 265 270
Leu Pro His Pro Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly
275 280 285
Ile Gly Ile Gly Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn
290 295 300
Ile Lys His Phe Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile
305 310 315 320
Leu Pro Val Ala Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu
325 330 335
Asp Pro Gln Glu Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly
340 345 350
Phe Leu Leu Ile Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala
355 360 365
Phe Glu Asn Leu Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln
370 375 380
Phe Ser Leu Ala Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg
385 390 395 400
Ser Leu Lys Glu Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys
405 410 415
Asn Leu Cys Tyr Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr
420 425 430
Ser Gly Gln Lys Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys
435 440 445
Lys Ala Thr Gly Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys
450 455 460
Trp Gly Pro Glu Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg
465 470 475 480
Gly Arg Glu Cys Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg
485 490 495
Glu Phe Val Glu Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu
500 505 510
Pro Gln Ala Met Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys
515 520 525
Ile Gln Cys Ala His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys
530 535 540
Pro Ala Gly Val Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala
545 550 555 560
Asp Ala Gly His Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly
565 570 575
Cys Thr Gly Pro Gly Leu Glu Gly Cys Pro Thr Asn Gly Pro Glu Ile
580 585 590
Asn Asn Ser Ser Gly Glu Met Asp Pro Ile Leu Leu Pro Pro Cys Leu
595 600 605
Thr Ile Ser Ile Leu Ser Phe Phe Ser Val Ala Leu Leu Val Ile Leu
610 615 620
Ala Cys Val Leu Trp Lys Lys Arg Ile Lys Pro Ile Val Trp Pro Ser
625 630 635 640
Leu Pro Asp His Lys Lys Thr Leu Glu His Leu Cys Lys Lys Pro Arg
645 650 655
Lys Asn Leu Asn Val Ser Phe Asn Pro Glu Ser Phe Leu Asp Cys Gln
660 665 670
Ile His Arg Val Asp Asp Ile Gln Ala Arg Asp Glu Val Glu Gly Phe
675 680 685
Leu Gln Asp Thr Phe Pro Gln Gln Leu Glu Glu Ser Glu Lys Gln Arg
690 695 700
Leu Gly Gly Asp Val Gln Ser Pro Asn Cys Pro Ser Glu Asp Val Val
705 710 715 720
Ile Thr Pro Glu Ser Phe Gly Arg Asp Ser Ser Leu Thr Cys Leu Ala
725 730 735
Gly Asn Val Ser Ala Cys Asp Ala Pro Ile Leu Ser Ser Ser Arg Ser
740 745 750
Leu Asp Cys Arg Glu Ser Gly Lys Asn Gly Pro His Val Tyr Gln Asp
755 760 765
Leu Leu Leu Ser Leu Gly Thr Thr Asn Ser Thr Leu Pro Pro Pro Phe
770 775 780
Ser Leu Gln Ser Gly Ile Leu Thr Leu Asn Pro Val Ala Gln Gly Gln
785 790 795 800
Pro Ile Leu Thr Ser Leu Gly Ser Asn Gln Glu Glu Ala Tyr Val Thr
805 810 815
Met Ser Ser Phe Tyr Gln Asn Gln
820
<210> 235
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический MV(ed)-HD24
<400> 235
Met Asn Arg Glu His Leu Met Ile Asp Arg Pro Tyr Val Leu Leu Ala
1 5 10 15
Val Leu Phe Val Met Ser Leu Ser Leu Ile Gly Leu Leu Ala Ile Ala
20 25 30
Gly Ile Arg Leu His Arg Ala Ala Ile Tyr Thr Ala Glu Ile His Lys
35 40 45
Ser Leu Ser Thr Asn Leu Asp Val Thr Asn Ser Ile Glu His Gln Val
50 55 60
Lys Asp Val Leu Thr Pro Leu Phe Lys Ile Ile Gly Asp Glu Val Gly
65 70 75 80
Leu Arg Thr Pro Gln Arg Phe Thr Asp Leu Val Lys Phe Ile Ser Asp
85 90 95
Lys Ile Lys Phe Leu Asn Pro Asp Arg Glu Tyr Asp Phe Arg Asp Leu
100 105 110
Thr Trp Cys Ile Asn Pro Pro Glu Arg Ile Lys Leu Asp Tyr Asp Gln
115 120 125
Tyr Cys Ala Asp Val Ala Ala Glu Glu Leu Met Asn Ala Leu Val Asn
130 135 140
Ser Thr Leu Leu Glu Thr Arg Thr Thr Asn Gln Phe Leu Ala Val Ser
145 150 155 160
Lys Gly Asn Cys Ser Gly Pro Thr Thr Ile Arg Gly Gln Phe Ser Asn
165 170 175
Met Ser Leu Ser Leu Leu Asp Leu Tyr Leu Ser Arg Gly Tyr Asn Val
180 185 190
Ser Ser Ile Val Thr Met Thr Ser Gln Gly Met Tyr Gly Gly Thr Tyr
195 200 205
Leu Val Glu Lys Pro Asn Leu Ser Ser Lys Arg Ser Glu Leu Ser Gln
210 215 220
Leu Ser Met Tyr Arg Val Phe Glu Val Gly Val Ile Arg Asn Pro Gly
225 230 235 240
Leu Gly Ala Pro Val Phe His Met Thr Asn Tyr Leu Glu Gln Pro Val
245 250 255
Ser Asn Asp Leu Ser Asn Cys Met Val Ala Leu Gly Glu Leu Lys Leu
260 265 270
Ala Ala Leu Cys His Gly Glu Asp Ser Ile Thr Ile Pro Tyr Gln Gly
275 280 285
Ser Gly Lys Gly Val Ser Phe Gln Leu Val Lys Leu Gly Val Trp Lys
290 295 300
Ser Pro Thr Asp Met Gln Ser Trp Val Pro Leu Ser Thr Asp Asp Pro
305 310 315 320
Val Ile Asp Arg Leu Tyr Leu Ser Ser His Arg Gly Val Ile Ala Asp
325 330 335
Asn Gln Ala Lys Trp Ala Val Pro Thr Thr Arg Thr Asp Asp Lys Leu
340 345 350
Arg Met Glu Thr Cys Phe Gln Gln Ala Cys Lys Gly Lys Ile Gln Ala
355 360 365
Leu Cys Glu Asn Pro Glu Trp Ala Pro Leu Lys Asp Asn Arg Ile Pro
370 375 380
Ser Tyr Gly Val Leu Ser Val Asp Leu Ser Leu Thr Val Glu Leu Lys
385 390 395 400
Ile Lys Ile Ala Ser Gly Phe Gly Pro Leu Ile Thr His Gly Ser Gly
405 410 415
Met Asp Leu Tyr Lys Ser Asn His Asn Asn Val Tyr Trp Leu Thr Ile
420 425 430
Pro Pro Met Lys Asn Leu Ala Leu Gly Val Ile Asn Thr Leu Glu Trp
435 440 445
Ile Pro Arg Phe Lys Val Ser Pro Asn Leu Phe Thr Val Pro Ile Lys
450 455 460
Glu Ala Gly Glu Asp Cys His Ala Pro Thr Tyr Leu Pro Ala Glu Val
465 470 475 480
Asp Gly Asp Val Lys Leu Ser Ser Asn Leu Val Ile Leu Pro Gly Gln
485 490 495
Asp Leu Gln Tyr Val Leu Ala Thr Tyr Asp Thr Ser Arg Val Glu His
500 505 510
Ala Val Val Tyr Tyr Val Tyr Ser Pro Gly Arg Ser Phe Ser Tyr Phe
515 520 525
Tyr Pro Phe Arg Leu Pro Ile Lys Gly Val Pro Ile Glu Leu Gln Val
530 535 540
Glu Cys Phe Thr Trp Asp Gln Lys Leu Trp Cys Arg His Phe Cys Val
545 550 555 560
Leu Ala Asp Ser Glu Ser Gly Gly His Ile Thr His Ser Gly Met Val
565 570 575
Gly Met Gly Val Ser Cys Thr Val Thr Arg Glu Asp Gly Thr Asn Arg
580 585 590
Arg
<210> 236
<211> 1275
<212> ДНК
<213> Mesoplasma florum
<400> 236
aaaaaaaata aaatcaatag caaatattaa gatttttaag aaataaaaaa ttaatattaa 60
tttacaactg aatataaaag aaacttatac agggtagcat aatgggctac tgaccccgcc 120
ttcaaaccta tttggagact ataagtgaaa aaccactctt taattattaa agtttctttt 180
tatgtccaaa agacaagaag aaactttttt atttagttga atttataata agagaaaaag 240
aaaggatatt atatggcaaa aataaaaaac caatattaca acgagtctgt ttcgccaatt 300
gaatatgcgc aacaaggatt taaaggaaaa atgcgttcag taaactgaaa cgtagtaaat 360
gatgaaaaag atttagaggt atgaaataga attacacaaa acttctgatt gcctgaaaaa 420
attccagttt caaatgattt aacttcatga agaactttga caccagaatg acaagaatta 480
attacaagaa cttttacagg attaacattg ttagatacaa ttcaagctac tgttggtgat 540
gtggctcaag ttcctaactc attaactgac catgaacaag taatttacac aaactttgca 600
tttatggttg cagttcacgc tagatcatat ggttcaatct tttcaacttt atgttcaagt 660
gaacaaattg aagaggctca tgaatgagtt atcaatacag aaacattaca agaaagagct 720
aaagcattaa ttccttatta tgtgaatgat gaccctttaa agtcaaaagt tgcagctgct 780
ttaatgccag gcttcttatt atatggaggc ttctatttac cattttacct atcagctaga 840
ggtaaattac caaacacttc agatattatt agattaatat taagagataa agttatacat 900
aactactata gtggttataa atatcaaaag aaagttgcta aactttctcc agaaaaacaa 960
gctgaaatga aagaatttgt ttttaaatta ttatatgaat taatagattt agaaaaagct 1020
tatttgaaag aattgtatga ggattttgga ttagctgatg atgctattag atttagtgtt 1080
tacaacgcag gtaaattttt acaaaattta ggttatgatt caccgtttac agaagaagaa 1140
acaagaattg agccagaaat attcacacaa ttatcagcta gagctgatga aaaccatgat 1200
ttcttttcag ggaatggctc atcatatatt atgggagttt cagaagaaac tgaagatgac 1260
gattgggagt tttaa 1275
<210> 237
<211> 64
<212> РНК
<213> Mesoplasma florum
<400> 237
acuuauacag gguagcauaa ugggcuacug accccgccuu caaaccuauu uggagacuau 60
aagu 64
<210> 238
<211> 69
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетические мутации аптамера дезоксигуанозинового рибопереключателя
<220>
<221> misc_feature
<222> (10)..(13)
<223> n в положениях 10-13 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (27)..(29)
<223> n в положениях 27-29 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (31)..(32)
<223> n в положениях 31-32 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (33)..(40)
<223> n в положениях 33-40 может представлять собой A, C, G, T или не нуклеотид
<220>
<221> misc_feature
<222> (44)..(46)
<223> n в положениях 44-46 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (57)..(59)
<223> n в положениях 57-59 может представлять собой A, C, G или T
<400> 238
acuuauacan nnnagcauaa ugggcunnng nnnnnnnnnn gccnnnaaac cuauuunnng 60
acuauaagu 69
<210> 239
<211> 84
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Библиотека синтетических нуклеотидов для скрининга
<220>
<221> misc_feature
<222> (19)..(21)
<223> n в положениях 19-21 может представлять собой A, C, G, or T
<220>
<221> misc_feature
<222> (32)..(34)
<223> n в положениях 32-34 может представлять собой A, C, G, or T
<220>
<221> misc_feature
<222> (38)..(39)
<223> n в положениях 38-39 может представлять собой A, C, G, or T
<220>
<221> misc_feature
<222> (40)..(47)
<223> n в положениях 40-47 может представлять собой A, C, G, T, или не нуклеотид
<220>
<221> misc_feature
<222> (49)..(51)
<223> n в положениях 49-51 может представлять собой A, C, G, or T
<220>
<221> misc_feature
<222> (65)..(68)
<223> n в положениях 65-68 может представлять собой A, C, G, or T
<400> 239
cgcgcgacac ttatagtcnn naaataggtt tnnnggcnnn nnnnnnncnn nagcccatta 60
tgctnnnntg tataagtgcc gccc 84
<210> 240
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер амплификации промотора T7
<400> 240
taatacgact cactataggg cggcacttat aca 33
<210> 241
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер обратной амплификации
<400> 241
cgcgcgacac ttatagtc 18
<210> 242
<211> 915
<212> ДНК
<213> Bacillus subtilis
<400> 242
tcaaaagcct ggcggcgcgg tcgtcagact cttttatatc gaatcccctt gaaatacgaa 60
tgatatctaa aaaaacaaaa ttaaagttcg ggaattttta ttttcagcct atgcaagaga 120
ttagaatctt gatataattt attacaatat aataggaaca ctcatataat cgcgtggata 180
tggcacgcaa gtttctaccg ggcaccgtaa atgtccgact atgggtgagc aatggaaccg 240
cacgtgtacg gttttttgtg atatcagcat tgcttgctct ttatttgagc gggcaatgct 300
ttttttattc tcataacgga ggtagacagg atggaagcac tgaaacggaa aatagaggaa 360
gaaggcgtcg tattatctga tcaggtattg aaagtggatt cttttttgaa tcaccaaatt 420
gatccgctgc ttatgcagag aattggtgat gaatttgcgt ctaggtttgc aaaagacggt 480
attaccaaaa ttgtgacaat cgaatcatca ggtatcgctc ccgctgtaat gacgggcttg 540
aagctgggtg tgccagttgt cttcgcgaga aagcataaat cgttaacact caccgacaac 600
ttgctgacag cgtctgttta ttcctttacg aagcaaacag aaagccaaat cgcagtgtct 660
gggacccacc tgtcggatca ggatcatgtg ctgattatcg atgatttttt ggcaaatgga 720
caggcagcgc acgggcttgt gtcgattgtg aagcaagcgg gagcttctat tgcgggaatc 780
ggcattgtta ttgaaaagtc atttcagccg ggaagagatg aacttgtaaa actgggctac 840
cgagtggaat ctttggcaag aattcagtct ttagaagaag gaaaagtgtc cttcgtacag 900
gaggttcatt catga 915
<210> 243
<211> 69
<212> РНК
<213> Bacillus subtilis
<400> 243
cacucauaua aucgcgugga uauggcacgc aaguuucuac cgggcaccgu aaauguccga 60
cuaugggug 69
<210> 244
<211> 74
<212> РНК
<213> Искусственная последовательность
<220>
<223> Синтетические мутации гуанозинового рибопереключателя xpt
<220>
<221> misc_feature
<222> (11)..(14)
<223> n в положениях 11-14 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (30)..(35)
<223> n в положениях 30-35 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (36)..(43)
<223> n в положениях 36-43 может представлять собой A, C, G, T или не нуклеотид
<220>
<221> misc_feature
<222> (47)..(49)
<223> n в положениях 47-49 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (61)..(63)
<223> n в положениях 61-63 может представлять собой A, C, G или T
<400> 244
cacucauaua nnnncgugga uauggcacgn nngnnnnnnn nnnaccnnnu accguaaaug 60
nnngacuaug ggug 74
<210> 245
<211> 89
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Библиотека синтетических олигонуклеотидов для скрининга
<220>
<221> misc_feature
<222> (20)..(22)
<223> n в положениях 20-22 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (34)..(36)
<223> n в положениях 34-36 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (40)..(41)
<223> n в положениях 40-41 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (42)..(49)
<223> n в положениях 42-49 может представлять собой A, C, G, T или не нуклеотид
<220>
<221> misc_feature
<222> (51)..(53)
<223> n в положениях 51-53 может представлять собой A, C, G или T
<220>
<221> misc_feature
<222> (69)..(72)
<223> n в положениях 69-72 может представлять собой A, C, G или T
<400> 245
cgcgcgacca cccatagtcn nncatttacg gtgnnnggtn nnnnnnnnnc nnncgtgcca 60
tatccacgnn nntatatgag tggccgccc 89
<210> 246
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер амплификации промотора T7
<400> 246
taatacgact cactataggg cggccactca tata 34
<210> 247
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер обратной амплификации
<400> 247
cgcgcgacca cccatagtc 19
<210> 248
<211> 152
<212> РНК
<213> Искусственная последовательность
<220>
<223> Транскрибируемая РНК синтетического олигонуклеотида 1
<400> 248
gggcggcacu uauacagggu agcauaaugg gcuacugacg ccuucaaacc uauuuggaga 60
cuauaagugu cgcgcggggc ggcacuuaua caggguagca uaaugggcua cugacgccuu 120
caaaccuauu uggagacuau aagugucgcg cg 152
<210> 249
<211> 76
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезируемая матрица синтетического олигонуклеотида 1
<400> 249
cgcgcgacac ttatagtctc caaataggtt tgaaggcgtc agtagcccat tatgctaccc 60
tgtataagtg ccgccc 76
<210> 250
<211> 79
<212> РНК
<213> Искусственная последовательность
<220>
<223> Транскрибируемая РНК синтетического олигонуклеотида 2
<400> 250
gggcggcacu uauacagggu agcauaaugg gcuacugacc ccgccuucaa accuauuugg 60
agacuauaag ugucgcgcg 79
<210> 251
<211> 79
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезируемая матрица синтетического олигонуклеотида 2
<400> 251
cgcgcgacac ttatagtctc caaataggtt tgaaggcggg gtcagtagcc cattatgcta 60
ccctgtataa gtgccgccc 79
<210> 252
<211> 560
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность DAFss-aCD3scFv(UCHT1)IgG1 Fc-CD14GPI
<400> 252
Met Thr Val Ala Arg Pro Ser Val Pro Ala Ala Leu Pro Leu Leu Gly
1 5 10 15
Glu Leu Pro Arg Leu Leu Leu Leu Val Leu Leu Cys Leu Pro Asp Ile
20 25 30
Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg
35 40 45
Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Arg Asn Tyr Leu Asn
50 55 60
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Tyr
65 70 75 80
Thr Ser Arg Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
85 90 95
Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp
100 105 110
Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp Thr Phe
115 120 125
Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
145 150 155 160
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala
165 170 175
Ser Gly Tyr Ser Phe Thr Gly Tyr Thr Met Asn Trp Val Arg Gln Ala
180 185 190
Pro Gly Lys Gly Leu Glu Trp Val Ala Leu Ile Asn Pro Tyr Lys Gly
195 200 205
Val Ser Thr Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val
210 215 220
Asp Lys Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala
225 230 235 240
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Gly Tyr Tyr Gly Asp
245 250 255
Ser Asp Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val
260 265 270
Ser Ser Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
275 280 285
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
290 295 300
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
305 310 315 320
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
325 330 335
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
340 345 350
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
355 360 365
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
370 375 380
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
385 390 395 400
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
405 410 415
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
420 425 430
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
435 440 445
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
450 455 460
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
465 470 475 480
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
485 490 495
Gln Lys Ser Leu Ser Leu Ser Pro Gly Val Asp Asn Leu Thr Leu Asp
500 505 510
Gly Asn Pro Phe Leu Val Pro Gly Thr Ala Leu Pro His Glu Gly Ser
515 520 525
Met Asn Ser Gly Val Val Pro Ala Cys Ala Arg Ser Thr Leu Ser Val
530 535 540
Gly Val Ser Gly Thr Leu Val Leu Leu Gln Gly Ala Arg Gly Phe Ala
545 550 555 560
<210> 253
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность DAFss-CD80ECD-CD16GPI
<400> 253
Met Thr Val Ala Arg Pro Ser Val Pro Ala Ala Leu Pro Leu Leu Gly
1 5 10 15
Glu Leu Pro Arg Leu Leu Leu Leu Val Leu Leu Cys Leu Pro Val Ile
20 25 30
His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu Ser Cys Gly His
35 40 45
Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile Tyr Trp Gln Lys
50 55 60
Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp Met Asn Ile Trp
65 70 75 80
Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr Asn Asn Leu Ser
85 90 95
Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly Thr Tyr Glu Cys
100 105 110
Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg Glu His Leu Ala
115 120 125
Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr Pro Ser Ile Ser
130 135 140
Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile Ile Cys Ser Thr
145 150 155 160
Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu Glu Asn Gly Glu
165 170 175
Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp Pro Glu Thr Glu
180 185 190
Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met Thr Thr Asn His
195 200 205
Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg Val Asn Gln Thr
210 215 220
Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro Asp Asn Val Ser
225 230 235 240
Thr Ile Ser Ser Phe Ser Pro Pro Gly Tyr Gln Val Ser Phe Cys Leu
245 250 255
Val Met Val Leu Leu Phe Ala Val Asp Thr Gly Leu Tyr Phe Ser Val
260 265 270
Lys Thr Asn Ile
275
<210> 254
<211> 533
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность DAFss-IL7-DAF
<400> 254
Met Ala Thr Thr Met Thr Val Ala Arg Pro Ser Val Pro Ala Ala Leu
1 5 10 15
Pro Leu Leu Gly Glu Leu Pro Arg Leu Leu Leu Leu Val Leu Leu Cys
20 25 30
Leu Pro Ala Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu
35 40 45
Ser Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu
50 55 60
Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His
65 70 75 80
Ile Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg
85 90 95
Lys Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu
100 105 110
His Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr
115 120 125
Gly Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro
130 135 140
Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu
145 150 155 160
Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys
165 170 175
Trp Asn Lys Ile Leu Met Gly Thr Lys Glu His Cys Gly Leu Pro Pro
180 185 190
Asp Val Pro Asn Ala Gln Pro Ala Leu Glu Gly Arg Thr Ser Phe Pro
195 200 205
Glu Asp Thr Val Ile Thr Tyr Lys Cys Glu Glu Ser Phe Val Lys Ile
210 215 220
Pro Gly Glu Lys Asp Ser Val Ile Cys Leu Lys Gly Ser Gln Trp Ser
225 230 235 240
Asp Ile Glu Glu Phe Cys Asn Arg Ser Cys Glu Val Pro Thr Arg Leu
245 250 255
Asn Ser Ala Ser Leu Lys Gln Pro Tyr Ile Thr Gln Asn Tyr Phe Pro
260 265 270
Val Gly Thr Val Val Glu Tyr Glu Cys Arg Pro Gly Tyr Arg Arg Glu
275 280 285
Pro Ser Leu Ser Pro Lys Leu Thr Cys Leu Gln Asn Leu Lys Trp Ser
290 295 300
Thr Ala Val Glu Phe Cys Lys Lys Lys Ser Cys Pro Asn Pro Gly Glu
305 310 315 320
Ile Arg Asn Gly Gln Ile Asp Val Pro Gly Gly Ile Leu Phe Gly Ala
325 330 335
Thr Ile Ser Phe Ser Cys Asn Thr Gly Tyr Lys Leu Phe Gly Ser Thr
340 345 350
Ser Ser Phe Cys Leu Ile Ser Gly Ser Ser Val Gln Trp Ser Asp Pro
355 360 365
Leu Pro Glu Cys Arg Glu Ile Tyr Cys Pro Ala Pro Pro Gln Ile Asp
370 375 380
Asn Gly Ile Ile Gln Gly Glu Arg Asp His Tyr Gly Tyr Arg Gln Ser
385 390 395 400
Val Thr Tyr Ala Cys Asn Lys Gly Phe Thr Met Ile Gly Glu His Ser
405 410 415
Ile Tyr Cys Thr Val Asn Asn Asp Glu Gly Glu Trp Ser Gly Pro Pro
420 425 430
Pro Glu Cys Arg Gly Lys Ser Leu Thr Ser Lys Val Pro Pro Thr Val
435 440 445
Gln Lys Pro Thr Thr Val Asn Val Pro Thr Thr Glu Val Ser Pro Thr
450 455 460
Ser Gln Lys Thr Thr Thr Lys Thr Thr Thr Pro Asn Ala Gln Ala Thr
465 470 475 480
Arg Ser Thr Pro Val Ser Arg Thr Thr Lys His Phe His Glu Thr Thr
485 490 495
Pro Asn Lys Gly Ser Gly Thr Thr Ser Gly Thr Thr Arg Leu Leu Ser
500 505 510
Gly His Thr Cys Phe Thr Leu Thr Gly Leu Leu Gly Thr Leu Val Thr
515 520 525
Met Gly Leu Leu Thr
530
<210> 255
<211> 1823
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность промотора EF-1a с miR
<400> 255
ggctccggtg cccgtcagtg ggcagagcgc acatcgccca cagtccccga gaagttgggg 60
ggaggggtcg gcaattgaac cggtgcctag agaaggtggc gcggggtaaa ctgggaaagt 120
gatgtcgtgt actggctccg cctttttccc gagggtgggg gagaaccgta tataagtgca 180
gtagtcgccg tgaacgttct ttttcgcaac gggtttgccg ccagaacaca ggtaagtgcc 240
gtgtgtggtt cccgcgggcc tggcctcttt acgggttatg gcccttgcgt gccttgaatt 300
acttccacct ggctgcagta cgtgattctt gatcccgagc ttcgggttgg aagtgggtgg 360
gagagttcga ggccttgcgc ttaaggagcc ccttcgcctc gtgcttgagt tgaggcctgg 420
cctgggcgct ggggccgccg cgtgcgaatc tggtggcacc ttcgcgcctg tctcgctgct 480
ttcgataagt ctctagccat ttaaaatttt tgatgacctg ctgcgacgct ttttttctgg 540
caagatagtc ttgtaaatgc gggccaagat ctgcacactg gtatttcggt ttttggggcc 600
gcgggcggcg acggggcccg tgcgtcccag cgcacatgtt cggcgaggcg gggcctgcga 660
gcgcggccac cgagaatcgg acgggggtag tctcaagctg gccggcctgc tctggtgcct 720
ggcctcgcgc cgccgtgtat cgccccgccc tgggcggcaa ggctggcccg gtcggcacca 780
gttgcgtgag cggaaagatg gccgcttccc ggccctgctg cagggagctc aaaatggagg 840
acgcggcgct cgggagagcg ggcgggtgag tcacccacac aaaggaaaag ggcctttccg 900
tcctcagccg tcgcttcatg tgactccact gagtaccggg cgccgtccag gcacctcgat 960
tagttcctgg aggcttgctg aaggctgtat gctgacatgg tacagttcaa tggtggtttt 1020
ggccactgac tgaccaccat tgctgtacca tgtcaggaca caaggcctgt tactagcact 1080
cacatggaac aaatggccca cattggtgcc ggatgaagct cttatgttgc acggtcatct 1140
ggaggcttgc tgaaggctgt atgctgtcag tctgttcatc ttctggcgtt ttggccactg 1200
actgacgcca gaaggaacag actgacagga cacaaggcct gttactagca ctcacatgga 1260
acaaatggcc gttgccggag tcttggcagc gagagatcac tatcaactaa ctggaggctt 1320
gctgaaggct gtatgctgaa gcgtgaagtg aatcaacggg ttttggccac tgactgaccc 1380
gttgatactt cacgcttcag gacacaaggc ctgttactag cactcacatg gaacaaatgg 1440
ccgtgttaat tgtccatgta gcgaggcatc cttatggcgt ggctggaggc ttgctgaagg 1500
ctgtatgctg gcagtatcct agtacattga cgttttggcc actgactgac gtcaatgtta 1560
ggatactgcc aggacacaag gcctgttact agcactcaca tggaacaaat ggccgctttt 1620
ggagtacgtc gtctttaggt tggggggagg ggttttatgc gatggagttt ccccacactg 1680
agtgggtgga gactgaagtt aggccagctt ggcacttgat gtaattctcc ttggaatttg 1740
ccctttttga gtttggatct tggttcattc tcaagcctca gacagtggtt caaagttttt 1800
ttcttccatt tcaggtgtcg tga 1823
<210> 256
<211> 28
<212> ДНК
<213> Mus musculus
<400> 256
ctggaggctt gctgaaggct gtatgctg 28
<210> 257
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 257
acatggtaca gttcaatggt g 21
<210> 258
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая петлю
<400> 258
gttttggcca ctgactgac 19
<210> 259
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель
<400> 259
caccattgct gtaccatgt 19
<210> 260
<211> 45
<212> ДНК
<213> Mus musculus
<400> 260
caggacacaa ggcctgttac tagcactcac atggaacaaa tggcc 45
<210> 261
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 261
tcagtctgtt catcttctgg c 21
<210> 262
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 262
gccagaagga acagactga 19
<210> 263
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 263
aagcgtgaag tgaatcaacg g 21
<210> 264
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 264
ccgttgatac ttcacgctt 19
<210> 265
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 265
gcagtatcct agtacattga c 21
<210> 266
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 266
gtcaatgtta ggatactgc 19
<210> 267
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 267
atatgtactt ggctggacag c 21
<210> 268
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 268
gctgtccaca agtacatat 19
<210> 269
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая линкер
<400> 269
cacattggtg ccggatgaag ctcttatgtt gccggtcat 39
<210> 270
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 270
ctgttaatgc taatcgtgat a 21
<210> 271
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 271
tatcacgatt attaacag 18
<210> 272
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая линкер
<400> 272
gttgccggag tcttggcagc gagagatcac tatcaactaa 40
<210> 273
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 273
taccagttta gcacgaagct c 21
<210> 274
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 274
gagcttcgct aaactggta 19
<210> 275
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая линкер
<400> 275
gtgttaattg tccatgtagc gaggcatcct tatggcgtgg 40
<210> 276
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 276
tgccgctgaa atccaaggca a 21
<210> 277
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК, кодирующая стебель MiRNA
<400> 277
ttgccttgtt tcagcggca 19
<210> 278
<211> 534
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность UCHT1scFvFc-GPI
<400> 278
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Ser Gly Ala Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Ile Arg Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Tyr Thr Ser Arg Leu Glu Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Gly Asn Thr Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
145 150 155 160
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
165 170 175
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
180 185 190
Ala Leu Ile Asn Pro Tyr Lys Gly Val Ser Thr Tyr Asn Gln Lys Phe
195 200 205
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ser Lys Asn Thr Ala Tyr
210 215 220
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
225 230 235 240
Ala Arg Ser Gly Tyr Tyr Gly Asp Ser Asp Trp Tyr Phe Asp Val Trp
245 250 255
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Glu Pro Lys Ser Cys Asp
260 265 270
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
275 280 285
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
290 295 300
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
305 310 315 320
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
325 330 335
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
340 345 350
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
355 360 365
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Thr Pro Ile Glu
370 375 380
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
385 390 395 400
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
405 410 415
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
420 425 430
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
435 440 445
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
450 455 460
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
465 470 475 480
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
485 490 495
Gly Pro Asn Lys Gly Ser Gly Thr Thr Ser Gly Thr Thr Arg Leu Leu
500 505 510
Ser Gly His Thr Cys Phe Thr Leu Thr Gly Leu Leu Gly Thr Leu Val
515 520 525
Thr Met Gly Leu Leu Thr
530
<210> 279
<211> 530
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность OKT3scFvFc-GPI
<400> 279
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Ser Gly Ala Arg Cys Gln Ile Val Leu Thr Gln Ser Pro Ala Ile
20 25 30
Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser
35 40 45
Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser
50 55 60
Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro
65 70 75 80
Ala His Phe Arg Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile
85 90 95
Ser Gly Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp
100 105 110
Ser Ser Asn Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Asn
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala Ser
145 150 155 160
Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr Thr
165 170 175
Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly
180 185 190
Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe Lys
195 200 205
Asp Lys Ala Thr Leu Thr Thr Asp Lys Ser Ser Ser Thr Ala Tyr Met
210 215 220
Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala
225 230 235 240
Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly Thr
245 250 255
Thr Leu Thr Val Ser Ser Glu Pro Lys Ser Cys Asp Lys Thr His Thr
260 265 270
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
275 280 285
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
290 295 300
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
305 310 315 320
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
325 330 335
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
340 345 350
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
355 360 365
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
370 375 380
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
385 390 395 400
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
405 410 415
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
420 425 430
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
435 440 445
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
450 455 460
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
465 470 475 480
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Pro Asn Lys
485 490 495
Gly Ser Gly Thr Thr Ser Gly Thr Thr Arg Leu Leu Ser Gly His Thr
500 505 510
Cys Phe Thr Leu Thr Gly Leu Leu Gly Thr Leu Val Thr Met Gly Leu
515 520 525
Leu Thr
530
<210> 280
<211> 280
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность hCD80-CD16 GPI
<400> 280
Met Gly His Thr Arg Arg Gln Gly Thr Ser Pro Ser Lys Cys Pro Tyr
1 5 10 15
Leu Asn Phe Phe Gln Leu Leu Val Leu Ala Gly Leu Ser His Phe Cys
20 25 30
Ser Gly Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu
35 40 45
Ser Cys Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile
50 55 60
Tyr Trp Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp
65 70 75 80
Met Asn Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr
85 90 95
Asn Asn Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly
100 105 110
Thr Tyr Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg
115 120 125
Glu His Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr
130 135 140
Pro Ser Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile
145 150 155 160
Ile Cys Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu
165 170 175
Glu Asn Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp
180 185 190
Pro Glu Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met
195 200 205
Thr Thr Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg
210 215 220
Val Asn Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro
225 230 235 240
Asp Asn Val Ser Thr Ile Ser Ser Phe Ser Pro Pro Gly Tyr Gln Val
245 250 255
Ser Phe Cys Leu Val Met Val Leu Leu Phe Ala Val Asp Thr Gly Leu
260 265 270
Tyr Phe Ser Val Lys Thr Asn Ile
275 280
<210> 281
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность VH MRB мишени 1
<400> 281
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Ser Phe Trp Gly Ala
20 25 30
Thr Met Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Leu Ile Lys Pro Ser Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala His Gly His Tyr Glu Ser Tyr Glu Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 282
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность VL MRB мишени 1
<400> 282
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Val Ser Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Trp Gln Asp Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Glu His Phe Ser Pro Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 283
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 1
<400> 283
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 284
<211> 357
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический контрольный полипептид C1, содержащий сигнальную
последовательность альфа-цепи GMCSF (аминокислоты 1-22) и eTAG
(аминокислоты 23-357)
<400> 284
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala
325 330 335
Thr Gly Met Val Gly Ala Leu Leu Leu Leu Leu Val Val Ala Leu Gly
340 345 350
Ile Gly Leu Phe Met
355
<210> 285
<211> 240
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический ScFv OKT3
<400> 285
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala His Phe Arg Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Gly Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Asn Gly Gly Gly Gly Ser Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Gln Ser
115 120 125
Gly Ala Glu Leu Ala Arg Pro Gly Ala Ser Val Lys Met Ser Cys Lys
130 135 140
Ala Ser Gly Tyr Thr Phe Thr Arg Tyr Thr Met His Trp Val Lys Gln
145 150 155 160
Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg
165 170 175
Gly Tyr Thr Asn Tyr Asn Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr
180 185 190
Thr Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr
195 200 205
Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Tyr Tyr Asp Asp His
210 215 220
Tyr Cys Leu Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
225 230 235 240
<210> 286
<211> 532
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическое слияние DAFss-IL7-DAF
<400> 286
Met Thr Val Ala Arg Pro Ser Val Pro Ala Ala Leu Pro Leu Leu Gly
1 5 10 15
Glu Leu Pro Arg Leu Leu Leu Leu Val Leu Leu Cys Leu Pro Ala Val
20 25 30
Trp Gly Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser
35 40 45
Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile
50 55 60
Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile
65 70 75 80
Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys
85 90 95
Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His
100 105 110
Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly
115 120 125
Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr
130 135 140
Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn
145 150 155 160
Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp
165 170 175
Asn Lys Ile Leu Met Gly Thr Lys Glu His Cys Gly Leu Pro Pro Asp
180 185 190
Val Pro Asn Ala Gln Pro Ala Leu Glu Gly Arg Thr Ser Phe Pro Glu
195 200 205
Asp Thr Val Ile Thr Tyr Lys Cys Glu Glu Ser Phe Val Lys Ile Pro
210 215 220
Gly Glu Lys Asp Ser Val Ile Cys Leu Lys Gly Ser Gln Trp Ser Asp
225 230 235 240
Ile Glu Glu Phe Cys Asn Arg Ser Cys Glu Val Pro Thr Arg Leu Asn
245 250 255
Ser Ala Ser Leu Lys Gln Pro Tyr Ile Thr Gln Asn Tyr Phe Pro Val
260 265 270
Gly Thr Val Val Glu Tyr Glu Cys Arg Pro Gly Tyr Arg Arg Glu Pro
275 280 285
Ser Leu Ser Pro Lys Leu Thr Cys Leu Gln Asn Leu Lys Trp Ser Thr
290 295 300
Ala Val Glu Phe Cys Lys Lys Lys Ser Cys Pro Asn Pro Gly Glu Ile
305 310 315 320
Arg Asn Gly Gln Ile Asp Val Pro Gly Gly Ile Leu Phe Gly Ala Thr
325 330 335
Ile Ser Phe Ser Cys Asn Thr Gly Tyr Lys Leu Phe Gly Ser Thr Ser
340 345 350
Ser Phe Cys Leu Ile Ser Gly Ser Ser Val Gln Trp Ser Asp Pro Leu
355 360 365
Pro Glu Cys Arg Glu Ile Tyr Cys Pro Ala Pro Pro Gln Ile Asp Asn
370 375 380
Gly Ile Ile Gln Gly Glu Arg Asp His Tyr Gly Tyr Arg Gln Ser Val
385 390 395 400
Thr Tyr Ala Cys Asn Lys Gly Phe Thr Met Ile Gly Glu His Ser Ile
405 410 415
Tyr Cys Thr Val Asn Asn Asp Glu Gly Glu Trp Ser Gly Pro Pro Pro
420 425 430
Glu Cys Arg Gly Lys Ser Leu Thr Ser Lys Val Pro Pro Thr Val Gln
435 440 445
Lys Pro Thr Thr Val Asn Val Pro Thr Thr Glu Val Ser Pro Thr Ser
450 455 460
Gln Lys Thr Thr Thr Lys Thr Thr Thr Pro Asn Ala Gln Ala Thr Arg
465 470 475 480
Ser Thr Pro Val Ser Arg Thr Thr Lys His Phe His Glu Thr Thr Pro
485 490 495
Asn Lys Gly Ser Gly Thr Thr Ser Gly Thr Thr Arg Leu Leu Ser Gly
500 505 510
His Thr Cys Phe Thr Leu Thr Gly Leu Leu Gly Thr Leu Val Thr Met
515 520 525
Gly Leu Leu Thr
530
<210> 287
<211> 564
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность DAFss-aCD3scFv(UCHT1)IgG1 Fc-CD14GPI
<400> 287
Met Thr Val Ala Arg Pro Ser Val Pro Ala Ala Leu Pro Leu Leu Gly
1 5 10 15
Glu Leu Pro Arg Leu Leu Leu Leu Val Leu Leu Cys Leu Pro Ala Val
20 25 30
Trp Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser
35 40 45
Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Arg
50 55 60
Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
65 70 75 80
Leu Ile Tyr Tyr Thr Ser Arg Leu Glu Ser Gly Val Pro Ser Arg Phe
85 90 95
Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu
100 105 110
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu
115 120 125
Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu
145 150 155 160
Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu
165 170 175
Ser Cys Ala Ala Ser Gly Tyr Ser Phe Thr Gly Tyr Thr Met Asn Trp
180 185 190
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Leu Ile Asn
195 200 205
Pro Tyr Lys Gly Val Ser Thr Tyr Asn Gln Lys Phe Lys Asp Arg Phe
210 215 220
Thr Ile Ser Val Asp Lys Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn
225 230 235 240
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Gly
245 250 255
Tyr Tyr Gly Asp Ser Asp Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr
260 265 270
Leu Val Thr Val Ser Ser Glu Pro Lys Ser Cys Asp Lys Thr His Thr
275 280 285
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
290 295 300
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
305 310 315 320
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
325 330 335
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
340 345 350
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
355 360 365
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
370 375 380
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
385 390 395 400
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
405 410 415
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
420 425 430
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
435 440 445
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
450 455 460
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
465 470 475 480
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
485 490 495
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Val Asp Asn
500 505 510
Leu Thr Leu Asp Gly Asn Pro Phe Leu Val Pro Gly Thr Ala Leu Pro
515 520 525
His Glu Gly Ser Met Asn Ser Gly Val Val Pro Ala Cys Ala Arg Ser
530 535 540
Thr Leu Ser Val Gly Val Ser Gly Thr Leu Val Leu Leu Gln Gly Ala
545 550 555 560
Arg Gly Phe Ala
<210> 288
<211> 280
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность DAFss-CD80ECD-CD16GPI
<400> 288
Met Thr Val Ala Arg Pro Ser Val Pro Ala Ala Leu Pro Leu Leu Gly
1 5 10 15
Glu Leu Pro Arg Leu Leu Leu Leu Val Leu Leu Cys Leu Pro Ala Val
20 25 30
Trp Gly Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu
35 40 45
Ser Cys Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile
50 55 60
Tyr Trp Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp
65 70 75 80
Met Asn Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr
85 90 95
Asn Asn Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly
100 105 110
Thr Tyr Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg
115 120 125
Glu His Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr
130 135 140
Pro Ser Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile
145 150 155 160
Ile Cys Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu
165 170 175
Glu Asn Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp
180 185 190
Pro Glu Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met
195 200 205
Thr Thr Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg
210 215 220
Val Asn Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro
225 230 235 240
Asp Asn Val Ser Thr Ile Ser Ser Phe Ser Pro Pro Gly Tyr Gln Val
245 250 255
Ser Phe Cys Leu Val Met Val Leu Leu Phe Ala Val Asp Thr Gly Leu
260 265 270
Tyr Phe Ser Val Lys Thr Asn Ile
275 280
<210> 289
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность VH MRB мишени 2
<400> 289
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Thr Gly
20 25 30
Glu Tyr Trp Asn Trp Val Arg Gln Ala Arg Gly Gln Arg Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Thr Tyr Asp Gly Ser Lys Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Phe Glu Gly Val Trp Tyr Gly Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 290
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность VL MRB мишени 2
<400> 290
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Arg Tyr
20 25 30
Gly Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Thr Tyr Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ser Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Thr Asn
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 291
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический линкер 2
<400> 291
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 292
<211> 368
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M001
<400> 292
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Pro Glu Ile Asn Asn Ser Ser
325 330 335
Gly Glu Met Asp Pro Ile Leu Leu Pro Pro Cys Leu Thr Ile Ser Ile
340 345 350
Leu Ser Phe Phe Ser Val Ala Leu Leu Val Ile Leu Ala Cys Val Leu
355 360 365
<210> 293
<211> 232
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M002
<400> 293
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro Ile Leu Leu
195 200 205
Pro Pro Cys Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser Val Ala Leu
210 215 220
Leu Val Ile Leu Ala Cys Val Leu
225 230
<210> 294
<211> 194
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M007
<400> 294
Met Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Glu His Asp Leu Glu
1 5 10 15
Arg Gly Pro Pro Gly Pro Arg Arg Pro Pro Arg Gly Pro Pro Leu Ser
20 25 30
Ser Ser Leu Gly Leu Ala Leu Leu Leu Leu Leu Leu Ala Leu Leu Phe
35 40 45
Trp Leu Tyr Ile Val Met Ser Asp Trp Thr Gly Gly Ala Leu Leu Val
50 55 60
Leu Tyr Ser Phe Ala Leu Met Leu Ile Ile Ile Ile Leu Ile Ile Phe
65 70 75 80
Ile Phe Arg Arg Asp Leu Leu Cys Pro Leu Gly Ala Leu Cys Ile Leu
85 90 95
Leu Leu Met Ile Thr Leu Leu Leu Ile Ala Leu Trp Asn Leu His Gly
100 105 110
Gln Ala Leu Phe Leu Gly Ile Val Leu Phe Ile Phe Gly Cys Leu Leu
115 120 125
Val Leu Gly Ile Trp Ile Tyr Leu Leu Glu Met Leu Trp Arg Leu Gly
130 135 140
Ala Thr Ile Trp Gln Leu Leu Ala Phe Phe Leu Ala Phe Phe Leu Asp
145 150 155 160
Leu Ile Leu Leu Ile Ile Ala Leu Tyr Leu Gln Gln Asn Trp Trp Thr
165 170 175
Leu Leu Val Asp Leu Leu Trp Leu Leu Leu Phe Leu Ala Ile Leu Ile
180 185 190
Trp Met
<210> 295
<211> 174
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M008
<400> 295
Met Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Ser Ser Ser Leu Gly
1 5 10 15
Leu Ala Leu Leu Leu Leu Leu Leu Ala Leu Leu Phe Trp Leu Tyr Ile
20 25 30
Val Met Ser Asp Trp Thr Gly Gly Ala Leu Leu Val Leu Tyr Ser Phe
35 40 45
Ala Leu Met Leu Ile Ile Ile Ile Leu Ile Ile Phe Ile Phe Arg Arg
50 55 60
Asp Leu Leu Cys Pro Leu Gly Ala Leu Cys Ile Leu Leu Leu Met Ile
65 70 75 80
Thr Leu Leu Leu Ile Ala Leu Trp Asn Leu His Gly Gln Ala Leu Phe
85 90 95
Leu Gly Ile Val Leu Phe Ile Phe Gly Cys Leu Leu Val Leu Gly Ile
100 105 110
Trp Ile Tyr Leu Leu Glu Met Leu Trp Arg Leu Gly Ala Thr Ile Trp
115 120 125
Gln Leu Leu Ala Phe Phe Leu Ala Phe Phe Leu Asp Leu Ile Leu Leu
130 135 140
Ile Ile Ala Leu Tyr Leu Gln Gln Asn Trp Trp Thr Leu Leu Val Asp
145 150 155 160
Leu Leu Trp Leu Leu Leu Phe Leu Ala Ile Leu Ile Trp Met
165 170
<210> 296
<211> 184
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M009
<400> 296
Met Glu His Asp Leu Glu Arg Gly Pro Pro Gly Pro Arg Arg Pro Pro
1 5 10 15
Arg Gly Pro Pro Leu Ser Ser Ser Leu Gly Leu Ala Leu Leu Leu Leu
20 25 30
Leu Leu Ala Leu Leu Phe Trp Leu Tyr Ile Val Met Ser Asp Trp Thr
35 40 45
Gly Gly Ala Leu Leu Val Leu Tyr Ser Phe Ala Leu Met Leu Ile Ile
50 55 60
Ile Ile Leu Ile Ile Phe Ile Phe Arg Arg Asp Leu Leu Cys Pro Leu
65 70 75 80
Gly Ala Leu Cys Ile Leu Leu Leu Met Ile Thr Leu Leu Leu Ile Ala
85 90 95
Leu Trp Asn Leu His Gly Gln Ala Leu Phe Leu Gly Ile Val Leu Phe
100 105 110
Ile Phe Gly Cys Leu Leu Val Leu Gly Ile Trp Ile Tyr Leu Leu Glu
115 120 125
Met Leu Trp Arg Leu Gly Ala Thr Ile Trp Gln Leu Leu Ala Phe Phe
130 135 140
Leu Ala Phe Phe Leu Asp Leu Ile Leu Leu Ile Ile Ala Leu Tyr Leu
145 150 155 160
Gln Gln Asn Trp Trp Thr Leu Leu Val Asp Leu Leu Trp Leu Leu Leu
165 170 175
Phe Leu Ala Ile Leu Ile Trp Met
180
<210> 297
<211> 162
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M010
<400> 297
Met Ser Leu Gly Leu Ala Leu Leu Leu Leu Leu Leu Ala Leu Leu Phe
1 5 10 15
Trp Leu Tyr Ile Val Met Ser Asp Trp Thr Gly Gly Ala Leu Leu Val
20 25 30
Leu Tyr Ser Phe Ala Leu Met Leu Ile Ile Ile Ile Leu Ile Ile Phe
35 40 45
Ile Phe Arg Arg Asp Leu Leu Cys Pro Leu Gly Ala Leu Cys Ile Leu
50 55 60
Leu Leu Met Ile Thr Leu Leu Leu Ile Ala Leu Trp Asn Leu His Gly
65 70 75 80
Gln Ala Leu Phe Leu Gly Ile Val Leu Phe Ile Phe Gly Cys Leu Leu
85 90 95
Val Leu Gly Ile Trp Ile Tyr Leu Leu Glu Met Leu Trp Arg Leu Gly
100 105 110
Ala Thr Ile Trp Gln Leu Leu Ala Phe Phe Leu Ala Phe Phe Leu Asp
115 120 125
Leu Ile Leu Leu Ile Ile Ala Leu Tyr Leu Gln Gln Asn Trp Trp Thr
130 135 140
Leu Leu Val Asp Leu Leu Trp Leu Leu Leu Phe Leu Ala Ile Leu Ile
145 150 155 160
Trp Met
<210> 298
<211> 363
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M012
<400> 298
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Ala Glu Thr Pro Thr Pro Pro
325 330 335
Lys Pro Lys Leu Ser Lys Cys Ile Leu Ile Ser Ser Leu Ala Ile Leu
340 345 350
Leu Met Val Ser Leu Leu Leu Leu Ser Leu Trp
355 360
<210> 299
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M013
<400> 299
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Ala Glu Thr Pro Thr Pro Pro Lys Pro Lys Leu Ser Lys Cys Ile
195 200 205
Leu Ile Ser Ser Leu Ala Ile Leu Leu Met Val Ser Leu Leu Leu Leu
210 215 220
Ser Leu Trp
225
<210> 300
<211> 354
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M018
<400> 300
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Thr Glu Ser Val Leu Pro Met
325 330 335
Trp Val Leu Ala Leu Ile Glu Ile Phe Leu Thr Ile Ala Val Leu Leu
340 345 350
Ala Leu
<210> 301
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M019
<400> 301
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Thr Glu Ser Val Leu Pro Met Trp Val Leu Ala Leu Ile Glu Ile
195 200 205
Phe Leu Thr Ile Ala Val Leu Leu Ala Leu
210 215
<210> 302
<211> 360
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M024
<400> 302
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Thr Pro Glu Gly Ser Glu Leu
325 330 335
His Ile Ile Leu Gly Leu Phe Gly Leu Leu Leu Leu Leu Asn Cys Leu
340 345 350
Cys Gly Thr Ala Trp Leu Cys Cys
355 360
<210> 303
<211> 224
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M025
<400> 303
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Thr Pro Glu Gly Ser Glu Leu His Ile Ile Leu Gly Leu Phe Gly
195 200 205
Leu Leu Leu Leu Leu Asn Cys Leu Cys Gly Thr Ala Trp Leu Cys Cys
210 215 220
<210> 304
<211> 359
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M030
<400> 304
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Thr Pro Ser Asp Leu Asp Pro
325 330 335
Cys Cys Leu Thr Leu Ser Leu Ile Leu Val Val Ile Leu Val Leu Leu
340 345 350
Thr Val Leu Ala Leu Leu Ser
355
<210> 305
<211> 223
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M031
<400> 305
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Thr Pro Ser Asp Leu Asp Pro Cys Cys Leu Thr Leu Ser Leu Ile
195 200 205
Leu Val Val Ile Leu Val Leu Leu Thr Val Leu Ala Leu Leu Ser
210 215 220
<210> 306
<211> 368
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M036
<400> 306
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Thr Leu Pro Gln Met Ser Gln
325 330 335
Phe Thr Cys Cys Glu Asp Phe Tyr Phe Pro Trp Leu Leu Cys Ile Ile
340 345 350
Phe Gly Ile Phe Gly Leu Thr Val Met Leu Phe Val Phe Leu Phe Ser
355 360 365
<210> 307
<211> 232
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M037
<400> 307
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Thr Leu Pro Gln Met Ser Gln Phe Thr Cys Cys Glu Asp Phe Tyr
195 200 205
Phe Pro Trp Leu Leu Cys Ile Ile Phe Gly Ile Phe Gly Leu Thr Val
210 215 220
Met Leu Phe Val Phe Leu Phe Ser
225 230
<210> 308
<211> 360
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M042
<400> 308
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly His Leu Pro Asp Asn Thr Leu
325 330 335
Arg Trp Lys Val Leu Pro Gly Ile Leu Cys Leu Trp Gly Leu Phe Leu
340 345 350
Leu Gly Cys Gly Leu Ser Leu Ala
355 360
<210> 309
<211> 224
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M043
<400> 309
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln His Leu Pro Asp Asn Thr Leu Arg Trp Lys Val Leu Pro Gly Ile
195 200 205
Leu Cys Leu Trp Gly Leu Phe Leu Leu Gly Cys Gly Leu Ser Leu Ala
210 215 220
<210> 310
<211> 359
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M048
<400> 310
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Glu Thr Ala Thr Glu Thr Ala
325 330 335
Trp Ile Ser Leu Val Thr Ala Leu His Leu Val Leu Gly Leu Asn Ala
340 345 350
Val Leu Gly Leu Leu Leu Leu
355
<210> 311
<211> 223
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид M049
<400> 311
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Glu Thr Ala Thr Glu Thr Ala Trp Ile Ser Leu Val Thr Ala Leu
195 200 205
His Leu Val Leu Gly Leu Asn Ala Val Leu Gly Leu Leu Leu Leu
210 215 220
<210> 312
<211> 368
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E006
<400> 312
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Leu Glu Arg Ile Ala Arg Leu
325 330 335
Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser
340 345 350
Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val
355 360 365
<210> 313
<211> 369
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E007
<400> 313
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Leu Glu Arg Ile Ala Arg Leu
325 330 335
Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser
340 345 350
Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val
355 360 365
Ala
<210> 314
<211> 370
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E008
<400> 314
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Leu Glu Arg Ile Ala Arg Leu
325 330 335
Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser
340 345 350
Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val
355 360 365
Ala Ala
370
<210> 315
<211> 371
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E009
<400> 315
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Leu Glu Arg Ile Ala Arg Leu
325 330 335
Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser
340 345 350
Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val
355 360 365
Ala Ala Ala
370
<210> 316
<211> 372
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E010
<400> 316
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Leu Glu Arg Ile Ala Arg Leu
325 330 335
Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser
340 345 350
Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val
355 360 365
Ala Ala Ala Ala
370
<210> 317
<211> 69
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E011
<400> 317
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Leu Glu
20 25 30
Arg Ile Ala Arg Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn
35 40 45
Ser Glu Leu Ala Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln
50 55 60
Leu Lys Gln Lys Val
65
<210> 318
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E012
<400> 318
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Leu Glu
20 25 30
Arg Ile Ala Arg Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn
35 40 45
Ser Glu Leu Ala Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln
50 55 60
Leu Lys Gln Lys Val Ala
65 70
<210> 319
<211> 71
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E013
<400> 319
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Leu Glu
20 25 30
Arg Ile Ala Arg Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn
35 40 45
Ser Glu Leu Ala Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln
50 55 60
Leu Lys Gln Lys Val Ala Ala
65 70
<210> 320
<211> 72
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E014
<400> 320
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Leu Glu
20 25 30
Arg Ile Ala Arg Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn
35 40 45
Ser Glu Leu Ala Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln
50 55 60
Leu Lys Gln Lys Val Ala Ala Ala
65 70
<210> 321
<211> 73
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид E015
<400> 321
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Leu Glu
20 25 30
Arg Ile Ala Arg Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn
35 40 45
Ser Glu Leu Ala Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln
50 55 60
Leu Lys Gln Lys Val Ala Ala Ala Ala
65 70
<210> 322
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T001
<400> 322
Leu Ile Ile Gly Ile Cys Gly Gly Gly Ser Leu Leu Met Val Phe Val
1 5 10 15
Ala Leu Leu Val Phe Tyr Ile
20
<210> 323
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T002
<400> 323
Gly Ile Ile Val Thr Asp Val Ile Ala Thr Leu Leu Leu Ala Leu Gly
1 5 10 15
Val Phe Cys Phe Ala
20
<210> 324
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T003
<400> 324
Val Met Ser Val Ala Thr Ile Val Ile Val Asp Ile Cys Ile Thr Gly
1 5 10 15
Gly Leu Leu Leu Leu Val Tyr Tyr Trp Ser
20 25
<210> 325
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T004
<400> 325
Gly Phe Leu Phe Ala Glu Ile Val Ser Ile Phe Val Leu Ala Val Gly
1 5 10 15
Val Tyr Phe Ile Ala
20
<210> 326
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T005
<400> 326
Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu
1 5 10 15
Thr Ala Leu Phe Leu
20
<210> 327
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T006
<400> 327
Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly Leu Leu Leu Phe Ile
1 5 10 15
Gly Leu Gly Ile Phe Phe
20
<210> 328
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T007
<400> 328
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr
20
<210> 329
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T008
<400> 329
Leu Gly Leu Leu Val Ala Gly Val Leu Val Leu Leu Val Ser Leu Gly
1 5 10 15
Val Ala Ile His Leu Cys Cys
20
<210> 330
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T009
<400> 330
Ile Leu Val Ile Phe Ser Gly Met Phe Leu Val Phe Thr Leu Ala Gly
1 5 10 15
Ala Leu Phe Leu His
20
<210> 331
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T010
<400> 331
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 332
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T011
<400> 332
Ala Leu Val Val Ile Pro Ile Ile Phe Gly Ile Leu Phe Ala Ile Leu
1 5 10 15
Leu Val Leu Val Phe Ile
20
<210> 333
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T012
<400> 333
Ile Ile Thr Ala Glu Gly Ile Ile Leu Leu Phe Cys Ala Val Val Pro
1 5 10 15
Gly Thr Leu Leu Leu Phe
20
<210> 334
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T013
<400> 334
Gly Ile Ile Met Ile Gln Thr Leu Leu Ile Ile Leu Phe Ile Ile Val
1 5 10 15
Pro Ile Phe Leu Leu Leu
20
<210> 335
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T014
<400> 335
Phe Ile Leu Ile Ser Ser Leu Ala Ile Leu Leu Met Val Ser Leu Leu
1 5 10 15
Leu Leu Ser Leu Trp
20
<210> 336
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T015
<400> 336
Cys Ile Leu Ile Ser Ser Leu Ala Ile Leu Leu Met Val Ser Leu Leu
1 5 10 15
Leu Leu Ser Leu Trp
20
<210> 337
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T016
<400> 337
Asn Leu Gly Ser Val Tyr Ile Tyr Val Leu Leu Ile Val Gly Thr Leu
1 5 10 15
Val Cys Gly Ile Val Leu Gly Phe Leu Phe
20 25
<210> 338
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T017
<400> 338
Met Trp Val Leu Ala Leu Ile Val Ile Phe Leu Thr Ile Ala Val Leu
1 5 10 15
Leu Ala Leu
<210> 339
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T018
<400> 339
Met Trp Val Leu Ala Leu Ile Glu Ile Phe Leu Thr Ile Ala Val Leu
1 5 10 15
Leu Ala Leu
<210> 340
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T019
<400> 340
Ile Ile Leu Gly Leu Phe Gly Leu Leu Leu Leu Leu Thr Cys Leu Cys
1 5 10 15
Gly Thr Ala Trp Leu Cys Cys
20
<210> 341
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T020
<400> 341
Ile Ile Leu Gly Leu Phe Gly Leu Leu Leu Leu Leu Asn Cys Leu Cys
1 5 10 15
Gly Thr Ala Trp Leu Cys Cys
20
<210> 342
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T021
<400> 342
Leu Ile Leu Thr Leu Ser Leu Ile Leu Val Val Ile Leu Val Leu Leu
1 5 10 15
Thr Val Leu Ala Leu Leu Ser
20
<210> 343
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T022
<400> 343
Cys Cys Leu Thr Leu Ser Leu Ile Leu Val Val Ile Leu Val Leu Leu
1 5 10 15
Thr Val Leu Ala Leu Leu Ser
20
<210> 344
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T023
<400> 344
Leu Cys Tyr Ile Leu Asp Ala Ile Leu Phe Leu Tyr Gly Ile Val Leu
1 5 10 15
Thr Leu Leu Tyr Cys
20
<210> 345
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T024
<400> 345
Ile Ile Val Ala Val Val Thr Gly Ile Ala Val Ala Ala Ile Val Ala
1 5 10 15
Ala Val Val Ala Leu Ile Tyr
20
<210> 346
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T025
<400> 346
Ile Ile Val Ala Val Val Ile Ala Thr Ala Val Ala Ala Ile Val Ala
1 5 10 15
Ala Val Val Ala Leu Ile Tyr
20
<210> 347
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T026
<400> 347
Phe Pro Trp Leu Leu Ile Ile Ile Phe Gly Ile Phe Gly Leu Thr Val
1 5 10 15
Met Leu Phe Val Phe Leu Phe Ser
20
<210> 348
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T027
<400> 348
Phe Pro Trp Leu Leu Cys Ile Ile Phe Gly Ile Phe Gly Leu Thr Val
1 5 10 15
Met Leu Phe Val Phe Leu Phe Ser
20
<210> 349
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T028
<400> 349
Phe Trp Leu Pro Ile Gly Cys Ala Ala Phe Val Val Val Cys Ile Leu
1 5 10 15
Gly Cys Ile Leu Ile
20
<210> 350
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T029
<400> 350
Ile Trp Leu Ile Val Gly Ile Cys Ile Ala Leu Phe Ala Leu Pro Phe
1 5 10 15
Val Ile Tyr Ala Ala
20
<210> 351
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T030
<400> 351
Ile Gly Gly Ile Ile Thr Val Phe Leu Ile Ala Leu Val Leu Thr Ser
1 5 10 15
Thr Ile Val Thr Leu
20
<210> 352
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T031
<400> 352
Ser Leu Trp Ile Pro Val Val Ala Ala Leu Leu Leu Phe Leu Val Leu
1 5 10 15
Ser Leu Val Phe Ile
20
<210> 353
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T032
<400> 353
Val Ile Leu Ile Ser Val Gly Thr Phe Ser Leu Leu Ser Val Leu Ala
1 5 10 15
Gly Ala Cys Phe Phe
20
<210> 354
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T033
<400> 354
Phe Leu Val Leu Pro Ser Leu Leu Ile Leu Leu Leu Val Ile Ala Ala
1 5 10 15
Gly Gly Val Ile Trp
20
<210> 355
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T034
<400> 355
His Met Ile Gly Ile Cys Val Thr Leu Thr Val Ile Ile Val Cys Ser
1 5 10 15
Val Phe Ile Tyr Lys Ile Phe
20
<210> 356
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T035
<400> 356
Val Leu Leu Val Val Ile Leu Ile Val Val Tyr His Val Tyr Trp Leu
1 5 10 15
Glu Met Val Leu Phe
20
<210> 357
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T036
<400> 357
Ile Tyr Cys Ile Ile Ala Val Cys Ser Val Phe Leu Met Leu Ile Asn
1 5 10 15
Val Leu Val Ile Ile
20
<210> 358
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T037
<400> 358
Ala Tyr Leu Ile Gly Gly Leu Ile Ala Leu Val Ala Val Ala Val Ser
1 5 10 15
Val Val Tyr Ile Tyr
20
<210> 359
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T038
<400> 359
Val Ala Val Ala Gly Cys Val Phe Leu Leu Ile Ser Val Leu Leu Leu
1 5 10 15
Ser Gly Leu
<210> 360
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T039
<400> 360
Ile Pro Trp Leu Gly His Leu Leu Val Gly Leu Ser Gly Ala Phe Gly
1 5 10 15
Phe Ile Ile Leu Val Tyr Leu Leu Ile
20 25
<210> 361
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T040
<400> 361
Val Val Ile Ser Val Gly Ser Met Gly Leu Ile Ile Ser Leu Leu Cys
1 5 10 15
Val Tyr Phe Trp Leu
20
<210> 362
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T041
<400> 362
Thr Ser Leu Leu Ile Ala Leu Gly Thr Leu Leu Ala Leu Val Cys Val
1 5 10 15
Phe Val Ile Cys
20
<210> 363
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T042
<400> 363
Leu Leu Leu Gly Val Ser Val Ser Cys Ile Val Ile Leu Ala Val Cys
1 5 10 15
Leu Leu Cys Tyr Val Ser Ile Thr
20
<210> 364
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T043
<400> 364
Phe Val Ile Val Ile Met Ala Thr Ile Cys Phe Ile Leu Leu Ile Leu
1 5 10 15
Ser Leu Ile Cys
20
<210> 365
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T044
<400> 365
Thr Phe Leu Val Ala Gly Gly Ser Leu Ala Phe Gly Thr Leu Leu Cys
1 5 10 15
Ile Ala Ile Val Leu
20
<210> 366
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T045
<400> 366
Ala Ile Val Val Pro Val Cys Leu Ala Phe Leu Leu Thr Thr Leu Leu
1 5 10 15
Gly Val Leu Phe Cys Phe
20
<210> 367
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T046
<400> 367
Ile Leu Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser Val Ala Leu Leu
1 5 10 15
Val Ile Leu Ala Cys Val Leu
20
<210> 368
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T047
<400> 368
Ile Leu Leu Pro Pro Cys Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser
1 5 10 15
Val Ala Leu Leu Val Ile Leu Ala Cys Val Leu
20 25
<210> 369
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T048
<400> 369
Gly Asn Thr Leu Val Ala Val Ser Ile Phe Leu Leu Leu Thr Gly Pro
1 5 10 15
Thr Tyr Leu Leu Phe
20
<210> 370
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T049
<400> 370
Val Ile Ile Phe Phe Ala Phe Val Leu Leu Leu Ser Gly Ala Leu Ala
1 5 10 15
Tyr Cys Leu Ala Leu
20
<210> 371
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T050
<400> 371
Trp Met Val Ala Val Ile Leu Met Ala Ser Val Phe Met Val Cys Leu
1 5 10 15
Ala Leu Leu Gly Cys Phe
20
<210> 372
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T051
<400> 372
Ser Leu Gly Ile Leu Ser Phe Leu Gly Leu Val Ala Gly Ala Leu Ala
1 5 10 15
Leu Gly Leu Trp Leu
20
<210> 373
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T052
<400> 373
Trp Leu Ile Phe Phe Ala Ser Leu Gly Ser Phe Leu Ser Ile Leu Leu
1 5 10 15
Val Gly Val Leu Gly Tyr Leu Gly Leu
20 25
<210> 374
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T053
<400> 374
Trp Met Ala Phe Val Ala Pro Ser Ile Cys Ile Ala Ile Ile Met Val
1 5 10 15
Gly Ile Phe Ser Thr
20
<210> 375
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T054
<400> 375
Leu Tyr Ile Thr Met Leu Leu Ile Val Pro Val Ile Val Ala Gly Ala
1 5 10 15
Ile Ile Val Leu Leu Leu Tyr Leu
20
<210> 376
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T055
<400> 376
Phe Trp Leu Pro Phe Gly Phe Ile Leu Ile Leu Val Ile Phe Val Thr
1 5 10 15
Gly Leu Leu Leu
20
<210> 377
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T056
<400> 377
Val Ala Ile Ser Thr Ser Thr Val Leu Leu Cys Gly Leu Ser Ala Val
1 5 10 15
Ser Leu Leu Ala Cys Tyr Leu
20
<210> 378
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T057
<400> 378
Val Tyr Trp Phe Ile Thr Gly Ile Ser Ile Leu Leu Val Gly Ser Val
1 5 10 15
Ile Leu Leu Ile Val
20
<210> 379
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T058
<400> 379
Leu Leu Leu Leu Ser Leu Leu Val Ala Thr Trp Val Leu Val Ala Gly
1 5 10 15
Ile Tyr Leu Met Trp
20
<210> 380
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T059
<400> 380
Trp Ala Leu Val Trp Leu Ala Cys Leu Leu Phe Ala Ala Ala Leu Ser
1 5 10 15
Leu Ile Leu Leu Leu
20
<210> 381
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T060
<400> 381
Ala Val Ala Ile Thr Val Pro Leu Val Val Ile Ser Ala Phe Ala Thr
1 5 10 15
Leu Phe Thr Val Met
20
<210> 382
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T061
<400> 382
Leu Gly Leu Leu Ile Leu Ala Leu Leu Ala Leu Leu Thr Leu Leu Gly
1 5 10 15
Val Val Leu Ala Leu
20
<210> 383
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T062
<400> 383
Gly Met Ile Ile Ala Val Leu Ile Leu Val Ala Val Val Cys Leu Val
1 5 10 15
Thr Val Cys Val Ile
20
<210> 384
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T063
<400> 384
Gly Val Val Leu Leu Tyr Ile Leu Leu Gly Thr Ile Gly Thr Leu Val
1 5 10 15
Ala Val Leu Ala Ala
20
<210> 385
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T064
<400> 385
Ile Ile Phe Trp Tyr Val Leu Pro Ile Ser Ile Thr Val Phe Leu Phe
1 5 10 15
Ser Val Met Gly Tyr
20
<210> 386
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T065
<400> 386
Val Leu Ala Leu Phe Ala Phe Val Gly Phe Met Leu Ile Leu Val Val
1 5 10 15
Val Pro Leu Phe Val
20
<210> 387
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T066
<400> 387
Gly Trp Asn Pro His Leu Leu Leu Leu Leu Leu Leu Val Ile Val Phe
1 5 10 15
Ile Pro Ala Phe Trp
20
<210> 388
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T067
<400> 388
Tyr Ser Phe Ser Gly Ala Phe Leu Phe Ser Met Gly Phe Leu Val Ala
1 5 10 15
Val Leu Cys Tyr Leu
20
<210> 389
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T068
<400> 389
Leu Leu Leu Gly Met Ile Val Phe Ala Val Met Leu Ser Ile Leu Ser
1 5 10 15
Leu Ile Gly Ile Phe
20
<210> 390
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T069
<400> 390
Val Leu Pro Gly Ile Leu Phe Leu Trp Gly Leu Phe Leu Leu Gly Cys
1 5 10 15
Gly Leu Ser Leu Ala
20
<210> 391
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T070
<400> 391
Val Leu Pro Gly Ile Leu Cys Leu Trp Gly Leu Phe Leu Leu Gly Cys
1 5 10 15
Gly Leu Ser Leu Ala
20
<210> 392
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T071
<400> 392
Ile Ile Leu Ile Thr Ser Leu Ile Gly Gly Gly Leu Leu Ile Leu Ile
1 5 10 15
Ile Leu Thr Val Ala Tyr Gly Leu
20
<210> 393
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T072
<400> 393
Ala Gly Leu Tyr Val Ile Val Pro Val Ile Ile Ser Ser Ser Ile Leu
1 5 10 15
Leu Leu Gly Thr Leu Leu Ile
20
<210> 394
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T073
<400> 394
Val Gly Leu Ile Ile Ala Ile Leu Ile Pro Val Ala Val Ala Val Ile
1 5 10 15
Val Gly Val Val Thr Ser Ile Leu Cys
20 25
<210> 395
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T074
<400> 395
Ile Ser Leu Val Thr Ala Leu His Leu Val Leu Gly Leu Ser Ala Val
1 5 10 15
Leu Gly Leu Leu Leu Leu
20
<210> 396
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T075
<400> 396
Ile Ser Leu Val Thr Ala Leu His Leu Val Leu Gly Leu Asn Ala Val
1 5 10 15
Leu Gly Leu Leu Leu Leu
20
<210> 397
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T076
<400> 397
Leu Ile His Ile Leu Leu Pro Met Val Phe Cys Val Leu Leu Ile Met
1 5 10 15
Val Met Cys Tyr Leu
20
<210> 398
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T077
<400> 398
Thr Thr Val Trp Ile Ser Val Ala Val Leu Ser Ala Val Ile Cys Leu
1 5 10 15
Ile Ile Val Trp Ala Val Ala Leu
20
<210> 399
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T078
<400> 399
Val Ala Ala Ile Leu Gly Leu Gly Leu Val Leu Gly Leu Leu Gly Pro
1 5 10 15
Leu Ala Ile Leu Leu
20
<210> 400
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T079
<400> 400
Pro Val Leu Asp Ala Gly Pro Val Leu Phe Trp Val Ile Leu Val Leu
1 5 10 15
Val Val Val Val Gly Ser Ser Ala Phe Leu Leu Cys
20 25
<210> 401
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T080
<400> 401
Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu
1 5 10 15
Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val
20 25
<210> 402
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T081
<400> 402
Trp Trp Phe Leu Ser Gly Ser Leu Val Ile Val Ile Val Cys Ser Thr
1 5 10 15
Val Gly Leu Ile Ile
20
<210> 403
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид T082
<400> 403
Leu Gly Trp Leu Thr Val Val Leu Leu Ala Val Ala Ala Cys Val Leu
1 5 10 15
Leu Leu Thr Ser Ala
20
<210> 404
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S036
<400> 404
Thr Lys Arg Lys Lys Gln Arg Ser Arg Arg Asn Asp Glu Glu Leu Glu
1 5 10 15
Thr Arg Ala His Arg Val Ala Thr Glu Glu Arg Gly Arg Lys Pro His
20 25 30
Gln Ile Pro Ala Ser Thr Pro Gln Asn Pro Ala Thr Ser Gln His Pro
35 40 45
Pro Pro Pro Pro Gly His Arg Ser Gln Ala Pro Ser His Arg Pro Pro
50 55 60
Pro Pro Gly His Arg Val Gln His Gln Pro Gln Lys Arg Pro Pro Ala
65 70 75 80
Pro Ser Gly Thr Gln Val His Gln Gln Lys Gly Pro Pro Leu Pro Arg
85 90 95
Pro Arg Val Gln Pro Lys Pro Pro His Gly Ala Ala Glu Asn Ser Leu
100 105 110
Ser Pro Ser Ser Asn
115
<210> 405
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S037
<400> 405
Gly His Glu Thr Gly Arg Leu Ser Gly Ala Ala Asp Thr Gln Ala Leu
1 5 10 15
Leu Arg Asn Asp Gln Val Tyr Gln Pro Leu Arg Asp Arg Asp Asp Ala
20 25 30
Gln Tyr Ser His Leu Gly Gly Asn Trp Ala Arg Asn Lys
35 40 45
<210> 406
<211> 55
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S038
<400> 406
Lys Asn Arg Lys Ala Lys Ala Lys Pro Val Thr Arg Gly Ala Gly Ala
1 5 10 15
Gly Gly Arg Gln Arg Gly Gln Asn Lys Glu Arg Pro Pro Pro Val Pro
20 25 30
Asn Pro Asp Tyr Glu Pro Ile Arg Lys Gly Gln Arg Asp Leu Tyr Ser
35 40 45
Gly Leu Asn Gln Arg Arg Ile
50 55
<210> 407
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S039
<400> 407
Gly Gln Asp Gly Val Arg Gln Ser Arg Ala Ser Asp Lys Gln Thr Leu
1 5 10 15
Leu Pro Asn Asp Gln Leu Tyr Gln Pro Leu Lys Asp Arg Glu Asp Asp
20 25 30
Gln Tyr Ser His Leu Gln Gly Asn Gln Leu Arg Arg Asn
35 40 45
<210> 408
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S042
<400> 408
Cys Val Arg Cys Arg His Arg Arg Arg Gln Ala Glu Arg Met Ser Gln
1 5 10 15
Ile Lys Arg Leu Leu Ser Glu Lys Lys Thr Cys Gln Cys Pro His Arg
20 25 30
Phe Gln Lys Thr Cys Ser Pro Ile
35 40
<210> 409
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S043
<400> 409
Leu Tyr Cys Asn His Arg Asn Arg Arg Arg Val Cys Lys Cys Pro Arg
1 5 10 15
Pro Val Val Lys Ser Gly Asp Lys Pro Ser Leu Ser Ala Arg Tyr Val
20 25 30
<210> 410
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S044
<400> 410
Arg Arg Arg Arg Ala Arg Leu Arg Phe Met Lys Gln Pro Gln Gly Glu
1 5 10 15
Gly Ile Ser Gly Thr Phe Val Pro Gln Cys Leu His Gly Tyr Tyr Ser
20 25 30
Asn Thr Thr Thr Ser Gln Lys Leu Leu Asn Pro Trp Ile Leu Lys Thr
35 40 45
<210> 411
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S045
<400> 411
Arg Arg Arg Arg Ala Arg Leu Arg Phe Met Lys Gln Leu Arg Leu His
1 5 10 15
Pro Leu Glu Lys Cys Ser Arg Met Asp Tyr
20 25
<210> 412
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S046
<400> 412
Arg Arg Arg Arg Ala Arg Leu Arg Phe Met Lys Gln Phe Tyr Lys
1 5 10 15
<210> 413
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S047
<400> 413
Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu Pro
1 5 10 15
Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser Thr
20 25 30
Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser Pro
35 40 45
<210> 414
<211> 41
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S048
<400> 414
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Ala Tyr Ala Ala
20 25 30
Ala Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 415
<211> 41
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S049
<400> 415
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 416
<211> 62
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S050
<400> 416
Lys Lys Val Ala Lys Lys Pro Thr Asn Lys Ala Pro His Pro Lys Gln
1 5 10 15
Glu Pro Gln Glu Ile Asn Phe Pro Asp Asp Leu Pro Gly Ser Asn Thr
20 25 30
Ala Ala Pro Val Gln Glu Thr Leu His Gly Cys Gln Pro Val Thr Gln
35 40 45
Glu Asp Gly Lys Glu Ser Arg Ile Ser Val Gln Glu Arg Gln
50 55 60
<210> 417
<211> 66
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S051
<400> 417
Ser Glu Ser Ser Glu Lys Val Ala Lys Lys Pro Thr Asn Lys Ala Pro
1 5 10 15
His Pro Lys Gln Glu Pro Gln Glu Ile Asn Phe Pro Asp Asp Leu Pro
20 25 30
Gly Ser Asn Thr Ala Ala Pro Val Gln Glu Thr Leu His Gly Cys Gln
35 40 45
Pro Val Thr Gln Glu Asp Gly Lys Glu Ser Arg Ile Ser Val Gln Glu
50 55 60
Arg Gln
65
<210> 418
<211> 61
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S052
<400> 418
Arg Lys Arg Trp Gln Asn Glu Lys Leu Gly Leu Asp Ala Gly Asp Glu
1 5 10 15
Tyr Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn Leu Asp Asp Cys Ser
20 25 30
Met Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly Thr Tyr Gln Asp Val
35 40 45
Gly Ser Leu Asn Ile Gly Asp Val Gln Leu Glu Lys Pro
50 55 60
<210> 419
<211> 49
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S053
<400> 419
Leu Asp Lys Asp Asp Ser Lys Ala Gly Met Glu Glu Asp His Thr Tyr
1 5 10 15
Glu Gly Leu Asp Ile Asp Gln Thr Ala Thr Tyr Glu Asp Ile Val Thr
20 25 30
Leu Arg Thr Gly Glu Val Lys Trp Ser Val Gly Glu His Pro Gly Gln
35 40 45
Glu
<210> 420
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S054
<400> 420
Lys Leu Trp Arg Val Lys Lys Phe Leu Ile Pro Ser Val Pro Asp Pro
1 5 10 15
Lys Ser Ile Phe Pro Gly Leu Phe Glu Ile His Gln Gly Asn Phe Gln
20 25 30
Glu Trp Ile Thr Asp Thr Gln Asn Val Ala His Leu His Lys Met Ala
35 40 45
Gly Ala Glu Gln Glu Ser Gly Pro Glu Glu Pro Leu Val Val Gln Leu
50 55 60
Ala Lys Thr Glu Ala Glu Ser Pro Arg Met Leu Asp Pro Gln Thr Glu
65 70 75 80
Glu Lys Glu Ala Ser Gly Gly Ser Leu Gln Leu Pro His Gln Pro Leu
85 90 95
Gln Gly Gly Asp Val Val Thr Ile Gly Gly Phe Thr Phe Val Met Asn
100 105 110
Asp Arg Ser Tyr Val Ala Leu
115
<210> 421
<211> 437
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S057
<400> 421
Arg Phe Cys Gly Ile Tyr Gly Tyr Arg Leu Arg Arg Lys Trp Glu Glu
1 5 10 15
Lys Ile Pro Asn Pro Ser Lys Ser His Leu Phe Gln Asn Gly Ser Ala
20 25 30
Glu Leu Trp Pro Pro Gly Ser Met Ser Ala Phe Thr Ser Gly Ser Pro
35 40 45
Pro His Gln Gly Pro Trp Gly Ser Arg Phe Pro Glu Leu Glu Gly Val
50 55 60
Phe Pro Val Gly Phe Gly Asp Ser Glu Val Ser Pro Leu Thr Ile Glu
65 70 75 80
Asp Pro Lys His Val Cys Asp Pro Pro Ser Gly Pro Asp Thr Thr Pro
85 90 95
Ala Ala Ser Asp Leu Pro Thr Glu Gln Pro Pro Ser Pro Gln Pro Gly
100 105 110
Pro Pro Ala Ala Ser His Thr Pro Glu Lys Gln Ala Ser Ser Phe Asp
115 120 125
Phe Asn Gly Pro Tyr Leu Gly Pro Pro His Ser Arg Ser Leu Pro Asp
130 135 140
Ile Leu Gly Gln Pro Glu Pro Pro Gln Glu Gly Gly Ser Gln Lys Ser
145 150 155 160
Pro Pro Pro Gly Ser Leu Glu Tyr Leu Cys Leu Pro Ala Gly Gly Gln
165 170 175
Val Gln Leu Val Pro Leu Ala Gln Ala Met Gly Pro Gly Gln Ala Val
180 185 190
Glu Val Glu Arg Arg Pro Ser Gln Gly Ala Ala Gly Ser Pro Ser Leu
195 200 205
Glu Ser Gly Gly Gly Pro Ala Pro Pro Ala Leu Gly Pro Arg Val Gly
210 215 220
Gly Gln Asp Gln Lys Asp Ser Pro Val Ala Ile Pro Met Ser Ser Gly
225 230 235 240
Asp Thr Glu Asp Pro Gly Val Ala Ser Gly Tyr Val Ser Ser Ala Asp
245 250 255
Leu Val Phe Thr Pro Asn Ser Gly Ala Ser Ser Val Ser Leu Val Pro
260 265 270
Ser Leu Gly Leu Pro Ser Asp Gln Thr Pro Ser Leu Cys Pro Gly Leu
275 280 285
Ala Ser Gly Pro Pro Gly Ala Pro Gly Pro Val Lys Ser Gly Phe Glu
290 295 300
Gly Tyr Val Glu Leu Pro Pro Ile Glu Gly Arg Ser Pro Arg Ser Pro
305 310 315 320
Arg Asn Asn Pro Val Pro Pro Glu Ala Lys Ser Pro Val Leu Asn Pro
325 330 335
Gly Glu Arg Pro Ala Asp Val Ser Pro Thr Ser Pro Gln Pro Glu Gly
340 345 350
Leu Leu Val Leu Gln Gln Val Gly Asp Tyr Cys Phe Leu Pro Gly Leu
355 360 365
Gly Pro Gly Pro Leu Ser Leu Arg Ser Lys Pro Ser Ser Pro Gly Pro
370 375 380
Gly Pro Glu Ile Lys Asn Leu Asp Gln Ala Phe Gln Val Lys Lys Pro
385 390 395 400
Pro Gly Gln Ala Val Pro Gln Val Pro Val Ile Gln Leu Phe Lys Ala
405 410 415
Leu Lys Gln Gln Asp Tyr Leu Ser Leu Pro Pro Trp Glu Val Asn Lys
420 425 430
Pro Gly Glu Val Cys
435
<210> 422
<211> 54
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S058
<400> 422
Lys Arg Phe Leu Arg Ile Gln Arg Leu Phe Pro Pro Val Pro Gln Ile
1 5 10 15
Lys Asp Lys Leu Asn Asp Asn His Glu Val Glu Asp Glu Ile Ile Trp
20 25 30
Glu Glu Phe Thr Pro Glu Glu Gly Lys Gly Tyr Arg Glu Glu Val Leu
35 40 45
Thr Val Lys Glu Ile Thr
50
<210> 423
<211> 64
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S059
<400> 423
Lys Arg Phe Leu Arg Ile Gln Arg Leu Phe Pro Pro Val Pro Gln Ile
1 5 10 15
Lys Asp Lys Leu Asn Asp Asn His Glu Val Glu Asp Glu Met Gly Pro
20 25 30
Gln Arg His His Arg Cys Gly Trp Asn Leu Tyr Pro Thr Pro Gly Pro
35 40 45
Ser Pro Gly Ser Gly Ser Ser Pro Arg Leu Gly Ser Glu Ser Ser Leu
50 55 60
<210> 424
<211> 186
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S062
<400> 424
Ser Pro Asn Arg Lys Asn Pro Leu Trp Pro Ser Val Pro Asp Pro Ala
1 5 10 15
His Ser Ser Leu Gly Ser Trp Val Pro Thr Ile Met Glu Glu Asp Ala
20 25 30
Phe Gln Leu Pro Gly Leu Gly Thr Pro Pro Ile Thr Lys Leu Thr Val
35 40 45
Leu Glu Glu Asp Glu Lys Lys Pro Val Pro Trp Glu Ser His Asn Ser
50 55 60
Ser Glu Thr Cys Gly Leu Pro Thr Leu Val Gln Thr Tyr Val Leu Gln
65 70 75 80
Gly Asp Pro Arg Ala Val Ser Thr Gln Pro Gln Ser Gln Ser Gly Thr
85 90 95
Ser Asp Gln Val Leu Tyr Gly Gln Leu Leu Gly Ser Pro Thr Ser Pro
100 105 110
Gly Pro Gly His Tyr Leu Arg Cys Asp Ser Thr Gln Pro Leu Leu Ala
115 120 125
Gly Leu Thr Pro Ser Pro Lys Ser Tyr Glu Asn Leu Trp Phe Gln Ala
130 135 140
Ser Pro Leu Gly Thr Leu Val Thr Pro Ala Pro Ser Gln Glu Asp Asp
145 150 155 160
Cys Val Phe Gly Pro Leu Leu Asn Phe Pro Leu Leu Gln Gly Ile Arg
165 170 175
Val His Gly Met Glu Ala Leu Gly Ser Phe
180 185
<210> 425
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S063
<400> 425
Ser Pro Asn Arg Lys Asn Pro Leu Trp Pro Ser Val Pro Asp Pro Ala
1 5 10 15
His Ser Ser Leu Gly Ser Trp Val Pro Thr Ile Met Glu Glu Leu Pro
20 25 30
Gly Pro Arg Gln Gly Gln Trp Leu Gly Gln Thr Ser Glu Met Ser Arg
35 40 45
Ala Leu Thr Pro His Pro Cys Val Gln Asp Ala Phe Gln Leu Pro Gly
50 55 60
Leu Gly Thr Pro Pro Ile Thr Lys Leu Thr Val Leu Glu Glu Asp Glu
65 70 75 80
Lys Lys Pro Val Pro Trp Glu Ser His Asn Ser Ser Glu Thr Cys Gly
85 90 95
Leu Pro Thr Leu Val Gln Thr Tyr Val Leu Gln Gly Asp Pro Arg Ala
100 105 110
Val Ser Thr Gln Pro Gln Ser Gln Ser Gly Thr Ser Asp Gln Val Leu
115 120 125
Tyr Gly Gln Leu Leu Gly Ser Pro Thr Ser Pro Gly Pro Gly His Tyr
130 135 140
Leu Arg Cys Asp Ser Thr Gln Pro Leu Leu Ala Gly Leu Thr Pro Ser
145 150 155 160
Pro Lys Ser Tyr Glu Asn Leu Trp Phe Gln Ala Ser Pro Leu Gly Thr
165 170 175
Leu Val Thr Pro Ala Pro Ser Gln Glu Asp Asp Cys Val Phe Gly Pro
180 185 190
Leu Leu Asn Phe Pro Leu Leu Gln Gly Ile Arg Val His Gly Met Glu
195 200 205
Ala Leu Gly Ser Phe
210
<210> 426
<211> 133
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S064
<400> 426
Ser Pro Asn Arg Lys Asn Pro Leu Trp Pro Ser Val Pro Asp Pro Ala
1 5 10 15
His Ser Ser Leu Gly Ser Trp Val Pro Thr Ile Met Glu Glu Asp Ala
20 25 30
Phe Gln Leu Pro Gly Leu Gly Thr Pro Pro Ile Thr Lys Leu Thr Val
35 40 45
Leu Glu Glu Asp Glu Lys Lys Pro Val Pro Trp Glu Ser His Asn Ser
50 55 60
Ser Glu Thr Cys Gly Leu Pro Thr Leu Val Gln Thr Tyr Val Leu Gln
65 70 75 80
Gly Asp Pro Arg Ala Val Ser Thr Gln Pro Gln Ser Gln Ser Gly Thr
85 90 95
Ser Asp Gln Ala Gly Pro Pro Arg Arg Ser Ala Tyr Phe Lys Asp Gln
100 105 110
Ile Met Leu His Pro Ala Pro Pro Asn Gly Leu Leu Cys Leu Phe Pro
115 120 125
Ile Thr Ser Val Leu
130
<210> 427
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S069
<400> 427
His Arg Arg Ala Leu Lys Gln Lys Ile Trp Pro Gly Ile Pro Ser Pro
1 5 10 15
Glu Ser Glu Phe Glu Gly Leu Phe Thr Thr His Lys Gly Asn Phe Gln
20 25 30
Leu Trp Leu Tyr Gln Asn Asp Gly Cys Leu Trp Trp Ser Pro Cys Thr
35 40 45
Pro Phe Thr Glu Asp Pro Pro Ala Ser Leu Glu Val Leu Ser Glu Arg
50 55 60
Cys Trp Gly Thr Met Gln Ala Val Glu Pro Gly Thr Asp Asp Glu Gly
65 70 75 80
Pro Leu Leu Glu Pro Val Gly Ser Glu His Ala Gln Asp Thr Tyr Leu
85 90 95
Val Leu Asp Lys Trp Leu Leu Pro Arg Asn Pro Pro Ser Glu Asp Leu
100 105 110
Pro Gly Pro Gly Gly Ser Val Asp Ile Val Ala Met Asp Glu Gly Ser
115 120 125
Glu Ala Ser Ser Cys Ser Ser Ala Leu Ala Ser Lys Pro Ser Pro Glu
130 135 140
Gly Ala Ser Ala Ala Ser Phe Glu Tyr Thr Ile Leu Asp Pro Ser Ser
145 150 155 160
Gln Leu Leu Arg Pro Trp Thr Leu Cys Pro Glu Leu Pro Pro Thr Pro
165 170 175
Pro His Leu Lys Tyr Leu Tyr Leu Val Val Ser Asp Ser Gly Ile Ser
180 185 190
Thr Asp Tyr Ser Ser Gly Asp Ser Gln Gly Ala Gln Gly Gly Leu Ser
195 200 205
Asp Gly Pro Tyr Ser Asn Pro Tyr Glu Asn Ser Leu Ile Pro Ala Ala
210 215 220
Glu Pro Leu Pro Pro Ser Tyr Val Ala Cys Ser
225 230 235
<210> 428
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S072
<400> 428
His Arg Arg Ala Leu Lys Gln Lys Ile Trp Pro Gly Ile Pro Ser Pro
1 5 10 15
Glu Ser Glu Phe Glu Gly Leu Phe Thr Thr His Lys Gly Asn Phe Gln
20 25 30
Leu Trp Leu Tyr Gln Asn Asp Gly Cys Leu Trp Trp Ser Pro Cys Thr
35 40 45
Pro Phe Thr Glu Asp Pro Pro Ala Ser Leu Glu Val Leu Ser Glu Arg
50 55 60
Cys Trp Gly Thr Met Gln Ala Val Glu Pro Gly Thr Asp Asp Glu Gly
65 70 75 80
Pro Leu Leu Glu Pro Val Gly Ser Glu His Ala Gln Asp Thr Tyr Leu
85 90 95
Val Leu Asp Lys Trp Leu Leu Pro Arg Asn Pro Pro Ser Glu Asp Leu
100 105 110
Pro Gly Pro Gly Gly Ser Val Asp Ile Val Ala Met Asp Glu Gly Ser
115 120 125
Glu Ala Ser Ser Cys Ser Ser Ala Leu Ala Ser Lys Pro Ser Pro Glu
130 135 140
Gly Ala Ser Ala Ala Ser Phe Glu Tyr Thr Ile Leu Asp Pro Ser Ser
145 150 155 160
Gln Leu Leu Arg Pro Trp Thr Leu Cys Pro Glu Leu Pro Pro Thr Pro
165 170 175
Pro His Leu Lys Phe Leu Phe Leu Val Val Ser Asp Ser Gly Ile Ser
180 185 190
Thr Asp Tyr Ser Ser Gly Asp Ser Gln Gly Ala Gln Gly Gly Leu Ser
195 200 205
Asp Gly Pro Tyr Ser Asn Pro Tyr Glu Asn Ser Leu Ile Pro Ala Ala
210 215 220
Glu Pro Leu Pro Pro Ser Tyr Val Ala Cys Ser
225 230 235
<210> 429
<211> 42
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S074
<400> 429
Arg Leu Lys Ile Gln Val Arg Lys Ala Ala Ile Thr Ser Tyr Glu Lys
1 5 10 15
Ser Asp Gly Val Tyr Thr Gly Leu Ser Thr Arg Asn Gln Glu Thr Tyr
20 25 30
Glu Thr Leu Lys His Glu Lys Pro Pro Gln
35 40
<210> 430
<211> 77
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S075
<400> 430
Cys Arg Lys Lys Arg Ile Ser Ala Asn Ser Thr Asp Pro Val Lys Ala
1 5 10 15
Ala Gln Phe Glu Pro Pro Gly Arg Gln Met Ile Ala Ile Arg Lys Arg
20 25 30
Gln Pro Glu Glu Thr Asn Asn Asp Tyr Glu Thr Ala Asp Gly Gly Tyr
35 40 45
Met Thr Leu Asn Pro Arg Ala Pro Thr Asp Asp Asp Lys Asn Ile Tyr
50 55 60
Leu Thr Leu Pro Pro Asn Asp His Val Asn Ser Asn Asn
65 70 75
<210> 431
<211> 77
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S076
<400> 431
Cys Arg Lys Lys Arg Ile Ser Ala Asn Ser Thr Asp Pro Val Lys Ala
1 5 10 15
Ala Gln Phe Glu Pro Pro Gly Arg Gln Met Ile Ala Ile Arg Lys Arg
20 25 30
Gln Leu Glu Glu Thr Asn Asn Asp Tyr Glu Thr Ala Asp Gly Gly Tyr
35 40 45
Met Thr Leu Asn Pro Arg Ala Pro Thr Asp Asp Asp Lys Asn Ile Tyr
50 55 60
Leu Thr Leu Pro Pro Asn Asp His Val Asn Ser Asn Asn
65 70 75
<210> 432
<211> 350
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S077
<400> 432
Lys Gln Gln Arg Ile Lys Met Leu Ile Leu Pro Pro Val Pro Val Pro
1 5 10 15
Lys Ile Lys Gly Ile Asp Pro Asp Leu Leu Lys Glu Gly Lys Leu Glu
20 25 30
Glu Val Asn Thr Ile Leu Ala Ile His Asp Ser Tyr Lys Pro Glu Phe
35 40 45
His Ser Asp Asp Ser Trp Val Glu Phe Ile Glu Leu Asp Ile Asp Glu
50 55 60
Pro Asp Glu Lys Thr Glu Glu Ser Asp Thr Asp Arg Leu Leu Ser Ser
65 70 75 80
Asp His Glu Lys Ser His Ser Asn Leu Gly Val Lys Asp Gly Asp Ser
85 90 95
Gly Arg Thr Ser Cys Cys Glu Pro Asp Ile Leu Glu Thr Asp Phe Asn
100 105 110
Ala Asn Asp Ile His Glu Gly Thr Ser Glu Val Ala Gln Pro Gln Arg
115 120 125
Leu Lys Gly Glu Ala Asp Leu Leu Cys Leu Asp Gln Lys Asn Gln Asn
130 135 140
Asn Ser Pro Tyr His Asp Ala Cys Pro Ala Thr Gln Gln Pro Ser Val
145 150 155 160
Ile Gln Ala Glu Lys Asn Lys Pro Gln Pro Leu Pro Thr Glu Gly Ala
165 170 175
Glu Ser Thr His Gln Ala Ala His Ile Gln Leu Ser Asn Pro Ser Ser
180 185 190
Leu Ser Asn Ile Asp Phe Tyr Ala Gln Val Ser Asp Ile Thr Pro Ala
195 200 205
Gly Ser Val Val Leu Ser Pro Gly Gln Lys Asn Lys Ala Gly Met Ser
210 215 220
Gln Cys Asp Met His Pro Glu Met Val Ser Leu Cys Gln Glu Asn Phe
225 230 235 240
Leu Met Asp Asn Ala Tyr Phe Cys Glu Ala Asp Ala Lys Lys Cys Ile
245 250 255
Pro Val Ala Pro His Ile Lys Val Glu Ser His Ile Gln Pro Ser Leu
260 265 270
Asn Gln Glu Asp Ile Tyr Ile Thr Thr Glu Ser Leu Thr Thr Ala Ala
275 280 285
Gly Arg Pro Gly Thr Gly Glu His Val Pro Gly Ser Glu Met Pro Val
290 295 300
Pro Asp Tyr Thr Ser Ile His Ile Val Gln Ser Pro Gln Gly Leu Ile
305 310 315 320
Leu Asn Ala Thr Ala Leu Pro Leu Pro Asp Lys Glu Phe Leu Ser Ser
325 330 335
Cys Gly Tyr Val Ser Thr Asp Gln Leu Asn Lys Ile Met Pro
340 345 350
<210> 433
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S080
<400> 433
Cys Trp Leu Thr Lys Lys Lys Tyr Ser Ser Ser Val His Asp Pro Asn
1 5 10 15
Gly Glu Tyr Met Phe Met Arg Ala Val Asn Thr Ala Lys Lys Ser Arg
20 25 30
Leu Thr Asp Val Thr Leu
35
<210> 434
<211> 100
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S081
<400> 434
Lys Val Phe Leu Arg Cys Ile Asn Tyr Val Phe Phe Pro Ser Leu Lys
1 5 10 15
Pro Ser Ser Ser Ile Asp Glu Tyr Phe Ser Glu Gln Pro Leu Lys Asn
20 25 30
Leu Leu Leu Ser Thr Ser Glu Glu Gln Ile Glu Lys Cys Phe Ile Ile
35 40 45
Glu Asn Ile Ser Thr Ile Ala Thr Val Glu Glu Thr Asn Gln Thr Asp
50 55 60
Glu Asp His Lys Lys Tyr Ser Ser Gln Thr Ser Gln Asp Ser Gly Asn
65 70 75 80
Tyr Ser Asn Glu Asp Glu Ser Glu Ser Lys Thr Ser Glu Glu Leu Gln
85 90 95
Gln Asp Phe Val
100
<210> 435
<211> 251
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S082
<400> 435
Lys Trp Ile Gly Tyr Ile Cys Leu Arg Asn Ser Leu Pro Lys Val Leu
1 5 10 15
Asn Phe His Asn Phe Leu Ala Trp Pro Phe Pro Asn Leu Pro Pro Leu
20 25 30
Glu Ala Met Asp Met Val Glu Val Ile Tyr Ile Asn Arg Lys Lys Lys
35 40 45
Val Trp Asp Tyr Asn Tyr Asp Asp Glu Ser Asp Ser Asp Thr Glu Ala
50 55 60
Ala Pro Arg Thr Ser Gly Gly Gly Tyr Thr Met His Gly Leu Thr Val
65 70 75 80
Arg Pro Leu Gly Gln Ala Ser Ala Thr Ser Thr Glu Ser Gln Leu Ile
85 90 95
Asp Pro Glu Ser Glu Glu Glu Pro Asp Leu Pro Glu Val Asp Val Glu
100 105 110
Leu Pro Thr Met Pro Lys Asp Ser Pro Gln Gln Leu Glu Leu Leu Ser
115 120 125
Gly Pro Cys Glu Arg Arg Lys Ser Pro Leu Gln Asp Pro Phe Pro Glu
130 135 140
Glu Asp Tyr Ser Ser Thr Glu Gly Ser Gly Gly Arg Ile Thr Phe Asn
145 150 155 160
Val Asp Leu Asn Ser Val Phe Leu Arg Val Leu Asp Asp Glu Asp Ser
165 170 175
Asp Asp Leu Glu Ala Pro Leu Met Leu Ser Ser His Leu Glu Glu Met
180 185 190
Val Asp Pro Glu Asp Pro Asp Asn Val Gln Ser Asn His Leu Leu Ala
195 200 205
Ser Gly Glu Gly Thr Gln Pro Thr Phe Pro Ser Pro Ser Ser Glu Gly
210 215 220
Leu Trp Ser Glu Asp Ala Pro Ser Asp Gln Ser Asp Thr Ser Glu Ser
225 230 235 240
Asp Val Asp Leu Gly Asp Gly Tyr Ile Met Arg
245 250
<210> 436
<211> 67
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S083
<400> 436
Lys Trp Ile Gly Tyr Ile Cys Leu Arg Asn Ser Leu Pro Lys Val Leu
1 5 10 15
Arg Gln Gly Leu Ala Lys Gly Trp Asn Ala Val Ala Ile His Arg Cys
20 25 30
Ser His Asn Ala Leu Gln Ser Glu Thr Pro Glu Leu Lys Gln Ser Ser
35 40 45
Cys Leu Ser Phe Pro Ser Ser Trp Asp Tyr Lys Arg Ala Ser Leu Cys
50 55 60
Pro Ser Asp
65
<210> 437
<211> 223
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S084
<400> 437
Cys Phe Tyr Ile Lys Lys Ile Asn Pro Leu Lys Glu Lys Ser Ile Ile
1 5 10 15
Leu Pro Lys Ser Leu Ile Ser Val Val Arg Ser Ala Thr Leu Glu Thr
20 25 30
Lys Pro Glu Ser Lys Tyr Val Ser Leu Ile Thr Ser Tyr Gln Pro Phe
35 40 45
Ser Leu Glu Lys Glu Val Val Cys Glu Glu Pro Leu Ser Pro Ala Thr
50 55 60
Val Pro Gly Met His Thr Glu Asp Asn Pro Gly Lys Val Glu His Thr
65 70 75 80
Glu Glu Leu Ser Ser Ile Thr Glu Val Val Thr Thr Glu Glu Asn Ile
85 90 95
Pro Asp Val Val Pro Gly Ser His Leu Thr Pro Ile Glu Arg Glu Ser
100 105 110
Ser Ser Pro Leu Ser Ser Asn Gln Ser Glu Pro Gly Ser Ile Ala Leu
115 120 125
Asn Ser Tyr His Ser Arg Asn Cys Ser Glu Ser Asp His Ser Arg Asn
130 135 140
Gly Phe Asp Thr Asp Ser Ser Cys Leu Glu Ser His Ser Ser Leu Ser
145 150 155 160
Asp Ser Glu Phe Pro Pro Asn Asn Lys Gly Glu Ile Lys Thr Glu Gly
165 170 175
Gln Glu Leu Ile Thr Val Ile Lys Ala Pro Thr Ser Phe Gly Tyr Asp
180 185 190
Lys Pro His Val Leu Val Asp Leu Leu Val Asp Asp Ser Gly Lys Glu
195 200 205
Ser Leu Ile Gly Tyr Arg Pro Thr Glu Asp Ser Lys Glu Phe Ser
210 215 220
<210> 438
<211> 69
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S085
<400> 438
Leu Val Leu Lys Tyr Arg Gly Leu Ile Lys Tyr Trp Phe His Thr Pro
1 5 10 15
Pro Ser Ile Pro Leu Gln Ile Glu Glu Tyr Leu Lys Asp Pro Thr Gln
20 25 30
Pro Ile Leu Glu Ala Leu Asp Lys Asp Ser Ser Pro Lys Asp Asp Val
35 40 45
Trp Asp Ser Val Ser Ile Ile Ser Phe Pro Glu Lys Glu Gln Glu Asp
50 55 60
Val Leu Gln Thr Leu
65
<210> 439
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S086
<400> 439
Lys Thr Leu Met Gly Asn Pro Trp Phe Gln Arg Ala Lys Met Pro Arg
1 5 10 15
Ala Leu Asp Phe Ser Gly His Thr His Pro Val Ala Thr Phe Gln Pro
20 25 30
Ser Arg Pro Glu Ser Val Asn Asp Leu Phe Leu Cys Pro Gln Lys Glu
35 40 45
Leu Thr Arg Gly Val Arg Pro Thr Pro Arg Val Arg Ala Pro Ala Thr
50 55 60
Gln Gln Thr Arg Trp Lys Lys Asp Leu Ala Glu Asp Glu Glu Glu Glu
65 70 75 80
Asp Glu Glu Asp Thr Glu Asp Gly Val Ser Phe Gln Pro Tyr Ile Glu
85 90 95
Pro Pro Ser Phe Leu Gly Gln Glu His Gln Ala Pro Gly His Ser Glu
100 105 110
Ala Gly Gly Val Asp Ser Gly Arg Pro Arg Ala Pro Leu Val Pro Ser
115 120 125
Glu Gly Ser Ser Ala Trp Asp Ser Ser Asp Arg Ser Trp Ala Ser Thr
130 135 140
Val Asp Ser Ser Trp Asp Arg Ala Gly Ser Ser Gly Tyr Leu Ala Glu
145 150 155 160
Lys Gly Pro Gly Gln Gly Pro Gly Gly Asp Gly His Gln Glu Ser Leu
165 170 175
Pro Pro Pro Glu Phe Ser Lys Asp Ser Gly Phe Leu Glu Glu Leu Pro
180 185 190
Glu Asp Asn Leu Ser Ser Trp Ala Thr Trp Gly Thr Leu Pro Pro Glu
195 200 205
Pro Asn Leu Val Pro Gly Gly Pro Pro Val Ser Leu Gln Thr Leu Thr
210 215 220
Phe Cys Trp Glu Ser Ser Pro Glu Glu Glu Glu Glu Ala Arg Glu Ser
225 230 235 240
Glu Ile Glu Asp Ser Asp Ala Gly Ser Trp Gly Ala Glu Ser Thr Gln
245 250 255
Arg Thr Glu Asp Arg Gly Arg Thr Leu Gly His Tyr Met Ala Arg
260 265 270
<210> 440
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S087
<400> 440
Lys Thr Leu Met Gly Asn Pro Trp Phe Gln Arg Ala Lys Met Pro Arg
1 5 10 15
Ala Leu Glu Leu Thr Arg Gly Val Arg Pro Thr Pro Arg Val Arg Ala
20 25 30
Pro Ala Thr Gln Gln Thr Arg Trp Lys Lys Asp Leu Ala Glu Asp Glu
35 40 45
Glu Glu Glu Asp Glu Glu Asp Thr Glu Asp Gly Val Ser Phe Gln Pro
50 55 60
Tyr Ile Glu Pro Pro Ser Phe Leu Gly Gln Glu His Gln Ala Pro Gly
65 70 75 80
His Ser Glu Ala Gly Gly Val Asp Ser Gly Arg Pro Arg Ala Pro Leu
85 90 95
Val Pro Ser Glu Gly Ser Ser Ala Trp Asp Ser Ser Asp Arg Ser Trp
100 105 110
Ala Ser Thr Val Asp Ser Ser Trp Asp Arg Ala Gly Ser Ser Gly Tyr
115 120 125
Leu Ala Glu Lys Gly Pro Gly Gln Gly Pro Gly Gly Asp Gly His Gln
130 135 140
Glu Ser Leu Pro Pro Pro Glu Phe Ser Lys Asp Ser Gly Phe Leu Glu
145 150 155 160
Glu Leu Pro Glu Asp Asn Leu Ser Ser Trp Ala Thr Trp Gly Thr Leu
165 170 175
Pro Pro Glu Pro Asn Leu Val Pro Gly Gly Pro Pro Val Ser Leu Gln
180 185 190
Thr Leu Thr Phe Cys Trp Glu Ser Ser Pro Glu Glu Glu Glu Glu Ala
195 200 205
Arg Glu Ser Glu Ile Glu Asp Ser Asp Ala Gly Ser Trp Gly Ala Glu
210 215 220
Ser Thr Gln Arg Thr Glu Asp Arg Gly Arg Thr Leu Gly His Tyr Met
225 230 235 240
Ala Arg
<210> 441
<211> 179
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S098
<400> 441
Lys Ile Asp Ile Val Leu Trp Tyr Arg Asp Ser Cys Tyr Asp Phe Leu
1 5 10 15
Pro Ile Lys Val Leu Pro Glu Val Leu Glu Lys Gln Cys Gly Tyr Lys
20 25 30
Leu Phe Ile Tyr Gly Arg Asp Asp Tyr Val Gly Glu Asp Ile Val Glu
35 40 45
Val Ile Asn Glu Asn Val Lys Lys Ser Arg Arg Leu Ile Ile Ile Leu
50 55 60
Val Arg Glu Thr Ser Gly Phe Ser Trp Leu Gly Gly Ser Ser Glu Glu
65 70 75 80
Gln Ile Ala Met Tyr Asn Ala Leu Val Gln Asp Gly Ile Lys Val Val
85 90 95
Leu Leu Glu Leu Glu Lys Ile Gln Asp Tyr Glu Lys Met Pro Glu Ser
100 105 110
Ile Lys Phe Ile Lys Gln Lys His Gly Ala Ile Arg Trp Ser Gly Asp
115 120 125
Phe Thr Gln Gly Pro Gln Ser Ala Lys Thr Arg Phe Trp Lys Asn Val
130 135 140
Arg Tyr His Met Pro Val Gln Arg Arg Ser Pro Ser Ser Lys His Gln
145 150 155 160
Leu Leu Ser Pro Ala Thr Lys Glu Lys Leu Gln Arg Glu Ala His Val
165 170 175
Pro Leu Gly
<210> 442
<211> 210
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S099
<400> 442
Lys Ile Asp Ile Val Leu Trp Tyr Arg Asp Ser Cys Tyr Asp Phe Leu
1 5 10 15
Pro Ile Lys Ala Ser Asp Gly Lys Thr Tyr Asp Ala Tyr Ile Leu Tyr
20 25 30
Pro Lys Thr Val Gly Glu Gly Ser Thr Ser Asp Cys Asp Ile Phe Val
35 40 45
Phe Lys Val Leu Pro Glu Val Leu Glu Lys Gln Cys Gly Tyr Lys Leu
50 55 60
Phe Ile Tyr Gly Arg Asp Asp Tyr Val Gly Glu Asp Ile Val Glu Val
65 70 75 80
Ile Asn Glu Asn Val Lys Lys Ser Arg Arg Leu Ile Ile Ile Leu Val
85 90 95
Arg Glu Thr Ser Gly Phe Ser Trp Leu Gly Gly Ser Ser Glu Glu Gln
100 105 110
Ile Ala Met Tyr Asn Ala Leu Val Gln Asp Gly Ile Lys Val Val Leu
115 120 125
Leu Glu Leu Glu Lys Ile Gln Asp Tyr Glu Lys Met Pro Glu Ser Ile
130 135 140
Lys Phe Ile Lys Gln Lys His Gly Ala Ile Arg Trp Ser Gly Asp Phe
145 150 155 160
Thr Gln Gly Pro Gln Ser Ala Lys Thr Arg Phe Trp Lys Asn Val Arg
165 170 175
Tyr His Met Pro Val Gln Arg Arg Ser Pro Ser Ser Lys His Gln Leu
180 185 190
Leu Ser Pro Ala Thr Lys Glu Lys Leu Gln Arg Glu Ala His Val Pro
195 200 205
Leu Gly
210
<210> 443
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S100
<400> 443
Tyr Arg Ala His Phe Gly Thr Asp Glu Thr Ile Leu Asp Gly Lys Glu
1 5 10 15
Tyr Asp Ile Tyr Val Ser Tyr Ala Arg Asn Ala Glu Glu Glu Glu Phe
20 25 30
Val Leu Leu Thr Leu Arg Gly Val Leu Glu Asn Glu Phe Gly Tyr Lys
35 40 45
Leu Cys Ile Phe Asp Arg Asp Ser Leu Pro Gly Gly Ile Val Thr Asp
50 55 60
Glu Thr Leu Ser Phe Ile Gln Lys Ser Arg Arg Leu Leu Val Val Leu
65 70 75 80
Ser Pro Asn Tyr Val Leu Gln Gly Thr Gln Ala Leu Leu Glu Leu Lys
85 90 95
Ala Gly Leu Glu Asn Met Ala Ser Arg Gly Asn Ile Asn Val Ile Leu
100 105 110
Val Gln Tyr Lys Ala Val Lys Glu Thr Lys Val Lys Glu Leu Lys Arg
115 120 125
Ala Lys Thr Val Leu Thr Val Ile Lys Trp Lys Gly Glu Lys Ser Lys
130 135 140
Tyr Pro Gln Gly Arg Phe Trp Lys Gln Leu Gln Val Ala Met Pro Val
145 150 155 160
Lys Lys Ser Pro Arg Arg Ser Ser Ser Asp Glu Gln Gly Leu Ser Tyr
165 170 175
Ser Ser Leu Lys Asn Val
180
<210> 444
<211> 299
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S101
<400> 444
Tyr Arg Ala His Phe Gly Thr Asp Glu Thr Ile Leu Asp Gly Lys Glu
1 5 10 15
Tyr Asp Ile Tyr Val Ser Tyr Ala Arg Asn Ala Glu Glu Glu Glu Phe
20 25 30
Val Leu Leu Thr Leu Arg Gly Val Leu Glu Asn Glu Phe Gly Tyr Lys
35 40 45
Leu Cys Ile Phe Asp Arg Asp Ser Leu Pro Gly Gly Asn Thr Val Glu
50 55 60
Ala Val Phe Asp Phe Ile Gln Arg Ser Arg Arg Met Ile Val Val Leu
65 70 75 80
Ser Pro Asp Tyr Val Thr Glu Lys Ser Ile Ser Met Leu Glu Phe Lys
85 90 95
Leu Gly Val Met Cys Gln Asn Ser Ile Ala Thr Lys Leu Ile Val Val
100 105 110
Glu Tyr Arg Pro Leu Glu His Pro His Pro Gly Ile Leu Gln Leu Lys
115 120 125
Glu Ser Val Ser Phe Val Ser Trp Lys Gly Glu Lys Ser Lys His Ser
130 135 140
Gly Ser Lys Phe Trp Lys Ala Leu Arg Leu Ala Leu Pro Leu Arg Ser
145 150 155 160
Leu Ser Ala Ser Ser Gly Trp Asn Glu Ser Cys Ser Ser Gln Ser Asp
165 170 175
Ile Ser Leu Asp His Val Gln Arg Arg Arg Ser Arg Leu Lys Glu Pro
180 185 190
Pro Glu Leu Gln Ser Ser Glu Arg Ala Ala Gly Ser Pro Pro Ala Pro
195 200 205
Gly Thr Met Ser Lys His Arg Gly Lys Ser Ser Ala Thr Cys Arg Cys
210 215 220
Cys Val Thr Tyr Cys Glu Gly Glu Asn His Leu Arg Asn Lys Ser Arg
225 230 235 240
Ala Glu Ile His Asn Gln Pro Gln Trp Glu Thr His Leu Cys Lys Pro
245 250 255
Val Pro Gln Glu Ser Glu Thr Gln Trp Ile Gln Asn Gly Thr Arg Leu
260 265 270
Glu Pro Pro Ala Pro Gln Ile Ser Ala Leu Ala Leu His His Phe Thr
275 280 285
Asp Leu Ser Asn Asn Asn Asp Phe Tyr Ile Leu
290 295
<210> 445
<211> 207
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S102
<400> 445
Leu Lys Met Phe Trp Ile Glu Ala Thr Leu Leu Trp Arg Asp Ile Ala
1 5 10 15
Lys Pro Tyr Lys Thr Arg Asn Asp Gly Lys Leu Tyr Asp Ala Tyr Val
20 25 30
Val Tyr Pro Arg Asn Tyr Lys Ser Ser Thr Asp Gly Ala Ser Arg Val
35 40 45
Glu His Phe Val His Gln Ile Leu Pro Asp Val Leu Glu Asn Lys Cys
50 55 60
Gly Tyr Thr Leu Cys Ile Tyr Gly Arg Asp Met Leu Pro Gly Glu Asp
65 70 75 80
Val Val Thr Ala Val Glu Thr Asn Ile Arg Lys Ser Arg Arg His Ile
85 90 95
Phe Ile Leu Thr Pro Gln Ile Thr His Asn Lys Glu Phe Ala Tyr Glu
100 105 110
Gln Glu Val Ala Leu His Cys Ala Leu Ile Gln Asn Asp Ala Lys Val
115 120 125
Ile Leu Ile Glu Met Glu Ala Leu Ser Glu Leu Asp Met Leu Gln Ala
130 135 140
Glu Ala Leu Gln Asp Ser Leu Gln His Leu Met Lys Val Gln Gly Thr
145 150 155 160
Ile Lys Trp Arg Glu Asp His Ile Ala Asn Lys Arg Ser Leu Asn Ser
165 170 175
Lys Phe Trp Lys His Val Arg Tyr Gln Met Pro Val Pro Ser Lys Ile
180 185 190
Pro Arg Lys Ala Ser Ser Leu Thr Pro Leu Ala Ala Gln Lys Gln
195 200 205
<210> 446
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S103
<400> 446
Asn Ile Phe Lys Ile Asp Ile Val Leu Trp Tyr Arg Ser Ala Phe His
1 5 10 15
Ser Thr Glu Thr Ile Val Asp Gly Lys Leu Tyr Asp Ala Tyr Val Leu
20 25 30
Tyr Pro Lys Pro His Lys Glu Ser Gln Arg His Ala Val Asp Ala Leu
35 40 45
Val Leu Asn Ile Leu Pro Glu Val Leu Glu Arg Gln Cys Gly Tyr Lys
50 55 60
Leu Phe Ile Phe Gly Arg Asp Glu Phe Pro Gly Gln Ala Val Ala Asn
65 70 75 80
Val Ile Asp Glu Asn Val Lys Leu Cys Arg Arg Leu Ile Val Ile Val
85 90 95
Val Pro Glu Ser Leu Gly Phe Gly Leu Leu Lys Asn Leu Ser Glu Glu
100 105 110
Gln Ile Ala Val Tyr Ser Ala Leu Ile Gln Asp Gly Met Lys Val Ile
115 120 125
Leu Ile Glu Leu Glu Lys Ile Glu Asp Tyr Thr Val Met Pro Glu Ser
130 135 140
Ile Gln Tyr Ile Lys Gln Lys His Gly Ala Ile Arg Trp His Gly Asp
145 150 155 160
Phe Thr Glu Gln Ser Gln Cys Met Lys Thr Lys Phe Trp Lys Thr Val
165 170 175
Arg Tyr His Met Pro Pro Arg Arg Cys Arg Pro Phe Pro Pro Val Gln
180 185 190
Leu Leu Gln His Thr Pro Cys Tyr Arg Thr Ala Gly Pro Glu Leu Gly
195 200 205
Ser Arg Arg Lys Lys Cys Thr Leu Thr Thr Gly
210 215
<210> 447
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S104
<400> 447
Thr Trp Gln Arg Arg Gln Arg Lys Ser Arg Arg Thr Ile
1 5 10
<210> 448
<211> 286
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S105
<400> 448
Asn Cys Arg Asn Thr Gly Pro Trp Leu Lys Lys Val Leu Lys Cys Asn
1 5 10 15
Thr Pro Asp Pro Ser Lys Phe Phe Ser Gln Leu Ser Ser Glu His Gly
20 25 30
Gly Asp Val Gln Lys Trp Leu Ser Ser Pro Phe Pro Ser Ser Ser Phe
35 40 45
Ser Pro Gly Gly Leu Ala Pro Glu Ile Ser Pro Leu Glu Val Leu Glu
50 55 60
Arg Asp Lys Val Thr Gln Leu Leu Leu Gln Gln Asp Lys Val Pro Glu
65 70 75 80
Pro Ala Ser Leu Ser Ser Asn His Ser Leu Thr Ser Cys Phe Thr Asn
85 90 95
Gln Gly Tyr Phe Phe Phe His Leu Pro Asp Ala Leu Glu Ile Glu Ala
100 105 110
Cys Gln Val Tyr Phe Thr Tyr Asp Pro Tyr Ser Glu Glu Asp Pro Asp
115 120 125
Glu Gly Val Ala Gly Ala Pro Thr Gly Ser Ser Pro Gln Pro Leu Gln
130 135 140
Pro Leu Ser Gly Glu Asp Asp Ala Tyr Cys Thr Phe Pro Ser Arg Asp
145 150 155 160
Asp Leu Leu Leu Phe Ser Pro Ser Leu Leu Gly Gly Pro Ser Pro Pro
165 170 175
Ser Thr Ala Pro Gly Gly Ser Gly Ala Gly Glu Glu Arg Met Pro Pro
180 185 190
Ser Leu Gln Glu Arg Val Pro Arg Asp Trp Asp Pro Gln Pro Leu Gly
195 200 205
Pro Pro Thr Pro Gly Val Pro Asp Leu Val Asp Phe Gln Pro Pro Pro
210 215 220
Glu Leu Val Leu Arg Glu Ala Gly Glu Glu Val Pro Asp Ala Gly Pro
225 230 235 240
Arg Glu Gly Val Ser Phe Pro Trp Ser Arg Pro Pro Gly Gln Gly Glu
245 250 255
Phe Arg Ala Leu Asn Ala Arg Leu Pro Leu Asn Thr Asp Ala Tyr Leu
260 265 270
Ser Leu Gln Glu Leu Gln Gly Gln Asp Pro Thr His Leu Val
275 280 285
<210> 449
<211> 86
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S106
<400> 449
Glu Arg Thr Met Pro Arg Ile Pro Thr Leu Lys Asn Leu Glu Asp Leu
1 5 10 15
Val Thr Glu Tyr His Gly Asn Phe Ser Ala Trp Ser Gly Val Ser Lys
20 25 30
Gly Leu Ala Glu Ser Leu Gln Pro Asp Tyr Ser Glu Arg Leu Cys Leu
35 40 45
Val Ser Glu Ile Pro Pro Lys Gly Gly Ala Leu Gly Glu Gly Pro Gly
50 55 60
Ala Ser Pro Cys Asn Gln His Ser Pro Tyr Trp Ala Pro Pro Cys Tyr
65 70 75 80
Thr Leu Lys Pro Glu Thr
85
<210> 450
<211> 53
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S109
<400> 450
Arg Arg Tyr Leu Val Met Gln Arg Leu Phe Pro Arg Ile Pro His Met
1 5 10 15
Lys Asp Pro Ile Gly Asp Ser Phe Gln Asn Asp Lys Leu Val Val Trp
20 25 30
Glu Ala Gly Lys Ala Gly Leu Glu Glu Cys Leu Val Thr Glu Val Gln
35 40 45
Val Val Gln Lys Thr
50
<210> 451
<211> 569
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S110
<400> 451
Lys Ile Lys Lys Glu Trp Trp Asp Gln Ile Pro Asn Pro Ala Arg Ser
1 5 10 15
Arg Leu Val Ala Ile Ile Ile Gln Asp Ala Gln Gly Ser Gln Trp Glu
20 25 30
Lys Arg Ser Arg Gly Gln Glu Pro Ala Lys Cys Pro His Trp Lys Asn
35 40 45
Cys Leu Thr Lys Leu Leu Pro Cys Phe Leu Glu His Asn Met Lys Arg
50 55 60
Asp Glu Asp Pro His Lys Ala Ala Lys Glu Met Pro Phe Gln Gly Ser
65 70 75 80
Gly Lys Ser Ala Trp Cys Pro Val Glu Ile Ser Lys Thr Val Leu Trp
85 90 95
Pro Glu Ser Ile Ser Val Val Arg Cys Val Glu Leu Phe Glu Ala Pro
100 105 110
Val Glu Cys Glu Glu Glu Glu Glu Val Glu Glu Glu Lys Gly Ser Phe
115 120 125
Cys Ala Ser Pro Glu Ser Ser Arg Asp Asp Phe Gln Glu Gly Arg Glu
130 135 140
Gly Ile Val Ala Arg Leu Thr Glu Ser Leu Phe Leu Asp Leu Leu Gly
145 150 155 160
Glu Glu Asn Gly Gly Phe Cys Gln Gln Asp Met Gly Glu Ser Cys Leu
165 170 175
Leu Pro Pro Ser Gly Ser Thr Ser Ala His Met Pro Trp Asp Glu Phe
180 185 190
Pro Ser Ala Gly Pro Lys Glu Ala Pro Pro Trp Gly Lys Glu Gln Pro
195 200 205
Leu His Leu Glu Pro Ser Pro Pro Ala Ser Pro Thr Gln Ser Pro Asp
210 215 220
Asn Leu Thr Cys Thr Glu Thr Pro Leu Val Ile Ala Gly Asn Pro Ala
225 230 235 240
Tyr Arg Ser Phe Ser Asn Ser Leu Ser Gln Ser Pro Cys Pro Arg Glu
245 250 255
Leu Gly Pro Asp Pro Leu Leu Ala Arg His Leu Glu Glu Val Glu Pro
260 265 270
Glu Met Pro Cys Val Pro Gln Leu Ser Glu Pro Thr Thr Val Pro Gln
275 280 285
Pro Glu Pro Glu Thr Trp Glu Gln Ile Leu Arg Arg Asn Val Leu Gln
290 295 300
His Gly Ala Ala Ala Ala Pro Val Ser Ala Pro Thr Ser Gly Tyr Gln
305 310 315 320
Glu Phe Val His Ala Val Glu Gln Gly Gly Thr Gln Ala Ser Ala Val
325 330 335
Val Gly Leu Gly Pro Pro Gly Glu Ala Gly Tyr Lys Ala Phe Ser Ser
340 345 350
Leu Leu Ala Ser Ser Ala Val Ser Pro Glu Lys Cys Gly Phe Gly Ala
355 360 365
Ser Ser Gly Glu Glu Gly Tyr Lys Pro Phe Gln Asp Leu Ile Pro Gly
370 375 380
Cys Pro Gly Asp Pro Ala Pro Val Pro Val Pro Leu Phe Thr Phe Gly
385 390 395 400
Leu Asp Arg Glu Pro Pro Arg Ser Pro Gln Ser Ser His Leu Pro Ser
405 410 415
Ser Ser Pro Glu His Leu Gly Leu Glu Pro Gly Glu Lys Val Glu Asp
420 425 430
Met Pro Lys Pro Pro Leu Pro Gln Glu Gln Ala Thr Asp Pro Leu Val
435 440 445
Asp Ser Leu Gly Ser Gly Ile Val Tyr Ser Ala Leu Thr Cys His Leu
450 455 460
Cys Gly His Leu Lys Gln Cys His Gly Gln Glu Asp Gly Gly Gln Thr
465 470 475 480
Pro Val Met Ala Ser Pro Cys Cys Gly Cys Cys Cys Gly Asp Arg Ser
485 490 495
Ser Pro Pro Thr Thr Pro Leu Arg Ala Pro Asp Pro Ser Pro Gly Gly
500 505 510
Val Pro Leu Glu Ala Ser Leu Cys Pro Ala Ser Leu Ala Pro Ser Gly
515 520 525
Ile Ser Glu Lys Ser Lys Ser Ser Ser Ser Phe His Pro Ala Pro Gly
530 535 540
Asn Ala Gln Ser Ser Ser Gln Thr Pro Lys Ile Val Asn Phe Val Ser
545 550 555 560
Val Gly Pro Thr Tyr Met Arg Val Ser
565
<210> 452
<211> 569
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S113
<400> 452
Lys Ile Lys Lys Glu Trp Trp Asp Gln Ile Pro Asn Pro Ala Arg Ser
1 5 10 15
Arg Leu Val Ala Ile Ile Ile Gln Asp Ala Gln Gly Ser Gln Trp Glu
20 25 30
Lys Arg Ser Arg Gly Gln Glu Pro Ala Lys Cys Pro His Trp Lys Asn
35 40 45
Cys Leu Thr Lys Leu Leu Pro Cys Phe Leu Glu His Asn Met Lys Arg
50 55 60
Asp Glu Asp Pro His Lys Ala Ala Lys Glu Met Pro Phe Gln Gly Ser
65 70 75 80
Gly Lys Ser Ala Trp Cys Pro Val Glu Ile Ser Lys Thr Val Leu Trp
85 90 95
Pro Glu Ser Ile Ser Val Val Arg Cys Val Glu Leu Phe Glu Ala Pro
100 105 110
Val Glu Cys Glu Glu Glu Glu Glu Val Glu Glu Glu Lys Gly Ser Phe
115 120 125
Cys Ala Ser Pro Glu Ser Ser Arg Asp Asp Phe Gln Glu Gly Arg Glu
130 135 140
Gly Ile Val Ala Arg Leu Thr Glu Ser Leu Phe Leu Asp Leu Leu Gly
145 150 155 160
Glu Glu Asn Gly Gly Phe Cys Gln Gln Asp Met Gly Glu Ser Cys Leu
165 170 175
Leu Pro Pro Ser Gly Ser Thr Ser Ala His Met Pro Trp Asp Glu Phe
180 185 190
Pro Ser Ala Gly Pro Lys Glu Ala Pro Pro Trp Gly Lys Glu Gln Pro
195 200 205
Leu His Leu Glu Pro Ser Pro Pro Ala Ser Pro Thr Gln Ser Pro Asp
210 215 220
Asn Leu Thr Cys Thr Glu Thr Pro Leu Val Ile Ala Gly Asn Pro Ala
225 230 235 240
Tyr Arg Ser Phe Ser Asn Ser Leu Ser Gln Ser Pro Cys Pro Arg Glu
245 250 255
Leu Gly Pro Asp Pro Leu Leu Ala Arg His Leu Glu Glu Val Glu Pro
260 265 270
Glu Met Pro Cys Val Pro Gln Leu Ser Glu Pro Thr Thr Val Pro Gln
275 280 285
Pro Glu Pro Glu Thr Trp Glu Gln Ile Leu Arg Arg Asn Val Leu Gln
290 295 300
His Gly Ala Ala Ala Ala Pro Val Ser Ala Pro Thr Ser Gly Tyr Gln
305 310 315 320
Glu Phe Val His Ala Val Glu Gln Gly Gly Thr Gln Ala Ser Ala Val
325 330 335
Val Gly Leu Gly Pro Pro Gly Glu Ala Gly Tyr Lys Ala Phe Ser Ser
340 345 350
Leu Leu Ala Ser Ser Ala Val Ser Pro Glu Lys Cys Gly Phe Gly Ala
355 360 365
Ser Ser Gly Glu Glu Gly Tyr Lys Pro Phe Gln Asp Leu Ile Pro Gly
370 375 380
Cys Pro Gly Asp Pro Ala Pro Val Pro Val Pro Leu Phe Thr Phe Gly
385 390 395 400
Leu Asp Arg Glu Pro Pro Arg Ser Pro Gln Ser Ser His Leu Pro Ser
405 410 415
Ser Ser Pro Glu His Leu Gly Leu Glu Pro Gly Glu Lys Val Glu Asp
420 425 430
Met Pro Lys Pro Pro Leu Pro Gln Glu Gln Ala Thr Asp Pro Leu Val
435 440 445
Asp Ser Leu Gly Ser Gly Ile Val Phe Ser Ala Leu Thr Cys His Leu
450 455 460
Cys Gly His Leu Lys Gln Cys His Gly Gln Glu Asp Gly Gly Gln Thr
465 470 475 480
Pro Val Met Ala Ser Pro Cys Cys Gly Cys Cys Cys Gly Asp Arg Ser
485 490 495
Ser Pro Pro Thr Thr Pro Leu Arg Ala Pro Asp Pro Ser Pro Gly Gly
500 505 510
Val Pro Leu Glu Ala Ser Leu Cys Pro Ala Ser Leu Ala Pro Ser Gly
515 520 525
Ile Ser Glu Lys Ser Lys Ser Ser Ser Ser Phe His Pro Ala Pro Gly
530 535 540
Asn Ala Gln Ser Ser Ser Gln Thr Pro Lys Ile Val Asn Phe Val Ser
545 550 555 560
Val Gly Pro Thr Tyr Met Arg Val Ser
565
<210> 453
<211> 58
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S115
<400> 453
Lys Ile Cys His Leu Trp Ile Lys Leu Phe Pro Pro Ile Pro Ala Pro
1 5 10 15
Lys Ser Asn Ile Lys Asp Leu Phe Val Thr Thr Asn Tyr Glu Lys Ala
20 25 30
Gly Ser Ser Glu Thr Glu Ile Glu Val Ile Cys Tyr Ile Glu Lys Pro
35 40 45
Gly Val Glu Thr Leu Glu Asp Ser Val Phe
50 55
<210> 454
<211> 82
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S116
<400> 454
Arg Phe Lys Lys Thr Trp Lys Leu Arg Ala Leu Lys Glu Gly Lys Thr
1 5 10 15
Ser Met His Pro Pro Tyr Ser Leu Gly Gln Leu Val Pro Glu Arg Pro
20 25 30
Arg Pro Thr Pro Val Leu Val Pro Leu Ile Ser Pro Pro Val Ser Pro
35 40 45
Ser Ser Leu Gly Ser Asp Asn Thr Ser Ser His Asn Arg Pro Asp Ala
50 55 60
Arg Asp Pro Arg Ser Pro Tyr Asp Ile Ser Asn Thr Asp Tyr Phe Phe
65 70 75 80
Pro Arg
<210> 455
<211> 277
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S117
<400> 455
Asn Lys Arg Asp Leu Ile Lys Lys His Ile Trp Pro Asn Val Pro Asp
1 5 10 15
Pro Ser Lys Ser His Ile Ala Gln Trp Ser Pro His Thr Pro Pro Arg
20 25 30
His Asn Phe Asn Ser Lys Asp Gln Met Tyr Ser Asp Gly Asn Phe Thr
35 40 45
Asp Val Ser Val Val Glu Ile Glu Ala Asn Asp Lys Lys Pro Phe Pro
50 55 60
Glu Asp Leu Lys Ser Leu Asp Leu Phe Lys Lys Glu Lys Ile Asn Thr
65 70 75 80
Glu Gly His Ser Ser Gly Ile Gly Gly Ser Ser Cys Met Ser Ser Ser
85 90 95
Arg Pro Ser Ile Ser Ser Ser Asp Glu Asn Glu Ser Ser Gln Asn Thr
100 105 110
Ser Ser Thr Val Gln Tyr Ser Thr Val Val His Ser Gly Tyr Arg His
115 120 125
Gln Val Pro Ser Val Gln Val Phe Ser Arg Ser Glu Ser Thr Gln Pro
130 135 140
Leu Leu Asp Ser Glu Glu Arg Pro Glu Asp Leu Gln Leu Val Asp His
145 150 155 160
Val Asp Gly Gly Asp Gly Ile Leu Pro Arg Gln Gln Tyr Phe Lys Gln
165 170 175
Asn Cys Ser Gln His Glu Ser Ser Pro Asp Ile Ser His Phe Glu Arg
180 185 190
Ser Lys Gln Val Ser Ser Val Asn Glu Glu Asp Phe Val Arg Leu Lys
195 200 205
Gln Gln Ile Ser Asp His Ile Ser Gln Ser Cys Gly Ser Gly Gln Met
210 215 220
Lys Met Phe Gln Glu Val Ser Ala Ala Asp Ala Phe Gly Pro Gly Thr
225 230 235 240
Glu Gly Gln Val Glu Arg Phe Glu Thr Val Gly Met Glu Ala Ala Thr
245 250 255
Asp Glu Gly Met Pro Lys Ser Tyr Leu Pro Gln Thr Val Arg Gln Gly
260 265 270
Gly Tyr Met Pro Gln
275
<210> 456
<211> 196
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S120
<400> 456
Trp Lys Lys Arg Ile Lys Pro Ile Val Trp Pro Ser Leu Pro Asp His
1 5 10 15
Lys Lys Thr Leu Glu His Leu Cys Lys Lys Pro Arg Lys Asn Leu Asn
20 25 30
Val Ser Phe Asn Pro Glu Ser Phe Leu Asp Cys Gln Ile His Arg Val
35 40 45
Asp Asp Ile Gln Ala Arg Asp Glu Val Glu Gly Phe Leu Gln Asp Thr
50 55 60
Phe Pro Gln Gln Leu Glu Glu Ser Glu Lys Gln Arg Leu Gly Gly Asp
65 70 75 80
Val Gln Ser Pro Asn Cys Pro Ser Glu Asp Val Val Ile Thr Pro Glu
85 90 95
Ser Phe Gly Arg Asp Ser Ser Leu Thr Cys Leu Ala Gly Asn Val Ser
100 105 110
Ala Cys Asp Ala Pro Ile Leu Ser Ser Ser Arg Ser Leu Asp Cys Arg
115 120 125
Glu Ser Gly Lys Asn Gly Pro His Val Tyr Gln Asp Leu Leu Leu Ser
130 135 140
Leu Gly Thr Thr Asn Ser Thr Leu Pro Pro Pro Phe Ser Leu Gln Ser
145 150 155 160
Gly Ile Leu Thr Leu Asn Pro Val Ala Gln Gly Gln Pro Ile Leu Thr
165 170 175
Ser Leu Gly Ser Asn Gln Glu Glu Ala Tyr Val Thr Met Ser Ser Phe
180 185 190
Tyr Gln Asn Gln
195
<210> 457
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S121
<400> 457
Trp Lys Lys Arg Ile Lys Pro Ile Val Trp Pro Ser Leu Pro Asp His
1 5 10 15
Lys Lys Thr Leu Glu His Leu Cys Lys Lys Pro Arg Lys Val Ser Val
20 25 30
Phe Gly Ala
35
<210> 458
<211> 230
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S126
<400> 458
Lys Leu Ser Pro Arg Val Lys Arg Ile Phe Tyr Gln Asn Val Pro Ser
1 5 10 15
Pro Ala Met Phe Phe Gln Pro Leu Tyr Ser Val His Asn Gly Asn Phe
20 25 30
Gln Thr Trp Met Gly Ala His Gly Ala Gly Val Leu Leu Ser Gln Asp
35 40 45
Cys Ala Gly Thr Pro Gln Gly Ala Leu Glu Pro Cys Val Gln Glu Ala
50 55 60
Thr Ala Leu Leu Thr Cys Gly Pro Ala Arg Pro Trp Lys Ser Val Ala
65 70 75 80
Leu Glu Glu Glu Gln Glu Gly Pro Gly Thr Arg Leu Pro Gly Asn Leu
85 90 95
Ser Ser Glu Asp Val Leu Pro Ala Gly Cys Thr Glu Trp Arg Val Gln
100 105 110
Thr Leu Ala Tyr Leu Pro Gln Glu Asp Trp Ala Pro Thr Ser Leu Thr
115 120 125
Arg Pro Ala Pro Pro Asp Ser Glu Gly Ser Arg Ser Ser Ser Ser Ser
130 135 140
Ser Ser Ser Asn Asn Asn Asn Tyr Cys Ala Leu Gly Cys Tyr Gly Gly
145 150 155 160
Trp His Leu Ser Ala Leu Pro Gly Asn Thr Gln Ser Ser Gly Pro Ile
165 170 175
Pro Ala Leu Ala Cys Gly Leu Ser Cys Asp His Gln Gly Leu Glu Thr
180 185 190
Gln Gln Gly Val Ala Trp Val Leu Ala Gly His Cys Gln Arg Pro Gly
195 200 205
Leu His Glu Asp Leu Gln Gly Met Leu Leu Pro Ser Val Leu Ser Lys
210 215 220
Ala Arg Ser Trp Thr Phe
225 230
<210> 459
<211> 322
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S129
<400> 459
Gln Leu Tyr Val Arg Arg Arg Lys Lys Leu Pro Ser Val Leu Leu Phe
1 5 10 15
Lys Lys Pro Ser Pro Phe Ile Phe Ile Ser Gln Arg Pro Ser Pro Glu
20 25 30
Thr Gln Asp Thr Ile His Pro Leu Asp Glu Glu Ala Phe Leu Lys Val
35 40 45
Ser Pro Glu Leu Lys Asn Leu Asp Leu His Gly Ser Thr Asp Ser Gly
50 55 60
Phe Gly Ser Thr Lys Pro Ser Leu Gln Thr Glu Glu Pro Gln Phe Leu
65 70 75 80
Leu Pro Asp Pro His Pro Gln Ala Asp Arg Thr Leu Gly Asn Arg Glu
85 90 95
Pro Pro Val Leu Gly Asp Ser Cys Ser Ser Gly Ser Ser Asn Ser Thr
100 105 110
Asp Ser Gly Ile Cys Leu Gln Glu Pro Ser Leu Ser Pro Ser Thr Gly
115 120 125
Pro Thr Trp Glu Gln Gln Val Gly Ser Asn Ser Arg Gly Gln Asp Asp
130 135 140
Ser Gly Ile Asp Leu Val Gln Asn Ser Glu Gly Arg Ala Gly Asp Thr
145 150 155 160
Gln Gly Gly Ser Ala Leu Gly His His Ser Pro Pro Glu Pro Glu Val
165 170 175
Pro Gly Glu Glu Asp Pro Ala Ala Val Ala Phe Gln Gly Tyr Leu Arg
180 185 190
Gln Thr Arg Cys Ala Glu Glu Lys Ala Thr Lys Thr Gly Cys Leu Glu
195 200 205
Glu Glu Ser Pro Leu Thr Asp Gly Leu Gly Pro Lys Phe Gly Arg Cys
210 215 220
Leu Val Asp Glu Ala Gly Leu His Pro Pro Ala Leu Ala Lys Gly Tyr
225 230 235 240
Leu Lys Gln Asp Pro Leu Glu Met Thr Leu Ala Ser Ser Gly Ala Pro
245 250 255
Thr Gly Gln Trp Asn Gln Pro Thr Glu Glu Trp Ser Leu Leu Ala Leu
260 265 270
Ser Ser Cys Ser Asp Leu Gly Ile Ser Asp Trp Ser Phe Ala His Asp
275 280 285
Leu Ala Pro Leu Gly Cys Val Ala Ala Pro Gly Gly Leu Leu Gly Ser
290 295 300
Phe Asn Ser Asp Leu Val Thr Leu Pro Leu Ile Ser Ser Leu Gln Ser
305 310 315 320
Ser Glu
<210> 460
<211> 83
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S130
<400> 460
Ala Leu Leu Trp Cys Val Tyr Lys Lys Thr Lys Tyr Ala Phe Ser Pro
1 5 10 15
Arg Asn Ser Leu Pro Gln His Leu Lys Glu Phe Leu Gly His Pro His
20 25 30
His Asn Thr Leu Leu Phe Phe Ser Phe Pro Leu Ser Asp Glu Asn Asp
35 40 45
Val Phe Asp Lys Leu Ser Val Ile Ala Glu Asp Ser Glu Ser Gly Lys
50 55 60
Gln Asn Pro Gly Asp Ser Cys Ser Leu Gly Thr Pro Pro Gly Gln Gly
65 70 75 80
Pro Gln Ser
<210> 461
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S135
<400> 461
Arg Leu Arg Arg Gly Gly Lys Asp Gly Ser Pro Lys Pro Gly Phe Leu
1 5 10 15
Ala Ser Val Ile Pro Val Asp Arg Arg Pro Gly Ala Pro Asn Leu
20 25 30
<210> 462
<211> 92
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S136
<400> 462
Asn Arg Ala Ala Arg His Leu Cys Pro Pro Leu Pro Thr Pro Cys Ala
1 5 10 15
Ser Ser Ala Ile Glu Phe Pro Gly Gly Lys Glu Thr Trp Gln Trp Ile
20 25 30
Asn Pro Val Asp Phe Gln Glu Glu Ala Ser Leu Gln Glu Ala Leu Val
35 40 45
Val Glu Met Ser Trp Asp Lys Gly Glu Arg Thr Glu Pro Leu Glu Lys
50 55 60
Thr Glu Leu Pro Glu Gly Ala Pro Glu Leu Ala Leu Asp Thr Glu Leu
65 70 75 80
Ser Leu Glu Asp Gly Asp Arg Cys Lys Ala Lys Met
85 90
<210> 463
<211> 90
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S137
<400> 463
Asn Arg Ala Ala Arg His Leu Cys Pro Pro Leu Pro Thr Pro Cys Ala
1 5 10 15
Ser Ser Ala Ile Glu Phe Pro Gly Gly Lys Glu Thr Trp Gln Trp Ile
20 25 30
Asn Pro Val Asp Phe Gln Glu Glu Ala Ser Leu Gln Glu Ala Leu Val
35 40 45
Val Glu Met Ser Trp Asp Lys Gly Glu Arg Thr Glu Pro Leu Glu Lys
50 55 60
Thr Glu Leu Pro Glu Gly Ala Pro Glu Leu Ala Leu Asp Thr Glu Leu
65 70 75 80
Ser Leu Glu Asp Gly Asp Arg Cys Asp Arg
85 90
<210> 464
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S138
<400> 464
His Tyr Phe Gln Gln Lys Val Phe Val Leu Leu Ala Ala Leu Arg Pro
1 5 10 15
Gln Trp Cys Ser Arg Glu Ile Pro Asp Pro Ala Asn Ser Thr Cys Ala
20 25 30
Lys Lys Tyr Pro Ile Ala Glu Glu Lys Thr Gln Leu Pro Leu Asp Arg
35 40 45
Leu Leu Ile Asp Trp Pro Thr Pro Glu Asp Pro Glu Pro Leu Val Ile
50 55 60
Ser Glu Val Leu His Gln Val Thr Pro Val Phe Arg His Pro Pro Cys
65 70 75 80
Ser Asn Trp Pro Gln Arg Glu Lys Gly Ile Gln Gly His Gln Ala Ser
85 90 95
Glu Lys Asp Met Met His Ser Ala Ser Ser Pro Pro Pro Pro Arg Ala
100 105 110
Leu Gln Ala Glu Ser Arg Gln Leu Val Asp Leu Tyr Lys Val Leu Glu
115 120 125
Ser Arg Gly Ser Asp Pro Lys Pro Glu Asn Pro Ala Cys Pro Trp Thr
130 135 140
Val Leu Pro Ala Gly Asp Leu Pro Thr His Asp Gly Tyr Leu Pro Ser
145 150 155 160
Asn Ile Asp Asp Leu Pro Ser His Glu Ala Pro Leu Ala Asp Ser Leu
165 170 175
Glu Glu Leu Glu Pro Gln His Ile Ser Leu Ser Val Phe Pro Ser Ser
180 185 190
Ser Leu His Pro Leu Thr Phe Ser Cys Gly Asp Lys Leu Thr Leu Asp
195 200 205
Gln Leu Lys Met Arg Cys Asp Ser Leu Met Leu
210 215
<210> 465
<211> 60
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S141
<400> 465
Lys Arg Leu Lys Ile Ile Ile Phe Pro Pro Ile Pro Asp Pro Gly Lys
1 5 10 15
Ile Phe Lys Glu Met Phe Gly Asp Gln Asn Asp Asp Thr Leu His Trp
20 25 30
Lys Lys Tyr Asp Ile Tyr Glu Lys Gln Thr Lys Glu Glu Thr Asp Ser
35 40 45
Val Val Leu Ile Glu Asn Leu Lys Lys Ala Ser Gln
50 55 60
<210> 466
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S142
<400> 466
Arg Lys Pro Asn Thr Tyr Pro Lys Met Ile Pro Glu Phe Phe Cys Asp
1 5 10 15
Thr
<210> 467
<211> 39
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S143
<400> 467
Lys Ser Arg Gln Thr Pro Pro Leu Ala Ser Val Glu Met Glu Ala Met
1 5 10 15
Glu Ala Leu Pro Val Thr Trp Gly Thr Ser Ser Arg Asp Glu Asp Leu
20 25 30
Glu Asn Cys Ser His His Leu
35
<210> 468
<211> 525
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S144
<400> 468
Cys Met Thr Trp Arg Leu Ala Gly Pro Gly Ser Glu Lys Tyr Ser Asp
1 5 10 15
Asp Thr Lys Tyr Thr Asp Gly Leu Pro Ala Ala Asp Leu Ile Pro Pro
20 25 30
Pro Leu Lys Pro Arg Lys Val Trp Ile Ile Tyr Ser Ala Asp His Pro
35 40 45
Leu Tyr Val Asp Val Val Leu Lys Phe Ala Gln Phe Leu Leu Thr Ala
50 55 60
Cys Gly Thr Glu Val Ala Leu Asp Leu Leu Glu Glu Gln Ala Ile Ser
65 70 75 80
Glu Ala Gly Val Met Thr Trp Val Gly Arg Gln Lys Gln Glu Met Val
85 90 95
Glu Ser Asn Ser Lys Ile Ile Val Leu Cys Ser Arg Gly Thr Arg Ala
100 105 110
Lys Trp Gln Ala Leu Leu Gly Arg Gly Ala Pro Val Arg Leu Arg Cys
115 120 125
Asp His Gly Lys Pro Val Gly Asp Leu Phe Thr Ala Ala Met Asn Met
130 135 140
Ile Leu Pro Asp Phe Lys Arg Pro Ala Cys Phe Gly Thr Tyr Val Val
145 150 155 160
Cys Tyr Phe Ser Glu Val Ser Cys Asp Gly Asp Val Pro Asp Leu Phe
165 170 175
Gly Ala Ala Pro Arg Tyr Pro Leu Met Asp Arg Phe Glu Glu Val Tyr
180 185 190
Phe Arg Ile Gln Asp Leu Glu Met Phe Gln Pro Gly Arg Met His Arg
195 200 205
Val Gly Glu Leu Ser Gly Asp Asn Tyr Leu Arg Ser Pro Gly Gly Arg
210 215 220
Gln Leu Arg Ala Ala Leu Asp Arg Phe Arg Asp Trp Gln Val Arg Cys
225 230 235 240
Pro Asp Trp Phe Glu Cys Glu Asn Leu Tyr Ser Ala Asp Asp Gln Asp
245 250 255
Ala Pro Ser Leu Asp Glu Glu Val Phe Glu Glu Pro Leu Leu Pro Pro
260 265 270
Gly Thr Gly Ile Val Lys Arg Ala Pro Leu Val Arg Glu Pro Gly Ser
275 280 285
Gln Ala Cys Leu Ala Ile Asp Pro Leu Val Gly Glu Glu Gly Gly Ala
290 295 300
Ala Val Ala Lys Leu Glu Pro His Leu Gln Pro Arg Gly Gln Pro Ala
305 310 315 320
Pro Gln Pro Leu His Thr Leu Val Leu Ala Ala Glu Glu Gly Ala Leu
325 330 335
Val Ala Ala Val Glu Pro Gly Pro Leu Ala Asp Gly Ala Ala Val Arg
340 345 350
Leu Ala Leu Ala Gly Glu Gly Glu Ala Cys Pro Leu Leu Gly Ser Pro
355 360 365
Gly Ala Gly Arg Asn Ser Val Leu Phe Leu Pro Val Asp Pro Glu Asp
370 375 380
Ser Pro Leu Gly Ser Ser Thr Pro Met Ala Ser Pro Asp Leu Leu Pro
385 390 395 400
Glu Asp Val Arg Glu His Leu Glu Gly Leu Met Leu Ser Leu Phe Glu
405 410 415
Gln Ser Leu Ser Cys Gln Ala Gln Gly Gly Cys Ser Arg Pro Ala Met
420 425 430
Val Leu Thr Asp Pro His Thr Pro Tyr Glu Glu Glu Gln Arg Gln Ser
435 440 445
Val Gln Ser Asp Gln Gly Tyr Ile Ser Arg Ser Ser Pro Gln Pro Pro
450 455 460
Glu Gly Leu Thr Glu Met Glu Glu Glu Glu Glu Glu Glu Gln Asp Pro
465 470 475 480
Gly Lys Pro Ala Leu Pro Leu Ser Pro Glu Asp Leu Glu Ser Leu Arg
485 490 495
Ser Leu Gln Arg Gln Leu Leu Phe Arg Gln Leu Gln Lys Asn Ser Gly
500 505 510
Trp Asp Thr Met Gly Ser Glu Ser Glu Gly Pro Ser Ala
515 520 525
<210> 469
<211> 189
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S145
<400> 469
Arg His Glu Arg Ile Lys Lys Thr Ser Phe Ser Thr Thr Thr Leu Leu
1 5 10 15
Pro Pro Ile Lys Val Leu Val Val Tyr Pro Ser Glu Ile Cys Phe His
20 25 30
His Thr Ile Cys Tyr Phe Thr Glu Phe Leu Gln Asn His Cys Arg Ser
35 40 45
Glu Val Ile Leu Glu Lys Trp Gln Lys Lys Lys Ile Ala Glu Met Gly
50 55 60
Pro Val Gln Trp Leu Ala Thr Gln Lys Lys Ala Ala Asp Lys Val Val
65 70 75 80
Phe Leu Leu Ser Asn Asp Val Asn Ser Val Cys Asp Gly Thr Cys Gly
85 90 95
Lys Ser Glu Gly Ser Pro Ser Glu Asn Ser Gln Asp Leu Phe Pro Leu
100 105 110
Ala Phe Asn Leu Phe Cys Ser Asp Leu Arg Ser Gln Ile His Leu His
115 120 125
Lys Tyr Val Val Val Tyr Phe Arg Glu Ile Asp Thr Lys Asp Asp Tyr
130 135 140
Asn Ala Leu Ser Val Cys Pro Lys Tyr His Leu Met Lys Asp Ala Thr
145 150 155 160
Ala Phe Cys Ala Glu Leu Leu His Val Lys Gln Gln Val Ser Ala Gly
165 170 175
Lys Arg Ser Gln Ala Cys His Asp Gly Cys Cys Ser Leu
180 185
<210> 470
<211> 232
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S146
<400> 470
Lys Lys Asp His Ala Lys Gly Trp Leu Arg Leu Leu Lys Gln Asp Val
1 5 10 15
Arg Ser Gly Ala Ala Ala Arg Gly Arg Ala Ala Leu Leu Leu Tyr Ser
20 25 30
Ala Asp Asp Ser Gly Phe Glu Arg Leu Val Gly Ala Leu Ala Ser Ala
35 40 45
Leu Cys Gln Leu Pro Leu Arg Val Ala Val Asp Leu Trp Ser Arg Arg
50 55 60
Glu Leu Ser Ala Gln Gly Pro Val Ala Trp Phe His Ala Gln Arg Arg
65 70 75 80
Gln Thr Leu Gln Glu Gly Gly Val Val Val Leu Leu Phe Ser Pro Gly
85 90 95
Ala Val Ala Leu Cys Ser Glu Trp Leu Gln Asp Gly Val Ser Gly Pro
100 105 110
Gly Ala His Gly Pro His Asp Ala Phe Arg Ala Ser Leu Ser Cys Val
115 120 125
Leu Pro Asp Phe Leu Gln Gly Arg Ala Pro Gly Ser Tyr Val Gly Ala
130 135 140
Cys Phe Asp Arg Leu Leu His Pro Asp Ala Val Pro Ala Leu Phe Arg
145 150 155 160
Thr Val Pro Val Phe Thr Leu Pro Ser Gln Leu Pro Asp Phe Leu Gly
165 170 175
Ala Leu Gln Gln Pro Arg Ala Pro Arg Ser Gly Arg Leu Gln Glu Arg
180 185 190
Ala Glu Gln Val Ser Arg Ala Leu Gln Pro Ala Leu Asp Ser Tyr Phe
195 200 205
His Pro Pro Gly Thr Pro Ala Pro Gly Arg Gly Val Gly Pro Gly Ala
210 215 220
Gly Pro Gly Ala Gly Asp Gly Thr
225 230
<210> 471
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S147
<400> 471
Lys Lys Asp His Ala Lys Ala Ala Ala Arg Gly Arg Ala Ala Leu Leu
1 5 10 15
Leu Tyr Ser Ala Asp Asp Ser Gly Phe Glu Arg Leu Val Gly Ala Leu
20 25 30
Ala Ser Ala Leu Cys Gln Leu Pro Leu Arg Val Ala Val Asp Leu Trp
35 40 45
Ser Arg Arg Glu Leu Ser Ala Gln Gly Pro Val Ala Trp Phe His Ala
50 55 60
Gln Arg Arg Gln Thr Leu Gln Glu Gly Gly Val Val Val Leu Leu Phe
65 70 75 80
Ser Pro Gly Ala Val Ala Leu Cys Ser Glu Trp Leu Gln Asp Gly Val
85 90 95
Ser Gly Pro Gly Ala His Gly Pro His Asp Ala Phe Arg Ala Ser Leu
100 105 110
Ser Cys Val Leu Pro Asp Phe Leu Gln Gly Arg Ala Pro Gly Ser Tyr
115 120 125
Val Gly Ala Cys Phe Asp Arg Leu Leu His Pro Asp Ala Val Pro Ala
130 135 140
Leu Phe Arg Thr Val Pro Val Phe Thr Leu Pro Ser Gln Leu Pro Asp
145 150 155 160
Phe Leu Gly Ala Leu Gln Gln Pro Arg Ala Pro Arg Ser Gly Arg Leu
165 170 175
Gln Glu Arg Ala Glu Gln Val Ser Arg Ala Leu Gln Pro Ala Leu Asp
180 185 190
Ser Tyr Phe His Pro Pro Gly Thr Pro Ala Pro Gly Arg Gly Val Gly
195 200 205
Pro Gly Ala Gly Pro Gly Ala Gly Asp Gly Thr
210 215
<210> 472
<211> 419
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S148
<400> 472
Cys Arg Lys Lys Gln Gln Glu Asn Ile Tyr Ser His Leu Asp Glu Glu
1 5 10 15
Ser Ser Glu Ser Ser Thr Tyr Thr Ala Ala Leu Pro Arg Glu Arg Leu
20 25 30
Arg Pro Arg Pro Lys Val Phe Leu Cys Tyr Ser Ser Lys Asp Gly Gln
35 40 45
Asn His Met Asn Val Val Gln Cys Phe Ala Tyr Phe Leu Gln Asp Phe
50 55 60
Cys Gly Cys Glu Val Ala Leu Asp Leu Trp Glu Asp Phe Ser Leu Cys
65 70 75 80
Arg Glu Gly Gln Arg Glu Trp Val Ile Gln Lys Ile His Glu Ser Gln
85 90 95
Phe Ile Ile Val Val Cys Ser Lys Gly Met Lys Tyr Phe Val Asp Lys
100 105 110
Lys Asn Tyr Lys His Lys Gly Gly Gly Arg Gly Ser Gly Lys Gly Glu
115 120 125
Leu Phe Leu Val Ala Val Ser Ala Ile Ala Glu Lys Leu Arg Gln Ala
130 135 140
Lys Gln Ser Ser Ser Ala Ala Leu Ser Lys Phe Ile Ala Val Tyr Phe
145 150 155 160
Asp Tyr Ser Cys Glu Gly Asp Val Pro Gly Ile Leu Asp Leu Ser Thr
165 170 175
Lys Tyr Arg Leu Met Asp Asn Leu Pro Gln Leu Cys Ser His Leu His
180 185 190
Ser Arg Asp His Gly Leu Gln Glu Pro Gly Gln His Thr Arg Gln Gly
195 200 205
Ser Arg Arg Asn Tyr Phe Arg Ser Lys Ser Gly Arg Ser Leu Tyr Val
210 215 220
Ala Ile Cys Asn Met His Gln Phe Ile Asp Glu Glu Pro Asp Trp Phe
225 230 235 240
Glu Lys Gln Phe Val Pro Phe His Pro Pro Pro Leu Arg Tyr Arg Glu
245 250 255
Pro Val Leu Glu Lys Phe Asp Ser Gly Leu Val Leu Asn Asp Val Met
260 265 270
Cys Lys Pro Gly Pro Glu Ser Asp Phe Cys Leu Lys Val Glu Ala Ala
275 280 285
Val Leu Gly Ala Thr Gly Pro Ala Asp Ser Gln His Glu Ser Gln His
290 295 300
Gly Gly Leu Asp Gln Asp Gly Glu Ala Arg Pro Ala Leu Asp Gly Ser
305 310 315 320
Ala Ala Leu Gln Pro Leu Leu His Thr Val Lys Ala Gly Ser Pro Ser
325 330 335
Asp Met Pro Arg Asp Ser Gly Ile Tyr Asp Ser Ser Val Pro Ser Ser
340 345 350
Glu Leu Ser Leu Pro Leu Met Glu Gly Leu Ser Thr Asp Gln Thr Glu
355 360 365
Thr Ser Ser Leu Thr Glu Ser Val Ser Ser Ser Ser Gly Leu Gly Glu
370 375 380
Glu Glu Pro Pro Ala Leu Pro Ser Lys Leu Leu Ser Ser Gly Ser Cys
385 390 395 400
Lys Ala Asp Leu Gly Cys Arg Ser Tyr Thr Asp Glu Leu His Ala Val
405 410 415
Ala Pro Leu
<210> 473
<211> 192
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S149
<400> 473
Thr Cys Arg Arg Pro Gln Ser Gly Pro Gly Pro Ala Arg Pro Val Leu
1 5 10 15
Leu Leu His Ala Ala Asp Ser Glu Ala Gln Arg Arg Leu Val Gly Ala
20 25 30
Leu Ala Glu Leu Leu Arg Ala Ala Leu Gly Gly Gly Arg Asp Val Ile
35 40 45
Val Asp Leu Trp Glu Gly Arg His Val Ala Arg Val Gly Pro Leu Pro
50 55 60
Trp Leu Trp Ala Ala Arg Thr Arg Val Ala Arg Glu Gln Gly Thr Val
65 70 75 80
Leu Leu Leu Trp Ser Gly Ala Asp Leu Arg Pro Val Ser Gly Pro Asp
85 90 95
Pro Arg Ala Ala Pro Leu Leu Ala Leu Leu His Ala Ala Pro Arg Pro
100 105 110
Leu Leu Leu Leu Ala Tyr Phe Ser Arg Leu Cys Ala Lys Gly Asp Ile
115 120 125
Pro Pro Pro Leu Arg Ala Leu Pro Arg Tyr Arg Leu Leu Arg Asp Leu
130 135 140
Pro Arg Leu Leu Arg Ala Leu Asp Ala Arg Pro Phe Ala Glu Ala Thr
145 150 155 160
Ser Trp Gly Arg Leu Gly Ala Arg Gln Arg Arg Gln Ser Arg Leu Glu
165 170 175
Leu Cys Ser Arg Leu Glu Arg Glu Ala Ala Arg Leu Ala Asp Leu Gly
180 185 190
<210> 474
<211> 191
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S154
<400> 474
Tyr Arg Val Asp Leu Val Leu Phe Tyr Arg His Leu Thr Arg Arg Asp
1 5 10 15
Glu Thr Leu Thr Asp Gly Lys Thr Tyr Asp Ala Phe Val Ser Tyr Leu
20 25 30
Lys Glu Cys Arg Pro Glu Asn Gly Glu Glu His Thr Phe Ala Val Glu
35 40 45
Ile Leu Pro Arg Val Leu Glu Lys His Phe Gly Tyr Lys Leu Cys Ile
50 55 60
Phe Glu Arg Asp Val Val Pro Gly Gly Ala Val Val Asp Glu Ile His
65 70 75 80
Ser Leu Ile Glu Lys Ser Arg Arg Leu Ile Ile Val Leu Ser Lys Ser
85 90 95
Tyr Met Ser Asn Glu Val Arg Tyr Glu Leu Glu Ser Gly Leu His Glu
100 105 110
Ala Leu Val Glu Arg Lys Ile Lys Ile Ile Leu Ile Glu Phe Thr Pro
115 120 125
Val Thr Asp Phe Thr Phe Leu Pro Gln Ser Leu Lys Leu Leu Lys Ser
130 135 140
His Arg Val Leu Lys Trp Lys Ala Asp Lys Ser Leu Ser Tyr Asn Ser
145 150 155 160
Arg Phe Trp Lys Asn Leu Leu Tyr Leu Met Pro Ala Lys Thr Val Lys
165 170 175
Pro Gly Arg Asp Glu Pro Glu Val Leu Pro Val Leu Ser Glu Ser
180 185 190
<210> 475
<211> 222
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S155
<400> 475
Ser Ala Leu Leu Tyr Arg His Trp Ile Glu Ile Val Leu Leu Tyr Arg
1 5 10 15
Thr Tyr Gln Ser Lys Asp Gln Thr Leu Gly Asp Lys Lys Asp Phe Asp
20 25 30
Ala Phe Val Ser Tyr Ala Lys Trp Ser Ser Phe Pro Ser Glu Ala Thr
35 40 45
Ser Ser Leu Ser Glu Glu His Leu Ala Leu Ser Leu Phe Pro Asp Val
50 55 60
Leu Glu Asn Lys Tyr Gly Tyr Ser Leu Cys Leu Leu Glu Arg Asp Val
65 70 75 80
Ala Pro Gly Gly Val Tyr Ala Glu Asp Ile Val Ser Ile Ile Lys Arg
85 90 95
Ser Arg Arg Gly Ile Phe Ile Leu Ser Pro Asn Tyr Val Asn Gly Pro
100 105 110
Ser Ile Phe Glu Leu Gln Ala Ala Val Asn Leu Ala Leu Asp Asp Gln
115 120 125
Thr Leu Lys Leu Ile Leu Ile Lys Phe Cys Tyr Phe Gln Glu Pro Glu
130 135 140
Ser Leu Pro His Leu Val Lys Lys Ala Leu Arg Val Leu Pro Thr Val
145 150 155 160
Thr Trp Arg Gly Leu Lys Ser Val Pro Pro Asn Ser Arg Phe Trp Ala
165 170 175
Lys Met Arg Tyr His Met Pro Val Lys Asn Ser Gln Gly Phe Thr Trp
180 185 190
Asn Gln Leu Arg Ile Thr Ser Arg Ile Phe Gln Trp Lys Gly Leu Ser
195 200 205
Arg Thr Glu Thr Thr Gly Arg Ser Ser Gln Pro Lys Glu Trp
210 215 220
<210> 476
<211> 282
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S156
<400> 476
Ser Ile Tyr Arg Tyr Ile His Val Gly Lys Glu Lys His Pro Ala Asn
1 5 10 15
Leu Ile Leu Ile Tyr Gly Asn Glu Phe Asp Lys Arg Phe Phe Val Pro
20 25 30
Ala Glu Lys Ile Val Ile Asn Phe Ile Thr Leu Asn Ile Ser Asp Asp
35 40 45
Ser Lys Ile Ser His Gln Asp Met Ser Leu Leu Gly Lys Ser Ser Asp
50 55 60
Val Ser Ser Leu Asn Asp Pro Gln Pro Ser Gly Asn Leu Arg Pro Pro
65 70 75 80
Gln Glu Glu Glu Glu Val Lys His Leu Gly Tyr Ala Ser His Leu Met
85 90 95
Glu Ile Phe Cys Asp Ser Glu Glu Asn Thr Glu Gly Thr Ser Leu Thr
100 105 110
Gln Gln Glu Ser Leu Ser Arg Thr Ile Pro Pro Asp Lys Thr Val Ile
115 120 125
Glu Tyr Glu Tyr Asp Val Arg Thr Thr Asp Ile Cys Ala Gly Pro Glu
130 135 140
Glu Gln Glu Leu Ser Leu Gln Glu Glu Val Ser Thr Gln Gly Thr Leu
145 150 155 160
Leu Glu Ser Gln Ala Ala Leu Ala Val Leu Gly Pro Gln Thr Leu Gln
165 170 175
Tyr Ser Tyr Thr Pro Gln Leu Gln Asp Leu Asp Pro Leu Ala Gln Glu
180 185 190
His Thr Asp Ser Glu Glu Gly Pro Glu Glu Glu Pro Ser Thr Thr Leu
195 200 205
Val Asp Trp Asp Pro Gln Thr Gly Arg Leu Cys Ile Pro Ser Leu Ser
210 215 220
Ser Phe Asp Gln Asp Ser Glu Gly Cys Glu Pro Ser Glu Gly Asp Gly
225 230 235 240
Leu Gly Glu Glu Gly Leu Leu Ser Arg Leu Tyr Glu Glu Pro Ala Pro
245 250 255
Asp Arg Pro Pro Gly Glu Asn Glu Thr Tyr Leu Met Gln Phe Met Glu
260 265 270
Glu Trp Gly Leu Tyr Val Gln Met Glu Asn
275 280
<210> 477
<211> 57
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S157
<400> 477
Trp Lys Met Gly Arg Leu Leu Gln Tyr Ser Cys Cys Pro Val Val Val
1 5 10 15
Leu Pro Asp Thr Leu Lys Ile Thr Asn Ser Pro Gln Lys Leu Ile Ser
20 25 30
Cys Arg Arg Glu Glu Val Asp Ala Cys Ala Thr Ala Val Met Ser Pro
35 40 45
Glu Glu Leu Leu Arg Ala Trp Ile Ser
50 55
<210> 478
<211> 285
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S158
<400> 478
Ser Leu Lys Thr His Pro Leu Trp Arg Leu Trp Lys Lys Ile Trp Ala
1 5 10 15
Val Pro Ser Pro Glu Arg Phe Phe Met Pro Leu Tyr Lys Gly Cys Ser
20 25 30
Gly Asp Phe Lys Lys Trp Val Gly Ala Pro Phe Thr Gly Ser Ser Leu
35 40 45
Glu Leu Gly Pro Trp Ser Pro Glu Val Pro Ser Thr Leu Glu Val Tyr
50 55 60
Ser Cys His Pro Pro Arg Ser Pro Ala Lys Arg Leu Gln Leu Thr Glu
65 70 75 80
Leu Gln Glu Pro Ala Glu Leu Val Glu Ser Asp Gly Val Pro Lys Pro
85 90 95
Ser Phe Trp Pro Thr Ala Gln Asn Ser Gly Gly Ser Ala Tyr Ser Glu
100 105 110
Glu Arg Asp Arg Pro Tyr Gly Leu Val Ser Ile Asp Thr Val Thr Val
115 120 125
Leu Asp Ala Glu Gly Pro Cys Thr Trp Pro Cys Ser Cys Glu Asp Asp
130 135 140
Gly Tyr Pro Ala Leu Asp Leu Asp Ala Gly Leu Glu Pro Ser Pro Gly
145 150 155 160
Leu Glu Asp Pro Leu Leu Asp Ala Gly Thr Thr Val Leu Ser Cys Gly
165 170 175
Cys Val Ser Ala Gly Ser Pro Gly Leu Gly Gly Pro Leu Gly Ser Leu
180 185 190
Leu Asp Arg Leu Lys Pro Pro Leu Ala Asp Gly Glu Asp Trp Ala Gly
195 200 205
Gly Leu Pro Trp Gly Gly Arg Ser Pro Gly Gly Val Ser Glu Ser Glu
210 215 220
Ala Gly Ser Pro Leu Ala Gly Leu Asp Met Asp Thr Phe Asp Ser Gly
225 230 235 240
Phe Val Gly Ser Asp Cys Ser Ser Pro Val Glu Cys Asp Phe Thr Ser
245 250 255
Pro Gly Asp Glu Gly Pro Pro Arg Ser Tyr Leu Arg Gln Trp Val Val
260 265 270
Ile Pro Pro Pro Leu Ser Ser Pro Gly Pro Gln Ala Ser
275 280 285
<210> 479
<211> 325
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S161
<400> 479
Ser Tyr Arg Tyr Val Thr Lys Pro Pro Ala Pro Pro Asn Ser Leu Asn
1 5 10 15
Val Gln Arg Val Leu Thr Phe Gln Pro Leu Arg Phe Ile Gln Glu His
20 25 30
Val Leu Ile Pro Val Phe Asp Leu Ser Gly Pro Ser Ser Leu Ala Gln
35 40 45
Pro Val Gln Tyr Ser Gln Ile Arg Val Ser Gly Pro Arg Glu Pro Ala
50 55 60
Gly Ala Pro Gln Arg His Ser Leu Ser Glu Ile Thr Tyr Leu Gly Gln
65 70 75 80
Pro Asp Ile Ser Ile Leu Gln Pro Ser Asn Val Pro Pro Pro Gln Ile
85 90 95
Leu Ser Pro Leu Ser Tyr Ala Pro Asn Ala Ala Pro Glu Val Gly Pro
100 105 110
Pro Ser Tyr Ala Pro Gln Val Thr Pro Glu Ala Gln Phe Pro Phe Tyr
115 120 125
Ala Pro Gln Ala Ile Ser Lys Val Gln Pro Ser Ser Tyr Ala Pro Gln
130 135 140
Ala Thr Pro Asp Ser Trp Pro Pro Ser Tyr Gly Val Cys Met Glu Gly
145 150 155 160
Ser Gly Lys Asp Ser Pro Thr Gly Thr Leu Ser Ser Pro Lys His Leu
165 170 175
Arg Pro Lys Gly Gln Leu Gln Lys Glu Pro Pro Ala Gly Ser Cys Met
180 185 190
Leu Gly Gly Leu Ser Leu Gln Glu Val Thr Ser Leu Ala Met Glu Glu
195 200 205
Ser Gln Glu Ala Lys Ser Leu His Gln Pro Leu Gly Ile Cys Thr Asp
210 215 220
Arg Thr Ser Asp Pro Asn Val Leu His Ser Gly Glu Glu Gly Thr Pro
225 230 235 240
Gln Tyr Leu Lys Gly Gln Leu Pro Leu Leu Ser Ser Val Gln Ile Glu
245 250 255
Gly His Pro Met Ser Leu Pro Leu Gln Pro Pro Ser Arg Pro Cys Ser
260 265 270
Pro Ser Asp Gln Gly Pro Ser Pro Trp Gly Leu Leu Glu Ser Leu Val
275 280 285
Cys Pro Lys Asp Glu Ala Lys Ser Pro Ala Pro Glu Thr Ser Asp Leu
290 295 300
Glu Gln Pro Thr Glu Leu Asp Ser Leu Phe Arg Gly Leu Ala Leu Thr
305 310 315 320
Val Gln Trp Glu Ser
325
<210> 480
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S165
<400> 480
Asn Arg Ser Phe Arg Thr Gly Ile Lys Arg Arg Ile Leu Leu Leu Ile
1 5 10 15
Pro Lys Trp Leu Tyr Glu Asp Ile Pro Asn Met Lys Asn Ser Asn Val
20 25 30
Val Lys Met Leu Gln Glu Asn Ser Glu Leu Met Asn Asn Asn Ser Ser
35 40 45
Glu Gln Val Leu Tyr Val Asp Pro Met Ile Thr Glu Ile Lys Glu Ile
50 55 60
Phe Ile Pro Glu His Lys Pro Thr Asp Tyr Lys Lys Glu Asn Thr Gly
65 70 75 80
Pro Leu Glu Thr Arg Asp Tyr Pro Gln Asn Ser Leu Phe Asp Asn Thr
85 90 95
Thr Val Val Tyr Ile Pro Asp Leu Asn Thr Gly Tyr Lys Pro Gln Ile
100 105 110
Ser Asn Phe Leu Pro Glu Gly Ser His Leu Ser Asn Asn Asn Glu Ile
115 120 125
Thr Ser Leu Thr Leu Lys Pro Pro Val Asp Ser Leu Asp Ser Gly Asn
130 135 140
Asn Pro Arg Leu Gln Lys His Pro Asn Phe Ala Phe Ser Val Ser Ser
145 150 155 160
Val Asn Ser Leu Ser Asn Thr Ile Phe Leu Gly Glu Leu Ser Leu Ile
165 170 175
Leu Asn Gln Gly Glu Cys Ser Ser Pro Asp Ile Gln Asn Ser Val Glu
180 185 190
Glu Glu Thr Thr Met Leu Leu Glu Asn Asp Ser Pro Ser Glu Thr Ile
195 200 205
Pro Glu Gln Thr Leu Leu Pro Asp Glu Phe Val Ser Cys Leu Gly Ile
210 215 220
Val Asn Glu Glu Leu Pro Ser Ile Asn Thr Tyr Phe Pro Gln Asn Ile
225 230 235 240
Leu Glu Ser His Phe Asn Arg Ile Ser Leu Leu Glu Lys
245 250
<210> 481
<211> 99
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S168
<400> 481
Thr Ser Gly Arg Cys Tyr His Leu Arg His Lys Val Leu Pro Arg Trp
1 5 10 15
Val Trp Glu Lys Val Pro Asp Pro Ala Asn Ser Ser Ser Gly Gln Pro
20 25 30
His Met Glu Gln Val Pro Glu Ala Gln Pro Leu Gly Asp Leu Pro Ile
35 40 45
Leu Glu Val Glu Glu Met Glu Pro Pro Pro Val Met Glu Ser Ser Gln
50 55 60
Pro Ala Gln Ala Thr Ala Pro Leu Asp Ser Gly Tyr Glu Lys His Phe
65 70 75 80
Leu Pro Thr Pro Glu Glu Leu Gly Leu Leu Gly Pro Pro Arg Pro Gln
85 90 95
Val Leu Ala
<210> 482
<211> 86
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S169
<400> 482
Thr Ser Trp Val Trp Glu Lys Val Pro Asp Pro Ala Asn Ser Ser Ser
1 5 10 15
Gly Gln Pro His Met Glu Gln Val Pro Glu Ala Gln Pro Leu Gly Asp
20 25 30
Leu Pro Ile Leu Glu Val Glu Glu Met Glu Pro Pro Pro Val Met Glu
35 40 45
Ser Ser Gln Pro Ala Gln Ala Thr Ala Pro Leu Asp Ser Gly Tyr Glu
50 55 60
Lys His Phe Leu Pro Thr Pro Glu Glu Leu Gly Leu Leu Gly Pro Pro
65 70 75 80
Arg Pro Gln Val Leu Ala
85
<210> 483
<211> 189
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S170
<400> 483
Lys Lys Pro Asn Lys Leu Thr His Leu Cys Trp Pro Thr Val Pro Asn
1 5 10 15
Pro Ala Glu Ser Ser Ile Ala Thr Trp His Gly Asp Asp Phe Lys Asp
20 25 30
Lys Leu Asn Leu Lys Glu Ser Asp Asp Ser Val Asn Thr Glu Asp Arg
35 40 45
Ile Leu Lys Pro Cys Ser Thr Pro Ser Asp Lys Leu Val Ile Asp Lys
50 55 60
Leu Val Val Asn Phe Gly Asn Val Leu Gln Glu Ile Phe Thr Asp Glu
65 70 75 80
Ala Arg Thr Gly Gln Glu Asn Asn Leu Gly Gly Glu Lys Asn Gly Tyr
85 90 95
Val Thr Cys Pro Phe Arg Pro Asp Cys Pro Leu Gly Lys Ser Phe Glu
100 105 110
Glu Leu Pro Val Ser Pro Glu Ile Pro Pro Arg Lys Ser Gln Tyr Leu
115 120 125
Arg Ser Arg Met Pro Glu Gly Thr Arg Pro Glu Ala Lys Glu Gln Leu
130 135 140
Leu Phe Ser Gly Gln Ser Leu Val Pro Asp His Leu Cys Glu Glu Gly
145 150 155 160
Ala Pro Asn Pro Tyr Leu Lys Asn Ser Val Thr Ala Arg Glu Phe Leu
165 170 175
Val Ser Glu Lys Leu Pro Glu His Thr Lys Gly Glu Val
180 185
<210> 484
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S171
<400> 484
Lys Lys Pro Asn Lys Leu Thr His Leu Cys Trp Pro Thr Val Pro Asn
1 5 10 15
Pro Ala Glu Ser Ser Ile Ala Thr Trp His Gly Asp Asp Phe Lys Asp
20 25 30
Lys Leu Asn Leu Lys Glu Ser Asp Asp Ser Val Asn Thr Glu Asp Arg
35 40 45
Ile Leu Lys Pro Cys Ser Thr Pro Ser Asp Lys Leu Val Ile Asp Lys
50 55 60
Leu Val Val Asn Phe Gly Asn Val Leu Gln Glu Ile Phe Thr Asp Glu
65 70 75 80
Ala Arg Thr Gly Gln Glu Asn Asn Leu Gly Gly Glu Lys Asn Gly Thr
85 90 95
Arg Ile Leu Ser Ser Cys Pro Thr Ser Ile
100 105
<210> 485
<211> 303
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S174
<400> 485
Ser His Gln Arg Met Lys Lys Leu Phe Trp Glu Asp Val Pro Asn Pro
1 5 10 15
Lys Asn Cys Ser Trp Ala Gln Gly Leu Asn Phe Gln Lys Pro Glu Thr
20 25 30
Phe Glu His Leu Phe Ile Lys His Thr Ala Ser Val Thr Cys Gly Pro
35 40 45
Leu Leu Leu Glu Pro Glu Thr Ile Ser Glu Asp Ile Ser Val Asp Thr
50 55 60
Ser Trp Lys Asn Lys Asp Glu Met Met Pro Thr Thr Val Val Ser Leu
65 70 75 80
Leu Ser Thr Thr Asp Leu Glu Lys Gly Ser Val Cys Ile Ser Asp Gln
85 90 95
Phe Asn Ser Val Asn Phe Ser Glu Ala Glu Gly Thr Glu Val Thr Tyr
100 105 110
Glu Asp Glu Ser Gln Arg Gln Pro Phe Val Lys Tyr Ala Thr Leu Ile
115 120 125
Ser Asn Ser Lys Pro Ser Glu Thr Gly Glu Glu Gln Gly Leu Ile Asn
130 135 140
Ser Ser Val Thr Lys Cys Phe Ser Ser Lys Asn Ser Pro Leu Lys Asp
145 150 155 160
Ser Phe Ser Asn Ser Ser Trp Glu Ile Glu Ala Gln Ala Phe Phe Ile
165 170 175
Leu Ser Asp Gln His Pro Asn Ile Ile Ser Pro His Leu Thr Phe Ser
180 185 190
Glu Gly Leu Asp Glu Leu Leu Lys Leu Glu Gly Asn Phe Pro Glu Glu
195 200 205
Asn Asn Asp Lys Lys Ser Ile Tyr Tyr Leu Gly Val Thr Ser Ile Lys
210 215 220
Lys Arg Glu Ser Gly Val Leu Leu Thr Asp Lys Ser Arg Val Ser Cys
225 230 235 240
Pro Phe Pro Ala Pro Cys Leu Phe Thr Asp Ile Arg Val Leu Gln Asp
245 250 255
Ser Cys Ser His Phe Val Glu Asn Asn Ile Asn Leu Gly Thr Ser Ser
260 265 270
Lys Lys Thr Phe Ala Ser Tyr Met Pro Gln Phe Gln Thr Cys Ser Thr
275 280 285
Gln Thr His Lys Ile Met Glu Asn Lys Met Cys Asp Leu Thr Val
290 295 300
<210> 486
<211> 96
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S175
<400> 486
Ser His Gln Arg Met Lys Lys Leu Phe Trp Glu Asp Val Pro Asn Pro
1 5 10 15
Lys Asn Cys Ser Trp Ala Gln Gly Leu Asn Phe Gln Lys Met Leu Glu
20 25 30
Gly Ser Met Phe Val Lys Ser His His His Ser Leu Ile Ser Ser Thr
35 40 45
Gln Gly His Lys His Cys Gly Arg Pro Gln Gly Pro Leu His Arg Lys
50 55 60
Thr Arg Asp Leu Cys Ser Leu Val Tyr Leu Leu Thr Leu Pro Pro Leu
65 70 75 80
Leu Ser Tyr Asp Pro Ala Lys Ser Pro Ser Val Arg Asn Thr Gln Glu
85 90 95
<210> 487
<211> 34
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S176
<400> 487
Ser His Gln Arg Met Lys Lys Leu Phe Trp Glu Asp Val Pro Asn Pro
1 5 10 15
Lys Asn Cys Ser Trp Ala Gln Gly Leu Asn Phe Gln Lys Arg Thr Asp
20 25 30
Ile Leu
<210> 488
<211> 44
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S177
<400> 488
Ser His Gln Arg Met Lys Lys Leu Phe Trp Glu Asp Val Pro Asn Pro
1 5 10 15
Lys Asn Cys Ser Trp Ala Gln Gly Leu Asn Phe Gln Lys Lys Met Pro
20 25 30
Gly Thr Lys Glu Leu Leu Gly Gly Gly Trp Leu Thr
35 40
<210> 489
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S180
<400> 489
Tyr Arg Lys Arg Glu Trp Ile Lys Glu Thr Phe Tyr Pro Asp Ile Pro
1 5 10 15
Asn Pro Glu Asn Cys Lys Ala Leu Gln Phe Gln Lys Ser Val Cys Glu
20 25 30
Gly Ser Ser Ala Leu Lys Thr Leu Glu Met Asn Pro Cys Thr Pro Asn
35 40 45
Asn Val Glu Val Leu Glu Thr Arg Ser Ala Phe Pro Lys Ile Glu Asp
50 55 60
Thr Glu Ile Ile Ser Pro Val Ala Glu Arg Pro Glu Asp Arg Ser Asp
65 70 75 80
Ala Glu Pro Glu Asn His Val Val Val Ser Tyr Cys Pro Pro Ile Ile
85 90 95
Glu Glu Glu Ile Pro Asn Pro Ala Ala Asp Glu Ala Gly Gly Thr Ala
100 105 110
Gln Val Ile Tyr Ile Asp Val Gln Ser Met Tyr Gln Pro Gln Ala Lys
115 120 125
Pro Glu Glu Glu Gln Glu Asn Asp Pro Val Gly Gly Ala Gly Tyr Lys
130 135 140
Pro Gln Met His Leu Pro Ile Asn Ser Thr Val Glu Asp Ile Ala Ala
145 150 155 160
Glu Glu Asp Leu Asp Lys Thr Ala Gly Tyr Arg Pro Gln Ala Asn Val
165 170 175
Asn Thr Trp Asn Leu Val Ser Pro Asp Ser Pro Arg Ser Ile Asp Ser
180 185 190
Asn Ser Glu Ile Val Ser Phe Gly Ser Pro Cys Ser Ile Asn Ser Arg
195 200 205
Gln Phe Leu Ile Pro Pro Lys Asp Glu Asp Ser Pro Lys Ser Asn Gly
210 215 220
Gly Gly Trp Ser Phe Thr Asn Phe Phe Gln Asn Lys Pro Asn Asp
225 230 235
<210> 490
<211> 202
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S183
<400> 490
Tyr Tyr His Gly Gln Arg His Ser Asp Glu His His His Asp Asp Ser
1 5 10 15
Leu Pro His Pro Gln Gln Ala Thr Asp Asp Ser Gly His Glu Ser Asp
20 25 30
Ser Asn Ser Asn Glu Gly Arg His His Leu Leu Val Ser Gly Ala Gly
35 40 45
Asp Gly Pro Pro Leu Cys Ser Gln Asn Leu Gly Ala Pro Gly Gly Gly
50 55 60
Pro Asp Asn Gly Pro Gln Asp Pro Asp Asn Thr Asp Asp Asn Gly Pro
65 70 75 80
Gln Asp Pro Asp Asn Thr Asp Asp Asn Gly Pro His Asp Pro Leu Pro
85 90 95
Gln Asp Pro Asp Asn Thr Asp Asp Asn Gly Pro Gln Asp Pro Asp Asn
100 105 110
Thr Asp Asp Asn Gly Pro His Asp Pro Leu Pro His Ser Pro Ser Asp
115 120 125
Ser Ala Gly Asn Asp Gly Gly Pro Pro Gln Leu Thr Glu Glu Val Glu
130 135 140
Asn Lys Gly Gly Asp Gln Gly Pro Pro Leu Met Thr Asp Gly Gly Gly
145 150 155 160
Gly His Ser His Asp Ser Gly His Gly Gly Gly Asp Pro His Leu Pro
165 170 175
Thr Leu Leu Leu Gly Ser Ser Gly Ser Gly Gly Asp Asp Asp Asp Pro
180 185 190
His Gly Pro Val Gln Leu Ser Tyr Tyr Asp
195 200
<210> 491
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S186
<400> 491
Arg Trp Gln Phe Pro Ala His Tyr Arg Arg Leu Arg His Ala Leu Trp
1 5 10 15
Pro Ser Leu Pro Asp Leu His Arg Val Leu Gly Gln Tyr Leu Arg Asp
20 25 30
Thr Ala Ala Leu Ser Pro Pro Lys Ala Thr Val Ser Asp Thr Cys Glu
35 40 45
Glu Val Glu Pro Ser Leu Leu Glu Ile Leu Pro Lys Ser Ser Glu Arg
50 55 60
Thr Pro Leu Pro Leu Cys Ser Ser Gln Ala Gln Met Asp Tyr Arg Arg
65 70 75 80
Leu Gln Pro Ser Cys Leu Gly Thr Met Pro Leu Ser Val Cys Pro Pro
85 90 95
Met Ala Glu Ser Gly Ser Cys Cys Thr Thr His Ile Ala Asn His Ser
100 105 110
Tyr Leu Pro Leu Ser Tyr Trp Gln Gln Pro
115 120
<210> 492
<211> 304
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S189
<400> 492
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Glu Glu Asp
100 105 110
Cys Gln Lys Tyr Ile Leu Lys Gln Gln Gln Glu Glu Ala Glu Lys Pro
115 120 125
Leu Gln Val Ala Ala Val Asp Ser Ser Val Pro Arg Thr Ala Glu Leu
130 135 140
Ala Gly Ile Thr Thr Leu Asp Asp Pro Leu Gly His Met Pro Glu Arg
145 150 155 160
Phe Asp Ala Phe Ile Cys Tyr Cys Pro Ser Asp Ile Gln Phe Val Gln
165 170 175
Glu Met Ile Arg Gln Leu Glu Gln Thr Asn Tyr Arg Leu Lys Leu Cys
180 185 190
Val Ser Asp Arg Asp Val Leu Pro Gly Thr Cys Val Trp Ser Ile Ala
195 200 205
Ser Glu Leu Ile Glu Lys Arg Leu Ala Arg Arg Pro Arg Gly Gly Cys
210 215 220
Arg Arg Met Val Val Val Val Ser Asp Asp Tyr Leu Gln Ser Lys Glu
225 230 235 240
Cys Asp Phe Gln Thr Lys Phe Ala Leu Ser Leu Ser Pro Gly Ala His
245 250 255
Gln Lys Arg Leu Ile Pro Ile Lys Tyr Lys Ala Met Lys Lys Glu Phe
260 265 270
Pro Ser Ile Leu Arg Phe Ile Thr Val Cys Asp Tyr Thr Asn Pro Cys
275 280 285
Thr Lys Ser Trp Phe Trp Thr Arg Leu Ala Lys Ala Leu Ser Leu Pro
290 295 300
<210> 493
<211> 296
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S190
<400> 493
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Glu Glu Asp
100 105 110
Cys Gln Lys Tyr Ile Leu Lys Gln Gln Gln Glu Glu Ala Glu Lys Pro
115 120 125
Leu Gln Val Ala Ala Val Asp Ser Ser Val Pro Arg Thr Ala Glu Leu
130 135 140
Ala Gly Ile Thr Thr Leu Asp Asp Pro Leu Gly His Met Pro Glu Arg
145 150 155 160
Phe Asp Ala Phe Ile Cys Tyr Cys Pro Ser Asp Ile Gln Phe Val Gln
165 170 175
Glu Met Ile Arg Gln Leu Glu Gln Thr Asn Tyr Arg Leu Lys Leu Cys
180 185 190
Val Ser Asp Arg Asp Val Leu Pro Gly Thr Cys Val Trp Ser Ile Ala
195 200 205
Ser Glu Leu Ile Glu Lys Arg Cys Arg Arg Met Val Val Val Val Ser
210 215 220
Asp Asp Tyr Leu Gln Ser Lys Glu Cys Asp Phe Gln Thr Lys Phe Ala
225 230 235 240
Leu Ser Leu Ser Pro Gly Ala His Gln Lys Arg Leu Ile Pro Ile Lys
245 250 255
Tyr Lys Ala Met Lys Lys Glu Phe Pro Ser Ile Leu Arg Phe Ile Thr
260 265 270
Val Cys Asp Tyr Thr Asn Pro Cys Thr Lys Ser Trp Phe Trp Thr Arg
275 280 285
Leu Ala Lys Ala Leu Ser Leu Pro
290 295
<210> 494
<211> 251
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S191
<400> 494
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Gly His Met
100 105 110
Pro Glu Arg Phe Asp Ala Phe Ile Cys Tyr Cys Pro Ser Asp Ile Gln
115 120 125
Phe Val Gln Glu Met Ile Arg Gln Leu Glu Gln Thr Asn Tyr Arg Leu
130 135 140
Lys Leu Cys Val Ser Asp Arg Asp Val Leu Pro Gly Thr Cys Val Trp
145 150 155 160
Ser Ile Ala Ser Glu Leu Ile Glu Lys Arg Cys Arg Arg Met Val Val
165 170 175
Val Val Ser Asp Asp Tyr Leu Gln Ser Lys Glu Cys Asp Phe Gln Thr
180 185 190
Lys Phe Ala Leu Ser Leu Ser Pro Gly Ala His Gln Lys Arg Leu Ile
195 200 205
Pro Ile Lys Tyr Lys Ala Met Lys Lys Glu Phe Pro Ser Ile Leu Arg
210 215 220
Phe Ile Thr Val Cys Asp Tyr Thr Asn Pro Cys Thr Lys Ser Trp Phe
225 230 235 240
Trp Thr Arg Leu Ala Lys Ala Leu Ser Leu Pro
245 250
<210> 495
<211> 191
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S192
<400> 495
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Glu Glu Asp
100 105 110
Cys Gln Lys Tyr Ile Leu Lys Gln Gln Gln Glu Glu Ala Glu Lys Pro
115 120 125
Leu Gln Val Ala Ala Val Asp Ser Ser Val Pro Arg Thr Ala Glu Leu
130 135 140
Ala Gly Ile Thr Thr Leu Asp Asp Pro Leu Gly Ala Ala Gly Trp Trp
145 150 155 160
Trp Leu Ser Leu Met Ile Thr Cys Arg Ala Arg Asn Val Thr Ser Arg
165 170 175
Pro Asn Leu His Ser Ala Ser Leu Gln Val Pro Ile Arg Ser Asp
180 185 190
<210> 496
<211> 146
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S193
<400> 496
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Gly Ala Ala
100 105 110
Gly Trp Trp Trp Leu Ser Leu Met Ile Thr Cys Arg Ala Arg Asn Val
115 120 125
Thr Ser Arg Pro Asn Leu His Ser Ala Ser Leu Gln Val Pro Ile Arg
130 135 140
Ser Asp
145
<210> 497
<211> 172
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S194
<400> 497
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Glu Glu Asp
100 105 110
Cys Gln Lys Tyr Ile Leu Lys Gln Gln Gln Glu Glu Ala Glu Lys Pro
115 120 125
Leu Gln Val Ala Ala Val Asp Ser Ser Val Pro Arg Thr Ala Glu Leu
130 135 140
Ala Gly Ile Thr Thr Leu Asp Asp Pro Leu Gly His Met Pro Glu Arg
145 150 155 160
Phe Asp Ala Phe Ile Cys Tyr Cys Pro Ser Asp Ile
165 170
<210> 498
<211> 127
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S195
<400> 498
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Gly His Met
100 105 110
Pro Glu Arg Phe Asp Ala Phe Ile Cys Tyr Cys Pro Ser Asp Ile
115 120 125
<210> 499
<211> 304
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S196
<400> 499
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Glu Glu Asp
100 105 110
Cys Gln Lys Tyr Ile Leu Lys Gln Gln Gln Glu Glu Ala Glu Lys Pro
115 120 125
Leu Gln Val Ala Ala Val Asp Ser Ser Val Pro Arg Thr Ala Glu Leu
130 135 140
Ala Gly Ile Thr Thr Leu Asp Asp Pro Leu Gly His Met Pro Glu Arg
145 150 155 160
Phe Asp Ala Phe Ile Cys Tyr Cys Pro Ser Asp Ile Gln Phe Val Gln
165 170 175
Glu Met Ile Arg Gln Leu Glu Gln Thr Asn Tyr Arg Leu Lys Leu Cys
180 185 190
Val Ser Asp Arg Asp Val Leu Pro Gly Thr Cys Val Trp Ser Ile Ala
195 200 205
Ser Glu Leu Ile Glu Lys Arg Leu Ala Arg Arg Pro Arg Gly Gly Cys
210 215 220
Arg Arg Met Val Val Val Val Ser Asp Asp Tyr Leu Gln Ser Lys Glu
225 230 235 240
Cys Asp Phe Gln Thr Lys Phe Ala Leu Ser Leu Ser Pro Gly Ala His
245 250 255
Gln Lys Arg Pro Ile Pro Ile Lys Tyr Lys Ala Met Lys Lys Glu Phe
260 265 270
Pro Ser Ile Leu Arg Phe Ile Thr Val Cys Asp Tyr Thr Asn Pro Cys
275 280 285
Thr Lys Ser Trp Phe Trp Thr Arg Leu Ala Lys Ala Leu Ser Leu Pro
290 295 300
<210> 500
<211> 296
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S197
<400> 500
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Glu Glu Asp
100 105 110
Cys Gln Lys Tyr Ile Leu Lys Gln Gln Gln Glu Glu Ala Glu Lys Pro
115 120 125
Leu Gln Val Ala Ala Val Asp Ser Ser Val Pro Arg Thr Ala Glu Leu
130 135 140
Ala Gly Ile Thr Thr Leu Asp Asp Pro Leu Gly His Met Pro Glu Arg
145 150 155 160
Phe Asp Ala Phe Ile Cys Tyr Cys Pro Ser Asp Ile Gln Phe Val Gln
165 170 175
Glu Met Ile Arg Gln Leu Glu Gln Thr Asn Tyr Arg Leu Lys Leu Cys
180 185 190
Val Ser Asp Arg Asp Val Leu Pro Gly Thr Cys Val Trp Ser Ile Ala
195 200 205
Ser Glu Leu Ile Glu Lys Arg Cys Arg Arg Met Val Val Val Val Ser
210 215 220
Asp Asp Tyr Leu Gln Ser Lys Glu Cys Asp Phe Gln Thr Lys Phe Ala
225 230 235 240
Leu Ser Leu Ser Pro Gly Ala His Gln Lys Arg Pro Ile Pro Ile Lys
245 250 255
Tyr Lys Ala Met Lys Lys Glu Phe Pro Ser Ile Leu Arg Phe Ile Thr
260 265 270
Val Cys Asp Tyr Thr Asn Pro Cys Thr Lys Ser Trp Phe Trp Thr Arg
275 280 285
Leu Ala Lys Ala Leu Ser Leu Pro
290 295
<210> 501
<211> 251
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S198
<400> 501
Met Ala Ala Gly Gly Pro Gly Ala Gly Ser Ala Ala Pro Val Ser Ser
1 5 10 15
Thr Ser Ser Leu Pro Leu Ala Ala Leu Asn Met Arg Val Arg Arg Arg
20 25 30
Leu Ser Leu Phe Leu Asn Val Arg Thr Gln Val Ala Ala Asp Trp Thr
35 40 45
Ala Leu Ala Glu Glu Met Asp Phe Glu Tyr Leu Glu Ile Arg Gln Leu
50 55 60
Glu Thr Gln Ala Asp Pro Thr Gly Arg Leu Leu Asp Ala Trp Gln Gly
65 70 75 80
Arg Pro Gly Ala Ser Val Gly Arg Leu Leu Glu Leu Leu Thr Lys Leu
85 90 95
Gly Arg Asp Asp Val Leu Leu Glu Leu Gly Pro Ser Ile Gly His Met
100 105 110
Pro Glu Arg Phe Asp Ala Phe Ile Cys Tyr Cys Pro Ser Asp Ile Gln
115 120 125
Phe Val Gln Glu Met Ile Arg Gln Leu Glu Gln Thr Asn Tyr Arg Leu
130 135 140
Lys Leu Cys Val Ser Asp Arg Asp Val Leu Pro Gly Thr Cys Val Trp
145 150 155 160
Ser Ile Ala Ser Glu Leu Ile Glu Lys Arg Cys Arg Arg Met Val Val
165 170 175
Val Val Ser Asp Asp Tyr Leu Gln Ser Lys Glu Cys Asp Phe Gln Thr
180 185 190
Lys Phe Ala Leu Ser Leu Ser Pro Gly Ala His Gln Lys Arg Pro Ile
195 200 205
Pro Ile Lys Tyr Lys Ala Met Lys Lys Glu Phe Pro Ser Ile Leu Arg
210 215 220
Phe Ile Thr Val Cys Asp Tyr Thr Asn Pro Cys Thr Lys Ser Trp Phe
225 230 235 240
Trp Thr Arg Leu Ala Lys Ala Leu Ser Leu Pro
245 250
<210> 502
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S199
<400> 502
Lys Ser Gln Trp Ile Lys Glu Thr Cys Tyr Pro Asp Ile Pro Asp Pro
1 5 10 15
Tyr Lys Ser Ser Ile Leu Ser Leu Ile Lys Phe Lys Glu Asn Pro His
20 25 30
Leu Ile Ile Met Asn Val Ser Asp Cys Ile Pro Asp Ala Ile Glu Val
35 40 45
Val Ser Lys Pro Glu Gly Thr Lys Ile Gln Phe Leu Gly Thr Arg Lys
50 55 60
Ser Leu Thr Glu Thr Glu Leu Thr Lys Pro Asn Tyr Leu Tyr Leu Leu
65 70 75 80
Pro Thr Glu Lys Asn His Ser Gly Pro Gly Pro Cys Ile Cys Phe Glu
85 90 95
Asn Leu Thr Tyr Asn Gln Ala Ala Ser Asp Ser Gly Ser Cys Gly His
100 105 110
Val Pro Val Ser Pro Lys Ala Pro Ser Met Leu Gly Leu Met Thr Ser
115 120 125
Pro Glu Asn Val Leu Lys Ala Leu Glu Lys Asn Tyr Met Asn Ser Leu
130 135 140
Gly Glu Ile Pro Ala Gly Glu Thr Ser Leu Asn Tyr Val Ser Gln Leu
145 150 155 160
Ala Ser Pro Met Phe Gly Asp Lys Asp Ser Leu Pro Thr Asn Pro Val
165 170 175
Glu Ala Pro His Cys Ser Glu Tyr Lys Met Gln Met Ala Val Ser Leu
180 185 190
Arg Leu Ala Leu Pro Pro Pro Thr Glu Asn Ser Ser Leu Ser Ser Ile
195 200 205
Thr Leu Leu Asp Pro Gly Glu His Tyr Cys
210 215
<210> 503
<211> 364
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S202
<400> 503
Lys Gly Tyr Ser Met Val Thr Cys Ile Phe Pro Pro Val Pro Gly Pro
1 5 10 15
Lys Ile Lys Gly Phe Asp Ala His Leu Leu Glu Lys Gly Lys Ser Glu
20 25 30
Glu Leu Leu Ser Ala Leu Gly Cys Gln Asp Phe Pro Pro Thr Ser Asp
35 40 45
Tyr Glu Asp Leu Leu Val Glu Tyr Leu Glu Val Asp Asp Ser Glu Asp
50 55 60
Gln His Leu Met Ser Val His Ser Lys Glu His Pro Ser Gln Gly Met
65 70 75 80
Lys Pro Thr Tyr Leu Asp Pro Asp Thr Asp Ser Gly Arg Gly Ser Cys
85 90 95
Asp Ser Pro Ser Leu Leu Ser Glu Lys Cys Glu Glu Pro Gln Ala Asn
100 105 110
Pro Ser Thr Phe Tyr Asp Pro Glu Val Ile Glu Lys Pro Glu Asn Pro
115 120 125
Glu Thr Thr His Thr Trp Asp Pro Gln Cys Ile Ser Met Glu Gly Lys
130 135 140
Ile Pro Tyr Phe His Ala Gly Gly Ser Lys Cys Ser Thr Trp Pro Leu
145 150 155 160
Pro Gln Pro Ser Gln His Asn Pro Arg Ser Ser Tyr His Asn Ile Thr
165 170 175
Asp Val Cys Glu Leu Ala Val Gly Pro Ala Gly Ala Pro Ala Thr Leu
180 185 190
Leu Asn Glu Ala Gly Lys Asp Ala Leu Lys Ser Ser Gln Thr Ile Lys
195 200 205
Ser Arg Glu Glu Gly Lys Ala Thr Gln Gln Arg Glu Val Glu Ser Phe
210 215 220
His Ser Glu Thr Asp Gln Asp Thr Pro Trp Leu Leu Pro Gln Glu Lys
225 230 235 240
Thr Pro Phe Gly Ser Ala Lys Pro Leu Asp Tyr Val Glu Ile His Lys
245 250 255
Val Asn Lys Asp Gly Ala Leu Ser Leu Leu Pro Lys Gln Arg Glu Asn
260 265 270
Ser Gly Lys Pro Lys Lys Pro Gly Thr Pro Glu Asn Asn Lys Glu Tyr
275 280 285
Ala Lys Val Ser Gly Val Met Asp Asn Asn Ile Leu Val Leu Val Pro
290 295 300
Asp Pro His Ala Lys Asn Val Ala Cys Phe Glu Glu Ser Ala Lys Glu
305 310 315 320
Ala Pro Pro Ser Leu Glu Gln Asn Gln Ala Glu Lys Ala Leu Ala Asn
325 330 335
Phe Thr Ala Thr Ser Ser Lys Cys Arg Leu Gln Leu Gly Gly Leu Asp
340 345 350
Tyr Leu Asp Pro Ala Cys Phe Thr His Ser Phe His
355 360
<210> 504
<211> 42
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S211
<400> 504
Ala Leu Tyr Leu Leu Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His
1 5 10 15
Lys Pro Pro Gly Gly Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln
20 25 30
Ala Asp Ala His Ser Thr Leu Ala Lys Ile
35 40
<210> 505
<211> 188
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S212
<400> 505
His Arg Arg Ala Cys Arg Lys Arg Ile Arg Gln Lys Leu His Leu Cys
1 5 10 15
Tyr Pro Val Gln Thr Ser Gln Pro Lys Leu Glu Leu Val Asp Ser Arg
20 25 30
Pro Arg Arg Ser Ser Thr Gln Leu Arg Ser Gly Ala Ser Val Thr Glu
35 40 45
Pro Val Ala Glu Glu Arg Gly Leu Met Ser Gln Pro Leu Met Glu Thr
50 55 60
Cys His Ser Val Gly Ala Ala Tyr Leu Glu Ser Leu Pro Leu Gln Asp
65 70 75 80
Ala Ser Pro Ala Gly Gly Pro Ser Ser Pro Arg Asp Leu Pro Glu Pro
85 90 95
Arg Val Ser Thr Glu His Thr Asn Asn Lys Ile Glu Lys Ile Tyr Ile
100 105 110
Met Lys Ala Asp Thr Val Ile Val Gly Thr Val Lys Ala Glu Leu Pro
115 120 125
Glu Gly Arg Gly Leu Ala Gly Pro Ala Glu Pro Glu Leu Glu Glu Glu
130 135 140
Leu Glu Ala Asp His Thr Pro His Tyr Pro Glu Gln Glu Thr Glu Pro
145 150 155 160
Pro Leu Gly Ser Cys Ser Asp Val Met Leu Ser Val Glu Glu Glu Gly
165 170 175
Lys Glu Asp Pro Leu Pro Thr Ala Ala Ser Gly Lys
180 185
<210> 506
<211> 42
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S213
<400> 506
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 507
<211> 60
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S214
<400> 507
Cys Val Lys Arg Arg Lys Pro Arg Gly Asp Val Val Lys Val Ile Val
1 5 10 15
Ser Val Gln Arg Lys Arg Gln Glu Ala Glu Gly Glu Ala Thr Val Ile
20 25 30
Glu Ala Leu Gln Ala Pro Pro Asp Val Thr Thr Val Ala Val Glu Glu
35 40 45
Thr Ile Pro Ser Phe Thr Gly Arg Ser Pro Asn His
50 55 60
<210> 508
<211> 58
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S215
<400> 508
Gln Leu Gly Leu His Ile Trp Gln Leu Arg Ser Gln Cys Met Trp Pro
1 5 10 15
Arg Glu Thr Gln Leu Leu Leu Glu Val Pro Pro Ser Thr Glu Asp Ala
20 25 30
Arg Ser Cys Gln Phe Pro Glu Glu Glu Arg Gly Glu Arg Ser Ala Glu
35 40 45
Glu Lys Gly Arg Leu Gly Asp Leu Trp Val
50 55
<210> 509
<211> 51
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид S216
<400> 509
Gln Leu Gly Leu His Ile Trp Gln Leu Arg Lys Thr Gln Leu Leu Leu
1 5 10 15
Glu Val Pro Pro Ser Thr Glu Asp Ala Arg Ser Cys Gln Phe Pro Glu
20 25 30
Glu Glu Arg Gly Glu Arg Ser Ala Glu Glu Lys Gly Arg Leu Gly Asp
35 40 45
Leu Trp Val
50
<210> 510
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид X001
<400> 510
Gly Ser Gly Gly Ser Glu Gly Gly Gly Ser Glu Gly Gly Ala Ala Thr
1 5 10 15
Ala Gly Ser Gly Ser Gly Ser
20
<210> 511
<211> 152
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид IL7
<400> 511
Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser Val Leu
1 5 10 15
Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile Gly Ser
20 25 30
Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile Cys Asp
35 40 45
Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys Leu Arg
50 55 60
Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His Leu Leu
65 70 75 80
Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly Gln Val
85 90 95
Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr Lys Ser
100 105 110
Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn Asp Leu
115 120 125
Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp Asn Lys
130 135 140
Ile Leu Met Gly Thr Lys Glu His
145 150
<210> 512
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий линкер синтетического полипептида
<400> 512
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 513
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид IL7RA ECD и TM
<400> 513
Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp Ala Glu Leu Asp
1 5 10 15
Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val Asn Gly Ser Gln
20 25 30
His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val Asn Ile Thr Asn
35 40 45
Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val Lys Cys Leu Asn
50 55 60
Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys Phe Leu
65 70 75 80
Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly Glu Lys Ser Leu
85 90 95
Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys Pro Glu Ala Pro
100 105 110
Phe Asp Leu Ser Val Val Tyr Arg Glu Gly Ala Asn Asp Phe Val Val
115 120 125
Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val Lys Val Leu Met
130 135 140
His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn Lys Trp Thr His
145 150 155 160
Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln Arg Lys Leu Gln
165 170 175
Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr
180 185 190
Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe Arg Thr
195 200 205
Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro Ile Leu Leu Thr
210 215 220
Ile Ser Ile Leu Ser Phe Phe Ser Val Ala Leu Leu Val Ile Leu Ala
225 230 235 240
Cys Val Leu Trp
<210> 514
<211> 286
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид IL2RB ICD
<400> 514
Asn Cys Arg Asn Thr Gly Pro Trp Leu Lys Lys Val Leu Lys Cys Asn
1 5 10 15
Thr Pro Asp Pro Ser Lys Phe Phe Ser Gln Leu Ser Ser Glu His Gly
20 25 30
Gly Asp Val Gln Lys Trp Leu Ser Ser Pro Phe Pro Ser Ser Ser Phe
35 40 45
Ser Pro Gly Gly Leu Ala Pro Glu Ile Ser Pro Leu Glu Val Leu Glu
50 55 60
Arg Asp Lys Val Thr Gln Leu Leu Leu Gln Gln Asp Lys Val Pro Glu
65 70 75 80
Pro Ala Ser Leu Ser Ser Asn His Ser Leu Thr Ser Cys Phe Thr Asn
85 90 95
Gln Gly Tyr Phe Phe Phe His Leu Pro Asp Ala Leu Glu Ile Glu Ala
100 105 110
Cys Gln Val Tyr Phe Thr Tyr Asp Pro Tyr Ser Glu Glu Asp Pro Asp
115 120 125
Glu Gly Val Ala Gly Ala Pro Thr Gly Ser Ser Pro Gln Pro Leu Gln
130 135 140
Pro Leu Ser Gly Glu Asp Asp Ala Tyr Cys Thr Phe Pro Ser Arg Asp
145 150 155 160
Asp Leu Leu Leu Phe Ser Pro Ser Leu Leu Gly Gly Pro Ser Pro Pro
165 170 175
Ser Thr Ala Pro Gly Gly Ser Gly Ala Gly Glu Glu Arg Met Pro Pro
180 185 190
Ser Leu Gln Glu Arg Val Pro Arg Asp Trp Asp Pro Gln Pro Leu Gly
195 200 205
Pro Pro Thr Pro Gly Val Pro Asp Leu Val Asp Phe Gln Pro Pro Pro
210 215 220
Glu Leu Val Leu Arg Glu Ala Gly Glu Glu Val Pro Asp Ala Gly Pro
225 230 235 240
Arg Glu Gly Val Ser Phe Pro Trp Ser Arg Pro Pro Gly Gln Gly Glu
245 250 255
Phe Arg Ala Leu Asn Ala Arg Leu Pro Leu Asn Thr Asp Ala Tyr Leu
260 265 270
Ser Leu Gln Glu Leu Gln Gly Gln Asp Pro Thr His Leu Val
275 280 285
<210> 515
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность типа Козак
<220>
<221> misc_feature
<222> (7)..(7)
<223> n = T или U
<220>
<221> misc_feature
<222> (9)..(9)
<223> n = G может присутствовать или может не присутствовать
<400> 515
ccaccangn 9
<210> 516
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность типа Козак 2
<220>
<221> misc_feature
<222> (7)..(7)
<223> n = T или U
<220>
<221> misc_feature
<222> (9)..(9)
<223> n = G может присутствовать или может не присутствовать
<400> 516
ccgccangn 9
<210> 517
<211> 13
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность типа Козак 3
<220>
<221> misc_feature
<222> (11)..(11)
<223> n = T или U
<220>
<221> misc_feature
<222> (13)..(13)
<223> n = G может присутствовать или может не присутствовать
<400> 517
gccgccgcca ngn 13
<210> 518
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность типа Козак 4
<220>
<221> misc_feature
<222> (11)..(11)
<223> n = T или U
<220>
<221> misc_feature
<222> (12)..(12)
<223> n = G может присутствовать или может не присутствовать
<400> 518
gccgccacca nn 12
<210> 519
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность Козак
<400> 519
gccgccacc 9
<210> 520
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная тройная стоп-последовательность
<400> 520
taatagtga 9
<210> 521
<211> 191
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический нуклеотид WPRE
<400> 521
gtcctttcca tggctgctcg cctgtgttgc cacctggatt ctgcgcggga cgtccttctg 60
ctacgtccct tcggccctca atccagcgga ccttccttcc cgcggcctgc tgccggctct 120
gcggcctctt ccgcgtcttc gccttcgccc tcagacgagt cggatctccc tttgggccgc 180
ctccccgcct g 191
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕ ВСТРЕЧАЮЩИЙСЯ В ПРИРОДЕ ВИРУС РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ (BPPCC) И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2687150C2 |
| МУЛЬТИВАЛЕНТНЫЕ FV-АНТИТЕЛА | 2016 |
|
RU2785766C2 |
| МОЛЕКУЛА РЕЦЕПТОРА IL4/IL13 ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2795591C2 |
| ГЛЮКОАМИЛАЗА TRICHODERMA REESEI И ЕЕ ГОМОЛОГИ | 2005 |
|
RU2394101C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОБИОТИКИ И ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ АФФИННОСТЬЮ СВЯЗЫВАНИЯ В ОТНОШЕНИИ IGE, И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2786578C2 |
| АКТИВИРУЕМЫЕ ПОЛИПЕПТИДЫ ИНТЕРЛЕЙКИНА-2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2826454C2 |
| АКТИВИРУЕМЫЕ ПОЛИПЕПТИДЫ ИНТЕРЛЕЙКИНА 12 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2826183C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С FCRN И С СОХРАНЕННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С БЕЛКОМ А | 2015 |
|
RU2727639C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
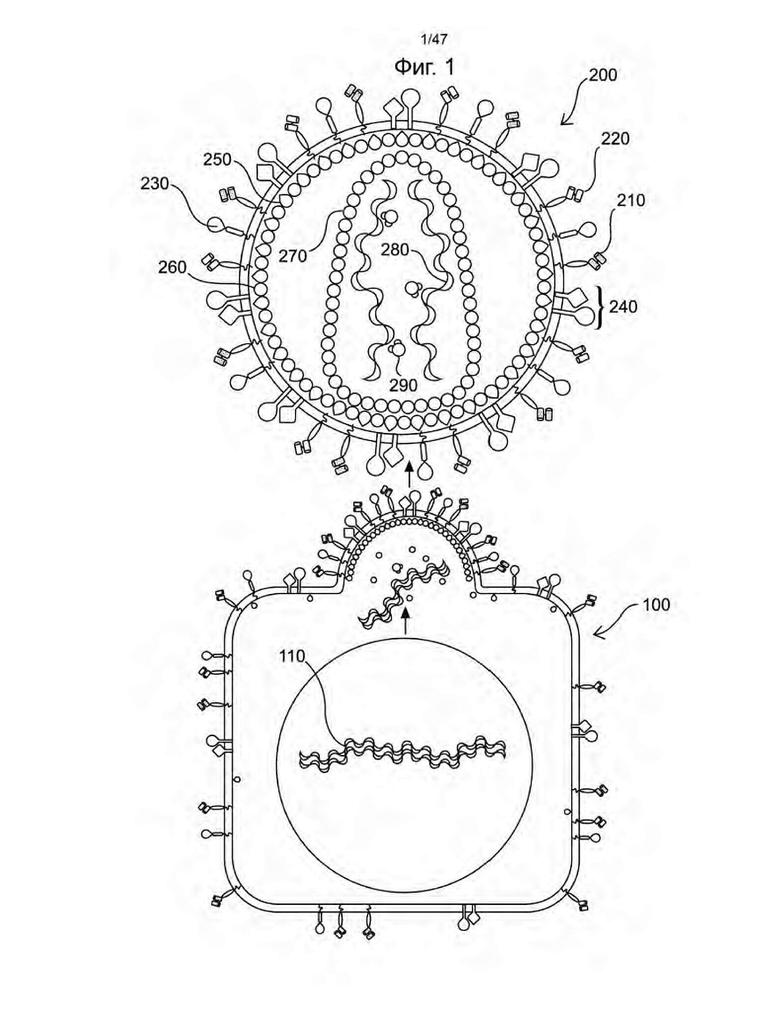
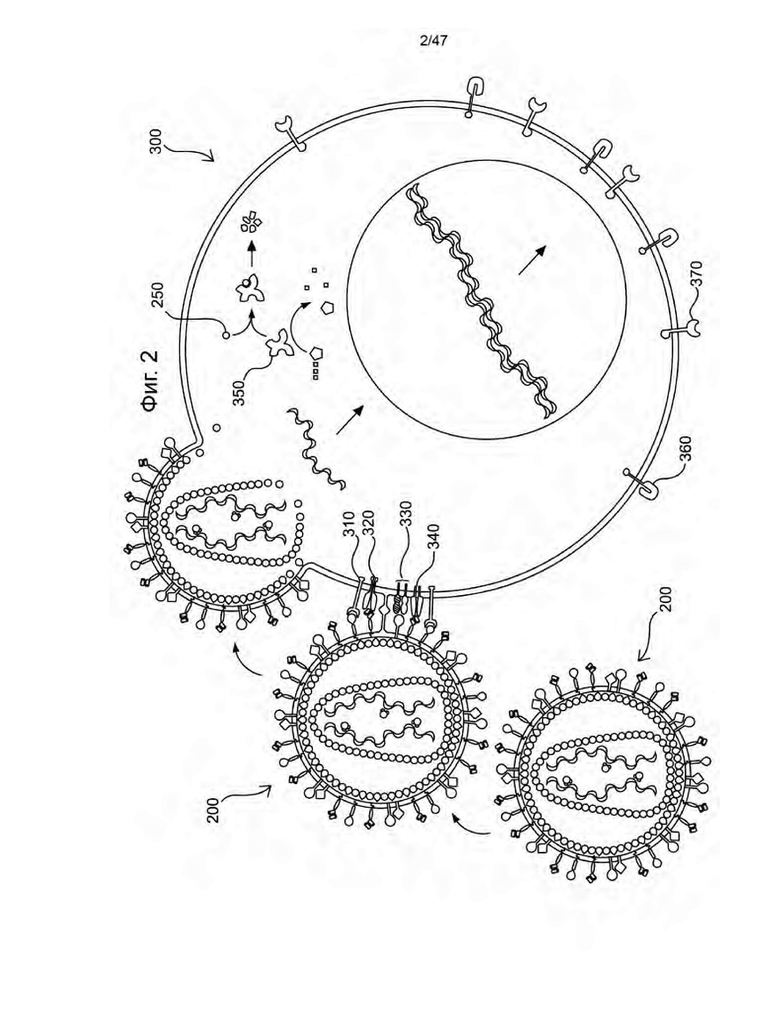
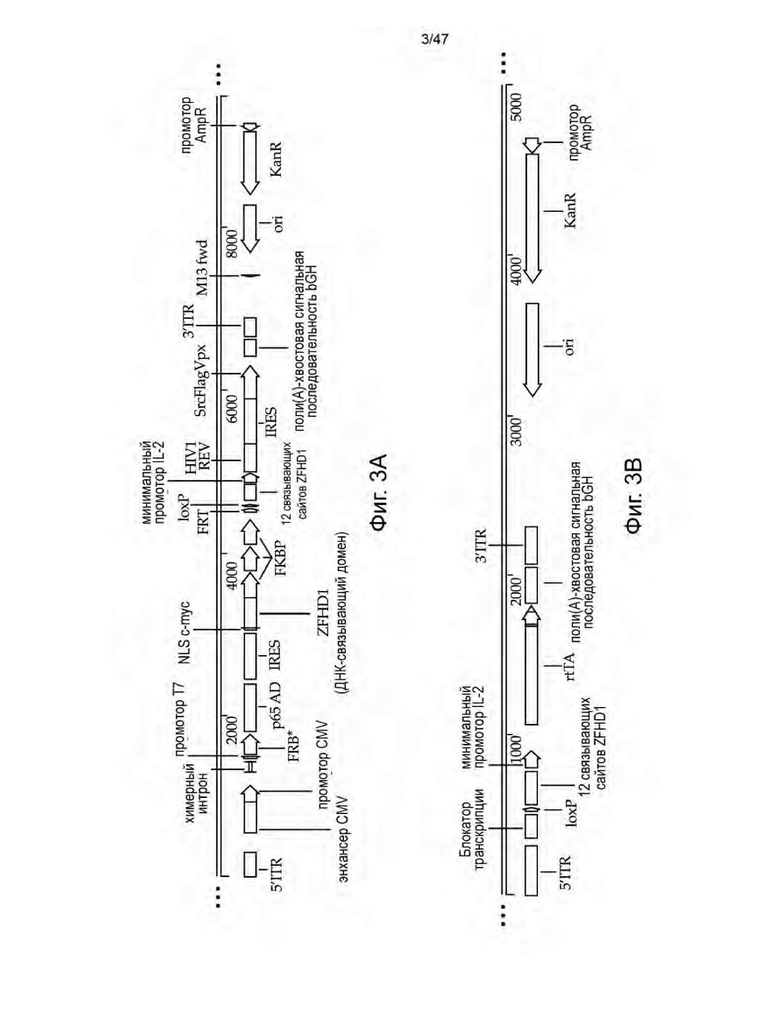
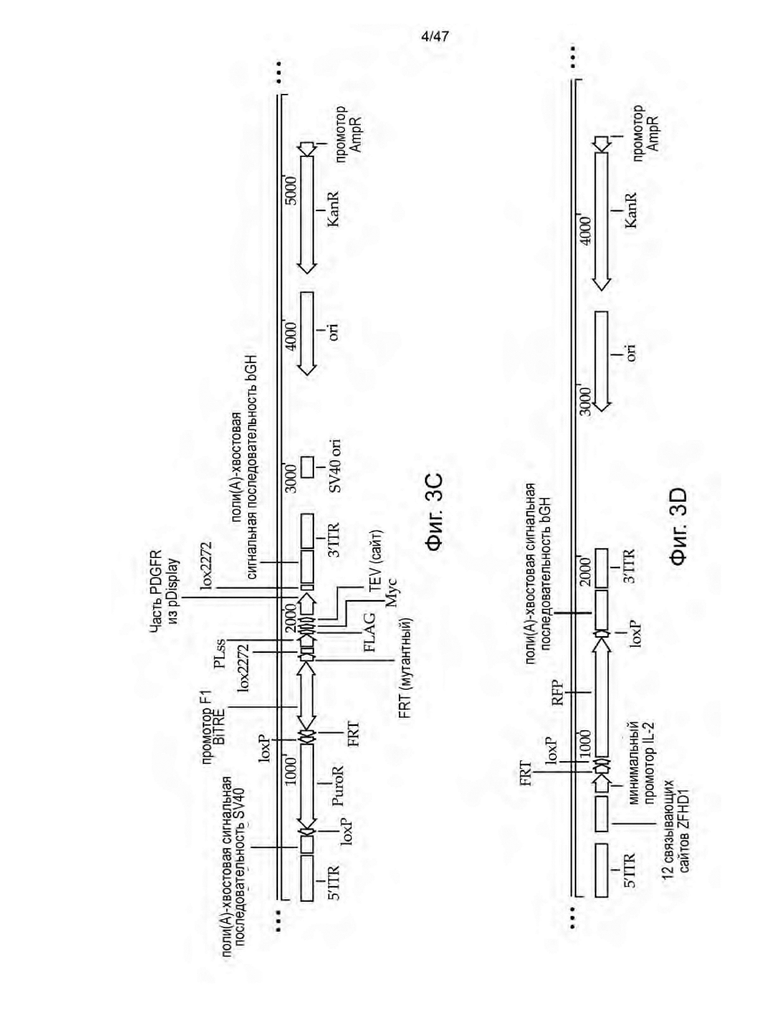
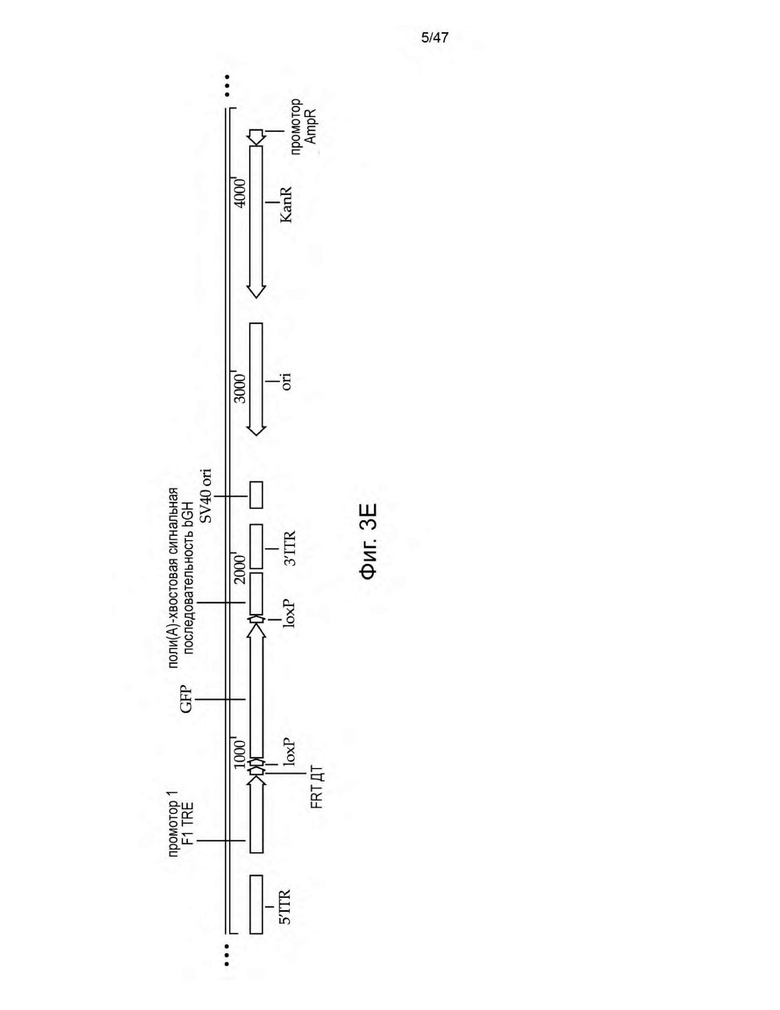
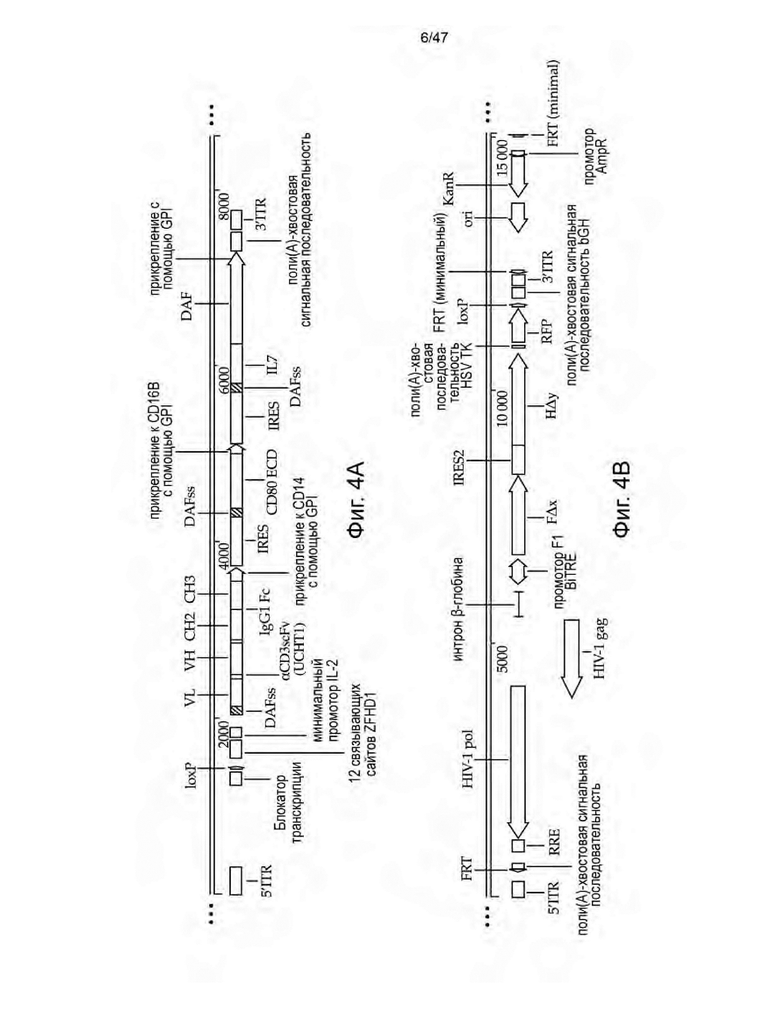
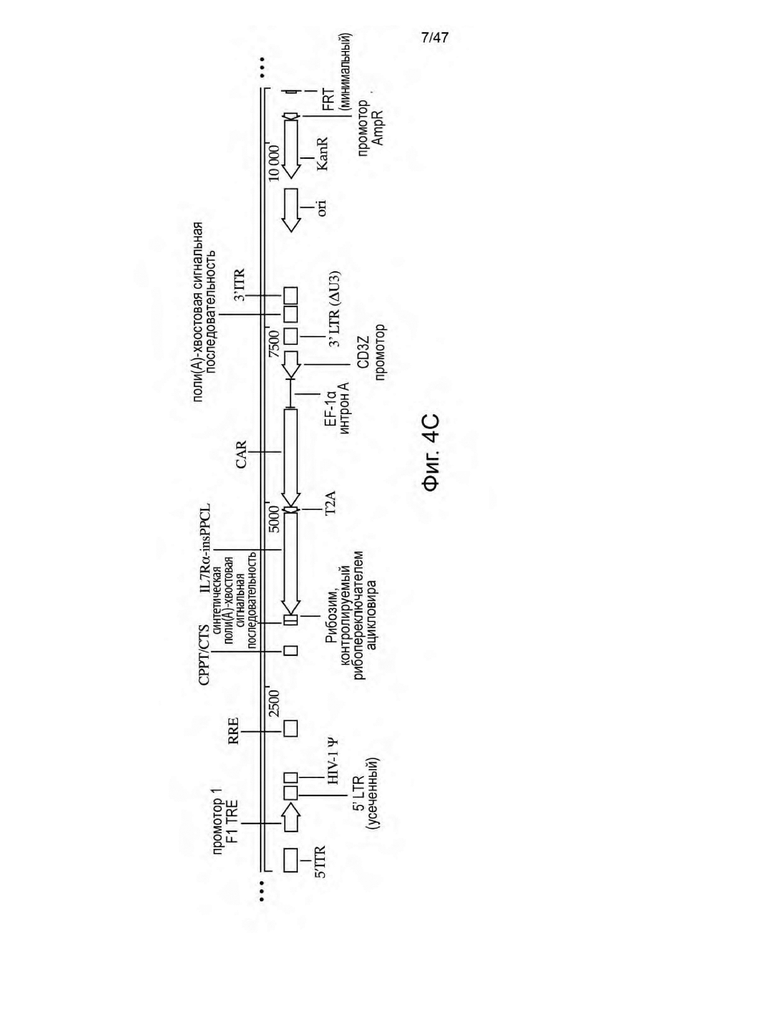
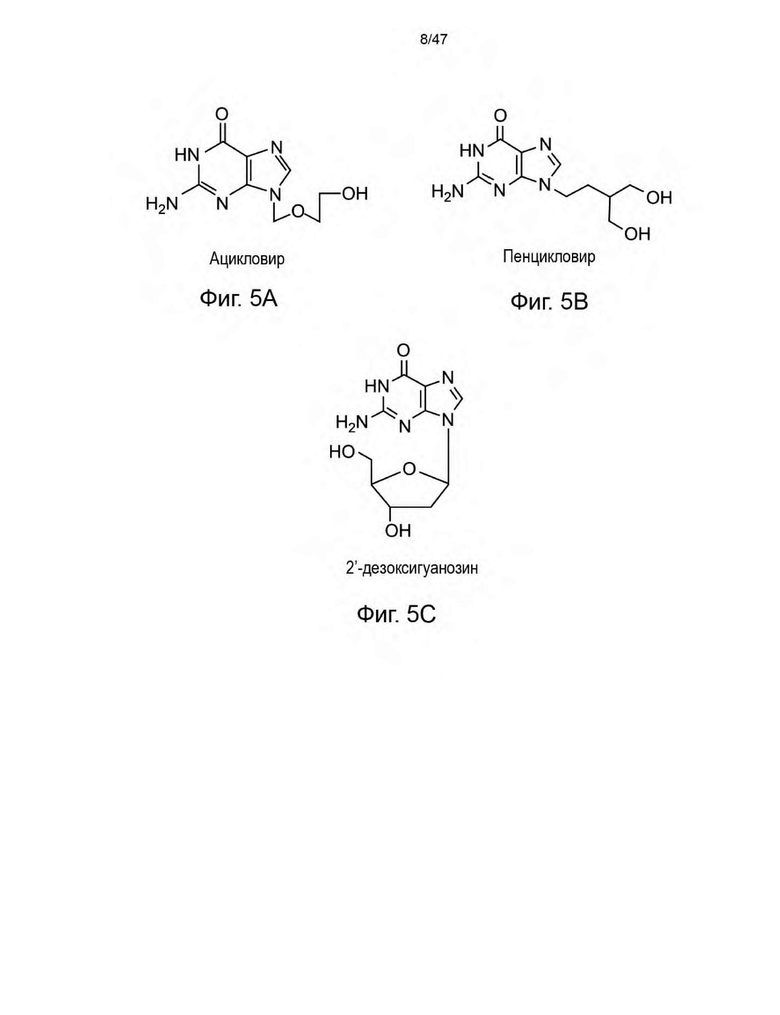

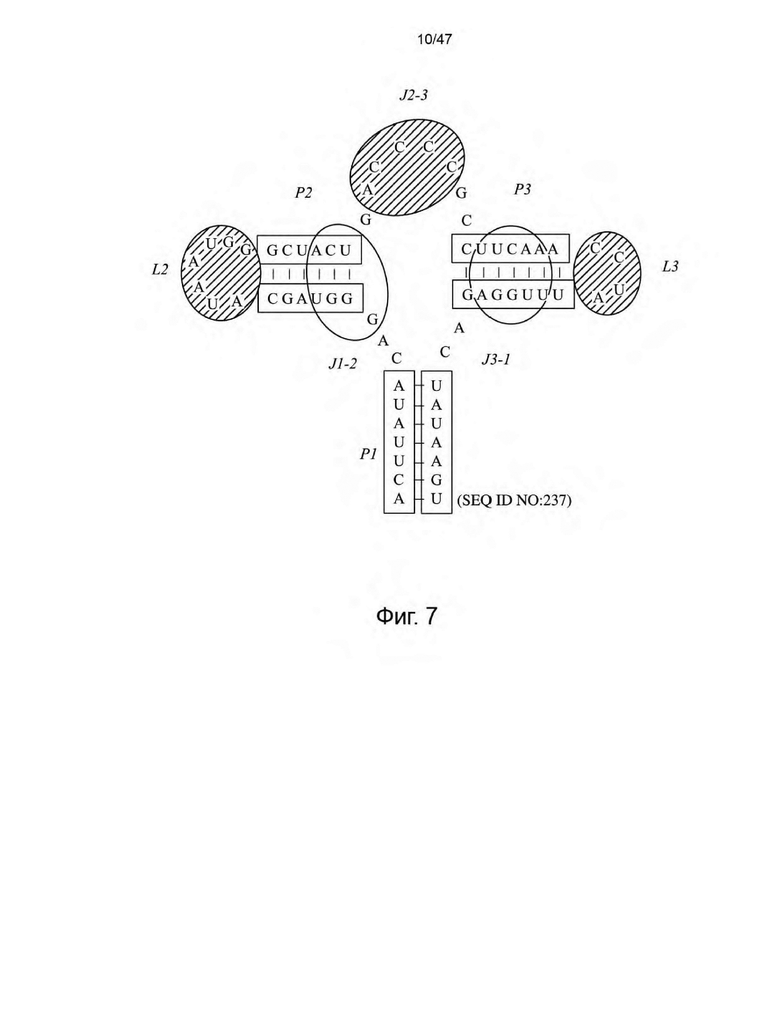
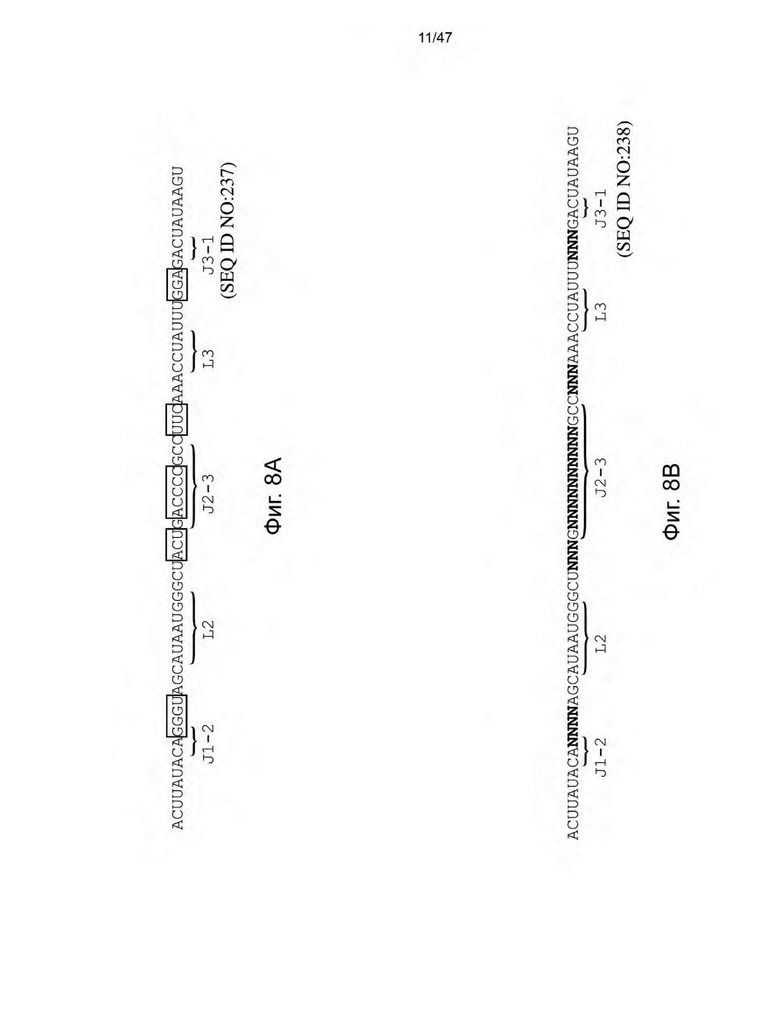


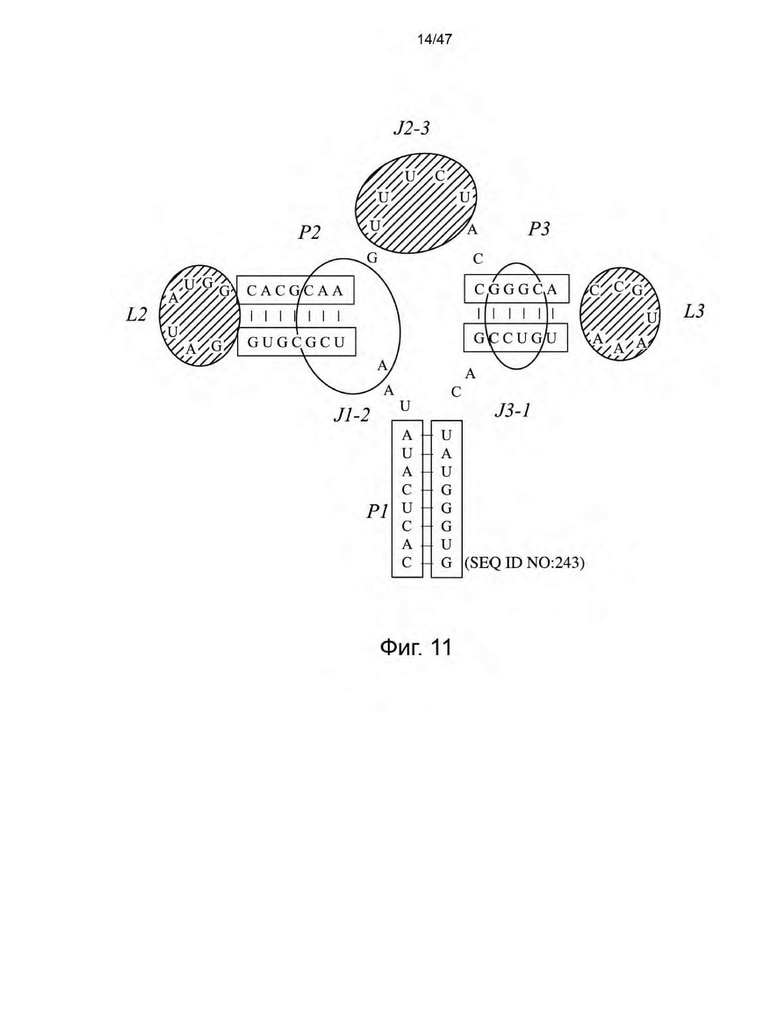
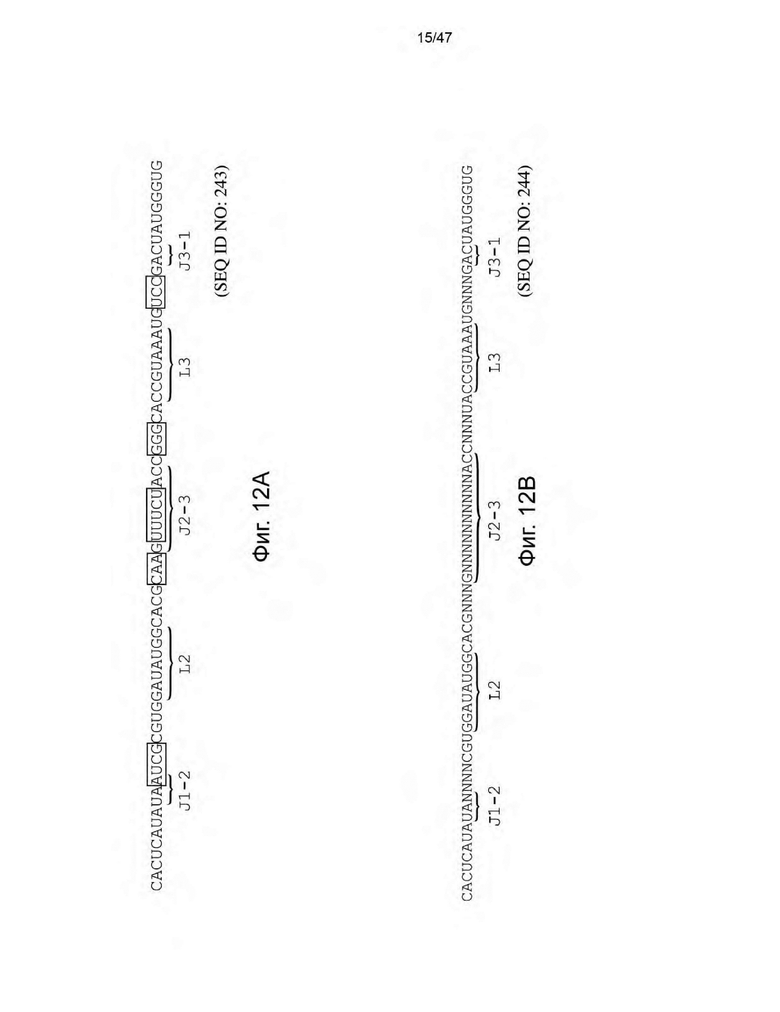

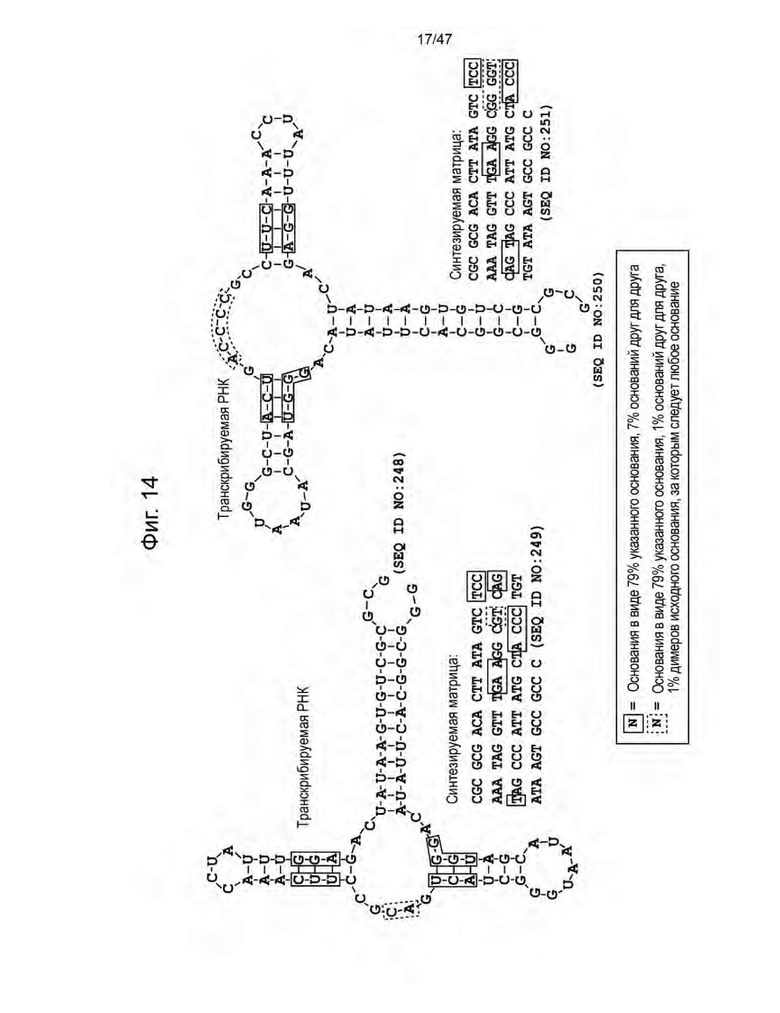
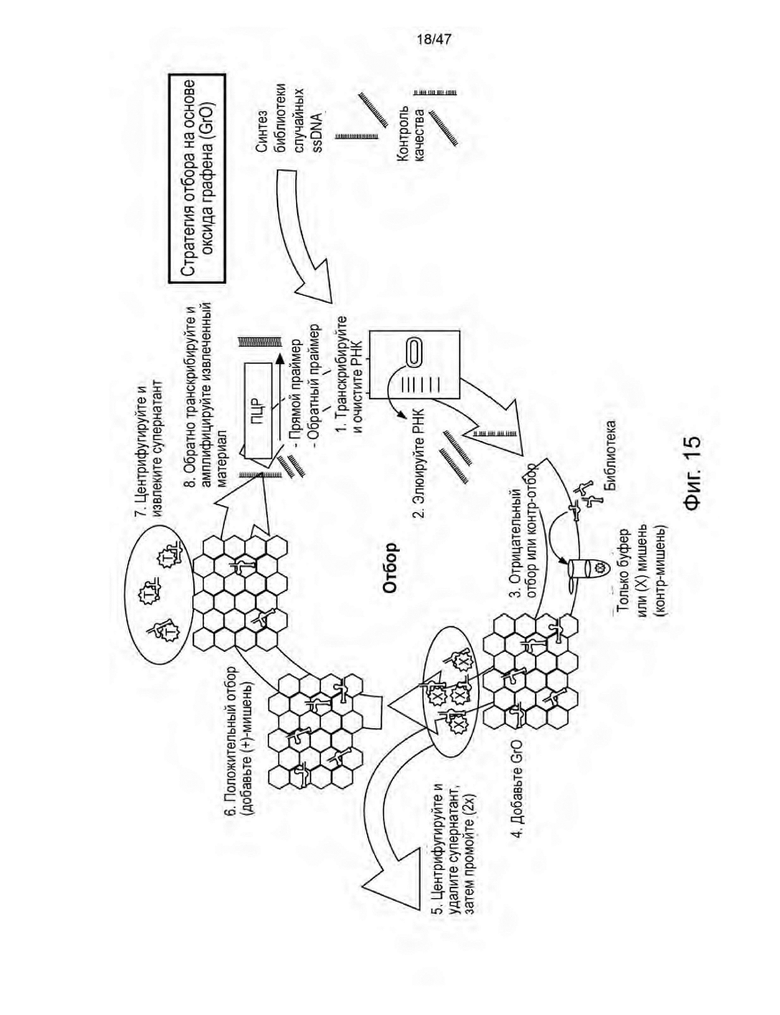
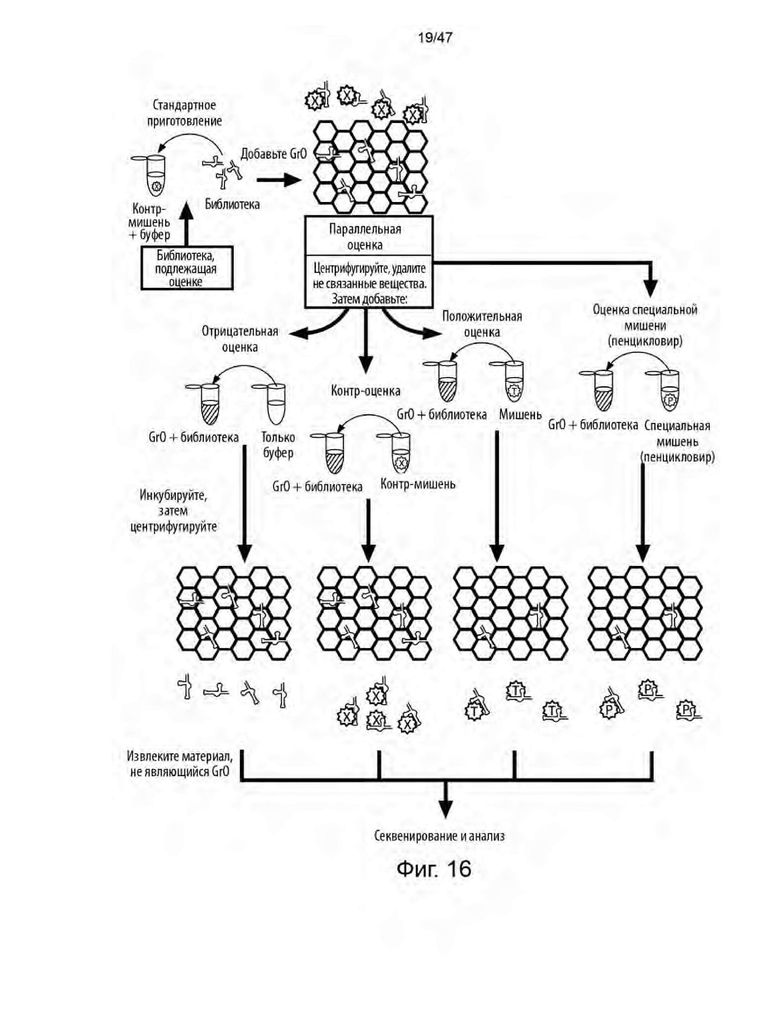

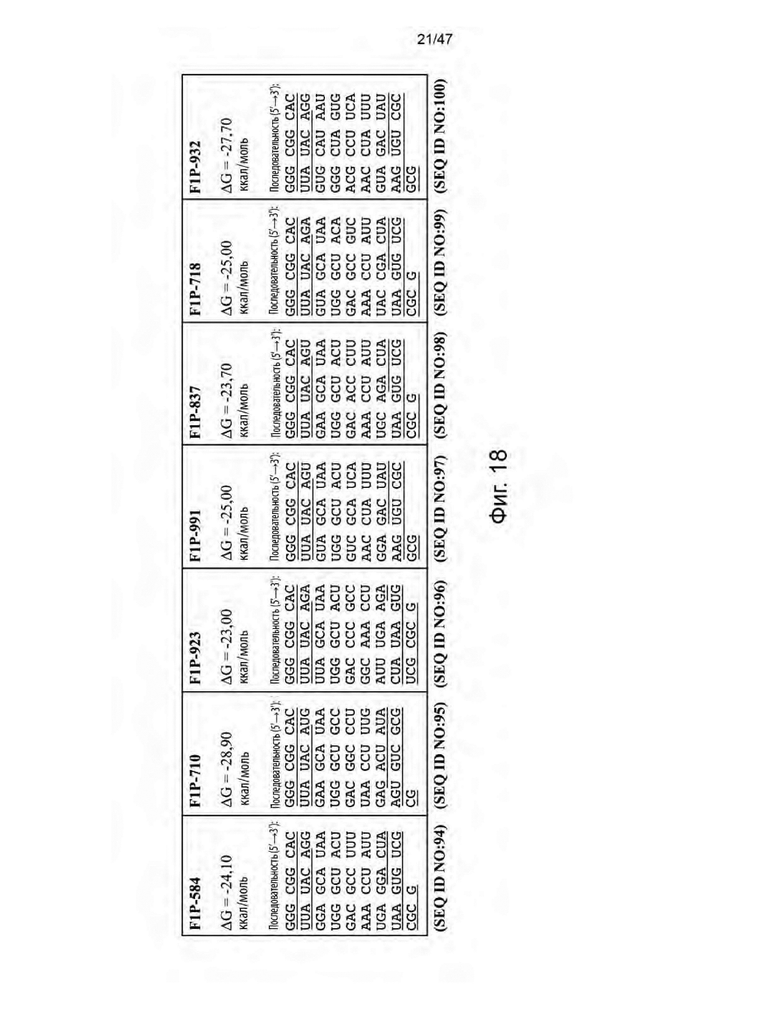
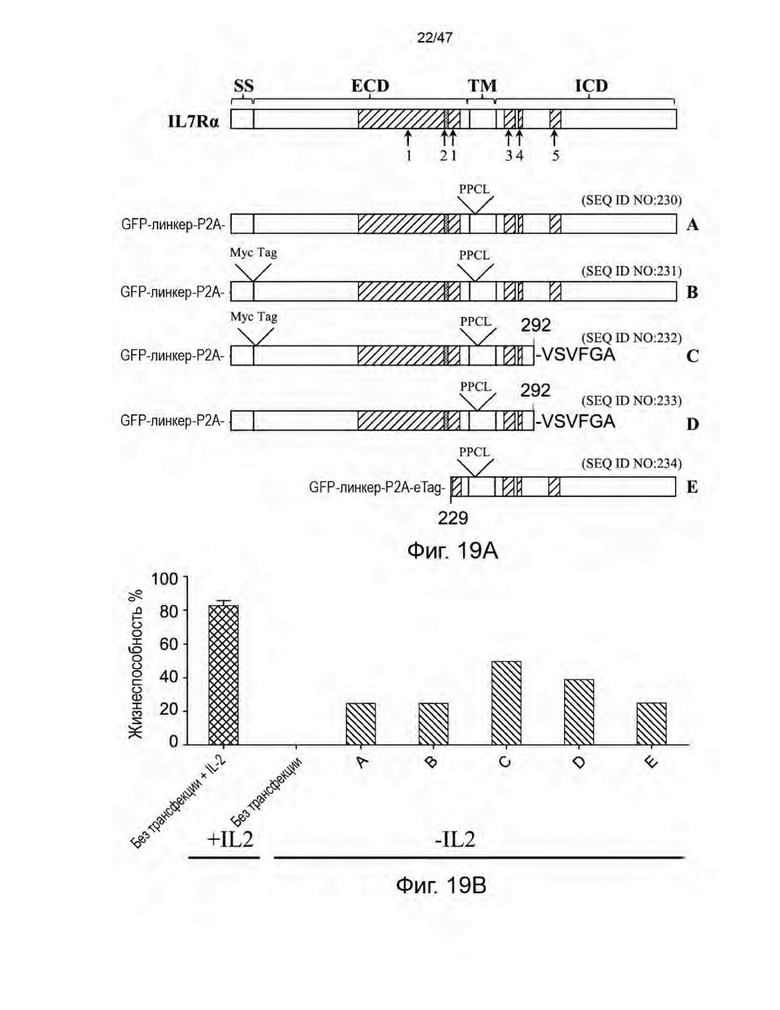
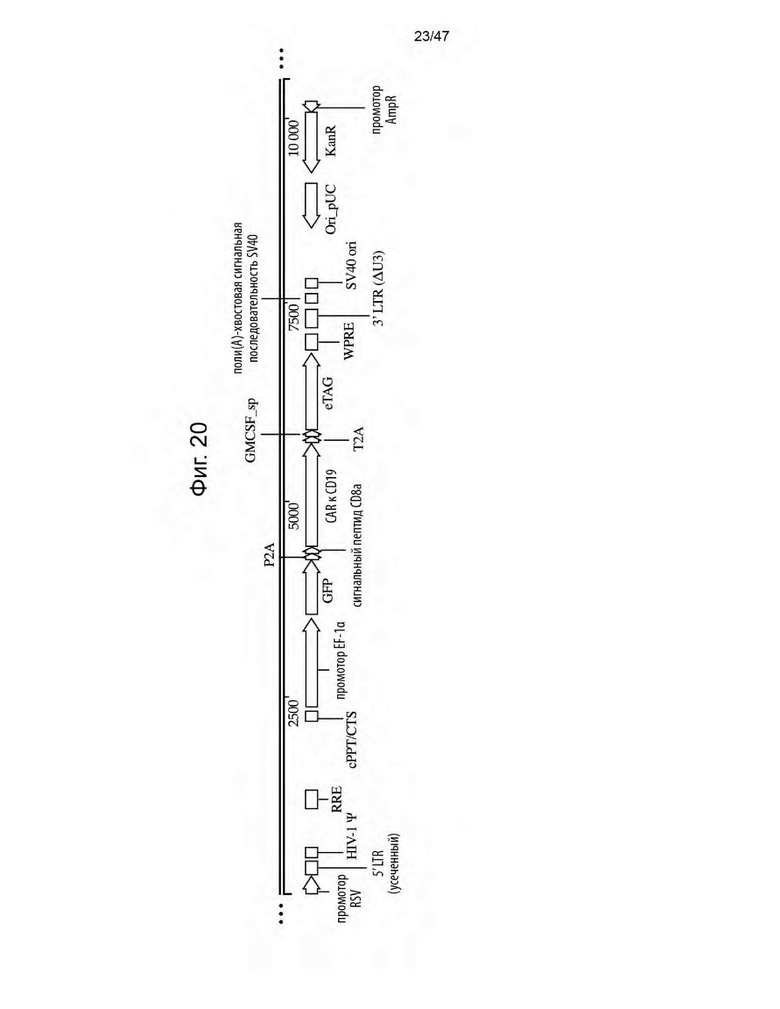
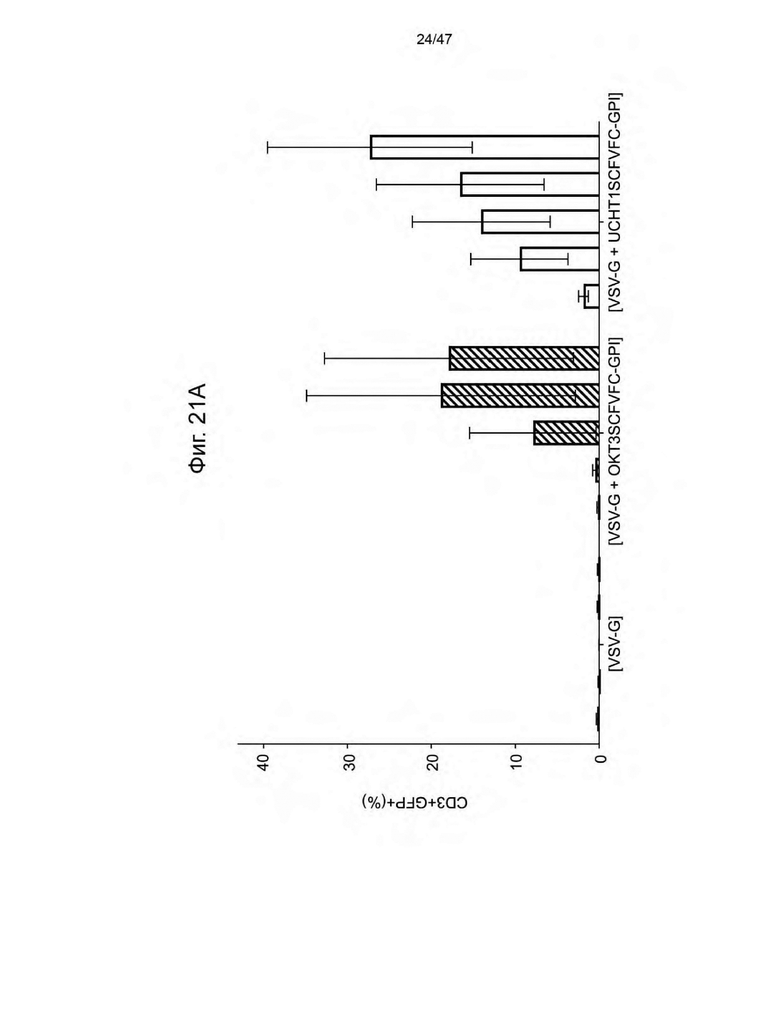
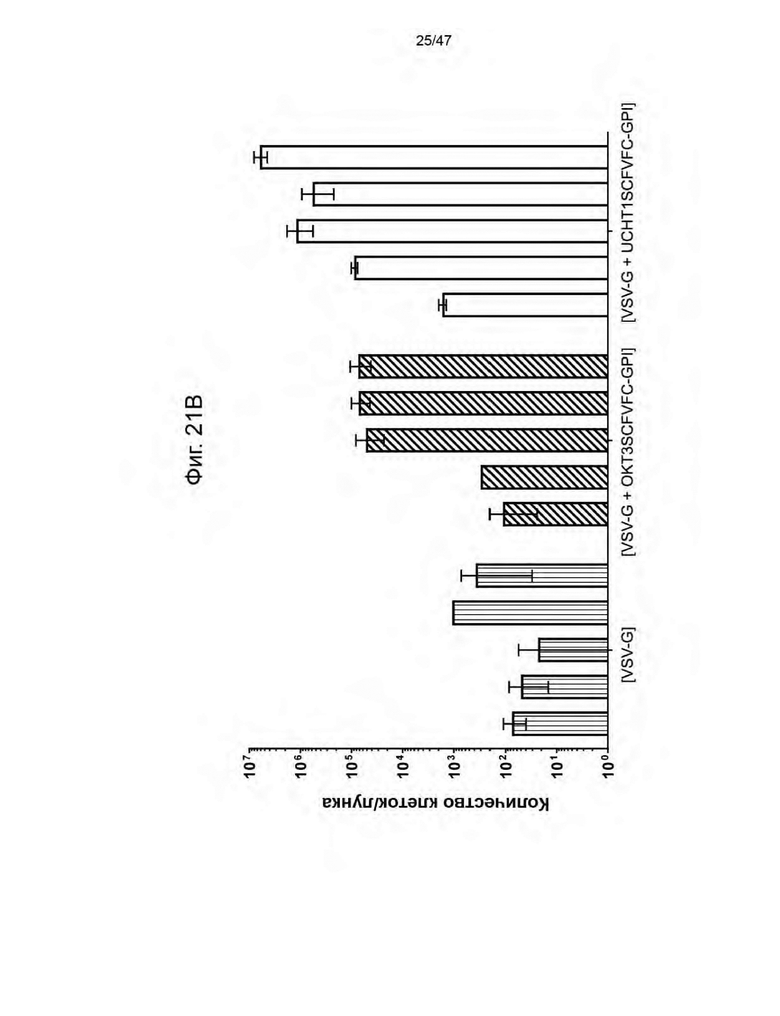
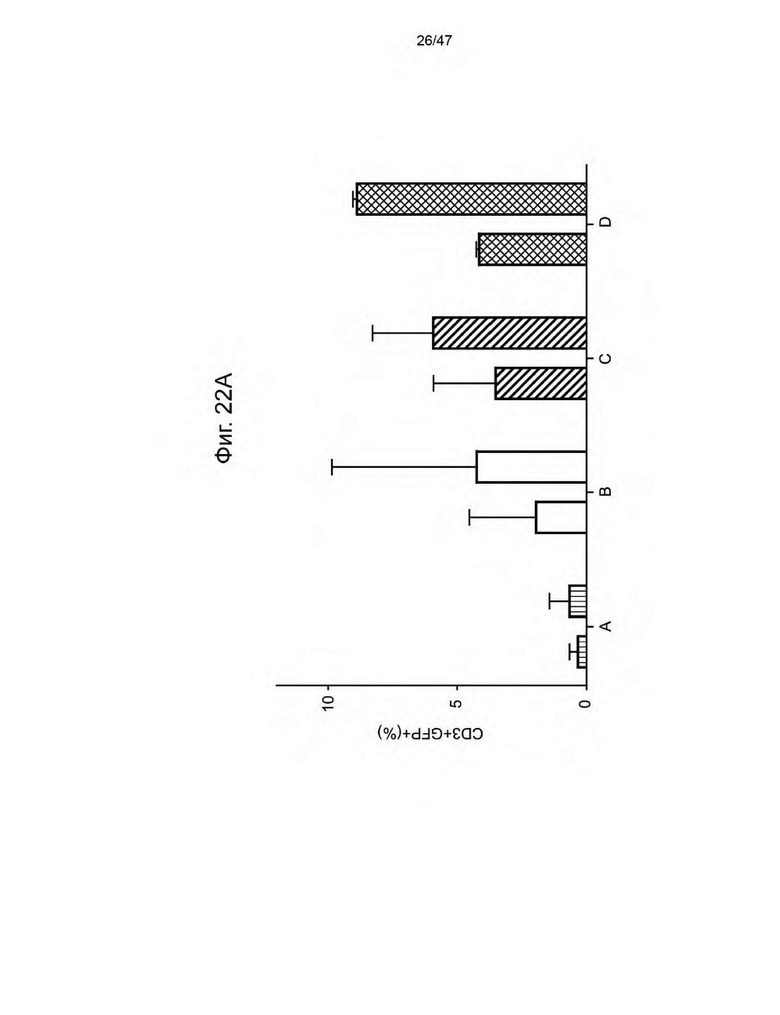
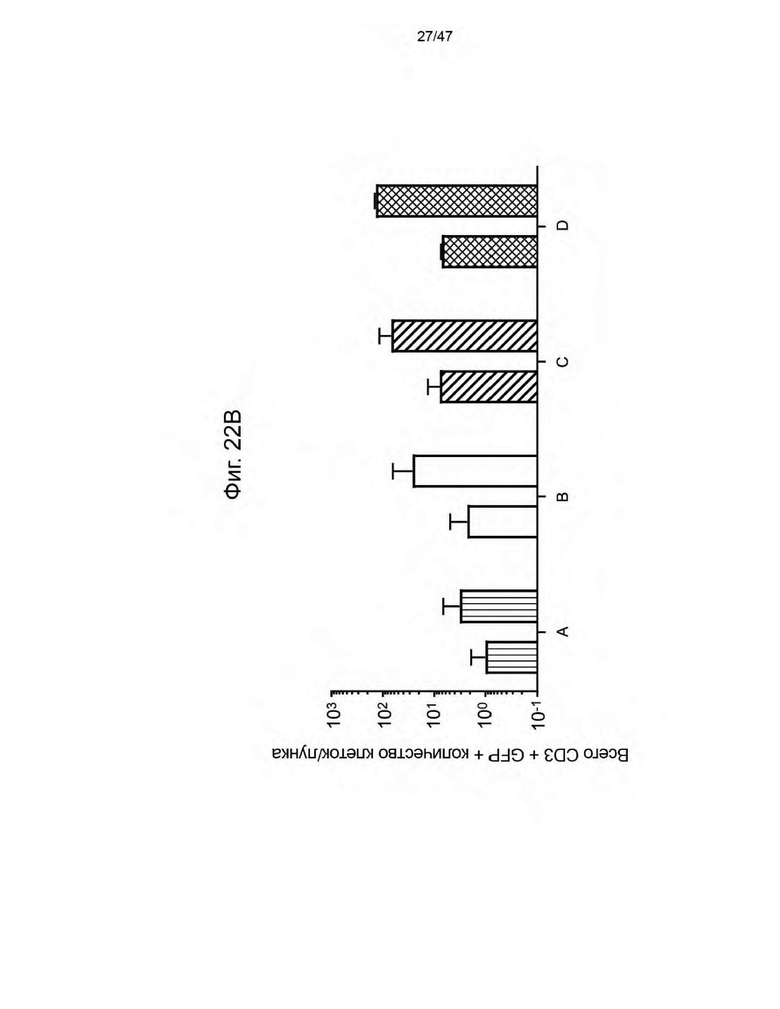
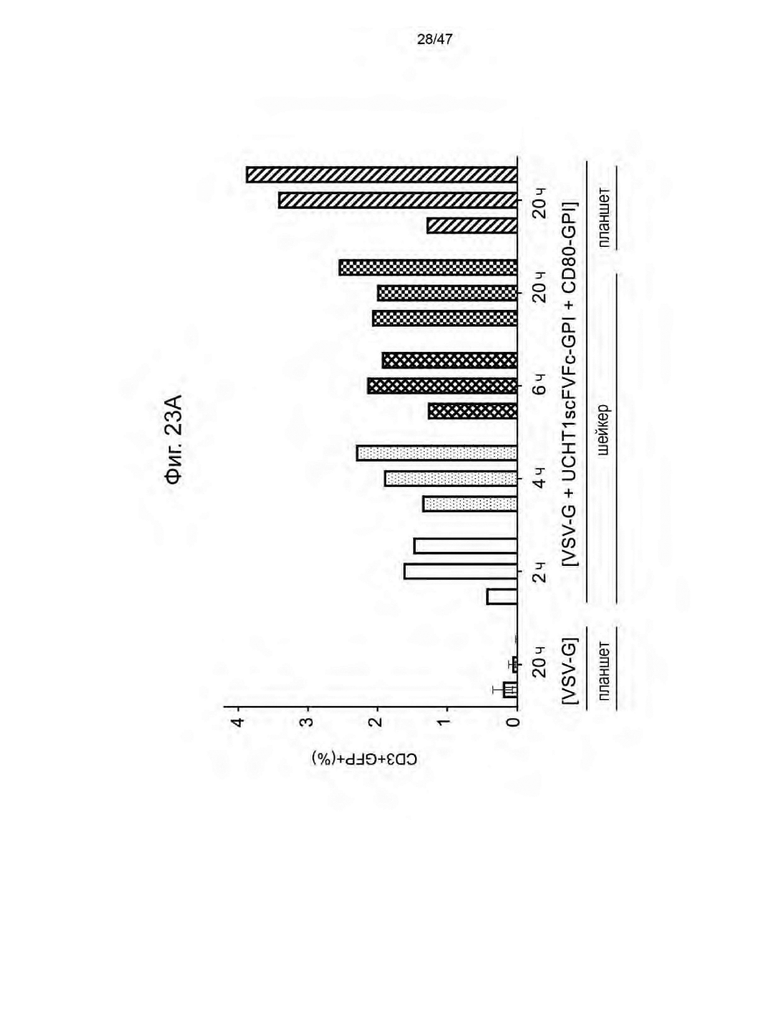
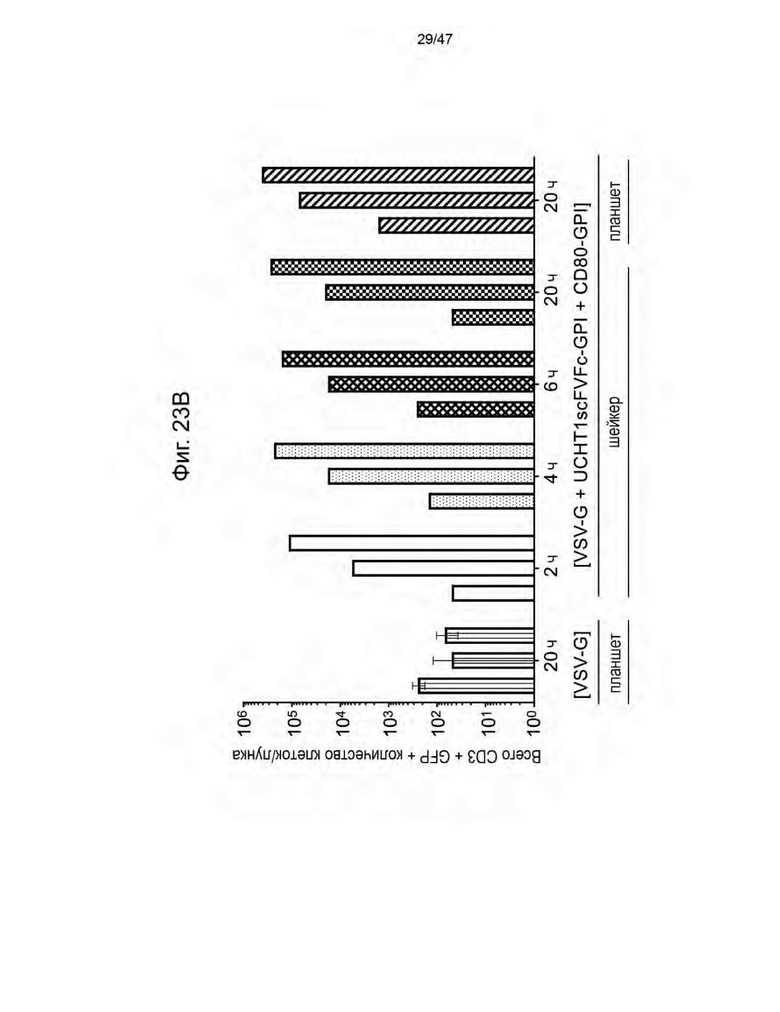
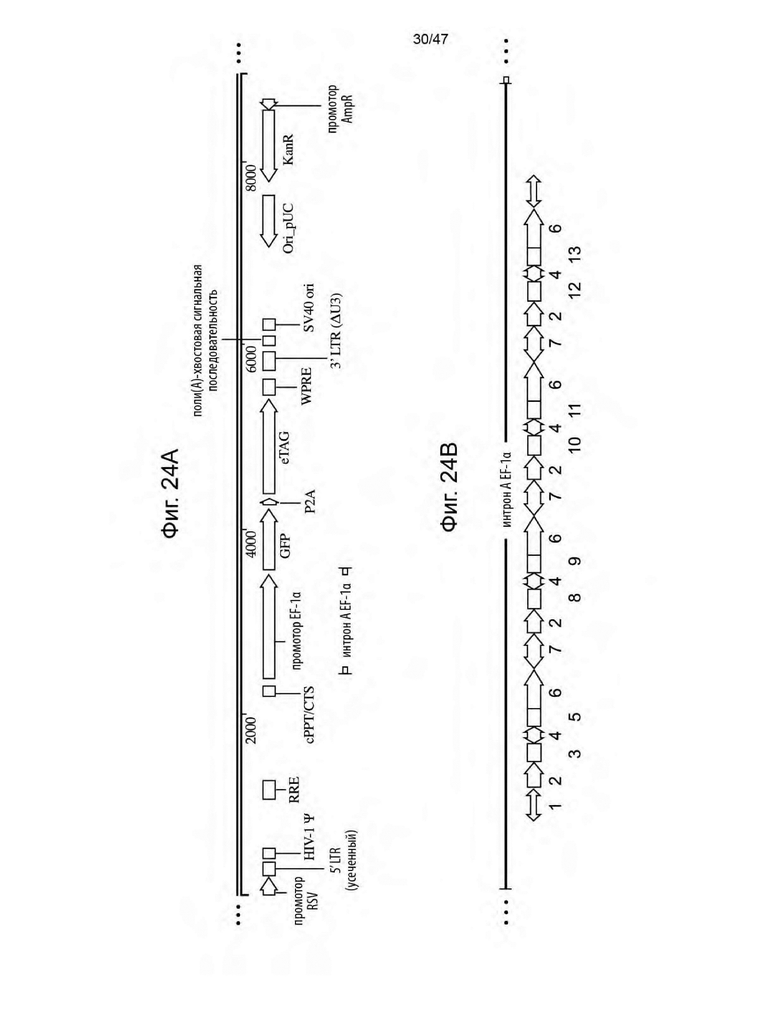
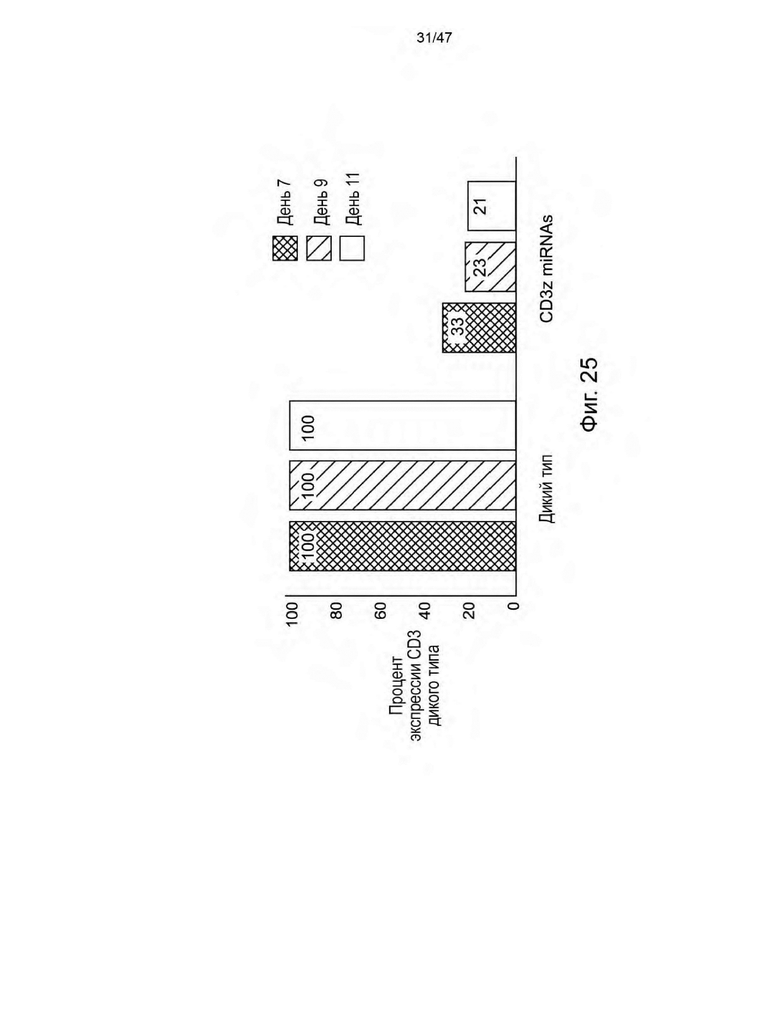
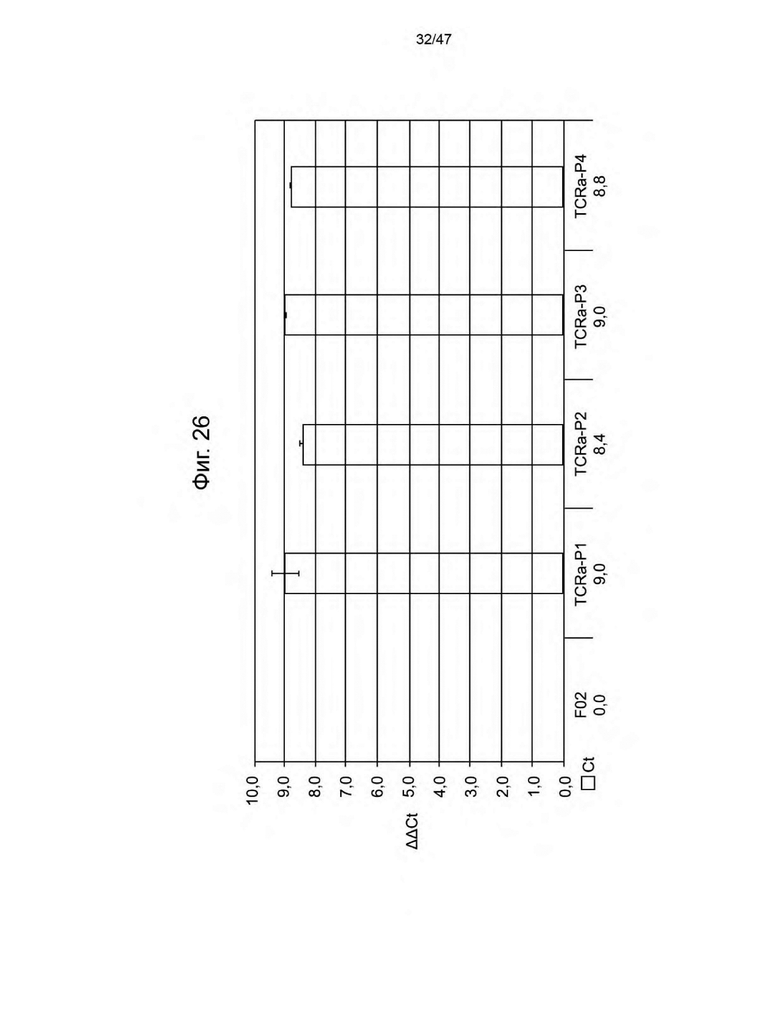
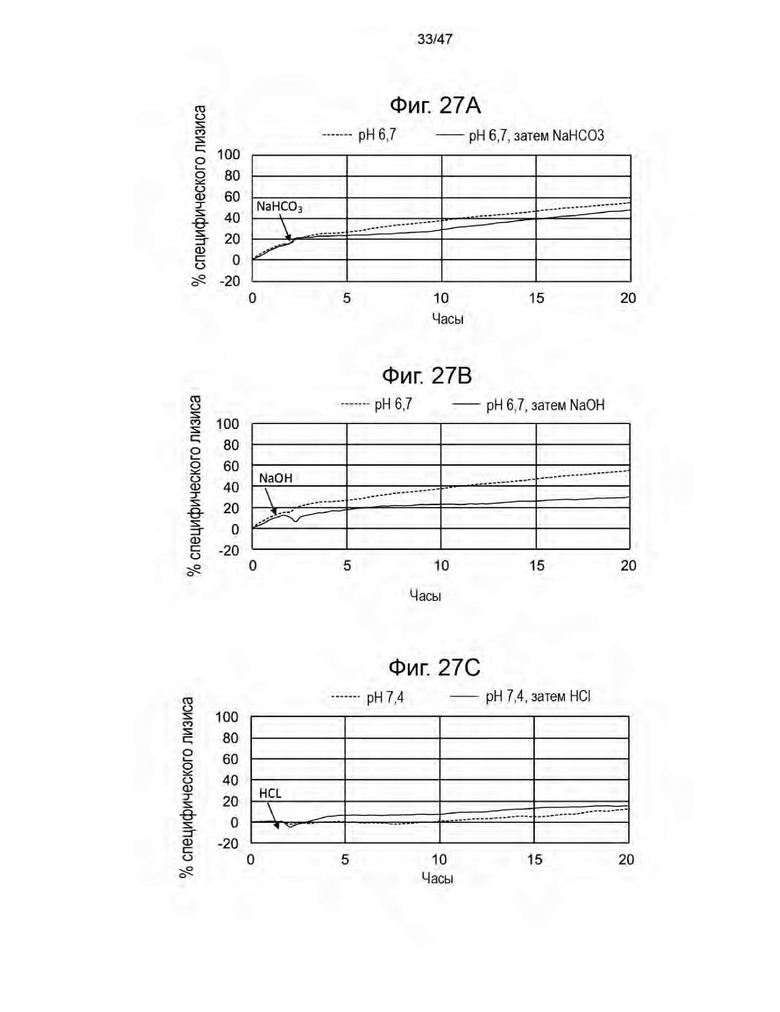
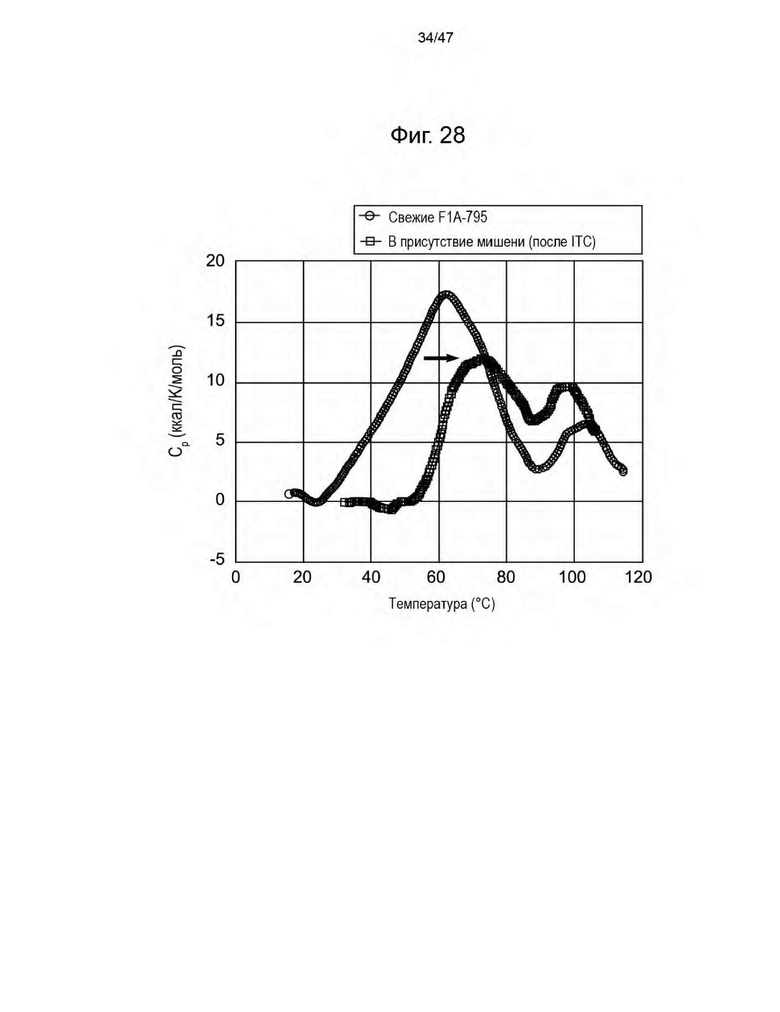
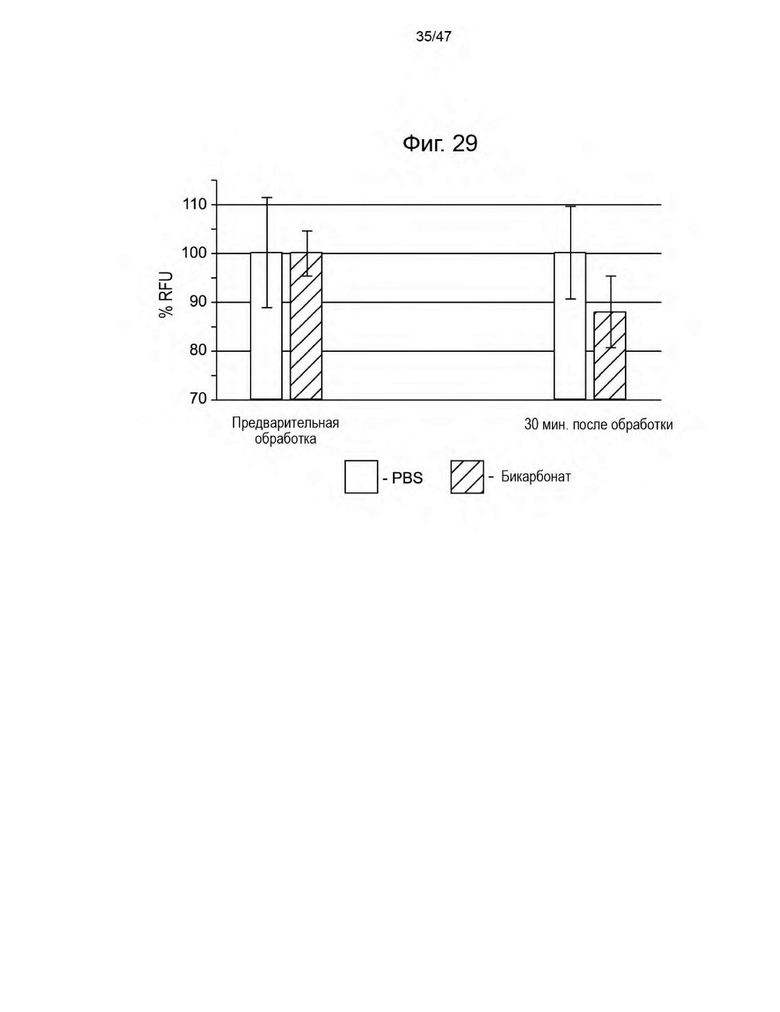
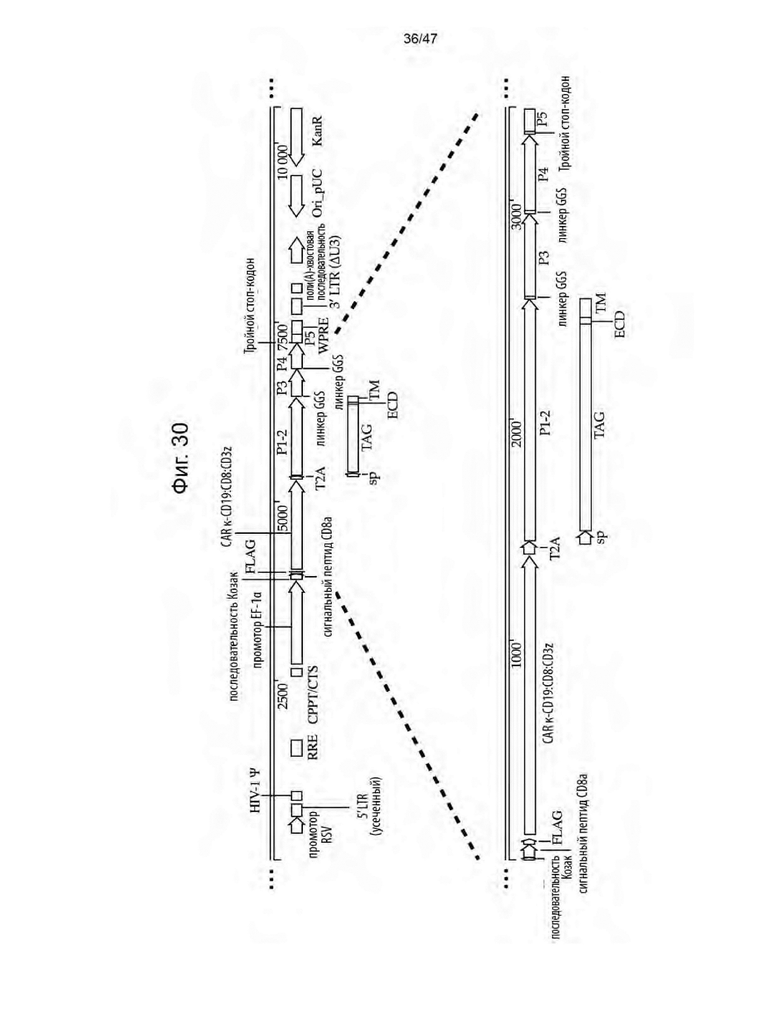
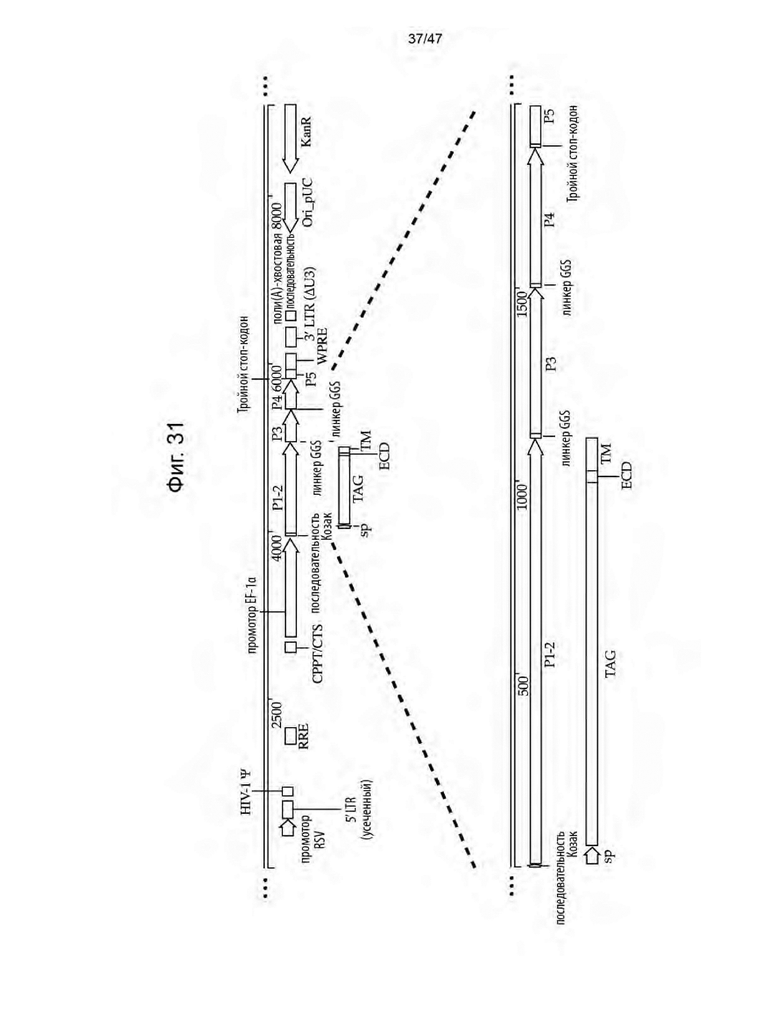
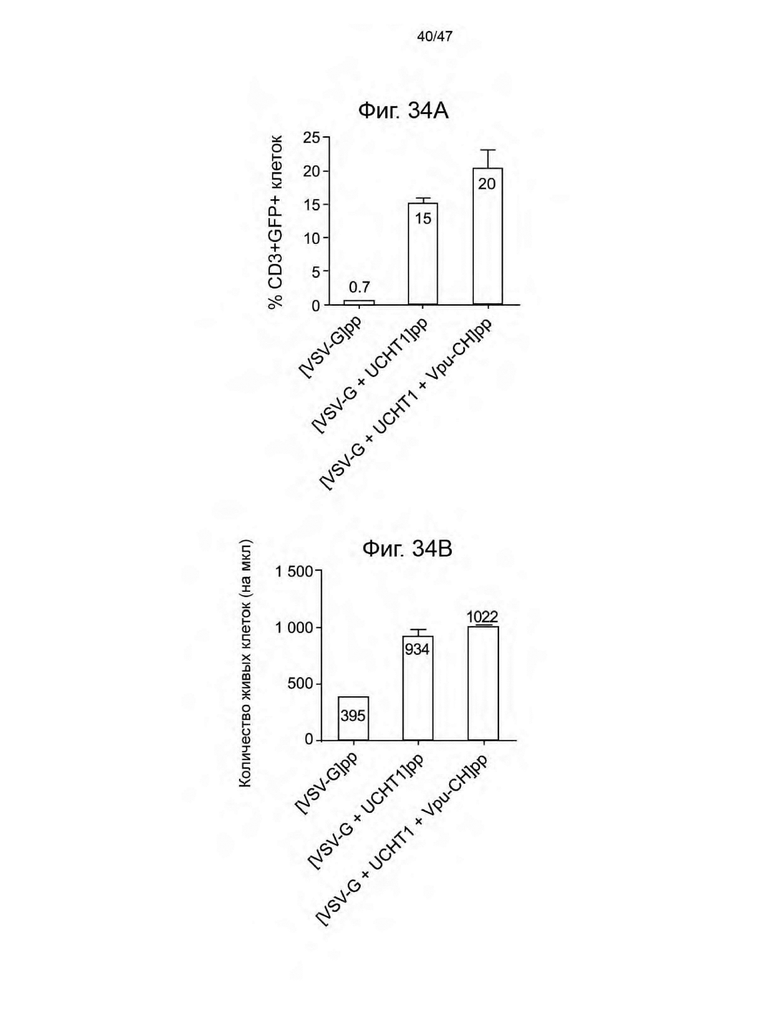
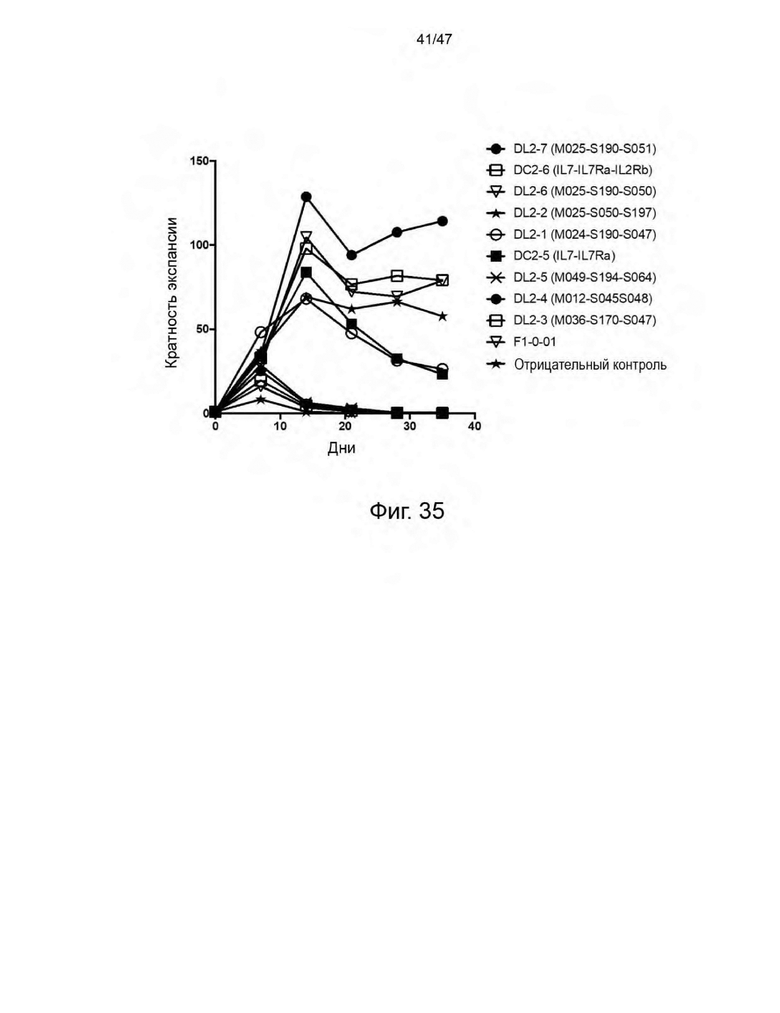
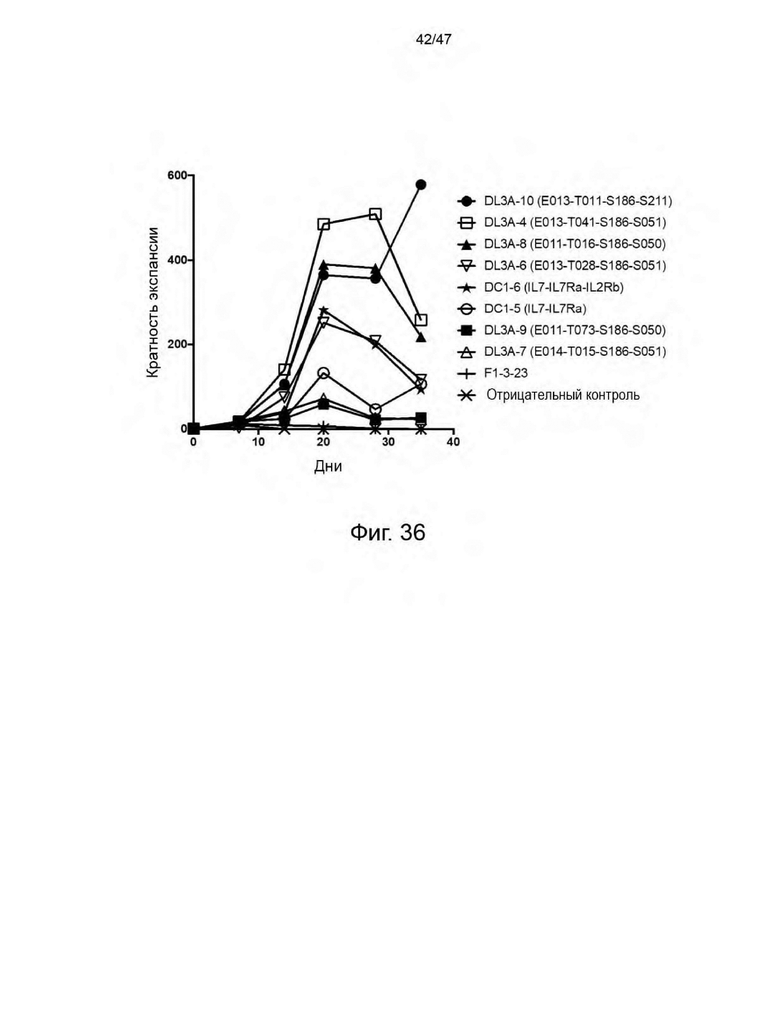
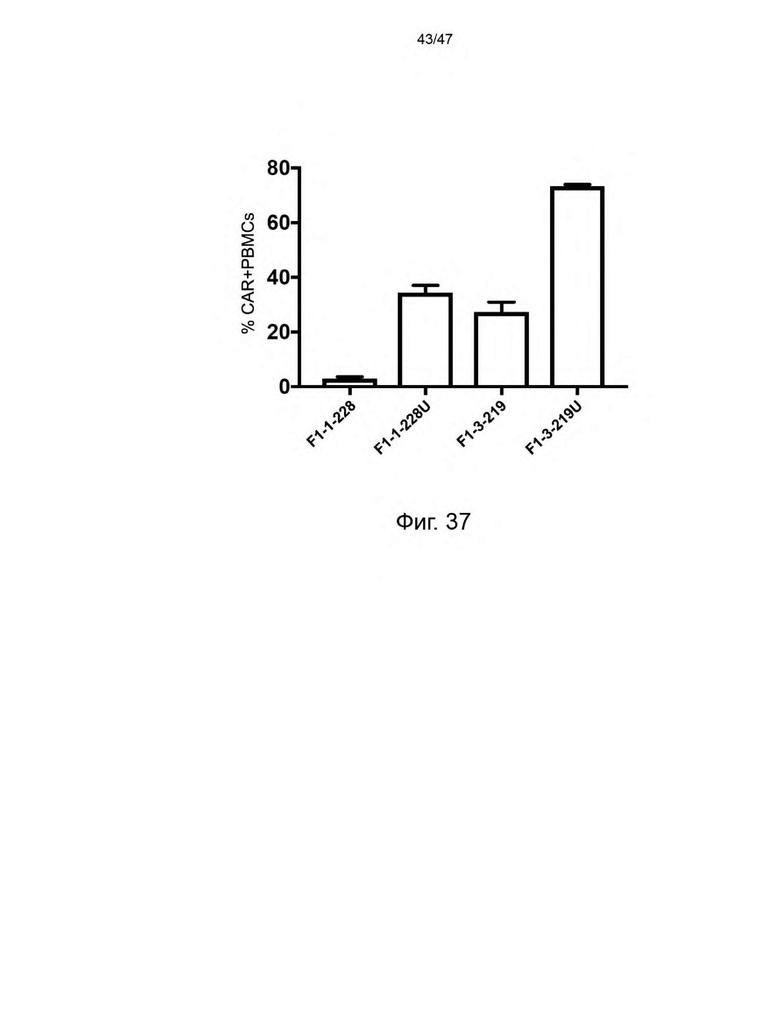
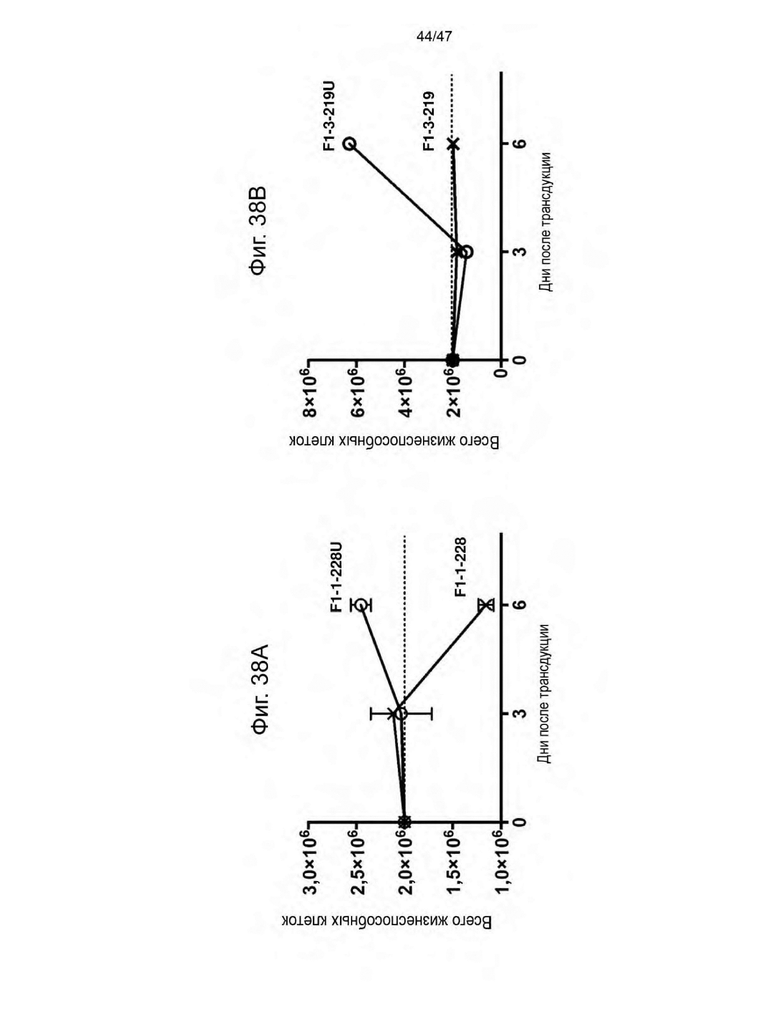
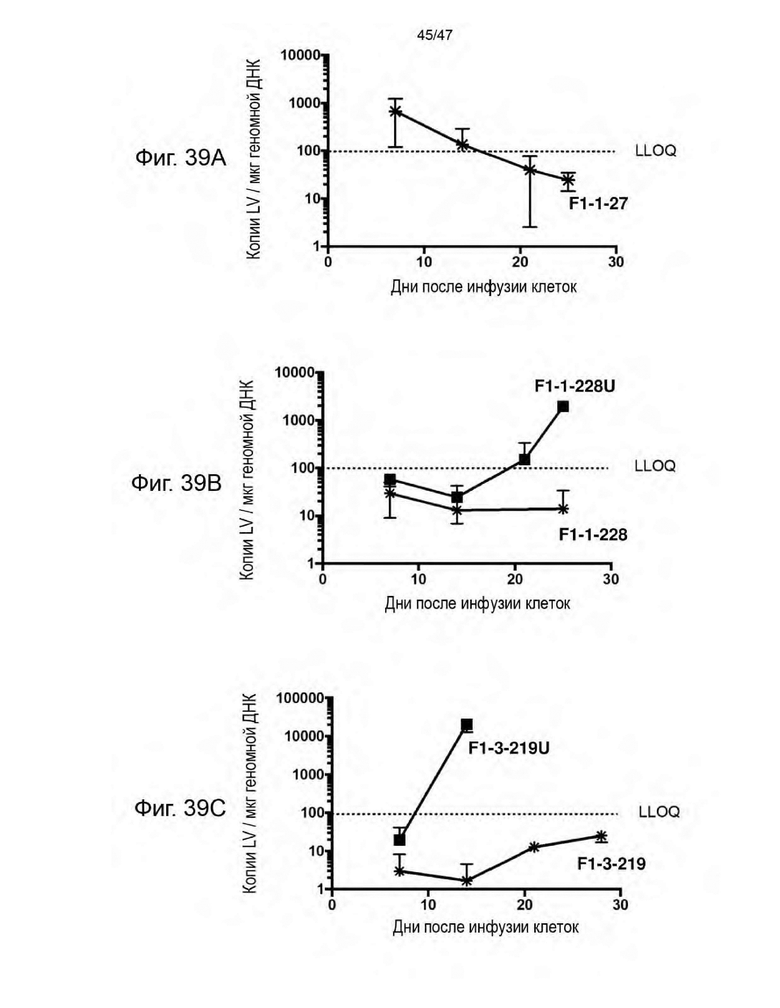
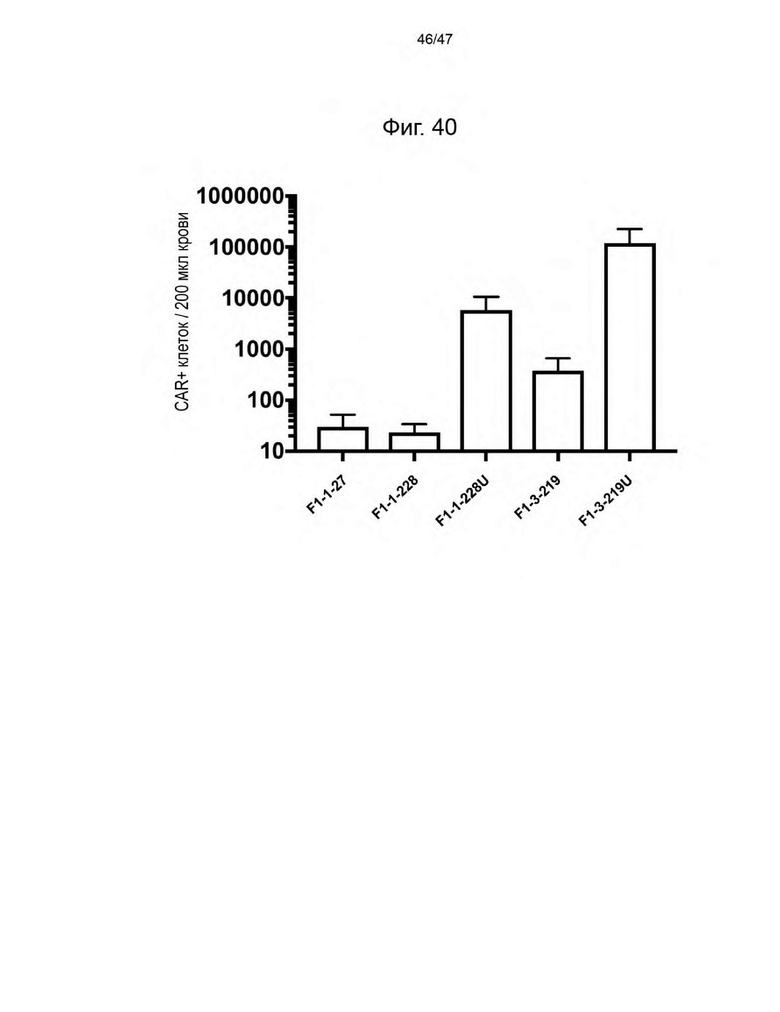
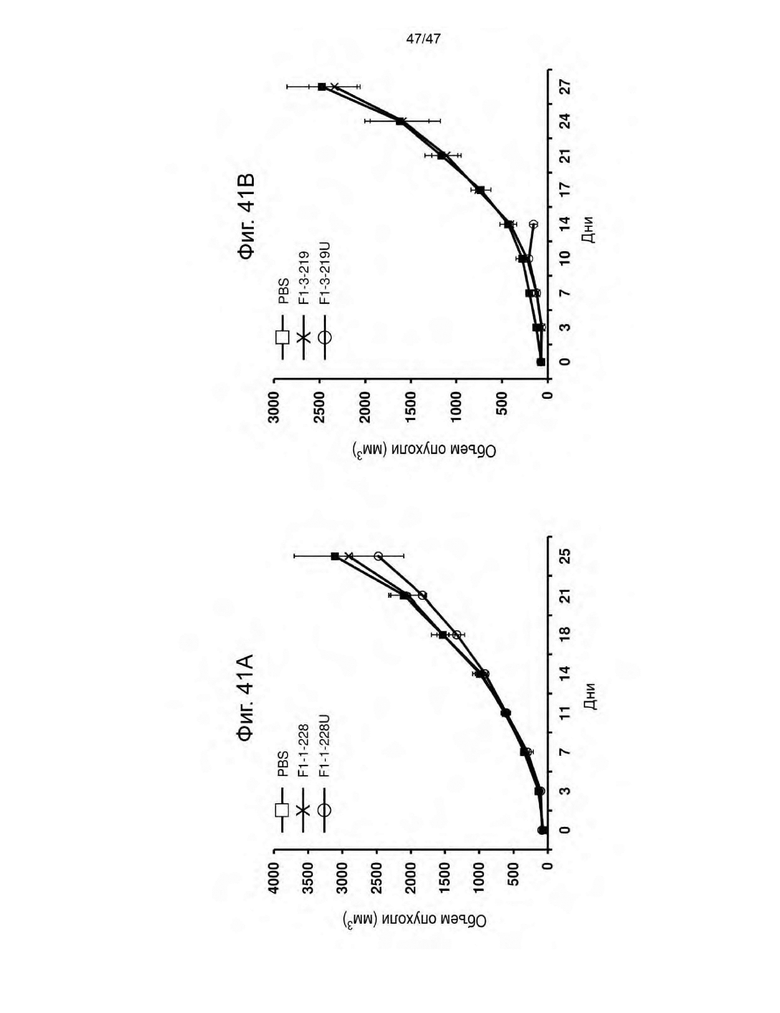
Изобретение относится к области иммунологии, более конкретно к генетической модификации иммунных клеток. Предложена не способная к репликации рекомбинантная ретровирусная частица для генетической модификации T- или NK-клеток. Частица содержит полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным по меньшей мере в одной из Т-клеток или NK-клеток. Одна или несколько транскрипционных единиц кодируют первый полипептид, содержащий конститутивно активный химерный лимфопролиферативный элемент. При этом химерный лимфопролиферативный элемент включает внеклеточный домен, который содержит димеризующий мотив, придающий химерному лимфопролиферативному элементу конститутивную активность в отсутствии димеризующего средства. Химерный лимфопролиферативный элемент способен стимулировать пролиферацию и/или выживаемость Т-клеток или NK-клеток и не содержит цитокин, связанный с когнантным ему рецептором или с фрагментом когнантного ему рецептора. Изобретение позволяет регулировать активность трансдуцированных и/или генетически модифицированных Т-клеток или NK-клеток. 36 з.п. ф-лы, 41 ил., 24 табл., 22 пр.
1. Не способная к репликации рекомбинантная ретровирусная частица для генетической модификации T- или NK-клеток, содержащая полинуклеотид, содержащий одну или несколько транскрипционных единиц, функционально связанных с промотором, активным по меньшей мере в одной из Т-клеток или NK-клеток, при этом одна или несколько транскрипционных единиц кодируют первый полипептид, содержащий конститутивно активный химерный лимфопролиферативный элемент, при этом химерный лимфопролиферативный элемент содержит:
внеклеточный домен,
трансмембранный домен и
первый внутриклеточный сигнальный домен, содержащий полипептид, способный активировать клеточный сигнальный путь,
где указанный трансмембранный домен ковалентно присоединен к указанному внеклеточному домену и указанному первому внутриклеточному сигнальному домену,
при этом химерный лимфопролиферативный элемент способен стимулировать пролиферацию и/или выживаемость Т-клеток,
при этом указанный внеклеточный домен содержит димеризующий мотив, который придает химерному лимфопролиферативному элементу конститутивную активность в отсутствие димеризующего средства, и
при этом химерный лимфопролиферативный элемент не содержит цитокин, связанный с когнантным ему рецептором или с фрагментом когнантного ему рецептора.
2. Не способная к репликации рекомбинантная ретровирусная частица по п. 1, отличающаяся тем, что димеризующий мотив представляет собой димеризующий мотив, содержащий лейциновую застежку, или ее мутант, или их фрагмент, или димеризующий мотив происходит из CD69, CD71, CD72, CD96, CD105, CD161, CD162 или CD249, или их мутанта, или их фрагмента, и где димеризующий мотив активен в отсутствие димеризующего средства.
3. Не способная к репликации рекомбинантная ретровирусная частица по п. 2, отличающаяся тем, что димеризующий мотив представляет собой димеризующий мотив, содержащий лейциновую застежку, и где димеризующий мотив, содержащий лейциновую застежку, происходит из полипептида jun.
4. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-3, отличающаяся тем, что внеклеточный домен содержит домен распознавания, при этом домен распознавания распознается одобренным биопрепаратом на основе моноклональных антител.
5. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-4, отличающаяся тем, что внеклеточный домен содержит последовательность SEQ ID NO:312.
6. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-5, отличающаяся тем, что первый внутриклеточный сигнальный домен содержит сигнальный домен из CD2, CD3D, CD3E, CD3G, CD4, CD8A, CD8B, CD27, CD28, CD40, CD79A, CD79B, CRLF2, CSF2RA, CSF2RB, CSF3R, EPOR, FCER1G, FCGR2C, FCGR2A, GHR, ICOS, IFNAR1, IFNAR2, IFNGR1, IFNGR2, IFNLR1, IL1R1, IL1RAP, IL1RL1, IL1RL2, IL2RA, IL2RB, IL2RG, IL3RA, IL4R, IL5RA, IL6R, IL6ST, IL7RA, IL9R, IL10RA, IL10RB, IL11RA, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL15RA, IL17RA, IL17RB, IL17RC, IL17RD, IL17RE, IL18R1, IL18RAP, IL20RA, IL20RB, IL21R, IL22RA1, IL23R, IL27RA, IL31RA, LEPR, LIFR, LMP1, MPL, OSMR, PRLR, TNFRSF4, TNFRSF8, TNFRSF9, TNFRSF14 или TNFRSF18, или его мутант, и/или их фрагмент, который сохраняет способность стимулировать пролиферацию, выживание (антиапоптоз) и/или обеспечивает костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
7. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-6, отличающаяся тем, что первый внутриклеточный сигнальный домен содержит сигнальный домен из CD3D, CD3E, CD3G, CD27, CD28, CD40, CD79A, CD79B, CRLF2, CSF2RA, CSF3R, EPOR, FCER1G, FCGR2A, FCGR2C, GHR, IFNAR1, IFNAR2, IFNGR2, IL1R1, IL1RL1, IL2RA, IL2RG, IL3RA, IL5RA, IL6R, IL7R, IL9R, IL10RB, IL11RA, IL12RB1, IL13RA1, IL13RA2, IL15RA, IL17RB, IL18R1, IL18RAP, IL20RB, IL22RA1, IL27RA, IL31RA, LEPR, MPL, OSMR, PRLR, TNFRSF4, TNFRSF8, TNFRSF9, TNFRSF14 или TNFRSF18, или его мутант, или их фрагмент, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
8. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-5, отличающаяся тем, что первый внутриклеточный сигнальный домен содержит сигнальный домен из CD40, CRLF2, CSF2RA, CSF3R, EPOR, FCGR2A, IFNAR2, IFNGR2, IL1R1, IL3RA, IL7R, IL10RB, IL11RA, IL12RB1, IL13RA2, IL18RAP, IL31RA, MPL, TNFRSF14 или TNFRSF18, или его мутант, или их фрагмент, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
9. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-5, отличающаяся тем, что первый внутриклеточный сигнальный домен содержит сигнальный домен из MPL, или его мутант, или фрагмент, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
10. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-5, отличающаяся тем, что первый внутриклеточный сигнальный домен содержит сигнальный домен из CD40, или его мутант, или фрагмент, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
11. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-5, отличающаяся тем, что первый внутриклеточный сигнальный домен содержит сигнальный домен из CD79A, или его мутант, или фрагмент, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
12. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-5, отличающаяся тем, что первый внутриклеточный сигнальный домен содержит сигнальный домен из CD79B, или его мутант, или фрагмент, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
13. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-5, отличающаяся тем, что первый внутриклеточный сигнальный домен содержит сигнальный домен из MYD88 или его мутант, или фрагмент, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
14. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-13, отличающаяся тем, что химерный лимфопролиферативный элемент дополнительно содержит второй внутриклеточный сигнальный домен, причем второй внутриклеточный сигнальный домен является С-концевым по отношению к первому внутриклеточному сигнальному домену, и при этом второй внутриклеточный сигнальный домен представляет собой сигнальный домен из гена, который способствует по меньшей мере одному из пролиферации или выживания (антиапоптоз) или обеспечивает костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
15. Не способная к репликации рекомбинантная ретровирусная частица по п. 14, отличающаяся тем, что второй внутриклеточный сигнальный домен содержит сигнальный домен из CD3D, CD3E, CD3G, CD8A, CD8B, CD27, CD28, CD40, CD79A, CD79B, FCER1G, FCGR2C, FCGRA2, GHR, ICOS, IL1RL1, IL10RB, MYD88, TNFRSF4, TNFRSF8, TNFRSF9, TNFRSF14 или TNFRSF18, или его мутант, или их фрагмент, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
16. Не способная к репликации рекомбинантная ретровирусная частица по п. 15, отличающаяся тем, что первый внутриклеточный сигнальный домен и второй внутриклеточный сигнальный домен происходят из разных генов.
17. Не способная к репликации рекомбинантная ретровирусная частица по п. 16, отличающаяся тем, что первый внутриклеточный сигнальный домен и второй внутриклеточный сигнальный домен выбраны из CD27-IL1RL1, CD28-CD40, CD40-CD3G, CD40-CD8A, CRLF2-CD79B, CRLF2-TNFRSF9, CSF2RA-CD40, CSF2RA-CD79B, CSF2RA- TNFRSF4, CSF3R-CD40, CSF3R-ICOS, CSF3R-TNFRSF14, EPOR-CD79B, EPOR-TNFRSF9, FCGR2C-CD79B, IFNAR1-CD27, IFNAR2-FCGRA2, IFNAR2-TNFRSF18, IFNGR2-CD3G, IFNGR2-TNFRSF18, IFNGR2-TNFRSF8, IL10RB-CD79A, IL10RB-FCGR2C, IL10RB-TNFRSF18, IL11RA-FCER1G, IL11RA-ICOS, IL11RA-TNFRSF4, IL12RB1-CD3G, IL12RB1-CD79A, IL12RB1-FCGRA2, IL12RB1-TNFRSF14, IL12RB1-TNFRSF18, IL13RA1-CD3D, IL13RA1-CD40, IL13RA1-CD79B, IL13RA1-ICOS, IL13RA2-CD28, IL13RA2-CD3D, IL13RA2-ICOS, IL13RA2-TNFRSF9, IL15RA-FCER1G, IL15RA-TNFRSF18, IL17RB-IL10RB, IL18R1-CD27, IL18RAP-ICOS, IL1RL1-CD79A, IL20RB-FCER1G, IL20RB-FCGR2C, IL22RA1-TNFRSF9, IL27RA-FCGR2C, IL27RA-TNFRSF4, IL2RA-TNFRSF18, IL2RG-CD28, IL2RG-CD3G, IL2RG-TNFRSF9, IL31RA-CD3G, IL31RA-MYD88, IL31RA-TNFRSF14, IL31RA-TNFRSF18, IL3RA-FCER1G, IL5RA-FCGR2C, IL5RA-TNFRSF4, IL6R-CD3E, IL6R-CD8B, IL6R-FCGR2C, IL7RA-CD3E, IL7RA-CD3G, IL7RA-CD79B, IL7RA- TNFRSF18, IL7RA-TNFRSF4, IL9R-CD40, LEPR-CD79B, LEPR-FCGR2C, LEPR-TNFRSF14, LEPR-TNFRSF18, LEPR-TNFRSF4, LEPR-TNFRSF9, MPL-CD27, MPL-CD3D, MPL-CD3G, MPL-CD40, MPL-CD79A, MPL-CD79B, MPL-FCGR2C, MPL-FCGRA2, MPL-TNFRSF18, MPL-TNFRSF4, MYD88-CD28, MYD88-CD3D, MYD88-CD3E, MYD88-CD40, MYD88-CD79B, MYD88-CD8A, MYD88-CD8B, MYD88-ICOS, MYD88-TNFRSF9, OSMR-CD79B, OSMR-FCGR2C, OSMR-TNFRSF9, PRLR-CD40, TNFRSF14-GHR или TNFRSF18-TNFRSF4.
18. Не способная к репликации рекомбинантная ретровирусная частица по п. 16, отличающаяся тем, что первый внутриклеточный сигнальный домен происходит из MPL, OSMR или CSF2RA, или его мутанта, или их фрагмента, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти, и где второй внутриклеточный сигнальный домен происходит из CD40, TNFRSF4, CD79B, CD27, FCGR2A или TNFRSF18, или его мутанта, или их фрагмента, который сохраняет по меньшей мере одну из способностей стимулировать пролиферацию, выживание (антиапоптоз) или способность обеспечивать костимуляторный сигнал, который усиливает состояние дифференцировки, пролиферативный потенциал или устойчивость к клеточной смерти.
19. Неспособная к репликации рекомбинантная ретровирусная частица по п. 16, отличающаяся тем, что первый внутриклеточный сигнальный домен и второй внутриклеточный сигнальный домен выбраны из CSF2RA-CD40, CSF2RA-CD79B, CSF2RA-TNFRSF4, MPL-CD27, MPL-CD3D, MPL-CD3G, MPL-CD40, MPL-CD79A, MPL- CD79B, MPL-FCGR2A, MPL-FCGR2C, MPL-TNFRSF18, MPL-TNFRSF4, OSMR-CD79B, OSMR-FCGR2C и OSMR-TNFRSF9.
20. Неспособная к репликации рекомбинантная ретровирусная частица по п. 19, отличающаяся тем, что первый внутриклеточный сигнальный домен и второй внутриклеточный сигнальный домен представляют собой CSF2RA-CD79B.
21. Неспособная к репликации рекомбинантная ретровирусная частица по п. 19, отличающаяся тем, что первый внутриклеточный сигнальный домен и второй внутриклеточный сигнальный домен представляют собой OSMR-CD79B.
22. Неспособная к репликации рекомбинантная ретровирусная частица по п. 19, отличающаяся тем, что первый внутриклеточный сигнальный домен и второй внутриклеточный сигнальный домен представляют собой MPL-CD40.
23. Неспособная к репликации рекомбинантная ретровирусная частица по п. 19, отличающаяся тем, что первый внутриклеточный сигнальный домен и второй внутриклеточный сигнальный домен представляют собой MPL-CD79A.
24. Неспособная к репликации рекомбинантная ретровирусная частица по п. 19, отличающаяся тем, что первый внутриклеточный сигнальный домен и второй внутриклеточный сигнальный домен представляют собой MPL-CD79B.
25. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-24, отличающаяся тем, что химерный лимфопролиферативный элемент кодируется в обратной ориентации относительно цис-действующего упаковывающего элемента РНК в геноме не способной к репликации рекомбинантной ретровирусной частицы.
26. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-25, отличающаяся тем, что не способная к репликации рекомбинантная ретровирусная частица дополнительно содержит один или несколько элементов активации на своей поверхности.
27. Не способная к репликации рекомбинантная ретровирусная частица по п. 26, отличающаяся тем, что по меньшей мере один из элементов активации способен связывать CD3.
28. Не способная к репликации рекомбинантная ретровирусная частица по п. 27, отличающаяся тем, что по меньшей мере один из элементов активации, способных связывать CD3, представляет собой антитело к CD3.
29. Не способная к репликации рекомбинантная ретровирусная частица по п. 28, отличающаяся тем, что антитело к CD3 представляет собой антитело на основе scFvFc к CD3.
30. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 26-29, отличающаяся тем, что по меньшей мере один из элементов активации способен связываться с CD28.
31. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-30, отличающаяся тем, что не способная к репликации рекомбинантная ретровирусная частица дополнительно содержит на своей поверхности мембраносвязанный полипептид слияния цитокинов, где полипептид слияния цитокинов содержит цитокин.
32. Не способная к репликации рекомбинантная ретровирусная частица по п. 31, отличающаяся тем, что мембраносвязанный полипептид слияния цитокинов содержит IL- 7, IL-15 или их активный фрагмент.
33. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 31, 32, отличающаяся тем, что мембраносвязанный полипептид слияния цитокинов содержит последовательность присоединения GPI-якоря.
34. Не способная к репликации рекомбинантная ретровирусная частица по п. 33, отличающаяся тем, что последовательность присоединения GPI-якоря происходит от CD14, CD16, CD48, CD55 (DAF), CD59, CD80 или CD87.
35. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 32-34, отличающаяся тем, что мембраносвязанный полипептид слияния цитокинов содержит IL-7 или его активный фрагмент, слитый с DAF.
36. Не способная к репликации рекомбинантная ретровирусная частица по п. 35, отличающаяся тем, что мембраносвязанный полипептид слияния цитокинов содержит последовательность SEQ ID NO:286.
37. Не способная к репликации рекомбинантная ретровирусная частица по любому из пп. 1-36, отличающаяся тем, что полинуклеотид дополнительно кодирует второй полипептид, содержащий антигенспецифическую нацеленную область, трансмембранный домен и внутриклеточный активирующий домен.
| WO 2016139463 A1, 09.09.2016 | |||
| WO 2016061574 A1 21.04.2016 | |||
| WO 2012138858 A1, 11.10.2012 | |||
| WO 2006007539 A1, 19.01.2006 | |||
| WO 2016033331 A1, 03.03.2016 | |||
| УЛУЧШЕННЫЙ СПОСОБ УВЕЛИЧЕНИЯ ЧИСЛА ОПУХОЛЕ-РЕАКТИВНЫХ Т-ЛИМФОЦИТОВ В ИММУНОТЕРАПИИ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ | 2006 |
|
RU2399382C2 |
Авторы
Даты
2024-06-14—Публикация
2018-03-03—Подача