ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка согласно PCT испрашивает приоритет предварительных заявок на патент Индии №№201921029556, поданной 22 июля 2019 г.; 201921051086, поданной 10 декабря 2019 г., и 202021003961, поданной 29 января 2020 г., раскрытие каждой из которых включено в данный документ посредством ссылки во всей своей полноте для всех целей.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к макроциклическому соединению, характеризующемуся общей формулой (II), и его фармацевтически приемлемой соли, содержащей его фармацевтической композиции, применению указанного соединения для изготовления лекарственного препарата, предназначенного для лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие, а также способу лечения такого заболевания или состояния с использованием указанного соединения.
Включение посредством ссылки
Все патенты США, публикации заявок на патент США, иностранные патенты, иностранные опубликованные заявки и опубликованные заявки согласно PCT, статьи и другие документы, ссылки и публикации, указанные в данном документе, и все, которые перечислены в качестве используемых при экспертизе материалов в любом патенте или патентах, из него вытекающих, включены в данный документ посредством ссылки во всей своей полноте. Включенная информация является частью данной заявки в таком объеме, как если бы весь текст и другое содержание были повторены в настоящей заявке, и ее следует рассматривать в качестве части текста и содержания настоящей заявки в поданном виде.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Далее включена информация, которая может быть полезной для понимания настоящего изобретения. Включение такой информации не является признанием того, что любая информация, публикации или документы, в конкретной или подразумеваемой форме процитированные в данном документе, относятся к существующему уровню техники или являются существенными в отношении описанного или заявленного в данном документе изобретения.
Стимулятор генов интерферона (STING, также известный как трансмембранный белок 173/TMEM173/MPYS/MITA/ERIS) представляет собой сигнальную молекулу, которая у людей кодируется геном TMEM173. STING представляет собой белок из 379 аминокислот, состоящий из нескольких трансмембранных участков. Белок STING экспрессируется в нескольких типах эндотелиальных и эпителиальных клеток, а также в клетках гемопоэтической линии дифференцировки, которые могут включать или исключать T-клетки, дендритные клетки (DC), в том числе плазмоцитоидные дендритные клетки (pDC), и макрофаги. STING связан с эндоплазматическим ретикулумом (ER) в клетке и играет важную роль в контроле транскрипции многих генов защиты хозяина, включая интерфероны типа I (IFN) и провоспалительные цитокины.
Распознавание аберрантных молекул ДНК или циклических динуклеотидов (CDN) в цитозоле клетки приводит к активации STING. Молекулы цитозольной ДНК могут активировать опосредованную STING передачу сигнала после связывания с синтазой циклического GMP-AMP (cGAS). Связывание цитозольной ДНК с cGAS катализирует образование типа CDN, известного как cGAMP (циклический GMP-AMP), который содержит одну 2',5'-фосфодиэфирную связь и каноническую 3',5'-связь (c[G(2',5')pA(3',5')p]). Связывание cGAMP и других бактериальных CDN вызывает изменение в конформации белка STING и упрощает связывание с TANK-связывающей киназой 1 (TBK1). Далее комплекс STING-TBK1 переносится в перинуклеарные участки клетки с обеспечением транспорта TBK1 в компартменты эндолизосом, где он фосфорилирует факторы транскрипции, такие как регуляторный фактор интерферонов 3 (IRF3). Подобным образом STAT6 и ядерный фактор κB (NF-κB) также активируются после активации STING. Эти факторы транскрипции затем транслоцируются в ядро с обеспечением инициирования транскрипции генов врожденного иммунитета и продуцирования IFN типа I и других цитокинов. STING затем подвергается быстрой деградации, - событие, которое помогает избежать нежелательных явлений, связанных с продолжительным продуцированием цитокинов. (Nature Reviews Immunol, 2015, 15:760-770; Cell Reports, 2015, 11:1018-1030).
Исследования на мышах показали, что сигнальные пути с участием IFN типа I играют важную роль в вызываемом опухолью прайминге Т-клеток и контроле опухоли (J. Exp. Med. 2011, 208, 1989-2003). Мыши без рецептора IFN-α/β в DC не смогли противостоять иммуногенным опухолям, и CD8α+ DC у таких мышей являются дефектными в отношении перекрестной презентации антигена CD8+ T-клеткам. Дополнительно анализ профилей транскрипции у пациентов, имеющих меланому, показал, что опухоли, содержащие инфильтрующие активированные Т-клетки, характеризуются транскриптомной сигнатурой IFN типа I (Cancer Res 2009, 69:3077-3085.). Таким образом, активация STING может играть роль в контроле опухоли.
В международных публикациях заявок согласно PCT №№ WO 2017/011920, WO 2017/175147, WO 2017/175156, WO 2018/234805, WO 2018/234807, WO 2018/234808, WO 2019/023635, WO 2019/027857, WO 2019/027858 и Nature (2018), 564 (7736):439-443 раскрываются модуляторы STING.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описанное и заявленное в данном документе изобретение характеризуется многими особенностями и вариантами осуществления, включающими без ограничения те, которые указаны, или описаны, или процитированы в данном разделе «Сущность настоящего изобретения». Для описанного и заявленного в данном документе изобретения не подразумевается включение всех представленных признаков, и оно не ограничено признаками или вариантами осуществления, указанными во вводной части данного документа, которые включены исключительно для иллюстрации, а не ограничения, или с их помощью.
Целью настоящего изобретения является предоставление соединений, композиций и способов, предназначенных для модуляции белка STING и/или белкового комплекса STING и/или для лечения нарушений, на которые благоприятно повлияет модуляция белка STING и/или белкового комплекса STING. В некоторых вариантах осуществления модуляция белка STING и/или белкового комплекса STING представляет собой активацию указанного белка STING и/или белкового комплекса STING. Таким образом, в одном аспекте настоящее изобретение относится к соединениям и способам, предназначенным для модуляции белка STING и/или белкового комплекса STING и, в частности, но не исключительно, к способам лечения нарушений, на которые может благоприятно повлиять модуляция белка STING и/или белкового комплекса STING, способам, включающим введение модулятора белка STING и/или белкового комплекса STING, например соединений формулы II и/или одного или более аналогов любых вышеуказанных соединений.
В одном аспекте настоящего изобретения предложено соединение общей формулы (II) или его фармацевтически приемлемая соль
 ,
,
где
R3m выбран из
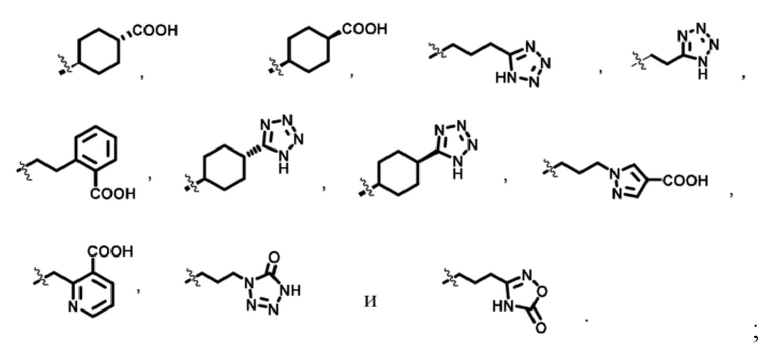 ;
;
G1 независимо выбран из -CH2- или  ;
;
кольцо A представляет собой 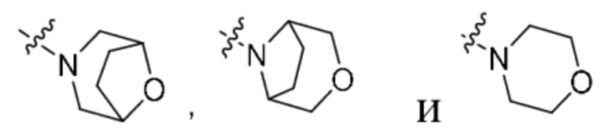 ;
;
каждый из R2a, R2b, R2c и R2d независимо выбран из водорода и C1-C3алкила.
В одном варианте осуществления соединение выбрано из
(1S,4S)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 1);
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 2);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 3);
(E)-N-(2-(1H-тетразол-5-ил)этил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 4);
(E)-2-(2-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)этил)бензойной кислоты (соединение 5);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 6);
(E)-N-((1S,4S)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 7);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 8);
(E)-2-((12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)метил)никотиновой кислоты (соединение 9);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1H-тетразол-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 10);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 11);
(8S,E)-N4-((1R,4S)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 12);
(8R,E)-N4-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 13);
(1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 14);
(1R,4R)-4-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 15);
(8S,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 16);
(8R,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 17);
1-(3-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 18);
1-(3-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 19);
(1R,4R)-4-((E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 20);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 21);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 22);
(E)-1-(3-(8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 23);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 24);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 25);
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 26);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 27);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(2-морфолиноэтил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 28);
(E)-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбонил)глицина (соединение 29);
(E)-N-(2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)этил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 30);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-морфолинопропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 32);
(E)-N-(3-(8-окса-3-азабицикло[3.2.1]октан-3-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 33);
(E)-N-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)бутил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 34);
(E)-(2-(4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксамидо)этил)-L-пролина (соединение 35);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(метилсульфонил)пиперазин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 36);
(E)-N-(3-(4,4-дифторпиперидин-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 37);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(4-морфолинобутил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 38);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-фторпиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 39);
(R,E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(3-фторпирролидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 41);
(S,E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(3-фторпирролидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 42);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(метилсульфонил)пиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 44);
E)-N-(3-(3,3-дифторпирролидин-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 45);
(E)-N-(3-((2R,6S)-2,6-диметилморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 46);
(E)-N-(3-(1,1-диоксидотиоморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 47);
(E)-N-(3-(1H-имидазол-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 48);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(пиридин-2-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 50);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(трифторметил)пиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 51);
(E)-N-(3-(3,3-диметилморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 52);
(E)-N,N'-(12-карбамоил-4-(1H-тетразол-5-ил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-1,15-диил)бис(1-этил-3-метил-1H-пиразол-5-карбоксамида (соединение 54);
(1S,3S)-3-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклобутан-1-карбоновой кислоты (соединение 55);
(1R,3R)-3-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклобутан-1-карбоновой кислоты (соединение 56);
(E)-1-((12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)метил)циклопропан-1-карбоновой кислоты (соединение 57);
(E)-2-(2-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)этил)никотиновой кислоты (соединение 58);
(E)-2-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)бензойной кислоты (соединение 59);
(E)-N-(3-(4-этокси-4-оксидо-1,4-азафосфинан-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 60).
В еще одном варианте осуществления соединение выбрано из
(1S,4S)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 1);
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 2);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 3);
(E)-N-(2-(1H-тетразол-5-ил)этил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 4);
(E)-2-(2-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)этил)бензойной кислоты (соединение 5);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 6);
(E)-N-((1S,4S)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 7);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 8);
(E)-2-((12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)метил)никотиновой кислоты (соединение 9);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1H-тетразол-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 10);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 11);
(8S,E)-N4-((1R,4S)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 12);
(8R,E)-N4-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 13);
(1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 14);
(1R,4R)-4-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 15);
(8S,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 16);
(8R,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 17);
1-(3-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 18);
1-(3-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 19);
(1R,4R)-4-((E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 20);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 21);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 22);
(E)-1-(3-(8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 23);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 24);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 25);
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 26);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 27).
В еще одном варианте осуществления соединение выбрано из
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 2);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 6);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 8);
(8S,E)-N4-((1R,4S)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4,12-дикарбоксамида (соединение 12);
(1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c’d’]диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 14).
В другом аспекте настоящего изобретения предложена фармацевтическая композиция для лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие, содержащая соединение формулы (II) или его фармацевтически приемлемую соль согласно данной заявке и по меньшей мере одно или более фармацевтически приемлемых вспомогательных веществ.
В еще одном аспекте настоящего изобретения предложено применение соединения формулы (II) или его фармацевтически приемлемой соли согласно данной заявке для изготовления лекарственного препарата, предназначенного для лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие.
В еще одном аспекте настоящего изобретения предложен способ лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие на субъекта, нуждающегося в этом, при этом способ включает введение субъекту терапевтически эффективного количества соединения формулы (II) или его фармацевтически приемлемой соли согласно данной заявке.
В одном варианте осуществления заболевание или состояние представляет собой рак или одно или более инфекционных заболеваний.
В еще одном варианте осуществления заболевание или состояние представляет собой рак, где рак представляет собой одно или более из солидных опухолей, лейкоза, лимфомы или их комбинацию.
В еще одном варианте осуществления заболевание или состояние представляет собой одно или более инфекционных заболеваний, где инфекционные заболевания представляют собой вирусную инфекцию, бактериальную инфекцию или их комбинацию.
В еще одном варианте осуществления рак выбран из рака головного мозга, рака почки, рака яичка, рака уретры, рака прямой кишки, рака фаллопиевых труб, рака полового члена, рака влагалища, рака желудка, рака кожи, рака печени, гастроинтестинальных стромальных опухолей, рака уротелия, рака щитовидной железы, рака паращитовидной железы, рака надпочечника, рака кости, рака полости рта, рака яичника, рака матки, плоскоклеточной карциномы головы и шеи, рака эндометрия, рака желчного пузыря, рака почки, рака мочевого пузыря, рака ротоглотки, рака лимфатического узла, глиобластомы, астроцитомы, мультиформной глиобластомы или типов саркомы мягких тканей, фибросаркомы, хондросаркомы, гемангиомы, тератомы, липомы, миксомы, фибромы, рабдомиомы, тератомы, холангиокарциномы, миеломы, саркомы Юинга, миеломы, лимфомы Ходжкина, неходжкинской лимфомы, фолликулярной лимфомы, лимфомы из клеток мантийной зоны, лимфомы Беркитта, лимфобластной Т-клеточной лимфомы, лимфомы из клеток маргинальной зоны, кожной Т-клеточной лимфомы, лимфомы ЦНС, мелкоклеточной лимфоцитарной лимфомы, лимфоплазмоцитарной лимфомы, диффузной В-крупноклеточной лимфомы (DLBCL), периферической T-клеточной лимфомы, анапластической крупноклеточной лимфомы, первичной медиастинальной лимфомы, грибовидного микоза, мелкоклеточной лимфомы с нерасщепленными ядрами, лимфобластной лимфомы, иммунобластной лимфомы, первичной эффузионной лимфомы, HIV-ассоциированных (или связанных со СПИД) лимфом, лимфобластного T-клеточного лейкоза, хронического миелогенного лейкоза, острого лимфобластного T-клеточного лейкоза, лимфобластного T-клеточного лейкоза, острого миелобластного лейкоза, волосатоклеточного лейкоза, хронического нейтрофильного лейкоза, лейкоза из клеток мантийной ткани, острого мегакариоцитарного лейкоза, множественной миеломы, мегакариобластного лейкоза, эритролейкемии, плазмоцитомы, промиелоцитарного лейкоза, хронического миеломоноцитарного лейкоза, миелодиспластического синдрома, миелофиброза, хронического миелолейкоза, истинной полицитемии, тромбоцитемии, хронического лимфоцитарного лейкоза, пролимфоцитарного лейкоза, волосатоклеточного лейкоза, макроглобулинемии Вальденстрема, болезни Кастлемана, хронического нейтрофильного лейкоза, иммунобластного крупноклеточного лейкоза и плазмоцитомы.
В еще одном варианте осуществления заболевание или состояние представляет собой инфекцию, обусловленную HIV, HPV, HCV, HBV, альфавирусом, ротавирусом или вирусом гриппа.
Краткое описание графических материалов
Сопутствующие графические материалы, которые включены в данный документ и образуют часть описания, иллюстрируют аспекты настоящего описания и вместе с описанием дополнительно служат для объяснения принципов аспектов и для обеспечения возможности получения и применения аспектов специалистом в рассматриваемой области техники. Графические материалы предназначены исключительно для иллюстративных целей, демонстрируют иллюстративные неограничивающие варианты осуществления и не обязательно изображены в масштабе.
На фигуре 1A продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 2, на модели мышей BALB/c с эктопическим аллотрансплантатом CT26 в отношении снижения объема опухоли, который свидетельствует о том, что соединение 2 обеспечивает снижение объема опухоли, при этом у 7 из 9 субъектов проявляется полная регрессия опухоли. Соединение 2 вводили субъектам (n = 9) в указанной дозе в дни 1, 4 и 8.
На фигуре 1B продемонстрирован эффект соединения 2 на модели мышей BALB/c с эктопическим аллотрансплантатом CT26 в отношении изменения веса тела у тех же субъектов, что и на фигуре 1A.
На фигуре 2A продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 6, на модели мышей BALB/c с эктопическим аллотрансплантатом CT26 в отношении снижения объема опухоли, который свидетельствует о том, что соединение 6 обеспечивает снижение объема опухоли, при этом у 7 из 9 субъектов проявляется полная регрессия опухоли. Соединение 6 вводили субъектам (n = 9) в указанной дозе в дни 1, 4 и 8.
На фигуре 2B продемонстрирован эффект соединения 6 на модели мышей BALB/c с эктопическим аллотрансплантатом CT26 в отношении изменения веса тела у тех же субъектов, что и на фигуре 2A.
На фигуре 3A продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 8, на модели мышей BALB/c с эктопическим аллотрансплантатом CT26 в отношении снижения объема опухоли, который свидетельствует о том, что соединение 8 обеспечивает снижение объема опухоли, при этом у 5 из 9 субъектов проявляется полная регрессия опухоли. Соединение 8 вводили субъектам (n = 9) в указанной дозе в дни 1, 4 и 8.
На фигуре 3B продемонстрирован эффект соединения 8 на модели мышей BALB/c с эктопическим аллотрансплантатом CT26 в отношении изменения веса тела у тех же субъектов, что и на фигуре 3A.
На фигуре 4A продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 12, на модели мышей BALB/c с эктопическим аллотрансплантатом CT26, в отношении снижения объема опухоли, который свидетельствует о том, что соединение 12 обеспечивает снижение объема опухоли, при этом у 8 из 10 субъектов проявляется полная регрессия опухоли. Соединение 12 вводили субъектам (n = 10) в указанной дозе в дни 1, 4 и 8.
На фигуре 4B продемонстрирован эффект соединения 12 на модели мышей BALB/c с эктопическим аллотрансплантатом CT26 в отношении изменения веса тела у тех же субъектов, что и на фигуре 4A.
На фигуре 5A продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 14, на модели мышей BALB/c с эктопическим аллотрансплантатом CT26, в отношении снижения объема опухоли, который свидетельствует о том, что соединение 14 обеспечивает снижение объема опухоли, при этом у 6 из 9 субъектов проявляется полная регрессия опухоли. Соединение 14 вводили субъектам (n = 9) в указанной дозе в дни 1, 4 и 8.
На фигуре 5B продемонстрирован эффект соединения 14 на модели мышей BALB/c с эктопическим аллотрансплантатом CT26 в отношении изменения веса тела у тех же субъектов, что и на фигуре 5A.
На фигуре 6 продемонстрирован эффект соединения 2 при высокой дозе на модели мышей BALB/c с эктопическим аллотрансплантатом CT26, при этом соединение 2 при двух разных дозах обеспечивает снижение объема опухоли (линии графика для двух доз соединения 2 перекрываются). Соединение 2 вводили субъектам (n = 10) в указанной дозе в дни 1, 4 и 8.
На фигуре 7A продемонстрирована полученная с помощью проточной цитометрии диаграмма, отображающая инфильтрацию в опухоль CD3+CD8+ T-клеток в процентах через 96 ч. после обработки носителем.
На фигуре 7B продемонстрированы иллюстративные данные полученной с помощью проточной цитометрии диаграммы, отображающие инфильтрацию в опухоль CD3+CD8+ T-клеток в процентах через 96 ч. после обработки иллюстративным соединением по настоящему изобретению, соединением 2, которые свидетельствуют о более высоком проценте инфильтрации T-клеток по сравнению с таковым для контроля, представляющего собой среду-носитель.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное описание иллюстративных вариантов осуществления предназначено для чтения совместно с сопутствующими графическими материалами, которые следует рассматривать в качестве части всего письменного описания. Кроме того, заголовки разделов, применяемые в данном документе, предназначены только для организационных целей и не должны трактоваться как ограничивающие описанный объект изобретения.
Общие термины, применяемые в формуле, можно определить как указано ниже; однако указанное значение не следует интерпретировать как ограничивающее объем термина per se.
Термин «алкил», применяемый в данном документе, относится к углеводородному радикалу, полученному из алкана, который содержит в остове только атомы углерода и водорода, не содержит ненасыщенных связей, содержит от одного до шести атомов углерода и присоединен к остатку молекулы одинарной связью, например к метилу, этилу, н-пропилу, 1-метилэтилу (изопропилу), н-бутилу, н-пентилу, 1,1-диметилэтилу (трет-бутилу) и т. п. Если не представлено или не указано обратное, все алкильные группы, описанные или заявленные в данном документе, могут представлять собой алкильные группы с неразветвленной цепью или с разветвленной цепью, замещенные или незамещенные.
Термин «пергалогеналкил», применяемый в данном документе, относится к алкильной группе, которая определена в данном документе выше, в которой все атомы водорода указанной алкильной группы замещены галогеном. Примерами пергалогеналкильной группы являются трифторметил, пентафторэтил и т. п.
Термин «гетероароматическое кольцо», применяемый в данном документе, относится к 5-6-членной моноциклической ароматической кольцевой системе, содержащей 1-2 гетероатома в кольце, выбранных из O, N или S.
Термин «циклоалкил» или «карбоцикл», применяемый в данном документе, относится к неароматической моно- или мультициклической кольцевой системе, содержащей от 3 до 12 атомов углерода, которая может включать или исключать циклопропил, циклобутил, циклопентил, циклогексил и т. п. Если не представлено или не указано обратное, то все циклоалкильные группы, описанные или заявленные в данном документе, могут быть замещенными или незамещенными.
Термин «моноциклический C3-C5циклоалкил», применяемый в данном документе, относится к замещенной или незамещенной неароматической моноциклической кольцевой системе, содержащей от 3 до 5 атомов углерода, которая может включать или исключать циклопропил, циклобутил, циклопентил и т. п.
Термин «ароматическое кольцо», применяемый в данном документе, относится к ароматической углеводородной кольцевой системе. Примеры включают бензольное кольцо и т. п.
Термин «арил», применяемый в данном документе, относится к моновалентной моноциклической, бициклической или трициклической ароматической углеводородной кольцевой системе. Примеры арильных групп включают фенил, нафтил, антраценил, флуоренил, инденил, азуленил и т. п.
Термин «аралкил», если не указано иное, относится к алкиларилу, соединенному посредством алкильной части (где алкил является таким, как определено выше), и алкильная часть содержит 1-6 атомов углерода, и арил является таким, как определено выше. Примеры аралкильных групп включают бензил, этилфенил, пропилфенил, нафтилметил и т. п.
Термин «гетероарил», применяемый в данном документе, относится к 5-14-членной моноциклической, бициклической или трициклической кольцевой системе с 1-4 гетероатомами в кольце, выбранными из O, N или S, при этом остальные атомы кольца представляют собой атомы углерода (с соответствующими атомами водорода, если не указано иное), где по меньшей мере одно кольцо в кольцевой системе является ароматическим.
Термин «гетероцикл» или «гетероциклил», если не указано иное, относится к замещенной или незамещенной неароматической, моноциклической, бициклической, трициклической или мостиковой/сочлененной/спирокольцевой системе, содержащей 3-15-членное кольцо, которое состоит из атомов углерода и одного или более (например, 2 или 3) гетероатомов, независимо выбранных из N, O, S, P(O)(OR4), P(O)(R4a) или S(O)2. Точкой соединения может являться любой подходящий углерод или азот.
Термин «гетероарилалкил», применяемый в данном документе, относится к гетероарильной группе, присоединенной посредством алкильной части, где алкил содержит от 1 до 6 атомов углерода, и гетероарил является таким же, как определено в данном документе.
Термин «гетероциклилалкил», применяемый в данном документе, относится к гетероциклильной группе, присоединенной посредством алкильной части, где алкил содержит от 1 до 6 атомов углерода, и гетероциклил является таким же, как определено в данном документе.
Термин «оксо», применяемый в данном документе, относится к двухвалентному кислороду (=O), присоединенному к исходной группе. Например, оксо, присоединенный к углероду, образует карбонил, оксо, замещенный по циклогексану, образует циклогексанон.
Термин «пролекарство», применяемый в данном документе, относится к модифицированному соединению формулы (I) или формулы (II), где функциональная аминогруппа, группа карбоновой кислоты или гидроксигруппа дополнительно присоединена к профрагменту. В некоторых вариантах осуществления «профрагмент» относится к молекуле, выполняющей функцию защитной группы, которая скрывает функциональную группу в активном средстве, тем самым преобразовывая активное средство в пролекарство. Как правило, профрагмент будет присоединен к лекарственному средству посредством связи(связей), которая(которые) отщепляется(отщепляются) ферментативным или неферментативным способами in vivo, тем самым преобразовывая пролекарство в его активную форму. В некоторых вариантах осуществления профрагмент также может представлять собой активное средство. В некоторых вариантах осуществления профрагмент может быть связан с соединением формулы I. В некоторых вариантах осуществления профрагмент может быть связан с соединением формулы II.
В некоторых вариантах осуществления профрагмент может включать или исключать C1-C4карбоновые кислоты, C1-C4спирты, C1-C4альдегиды, C1-C4кетоны, отдельную аминокислоту или пептид. В некоторых вариантах осуществления профрагмент представляет собой отдельную аминокислоту, функциональные группы которой необязательно защищены. Способы образования пролекарств путем сочетания вышеупомянутых профрагментов и соединений формулы (I) или формулы (II) можно осуществлять путем применения традиционных способов образования сложных эфиров, амидов или ацеталей, которые хорошо известны в данной области техники. В качестве неограничивающего примера функциональную группу, представляющую собой карбоновую кислоту в соединении формулы (I) или формулы (II), можно вводить в реакцию с этанолом в присутствии EDC с образованием сложного эфира.
В некоторых вариантах осуществления профрагмент представляет собой молекулу для нацеливания. В некоторых аспектах профрагмент представляет собой субстрат для инфлюксных или эффлюксных переносчиков на клеточной мембране, например таких, которые описаны в работе Gaudana, R. et al. AAPS Journal, 12(3):348-360 (2012), включенной в данный документ посредством ссылки во всей своей полноте. Профрагмент может представлять собой, например, химически связанный биотин или химически связанный D-серин.
Термин «таутомер» или «таутомерная форма», применяемый в данном документе, относится к структурным изомерам с разными значениями энергии, которые являются взаимопревращаемыми ввиду низкого энергетического барьера. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимопревращения, обусловленные миграцией протона, которые могут включать или исключать виды кето-енольной изомеризации. Валентные таутомеры включают взаимопревращения путем реорганизации некоторых из связывающих электронов.
Термин «геометрический изомер», применяемый в данном документе, относится к E- или Z-геометрическим изомерам (например, цис- или транс-) относительно двойной связи.
Все таутомерные формы и их возможные геометрические изомеры, включая без ограничения формулу (s), формулу (r) и формулу (t), формул и соединений, описанных в данном документе, предназначены для включения в объем настоящего изобретения.
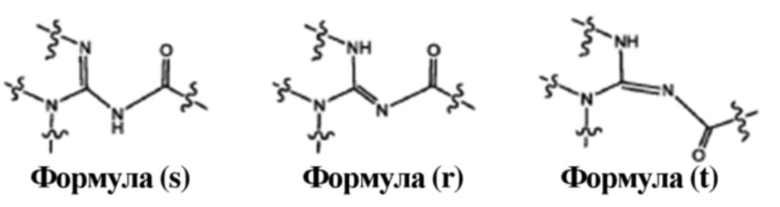
Соединения по настоящему изобретению могут иметь один или более хиральных центров. Абсолютная стереохимия в каждом хиральном центре может представлять собой «R» или «S». Соединения по настоящему изобретению включают все диастереомеры и энантиомеры и их смеси. Если специально не указано иное, то упоминание одного стереоизомера используется в отношении любого из возможных стереоизомеров. Всякий раз, когда стереоизомерная композиция не определена, следует понимать, что включены все возможные стереоизомеры.
Термин «стереоизомер», применяемый в данном документе, означает соединение, состоящее из одинаковых атомов, связанных с помощью одинаковых связей, но имеющих различные трехмерные структуры, которые не являются взаимозаменяемыми. Трехмерные структуры называют конфигурациями. Применяемый в данном документе термин «энантиомер» относится к двум стереоизомерам, молекулы которых не являются совпадающими при наложении зеркальными отображениями друг друга. Термин «хиральный центр» означает атом углерода, к которому присоединены четыре различные группы. Применяемый в данном документе термин «диастереомеры» означает стереоизомеры, которые не являются энантиомерами. Термины «рацемат» или «рацемическая смесь» означают смесь равных частей энантиомеров.
Применяемые в данном документе термины «осуществление лечения» или «лечение» статуса, заболевания, нарушения, состояния или синдрома включают: (a) предупреждение или задержку возникновения клинических симптомов статуса, заболевания, нарушения, состояния или синдрома, развивающихся у субъекта, который может страдать от статуса, заболевания, нарушения, состояния или синдрома или быть предрасположенным к таковым, однако еще не испытывать или не проявлять клинических или субклинических симптомов статуса, заболевания, нарушения, состояния или синдрома; (b) подавление статуса, заболевания, нарушения, состояния или синдрома, т. е. купирование или снижение темпов развития заболевания или по меньшей мере одного из его клинических или субклинических симптомов; c) снижение тяжести заболевания, нарушения или состояния или по меньшей мере одного из их клинических или субклинических симптомов; и/или (d) облегчение заболевания, т. е. обеспечение регрессии статуса, нарушения или состояния или по меньшей мере одного из их клинических или субклинических симптомов.
Термин «субъект», применяемый в данном документе, относится к млекопитающему и включает без ограничения человека, крупный рогатый скот, лошадиных, кошачьих, собачьих, грызунов, приматов или других животных (таких как домашние животные или не домашние животные). Субъектом предпочтительно является человек, который может являться мужчиной или женщиной. Субъект также может относится к взрослому или ребенку.
Термин «терапевтически эффективное количество», применяемый в данном документе, относится к количеству соединения, которое при введении субъекту, нуждающемуся в этом, является достаточным, чтобы вызвать требуемый эффект. «Терапевтически эффективное количество» будет варьировать в зависимости от соединения, заболевания и его тяжести, возраста, веса, физического состояния и чувствительности субъекта, подлежащего лечению. Терапевтически эффективное количество также предпочтительно представляет собой такое, при котором любые токсичные или вредоносные эффекты вещества/молекулы, агониста или антагониста могут перевешиваться терапевтически благоприятными эффектами.
Термин «фармацевтический состав», применяемый в данном документе, относится к препарату, который находится в такой форме, которая обеспечивает биологическую активность активного ингредиента, содержащегося в нем, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, для введения которому предназначен данный состав.
«Фармацевтически приемлемый носитель», применяемый в данном документе, относится к ингредиенту в фармацевтическом составе, отличному от активного ингредиента, который можно безопасно вводить субъекту. Фармацевтически приемлемый носитель включает без ограничения буфер, вспомогательное вещество, стабилизатор или консервант. Подходящие носители и разбавители включают забуференные, водные растворы, солевой раствор, декстрозу, глицерин, изотонические солевые растворы, например фосфатно-солевой буферный раствор, изотоническая вода и т. п., и их комбинации. В некоторых вариантах осуществления носители могут включать пропиленгликоль, диметилизосорбид и воду, и еще более конкретно фосфатно-солевой буферный раствор, изотоническую воду, деионизированную воду, спирты с одной функциональной группой и симметричные спирты.
Применяемый в данном документе термин «нарушение, при котором модуляция белка STING и/или белкового комплекса STING может обеспечивать благоприятный эффект» включает любое заболевание, нарушение или состояние, при которых функция или активность белка STING и/или белкового комплекса STING может быть вовлечена в лечение заболевания, нарушения или состояния. В одном варианте осуществления заболевание, нарушение или состояние может включать или исключать рак или инфекционное заболевание.
Термин «предусматривающий», который является синонимичным с «включающий», «содержащий» или «характеризующийся», является включительным или неограничивающим и не исключает дополнительные, неупомянутые элементы или ингредиенты из лекарственного препарата (или стадии в случае способа). Выражение «состоящий из» исключает любой элемент, стадию или ингредиент, не указанные для данного лекарственного препарата (или стадии в случае способа). Выражение «по сути состоящий из» относится к указанным материалам и материалам, которые не оказывают существенного влияния на основные и новые характеристики лекарственного препарата (или стадии в случае способа).
Термин «опухоль», применяемый в данном документе, относится ко всем видам роста и пролиферации неопластических клеток, независимо от того, являются они злокачественными или доброкачественными, и всем предраковым и раковым клеткам и тканям. Термины «рак», «раковый», «нарушение, связанное с пролиферацией клеток», «пролиферативное нарушение» и «опухоль» не являются взаимно исключающими, как указано в данном документе.
Термины «рак» и «раковый», применяемые в данном документе, означают или описывают физиологическое состояние у субъекта, которое, как правило, характеризуется неконтролируемым ростом и/или пролиферацией клеток. Некоторые виды рака состоят из быстро делящихся клеток, тогда как другие состоят из клеток, которые делятся медленнее, чем в норме. Примеры типов рака могут включать или исключать, например, карциному, лимфому (например, лимфому Ходжкина и неходжкинскую лимфому), бластому, саркому и лейкоз. Более конкретные примеры таких видов рака могут включать или исключать, например, плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, рак брюшной полости, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, лейкоз и другие лимфопролиферативные нарушения и различные типы рака головы и шеи.
Выражение «фармацевтически приемлемая соль», применяемое в данном документе, относится к одной или более фармацевтически приемлемым органическим или неорганическим солям соединения по настоящему изобретению. Иллюстративные соли включают без ограничения сульфатные, цитратные, ацетатные, оксалатные, хлоридные, бромидные, йодидные, нитратные, бисульфатные, фосфатные, кислотные фосфатные, изоникотинатные, лактатные, салицилатные, кислые цитратные, тартратные, олеатные, таннатные, пантотенатные, битартратные, аскорбатные, сукцинатные, малеатные, гентизинатные, фумаратные, глюконатные, глюкуронатные, сахаратные, формиатные, бензоатные, глутаматные, метансульфонатные «мезилатные», этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные (т. е. 1,1′-метилен-бис(2-гидрокси-3-нафтоатные)) соли. Фармацевтически приемлемая соль может предусматривать включение другой молекулы, такой как ион ацетата, ион сукцината или другой противоион. В некоторых вариантах осуществления противоион представляет собой любой органический или неорганический фрагмент, который стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может содержать более одного заряженного атома в своей структуре. В случаях, когда несколько заряженных атомов являются частью фармацевтически приемлемой соли, для нее может существовать несколько противоионов. Следовательно, фармацевтически приемлемая соль может содержать один или более заряженных атомов и/или один или более противоионов.
В некоторых вариантах осуществления, если соединение по настоящему изобретению представляет собой основание, то требуемую фармацевтически приемлемую соль получают с помощью любого подходящего способа, доступного в данной области техники, например обработки свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и т. п., или органической кислотой, такой как уксусная кислота, трифторуксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота или т. п.
В некоторых вариантах осуществления, если соединение по настоящему изобретению представляет собой кислоту, то требуемую фармацевтически приемлемую соль получают с помощью любого подходящего способа, например обработки свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочноземельного металла или т. п. Иллюстративные примеры подходящих солей включают без ограничения органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
Применяемый в данном документе термин «сольват» относится к ассоциации или комплексу, состоящим из одной или более молекул растворителя и соединения по настоящему изобретению. Примеры растворителей, с которыми образуются сольваты, включают без ограничения воду, изопропанол, этанол, метанол, DMSO, этилацетат, уксусную кислоту и этаноламин.
Соединения
Многочисленные исследования показали, что активация пути STING в находящихся в опухоли APC хозяина необходима для индуцирования спонтанного ответа CD8+ T-клеток на антигены, происходящие из опухоли, in vivo (Immunity, 2014, 41:830-842). Большое количество данных указывает на то, что наличие опухоль-инфильтрирующих лимфоцитов (TIL) коррелирует с благоприятным прогнозом для разнообразных злокачественных опухолей (J. Transl. Med. 2012, 10:205) и предсказывает положительный клинический исход в ответ на несколько стратегий иммунотерапии (Cancer J. 2012, 18:153-159). Активация STING частично способствует противоопухолевой активности химиотерапевтических средств, а также лучевой терапии (Immunity, 2014, 41:843-852). Дополнительно, было открыто, что активация и сигнальные пути с участием STING являются важными для защиты от развития рака, что обеспечивается посредством стимуляции противоопухолевых иммунных ответов. Таким образом, активация STING представляет собой потенциальный иммунотерапевтический подход в лечении рака.
Исследования показали, что прямое внутриопухолевое введение (I.Tu.) модифицированных CDN в стабильную меланому B16F10, карциному толстой кишки CT26 и карциному молочной железы 4T1 привело к быстрой и значительной регрессии опухоли и долговременному системному противоопухолевому иммунитету. Таким образом, активация пути с участием STING в TME посредством специфических агонистов может являться эффективной терапевтической стратегией для стимулирования широкомасштабного вызываемого опухолью прайминга Т-клеток и тем самым лечения рака. (J. Immunol. 2013, 190:5216-5225; Cell Rep. 2015, 19, 11(7):1018-30). Кроме CDN, другие классы соединений могут активировать STING.
Наряду с противораковым механизмом STING, активация STING впоследствии также приводит к индуцированию нескольких противовирусных генов, которые включают IFN-β и несколько стимулируемых интерферонами генов (ISG). Удаление STING в фибробластах эмбриона мыши сделало их подверженными инфекции вирусами с геномом в виде цепочки рибонуклеиновой кислоты отрицательной полярности, включая вирус везикулярного стоматита. Было показано, что мышиный агонист STING первого поколения, DMXAA, является эффективным во многих моделях вирусов in-vivo, например в мышиной модели HBV (вирус гепатита В), полученной путем гидродинамического введения ДНК, модели вируса чикунгунья, модели штамма гриппа H1N1 PR8, что демонстрирует применимость агониста STING в качестве противовирусного средства против многих вирусных инфекций (Nature, 2008, 455:674-678; PLoS Pathog. 2015, 11:12; Antimicrob. Agents Chemother. 2015, 59(2):1273-1281; J Leukocyte Biol. 2011, 89(3):351-357).
Авторы настоящего изобретения установили, что модификация одной или более субъединиц присоединенного соединения может обеспечивать значительное повышение биологической доступности и фармакокинетики, так что введение ассиметрично присоединенных соединений обеспечивает значительное преимущество в отношении активации белка STING. Более того, авторы настоящего изобретения установили, что включение гидрофильных фрагментов (например, способных к ионизации и/или высокополярных) в одну или более субъединиц присоединенного соединения может обеспечивать повышение растворимости и облегчение составления с обеспечением эффективной активации белка STING, который можно применять для лечения инфекционного заболевания и/или рака.
Соединения, раскрытые в данном документе и их таутомерные формы, стереоизомеры, пролекарства могут быть получены, например, посредством методик, широко известных в органическом синтезе и знакомых практикующему специалисту средней квалификации в области техники данного изобретения. Кроме того, с помощью способов, описанных в данном документе, можно обеспечить синтез соединений по настоящему изобретению. Однако данные способы не являются единственными, посредством которых могут быть синтезированы соединения, описанные в настоящем изобретении. Дополнительно, последовательности различных стадий синтеза, описанных в данном документе, могут чередоваться с целью обеспечения требуемых соединений.
В некоторых вариантах осуществления в настоящем изобретении предусмотрены соединение формулы (I), формулы (II) или его фармацевтически приемлемая соль, предназначенные для применения в лечении заболевания или состояния, при которых активация белка STING и/или белкового комплекса STING оказывает благоприятное действие.
Способы
В некоторых вариантах осуществления в настоящем изобретении предусмотрено применение соединения или фармацевтической композиции формулы (I), формулы (II) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для применения в лечении заболевания или состояния, при которых активация белка STING и/или белкового комплекса STING оказывает благоприятное действие.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения заболевания или состояния, при которых активация белка STING и/или белкового комплекса STING оказывает благоприятное действие на субъекта, нуждающегося в этом, при этом способ включает введение терапевтически эффективного количества соединения формулы (I), формулы (II) или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения рака или одного или более инфекционных заболеваний у субъекта, нуждающегося в этом, при этом способ включает введение субъекту терапевтически эффективного количества соединения формулы (I), формулы (II), или пролекарства на его основе, или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения рака, где рак может включать или исключать один или более типов солидных опухолей, один или более типов лейкоза, один или более типов лимфомы или их комбинацию.
В некоторых вариантах осуществления солидные опухоли, лечение которых можно осуществлять посредством соединений по настоящему изобретению, могут включать или исключать рак молочной железы, рак поджелудочной железы, рак легкого, рак толстой кишки, колоректальный рак, рак головного мозга, рак почки, рак яичка, рак уретры, рак прямой кишки, рак фаллопиевых труб, рак полового члена, рак влагалища, рак желудка, рак кожи, меланому, рак печени, гастроинтестинальные стромальные опухоли, рак уротелия, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, рак кости, рак полости рта, рак яичника, рак матки, плоскоклеточную карциному головы и шеи, рак эндометрия, рак желчного пузыря, рак мочевого пузыря, рак ротоглотки, рак лимфатического узла, глиобластому, астроцитому, мультиформную глиобластому или типы саркомы мягких тканей, фибросаркому, хондросаркому, гемангиому, тератому, липому, миксому, фиброму, рабдомиому, тератому, холангиокарциному, саркому Юинга. Примеры лейкоза, лечение которого можно осуществлять посредством соединений по настоящему изобретению могут включать или исключать лимфобластный T-клеточный лейкоз, хронический миелолейкоз, острый лимфобластный T-клеточный лейкоз, острый миелобластный лейкоз, волосатоклеточный лейкоз, хронический нейтрофильный лейкоз, лейкоз из клеток мантийной ткани, острый мегакариоцитарный лейкоз, множественную миелому, мегакариобластный лейкоз, эритролейкоз, плазмоцитому, промиелоцитарный лейкоз, хронический миеломоноцитарный лейкоз, миелодиспластический синдром, миелофиброз, хронический миелогенный лейкоз, истинную полицитемию, тромбоцитемию, хронический лимфоцитарный лейкоз, пролимфоцитарный лейкоз, волосатоклеточный лейкоз, макроглобулинемию Вальденстрема, болезнь Кастлемана, хронический нейтрофильный лейкоз, иммунобластный крупноклеточный лейкоз, плазмоцитому и типы лейкоза в любой другой части тела. Примеры лимфомы, лечение которой можно осуществлять посредством соединений по настоящему изобретению могут включать или исключать лимфому Ходжкина, неходжкинскую лимфому, фолликулярную лимфому, лимфому из клеток мантийной зоны, лимфому Беркитта, лимфобластную T-клеточную лимфому, лимфому из клеток маргинальной зоны, кожную T-клеточную лимфому, лимфому ЦНС, мелкоклеточную лимфоцитарную лимфому, лимфоплазмоцитарную лимфому, диффузную В-крупноклеточную лимфому (DLBCL), периферическую Т-клеточную лимфому, анапластическую крупноклеточную лимфому, первичную медиастинальную лимфому, грибовидный микоз, мелкоклеточную лимфому с нерасщепленными ядрами, лимфобластную лимфому, иммунобластную лимфому, первичную эффузионную лимфому и HIV-ассоциированные лимфомы (или связанные со СПИД). Вышеуказанные солидные опухоли можно моделировать с применением способа и клеточных линий, описанных в примерах.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения одного или более инфекционных заболеваний, где инфекционные заболевания могут включать или исключать вирусную инфекцию, бактериальную инфекцию или их комбинацию. Примеры вирусной инфекции, лечение которой можно осуществлять посредством соединений по настоящему изобретению, могут включать или исключать вирус иммунодефицита человека (HIV), вирус папилломы человека (HPV), вирус гепатита C (HCV), вирус гепатита B (HBV), вирус гриппа (из семейства Orthomyxoviridae, что может включать или исключать Alphainfluenzavirus (грипп типа A - все подтипы или серотипы) и грипп типа B), вирус из рода Coronavirus (что может включать или исключать SARS-CoV-1 и SARS-CoV-2), вирус из рода Alphavirus, вирус из рода Rotavirus, вирус Сендай, вирус осповакцины, респираторно-синцитиальный вирус, вирус Ласса (Arenaviridae), вирус бешенства (Rhabdoviridae), вирус лихорадки Западного Нила, вирус Денге, вирус японского энцефалита и другие из семейства Flaviviridae, РНК-содержащий вирус, ДНК-содержащий вирус, вирус, принадлежащий к семейству Alphaflexiviridae, Astroviridae, Alphatetraviridae, Alvernaviridae, Asfarviridae, Ampullaviridae, Adenoviridae, Ascoviridae, Betaflexiviridae, Bromoviridae, Barnaviridae, Bicaudaviridae, Baculoviridae Closteroviridae, Caliciviridae, Carmotetraviridae, Clavaviridae, Corticoviridae, Dicistroviridae, Endornaviridae, Filoviridae, Globuloviridae, Guttaviridae, Geminiviridae, Hytrosaviridae, Leviviridae, Luteoviridae, Lipothrixviridae, Mesoniviridae, Marnaviridae, Metaviridae, Malacoherpesviridae, Nodaviridae, Nyamiviridae, Nimaviridae, Nanoviridae, Piconaviridae, Partitiviridae, Picobirnaviridae, Paramyxoviridae, Poxviridae, Pandoraviridae, Polymaviridae, Phycodnaviridae, Papillomaviridae, Polydnaviruses, Polymaviridae, Permutotetraviridae, Potyviridae, Retroviridae, Siphoviridae, Sphaerolipoviridae, Virgaviridae, Togaviridae, Turriviridae, Tectiviridae.
Примеры бактериальной инфекции, лечение которой можно осуществлять посредством соединений по настоящему изобретению могут включать или исключать инфекции, вызванные бактериями, принадлежащими к родам Brucella, Clostridium, Clostrodium, Campylobacter, Enterococcus, Fransicella, Listeria, Legionella, Mycobacteria, Pseudomonas, Salmonella, Staphylococcus, Yersinia.
В некоторых вариантах осуществления в настоящем изобретении предусмотрена композиция, содержащая соединение формулы (I), формулы (II) или его фармацевтически приемлемую соль и одно или более дополнительных средств терапии.
В некоторых вариантах осуществления в настоящем изобретении предусмотрена композиция, содержащая соединение формулы (I), формулы (II), или пролекарство на его основе, или его фармацевтически приемлемую соль и одно или более дополнительных средств терапии, которые могут включать или исключать химиотерапию, иммунотерапию, лучевую терапию или их комбинацию.
Химиотерапия включает введение одного или более дополнительных химиотерапевтических средств, которые могут применяться в комбинации с соединениями формулы (I), формулы (II), или пролекарствами на их основе, или их фармацевтически приемлемой солью. Химиотерапевтические средства, которые можно применять в комбинации, могут включать или исключать ингибиторы топоизомеразы II, противоопухолевые антибиотики, антиметаболиты, ретиноиды, противовирусные средства, абиратерона ацетат, алтретамин, ангидровинбластин, ауристатин, бексаротен, бикалутамид, BMS 184476, 2,3,4,5,6-пентафтор-N-(3-фтор-4-метоксифенил)бензолсульфонамид, блеомицин, N,N-диметил-L-валил-L-валил-N-метил-L-валил-L-пролил-L-пролин-трет-бутиламид, кахектин, цемадотин, хлорамбуцил, циклофосфамид, 3',4'-дидегидро-4'-дезокси-8'-норвин-калейкобластин, доцетаксол, доксетаксел, циклофосфамид, карбоплатин, кармустин, цисплатин, криптофицин, циклофосфамид, цитарабин, дакарбазин (DTIC), дактиномицин, даунорубицин, децитабин, доластатин, доксорубицин (адриамицин), этопозид, 5-фторурацил, финастерид, флутамид, гидроксимочевину и гидроксимочевину с таксанами, ифосфамид, лиарозол, лонидамин, ломустин (CCNU), MDV3100, мехлоретамин (азотистый иприт), мелфалан, мивобулина изетионат, ризоксин, сертенеф, стрептозоцин, митомицин, метотрексат, таксаны, нилутамид, онапристон, паклитаксел, преднимустин, прокарбазин, RPR109881, страмустина фосфат, тамоксифен, тазонермин, таксол, третиноин, винбластин, винкристин, виндезина сульфат и винфлунин.
Дополнительные примеры химиотерапевтических средств включают трастузумаб (HERCEPTIN®, Genentech), эрлотиниб (TARCEVA®, Genentech/OSI Pharm.), доцетаксел (TAXOTERE®, Sanofi-Aventis), 5-FU (фторурацил, 5-фторурацил, № согласно CAS 51-21-8), гемцитабин (GEMZAR®, Lilly), PD-0325901 (№ согласно CAS 391210-10-9, Pfizer), цисплатин (цис-диаминдихлорплатин(II), № согласно CAS 15663-27-1), карбоплатин (№ согласно CAS 41575-94-4), паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Принстон, штат Нью-Джерси), пеметрексед (ALIMTA®, Eli Lilly), темозоломид (4-метил-5-оксо-2,3,4,6,8-пентазабицикло[4.3.0]нона-2,7,9-триен-9-карбоксамид, № согласно CAS 85622-93-1, TEMODAR®, TEMODAL®, Schering Plough), тамоксифен ((Z)-2-[4-(1,2-дифенилбут-1-енил)фенокси]-N,N-диметилэтанамин, NOLVADEX®, ISTUBAL®, VALODEX®) и доксорубицин (ADRIAMYCIN®), Akti-1/2, HPPD и рапамицин.
Дополнительные примеры химиотерапевтических средств включают оксалиплатин (ELOKCATIN®, Sanofi), бортезомиб (VELCADE®, Millennium Pharm.), сутент (SUNITINIB®, SU11248, Pfizer), летрозол (FEMARA®, Novartis), иматиниба мезилат (GLEEVEC®, Novartis), XL-518 (ингибитор Mek, Exelixis, WO 2007/044515), ARRY-886 (ингибитор Mek, AZD6244, Array BioPharma, Astra Zeneca), SF-1126 (ингибитор PI3K, Semafore Pharmaceuticals), BEZ-235 (ингибитор PI3K, Novartis), XL-147 (ингибитор PI3K, Exelixis), PTK787/ZK 222584 (Novartis), фулвестрант (FASLODEX®, AstraZeneca), лейковорин (фолиновая кислота), рапамицин (сиролимус, RAPAMUNE®, Wyeth), лапатиниб (TYKERB®, GSK572016, Glaxo Smith Kline), лонафарниб (SARASAR™, SCH 66336, Schering Plough), сорафениб (NEXAVAR®, BAY43-9006, Bayer Labs), гефитиниб (IRESSA®, AstraZeneca), иринотекан (CAMPTOSAR®, CPT-11, Pfizer), типифарниб (ZARNESTRA™, Johnson & Johnson), ABRAXANE™ (без кремофора), составы паклитаксела на основе альбуминовых наночастиц (American Pharmaceutical Partners, Шаумбург, штат Иллинойс), вандетаниб (rINN, ZD6474, ZACTIMA®, AstraZeneca), хлорамбуцил, AG1478, AG1571 (SU 5271; Sugen), темсиролимус (TORISEL®, Wyeth), пазопаниб (GlaxoSmithKline), канфосфамид (TELCYTA®, Telik), тиотепу и циклосфосфамид (CYTOKCAN®, NEOSAR®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, в том числе алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (в частности, буллатацин и буллатацинон); камптотецин (в том числе синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (в том числе его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, оксида мехлорэтамина гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как ендииновые антибиотики (например, калихеамицин, калихеамицин гамма-1I, калихеамицин омега-I1 (Angew Chem. Intl. Ed. Engl. (1994) 33:183-186); динемицин, динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарзиностатин и родственные хромофоры антибиотиков на основе хромопротеина ендиина), аклациномизины, актиномицин, антрамицин, азасерин, блеомицины, кактиномицин, карабицин, каминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, неморубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калюстерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; средство для восполнения недостатка фолиевой кислоты, такое как фолиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиния ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; комплекс полисахаридов PSK® (JHS Natural Products, Юджин, штат Орегон); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2′,2″-трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепу; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин (NAVELBINE®); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин (XELODA®, Roche); ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевую кислоту; и фармацевтически приемлемые соли, кислоты и производные любого из указанного выше.
Также в определение «химиотерапевтическое средство» включены: (i) антигормональные средства, которые контролируют или подавляют действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), в том числе, например, тамоксифен (в том числе NOLVADEX®; тамоксифена цитрат), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и FARESTON® (торемифена цитрат); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, который контролирует выработку эстрогена в надпочечных железах, такие как, например, 4(5)-имидазолы, аминоглютетимид, MEGASE® (мегестрола ацетат), AROMASIN® (эксеместан; Pfizer), форместани, фадрозол, RIVISOR® (ворозол), FEMARA® (летрозол; Novartis) и ARIMIDEX® (анастрозол; AstraZeneca); (iii) антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (аналог нуклеозида цитозина 1,3-диоксолан); (iv) ингибиторы протеинкиназы, такие как ингибиторы MEK (WO 2007/044515); (v) ингибиторы липидкиназы; (vi) антисмысловые олигонуклеотиды, в частности те, которые ингибируют экспрессию генов в сигнальных путях, вовлеченных в пролиферацию аномальных клеток, например PKC-альфа, Raf и H-Ras, такие как облимерсен (GENASENSE®, Genta Inc.); (vii) рибозимы, такие как ингибиторы экспрессии VEGF (например, ANGIOZYME®), и ингибиторы экспрессии HER2; (viii) вакцины, такие как вакцины для генной терапии, например ALLOVECTIN®, LEUVECTIN® и VAXID®; rIL-2 PROLEUKIN®; ингибиторы топоизомеразы 1, такие как LURTOTECAN®; rmRH ABARELIX®; (ix) антиангиогенные средства, такие как бевацизумаб (AVASTIN®, Genentech); и фармацевтически приемлемые соли, кислоты и производные любого из указанного выше.
Также в определение «химиотерапевтическое средство» включены: терапевтические антитела, такие как алемтузумаб (Campath), бевацизумаб (AVASTIN®, Genentech); цетуксимаб (ERBITUX®, Imclone); панитумумаб (VECTIBIX®, Amgen), ритуксимаб (RITUXAN®, Genentech/Biogen Idec), пертузумаб (OMNITARG™, 2C4, Genentech), трастузумаб (HERCEPTIN®, Genentech), тозитумомаб (Bexxar, Corixia) и конъюгат антитела и лекарственного средства, гемтузумаб-озогамицин (MYLOTARG®, Wyeth).
Иммунотерапия включает введение одного или более дополнительных иммуностимулирующих средств, которые могут применяться в комбинации с соединением формулы (I), формулы (II) или его фармацевтически приемлемой солью. Иммуностимулирующие средства, которые можно применять в комбинации в данном документе включают адъюванты вакцин, которые могут включать или исключать агонисты Toll-подобного рецептора, блокаторы контрольных точек иммунного ответа T-клеток, антитело к CTLA4, PD-1, PD-L1, TIM3, OX40, LAG3, B7-H3, GITR, 4-1BB, ICOS, CD40 и KIR. Примеры антагонистов CTLA-4 и PD-1 могут включать или исключать ипилимумаб, тремелимумаб, ниволумаб, пембролизумаб, CT-011, AMP-224 и MDX-1106.
Введение
В некоторых вариантах осуществления соединения формулы (I) или формулы (II), в том числе иллюстративные соединения 1-60, вводят посредством любого из путей, подходящих для состояния, подлежащего лечению. Подходящие пути могут включать или исключать пероральный, парентеральный (в том числе подкожный, внутримышечный, внутривенный, внутриартериальный, внутрикожный, интратекальный и эпидуральный), внутрибрюшинный (IP), трансдермальный, ректальный, назальный, местный (в том числе буккальный и подъязычный), вагинальный, внутрилегочный и интраназальный. В некоторых вариантах осуществления при осуществлении местного лечения соединения вводят посредством внутриопухолевого введения, в том числе перфузии, или другим способом приводят опухоль в контакт с ингибитором. Понятно, что предпочтительный путь может изменятся, например, в зависимости от состояния реципиента. В некоторых вариантах осуществления, где соединение вводят перорально, оно составлено в виде пилюли, капсулы, таблетки и т. д., с фармацевтически приемлемым носителем или вспомогательным веществом. В некоторых вариантах осуществления, где соединение вводят парентерально, оно составлено с фармацевтически приемлемым носителем для парентерального введения и в виде стандартной инъекционной лекарственной формы, описанной в данном документе.
В некоторых вариантах осуществления, соединения формулы (I) или формулы (II), например иллюстративные соединения 1-60, и аналоги любого из вышеуказанных соединений или пролекарства на основе любого из вышеуказанных соединений вводят с обеспечением системного действия, например посредством внутривенного, внутриартериального или внутрибрюшинного введения, с обеспечением таким образом конечной концентрации в кровотоке от примерно 0,001 до примерно 150 микромоль или более, вплоть до 200, 300, 400, 500, 600, 700, 800, 900 или 1000 микромоль. Конечная концентрация в кровотоке может составлять 0,001, 0,002, 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2., 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 100, 110, 120, 130, 140 или 150 микромоль или представлять собой любую концентрацию, находящуюся между любыми двумя упомянутыми числами, или большую, как описано выше, и любую концентрацию в пределах указанных диапазонов. Специалисты в данной области техники установят требуемые дозировки для одного или более активных средств, принимая во внимание природу этого средства и принципы, рассмотренные в данном документе выше.
В некоторых вариантах осуществления соединения формулы (I) или формулы (II) или пролекарства на их основе можно применять отдельно или в комбинации с одним или более дополнительными средствами или композицией, применимой в лечении конкретного нарушения. Совместное введение может обеспечивать улучшение в отношении облегчения или ослабления одного или более симптомов, снижения длительности или степени заболевания, задержки или замедления прогрессирования заболевания, ослабления, временного облегчения или стабилизации состояния заболевания, частичной или полной ремиссии, повышения длительности жизни и/или других благоприятных терапевтических результатов. Такие средства лечения можно вводить одновременно или последовательно в любом порядке с промежутком времени между введениями. Специалист в данной области техники легко установит, каким способом вводить средства или средства терапии, одновременно или последовательно и возможные промежутки времени между введениями. Средства терапии можно вводить посредством одинаковых или разных путей.
В некоторых вариантах осуществления лечение в соответствии с настоящим изобретением может предусматривать введение одного или более других средств субъекту. Например, можно вводить одно или более средств, применимых для улучшения общего состояния здоровья субъекта или снижения одного или более побочных эффектов терапии. Специалисты в данной области техники легко установят различные средства, введение которых обеспечит благоприятное действие, принимая во внимание, например, заболевание, которое подлежит лечению. В некоторых вариантах осуществления, где соединение формулы (I) или формулы (II) изначально вводят совместно с химиотерапевтическим средством, введение соединения формулы (I) или формулы (II) или пролекарств на его основе можно прекращать или постепенно снижать, в то же время введение химиотерапевтического средства продолжается.
Введение соединения формулы (I) или формулы (II) или пролекарств на его основе, например иллюстративных соединений 1-60, и необязательно одного или более других активных средств (которые могут включать или исключать химиотерапевтическое средство) можно осуществлять в любое время во время прогрессирования заболевания или нарушения, или до или после развития нарушения или одного или более симптомов заболевания или нарушения. В одном варианте осуществления соединение формулы (I) или формулы (II), например иллюстративные соединения 1-60, вводят на ежедневной основе в течение длительного периода времени для обеспечения содействия в осуществляемом контроле симптомов. В другом варианте осуществления соединение формулы (I) или формулы (II), например иллюстративные соединения 1-60, вводят на ежедневной основе в течение продолжительного периода времени либо для предотвращения, либо для задержки развития заболевания или нарушения.
Дозы, фармацевтические составы и наборы
Термин «комбинированный препарат», применяемый в данном документе, включает «набор из составляющих» или «изделие» в том смысле, что элементы комбинации, определенные выше, можно вводить независимо или посредством применения разных фиксированных комбинаций с определенными количествами элементов комбинации (a) и (b), например одновременно, по отдельности или последовательно, либо в лекарственной форме, либо в форме покрытия/основы, либо в обеих. Составляющие набора затем можно, например, вводить одновременно или с разнесением по времени, то есть в разные моменты времени и с равными или разными интервалами времени для любой составляющей набора из составляющих.
В одном варианте осуществления вводят комбинированный препарат, при этом (i) соединение формулы (I) или формулы (II), или пролекарство на его основе, или его фармацевтически приемлемая соль и (2) химиотерапевтическое средство, описанное в данном документе, вводят субъекту, при этом первая композиция содержит терапевтически эффективное количество соединения формулы (I) или формулы (II), или пролекарства на его основе, или его фармацевтически приемлемой соли, и вторая композиция содержит терапевтически эффективное количество химиотерапевтического средства, описанного в данном документе.
Предусмотрены фармацевтические композиции для отдельного, комбинированного, одновременного, раздельного, последовательного или замедленного введения. В одном варианте осуществления композицию, содержащую одно или более соединений формулы (I) или формулы (II), или пролекарств на их основе, или их фармацевтически приемлемых солей, вводят в одной или более требуемых дозах в один или более моментов времени. В другом варианте осуществления композиция, содержащая одно или более соединений формулы (I) или формулы (II), или пролекарств на их основе, или их фармацевтически приемлемых солей, вводят приблизительно в одно и то же время, что и химиотерапевтическое средство. Если две композиции вводят в разные моменты времени, их можно вводить в пределах интервала, составляющего, например, 30 минут, 1 час, 1 день, 1 неделю или 1 месяц, или любого интервала времени, находящегося между любыми двумя упомянутыми промежутками времени. Дозы можно вводить один раз в день (QD), дважды в день (BID), три раза в день (TID), четыре раза в день (QID) или дозами с расчетом на неделю, например четыре раза в неделю (QIW), три раза в неделю (TIW), дважды в неделю (BIW), один раз в неделю (QWK). Их также можно вводить при необходимости (PRN) и каждый день перед сном (hora somni).
Все описания в отношении дозирования, если явно не указано иное, применимы к соединениям по настоящему изобретению, в том числе соединениям формулы (I) или формулы (II).
Соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли по настоящему изобретению можно дозировать, вводить или составлять, как описано в данном документе.
Понятно, что вводимая доза соединений формулы (I) или формулы (II), или пролекарств на их основе или их фармацевтически приемлемых солей, период введения и общий режим введения для субъектов может отличатся в зависимости от таких переменных, как сайт-мишень, к которому она должна быть доставлена, тяжесть любых симптомов у субъекта, подлежащего лечению, тип нарушения, подлежащего лечению, размер однократной дозы, выбранный механизм введения и возраст, пол и/или общее состояние здоровья субъекта и другие факторы, известные специалистам средней квалификации в данной области техники.
Данные, полученные из анализа с использованием культур клеток и исследований на животных, можно использовать при составлении диапазона доз для применения в отношении людей. Доза может варьировать в пределах данного диапазона в зависимости от используемой лекарственной формы и применяемого пути введения. Для любого средства, применяемого в способе по настоящему изобретению, терапевтически эффективная доза может быть рассчитана изначально на основе анализов с использованием культур клеток. Доза может быть получена с использованием культур клеток или животных моделей с достижением диапазона концентрации в клетках, который включает IC50 (то есть концентрацию испытываемого соединения, с помощью которой достигается полумаксимальное подавление симптомов), при определении в культуре клеток. Такая информация может использоваться для более точного определения значений применимой дозы для людей. Точный состав, путь введения и дозу может выбирать лечащий врач с учетом состояния пациента. (См., например., Fingl et al., 1975, In: The Pharmacological Basis of Therapeutics, Ch.1, p.1). Дозу можно определять на основе концентрации введенного количества, предполагаемого веса подопытного животного-модели (200-300 г на крысу для взрослых крыс породы Вистар) с определением дозы в единицах, представляющих собой мг/кг, на основе введенной концентрации (микромоли) или введенного количества (мг).
В данном документе заявляются примеры эффективной дозы, которую можно применять для лечения рака или одного или более инфекционных заболеваний или любого другого заболевания или нарушения у субъекта, нуждающегося в этом, описанные в данном документе. В некоторых вариантах осуществления терапевтически эффективное количество соединений формулы (I) или формулы (II), или пролекарств на их основе, или их фармацевтически приемлемых солей, которое является эффективным для лечения рака, представляет собой концентрацию, составляющую от приблизительно 0,001 до приблизительно 1,0 микрограмма/мл, или от приблизительно 0,001 до приблизительно 0,01 мг/мл, или от приблизительно 0,1 мг/мл до приблизительно 100 мг/мл, или более, или входящую в любой диапазон, находящийся между любыми двумя упомянутыми дозами, или представляет собой любую дозу, находящуюся между любыми двумя упомянутыми числами. Доза может составлять 0,001, 0,002, 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2., 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 мг/мл или входить в любой диапазон, находящийся между любыми двумя упомянутыми дозами, или представлять собой любую дозу, находящуюся между любыми двумя упомянутыми числами. В некоторых вариантах осуществления терапевтически эффективное количество соединений формулы (I) или формулы (II), или пролекарств на их основе, или их фармацевтически приемлемых солей присутствует в концентрации, находящейся в диапазоне от приблизительно 0,5 до приблизительно 50 мг/мл. В некоторых вариантах осуществления соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли присутствуют в концентрации, находящейся в диапазоне от приблизительно 0,3 до приблизительно 30 мг/мл. В некоторых вариантах осуществления соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли присутствуют в концентрации, находящейся в диапазоне от приблизительно 0,1 или 1,0 до приблизительно 10 мг/мл. В некоторых вариантах осуществления соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли присутствуют в концентрации, находящейся в диапазоне от приблизительно 0,1 или 1,0 до приблизительно 0,3 или 3,0 мг/мл. В некоторых вариантах осуществления соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли присутствуют при концентрации приблизительно 3,0 мг/мл. В любом из вариантов осуществления, описанных в данном документе, носитель (среда-носитель) может представлять собой фармацевтически приемлемый носитель.
В некоторых вариантах осуществления соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли можно вводить в терапевтически эффективной дозе, составляющей от приблизительно 0,001 до приблизительно 100 мг/кг, от приблизительно 0,001 до приблизительно 0,01 мг/кг, от приблизительно 0,01 до приблизительно 0,1 мг/кг, от 0,1 до приблизительно 1 мг/кг, от приблизительно 1 до приблизительно 10 мг/кг или от приблизительно 10 до приблизительно 100 мг/кг, или входящей в любой диапазон, находящийся между любыми двумя упомянутыми дозами, или представляющей собой любую дозу, находящуюся между любыми двумя упомянутыми дозами. В некоторых аспектах, доза может составлять 0,001, 0,002, 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2., 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 мг/мл, или входить в любой диапазон, находящийся между любыми двумя упомянутыми дозами, или представлять собой любую дозу, находящуюся между любыми двумя упомянутыми числами. В некоторых вариантах осуществления эффективная доза находится в диапазоне от 0,093 мг/кг до 0,375 мг/кг.
Хоть и каждое из терапевтически эффективных концентраций, количеств или доз, предназначенных для применения с контексте данного изобретения, как пояснено выше, можно применять в отношении соединений формулы (I) или формулы (II), в некоторых аспектах данного изобретения для каждого из терапевтически эффективных концентраций, количеств или доз, описанных выше, доза пролекарства на основе соединения формулы (I) или формулы (II) может составлять от 1/10 до 1/100 или от 1/100 до 1/1000 от любого из упомянутых концентраций, количеств или доз. Кроме того, терапевтически эффективные концентрации, количества или дозы для пролекарства в некоторых аспектах могут составлять от 1/10 до 1/100 или от 1/100 до 1/1000 от упомянутых концентраций, количеств или доз, или входить в любой диапазон, находящийся между любыми двумя упомянутыми дозами, или представлять собой любую дозу, находящуюся между любыми двумя упомянутыми дозами.
Следует понимать, что введение может включать одну суточную дозу, введение некоторого количества отдельных разделенных доз или непрерывное введение, в зависимости оттого, что целесообразно. В качестве примера однократные дозы можно вводить один раз или более чем один раз в день, например 1, 2, 3, 4, 5 или 6 раз в день, с достижением требуемой общей суточной дозы. В качестве примера однократную дозу соединения формулы (I) или формулы (II), или пролекарства на его основе, или его фармацевтически приемлемых солей можно вводить в виде одной суточной дозы, или некоторого количества отдельных доз, или непрерывно с достижением суточной дозы, составляющей от примерно 0,1 до 10 мг, от 10 до 100 мг, от 100 до 1000 мг, от 1000 до 2000 мг или от 2000 мг до 5000 мг, от 0,1 до примерно 2000 мг, от примерно 0,1 до примерно 1000 мг, от примерно 1 до примерно 500 мг, от примерно 1 до примерно 200 мг, от примерно 1 до примерно 100 мг, от примерно 1 до примерно 50 мг или от примерно 1 до примерно 25 мг, или входящей в любой диапазон, находящийся между любыми двумя упомянутыми дозами, или представляющей собой любую дозу, находящуюся между любыми двумя упомянутыми дозами.
В одном варианте осуществления доза соединения формулы (I) или формулы (II), или пролекарства на его основе, или его фармацевтически приемлемых солей составляет от примерно 0,001 микромоля до 0,1 микромоля, от 0,1 микромоля и вплоть до примерно 200 микромоль в месте действия или больше в кровотоке с достижением указанных концентраций в месте действия. Доза может представлять собой (без ограничения) конечную концентрацию в кровотоке, составляющую приблизительно 0,001, 0,002, 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2., 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490 или 500 микромоль, или входящую в любой диапазон, находящийся между любыми двумя упомянутыми значениями концентрации, или представляющую собой любую концентрацию, находящуюся между любыми двумя упомянутыми числами.
Соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли могут присутствовать в фармацевтическом составе в по сути изолированной форме. Будет понятно, что продукт может быть смешан с носителями или разбавителями, которые не влияют на реализацию предусмотренного назначения продукта, и он все еще будет считаться по сути изолированным. Продукт по настоящему изобретению также может находится в по сути очищенной форме, в случае чего он в общем будет содержать приблизительно 80%, 85% или 90%, например по меньшей мере приблизительно 88%, по меньшей мере приблизительно 90, 95 или 98% или по меньшей мере приблизительно 99%, соединения формулы (I) или формулы (II), или пролекарств на его основе, или его фармацевтически приемлемых солей, или сухой массы препарата.
Фармацевтически приемлемые разбавители, носители и/или вспомогательные вещества включают таковые, которые являются подходящими для ветеринарного применения, а также фармацевтического применения в отношении человека. Подходящие носители и/или вспомогательные вещества легко определит специалист средней квалификации в данной области техники, учитывая природу соединений формулы (I) или формулы (II), или пролекарств на их основе, или их фармацевтически приемлемых солей. Однако, в качестве примера разбавители, носители и/или вспомогательные вещества включают растворы, растворители, дисперсионные среды, замедляющие средства, полимерные и липидные средства, эмульсии и т. п. В качестве дополнительного примера подходящие жидкие носители, особенно для инъекционных растворов, включают воду, водный солевой раствор, водный раствор декстрозы и т. п., при этом изотонические растворы являются предпочтительными для внутривенного, интраспинального и интрацистернального введения, и среды-носители, такие как липосомы, являются также особенно подходящими для введения средств.
Кроме того, при необходимости вещества, такие как смачивающие или эмульгирующие средства, стабилизирующие или pH-буферные средства или консерванты, также могут присутствовать в фармацевтических композициях по настоящему изобретению. В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению будут содержать подходящие фармацевтически приемлемые буферы, такие как ацетатные буферы, цитратные буферы, фосфатные буферы, боратные буферы и их смеси. В некоторых вариантах осуществления применимые в настоящем изобретении буферы включают борную кислоту, борат натрия, фосфаты натрия, в том числе одно-, двух- и трехосновные фосфаты, такие как моногидрат одноосновного фосфата натрия и гептагидрат двухосновного фосфата натрия, и их смеси. В некоторых вариантах осуществления консервант может представлять собой стабилизированный диоксид хлора, катионные полимеры или соединения четвертичного аммония. В некоторых вариантах осуществления фармацевтические композиции также могут содержать смачивающие средства, питательные вещества, загустители, антиоксиданты и т. п., например этилендиаминтетраацетат динатрия, гексаметафосфат щелочного металла, лимонную кислоту, цитрат натрия, метабисульфит натрия, тиосульфат натрия, N-ацетилцистеин, бутилированный гидроксианизол, бутилированный гидрокситолуол, поливиниловый спирт, полоксамеры, поливинилпирролидон, гидроксипропилметилцеллюлозу, гидроксиэтилметилцеллюлозу и их смеси. В некоторых вариантах осуществления фармацевтические составы по настоящему изобретению не включают консервант.
В некоторых вариантах осуществления фармацевтические композиции на основе соединений формулы (I) или формулы (II) или пролекарства на их основе, в том числе иллюстративные соединения 1-60, находятся в форме стерильного инъекционного препарата, такого как стерильная инъекционная водная или масляная суспензия. В некоторых вариантах осуществления суспензия составлена в соответствии со способами с применением таких подходящих диспергирующих или смачивающих средств и суспендирующих средств, которые были указаны выше. Стерильный инъекционный препарат также может представлять собой стерильные инъекционные раствор или суспензию в нетоксичном разбавителе или растворителе, приемлемом для парентерального введения, таком как раствор в 1,3-бутандиоле, полученный в виде лиофилизированного порошка. В некоторых вариантах осуществления приемлемые среды-носители и растворители, которые используются, могут включать или исключать воду, раствор Рингера (в том числе раствор Рингера с лактатом), раствор Хартмана, раствор Тироде и изотонический раствор хлорида натрия. В некоторых вариантах осуществления стерильные нелетучие масла используют в качестве растворителя или суспендирующей среды. Для этой цели используют любое легкое нелетучее масло, в том числе синтетические моно- или диглицериды. В некоторых вариантах осуществления жирные кислоты, такие как олеиновая кислота, применяют в получении инъекционных лекарственных форм.
Композиции по настоящему изобретению могут содержать соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли на любом подходящем уровне, исходя из лекарственной формы и механизма введения. Однако, в качестве примера применяемые в настоящем изобретении композиции могут содержать от примерно 0,1% до примерно 99% по весу, предпочтительно от примерно 1% до примерно 60% по весу соединений формулы (I) или формулы (II), или пролекарств на их основе, или их фармацевтически приемлемых солей в зависимости от способа введения.
В дополнение к стандартным разбавителям, носителям и/или вспомогательным веществам композиция в соответствии с настоящим изобретением может быть составлена с одним или более дополнительными составляющими или таким образом, чтобы обеспечивать повышение активности или биологической доступности соединений формулы (I) или формулы (II), или пролекарств на их основе, или их фармацевтически приемлемых солей, способствовать сохранению их целостности или обеспечивать увеличение их периода полувыведения или их срока годности, обеспечивать замедленное высвобождение после введения субъекту или обеспечивать другие необходимые преимущества, например. Например, среды-носители для замедленного высвобождения включают макромеры, поли(этиленгликоль), гиалуроновую кислоту, поли(винилпирролидон) или гидрогель. В качестве дополнительного примера композиции также могут включать консерванты, солюбилизирующие средства, стабилизирующие средства, смачивающие средства, эмульгирующие средства, подсластители, красящие средства, вкусоароматические добавки, средства для нанесения покрытия, буферы и т. п. Специалисты в области техники, к которой относится настоящее изобретение, легко идентифицируют дополнительные добавки, которые могут быть необходимы для конкретной цели.
Фармацевтические композиции, описанные в данном документе, можно составлять в соответствии со стандартными методиками, какие можно найти в таких стандартных источниках, как Gennaro AR: Remington: Science and Practice of Pharmacy, 20th ed., Lippincott, Williams & Wilkins, 2000, например.
Лечение инфекционных заболеваний
В некоторых вариантах осуществления в настоящем изобретении предусмотрен адъювант вакцины, содержащий соединение формулы (I), формулы (II), или пролекарства на его основе, или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления в настоящем изобретении предусмотрена вакцинная композиция, содержащая (i) соединение формулы (I), формулы (II), или пролекарства на его основе, или его фармацевтически приемлемую соль и (ii) один или более антигенов, одну или более композиций на основе антигенов или их комбинацию.
Антигены и адъюванты, которые можно применять в комбинации с соединением формулы (I), формулы (II) или пролекарствами на его основе, или его фармацевтически приемлемой солью, раскрытыми в данном документе, включают костимулирующую молекулу B7, C-34, интерлейкин-2, интерферон-α, интерферон-γ, GM-CSF, антагонисты CTLA-4, агонист OX-40, агонист CD40, сарграмостим, левамизол, вирус осповакцины, бациллу Кальмета-Герена (BCG), липосомы, квасцы, обезвреженные эндотоксины, минеральные масла, поверхностно-активные вещества, которые могут включать или исключать липолецитин, полиолы-плюроники, полианионы, пептиды и масляные или углеводородные эмульсии. Адъюванты, которые могут включать или исключать гидроксид алюминия или фосфат алюминия, можно добавлять для повышения способности вакцины вызывать, усиливать или продлевать иммунный ответ. Сильными адъювантами также являются дополнительные материалы, которые могут включать или исключать цитокины, хемокины и последовательности нуклеиновых кислот бактерий, такие как CpG, агонист toll-подобного рецептора 9 (TLR), а также дополнительные агонисты TLR 2, TLR 4, TLR 5, TLR 7, TLR 8, TLR9, в том числе липопротеин, LPS, монофосфориллипид A, липотейхоевую кислоту, имиквимод, резиквимод и в дополнение агонисты гена I, индуцируемого ретиноевой кислотой (RIG-I), которые могут включать или исключать поли I:C, применяемые по отдельности или в комбинации с описанными композициями.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения инфекционного заболевания. Как описано в данном документе, полученные in vitro данные, представленные в разделе «Примеры» демонстрируют, что опосредованная STING передача сигнала активируется с применением соединений формулы (I) или формулы (II), про что свидетельствует секреция цитокинов (в частности, IFNb) в ответ на агонисты STING. Известно, что активация STING приводит к индуцированию нескольких противовирусных генов, которые включают IFN-β, что указывает на применимость агониста STING в качестве противовирусного средства против многих типов вирусных инфекций. Как описано ранее, активация STING посредством агонистов STING может использоваться для лечения инфекционного заболевания ((Nature, 2008, 455:674-678; PLoS Pathog. 2015, 11:12; Antimicrob. Agents Chemother. 2015, 59(2):1273-1281; J Leukocyte Bio. 2011, 89(3):351-357). Авторы настоящего изобретения установили, что соединения формулы (I) или формулы (II), или пролекарства на их основе, или их фармацевтически приемлемые соли можно использовать для лечения вирусной инфекции или бактериальной инфекции. Примеры вирусной инфекции, лечение которой можно осуществлять посредством соединений по настоящему изобретению, могут включать или исключать вирус иммунодефицита человека (HIV), вирус папилломы человека (HPV), вирус гепатита C (HCV), вирус гепатита B (HBV), вирус гриппа (из семейства Orthomyxoviridae, что может включать или исключать Alphainfluenzavirus (грипп типа A - все подтипы или серотипы) и грипп типа B), вирус из рода Coronavirus (который может включать или исключать SARS-CoV-1 и SARS-CoV-2), вирус из рода Alphavirus, вирус из рода Rotavirus, вирус Сендай, вирус осповакцины, респираторно-синцитиальный вирус, вирус Ласса (Arenaviridae), вирус бешенства (Rhabdoviridae), вирус лихорадки Западного Нила, вирус Денге, вирус японского энцефалита и другие из семейства Flaviviridae, РНК-содержащий вирус, ДНК-содержащий вирус, вирус, принадлежащий к семейству Alphaflexiviridae, Astroviridae, Alphatetraviridae, Alvernaviridae, Asfarviridae, Ampullaviridae, Adenoviridae, Ascoviridae, Betaflexiviridae, Bromoviridae, Barnaviridae, Bicaudaviridae, Baculoviridae Closteroviridae, Caliciviridae, Carmotetraviridae, Clavaviridae, Corticoviridae, Dicistroviridae, Endornaviridae, Filoviridae, Globuloviridae, Guttaviridae, Geminiviridae, Hytrosaviridae, Leviviridae, Luteoviridae, Lipothrixviridae, Mesoniviridae, Marnaviridae, Metaviridae, Malacoherpesviridae, Nodaviridae, Nyamiviridae, Nimaviridae, Nanoviridae, Piconaviridae, Partitiviridae, Picobirnaviridae, Paramyxoviridae, Poxviridae, Pandoraviridae, Polymaviridae, Phycodnaviridae, Papillomaviridae, Polydnaviruses, Polymaviridae, Permutotetraviridae, Potyviridae, Retroviridae, Siphoviridae, Sphaerolipoviridae, Virgaviridae, Togaviridae, Turriviridae, Tectiviridae.
Примеры бактериальной инфекции, лечение которой можно осуществлять посредством соединений формулы (I) или формулы (II), или пролекарств на их основе, или их фармацевтически приемлемых солей могут включать или исключать инфекции, обусловленные бактериями, принадлежащими к родам Brucella, Clostridium, Clostrodium, Campylobacter, Enterococcus, Fransicella, Listeria, Legionella, Mycobacteria, Pseudomonas, Salmonella, Staphylococcus, Yersinia. В некоторых вариантах осуществления в настоящем изобретении предусмотрена композиция, содержащая соединение формулы (I), формулы (II), или пролекарство на его основе, или его фармацевтически приемлемую соль и одно или более дополнительных средств терапии.
Изготовление и стабильность
В некоторых вариантах осуществления составы по настоящему изобретению являются по сути чистыми. Под по сути чистым подразумевается, что составы содержат менее приблизительно 10%, 5% или 1%, и предпочтительно менее приблизительно 0,1%, любой примеси. В некоторых вариантах осуществления общее количество примесей, в том числе метаболитов соединений формулы (I) или формулы (II), будет составлять не более 15%. В некоторых вариантах осуществления общее количество примесей, в том числе метаболитов соединений формулы (I) или формулы (II), будет составлять не более 12%. В некоторых вариантах осуществления общее количество примесей, в том числе метаболитов соединений формулы (I) или формулы (II), будет составлять не более 11%. В других вариантах осуществления общее количество примесей, в том числе метаболитов соединений формулы (I) или формулы (II), будет составлять не более 10%.
В некоторых вариантах осуществления чистоту составов по настоящему изобретению можно измерять с применением способа, выбранного из анионообменной HPLC (AEX-HPLC) или масс-спектрометрии. Масс-спектрометрия может включать LC/MS или LC/MS/MS. В некоторых вариантах осуществления способ, применяемый для измерения количества примеси, может включать как AEX-HPLC, так и LC/MS.
Стерильные композиции, содержащие соединения формулы (I) или формулы (II), или пролекарства на их основе по настоящему изобретению получают с применением асептической обработки путем растворения соединения в среде-носителе для составления. В одном варианте осуществления состав также можно стерилизовать путем фильтрования. Вспомогательные вещества, применяемые в изготовлении составов по настоящему изобретению, являются широко применяемыми в фармацевтических продуктах и их выпускают согласно фармакопейным стандартам.
Общие способы получения
Соединения формул (I) и (II), описанные в данном документе, можно получать с помощью методик, известных в данной области техники. Кроме того, соединения формул (I) и (II), описанные в данном документе, можно получать с помощью следующей последовательности реакции, изображенной на схемах ниже. Дополнительно, следует понимать, что на следующих схемах синтеза, где упоминаются конкретные основания, кислоты, реагенты, растворители, средства для реакции сочетания и т. д., также можно применять другие основания, кислоты, реагенты, растворители, средства для реакции сочетания и т. д., известные в данной области техники, и, следовательно, они включены в объем настоящего изобретения. В объем настоящего изобретения также входят вариации в условиях реакций, например температуры и/или длительности реакции, которые можно использовать, как известно в данной области техники. Объемом настоящего изобретения, если не определено иное, также охватываются все изомеры соединений формул (I) и (II), описанных на этих схемах.
С помощью способов, описанных в данном документе, можно обеспечить синтез соединений согласно настоящему изобретению. Однако данные способы не являются единственными, посредством которых могут быть синтезированы соединения, описанные в настоящем изобретении. Дополнительно, последовательности различных стадий синтеза, описанных в данном документе, могут чередоваться с целью предоставления требуемых соединений.

Схема 1
На схеме 1 продемонстрирован способ получения соединения (9) в качестве промежуточного соединения 1 [где кольцо B представляет собой фенил, кольцо C, p и R2 определены ранее для формулы I, m равняется 1, G1 представляет собой -CH2-, и G2 представляет собой -CH=CH-] из соединения формулы (2).
Соединение формулы (2) вводят в реакцию с 3-бромпропан-1-олом в присутствии основания, такого как карбонат цезия, карбонат калия, в растворителях, таких как диметилформамид, ацетонитрил, THF, ацетон, с получением соединения формулы (3).
Соединение формулы (3), полученное на предыдущей стадии, вводят в реакцию с метансульфонилхлоридом в присутствии основания, такого как TEA, DIPEA, в растворителях, таких как DCM, THF, с получением соединений формулы (4).
Соединение формулы (4) вводят в реакцию с соединением формулы (10) в присутствии основания, такого как карбонат цезия, карбонат калия, в растворителях, таких как DMF, ацетонитрил, с получением соединения формулы (5). Обеспечение циклизации соединения формулы (5) с дигидрохлоридом (E)-бут-2-ен-1,4-диамина путем применения основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как этанол, тетрагидрофуран, с получением соединения формулы (6).
Соединение формулы (6) вводят в реакцию с цинком и уксусной кислотой с получением соединения формулы (7). Реакция сочетания соединения формулы (7) с соединениями формулы (11) может быть осуществлена путем применения EDC и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, тетрагидрофуран, с получением соединения формулы (8).
Соединения формулы (8), полученные на предыдущей стадии, можно обрабатывать основаниями, такими как гидроксид лития или гидроксид натрия, для обеспечения гидролиза с получением соединения формулы (9) в качестве промежуточного соединения 1.

Схема 2
На схеме 2 продемонстрирован альтернативный способ получения соединения (9) в качестве промежуточного соединения 1 [где кольцо B представляет собой фенил, кольцо C, p и R2 определены ранее для формулы I, m равняется 1, G1 представляет собой -CH2-, и G2 представляет собой -CH=CH-] из соединения формулы (2).
Обеспечивают гидролиз соединения формулы (2) в присутствии основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в смеси, состоящей из метанола, THF и воды в разных комбинациях, с получением соединения формулы (12).
Соединение формулы (12) вводят в реакцию с трет-бутанолом в присутствии безводного сульфата магния и серной кислоты, или пентоксида фосфора и серной кислоты, или трет-бутилацетоацетата и кат. серной кислоты в растворителях, таких как DCM или хлороформ, с получением соединения формулы (13) в виде сложного трет-бутилового эфира. Соединение формулы (14) получают путем осуществления реакции с соединением формулы (3) в соответствии с протоколом реакции Мицунобу с применением трифенилфосфина и азодикарбоксилата, такого как диэтилазодикарбоксилат (DEAD) или диизопропилазодикарбоксилат (DIAD), в THF или в качестве альтернативы путем осуществления опосредованного основанием алкилирования фенола (13) с помощью мезилата формулы (4) в присутствии карбоната цезия или карбоната калия в растворителях, таких как DMF или ацетонитрил.
Макроциклизация соединения формулы (14) с дигидрохлоридом (E)-бут-2-ен-1,4-диамина путем применения основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как этанол, тетрагидрофуран, обеспечивала получение соединений формулы (15). Обеспечивали восстановление соединения формулы (15) до аминового соединения (16) в присутствии дитионита натрия и гидроксида аммония в смеси растворителей, состоящей из THF, этанола и воды. Сочетание соединения формулы (16) с соединением формулы (11) может быть осуществлено путем применения EDC и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид или тетрагидрофуран, может обеспечивать получение соединений формулы (17). Можно удалять защитную группу со сложного трет-бутилового эфира в соединении (17) в кислотных условиях, в присутствии трифторуксусной кислоты или хлористоводородной кислоты, с получением соединения (18).
Соединение формулы (8) можно получать из соединения (18) путем преобразования кислотной функциональной группы в амид с применением условий, таких как хлорид аммония, и основания, такого как триэтиламин или DIPEA, в присутствии средства для реакции сочетания, такого как EDCI, TBTU, HATU, или путем образования комплекса кислоты с CDI и осуществления реакции с аммиаком. Соединение формулы (8) можно преобразовывать в соединение формулы (9) или промежуточное соединение 1 с применением условий, указанных на схеме 1.

Схема 3
На схеме 3 продемонстрирован способ получения соединений формулы (I-A) [где кольцо B представляет собой фенил, кольцо C, p и R2 определены ранее для формулы I, m равняется 1, G1 представляет собой -CH2-, G2 представляет собой -CH=CH-, и R1 представляет собой -CON(R3)2] из соединений, представляющих собой промежуточное соединение 1 формулы (9).
Реакция сочетания соединения формулы (9) с первичными или вторичными аминами может быть осуществлена путем применения средств для реакции сочетания, таких как TBTU, EDC, и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, диметилсульфоксид и т. д., с получением соединения формулы (I-A).
Можно дополнительно осуществлять гидролиз соединения формулы (I-A), если оно содержит замещения, такие как -COOMe, -COOEt или -COOtBu в положении R3, с получением соответствующих кислот с помощью способов, известных в данной области техники, путем обработки основаниями, такими как гидроксид лития или гидроксид натрия, или в качестве альтернативы можно обрабатывать кислотой, такой как трифторуксусная кислота или хлористоводородная кислота, для обеспечения гидролиза.
Схема 4
На схеме 4 продемонстрированы способы получения соединения (21) из соединения (2).
Соединение (2) вводят в реакцию с 2-(метоксиметокси)пропан-1,3-диолом в условиях реакции Мицунобу в присутствии реагентов, таких как DIAD или DEAD и TPP, в растворителях, таких как диметилформамид, ацетонитрил, THF, с получением смеси энантиомеров в качестве соединений формулы (19A и 19B). Соединения 19A и 19B разделяли с помощью хиральной препаративной HPLC с получением чистых энантиомеров.
Соединение (19A) вводят в реакцию с соединением (13) в условиях реакции Мицунобу в присутствии реагентов, таких как DIAD или DEAD и TPP, в растворителях, таких как диметилформамид, ацетонитрил, THF, с получением соединения (20).
Соединение (20) вводят в реакцию с тетрабромидом углерода и TPP в DCM с получением соединения (21) путем удаления защитной метоксиметильной (MOM) группы. Подобные реакции осуществляли для получения энантиомера соединения (21) из соединения (19B).
В качестве альтернативы соединение (2) вводят в реакцию с (S)-оксиран-2-илметанолом в условиях реакции Мицунобу в присутствии реагентов, таких как DIAD или DEAD и TPP, в растворителях, таких как диметилформамид, ацетонитрил, THF, с получением соединения (22). Соединение (22), полученное на предыдущей стадии, вводят в реакцию с соединением (13) в присутствии основания, такого как 2,6-лутидин, DIPEA, в растворителях, таких как этанол, метанол, с получением соединения (21).
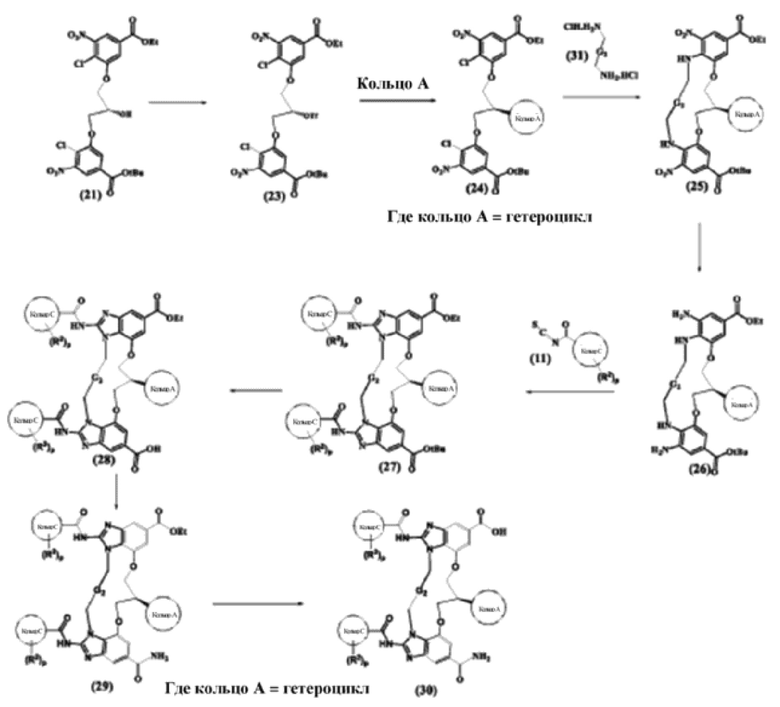
Схема 5
На схеме 5 продемонстрирован способ получения соединений формулы (30) [где кольцо B представляет собой фенил, кольцо A представляет собой гетероцикл, кольцо C, m, G2, p и R2 определены ранее для формулы 1] из соединения (21).
В результате обработки соединения (21) трифторметансульфоновым ангидридом в присутствии основания, такого как 2,6-лутидин, получают соединение формулы (23).
Соединение формулы (23) можно вводить в реакцию с кольцом A в присутствии основания, такого как триэтиламин, в растворителях, таких как тетрагидрофуран или хлорсодержащий растворитель, с получением соединений формулы (24).
Соединения формулы (24), полученные на предыдущей стадии, можно вводить в реакцию с соединениями формулы (31) в присутствии основания, такого как DIPEA, в растворителях, таких как этанол, метанол, с получением соединений формулы (25).
Соединения формулы (25) можно вводить в реакцию с дитионитом натрия в растворителях, таких как метанол, с получением соединений формулы (26). Реакция сочетания соединений формулы (26) с соединениями формулы (11) может быть осуществлена путем применения EDC и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, тетрагидрофуран, с получением соединений формулы (27).
Соединения формулы (27), полученные на предыдущей стадии, можно обрабатывать кислотой, такой как TFA или HCl, для обеспечения гидролиза с получением соединений формулы (28).
Соединения формулы (28) можно вводить в реакцию с TBTU и хлоридом аммония в растворителях, таких как тетрагидрофуран, диметилформамид, с получением соединений формулы (29), которые после дополнительного гидролиза обеспечивают получение соединений формулы (30). Подобные реакции можно осуществлять для получения энантиомеров соединения (30) из энантиомера соединения (21).
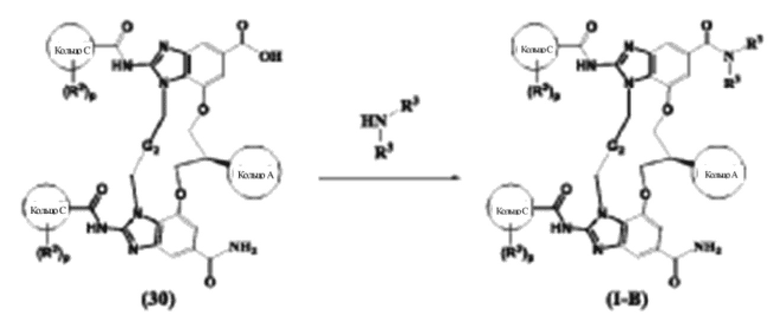
Схема 6
На схеме 6 продемонстрирован способ получения соединений формулы (I-B) [где кольцо B представляет собой фенил, кольцо A представляет собой гетероцикл, кольцо C, p и R2 определены ранее для формулы I, m равняется 1, G2 представляет собой -CH=CH-, и R1 представляет собой -CON(R3)2] из соединений формулы (30).
Реакция сочетания соединения формулы (30) с первичными или вторичными аминами может быть осуществлена путем применения средств для реакции сочетания, таких как TBTU, EDC, и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, диметилсульфоксид и т. д., с получением соединения формулы (I-B).
Можно дополнительно осуществлять гидролиз соединения формулы (I-B), если оно содержит замещения, такие как -COOMe, -COOEt или -COOtBu в положении R3, с получением соответствующих кислот с помощью способов, известных в данной области техники, путем обработки основаниями, такими как гидроксид лития или гидроксид натрия, или в качестве альтернативы кислотой, такой как трифторуксусная кислота или хлористоводородная кислота, для обеспечения гидролиза. Подобные реакции можно осуществлять для получения энантиомеров соединения (I-B) из энантиомеров соединения (30).
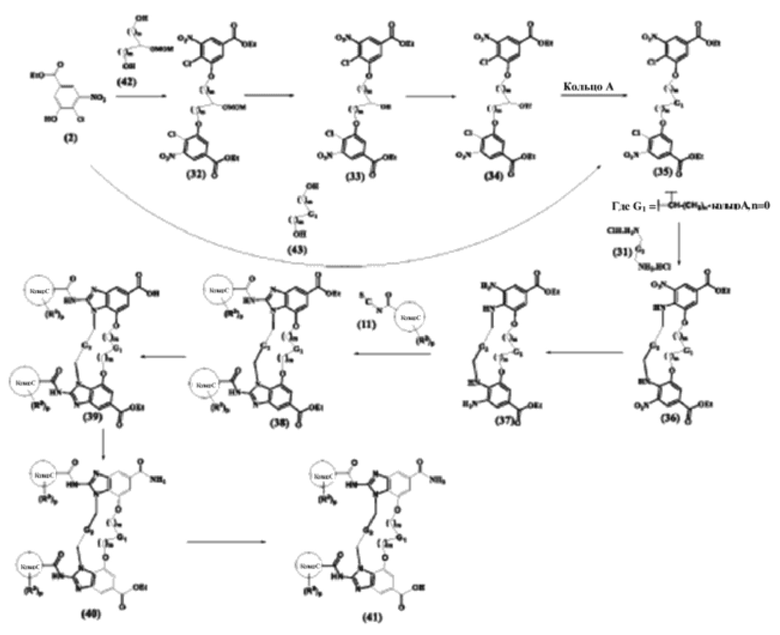
Схема 7
На схеме 7 продемонстрирован способ получения соединений формулы (41) [где кольцо B представляет собой фенил, G1 представляет собой  , n = 0, кольцо A представляет собой гетероцикл, кольцо C, m, G2, p и R2 определены ранее для формулы 1] из соединения (2).
, n = 0, кольцо A представляет собой гетероцикл, кольцо C, m, G2, p и R2 определены ранее для формулы 1] из соединения (2).
Соединение формулы (2) можно вводить в реакцию с соединениями формулы (42) в условиях реакции Мицунобу в присутствии реагентов, таких как DIAD или DEAD и TPP, в растворителях, таких как диметилформамид, ацетонитрил, THF, с получением соединений формулы (32).
Соединения формулы (32) можно вводить в реакцию с HCl в диоксане в растворителях, таких как хлорсодержащий растворитель или тетрагидрофуран, для обеспечения удаления защитной метоксиметильной (MOM) группы, что после дополнительной обработки трифторметансульфоновым ангидридом в присутствии основания, такого как 2,6-лутидин, обеспечивало получение соединений формулы (34).
Соединения формулы (34) можно вводить в реакцию с кольцом A в присутствии основания, такого как триэтиламин, в растворителях, таких как тетрагидрофуран или хлорсодержащий растворитель, с получением соединений формулы (35). Соединение формулы (2) в качестве альтернативы можно вводить в реакцию с соединениями формулы (43) в условиях реакции Мицунобу в присутствии реагентов, таких как DIAD или DEAD и TPP, в растворителях, таких как диметилформамид, ацетонитрил, THF, с получением соединений формулы (35).
Соединения формулы (35), полученные на предыдущей стадии, можно вводить в реакцию с соединениями формулы (31) в присутствии основания, такого как DIPEA, в растворителях, таких как этанол, метанол, с получением соединений формулы (36).
Соединения формулы (36) можно вводить в реакцию с дитионитом натрия в растворителях, таких как метанол, с получением соединений формулы (37). Реакция сочетания соединений формулы (11) с соединениями формулы (37) может быть осуществлена путем применения EDC и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, тетрагидрофуран, с получением соединений формулы (38).
Соединения формулы (38), полученные на предыдущей стадии, можно обрабатывать основаниями, такими как гидроксид лития или гидроксид натрия, для обеспечения гидролиза с получением соединений формулы (39).
Соединения формулы (39) можно вводить в реакцию с TBTU и хлоридом аммония в растворителях, таких как тетрагидрофуран, диметилформамид, с получением соединений формулы (40), которые после дополнительного гидролиза обеспечивают получение соединений формулы (41).
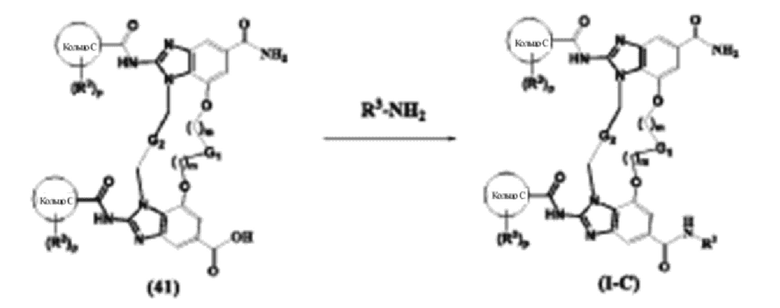
Схема 8
На схеме 8 продемонстрирован способ получения соединений формулы (I-C) [где m равняется 1, G1 представляет собой >CH-кольцо A, G2 представляет собой -CH=CH-, и R1 представляет собой -CON(R3)2, где один из R3 представляет собой водород], где кольцо C, p и R2 определены ранее, из соединений формулы (41).
Реакция сочетания соединения формулы (41) с первичными аминами может быть осуществлена путем применения средств для реакции сочетания, таких как TBTU, EDC, и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, тетрагидрофуран, с получением соединения формулы (I-C).
Можно дополнительно осуществлять гидролиз соединения формулы (I-C), если оно содержит замещения, такие как -COOMe, -COOEt или -COOtBu в положении R3, с получением соответствующих кислот с помощью способов, известных в данной области техники, путем обработки основаниями, такими как гидроксид лития или гидроксид натрия, или в качестве альтернативы кислотой, такой как трифторуксусная кислота или хлористоводородная кислота, для обеспечения гидролиза.
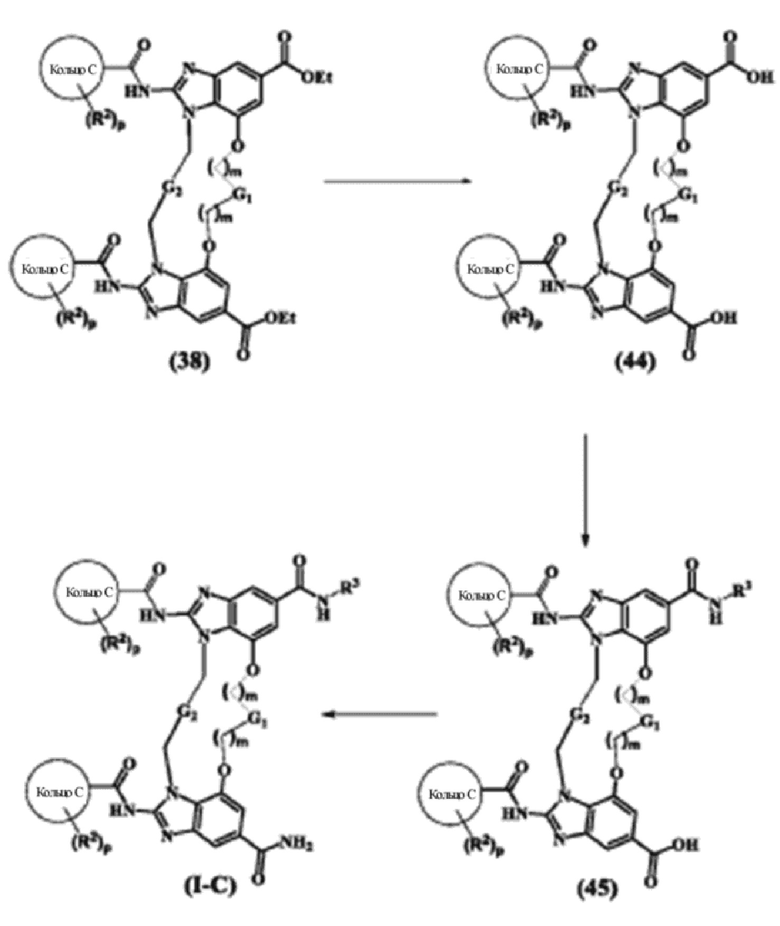
Схема 9
На схеме 9 продемонстрирован способ получения соединений формулы (I-C) [формула I, когда m равняется 1, G1 представляет собой >CH-кольцо A, G2 представляет собой -CH=CH-, и R1 представляет собой -CON(R3)2, где один из R3 представляет собой водород], где кольцо C, p и R2 определены ранее, из соединений формулы (38).
Соединения формулы (38) можно обрабатывать основанием, таким как гидроксид лития или гидроксид натрия, для обеспечения гидролиза с получением соединений формулы (44).
Реакция сочетания соединения формулы (44) с первичными аминами может быть осуществлена путем применения средств для реакции сочетания, таких как TBTU, EDC, и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, тетрагидрофуран, с получением соединения формулы (45). Соединения формулы (45) можно вводить в реакцию с TBTU и хлоридом аммония в растворителях, таких как тетрагидрофуран, диметилформамид, с получением соединений формулы (I-C).
Можно дополнительно осуществлять гидролиз соединения формулы (I-C), если оно содержит замещения, такие как -COOMe, -COOEt или -COOtBu в положении R3, с получением соответствующих кислот с помощью способов, известных в данной области техники, путем обработки основаниями, такими как гидроксид лития или гидроксид натрия, для обеспечения гидролиза или в качестве альтернативы кислотой, такой как трифторуксусная кислота или хлористоводородная кислота, для обеспечения гидролиза.
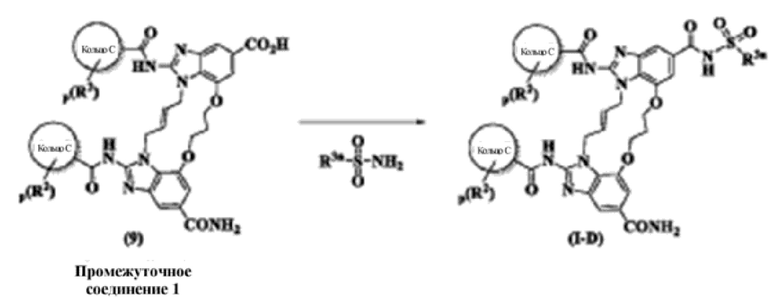
Схема 10
На схеме 10 продемонстрирован способ получения соединений формулы (I-D) [формула I, если m равняется 1, G1 представляет собой -CH2-, G2 представляет собой -CH=CH-, и R1 представляет собой -CONHSO2R3a], где кольцо C, p и R2 определены ранее, из соединений формулы (9) в качестве промежуточного соединения 1.
Реакция сочетания соединения формулы (9) с алкил/циклоалкилсульфонамидами может быть осуществлена путем применения средств для реакции сочетания, таких как TBTU, EDC, и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, тетрагидрофуран, с получением соединения формулы (I-D).

Схема 11
На схеме 11 продемонстрирован способ получения соединений формулы (I-E) [формула I, если m равняется 1, G1 представляет собой -CH2-, G2 представляет собой -CH=CH-, и R1 представляет собой гетероарил (тетразол)], где кольцо C, p и R2 определены ранее, из соединения формулы (10).
Соединение формулы (10) можно вводить в реакцию с трихлорметилхлорформиатом в растворителях, таких как ацетонитрил, THF, с получением соединения формулы (46).
Соединение формулы (46) можно вводить в реакцию с соединением формулы (10) и 1,3-дибромпропаном в присутствии основания, такого как TEA, DIPEA, в растворителях, таких как NMP, диметилформамид, с получением соединения формулы (47).
Циклизация соединения формулы (47) с дигидрохлоридом (E)-бут-2-ен-1,4-диамина путем применения основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как этанол, тетрагидрофуран, обеспечивает получение соединения формулы (48).
Соединение формулы (48) можно вводить в реакцию с цинком и уксусной кислотой с получением соединения формулы (49). Реакция сочетания соединения формулы (49) с соединением формулы (11) может быть осуществлена путем применения EDC и основания, такого как триэтиламин или диизопропиламин, в растворителях, таких как диметилформамид, тетрагидрофуран, с получением соединения формулы (50).
Соединение формулы (50), полученное на предыдущей стадии, можно обрабатывать азидом натрия и хлоридом аммония в DMF в качестве растворителя с получением соединения формулы (I-E).
Сокращения
DMF: диметилформамид
DMSO: диметилсульфоксид
THF: тетрагидрофуран
CDI: 1,1’-карбонилдиимидазол
EDC: 1-этил-3-(3-диметиламинопропил)карбодиимид
TBTU: 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат
HATU: 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат
DIPEA: диизопропиламин
NMP: N-метил-2-пирролидон
TEA: триэтиламин
KI: йодид калия
DCM: дихлорметан
Ms: метансульфонил
Ts: 4-метилбензолсульфонил
PMB: 4-метоксибензил
DEAD: диэтилазодикарбоксилат
DIAD: диизопропилазодикарбоксилат
TPP: трифенилфосфин
Пром. соед.: промежуточное соединение
Некоторые из иллюстративных примеров по настоящему изобретению получали согласно последовательности одной или более схем реакций, как описано выше.
Настоящее изобретение далее иллюстрируется следующими примерами, которые представлены исключительно в качестве иллюстрации настоящего изобретения и не ограничивают объем настоящего изобретения. Нижеприведенные примеры демонстрируют процедуры синтеза для получения родственных соединений. Специалистам в данной области техники будут очевидны определенные модификации и эквиваленты, которые подлежат включению в объем настоящего изобретения.
Номенклатура соединений согласно настоящему изобретению представлена в соответствии с ChemDraw Professional 18.0. Структуры промежуточных соединений, а также конечных соединений, подтверждали посредством спектральных данных.
Экспериментальная часть
Синтез промежуточных соединений
Промежуточное соединение 1. Синтез (E)-4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоновой кислоты
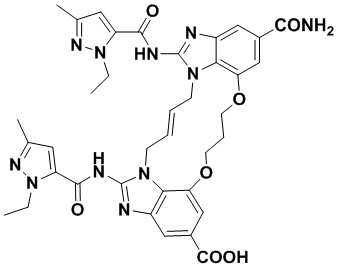
Стадия 1. 4-Хлор-3-гидрокси-5-нитробензойная кислота:

К перемешиваемому раствору этил-4-хлор-3-гидрокси-5-нитробензоата (320 г, 1303 ммоль) в смеси растворителей, состоящей из 1 л метанола, 1 л THF и 1 л H2O, добавляли гидрат гидроксида лития (164 г, 3909 ммоль) при комнатной температуре и перемешивали в течение 2 ч. Реакцию отслеживали с помощью TLC и по завершении реакции реакционную смесь концентрировали при пониженном давлении и добавляли воду. pH раствора регулировали до кислотного с помощью 6 н HCl и неочищенный продукт экстрагировали этилацетатом. Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали с получением продукта в виде грязно-белого твердого вещества (выход = 255 г, 90%). 1H ЯМР (400 МГц, DMSO-d6) δ 13,63 (s, 1H), 11,70 (s, 1H), 7,88 (d, J = 1,9 Гц, 1H), 7,77 (d, J = 1,9 Гц, 1H). LCMS: масса/заряд 216,39 (M+H)+.
Стадия 2. трет-Бутил-4-хлор-3-гидрокси-5-нитробензоат
К раствору 4-хлор-3-гидрокси-5-нитробензойной кислоты (255 г, 1172 ммоль) в 3 л DCM добавляли безводный MgSO4 (635 г, 5274 ммоль) и круглодонную колбу герметично закрывали для предотвращения утечки газов. Добавляли H2SO4 (75 мл, 1407 ммоль), за которой следовал трет-бутанол (729 мл, 7619 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали с удалением остатка MgSO4 и фильтрат разбавляли с помощью DCM. Слой DCM промывали с помощью насыщ. раствора NaHCO3, затем солевым раствором, и высушивали над Na2SO4, и концентрировали с получением продукта в виде грязно-белого твердого вещества (выход = 200 г, 62%). 1H ЯМР (400 МГц, хлороформ-d) δ 8,08 (d, J = 1,9 Гц, 1H), 7,88 (d, J = 1,9 Гц, 1H), 1,62 (s, 9H). LCMS: масса/заряд 272,33 (M-H)-.
Стадия 3. Этил-4-хлор-3-(3-гидроксипропокси)-5-нитробензоат

К перемешиваемому раствору этил-4-хлор-3-гидрокси-5-нитробензоата (200 г, 814 ммоль) в 2 л DMF добавляли 3-бромпропан-1-ол (147 г, 1059 ммоль) и K2CO3 (225 г, 1629 ммоль) и реакционную смесь перемешивали при 80°C в течение 1,5 ч. После исчерпания исходных материалов реакционную массу охлаждали и выливали в воду, и экстрагировали этилацетатом. Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали промыванием с помощью 5% EtOAc/гексана, c получением бледно-желтого твердого вещества (выход = 230 г, 93%). 1H ЯМР (400 МГц, хлороформ-d) δ 8,04 (d, J = 1,8 Гц, 1H), 7,80 (d, J = 1,8 Гц, 1H), 4,44 (q, J = 7,1 Гц, 2H), 4,34 (t, J = 5,9 Гц, 2H), 3,94 (t, J = 5,8 Гц, 2H), 2,17 (p, J = 5,9 Гц, 2H), 1,43 (t, J = 7,1 Гц, 3H).
Стадия 4. трет-Бутил-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)пропокси)-5-нитробензоат
К перемешиваемому раствору этил-4-хлор-3-(3-гидроксипропокси)-5-нитробензоата (200 г, 659 ммоль) в 3 л THF добавляли трет-бутил-4-хлор-3-гидрокси-5-нитробензоат (198 г, 724 ммоль) и трифенилфосфин (242 г, 922 ммоль). К данном раствору по каплям добавляли DIAD (192 мл, 988 ммоль) и после добавления реакционную смесь перемешивали при комнатной температуре в течение 2 ч. После окончания реакции смесь концентрировали c получением неочищенного продукта, который растирали с этанолом. Осажденное твердое вещество фильтровали и высушивали c получением чистого продукта в виде бледно-желтого твердого вещества (выход = 320 г, 87%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,08 (d, J = 1,8 Гц, 1H), 8,01 (d, J = 1,7 Гц, 1H), 7,85 (d, J = 1,8 Гц, 1H), 7,80 (d, J = 1,8 Гц, 1H), 4,47 (td, J = 6,0, 3,3 Гц, 4H), 4,37 (q, J = 7,1 Гц, 2H), 2,35 (p, J = 6,1 Гц, 2H), 1,56 (s, 9H), 1,34 (t, J = 7,1 Гц, 3H).
Стадия 5. 3-(трет-Бутил)-11-этил-(E)-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилат
К перемешиваемому раствору трет-бутил-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)пропокси)-5-нитробензоата (310 г, 554 ммоль) в смеси растворителей, состоящей из 9 л этанола и 3 л THF, добавляли (E)-бут-2-ен-1,4-диамина дигидрохлорид (127,7 г, 802 ммоль) и DIPEA (798 мл, 4567 ммоль). Реакционную смесь нагревали при 105°C в течение 36 ч в автоклаве из нержавеющей стали. После окончания реакции смесь выпаривали до сухого состояния и добавляли воду. Полученное твердое вещество фильтровали и высушивали под вакуумом. Неочищенный продукт растирали в порошок с 5% этилацетатом в метаноле и фильтровали. Твердое вещество собирали и высушивали под вакуумом с получением требуемого продукта (выход = 285 г, 90%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,33 (dt, J = 14,5, 6,3 Гц, 2H), 8,25 (d, J = 1,9 Гц, 1H), 8,18 (d, J = 1,9 Гц, 1H), 7,51 (d, J = 2,0 Гц, 1H), 7,47 (d, J = 2,0 Гц, 1H), 5,73 (d, J = 1,9 Гц, 2H), 4,42 - 4,32 (m, 2H), 4,21 - 4,11 (m, 8H), 2,23 (t, J = 5,9 Гц, 2H), 1,53 (s, 9H), 1,30 (t, J = 7,1 Гц, 3H). LCMS: масса/заряд 572,95 (M+H)+.
Стадия 6. 3-(трет-Бутил)-11-этил-(E)-1,13-диамино-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилат
3-(трет-Бутил)-11-этил-(E)-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилат (280 г, 489 ммоль) растворяли в смеси растворителей, состоящей из 1,2 л THF и 0,8 л EtOH. Раствор охлаждали до 0°C и к нему добавляли раствор дитионита натрия (851 г, 4890 ммоль) в 800 мл воды, с последующим добавлением 28% водн. раствора гидроксида аммония (1020 мл, 7335 ммоль). Обеспечивали нагревание реакционной смеси до комнатной температуры и перемешивали в течение 2 ч, после чего о завершении реакции свидетельствовали данные TLC. Летучие вещества затем концентрировали на ротационном испарителе и остаток разбавляли этилацетатом. Слой этилацетата промывали солевым раствором, высушивали над Na2SO4 и концентрировали с получением продукта (выход = 220 г, 88%). LCMS: масса/заряд 512,44 (M+H)+.
Стадия 7. 12-(трет-Бутил)-4-этил-(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксилат

К перемешиваемому раствору 3-(трет-бутил)-11-этил-(E)-1,13-диамино-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата (200 г, 351 ммоль) в 2,5 л DMF по каплям добавляли раствор 1-этил-3-метил-1H-пиразол-5-карбонилизотиоцианата (137 г, 702 ммоль) в 200 мл DMF при 0°C. Реакционную смесь перемешивали при 0°C в течение 30 минут, после чего в реакционную смесь добавляли 3-(этилиминометилиденамино)-N,N-диметилпропан-1-амина гидрохлорид (269 г, 1405 ммоль) с последующим добавлением DIPEA (368 мл, 2107 ммоль). Обеспечивали нагревание реакционной смеси до к. т. и перемешивали в течение ночи. Протекание реакции отслеживали с помощью LCMS и по завершении реакционную смесь концентрировали при пониженном давлении и добавляли воду. Полученный твердый осадок фильтровали c получением неочищенного продукта, который очищали с помощью колоночной хроматографии с использованием в качестве элюента 5% DCM-MeOH с получением продукта. Для дополнительной очистки твердое вещество промывали с помощью MeOH c получением чистого продукта (выход = 170 г, 58%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,91 (d, J = 7,3 Гц, 2H), 7,83 (d, J = 1,3 Гц, 1H), 7,81 (d, J = 1,3 Гц, 1H), 7,51 (d, J = 1,4 Гц, 1H), 7,45 (d, J = 1,4 Гц, 1H), 6,54 (s, 2H), 5,48 (s, 2H), 4,87 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,40 (q, J = 5,0 Гц, 4H), 4,34 (q, J = 7,1 Гц, 2H), 2,32 - 2,21 (m, 2H), 2,07 (s, 6H), 1,57 (s, 9H), 1,34 (t, J = 7,1 Гц, 3H), 1,27 (t, J = 7,1 Гц, 6H). LCMS: масса/заряд 835,05 (M+H)+.
Стадия 8. (E)-4-(Этоксикарбонил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоновая кислота
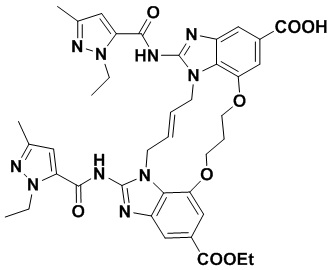
2-(трет-Бутил)-4-этил-(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксилат (160 г, 192 ммоль) растворяли в 1,5 л DCM и TFA (517 мл, 6707 ммоль) добавляли, и раствор перемешивали при к. т. в течение 12 ч. Реакцию отслеживали с помощью LCMS и после завершения летучие вещества концентрировали и добавляли диэтиловый эфир, получая бледно-желтое твердое вещество в результате осаждения. Твердое вещество фильтровали с получением продукта, который промывали с помощью 50% EtOAc:простой эфир с получением чистого продукта (выход = 143 г, 96%). 1H ЯМР (400 МГц, DMSO-d6) δ 7,83 (d, J = 1,3 Гц, 1H), 7,81 (d, J = 1,3 Гц, 1H), 7,54 - 7,47 (m, 2H), 6,56 (s, 2H), 5,50 (s, 2H), 4,88 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,40 (t, J = 5,4 Гц, 4H), 4,34 (q, J = 7,1 Гц, 2H), 2,27 (t, J = 5,6 Гц, 2H), 2,08 (s, 6H), 1,34 (t, J = 7,1 Гц, 3H), 1,27 (t, J = 7,1 Гц, 6H). LCMS: масса/заряд 779,16 (M+H)+.
Стадия 9. Этил-(E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксилат
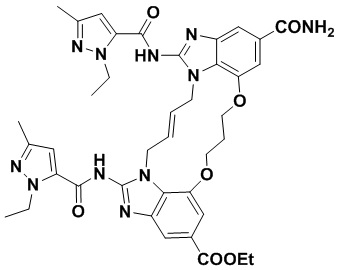
(E)-4-(Этоксикарбонил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоновую кислоту (140 г, 180 ммоль) суспендировали в 2 л смеси растворителей, состоящей из DMF и THF, в соотношении 1:1 и CDI (117 г, 719 ммоль) добавляли частями. По мере реакции образования комплекса CDI смесь становилась однородной. Через час при 60°C реакционную смесь охлаждали до комнатной температуры, добавляли 28% водный раствор гидроксида аммония (250 мл, 1798 ммоль) и реакционную смесь перемешивали при комнатной температуре. Начал образовываться густой грязно-белый твердый осадок, и после перемешивания в течение 3 ч. летучие вещества концентрировали, добавляли воду, полученный неочищенный продукт фильтровали и сушили. Неочищенный продукт нагревали с обратным холодильником с помощью МеОН:THF в соотношении 1:1 в течение 2 ч. и фильтровали, а затем снова суспендировали в DMF, нагревали до 90°C в течение 2 ч. и фильтровали с получением чистого продукта (выход = 125 г, 89%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,92 (s, 1H), 12,87 (s, 1H), 8,00 (brs, 1H), 7,84 (s, 1H), 7,70 (s, 1H), 7,52 (d, J = 5,7 Гц, 2H), 7,37 (brs, 1H), 6,54 (d, J = 5,6 Гц, 2H), 5,50 (s, 2H), 4,88 (brs, 4H), 4,53 (d, J = 7,3 Гц, 4H), 4,42 (q, J = 5,9 Гц, 4H), 4,34 (q, J = 7,1 Гц, 2H), 2,36 - 2,21 (m, 2H), 2,08 (s, 6H), 1,35 (t, J = 7,1 Гц, 3H), 1,27 (t, J = 7,1 Гц, 7H). LCMS: масса/заряд 778,16 (M+H)+.
Стадия 10. (E)-4-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоновая кислота (промежуточное соединение 1)
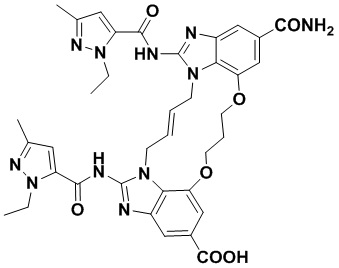
К перемешиваемой суспензии этил-(E)-4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксилата (105 г, 135 ммоль) в 2 л смеси растворителей, состоящей из MeOH и THF, в соотношении 1:1 добавляли раствор гидрата гидроксида лития (56,6 г, 1350 ммоль) в 300 мл воды. После добавления основания смесь становилась однородной и ее нагревали при 45°С в течение 24 ч. Реакцию отслеживали с помощью LCMS. После завершения реакционную смесь концентрировали при пониженном давлении и добавляли воду, pH регулировали до 6 с применением 3 н. HCl. Полученное твердое вещество фильтровали и промывали ацетонитрилом, далее диэтиловым эфиром с получением (E)-4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоновой кислоты (выход = 100 г, 99%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,89 (brs, 2H), 8,01 (brs, 1H), 7,81 (s, 1H), 7,71 (s, 1H), 7,53 (d, J = 8,1 Гц, 2H), 7,37 (brs, 1H), 6,55 (s, 2H), 5,51 (s, 2H), 4,89 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,42 (q, J = 6,3 Гц, 4H), 2,29 (t, J = 5,7 Гц, 2H), 2,08 (s, 6H), 1,27 (t, J = 7,1 Гц, 6H). LCMS: масса/заряд 750,28 (M+H)+.
Альтернативный способ получения промежуточного соединения 1
Стадия 1. Этил-4-хлор-3-(3-гидроксипропокси)-5-нитробензоат
В раствор этил-4-хлор-3-гидрокси-5-нитробензоата (15 г, 61,1 ммоль) в 150 мл DMF добавляли карбонат калия (16,88 г, 122 ммоль) и обеспечивали перемешивание суспензии при комнатной температуре. Через 15 мин. добавляли 3-бромпропан-1-ол (11,03 г, 79 ммоль) и температуру повышали до 100°С и протекание реакции отслеживали с помощью TLC. После завершения реакции смесь выливали в воду и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали с получением неочищенного продукта, который очищали на колонке с получением чистого продукта в виде бледно-желтого твердого вещества. (13 г, 70%). 1H ЯМР (400 МГц, CDCl3) δ 8,04 (d, J = 1,8 Гц, 1H), 7,80 (d, J = 1,8 Гц, 1H), 4,44 (q, J = 7,1 Гц, 2H), 4,34 (t, J = 5,9 Гц, 2H), 3,94 (t, J = 5,8 Гц, 2H), 2,17 (m, 2H), 1,43 (t, J = 7,1 Гц, 3H).
Стадия 2. Этил-4-хлор-3-(3-((метилсульфонил)окси)пропокси)-5-нитробензоат
Этил-4-хлор-3-(3-гидроксипропокси)-5-нитробензоат (13 г, 42,8 ммоль) растворяли в 120 мл THF и раствор охлаждали до 0°C. В него добавляли метансульфонилхлорид (6,67 мл, 86 ммоль) с последующим добавлением триэтиламина (23,87 мл, 171 ммоль), и обеспечивали нагревание реакционной смеси до к. т. в течение периода 2 ч. Реакционную смесь гасили добавлением воды и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали с получением неочищенного продукта, который был достаточно очищен для следующей стадии и использовался как таковой. (13 г, 80%). 1H ЯМР (400 МГц, CDCl3) δ 8,07 (d, J = 1,8 Гц, 1H), 7,79 (d, J = 1,8 Гц, 1H), 4,53 (t, J = 5,9 Гц, 2H), 4,45 (q, J = 7,1 Гц, 2H), 4,32 (t, J = 5,8 Гц, 2H), 3,05 (s, 3H), 2,37 (m, 3H), 1,44 (t, J = 7,1 Гц, 3H); LCMS: масса/заряд = 404,1 (M+Na)+
Стадия 3. Этил-3-(3-(5-карбамоил-2-хлор-3-нитрофенокси)пропокси)-4-хлор-5-нитробензоат
В раствор 4-хлор-3-гидрокси-5-нитробензамида (7,2 г, 33,2 ммоль) в 150 мл DMF добавляли карбонат калия (11,49 г, 83 ммоль) и обеспечивали перемешивание суспензии при комнатной температуре. Этил-4-хлор-3-(3-((метилсульфонил)окси)пропокси)-5-нитробензоат (12,69 г, 33,2 ммоль) добавляли через 15 мин. и температуру повышали до 100°C и протекание реакции отслеживали с помощью TLC. После завершения реакции смесь выливали в воду и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали с получением неочищенного продукта, который промывали диэтиловым эфиром с получением продукта в виде бледно-коричневого твердого вещества. (12,5 г, 75%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,30 (s, 1H), 8,10 (d, J = 1,7 Гц, 1H), 8,06 (d, J = 1,8 Гц, 1H), 7,91 (d, J = 1,9 Гц, 1H), 7,86 (d, J = 1,8 Гц, 1H), 7,80 (s, 1H), 4,50 - 4,42 (m, 4H), 4,37 (q, J = 7,1 Гц, 2H), 2,36 (m, 2H), 1,34 (t, J = 7,1 Гц, 3H),; LCMS: масса/заряд = 502,2 (M+H)+
Стадия 4. Этил-(E)-11-карбамоил-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3-карбоксилат
К перемешиваемому раствору этил-3-(3-(5-карбамоил-2-хлор-3-нитрофенокси)пропокси)-4-хлор-5-нитробензоата (20 г, 39,8 ммоль) в смеси 300 мл этанола и 100 мл THF добавляли (E)-бут-2-ен-1,4-диамина дигидрохлорид (8,23 г, 51,8 ммоль) и DIPEA (41,7 мл, 239 ммоль) и реакционную смесь перемешивали при 120°C в течение 30 ч. в автоклаве. Затем реакционную смесь концентрировали при пониженном давлении и полученное темно-красное твердое вещество промывали минимальным объемом этанола, а затем диэтиловым эфиром с получением продукта. (15 г, 73%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,36 (t, J = 6,7 Гц, 1H), 8,28 - 8,21 (m, 2H), 8,07 (t, J = 6,8 Гц, 1H), 8,01 (s, 1H), 7,63 (d, J = 1,9 Гц, 1H), 7,53 (d, J = 1,9 Гц, 1H), 7,33 (s, 1H), 5,74 (t, J = 2,2 Гц, 2H), 4,29 (q, J = 7,1 Гц, 2H), 4,21 - 4,08 (m, 8H), 2,23 (m, 2H), 1,31 (t, J = 7,1 Гц, 3H).; LCMS: масса/заряд = 515,57 (M+H)+
Стадия 5. Этил-(E)-1,13-диамино-11-карбамоил-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3-карбоксилат
К перемешиваемой суспензии этил-(E)-11-карбамоил-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3-карбоксилата (9,5 г, 18,43 ммоль) в уксусной кислоте (52,8 мл, 921 ммоль) частями добавляли порошок цинка (7,2 г, 111 ммоль) при комнатной температуре и реакционную смесь перемешивали в течение 1 ч. Протекание реакции отслеживали с помощью LCMS и после полного превращения исходного материала в продукт реакционную смесь фильтровали через слой целита. Фильтрат, содержащий диамин в уксусной кислоте, отгоняли, и неочищенный продукт промывали диэтиловым эфиром, а затем 10% водным раствором NaHCO3. Затем диамин высушивали для следующей реакции путем азеотропной перегонки с толуолом. (7,2 г, 86%). 1H ЯМР (400 МГц, DMSO-d6) δ 7,63 (s, 1H), 7,02 (d, J = 1,8 Гц, 1H), 6,98 (s, 1H), 6,92 (d, J = 1,9 Гц, 1H), 6,90 (d, J = 1,9 Гц, 1H), 6,87 (d, J = 1,8 Гц, 1H), 5,53 - 5,36 (m, 2H), 4,82 (s, 2H), 4,66 (s, 2H), 4,23 - 4,08 (m, 6H), 2,28 - 2,16 (m, 2H), 1,29 (t, J = 7,1 Гц, 3H).; LCMS: масса/заряд = 456,23 (M+H)+
Стадия 6. Этил-(E)-4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксилат
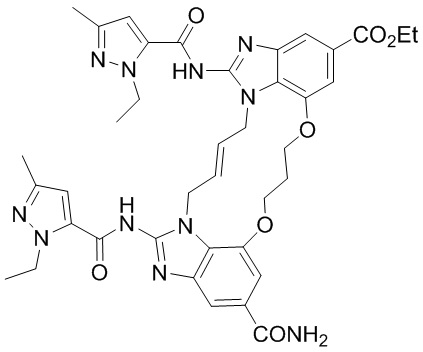
К перемешиваемому раствору этил-(E)-1,13-диамино-11-карбамоил-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3-карбоксилата (7,2 г, 15,81 ммоль) в 100 мл DMF, охлажденному до 0°C, добавляли 1-этил-3-метил-1H-пиразол-5-карбонилизотиоцианат (6,17 г, 31,6 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 минут, после чего добавляли 3-(этилиминометилиденамино)-N,N-диметилпропан-1-амина гидрохлорид (10,61 г, 55,3 ммоль) с последующим добавлением DIPEA (16,56 мл, 95 ммоль) в реакционную смесь. После добавления обеспечивали нагревание реакционной смеси до к. т. и перемешивали в течение ночи. Затем DMF концентрировали при пониженном давлении и к нему добавляли воду, что приводило к осаждению продукта. Осадок фильтровали и промывали водой с получением неочищенного продукта, который затем очищали растиранием с ацетонитрилом, с получением продукта, который использовали как таковой на следующей стадии. (8,5 г, 69%). LCMS: масса/заряд = 778,16 (M+H)+
Стадия 7. (E)-4-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоновая кислота (промежуточное соединение 1)
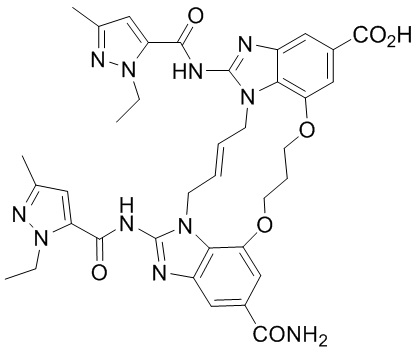
Этил-(Е)-4-карбамоил-1,15-бис(1-этил-3-метил-1Н-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7Н-6,10-диокса-2,14,15а,19а-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксилат (11,5 г, 14,78 ммоль) суспендировали в смеси 1:1 200 мл МеОН и THF и к нему добавляли раствор гидрата гидроксида лития (3,10 г, 73,9 ммоль) в 40 мл воды, что приводило к образованию прозрачного раствора. Реакционную смесь перемешивали при комнатной температуре и протекание гидролиза отслеживали с помощью LCMS. После завершения реакции летучие вещества концентрировали и добавляли 100 мл воды. Водную часть промывали диэтиловым эфиром и затем подкисляли посредством добавления 3 н. раствора HCl, что приводило к осаждению кислоты. Осадок фильтровали и промывали водой с получением неочищенного продукта, который затем очищали растиранием с ацетонитрилом. (8 г, 72%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,01 (s, 1H), 7,81 (s, 1H), 7,71 (s, 1H), 7,53 (d, J = 7,5 Гц, 2H), 7,37 (s, 1H), 6,55 (s, 2H), 5,51 (s, 2H), 4,89 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,47 - 4,35 (m, 4H), 2,32 - 2,24 (m, 2H), 2,08 (s, 6H), 1,27 (t, J = 7,1 Гц, 6H).; LCMS: масса/заряд = 750,16 (M+H)+
Синтез 2-(1H-тетразол-5-ил)этан-1-амина (пром. соед. 2)

Стадия 1. Синтез 3-(1,3-диоксоизоиндолин-2-ил)пропаннитрила
К перемешиваемому раствору фталимида калия (7 г, 37,8 ммоль) в 50 мл DMF добавляли 3-бромпропаннитрил (2,02 г, 15,12 ммоль) и смесь нагревали при 80oC в течение 3 ч. После завершения реакционную смесь гасили посредством добавления воды и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали с получением неочищенного продукта, который очищали на колонке, с получением чистого продукта (выход = 3,15 г, 96%). 1H ЯМР (400 МГц, CDCl3) δ 7,93 - 7,90 (m, 2H), 7,79 - 7,77 (m, 2H), 4,04 (t, J = 6,9 Гц, 2H), 2,83 (t, J = 6,9 Гц, 2H).
Стадия 2. Синтез 2-(2-(1H-тетразол-5-ил)этил)изоиндолин-1,3-диона
В раствор 3-(1,3-диоксоизоиндолин-2-ил)пропаннитрила (3,04 г, 15,22 ммоль) в 50 мл диоксана добавляли азидотрибутилолово (10,35 мл, 37,8 ммоль) и смесь нагревали в герметичной пробирке при 80°C в течение 36 ч. После завершения реакционную смесь концентрировали и разбавляли этилацетатом и органический слой промывали солевым раствором. Органический слой высушивали над Na2SO4 и неочищенный продукт очищали на колонке (выход = 2,0 г, 54%). 1H ЯМР (400 МГц, DMSO-d6) δ 7,91 - 7,82 (m, 4H), 3,92 (t, J = 6,8 Гц, 2H), 3,25 (t, J = 6,8 Гц, 2H); LCMS: масса/заряд = 244,2 (M+H)+
Стадия 3. Синтез 2-(1H-тетразол-5-ил)этан-1-амина
2-(2-(1H-Тетразол-5-ил)этил)изоиндолин-1,3-дион (0,8 г, 3,29 ммоль) растворяли в 30 мл EtOH и в него добавляли гидрат гидразина (823 мг, 16,45 ммоль) и реакционную смесь нагревали при 60°C в течение 1 ч. Начал образовываться белый осадок, количество которого увеличивалось по мере протекания реакции. Реакционную смесь затем охлаждали до к. т. и фильтровали. Фильтрат концентрировали с получением неочищенного амина, который был достаточно чистым для следующей стадии и использовался как таковой (выход = 0,25 г, 67%). 1H ЯМР (400 МГц, DMSO-d6) δ 3,04 (t, J = 8,0 Гц, 2H), 2,90 (t, J = 8,0 Гц, 2H); LCMS: масса/заряд = 114,07 (M+H)+
Синтез (1R,4R)-4-(1H-тетразол-5-ил)циклогексан-1-амина трифторацетата (пром. соед. 3a)
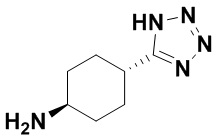
Стадия 1. Синтез трет-бутил-((1r,4r)-4-(1H-тетразол-5-ил)циклогексил)карбамата
трет-Бутил-((1r,4r)-4-цианоциклогексил)карбамат (3 г, 13,37 ммоль), (синтезирован, как в Journal of Medicinal Chemistry, 55(15):6866-6880; 2012), растворяли в 40 мл DMF и азида натрия (3,48 г, 53,5 ммоль) и добавляли хлорид аммония (7,15 г, 134 ммоль), и смесь нагревали в герметичной пробирке в течение 36 ч. После завершения реакции смесь фильтровали и фильтрат концентрировали. Остаток растворяли в этилацетате и органический слой промывали солевым раствором. Органический слой высушивали над Na2SO4 и концентрировали с получением продукта (выход = 2,3 г, 63%). 1H ЯМР (400 МГц, DMSO-d6) δ 6,83 (d, J = 7,9 Гц, 1H), 3,30 - 3,21 (m, 1H), 2,93 - 2,82 (m, 1H), 2,09 - 1,99 (m, 2H), 1,96 - 1,83 (m, 2H), 1,53 (m, 2H), 1,39 (s, 9H), 1,37 - 1,22 (m, 2H); LCMS: масса/заряд = 268,46 (M+H)+
Стадия 2. Синтез (1r,4r)-4-(1H-тетразол-5-ил)циклогексан-1-амина трифторацетата (пром. соед. 3a)
трет-Бутил-((1r,4r)-4-(1H-тетразол-5-ил)циклогексил)карбамат (2 г, 7,48 ммоль) растворяли в 40 мл CH2Cl2 и добавляли трифторуксусную кислоту (8,65 мл, 112 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения удаления защитной группы, как отслеживали посредством TLC, реакционную смесь выпаривали до сухого состояния и твердое вещество дважды растирали в порошок с диэтиловым эфиром. Твердую трифторацетатную соль фильтровали и промывали простым эфиром (выход = 1,1 г, 88%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,16 - 7,76 (m, 3H), 3,18 - 3,02 (m, 1H), 3,02 - 2,81 (m, 1H), 2,18 - 1,97 (m, 4H), 1,64 - 1,39 (m, 4H); LCMS: масса/заряд = 168,13 (M+H)+
Синтез (1R,4R)-4-(1H-тетразол-5-ил)циклогексан-1-амина гидрохлорида (пром. соед. 3b)
Синтезировали из трет-бутил-((1r,4r)-4-(1H-тетразол-5-ил)циклогексил)карбамата в соответствии с аналогичной процедурой, описанной для удаления защитной группы на стадии 2, как указано выше, с заменой трифторуксусной кислоты 4 н. хлористоводородной кислотой в диоксане (выход = 93%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,18 (brs, 3H), 3,12 - 3,00 (m, 1H), 3,00 - 2,89 (m, 1H), 2,09 (m, 4H), 1,67 - 1,45 (m, 4H); LCMS: масса/заряд = 168,13 (M+H)+
Синтез (1S,4S)-4-(1H-тетразол-5-ил)циклогексан-1-амина (пром. соед. 4)
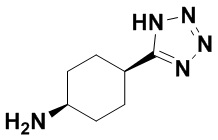
Синтезировали из трет-бутил-((1S,4S)-4-цианоциклогексил)карбамата (синтезировали, как в публикации международной заявки PCT № WO 2009145719) в соответствии с аналогичной процедурой, описанной для пром. соед. 3a в виде трифторацетатной соли. (Выход = 51%). LCMS: масса/заряд = 168,13 (M+H)+
Синтез этил-1-(3-аминопропил)-1H-пиразол-4-карбоксилата (пром. соед. 5)
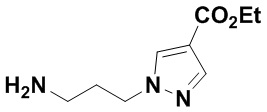
Стадия 1. Этил-1-(3-(1,3-диоксоизоиндолин-2-ил)пропил)-1H-пиразол-4-карбоксилат
2-(3-Гидроксипропил)изоиндолин-1,3-дион (600 мг, 2,92 ммоль) (синтезировали, как в Angewandte Chemie, International Edition, 57(1):292-295; 2018) и этил-1H-пиразол-4-карбоксилат (451 мг, 3,22 ммоль) растворяли в 20 мл ТГФ с последующим добавлением трифенилфосфина (997 мг, 3,80 ммоль). Диизопропилазодикарбоксилат (0,853 мл, 4,39 ммоль) добавляли по каплям и после добавления реакционную смесь перемешивали при к. т. в течение 4 ч. После завершения реакционную смесь гасили посредством добавления воды и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали с получением неочищенного продукта, который очищали на колонке, с получением чистого продукта (выход = 400 мг, 42%). 1H ЯМР (400 МГц, CDCl3) δ 8,02 (s, 1H), 7,90 (s, 1H), 7,89 - 7,85 (m, 2H), 7,77 - 7,74 (m, 2H), 4,30 (q, J = 7,1 Гц, 2H), 4,21 (t, J = 6,8 Гц, 2H), 3,77 (t, J = 6,5 Гц, 2H), 2,33 (p, J = 6,7 Гц, 2H), 1,36 (t, J = 7,1 Гц, 3H); LCMS: масса/заряд = 328,3 (M+H)+
Стадия 2. Этил-1-(3-аминопропил)-1H-пиразол-4-карбоксилат
Синтезировали из этил-1-(3-(1,3-диоксоизоиндолин-2-ил)пропил)-1H-пиразол-4-карбоксилата, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 3 пром. соед. 2. (Выход = 83%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,34 (s, 1H), 7,84 (s, 1H), 4,24 - 4,18 (m, 4H), 2,47 (t, J = 6,6 Гц, 2H), 1,84 (m, 2H), 1,26 (t, J = 7,1 Гц, 3H); LCMS: масса/заряд = 198,2 (M+H)+
Синтез метил-2-(аминометил)никотината гидрохлорида (пром. соед. 6)
Синтезировали из метил-2-цианоникотината в соответствии с процедурой, описанной в J. of Heterocyclic Chemistry, 1993, 30(2):473-476.
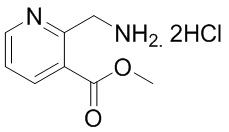
1H ЯМР (400 МГц, DMSO-d6) δ 8,84 (dd, J = 4,8, 1,7 Гц, 1H), 8,51 (s, 2H), 8,38 (dd, J = 7,9, 1,7 Гц, 1H), 7,62 (dd, J = 7,9, 4,8 Гц, 2H), 4,52 (q, J = 5,8 Гц, 2H), 3,90 (s, 3H).
Синтез 1-(3-аминопропил)-1,4-дигидро-5H-тетразол-5-она (пром. соед. 7)
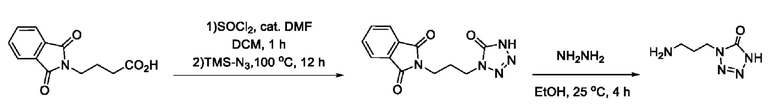
Стадия 1. 2-(3-(5-Оксо-4,5-дигидро-1H-тетразол-1-ил)пропил)изоиндолин-1,3-дион
4-(1,3-Диоксоизоиндолин-2-ил)бутановую кислоту (1 г, 4,29 ммоль) (синтезировали, как в European Journal of Medicinal Chemistry, 158:184-200; 2018) суспендировали в 50 мл DCM и в нее добавляли несколько капель DMF. Тионилхлорид (0,47 мл, 6,43 ммоль) добавляли по каплям при 0°C и реакционную смесь перемешивали при к. т. в течение 1 ч. до полного образования хлорангидрида. Затем летучие вещества концентрировали и липкий остаток подвергали азеотропной перегонке с толуолом для удаления любых следов избытка тионилхлорида. Затем неочищенный хлорангидрид растворяли в триметилсилилазиде (4,55 мл, 34,3 ммоль) и нагревали в течение 12 ч. при 100°С в герметичной пробирке. Затем реакционную смесь охлаждали и добавляли метанол, что приводило к осаждению продукта в виде белого твердого вещества (выход = 400 мг, 34%). 1H ЯМР (400 МГц, DMSO-d6) δ 14,33 (brs, 1H), 7,94 - 7,71 (m, 4H), 3,91 (t, J = 7,0 Гц, 2H), 3,64 (t, J = 7,1 Гц, 2H), 2,09 (m, 2H); LCMS: масса/заряд = 274,2 (M+H)+
Стадия 2. 1-(3-Аминопропил)-1,4-дигидро-5H-тетразол-5-он
Синтезировали из 2-(3-(5-оксо-4,5-дигидро-1H-тетразол-1-ил)пропил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 3 пром. соед. 2. (Выход = 66%). 1H ЯМР (400 МГц, DMSO-d6) δ 3,89 - 3,83 (m, 2H), 2,68 - 2,63 (m, 2H), 1,89 - 1,82 (m, 2H).
Синтез 3-(3-аминопропил)-1,2,4-оксадиазол-5(4H)-она (пром. соед. 8)
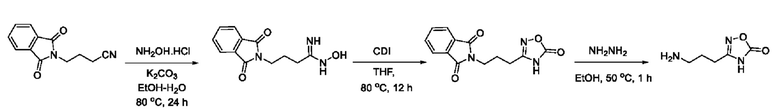
Стадия 1. Синтез 4-(1,3-диоксоизоиндолин-2-ил)-N-гидроксибутанимид-амида
4-(1,3-Диоксоизоиндолин-2-ил)бутаннитрил (синтезировали, как в J. of Organometallic Chemistry, 620(1-2):94-105; 2001) (4,5 г, 21,01 ммоль) растворяли в смеси 50 мл EtOH и 10 мл воды. Добавляли гидроксиламина гидрохлорид (3,65 г, 52,5 ммоль) и K2CO3 (4,35 г, 31,5 ммоль) и реакционную смесь нагревали в течение 24 ч. при 80°C, после чего реакционную смесь концентрировали и очищали с помощью колонки (выход = 600 мг, 12%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,74 (s, 1H), 7,94 - 7,81 (m, 4H), 5,36 (brs, 2H), 3,58 (t, J = 7,1 Гц, 2H), 2,05 - 1,95 (m, 2H), 1,86 - 1,75 (m, 2H); LCMS: масса/заряд = 248,33 (M+H)+
Стадия 2. 2-(3-(5-Оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)изоиндол-ин-1,3-дион
В раствор 4-(1,3-диоксоизоиндолин-2-ил)-N-гидроксибутанимидамида (520 мг, 2,10 ммоль) в 20 мл THF добавляли CDI (443 мг, 2,73 ммоль) и реакционную смесь нагревали при 80°C в течение 12 ч. После завершения реакции летучие вещества концентрировали и остаток растворяли в этилацетате, и органический слой промывали солевым раствором. Органический слой высушивали над Na2SO4 и концентрировали с получением неочищенного продукта, который был достаточно очищен для следующей стадии. 1H ЯМР (400 МГц, DMSO-d6) δ 7,91 - 7,81 (m, 4H), 7,78 (brs, 1H), 3,63 (t, J = 6,8 Гц, 2H), 2,21 - 2,14 (m, 2H), 1,91 (t, J = 7,4 Гц, 2H); LCMS: масса/заряд = 274,21 (M+H)+
Стадия 3. 3-(3-Аминопропил)-1,2,4-оксадиазол-5(4H)-он
Синтезировали из 2-(3-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)изоиндолин-1,3-диона, полученного на стадии 2, в соответствии с аналогичной процедурой, описанной на стадии 3 пром. сред. 2. (Выход = 40%). 1H ЯМР (400 МГц, DMSO-d6) δ 2,83 (t, J = 6,7 Гц, 2H), 2,31 (t, J = 6,9 Гц, 2H), 1,75 (t, J = 6,8 Гц, 2H).
Синтез 2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)этан-1-амина (пром. соед. 9)
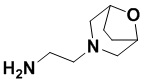
Стадия 1. 2-(2-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)этил)изоиндолин-1,3-дион
2-(2-Бромэтил)изоиндолин-1,3-дион (3 г, 11,81 ммоль) (Org. Biomol. Chem., 9(12):4498-4506; 2011), KI (0,39 г, 2,36 ммоль) и K2CO3 (3,26 г, 23,61 ммоль) добавляли в раствор (1R,5S)-8-окса-3-азабицикло[3.2.1]октана гидрохлорида (1,77 г, 11,81 ммоль) в 30 мл DMF при комнатной температуре. Реакционную смесь нагревали при 90°C в течение 12 ч., после чего реакционную смесь гасили посредством добавления воды и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали с получением неочищенного продукта, который очищали посредством колоночной хроматографии (выход = 2,5 г, 74%). 1H ЯМР (400 МГц, CDCl3) δ 7,93 - 7,83 (m, 2H), 7,77 - 7,71 (m, 2H), 4,31 - 4,19 (m, 2H), 3,79 (t, J = 6,1 Гц, 2H), 2,71 - 2,54 (m, 4H), 2,41 - 2,23 (m, 2H), 1,72 - 1,66 (m, 4H).; LCMS: масса/заряд = 287,34 (M+H)+
Стадия 2. 2-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)этан-1-амин
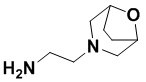
К раствору 2-(2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)этил)изоиндолин-1,3-диона (1,5 г, 5,24 ммоль) в 30 мл этанола добавляли гидразин (1,64 мл, 52,4 ммоль) и смесь перемешивали с обратным холодильником в течение 1 ч. Осажденное белое твердое вещество отфильтровывали и промывали этанолом. Фильтрат концентрировали в вакууме, ресуспендировали в этилацетате и снова фильтровали с удалением следов побочного продукта фталимида. Фильтрат после концентрирования обеспечивал продукт в виде вязкого желтого масла (выход = 0,82 г, 73%). 1H ЯМР (400 МГц, CDCl3) δ 4,37 - 4,18 (m, 2H), 2,80 - 2,69 (m, 2H), 2,63 - 2,52 (m, 2H), 2,41 (dd, J = 6,5, 5,2 Гц, 2H), 2,37 - 2,29 (m, 2H), 1,97 - 1,92 (m, 2H), 1,92 - 1,83 (m, 2H).; GCMS: масса/заряд = 156,18 (M.+)
Синтез 3-(8-окса-3-азабицикло[3.2.1]октан-3-ил)пропан-1-амина (пром. соед. 10)
Стадия 1. 2-(3-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)пропил)изоиндолин-1,3-дион Синтезировали из (1R,5S)-8-окса-3-азабицикло[3.2.1]октана гидрохлорида и 2-(3-бромпропил)изоиндолин-1,3-диона (Chem. Eur. J., 2014, 20(6):1530-1538) с последующей аналогичной процедурой, описанной на стадии 1 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 7,90 - 7,83 (m, 2H), 7,76 - 7,69 (m, 2H), 4,38 - 4,22 (m, 2H), 3,86 - 3,73 (m, 2H), 2,66 - 2,51 (m, 2H), 2,37 (t, J = 6,6 Гц, 2H), 2,32 - 2,18 (m, 2H), 1,95 - 1,77 (m, 6H).; LCMS: масса/заряд = 301,34 (M+H)+
Стадия 2. 3-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)пропан-1-амин Синтезировали из 2-(3-(8-окса-3-азабицикло[3.2.1]октан-3-ил)пропил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 4,33 - 4,23 (m, 2H), 2,77 (t, J = 6,8 Гц, 2H), 2,65 - 2,54 (m, 2H), 2,36 (t, J = 6,9 Гц, 2H), 2,29 - 2,21 (m, 2H), 1,93 - 1,81 (m, 5H), 1,59 (p, J = 6,8 Гц, 2H).; GCMS: масса/заряд = 170,22 (M.+)
Синтез 4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)бутан-1-амина (пром. соед. 11)
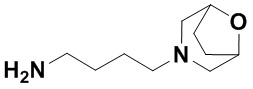
Стадия 1. 2-(4-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)бутил)изоиндолин-1,3-дион Синтезировали из (1R,5S)-8-окса-3-азабицикло[3.2.1]октана гидрохлорида и 2-(4-бромбутил)изоиндолин-1,3-диона (ACS Med. Chem. Lett., 2016, 7(3):245-249) с последующей аналогичной процедурой, описанной на стадии 1 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 7,86 (dd, J = 5,4, 3,1 Гц, 2H), 7,74 (dd, J = 5,4, 3,0 Гц, 2H), 4,39 - 4,21 (m, 2H), 3,72 (t, J = 7,0 Гц, 2H), 2,43 - 2,21 (m, 3H), 2,00 - 1,80 (m, 3H), 1,74 (t, J = 7,4 Гц, 2H), 1,70 - 1,59 (m, 4H), 1,58 - 1,40 (m, 2H).; LCMS: масса/заряд = 315,40 (M+H)+
Стадия 2. 4-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)бутан-1-амина Синтезировали из 2-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)бутил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 4,26 (dd, J = 4,6, 2,3 Гц, 2H), 2,79 (t, J = 6,7 Гц, 2H), 2,61 - 2,53 (m, 2H), 2,33 - 2,20 (m, 6H), 1,90 (dd, J = 9,3, 2,0 Гц, 4H), 1,86 - 1,80 (m, 2H), 1,57 - 1,45 (m, 2H).; LCMS: масса/заряд = 185,51 (M+H)+
Синтез 3-(4-фторпиперидин-1-ил)пропан-1-амина (пром. соед. 12)
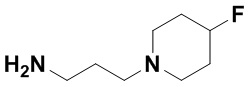
Стадия 1. 2-(3-(4-Фторпиперидин-1-ил)пропил)изоиндолин-1,3-дион Синтезировали из 4-фторпиперидина гидрохлорида и 2-(3-бромпропил)изоиндолин-1,3-диона в соответствии с аналогичной процедурой, описанной на стадии 1 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 7,89 - 7,82 (m, 2H), 7,78 - 7,69 (m, 2H), 4,69 - 4,44 (m, 1H), 3,78 (t, J = 6,9 Гц, 2H), 2,63 - 2,48 (m, 2H), 2,43 (t, J = 6,9 Гц, 2H), 2,40 - 2,26 (m, 2H), 1,89 (q, J = 6,9 Гц, 2H), 1,81 - 1,70 (m, 4H). LCMS: масса/заряд = 290,59 (M+H)+
Стадия 2. 3-(4-Фторпиперидин-1-ил)пропан-1-амин Синтезировали из 2-(3-(4-фторпиперидин-1-ил)пропил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 4,69 (dt, J = 50,5, 4,4 Гц, 1H), 2,77 (t, J = 6,8 Гц, 2H), 2,59 (d, J = 7,2 Гц, 3H), 2,47 - 2,29 (m, 3H), 1,95 - 1,85 (m, 4H), 1,73 - 1,59 (m, 4H). LCMS: масса/заряд = 160,28 (M+H)+
Синтез (R)-3-(3-фторпирролидин-1-ил)пропан-1-амина (пром. соед. 13)
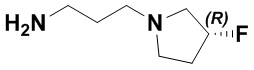
Стадия 1. (R)-2-(3-(3-Фторпирролидин-1-ил)пропил)изоиндолин-1,3-дион Синтезировали из (R)-3-фторпирролидина гидрохлорида и 2-(3-бромпропил)изоиндолин-1,3-диона в соответствии с аналогичной процедурой, описанной на стадии 1 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 7,90 - 7,78 (m, 2H), 7,77 - 7,65 (m, 2H), 5,10 - 5,01 (m, 1H), 3,78 (d, J = 7,1 Гц, 2H), 2,89 - 2,64 (m, 3H), 2,60 - 2,54 (m, 2H), 2,40 (td, J = 8,4, 6,2 Гц, 1H), 2,15 - 1,96 (m, 2H), 1,90 (t, J = 6,8 Гц, 2H).; LCMS: масса/заряд = 277,2 (M+H)+
Стадия 2. (R)-3-(3-Фторпирролидин-1-ил)пропан-1-амин Синтезировали из (R)-2-(3-(3-фторпирролидин-1-ил)пропил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 5,15 - 5,06 (m, 1H), 3,03 - 2,92 (m, 1H), 2,90 - 2,83 (m, 1H), 2,80 (t, J = 6,8 Гц, 2H), 2,69 - 2,65 (m, 1H), 2,58 - 2,48 (m, 2H), 2,47 - 2,36 (m, 1H), 2,25 - 2,14 (m, 1H), 2,13 - 2,06 (m, 1H), 1,69 (dq, J = 8,1, 6,8 Гц, 2H).; LCMS: масса/заряд = 147,3 (M+H)+
Синтез (S)-3-(3-фторпирролидин-1-ил)пропан-1-амина (пром. соед. 14)
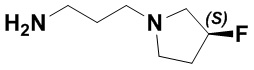
Стадия 1. (S)-2-(3-(3-Фторпирролидин-1-ил)пропил)изоиндолин-1,3-дион Синтезировали из (S)-3-фторпирролидина гидрохлорида и 2-(3-бромпропил)изоиндолин-1,3-диона в соответствии с аналогичной процедурой, описанной на стадии 1 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 7,90 - 7,78 (m, 2H), 7,77 - 7,65 (m, 2H), 5,10 - 5,01 (m, 1H), 3,78 (d, J = 7,1 Гц, 2H), 2,89 - 2,64 (m, 3H), 2,60 - 2,54 (m, 2H), 2,40 - 2,37 (m, 1H), 2,15 - 1,96 (m, 2H), 1,90 (t, J = 6,8 Гц, 2H).; LCMS: масса/заряд = 277,2 (M+H)+
Стадия 2. (S)-3-(3-Фторпирролидин-1-ил)пропан-1-амин Синтезировали из (S)-2-(3-(3-фторпирролидин-1-ил)пропил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 5,15 - 5,06 (m, 1H), 3,03 - 2,92 (m, 1H), 2,90 - 2,83 (m, 1H), 2,80 (t, J = 6,8 Гц, 2H), 2,69 - 2,55 (m,1H), 2,58 - 2,48 (m, 2H), 2,47 - 2,36 (m, 1H), 2,25 - 2,14 (m, 1H), 2,13 - 2,06 (m, 1H), 1,69 - 1,65 (m, 2H).; LCMS: масса/заряд = 147,3 (M+H)+
Синтез 3-(4-(метилсульфонил)пиперидин-1-ил)пропан-1-амина (пром. соед. 15)
Стадия 1. 2-(3-(4-(Метилсульфонил)пиперидин-1-ил)пропил)изоиндолин-1,3-дион Синтезировали из 4-(метилсульфонил)пиперидина гидрохлорида и 2-(3-бромпропил)изоиндолин-1,3-диона в соответствии с аналогичной процедурой, описанной на стадии 1 пром. соед. 9. 1H ЯМР (400 МГц, DMSO-d6) δ 7,88 - 7,82 (m, 4H), 4,11 - 3,95 (m, 1H), 3,67 - 3,57 (m, 2H), 2,97 - 2,85 (m, 5H), 2,32 (t, J = 6,6 Гц, 2H), 1,93 - 1,66 (m, 6H), 1,36 - 1,07 (m, 2H).; LCMS: масса/заряд = 351,34 (M+H)+
Стадия 2. 3-(4-(Метилсульфонил)пиперидин-1-ил)пропан-1-амин Синтезировали из 2-(3-(4-(метилсульфонил)пиперидин-1-ил)пропил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9. 1H ЯМР (400 МГц, DMSO-d6) δ 3,05 - 2,86 (m, 6H), 2,66 - 2,54 (m, 2H), 2,31 (t, J = 7,2 Гц, 2H), 2,09 - 1,82 (m, 4H), 1,63 - 1,44 (m, 4H).; LCMS: масса/заряд = 221,45 (M+H)+
Синтез 3-(3,3-дифторпирролидин-1-ил)пропан-1-амина (пром. соед. 16)
Стадия 1. 2-(3-(3,3-Дифторпирролидин-1-ил)пропил)изоиндолин-1,3-дион Синтезировали из 3,3-дифторпирролидина гидрохлорида и 2-(3-бромпропил)изоиндолин-1,3-диона в соответствии с аналогичной процедурой, описанной на стадии 1 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 7,93 - 7,82 (m, 2H), 7,79 - 7,70 (m, 2H), 3,80 (t, J = 6,9 Гц, 2H), 2,88 (t, J = 13,3 Гц, 2H), 2,71 (t, J = 6,9 Гц, 2H), 2,58 (t, J = 7,0 Гц, 2H), 2,16 (dq, J = 14,7, 7,2 Гц, 2H), 1,88 (p, J = 6,9 Гц, 2H).; LCMS: масса/заряд = 295,21 (M+H)+
Стадия 2. 3-(3,3-Дифторпирролидин-1-ил)пропан-1-амин Синтезировали из 2-(3-(3,3-дифторпирролидин-1-ил)пропил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 2,91 (t, J = 13,3 Гц, 2H), 2,84 - 2,70 (m, 4H), 2,55 (t, J = 7,2 Гц, 2H), 2,37 - 2,21 (m, 2H), 1,70 - 1,60 (m, 2H).
Синтез 3-(3,3-диметилморфолино)пропан-1-амина (пром. соед. 17)

Стадия 1. 2-(3-(3,3-Диметилморфолино)пропил)изоиндолин-1,3-дион Синтезировали из 3,3-диметилморфолина (Eur. J. Org. Chem., 2011, 17:3156-3164) и 2-(3-бромпропил)изоиндолин-1,3-диона в соответствии с аналогичной процедурой, описанной на стадии 1 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 7,91 - 7,80 (m, 2H), 7,79 - 7,68 (m, 2H), 3,75 - 3,70 (m, 2H), 3,32 (s, 2H), 2,77 (t, J = 6,7 Гц, 2H), 2,58 - 2,51 (m, 2H), 2,41 (t, J = 6,8 Гц, 2H), 1,57 (p, J = 6,8 Гц, 2H), 1,01 (s, 6H).; LCMS: масса/заряд = 303,1 (M+H)+
Стадия 2. 3-(3,3-Диметилморфолино)пропан-1-амин Синтезировали из 2-(3-(3,3-диметилморфолино)пропил)изоиндолин-1,3-диона, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9. 1H ЯМР (400 МГц, CDCl3) δ 3,75 - 3,70 (m, 2H), 3,32 (s, 2H), 2,77 (t, J = 6,7 Гц, 2H), 2,58 - 2,51 (m, 2H), 2,41 (t, J = 6,8 Гц, 2H), 1,57 (p, J = 6,8 Гц, 2H), 1,01 (s, 6H).; LCMS: масса/заряд = 172,95 (M+H)+
Синтез этил-(1S,3S)-3-аминоциклобутан-1-карбоксилата (пром. соед. 18)

Синтезировали из этил-(1R,3R)-3-гидроксициклобутан-1-карбоксилата в соответствии с процедурой, описанной в WO2016/115090A1. 1H ЯМР (400 МГц, хлороформ-d) δ 4,17 - 4,08 (m, 2H), 3,47 - 3,29 (m, 1H), 2,67 (tdd, J = 9,4, 8,5, 7,1 Гц, 1H), 2,61 - 2,48 (m, 2H), 2,02 - 1,88 (m, 2H), 1,29 - 1,24 (m, 4H).
Синтез этил-(1R,3R)-3-аминоциклобутан-1-карбоксилата (пром. соед. 19)

Синтезировали из этил-(1S,3S)-3-гидроксициклобутан-1-карбоксилата в соответствии с процедурой, описанной в WO2016/115090A1. 1H ЯМР (400 МГц, DMSO-d6) δ 4,08 (q, J = 7,1 Гц, 2H), 3,58 (dtd, J = 7,9, 6,9, 5,8 Гц, 1H), 3,09 - 3,01 (m, 1H), 2,41 - 2,31 (m, 2H), 2,10 (tdd, J = 9,8, 6,9, 2,7 Гц, 2H), 1,19 (t, J = 7,1 Гц, 3H).
Синтез этил-1-цианоциклопропан-1-карбоксилата (пром. соед. 20)

Стадия 1. Синтез этил-1-цианоциклопропан-1-карбоксилата
1,2-Дибромэтан (19,93 г, 106 ммоль) растворяли в DMF (30 мл) и охлаждали до 0°C. Этил-2-цианоацетат (10 г, 88 ммоль), K2CO3 (61,1 г, 442 ммоль) добавляли и полученную желтую взвесь перемешивали в течение 12 ч. при 120°C. Полученную смесь экстрагировали дважды с помощью этилацетата и объединенные органические экстракты промывали водой и солевым раствором и высушивали над сульфатом натрия, фильтровали и концентрировали с получением неочищенного материала. 1H ЯМР (400 МГц, хлороформ-d) δ 4,27 (q, J = 7,2 Гц, 2H), 1,68 (dd, J = 3,8, 3,1 Гц, 2H), 1,65 - 1,59 (m, 2H), 1,34 (t, J = 7,1 Гц, 3H).
Стадия 2. Синтез этил-1-(аминометил)циклопропан-1-карбоксилата
К раствору этил-1-цианоциклопропан-1-карбоксилата (1,0 г, 7,19 ммоль) в этаноле (объем: 50 мл) добавляли катализатор алюминий-никель, сплав типа Ренея, порошок Al-Ni 50/50 (0,630 г, 7,19 ммоль) (промывали этанолом несколько раз) и перемешивали под давлением H2 (45 фунтов/кв. дюйм) в смесителе Парра в течение 6 ч. Фильтровали реакционную смесь через слой целита и концентрировали при пониженном давлении с получением неочищенного продукта, который применяли как таковой. 1H ЯМР (400 МГц, DMSO-d6) δ 4,06 (dq, J = 12,1, 7,1 Гц, 2H), 3,37 - 3,26 (m, 2H), 1,18 (q, J = 7,0 Гц, 3H), 1,09 (h, J = 4,0 Гц, 1H), 1,04 (q, J = 3,8 Гц, 1H), 0,98 - 0,91 (m, 1H), 0,81 (q, J = 3,8 Гц, 1H).; LCMS: масса/заряд = 144,2 (M+H)+
Синтез метил-2-(2-аминоэтил)никотината дигидрохлорида (пром. соед. 21)
Стадия 1. Метил-2-(бромметил)никотинат
К перемешиваемому раствору метил-2-метилникотината (4,5 г, 29,8 ммоль), NBS (6,36 г, 35,7 ммоль), AIBN (0,49 г, 2,98 ммоль) в 50 мл тетрахлорметана перемешивали при 90°C в течение 16 ч. в атмосфере азота. После охлаждения реакционную смесь разбавляли с помощью 25 мл воды и водный слой экстрагировали дихлорметаном (100 мл x 2). Объединенные органические слои высушивали над сульфатом натрия и концентрировали под вакуумом, и полученный осадок очищали посредством флеш-хроматографии с применением 18-20% этилацетата в гексане с получением необходимого продукта в виде метил-2-(бромметил)никотината (выход = 3,2 г, 47%). 1H ЯМР (400 МГц, хлороформ-d) δ 8,73 (dd, J = 4,8, 1,8 Гц, 1H), 8,30 (dd, J = 7,9, 1,8 Гц, 1H), 7,45 - 7,29 (m, 1H), 5,06 (s, 2H), 4,00 (s, 3H).
Стадия 2. Метил-2-(цианометил)никотинат
К перемешиваемому раствору метил-2-(бромметил)никотината (3,0 г, 13,04 ммоль) в 50 мл ацетонитрила, охлажденного до 0-5°C, добавляли TBAF (5,11 г, 19,56 ммоль) и TMS-CN (2,59 г, 26,1 ммоль) и перемешивали при 25-30°C в течение 16 ч. в атмосфере азота. Протекание реакции отслеживали с помощью TLC. После завершения реакционную смесь разбавляли с помощью 25 мл воды и водный слой экстрагировали этилацетатом (100 мл x 2). Объединенные органические слои высушивали над сульфатом натрия и концентрировали под вакуумом, и полученный осадок очищали посредством флеш-хроматографии с применением 20-40% этилацетата в гексане с получением необходимого метил-2-(цианометил)никотината (выход = 1,6 г, 70%). 1H ЯМР (400 МГц, хлороформ-d) δ 8,78 (dd, J = 4,8, 1,8 Гц, 1H), 8,37 (dd, J = 7,9, 1,8 Гц, 1H), 7,43 (dd, J = 8,0, 4,8 Гц, 1H), 4,45 (s, 2H), 3,99 (s, 3H).
Стадия 3. Метил-2-(2-аминоэтил)никотината дигидрохлорид
В реакторе смесителя Парра к перемешиваемому раствору метил-2-(цианометил)никотината (0,50 г, 2,84 ммоль) в смеси метанол: DCM (объем: 30 мл, соотношение: 3:1) добавляли Pd/C (0,302 г, 0,284 ммоль) и HCl (0,35 мл, 4,26 ммоль) и реакционную смесь перемешивали под давлением водорода 50 фунтов/кв. дюйм в течение 3 ч. смесителе Парра. Реакционную смесь фильтровали через слой целита и слой целита промывали избытком MeOH. Фильтрат концентрировали при пониженном давлении с получением метил-2-(2-аминоэтил)никотината гидрохлорида (выход = 0,5 г, 81%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,79 - 8,71 (m, 1H), 8,33 - 8,23 (m, 1H), 7,55 - 7,45 (m, 1H), 3,92 - 3,88 (m, 3H).
Синтез метил-2-(3-аминопропил)бензоата (пром. соед. 22)
Стадия 1. Синтез метил-2-(3-(1,3-диоксоизоиндолин-2-ил)пропил)бензоата
Метил-2-йодбензоат (3,00 г, 11,45 ммоль) растворяли в 20 мл DMF и раствор дегазировали путем пропускания азота. В него добавляли раствор 2-(3-(9-борабицикло[3.3.1]нонан-9-ил)пропил)изоиндолин-1,3-диона (3,54 г, 11,45 ммоль) (синтезировали, как в Angewandte Chemie, International Edition, 46(40), 7671-7673; 2007 ) в 30 мл THF с последующим добавлением тетракис(трифенилфосфин)палладия(0) (0,66 г, 0,57 ммоль) и дегазированного раствора 3 M K2CO3 в 15 мл воды. Реакционную смесь нагревали при 80°C в течение 16 ч., после чего ее разбавляли этилацетатом и органический слой промывали солевым раствором. Органический слой высушивали над Na2SO4 и неочищенный продукт очищали на колонке (выход = 1,2 г, 32%). 1H ЯМР (400 МГц, CDCl3) δ 7,90 - 7,85 (m, 2H), 7,75 - 7,71 (m, 2H), 7,42 (td, J = 7,5, 1,5 Гц, 1H), 7,31 - 7,23 (m, 3H), 3,86 (s, 3H), 3,80 (t, J = 7,1 Гц, 2H), 3,06 - 2,96 (m, 2H), 2,10 - 1,96 (m, 2H).; LCMS: масса/заряд = 323,84 (M+H)+
Стадия 2. Синтез метил-2-(3-аминопропил)бензоата
Синтезировали из метил-2-(3-(1,3-диоксоизоиндолин-2-ил)пропил)бензоата, полученного на стадии 1, в соответствии с аналогичной процедурой, описанной на стадии 2 пром. соед. 9 (выход = 150 мг, 84%). 1H ЯМР (400 МГц, CDCl3) δ 7,47 - 7,41 (m, 2H), 7,28 - 7,24 (m, 2H), 3,91 (s, 3H), 3,06 - 2,99 (m, 2H), 2,78 (t, J = 7,0 Гц, 2H), 1,83 - 1,74 (m, 2H).; GCMS: масса/заряд = 193,14 (M).+
Синтез 2-(3-(4-этокси-4-оксидо-1,4-азафосфинан-1-ил)пропил)изоиндолин-1,3-диона (пром. соед. 23)
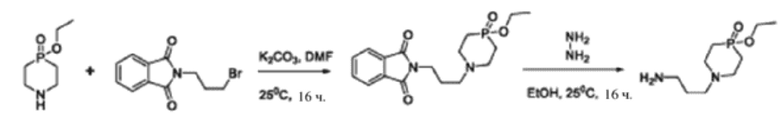
Стадия 1. Синтез 2-(3-(4-этокси-4-оксидо-1,4-азафосфинан-1-ил)пропил)изоиндолин-1,3-диона
К раствору 4-этокси-1,4-азафосфинан-4-оксида (1,50 г, 9,19 ммоль) (получен в соответствии с процедурой, описанной в WO 2008090570) в 25 мл DMF добавляли карбонат калия (3,18 г, 22,98 ммоль) и 2-(3-бромпропил)изоиндолин-1,3-дион (3,20 г, 11,95 ммоль), и реакционную смесь перемешивали при 25°C в течение 16 ч. Реакцию отслеживали с помощью TLC. После полного превращения реакционную смесь концентрировали с удалением DMF и очищали с помощью колоночной хроматографии на силикагеле с применением 0-5% метанола в DCM с получением 2-(3-(4-этокси-4-оксидо-1,4-азафосфинан-1-ил)пропил)изоиндолин-1,3-диона (выход = 2,1 г, 65%). LCMS: 351,2 (M+H)+
Стадия 2. Синтез 1-(3-аминопропил)-4-этокси-1,4-азафосфинан-4-оксида
К раствору 2-(3-(4-этокси-4-оксидо-1,4-азафосфинан-1-ил)пропил)изоиндолин-1,3-диона (2,100 г, 5,99 ммоль) в 30 мл этанола добавляли гидразина моногидрат (1,78 мл, 36,0 ммоль) по каплям и реакционную смесь перемешивали при 25°C в течение 16 ч. Полученное твердое вещество фильтровали через воронку Бюхнера и фильтрат концентрировали с получением 1-(3-аминопропил)-4-этокси-1,4-азафосфинан-4-оксида (1,1 г, 4,99 ммоль, выход 83%). LCMS: масса/заряд = 221,4 (M+H)+
Пример 1. (1S,4S)-4-((E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновая кислота (соединение 1)
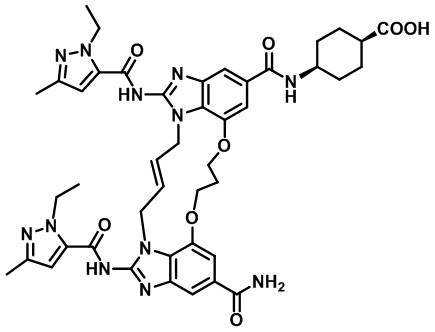
(E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (промежуточное соединение 1) (0,25 г, 0,33 ммоль) и метил-(1s,4s)-4-аминоциклогексан-1-карбоксилата гидрохлорид (0,08 г, 0,42 ммоль) растворяли в 10 мл DMF. Добавляли TBTU (0,17 г, 0,53 ммоль), затем диизопропилэтиламин (0,35 мл, 2,00 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем DMF концентрировали при пониженном давлении и к нему добавляли воду, что приводило к осаждению продукта. Осадок фильтровали и промывали водой и неочищенный продукт применяли как таковой на следующей стадии. LCMS: масса/заряд = 889,19 (M+H)+
Сложный метиловый эфир (0,12 г, 0,14 ммоль) затем подвергали сложноэфирному гидролизу путем растворения в 25 мл смеси THF-MeOH-H2O (2:2:1) с последующим добавлением LiOH (34 мг, 0,81 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и летучие вещества концентрировали с последующим добавлением 2 н HCl, что приводило к осаждению продукта, представляющего собой кислоту. Осадок фильтровали и промывали водой и очищали с помощью препаративной хроматографии с обращенной фазой с получением конечного продукта в виде белого твердого вещества. (Выход = 30 мг, 25%). 1H ЯМР (400 МГц, DMSO-d6) 8,29 - 8,16 (m, 2H), 8,01 (brs, 1H), 7,71 (s, 1H), 7,70 (s, 1H), 7,54 (s, 1H), 7,49 (s, 1H), 7,39 (brs, 1H), 6,55 (s, 2H), 5,50 - 5,46 (m, 2H), 4,88 (brs, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,48 - 4,37 (m, 4H), 4,21 - 4,00 (m, 1H), 3,94 - 3,81 (m, 1H), 2,33 - 2,25 (m, 2H), 2,12 - 1,96 (m, 8H), 1,74 - 1,64 (m, 2H), 1,64 - 1,48 (m, 4H), 1,26 (m, 6H).; LCMS: масса/заряд = 875,06 (M+H)+; чистота в соответствии с HPLC: 98,19%
Пример 2. Натриевая соль (1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 2)
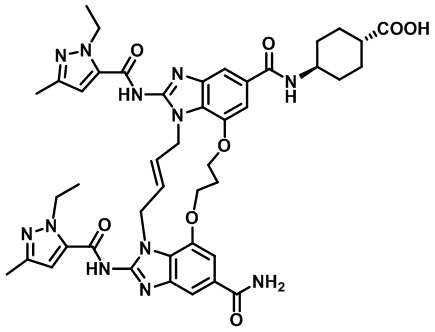
Синтезировали из промежуточного соединения 1 и метил-(1R,4R)-4-аминоциклогексан-1-карбоксилата гидрохлорида в соответствии с аналогичной процедурой, описанной для синтеза примера 1.
В качестве альтернативы сочетание также проводили путем применения разных связующих веществ с последующей ниже указанной процедурой.
(E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (промежуточное соединение 1) (19 г, 25,3 ммоль) и метил-(1R,4R)-4-аминоциклогексан-1-карбоксилата гидрохлорид (6,38 г, 32,9 ммоль) растворяли в 150 мл DMSO. HOBt (11,64 г, 76 ммоль) и EDC (19,43 г, 101 ммоль) добавляли в смесь с последующим добавлением DIPEA (31,0 мл, 177 ммоль) и реакционную смесь перемешивали при к. т. в течение 18 ч. После завершения реакции, как отслеживали с помощью LCMS, смесь выливали в воду при перемешивании, что приводило к осаждению неочищенного продукта в виде твердого вещества, которое промывали ацетонитрилом, затем диэтиловым эфиром и высушивали. Неочищенный продукт очищали на колонке с удалением полярных примесей с последующей обработкой растворителем после суспендирования в 1 л THF-MeOH (1:1) и нагревания до 70°C в течение 1 ч. После охлаждения до комнатной температуры твердое вещество фильтровали с получением очищенного продукта (выход = 15 г, 67%).
Сложный метиловый эфир (15 г, 16,87 ммоль) затем подвергали сложноэфирному гидролизу путем растворения в 325 мл смеси THF-MeOH-H2O (2:2:1) с последующим добавлением LiOH (5,67 г, 135 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и летучие вещества концентрировали с последующим добавлением 2 н HCl, что приводило к осаждению продукта, представляющего собой кислоту. Осадок фильтровали и промывали водой с получением конечного продукта в виде белого твердого вещества. (Выход = 13 г, 88%).
Кислоту (11,7 г, 13,37 ммоль) затем превращали в ее натриевую соль путем ее суспендирования в 300 мл метанола и добавления бикарбонат натрия (1,11 г, 13,24 ммоль), растворенного в 60 мл воды. Неоднородную смесь перемешивали при к. т. в течение 1 ч., к этому времени суспензия очищалась в молочный раствор. Летучие вещества концентрировали и остаток лиофилизировали с получением натриевой соли указанного в заголовке соединения (выход = 11 г, 92%).
1H ЯМР (400 МГц, DMSO-d6) δ 8,13 (brs, 1H), 7,94 (brs, 1H), 7,70 (m, 2H), 7,47 (s, 1H), 7,42 (s, 1H), 7,28 (brs, 1H), 6,48 (s, 2H), 5,56 - 5,38 (m, 2H), 4,88 (brs, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,43 - 4,36 (m, 4H), 3,81 - 3,70 (m, 1H), 2,31 - 2,24 (m, 2H), 2,07 (s, 6H), 2,05 - 2,00 (m, 1H), 1,97 - 1,85 (m, 4H), 1,43 - 1,32 (m, 4H), 1,24 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 875,18 (M+H)+; чистота в соответствии с HPLC: 99,02%
Пример 3. Натриевая соль (E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 3)
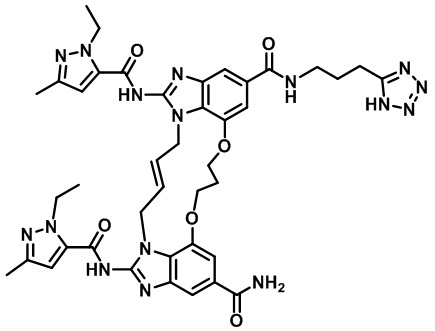
(E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (промежуточное соединение 1) (0,35 г, 0,47 ммоль) и 3-(1H-тетразол-5-ил)пропан-1-амин (синтезировали, как в Synth. Commun., 2000, 30(9), 1587-1591) (0,16 г, 1,35 ммоль) растворяли в 10 мл DMF. Добавляли TBTU (0,22 г, 0,7 ммоль), затем диизопропилэтиламин (0,33 мл, 1,86 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем DMF концентрировали при пониженном давлении и к нему добавляли воду, что приводило к осаждению продукта. Осадок фильтровали и промывали водой и неочищенный продукт очищали с помощью препаративной хроматографии с обращенной фазой с получением чистого продукта в виде грязно-белого твердого вещества. Выделенное соединение затем превращали в его натриевую соль, как указано в примере 2 (выход = 72 мг, 19%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,87 (brs, 1H), 9,04 (brs, 1H), 8,01 (brs, 1H), 7,77 - 7,68 (m, 2H), 7,63 - 7,48 (m, 2H), 7,36 (brs, 1H), 6,54 (s, 2H), 5,58 - 5,34 (m, 2H), 4,89 (brs, 4H), 4,57 - 4,50 (m, 6H), 4,46 - 4,39 (m, 2H), 3,42 - 3,38 (m, 2H), 2,75 (t, J = 7,1 Гц, 2H), 2,32 - 2,25 (m, 2H), 2,08 (s, 6H), 1,95 - 1,84 (m, 2H), 1,26 (t, J = 6,5 Гц, 6H); LCMS: масса/заряд = 858,93 (M+H)+; чистота в соответствии с HPLC: 99,74%
Пример 4. (E)-N-(2-(1H-Тетразол-5-ил)этил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 4)
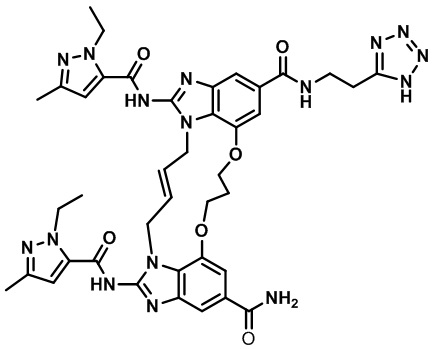
(E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (промежуточное соединение 1) (0,35 г, 0,47 ммоль) и 2-(1H-тетразол-5-ил)этан-1-амин (0,16 г, 1,4 ммоль) (пром. соед. 2) растворяли в 10 мл DMF. Добавляли TBTU (0,22 г, 0,7 ммоль), затем диизопропилэтиламин (0,33 мл, 1,86 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем DMF концентрировали при пониженном давлении и к нему добавляли воду, что приводило к осаждению продукта. Осадок фильтровали и промывали водой и неочищенный продукт очищали с помощью препаративной хроматографии с обращенной фазой с получением чистого продукта в виде грязно-белого твердого вещества (выход = 35 мг, 9%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,90 (brs, 2H), 8,67 (t, J = 5,7 Гц, 1H), 8,06 - 7,96 (m, 1H), 7,71 (s, 1H), 7,67 (s, 1H), 7,53 (s, 1H), 7,45 (s, 1H), 7,38 (s, 1H), 6,55 (s, 2H), 5,49 (s, 2H), 4,88 (s, 4H), 4,53 (m, 4H), 4,42 (q, J = 6,0 Гц, 4H), 3,65 (q, J = 6,7 Гц, 3H), 3,17 - 3,14 (m, 2H), 2,35 - 2,26 (m, 2H), 2,08 (s, 6H), 1,29 - 1,23 (m, 6H); LCMS: масса/заряд = 845,05 (M+H)+; чистота в соответствии с HPLC: 99,78%
Пример 5. Натриевая соль (E)-2-(2-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)этил)бензойной кислоты (соединение 5)

(E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (промежуточное соединение 1) (4,2 г, 5,60 ммоль) и метил-2-(2-аминоэтил)бензоата гидрохлорид (синтезирован, как описано в Angewandte Chemie, International Edition, 56(43), 13351-13355; 2017) (1,81 г, 8,40 ммоль) растворяли в 20 мл DMF. Добавляли TBTU (5,40 г, 16,80 ммоль), затем диизопропилэтиламин (3,91 мл, 22,41 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем DMF концентрировали при пониженном давлении и к нему добавляли воду, что приводило к осаждению продукта. Осадок фильтровали и промывали водой и неочищенный продукт очищали с помощью препаративной хроматографии с обращенной фазой с получением промежуточного соединения, представляющего собой сложный метиловый эфир (выход = 1,1 г, 22%). LCMS: масса/заряд = 911,06 (M+H)+
Сложный метиловый эфир (1,05 г, 1,15 ммоль) затем подвергали сложноэфирному гидролизу путем растворения в 45 мл смеси THF-MeOH-H2O (3:3:1) с последующим добавлением LiOH (0,193 г, 8,07 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и летучие вещества концентрировали с последующим добавлением 2 н. HCl, что приводило к осаждению продукта, представляющего собой кислоту. Осадок фильтровали и промывали водой с получением конечного продукта в виде белого твердого вещества (0,99 г, 96%) и превращали в его натриевую соль в соответствии с процедурой, как указано в примере 2. 1H ЯМР (400 МГц, DMSO-d6) δ 12,81 (brs, 2H), 11,45 (brs, 1H), 8,32 (brs, 1H), 7,70 (s, 1H), 7,65 - 7,54 (m, 3H), 7,54 - 7,45 (m, 1H), 7,31 (brs, 1H), 7,23 - 7,14 (m, 2H), 7,13 - 7,04 (m, 1H), 6,53 (s, 2H), 5,50 (brs, 2H), 4,87 (brs, 4H), 4,56 - 4,42 (m, 8H), 3,49 - 3,43 (m, 2H), 3,11 - 3,01 (m, 2H), 2,36 - 2,33 (m, 2H), 2,08 (s, 6H), 1,26 (t, J = 7,7 Гц, 6H); LCMS: масса/заряд = 897,06 (M+H)+; чистота в соответствии с HPLC: 99,04%
Пример 6. Натриевая соль (E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 6)
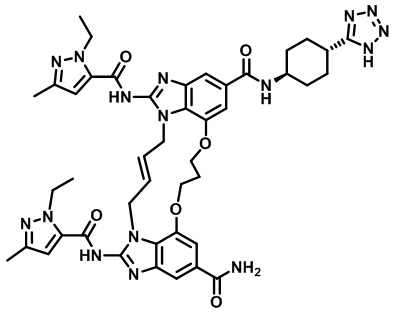
Синтезировали из промежуточного соединения 1 и (1R,4R)-4-(1H-тетразол-5-ил)циклогексан-1-амина трифторацетата (пром. соед. 3a) в соответствии с аналогичной процедурой, описанной для синтеза примера 1, и превращали в его натриевую соль в соответствии с процедурой, как указано в примере 2. (Выход = 60 мг, 14%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,89 (brs, 2H), 8,31 (d, J = 7,8 Гц, 1H), 8,01 (brs, 1H), 7,71 (s, 2H), 7,54 (d, J = 1,4 Гц, 1H), 7,51 (d, J = 1,4 Гц, 1H), 7,39 (brs, 1H), 6,55 (s, 2H), 5,49 (s, 2H), 4,89 (s, 4H), 4,53 (d, J = 7,3 Гц, 4H), 4,44 (d, J = 5,3 Гц, 4H), 3,96 - 3,82 (m, 1H), 2,98 (t, J = 11,8 Гц, 1H), 2,33 - 2,27 (m, 2H), 2,17 - 2,09 (m, 3H), 2,08 (s, 6H), 2,05 - 1,97 (m, 2H), 1,70 - 1,52 (m, 4H), 1,27 (t, J = 7,1 Гц, 6H). ).; LCMS: масса/заряд = 899,9 (M+H)+; чистота в соответствии с HPLC: 99,22%
Пример 7. (E)-N-((1S,4S)-4-(1H-Тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 7)

Синтезировали из промежуточного соединения 1 и (1S,4S)-4-(1H-тетразол-5-ил)циклогексан-1-амина трифторацетата (пром. соед. 4) в соответствии с аналогичной процедурой, описанной для синтеза примера 1. (Выход = 15 мг, 8%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,88 (brs, 2H), 8,19 - 8,13 (m, 1H), 8,00 (brs, 1H), 7,71 (s, 1H), 7,68 (s, 1H), 7,53 (d, J = 1,4 Гц, 1H), 7,46 (d, J = 1,4 Гц, 1H), 7,38 (brs, 1H), 6,54 (s, 2H), 5,47 (d, J = 1,9 Гц, 2H), 4,88 (s, 4H), 4,52 (d, J = 7,4 Гц, 4H), 4,41 (dt, J = 11,5, 5,5 Гц, 4H), 4,05 - 3,88 (m, 1H), 3,06 - 2,91 (m, 1H), 2,33 - 2,19 (m, 4H), 2,08 (s, 6H), 1,96 - 1,85 (m, 2H), 1,79 - 1,69 (m, 2H), 1,65 - 1,53 (m, 2H), 1,30 - 1,24 (m, 6H); LCMS: масса/заряд = 899,19 (M+H)+; чистота в соответствии с HPLC: 98,38%
Пример-8. Натриевая соль (E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 8)
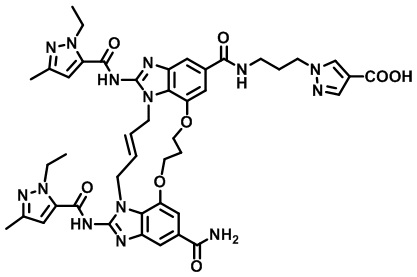
Синтезировали из промежуточного соединения 1 и этил-1-(3-аминопропил)-1H-пиразол-4-карбоксилата (пром. соед. 5) в соответствии с аналогичной процедурой, описанной для синтеза примера 1, и превращали в его натриевую соль в соответствии с процедурой, как указано в примере 2. (Выход = 650 мг, 11%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,85 (brs, 2H), 8,55 (t, J = 5,4 Гц, 1H), 8,29 (s, 1H), 8,02 (s, 1H), 7,81 (s, 1H), 7,71 (d, J = 1,2 Гц, 1H), 7,69 (d, J = 1,2 Гц, 1H), 7,53 (d, J = 1,3 Гц, 1H), 7,48 (d, J = 1,4 Гц, 1H), 7,38 (s, 1H), 6,55 (s, 2H), 5,50 (d, J = 1,8 Гц, 2H), 4,89 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,43 (q, J = 4,9 Гц, 4H), 4,22 (t, J = 6,7 Гц, 2H), 3,28 - 3,23 (m, 2H), 2,55 - 2,52 (m, 2H), 2,34 - 2,24 (m, 2H), 2,08 (s, 6H), 1,27 (t, J = 7,1 Гц, 6H).; LCMS: масса/заряд = 901,19 (M+H)+; чистота в соответствии с HPLC: 99,36%
Пример-9. (E)-2-((4-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоксамидо)метил)никотиновая кислота (соединение 9)
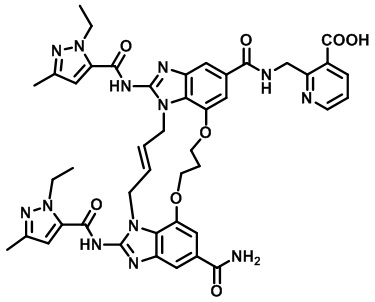
Синтезировали из промежуточного соединения 1 и метил-2-(аминометил)никотината гидрохлорида (пром. соед. 6) в соответствии с аналогичной процедурой, описанной для синтеза примера 1 (выход = 12 мг, 5,2%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,91 (s, 2H), 9,04 (s, 1H), 8,68 - 8,61 (m, 1H), 8,21 (dd, J = 7,8, 1,8 Гц, 1H), 8,15 (s, 1H), 8,01 (s, 1H), 7,72 (d, J = 5,2 Гц, 2H), 7,56 (d, J = 13,1 Гц, 2H), 7,46 - 7,35 (m, 2H), 6,55 (s, 2H), 5,50 (s, 2H), 4,92 (d, J = 18,5 Гц, 6H), 4,54 (d, J = 7,4 Гц, 4H), 4,44 (s, 4H), 2,33 - 2,28 (m, 2H), 2,08 (s, 6H), 1,28 - 1,20 (m, 6H). LCMS: масса/заряд = 883,93 (M+H)+; чистота в соответствии с HPLC: 99,04%
Пример-10. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1H-тетразол-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 10)
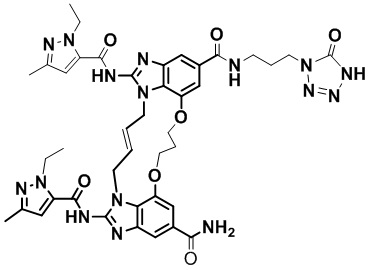
Синтезировали из промежуточного соединения 1 и 1-(3-аминопропил)-1,4-дигидро-5H-тетразол-5-она (пром. соед. 7) в соответствии с аналогичной процедурой, описанной для синтеза примера 1 (выход = 16 мг, 8%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,90 (brs, 2H), 8,62 (t, J = 5,6 Гц, 1H), 8,01 (brs, 1H), 7,71 (s, 1H), 7,69 (s, 1H), 7,54 (d, J = 1,4 Гц, 1H), 7,50 (s, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,43 (t, J = 5,2 Гц, 4H), 3,94 (t, J = 7,0 Гц, 2H), 3,40 - 3,36 (m, 2H), 2,34 - 2,25 (m, 2H), 2,07 (s, 6H), 1,99 (q, J = 7,0 Гц, 2H), 1,27 (t, J = 7,1 Гц, 6H).; LCMS: масса/заряд = 875,06 (M+H)+; чистота в соответствии с HPLC: 99,70%
Пример-11. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 11)
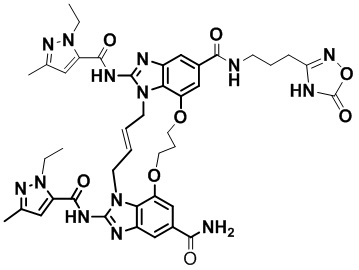
Синтезировали из промежуточного соединения 1 и 3-(3-аминопропил)-1,2,4-оксадиазол-5(4H)-она (пром. соед. 8) в соответствии с аналогичной процедурой, описанной для синтеза примера 1 (выход = 12 мг, 7%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,90 (brs, 2H), 8,63 (t, J = 5,6 Гц, 1H), 8,01 (brs, 1H), 7,78 - 7,68 (m, 2H), 7,53 (s, 1H), 7,49 (s, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (s, 4H), 4,54 (t, J = 7,3 Гц, 4H), 4,44 (brs, 4H), 3,38 - 3,31 (m, 2H), 2,56 - 2,53 (m, 2H), 2,34 - 2,24 (m, 2H), 2,08 (s, 6H), 1,87 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H).; LCMS: масса/заряд = 875,06 (M+H)+ ; чистота в соответствии с HPLC: 97,09%
Пример 12. Натриевая соль (8S,E)-N4-((1R,4S)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 12)
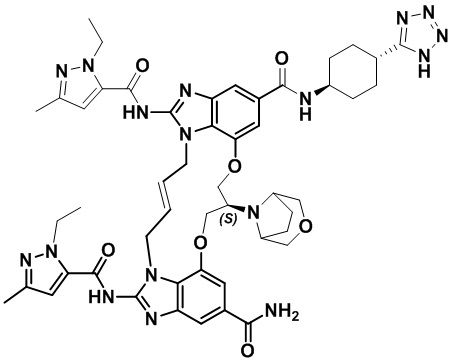
Стадия 1. Синтез этил-4-хлор-3-(3-гидрокси-2-(метоксиметокси)пропокси)-5-нитробензоата
и
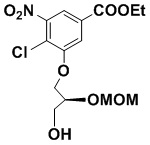
К охлаждаемому раствору этил-4-хлор-3-гидрокси-5-нитробензоата (50 г, 204 ммоль), 2-(метоксиметокси)пропан-1,3-диола (55,4 г, 407 ммоль), трифенилфосфина (107 г, 407 ммоль) в THF (400 мл) добавляли DIAD (79 мл, 407 ммоль), по каплям и реакционную смесь перемешивали при 25°C в течение 2 ч. Протекание реакции отслеживали с помощью TLC и после завершения ее концентрировали при пониженном давлении с получением неочищенного материала. Неочищенный продукт очищали посредством колоночной хроматографии с получением необходимого продукта в виде смеси энантиомеров. Кроме того, энантиомеры разделяли посредством хиральной препаративной HPLC в виде пика 1 (RT: 6,47) и пика 2 (RT: 7,22) путем применения Chiral Pak IG 30X250 мм, 5 мкм.
Пик 1. Этил-4-хлор-3-(3-гидрокси-2-(метоксиметокси)пропокси)-5-нитробензоат (энантиомер 1, 15,5 г, 36,9%)
1H ЯМР (400 МГц, хлороформ-d) δ 8,06 (d, J = 1,8 Гц, 1H), 7,80 (d, J = 1,8 Гц, 1H), 4,90 - 4,82 (m, 2H), 4,44 (q, J = 7,1 Гц, 2H), 4,30 (d, J = 5,4 Гц, 2H), 4,14 (m, 1H), 3,93 (dd, J = 12,0, 3,7 Гц, 1H), 3,85 (dd, J = 12,0, 5,4 Гц, 1H), 3,48 (s, 3H), 1,44 (t, J = 7,1 Гц, 3H); LCMS: масса/заряд 362 [M+H]+
Пик 2. Этил-4-хлор-3-(3-гидрокси-2-(метоксиметокси)пропокси)-5-нитробензоат (энантиомер 2, 12,6 г, 29,5%)
1H ЯМР (400 МГц, хлороформ-d) δ 8,06 (d, J = 1,8 Гц, 1H), 7,80 (d, J = 1,8 Гц, 1H), 4,90 - 4,82 (m, 2H), 4,44 (q, J = 7,1 Гц, 2H), 4,30 (d, J = 5,4 Гц, 2H), 4,14 (m, 1H), 3,93 (dd, J = 12,0, 3,7 Гц, 1H), 3,85 (dd, J = 12,0, 5,4 Гц, 1H), 3,48 (s, 3H), 1,44 (t, J = 7,1 Гц, 3H).; LCMS: масса/заряд 362 [M+H]+
Стадия 2. Синтез трет-бутил-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-(метоксиметокси)пропокси)-5-нитробензоата
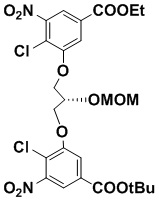
К охлаждаемому раствору трет-бутил-4-хлор-3-гидрокси-5-нитробензоата (7,52 г, 27,5 ммоль), этил-4-хлор-3-(3-гидрокси-2-(метоксиметокси)пропокси)-5-нитробензоата (энантиомер 1 стадии 1, 10,0 г, 27,5 ммоль), трифенилфосфина (10,82 г, 41,2 ммоль) в THF (200 мл) добавляли DIAD (10,69 мл, 55,0 ммоль) по каплям и реакционную смесь перемешивали при 25°C в течение 2 ч. Протекание реакции отслеживали с помощью TLC и после завершения смесь концентрировали при пониженном давлении с получением неочищенного материала, который очищали посредством колоночной хроматографии с получением необходимого продукта (8,89 г, выход: 70,2%).
1H ЯМР (400 МГц, DMSO-d6) δ 8,10 (d, J = 1,8 Гц, 1H), 8,04 (d, J = 1,7 Гц, 1H), 7,90 (d, J = 1,8 Гц, 1H), 7,84 (d, J = 1,8 Гц, 1H), 4,83 (s, 2H), 4,58 (m, 2H), 4,49 (dd, J = 10,4, 5,6 Гц, 2H), 4,43 (q, J = 4,4 Гц, 1H), 4,38 (q, J = 7,1 Гц, 2H), 3,34 (s, 3H), 1,57 (s, 9H), 1,35 (t, J = 7,1 Гц, 3H).
Стадия 3. Синтез трет-бутил-(S)-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-гидроксипропокси)-5-нитробензоата

К охлаждаемому раствору трет-бутил-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-(метоксиметокси)пропокси)-5-нитробензоата (стадия 2, 12 г, 19,37 ммоль), тетрабромида углерода (1,285 г, 3,87 ммоль) добавляли трифенилфосфин (1,016 г, 3,87 ммоль) в дихлорэтане (200 мл) и реакционную смесь перемешивали при 60°C в течение 4 ч. Протекание реакции отслеживали с помощью TLC и после завершения смесь концентрировали и очищали с помощью колоночной хроматографии с получением необходимого продукта (7,99 г, выход: 72,4%).
1H ЯМР (400 МГц, хлороформ-d) δ 8,10 (d, J = 1,8 Гц, 1H), 8,00 (d, J = 1,8 Гц, 1H), 7,85 (d, J = 1,8 Гц, 1H), 7,81 (d, J = 1,8 Гц, 1H), 4,60 (q, J = 5,1 Гц, 1H), 4,51 - 4,40 (m, 6H), 1,63 (s, 9H), 1,44 (t, J = 7,2 Гц, 3H).
Подтверждение абсолютной стереохимии для трет-бутил-(S)-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-гидроксипропокси)-5-нитробензоата посредством его синтеза из (S)-оксиран-2-илметанола
Синтез трет-бутил-(S)-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-гидроксипропокси)-5-нитробензоата
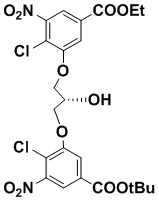
К охлаждаемому раствору этил-4-хлор-3-гидрокси-5-нитробензоата (2,0 г, 8,14 ммоль), (S)-оксиран-2-илметанола (0,603 г, 8,14 ммоль), трифенилфосфина (4,27 г, 16,29 ммоль) в THF (150 мл) добавляли DIAD (3,17 мл, 16,29 ммоль) по каплям и реакционную смесь перемешивали при 25°C в течение 2 ч. Протекание реакции отслеживали с помощью TLC и после завершения смесь концентрировали с получением неочищенного материала. Неочищенный продукт очищали посредством колоночной хроматографии с получением этил-(R)-4-хлор-3-нитро-5-(оксиран-2-илметокси)бензоата (1,4 г, выход: 57%).
1H ЯМР (400 МГц, хлороформ-d) δ 8,07 (d, J = 1,7 Гц, 1H), 7,83 (d, J = 1,8 Гц, 1H), 4,51 (dd, J = 11,2, 2,6 Гц, 1H), 4,44 (q, J = 7,1 Гц, 2H), 4,16 (dd, J = 11,2, 5,6 Гц, 1H), 3,54 - 3,42 (m, 1H), 2,99 (t, J = 4,5 Гц, 1H), 2,89 (dd, J = 4,8, 2,6 Гц, 1H), 1,44 (t, J = 7,1 Гц, 3H).
К раствору трет-бутил-4-хлор-3-гидрокси-5-нитробензоата (1,524 г, 5,57 ммоль), этил-(R)-4-хлор-3-нитро-5-(оксиран-2-илметокси)бензоата (1,4 г, 4,64 ммоль) 2,6-лутидин (1,622 мл, 13,92 ммоль) в IPA 100 мл добавляли и реакционную смесь перемешивали при 100°C в течение 12 ч. в герметичной пробирке. Протекание реакции отслеживали с помощью TLC и после завершения смесь концентрировали при пониженном давлении с получением неочищенного материала, который очищали посредством колоночной хроматографии с получением трет-бутил-(S)-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-гидроксипропокси)-5-нитробензоата (2,2 г, выход: 75%).
Абсолютную стереохимию продукта со стадии 3 подтверждали с помощью проведения хиральной HPLC с этим продуктом (трет-бутил-(S)-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-гидроксипропокси)-5-нитробензоат), что касается обоих продуктов RT в хиральной HPLC (Chiral Pak IG 30X250 мм, 5 мкм) было одинаковым (RT: 9,99), при этом RT его (R) энантиомера составляло 11,13.
1H ЯМР (400 МГц, хлороформ-d) δ 8,10 (d, J = 1,8 Гц, 1H), 8,00 (d, J = 1,8 Гц, 1H), 7,85 (d, J = 1,8 Гц, 1H), 7,81 (d, J = 1,8 Гц, 1H), 4,60 (q, J = 5,1 Гц, 1H), 4,49 - 4,39 (m, 6H), 1,63 (s, 9H), 1,45 (t, J = 7,1 Гц, 3H).
Стадия 4. Синтез трет-бутил-(S)-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-(((трифторметил)сульфонил)окси)пропокси)-5-нитробензоата

К охлаждаемому раствору трет-бутил-(S)-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-гидроксипропокси)-5-нитробензоата (стадия 3, 8,0 г, 13,90 ммоль), 2,6-лутидина (5,96 г, 55,6 ммоль) в дихлорметане (100 мл) добавляли трифлатный ангидрид (7,85 г, 27,8 ммоль) и реакционную смесь перемешивали при 0°C в течение 4 ч. Протекание реакции отслеживали с помощью TLC и после завершения ее разбавляли дихлорметаном, гасили с помощью 1 н. HCl, оба слоя разделяли, органический слой промывали водой и концентрировали и очищали посредством колоночной хроматографии (9,8 г, выход: 98%).
1H ЯМР (400 МГц, хлороформ-d) δ 8,15 (d, J = 1,7 Гц, 1H), 8,05 (d, J = 1,7 Гц, 1H), 7,83 (d, J = 1,8 Гц, 1H), 7,79 (d, J = 1,7 Гц, 1H), 5,63 (q, J = 4,7 Гц, 1H), 4,67 (t, J = 5,3 Гц, 4H), 4,47 (q, J = 7,1 Гц, 2H), 1,64 (s, 9H), 1,45 (t, J = 7,1 Гц, 3H).
Стадия 5. Синтез трет-бутил-3-((2R)-2-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)пропокси)-4-хлор-5-нитробензоата
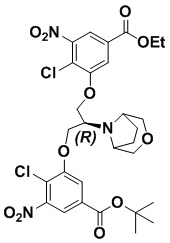
К охлаждаемому раствору (1R,5S)-3-окса-8-азабицикло[3.2.1]октана гидрохлорида (4,15 г, 27,7 ммоль) в THF (100 мл) добавляли триэтиламин (7,72 мл, 55,4 ммоль) и перемешивали в течение 30 мин. при 0°C, и затем добавляли трет-бутил-(S)-4-хлор-3-(3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)-2-(((трифторметил)сульфонил)окси)пропокси)-5-нитробензоат (стадия 4, 9,8 г, 13,85 ммоль) и перемешивали при такой же температуре в течение 12 ч. Протекание реакции отслеживали с помощью TLC и после завершения смесь концентрировали и очищали с помощью колоночной хроматографии с получением необходимого соединения (6,5 г, выход: 70,6%).
1H ЯМР (400 МГц, хлороформ-d) δ 8,07 (d, J = 1,7 Гц, 1H), 7,97 (d, J = 1,7 Гц, 1H), 7,85 (s, 1H), 7,81 (s, 1H), 4,44 (q, J = 7,2 Гц, 6H), 3,77 (s, 2H), 3,61 (d, J = 10,5 Гц, 2H), 3,40-3,20 (m, 3H), 2,06 (s, 4H), 1,62 (s, 9H), 1,44 (t, J = 7,1 Гц, 3H); LCMS: масса/заряд 669,97 [M+H]+
Стадия 6. Синтез 3-(трет-бутил)-11-этил-(7R,E)-1,13-диамино-7-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата
К раствору трет-бутил-3-((2R)-2-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-3-(2-хлор-5-(этоксикарбонил)-3-нитрофенокси)пропокси)-4-хлор-5-нитробензоата (стадия 5, 6,5 г, 9,69 ммоль) в этаноле (80 мл) в герметичной пробирке добавляли (E)-бут-2-ен-1,4-диамина дигидрохлорид (2,159 г, 13,57 ммоль) и DIPEA (13,55 мл, 78 ммоль) и перемешивали реакционную смесь при 105°C в течение 24 ч. Протекание реакции отслеживали с помощью TLC и после завершения ее охлаждали до комнатной температуры и полученное твердое вещество фильтровали и высушивали с получением неочищенного материала в виде необходимого продукта (5,96 г, выход: 89,8%).
1H ЯМР (400 МГц, DMSO-d6) δ 7,60 (d, J = 2,0 Гц, 2H), 7,55 (d, J = 1,9 Гц, 2H), 5,63 (s, 2H), 4,37 (q, J = 6,1, 5,5 Гц, 4H), 4,29 (q, J = 7,1 Гц, 5H), 4,18 (s, 1H), 4,06 (m, 2H), 3,77 (dd, J = 9,8, 5,5 Гц, 2H), 3,66 - 3,58 (m, 2H), 3,50-3,40 (m, 2H), 1,95 (d, J = 7,0 Гц, 2H), 1,82 (t, J = 6,4 Гц, 2H), 1,53 (s, 9H), 1,31 (t, J = 7,1 Гц, 3H); LCMS: масса/заряд 684,27 [M+H]+
Стадия 7. Синтез 3-(трет-бутил)-11-этил-(7R,E)-1,13-диамино-7-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата
К перемешиваемой суспензии 3-(трет-бутил)-11-этил-(7R,E)-1,13-диамино-7-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата (стадия 6, 6,0 г, 8,78 ммоль) в THF (75 мл) и этаноле (75 мл) добавляли дитионит натрия (15,28 г, 88 ммоль) (раствор в 50 мл воды) при 0°C. Гидроксид аммония (27,3 мл, 176 ммоль) добавляли при такой же температуре. Реакционную смесь нагревали до 25°C и перемешивали в течение 3 ч. Протекание реакции отслеживали с помощью LCMS. Твердое вещество отфильтровывали и органические растворители удаляли из исходного раствора под вакуумом. Воду (20 мл) добавляли и экстрагировали с помощью 10% метанола в этилацетате (3 раза). Органический слой высушивали с помощью сульфата натрия и концентрировали с получением неочищенного остатка. Твердое вещество промывали в простом эфире с получением указанного в заголовке соединения (5,1 г, выход: 93,2%).
LCMS: масса/заряд 624,09 [M+H]+
Стадия 8. Синтез 12-(трет-бутил)-4-этил-(8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксилата
К перемешиваемому раствору 3-(трет-бутил)-11-этил-(7R,E)-1,13-диамино-7-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата (стадия 7, 5,1 г, 8,18 ммоль) в DMF (объем: 50 мл) добавляли 1-этил-3-метил-1H-пиразол-5-карбонила изотиоцианат (2,87 г, 14,72 ммоль) в 1 мл DMF при 0°C и перемешивали в течение 30 мин., далее добавляли EDC (6,27 г, 32,7 ммоль) и триэтиламин (9,12 мл, 65,4 ммоль) при 0°C и перемешивали в течение 16 ч. Протекание реакции отслеживали с помощью LCMS. После завершения смесь концентрировали при пониженном давлении, добавляли воду, твердое вещество фильтровали и высушивали с получением неочищенного материала, который очищали посредством колоночной хроматографии с использованием метанола в дихлорметане в качестве элюента с получением необходимого продукта (4,0 г, выход: 52,8%).
1H ЯМР (400 МГц, DMSO-d6) δ 12,92 (d, J = 6,7 Гц, 2H), 7,84 (d, J = 1,3 Гц, 1H), 7,82 (d, J = 1,3 Гц, 1H), 7,63 (d, J = 1,4 Гц, 1H), 7,55 (d, J = 1,3 Гц, 1H), 6,49 (s, 2H), 5,33 (s, 2H), 4,95 (m, 2H), 4,87 - 4,75 (m, 2H), 4,63 - 4,55 (m, 2H), 4,49 (d, J = 6,7 Гц, 4H), 4,37 - 4,30 (m, 4H), 3,97 (m, 2H), 3,70 (d, J = 10,2 Гц, 2H), 3,60 (d, J = 4,4 Гц, 2H), 3,52 (d, J = 10,3 Гц, 2H), 2,90 (d, J = 5,2 Гц, 1H), 2,30 (s, 6H), 1,82 (d, J = 7,7 Гц, 2H), 1,56 (s, 9H), 1,34 (t, J = 7,1 Гц, 3H), 1,24 (m, 6H).
LCMS: масса/заряд 946,32 [M+H]+
Стадия 9. Синтез (8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-4-(этоксикарбонил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоновой кислоты

К перемешиваемому раствору 12-(трет-бутил)-4-этил-(8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксилата (стадия 8, 4,0 г, 4,23 ммоль) в DCM (40 мл) добавляли трифторуксусную кислоту (13,03 мл, 169 ммоль) при 25°C и перемешивали в течение 4 ч. Протекание реакции отслеживали с помощью LCMS. После завершения смесь концентрировали при пониженном давлении и промывали диэтиловым эфиром, высушивали с получением неочищенного материала, который переносили для дополнительного преобразования (3,75 г, выход: 99%).
1H ЯМР (400 МГц, DMSO-d6) δ 13,00 (s, 2H), 10,40-10,25 (br s, 1H), 7,89 (d, J = 1,2 Гц, 1H), 7,87 (d, J = 1,2 Гц, 1H), 7,75 (d, J = 1,3 Гц, 1H), 7,71 (s, 1H), 6,54 (s, 2H), 5,53 (s, 2H), 5,02 - 4,92 (m, 4H), 4,88-4,76 (m, 2H), 4,51 (q, J = 7,6 Гц, 6H), 4,35 (q, J = 7,0 Гц, 3H), 4,28 (m, 1H), 4,07-3,98 (m, 2H), 3,86 (s, 2H), 3,69-3,61 (m, 1H), 2,38-2,29 (m, 2H), 2,18 (q, J = 7,5, 7,0 Гц, 2H), 2,06 (s, 6H), 1,34 (t, J = 7,1 Гц, 3H), 1,26 (t, J = 7,1 Гц, 6H).
LCMS: масса/заряд 890,06 [M+H]+
Стадия 10. Синтез этил-(8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксилата

(8S,E)-8-(3-Окса-8-азабицикло[3.2.1]октан-8-ил)-4-(этоксикарбонил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоновую кислоту (стадия 9, 3,75 г, 4,21 ммоль) растворяли в DMF (10 мл), TBTU (1,764 г, 5,48 ммоль) и DIPEA (3,68 мл, 21,07 ммоль) добавляли в нее. Добавляли хлорид аммония (7,89 г, 147 ммоль) и обеспечивали перемешивание реакционной смеси при 25°C в течение 2 ч. Протекание реакции отслеживали с помощью LCMS. Реакционную смесь концентрировали до сухого состояния и затем добавляли воду, полученное твердое вещество фильтровали и высушивали с получением необходимого продукта (3,70 г, выход: 98%).
LCMS: масса/заряд 889,06 [M+H]+
Стадия 11. Синтез (8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновой кислоты
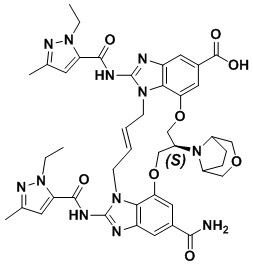
К перемешиваемому раствору этил-(8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксилата (стадия 10, 3,70 г, 4,16 ммоль) в этаноле (40 мл) и THF (: 40 мл) добавляли раствор гидрата гидроксида лития (1,746 г, 41,6 ммоль) в воде (10 мл) при комнатной температуре и перемешивали в течение 16 ч. при 50°C. Протекание реакции отслеживали с помощью LCMS, реакционную смесь концентрировали при пониженном давлении и добавляли воду, pH регулировали до кислотного путем применения 1 н. HCl, твердое вещество осаждают, его фильтровали и высушивали с получением указанного в заголовке соединения (3,4 г, выход: 94,8%).
1H ЯМР (400 МГц, DMSO-d6) δ 13,20 - 12,81 (m, 2H), 11,73 (s, 1H), 8,08 (s, 1H), 7,87 (d, J = 1,4 Гц, 1H), 7,77 (m, 3H), 7,45 (s, 1H), 7,28 - 7,13 (m, 1H), 6,53 (s, 2H), 5,46 (s, 2H), 5,12 - 4,77 (m, 6H), 4,50 (m, 7H), 4,41 - 4,26 (m, 2H), 3,85 - 3,55 (m, 5H), 2,33 (s, 1H), 2,15 (s, 2H), 2,05 (s, 6H), 1,81 - 1,72 (m, 1H), 1,25 (t, J = 7,1 Гц, 6H).
LCMS: масса/заряд 861,05 [M+H]+
Стадия 12. Синтез натриевой соли (8S,E)-N4-((1R,4S)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 12)
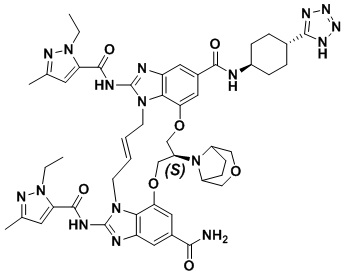
(8S,E)-8-(3-Окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (стадия 11, 600 мг, 0,697 ммоль) растворяли в DMSO (10 мл), EDC (401 мг, 2,091 ммоль) и DIPEA (0,609 мл, 3,48 ммоль), (1R,4R)-4-(1H-тетразол-5-ил)циклогексан-1-амина гидрохлорид (пром. соед. 3b) (284 мг, 1,394 ммоль) добавляли в нее. Добавляли HOBT (320 мг, 2,091 ммоль) и обеспечивали перемешивание реакционной смеси при комнатной температуре в течение ночи. Реакцию отслеживали с помощью LCMS. Реакционную смесь концентрировали для удаления DIPEA и затем добавляли воду, полученное твердое вещество фильтровали и высушивали с получением неочищенного продукта. Очищали посредством препаративной HPLC с обращенной фазой. Выделенный продукт затем превращали в его натриевую соль, как указано в примере 2 (0,14 г, выход: 19,8%).
1H ЯМР (400 МГц, DMSO-d6) δ 12,87 (s, 2H), 8,27 (m, 1H), 8,00 (s, 1H), 7,72 (m, 2H), 7,62 (s, 1H), 7,57 (s, 1H), 7,38 (s, 1H), 6,50 (s, 2H), 5,40 (s, 2H), 4,99 (d, J = 16,9 Гц, 2H), 4,80 (m, 2H), 4,62 (m, 2H), 4,50 (d, J = 7,5 Гц, 4H), 3,94 (m, 2H), 3,87 (m, 1H), 3,69 (d, J = 10,2 Гц, 2H), 3,61 (m, 1H), 3,54 (d, J = 9,9 Гц, 2H), 2,94 (s, 2H), 2,14 - 2,07 (m, 2H), 2,04 (s, 6H), 1,97 (m, 5H), 1,82 (d, J = 7,2 Гц, 2H), 1,60 (m, 5H), 1,25 (m, 6H); LCMS: масса/заряд 1010,21 [M+H]+; чистота в соответствии с HPLC: 99,89%
Пример 13. Натриевая соль (8R,E)-N4-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 13)
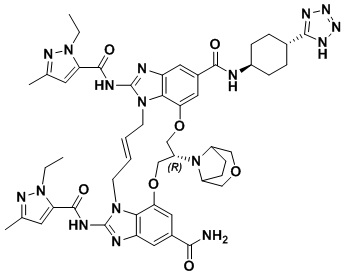
Синтезировали из продукта со стадии 1 примера 12 (энантиомер 2) и (1R,4R)-4-(1H-тетразол-5-ил)циклогексан-1-амина гидрохлорида (пром. соед. 3b) в соответствии с аналогичной процедурой, описанной для синтеза примера 12.
1H ЯМР (400 МГц, DMSO-d6) δ 12,87 (s, 2H), 8,27 (m, 1H), 8,00 (s, 1H), 7,72 (m, 2H), 7,62 (s, 1H), 7,57 (s, 1H), 7,38 (s, 1H), 6,50 (s, 2H), 5,40 (s, 2H), 4,99 (d, J = 16,9 Гц, 2H), 4,80 (m, 2H), 4,62 (m, 2H), 4,50 (d, J = 7,5 Гц, 4H), 3,94 (m, 2H), 3,87 (m, 1H), 3,69 (d, J = 10,2 Гц, 2H), 3,61 (m, 1H), 3,54 (d, J = 9,9 Гц, 2H), 2,94 (s, 2H), 2,14 - 2,07 (m, 2H), 2,04 (s, 6H), 1,97 (m, 5H), 1,82 (d, J = 7,2 Гц, 2H), 1,60 (m, 5H), 1,25 (m, 6H); LCMS: масса/заряд 1010,21 [M+H]+; чистота в соответствии с HPLC: 99,81%
Пример 14. Натриевая соль (1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 14)
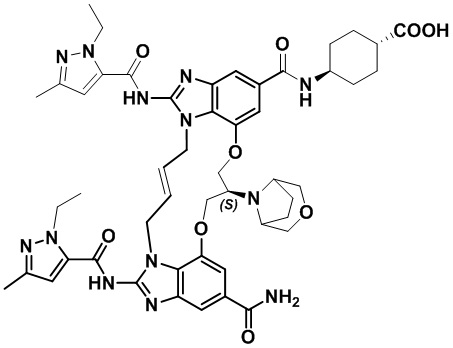
Стадия 1. Синтез метил-(1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоксилата

(8S,E)-8-(3-Окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (продукт со стадии 11 примера 12, 600 мг, 0,697 ммоль) растворяли в DMSO (10 мл), EDC (401 мг, 2,091 ммоль) и DIPEA (0,609 мл, 3,48 ммоль), метил-(1R,4R)-4-аминоциклогексан-1-карбоксилата гидрохлорид (284 мг, 1,394 ммоль) добавляли в нее. Добавляли HOBT (320 мг, 2,091 ммоль) и обеспечивали перемешивание реакционной смеси при комнатной температуре в течение ночи. Реакцию отслеживали с помощью LCMS. Реакционную смесь концентрировали с удалением DIPEA и затем добавляли воду, полученное твердое вещество фильтровали и высушивали с получением неочищенного материала, который очищали посредством препаративной HPLC с обращенной фазой с получением необходимого соединения (0,23 г, выход: 49,4%).
1H ЯМР (400 МГц, DMSO-d6) δ 12,86 (bs, 2H), 8,21 (m, 1H), 8,00 (s, 1H), 7,72 (d, J = 1,2 Гц, 1H), 7,69 (d, J = 1,2 Гц, 1H), 7,62 (s, 1H), 7,54 (s, 1H), 7,37 (s, 1H), 6,49 (d, J = 1,5 Гц, 2H), 5,40 (d, J = 4,9 Гц, 2H), 4,99 (m, 2H), 4,79 (m, 2H), 4,60 (dt, J = 9,8, 4,4 Гц, 2H), 4,50 (m, 4H), 3,94 (m, 2H), 3,83 - 3,73 (m, 1H), 3,69 (d, J = 10,1 Гц, 2H), 3,61 (m, 5H), 3,53 (d, J = 10,7 Гц, 2H), 2,93 (q, J = 5,3 Гц, 1H), 2,30 (m, 1H), 2,04 (s, 6H), 1,99-1,90 (m, 6H), 1,81 (d, J = 7,2 Гц, 2H), 1,51 - 1,36 (m, 4H), 1,25 (m, 6H); LCMS: масса/заряд 1000,21 [M+H]+
Стадия 2. Натриевая соль (1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 14)
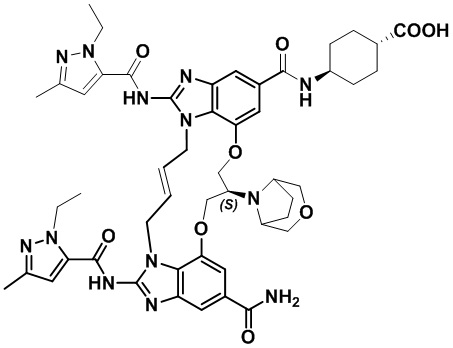
Метил-(1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоксилат (стадия 1, 210 мг, 0,210 ммоль) растворяли в THF (10 мл), метаноле (10 мл) и воде (5 мл). Добавляли гидрат гидроксида лития (88 мг, 2,100 ммоль) и обеспечивали перемешивание реакционной смеси при комнатной температуре в течение ночи. Реакцию отслеживали с помощью LCMS. Реакционную смесь концентрировали до сухого состояния и затем добавляли воду, нейтрализовали с помощью разбавл. HCl, твердое вещество фильтровали и затем сушили с получением указанного в заголовке соединения. Выделенную кислоту затем превращали в ее натриевую соль, как указано в примере 2 (0,15 г, выход: 72,4%).
1H ЯМР (400 МГц, DMSO-d6) δ 12,94 (s, 2H), 12,11 (s, 1H), 11,3 (br s, 1H), 8,37 (s, 1H), 8,05 (s, 1H), 7,74 (d, J = 1,4 Гц, 4H), 7,46 (s, 1H), 6,52 (s, 2H), 5,41 (s, 2H), 4,99 (m, 4H), 4,81 (m, 2H), 4,50 (m, 6H), 4,25 (m, 1H), 3,78 (m, 2H), 3,69-3,51 (m, 2H), 2,99-2,89 (m, 1H), 2,30 (d, J = 6,9 Гц, 2H), 2,17 (s, 3H), 2,09 (s, 3H), 2,04 (m, 4H), 1,97 (s, 2H), 1,95 - 1,87 (m, 2H), 1,42 (m, 4H), 1,25 (m, 6H); LCMS: масса/заряд 986,21 [M+H]+; чистота в соответствии с HPLC: 99,80%
Пример 15. Натриевая соль (1R,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 15)
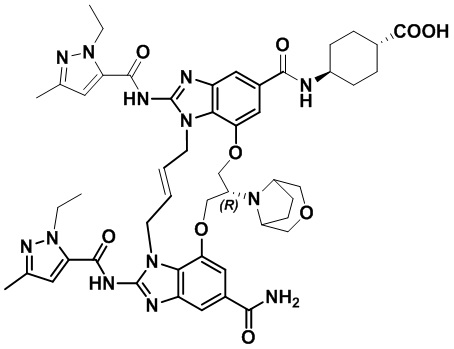
Синтезировали из продукта со стадии 1 примера 12 (энантиомер 2) и метил-(1R,4R)-4-аминоциклогексан-1-карбоксилата гидрохлорида в соответствии с аналогичными процедурами, описанными для синтеза примера 12 и 14.
1H ЯМР (400 МГц, DMSO-d6) δ 12,94 (s, 2H), 12,11 (s, 1H), 11,3 (br s, 1H), 8,37 (s, 1H), 8,05 (s, 1H), 7,74 (d, J = 1,4 Гц, 4H), 7,46 (s, 1H), 6,52 (s, 2H), 5,41 (s, 2H), 4,99 (m, 4H), 4,81 (m, 2H), 4,50 (m, 6H), 4,25 (m, 1H), 3,78 (m, 2H), 3,69-3,51 (m, 2H), 2,99-2,89 (m, 1H), 2,30 (d, J = 6,9 Гц, 2H), 2,17 (s, 3H), 2,09 (s, 3H), 2,04 (m, 4H), 1,97 (s, 2H), 1,95 - 1,87 (m, 2H), 1,42 (m, 4H), 1,25 (m, 6H); LCMS: масса/заряд 986,21 [M+H]+; чистота в соответствии с HPLC: 99,75%
Пример 16. Натриевая соль (8S,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 16)
Синтезировали из продукта со стадии 11 примера 12 и 3-(1H-тетразол-5-ил)пропан-1-амина в соответствии с аналогичной процедурой, описанной для синтеза примера 12.

1H ЯМР (400 МГц, DMSO-d6) δ 12,88 (s, 2H), 8,57 (m, 1H), 8,00 (s, 1H), 7,71 (m, 2H), 7,62 (s, 1H), 7,56 (s, 1H), 7,38 (s, 1H), 6,49 (s, 2H), 5,42 (s, 2H), 4,99 (m, 2H), 4,85 - 4,75 (m, 2H), 4,60 (d, J = 10,7 Гц, 2H), 4,51 (q, J = 7,0 Гц, 4H), 3,94 (m, 2H), 3,68 (d, J = 10,1 Гц, 2H), 3,60 (s, 2H), 3,57 - 3,49 (m, 2H), 2,95 (m, 4H), 2,08 (m, 2H), 2,04 (s, 6H), 1,98 (dd, J = 15,1, 7,7 Гц, 4H), 1,81 (d, J = 7,7 Гц, 2H), 1,25 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд 970,33 [M+H]+; чистота в соответствии с HPLC: 99,61%
Пример 17. Натриевая соль (8R,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 17)
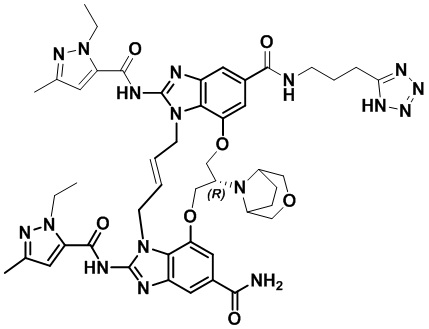
Синтезировали из продукта со стадии 1 примера 12 (энантиомер 2) и 3-(1H-тетразол-5-ил)пропан-1-амина в соответствии с аналогичной процедурой, описанной для синтеза примера 12.
1H ЯМР (400 МГц, DMSO-d6) δ 12,88 (s, 2H), 8,57 (m, 1H), 8,00 (s, 1H), 7,71 (m, 2H), 7,62 (s, 1H), 7,56 (s, 1H), 7,38 (s, 1H), 6,49 (s, 2H), 5,42 (s, 2H), 4,99 (m, 2H), 4,85 - 4,75 (m, 2H), 4,60 (d, J = 10,7 Гц, 2H), 4,51 (q, J = 7,0 Гц, 4H), 3,94 (m, 2H), 3,68 (d, J = 10,1 Гц, 2H), 3,60 (s, 2H), 3,57 - 3,49 (m, 2H), 2,95 (m, 4H), 2,08 (m, 2H), 2,04 (s, 6H), 1,98 (dd, J = 15,1, 7,7 Гц, 4H), 1,81 (d, J = 7,7 Гц, 2H), 1,25 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд 970,33 [M+H]+; чистота в соответствии с HPLC: 99,90%
Пример 18. Натриевая соль 1-(3-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 18)
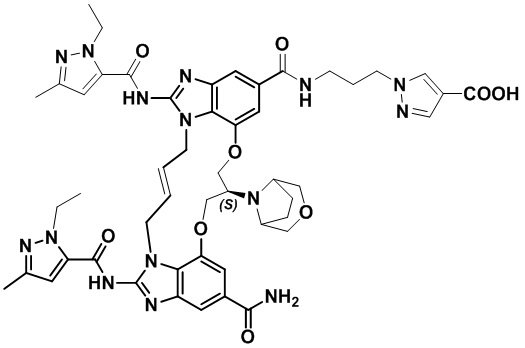
Синтезировали из продукта со стадии 11 примера 12 (энантиомер 1) и этил-1-(3-аминопропил)-1H-пиразол-4-карбоксилата в соответствии с аналогичной процедурой, описанной для синтеза примера 12 и 14.
1H ЯМР (400 МГц, DMSO-d6) δ 12,96 (bs, 2H), 12,32 (s, 1H), 11,19 (s, 1H), 8,72 (s, 1H), 8,35 (s, 1H), 8,05 (s, 1H), 7,83 (s, 1H), 7,75 (m, 3H), 7,47 (s, 1H), 6,52 (s, 2H), 5,42 (s, 2H), 5,11 - 4,75 (m, 6H), 4,50 (m, 6H), 4,23 (m, 3H), 3,89 (m, 2H), 3,74 - 3,49 (m, 3H), 3,27 (d, J = 7,8 Гц, 2H), 2,94 (m, 1H), 2,30 (d, J = 9,6 Гц, 1H), 2,22 - 1,75 (m, 11H), 1,24 (m, 6H); LCMS: масса/заряд 1012,21 [M+H]+; чистота в соответствии с HPLC: 98,43%
Пример 19. Натриевая соль 1-(3-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 19)
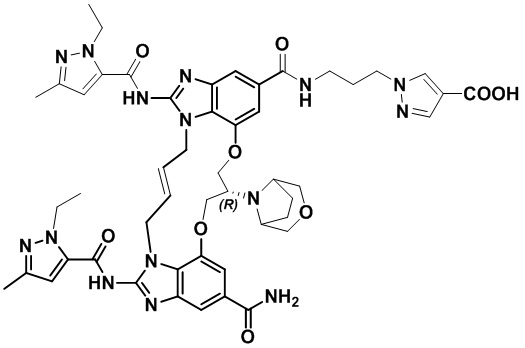
Синтезировали из продукта со стадии 1 примера 12 (энантиомер 2) и этил-1-(3-аминопропил)-1H-пиразол-4-карбоксилата в соответствии с аналогичными процедурами, описанными для синтеза примера 12 и 14.
1H ЯМР (400 МГц, DMSO-d6) δ 12,96 (bs, 2H), 12,32 (s, 1H), 11,19 (s, 1H), 8,72 (s, 1H), 8,35 (s, 1H), 8,05 (s, 1H), 7,83 (s, 1H), 7,75 (m, 3H), 7,47 (s, 1H), 6,52 (s, 2H), 5,42 (s, 2H), 5,11 - 4,75 (m, 6H), 4,50 (m, 6H), 4,23 (m, 3H), 3,89 (m, 2H), 3,74 - 3,49 (m, 3H), 3,27 (d, J = 7,8 Гц, 2H), 2,94 (m, 1H), 2,30 (d, J = 9,6 Гц, 1H), 2,22 - 1,75 (m, 11H), 1,24 (m, 6H); LCMS: масса/заряд 1012,21 [M+H]+; чистота в соответствии с HPLC: 99,78%
Пример 20. (1R,4R)-4-((E)-8-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновая кислота (соединение 20)
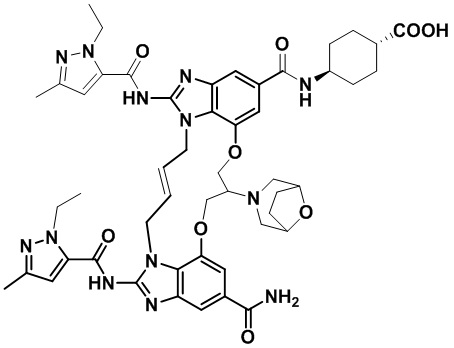
Стадия 1. Диэтил-2-((1R,5S)-8-окса-3-азабицикло[3.2.1]октан-3-ил)малонат
К перемешиваемому раствору диэтил-2-броммалоната (5,0 г, 20,91 ммоль) в хлороформе (50 мл) добавляли 8-окса-3-азабицикло[3.2.1]октана гидрохлорид (4,69 г, 31,4 ммоль) и TEA (14,58 мл, 105 ммоль) при комнатной температуре и нагревали реакционную смесь при 60°C в течение 12 ч. Реакцию отслеживали путем применения TLC. Реакционную смесь концентрировали с получением неочищенного продукта, который очищали посредством Combiflash с применением 15-20% этилацетата в гексанах с получением указанного в заголовке соединения (3,5 г, выход 61,7%).
LCMS (ESI): масса/заряд 272,08 (M+H)+
1H ЯМР (400 МГц, DMSO-d6) δ 4,20 (d, J = 2,6 Гц, 3H), 4,15 (m, 4H), 2,70 (dd, J = 11,0, 2,1 Гц, 2H), 2,61 (dt, J = 10,8, 1,3 Гц, 2H), 1,92 - 1,74 (m, 2H), 1,74 - 1,64 (m, 2H), 1,20 (t, J = 7,1 Гц, 6H).
Стадия 2. 2-((1R,5S)-8-Окса-3-азабицикло[3.2.1]октан-3-ил)пропан-1,3-диол
Диэтил-2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)малонат (3,50 г, 12,90 ммоль) в THF (20 мл) добавляли в раствор алюмогидрида лития (2,448 г, 64,5 ммоль) в THF (20 мл) при 0°C. Полученный раствор перемешивали при 25°C в течение 5 ч. Смесь гасили путем добавления 25 мл этилацетата и насыщенного водного раствора NaCl по каплям. Полученное твердое вещество фильтровали через подушку из целита и фильтрат концентрировали с получением неочищенного продукта, который очищали с помощью колоночной хроматографии с применением 10% метанола в дихлорметане с получением указанного в заголовке соединения (1,5 г, выход: 62,1%).
LCMS (ESI): масса/заряд 188,14 (M+H)+
1H ЯМР (400 МГц, DMSO-d6) δ 4,16 (dq, J = 4,5, 2,2 Гц, 2H), 3,44 (qd, J = 10,9, 6,1 Гц, 4H), 2,69 (dd, J = 11,2, 2,0 Гц, 2H), 2,44 (dt, J = 11,2, 1,3 Гц, 2H), 2,36 (m, 1H), 1,86 - 1,77 (m, 2H), 1,72 - 1,61 (m, 2H).
Стадия 3. Диэтил-5,5'-((2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)пропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоат)
Этил-4-хлор-3-гидрокси-5-нитробензоат (514 г, 2094 ммоль), 2-((1R,5S)-8-окса-3-азабицикло[3.2.1]октан-3-ил)пропан-1,3-диол (196 г, 1047 ммоль) и трифенилфосфин (1098 г, 4187 ммоль) растворяли в 6 л THF и DIAD (0,814 л, 4187 ммоль) добавляли по каплям. После добавления реакционную смесь нагревали при 55°C в течение 16 ч. Протекание реакции отслеживали с помощью TLC и после завершения реакционную смесь концентрировали с получением неочищенного материала. Это неочищенное вещество суспендировали в этилацетате и перемешивали при -78°C в течение 30 мин., после чего осажденный трифенилфосфиноксид фильтровали и фильтрат концентрировали. Остаток растирали в порошок с этанолом и перемешивали при -78°C в течение 30 мин., после чего осажденный чистый продукт фильтровали и промывали холодным этанолом и высушивали с получением указанного в заголовке соединения (выход: 400 г, 60%).
1H ЯМР (400 МГц, DMSO-d6) δ 8,10 (d, J = 1,8 Гц, 2H), 7,90 (d, J = 1,8 Гц, 2H), 4,57 - 4,46 (m, 4H), 4,38 (q, J = 7,1 Гц, 4H), 4,20 (t, J = 3,4 Гц, 2H), 3,37 (t, J = 5,8 Гц, 1H), 2,86 (dd, J = 11,0, 2,0 Гц, 2H), 2,64 (d, J = 10,6 Гц, 2H), 1,80 (t, J = 5,9 Гц, 2H), 1,71 - 1,59 (m, 2H), 1,35 (t, J = 7,1 Гц, 6H); LCMS (ESI): масса/заряд 642,3 (M+H)+
Стадия 4. Диэтил-(E)-7-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилат
К раствору диэтил-5,5'-((2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)пропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоата (стадия 3, 400 г, 623 ммоль) в смеси растворителей, состоящей из этанола (3700 мл) и THF (500 мл), в автоклаве объемом 10 л добавляли (E)-бут-2-ен-1,4-диамина дигидрохлорид (139 г, 872 ммоль) и DIPEA (1087 мл, 6226 ммоль) и перемешивали реакционную смесь при 110°C в течение 24 ч. Протекание реакции отслеживали с помощью TLC. Реакционную смесь охлаждали до комнатной температуры и полученное твердое вещество фильтровали и высушивали с получением продукта в виде красного твердого вещества (выход: 360 г, 88%).
1H ЯМР (400 МГц, DMSO-d6) δ 8,35 (t, J = 6,7 Гц, 2H), 8,26 (d, J = 1,9 Гц, 2H), 7,59 (d, J = 2,0 Гц, 2H), 5,66 (d, J = 1,8 Гц, 2H), 4,40 (dd, J = 9,8, 5,0 Гц, 2H), 4,34 - 4,24 (m, 8H), 4,05 (dd, J = 15,5, 6,7 Гц, 2H), 3,87 (dd, J = 9,8, 6,0 Гц, 2H), 3,22 (t, J = 5,5 Гц, 1H), 2,77 (dd, J = 10,9, 2,1 Гц, 2H), 2,63 (d, J = 10,6 Гц, 2H), 1,93 (t, J = 6,0 Гц, 2H), 1,79 - 1,67 (m, 2H), 1,31 (t, J = 7,1 Гц, 6H); LCMS (ESI): масса/заряд 656,10 (M+H)+
Стадия 5. Диэтил-(E)-1,13-диамино-7-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилат
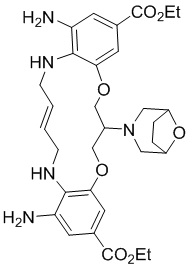
К перемешиваемой суспензии диэтил-(E)-7-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата (стадия 4, 200 г, 305 ммоль) в THF (1500 мл) и этаноле (500 мл) добавляли дитионит натрия (531 г, 3050 ммоль) (раствор в 750 мл воды) при 0°C. Добавляли гидроксид аммония (713 мл, 4576 ммоль) при такой же температуре. Реакционную смесь нагревали до 25°C и перемешивали в течение 3 ч. Протекание реакции отслеживали с помощью LCMS. Твердое вещество отфильтровывали и органические растворители удаляли в вакууме. В реакционную смесь добавляли воду и экстрагировали с помощью DCM (4x250 мл). Органический слой высушивали над сульфатом натрия и концентрировали с получением неочищенного остатка. Твердое вещество промывали простым эфиром с получением неочищенного диамина, который применяли как таковой на следующей стадии (выход: 167 г, 92%).
LCMS (ESI): масса/заряд 596,4 (M+H)+
Стадия 6. Синтез диэтил-(E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксилата
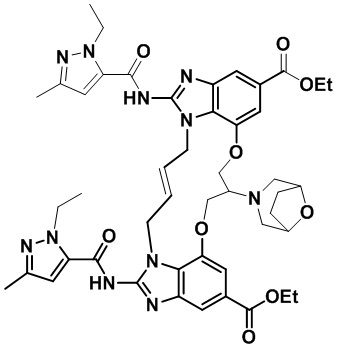
К перемешиваемому раствору диэтил-(E)-1,13-диамино-7-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата (стадия 5, 143 г, 240 ммоль) в DMF (1200 мл) добавляли 1-этил-3-метил-1H-пиразол-5-карбонила изотиоцианат (89 г, 456 ммоль) в 100 мл DMF при 0°C и перемешивали в течение 30 мин. EDC (138 г, 720 ммоль) и TEA (201 мл, 1440 ммоль) добавляли при 0°C, после чего реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакцию отслеживали с помощью LCMS. После завершения смесь концентрировали при пониженном давлении, добавляли воду и полученное твердое вещество фильтровали и высушивали с получением неочищенного материала. Затем его промывали с помощью 50% EA в гексане с удалением неполярных примесей и затем с помощью 10% THF в ацетонитриле с удалением полярных примесей, с получением чистого продукта (выход: 100 г, 45%).
1H ЯМР (400 МГц, DMSO-d6) δ 12,93 (s, 2H), 7,84 (d, J = 1,2 Гц, 2H), 7,68 - 7,49 (m, 2H), 6,53 (s, 2H), 5,44 (brs, 2H), 4,87 (brs, 4H), 4,61 - 4,48 (m, 10H), 4,41 - 4,23 (m, 4H), 3,04 (s, 1H), 2,87 (d, J = 10,5 Гц, 2H), 2,67 (m, 4H), 1,99 (s, 6H), 1,86 - 1,75 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H), 1,18 (t, J = 7,1 Гц, 6H); LCMS (ESI) : масса/заряд 917,94 (M+H)+
Стадия 7. (E)-8-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоновая кислота
К перемешиваемому раствор диэтил-(E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксилата (стадия 6, 100 г, 109 ммоль) в смеси растворителей, состоящей из метанола (1000 мл) и THF (1000 мл), добавляли моногидрат гидроксида лития (36,6 г, 871 ммоль) путем растворения его в 300 мл H2O. Реакционную смесь нагревали при 50°C и перемешивали в течение 16 ч. Протекание реакции отслеживали с помощью LCMS, и после завершения реакционную смесь концентрировали при пониженном давлении и добавляли воду. pH регулировали до 6 путем применения 1 н. HCl, и осажденное твердое вещество фильтровали. Твердую двухосновную кислоту промывали этилацетатом с получением указанного в заголовке соединения (выход: 92 г, 98%).
1H ЯМР (400 МГц, DMSO-d6) δ 7,71 (s, 2H), 7,54 (s, 2H), 6,46 (s, 2H), 5,38 (s, 2H), 4,98 - 4,76 (m, 4H), 4,52 (q, J = 7,0 Гц, 6H), 4,27 (d, J = 4,6 Гц, 2H), 4,15 (t, J = 8,7 Гц, 2H), 3,07 (s, 1H), 2,87 (d, J = 10,4 Гц, 2H), 2,68 (d, J = 9,9 Гц, 2H), 2,06 (s, 6H), 2,04 - 2,01 (m, 2H), 1,74 (dd, J = 7,9, 3,9 Гц, 2H), 1,24 (t, J = 7,1 Гц, 6H); LCMS (ESI) : масса/заряд 862,05 (M+H)+
Стадия 8. (E)-8-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-12-(((1R,4R)-4-(метоксикарбонил)циклогексил)карбамоил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновая кислота
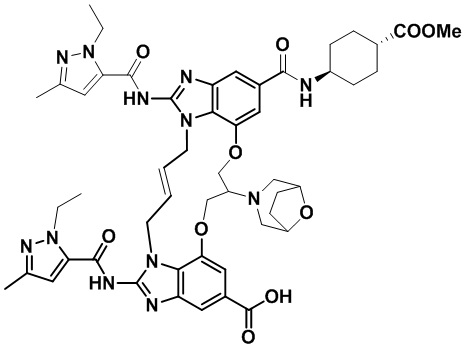
К перемешиваемому раствору (E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоновой кислоты (стадия 7, 0,6 г, 0,70 ммоль) в 6 мл DMF последовательно добавляли метил-(1R,4R)-4-аминоциклогексан-1-карбоксилата гидрохлорид (0,17 г, 0,87 ммоль), [бензотриазол-1-илокси(диметиламино)метилиден]-диметилазания тетрафторборат (0,34 г, 1,04 ммоль) и DIPEA (0,24 мл, 1,39 ммоль) и реакционную смесь перемешивали в течение 1,5 ч. при комнатной температуре. Протекание реакции отслеживали с помощью LCMS и после завершения реакционную смесь концентрировали и добавляли воду, что приводило к образованию твердого вещества, которое фильтровали и применяли как таковое на следующей стадии.
LCMS (ESI): масса/заряд 1001,21 (M+H)+
Стадия 9. Метил-(1R,4R)-4-((E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоксамидо)циклогексан-1-карбоксилат
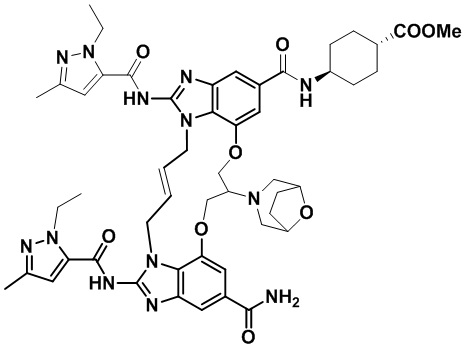
К перемешиваемому раствору (E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-12-(((1R,4R)-4-(метоксикарбонил)циклогексил)карбамоил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновой кислоты (стадия 8, 0,6 г, 0,60 ммоль), растворенному в 5 мл DMF, добавляли хлорид аммония (0,16 г, 3,00 ммоль), [бензотриазол-1-илокси(диметиламино)метилиден]-диметилазания тетрафторборат (0,29 г, 0,90 ммоль) и DIPEA (0,155 г, 1,199 ммоль) и реакционную смесь перемешивали в течение 2 ч. при комнатной температуре. Протекание реакции отслеживали с помощью LCMS и после завершения реакционную смесь концентрировали и добавляли воду, что приводило к образованию твердого вещества, которое фильтровали, и необходимый продукт очищали из неочищенного вещества посредством препаративной хроматографии с обращенной фазой.
LCMS (ESI): масса/заряд 1000,33 (M+H)+
Стадия 10. (1R,4R)-4-((E)-8-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)-4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоксамидо)циклогексан-1-карбоновая кислота (соединение 20)
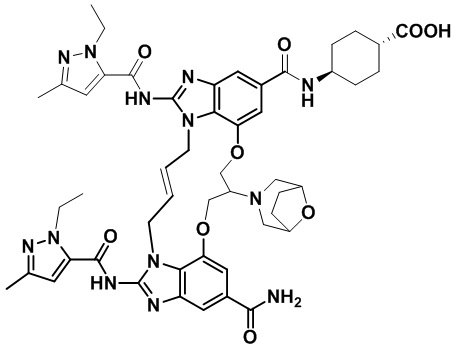
Метил-(1R,4R)-4-((E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоксамидо)циклогексан-1-карбоксилат (стадия 9, 0,12 г, 0,12 ммоль), полученный после очистки, суспендировали в смеси растворителей, состоящей из 6 мл метанол:THF:H2O (1:1:1). Добавляли LiOH (0,03 г, 1,20 ммоль) и реакционную смесь перемешивали в течение 12 ч. при комнатной температуре. После завершения гидролиза летучие вещества концентрировали, и добавляли воду для разбавления реакционной смеси. Раствор затем осторожно нейтрализовали с помощью 1 н. HCl. Полученную суспензию центрифугировали и твердое вещество собирали и высушивали с получением (1R,4R)-4-((E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоксамидо)циклогексан-1-карбоновой кислоты (0,09 г, выход 76%).
1H ЯМР (400 МГц, DMSO-d6) δ 12,84 (s, 2H), 8,22 (m, 1H), 8,00 (s, 1H), 7,69 (s, 1H), 7,64 (s, 1H), 7,56 (s, 1H), 7,46 (s, 1H), 7,40 (s, 1H), 6,53 (m, 2H), 5,46 (m, 2H), 4,87 (m, 4H), 4,65 - 4,44 (m, 6H), 4,29 (s, 2H), 4,19 (s, 2H), 3,75 (s, 1H), 3,08 (s, 1H), 2,92 - 2,84 (m, 2H), 2,73 - 2,66 (m, 2H), 2,18 (s, 1H), 2,10 - 1,89 (m, 12H), 1,77 (d, J = 7,3 Гц, 2H), 1,42 (m, 4H), 1,27 - 1,23 (m, 6H); LCMS (ESI): масса/заряд 986,21 (M+H)+; чистота в соответствии с HPLC: 99,19%
Пример 21. (E)-N-(3-(1H-Тетразол-5-ил)пропил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 21)
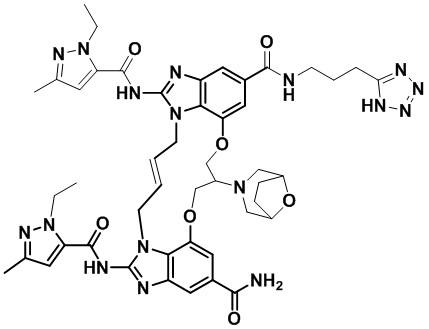
Стадия 1. (E)-12-((3-(1H-Тетразол-5-ил)пропил)карбамоил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновая кислота
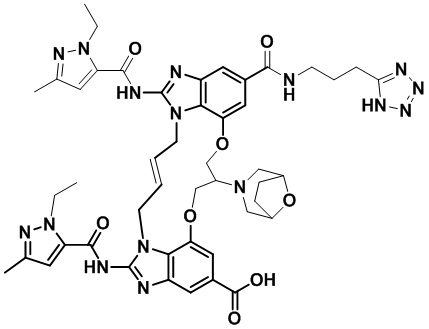
Синтезировали аналогично в соответствии с процедурой, подробно показанной на стадии 8 примера 20, путем применения (E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоновой кислоты и 3-(1H-тетразол-5-ил)пропан-1-амина гидрохлорида.
LCMS (ESI): масса/заряд 971,33 (M+H)+
Стадия 2. (E)-N-(3-(1H-Тетразол-5-ил)пропил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид
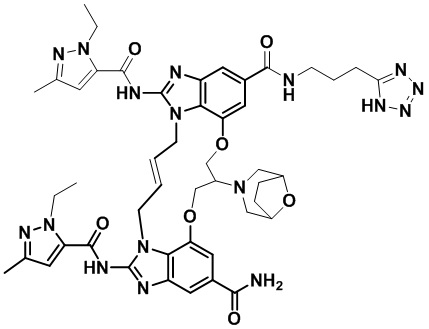
Синтезировали аналогично в соответствии с процедурой, подробно показанной на стадии 9 примера 20, путем применения продукта со стадии 1 и хлорида аммония и очистки посредством препаративной хроматографии с обращенной фазой.
1H ЯМР (400 МГц, DMSO-d6) δ 12,88 (d, J = 3,9 Гц, 2H), 8,58 (m, 1H), 8,00 (s, 1H), 7,69 (s, 1H), 7,65 (s, 1H), 7,57 (s, 1H), 7,50 (s, 1H), 7,41 (s, 1H), 6,53 (m, 2H), 5,49 (m, 2H), 4,88 (m, 4H), 4,63 - 4,44 (m, 6H), 4,29 (d, J = 4,9 Гц, 2H), 4,24 - 4,15 (m, 2H), 3,08 (s, 1H), 2,96 (t, J = 7,7 Гц, 2H), 2,88 (d, J = 10,4 Гц, 2H), 2,81 - 2,62 (m, 2H), 2,20 - 1,92 (m, 10H), 1,75 (d, J = 4,2 Гц, 4H), 1,30 - 1,23 (m, 6H); LCMS (ESI): масса/заряд 970,20 (M+H)+; чистота в соответствии с HPLC: 96,27%
Пример 22. (E)-N-((1R,4R)-4-(1H-Тетразол-5-ил)циклогексил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 22)
Стадия 1. (E)-12-(((1R,4R)-4-(1H-Тетразол-5-ил)циклогексил)карбамоил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновая кислота
Синтезировали аналогично в соответствии с процедурой, подробно показанной на стадии 8 примера 20, путем применения (E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоновой кислоты и (1R,4R)-4-(1H-тетразол-5-ил)циклогексан-1-амина гидрохлорида (пром. соед. 3b).
LCMS (ESI) : масса/заряд 1011,21 (M+H)+
Стадия 2. (E)-N-((1R,4R)-4-(1H-Тетразол-5-ил)циклогексил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид
Синтезировали аналогично в соответствии с процедурой, подробно показанной на стадии 9 примера 20, путем применения продукта со стадии 1 и хлорида аммония и очистки посредством препаративной хроматографии с обращенной фазой.
1H ЯМР (400 МГц, DMSO-d6) δ 12,95 (s, 1H), 8,31 (m, 1H), 8,01 (s, 1H), 7,70 (s, 1H), 7,66 (s, 1H), 7,57 (d, J = 1,3 Гц, 1H), 7,49 (s, 1H), 7,42 (s, 1H), 6,53 (m, 2H), 5,47 (m, 2H), 4,88 (m, 4H), 4,71 - 4,48 (m, 6H), 4,30 (s, 2H), 4,20 (q, J = 10,5 Гц, 2H), 3,98 - 3,75 (m, 1H), 3,09 (s, 1H), 3,03 - 2,93 (m, 1H), 2,92 - 2,83 (m, 2H), 2,71 (s, 1H), 2,70 - 2,65 (m, 1H), 2,12 (d, J = 12,2 Гц, 2H), 2,08 - 1,99 (m, 11H), 1,76 (s, 2H), 1,62 (m, 4H), 1,29 - 1,23 (m, 6H); LCMS (ESI) : масса/заряд 1010,21 (M+H)+; чистота в соответствии с HPLC: 97,05%
Пример 23. (E)-1-(3-(8-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновая кислота (соединение 23)
Синтезировали из продукта со стадии 7 примера 20 и этил-1-(3-аминопропил)-1H-пиразол-4-карбоксилата (пром. соед. 5) в соответствии с аналогичной процедурой, описанной на стадиях 8, 9 и 10 примера 20.(Выход: 22,0%)
1H ЯМР (400 МГц, DMSO-d6) δ 8,50 (brs, 1H), 8,40 (s, 2H), 8,26 (s, 1H), 7,98 (brs, 1H), 7,79 (s, 1H), 7,64 (s, 1H), 7,53 (s, 1H), 7,46 (s, 1H), 6,50 (s, 2H), 5,54 - 5,31 (m, 2H), 4,88 (m, 4H), 4,63 - 4,46 (m, 6H), 4,28 (s, 2H), 4,21 (t, J = 6,8 Гц, 4H), 3,27 (d, J = 6,7 Гц, 2H), 3,14 - 3,03 (m, 1H), 2,88 (d, J = 10,5 Гц, 2H), 2,76 - 2,65 (m, 2H), 2,08 - 1,99 (m, 10H), 1,83 - 1,66 (m, 2H), 1,24 (m, 6H); LCMS (ESI) : масса/заряд 1012,21 (M+H)+; чистота в соответствии с HPLC: 99,29%
Пример 24. (E)-N-((1R,4R)-4-(1H-Тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 24)
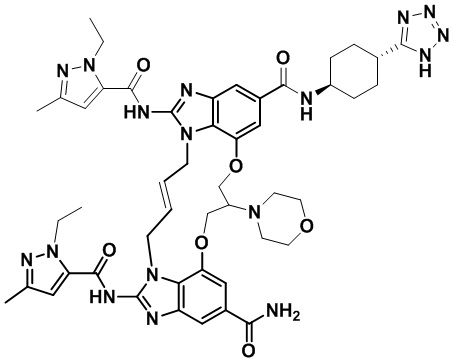
Стадия 1. Синтез диэтил-5,5'-((2-(метоксиметокси)пропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоата)
К охлаждаемому раствору этил-4-хлор-3-гидрокси-5-нитробензоата (325 г, 1323 ммоль), 2-(метоксиметокси)пропан-1,3-диола (90 г, 662 ммоль), трифенилфосфина (694 г, 2646 ммоль) в THF (2 л) добавляли DIAD (0,515 l, 2646 ммоль) по каплям и реакционную смесь перемешивали при 60°C в течение 16 ч. Протекание реакции отслеживали с помощью TLC. Реакционную смесь концентрировали с получением неочищенного материала, к ней добавляли IPA (200 мл) и перемешивали в течение 30 мин. при комнатной температуре и затем при -78°C в течение 30 мин., фильтровали твердое вещество, надлежащим образом высушивали с получением чистого диэтил-5,5'-((2-(метоксиметокси)пропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоата (выход =230 г, 59%).
1H ЯМР (400 МГц, хлороформ-d) δ 8,08 (d, J = 1,7 Гц, 2H), 7,84 (d, J = 1,8 Гц, 2H), 4,91 (s, 2H), 4,58 - 4,40 (m, 10H), 3,48 (s, 3H), 1,44 (t, J = 7,1 Гц, 6H).
Стадия 2. Синтез диэтил-5,5'-((2-гидроксипропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоата)
К охлаждаемому раствору диэтил-5,5'-((2-(метоксиметокси)пропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоат) (стадия 1, 23,0 г, 38,9 ммоль) в DCM (150 мл) и этанола (150 мл) добавляли HCl в диоксане (97,2 мл, 388,9 ммоль), и реакционную смесь перемешивали при 25°C в течение 12 ч. Протекание реакции отслеживали с помощью TLC. Реакционную смесь концентрировали и растворяли в DCM (200 мл) и промывали с помощью 8% раствора бикарбоната натрия и воды, органическую фазу высушивали над сульфатом натрия и перегоняли при пониженном давлении с получением диэтил-5,5'-((2-гидроксипропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоат), (выход =21,0 г, 97%).
1H ЯМР (400 МГц, хлороформ-d) δ 8,10 (d, J = 1,7 Гц, 2H), 7,85 (d, J = 1,8 Гц, 2H), 4,61 (p, J = 5,1 Гц, 1H), 4,50 - 4,40 (m, 7H), 3,72 (s, 3H), 1,44 (t, J = 7,1 Гц, 5H).
Стадия 3. Синтез диэтил-5,5'-((2-(((трифторметил)сульфонил)окси)пропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоата)
К охлаждаемому раствору диэтил-5,5'-((2-гидроксипропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоат) (стадия 2, 21,0 г, 38,4 ммоль) в DCM (200 мл) 2,6-лутидин (17,9 мл, 153,5 ммоль), добавляли по каплям трифторметансульфоновый ангидрид (16,2 г, 57,6 ммоль) и реакционную смесь перемешивали при 0°C в течение 1 ч. Протекание реакции отслеживали с помощью TLC. Реакционную смесь гасили в 2 н. водном растворе HCl и экстрагировали с помощью DCM и промывали водой, высушивали над сульфатом натрия и концентрировали при пониженном давлении с получением диэтил-5,5'-((2-(((трифторметил)сульфонил)окси)пропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоат) (выход =24,0 г, 92%).
1H ЯМР (400 МГц, хлороформ-d) δ 8,15 (d, J = 1,7 Гц, 2H), 7,83 (d, J = 1,7 Гц, 2H), 5,64 (p, J = 4,8 Гц, 1H), 4,70 - 4,66 (m, 4H), 4,47 (q, J = 7,1 Гц, 4H), 3,73 (s, 1H), 1,45 (t, J = 7,1 Гц, 6H).
Стадия 4. Синтез диэтил-5,5'-((2-морфолинопропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоат)

К охлаждаемому раствору морфолина (1,924 г, 22,08 ммоль) в THF (300 мл) добавляли TEA (1,847 мл, 13,25 ммоль) и перемешивали в течение 30 мин. при комнатной температуре. Реакционную смесь охлаждали до 0°C и затем добавляли раствор диэтил-5,5'-((2-(((трифторметил)сульфонил)окси)пропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоат) (стадия 3, 7,5 г, 11,04 ммоль) в THF (30 мл), перемешивали при 25°C в течение 12 ч. Протекание реакции отслеживали с помощью TLC. Реакционную смесь концентрировали и очищали с помощью колоночной хроматографии с получением необходимого продукта (выход =2,8 г, 41,1%).
1H ЯМР (400 МГц, DMSO-d6) δ 8,10 (d, J = 1,8 Гц, 2H), 7,93 (d, J = 1,8 Гц, 2H), 4,54 (d, J = 5,7 Гц, 4H), 4,38 (q, J = 7,1 Гц, 4H), 3,53 (t, J = 4,5 Гц, 4H), 3,44 (m, 1H), 2,79 (t, J = 4,6 Гц, 4H), 1,35 (t, J = 7,1 Гц, 6H); LCMS (ESI): масса/заряд 615,84 (M+H)+
Стадия 5. Диэтил-(E)-7-морфолино-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилат
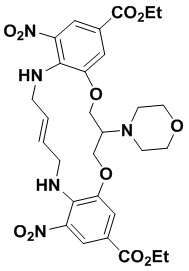
К раствору диэтил-5,5'-((2-морфолинопропан-1,3-диил)бис(окси))бис(4-хлор-3-нитробензоата) (стадия 4, 40,0 г, 62,6 ммоль) в смеси растворителей, состоящей из этанола (350 мл) и THF (50 мл), в автоклаве объемом 1 л добавляли (E)-бут-2-ен-1,4-диамина дигидрохлорид (13,9 г, 87,2 ммоль) и DIPEA (108 мл, 622,6 ммоль) и перемешивали реакционную смесь при 110°C в течение 24 ч. Протекание реакции отслеживали с помощью TLC. Реакционную смесь охлаждали до комнатной температуры и полученное твердое вещество фильтровали и высушивали с получением продукта в виде красного твердого вещества (выход: 36,0 г, 88%).
1H ЯМР (400 МГц, DMSO-d6) δ 8,37 (m, 2H), 8,26 (d, J = 1,9 Гц, 2H), 7,64 (d, J = 2,0 Гц, 2H), 5,73 - 5,63 (m, 2H), 4,53 - 4,41 (m, 2H), 4,35 - 4,24 (m, 6H), 4,11 - 4,01 (m, 2H), 3,94 - 3,85 (m, 2H), 3,64 (t, J = 4,4 Гц, 4H), 3,32 - 3,23 (m, 1H), 2,74 (t, J = 4,6 Гц, 4H), 1,31 (t, J = 7,1 Гц, 6H); LCMS (ESI) : масса/заряд 629,96 (M+H)+
Стадия 6. Диэтил-(E)-1,13-диамино-7-морфолино-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилат
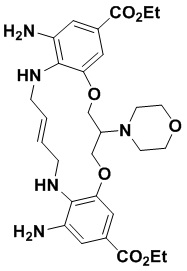
К перемешиваемой суспензии диэтил-(E)-7-морфолино-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата (стадия 5, 20,0 г, 30,8 ммоль) в THF (150 мл) и этаноле (50 мл) добавляли дитионит натрия (53,1 г, 305,0 ммоль) (раствор в 750 мл воды) при 0°C. Добавляли гидроксид аммония (71,3 мл, 457,6 ммоль) при такой же температуре. Реакционную смесь нагревали до 25°C и перемешивали в течение 3 ч. Протекание реакции отслеживали с помощью LCMS. Твердое вещество отфильтровывали и органические растворители удаляли в вакууме. В реакционную смесь добавляли воду и экстрагировали с помощью DCM (2x250 мл). Органический слой высушивали над сульфатом натрия и концентрировали с получением неочищенного остатка. Твердое вещество промывали простым эфиром с получением неочищенного диамина, который применяли как таковой на следующей стадии (выход: 16,7 г, 92%).
1H ЯМР (400 МГц, DMSO-d6) δ 7,31 - 7,08 (m, 4H), 7,04 - 7,01 (m, 2H), 7,00 - 6,92 (m, 2H), 5,52 - 5,39 (m, 2H), 4,34 - 4,20 (m, 8H), 3,71 - 3,61 (m, 4H), 3,57 - 3,46 (m, 4H), 3,45 - 3,38 (m, 1H), 2,87 - 2,67 (m, 4H), 1,31 - 1,27 (m, 6H); LCMS (ESI): масса/заряд 570,20 (M+H)+
Стадия 7. Диэтил-(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксилат
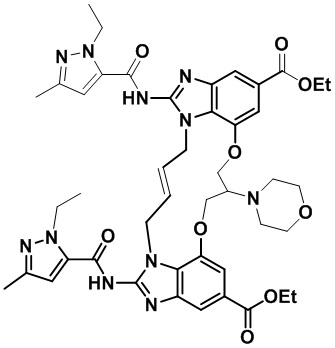
К перемешиваемому раствору диэтил-диэтил-(E)-1,13-диамино-7-морфолино-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3,11-дикарбоксилата (стадия 6, 14,3 г, 24,5 ммоль) в DMF (120 мл) добавляли 1-этил-3-метил-1H-пиразол-5-карбонила изотиоцианат (8,9 г, 45,6 ммоль) в 20 мл DMF добавляли при 0°C и перемешивали в течение 30 мин. EDC (13,8 г, 72,0 ммоль) и TEA (20,1 мл, 144,0 ммоль) добавляли при 0°C, после чего реакционную смесь перемешивали в течение 18 ч. Реакцию отслеживали с помощью LCMS. После завершения смесь концентрировали при пониженном давлении, добавляли воду и полученное твердое вещество фильтровали и высушивали с получением неочищенного материала. Затем его промывали с помощью 50% EA в гексане с удалением неполярных примесей и затем с помощью 10% THF в ацетонитриле с удалением полярных примесей, с получением чистого продукта (выход: 10,0 г, 45%).
1H ЯМР (400 МГц, DMSO-d6) δ 12,92 (s, 2H), 7,84 (d, J = 1,3 Гц, 2H), 7,69 (d, J = 1,4 Гц, 2H), 6,55 (s, 2H), 5,62 - 5,49 (m, 2H), 4,97 - 4,82 (m, 4H), 4,70 - 4,59 (m, 2H), 4,59 - 4,48 (m, 4H), 4,38 - 4,24 (m, 6H), 3,76 - 3,62 (m, 4H), 3,15 - 3,05 (m, 1H), 2,86 - 2,75 (m, 4H), 2,08 (s, 6H), 1,35 (t, J = 7,1 Гц, 6H), 1,28 (t, J = 7,1 Гц, 6H); LCMS (ESI): масса/заряд 892,06 (M+H)+
Стадия 8. (E)-4-(Этоксикарбонил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоновая кислота
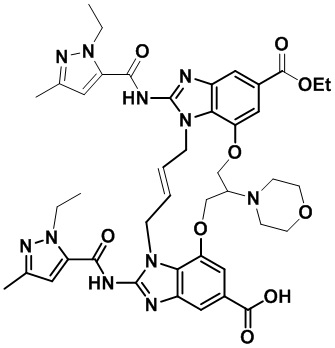
К перемешиваемому раствор диэтил-(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксилата (стадия 7, 1,0 г, 1,089 ммоль) в этаноле (20 мл) и THF (20 мл) добавляли гидрат гидроксида лития (0,183 г, 4,36 ммоль) путем растворения в H2O (объем: 5 мл) при комнатной температуре и перемешивали в течение 16 ч. при 50°C. Реакцию отслеживали с помощью LCMS, реакционную смесь концентрировали при пониженном давлении и добавляли воду, pH регулировали до кислотного путем применения 1 н. HCl, твердое вещество осаждали, его фильтровали и высушивали с получением (E)-4-(этоксикарбонил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоновой кислоты (600 мг, выход 61,9%).
LCMS (ESI): масса/заряд 864,06 (M+H)+
Стадия 9. Этил-(E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксилат
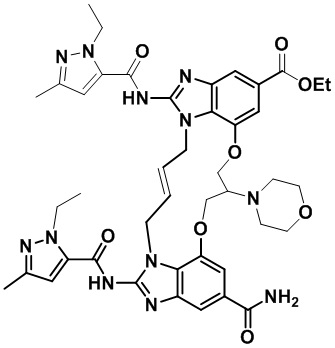
(E)-4-(Этоксикарбонил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-12-карбоновую кислоту (стадия 8, 1,0 г, 1,124 ммоль) растворяли в DMF (10 мл), EDC (0,470 г, 1,461 ммоль) и DIPEA (0,981 мл, 5,62 ммоль) добавляли в нее. Добавляли хлорид аммония (2,104 г, 39,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию отслеживали с помощью LCMS. Реакционную смесь концентрировали до сухого состояния и затем добавляли воду, полученное твердое вещество фильтровали и высушивали с получением продукта (600 мг, 0,674 ммоль, выход 60,9%).
1H ЯМР (400 МГц, DMSO-d6) δ 12,97 - 12,84 (m, 2H), 8,00 (s, 1H), 7,84 (d, J = 1,3 Гц, 1H), 7,75 - 7,65 (m, 2H), 7,62 (d, J = 1,4 Гц, 1H), 7,42 (s, 1H), 6,56 (s, 1H), 6,53 (s, 1H), 5,55 (s, 2H), 5,08 - 4,73 (m, 4H), 4,70 - 4,47 (m, 6H), 4,41 - 4,30 (m, 2H), 4,30 - 4,19 (m, 2H), 3,79 - 3,60 (m, 4H), 3,15 - 3,05 (m, 1H), 2,89 - 2,74 (m, 4H), 2,09 - 2,04 (m, 6H), 1,35 (t, J = 7,1 Гц, 3H), 1,31 - 1,25 (m, 6H); LCMS (ESI): масса/заряд 863,18 (M+H)+
Стадия 10. (E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновая кислота
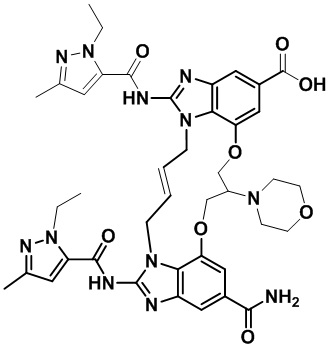
К перемешиваемому раствору этил-этил-(E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоксилата (стадия 9, 900 мг, 1,012 ммоль) в MeOH (10 мл) и THF (10 мл) добавляли гидрат гидроксида лития (425 мг, 10,12 ммоль) путем растворения в H2O (объем: 5 мл) при комнатной температуре и перемешивали в течение 16 ч. при 50°C. Реакцию отслеживали с помощью LCMS, реакционную смесь концентрировали при пониженном давлении и добавляли воду, pH регулировали до кислотного путем применения 1 н. HCl, твердое вещество осаждали, его фильтровали и высушивали с получением необходимого продукта (840 мг, выход: 86%).
1H ЯМР (400 МГц, DMSO-d6) δ 8,16 (s, 1H), 7,94 (s, 2H), 7,89 (d, J = 1,2 Гц, 1H), 7,78 (d, J = 1,1 Гц, 1H), 7,49 (s, 1H), 6,54 (s, 1H), 6,52 (s, 1H), 5,44 - 5,29 (m, 2H), 5,20 - 5,08 (m, 2H), 5,03 - 4,84 (m, 4H), 4,57 - 4,37 (m, 6H), 4,08 - 4,01 (m, 4H), 3,70 - 3,47 (m, 5H), 2,05 - 2,03 (m, 6H), 1,27 - 1,23 (m, 6H); LCMS (ESI): масса/заряд 835,26 (M+H)+
Стадия 11. (E)-N-((1R,4R)-4-(1H-Тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 24)
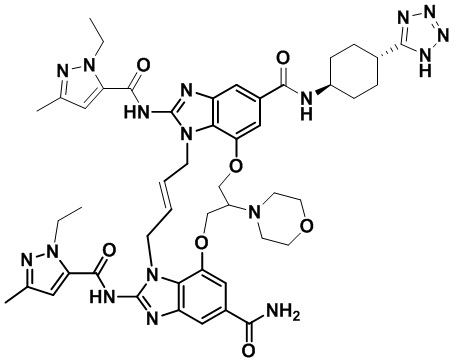
(E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3.2.1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (стадия 10, 600 мг, 0,697 ммоль) растворяли в DMSO (10 мл), EDC (401 мг, 2,091 ммоль) и DIPEA (0,609 мл, 3,48 ммоль), в нее добавляли (1R,4R)-4-(1H-тетразол-5-ил)циклогексан-1-амина гидрохлорид (284 мг, 1,394 ммоль) (пром. соед. 3b). Добавляли HOBT (320 мг, 2,091 ммоль) и обеспечивали перемешивание реакционной смеси при к. т. в течение ночи. Реакцию отслеживали с помощью LCMS. Реакционную смесь концентрировали для удаления DIPEA и затем добавляли воду, полученное твердое вещество фильтровали и высушивали с получением неочищенного продукта. Очищали посредством препаративной HPLC с обращенной фазой. (Выход: 21,0%)
1H ЯМР (400 МГц, DMSO-d6) δ 12,88 (s, 2H), 8,30 (m, 1H), 8,01 (s, 1H), 7,71 (s, 1H), 7,69 (s, 1H), 7,64 (s, 1H), 7,58 (s, 1H), 7,41 (s, 1H), 6,54 (m, 2H), 5,61 - 5,46 (m, 2H), 4,98 - 4,81 (m, 4H), 4,72 - 4,62 (m, 2H), 4,56 - 4,47 (m, 3H), 4,28 - 4,16 (m, 2H), 3,95 - 3,77 (m, 2H), 3,74 - 3,60 (m, 4H), 3,20 - 3,13 (m, 1H), 3,02 - 2,93 (m, 1H), 2,92 - 2,77 (m, 4H), 2,22 - 1,88 (m, 10H), 1,71 - 1,48 (m, 4H), 1,30 - 1,20 (m, 6H); LCMS (ESI): масса/заряд 984,08 (M+H)+; чистота в соответствии с HPLC: 99,36%
Пример 25. (E)-N-(3-(1H-Тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 25)
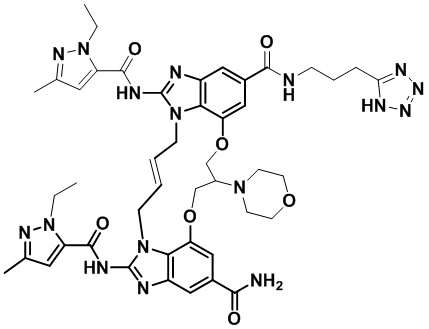
Синтезировали из продукта со стадии 10 примера 24 и 3-(1H-тетразол-5-ил)пропан-1-амина в соответствии с аналогичной процедурой, описанной на стадии 11 примера 24. (выход: 26,0%)
1H ЯМР (400 МГц, DMSO-d6) δ 13,01-12,81 (m, 2H), 8,60 (m, 1H), 8,00 (s, 1H), 7,70 (m, 2H), 7,64 (s, 1H), 7,58 (s, 1H), 7,41 (s, 1H), 6,53 (s, 2H), 5,60-5,42 (m, 2H), 5,04-4,81 (m, 4H), 4,72-4,59 (m, 2H), 4,58-4,46 (m, 4H), 4,24-4,13 (m, 2H), 3,73-3,63 (m, 4H), 3,41-3,37 (m, 2H), 3,16 (s, 1H), 3,00-2,91 (m, 2H), 2,90-2,77 (m, 4H), 2,06 (s, 6H), 2,04-1,93 (m, 4H), 1,33-1,25 (m, 6H); LCMS (ESI): масса/заряд 944,20 (M+H)+; чистота в соответствии с HPLC: 99,22%
Пример 26. (1R,4R)-4-((E)-12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновая кислота (соединение 26)
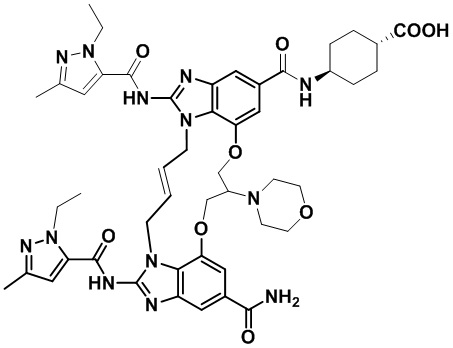
Синтезировали из продукта со стадии 10 примера 24 и метил-(1R,4R)-4-аминоциклогексан-1-карбоксилата гидрохлорида в соответствии с аналогичными процедурами, описанными на стадиях 1 и 2 примера 14. (выход: 24,0%)
1H ЯМР (400 МГц, DMSO-d6) δ 12,87 (s, 1H), 8,28-8,08 (m, 1H), 8,00 (s, 1H), 7,71 (s, 1H), 7,67 (s, 1H), 7,63 (s, 1H), 7,55 (s, 1H), 7,41 (s, 1H), 6,53 (s, 2H), 5,70-5,34 (m, 2H), 5,05-4,78 (m, 4H), 4,65 (t, J = 11,6 Гц, 2H), 4,56-4,37 (m, 4H), 4,30-4,09 (m, 2H), 3,86-3,73 (m, 1H), 3,74-3,62 (m, 4H), 3,21-3,08 (m, 1H), 2,96-2,76 (m, 4H), 2,25-2,11 (m, 1H), 2,07-2,09 (m, 6H), 2,00-1,88 (m, 4H), 1,53-1,32 (m, 4H), 1,31-1,24 (m, 6H); LCMS (ESI) масса/заряд 960,20 (M+H)+; чистота в соответствии с HPLC: 99,02%
Пример 27. (E)-1-(3-(12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновая кислота (соединение 27)
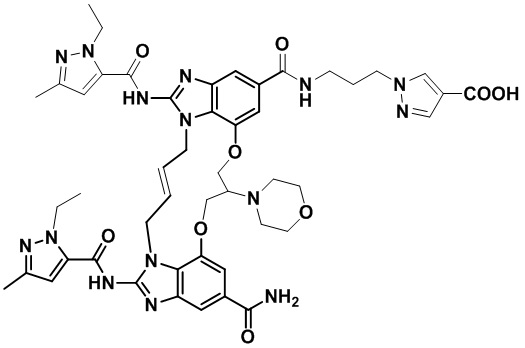
Синтезировали из продукта со стадии 10 примера 24 и этил-1-(3-аминопропил)-1H-пиразол-4-карбоксилата (пром. соед. 5) в соответствии с аналогичными процедурами, описанными на стадиях 1 и 2 примера 14. (Выход: 28,0%)
1H ЯМР (400 МГц, DMSO-d6) δ 8,53 (m, 1H), 8,00 (s, 1H), 7,71 (s, 1H), 7,68 (s, 1H), 7,64 (s, 1H), 7,58 (s, 1H), 7,41 (s, 1H), 6,54 (s, 2H), 5,52 (d, J = 4,1 Гц, 2H), 5,00-4,77 (m, 4H), 4,70-4,61 (m, 2H), 4,59-4,44 (m, 4H), 4,30-4,14 (m, 6H), 3,75-3,61 (m, 4H), 3,27-3,22 (m, 2H), 3,21-3,10 (m, 1H), 2,90-2,77 (m, 4H), 2,06 (s, 8H), 1,29-1,25 (m, 8H); LCMS (ESI): масса/заряд 986,21 (M+H)+; чистота в соответствии с HPLC: 99,26%
Пример 28. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(2-морфолиноэтил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 28)
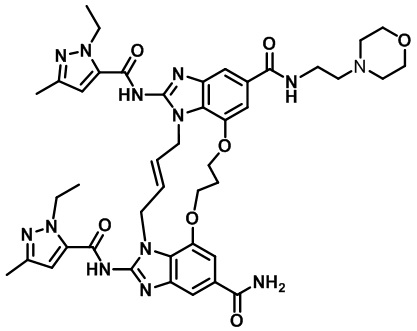
Растворяли (E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (промежуточное соединение 1) (0,2 г, 0,27 ммоль) и 2-морфолиноэтан-1-амин (0,17 г, 1,33 ммоль) в 5 мл DMF. Добавляли TBTU (0,17 г, 0,54 ммоль) с последующим добавлением диизопропилэтиламина (0,28 мл, 1,60 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем DMF концентрировали при пониженном давлении и к нему добавляли воду, что приводило к осаждению продукта. Осадок фильтровали и промывали водой и неочищенный продукт очищали с помощью препаративной хроматографии с обращенной фазой с получением чистого продукта. Затем полученное преобразовывали в его гидрохлоридную соль путем перемешивания с 3 н раствором HCl в метаноле в течение 15 мин., концентрировали смесь и растирали полученное твердое вещество с диэтиловым эфиром с получением соли в виде грязно-белого твердого вещества (15 мг, 6,5%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,95 (brs, 2H), 10,67 (brs, 1H), 8,95 (t, J = 5,5 Гц, 1H), 8,03 (brs, 1H), 7,74 (s, 1H), 7,71 (s, 1H), 7,66 (s, 1H), 7,54 (s, 1H), 7,39 (brs, 1H), 6,56 (s, 1H), 6,55 (s, 1H), 5,56-5,42 (m, 2H), 4,89 (brs, 4H), 4,55-4,42 (m, 8H), 4,02-3,99 (m, 2H), 3,83 (t, J = 12,1 Гц, 2H), 3,74-3,68 (m, 2H), 3,59 (d, J = 12,2 Гц, 2H), 3,37-3,31 (m, 2H), 3,19-3,10 (m, 2H), 2,33-2,26 (m, 2H), 2,08 (s, 6H), 1,30-1,25 (m, 6H); LCMS: масса/заряд = 862,18 (M+H)+; чистота в соответствии с HPLC: 98,18%
Пример 29. (E)-(12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбонил)глицин (соединение 29)

Растворяли (E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (промежуточное соединение 1) (0,3 г, 0,40 ммоль) и трет-бутилглицинат (0,17 г, 0,80 ммоль) в 5 мл DMF. Добавляли TBTU (0,19 г, 0,60 ммоль) с последующим добавлением диизопропилэтиламина (0,28 мл, 1,60 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем DMF концентрировали при пониженном давлении и к нему добавляли воду, что приводило к осаждению продукта. Осадок фильтровали и промывали водой и неочищенный продукт очищали с помощью препаративной хроматографии с обращенной фазой с получением промежуточного соединения, которое представляло собой трет-бутиловый сложный эфир (70 мг, 20%). LCMS: масса/заряд = 877,06 (M+H)+
В перемешиваемый раствор трет-бутил-(E)-3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропаноата (70 мг, 0,08 ммоль) в 10 мл DCM добавляли TFA (0,13 мл, 1,60 ммоль) и перемешивали в течение 1 ч. После удаления защитной группы с группы трет-бутила, что наблюдали с помощью LCMS, реакционную смесь выпаривали до сухого состояния и полученное твердое вещество промывали простым эфиром и высушивали с получением конечного продукта (39 мг, 61%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,93 (brs, 2H), 8,86 (t, J = 5,9 Гц, 1H), 8,01 (brs, 1H), 7,72 (s, 1H), 7,71 (s, 1H), 7,53 (s, 2H), 7,38 (brs, 1H), 6,56 (s, 2H), 5,54-5,48 (m, 2H), 4,89 (brs, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,47-4,41 (m, 4H), 3,96 (d, J = 5,8 Гц, 2H), 2,32-2,24 (m, 2H), 2,08 (s, 6H), 1,30-1,24 (m, 6H); LCMS: масса/заряд = 807,04 (M+H)+; чистота в соответствии с HPLC: 100,0%
Пример 30. (E)-N-(2-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)этил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 30)

Синтезировали из промежуточного соединения 1 и 2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)этан-1-амина (пром. соед. 9) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 80 мг, 19%). 1H ЯМР (400 МГц, DMSO-d6) δ 10,36 (bs, 1H), 9,07 (t, J = 5,3 Гц, 1H), 8,03 (bs, 1H), 7,74 (s, 1H), 7,71 (s, 1H), 7,67 (s, 1H), 7,54 (s, 1H), 7,38 (bs, 1H), 6,57 (s, 1H), 6,56 (s, 1H), 5,57-5,43 (m, 2H), 4,89 (bs, 4H), 4,56-4,43 (m, 10H), 3,76-3,68 (m, 2H), 3,53-3,44 (m, 2H), 3,35-3,26 (m, 2H), 3,16 (t, J = 10,7 Гц, 2H), 2,32-2,23 (m, 4H), 2,08 (s, 6H), 2,00-1,92 (m, 2H), 1,27 (m, 6H); LCMS: масса/заряд = 888,19 (M+H)+; чистота в соответствии с HPLC: 99,79%
Пример 31. (E)-3-(12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропановая кислота (соединение 31)
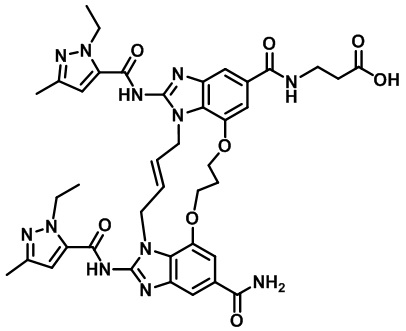
Синтезировали из промежуточного соединения 1 и трет-бутил-3-аминопропаноата в соответствии с аналогичной процедурой, описанной для синтеза примера 29 (выход = 40 мг, 61%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,91 (brs, 2H), 8,56 (t, J = 5,5 Гц, 1H), 8,01 (brs, 1H), 7,71 (s, 1H), 7,68 (s, 1H), 7,53 (s, 1H), 7,49 (s, 1H), 7,39 (brs, 1H), 6,55 (s, 2H), 5,51-5,48 (m, 2H), 4,88 (brs, 4H), 4,53 (q, J = 7,0 Гц, 4H), 4,46-4,40 (m, 4H), 3,50-3,46 (m, 2H), 2,56-2,55 (m, 2H), 2,31-2,25 (m, 2H), 2,08 (s, 6H), 1,29-1,25 (m, 6H); LCMS: масса/заряд = 821,05 (M+H)+; чистота в соответствии с HPLC: 99,18%
Пример 32. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-морфолинопропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 32)
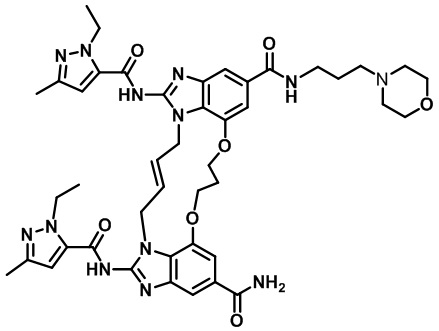
Синтезировали из промежуточного соединения 1 и 3-морфолинопропан-1-амина в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 61 мг, 14%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,92 (brs, 2 H), 10,79 (s, 1H), 8,80 (t, J = 5,7 Гц, 1H), 8,02 (bs, 1H), 7,80-7,64 (m, 2H), 7,58 (s, 1H), 7,55 (s, 1H), 7,39 (bs, 1H), 6,57 (s, 1H), 6,56 (s, 1H), 5,59-5,35 (m, 2H), 4,89 (bs, 4H), 4,60-4,46 (m, 8H), 4,01-3,93 (m, 2H), 3,80 (t, J = 12,1 Гц, 2H), 3,47-3,33 (m, 4H), 3,21-3,01 (m, 4H), 2,33-2,26 (m, 2H), 2,08 (s, 6H), 2,04-1,95 (m, 2H), 1,27 (t, J = 7,1, 1,4 Гц, 6H); LCMS: масса/заряд = 876,18 (M+H)+; чистота в соответствии с HPLC: 99,25%
Пример 33. (E)-N-(3-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 33)

Синтезировали из промежуточного соединения 1 и 3-(8-окса-3-азабицикло[3.2.1]октан-3-ил)пропан-1-амина (пром. соед. 10) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 60 мг, 14%). 1H ЯМР (400 МГц, DMSO-d6) δ 10,07 (brs, 1H), 8,80 (t, J = 5,8 Гц, 1H), 8,03 (brs, 1H), 7,72-7,70 (m, 2H), 7,57 (s, 1H), 7,54 (s, 1H), 7,39 (brs, 1H), 6,57 (s, 1H), 6,56 (s, 1H), 5,63-5,35 (m, 2H), 4,89 (brs, 4H), 4,61-4,39 (m, 10H), 3,40-3,25 (m, 4H), 3,09 (t, J = 10,2 Гц, 4H), 2,33-2,27 (m, 2H), 2,22-2,15 (m, 2H), 2,08 (s, 6H), 2,03-1,89 (m, 4H), 1,27 (t, J = 7,1, 1,5 Гц, 6H); LCMS: масса/заряд = 902,19 (M+H)+; чистота в соответствии с HPLC: 99,17%
Пример 34. (E)-N-(4-(8-Окса-3-азабицикло[3.2.1]октан-3-ил)бутил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 34)
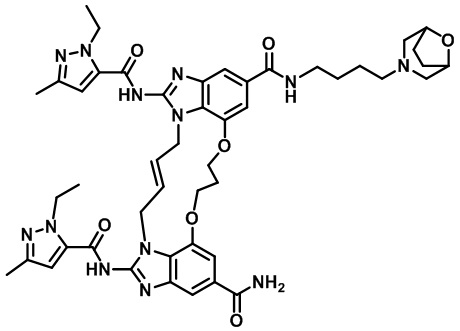
Синтезировали из промежуточного соединения 1 и 4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)бутан-1-амина (пром. соед. 11) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 20 мг, 7%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,92 (brs, 2H), 10,11 (brs, 1H), 8,65 (t, J = 5,7 Гц, 1H), 8,03 (brs, 1H), 7,72-7,69 (m, 2H), 7,56 (s, 1H), 7,54 (s, 1H), 7,39 (brs, 1H), 6,56 (s, 2H), 5,59-5,39 (m, 2H), 4,89 (brs, 4H), 4,56-4,44 (m, 10H), 3,35-3,27 (m, 4H), 3,11-3,02 (m, 4H), 2,32-2,26 (m, 2H), 2,20-2,14 (m, 2H), 2,08 (s, 6H), 1,97-1,91 (m, 2H), 1,81-1,73 (m, 2H), 1,58-1,49 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 915,57 (M+H)+; чистота в соответствии с HPLC: 98,36%
Пример 35. (E)-(2-(4-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксамидо)этил)-L-пролина гидрохлоридная соль (соединение 35)
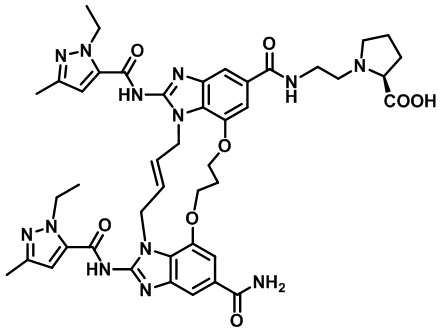
Растворяли (E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоновую кислоту (промежуточное соединение 1) (0,25 г, 0,33 ммоль) и метил-(2-аминоэтил)-L-пролинат (синтезировали как в WO 2017202390) (0,11 г, 0,66 ммоль) в 5 мл DMF. Добавляли TBTU (0,22 г, 0,70 ммоль) с последующим добавлением диизопропилэтиламина (0,23 мл, 1,33 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем DMF концентрировали при пониженном давлении и к нему добавляли воду, что приводило к осаждению продукта. Осадок фильтровали и промывали водой и неочищенный продукт очищали с помощью препаративной хроматографии с обращенной фазой с получением промежуточного соединения, представляющего собой метиловый сложный эфир. LCMS: масса/заряд = 904,19 (M+H)+
Затем метиловый сложный эфир (0,015 г, 0,017 ммоль) подвергали гидролизу сложного эфира путем растворения в 2,5 мл смеси THF-MeOH-H2O (2:2:1) с последующим добавлением LiOH (4 мг, 0,083 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и летучие вещества концентрировали с последующим добавлением 2 н HCl, что приводило к осаждению продукта, представляющего собой кислоту. Осадок фильтровали и промывали водой с получением конечного продукта в виде белого твердого вещества (10 мг, 65%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,92 (brs, 2H), 9,08 (brs, 1H), 8,06 (brs, 1H), 7,73-7,70 (m, 3H), 7,56 (s, 1H), 7,39 (brs, 1H), 6,55 (s, 2H), 5,57-5,40 (m, 2H), 4,89 (brs, 4H), 4,64-4,32 (m, 10H), 3,95-3,85 (m, 1H), 3,76-3,54 (m, 4H), 2,32-2,24 (m, 2H), 2,12-2,01 (m, 10H), 1,27 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 890,06 (M+H)+; чистота в соответствии с HPLC: 95,03%
Пример 36. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(метилсульфонил)пиперазин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 36)
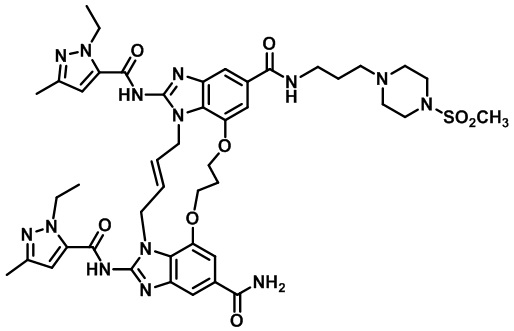
Синтезировали из промежуточного соединения 1 и 3-(4-(метилсульфонил)пиперазин-1-ил)пропан-1-амина (синтезировали как в US 20070293494) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 60 мг, 13%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,85 (brs, 2H) 10,84 (brs, 1H), 8,78 (t, J = 5,8 Гц, 1H), 8,03 (brs, 1H), 7,73-7,70 (m, 2H), 7,56 (s, 1H), 7,55 (s, 1H), 7,39 (brs, 1H), 6,57 (s, 1H), 6,56 (s, 1H), 5,57-5,41 (m, 2H), 4,89 (brs, 4H), 4,56-4,51 (m, 4H), 4,46-4,43 (m, 4H), 3,76-3,68 (m, 2H), 3,64-3,56 (m, 2H), 3,42-3,34 (m, 2H), 3,31-3,11 (m, 6H), 3,02 (s, 3H), 2,33-2,26 (m, 2H), 2,08 (s, 6H), 2,03-1,97 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 953,20 (M+H)+; чистота в соответствии с HPLC: 99,88%
Пример 37. (E)-N-(3-(4,4-Дифторпиперидин-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 37)

Синтезировали из промежуточного соединения 1 и 3-(4,4-дифторпиперидин-1-ил)пропан-1-амина (синтезировали как в US 20050256153) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 65 мг, 15%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,95 (brs, 2H), 10,66 (s, 1H), 8,74 (t, J = 5,8 Гц, 1H), 8,02 (brs, 1H), 7,72-7,70 (m, 2H), 7,55-7,53 (m, 2H), 7,39 (brs, 1H), 6,56 (s, 1H), 6,55 (s, 1H), 5,57-5,40 (m, 2H), 4,89 (brs, 4H), 4,52 (q, J = 7,1 Гц, 4H), 4,43 (q, J = 5,8 Гц, 4H), 3,68-3,62 (m, 2H), 3,42-3,34 (m, 4H), 3,26-3,10 (m, 4H), 2,41-2,28 (m, 4H), 2,10-2,06 (m, 6H), 2,04-1,96 (m, 2H), 1,27 (td, J = 7,1, 1,7 Гц, 6H); LCMS: масса/заряд = 910,19 (M+H)+; чистота в соответствии с HPLC: 99,03%
Пример 38. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(4-морфолинобутил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 38)
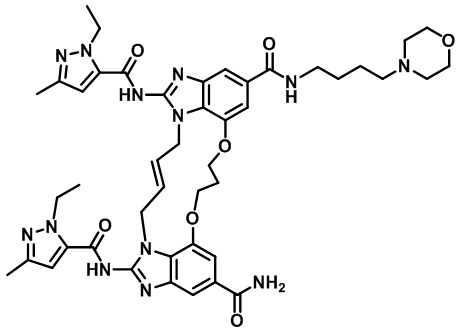
Синтезировали из промежуточного соединения 1 и 4-морфолинобутан-1-амина (синтезировали как в Eur. J. Med. Chem., 2014, 84:200-205) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 20 мг, 8%). 1H ЯМР (400 МГц, DMSO-d6) δ 10,72 (brs, 1H), 8,65 (t, J = 5,7 Гц, 1H), 8,04 (brs, 1H), 7,72-7,68 (m, 2H), 7,60-7,50 (m, 2H), 7,39 (brs, 1H), 6,56 (s, 2H), 5,58-5,39 (m, 2H), 4,89 (m, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,46-4,43 (m, 4H), 4,01-3,92 (m, 2H), 3,83-3,72 (m, 2H), 3,47-3,37 (m, 2H), 3,37-3,29 (m, 2H), 3,15-3,00 (m, 4H), 2,33-2,21 (m, 2H), 2,08 (s, 6H), 1,76 (s, 2H), 1,65-1,54 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 890,19 (M+H)+; чистота в соответствии с HPLC: 96,77%
Пример 39. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-фторпиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 39)
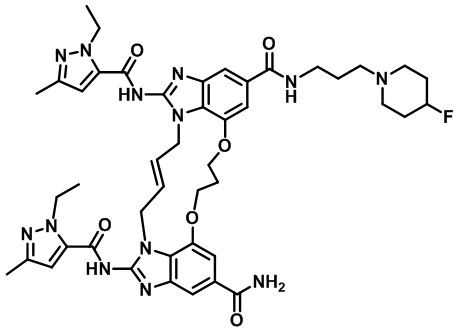
Синтезировали из промежуточного соединения 1 и 3-(4-фторпиперидин-1-ил)пропан-1-амина (пром. соед. 12) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 15 мг, 5%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,95 (brs, 2H), 10,42 (s, 1H), 8,78 (t, J = 5,2 Гц, 1H), 8,03 (brs, 1H), 7,73-7,70 (m, 2H), 7,57 (s, 1H), 7,55 (s, 1H), 7,39 (brs, 1H), 6,56 (s, 1H), 6,55 (s, 1H) 5,61-5,40 (m, 2H), 4,89 (brs, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,48-4,41 (m, 4H), 3,57-3,49 (m, 1H), 3,47-3,33 (m, 4H), 3,19-3,00 (m, 4H), 2,59-2,55 (m, 2H), 2,34-2,26 (m, 2H), 2,24-2,14 (m, 2H), 2,08 (s, 6H), 2,04-1,95 (m, 2H), 1,31-1,25 (m, 6H); LCMS: масса/заряд = 892,19 (M+H)+; чистота в соответствии с HPLC: 99,79%
Пример 40. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(метилсульфонил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 40)
Синтезировали из промежуточного соединения 1 и метансульфонамида в соответствии с аналогичной процедурой, описанной для синтеза примера 28. 1H ЯМР (400 МГц, DMSO-d6) δ 12,97-12,88 (m, 2H), 12,18 (brs, 1H), 8,01 (brs, 1H), 7,79 (s, 1H), 7,71 (s, 1H),7,64 (s, 1H), 7,53 (s, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (brs, 4H), 4,54 (q, J = 7,1 Гц, 4H), 4,43 (t, J = 5,3 Гц, 4H), 3,34 (s, 3H), 2,32-2,27 (m, 2H), 2,10-2,06 (m, 6H), 1,27 (t, J = 7,2 Гц, 6H); LCMS: масса/заряд = 826,92 (M+H)+.
Пример 41. (R,E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(3-фторпирролидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 41)
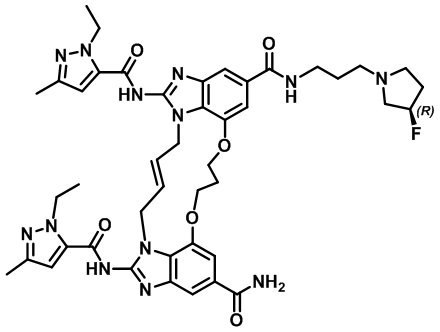
Синтезировали из промежуточного соединения 1 и (R)-3-(3-фторпирролидин-1-ил)пропан-1-амин (пром. соед. 13) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 20 мг, 7%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,84 (s, 2H), 8,51 (t, J = 5,7 Гц, 1H), 8,01 (brs, 1H), 7,71 (s, 1H), 7,68 (s, 1H), 7,53 (s, 1H), 7,48 (d, J = 1,5 Гц, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 5,32-5,07 (m, 1H), 4,89 (brs, 4H), 4,54 (t, J = 7,1 Гц, 4H), 4,43 (d, J = 5,2 Гц, 4H), 3,45-3,35 (m, 2H), 2,88-2,78 (m, 2H), 2,64-2,58 (m, 1H), 2,48-2,45 (m, 3H), 2,32-2,25 (m, 2H), 2,20-2,11 (m, 1H), 2,08 (s, 6H), 1,98-1,78 (m, 1H), 1,77-1,68 (m, 2H), 1,26 (d, J = 7,3 Гц, 6H); LCMS: масса/заряд = 878,19 (M+H)+; чистота в соответствии с HPLC: 97,69%
Пример 42. (S,E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(3-фторпирролидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 42)
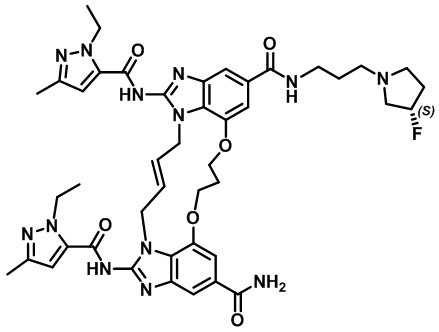
Синтезировали из промежуточного соединения 1 и (S)-3-(3-фторпирролидин-1-ил)пропан-1-амина (пром. соед. 14) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 18 мг, 6%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,67-8,40 (m, 1H), 8,01 (brs, 1H), 7,71 (s, 1H), 7,67 (s, 1H), 7,53 (s, 1H), 7,48 (s, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,49 (s, 2H), 5,30-5,20 (m, 1H), 4,89 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,43 (d, J = 5,2 Гц, 4H), 3,34-3,31 (m, 2H), 2,90-2,70 (m, 2H), 2,64-2,59 (m, 1H), 2,45-2,40 (m, 2H), 2,32-2,25 (m, 3H), 2,20-2,11 (m, 1H), 2,08 (s, 6H), 1,96-1,78 (m, 1H), 1,74-1,68 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H). LCMS: масса/заряд = 878,19 (M+H)+; чистота в соответствии с HPLC: 95,28%
Пример 43. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(2-(метилсульфонамидо)этил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 43)
Синтезировали из промежуточного соединения 1 и N-(2-аминоэтил)метансульфонамида (синтезировали как в Organometallics, 2012, 31(16):5958-5967) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 18 мг, 5%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,89 (brs, 2H), 8,57 (t, J = 5,7 Гц, 1H), 8,00 (s, 1H), 7,71 (d, J = 1,2 Гц, 1H), 7,69 (s, 1H), 7,52 (d, J = 1,4 Гц, 1H), 7,50 (s, 1H), 7,38 (brs, 1H), 7,19 (t, J = 6,0 Гц, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (brs, 4H), 4,66-4,31 (m, 8H), 3,49-3,37 (m, 2H), 3,21-3,11 (m, 2H), 2,94 (s, 3H), 2,37-2,29 (m, 2H), 2,08 (s, 6H), 1,35-1,20 (m, 6H); LCMS: масса/заряд = 870,18 (M+H)+; чистота в соответствии с HPLC: 96,74%
Пример 44. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(метилсульфонил)пиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 44)

Синтезировали из промежуточного соединения 1 и 3-(4-(метилсульфонил)пиперидин-1-ил)пропан-1-амина (пром. соед. 15) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 9 мг, 3%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,87 (brs, 2H), 8,48 (t, J = 5,6 Гц, 1H), 8,01 (brs, 1H), 7,69 (d, J = 1,2 Гц, 1H), 7,67 (s, 1H), 7,53 (d, J = 1,4 Гц, 1H), 7,48 (s, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (brs, 4H), 4,66-4,19 (m, 8H), 3,26-3,15 (m, 3H), 3,06-2,99 (m, 2H), 2,92 (s, 3H), 2,41-2,28 (m, 4H), 2,08 (s, 6H), 2,02-1,89 (m, 4H), 1,76-1,55 (m, 4H), 1,31-1,18 (m, 6H); LCMS: масса/заряд = 952,20 (M+H)+; чистота в соответствии с HPLC: 98,13%
Пример 45. (E)-N-(3-(3,3-Дифторпирролидин-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 45)
Синтезировали из промежуточного соединения 1 и 3-(3,3-дифторпирролидин-1-ил)пропан-1-амина (пром. соед. 16) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 18 мг, 5%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,89 (brs, 2H), 8,50 (t, J = 5,7 Гц, 1H), 8,01 (brs, 1H), 7,71 (s, 1H), 7,67 (s, 1H), 7,53 (s, 1H), 7,48 (s, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (brs, 4H), 4,69-4,21 (m, 8H), 2,89 (t, J = 13,5 Гц, 2H), 2,77-2,65 (m, 2H), 2,48-2,15 (m, 8H), 2,07 (s, 6H), 1,79-1,65 (m, 2H), 1,30-1,18 (m, 6H); LCMS: масса/заряд = 896,19 (M+H)+; чистота в соответствии с HPLC: 96,30%
Пример 46. (E)-N-(3-((2R,6S)-2,6-Диметилморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 46)

Синтезировали из промежуточного соединения 1 и 3-((2R,6S)-2,6-диметилморфолино)пропан-1-амина (синтезировали как в WO 2005058871) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 50 мг, 11%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,87 (brs, 2H), 8,48 (t, J = 5,5 Гц, 1H), 8,00 (brs, 1H), 7,71 (d, J = 1,3 Гц, 1H), 7,67 (d, J = 1,3 Гц, 1H), 7,53 (d, J = 1,4 Гц, 1H), 7,47 (d, J = 1,5 Гц, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,49 (s, 2H), 4,89 (brs, 4H), 4,52 (t, J = 7,2 Гц, 4H), 4,43 (d, J = 5,6 Гц, 4H), 3,59-3,51 (m, 2H), 2,78 (s, 1H), 2,75 (s, 1H), 2,60-2,55 (m, 2H), 2,32-2,26 (m, 4H), 2,08 (s, 6H), 1,77-1,67 (m, 2H), 1,57 (t, J = 10,6 Гц, 2H), 1,27 (t, J = 7,1 Гц, 6H), 1,05 (d, J = 6,2 Гц, 6H); LCMS: масса/заряд = 904,31 (M+H)+; чистота в соответствии с HPLC: 99,10%
Пример 47. (E)-N-(3-(1,1-Диоксидотиоморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида гидрохлорид (соединение 47)
Синтезировали из промежуточного соединения 1 и 4-(3-аминопропил)тиоморфолин-1,1-диоксида (синтезировали как в WO 2014104272) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 60 мг, 13%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,89 (brs, 2H), 8,48 (t, J = 5,7 Гц, 1H), 8,01 (brs, 1H), 7,71 (s, 1H), 7,67 (s, 1H), 7,53 (s, 1H), 7,47 (s, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (brs, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,43 (q, J = 5,4 Гц, 4H), 3,12-3,06 (m, 4H), 2,93-2,88 (m, 4H), 2,57-2,54 (m, 4H), 2,32-2,27 (m, 2H), 2,08 (s, 6H), 1,71-1,69 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 925,19 (M+H)+; чистота в соответствии с HPLC: 99,03%
Пример 48. (E)-N-(3-(1H-Имидазол-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 48)
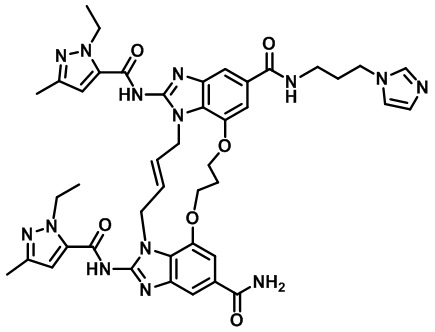
Синтезировали из промежуточного соединения 1 и 3-(1H-имидазол-1-ил)пропан-1-амина в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 18 мг, 5%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,89 (brs, 2H), 8,53 (t, J = 5,7 Гц, 1H), 8,01 (brs, 1H), 7,72-7,67 (m, 3H), 7,53 (s, 1H), 7,47 (s, 1H), 7,38 (brs, 1H), 7,24 (d, J = 1,3 Гц, 1H), 6,92 (d, J = 1,1 Гц, 1H), 6,55 (s, 2H), 5,50 (brs, 2H), 4,89 (brs, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,43 (q, J = 5,2 Гц, 4H), 4,05 (t, J = 6,9 Гц, 2H), 3,28-3,26 (m, 2H), 2,33-2,26 (m, 2H), 2,08 (s, 6H), 1,98 (q, J = 6,9 Гц, 2H), 1,31-1,23 (m, 6H); LCMS: масса/заряд = 856,93 (M+H)+; чистота в соответствии с HPLC: 95,10%
Пример 49. (S,E)-2-(12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)-3-(диметиламино)пропановая кислота (соединение 49)
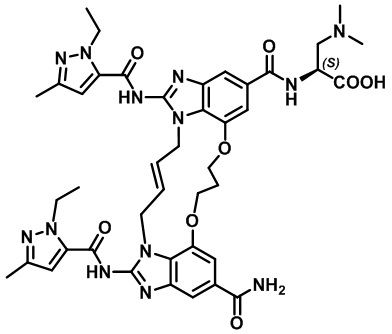
Синтезировали из промежуточного соединения 1 и метил-(S)-2-амино-3-(диметиламино)пропаноата 2,2,2-трифторацетата (синтезировали как в EP 1366018, 2016) в соответствии с аналогичной процедурой, описанной для синтеза примера 35 (выход = 10 мг, 38%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,92 (s, 2H), 8,36 (d, J = 7,2 Гц, 1H), 8,23 (s, 1H), 8,01 (s, 1H), 7,72 (dd, J = 4,0, 1,2 Гц, 2H), 7,53 (dd, J = 4,7, 1,3 Гц, 2H), 7,38 (s, 1H), 6,55 (s, 2H), 5,49 (d, J = 1,7 Гц, 2H), 4,89 (s, 4H), 4,52-4,40 (m, 9H), 3,07-2,85 (m, 2H), 2,61-2,53 (m, 6H), 2,39-2,22 (m, 2H), 2,07 (s, 6H), 1,27 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 864,06 (M+H)+; чистота в соответствии с HPLC: 96,40%
Пример 50. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(пиридин-2-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 50)
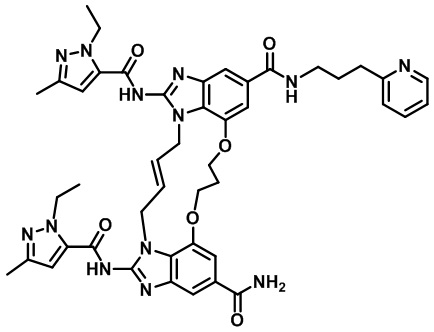
Синтезировали из промежуточного соединения 1 и 3-(пиридин-2-ил)пропан-1-амина (синтезировали как в MedChemComm, 2014, 5(1):72-81) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 80 мг, 19%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,89 (brs, 2H), 8,60-8,52 (m, 1H), 8,51-8,47 (m, 1H), 8,00 (brs, 1H), 7,77-7,67 (m, 3H), 7,53 (d, J = 1,2 Гц, 1H), 7,49 (d, J = 1,4 Гц, 1H), 7,38 (brs, 1H), 7,31 (d, J = 7,8 Гц, 1H), 7,27-7,16 (m, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (brs, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,47-4,40 (m, 4H), 2,87-2,75 (m, 2H), 2,57-2,53 (m, 2H), 2,33-2,27 (m, 2H), 2,08 (s, 6H), 2,01-1,92 (m, 2H), 1,29-1,21 (m, 6H); LCMS: масса/заряд = 868,06 (M+H)+; чистота в соответствии с HPLC: 99,49%
Пример 51. (E)-1,15-бис(1-Этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(трифторметил)пиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида формиат (соединение 51)
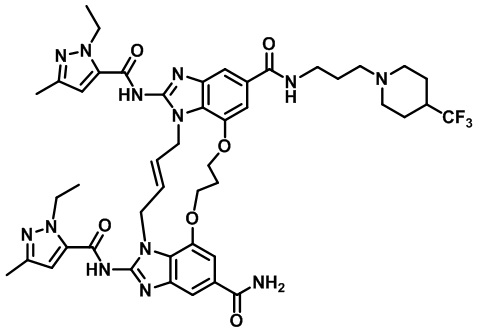
Синтезировали из промежуточного соединения 1 и 3-(4-(трифторметил)пиперидин-1-ил)пропан-1-амина (синтезировали как в US 2005/256153) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 60 мг, 13%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,88 (s, 2H), 8,48 (t, J = 5,7 Гц, 1H), 8,00 (brs, 1H), 7,71 (s, 1H), 7,67 (d, J = 1,2 Гц, 1H), 7,53 (d, J = 1,4 Гц, 1H), 7,47 (d, J = 1,4 Гц, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (brs, 4H), 4,54 (t, J = 7,1 Гц, 4H), 4,43 (q, J = 5,2 Гц, 4H), 3,40-3,35 (m, 1H), 3,34-3,26 (m, 2H), 3,00-2,93 (m, 2H), 2,37 (t, J = 7,1 Гц, 2H), 2,32-2,26 (m, 2H), 2,08 (s, 6H), 1,97-1,86 (m, 2H), 1,83-1,66 (m, 4H), 1,50-1,37 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 942,20 (M+H)+; чистота в соответствии с HPLC: 99,43%
Пример 52. (E)-N-(3-(3,3-Диметилморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамид (соединение 52)
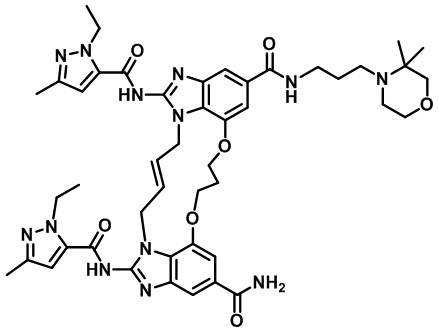
Синтезировали из промежуточного соединения 1 и 3-(3,3-диметилморфолино)пропан-1-амина (пром. соед. 17) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 6 мг, 2%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,86 (brs, 2H), 8,43 (t, J = 5,5 Гц, 1H), 8,01 (brs, 1H), 7,71 (d, J = 1,2 Гц, 1H), 7,66 (d, J = 1,2 Гц, 1H), 7,53 (d, J = 1,4 Гц, 1H), 7,46 (d, J = 1,4 Гц, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,43 (q, J = 5,5 Гц, 4H), 3,60 (t, J = 4,9 Гц, 2H), 3,36-3,29 (m, 2H), 3,21 (s, 2H), 2,51-2,45 (m, 2H), 2,41-2,37 (m, 2H), 2,32-2,26 (m, 2H), 2,08 (s, 6H), 1,65 (p, J = 7,0 Гц, 2H), 1,27 (t, J = 7,1 Гц, 6H), 0,94 (s, 6H); LCMS: масса/заряд = 904,19 (M+H)+; чистота в соответствии с HPLC: 96,54%
Пример 53. (E)-(12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбонил)глицил-L-валин (соединение 53)

Синтезировали из промежуточного соединения 1 и трет-бутилглицил-L-валината (синтезировали как в Eur. J. Org. Chem., 2017, 37:5592-5596) в соответствии с аналогичной процедурой, описанной для синтеза примера 29. 1H ЯМР (400 МГц, DMSO-d6) δ 12,91 (brs, 2H), 8,75 (t, J = 5,8 Гц, 1H), 8,02 (brs, 2H), 7,71 (s, 2H), 7,54 (brs, 2H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (brs, 4H), 4,53 (d, J = 7,4 Гц, 4H), 4,43 (d, J = 5,2 Гц, 4H), 4,16 (t, J = 8,0 Гц, 1H), 4,01-3,88 (m, 2H), 2,42-2,40 (m, 1H), 2,30 (t, J = 8,0 Гц, 2H), 2,08 (s, 6H), 1,27 (t, J = 7,2 Гц, 6H), 0,89 (dd, J = 6,9, 1,6 Гц,6H).; LCMS: масса/заряд = 906,19 (M+H)+.
Пример 54. (E)-N,N'-(12-Карбамоил-4-(1H-тетразол-5-ил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-1,15-диил)бис(1-этил-3-метил-1H-пиразол-5-карбоксамид) (соединение 54)

Стадия 1. Синтез 4-хлор-3-гидрокси-5-нитробензонитрила
Добавляли 4-хлор-3-гидрокси-5-нитробензамид (2,0 г, 9,23 ммоль) к трихлорметилхлорформиату (7,31 г, 36,9 ммоль) в 25 мл ацетонитрила и реакционную смесь нагревали с обратным холодильником в течение 12 ч. Протекание реакции отслеживали с помощью TLC. После завершения реакционную смесь гасили путем добавления воды. Смесь экстрагировали с помощью EtOAc и объединенный органический раствор промывали солевым раствором и высушивали над Na2SO4, концентрировали и очищали с помощью колоночной хроматографии. 1H ЯМР (400 МГц, DMSO-d6) δ 12,14 (s, 1H), 8,08 (d, J = 1,8 Гц, 1H), 7,56 (d, J = 1,9 Гц, 1H).
Стадия 2. Синтез 4-хлор-3-(3-(2-хлор-5-циано-3-нитрофенокси)пропокси)-5-нитробензамида

Растворяли 4-хлор-3-гидрокси-5-нитробензамид (500 мг, 2,31 ммоль) в 6 мл NMP в сосуде для микроволновой обработки объемом 20 мл и к нему добавляли 1,3-дибромпропан (1,4 г, 6,93 ммоль) с последующим добавлением DIPEA (1,21 мл, 6,93 ммоль) и реакционную смесь нагревали при 130°C в течение 3 ч. в микроволновой печи. Затем смесь выливали в 100 мл воды и водную фазу три раза экстрагировали с помощью EtOAc. Объединенный органический раствор промывали солевым раствором и высушивали над Na2SO4, концентрировали и очищали с помощью колоночной хроматографии с получением 3-(3-бромпропокси)-4-хлор-5-нитробензамида в качестве промежуточного соединения. Данное растворяли в 6 мл NMP сосуде для микроволновой обработки объемом 20 мл и к нему добавляли 4-хлор-3-гидрокси-5-нитробензонитрил (458 мг, 2,31 ммоль) с последующим добавлением DIPEA (1,21 мл, 6,93 ммоль) и реакционную смесь нагревали при 130°C в течение 3 ч. в микроволновой печи. Затем смесь выливали в 100 мл воды и осажденный продукт фильтровали и высушивали. 1H ЯМР (400 МГц, DMSO-d6) δ 8,32-8,23 (m, 1H), 8,08 (dd, J = 10,8, 1,7 Гц, 1H), 7,91 (d, J = 1,8 Гц, 1H), 7,79 (s, 1H), 4,48-4,44 (m, 2H), 3,41-3,25 (m, 2H), 2,20-2,18 (m, 2H).
Стадия 3. Синтез (E)-11-циано-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3-карбоксамида
Растворяли 4-хлор-3-(3-(2-хлор-5-циано-3-нитрофенокси)пропокси)-5-нитробензамид (1,1 г, 2,42 ммоль) в 10 мл DMSO и добавляли (E)-бут-2-ен-1,4-диамина дигидрохлорид (0,38 г, 2,42 ммоль) с последующим добавлением DIPEA (3,38 мл, 19,33 ммоль) и реакционную смесь нагревали при 100°C в течение 12 ч. Затем реакционную смесь выливали в 100 мл воды, и продукт осаждался в виде твердого вещества, которое фильтровали и высушивали. LCMS: масса/заряд = 469,09 (M+H)+
Стадия 4. Синтез (E)-1,13-диамино-11-циано-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3-карбоксамида
Растворяли (E)-11-циано-1,13-динитро-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3-карбоксамид (1 г, 4,27 ммоль) в смеси 25 THF и 10 мл MeOH и к нему добавляли раствор гидросульфита натрия (7,43 г, 42,7 ммоль) в 50 мл воды при 0°C с последующим добавлением водного раствора аммиака (9,24 мл, 107 ммоль). Реакционную смесь перемешивали в течение 1 ч. и после завершения реакции, что определяли с помощью LCMS, летучие вещества концентрировали и остаток несколько раз экстрагировали смесью 1:1 THF и этилацетатом. Органический слой высушивали над Na2SO4 и концентрировали с получением неочищенного продукта, который применяли как таковой на следующей стадии. LCMS: масса/заряд = 409,29 (M+H)+
Стадия 5. Синтез (E)-1,15-диамино-4-циано-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксамида дигидробромида
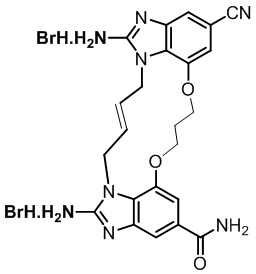
Суспендировали (E)-1,13-диамино-11-циано-7,8,14,15,18,19-гексагидро-6H-дибензо[b,j][1,12]диокса[4,9]диазациклопентадецин-3-карбоксамид (700 мг, 1,714 ммоль) в 50 мл DMF и к нему добавляли цианобромид (1,8 г, 17,14 ммоль). Обеспечивали перемешивание смеси в течение ночи при комнатной температуре, и суспензия медленно превращалась в однородный раствор зеленого цвета. Протекание реакции отслеживали с помощью LCMS. После завершения DMF концентрировали при пониженном давлении и полученное твердое вещество промывали смесью MeCN-MeOH (7:3) и фильтровали с получением продукта в виде дигидробромидной соли. LCMS: масса/заряд = 459,29 (M+H)+
Стадия 6. (E)-N,N'-(12-Карбамоил-4-циано-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-1,15-диил)бис(1-этил-3-метил-1H-пиразол-5-карбоксамид)
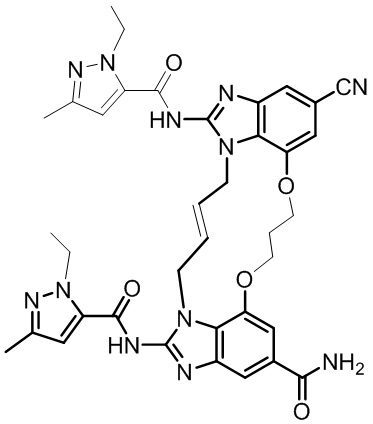
Растворяли (E)-1,15-диамино-4-циано-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксамида дигидробромид (150 мг, 0,24 ммоль) и 1-этил-3-метил-1H-пиразол-5-карбоновую кислоту (112 мг, 0,72 ммоль) в 5 мл NMP и к ним добавляли DIPEA (0,34 мл, 1,93 ммоль) с последующим добавлением HATU (276 мг, 0,725 ммоль) и реакционную смесь перемешивали в течение 30 мин. при к. т. с последующим нагреванием при 130°C в микроволновой печи в течение 1 ч. После завершения реакции реакционную смесь выливали в холодный насыщенный солевой раствор и осажденное коричневое твердое вещество фильтровали. Твердое вещество несколько раз промывали ацетонитрилом и очищали с помощью препаративной HPLC с получением чистого продукта. 1H ЯМР (400 МГц, DMSO-d6) δ 12,96 (s, 2H), 8,00 (s, 1H), 7,70 (s, 1H), 7,62-7,31 (m, 4H), 6,56 (d, J = 14,8 Гц, 2H), 5,50 (s, 2H), 4,88 (s, 4H), 4,62-4,32 (m, 9H), 2,29 (d, J = 10,0 Гц, 2H), 2,08 (s, 6H), 1,32-1,22 (m, 6H); LCMS: масса/заряд = 731,65 (M+H)+.
Стадия 7. (E)-N,N'-(12-Карбамоил-4-(1H-тетразол-5-ил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-1,15-диил)бис(1-этил-3-метил-1H-пиразол-5-карбоксамид)
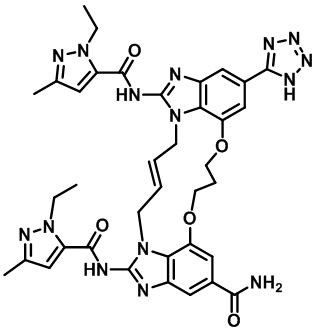
Растворяли (E)-N,N'-(12-карбамоил-4-циано-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-1,15-диил)бис(1-этил-3-метил-1H-пиразол-5-карбоксамид) (170 мг, 0,233 ммоль) в 10 мл DMF в закрытой пробирке. Добавляли азид натрия (378 мг, 5,82 ммоль) и хлорид аммония (311 мг, 5,82 ммоль) и реакционную смесь нагревали в течение 4 ч. при 120°C. После завершения реакции DMF отгоняли и добавляли воду, что приводило к осаждению неочищенного продукта. Твердое вещество фильтровали и очищали с помощью препаративной хроматографии с обращенной фазой с получением чистого продукта. 1H ЯМР (400 МГц, DMSO-d6) δ 12,99-12,85 (m, 2H), 8,01 (brs, 1H), 7,87 (s, 1H), 7,71 (s, 1H), 7,65 (s, 1H), 7,53 (s, 1H), 7,38 (brs, 1H), 6,55 (s, 2H), 5,61-5,45 (m, 2H), 4,90 (brs, 4H), 4,60-4,50 (m, 4H), 4,50-4,32 (m, 4H), 2,37-2,30 (m, 2H), 2,08 (s, 6H), 1,31-1,25 (m, 6H); LCMS: масса/заряд = 774,16 (M+H)+.
Пример-55. (1S,3S)-3-((E)-4-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксамидо)циклобутан-1-карбоновая кислота (соединение 55)
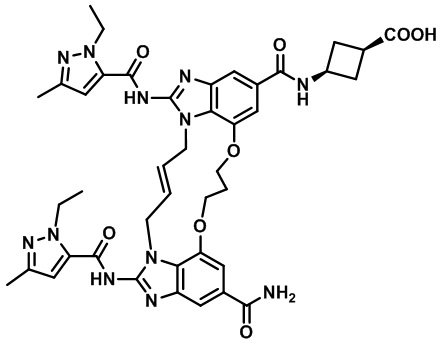
Синтезировали из промежуточного соединения 1 и этил-(1S,3S)-3-аминоциклобутан-1-карбоксилата (пром. соед. 18) в соответствии с аналогичной процедурой, описанной для синтеза примера 35 (выход = 25 мг, 54%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,90 (s, 2H), 8,68 (t, J = 7,8 Гц, 1H), 8,01 (s, 1H), 7,71 (dd, J = 6,9, 1,2 Гц, 2H), 7,53 (d, J = 11,0 Гц, 2H), 7,38 (s, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,43 (d, J = 8,0 Гц, 4H), 2,46 (t, J = 4,8 Гц, 5H), 2,27 (dd, J = 20,0, 9,5 Гц, 4H), 2,08 (s, 6H), 1,34-1,20 (m, 6H). LCMS: масса/заряд = 847,05 (M+H)+; чистота в соответствии с HPLC: 91,42%
Пример-56. (1R,3R)-3-((E)-4-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксамидо)циклобутан-1-карбоновая кислота (соединение 56)

Синтезировали из промежуточного соединения 1 и этил-(1R,3R)-3-аминоциклобутан-1-карбоксилата (пром. соед. 19) в соответствии с аналогичной процедурой, описанной для синтеза примера 35 (выход = 18 мг, 7%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,85 (s, 3H), 8,69 (d, J = 7,4 Гц, 1H), 8,28 (s, 1H), 8,01 (s, 1H), 7,70 (dd, J = 12,9, 1,2 Гц, 2H), 7,51 (dd, J = 18,8, 1,4 Гц, 2H), 7,38 (s, 1H), 6,55 (s, 2H), 5,50 (s, 2H), 4,89 (s, 4H), 4,56 (dq, J = 21,0, 7,5 Гц, 5H), 4,44 (s, 4H), 2,42-2,22 (m, 5H), 2,08 (d, J = 6,1 Гц, 5H), 1,31-1,16 (m, 8H). LCMS: масса/заряд = 847,05 (M+H)+; чистота в соответствии с HPLC: 91,06%
Пример-57. Синтез (E)-1-((12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)метил)циклопропан-1-карбоновой кислоты (соединение 57)
Синтезировали из промежуточного соединения 1 и этил-1-цианоциклопропан-1-карбоксилата (пром. соед. 20) в соответствии с аналогичной процедурой, описанной для синтеза примера 35 (выход = 22 мг, 17%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,37 (t, J = 5,8 Гц, 1H), 8,02 (s, 1H), 7,69 (d, J = 13,6 Гц, 2H), 7,52 (d, J = 14,0 Гц, 2H), 7,39 (s, 1H), 6,55 (s, 2H), 5,49 (s, 2H), 4,88 (s, 4H), 4,52 (q, J = 7,1 Гц, 4H), 4,43 (q, J = 4,5 Гц, 4H), 3,59 (d, J = 5,7 Гц, 2H), 2,30 (q, J = 5,8 Гц, 2H), 2,07 (s, 6H), 1,26 (t, J = 7,1 Гц, 7H), 1,07 (q, J = 3,8, 3,3 Гц, 2H), 0,96 (q, J = 4,3, 3,9 Гц, 2H). LCMS: масса/заряд = 847,05 [M+H]+; чистота в соответствии с HPLC: 99,57%
Пример-58. (E)-2-(2-(4-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксамидо)этил)никотиновая кислота (соединение 58)
Синтезировали из промежуточного соединения 1 и метил-2-(2-аминоэтил)никотината дигидрохлорида (пром. соед. 21) в соответствии с аналогичной процедурой, описанной для синтеза примера 35 (выход = 14 мг, 8,3%). 1H ЯМР (400 МГц, DMSO-d6) δ 8,61 (t, J = 5,7 Гц, 1H), 8,41 (d, J = 7,9 Гц, 1H), 8,04 (s, 1H), 7,71 (d, J = 1,2 Гц, 1H), 7,59 (dd, J = 28,5, 1,3 Гц, 3H), 7,47 (d, J = 1,4 Гц, 1H), 7,38 (s, 1H), 6,56 (s, 2H), 5,50 (d, J = 1,8 Гц, 2H), 4,89 (s, 3H), 4,53 (q, J = 7,1 Гц, 4H), 4,44 (d, J = 5,4 Гц, 4H), 3,72 (q, J = 6,6 Гц, 3H), 3,49 (t, J = 6,9 Гц, 2H), 3,17 (s, 3H), 2,57-2,52 (m, 11H), 2,29 (d, J = 6,2 Гц, 2H), 2,08 (s, 5H), 1,27 (t, J = 7,1 Гц, 6H). LCMS: масса/заряд = 898,90 (M+H)+; чистота в соответствии с HPLC: 99,20%
Пример-59. (E)-2-(3-(12-Карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)бензойная кислота (соединение 59)
Синтезировали из промежуточного соединения 1 и метил-2-(3-аминопропил)бензоата (пром. соед. 22) в соответствии с аналогичной процедурой, описанной для синтеза примера 35 (выход = 25 мг, 16%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,89 (brs, 3H), 8,51 (s, 1H), 8,01 (brs, 1H), 7,89-7,78 (m, 1H), 7,76-7,67 (m, 2H), 7,57-7,44 (m, 3H), 7,43-7,28 (m, 3H), 6,54 (s, 2H), 5,50 (s, 2H), 4,89 (s, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,42 (brs, 4H), 3,33-3,25 (m, 2H), 3,00 (t, J = 7,8 Гц, 2H), 2,36-2,25 (m, 2H), 2,08 (s, 6H), 1,91-1,75 (m, 2H), 1,27 (t, J = 7,1 Гц, 6H); LCMS: масса/заряд = 911,06 (M+H)+; чистота в соответствии с HPLC: 98,37%
Пример-60. Гидрохлоридная соль (E)-N-(3-(4-Этокси-4-оксидо-1,4-азафосфинан-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 60)

Синтезировали из промежуточного соединения 1 и 2-(3-(4-этокси-4-оксидо-1,4-азафосфинан-1-ил)пропил)изоиндолин-1,3-диона (пром. соед. 23) в соответствии с аналогичной процедурой, описанной для синтеза примера 28 (выход = 12 мг, 15,7%). 1H ЯМР (400 МГц, DMSO-d6) δ 11,28 (s, 1H), 8,80 (t, J = 5,8 Гц, 1H), 8,05 (bs, 1H), 7,71 (s, 2H), 7,61-7,57 (m, 1H), 7,55 (s, 1H), 7,39 (bs, 1H), 6,57 (d, J = 1,7 Гц, 2H), 5,57-5,43 (m, 2H), 4,89 (bs, 4H), 4,53 (q, J = 7,1 Гц, 4H), 4,45 (q, J = 5,3 Гц, 4H), 4,13-3,97 (m, 2H), 3,83-3,59 (m, 2H), 3,59-3,37 (m, 2H), 3,38-3,29 (m, 2H), 3,28-3,11 (m, 4H), 2,34-2,21 (m, 4H), 2,09 (s, 6H), 2,06-1,96 (m, 2H), 1,34-1,21 (m, 9H); LCMS: масса/заряд = 92,50 (M+H)+; чистота в соответствии с HPLC: 98,37%
Биологический анализ - определение эффективной растворимости/повышенной кинетической растворимости с помощью UHPLC
Получение тестового образца. Взвешивали приблизительно 0,5 мг тестового образца и переносили в двух повторностях в стеклянные вставки объемом 1 мл в 96-луночных планшетах. Добавляли 5 мкл DMSO и 1 мл фосфатного буфера. Обеспечивали достижение равновесия на орбитальном шейкере при 37°C в течение 24 ч. Затем обеспечивали охлаждение полученного до комнатной температуры и центрифугировали 96-луночный планшет (при 240 × 10 об./мин. в течение 20 мин.) и материал, представляющий собой надосадочную жидкость, отбирали в планшет для сбора материала, накрывали его теплоустойчивой алюминиевой пластиной или материал, представляющий собой надосадочную жидкость, непосредственно отбирали во флакон для образцов HPLC.
Вводили разбавитель в качестве холостого раствора и растворы для определения характеристик линейности в двух повторностях. Записывали хроматограммы и строили калибровочные кривые зависимости площади (ось y) от концентрации (ось X). Коэффициент корреляции для калибровочной кривой должен составлять не менее 0,95. Если критерий выше выполнялся, то затем вводили тестовые образцы и записывали хроматограммы. В случае если насыщенные пики наблюдали, то затем разбавляли образец разбавителем по мере необходимости.
Рассчитывали угол наклона и точку пересечения с осью для калибровочной кривой. На основании стандартной кривой определяли растворимость образца в мкМ (микромоль).
Соединения были растворимыми, как показано в таблице 2 ниже, что является ключевой характеристикой для введения (такого как внутривенное введение) агонистов STING.
Таблица 2. Данные растворимости
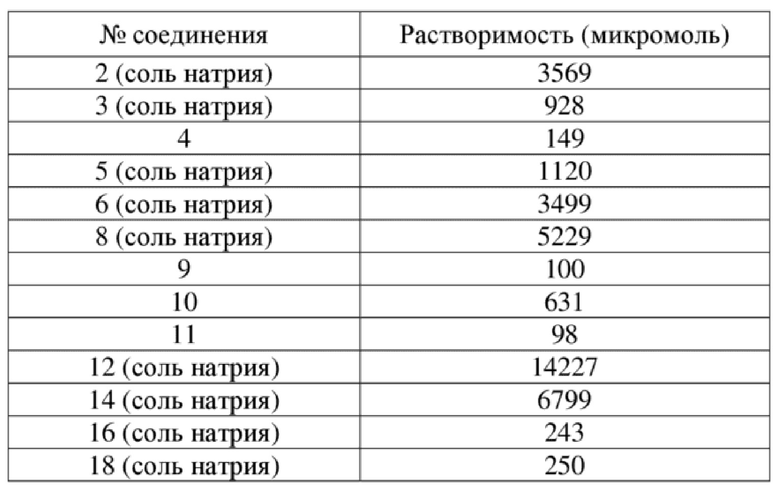
Биологический анализ - стимуляция передачи сигнала STING человека в клеточной линии THP1
Соединения тестировали с целью определения их способности активировать STING с применением клеточной линии человека THP1-Blue™ ISG, основанной на SEAP (Invivogen). Кратко, клетки THP1-Blue ISG (100000 клеток/лунка) в 96-луночном планшете обрабатывали различными концентрациями тестовых и контрольных соединений и инкубировали при 37°C с 5% CO2 в течение 18-20 часов. Также готовили клетки, не получающие обработку контролем. После инкубации клеточный супернатант тестировали с целью определения активности SEAP (секретируемой эмбрионной щелочной фосфатазы) с применением реагента субстрата QuantiBlue™ (Invivogen). Образование продукта, окрашенного в синий цвет, количественно определяли путем измерения абсорбции при длине волны 620 нм с применением ридера PheraStar/Tecan. Среднюю величину дублированных значений для каждой точки данных наносили на график в GraphPad prism 6 относительно концентрации тестового или контрольного соединения с целью расчета значения EC50. Кратность индуцирования или увеличения люминисценции SEAP для разных точек данных определяли относительно не подвергавшейся стимуляции контрольной группы.
Соединения 2, 3, 4, 5, 6, 8, 11, 12, 14, 16 и 18 демонстрировали значение EC50, находящееся в диапазоне от 1 до 10 нМ.
Соединения 1, 7, 9, 10, 17, 19, 20 и 22 демонстрировали значение EC50, находящееся в диапазоне 11-100 нМ.
Соединения 13, 15, 21, 23, 24, 25, 26 и 27 демонстрировали значение EC50, составляющее от 101 нМ до 2,5 микромоль.
Количественное определение секреции цитокина в цельной крови мышей или человека в ответ на агонисты STING
Соединения тестировали с целью определения их способности вызывать секрецию цитокинов, в частности IFNββ, у мыши или в цельной крови человека. Кровь мышей собирали у мышей C57 с использованием гепарина в качестве антикоагулянта. Кровь человека собирали в вакутейнеры, содержащие гепарин натрия. Кровь мыши или человека разбавляли в соотношении 1:3 (четырехкратно) бессывороточной средой RPMI, содержащей 2X раствор пенициллин-стрептомицин. Разбавленную цельную кровь (150 мкл) помещали на планшеты с U-образным дном и к ним добавляли 50 мкл тестового соединения, приготовленного в среде RPMI и дважды перемешивали пипеткой с последующей инкубацией планшета при 37°C в течение 4 ч. (мышь) и 5 ч. (человек). Тестовые соединения добавляли при конечных значениях концентрации, составляющих 3 мкМ. После инкубационного периода образцы центрифугировали при 2500 об./мин. в течение 5 мин. и супернатант собирали и переносили на планшеты с V-образным дном и сразу же помещали на хранение при -80°C. Образцы обрабатывали для количественного определения IFNβ с помощью ELISA с использованием коммерчески доступных наборов для измерения либо IFNβ мыши (VeriKine Mouse IFN Beta ELISA, PBL assay science, № в каталоге 42400-2), либо IFNβ человека (VeriKine Human IFN Beta ELISA, PBL assay science, № в каталоге 41410-2) соответственно. Уровни IFNβ выражали в пг/мл.
В анализе цельной крови мышей соединения 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 14, 16 и 18 продемонстрировали секрецию IFNβ, находящуюся в диапазоне 200-1000 пг/мл при концентрации 1 мкМ в момент времени 4 ч.
В анализе цельной крови человека соединения 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 14, 16 и 18 продемонстрировали секрецию IFNβ, находящуюся в диапазоне 200-600 пг/мл при концентрации 3 мкМ в момент времени 5 ч.
Эффект соединений в отношении объема опухоли на модели аллотрансплантата CT26 в организме мышей BALB/c при внутривенном введении (i. v.) Введение
Здоровые самки мышей BALB/c в возрастной группе 5-8 недель, полученные из Центра экспериментальных животных (RAF). Этих мышей содержали в индивидуально вентилируемых клетках (IVC) в комнате для содержания экспериментальных животных и акклиматизировали, начиная за по меньшей мере 5 дней до инокуляции клеток. Все экспериментальные действия проводили внутри бокса микробиологической безопасности для обеспечения стерильности. При асептических условиях создавали аллотрансплантантную модель опухоли путем инокуляции мышам BALB/c суспензии, содержащей 0,1 миллиона отдельных клеток CT26 (модель колоректального рака), с применением одноразового шприца объемом 1 мл, оснащенного стерильной иглой 26G 1/2’’. Каждую мышь инокулировали с помощью 100 мкл клеточной суспензии CT26 в среде с фосфатно-солевым буфером (PBS) подкожно в правый бок. Мышей рандомизировали в разные группы после инокуляции клетками с примерно равными значениями среднего отклонения и среднего (S.E.M.) объема опухоли у разных групп, получавших обработку, включая контрольную группу, получающую среду-носитель.
Размер опухоли измеряли с помощью штангельциркуля с нониусом, когда опухоль становилась пальпируемой. Объем опухоли (T. V.) рассчитывали с применением формулы:
Объем опухоли (мм3) = (L × W2)/2,
где L- длина опухоли, W- ширина опухоли.
Мышей выбирали и рандомизировали на основании объема опухоли в необходимое число групп с примерно равным средним значением и равным разбросом в день 1 обработки после инокуляции клеток опухоли. Все исследуемые группы обрабатывали внутривенно в дни 1, 4 и 8 графика введения доз через латеральную хвостовую вену дозой объемом 5 мл/кг.
Размеры опухоли измеряли с помощью штангельциркуля с нониусом дважды в неделю и показатели веса тела мышей записывали ежедневно.
Процент подавления роста опухоли (% TGI) рассчитывали с применением формулы:
% TGI = [1- (Tf - Ti)/ (Cf - Ci)] ×100,
где Tf и Ti представляют собой конечный и исходный объемы опухоли для тестирования соответственно, и Cf и Ci представляют собой конечный и исходный средние объемы опухоли для контроля соответственно.
Процент регресса опухоли (% TR) рассчитывали с применением формулы:
% TR = [(исходный T.V. - конечный T.V.) / (исходный T.V.)] × 100,
где T.V. представляет собой объем опухоли
Изменение веса тела (%) рассчитывали путем применения формулы:
Изменение веса тела (%) = [(конечный B.Wt.) - (исходный B.Wt.) / исходный B.Wt.] × 100,
где B.Wt.= вес тела.
На фиг. 1A и 1B продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 2, на модели эктопического аллотрансплантата CT26 в организме мышей BALB/c, в отношении снижения объема опухоли и изменения веса тела соответственно, который свидетельствует о том, что соединение 2 обеспечивает снижение объема опухоли, при этом у 7 из 9 субъектов проявляется полная регрессия опухоли. Соединение 2 вводили субъектам (n = 9) в указанной дозе в дни 1, 4 и 8.
На фиг. 2A и 2B продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 6, на модели эктопического аллотрансплантата CT26 в организме мышей BALB/c, в отношении снижения объема опухоли и изменения веса тела соответственно, который свидетельствует о том, что соединение 6 обеспечивает снижение объема опухоли, при этом у 7 из 9 субъектов проявляется полная регрессия опухоли. Соединение 6 вводили субъектам (n = 9) в указанной дозе в дни 1, 4 и 8.
На фиг. 3A и 3B продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 8, на модели эктопического аллотрансплантата CT26 в организме мышей BALB/c, в отношении снижения объема опухоли и изменения веса тела соответственно, который свидетельствует о том, что соединение 8 обеспечивает снижение объема опухоли, при этом у 5 из 9 субъектов проявляется полная регрессия опухоли. Соединение 8 вводили субъектам (n = 9) в указанной дозе в дни 1, 4 и 8.
На фиг. 4A и 4B продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 12, на модели эктопического аллотрансплантата CT26 в организме мышей BALB/c, в отношении снижения объема опухоли и изменения веса тела соответственно, который свидетельствует о том, что соединение 12 обеспечивает снижение объема опухоли, при этом у 8 из 10 субъектов проявляется полная регрессия опухоли. Соединение 12 вводили субъектам (n = 10) в указанной дозе в дни 1, 4 и 8.
На фиг. 5A и 5B продемонстрирован эффект иллюстративного соединения по настоящему изобретению, соединения 14, на модели эктопического аллотрансплантата CT26 в организме мышей BALB/c, в отношении снижения объема опухоли и изменения веса тела, который свидетельствует о том, что соединение 14 обеспечивает снижение объема опухоли, при этом у 6 из 9 субъектов проявляется полная регрессия опухоли. Соединение 14 вводили субъектам (nc9) в указанной дозе в дни 1, 4 и 8.
На фиг. 6 продемонстрирован эффект соединения 2 при высокой дозе на модели мышей BALB/c с эктопическим аллотрансплантатом CT26, при этом соединение 2 при двух разных дозах обеспечивает снижение объема опухоли (линии графика для двух доз соединения 2 перекрываются). Соединение 2 вводили субъектам (n = 10) в указанной дозе в дни 1, 4 и 8.
Дополнительно, более 75% мышей демонстрировали более чем 70% регрессию опухоли после дня 21 в модели эктопического аллотрансплантата CT26 в организме мышей BALB/c, если соединения 2, 6, 8, 12 или 14 вводят при дозах 0,375 мг/кг (мг/кг), или соединение 2 вводят при дозе 1,5 мг/кг (мг/кг) или 3 мг/кг (мг/кг). Также соединение 2 сохраняло высокую эффективность даже при 3 мг/кг (мг/кг) без значительного эффекта в отношении веса тела (<10%).
Анализ фармакокинетических и фармакодинамических профилей и оценка инфильтрации иммунных клеток в опухолях после обработки соединениями 2, 6, 8, 12 и 14
Уровни цитокина в сыворотке крови и опухоли и соответствующие значения концентрации соединения в плазме крови мышей определяли после внутривенного введения одной дозы в CT26 (колоректальную карциному мыши) несущих опухоль мышей. Вкратце, не подвергнутых воздействию мышей BALB/c в возрастной группе 6-8 недель инокулировали с помощью 0,1 миллиона клеток CT-26/животное в фосфатно-солевом буфере (PBS) подкожно. При достижении объема опухоли, составляющего 150-300 мм3, животным вводили внутривенно одну дозу носителя, тестовых соединений: соединения 2, соединения 6, соединения 8, соединения 12 и соединения 14 при 0,375 мг/кг, при объеме дозы, составляющем 5 мл/кг. Образцы крови и опухоли собирали в различные моменты времени через не более чем 24 ч. после введения дозы. Образцы опухоли гомогенизировали и подготавливали для оценки цитокина (ELISA) и концентрацию соединения определяли с помощью LC-MS/MS. Аликвоты сыворотки крови и образцы опухоли мгновенно замораживали и хранили при -80°C до дополнительного анализа. Образцы сыворотки крови и опухоли оценивали в отношении интерферона-бета (IFNβ), интерлейкина-6 (IL-6) и фактора некроза опухоли альфа (TNFα) с помощью иммуноферментного твердофазного анализа (ELISA) с применением наборов от R&D systems (наборы Quantikine для IL-6 и TNFα мышей) и PBL biosciences (набор Verikine для IFNβ мышей).
Анализ цитокина в образцах сыворотки крови мышей. Для оценки IL-6 и TNFα вводили по 50 мкл тестовых образцов или внутреннего стандарта или контроля в лунки в двух повторностях и инкубировали в течение 2 ч. при комнатной температуре, с последующим отсасыванием и промыванием четыре раза с помощью 400 мкл буфера для промывания. Добавляли 100 мкл раствора конъюгата IL-6 или TNFα мышей и инкубировали дополнительно в течение 2 ч. при комнатной температуре с последующими 4 циклами промывания. Добавляли 100 мкл раствора субстрата в каждую лунку, при этом добавляли стоп-раствор через 30 мин. Оптическую плотность измеряли при 450 нм с усреднением и использовали для дополнительных расчетов после вычитания соответствующих холостых контролей. Значения концентрации цитокина определяли путем интерполяции оптической плотности образцов на кривую эталонного стандарта с использованием аппроксимации от четырех-параметрической логистической кривой (4-PL). Значения концентрации цитокина нормализовали с их соответствующими факторами разбавления и представляли в пг/мл. Для оценки IFNβ вводили по 100 мкл тестового образца или внутреннего стандарта или контролей в лунки в двух повторностях и инкубировали в течение 1 ч. при комнатной температуре с последующими тремя промываниями и добавлением раствора антитела к IFNβ мыши с дополнительной инкубацией в течение 1 ч. После этого добавляли раствор пероксидазы хрена (HRP) и промывали три раза, позднее добавляли субстрат TMB и считывали оптическую плотность при 450 нм. Из значений оптической плотности вычитали значения холостого раствора и значения интерполировали на кривую эталонного стандарта с использованием аппроксимации от четырех-параметрической логистической кривой (4-PL). Значения концентрации цитокина нормализовали с их соответствующими факторами разбавления и представляли в пг/мл. В таблицах 4 и 5 указаны уровни цитокина для соединений 2, 6, 8, 12, и 14 в сыворотке крови и опухоли при разных введенных дозах.
Анализ цитокина в образцах опухоли. Образцы опухоли гомогенизировали в гомогенизаторе на основе шариков и лизаты получали с буфером с добавлением 1% Triton X-100 и ингибиторов протеазы. Уровни цитокина оценивали с помощью ELISA и выражали в пг/г опухоли.
Биологический анализ образцов плазмы крови и опухоли. Значения концентрации тестовых соединений в плазме крови и опухоли определяли с помощью способа LC-MS/MS. Образцы опухоли гомогенизировали с использованием гомогенизатора на основе шариков. Образцы плазмы крови и гомогенаты опухоли экстрагировали с применением способа осаждения белка с органическим раствором, содержащим соответствующие внутренние стандарты. Значения концентрации в плазме крови и опухоли определяли на основе соответствующей калибровочной кривой. В таблице 3 указана концентрация соединения 2 в плазме крови и опухоли при разных введенных дозах. В таблице 4 указана концентрация соединений 6, 8, 12, и 14 в плазме крови и опухоли при разных введенных дозах. В таблице 5 указаны уровни цитокина для соединения 2 в сыворотке крови и опухоли при разных дозах. В таблице 6 указаны уровни цитокина для соединений 6, 8, 12 и 14 в сыворотке крови и опухоли при 0,375 мг/кг.
Соединения продемонстрировали более медленный клиренс в опухоли, чем в плазме крови, что также отражено в более высоких уровнях цитокина в опухоли по сравнению с сывороткой крови. Кроме того, наблюдали значительные уровни цитокинов в опухоли даже через 24 ч. Соединение 2 демонстрировало устойчивые уровни в опухоли и оно также коррелировало с устойчивыми уровнями цитокина, и, таким образом, обеспечивало более высокую переносимость.
Таблица 3. Концентрация соединения 2 в плазме крови и опухоли при разных дозах
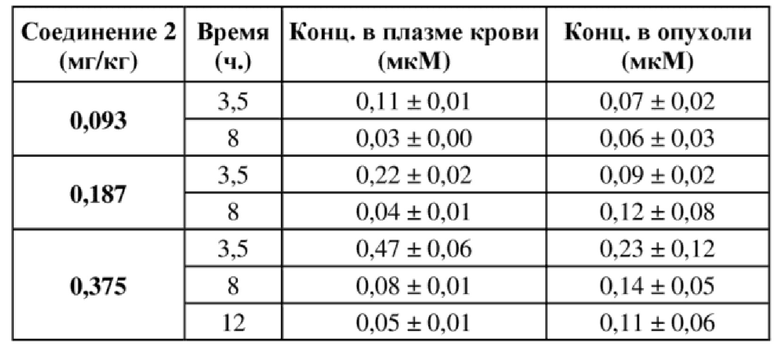
Таблица 4. Концентрация соединений 6, 8, 12 и 14 в плазме крови и опухоли при 0,375 мг/кг
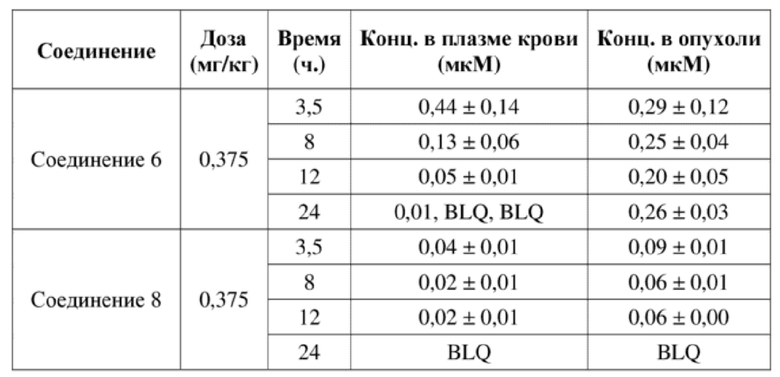
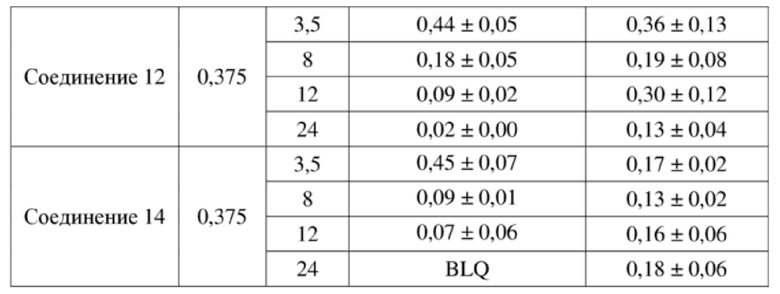
Таблица 5. Уровни цитокина для соединения 2 в сыворотке крови и опухоли при разных дозах
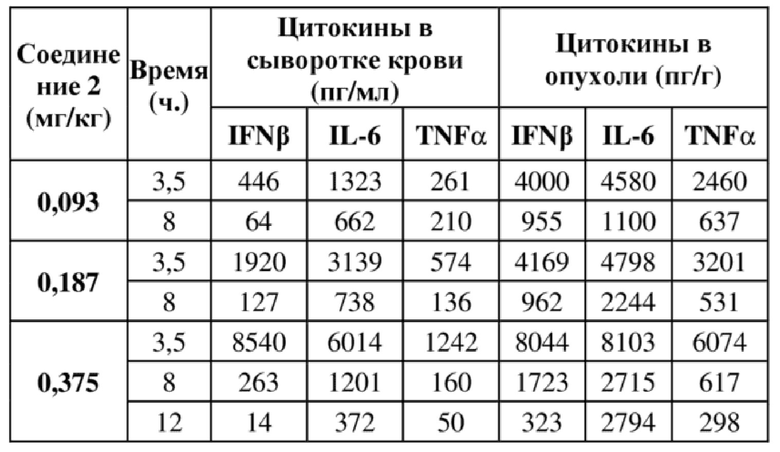
Таблица 6. Уровни цитокина для соединений 6, 8, 12 и 14 в сыворотке крови и опухоли при 0,375 мг/кг
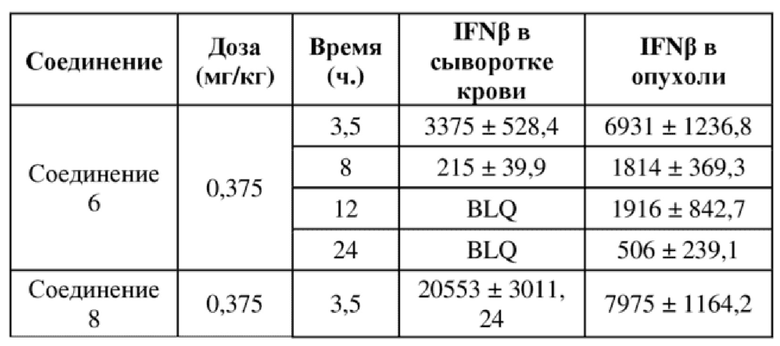
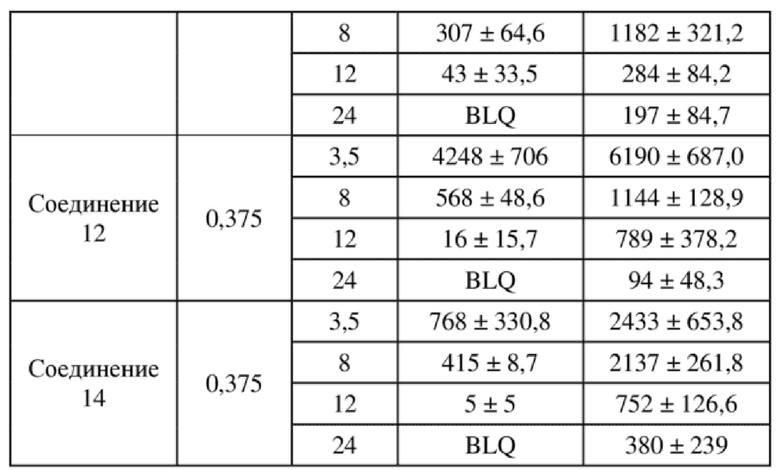
Оценка инфильтрации иммунных клеток в опухоли. Несущих опухоль CT-26 мышей Balb/c обрабатывали внутривенно с помощью 0,375 мг/кг тестовых соединений и кровь и опухоли обрабатывали для анализа CD8+, CD3+ и CD45+ T-клеток через 24 ч. и 96 ч. после начала обработки. Образцы крови подвергали лизису RBC и клетки извлекали путем центрифугирования. После этого промывали с помощью PBS, клетки блокировали с применением блокирующего антитела TruStain FcX™ и окрашивали с помощью меченых флуорофором антител к CD45, CD3 и CD8. Образцы опухоли измельчали и подвергали расщеплению ткани с применением свежеполученного раствора коллагеназы-IV (1 мг/мл), содержащего ДНКазу (0,05 мг/мл), в течение 1-1,5 ч. при 37°C и 150-200 об./мин. Суспензию отдельных клеток получали путем ее фильтрования через сетку с размером пор 100 мкм и проверяли в отношении жизнеспособности клеток. Клетки окрашивали с помощью различных антител, как указано выше. Различные подгруппы T-клеток анализировали на FACS Canto II (BD) и рассчитывали долю в процентах каждой популяции после исходного гейтинга популяции лимфоцитов CD45+.
В результате обработки с помощью внутривенного введения одной дозы 0,375 мг/кг соединений 2 (фигуры 7A и 7B), 6, 8 или 12 получали увеличение в % инфильтрации в опухоль CD3+CD8+ T-клеток по сравнению с обработанной носителем группы через 96 ч. после начала обработки, таблица 7.
Например, на фигуре 7A продемонстрирована полученная с помощью проточной цитометрии диаграмма, отображающая инфильтрацию в опухоль CD3+CD8+ T-клеток в процентах через 96 ч. после обработки носителем (DMA (10%): CrEL (10%): PEG300 (20%): н. солевой раствор (60%)). На фигуре 7B продемонстрированы иллюстративные данные полученной с помощью проточной цитометрии диаграммы, отображающие инфильтрацию в опухоль CD3+CD8+ T-клеток в процентах через 96 ч. после обработки иллюстративным соединением по настоящему изобретению, соединением 2, которые свидетельствуют о более высоком проценте инфильтрации T-клеток по сравнению с таковым для контроля, представляющего собой среду-носитель.
Таблица 7. % инфильтрации в опухоль CD3+CD8+ T-клеток через 96 ч. после обработки
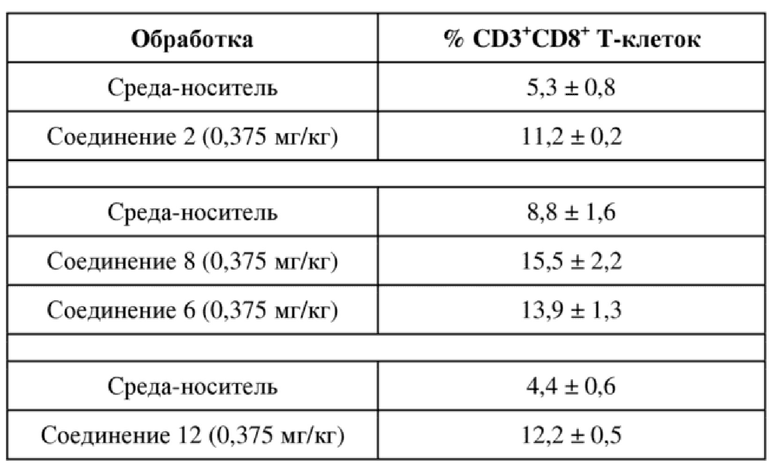
Обработка типов модели рака
Создавали ряд моделей раковых опухолей с применением способов, описанных в абзаце [0608] выше, модифицированных для ряда типов рака. Клеточные линии рака пересаживали в качестве аллотрансплантата мышам с применением известных способов. Ожидается, что размер опухоли у мышей после введения соединений формулы (I) или формулы (II) или пролекарств будет уменьшаться относительно контроля, представляющего собой среду-носитель. Следующие типы клеток могут выполнять функцию моделей для различных типов рака: 4-T1 и EMT-6 (рак молочной железы), B16BL6 и B16F10 (меланома), H22 (рак печени), RM1 (рак предстательной железы) и Pan02 (рак поджелудочной железы).
Описанное и заявленное в данном документе изобретение характеризуется многими особенностями и вариантами осуществления, включающими без ограничения те, которые указаны, или описаны, или процитированы в данном подробном описании изобретения. Для описанного и заявленного в данном документе изобретения не подразумевается включение всех представленных признаков, и оно не ограничено признаками или вариантами осуществления, указанными в данном подробном описании изобретения, которое включено исключительно для иллюстрации, а не ограничения, или с их помощью. Специалист средней квалификации в данной области техники легко определит, что можно изменять или модифицировать множество компонентов и параметров до определенной степени или заменять на известные эквиваленты без отступления от объема настоящего изобретения. Следует отметить, что такие модификации и эквиваленты включены в данный документ, как если бы они были изложены по отдельности. В настоящее изобретение также включены все стадии, признаки, композиции и соединения, на которые ссылаются, или которые указаны в данном описании, по отдельности или в совокупности, и все без исключения комбинации любых двух или более указанных стадий или признаков.
Все патенты, публикации, научные статьи, веб-сайты и другие документы и материалы, цитированные или указанные в данном документе, указывают на уровень квалификации специалистов в данной области техники, к которому настоящее изобретение относится, и каждый такой цитированный документ и материал включен в данный документ посредством ссылки в такой же степени, как если бы он был включен посредством ссылки во всей свое полноте по отдельности или изложен в данном документе во всей своей полноте. Заявитель оставляет за собой право физически включать в данное описание все без исключения материалы и информацию из любых таких патентов, публикаций, научных статей, веб-сайтов, источников информации, доступной в электронном формате, и других цитированных материалов или документов. Ссылка на любые заявки на патент, патенты и публикации в данном описании не является и не должна восприниматься как признание или любая форма предположения, что они составляют действующий уровень техники или образуют часть общедоступных сведений в какой-либо стране мира.
Конкретные способы и композиции, описанные в данном документе, являются примером предпочтительных вариантов осуществления, и они являются иллюстративными и не подразумеваются как ограничивающие объем настоящего изобретения. Другие объекты, аспекты и варианты осуществления будут очевидны специалистам в данной области техники при рассмотрении данного описания, и они охватываются сущностью настоящего изобретения, как определено объемом формулы изобретения. Специалисту в данной области техники будет очевидно, что можно выполнять различные замещения и модификации в настоящем изобретении, раскрытом в данном документе, без отступления от объема и сущности настоящего изобретения. Настоящее изобретение, иллюстративно описанное в данном документе, соответствующим образом можно применять на практике при отсутствии любого элемента или элементов, или ограничения или ограничений, конкретно не раскрытых в данном документе как ключевые. Таким образом, например, в каждом случае в данном документе и в вариантах осуществления или примерах настоящего изобретения любой из терминов “содержащий,” “по сути состоящий из” и “состоящий из” можно заменять на любой из других двух терминов в описании. Способы и процессы, иллюстративно описанные в данном документе, соответствующим образом можно применять на практике с отличающимся порядком стадий, и они не обязательно являются ограниченными порядком стадий, указанным в данном документе или в формуле изобретения. Также при использовании в данном документе и в прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если в контексте явно не указывается иное. Ни при каких обстоятельствах патент не следует интерпретировать как ограниченный конкретными примерами или вариантами осуществления или способами, конкретно раскрытыми в данном документе. Ни при каких обстоятельствах патент не следует интерпретировать как ограниченный каким-либо утверждением, сделанным каким-либо экспертом, проводящим экспертизу, или каким-либо другим должностным лицом или сотрудником Бюро по регистрации патентов и товарных знаков, если такое утверждение конкретно и без уточнения или оговорки не принято заявителем в явном виде в ответном письме. Кроме того, названия, заголовки или т. п. приведены для улучшения понимания читателем данного документа и не должны рассматриваться как ограничивающие объем настоящего изобретения. Любые примеры аспектов, вариантов осуществления или компонентов настоящего изобретения, на которые ссылаются в данном документе, следует рассматривать как неограничивающие.
Термины и выражения, которые использовались, применяют в качестве терминов для описания и не для ограничения, и нет намерения применять такие термины и выражения для исключения какого-либо эквивалента показанных и описанных признаков или их частей, но должно быть очевидно, что являются возможными различные модификации в пределах объема заявленного изобретения. Таким образом, будет понятно, что хотя настоящее изобретение было конкретно раскрыто посредством предпочтительных вариантов осуществления и необязательных признаков, специалист в данной области техники может обратиться к модификации и вариации идей, раскрытых в данном документе, и такие модификации и вариации рассматриваются как находящиеся в пределах объема данного изобретения, определенного прилагаемой формулой изобретения.
Настоящее изобретение было описано в широком и общем смысле в данном документе. Каждый из более узких признаков и подродовых групп входят в общее раскрытие и также образуют часть настоящего изобретения. Это включает общее описание настоящего изобретения с условием или отрицательным ограничением, исключающими любой объект изобретения из рода, независимо от того, был ли удаленный материал конкретно перечислен в данном документе или нет.
Другие варианты осуществления находятся в пределах объема следующей формулы изобретения. Кроме того, если признаки или аспекты настоящего изобретения описаны с учетом групп Маркуша, специалисту в данной области техники будет понятно, что настоящее изобретение тем самым также описано с учетом любых отдельных члена или подгруппы членов группы Маркуша.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ПИРАЗОЛА, ПРИГОДНОЕ В КАЧЕСТВЕ ИНГИБИТОРА РI3К | 2016 |
|
RU2710549C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PRMT5 | 2018 |
|
RU2797822C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ГИДРОКСИПУРИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2685417C1 |
| ИНДАЗОЛ-3-КАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СИГНАЛЬНОГО ПУТИ WNT/b-КАТЕНИНА | 2012 |
|
RU2627693C2 |
| ГЕМИНАЛЬНО-ЗАМЕЩЕННЫЕ ЦИАНОЭТИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ JANUS КИНАЗ | 2014 |
|
RU2664533C2 |
| СРЕДСТВА, ИНДУЦИРУЮЩИЕ АПОПТОЗ, ДЛЯ ЛЕЧЕНИЯ РАКА, ИММУННЫХ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2568611C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И ЕГО ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ | 2014 |
|
RU2719480C2 |
| ГИДРОКСИПУРИНОВЫЕ СОЕДИНЕНИЯ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2673458C1 |
| МОДУЛЯТОРЫ КАЛЬПАИНА И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2773288C2 |
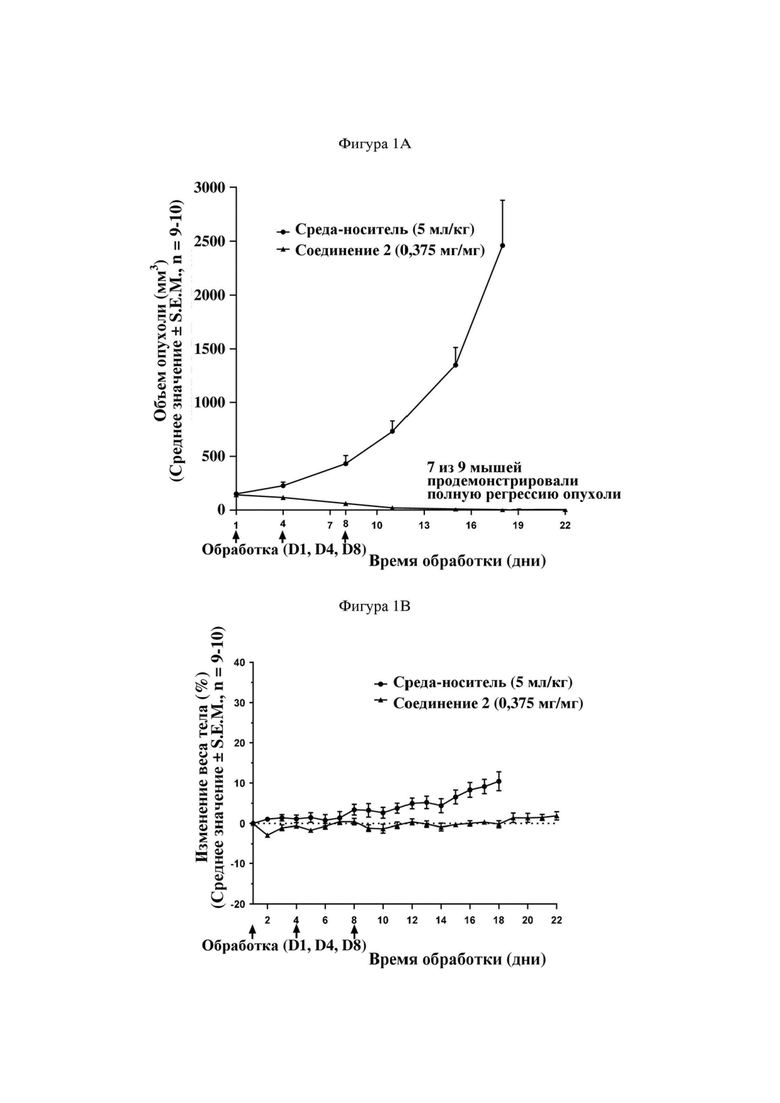

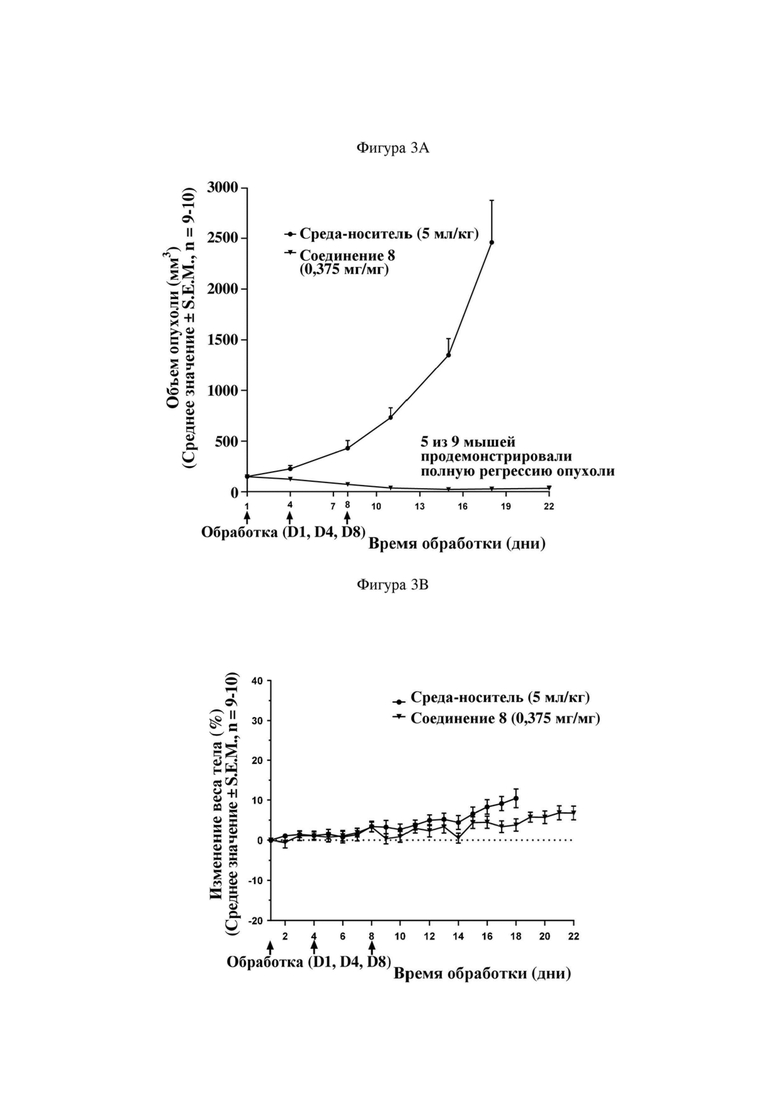
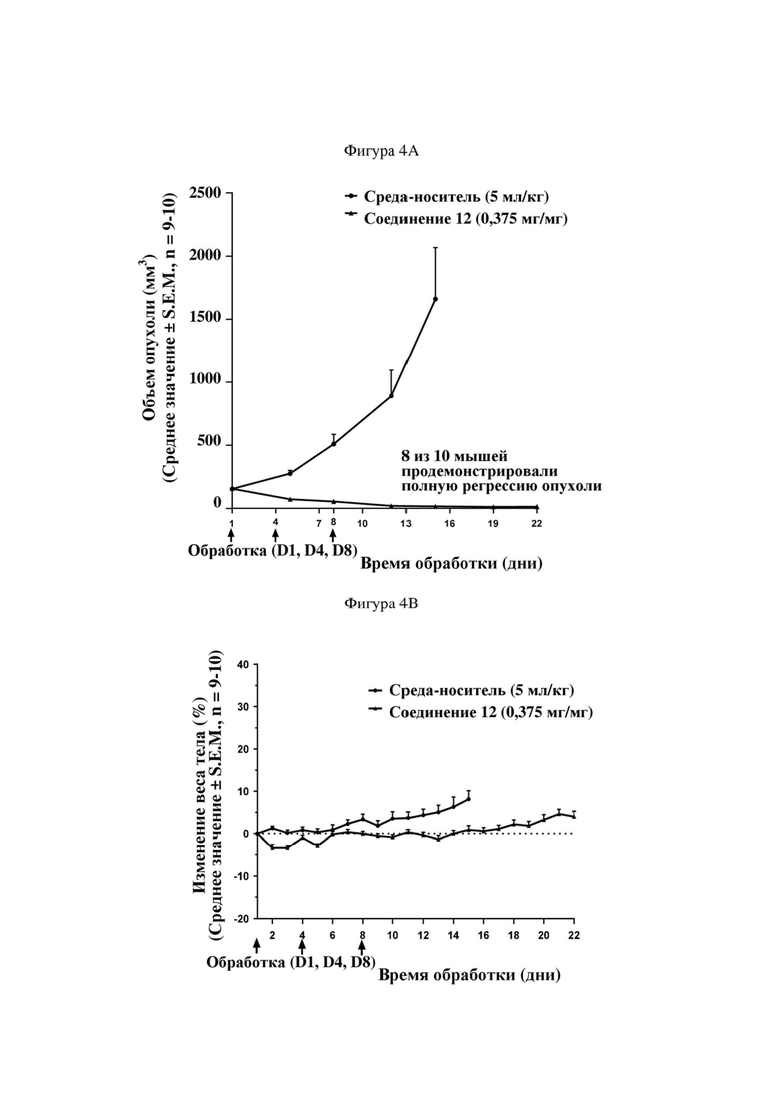
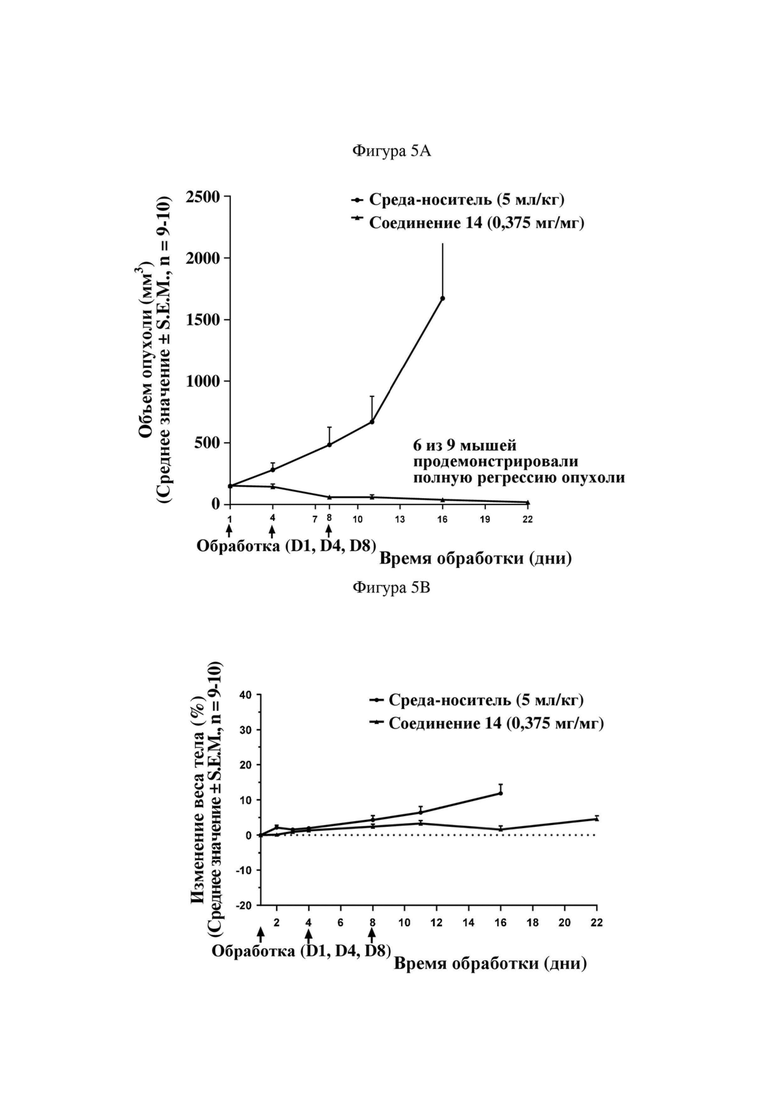

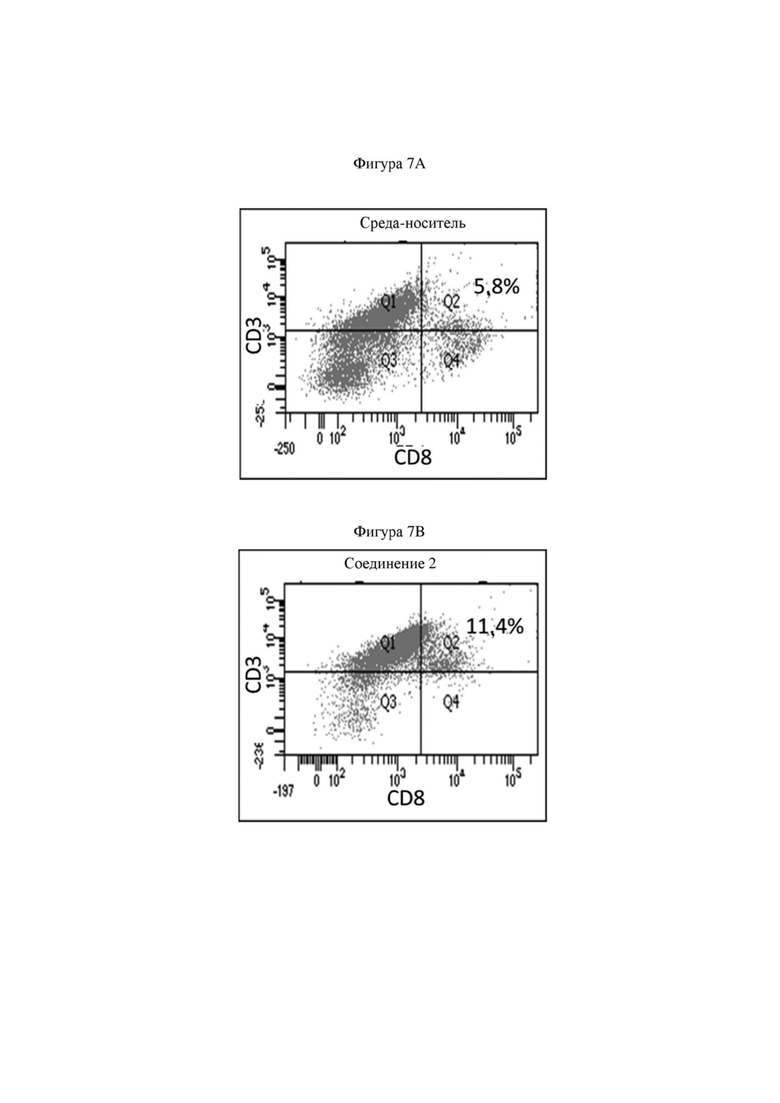
Группа изобретений относится к фармацевтической химии и включает макроциклическое соединение формулы (II), его фармацевтически приемлемые соли, фармацевтическую композицию на его основе, применение и способ лечения. В формуле (II) R3m выбран из
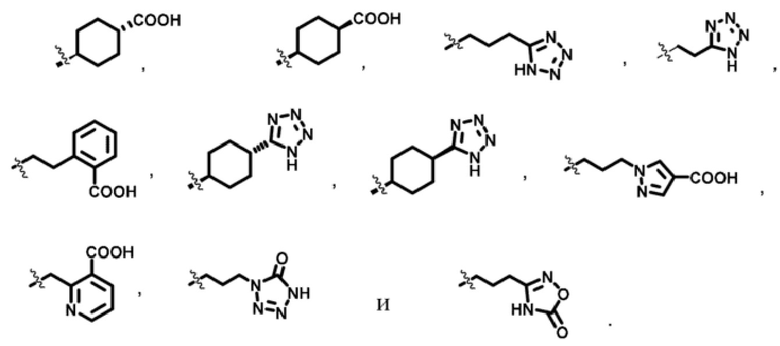 ;
;
G1 независимо выбран из -CH2- или 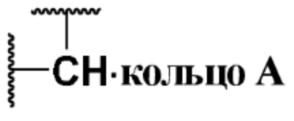 ; кольцо A представляет собой
; кольцо A представляет собой 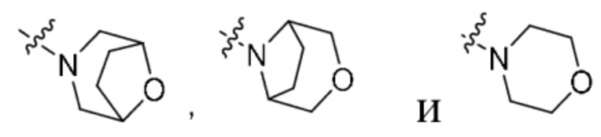 ; каждый из R2a, R2b, R2c и R2d независимо выбран из водорода и C1-C3алкила. Технический результат - макроциклическое соединение формулы (II), применяемое для лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие. 4 н. и 8 з.п. ф-лы, 13 ил., 6 табл., 60 пр.
; каждый из R2a, R2b, R2c и R2d независимо выбран из водорода и C1-C3алкила. Технический результат - макроциклическое соединение формулы (II), применяемое для лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие. 4 н. и 8 з.п. ф-лы, 13 ил., 6 табл., 60 пр.
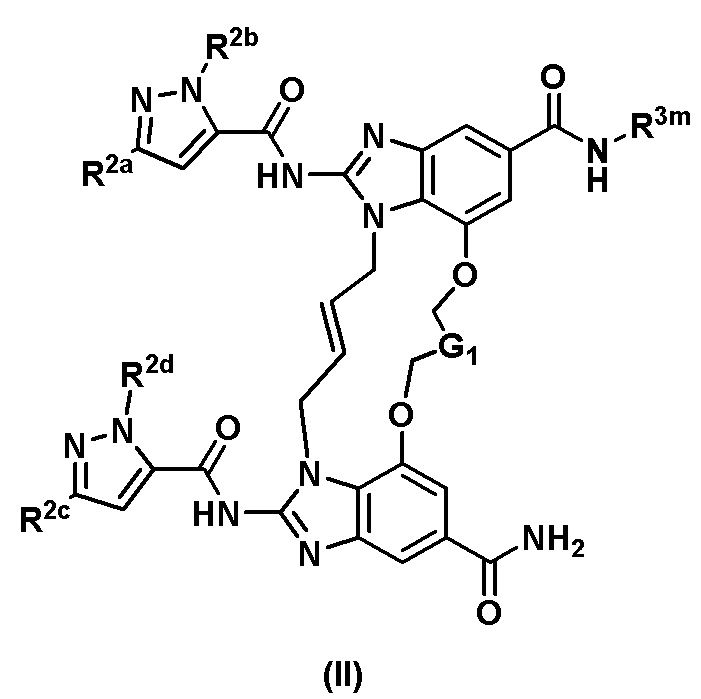
1. Соединение общей формулы (II) или его фармацевтически приемлемая соль
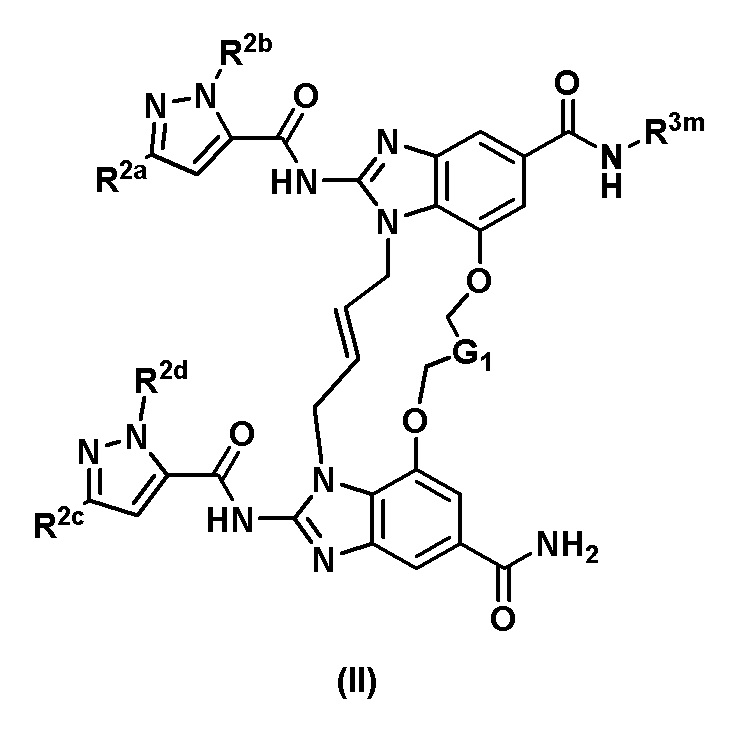 ,
,
где
R3m выбран из
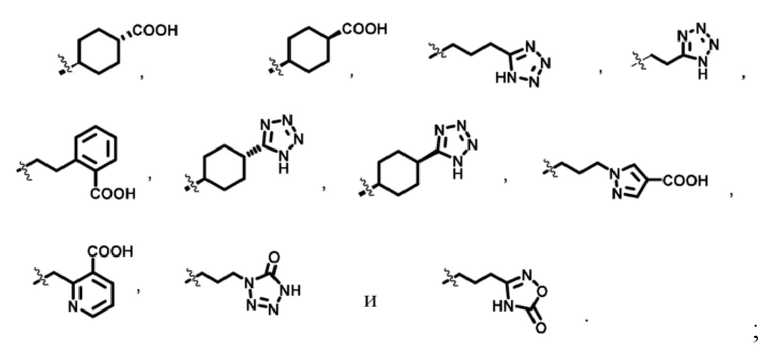
G1 независимо выбран из -CH2- или 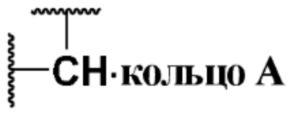 ;
;
кольцо A представляет собой 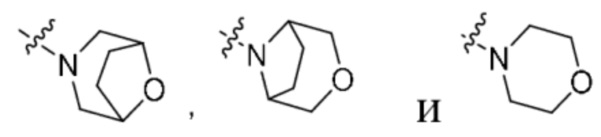 ;
;
каждый из R2a, R2b, R2c и R2d независимо выбран из водорода и C1-C3алкила.
2. Соединение по п. 1, где соединение выбрано из
(1S,4S)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 1);
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 2);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 3);
(E)-N-(2-(1H-тетразол-5-ил)этил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 4);
(E)-2-(2-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)этил)бензойной кислоты (соединение 5);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 6);
(E)-N-((1S,4S)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 7);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 8);
(E)-2-((12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)метил)никотиновой кислоты (соединение 9);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1H-тетразол-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 10);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 11);
(8S,E)-N4-((1R,4S)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 12);
(8R,E)-N4-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 13);
(1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 14);
(1R,4R)-4-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 15);
(8S,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 16);
(8R,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 17);
1-(3-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 18);
1-(3-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 19);
(1R,4R)-4-((E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 20);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 21);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 22);
(E)-1-(3-(8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 23);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 24);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 25);
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 26);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 27);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(2-морфолиноэтил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 28);
(E)-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбонил)глицина (соединение 29);
(E)-N-(2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)этил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 30);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-морфолинопропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 32);
(E)-N-(3-(8-окса-3-азабицикло[3.2.1]октан-3-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 33);
(E)-N-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)бутил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 34);
(E)-(2-(4-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-12-карбоксамидо)этил)-L-пролина (соединение 35);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(метилсульфонил)пиперазин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 36);
(E)-N-(3-(4,4-дифторпиперидин-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 37);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(4-морфолинобутил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 38);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-фторпиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 39);
(R,E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(3-фторпирролидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 41);
(S,E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(3-фторпирролидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 42);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(метилсульфонил)пиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 44);
E)-N-(3-(3,3-дифторпирролидин-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 45);
(E)-N-(3-((2R,6S)-2,6-диметилморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 46);
(E)-N-(3-(1,1-диоксидотиоморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 47);
(E)-N-(3-(1H-имидазол-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 48);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(пиридин-2-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 50);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(4-(трифторметил)пиперидин-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 51);
(E)-N-(3-(3,3-диметилморфолино)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 52);
(E)-N,N'-(12-карбамоил-4-(1H-тетразол-5-ил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-1,15-диил)бис(1-этил-3-метил-1H-пиразол-5-карбоксамида (соединение 54);
(1S,3S)-3-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклобутан-1-карбоновой кислоты (соединение 55);
(1R,3R)-3-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклобутан-1-карбоновой кислоты (соединение 56);
(E)-1-((12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)метил)циклопропан-1-карбоновой кислоты (соединение 57);
(E)-2-(2-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)этил)никотиновой кислоты (соединение 58);
(E)-2-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)бензойной кислоты (соединение 59);
(E)-N-(3-(4-этокси-4-оксидо-1,4-азафосфинан-1-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 60).
3. Соединение по п. 1, где соединение выбрано из
(1S,4S)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 1);
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 2);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 3);
(E)-N-(2-(1H-тетразол-5-ил)этил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 4);
(E)-2-(2-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)этил)бензойной кислоты (соединение 5);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 6);
(E)-N-((1S,4S)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 7);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 8);
(E)-2-((12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)метил)никотиновой кислоты (соединение 9);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1H-тетразол-1-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 10);
(E)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-N-(3-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 11);
(8S,E)-N4-((1R,4S)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 12);
(8R,E)-N4-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 13);
(1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 14);
(1R,4R)-4-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 15);
(8S,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 16);
(8R,E)-N4-(3-(1H-тетразол-5-ил)пропил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 17);
1-(3-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 18);
1-(3-((8R,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 19);
(1R,4R)-4-((E)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 20);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 21);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 22);
(E)-1-(3-(8-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 23);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 24);
(E)-N-(3-(1H-тетразол-5-ил)пропил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 25);
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 26);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8-морфолино-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 27).
4. Соединение по п. 1, где соединение выбрано из
(1R,4R)-4-((E)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 2);
(E)-N-((1R,4R)-4-(1H-тетразол-5-ил)циклогексил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 6);
(E)-1-(3-(12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)пропил)-1H-пиразол-4-карбоновой кислоты (соединение 8);
(8S,E)-N4-((1R,4S)-4-(1H-тетразол-5-ил)циклогексил)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4,12-дикарбоксамида (соединение 12);
(1S,4R)-4-((8S,E)-8-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-12-карбамоил-1,15-бис(1-этил-3-метил-1H-пиразол-5-карбоксамидо)-8,9,16,19-тетрагидро-7H-6,10-диокса-2,14,15a,19a-тетраазациклопентадека[3,2,1-cd:8,9,10-c'd']диинден-4-карбоксамидо)циклогексан-1-карбоновой кислоты (соединение 14).
5. Фармацевтическая композиция для лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие, содержащая соединение формулы (II) или его фармацевтически приемлемую соль по любому из пп. 1-4 и по меньшей мере одно или более фармацевтически приемлемых вспомогательных веществ.
6. Применение соединения формулы (II) или его фармацевтически приемлемой соли по любому из пп. 1-4 для изготовления лекарственного препарата, предназначенного для лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие.
7. Способ лечения заболевания или состояния, при которых активация STING оказывает благоприятное действие на субъекта, нуждающегося в этом, при этом способ включает введение субъекту терапевтически эффективного количества соединения формулы (II) или его фармацевтически приемлемой соли по любому из пп. 1-4.
8. Способ по п. 7, где заболевание или состояние представляет собой рак или одно или более инфекционных заболеваний.
9. Способ по п. 7, где заболевание или состояние представляет собой рак, и где рак представляет собой одно или более из солидных опухолей, лейкоза, лимфомы или их комбинацию.
10. Способ по п. 7, где заболевание или состояние представляет собой одно или более инфекционных заболеваний, где инфекционные заболевания представляют собой вирусную инфекцию, бактериальную инфекцию или их комбинацию.
11. Способ по п. 8 или 9, где рак выбран из рака головного мозга, рака почки, рака яичка, рака уретры, рака прямой кишки, рака фаллопиевых труб, рака полового члена, рака влагалища, рака желудка, рака кожи, рака печени, гастроинтестинальных стромальных опухолей, рака уротелия, рака щитовидной железы, рака паращитовидной железы, рака надпочечника, рака кости, рака полости рта, рака яичника, рака матки, плоскоклеточной карциномы головы и шеи, рака эндометрия, рака желчного пузыря, рака почки, рака мочевого пузыря, рака ротоглотки, рака лимфатического узла, глиобластомы, астроцитомы, мультиформной глиобластомы или типов саркомы мягких тканей, фибросаркомы, хондросаркомы, гемангиомы, тератомы, липомы, миксомы, фибромы, рабдомиомы, тератомы, холангиокарциномы, миеломы, саркомы Юинга, миеломы, лимфомы Ходжкина, неходжкинской лимфомы, фолликулярной лимфомы, лимфомы из клеток мантийной зоны, лимфомы Беркитта, лимфобластной Т-клеточной лимфомы, лимфомы из клеток маргинальной зоны, кожной Т-клеточной лимфомы, лимфомы ЦНС, мелкоклеточной лимфоцитарной лимфомы, лимфоплазмоцитарной лимфомы, диффузной В-крупноклеточной лимфомы (DLBCL), периферической T-клеточной лимфомы, анапластической крупноклеточной лимфомы, первичной медиастинальной лимфомы, грибовидного микоза, мелкоклеточной лимфомы с нерасщепленными ядрами, лимфобластной лимфомы, иммунобластной лимфомы, первичной эффузионной лимфомы, HIV-ассоциированных (или связанных со СПИД) лимфом, лимфобластного T-клеточного лейкоза, хронического миелогенного лейкоза, острого лимфобластного T-клеточного лейкоза, лимфобластного T-клеточного лейкоза, острого миелобластного лейкоза, волосатоклеточного лейкоза, хронического нейтрофильного лейкоза, лейкоза из клеток мантийной ткани, острого мегакариоцитарного лейкоза, множественной миеломы, мегакариобластного лейкоза, эритролейкемии, плазмоцитомы, промиелоцитарного лейкоза, хронического миеломоноцитарного лейкоза, миелодиспластического синдрома, миелофиброза, хронического миелолейкоза, истинной полицитемии, тромбоцитемии, хронического лимфоцитарного лейкоза, пролимфоцитарного лейкоза, волосатоклеточного лейкоза, макроглобулинемии Вальденстрема, болезни Кастлемана, хронического нейтрофильного лейкоза, иммунобластного крупноклеточного лейкоза и плазмоцитомы.
12. Способ по п. 8 или 10, где заболевание или состояние представляет собой инфекцию, обусловленную HIV, HPV, HCV, HBV, альфавирусом, ротавирусом или вирусом гриппа.
| WO 2019069269 A1, 11.04.2019 | |||
| WO 2019069270 A1, 11.04.2019 | |||
| WO 2017175147 A1, 12.10.2017 | |||
| Ramanjulu J.M | |||
| et al | |||
| Design of amidobenzimidazole STING receptor agonists with systemic activity | |||
| Nature, 2018, vol.564, p.439-443 | |||
| Способ горячего лужения или освинцования жести | 1932 |
|
SU31728A1 |
Авторы
Даты
2024-08-23—Публикация
2020-07-22—Подача