УРОВЕНЬ ТЕХНИКИ
Протеинкиназы представляют собой группу ферментов, которые регулируют активность их белков-мишеней путем присоединения фосфатных групп к белковому субстрату. Киназы играют существенную роль во многих физиологических процессах, включая клеточное деление, дифференциацию, клеточный гомеостаз и сигнальную трансдукцию. Киназы можно подразделить в соответствии с их мишенью на Сериновые/Треониновые киназы и Тирозиновые киназы. Тирозиновые киназы можно далее подразделить на рецепторные тирозиновые киназы и нерецепторные тирозиновые киназы. Члены семейства Janus киназ (JAK) млекопитающих являются нерецепторными тирозиновыми киназами.
JAK семейство включает четыре члена: JAK1, JAK2, JAK3 и TYK2. JAK1, JAK2 и TYK2 универсально экспрессируются, тогда как экспрессия JAK3 ограничена гематопоэтическими клетками. JAK семейство вовлечено во внутриклеточную сигнальную трансдукцию от >70 различных цитокинов. Цитокины связываются с их клеточно-поверхностными рецепторами, приводя к димеризации рецептора и последующим активации/фосфорилированию JAK тирозиновых киназ. JAK либо конститутивно связаны с рецептором, либо вступают в ассоциацию с ним при связывании цитокинов. Специфические тирозиновые остатки на рецепторе затем фосфорилируются активированными JAK и служат в качестве сайтов связывания для STAT белков. STAT фосфорилируются посредством JAKs, димеризуются, затем транслоцируются к ядру, где они связываются со специфическими ДНК элементами и активируют генную транскрипцию. JAK1 осуществляет передачу сигналов вместе со всеми JAK изоформами цитокин-зависимым образом.
JAK являются существенными для многих физиологических функций. Это было продемонстрировано с использованием генноинженерных мышиных моделей с дефицитом специфических JAK. Jak1-/- мыши умирают перинатально, тогда как Jak2-/- мыши имеют нарушение эритропоэза и умирают примерно в день E12. Jak3-/- мыши являются жизнеспособными, но имеют SCID фенотип с дефицитом T клеток, B клеток и NK клеток. TYK2-/- мыши демонстрируют признаки гипер IgE синдрома. Эти фенотипы демонстрируют существенные и не-чрезмерные роли JAK активности in vivo (K. Ghoreschi, A. Laurence, J. J. O'Shea, Immunol. Rev. 228, 273 (2009)).
Кроме того, мутации в JAK ферментах связывают с заболеваниями у человека. Инактивирующие мутации в JAK3 (или родственном имеющем общую гамма цепь цитокиновом рецепторе) вызывают тяжелый SCID фенотип (J. J. O'Shea, M. Pesu, D. C. Borie, P. S. Changelian, Nat. Rev. Drug Discov. 3, 555 (2004)). Делеции TYK2 приводят к гипер IgG синдрому и повышенному риску инфекционных заболеваний (Y. Minegishi et al., Immunity. 25, 745 (2006)). Ни о каких инактивирующих мутациях не сообщалось для JAK1 или JAK2, что согласуется с данными, демонстрирующими, что мыши с JAK1 и JAK2 дефицитом не являются жизнеспособными. Однако были идентифицированы некоторые мутации, которые приводят к конститутивно активной JAK2, приводя к миелопролиферативным заболеваниям и подтверждая центральную роль JAK2 в гематопоэзе (O. bdel-Wahab, Curr. Opin. Hematol. 18, 117 (2011)). JAK2 является единственным членом JAK семейства, вовлеченным в сигнальную трансдукцию критических гематопоэтических цитокинов IL-3, GMCSF, EPO и TPO.
Большое количество генетических данных мыши и человека, демонстрирующих центральную роль активности JAK киназы в аутоиммунном заболевании, гематопоэзе и онкологии, было подтверждено использованием ингибиторов pan-JAK в клинических испытаниях для аутоиммунных заболеваний и опухолевых заболеваний (см. K. Ghoreschi, et al, Immunol. Rev. 228, 273 (2009) и A. Quintas-Cardama, H. Kantarjian, J. Cortes, S. Verstovsek, Nat. Rev. Drug Discov. 10, 127 (2011)).
Известно большое количество литературных источников, связывающих Jak/STAT путь с различными заболеваниями и расстройствами, включая гиперпролиферативные расстройства и рак, такие как лейкоз и лимфомы, иммунологические и воспалительные расстройства, такие как отторжение трансплантата, астма, хроническое обструктивное легочное заболевание, аллергии, ревматоидный артрит, диабет I типа, амиотрофический боковой склероз и рассеянный склероз.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает новые соединения, которые являются ингибиторами JAKs. Изобретение также обеспечивает способ лечения и профилактики JAK-опосредованных заболеваний и расстройств с использованием новых соединений, а также фармацевтические композиции, содержащие такие соединения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает соединения формулы I или их фармацевтически приемлемые соли или стереоизомеры:
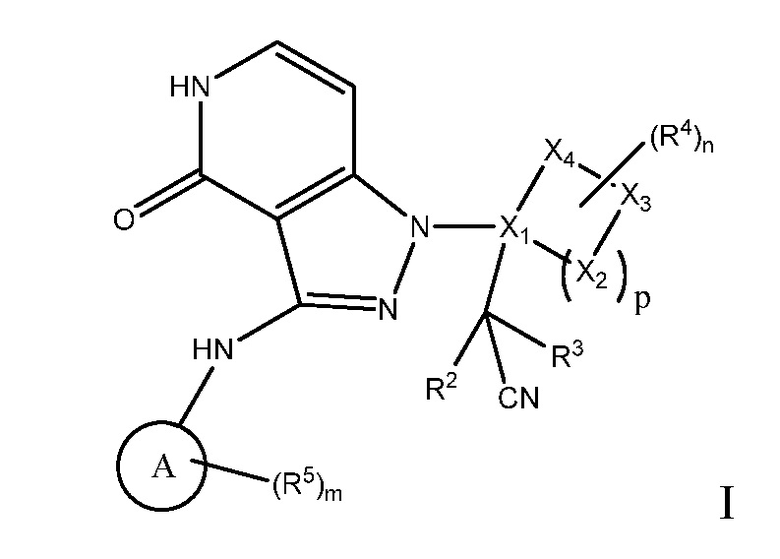
A выбран из арила, гетероарила, циклоалкил C(0-10)алкила, C1-6алкила;
R2 и R3, каждый независимо, выбраны из водорода, C1-4алкила и гидрокси, где R2 и R3, необязательно, могут вместе с атомом углерода, с которым они связаны, образовывать 3 - 6-членное кольцо;
X1 представляет собой C;
X2, X3 и X4, каждый независимо, выбраны из O, N, S и C, и при условии, что образованная кольцевая система содержит 0, 1, 2 или 3 атома, выбранных из O, N и S;
n имеет значение 0, 1, 2, 3 или 4;
m имеет значение 0, 1, 2, 3 или 4;
p имеет значение 0, 1, 2, 3 или 4;
R4 выбран из:
галогена,
оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C1-10 алкиламино(карбонил)0-1C0-10алкила,
(C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10алкила,
(C1-10)гетероалкиламино(карбонил)0-1C0-10алкила,
C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила,
арил C0-10 алкиламиноC0-10 алкила,
гетероарил C0-10 алкиламиноC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила,
C1-10 алкилсульфонила,
C1-10 гетероалкилсульфонила,
(C3-12)циклоалкилC0-10алкилсульфонила,
(C3-12)циклогетероалкилC0-10алкилсульфонила,
гетероарилC0-10 алкилсульфонила,
арилC0-10 алкилсульфонила,
-SO2NH2,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)2,
C0-10 алкилсульфамоила,
C1-10 гетероалкилсульфамоила,
(C3-12)циклоалкилC0-10 алкилсульфамоила,
(C3-12)циклогетероалкилC0-10 алкилсульфамоила,
гетероарилC0-10 алкилсульфамоила,
арилC0-10 алкилсульфамоила,
C0-10 алкилсульфонимидоилC0-10 алкила,
C1-10 гетероалкилсульфонимидоилC0-10 алкила,
(C3-12)циклоалкилC0-10 алкилсульфонимидоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфонимидоилC0-10 алкила,
гетероарилC0-10 алкилсульфонимидоилC0-10 алкила,
арилC0-10 алкилсульфонимидоилC0-10 алкила,
(C1-10 алкил)1-2амино,
-CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
-SO2CF3,
-SO2CF2H,
-SO2CH2CF3,
C1-10 алкилсульфинила,
C1-4ациламиноC0-10 алкила,
гидрокси,
-(C1-10 алкил)OH,
C1-10 алкоксиC0-10 алкила,
циано,
(C1-6алкил)циано и
C1-6галогеналкила,
где два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо;
R5 выбран из:
галогена,
оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1 C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкиламинокарбонилC0-10алкила,
C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
(C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила,
арил C0-10 алкиламиноC0-10 алкила,
гетероарил C0-10 алкиламиноC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила,
(C1-10 алкил)1-2 амино,
-SF5,
C0-10 алкилсульфонила,
C1-10 гетероалкилсульфонила,
(C3-12)циклоалкилC0-10алкилсульфонила,
(C3-12)циклогетероалкилC0-10алкилсульфонила,
гетероарилC0-10 алкилсульфонила,
арилC0-10 алкилсульфонила,
C0-10 алкилсульфамоила,
C1-10 гетероалкилсульфамоила,
(C3-12)циклоалкилC0-10 алкилсульфамоила,
(C3-12)циклогетероалкилC0-10 алкилсульфамоила,
гетероарилC0-10 алкилсульфамоила,
C0-10 алкилсульфонимидоилC0-10 алкила,
C1-10 гетероалкилсульфонимидоилC0-10 алкила,
(C3-12)циклоалкилC0-10 алкилсульфонимидоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфонимидоилC0-10 алкила,
гетероарилC0-10 алкилсульфонимидоилC0-10 алкила,
арилC0-10 алкилсульфонимидоилC0-10 алкила,
-SO2NH2,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)2,
арилC0-10 алкилсульфамоила,
(C0-10алкил)1-2 амино,
- CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
-SO2CF3,
-SO2CF2H,
-SO2CH2CF3,
C1-10 алкилсульфинила,
C1-4ациламиноC0-10 алкила,
гидрокси,
-(C1-10 алкил)OH,
C1-10 алкоксиC0-10 алкила,
циано,
(C1-6алкил)циано и
C1-6галогеналкила; и
где R4 и R5, каждый, необязательно замещен 1, 2, 3 или 4 заместителями R6, и R6 независимо выбран из:
галогена,
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 алкил(карбонил)0-1оксиC0-10 алкила,
C2-10 алкенил(карбонил)0-1оксиC0-10 алкила,
C1-10 гетероалкил(карбонил)0-1оксиC0-10 алкила,
арил C0-10 алкил(карбонил)0-1оксиC0-10 алкила,
(C3-12)циклоалкил C0-10 алкил(карбонил)0-1оксиC0-10 алкила,
гетероарил C0-10 алкил(карбонил)0-1оксиC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(карбонил)0-1оксиC0-10 алкила,
((C0-10)алкил)1-2аминокарбонилокси,
арил (C0-10)алкил аминокарбонилокси,
- CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
оксо (=O),
C0-10 алкилсульфонила,
C1-10 гетероалкилсульфонила,
(C3-12) циклоалкилсульфонила,
(C3-12) циклогетероалкилсульфонила,
гетероарилсульфонила,
арилсульфонила,
аминосульфонила,
-SO2NH2,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)2,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинила,
амино,
(C1-10 алкил)1-2амино,
-(окси)0-1(карбонил)0-1N(C0-10 алкил)1-2
C1-4ациламиноC0-10 алкила,
гидрокси,
(C1-10 алкил)OH,
C1-10 алкоксиC0-10 алкила,
(C1-10 алкил)циано,
циано и
C1-6галогеналкила; и
R6 необязательно замещен 1, 2 или 3 заместителями R7, выбранными из водорода, гидрокси, (C1-6)алкила, C1-10 алкоксиC0-10 алкила, (C1-10 алкил)OH, галогена, CO2H, -(C0-6)алкилCN, -O(C=O)C1-C6алкила, NO2, трифторметокси, трифторэтокси, трифторметила, трифторэтила, -N-C(O)O(C0-6)алкила, C1-10 алкилсульфонила, оксо (O=), аминосульфонила, -SO2C1-6алкила, -SO2CF3, -SO2CF2H, -C1-10 алкилсульфинила, -O(0-1)(C1-10)галогена, -SO2NH2, -SO2NH(C1-6алкил), -SO2N(C1-6алкил)2, алкила, амино(C1-6алкил)0-2 и NH2
Репрезентативные соединения по настоящему изобретению включают, но не ограничиваются этим, следующие соединения и их фармацевтически приемлемые соли и стереоизомеры:
трет-бутил-3-(цианометил)-3-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-[3-(этиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-{3-[(циклопропилметил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-[3-(циклобутиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат;
трет-бутил-3-(цианометил)-3-[3-(этиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]азетидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-[3-(метиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат;
трет-бутил-3-(цианометил)-3-[3-(циклопропиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]азетидин-1-карбоксилат;
трет-бутил-3-(цианометил)-3-(4-оксо-3-((2-(трифторметил)пиридин-4-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилат;
трет-бутил-3-(цианометил)-3-(3((4(метоксикарбонил)фенил) амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилат;
трет-бутил-3-(цианометил)-3-(3-((4-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c] пиридин-1-ил)азетидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-[4-оксо-3-({4-[2,2,2-трифтор-гидроксиэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-{4-оксо-3-[(4-сульфамоилфенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-{[1-оксо-2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-3-фтор-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-{3-[(2-метил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-{[4-(пентафторсульфанил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-3-фтор-4-{3-[(2-метил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-3-метил-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-((1-оксо-2,3-дигидро-1H-инден-5-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-{[3-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-3-фтор-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-{[4-(диметилсульфамоил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фторпиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-3-фтор-4-[4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-3-фтор-4-[4-оксо-3-({4-[2,2,2-трифтор-1-гидроксиэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат;
трет-бутил-4-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)-3-фторпиперидин-1-карбоксилат;
трет-бутил-4-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-{[1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фторпиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
2-(4-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)ацетонитрил;
2-(3-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
4-((1-(3-(цианометил)тетрагидро-2H-пиран-3-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
2-(3-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
метил-5-(цианометил)-5-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-3-(цианометил)-3-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилат;
трет-бутил-3-(цианометил)-3-{3-[(2-фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}азетидин-1-карбоксилат;
трет-бутил-3-(цианометил)-3-[4-оксо-3-({4-[(трифторметил)сульфонил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]азетидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-5-(3-((4-1-амино-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
N-(трет-бутил)-4-((1-(4-(цианометил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензолсульфонамид;
2-(1-(2,2-дифторпропаноил)-4-(3-((4-(изопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрил;
N-(трет-бутил)-4-((1-(4-(цианометил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензолсульфонамид;
2-(4-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)ацетонитрил;
трет-бутил-4-(3-(3,5-бис((1H-пиразол-1-ил)метил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-(3,5-диметилфениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(3-(3,5-бис((1H-1,2,3-триазол-1-ил)метил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(3-(3,5-бис((2H-1,2,3-триазол-2-ил)метил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(3-(3-((1H-1,2,3-триазол-1-ил)метил)-5-((2H-1,2,3-триазол-2-ил)метил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(3-(м-толуидино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-(изоиндолин-5-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-{[2-(циклопропилметил)-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1- карбоксилат;
трет-бутил-4-(цианометил)-4-{3-[(2-этил-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил)амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-[3-[(2-метил-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил)амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат;
метил-4-{3-[(2-трет-бутил-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил)амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)пиперидин-1-карбоксилат;
метил-4-{3-[(2-этил-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил)амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-{[2-(2-метилпропил)-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-{[2-(циклопропилметил)-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-{[2-(циклопентилметил)-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-[4-оксо-3-({4-[(трифторметил)сульфонил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-{3-[(2-фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
4-(1-(1-(цианометил)циклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-иламино)-N,N-диметилбензолсульфонамид;
2-(1-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(1-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
трет-бутил-4-(цианометил)-4-(3-((1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
2-(8-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ил)ацетонитрил;
4-({1-[1-(цианометил)-2-фторциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
{2-фтор-1-[4-оксо-3-({4-[2,2,2-трифтор-1-гидрокси-1-метилэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексил}ацетонитрил
{2-фтор-1-[3-({4-[(1-метилэтил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексил}ацетонитрил;
2-(1-(3-((4-(1-амино-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил;
трет-бутил-5-(3-((4-(N-(трет-бутил)-N-метилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(N-изопропил-N-метилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(N-этил-N-метилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(N-метилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((1-оксо-2-(2,2,2-трифторэтил)изоиндолин-5-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(3-((4-((1H-1,2,3-триазол-1-ил)метил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(3-((4-((2H-1,2,3-триазол-2-ил)метил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(изопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(циклопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(3-((2-(трет-бутил)-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-циклогексил-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-циклопентил-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(3-((4-(1-амино-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
[3-(3-{[4-(азетидин-1-илсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрил;
{3-[3-({4-[(3-метилазетидин-1-ил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
{3-[3-({4-[(2,2-диметилпирролидин-1-ил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
[3-{3-[(4-{[2-метилазетидин-1-ил]сульфонил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрил;
{3-[4-оксо-3-({4-[2,2,2-трифтор-1-гидрокси-1-метилэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
этил-3-(4-((1-(3-(цианометил)тетрагидро-2H-пиран-3-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноат;
2-(3-(3-((4-(3-гидрокси-3-(трифторметил)пирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((4-(3-фторпирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((4-(3-метоксипирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((4-(3-метоксипирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((3-метил-4-(морфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((1-гидрокси-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(1-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил;
2-(1-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензонитрил;
2-(1-(4-оксо-3-((1-оксо-1,3-дигидроизобензофуран-5-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил;
(1-{3-[(3,3-диметил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклопентил)ацетонитрил;
трет-бутил-4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензоат;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензамид;
2-(1-(3-((2-изопропил-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-изопропилбензолсульфонамид;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензолсульфонамид;
2-(1-(3-((4-(азетидин-1-илсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил;
2-(1-(3-((4-(этилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил;
N-(трет-бутил)-4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензолсульфонамид;
N-(трет-бутил)-4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-этилбензолсульфонамид;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диэтилбензолсульфонамид;
трет-бутил-2-(4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилфенилсульфонамидо)-2-метилпропаноат;
2-(1-(4-оксо-3-((1-оксо-2-(2,2,2-трифторэтил)изоиндолин-5-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил;
этил-2-(4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилфенилсульфонамидо)-2-метилпропаноат;
трет-бутил-2-(5-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1-оксоизоиндолин-2-ил)-2-метилпропаноат;
метил-4-(цианометил)-4-(4-оксо-3-((4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-((1-гидрокси-1-(трифторметил)-2,3-дигидро-1H-инден-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-((4-цианофенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-((4-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(4-оксо-3-(хинолин-6-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-((4-(изопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
2-(2-фтор-1-(3-((3-метил-4-(морфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(2-фтор-1-(3-((2-фторпиридин-4-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(1-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-2-фторциклогексил)ацетонитрил;
2-(2-фтор-1-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(тиазолидин-3-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(2-метилтиазолидин-3-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(2-метилтиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(3-гидрокси-3-(трифторметил)пирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1,1,1-трифтор-2-гидрокси-4-изопропокси-3,3-диметил-4-оксобутан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((1-гидрокси-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1,1,1-трифтор-2-гидрокси-3,3-диметилбутан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2,2,2-трифтор-1-гидроксиэтил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1,1,1-трифтор-2-метоксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
{1-[3-({4-[1-(этиламино)-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]-2-фторциклогексил}ацетонитрил;
[2-фтор-1-{3-[(4-{1-метил-1-[(1-метилэтил)амино]этил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексил]ацетонитрил;
{1-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]-2-фторциклогексил}ацетонитрил;
[3-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрил;
{3-[3-({4-[(1-метилэтил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
4-({1-[3-(цианометил)-4-фтортетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
N-трет-бутил-4-({1-[3-(цианометил)тетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-метилбензолсульфонамид;
[3-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрил;
N-трет-бутил-4-({1-[3-(цианометил)тетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамид;
трет-бутил[5-({1-[3-(цианометил)тетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензизотиазол-2(3H)-ил]ацетат;
трет-бутил-3-{[4-({1-[3-(цианометил)тетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]сульфонил}-3-метилбутаноат;
{3-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
{3-[3-({4-[1-(трет-бутиламино)-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
[3-(3-{[4-(циклопентилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрил;
{3-[4-оксо-3-({4-[(1,1,2-триметилпропил)сульфонил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
[3-(3-{[4-(циклогексилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрил;
трет-бутил-5-(3-((4-(1-(трет-бутиламино)-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
{3-[3-({4-[(1,1-диметилпропил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
[3-{3-[(2-циклопентил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрил;
{3-[4-оксо-3-({4-[2,2,2-трифтор-1-пирролидин-1-илэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
{3-[4-оксо-3-({4-[1-пирролидин-1-илэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
{3-[3-({4-[(2,2-диметилциклопентил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрил;
трет-бутил-5-(цианометил)-5-(3-((4-(морфолинoсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
[3-(3-{[4-(морфолин-4-илсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрил;
[3-{4-оксо-3-[(4-{2,2,2-трифтор-1-[(1-метилэтил)амино]этил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрил;
трет-бутил-5-(цианометил)-5-(3-((4-(1-(этиламино)-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2,2,2-трифтор-1-(изопропиламино)этил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1-(пирролидин-1-ил)этил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(1-(диметиламино)-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-(хинолин-6-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-цианохинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-метилхинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(3,5-диметил-1H-пиразол-1-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(1H-пиразол-1-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(2,2-диметилморфолин-4-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-(хинолин-3-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-(диметиламино)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(3-((2-карбамоилхинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
2-(3-(4-оксо-3-((4-(1-(трифторметил)циклопропил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((2-(диметиламино)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((2-метилхинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
трет-бутил-5-(цианометил)-5-(3-((2-морфолинoхинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-(2-метилморфолинo)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(3-((2-(8-окса-3-азабицикло[3.2.1]октан-3-ил)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(пропан-2-ил-(S или R)-сульфонимидоил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
2-(3-(4-оксо-3-((4-(пропан-2-ил-(S или R)-сульфонимидоил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
4-({1-[1-(цианометил)-2-фторциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
трет-бутил-5-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(циклопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(изопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-(диметилкарбамоил)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
4-({1-[3-(цианометил)тетрагидрофуран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензонитрил;
[3-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидрофуран-3-ил]ацетонитрил;
[3-{3-[(4-хлор-8-фторхинолин-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидрофуран-3-ил]ацетонитрил;
[3-{3-[(4-фторхинолин-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидрофуран-3-ил]ацетонитрил;
(3-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидрофуран-3-ил)ацетонитрил;
2-(3-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидрофуран-3-ил)ацетонитрил;
2-(4-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-4-ил)ацетонитрил;
2-(4-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-4-ил)ацетонитрил;
N-(трет-бутил)-4-((1-(4-(цианометил)тетрагидро-2H-пиран-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензолсульфонамид;
4-((1-(4-(цианометил)тетрагидро-2H-пиран-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
2-(4-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрил;
2-(3-фтор-4-(3-(3-метил-4-(морфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-тетрагидро-2H-пиран-4-ил)ацетонитрил;
2-(4-(3-((2-(трет-бутил)-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрил;
2-(3-фтор-4-(3-(3-метил-4-(тиоморфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-тетрагидро-2H-пиран-4-ил)ацетонитрил;
2-(3-фтор-4-(4-оксо-3-((4-(2-(трифторметил)пиперидин-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-4-ил)ацетонитрил;
2-(4-(3-((4-(1-(трет-бутиламино)-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрил;
2-[4-(3-{[1,1-диоксо-2-(пиперидин-4-ил)-3H-1,2-бензотиазол-5-ил]амино}-4-оксо-5H-пиразоло[4,3-c]пиридин-1-ил)-3-фтороксан-4-ил]ацетонитрил;
трет-бутил-4-(цианометил)-3-фтор-4-{3-[(4-{1-метил-1-[(1-метилэтил)амино]этил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(2-(изопропиламино)пропан-2-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-4-(цианометил)-3-фтор-4-(3-{[4-(1-метоксиэтил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-{3-[(4-{1-метил-1-[(1-метилэтил)амино]этил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
2-(4-(3-((1,1-диоксидо-2-(1-(2,2,2-трифторэтил)пиперидин-4-ил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрил;
трет-бутил-4-(цианометил)-3-фтор-4-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(3-((4-(1-бензил-3-(трифторметил)пирролидин-3-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-((4-(3-(трифторметил)пирролидин-3-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(3-(трифторметил)пирролидин-3-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-((S или R)-2-(трифторметил)пиперидин-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-((4-(((2,2,2-трифторэтил)амино)метил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(N-изопропилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(3-((4-(N-бензилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(N-(циклопропилметил) сульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(N-(2-метоксиэтил)сульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(N-циклогексилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-((4-(пиперидин-1-илсульфонил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(морфолинoсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((3-фтор-4-(N-изопропилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(N-(циклопропилметил)сульфамоил)-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
(4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил)ацетонитрил;
[1-(циклопропилкарбонил)-4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил]ацетонитрил;
4-({1-[1-бензил-4-(цианометил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(4-метилбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-[(1-{4-(цианометил)-1-[4-(трифторметил)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-[(1-{4-(цианометил)-1-[4-(1-метилэтил)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-[(1-{4-(цианометил)-1-[4-(1-метилэтил)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-[(1-{4-(цианометил)-1-[4-(1метилэтокси)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(4-фторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(3-фторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(2-фторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(2,6-дифторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(2,3,6-трифторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(1,3-оксазол-2-илметил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(4-изоксазол-3-илбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-[(1-{4-(цианометил)-1-[4-(2-оксопирролидин-1-ил)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(3-фенилпропил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(1H-индол-4-илметил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-((1-(4-(цианометил)-1-(1-(2,6-дифторфенил)этил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
4-((1-(4-(цианометил)-1-фенетилпиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
3-({1-[4-(цианометил)-1-(пиридин-3-илметил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-пропаноилпиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(3,3,3-трифторпропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(метоксиацетил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(N,N-диметилглицил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(2,2-диметилпропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(циклопропилкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-[(1-{4-(цианометил)-1-[(3,3-дифторциклобутил)карбонил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(циклогексилкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-[(1-{4-(цианометил)-1-[трицикло[3.3.1.13,7]дец-1-илкарбонил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(циклопропилацетил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(3-циклопропилпропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(фенилкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-[(1-{1-[(4-хлорфенил)карбонил]-4-(цианометил)пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-[(1-{1-[(3-хлорфенил)карбонил]-4-(цианометил)пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-[(1-{1-[(2-хлорфенил)карбонил]-4-(цианометил)пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-{[4-(трифторметил)фенил]ацетил}пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(3-фенилпропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(2,3-дигидро-1H-инден-2-илкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-[(1-{4-(цианометил)-1-[(2-оксопирролидин-1-ил)ацетил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(тетрагидро-2H-пиран-4-илкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(4,4,4-трифторбутаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(3-цианопропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[4-(цианометил)-1-(3,3-диметилбутаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-((1-(4-(цианометил)-1-(2-(метилтио)пропаноил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
4-((1-(1-(2-цианоацетил)-4-(цианометил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
метил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
фенил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
4-фторфенил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
неопентил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
этил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
изопропил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
2-метилциклопентил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
2-(метилтио)этил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
тетрагидро-2H-тиопиран-4-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
1-метоксипропан-2-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
тетрагидрофуран-3-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
тетрагидро-2H-пиран-4-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
1,1,1-трифторпропан-2-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
1-(пиридин-2-ил)этил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
1-цианоэтил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
тетрагидрофуран-3-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
2,2,2-трифторэтил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
изопропил-4-(цианометил)-4-(3-(2-фторпиридин-4-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
метил-4-(цианометил)-4-(3-(2-фторпиридин-4-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
4-((1-(4-(цианометил)-1-((2,2,2-трифторэтил)сульфонил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
4-((1-(4-(цианометил)-1-(циклопропилсульфонил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
2-(4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил;
6-(4-(цианометил)-4-(3-((4(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрил;
6-(4-(цианометил)-4-(3-((4((дифторметил)сульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрил;
2-(4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(5(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил;
6-(4-(цианометил)-4-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрил;
6-((3R,4R)-4-(цианометил)-3-фтор-4-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрил;
2-(1-(5-иодпиридин-2-ил)-4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрил;
2-(1-(5-бромпиридин-2-ил)-4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрил;
2-(4-(3-(3-метил-4-(тиоморфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил;
2-(4-(4-оксо-3-(4-(2,2,2-трифтор-1-гидроксиэтил)фениламино)-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил;
2-(4-(3-(4-(4,4-дифторпиперидин-1-карбонил)-3-метилфениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил;
2-(1-(2,2-дифторпропаноил)-4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрил;
2-(4-(3-фторазетидин-1-ил)-1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(фениламино)циклогексил)ацетонитрил;
2-(4-гидрокси-1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(3-фторазетидин-1-ил)циклогексил)ацетонитрил;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(3-метоксиазетидин-1-ил)циклогексил)ацетонитрил;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-((2,2,2-трифторэтил)амино)циклогексил)ацетонитрил;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-гидроксициклогексил)ацетонитрил;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(фениламино)циклогексил)ацетонитрил;
2-(4-(3-метоксиазетидин-1-ил)-1-(4-оксо-3-((4-(трифторметокси)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(1-(4-оксо-3-((4-(трифторметокси)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(фениламино)циклогексил)ацетонитрил;
2-(4-(циклогексиламино)-1-(4-оксо-3-((4-(трифторметокси)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(1-(3-((4-хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(циклогексиламино)циклогексил)ацетонитрил;
2-(1-(3-((4-хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(3-метоксиазетидин-1-ил)циклогексил)ацетонитрил;
2-(1-(3-((4-хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(фениламино)циклогексил)ацетонитрил;
2-(1-(3-((4-((дифторметил)сульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(3-фторазетидин-1-ил)циклогексил)ацетонитрил;
4-((1-(1-(цианометил)-4-(3-фторазетидин-1-ил)циклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
2-(4-(3-фторазетидин-1-ил)-1-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(4-(диметиламино)-1-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо-[d]изотиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(4-(3-фторазетидин-1-ил)-1-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил;
2-(1-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(диметиламино)циклогексил)ацетонитрил;
4-((1-(1-(цианометил)-4-оксоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид;
N-(трет-бутил)-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксамид;
N-трет-бутил-5-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-(цианометил)-N-метилтетрагидро-2H-пиран-2-карбоксамид;
изопропил-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
2-(3-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((3-метил-4-(2-метилпиперидин-1-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((3-метил-4-(2-метилпиперидин-1-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
2-(3-(3-((4-(4-гидрокси-4-метилпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(морфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(пирролидин-1-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(3-метилморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(2-метилморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(2,6-диметилморфолин-4-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((4-(этил(2,2,2-трифторэтил)карбамоил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(метил(2,2,2-трифторэтил)карбамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(3-((4-(2-окса-5-азабицикло[2.2.1]гептан-5-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(3-((2-метилбензо[d]тиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
[1-{3-[(3,3-диметил-2-оксо-2,3-дигидро-1H-индол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-2-фторциклогексил]ацетонитрил;
(трет-бутил-5-(цианометил)-5-(3-((3,3-диметил-2-оксоиндолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
[3-{3-[(3,3-диметил-2-оксо-2,3-дигидро-1H-индол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрил;
[3-{3-[(2-метил-1,3-бензотиазол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрил;
трет-бутил-5-(цианометил)-5-(3-((2-фторпиридин-4-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2,2,2-трифтор-1-метоксиэтил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2,2,2-трифтор-1-метоксиэтил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(3-((4-(8-окса-3-азабицикло[3.2.1]октан-3-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-{3-[(5-метил-4-{3-окса-8-азабицикло[3.2.1]октан-8-илкарбонил}циклогекса-1,3,5-триен-1-ил)амино]-4-оксо-5H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-(3-метил-4-(тиоморфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-((1,1-диоксидо-2-(1-(2,2,2-трифторэтил)пиперидин-4-ил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-(4-(2-(трифторметил)пиперидин-2-ил)фениламино)-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(4-оксо-3-(4-(2-(трифторметил)пирролидин-2-ил)фениламино)-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
трет-бутил-4-(цианометил)-4-(3-(3-метил-4-(морфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат;
5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)-N-(метилсульфонил)тетрагидро-2H-пиран-2-карбоксамид;
5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)-N,N-диметилтетрагидро-2H-пиран-2-карбоксамид; и
2-(3-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-6-(2-гидроксипропан-2-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил.
Изобретение также охватывает фармацевтические композиции, содержащие соединение формулы I, и способы лечения или профилактики JAK-опосредованных заболеваний с использованием соединений формулы I.
Изобретение описано с использованием следующих определений, если не указано иное.
Как используется в настоящей заявке, за исключением тех случаев, где есть специальные указания, "алкил" предполагает включение насыщенных алифатических углеводородных групп как с разветвленной цепью, так и с прямой цепью, включая все изомеры, содержащие указанное количество атомов углерода. Широко применяемые аббревиатуры для алкильных групп используются повсеместно в тексте описания изобретения, например, метил может быть представлен как “Me” или CH3, этил может быть представлен как “Et” или CH2CH3, пропил может быть представлен как “Pr” или CH2CH2CH3, бутил может быть представлен как “Bu” или CH2CH2CH2CH3, и т.д. “C1-6 алкил” (или “ C1-C6 алкил”), например, означает алкильные группы с прямой цепью или с разветвленной цепью, включая все изомеры, содержащие указанное количество атомов углерода. C1-6 алкил включает все гексильные и пентильные изомеры алкила, а также н-, изо-, втор- и трет-бутил, н- и изо-пропил, этил и метил. “C1-4 алкил” означает н-, изо-, втор- и трет-бутил, н- и изо-пропил, этил и метил.
Термин “алкилен” относится к насыщенным алифатическим углеводородным группам как с разветвленной цепью, так и с прямой цепью, включая все изомеры, содержащие указанное количество атомов углерода и содержащих два присоединения на конце цепи. Для иллюстрации, термин “незамещенный A-C4алкилен-B” представляет собой A-CH2-CH2-CH2-CH2-B.
Термин "алкокси" представляет собой алкильную группу с прямой цепью или с разветвленной цепью, содержащую указанное количество атомов углерода, присоединенную через кислородный мостик.
"Ацил" означает-C(O)R радикал, где R представляет собой необязательно замещенный алкил, алкенил, циклоалкил, гетероциклоалкил, арил, гетероарил, и т.д.
"Ациламино" означает -NRR' радикал, где R представляет собой H, OH или алкокси, и R' представляет собой ацил, как он определен в настоящей заявке.
Термин "алкил" относится к алифатической углеводородной группе, которая может иметь линейную или разветвленную цепь и содержит указанное количество атомов углерода. Неограничивающие примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил и подобные.
Термин "гетероалкил" относится к алкильной группе, где 1, 2 или 3 атома углерода замещены гетероатомом, независимо выбранным из N, O или S.
"Алкенил" относится к алифатической углеводородной группе, содержащей по меньшей мере одну углерод-углеродную двойную связь, и которая может иметь линейную или разветвленную цепь и содержит указанное количество атомов углерода. Предпочтительно алкенил содержит одну углерод-углеродную двойную связь и могут присутствовать вплоть до четырех неароматических углерод-углеродных двойных связей. Примеры алкенильных групп включают этенил, пропенил, н-бутенил, 2-метил-1-бутенил, 3-метилбут-2-енил, n-пентенил, октенил и деценил.
"Алкинил" относится к алифатической углеводородной группе, содержащей по меньшей мере одну углерод-углеродную тройную связь, и которая может иметь линейную или разветвленную цепь и содержит указанное количество атомов углерода. Неограничивающие примеры подходящих алкинильных групп включают этинил, пропинил, 2-бутинил и 3-метилбутинил.
“Алкокси” относится к алкил-O- группе, в которой алкильн группа имеет значение, определенное выше. C1-6алкокси, например, включает метокси, этокси, пропокси, изопропокси и т.п.
"Алкоксиалкил" относится к алкильной группе, описанной выше, в которой один или несколько (в частности, от 1 до 3) атомов водорода замещены алкокси группами. Примеры включают CH2OCH3, CH2CH2OCH3 и CH(OCH3)CH3.
"Аминоалкил" относится к алкильной группе, описанной выше, в которой один атом водорода замещен амино, моноалкиламино или диалкиламино группой. Примеры включают CH2NH2, CH2CH2NHCH3 и CH(N(CH3)2)CH3.
Термин “C0”, как он используется в выражениях, таких как “C0-6 алкил”, означает прямую ковалентную связь; или когда термин присутствует на конце заместителя, C0-6 алкил означает водород или C1-6алкил. Подобным образом, когда целое число, определяющее присутствие определенного количества атомов в группе, равно нулю, это означает, что атомы, являющиеся смежными с группой, присоединяются непосредственно посредством связи. Например, в структуре 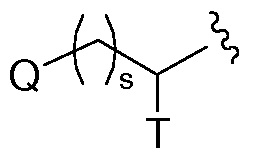 , где s представляет собой целое число, имеющее значение 0, 1 или 2, структура представляет собой
, где s представляет собой целое число, имеющее значение 0, 1 или 2, структура представляет собой  , когда s равен нулю.
, когда s равен нулю.
Термин “C3-8 циклоалкил” (или “C3-C8 циклоалкил”) означает циклическое кольцо алкана, содержащее в целом от трех до восьми атомов углерода (т.е. циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил). Термины “C3-7 циклоалкил”, “C3-6 циклоалкил”, “ C5-7циклоалкил” и подобные имеют аналогичные значения.
Термин "галоген" (или “гало”) относится к фтору, хлору, брому и иоду (альтернативно указаны как фтор (F), хлор (Cl), бром (Br) и иод (I)).
Термин "арил" относится к ароматическим моно- и поли-карбоциклическим кольцевым системам, где отдельные карбоциклические кольца в полициклических системах являются конденсированными или присоединяются друг к другу через простую связь. Подходящие арильные группы включают фенил, нафтил, 2,3-дигидро-1H-инденил и бифенил.
Термин “карбоцикл” (и его варианты, такие как “карбоциклический” или “карбоциклил”), как он используется в настоящей заявке, если не указано иное, относится (i) к C3 - C8 моноциклическому насыщенному или ненасыщенному кольцу, или (ii) к C7 - C12 бициклической насыщенной или ненасыщенной кольцевой системе. Каждое кольцо в (ii) является либо независимым от другого кольца, либо конденсированным с ним, и каждое кольцо является насыщенным или ненасыщенным. Карбоцикл может присоединяться к остальной части молекулы по любому атому углерода, что обеспечивает стабильное соединение. Конденсированные бициклические карбоциклы представляют собой подгруппу карбоциклов; т.е. термин "конденсированный бициклический карбоцикл", как правило, относится к C7 - C10 бициклической кольцевой системе, в которой каждое кольцо является насыщенным или ненасыщенным, и два смежных атома углерода являются общими для каждого из колец в кольцевой системе. Конденсированный бициклический карбоцикл, в котором одно кольцо является насыщенным, и другое является насыщенным, представляет собой насыщенную бициклическую кольцевую систему. Конденсированный бициклический карбоцикл, в котором одно кольцо представляет собой бензол, а другое является насыщенным, представляет собой ненасыщенную бициклическую кольцевую систему. Конденсированный бициклический карбоцикл, в котором одно кольцо представляет собой бензол, а другое является ненасыщенным, представляет собой ненасыщенную кольцевую систему. Насыщенные карбоциклические кольца также называются циклоалкильными кольцами, например, циклопропил, циклобутил и т.д. Если не указано иное, карбоцикл является незамещенным или замещен C1-6 алкилом, C1-6 алкенилом, C1-6 алкинилом, арилом, галогеном, NH2 или OH. Подгруппа конденсированных бициклических ненасыщенных карбоциклов включает такие бициклические карбоциклы, в которых одно кольцо представляет собой бензольное кольцо, а другое кольцо является насыщенным или ненасыщенным, с присоединением через любой атом углерода, что обеспечивает стабильное соединение. Репрезентативные примеры этой подгруппы включают следующие: 
"Цианоалкил" относится к алкильной группе, описанной выше, в которой один атом водорода замещен циано группой. Примеры включают CH2CN, CH2CH2CN и CH(CN)CH3.
"Циклоалкил" означает карбоциклическую кольцевую систему, содержащую от 3 до 12 кольцевых атомов углерода; указанная кольцевая система может представлять собой (a) моноциклический насыщенный карбоцикл, необязательно конденсированный с бензолом или частично ненасыщенным карбоциклом, или (b) бициклический насыщенный карбоцикл. Для бициклической системы, относящейся либо к (a) либо к (b), кольца являются конденсированными через два смежных кольцевых атома углерода (например, декалин), по одному кольцевому атому углерода (например, спиро[2.2]пентан) или представляют собой связанные мостиковой связью группы (например, норборнан). Дополнительные примеры, охватываемые указанным выше значением, включают, но не ограничиваются этим, циклопропан, циклобутан, циклопентан, циклогексан, пергидроиндан, декалин, спиро[4.5]декан, бицикло[2.2.2]октан и подобные.
“Галогеналкил” относится к алкильной группе, описанной выше, где один или несколько (в частности, от 1 до 5) атомов водорода замещены атомами галогена, вплоть до полного замещения всех атомов водорода галогеновыми группами. C1-6галогеналкил, например, включает -CF3, -CF2CF3, CHFCH3 и подобные.
"Гетероцикл", "гетероциклический" или "гетероциклил" представляет собой моноциклическую или бициклическую 3-12-членную кольцевую систему, в которой по меньшей мере одно кольц является неароматическим (насыщенным или частично ненасыщенным) и которая содержит по меньшей мере один гетероатом, выбранный из O, S и N. В бициклической кольцевой системе второе кольцо может представлять собой гетероарил, гетероцикл или насыщенный, частично ненасыщенный или ароматический карбоцикл, и точка(точки) присоединения к остальной части молекулы может находиться на любом кольце. Что касается бициклической системы, кольца могут быть конденсированы через два смежных кольцевых атома (например, хинолин), по одному кольцевому атому углерода (например, 1,4-диоксаспиро[4.5]декан) или представляют собой связанные мостиковой связью группы (например, 8-азабицикло[3.2.1]октанил). “Гетероциклил” поэтому включает гетероарилы, а также их дигидро и тетрагидро аналоги. Присоединение гетероциклического заместителя может происходить через атом углерода или через гетероатом.
Примеры гетероциклов (гетероциклил) включают, но не ограничиваются этим, азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиаморфолинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, дигидроимидазолил, дигидроиндолил, 1,2,3,4-тетрагидроизохинолинил, 5,6,7,8-тетрагидроимидазо[1,2-a]пиразин, 2,3-дигидробензофуранил, бензо-1,4-диоксанил, бензоимидазолил, бензофуранил, бензофуразанил, бензопиразолил, бензотриазолил, бензотиофенил, бензоксазолил, карбазолил, карболинил, циннолинил, фуранил, имидазолил, индолинил, индолил, индолазинил, индазолил, изобензофуранил, изоиндолил, изохинолил, изотиазолил, изоксазолил, нафтпиридинил, оксадиазолил, оксазолил, оксазолин, изоксазолин, оксетанил, пиранил, пиразинил, пиразолил, пиридазинил, пиридопиридинил, пиридазинил, пиридинил, пиримидил, пирролил, хиназолинил, хинолил, хиноксалинил, тетрагидропиранил, тетразолил, тетразолoпиридил, тиадиазолил, тиазолил, тиенил, триазолил, азетидинил, азиридинил, 1,4-диоксанил, генксагидроазепинил, пиперазинил, пиперидинил, пирролидинил, морфолинил, тиоморфолинил, дигидробензоимидазолил, дигидробензофуранил, дигидробензотиофенил, дигидробензоксазолил, дигидрофуранил, дигидроимидазолил, дигидроиндолил, дигидроизооксазолил, дигидроизотиазолил, дигидрооксадиазолил, дигидрооксазолил, дигидропиразинил, дигидропиразолил, дигидропиридинил, дигидропиримидинил, дигидропирролил, дигидрохинолинил, дигидротетразолил, дигидротиадиазолил, дигидротиазолил, дигидротиенил, дигидротриазолил, дигидроазетидинил, метилендиоксибензоил, тетрагидрофуранил и тетрагидротиенил и их N-оксиды.
Насыщенные гетероциклические группы образуют подгруппу гетероциклов; т.е. термины "насыщенный гетероциклический и (C3-12)гетероциклоалкил", как правило, относятся к гетероциклу, как он определен выше, в котором вся кольцевая система (моно- или полициклическая) является насыщенной. Термин "насыщенное гетероциклическое кольцо" относится к 4 - 8-членному насыщенному моноциклическому кольцу или стабильной 7 - 12-членной бициклической кольцевой системе, которая состоит из атомов углерода и одного или нескольких гетероатомов, выбранных из N, O и S. Репрезентативные примеры включают пиперидинил, пиперазинил, азепанил, пирролидинил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, морфолинил, тиоморфолинил, тиазолидинил, изотиазолидинил и тетрагидрофурил (или тетрагидрофуранил).
Гетероароматические группы образуют еще одну подгруппу гетероциклов; т.е. термин "гетероароматический" (альтернативно “гетероарил”), как правило, относится к гетероциклу, как он определен выше, в котором вся кольцевая система (моно- или полициклическая) представляет собой ароматическую кольцевую систему. Термин "гетероароматическое кольцо" относится к 5- или 6-членному моноциклическому ароматическому кольцу или 7 - 12-членное бициклической кольцевой системе, которая состоит из атомов углерода и одного или нескольких гетероатомов, выбранных из N, O и S. Для бициклического гетероарила только одно из колец обязательно должно быть гетероароматическим, второе кольцо может представлять собой гетероароматический или ароматический, насыщенный или частично ненасыщенный карбоцикл, и точка(точки) присоединения к остальной части молекулы может быть на любом кольце. В случае замещенных гетероарильных колец, содержащих по меньшей мере один атом азота (например, пиридин), такие замещения могут представлять собой замещения, приводящие к образованию N-оксида. Примеры гетероарила включают, но не ограничиваются этим, фуранил, тиенил (или тиофенил), пирролил, имидазолил, пиразолил, оксазолил, тиазолил, изоксазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, хинолинил, изохинолинил, нафтиридинил, бензотиенил, бензофуранил, бензимидазол, бензпиразолил, индолил, изоиндолил, индолизинил, индазолил, пуринил, хинолизинил, фталазинил, хиноксалинил, хиназолинил, бензоксазолил, бензизоксазолил, 5,6,7,8-тетрагидрохинолинил, имидазо[1,2-a]пиридинил, имидазо[1,2-a]пиримидинил, 5,6-дигидропирролo[1,2-b]пиразолил, пирролo[3,2-c]пиридинил, пирролo[2,3-b]пиридинил, тиенo[2,3-b]пирролил, фуропиридин и тиенoпиридин.
Репрезентативные примеры бициклических гетероциклов включают бензотриазолил, индолил, изоиндолил, индазолил, индолинил, изоиндолинил, хиноксалинил, хиназолинил, циннолинил, хроманил, изохроманил, тетрагидрохинолинил, хинолинил, тетрагидроизохинолинил, изохинолинил, 2,3-дигидробензофуранил, 2,3-дигидробензо-1,4-диоксинил (т.е.  ), имидазо(2,1-b)(1,3)тиазол, (т.е.
), имидазо(2,1-b)(1,3)тиазол, (т.е.  ) и бензо-1,3-диоксолил (т.е.
) и бензо-1,3-диоксолил (т.е.  ). В некоторых контекстах настоящего описания,
). В некоторых контекстах настоящего описания,  альтернативно указан как фенил, содержащий в качестве заместителя метилендиокси, связанный с двумя смежными атомами углерода.
альтернативно указан как фенил, содержащий в качестве заместителя метилендиокси, связанный с двумя смежными атомами углерода.
Неограничивающие примеры замещенные гетероарилы включают: изоиндолинон, изоиндолин-1-он, 2,3-дигидро-1H-пиразоло[4,3-c]пиридин-4(5H)-он, 2,3,4,5-тетрагидробензо[d]изотиазол 1,1-диоксид и 2,3,4,5-тетрагидробензо[b]тиофен 1,1-диоксид.
"Гидроксиалкил" относится к алкильной группе, описанной выше, в которой один или несколько (в частности, от 1 до 3) атомов водорода замещены гидрокси группами. Примеры включают CH2OH, CH2CHOH и CHOHCH3.
"Алкилен", "алкенилен", "алкинилен", "циклоалкилен", "арилен", "гетероарилен" и "гетероциклилен" относятся к двухвалентному радикалу, полученному путем удаления одного атома водорода из алкильной, алкенильной, алкинильной, циклоалкильной, арильной, гетероарильной и гетероциклильной группы, соответственно, каждая из которых определена выше.
Если только определенно не указано иное, “ненасыщенное” кольцо представляет собой частично или полностью ненасыщенное кольцо. Например, “ненасыщенный моноциклический C6 карбоцикл” относится к циклогексену, циклогексадиену и бензолу.
Если только определенно не указано иное, все диапазоны, указанные в настоящей заявке, являются инклюзивными. Например, гетероцикл, описанный как содержащий от "1 до 4 гетероатомов", означает, что гетероцикл может содержать 1, 2, 3 или 4 гетероатома.
Когда какая-либо переменная встречается более одного раза в любом составляющем элементе или в любой формуле, предстапвляющей и описывающей соединения по настоящему изобретению, ее определение в каждом случае ее присутствия является независимым от ее определения в каждом другом случае ее присутствия. Также, комбинации заместителей и/или переменных допустимы только в том случае, если такие комбинации приводят к стабильным соединениям.
Термин “сульфамоил” представляет собой суффикс для обозначения радикалов, образованных из сульфамида, таких как -SO2NH2, -SO2NHR и -SO2N(RR1).
Термин “сульфонимидоил” представляет собой суффикс для обозначения радикала  , где R представляет собой C(1-10) алкил, арил, гетероарил, циклоалкил, гетероциклоалкил и т.п., такие как, например, метил, этил, изопропил и пропил.
, где R представляет собой C(1-10) алкил, арил, гетероарил, циклоалкил, гетероциклоалкил и т.п., такие как, например, метил, этил, изопропил и пропил.
Термин "замещенный" (например, как в “ариле, который необязательно замещен одним или несколькими заместителями ...”) включает моно- и поли-замещение указанным заместителем в той степени, в которой такое моно- и поли-замещение (включая полизамещение в одном и том же положении) является химически возможным.
Термин "окси" означает атом кислорода (O). Термин "тио" означает атом серы (S). Термин "оксо" означает “=O”. Термин “карбонил” означает “C=O.”
Когда какая-либо переменная (например, R2, R3 и т.д.) встречается более одного раза в любом заместителе или в Формуле I, ее определение в каждом случае ее присутствия является независимым от ее определения в каждом другом случае ее присутствия. Также, комбинации заместителей и/или переменных допустимы только в том случае, если такие комбинации приводят к стабильным соединениям.
В соответствии со стандартной номенклатурой, испоьзуемой в описании настоящего изобретения, сначала описывают концевую часть указанной боковой цепи, с последующим описанием смежной функциональной группы по направлению к точке присоединения. Например, C1-5 алкилкарбониламино C1-6 алкильный заместитель эквивалентен  .
.
При выборе соединений по настоящему изобретению, среднему специалисту в данной области будет понятно, что различные заместители, т.е. R1, R2, R3 и т.д., следует выбирать в соответствии с хорошо известными принципами связности химических структур.
Линии, проведенные к кольцевым системам от заместителей, показывают, что указанная связь может быть присоединена к любому из кольцевых атомов, которые могут быть замещены. Когда кольцевая система является полициклической, предполагается, что связь должны быть присоединена к любому из подходящих атомов углерода только на проксимальном кольце.
Должно быть понятно, что заместители и картины замещения в соединениях по настоящему изобретению может выбрать средний специалист в данной области для получения соединений, которые являются химически стабильными, и которые легко можно синтезировать способами, известными в данной области техники, а также способами, описанными ниже, из легко доступных исходных веществ. Когда заместитель сам является замещенным более чем одной группой, должно быть понятно, что эти несколько групп могут присутствовать на одном и том же углероде или на разных атомах углерода, при условии, что это приводит к стабильной структуре. Фразу “необязательно замещен одним или несколькими заместителями” следует рассматривать как эквивалентную фразе “необязательно замещен по меньшей мере одним заместителем”, и в таких случаях один вариант осуществления будет включать от нуля до трех заместителей.
Структурные представления соединений, содержащих заместители с метильной группой на конце, могут представлять концевую метильную группу либо с использованием символов “CH3”, например, “-CH3”, либо с использованием прямой линии, указывающей присутствие метильной группы, например,  , т.е.
, т.е.  и
и  имеют эквивалентные значения.
имеют эквивалентные значения.
Для определений переменных, содержащих термины, включающие повторяющиеся термины, например, (CRiRj)r, где R представляет собой целое число 2, Ri представляет собой имеющую определенное значение переменную, и Rj представляет собой имеющую определенное значение переменную, значение Ri может быть разным в каждом случае присутствия этой переменной, и значение Rj может быть разным в каждом случае присутствия этой переменной. Например, когда Ri и Rj независимо выбраны из группы, состоящей из метила, этила, пропила и бутила, тогда (CRiRj)2 может представлять собой

"Пациент" включает как человека, так и животных.
“Млекопитающее” означает человека и других млекопитающих животных.
“Терапевтически эффективное количество” означает такое количество лекарственного средства или фармацевтического средства, которое будет вызывать биологический или медицинский ответ ткани, системы, животного или человека, получение которого добивается исследователь, ветеринар, лечащий врач или другой клиницист.
Термин “лечение” или “лечить” включает облегчение, уменьшение тяжести, ослабление или другое уменьшение признаков и симптомов, связанных с заболеванием или расстройством.
Термин "композиция", как в фармацевтической композиции, предназначен для охвата продукта, включающего активный ингредиент(ингредиенты) и инертный ингредиент(ингредиенты) (фармацевтически приемлемые эксципиенты), который представляет собой носитель, а также любой продукт, который является результатом, прямым или опосредованным, комбинации, комплексообразования или агрегации любых двух или более ингредиентов или диссоциации одного или нескольких ингредиентов или других типов реакций или взаимодействий одного или нескольких ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению охватывают любую композицию, полученную путем смешивания соединения формулы I и фармацевтически приемлемых эксципиентов.
Термин “необязательно замещенный” означает “незамещенный или замещенный”, и поэтому общие структурные формулы, описанные в настоящей заявке, охватывают соединения, содержащие указанный необязательный заместитель, а также соединения, которые не содержат необязательный заместитель.
Каждая переменная независимо определяется в каждом случае ее присутствия в пределах определений общей структурной формулы. Например, когда присутствует более чем один заместитель для арила/гетероарила, каждый заместитель независимо выбран в каждом случае его присутствия, и каждый заместитель может иметь такое же или отличное от другого(других) значение. В качестве еще одного примера, для группы -(CR3R3)2-, в каждом случае, когда присутствуют две R3 группы, они могут быть одинаковыми или отличными друг от друга. Как используется в настоящей заявке, если только четко не указано иное, каждая ссылка на конкретное соединение по настоящему изобретению или общую формулу соединений по настоящему изобретению предполагает включение соединения(соединений), а также его(их) фармацевтически приемлемых солей.
В одном варианте осуществления изобретения, A выбран из фенила, метила, этила, пиридинила, циклобутила, циклопропила, циклопропилметила, дигидроизоиндолила, дигидробензизотиазолила, дигидроинденила, изоиндолила, дигидро[b]тиофенила, 2,3-дигидробензо[d]изотиазол-1,1-диоксида 1-оксо-2,3-дигидро-1H-индена и 1,1-диоксидо-2,3-дигидробензо[b]тиофена.
В одном варианте осуществления изобретения, A выбран из: фенила, метила, этила, циклопропилметила, циклопропила, циклобутила, изоиндолинила, бензо[d]тиазолила,  , 2,3-дигидро-1H-инденила, хинолинила, пиридинила и индолинила.
, 2,3-дигидро-1H-инденила, хинолинила, пиридинила и индолинила.
В одном варианте этого варианта осуществления, A выбран из: метила, этила, циклопропилметила, циклопропила и циклобутила,
В другом варианте, A выбран из изоиндолинила, бензо[d]тиазолила 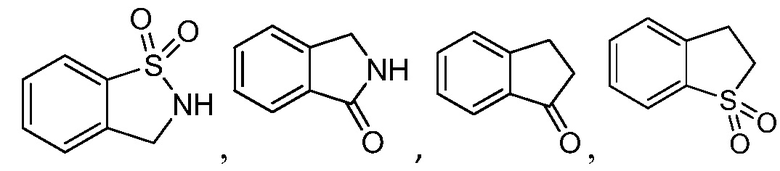 , 2,3-дигидро-1H-инденила, хинолинила, пиридинила и индолинила.
, 2,3-дигидро-1H-инденила, хинолинила, пиридинила и индолинила.
В одном варианте осуществления изобретения, R2 и R3, каждый независимо, выбраны из водорода, метила, этила, пропила и гидроксила. В одном варианте этого варианта осуществления, R2 и R3 каждый представляют собой водород.
В другом варианте осуществления, R2 и R3 объединяются вместе с атомом углерода, с которым они связаны, с образованием 3 - 6-членного кольца.
В одном варианте осуществления изобретения,  формулы I, где p имеет значение 0, 1, 2, 3 или 4; n имеет значение 0, 1, 2, 3 или 4; и два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо, выбран из: пиперидинила, азетидинила, тетрагидропиранила, тетрагидро-2H-пиранила, циклогексила, циклопентила, тетрагидрофуранила и 1,4-диоксаспиро[4.5]деканила
формулы I, где p имеет значение 0, 1, 2, 3 или 4; n имеет значение 0, 1, 2, 3 или 4; и два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо, выбран из: пиперидинила, азетидинила, тетрагидропиранила, тетрагидро-2H-пиранила, циклогексила, циклопентила, тетрагидрофуранила и 1,4-диоксаспиро[4.5]деканила
В другом варианте осуществления,  формулы I, где p имеет значение 0,1, 2, 3 или 4; n имеет значение 0, 1, 2, 3 или 4, выбран из циклогексила, пиперидинила, тетрагидропиранила, циклопентила, тетрагидрофуранила и азетидинила.
формулы I, где p имеет значение 0,1, 2, 3 или 4; n имеет значение 0, 1, 2, 3 или 4, выбран из циклогексила, пиперидинила, тетрагидропиранила, циклопентила, тетрагидрофуранила и азетидинила.
В одном варианте осуществления изобретения, n имеет значение 0, 1, 2, 3 или 4. В одном варианте осуществления изобретения, n имеет значение 0, 1, 2 или 3. В одном варианте этого варианта осуществления, n имеет значение 0, 1 или 2.
В одном варианте осуществления изобретения, m имеет значение 0, 1, 2, 3 или 4. В одном варианте осуществления изобретения, m имеет значение 0, 1, 2 или 3. В одном варианте этого варианта осуществления, m имеет значение 0, 1 или 2.
В одном варианте осуществления изобретения, p имеет значение 1, 2, 3 или 4.
В одном варианте осуществления изобретения, p имеет значение 0, 1, 2 или 3. В одном варианте этого варианта осуществления, p имеет значение 1, 2 или 3.
В одном варианте осуществления изобретения, R4 выбран из: галогена, оксо (=O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, C1-10 алкиламино(карбонил)0-1C0-10алкила, (C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10алкила, (C1-10)гетероалкиламино(карбонил)0-1C0-10алкила, C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила, арил C0-10 алкиламиноC0-10 алкила, гетероарил C0-10 алкиламиноC0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила, C0-10 алкилсульфонила, (C3-12)циклоалкилC0-10алкилсульфонила, (C3-12)циклогетероалкилC0-10алкилсульфонила, -SO2NH2, -SO2NH(C1-6алкил), -SO2N(C1-6алкил)2, C0-10 алкилсульфонимидоилC0-10 алкила, C1-10 гетероалкилсульфонимидоилC0-10 алкила, (C1-10 алкил)1-2амино, -CO2(C0-10 алкил), -SO2CF3, -SO2CF2H, -SO2CH2CF3, гидрокси, -(C1-10 алкил)OH, C1-10 алкоксиC0-10 алкила, циано, (C1-6алкил)циано и C1-6галогеналкила, где R4 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6, и два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо.
В одном варианте этого варианта осуществления, R4 выбран из: галогена, оксо (=O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, C1-10 алкиламино(карбонил)0-1C0-10алкила, C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила, арил C0-10 алкиламиноC0-10 алкила, C0-10 алкилсульфонила, (C3-12)циклоалкилC0-10алкилсульфонила, (C1-10 алкил)1-2амино, -SO2CH2CF3, гидрокси, -(C1-10 алкил)OH, C1-10 алкоксиC0-10 алкил и C1-6галогеналкила, где R4 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6, и два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо.
В одном варианте этого варианта осуществления, R4 выбран из трет-бутилкарбонила, метоксикарбонила, метилкарбонила, циклопропилметила, циклопропилметилкарбонила, циклопропилэтилкарбонила, циклопропилкарбонила, циклобутилкарбонила, циклопентилоксикарбонила, изопропилоксикарбонила, фенилметила, фенилпропила, фенилметилкарбонила, фенилэтилкарбонила, фенилоксикарбонила, фенилкарбонила, оксазолилметила, 1,3-оксазолилметила, индолилметила, 1-фенилэтила, пиридинилметила, циклогексилкарбонила, фтор, 2,2,2-трифторэтила, этила, 2-гидроксиэтила, неопентилкарбонила, неопентилоксикарбонила, этилкарбонила, этилоксикарбонила, метоксиметилкарбонил (метиламино)метилкарбонила, 2,3-дигидро-1H-инденилкарбонила, пирролидинилметилкарбонила, тетрагидро-2H-пиранилкарбонила, тетрагидро-2H-тиопиранилоксикарбонила, тетрагидро-2H-пиранилоксикарбонила, 1-(пиридинил)этилоксикарбонила, адамантилкарбонила, тетрагидрофуранилоксикарбонила, трифторэтилсульфонила, диметиламино, трет-бутилоксикарбонила, метила, трет-бутиламинокарбонила, аминокарбонила, азетидинила, циклогексиламино, оксо, гидрокси, метиламинокарбонила, циклопропилсульфонила, метокси, фениламино, пиридинила, гидроксиизопропила, гидроксиэт-2-ила, трифторметила, 2-(метилтио)эт-2-илкарбонила, метилсульфонила, этилкарбонила, метиламино, изопропилоксикарбонил и гидроксиизопропил; где R4 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6, и где два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо.
В одном варианте осуществления, R5 выбран из: галогена, оксо (=O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкиламинокарбонилC0-10алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, -SF5, C0-10 алкилсульфонила, C1-10 гетероалкилсульфонила, (C3-12)циклоалкилC0-10алкилсульфонила, (C3-12)циклогетероалкилC0-10алкилсульфонила, C0-10 алкилсульфамоила, (C3-12)циклоалкилC0-10 алкилсульфамоила, (C3-12)циклогетероалкилC0-10 алкилсульфамоила, гетероарилC0-10 алкилсульфамоила, C0-10 алкилсульфонимидоилC0-10 алкила, C1-10 гетероалкилсульфонимидоилC0-10 алкила, -SO2NH2, -SO2NH(C1-6алкил), -SO2N(C1-6алкил)2, арилC0-10 алкилсульфамоила, (C1-10 алкил)1-2амино, -SO2CF3, -SO2CF2H, -SO2CH2CF3, гидрокси, -(C1-10 алкил)OH, C1-10 алкоксиC0-10 алкила, циано, (C1-6алкил)циано и C1-6галогеналкила; где R5 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6.
В другом варианте осуществления, R5 выбран из: галогена, оксо (=O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкиламинокарбонилC0-10алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, -SF5, C0-10 алкилсульфонила, C1-10 гетероалкилсульфонила, (C3-12)циклоалкилC0-10алкилсульфонила, (C3-12)циклогетероалкилC0-10алкилсульфонила, C0-10 алкилсульфамоила, (C3-12)циклоалкилC0-10 алкилсульфамоила, (C3-12)циклогетероалкилC0-10 алкилсульфамоила, гетероарилC0-10 алкилсульфамоила, C0-10 алкилсульфонимидоилC0-10 алкила, C1-10 гетероалкилсульфонимидоилC0-10 алкила, -SO2NH2, -SO2NH(C1-6алкил), -SO2N(C1-6алкил)2, арилC0-10 алкилсульфамоила, (C1-10 алкил)1-2амино, -SO2CF3, -SO2CF2H, -SO2CH2CF3, гидрокси, -(C1-10 алкил)OH, C1-10 алкоксиC0-10 алкила, циано, (C1-6алкил)циано и C1-6галогеналкила; и где R5 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6.
В одном варианте осуществления, где R5 выбран из: оксо, трифторметила, метоксикарбонила, фтора, диметилсульфамоила, гидроксиэтила, сульфамоила, трифторэтила, метилсульфонила, метила, пентафторсульфанила, 2,2,2-трифторэтила, трет-бутила, (трифторметил)сульфонила, метиламино, трет-бутилсульфамоила, изопропилсульфонила, трет-бутилсульфамоила, пиразолилметила, триазолилметила, 1,2,3-триазолилметила, изобутила, циклопропилметила, этила, циклопентилметила, изопропилсульфамоила, бензилсульфамоила, (циклопропилметил)сульфамоила, (метоксиэтил)сульфамоила, циклогексилсульфамоила, пиперидинилсульфонила, морфолинoсульфонила, дифторметилсульфонила, хлора и метокси; где R5 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6.
В другом варианте осуществления R5 выбран из: метоксикарбонила, трет-бутилсульфонила, трет-бутилсульфамоила, трет-бутил(метил)сульфамоила, трет-бутил(этил)сульфамоила, пентафторсульфанила, метокси, диметиламино, оксо, амино, фтор, изобутила, изопропила, сульфамоила, диметилсульфамоила, метилсульфонила, этилсульфонила, трифторметилсульфонила, трет-бутилоксикарбонил(1-метил)этила, диэтилсульфамоила, этилсульфамоила, пирролидинилсульфонила, метила, трет-бутиламинометила, метиламинокарбонила, метиламинометила, этила, (1-гидрокси)этила, пиперидинилсульфонила, пиперидинила, тиоморфолинилкарбонила, тиазолидинилкарбонила, тиоморфолинилметила, пирролидинилкарбонила, пиперидинилкарбонила, этиламинокарбонила, морфолинилкарбонила, трет-бутила, циклопентилметила, циклогексила, циклогексилсульфонила, циклогексилсульфамоила, циклопентила, циклопентилсульфонила, бензила, гидроксиметила, 8-окса-3-азабицикло[3.2.1]октанила, 8-окса-3-азабицикло[3.2.1]октан-3карбонила, 3-окса-8-азабицикло[3.2.1]октан-8-илкарбонила, этоксикарбонил(диметилэт-2-ил), гидрокси, трифторметила, азетидинилсульфонила, циклопропилсульфонила, циклопропила, хлор, этиламинометила, пирролидинилметила, 1-пирролидин-1-илэтила, циклопропилметила, пиразолилметила, морфолинилсульфонила, изопропиламинометила, пиразолила, пирролидинила, метилсульфонила, изопропилсульфонила, изопропилсульфамоила, метилсульфамоила, бензилсульфамоила, циклопропилметила, циклобутила, трет-бутилсульфонила, трет-бутилоксикарбонила, трет-бутилоксикарбонилметила, метоксиметила, 2-окса-5-азабицикло[2.2.1]гептан-5-карбонила, метоксиэт-2-ила, триазолилметила, 1,2,3-триазолилметила, аминометила, этиламинометила, аминокарбонила, морфолинила, изопропила, изопропил(метил)сульфамоила, сульфонила, циано, 2,2,2-трифторэтила, этиламинокарбонила, трет-бутиламинометила, изопропилоксикарбонил(диметилэт-2-ил), 1,1,1-трифтор-3,3-диметилбут-2-ила, (1,1,2-триметилпропил)сульфонила, (1,1-диметилпропил)сульфонила, изопропилсульфонимидоил метилсульфонила, этилкарбонила, 2,3-дигидро-1H-инденила, этилметилсульфамоила, неопентила, метиламинометил диметиламино, 2-(изопропиламино)пропан-2-ила, 2,2-диметилпропила, гидроксиметила, гидроксиэт-2-ила, трет-бутилоксикарбонил(2-метилпроп-2-ил), метокси, этиламинокарбонила, метиламинокарбонила и метоксиметила; и где R5 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6.
В одном варианте осуществления, R6 независимо выбран из: галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 алкил(карбонил)0-1оксиC0-10 алкила, ((C0-10)алкил)1-2аминокарбонилокси, C0-10алкилсульфонила, - CO2(C0-10 алкил), -(C0-10 алкил)CO2H, оксо (=O), -SO2NH2, -SO2NH(C1-6алкил), -SO2N(C1-6алкил)2,-SO2CF3, -SO2CF2H, амино, (C0-10 алкил)1-2 амино, гидрокси, (C1-10 алкил)OH, C1-10 алкоксиC0-10 алкила, циано и C1-6галогеналкила.
В одном варианте осуществления, R6 независимо выбран из: галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, оксо (=O), C0-10алкилсульфонила, амино, гидрокси, C1-10 алкоксиC0-10 алкила, циано и C1-6галогеналкила, где R6 необязательно замещен 1, 2 или 3 заместителями R7
В другом варианте осуществления, R6 независимо выбран из: трифторметила, 2,2,2-трифторэтила, амино, метила, фтор, метокси, трет-бутила, этила, трет-бутилоксикарбонил(1-метил)этила, этоксикарбонила, трет-бутилоксикарбонилметила, фенила, трифторэтила, циклопропила, оксо, трет-бутилоксикарбонила, изопропила, циано, изопропилокси, изоксазолила, пирролидинила, хлора, метилтио, метилсульфонила, иода и брома; где R6 необязательно замещен 1, 2 или 3 заместителями R7.
В одном варианте осуществления, R7 выбран из водорода, гидрокси, (C1-6)алкила, галогена, трифторметила, трифторэтила, C1-10 алкилсульфонила, оксо (O=), -SO2CF3, -SO2CF2H и NH2. В одном варианте этого варианта осуществления R7 выбран из водорода и оксо (O=).
В одном варианте осуществления, часть формулы I,  выбрана из:
выбрана из:  и
и  ; где R2 представляет собой водород; Q имеет значение 0, 1, 2 или 3; R4a представляет собой OH, C(1-4) алкил, оксо или галоген; pb независимо имеет значение 0, 1, 2, 3 или 4; и Z имеет значение 0, 1 или 2, при условии, что сумма Q и Z меньше чем или равна 4; R4 выбран из трет-бутилкарбонила, метоксикарбонила, метилкарбонила, циклопропилметила, циклопропилметилкарбонила, циклопропилэтилкарбонила, циклопропилкарбонила, циклобутилкарбонила, циклопентилоксикарбонила, изопропилоксикарбонила, фенилметила, фенилпропила, фенилметилкарбонила, фенилэтилкарбонила, фенилоксикарбонила, фенилкарбонила, оксазолилметила, 1,3-оксазолилметила, индолилметила, 1-фенилэтила, пиридинилметила, циклогексилкарбонила, фтор, 2,2,2-трифторэтила, этила, 2-гидроксиэтила, неопентилкарбонила, неопентилоксикарбонила, этилкарбонила, этилоксикарбонила, метоксиметилкарбонил (метиламино)метилкарбонила, 2,3-дигидро-1H-инденилкарбонила, пирролидинилметилкарбонила, тетрагидро-2H-пиранилкарбонила, тетрагидро-2H-тиопиранилоксикарбонила, тетрагидро-2H-пиранилоксикарбонила, 1-(пиридинил)этилоксикарбонила, адамантилкарбонила, тетрагидрофуранилоксикарбонила, трифторэтилсульфонила, диметиламино, трет-бутилоксикарбонила, метила, трет-бутиламинокарбонила, аминокарбонила, азетидинила, циклогексиламино, оксо, гидрокси, метиламинокарбонила, циклопропилсульфонила, метокси, фениламино, пиридинила, карбонила, гидроксиизопропила, гидроксиэт-2-ила, трифторметила, 2-(метилтио)эт-2-илкарбонила, метилсульфонила, этилкарбонила, метиламино, изопропилоксикарбонила и гидроксиизопропила; где R4 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6, и R6 выбран из водорода и оксо. В одном варианте этого варианта осуществления, Q имеет значение 0, и R6 представляет собой оксо.
; где R2 представляет собой водород; Q имеет значение 0, 1, 2 или 3; R4a представляет собой OH, C(1-4) алкил, оксо или галоген; pb независимо имеет значение 0, 1, 2, 3 или 4; и Z имеет значение 0, 1 или 2, при условии, что сумма Q и Z меньше чем или равна 4; R4 выбран из трет-бутилкарбонила, метоксикарбонила, метилкарбонила, циклопропилметила, циклопропилметилкарбонила, циклопропилэтилкарбонила, циклопропилкарбонила, циклобутилкарбонила, циклопентилоксикарбонила, изопропилоксикарбонила, фенилметила, фенилпропила, фенилметилкарбонила, фенилэтилкарбонила, фенилоксикарбонила, фенилкарбонила, оксазолилметила, 1,3-оксазолилметила, индолилметила, 1-фенилэтила, пиридинилметила, циклогексилкарбонила, фтор, 2,2,2-трифторэтила, этила, 2-гидроксиэтила, неопентилкарбонила, неопентилоксикарбонила, этилкарбонила, этилоксикарбонила, метоксиметилкарбонил (метиламино)метилкарбонила, 2,3-дигидро-1H-инденилкарбонила, пирролидинилметилкарбонила, тетрагидро-2H-пиранилкарбонила, тетрагидро-2H-тиопиранилоксикарбонила, тетрагидро-2H-пиранилоксикарбонила, 1-(пиридинил)этилоксикарбонила, адамантилкарбонила, тетрагидрофуранилоксикарбонила, трифторэтилсульфонила, диметиламино, трет-бутилоксикарбонила, метила, трет-бутиламинокарбонила, аминокарбонила, азетидинила, циклогексиламино, оксо, гидрокси, метиламинокарбонила, циклопропилсульфонила, метокси, фениламино, пиридинила, карбонила, гидроксиизопропила, гидроксиэт-2-ила, трифторметила, 2-(метилтио)эт-2-илкарбонила, метилсульфонила, этилкарбонила, метиламино, изопропилоксикарбонила и гидроксиизопропила; где R4 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6, и R6 выбран из водорода и оксо. В одном варианте этого варианта осуществления, Q имеет значение 0, и R6 представляет собой оксо.
В другом варианте осуществления изобретения, часть формулы I,  выбран из:
выбран из:  ; и t имеет значение 0, 1, 2 или 3; m имеет значение 0, 1 или 2; и R5a выбран из галогена, метила, этила, оксо, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила и (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила; при условии, что сумма t плюс m меньше чем или равна 4.
; и t имеет значение 0, 1, 2 или 3; m имеет значение 0, 1 или 2; и R5a выбран из галогена, метила, этила, оксо, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила и (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила; при условии, что сумма t плюс m меньше чем или равна 4.
В одном варианте этого варианта осуществления, R5a выбран из галогена, метила, этила, оксо и гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, и R5 выбран из: метоксикарбонила, трет-бутилсульфонила, трет-бутилсульфамоила, трет-бутил(метил)сульфамоила, трет-бутил(этил)сульфамоила, пентафторсульфанила, метокси, диметиламино, оксо, амино, фтора, изобутила, изопропила, сульфамоила, диметилсульфамоила, метилсульфонила, этилсульфонила, трифторметилсульфонила, трет-бутилоксикарбонил(1-метил)этила, диэтилсульфамоила, этилсульфамоила, пирролидинилсульфонила, метила, трет-бутиламинометила, метиламинокарбонила, метиламинометила, этила, (1-гидрокси)этила, пиперидинилсульфонила, пиперидинила, тиоморфолинилкарбонила, тиазолидинилкарбонила, тиоморфолинилметила, пирролидинилкарбонила, пиперидинилкарбонила, этиламинокарбонила, морфолинилкарбонила, трет-бутила, циклопентилметила, циклогексила, циклогексилсульфонила, циклогексилсульфамоила, циклопентила, циклопентилсульфонила, бензила, гидроксиметила, 8-окса-3-азабицикло[3.2.1]октанила, 8-окса-3-азабицикло[3.2.1]октан-3карбонила, 3-окса-8-азабицикло[3.2.1]октан-8-илкарбонила, этоксикарбонил(диметилэт-2-ил), гидрокси, трифторметила, азетидинилсульфонила, циклопропилсульфонила, циклопропила, хлора, этиламинометила, пирролидинилметила, 1-пирролидин-1-илэтила, циклопропилметила, пиразолилметила, морфолинилсульфонила, изопропиламинометила, пиразолила, пирролидинила, метилсульфонила, изопропилсульфонила, изопропилсульфамоила, метилсульфамоила, бензилсульфамоила, циклопропилметила, циклобутила, трет-бутилсульфонила, трет-бутилоксикарбонила, трет-бутилоксикарбонилметила, метоксиметила, 2-окса-5-азабицикло[2.2.1]гептан-5-карбонила, метоксиэт-2-ила, триазолилметила, 1,2,3-триазолилметила, аминометила, этиламинометила, аминокарбонила, морфолинила, изопропила, изопропил(метил)сульфамоила, сульфонила, циано, 2,2,2-трифторэтила, этиламинокарбонила, трет-бутиламинометила, изопропилоксикарбонил(диметилэт-2-ил), 1,1,1-трифтор-3,3-диметилбут-2-ила, (1,1,2-триметилпропил)сульфонила, (1,1-диметилпропил)сульфонила, изопропилсульфонимидоил метилсульфонила, этилкарбонила, 2,3-дигидро-1H-инденила, этилметилсульфамоила, неопентила, метиламинометил диметиламино, 2-(изопропиламино)пропан-2-ила, 2,2-диметилпропила, гидроксиметила, гидроксиэт-2-ила, трет-бутилоксикарбонил(2-метилпроп-2-ил), метокси, этиламинокарбонила, метиламинокарбонила и метоксиметила; и где R5 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6.
В одном варианте осуществления изобретения обеспечивает соединения формулы I или их фармацевтически приемлемые соли или стереоизомеры:

A выбран из арила, гетероарила, циклоалкилC(0-10)алкила, C1-6алкила;
R2 и R3, каждый независимо, выбраны из водорода, C1-4алкила и гидроксила, где R2 и R3, необязательно, могут вместе с атомом углерода, с которым они связаны, образовывать 3 - 6-членное кольцо;
X1 представляет собой C;
X2, X3 и X4, каждый независимо, выбраны из O, N, S и C, и при условии, что образованная кольцевая система содержит 0, 1, 2 или 3 атома, выбранных из O, N и S;
n имеет значение 0, 1, 2, 3 или 4;
m имеет значение 0, 1, 2, 3 или 4;
p имеет значение 0, 1, 2, 3 или 4;
R4 выбран из:
галогена,
оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C0-10 алкиламино(окси)0-1(карбонил)0-1C0-10 алкила,
(C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10алкила,
(C1-10)гетероалкиламино(окси)0-1(карбонил)0-1C0-10алкила,
C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила,
арил C0-10 алкиламиноC0-10 алкила,
гетероарил C0-10 алкиламиноC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила,
сульфонила,
C1-10 алкилсульфонила,
C1-10 гетероалкилсульфонила,
(C3-12)циклоалкилC0-10алкилсульфонила,
(C3-12)циклогетероалкилC0-10алкилсульфонила,
гетероарилC0-10 алкилсульфонила,
арилC0-10 алкилсульфонила,
-SO2NH2,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)2,
C1-10 алкилсульфамоила,
C1-10 гетероалкилсульфамоила,
(C3-12)циклоалкилC0-10 алкилсульфамоила,
(C3-12)циклогетероалкилC0-10 алкилсульфамоила,
гетероарилC0-10 алкилсульфамоила,
арилC0-10 алкилсульфамоила,
(C0-10 алкил)1-2 амино,
- CO2(C0-10 алкил),
-(C0-10 алкил) CO2H,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинила,
C1-4ациламиноC0-10 алкила,
гидрокси,
-(C1-10 алкил)OH,
-C0-10 алкилалкокси,
циано,
(C1-6алкил)циано и
C1-6галогеналкила,
где два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо;
R5 выбран из:
галогена,
оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
(C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила,
арил C0-10 алкиламиноC0-10 алкила,
гетероарил C0-10 алкиламиноC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила,
-SF5,
C1-10 алкилсульфонила,
C1-10 гетероалкилсульфонила,
(C3-12)циклоалкилC0-10алкилсульфонила,
(C3-12)циклогетероалкилC0-10алкилсульфонила,
гетероарилC0-10 алкилсульфонила,
арилC0-10 алкилсульфонила,
C0-10 алкилсульфамоила,
C1-10 гетероалкилсульфамоила,
(C3-12)циклоалкилC0-10 алкилсульфамоила,
(C3-12)циклогетероалкилC0-10 алкилсульфамоила,
гетероарилC0-10 алкилсульфамоила,
-SO2NH2,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)2,
арилC0-10 алкилсульфамоила,
(C0-10 алкил)1-2 амино,
- CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинила,
C1-4ациламиноC0-10 алкила,
гидрокси,
-(C1-10 алкил)OH,
C0-10 алкилалкокси,
циано,
(C1-6алкил)циано и
C1-6галогеналкила; и
где R4 и R5, каждый, необязательно замещен 1, 2, 3 или 4 заместителями R6, и R6 независимо выбран из:
галогена,
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 алкил(карбонил)0-1оксиC0-10 алкила,
C2-10 алкенил(карбонил)0-1оксиC0-10 алкила,
C1-10 гетероалкил(карбонил)0-1оксиC0-10 алкила,
арил C0-10 алкил(карбонил)0-1оксиC0-10 алкила,
(C3-12)циклоалкил C0-10 алкил(карбонил)0-1оксиC0-10 алкила,
гетероарил C0-10 алкил(карбонил)0-1оксиC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(карбонил)0-1оксиC0-10 алкила,
((C0-10)алкил)1-2аминокарбонилокси,
арил (C0-10)алкил аминокарбонилокси,
- CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
оксо (=O),
C1-10 алкилсульфонила,
C1-10 гетероалкилсульфонила,
(C3-12) циклоалкилсульфонила,
(C3-12) циклогетероалкилсульфонила,
гетероарилсульфонила,
арилсульфонила,
аминосульфонила,
-SO2NH2,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)2,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинила,
амино,
(C0-10 алкил)1-2 амино,
-(окси)0-1(карбонил)0-1N(C0-10 алкил)1-2
C1-4ациламиноC0-10 алкила,
гидрокси,
(C1-10 алкил)OH,
C1-10 алкокси,
(C1-10 алкил)циано,
циано и
C1-6галогеналкила; и
R6 необязательно замещен 1, 2 или 3 заместителями, выбранными из водорода, гидрокси, (C1-6)алкила, (C1-6)алкокси, (C1-10 алкил)OH, галогена, CO2H, -(C0-6)алкилCN, -O(C=O) C1-C6 алкила, NO2, трифторметокси, трифторэтокси, трифторметила, трифторэтила, -N-C(O)O(C0-6)алкила, C1-10 алкилсульфонила, оксо (O=), аминосульфонила, -SO2C1-6алкила, -SO2CF3, -SO2CF2H, - C1-10 алкилсульфинила, -O(0-1)(C1-10)галогена, -SO2NH2, -SO2NH(C1-6алкил), -SO2N(C1-6алкил)2, алкила, амино(C1-6алкил)0-2 и NH2.
Оптические изомеры - Диастереомеры - Геометрические изомеры - Таутомеры
Соединения формулы I содержат один или несколько асимметричных центров, и таким образом, могут существовать в виде рацематов и рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Предполагается, что настоящее изобретение охватывает все такие изомерные формы соединений формулы I, либо в виде отдельных изомеров, либо в виде их смесей.
Некоторые соединения, описанные в настоящей заявке, содержат олефиновые двойные связи, и если не указано иное, предполагается, что они включают как E, так и Z геометрические изомеры.
Некоторые соединения, описанные в настоящей заявке, могут существовать с различными точками присоединения водорода, и их называют таутомерами. Таким примером может быть кетон и его енольная форма, известные как кето-енольные таутомеры. Индивидуальные таутомеры, а также их смесь охватываеются соединениями формулы I.
Специальные варианты осуществления настоящего изобретения включают соединение, которое выбрано из группы, состоящей из соединений примеров, представленных в настоящей заявке, или фармацевтически приемлемое соли такого соединения.
Соединения по настоящему изобретению могут содержать один или несколько асимметричных центров, таким образом, могут существовать в виде "стереоизомеров", включая рацематы и рацемические смеси, энантиомерные смеси, отдельные энантиомеры, диастереомерные смеси и индивидуальные диастереомеры. Дополнительные асимметричные центры могут присутствовать в зависимости от природы различных заместителей в молекуле. Каждый такой асимметричный центр независимо будет образовывать два оптических изомера, и предполагается, что все возможные оптические изомеры и диастереомеры в виде смесей и в виде чистых или частично очищенных соединений включены в объем настоящего изобретения. Предполагается, что настоящее изобретение охватывает все такие изомерные формы этих соединений. Когда связи с хиральным углеродом показаны в виде прямых линий в формулах в соответствии с настоящим изобретением, должно быть понятно, что как (R), так и (S) конфигурации хирального углерода и следовательно, оба энантиомера и их смеси охватываются такой формулой. Например, Формула I показывает структуру класса соединений без специфической стереохимии. Когда соединения по настоящему изобретению содержат один хиральный центр, термин "стереоизомер" включает оба энантиомера и смеси энантиомеров, такие как специфические 50:50 смеси, называемые рацемическими смесями.
Соединения формулы (I) могут содержать асимметричные или хиральные центры, и поэтому существуют в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений формулы (I), а также их смеси, включая рацемические смеси, образуют часть настоящего изобретения. Кроме того, настоящее изобретение охватывает все геометрические и позиционные изомеры. Например, когда соединение формулы (I) включает двойную связь или конденсированное кольцо, обе цис- и транс- формы, а также смеси охватываются объемом настоящего изобретения.
Диастереомерные смеси можно разделить на их индивидуальные диастереомеры на основании их физико-химических различий способами, хорошо известными специалистам в данной области, такими как, например, хроматография и/или фракционная кристаллизация. Энантиомеры можно разделить путем преобразования энантиомерной смеси в диастереомерную смесь путем взаимодействия с подходящим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделения диастереомеров и преобразования (например, гидролиз) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Также, некоторые соединения формулы (I) могут представлять собой атропизомеры (например, замещенные биарилы), и считаются частью настоящего изобретения. Энантиомеры также можно разделить с использованием хиральной ВЭЖХ колонки.
Также возможно, что соединения формулы (I) могут существовать в различных таутомерных формах, и все такие формы охватываются объемом настоящего изобретения. Также, например, все кето-енольные и имин-енаминовые формы соединений включены в изобретение.
Все стереоизомеры (например, геометрические изомеры, оптические изомеры и подобные) соединений по настоящему изобретению (включая такие формы солей, сольватов, сложных эфиров и пролекарств соединений, а также солей, сольватов и сложных эфиров пролекарств), например, которые могут существовать, благодаря асимметричным атомам углерода на различных заместителях, включая энантиомерные формы (которые могут существовать даже в отсутствие асимметричных атомов углерода), ротамерные формы, атропизомеры и диастереомерные формы, охватываются объемом настоящего изобретения, также как и позиционные изомеры (такие как, например, 4-пиридил и 3-пиридил). Например, когда соединение формулы (I) включает двойную связь или конденсированное кольцо, как цис-, так и транс-формы, а также их смеси охватываются объемом настоящего изобретения. Также, например, все кето-енольные и имин-енаминовые формы соединений включены в изобретение. Индивидуальные стереоизомеры соединений по настоящему изобретению могут быть, например, по существу свободными от других изомеров или могут быть смешаны, например, в виде рацематов или со всеми другими или другими выбранными стереоизомерами. Хиральные центры в соответствии с настоящим изобретением могут иметь S или R конфигурацию, как это определяется в соответствии с рекомендациями IUPAC 1974. Предполагается, что использование терминов "соль", "сольват", “сложный эфир”, "пролекарство" и подобных равным образом относится к соли, сольвату, сложному эфиру и пролекарству энантиомеров, стереоизомеров, ротамеров, таутомеров, позиционных изомеров, рацематов или пролекарств соединений по настоящему изобретению.
В настоящей заявке, когда конкретное стереомерное соединение названо с использованием "и" в стереомерном обозначении, например, трет-бутил-(3R,4S и 3S,4R)-4-(цианометил)-3-метил-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат, "и" указывает рацемическую смесь энантиомеров. То есть, индивидуальные энантиомеры не были индивидуально выделены.
Когда стереомерная номенклатура включает "или", например, трет-бутил-4-(цианометил)-4-[4-оксо-3-({4-[(1R или 1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат, "или" указывает, что хиральное разделение рацемата на индивидуальные энантиомеры было осуществлено, но при этом необязательно была определена действительная оптическая активность конкретного энантиомера.
Независимый синтез этих диастереомеров или их хроматографические разделения можно осуществить, как это известно в данной области техники, при помощи подходящей модификации процедур, раскрытых в настоящей заявке. Их абсолютную стереохимию можно определить при помощи рентгеновского кристаллографического анализа кристаллических продуктов или кристаллических промежуточных соединений, которые дериватизируют, если это необходимо, при помощи реагента, содержащего асимметричный центр известной абсолютной конфигурации. Если желательно, рацемические смеси соединений можно разделить таким образом, чтобы выделить индивидуальные энантиомеры. Разделение можно осуществить способами, хорошо известными в данной области техники, такими как взаимодействие рацемической смеси соединений с энантиомерно чистым соединением с образованием диастереомерной смеси, с последующим разделением индивидуальных диастереомеров стандартными способами, такими как фракционная кристаллизация или хроматография. Реакция связывания часто представляет собой реакцию образования солей с использованием энантиомерно чистой кислоты или основания. Диастереомерные производные затем могут быть преобразованы в чистые энантиомеры путем отщепления присоединенного хирального остатка. Рацемическую смесь соединений также можно разделить непосредственно хроматографическими способами с использованием хиральных стационарных фаз, и такие способы хорошо известны в данной области техники. Альтернативно, любой энантиомер соединения может быть получен путем стереоселективного синтеза с использованием оптически чистых исходных веществ или реагентов известной конфигурации способами, хорошо известными в данной области техники.
Соль
Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований, включая неорганические основания и органические основания. Соли, образованные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия, цинка и подобные. Особенно предпочтительными являются аммониевые, кальциевые, магниевые, калиевые и натриевые соли. Соли, образованные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и оснóвные ионообменные смолы, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этил-морфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и подобные.
Когда соединение по настоящему изобретению является щелочным, соли можно получить из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромистоводородную, хлористоводородную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую кислоту, 1-гидрокси-2-нафтойную кислоту (ксинафоат) и подобные. Особенно предпочтительными являются лимонная, бромистоводородная, хлористоводородная, малеиновая, фосфорная, серная и винная кислоты.
Должно быть понятно, что, если не указано иное, ссылки на соединение формулы I, его подгруппы, его варианты осуществления, а также специфические соединения предполагают также включение фармацевтически приемлемых солей и стереоизомеров такого соединения.
Кроме того, некоторые из кристаллических форм для соединений по настоящему изобретению могут существовать в виде полиморфов, и предполагается, что все такие формы включены в настоящее изобретение. Кроме того, некоторые соединения по настоящему изобретению могут образовывать сольваты с водой (гидраты) или традиционными органическими растворителями. Такие сольваты охватываеются объемом настоящего изобретения.
Меченые соединения
В соединениях общей Формулы I, атомы могут демонстрировать их природную изотопную распространенность, или один или несколько атомов могут быть искусственно обогащены определенным изотопом, имеющим такой же атомный номер, но атомную массу или массовое число отличные от атомной массы или массового числа, преимущественно присутствующих в природе. Предполагается, что настоящее изобретение включают все подходящие изотопные варианты соединений общей Формулы I. Например, различные изотопные формы водорода (H) включают протий (1H) и дейтерий (2H). Протий является преобладающим изотопом водорода, обнаруженным в природе. Обогащение дейтерием может дать некоторые терапевтические преимущества, такие как увеличение периода полужизни in vivo или снижение уровня необходимых доз, или может обеспечить соединение, полезное в качестве стандарта для характеризации биологических образцов. Изотопно-обогащенные соединения, охватываемые общей Формулой I, можно получить без излишнего экспериментирования традиционными способами, хорошо известными специалистам в данной области, или способами, аналогичными тем, которые описаны на схемах и в примерах в настоящей заявке, с использованием подходящих изотопно-обогащенных реагентов и/или промежуточных соединений.
Полезность
Соединение формулы I или его фармацевтически приемлемые соли и фармацевтические композиции можно использовать для лечения или профилактики ряда состояний или заболеваний, опосредованных Janus киназами, в частности, заболеваний или состояний, которые можно облегчить путем ингибирования Janus киназы, такой как JAK1, JAK2, JAK3 или TYK2. Такие состояния и заболевания включают, но не ограничиваются этим, следующие:
(1) артрит, включая ревматоидный артрит, ювенильный артрит и псориатический артрит; (2) астма и другие обструктивные заболевания дыхательных путей, включая хроническую астму, астму с поздним началом, сверхчувствительность дыхательных путей, бронхит, бронхиальную астму, аллергическую астму, наследственную бронхиальную астму, приобретенную бронхиальную астму, астматическую реакцию на пыль, рецидивирующую обструкцию дыхательных путей и хроническое обструктивное легочное заболевание, включая эмфизему; (3) аутоиммунные заболевания или расстройства, включая такие, которые определяются как аутоиммунные расстройства одного органа или одного типа клеток, например, тиреоидит Хашимото, аутоиммунная гемолитическая анемия, аутоиммунный атрофический гастрит со злокачественной анемией, аутоиммунный энцефаломиелит, аутоиммунн орхит, болезнь Гудпасчура, аутоиммунная тромбоцитопения, симпатетическая офтальмия, злокачественаня миастения, болезнь Грейвса, первичный билиарный цирроз, хронический агрессивный гепатит, язвенный колит и мембранозная гломерулопатия, расстройства, которые определяются как включающие системное аутоиммунное расстройство, например, системная красная волчанка, ревматоидный артрит, синдром Шегрена, синдром Рейтера, полимиозит-дерматомиозит, системный склероз, нодозный полиартериит, рассеянный склероз и буллезный пемфигоид, и дополнительные аутоиммунные заболевания, которые могут быть B-клеточного (гуморального) типа или Т-клеточного типа, включая такие, как синдром Когана, анкилозирующий спондилоартрит, грануломатоз Вегенера, аутоиммунная алопеция, диабет I типа или ювенильный диабет и тиреоидит; (4) раковые или опухолевые заболевания, включая алиментарный/желудочно-кишечный рак, рак толстой кишки, рак печени, рак кожи, включая тучно-клеточную опухоль и сквамозно-клеточную карциному, рак груди и молочной железы, рак яичника, рак предстательной железы, лимфому, лейкоз, включая острый миелогенный лейкоз и хронический миелогенный лейкоз, рак почки, рак легкого, мышечный рак, рак кости, рак мочевого пузыря, рак головного мозга, меланому, включая оральную и метастатическую меланому, саркому Капоши, миеломы, включая множественную миелому, миелопролиферативные расстройства, пролиферативную диабетическую ретинопатию и ангиогенно-ассоциируемые расстройства, включая солидные опухоли; (5) диабет, включая Диабет I типа и осложнения диабета; (6) глазные заболевания, расстройства или состояния, в том числе аутоиммунные заболевания глаз, кератоконъюнктивит, весенний конъюнктивит, увеит, включая увеит, связанный с болезнью Бехета, и индуцируемый линзами увеит, кератит, герпетический кератит, конический кератит, корнеальная эпителиальная дистрофия, кератолейкома, офтальмический пемфигус, разъедающая язва роговицы, склерит, офтальмопатия Грейва, синдром Фогта-Коянаги-Харада, сухой кератоконъюнктивит (сухой глаз), фликтенула, иридоциклит, саркоидоз, эндокринная офтальмопатия, симпатетический офтальмит, аллергический конъюнктивит и глазная неоваскуляризация; (7) кишечные воспаления, аллергии или состояния, включающие болезнь Крона и/или язвенный колит, воспалительное заболевание кишечника, заболевания брюшной полости, проктит, эозинофильный гастроэнтерит и мастоцитоз; (8) нейродегенеративные заболевания, включая мотонейронную болезнь, болезнь Альцгеймера, болезнь Паркинсона, амиотрофический боковой склероз, болезнь Гентингтона, церебральную ишемию или нейродегенеративное заболевание в результате травматического поражения, удара, глутаматной нейротоксичности или гипоксии; ишемическое/реперфузионное поражение при ударе, ишемическом поражении миокарда, почечной ишемии, сердечных приступах, гипертрофии сердва, атеросклерозе и артериосклерозе, гипоксии органов и агрегации тромбоцитов; (9) кожные заболевания, состояния или расстройства, включая атопический дерматит, экзему, псориаз, склеродерму, зуд и другие вызывающие зуд состояния; (10) аллергические реакции, включая анафилаксию, аллергический ринит, аллергический дерматит, аллергическую крапивницу, ангиоэдему, аллергическую астму или аллергическую реакцию на укусы насекомых, пищу, лекарственные средства или пыльцу; (11) отторжение трансплантата, включая отторжение трансплантата панкреатических островков, отторжение трансплантата костного мозга, болезнь трансплантат-против-хозяина, отторжение трансплантатов органов и клеток, таких как костный мозг, хрящ, роговица, сердце, межпозвоночный диск, островок, почка, конечность, печень, легкое, мышца, миобласт, нерв, поджелудочная железа, кожа, тонкий кишечник или трахея, и ксенотрансплантатa.
Соответственно, еще один аспект настоящего изобретения обеспечивает способ лечения или профилактики JAK-опосредованного заболевания или расстройства, включающий введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I. В одном варианте осуществления такие заболевания включают астму и ревматоидный артрит.
Еще один аспект настоящего изобретения обеспечивает применение соединения формулы I для получения лекарственного средства для лечения или профилактики JAK-опосредованного заболевания или расстройства.
Один аспект настоящего изобретения включает применение соединения формулы I или его фармацевтически приемлемой соли или стереоизомера для получения лекарственного средства для лечения заболевания или a расстройства, которое можно облегчить путем ингибирования Janus киназ JAK1 и JAK2.
Еще один аспект настоящего изобретения включает применение соединения формулы I или его фармацевтически приемлемой соли или стереоизомера и второго активного средства для получения лекарственного средства для лечения заболевания или расстройства, которое можно облегчить путем ингибирования Janus киназ JAK1 и JAK2.
Диапазоны доз
Размер профилактической или терапевтической дозы соединения формулы I, конечно, варьируется в зависимости от природы и тяжести состояния, подлежащего лечению, и от конкретного соединения формулы I и пути его введения. Он также варьируется в зависимости от различных факторов, включая возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, скорость экскреции, комбинацию лекарственных средств и ответ индивидуального пациента. Как правило, суточная доза составляет от около 0,001 мг до около 100 мг на кг массы тела млекопитающего, предпочтительно от 0,01 мг до около 10 мг на кг. С другой стороны, в некоторых случаях могут быть необходимы дозы вне этих пределов.
Количество активного ингредиента, которое можно объединять с веществами-носителями для получения лекарственной формы в виде разовой дозы, варьируется в зависимости от хозяина, которого лечат, и конкретного способа введения. Например, композиция, предназначенная для перорального введения человеку, может содержать от 0,05 мг до 5 г активного вещества, смешанного с подходящим и удобным количеством вещества-носителя, которое может варьироваться от около 5 до около 99,95 процентов в расчете на общую массу композиции. В некоторых случаях, стандартные лекарственные формы могут содержать от около 0,05 до около 3 г активного ингредиента. Стандартные лекарственные формы, как правило, содержат от около 0,1 мг до около 0,4 г активного ингредиента, типично 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 1 мг, 2 мг, 5 мг, 10 мг, 25 мг, 50 мг, 100 мг, 200 мг или 400 мг.
Фармацевтические композиции
Еще один аспект настоящего изобретения обеспечивает фармацевтические композиции, включающие соединение формулы I с фармацевтически приемлемым носителем. Для лечения любого из простаноид-опосредованных заболеваний соединения формулы I можно вводить перорально, при помощи спрея для ингаляции, местным путем, парентерально или ректально в стандартных лекарственных формах, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители. Термин “парентеральный”, как он используется в настоящей заявке, включает подкожные инъекции, внутривенные, внутримышечные, интрастернальные инъекции или введения при помощи инфузии. Помимо лечения теплокровных животных, таких как мыши, крысы, лошади, крупный рогатый скот, овцы, собаки, кошки и т.д., соединение по настоящему изобретению является эффективным для лечения человека.
Фармацевтические композиции, содержащие активный ингредиент, могут быть в форме, подходящей для перорального применения, например, в виде таблеток, пастилок, лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального применения, можно получить в соответствии с любым способом известн из уровня техники для получения фармацевтических композиций, и такие композиции могут содержать одно или несколько веществ, выбранных из группы, состоящей из подсластителей, отдушек, красителей и консервантов, для получения фармацевтически элегантных и имеющих приятный вкус препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые являются подходящими для получения таблеток. Эти эксципиенты могут, например, представлять собой инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие вещества и разрыхлители, например, кукурузный крахмал или альгиновая кислота; связующие, например, крахмал, желатин или аравийская камедь, и смазывающие вещества, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без покрытия, или они могут иметь покрытие, нанесенное известными методами, для замедления разложения и абсорбции в желудочно-кишечном тракте и, таким образом, обеспечения непрерывного действия в течение более продолжительного периода времени. Например, можно использовать замедляющие действие вещества, такие как глицерилмоностеарат или глицерилдистеарат. Они также могут иметь покрытие, нанесенное способами, описанными в Патентах США №№ 4256108; 4166452; и 4265874, для получения осмотических терапевтических таблеток для контроля высвобождения.
Композиции для перорального применения также могут быть представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где где активный ингредиент смешан со смешиваемыми с водой растворителями, такими как пропиленгликоль, ПЭГ и этанол, или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активное вещество в смеси с эксципиентами, подходящими для получения водных суспензий. Такие эксципиенты представляют собой суспендирующие вещества, например, натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, камедь трагаканта и gum аравийская камедь; диспергирующие или смачивающие вещества могут представлять собой природные фосфатиды, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, образованными из жирных кислот и гексита, такие как полиоксиэтиленсорбитолмоноолеат, или продукты конденсации этиленоксида с неполными сложными эфирами, образованными из из жирных кислот и ангидридов гексита, например, полиэтиленсорбитанмоноолеат. Водные суспензии также могут содержать один или несколько консервантов, например, этил- или н-пропил-п-гидроксибензоат, один или несколько красителей, одну или несколько отдушек и один или несколько подсластителей, таких как сахароза, сахарин или аспартам.
Масляные суспензии могут быть сформулированы путем суспендирования активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Можно добавить подсластители, такие как вещества, указанные выше, и отдушки для получения приятного на вкус перорального препарата. Эти композиции можно хранить при добавлении антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии путем добавления воды, обеспечивают активный ингредиент в смеси с диспергирующим или смачивающим веществом, суспендирующим веществом и одним или несколькими консервантами. Подходящие примеры диспергирующих или смачивающих веществ и суспендирующих веществ включают вещества, которые были указаны выше. Дополнительные эксципиенты, например, подсластители, отдушки и красители, также могут присутствовать.
Фармацевтические композиции по настоящему изобретению также могут быть в форме эмульсии масло-в-воде. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин, или смеси таких веществ. Подходящие эмульгаторы могут представлять собой природные фосфатиды, например, соя, лецитин и сложные эфиры или неполные сложные эфиры, являющиеся производными жирных кислот и гекситангидридов, например, сорбитанмоноолеат, и продукты конденсации указанных неполных сложных эфиров с этиленоксидом, например, полиоксиэтиленсорбитанмоноолеат. Эмульсии также могут содержать подсластители и отдушки.
Сиропы и эликсиры могут быть сформулированы с подсластителями, например, с глицерином, пропиленгликолем, сорбитом или сахарозой. Такие композиции также могут содержать мягчительное средство, консервант и отдушку и красители. Фармацевтические композиции могут быть в форме стерильной водной или масляной суспензии для инъекций. Такая суспензия может быть сформулирована в соответствии со способом, известным из уровня техники, с использованием таких подходящих диспергирующих или смачивающих веществ и суспендирующих веществ, которые были указаны выше. Стерильный препарат для инъекций также может представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально-приемлемом разбавителе или растворителе, например, раствор в 1,3-бутандиоле. Из приемлемых носителей и растворителей, которые можно использовать, можно указать воду, раствор Рингера и изотонический раствор хлорида натрия. Также можно использовать со-растворители, такие как этанол, пропиленгликоль или полиэтиленгликоли. Кроме того, стерильные нелетучие масла традиционно используют в качестве растворителя или среды для суспендирования. Для этих целей можно использовать любое светлое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, можно использовать в препаратах для инъекций.
Лекарственные формы для введения путем ингаляции для удобства могут быть сформулированы в виде аэрозолей или сухих порошков. Для композиций, подходящих и/или адаптированных для введения путем ингаляции, предпочтительно, когда активное веществ присутствует в форме частиц уменьшенного размера, и более предпочтительно, чтобы форма с уменьшенным размером частиц была получена, или могла быть получена, методом тонкого измельчения.
В одном варианте осуществления медицинский препарат адаптирован для применения с находящимся под давлением дозирующим ингалятором (pMDI), который высвобождает отмеренную дозу лекарственного средства при каждом приведении в действие. Композиция для pMDIs может быть в форме растворов или суспензий в галогенированных углеводородных пропеллентах. Тип пропеллента, используемого в pMDIs, предпочтительно представляет собой гидрофторалканы (HFAs), также известные как гидрофторуглероды (HFCs). В частности, 1,1,1,2-тетрафторэтан (HFA 134a) и 1,1,1,2,3,3,3-гептафторпропан (HFA 227) используют в некоторых имеющихся на рынке фармацевтических продуктах для ингаляции. Композиция может включать другие фармацевтически приемлемые эксципиенты для ингаляци, такие как этанол, олеиновая кислота, поливинилпирролидон и подобные.
Находящиеся под давлением MDIs типично включают два компонента. Во-первых, компонент, представляющий собой аэрозольный баллон, в котором частицы лекарственного средства хранятся под давлением в форме суспензии или раствора. Во-вторых, компонент, представляющий собой приемный резервуар, используемый как вмещающий в себя и приводящий в действие аэрозольный баллон. Типично, аэрозольный баллон содержит несколько доз композиции, хотя также можно использовать аэрозольные баллоны, содержащие разовую дозу. Компонент, представляющий собой аэрозольный баллон, типично включает выпускной клапан, из которого можно выпускать содержимое аэрозольного баллона. Аэрозольный препарат дозируют из pMDI путем приложения силы к аэрозольному баллону, проталкивая его в приемный резервуар, открывая при этом выпускной клапан и вызывая продвижение частиц лекарственного средства из выпускного клапана через приемный резервуар и их выпуск из выпускного отверстия приемного резервуара. При выпуске из аэрозольного баллона частицы лекарственного средства "распыляются", образуя аэрозоль. Предполагается, что пациент координирует выпуск распыляемого лекарственного средства с его или ее вдыханием так, чтобы частицы лекарственного средства захватывалисть потоком, вдыхаемым пациентом, и передавались в легкие. Типично, в pMDIs используют пропелленты для сжатия содержимого аэрозольного баллона и продвижения частиц лекарственного средства из выпускного отверстия приемного резервуара. В pMDIs композиция лекарственного средства обеспечивается в форме жидкости или суспензии, и она находится внутри контейнера вместе с пропеллентом. Пропеллент может иметь различные формы. Например, пропеллент может включать сжатый газ или сжиженный газ.
В другом варианте осуществления медицинский препарат адаптирован для применения с ингалятором сухого порошка (DPI). Композиция для ингаляции, подходящая для применения в DPIs, типично включает частицы активного ингредиента и частицы фармацевтически приемлемого носителя. Размер частиц активного вещества может варьироваться от около 0,1 мкм до около 10 мкм; однако для эффективной доставки в дистальное легкое, по меньшей мере 95 процентов частиц активного вещества имеют размер 5 мкм или меньше. Каждое из активных веществ может присутствовать в концентрации 0,01 - 99%. Типично, однако, когда каждое из активных веществ присутствует в концентрации от около 0,05 до 50%, более типично около 0,2 - 20% в расчете на общую массу композиции.
Как указано выше, помимо активных ингредиентов, порошок для ингаляции предпочтительно включает фармацевтически приемлемый носитель, который может состоять из любого фармакологически инертного вещества или комбинации веществ, которая является приемлемой для ингаляции. Предпочтительно, частицы носителя состоят из одного или нескольких кристаллических сахаров; частицы носителя могут состоять из одного или нескольких сахарных спиртов или полиолов. Предпочтительно, частицы носителя представляют собой частицы декстрозы или лактозы, особенно предпочтительно - лактозы. В вариантах осуществления настоящего изобретения, в которых используют традиционные ингаляторы сухого порошка, такие как Handihaler, Rotohaler, Diskhaler, Twisthaler и Turbohaler, размер частиц носителя может находиться в пределах от около 10 микрон до около 1000 микрон. В некоторых из этих вариантов осуществления размер частиц носителя может находиться в пределах от около 20 микрон до около 120 микрон. В некоторых других вариантах осуществления размер по меньшей мере 90% масс. частиц носителя составляет меньше чем 1000 микрон и предпочтительно находится в пределах от 60 микрон до 1000 микрон. Относительно большой размер этих частиц носителя обеспечивает хорошие характеристики текучести и захвата. Когда присутствует носитель, количество частиц носителя, как правило, составляет до 95%, например, до 90%, предпочтительно до 80%, и предпочтительно до 50% масс. в расчете на общую массу порошка. Количество любого тонкоизмельченного эксципиента, если он присутствует, может составлять до 50%, и предпочтительно до 30%, в частности, до 20% масс. в расчете на общую массу порошка. Порошок, необязательно, может содержать модифицирующую добавку, такую как L-лейцин или другая аминокислота, и/или соли металлов и стеариновой кислоты, такий как стеарат магния или кальция.
Соединения формулы I также можно вводить в форме суппозиториев для ректального введения лекарственного средства. Эти композиции можно получить путем смешивания лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при температуре окружающей среды, но жидким при ректальной температуре, и поэтому будет плавиться в прямой кишке с высвобождением лекарственного средства. Такие вещества представляют собой масло какао и полиэтиленгликоли.
Для местного применения используют кремы, мази, гели, растворы или суспензии и т.д., содержащие соединение формулы I. (Для целей настоящей заявки, местное применение должно включать растворы или жидкости для полоскания рта или горла). Композиции для местного применения, как правило, могут включать фармацевтический носитель, со-растворитель, эмульгатор, усилитель пенетрации, систему консерванта и смягчающее вещество.
Комбинации с другими лекарственными средствами
Для лечения и профилактики JAK-опосредованных заболеваний, соединение формулы I можно вводить совместно с другими терапевтическими средствами. Таким образом, еще в одном аспекте настоящее изобретение обеспечивает фармацевтические композиции для лечения JAK-опосредованных заболеваний, включающие терапевтически эффективное количество соединения формулы I и одного или нескольких других терапевтических средств. В частности, для лечения воспалительных заболеваний, ревматоидного артрита, псориаза, воспалительного заболевания кишечника, ХОБЛ, астмы и аллергического ринита соединение формулы I можно использовать в комбинации со средствами, такими как: (1) ингибиторы TNF-α, такие как Remicade® и Enbrel®); (2) неселективные ингибиторы COX-I/COX-2 (такие как пироксикам, диклофенак, пропионовые кислоты, такие как напроксен, флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, такие как мефенамовая кислота, индометацин, сулиндак, апазон, пиразолоны, такие как фенилбутазон, салицилаты, такие как аспирин); (3) ингибиторы COX-2 (такие как мелоксикам, целекоксиб, рофекоксиб, валдекоксиб и эторикоксиб); (4) другие средства для лечения ревматоидного артрита, включая низкие дозы метотрексата, лефуномид, циклесонид, гидроксихлорохин, d-пеницилламин, ауранофин или парентеральные или пероральные препараты золота; (5) ингибитор биосинтеза лейкотриенов, ингибитор 5-липоксигеназы (5-LO) или антагонист 5-липоксигеназа-активирующего белка (FLAP), такой как зилеутон; (6) антагонист LTD4 рецептора, такой как зафирлукаст, монтелукаст и пранлукаст; (7) ингибитор PDE4, такой как рофлумиласт; (8) антагонисты антигистаминового H1 рецептора, такие как цетиризин, лоратадин, деслоратадин, фексофенадин, астемизол, азеластин и хлорфенирамин; (9) агонист α1- и α2-адренорецептора, представляющий собой сосудосуживающее симпатомиметическое средство, такое как пропилгекседрин, фенилэфрин, фенилпропаноламин, псевдоэфедрин, нафазолин гидрохлорид, оксиметазолин гидрохлорид, тетрагидрозолин гидрохлорид, ксилометазолин гидрохлорид и этилнорэпинефрин гидрохлорид; (10) антихолинергические средства, такие как ипратропиум бромид, тиотропиум бромид, окситропиум бромид, аклиндиниум бромид, гликопирролат, пирензепин и телензепин; (11) агонисты β-адренорецептора, такие как метапротеренол, изопротеренол, изопреналин, албутерол, салбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерол мезилат и пирбутерол или метилксантанины, включая теофиллин и аминофиллин, натрий кромогликат; (12) миметик инсулино-подобного фактора роста типа I (IGF-l); (13) глюкокортикоидное средство для ингаляции с уменьшенными системными побочными эффектами, такое как преднизон, преднизолон, флунисолид, триамцинолон ацетонид, беклометазон дипропионат, будесонид, флутиказон пропионат, циклесонид и мометазон фуроат.
СХЕМЫ И ПРИМЕРЫ
Аббревиатуры, используемые в настоящей заявке, имеют следующие указанные в таблице значения. Аббревиатуры, не представленные в таблице ниже, имеют широко известные значения, если только специально не указано иное.
Аббревиатуры, используемые для алкильных групп
СПОСОБЫ СИНТЕЗА
Соединения по настоящему изобретению можно получить в соответствии со следующими общими схемами с использованием подходящих веществ, и далее они проиллюстрированы следующими конкретными примерами. Соединения, проиллюстрированные в примерах, не следует рассматривать как образующие единственный род, который считается изобретением. Иллюстративные Примеры, представленные ниже, поэтому не ограничиваются перечисленными соединениями или какими-либо конкретными заместителями, используемыми для иллюстративных целей. Нумерация заместителей, как показано на схемах, необязательно соответствует той, которую используют в формуле изобретения, и часто, для ясности, показан один заместитель, присоединенный к соединению, там, где, в соответствии с определениями настоящего изобретения, представленными в настоящей заявке выше, возможны несколько заместителей.
Специалистам в данной области легко будет понятно, что можно использовать известные варианты условий и способов осуществления описанных ниже процедур для получения этих соединений. Изобретение далее будет проиллюстрировано в следующих неограничивающих примерах, в которых, если не указано иное:
Все реакции перемешивали (механически, с использованием стержня/пластины для перемешивания или при встряхивании) и осуществляли в инертной атмосфере азота или аргона, если специфиально не указано иное.
Все исходные вещества, используемые для получения промежуточных соединений и конечных соединений, описанных в настоящей заявке, были получены из коммерческих источников и использованы в том виде, как они были получены.
Все температуры указаны в градусах Цельсия(°C), если не указано иное.
Температура окружающей среды равна 15-25°C.
Большинство соединений очищали методом обращенно-фазовой препаративной ВЭЖХ, ЖХСД на силикагеле, СКЖХ, перекристаллизации и/или swish (суспендирование в растворителе с последующим фильтрованием твердого вещества).
Ход реакций отслеживали методом тонкослойной хроматографии (ТСХ) и/или ЖХ/МС и/или ЯМР, и время реакции представлено только для иллюстрации.
Все конечные продукты анализировали методом ЯМР и ЖХ/МС.
Промежуточные соединения анализировали методом ЯМР и/или ТСХ и/или ЖХ/МС.
Способ 1
Общие процедуры для получения промежуточных соединений по настоящему изобретению описаны на Схеме 1. Необязательно замещенные алкилальдегиды или кетоны I подергают конденсации с диэтил(цианометил)фосфонатом в присутствии подходящего основания, такого как трет-бутоксид калия, гидроксид калия, гидрид натрия или триэтиламин/LiBr, с получением замещенных акрилонитрилов II, используемых в качестве промежуточных соединений в синтезе примеров по настоящему изобретению.
СХЕМА 1

Способ 2
Общие процедуры для получения промежуточных соединений по настоящему изобретению описаны на Схеме 2. На Схеме 2, сумма n + m может составлять 1, 2, 3 или 4. Необязательно замещенные карбамат-защищенные гетероциклические кетоны III подергают конденсации с диэтил (цианометил)фосфонатом или другим подходящим цианоалкилфосфонатом в присутствии подходящего основания, такого как трет-бутоксид калия или TEA/LiBr, с получением необязательно замещенных акрилонитрилов IV, используемых в качестве промежуточных соединений в синтезе примеров по настоящему изобретению.
СХЕМА 2
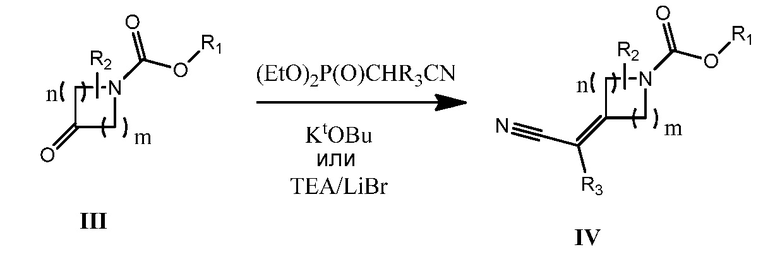
Способ 3
Общие процедуры для получения промежуточных соединений по настоящему изобретению описаны на Схеме 3. Карбамат-защищенные необязательно замещенные акрилонитрилы IV подвергают процедуре удаления защиты в присутствии подходящей кислоты, такой как TFA или HCl, с образованием промежуточных аминосоединений V, которые подвергают дальнейшей дериватизации с образованием сульфонамидов VI, карбаматов VII, N-арилированных промежуточных соединений VIII или амидов IX. Сульфонамидные производные VI получают путем взаимодействия необязательно замещенных акрилонитрилов, у которых удалена защита, с необязательно замещенными сульфонилхлоридами в подходящем растворителе, таком как DCM, с использованием подходящего основания, такого как DIPEA. Карбаматные производные VII получают путем взаимодействия необязательно замещенных акрилонитрилов, у которых удалена защита, с дважды активированным карбонильным эквивалентном, таким как DSC или трифосген, и необязательно замещенными спиртами в присутствии подходящего основания, такого как TEA. Альтернативно, карбаматные производные VII можно получить путем взаимодействия амина и активированной карбамоильной группы, такой как алкилхлорформиат, в присутствии подходящего основания, такого как 2,6-лутидин, DIPEA или TEA, в подходящем растворителе, таком как DCM. N-арилированные производные VIII получают путем взаимодействия необязательно замещенных акрилонитрилов, у которых удалена защита, с необязательно замещенными электронно-дефицитными арилгалогенидами с использованием подходящего основания, такого как TEA, в растворителе, таком как DMF или NMP, при температуре 120°C или около этого. Амидные производные IX получают путем взаимодействия необязательно замещенных акрилонитрилов, у которых удалена защита, с необязательно замещенными карбоновыми кислотами в присутствии подходящего связующего агента, такого как EDC, CDI или HATU, в присутствии подходящего основания, такого как TEA или основания Хунига. Альтернативно, амидные производные IX в некоторых случаях можно получить с использованием активированного ацилирующего реагента, такого как хлорангидрид кислоты вместо карбоновой кислоты.
СХЕМА 3

Способ 4
Общие процедуры для получения промежуточных соединений по настоящему изобретению описаны на Схеме 4. С использованием подходящего основания, такого как DBU, в подходящем растворителе, таком как MeCN, EtOH, n-BuOH или t-BuOH, при температуре в пределах 25-110°C либо незащищенный пиразолопиридон X либо защищенный пиразолопиридон XI можно подвергнуть реакции присоединения конъюгата к необязательно замещенным акрилонитрилам с получением алкилированных незащищенных пиразолопиридонов XII или защищенных пиразолопиридонов XIII, промежуточного соединения в синтезе примеров по настоящему изобретению. Удаление защиты у соединения XIII для получения свободного алкилированного пиридона XII затем можно осуществить либо с использованием подходящей кислоты, такой как TFA, либо в условиях гидрогенолиза с использованием Pd на углероде при давлении приблизительно 1 атмосфера водорода, в подходящем растворителе, таком как EtOAc, EtOH, MeOH, или с использованием омбинации таких растворителей.
СХЕМА 4

Способ 5
Общие процедуры для получения примеров по настоящему изобретению описаны на Схеме 5. Алкилированные 3-амино пиразолопиримидины XIII (R2 =H) подвергают реакции перекрестного связывания с арил- и гетероарилгалогенидами XIV с использованием подходящей каталитической системы палладий-лиганд, такой как Pd2(dba)3 или Pd2(dba)3⋅CHCl3 и 2-ди-трет-бутилфосфино-2′,4′,6′-триизопропилбифенил (t-Bu XPhos) или ди-трет-бутил[3,4,5,6-тетраметил-2',4',6'-три(пропан-2-ил)бифенил-2-ил]фосфан (Me4 tBu-XPhos) или 2-дициклогексилфосфино-2′,4′,6′-триизопропилбифенил (XPhos). Типичные условия включают использование 1-2 эквивалентнов арил/гетероарил галогенида в расчете на пиразолопиримидин с нагрузкой 10-25% Pd пред-катализатора, с использованием отношения Pd:лиганд приблизительно от 1:2 до 1:2,5. Типично, реакцию перекрестного связывания осуществляют с использованием либо 2-пропанола либо трет-амилового спирта в качестве растворителей и 1-3,1 эквивалентов KOAc или K3PO4 основания. Реакции типично осуществляют при температуре 65-90°C, с получением промежуточных соединений XV по настоящему изобретению.
СХЕМА 5

Способ 6
Общие процедуры для получения примеров по настоящему изобретению описаны на Схеме 6. Карбамат-содержащие с удаленной защитой пиразолопиридоны XVII подвергают процедуре удаления защиты в присутствии подходящей кислоты, такой как TFA или HBF4⋅OEt2, с образованием промежуточных аминосоединений XVIII, которые подвергают дальнейшей дериватизации с образованием сульфонамидов IXX, карбаматов XX, третичных аминов XXI, N-арилированных промежуточных соединений XXII или амидов XXIII. Сульфонамидные производные IXX получают путем взаимодействия необязательно замещенных акрилонитрилов, у которых удалена защита, с необязательно замещенными сульфонилхлоридами в подходящем растворителе, таком как DCM, с использованием подходящего основания, такого как DIPEA или TEA. Карбаматные производные XX получают путем взаимодействия необязательно замещенных акрилонитрилов, у которых удалена защита, с дважды активированным карбонильным эквивалентном, таким как DSC или трифосген, и необязательно замещенными спиртами в присутствии подходящего основания, такого как DIPEA или TEA. Альтернативно, карбаматные производные XX можно получить путем взаимодействия амина и активированной карбамоильной группы, такой как алкилхлорформиат, в присутствии подходящего основания, такого как 2,6-лутидин, DIPEA или TEA, в подходящем растворителе, таком как DCM. Третичные аминовые производные XXI можно получить путем взаимодействия амина и подходящего карбонил-содержащего соединения, такого как альдегид или кетон, в присутствии подходящего кислотного катализатора, такого как TFA, и подходящего восстановителя, такого как триацетоксиборогидрид натрия. N-арилированные производные XXII получают путем взаимодействия необязательно замещенных акрилонитрилов, у которых удалена защита, с необязательно замещенными электронно-дефицитными арилгалогенидами с использованием подходящего основания, такого как TEA, в растворителе, таком как DMF или NMP, при температуре 120°C или около этого. Амидные производные XXIII получают путем взаимодействия необязательно замещенных акрилонитрилов, у которых удалена защита, с необязательно замещенными карбоновыми кислотами в присутствии подходящего связующего агента, такого как EDC, CDI или HATU, в присутствии подходящего основания, такого как TEA или DIPEA. Альтернативно, амидные производные XXIII в некоторых случаях можно получить с использованием активированного ацилирующего реагента, такого как хлорангидрид кислоты, вместо карбоновой кислоты.
СХЕМА 6
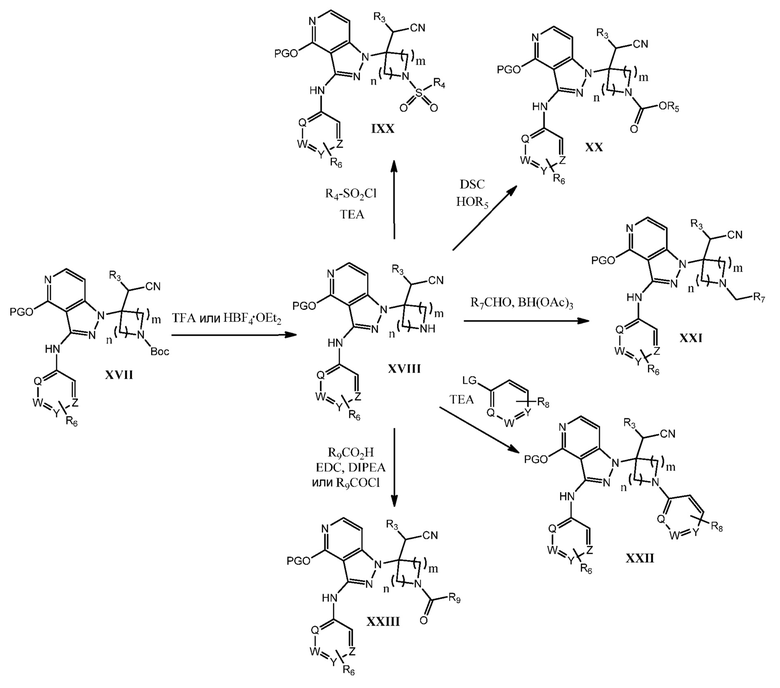
Способ 7
Общие процедуры для получения примеров по настоящему изобретению описаны на Схеме 7. Защищенные пиразолопиримидины XV подвергают процедуре удаления защиты в присутствии кислоты, такой как TFA или HCl, с получением пиразолопиридонов XVI с удаленной защитой. Альтернативно, в случае гидролитически нестабильных пиридоновых защитных групп (например, PG = Bn), удаление защиты можно осуществить в условиях гидрогенолиза с использованием Pd на углероде в присутствии водорода в подходящем растворителе, таком как EtOAc, EtOH, MeOH, или комбинации таких растворителей.
СХЕМА 7

ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ
Следующие экспериментальные процедуры представлены как подробно описывающие получение химических веществ, используемых в синтезе примеров по настоящему изобретению. Проиллюстрированные процедуры представлены только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения каким-либо образом.
Промежуточное соединение 1
4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амин

Стадия 1: 2-(бензилокси)-4-метоксиникотинонитрил

К раствору 2-гидрокси-4-метоксиникотинонитрила (60 г, 0,4 моль) в толуоле (0,60 л) добавляли Ag2CO3 (0,14 кг, 0,51 моль) и BnBr (87 г, 0,51 моль) при комнатной температуре. Смесь перемешивали при 50°C в течение 3 часов. Смесь фильтровали и фильтровальную лепешку промывали при помощи DCM. Фильтрат концентрировали в вакууме и к остатку добавляли петролейный эфир (100 мл) и твердое вещество фильтровали с получением 2-(бензилокси)-4-метоксиникотинонитрила в виде твердого вещества. LRMS (ESI) рассчитано для C14H13N2O2 [M+H]+: 241, найдено 241. 1H ЯМР (600 МГц CDCl3): δ 8,21 (д, J=6,6 Гц, 1H), 7,48 (д, J=7,8 Гц, 2H), 7,38 (м, 2H), 7,32 (м, 1H), 6,58 (д, J=6,0 Гц, 1H), 5,51 (с, 2H), 3,99 (с, 3H).
Стадия 2: 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амин
Суспензию 2-(бензилокси)-4-метоксиникотинонитрила (100 г, 410 ммоль) в гидразингидрате (0,20 кг, 4,1 моль) и n-BuOH (600 мл) нагревали до температуры кипения с обратным холодильником в течение ночи. Смесь концентрировали в вакууме и очищали хроматографией на диоксиде кремния, элюируя смесью 25% этилацетата в гексане. Концентрирование желаемой фракции в вакууме давало соединение I-1. 1H ЯМР (400 МГц CDCl3) δ 9,97 (с, 1H), 7,75 (д, J=6,4 Гц, 1H), 7,40 (д, J=7,2 Гц, 2H), 7,24-7,33 (м, 3H), 6,69 (д, J=6,4 Гц, 1H), 5,46 (с, 2H), 4,50 (с, 2H).
Промежуточное соединение 2
3-амино-1H-пиразоло[4,3-c]пиридин-4-ол

3-Циано-2-гидрокси-4-метоксипиридин (1,00 г, 6,66 ммоль) растворяли в гидразингидрате (24,8 мл, 260 ммоль) в сосуде высокого давления. Реакционную смесь нагревали до 140°C в течение 21 часов, затем охлаждали до температуры окружающей среды и оставляли для перемешивания еще в течение 48 часов. Реакционную смесь концентрировали с получением твердого вещества, которое суспендировали в диэтиловом эфире, фильтровали и промывали диэтиловым эфиром. Твердое вещество сушили в вакууме с получением соединения I-2. LRMS (ESI) рассчитано для C6H7N4O [M+H]+: 151, найдено 151.
Промежуточное соединение 3
3-(фениламино)-1H-пиразоло[4,3-c]пиридин-4(5H)-он

3-Амино-1H-пиразоло[4,3-c]пиридин-4-ол (50,0 мг, 0,333 ммоль), 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-три-изопропилбифенил (4,0 мг, 8,3 мкмоль), Pd2dba3 (30,5 мг, 0,033 ммоль), треохосновной фосфат калия (141 мг, 0,666 ммоль) и бромбензол (26 мкл, 0,25 ммоль) суспендировали в 2-пропаноле (3,0 мл). Реакционную смесь продували аргоном в течение 10 минут, затем нагревали до 75°C в течение 2 часов. Реакционную смесь разбавляли в 3:1 хлороформе/изопропаноле, промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали препаративной обращенно-фазовой хроматографией, элюируя смесью ацетонитрил/вода с 0,1% TFA модификатора. Фракции, содержащие желаемый продукт, объединяли и разбавляли в 3:1 хлороформе/изопропаноле, промывали водным раствором бикарбоната натрия и насыщенным солевым раствором. Объединенные водные слои обратно экстрагировали при помощи 3:1 хлороформа/изопропанола (× 1) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением желаемого продукта I-3 в виде твердого вещества. LRMS (ESI) рассчитано для C12H11N4O [M+H]+: 227, найдено 227.
Промежуточное соединение I-4
4-фтордигидро-2H-пиран-3(4H)-он
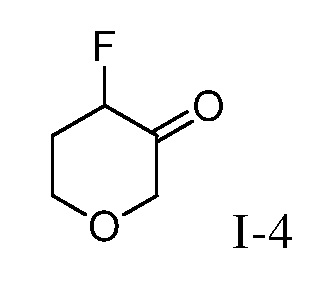
Стадия 1: ((5,6-дигидро-2H-пиран-3-ил)окси)триметилсилан
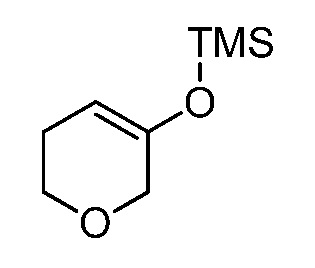
Дигидро-2H-пиран-3(4H)-он (4,00 г, 40,0 ммоль) растворяли в ТГФ (32,0 мл) и добавляли хлортриметилсилан (12,8 мл, 100 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут. Затем добавляли по каплям триэтиламин (15,0 мл, 108 ммоль) в атмосфере азота. Происходило образование белого осадка, и полученную суспензию нагревали до 70°C в течение уикенда. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Добавляли пентан (80 мл), суспензию фильтровали и твердое вещество промывали пентаном (40 мл). Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде жидкости, которую использовали как таковую на следующей стадии без дополнительной очистки. 1H ЯМР (500 МГц, CDCl3) δ 4,98-4,92 (м, 1H), 3,88 (м, 2H), 3,69 (т, J=5,5 Гц, 2H), 2,16 (м, 2H), 0,19 (с, 9H).
Стадия 2: 4-фтордигидро-2H-пиран-3(4H)-он (I-4)
К раствору ((5,6-дигидро-2H-пиран-3-ил)окси)триметилсилана (5,1 г, 30 ммоль) в ацетонитриле (75,0 мл) при 0°C добавляли Selectfluor® (15,8 г, 44,5 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в течение ночи, разбавляли этилацетатом, промывали насыщенным солевым раствором и водный слой экстрагировали этилацетатом (× 2). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением твердого вещества. Твердое вещество поглощали в DCM, фильтровали и концентрировали в вакууме с получением соединения I-4 в виде жидкости, которую использовали без дополнительной очистки. 1H ЯМР (500 МГц, CDCl3) δ 5,06 (ддд, J=6,9, 11,1, 48,0 Гц, 1H), 4,21 (дд, J=4,5, 14,9 Гц, 1H), 4,11 (дт, J=4,1, 12,7 Гц, 1H), 3,84 (м, 2H), 2,50 (м, 1H), 2,37-2,24 (м, 1H).
Промежуточное соединение 5-1
трет-бутил-4-(цианометилен)-3-фторпиперидин-1-карбоксилат

К раствору диэтил (цианометил)фосфоната (67 г, 0,38 моль) в ТГФ (0,70 л) добавляли TEA (70 г, 0,69 моль) и LiBr (36 г, 0,42 моль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, затем добавляли трет-бутил-3-фтор-4-оксопиперидин-1-карбоксилат (75 г, 0,35 моль). Реакционную смесь перемешивали еще в течение 3 часов, затем добавляли H2O (1,0 л) и смесь экстрагировали при помощи EtOAc (× 3). Органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 10% этилацетата в гексане. Концентрирование в вакууме желаемых фракциий давало желаемый продукт в виде твердого вещества, I-5-1. 1H ЯМР (600 МГц DMSO-d6): δ 5,88 (с, 1H), 5,27 (м, 0,5H), 5,19 (м, 0,5H), 3,86-3,40 (шир. м, 4H), 2,65 (м, 1H), 2,51 (м, 1H), 1,45 (с, 9H).
Следуя процедуре, аналогичной той, которая описана выше для Промежуточного соединения 5-1, были получены следующие акрилонитрильные промежуточные соединения, представленные в Таблице 1:


Промежуточное соединение 6-1
трет-бутил-4-(цианометилиден)пиперидин-1-карбоксилат

К охлажденному до 0°C раствору трет-бутоксида калия (263 мл, 263 ммоль, 1,0 M в ТГФ) и ТГФ (200 мл) медленно добавляли диэтил (цианометил)фосфонат (43,7 мл, 276 ммоль). Реакционную смесь поддерживали при 0°С в течение 10 минут, затем нагревали до температуры окружающей среды и поддерживали в течение 1 часа. Смесь охлаждали до 0°C и обрабатывали добавлением по каплям трет-бутил-4-оксопиперидин-1-карбоксилата (50,0 г, 251 ммоль) в ТГФ (150 мл) в течение 30 минут. После добавления смесь поддерживали при 0°C в течение 20 минут, затем нагревали до температуры окружающей среды и поддерживали в течение 18 часов. Реакционную смесь затем разбавляли водой (800 мл) и экстрагировали при помощи EtOAc (× 2). Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества, I-6-1. 1H ЯМР (600 МГц, CDCl3): δ 5,19 (с, 1H), 3,48-3,53 (м, 4H), 2,56 (т, J=5,4 Гц, 2H), 2,33 (т, J=5,4 Гц, 2H), 1,47 (с, 9H).
Следуя процедуре, аналогичной той, которую использовали для Промежуточного соединения I-6-1, были получены следующие акрилонитрильные промежуточные соединения, представленные в Таблице 2:
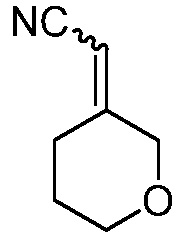
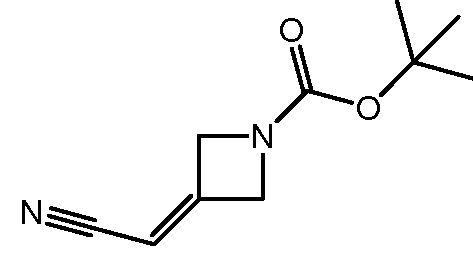


Промежуточные соединения 7-1 и 7-2
(3R,4S и 3S,4R)-трет-бутил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)-3-фторпиперидин-1-карбоксилат (I-7-1), и
(3S,4S и 3R,4R)-трет-бутил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)-3-фторпиперидин-1-карбоксилат (I-7-2)

К раствору трет-бутил-4-(цианометилен)-3-фторпиперидин-1-карбоксилата (50 г, 208 ммоль) и 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (25 г, 104 ммоль) в CH3CN (200 мл) при комнатной температуре добавляли DBU (17,4 г, 115 ммоль). Смесь перемешивали при 50°C в течение 48 часов, затем концентрировали в вакууме. Затем добавляли воду (200 мл) и реакционную смесь экстрагировали при помощи EtOAc (×3). Органический слой промывали насыщенным солевым раствором (500 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 9-33% EtOAc в гексане, с получением двух диастереомеров в виде твердых веществ.
Главный изомер I-7-1: LRMS (ESI) рассчитано для C25H30N6O3F [M+H]+: 481, найдено 481. 1H ЯМР (600 МГц, DMSO-d6): δ 7,77 (д, J=6,1 Гц, 1H), 7,48 (д, J=6,5 Гц, 2H), 7,35 (т, J=7,6 Гц, 2H), 7,29 (т, J=7,2 Гц, 1H), 7,17 (д, J=6,1 Гц, 1H), 5,51 (с, 2H), 5,47 (м, 1H), 5,30 (с, 2H), 4,13 (т, J=13,1 Гц, 1H), 3,91 (д, J=13,1 Гц, 1H), 3,17 (м, 2H), 3,15 (м, 1H), 2,91 (шир. м, 1H), 2,75 (д, J=15,5 Гц, 1H), 2,05 (т, J=13,0 Гц, 1H), 1,37 (с, 9H). Разделение методом СКЖХ осуществляли с использованием ChiralPak OJ-H, с 30% метанольного модификатора в CO2: время удерживания = 3,7 (I-7-1A) & 5,7 (I-7-1B) минут.
Второстепенный изомер I-7-2: LRMS (ESI) рассчитано для C25H30N6O3F [M+H]+: 481, найдено 481. 1H ЯМР (600 МГц, DMSO-d6): δ 7,77 (д, J=7,0 Гц, 1H), 7,55 (д, J=7,0 Гц, 2H), 7,43 (т, J=8,2 Гц, 2H), 7,36 (т, J=7,3 Гц, 1H), 7,25 (д, J=6,7 Гц, 1H), 5,56 (с, 2H), 5,49 (с, 2H), 5,23 (д, J=46,8 Гц, 1H), 4,18 (м, 2H), 3,57 (д, J=17,2 Гц, 1H), 3,46 (д, J=17,3 Гц, 1H), 3,35-3,14 (м, 2H), 2,67 (м, 1H), 2,44 (м, 1H), 1,38 (с, 9H). Разделение методом СКЖХ осуществляли с использованием ChiralPak AD-3, с 5-40% этанольного модификатора (0,05% DEA в этаноле) в CO2: время удерживания = 5,4 (I-7-2A) & 6,1 (I-7-2B) минут.
Следуя процедуре, аналогичной той, которая описана выше для Промежуточного соединения 7-1 и 7-2, были получены следующие промежуточные соединения, представленные в Таблице 3. В отдельных случаях, общую процедуру модифицировали таким образом, чтобы альтернативно использовать 1,0-1,5 эквивалентнов DBU, при 25-50°C.

(выделен из Пика A посредством СКЖХ: AD-H, 25% MeOH в CO2, Tr = 4,8 минут)

(выделен из Пика B при помощи СКЖХ, AD-H, 25% MeOH в CO2, Tr = 5,9 минут)
Промежуточное соединение 8
трет-бутил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат

К раствору 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (155 г, 645 ммоль) в CH3CN (2,50 л), добавляли (по партиям) трет-бутил-4-(цианометилиден)пиперидин-1-карбоксилат (286 г, 1,29 моль), с последующим добавлением по каплям DBU (99,0 г, 650 ммоль) при 20°C в течение 20 минут. Полученный раствор перемешивали в течение 3 дней при 20°C, концентрировали в вакууме при 40-45°C и затем очищали хроматографией на диоксиде кремния, элюируя смесью 0-50% этилацетата/петролейный эфир. Концентрирование желаемой фракции в вакууме давало соединение I-8. LRMS (ESI) рассчитано для C25H31N6O3 [M+H]+: 463, найдено 463. 1H ЯМР (300 МГц, CDCl3): δ 7,82 (д, 1H), 7,34-7,50 (м, 5H), 6,84 (д, 1H), 5,54 (с, 2H), 4,51 (шир. с, 2H), 3,94-3,97 (д, 2H), 3,05 (шир. с, 2H), 2,85-2,90 (м, 2H), 2,79 (с, 2H), 1,92-2,04 (м, 2H), 1,45 (с, 9H).
Промежуточное соединение 9
трет-бутил-3-(3-амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-(цианометил)азетидин-1-карбоксилат

К раствору 3-амино-1H-пиразоло[4,3-c]пиридин-4-ола (500 мг, 3,33 ммоль) и трет-бутил-3-(цианометилиден)азетидин-1-карбоксилата (356 мг, 1,83 ммоль) в DMF (22,2 мл) добавляли DBU (0,602 мл, 4,00 ммоль). Реакционную смесь нагревали до 50°C и оставляли для перемешивания в течение 1 часа, после этого к реакционной смеси добавляли вторую порцию трет-бутил-3-(цианометилиден)азетидин-1-карбоксилата (356 мг, 1,83 ммоль). По прошествии еще 2 часов при 50°C реакционную смесь охлаждали, разбавляли водой (100 мл) и экстрагировали смесью 3:1 CHCl3:IPA (× 3). Объединенные органические слои промывали один раз насыщенным солевым раствором (50 мл). Полученный органический слой сушили при помощи Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали обращенно-фазовой хроматографией, элюируя смесью ацетонитрил/вода с 0,1% TFA модификатора. Фракции, содержащие желаемый продукт, разбавляли при помощи EtOAc, промывали насыщенным раствором NaHCO3, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением соединения I-9. LRMS (ESI) рассчитано для C16H21N6O3 [M+H]+: 345, найдено 345. 1H ЯМР (600 МГц, DMSO-d6): δ 10,92 (с, 1H), 7,07 (т, J=5,7 Гц, 1H), 6,20 (д, J=7,2 Гц, 1H), 5,46 (с, 2H), 4,35 (м, 2H), 4,15 (м, 2H), 3,28 (с, 2H) 1,34 (с, 9H).
Промежуточное соединение 10
трет-бутил-3-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил]-3-(цианометил)азетидин-1-карбоксилат

4-(Бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амин (8,0 г, 33 ммоль) и трет-бутил-3-(цианометилиден)азетидин-1-карбоксилат (9,7 г, 50 ммоль) растворяли в ацетонитриле (200 мл) и добавляли DBU (7,6 г, 50 ммоль). Полученную смесь перемешивали в течение 2 часов при комнатной температуре, затем концентрировали в вакууме и очищали хроматографией на диоксиде кремния, элюируя смесью 17-67% EtOAc в гексане. Концентрирование желаемых фракций давало соединение I-10 в виде твердого вещества. LRMS (ESI) рассчитано для C23H27N6O3 [M+H]+: 435, найдено 435. 1H ЯМР (400 МГц, CDCl3): δ 7,85 (д, J=6,4 Гц, 1H), 7,45 (д, J=7,2 Гц, 2H), 7,30-7,39 (м, 3H), 6,65 (д, J=6,4 Гц, 1H), 5,51 (с, 2H), 4,60 (д, J=9,2 Гц, 2H), 4,52 (с, 2H), 4,22 (д, J=9,6 Гц, 2H), 3,04 (с, 2H), 1,44 (с, 9H).
Промежуточное соединение 11
2-(4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)ацетонитрил

Стадия 1: 2-(пиперидин-4-илиден)ацетонитрил, HCl соль

К трет-бутил-4-(цианометилен)пиперидин-1-карбоксилату (2,03 г, 9,15 ммоль) добавляли HCl в диоксане (21 мл, 84 ммоль, 4M) и полученн суспензию перемешивали при комнатной температуре в течение 30 минут, затем концентрировали в вакууме с получением неочищенного продукта, который использовали как таковой без дополнительной очистки. 1H ЯМР (600 МГц, DMSO-d6): δ 9,30 (шир. с, 1H), 5,66 (с, 1H), 3,20-3,10 (м, 4H), 2,67 (т, J=6,1 Гц, 2H), 2,56 (т, J=6,1 Гц, 2H).
Стадия 2: 2-(1-(2,2-дифторпропаноил)пиперидин-4-илиден)ацетонитрил

К смеси 2-(пиперидин-4-илиден)ацетонитрила (1,12 г, 9,15 ммоль), HATU (5,22 г, 13,7 ммоль) в DCM (36,6 мл), добавляли DIPEA (8,0 мл, 46 ммоль) и 2,2-дифторпропановую кислоту (2,00 г, 18,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 3% EtOAc в гексане. Концентрирование желаемой фракции давало 2-(1-(2,2-дифторпропаноил)пиперидин-4-илиден)ацетонитрил в виде твердого вещества. LRMS (ESI) рассчитано для C10H13F2N2O [M+H]+: 215, найдено 215. 1H ЯМР (600 МГц, CDCl3): δ 5,23 (с, 1H), 3,73-3,75 (м, 4H), 2,62-2,63 (м, 2H), 2,41 (кв., J=6,2 Гц, 2H), 1,84 (т, J=19,9 Гц, 3H).
Стадия 3: 2-(4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)ацетонитрил
К раствору 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (4,76 г, 19,8 ммоль) в ацетонитриле (45 мл) добавляли 2-(1-(2,2-дифторпропаноил)пиперидин-4-илиден)ацетонитрил (2,12 г, 9,90 ммоль) и DBU (1,49 мл, 9,90 ммоль). Реакционную смесь перемешивали при 40°C в течение 72 часов, затем концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 43% EtOAc в гексане. LRMS (ESI) рассчитано для C23H25F2N6O2 [M+H]+: 455, найдено 455. 1H ЯМР (600 МГц, DMSO-d6): δ 7,76 (д, J=6,4 Гц, 1H), 7,52 (д, J=7,5 Гц, 2H), 7,39 (т, J=7,9 Гц, 2H), 7,32 (т, J=7,3 Гц, 1H), 7,20 (д, J=6,3 Гц, 1H), 5,52 (с, 2H), 5,46 (с, 2H), 4,12 (м, 1H), 4,01 (м, 1H), 3,31 (м, 1H), 3,17 (с, 2H), 3,01 (м, 1H), 2,83-2,77 (м, 2H), 2,04-1,94 (м, 2H), 1,79 (т, J=20,1 Гц, 3H).
Промежуточное соединение 12
метил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат

Стадия 1: 2-(пиперидин-4-илиден)ацетонитрил, TFA соль
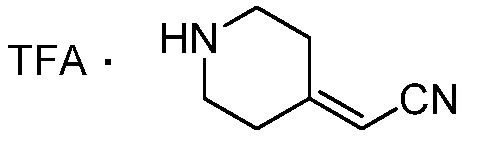
К раствору трет-бутил-4-(цианометилиден)пиперидин-1-карбоксилата (3,00 г, 13,5 ммоль) в дихлорметане (30 мл) при 20°C добавляли трифторуксусную кислоту (13,0 г, 115 ммоль). Полученный раствор перемешивали в течение 1 часа при 20°C и затем концентрировали в вакууме с получением масла, которое использовали как таковое.
Стадия 2: метил-4-(цианометилен)пиперидин-1-карбоксилат

К раствору неочищенного 2-(пиперидин-4-илиден)ацетонитрила в форме TFA соли (3,00 г, 13,7 ммоль) в дихлорметане (30 мл) добавляли триэтиламин (7,50 г, 74,1 ммоль) и хлор(метокси)метанон (2,80 г, 29,6 ммоль). Полученный раствор перемешивали в течение 30 минут при 20°C и затем концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 25% EtOAc в гексане. Концентрирование желаемых фракций давало метил-4-(цианометилиден)пиперидин-1-карбоксилат в виде твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 5,22 (с, 1H), 3,74 (с, 3H), 3,57 (м, 4H), 2,59 (т, J=2,8 Гц, 2H), 2,36 (т, J=2,8 Гц, 2H).
Стадия 3: метил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат (I-12)
К раствору 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (1,00 г, 4,16 ммоль) в этаноле (10 мл) добавляли метил-4-(цианометилиден)пиперидин-1-карбоксилат (750 мг, 4,16 ммоль) и DBU (630 мг, 4,14 ммоль). Полученный раствор перемешивали в течение 8 часов при 78°C. Реакционную смесь концентрировали в вакууме и очищали хроматографией на диоксиде кремния, элюируя смесью 50% EtOAc в гексане, и затем желаемые фракции концентрировали в вакууме и снова очищали препаративной ТСХ с использованием DCM/MeOH=10:1, с получением соединения I-12 в виде твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 7,86 (д, J=6,4 Гц, 1H), 7,50 (д, J=7,2 Гц, 2H), 7,36-7,44 (м, 3H), 6,86 (д, J=6,4 Гц, 1H), 5,57 (с, 2H), 4,53 (м, 2H), 4,12 (м, 2H), 3,72 (с, 3H), 3,05-3,17 (м, 2H), 2,90-2,98 (м, 2H), 2,82 (с, 2H), 1,96-2,05 (м, 2H).
Промежуточное соединение 13
метил-5-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат

Стадия 1: метил-5-оксотетрагидро-2H-пиран-2-карбоксилат
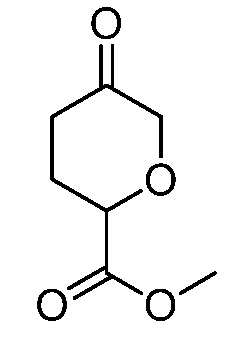
К раствору метил-5-гидрокси-тетрагидро-2H-пиран-2-карбоксилата (487 мг, 3,04 ммоль) в CH2Cl2 (10 мл) добавляли периодинан Десс-Мартина (1,60 г, 3,80 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем разбавляли насыщенным раствором тиосульфата натрия и насыщенным раствором бикарбоната натрия и фильтровали через Целит. Водный слой экстрагировали при помощи CH2Cl2 (× 2) и объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 33% EtOAc в гексане. Концентрирование желаемых фракций давало метил-5-оксотетрагидро-2H-пиран-2-карбоксилат в виде масла. 1H ЯМР (600 МГц, CDCl3): δ 4,40 (дд, J=9,2, 4,9 Гц, 1H), 4,32 (д, J=16,9 Гц, 1H), 4,05 (д, J=16,9 Гц, 1H), 3,79 (с, 3H), 2,56 (м, 2H), 2,39 (м, 1H), 2,21 (м, 1H).
Стадия 2: метил-5-(цианометилен)тетрагидро-2H-пиран-2-карбоксилат

Смесь триэтиламина (594 мкл, 4,26 ммоль), бромида лития (341 мг, 3,93 ммоль) и диэтил (цианометил)фосфоната (379 мкл, 2,34 ммоль) в ТГФ (5 мл) перемешивали в течение 30 минут при комнатной температуре. Затем добавляли метил-5-оксотетрагидро-2H-пиран-2-карбоксилат (337 мг, 2,13 ммоль) в ТГФ (1 мл) и реакционную смесь перемешивали в течение 12 часов, затем гасили водой (5 мл) и экстрагировали этилацетатом (× 4). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 38% EtOAc в гексане. Концентрирование желаемых фракций давало указанное в заголовке соединение (E и Z = 5:3) в виде масла. LRMS (ESI) рассчитано для C9H12NO3 [M+H]+: 182, найдено 182. 1H ЯМР (600 МГц, DMSO-d6): δ 5,62 (д, J=16,7 Гц, 1H), 4,46 (д, J=13,7 Гц, 0,5H), 4,29 (м, 1,5H), 4,16 (д, J=13,7 Гц, 0,5H), 4,09 (д, J=13,4 Гц, 0,5H), 3,63 (д, J=1,4 Гц, 3H), 2,68 (дт, J=14,7, 4,5 Гц, 0,5H), 2,52 (м, 1,5H), 2,02 (м, 1H), 1,69 (м, 1H).
Стадия 3: 5-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат
К 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амину (1,56 г, 6,46 ммоль) в ацетонитриле (4,3 мл) добавляли метил-5-(цианометилен)тетрагидро-2H-пиран-2-карбоксилат (234 мг, 1,29 ммоль) и DBU (195 мкл, 1,29 ммоль). Реакционную смесь перемешивали при 40°C в течение 72 часов, затем концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 33% EtOAc в гексане. Концентрирование желаемых фракций давало соединение I-13 в виде твердого вещества. LRMS (ESI) рассчитано для C22H24N5O4 [M+H]+: 422, найдено 422. 1H ЯМР (600 МГц, DMSO-d6): δ 7,70 (д, J=6,4 Гц, 1H), 7,46 (д, J=7,6 Гц, 2H), 7,35 (т, J=7,5 Гц, 2H), 7,29 (д, J=7,3 Гц, 1H), 7,17 (д, J=6,4 Гц, 1H), 5,48 (с, 2H), 5,40 (с, 2H), 4,29 (дд, J=9,4, 3,9 Гц, 1H), 4,19 (д, J=12,0 Гц, 1H), 4,05 (д, J=11,7 Гц, 1H), 3,66 (с, 3H), 3,32 (м, 1H), 3,28 (д, J=9,1 Гц, 1H), 2,55 (м, 1H), 2,49-2,44 (м, 1H), 1,94-1,78 (м, 2H).
Промежуточное соединение 14
трет-бутил-5-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат
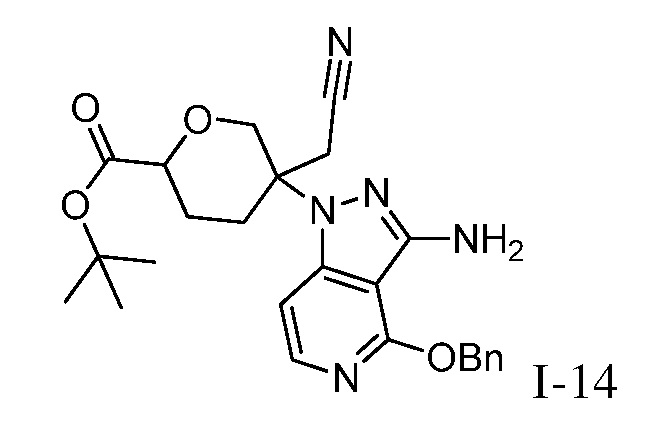
Стадия 1: (2S,5R)-метил-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоксилат
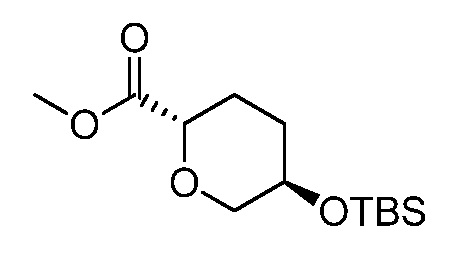
К раствору (2S,5R)-метил-5-гидрокситетрагидро-2H-пиран-2-карбоксилата (3,48 г, 21,7 ммоль) в CH2Cl2 (90 мл) добавляли имидазол (2,22 г, 32,6 ммоль) и трет-бутилдиметилсилилхлорид (3,93 г, 26,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой (50 мл) и экстрагировали при помощи CH2Cl2 (× 3). Объединенные органические слои концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 10% EtOAc в гексане. Концентрирование желаемых фракций давало (2S,5R)-метил-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоксилат в виде масла. 1H ЯМР (600 МГц, CDCl3): δ 3,97 (ддд, J=11,0, 4,9, 1,9 Гц, 1H), 3,90 (дд, J=11,6, 2,2 Гц, 1H), 3,74 (с, 3H), 3,61 (м, 1H), 3,13 (дд, J=11,0, 9,8 Гц, 1H), 2,06 (м, 2H), 1,68-1,60 (м, 1H), 1,51-1,45 (м, 1H), 0,85 (с, 9H), 0,03 (д, J=6,45 Гц, 6H).
Стадия 2: (2S,5R)-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоновая кислота

К раствору (2S,5R)-метил-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоксилата (5,40 г, 19,7 ммоль) в метаноле (55 мл) добавляли 4н водный раствор гидроксида калия (24,6 мл, 98,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и затем растворитель удаляли в вакууме. Водный остаток подкисляли до pH~2 с использованием 1н раствора HCl и экстрагировали хлороформом/изопропанолом (3:1, × 3). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением (2S,5R)-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоновой кислоты в виде твердого вещества. LRMS (ESI) рассчитано для C12H25O4Si [M+H]+: 261, найдено 261. 1H ЯМР (600 МГц, DMSO-d6): δ 12,56 (с, 1H), 3,78 (дд, J=11,1, 2,9 Гц, 1H), 3,73 (м, 1H), 3,58 (м, 1H), 3,03 (дд, J=10,8, 9,5 Гц, 1H), 1,90 (м, 2H), 1,48-1,40 (м, 2H), 0,81 (с, 9H), 0,05 (д, J=4,1 Гц, 6H).
Стадия 3: (2S,5R)-трет-бутил-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоксилат
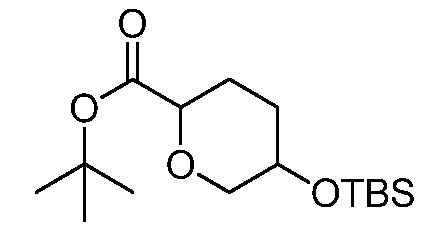
К раствору (2S,5R)-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоновой кислоты (5,46 г, 19,8 ммоль) в толуоле (80 мл) при 95° добавляли 5 мл раствора N,N-диметилформамид ди-трет-бутил ацеталя (19,0 мл, 79 ммоль) в толуоле (10 мл) в атмосфере азота. Полученный раствор перемешивали при 95°C в течение 1 часа, в этот момент добавляли остальное количество ацетального раствора и полученный раствор перемешивали еще в течение 1 часа. Реакционную смесь затем концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 10% EtOAc в гексане. Концентрирование желаемых фракций давало (2S,5R)-трет-бутил-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоксилат в виде масла. LRMS (ESI) рассчитано для C16H33O4Si [M+H]+: 317, найдено 317. 1H ЯМР (600 МГц, DMSO-d6) δ 3,74 (м, 2H), 3,59 (тт, J=9,7, 4,6 Гц, 1H), 3,02 (дд, J=10,8, 9,5 Гц, 1H), 1,90-1,81 (м, 2H), 1,50-1,41 (м, 2H), 1,38 (с, 9H), 0,81 (с, 9H), 0,02 (д, J=4,7 Гц, 6H).
Стадия 4: трет-бутил-5-гидрокситетрагидро-2H-пиран-2-карбоксилат
К трет-бутил-5-((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-2-карбоксилату (4,58 г, 14,5 ммоль) добавляли тетра-н-бутиламмонийфторид (72,0 мл, 72,0 ммоль, 1M в ТГФ) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 44% EtOAc в гексане. Концентрирование желаемой фракции давало трет-бутил-5-гидрокситетрагидро-2H-пиран-2-карбоксилат. LRMS (ESI) рассчитано для C10H19O4 [M+H]+: 203, найдено 203. 1H ЯМР (600 МГц, DMSO-d6): δ 4,79 (д, J=4,8 Гц, 1H), 3,77 (ддд, J=10,7, 4,7, 1,9 Гц, 1H), 3,71 (дд, J=10,9, 2,6 Гц, 1H), 3,40-3,34 (м, 1H), 2,96 (т, J=10,2 Гц, 1H), 1,83 (м, 2H), 1,36 (с, 9H), 1,48-1,13 (м, 2H).
Стадия 5: трет-бутил-5-оксотетрагидро-2H-пиран-2-карбоксилат
К раствору трет-бутил-5-гидрокситетрагидро-2H-пиран-2-карбоксилата (2,85 г, 14,1 ммоль) в CH2Cl2 (45 мл) добавляли периодинан Десс-Мартина (7,47 г, 17,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем разбавляли насыщенным раствором тиосульфата натрия и насыщенным раствором бикарбоната натрия. Водный слой экстрагировали при помощи CH2Cl2 (× 4) и объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 25% EtOAc в гексане. Концентрирование желаемых фракций давало трет-бутил-5-оксотетрагидро-2H-пиран-2-карбоксилат в виде масла. 1H ЯМР (600 МГц, DMSO-d6): δ 4,31 (дд, J=9,5, 4,6 Гц, 1H), 4,05 (д, J=16,5 Гц, 2H), 2,75 (дт, J=16,8, 5,3 Гц, 1H), 2,37 (дт, J=16,8, 5,3 Гц, 1H), 2,24-2,08 (м, 1H), 1,98 (м, 1H), 1,38 (с, 9H).
Стадия 6: трет-бутил-5-(цианометилен)тетрагидро-2H-пиран-2-карбоксилат

Смесь триэтиламина (3,56 мл, 25,6 ммоль), бромида лития (2,05 г, 23,7 ммоль) и диэтил (цианометил)фосфоната (2,28 мл, 14,1 ммоль) в ТГФ (40 мл) перемешивали в течение 30 минут при комнатной температуре, затем добавляли трет-бутил-5-оксотетрагидро-2H-пиран-2-карбоксилат (2,56 г, 12,8 ммоль) в ТГФ (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, гасили водой (20 мл) и экстрагировали этилацетатом (× 4). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 25% EtOAc в гексане. Концентрирование желаемых фракций давало трет-бутил-5-(цианометилен)тетрагидро-2H-пиран-2-карбоксилат в виде твердого вещества и в виде 9:7 смеси E и Z изомеров. LRMS (ESI) рассчитано для C12H18NO3 [M+H]+: 224, найдено 224. 1H ЯМР (400 МГц, DMSO-d6): δ 5,61 (д, J=14,9 Гц, 1H), 4,46 (д, J=14,1 Гц, 0,5H), 4,28 (д, J=13,5 Гц, 0,5H), 4,12 (м, 1,5H), 4,06 (д, J=13,4 Гц, 0,5H), 2,70-2,64 (м, 0,5H), 2,66-2,53 (м, 1,5H), 2,05-1,96 (м, 1H), 1,68-1,63 (м, 1H), 1,38 (с, 9H).
Стадия 7: трет-бутил-5-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат
К раствору 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (10,8 г, 45,0 ммоль) в ацетонитриле (35mL) добавляли трет-бутил-5-(цианометилен)тетрагидро-2H-пиран-2-карбоксилат (2,00 г, 8,96 ммоль) и DBU (1,35 мл, 8,96 ммоль). Сосуд герметично закрывали и перемешивали при 40°C в течение 72 часов, затем концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 43% EtOAc в гексане. Концентрирование желаемых фракций давало трет-бутил-5-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат (Диастереомер 1 и 2 = 3:1), оба в виде твердых веществ. Диастереомер I-14-1: LRMS (ESI) рассчитано для C25H30N5O4 [M+H]+: 464, найдено 464. 1H ЯМР (600 МГц, DMSO-d6): δ 7,70 (д, J=6,5 Гц, 1H), 7,47 (д, J=7,6 Гц, 2H), 7,35 (т, J=7,6 Гц, 2H), 7,28 (т, J=7,5 Гц, 1H), 7,17 (д, J=6,5 Гц, 1H), 5,48 (с, 2H), 5,40 (шир.с, 2H), 4,21 (д, J=11,9 Гц, 1H), 4,11 (дд, J=9,1, 3,7 Гц, 1H), 4,02 (д, J=12,1 Гц, 1H), 3,23 (д, J=4,5 Гц, 2H), 2,45-2,38 (м, 2H), 1,86-1,75 (м, 2H), 1,38 (с, 9H). Диастереомер I-14-2: LRMS (ESI) рассчитано для C25H30N5O4 [M+H]+: 464, найдено 464. 1H ЯМР (600 МГц, DMSO-d6): δ 7,71 (д, J=6,4 Гц, 1H), 7,47 (д, J=7,6 Гц, 2H), 7,35 (т, J=7,5 Гц, 2H), 7,28 (т, J=7,4 Гц, 1H), 7,13 (д, J=6,4 Гц, 1H), 5,48 (с, 2H), 5,40 (шир. с, 2H), 4,68 (д, J=14,6 Гц, 1H), 4,15 (дд, J=10,6, 2,9 Гц, 1H), 3,75-3,68 (д, J=12,9 Гц, 1H), 3,00 (д, J=3,9 Гц, 2H), 2,80 (д, J=11,7 Гц, 1H), 2,05-1,95 (м, 1H), 1,85-1,80 (м, 1H), 1,55-1,48 (м, 1H), 1,32 (с, 9H). СКЖХ разделение Диастереомера I-14-1 осуществляли на Chiralpak IA колонке 21 × 250 мм, элюируя смесью 30% метанола в CO2, с получением Энантиомера 1 (3,06 минут - I-14-1A) и Энантиомера 2 (4,41 минут - I-14-1B).
Промежуточное соединение 15
2-(8-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-1,4-диоксаспиро[4,5]декан-8-ил)ацетонитрил
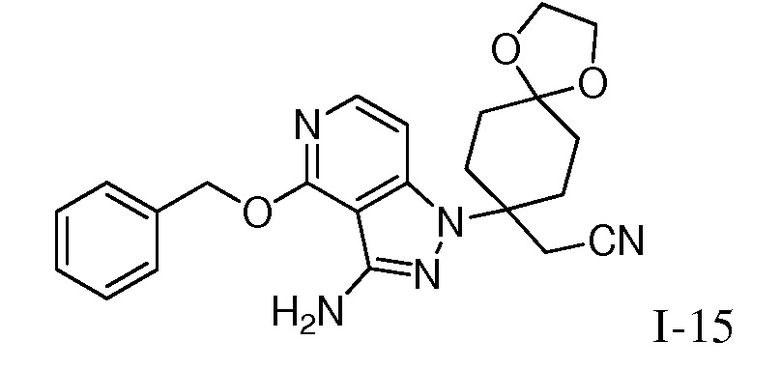
К суспензии 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (1,0 г, 4,2 ммоль) в MeCN (10 мл) добавляли 2-(1,4-диоксаспиро[4,5]декан-8-илиден)ацетонитрил (7,5 г, 42 ммоль) и DBU (1,3 г, 8,3 ммоль). Полученную реакционную смесь перемешивали при 55°C в течение 41 часов. Объем реакционной смеси наполовину уменьшали в вакууме, затем очищали хроматографией на диоксиде кремния, элюируя смесью 0-100 EtOAc в гексане, с получением соединения I-15. LRMS (ESI) рассчитано для C23H26N5O3 [M+H]+: 420, найдено 420. 1H ЯМР (600 МГц, DMSO-d6): δ 7,70 (д, J=6,4, 1H), 7,47 (д, J=7,5, 2H), 7,35 (т, J=7,5, 2H), 7,28 (т, J=7,3, 1H), 7,09 (д, J=6,4, 1H), 5,47 (с, 2H), 5,38 (с, 2H), 3,88-3,83 (м, 2H), 3,83-3,78 (м, 2H), 3,03 (с, 2H), 2,71 (д, J=13,9, 2H), 2,03-1,89 (м, 2H), 1,70-1,59 (м, 2H), 1,53-1,41 (м, 2H).
Промежуточное соединение 16
2-(1-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил
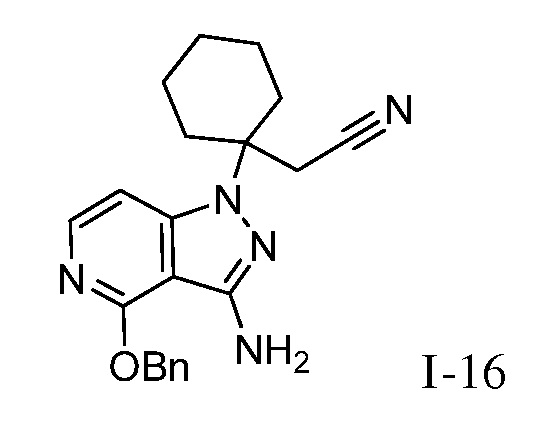
Стадия 1: 2-циклогексилиденацетонитрил

Раствор гидроксида калия (2,86 г, 51,1 ммоль) в ацетонитриле (30 мл) перемешивали при 80°C в течение 5 минут, затем добавляли по каплям раствор циклогексанона (5,00 г, 51,0 ммоль) в ацетонитриле (10 мл). Полученный раствор перемешивали в течение 2 часов при 80°C и затем концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-1% EtOAc в гексане, с получением 2-циклогексилиденацетонитрила в виде масла. ГХ/МС низкого разрешения (EI), рассчитано для C8H11N [M]+: 121, найдено 121.
Стадия 2: 2-(1-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил
К 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амину (0,050 г, 0,21 ммоль) и 2-циклогексилиденацетонитрилу (0,050 г, 0,42 ммоль) в этаноле (0,1 мл) добавляли DBU (0,031 г, 0,20 ммоль). Полученный раствор перемешивали в течение 16 часов при 55°C, затем концентрировали в вакууме с получением неочищенного соединения I-16 в виде твердого вещества. LRMS (ESI) рассчитано для C21H24N5O [M+H]+: 362, найдено 362.
Промежуточное соединение 17
2-(3-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил

К 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амину (500 мг, 2,08 ммоль) в ацетонитриле (6,9 мл) добавляли (E)-2-(дигидро-2H-пиран-3(4H)-илиден)ацетонитрил (436 мг, 3,54 ммоль) и DBU (314 мкл, 2,08 ммоль). Колбу герметично закрывали и нагревали до 40°C в течение 24 часов, затем концентрировали в вакууме и очищали хроматографией на диоксиде кремния, элюируя смесью 10-100% EtOAc в гексане. Продукт собирали и концентрировали в вакууме с получением желаемого продукта в виде твердого вещества. 1H ЯМР (600 МГц, CDCl3): δ 7,81 (д, J=6,4 Гц, 1H), 7,48 (д, J=7,3 Гц, 2H), 7,40 (кажущийся т, J=6,9 Гц, 2H), 7,35 (м, 1H), 7,00 (д, J=6,9 Гц, 1H), 5,53 (с, 2H), 4,49 (с, 2H), 4,21 (д, J=12,1 Гц, 1H), 4,08 (д, J=12,1 Гц, 1H), 3,82 (м, 1H), 3,69 (м, 1H), 3,09 (д, J=18,5 Гц, 1H), 3,01 (д, J=18,5 Гц, 1H), 2,65 (м, 1H), 2,46 (м, 1H), 1,75 (кажущийся квинтет, J=5,8 Гц, 2H). Разделение методом СКЖХ осуществляли на Chiral Technology OJ-H колонке, элюируя смесью 25% метанола в CO2, с получением Энантиомера 1 (3,6 минут - I-17A) и Энантиомера 2 (4,7 минут - I-17B).
Промежуточное соединение 18
2-(1-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрил

К раствору 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (1,7 г, 7,0 ммоль) и EtOH (21,5 мл) добавляли 2-циклопентилиденацетонитрил I-6-5 (3,8 г, 35 ммоль) и DBU (2,1 мл, 14 ммоль). Реакционную смесь нагревали до 90°C в течение 24 часов, концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением соединения I-18. LRMS (ESI) Рассчитано для C20H22N5O [M+H]+: 348, найдено 348. 1H ЯМР (CDCl3, 500 МГц): δ 7,81 (д; J=6,4 Гц, 1H), 7,48 (д, J=7,5 Гц, 2H), 7,41-7,34 (м, 3H), 6,92 (д, J=6,3 Гц, 1H), 5,54 (с, 2H), 4,47 (шир.с, 2H), 2,88 (с, 2H), 2,67-2,63 (м, 2H), 2,31-2,27 (м, 2H), 1,90-1,82 (м, 4H).
Промежуточное соединение 19
2-((1R,2R)-1-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-2-фторциклогексил)ацетонитрил

Стадия 1: 2-фторциклогексанон
К раствору циклогексанона (275 г, 2,80 моль) в ACN (2,75 л), в атмосфере азота, добавляли 1-хлорметил-4-фтор-1,4-диазониабицикло[2,2,2]октан бис(тетрафторборат) (1,09 кг, 3,08 моль). Полученный раствор перемешивали в течение 24 часов при 80°C. Реакционную смесь концентрировали в вакууме и остаток растворяли в дихлорметане (2,00 л) и нерастворимые вещества отфильтровывали. Фильтрат промывали насыщенным водным раствором NaHCO3, сушили над Na2SO4 и концентрировали в вакууме с получением масла, которое использовали как таковое на следующей стадии.
Стадия 2: 2-(2-фторциклогексилиден)ацетонитрил

К раствору диэтил (цианометил)фосфоната (528 г, 2,98 моль) в ТГФ (1,75 л) в атмосфере азота при 10°C добавляли TEA (302 г, 2,98 моль) и LiBr (259 г, 2,98 моль). Полученный раствор перемешивали в течение 30 минут и затем добавляли по каплям раствор 2-фторциклогексан-1-она (350 г, 2,71 моль, чистота 90%) в ТГФ (1,75 л) при 10°C. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, разбавляли водой (300 мл) и полученный раствор экстрагировали этилацетатом (× 3). Органические слои объединяли и промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 2-5% этилацетата/петролейный эфир, с получением масла.
Стадия 3: 2-((1R,2R)-1-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-2-фторциклогексил)ацетонитрил
К раствору 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (0,22 кг, 0,91 моль) в ACN (635 мл) в атмосфере азота добавляли 2-(2-фторциклогексилиден)ацетонитрил (0,13 кг, 0,91 моль). Затем добавляли DBU (0,139 кг, 0,91 моль) и раствор перемешивали в течение 10 минут, затем добавляли еще одну партию 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (0,22 кг, 0,91 ммоль). Полученный раствор перемешивали в течение 48 часов при 50°C на масляной бане, затем разбавляли водой и полученный раствор экстрагировали этилацетатом (× 3). Объединенные органические слои промывали насыщенным солевым раствором (× 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток разбавляли диэтиловым эфиром и твердые вещества собирали фильтрованием и промывали дополнительным количеством диэтилового эфира. Фильтрат концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя смесью 20% этилацетата/петролейный эфир. Желаемые фракции объединяли и концентрировали в вакууме и желаемый продукт затем перекристаллизовывали из диизопропилового эфира. Рацемический цис (фтор, относящийся к пиразолопиридину) разделяли препаративной СКЖХ с использованием CHIRALPAK AD-H, используя 35% этанольного модификатора в CO2. Аналитическая СКЖХ с использованием CHIRALPAK AD-H с 15% этанольного модификатора в CO2 давала Tr = 3,5 минут (желаемый R,R изомер, I-19A) и 4,0 минут I-19B. LRMS (ESI) рассчитано для C21H23FN5O [M+H]+: 380, найдено: 380. 1H ЯМР (300 МГц, CDCl3): δ 7,72 (д, J=6,3 Гц, 1H), 7,61-7,41 (м, 2H), 7,39-7,21 (м, 3H), 7,17 (д, J=7,5 Гц, 1H), 5,51 (с, 2H), 5,40 (с, 2H), 5,29-4,96 (м, 1H), 3,97-3,23 (м, 2H), 2,73-2,61 (м, 1H), 2,58-2,00 (м, 1H), 1,86 (м, 2H), 1,74-1,66 (м, 2H), 1,59-1,38 (м, 2H).
Промежуточное соединение 20
(2S,5S)-5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоновая кислота

Стадия 1: (2S,5S)-трет-бутил-5-(4-(бензилокси)-3-((4-хлорфенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат
(2S,5S)-трет-бутил-5-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат (500 мг, 1,08 ммоль), 4-бромхлорбензол (248 мг, 1,29 ммоль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (92 мг, 0,22 ммоль) и ацетат калия (318 мг, 3,24 ммоль) объединяли в микроволновом сосуде и растворяли в 2-пропаноле (5 мл). Реакционную смесь дегазировали путем барботирования раствора аргоном в течение 10 минут и затем добавляли Pd2(dba)3 (99 мг, 0,11 ммоль). Сосуд затем герметично закрывали и перемешивали при 85°C в течение ночи. Реакционную смесь затем разбавляли этилацетатом и фильтровали через Целит и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на диоксиде кремния, элюируя с градиентом 25-75% этилацетата в гексане, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C31H33N5O4Cl [M+H]+: 574, найдено 574.
Стадия 2: (2S,5S)-5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоновая кислота (I-20)
(2S,5S)-трет-бутил-5-(4-(бензилокси)-3-((4-хлорфенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат (520 мг, 0,906 ммоль) растворяли в хлористоводородной кислоте (5,00 мл, 20,0 ммоль, 4M в диоксане) в 250-мл круглодонной колбе. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем концентрировали в вакууме с получением соединения I-20. LRMS (ESI) рассчитано для C20H19ClN5O4 [M+H]+: 428, найдено: 428. 1H ЯМР (500 МГц, DMSO-d6): δ 12,94 (шир. с, 1H), 11,34 (д, J=5,6 Гц, 1H), 8,35 (с, 1H), 7,74 (д, J=9,2 Гц, 2H), 7,35 (д, J=9,2 Гц, 2H), 7,24 (дд, J=6,2, 7,6 Гц, 1H), 6,77 (д, J=7,6 Гц, 1H), 4,35 (д, J=11,8 Гц, 1H), 4,28 (дд, J=3,9, 8,6 Гц, 1H), 4,18 (д, J=12,1 Гц, 1H), 3,41 (с, 2H), 2,58 (м, 1H), 2,47 (м, 1H), 1,96 (м, 2H).
Промежуточное соединение 21-1
2-(3-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидрофуран-3-ил)ацетонитрил

Стадия 1: 2-(дигидрофуран-3(2H)-илиден)ацетонитрил

К перемешиваемому раствору гидрида натрия (1,34 г, 55,8 ммоль, 60% масс. дисперсия в минеральном масле) в ТГФ (250 мл) добавляли диэтил (цианометил)фосфонат (9,88 г, 55,8 ммоль) по каплям при 0°C. Смесь перемешивали при 0°C в течение 30 минут, затем добавляли по каплям дигидрофуран-3(2H)-он (4,0 г, 47 ммоль) при 0°C. Полученную смесь перемешивали в течение 2 часов при 0°C, затем смесь разбавляли дихлорметаном (500 мл) и промывали водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-5% этилацетата в петролейном эфире, с получением указанного в заголовке соединения в виде смеси E и Z изомеров. 1H ЯМР (400 МГц, CDCl3): δ 5,39 (с, 1H), 4,60 (с, 2H), 4,07-4,00 (м, 2H), 2,78 (м, 2H). 1H ЯМР (400 МГц, CDCl3): δ 5,36 (с, 1H), 4,46 (с, 2H), 4,03 (м, 2H), 2,92 (м, 2H).
Стадия 2: 2-(3-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидрофуран-3-ил)ацетонитрил
Раствор 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (Промежуточное соединение 1, 2,0 г, 8,3 ммоль), 2-(дигидрофуран-3(2H)-илиден)ацетонитрила (1,82 г, 16,7 ммоль) и DBU (3,80 г, 25,0 ммоль) в ацетонитриле (20 мл) нагревали при температуре кипения с обратным холодильником в течение 16 часов. Смесь затем концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя смесью 10% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, CD3OD): δ 7,81 (д, J=6,4 Гц, 1H), 7,52 (д, J=7,2 Гц, 2H), 7,32-7,42 (м, 3H), 7,06 (д, J=6,4 Гц, 1H), 5,55 (с, 2H), 4,39 (д, J=9,6 Гц, 1H), 4,24 (д, J=9,6 Гц, 1H), 4,04-4,23 (м, 2H), 3,21 (с, 2H), 2,85-2,92 (м, 1H), 2,61-2,68 (м, 1H).
Следуя процедуре, аналогичной той, которая описана выше, были получены следующие арилбромиды, представленные в Таблице 4.
Промежуточное соединение 22
2-((3R,4R или 3S,4S)-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрил (I-22A) и 2-((3S,4S или 3R,4R)-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрил (I-22B)

Стадия 1: 3-фтордигидро-2H-пиран-4(3H)-он

К раствору дигидро-2H-пиран-4(3H)-она (20,0 г, 200 ммоль) в ацетонитриле/воде (20/1, 210 мл) добавляли 1-(хлорметил)-4-фтор-1,4-диазабицикло[2,2,2]октан-1,4-дииум тетрафторборат (85,0 г, 240 ммоль) и полученную реакционную смесь перемешивали при 80°C в течение 12 часов. Реакционную смесь концентрировали в вакууме и остаток экстрагировали при помощи EtOAc (× 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя с градиентом 0-100% EtOAc в петролейном эфире, с получением указанного в заголовке соединения в виде масла: 1H ЯМР (300 МГц, CDCl3): δ 4,94 (ддд, J=48, 9,6, 6,6Гц, 1H), 4,42-4,35 (м, 1H), 4,23-4,13 (м, 1H), 3,77-3,61 (м, 2H), 2,76-2,61 (м, 2H).
Стадия 2: 2-(3-фтордигидро-2H-пиран-4(3H)-илиден)ацетонитрил

К раствору диэтил (цианометил)фосфоната (10,8 г, 61,0 ммоль) в ТГФ (300 мл) при -20°C добавляли по каплям бис(триметилсилил)амид лития (61,0 мл, 61,0 ммоль, 1M в ТГФ). Полученный раствор перемешивали при -20°C в течение 30 минут и добавляли по каплям 3-фтордигидро-2H-пиран-4(3H)-он (6,00 г, 40,6 ммоль) в ТГФ (5 мл). Реакционную смесь перемешивали при -20°C в течение 1 часа, затем гасили путем добавления воды (100 мл) и экстрагировали при помощи EtOAc (× 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-40% EtOAc/петролейный эфир, с получением указанного в заголовке соединения в виде масла: 1H ЯМР (300 МГц, CDCl3): δ 5,51 (с, 1H), 5,00 (ддд, J=48,6, 7,9, 5,4 Гц, 1H), 4,15 (м, 1H), 3,99 (м, 1H), 3,59-3,41 (м, 2H), 3,02-2,94 (м, 1H), 2,54 (м, 1H).
Стадия 3: 2-((3R,4R или 3S,4S)-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрил (I-22A) и 2-((3S,4S или 3R,4R)-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрил (I-22B)
К раствору 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (4,00 г, 16,7 ммоль) и 2-(3-фтордигидро-2H-пиран-4(3H)-илиден)ацетонитрила (4,70 г, 33,3 ммоль) в ацетонитриле (80 мл) добавляли DBU (5,07 г, 33,3 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 12 часов, затем гасили путем добавления воды (100 мл) и экстрагировали при помощи EtOAc (× 3). Объединенные органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-40% EtOAc/петролейный эфир, с получением рацемической смеси цис и транс продукта в виде масла. Неочищенный продукт очищали обращенно-фазовой флэш-хроматографией, элюируя с градиентом 23-41% ацетонитрила/вода с 0,05% NH4HCO3 модификатора, с получением 2-((3R,4R и 3S,4S)-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрила при 35 мин и 2-((3R,4S и 3S,4R)-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрильного продукта при 60 мин. Разделение 2-((3R,4R и 3S,4S)-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрила хиральной препаративной ВЭЖХ с использованием IC колонки и гексан:EtOH=80:20 в качестве подвижной фазы давало оба энантиомера I-22A при 27 мин и I-22B при 23 мин: LRMS (ESI) рассчитано для C20H21FN5O2 [M+H]+: 382 найдено 382; 1H ЯМР (300 МГц, CDCl3): δ 7,84 (д, J=6,6 Гц, 1H), 7,52-7,33 (м, 5H), 6,99 (д, J=6,6 Гц, 1H), 5,56 (с, 2H), 5,09 (д, J=46,2 Гц, 1H), 4,53 (шир. с, 2H), 4,22-4,15 (м, 1H), 4,07-3,98 (м, 1H), 3,83-3,68 (м, 2H), 3,37 (м, 1H), 3,13 (м, 1H), 3,05 (м, 1H), 2,47 (м, 1H).
Промежуточное соединение 23
5-бром-2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-1-он

5-Бром-2,3-дигидро-1H-изоиндол-1-он (100 мг, 0,47 ммоль) растворяли в DMF (4,7 мл) и перемешивали при 0°C. NaH (38 мг, 0,94 ммоль, 60% масс. дисперсия в масла) осторожно добавляли двумя порциями и полученную смесь оставляли для перемешивания при 0°C в течение 15 минут, затем добавляли 2,2,2-трифторэтилтрифторметансульфонат (110 мг, 0,47 ммоль). Смесь оставляли для перемешивания при 0°C в течение 30 минут, затем осторожно добавляли насыщенный водный раствор NaHCO3 (10 мл) и смесь экстрагировали при помощи EtOAc. Органический слой промывали водой, насыщенным солевым раствором, сушили над безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-20% EtOAc в гексане. Желаемые фракции концентрировали в вакууме с получением указанного в заголовке соединения, I-23. LRMS (ESI) рассчитано для C10H8BrF3NO [M+H]+: 294, найдено: 294.
Промежуточное соединение 24
N-(4-бромбензил)-2,2,2-трифторэтанамин

К раствору 4-бромбензилбромида (0,50 г, 2,0 ммоль) в CH3CN (8,0 мл) добавляли 2,2,2-трифторэтанамин (0,60 г, 6,1 ммоль) и Cs2CO3 (0,97 г, 3,0 ммоль). Смесь перемешивали при 40°C в течение 8 часов, затем распределяли между водой и EtOAc. Органическую фазу промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 9% EtOAc в гексане, с получением соединения I-24. LRMS (ESI) рассчитано для C9H10NBrF3 [M+H]+: 268, найдено 268. 1H ЯМР (400 МГц, CDCl3): δ 7,43 (д, J=8,4 Гц, 2H), 7,19 (д, J=8,4 Гц, 2H), 3,83 (с, 2H), 3,18-3,10 (кв., J=9,6 Гц, 2H).
Промежуточное соединение 25
(R и S)-1-(4-бромфенил)-2,2,2-трифторэтанол

К раствору 1-(4-бромфенил)-2,2,2-трифторэтанона (1,0 г, 3,95 ммоль) в ТГФ (10 мл) добавляли борогидрид натрия (164 мг, 4,35 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов, затем гасили водой и концентрировали в вакууме. Полученный остаток экстрагировали при помощи CH2Cl2 (× 2) и объединенные органические слои промывали насыщенным солевым раствором (× 2), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением 1-(4-бромфенил)-2,2,2-трифторэтанола в виде бесцветной жидкости. 1H ЯМР (600 МГц, DMSO-d6): δ 7,58 (д, J=8,4 Гц, 2H), 7,41 (д, J=8,2 Гц, 2H), 6,90 (д, J=5,6 Гц, 1H), 5,16 (м, 1H). Разделение энантиомеров осуществляли при помощи СКЖХ с использованием Chiral Technologies OJ-H, элюируя с использованием 5% изопропанольного модификатора в CO2. Время удерживания = 4,1 (энантиомер A - Промежуточное соединение 25A) & 5,1 (энантиомер B - Промежуточное соединение 25B) минут.
Промежуточное соединение 26-1
4-бром-N-изопропилбензолсульфонамид
К раствору пропан-2-амина (0,16 г, 2,6 ммоль) и DIPEA (0,78 г, 6,0 ммоль) в CH2Cl2 (7 мл) добавляли раствор 4-бромфенилсульфонилхлорида (0,51 г, 2,0 ммоль) в CH2Cl2 (14 мл). Смесь перемешивали при комнатной температуре в течение ночи, затем выливали в воду и экстрагировали при помощи CH2Cl2 (× 3). Органический слой концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5% EtOAc в гексане. Концентрирование желаемых фракций давало указанное в заголовке соединение I-26-1. 1H ЯМР (400 МГц, CDCl3): δ 7,75-7,72 (м, 2H), 7,65-7,62 (м, 2H), 4,43 (д, J=7,5 Гц, 1H), 3,49-3,44 (м, 1H), 1,08 (д, J=6,4 Гц, 6H).
Следуя процедуре, аналогичной той, которая описана для I-26-1 выше, были получены следующие арилбромиды, представленные в Таблице 5. В некоторых случаях общую процедуру модифицировали, используя TEA вместо DIPEA, или альтернативно, осуществляя реакцию в отсутствие основания.





(Разделяли при помощи СКЖХ, Chiralpak AD-H, 15% MeOH в CO2, Tr = 3,0 минут.)
(Разделяли при помощи СКЖХ, Chiralpak AD-H, 15% MeOH в CO2, Tr = 4,4 минут.)

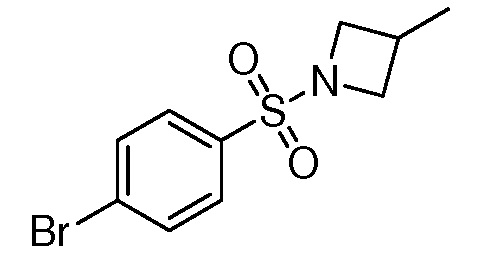
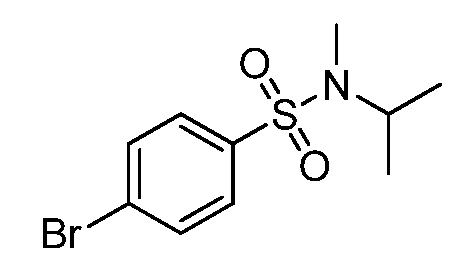




(СКЖХ разделение с использованием Chiralpak AD-H, 10% MeOH в CO2 Tr = 3,9 минут.)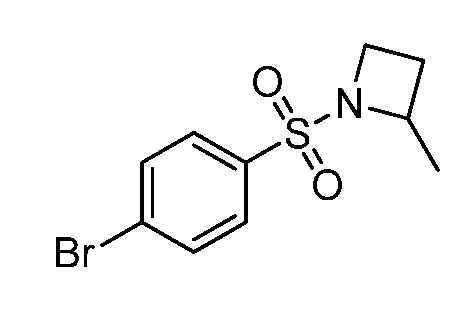
(СКЖХ разделение с использованием Chiralpak AD-H, 10% MeOH в CO2 Tr = 4,5 минут.)
Промежуточное соединение 27-1
5-бром-2-(трет-бутил)-2,3-дигидробензо[d]изотиазол-1,1-диоксид

Стадия 1: 4-бром-2-метилбензол-1-сульфонилхлорид

Хлорсульфоновую кислоту (63 г, 0,54 моль) медленно добавляли к охлажденному раствору (0°C) 1-бром-3-метилбензола (10,0 г, 58 ммоль) в CHCl3 (100 мл). Реакционную смесь оставляли для взаимодействия при перемешивании в течение 2 часов при 0°C, затем реакционную смесь выливали в ледяную воду и экстрагировали при помощи EtOAc. Органический слой затем промывали насыщенным солевым раствором, сушили над NaSO4, фильтровали и концентрировали в вакууме с получением 4-бром-2-метилбензол-1-сульфонилхлорида в виде твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 7,90 (д, J=8,4 Гц, 1H), 7,59-7,53 (м, 2H), 2,75 (с, 3H).
Стадия 2: 4-бром-N-(трет-бутил)-2-метилбензолсульфонамид

К раствору 4-бром-2-метилбензол-1-сульфонилхлорида (2,0 г, 7,4 ммоль) в CH2Cl2 (15 мл) добавляли раствор 2-метилпропан-2-амина (0,65 г, 8,9 ммоль) и триэтиламина (0,90 г, 8,9 ммоль) в CH2Cl2 (30 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 2 часов и затем при комнатной температуре в течение 16 часов. Смесь промывали раствором 0,1 M HCl, насыщенным водным раствором NaHCO3, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением 4-бром-N-(трет-бутил)-2-метилбензолсульфонамида в виде твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 7,78 (д, J=8,4 Гц, 1H), 7,63 (д, J=1,6 Гц, 1H), 7,59-7,56 (м, 2H), 2,57 (с, 3H), 1,09(с, 9H).
Стадия 3: 5-бром-2-(трет-бутил)бензо[d]изотиазол-3(2H)-он-1,1-диоксид

Смесь H5IO6 (5,9 г, 26 ммоль) в ацетонитриле (50 мл) перемешивали при комнатной температуре в течение 1 часа, затем добавляли CrO3 (33 мг, 0,33 ммоль) с последующим добавлением уксусного ангидрида (2,67 г, 26 ммоль). Полученный оранжевый раствор охлаждали до 0°C, добавляли 4-бром-N-(трет-бутил)-2-метил бензолсульфонамид (1,0 г, 3,3 ммоль). После перемешивания при 0°C в течение 15 минут реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 16 часов. Растворитель удаляли в вакууме и остаток экстрагировали при помощи EtOAc (× 3). Объединенные органические слои промывали насыщенным водным раствором NaHCO3, насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением 5-бром-2-(трет-бутил)бензо[d]изотиазол-3(2H)-он 1,1-диоксида в виде твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,82-8,14 (м, 3H), 1,66 (с, 9H).
Стадия 4: 5-бром-2-(трет-бутил)-2,3-дигидробензо[d]изотиазол-1,1-диоксид (I-27-1)
К раствору 5-бром-2-(трет-бутил)бензо[d]изотиазол-3(2H)-он 1,1-диоксида (0,20 г, 0,63 ммоль) в ТГФ (4 мл) добавляли BH3⋅Me2S (240 мг, 3,16 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 16 часов. После охлаждения до комнатной температуры, реакционную смесь гасили раствором 2 M HCl и экстрагировали при помощи EtOAc (× 2), объединенные экстракты промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали препаративной ТСХ с получением соединения I-27-1. 1H ЯМР (400 МГц, DMSO-d6) δ 7,83-7,56 (м, 3H), 4,55 (с, 2H), 1,46 (с, 9H).
Следуя способу, аналогичному тому, который описан для соединения I-27-1 выше, были получены следующие промежуточные соединения, представленные в Таблице 6:
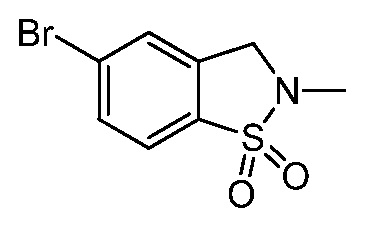
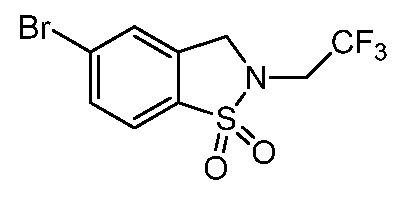
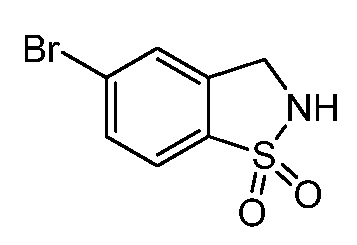
Промежуточное соединение 28
5-бром-2,3-дигидробензо[b]тиофен 1,1-диоксид

К раствору 5-бром-бензо[b]тиофен 1,1-диоксида (1,0 г, 4,1 ммоль) в этаноле (13,6 мл) при 0°C добавляли борогидрид натрия (193 мг, 5,10 ммоль). Полученную реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь затем охлаждали до 0°C и гасили 1н раствором HCl. Смесь экстрагировали этилацетатом (× 4) и объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенное масло очищали хроматографией на диоксиде кремния, элюируя смесью 20% EtOAc в гексане, с получением соединения I-28. 1H ЯМР (500 МГц, CDCl3): δ 7,62-7,53 (м, 2H), 7,51 (с, 1H), 3,55-3,45 (м, 2H), 3,39-3,29 (м, 2H).
Промежуточное соединение 29
1-(4-бромфенил)-2,2,2-трифторэтанамин

К раствору 1-(4-бромфенил)-2,2,2-трифторэтанона (1,00 г, 3,95 ммоль) в толуоле (14 мл) при комнатной температуре добавляли (по каплям) раствор бис(триметилсилил)амида лития (4,35 мл, 4,35 ммоль, 1M в ТГФ). Реакционную смесь перемешивали при комнатной температуре в течение 15 минут и затем добавляли BH3⋅ТГФ (7,90 мл, 7,90 ммоль, 1M в ТГФ). Реакционную смесь перемешивали при комнатной температуре в течение 20 минут, затем гасили при 0°C путем медленного добавления 2M водного раствора NaOH (5,93 мл, 11,9 ммоль). Смесь перемешивали при комнатной температуре в течение 90 минут, затем органический слой отделяли и промывали 1н водным раствором NaOH, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Разделение энантиомеров методом СКЖХ осуществляли из неочищенной реакционной смеси с использованием ChiralPak AZ-H, с 7% метанольного модификатора в CO2: время удерживания = 2,37 (I-29A) & 2,89 (I-29B) минут. LRMS (ESI) рассчитано для C8H8NBrF3 [M+H]+: 254, найдено 254. 1H ЯМР (600 МГц, CDCl3): δ 7,53 (д, J=8,5 Гц, 2H), 7,32 (д, J=8,5 Гц, 2H), 4,38 (кв., J=7,5 Гц, 1H), 1,78 (шир. с, 2H).
Промежуточное соединение 30-1
1,1'-((5-бром-1,3-фенилен)бис(метилен))бис(1H-пиразол)

Стадия 1: 1-бром-3,5-бис(бромметил)бензол

К 1-бром-3,5-диметилбензолу (5,00 г, 27,0 ммоль), 1-бромпирролидин-2,5-диону (7,20 г, 40,5 ммоль), (Z)-2,2'-(диазен-1,2-диил)бис(2-метилпропаннитрилу) (0,045 г, 0,27 ммоль) в атмосфере азота добавляли ацетонитрил (80 мл). Полученный раствор перемешивали в течение 1 часа при 80°C и затем разбавляли насыщенным водным раствором хлорида аммония и экстрагировали дихлорметаном (× 3). Объединенные органические слои концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя гексаном, с получением, после концентрирования желаемых фракций, 1-бром-3,5-бис(бромметил)бензола в виде твердого вещества.
Стадия 2: 1,1'-((5-бром-1,3-фенилен)бис(метилен))бис(1H-пиразол)
Раствор 1H-пиразола (1,80 г, 26,4 ммоль) в ацетонитриле (120 мл) и карбоната калия (3,60 г, 26,1 ммоль) перемешивали в атмосфере азота при 25°C в течение 1 часа, затем к смеси добавляли 1-бром-3,5-бис(бромметил)бензол (3,00 г, 8,75 ммоль) и раствор перемешивали еще в течение 16 часов. Реакционную смесь затем гасили путем добавления насыщенного водного раствора хлорида аммония, экстрагировали этилацетатом (× 3) и органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на диоксиде кремния, элюируя смесью 50% EtOAc в гексане. Концентрирование желаемых фракций давало соединение I-30-1 в виде твердого вещества. LRMS (ESI) рассчитано для C14H14N4Br [M+H]+: 317, найдено 317.
Следуя общей процедуре, описанной выше для соединения I-30-1, были получены промежуточные соединения, представленные в Таблице 7. В некоторых случаях, когда бензилбромид был коммерчески доступным, осуществляли только Стадию 2. В некоторых случаях стадию реакции замещения альтернативно можно модифицировать, осуществляя ее в присутствии каталитического KI и/или в ацетоне при температуре кипения с обратным холодильником.
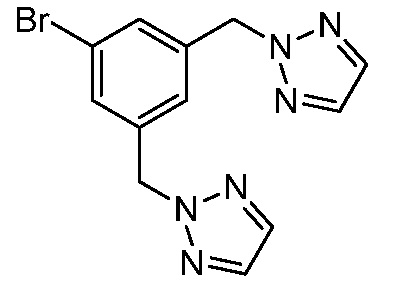




Промежуточное соединение 31-1
4-бром-N-(трет-бутил)-N-метилбензолсульфонамид

К раствору 4-бром-N-(трет-бутил)бензолсульфонамида (1,00 г, 3,42 ммоль) и карбоната калия (0,946 г, 6,84 ммоль) в DMF (20,0 мл) добавляли метилиодид (0,43 мл, 6,8 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 6 часов, затем гасили путем добавления воды и экстрагировали при помощи EtOAc (× 3). Органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме и очищали хроматографией на диоксиде кремния, элюируя смесью 0-10% EtOAc в гексане, с получением соединения I-31-1 в виде масла. LRMS (ESI) рассчитано для C11H17NBrO2SNa [M+Na]+: 328, найдено 328. 1H ЯМР (600 МГц, CDCl3): δ 7,69 (д, J=8,7 Гц, 2H), 7,62 (д, J=8,7 Гц, 2H), 2,97 (с, 3H), 1,35 (с, 9H).
Следующее промежуточное соединение, представленное в Таблице 8, может быть получено аналогично получению соединения I-31-1, описанному выше, с использованием Cs2CO3 при 50°C или NaH при 0-25°C.

Промежуточные соединения 32 и 33
(R или S) 2-(4-бромфенил)-1,1,1-трифторпропан-2-ол (I-32)
(R или S) 1-бром-4-(1,1,1-трифтор-2-метоксипропан-2-ил)бензол (I-33)

Стадия 1: (R или S) 2-(4-бромфенил)-1,1,1-трифторпропан-2-ол (I-32)
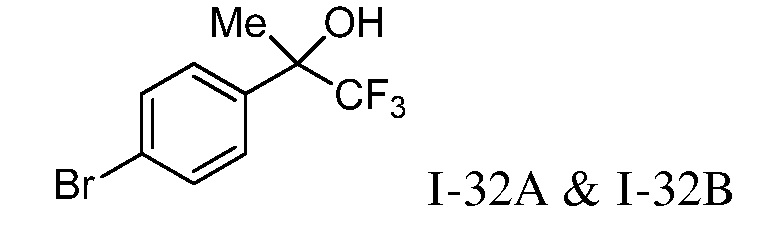
В высушенную в печи круглодонную колбу с магнитной мешалкой в атмосфере N2 загружали 1-(4-бромфенил)-2,2,2-трифторэтанон (2,0 г, 7,9 ммоль) и ТГФ (13 мл). Раствор охлаждали до 0°C и добавляли метилмагнийбромид (17 мл, 23,7 ммоль, 1,4 M в диэтиловом эфире). Реакционную смесь нагревали до комнатной температуры в течение 1-2 часов и гасили путем добавления насыщенного водного раствора NH4Cl (10 мл). Полученную смесь экстрагировали при помощи Et2O (× 3) и объединенные органические слои концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением рацемического 2-(4-бромфенил)-1,1,1-трифторпропан-2-ола. LRMS (ESI) рассчитано для C9H9BrF3O [M+H]+: 269, найдено 269. 1H ЯМР (CDCl3, 500МГц): δ 7,54 (д, J=8,31 Гц, 2H), 7,47 (д, J=8,26 Гц, 2H), 2,44 (с, 1H), 1,78 (с, 3H). Разделение энантиомеров осуществляли методом СКЖХ очистки с использованием Chiral Technology AZ-H с 5% MeOH в CO2. Tr = 2,6 минут (Промежуточное соединение I-32A) & 3,2 минут (Промежуточное соединение I-32B).
Стадия 2: (R или S) 1-бром-4-(1,1,1-трифтор-2-метоксипропан-2-ил)бензол (I-33)
В высушенную в печи круглодонную колбу с магнитной мешалкой в атмосфере N2 загружали 2-(4-бромфенил)-1,1,1-трифторпропан-2-ол I-32A (300 мг, 1,10 ммоль) и DMF (3,5 мл). Раствор охлаждали до 0°C, добавляли гидрид натрия (67 мг, 1,7 ммоль, 60% масс. в минеральном масле) и реакционную смесь перемешивали в течение 30 минут. Затем добавляли иодметан (0,21 мл, 3,3 ммоль) и реакционную смесь нагревали до комнатной температуры в течение 1-2 часов, гасили путем добавления насыщенного водного раствора NH4Cl (10 мл) и экстрагировали при помощи Et2O (× 3). Объединенные органические слои концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc , с получением соединения I-33A. Соединение I-33B получали способом, аналогичным способу получения соединения I-33A, описанному выше, с использованием соединения I-32B. 1H ЯМР (CDCl3, 500 МГц): δ 7,54 (д, J=8,19 Гц, 2H), 7,38 (д, J=8,14 Гц, 2H), 3,23 (с, 3H), 1,76 (с, 3H).
Промежуточные соединения 34-1
5-бром-2-циклопентил-2,3-дигидро-1H-изоиндол-1-он

Стадия 1: метил-4метил-4-бром-2-(бромметил)бензоат

К раствору NBS (38,8 г, 218 ммоль) и метил-4метил-4-бром-2-метилбензоата (50,0 г, 218 ммоль) в CCl4 (1,00 л) добавляли AIBN (3,58 г, 21,8 ммоль) и раствор перемешивали в течение 16 часов при температуре кипения с обратным холодильником. Реакционную смесь охлаждали до температуры окружающей среды, гасили путем добавления воды (300 мл) и органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью гексан:этилацетат (100:1), с получением указанного в заголовке соединения в виде твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,81 (д, J=8,4 Гц, 1H), 7,63 (м, 1H), 7,51 (д, J=8,4 Гц, 1H), 4,90 (с, 2H), 3,94 (с, 3H).
Стадия 2: 5-бром-2-циклопентил-2,3-дигидро-1H-изоиндол-1-он (I-34-1)
К раствору метил-4метил-4-бром-2-(бромметил)бензоата (6,00 г, 19,5 ммоль) в толуоле (100 мл) добавляли циклопентиламин (1,83 г, 21,49 ммоль) и толуол (100 мл). Добавляли триэтиламин (3,96 г, 39,1 ммоль) и полученный раствор перемешивали в течение 16 часов при 110°C. Полученную смесь охлаждали до комнатной температуры и концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0,5-1% метанола в дихлорметане, с получением соединения I-34-1 в виде твердого вещества: ЖХ/МС (ESI) рассчитано для C13H15BrNO [M + H]+: 280, 282, найдено 280, 282; 1H ЯМР (400 МГц, CD3OD) δ 7,81 (с, 1H), 7,70-7,65 (м, 2H), 4,71-4,64 (м, 1H), 4,53 (с, 2H), 2,07-1,91 (м, 2H), 1,89-1,81 (м, 2H), 1,79-1,74 (м, 4H).
Следующие соединения, представленные в Таблице 9, были получены способом, аналогичным способу получения соединения I-34-1, описанному выше.

1H ЯМР (300 МГц, CDCl3): δ 7,65 (с, 1H), 7,57 (м, 2H), 4,43 (с, 2H), 1,59 (с, 9H).

1H ЯМР (300 МГц, CDCl3) δ 7,74 (д, J=7,2 Гц, 1H), 7,60 (с, 1H), 7,62 (д, J=7,2 Гц, 1H), 4,33 (с, 2H), 4,23 (м, 1H), 1,87 (м, 4H), 1,73 (м, 1H), 1,50-1,39 (м, 4H).
Промежуточное соединение 35-1
этил-3-(4-бромфенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноат
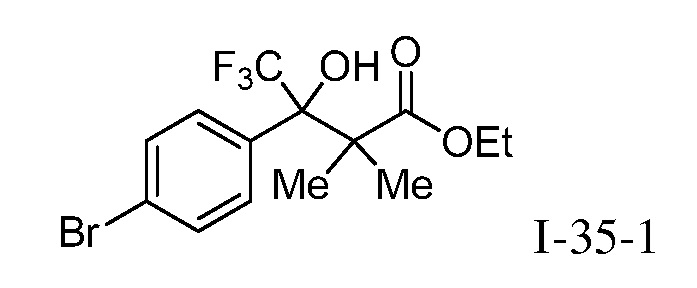
В высушенную в печи круглодонную колбу в атмосфере азота загружали этилизобутират (0,69 г, 5,9 ммоль) и ТГФ (2,5 мл). Раствор охлаждали до -78°C и добавляли диизопропиламид лития (3,0 мл, 5,9 ммоль, 2,0 M в ТГФ). Реакционную смесь перемешивали в течение 30 минут и затем добавляли 1-(4-бромфенил)-2,2,2-трифторэтанон (0,50 г, 2,0 ммоль). Реакционную смесь нагревали до комнатной температуры в течение 1-2 часов и гасили путем добавления насыщенного водного раствора NH4Cl. Полученную смесь экстрагировали при помощи EtOAc (× 3) и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением соединения I-35-1. LRMS (ESI) рассчитано для C14H17BrF3O3 [M+H]+: 369, найдено 369. 1H ЯМР (CDCl3, 500 МГц): δ 7,60 (д, J=8,2 Гц, 2H), 7,53 (д, J=8,5 Гц, 2H), 4,31-4,27 (м, 2H), 1,38 (д, J=3,5 Гц, 3H), 1,30 (с, 6H).
Следующие соединения, представленные в Таблице 10, были получены способом, аналогичным способу получения соединения I-35-1, описанным выше.

Промежуточное соединение 36
5-бром-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-1-ол
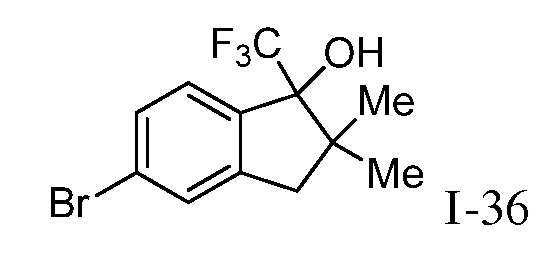
Стадия 1: 5-бром-2,2-диметил-2,3-дигидро-1H-инден-1-он
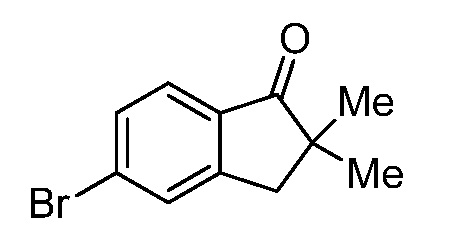
К раствору 5-бром-2,3-дигидро-1H-инден-1-она (0,50 г, 2,4 ммоль) в DMF (7,5 мл) при 0°C добавляли гидрид натрия (237 мг, 5,9 ммоль, 60% масс. дисперсия в минеральном масле). Реакционную смесь перемешивали в течение 30 минут и затем добавляли иодметан (0,37 мл, 5,9 ммоль). Реакционную смесь нагревали до комнатной температуры в течение 1-2 часов, гасили путем добавления насыщенного водного раствора NH4Cl и полученную смесь экстрагировали при помощи Et2O (× 3). Объединенные органические слои концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C11H12BrO [M+H]+: 240, найдено 240. 1H ЯМР (CDCl3, 500 МГц): δ 7,64-7,61 (м, 2H), 7,53 (д, J=8,2 Гц, 1H), 2,99 (с, 2H), 1,26-1,24 (с, 6H).
Стадия 2: 5-бром-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-1-ол (I-36)
К раствору 5-бром-2,2-диметил-2,3-дигидро-1H-инден-1-она (2,2 г, 9,5 ммоль) в ТГФ (23 мл) при 0°C добавляли (трифторметил) триметилсилан (7,00 мл, 47,4 ммоль) с последующим медленным добавлением (экзотерма) тетрабутиламмонийфторида (11,9 мл, 11,9 ммоль, 1M в ТГФ). Реакционную смесь нагревали до комнатной температуры в течение 1-2 часов и перемешивали в течение ночи, затем гасили путем добавления насыщенного водного раствора NH4Cl. Полученную смесь экстрагировали при помощи EtOAc (× 3) и объединенные органические слои концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением соединения I-36. 1H ЯМР (CDCl3, 500 МГц): δ 7,43-7,41 (м, 2H), 7,33 (д, J=8,1 Гц, 1H), 2,89 (д, J=15,7 Гц, 1H), 2,82 (д, J=15,6 Гц, 1H), 1,27 (с, 3H), 1,16 (с, 3H).
Промежуточное соединение 37-1
2-(4-бромфенил)-1,1,1-трифтор-3,3-диметилбутан-2-ол

К раствору 1-(4-бромфенил)-2,2-диметилпропан-1-она (0,20 г, 0,80 ммоль) в ТГФ (1 мл) при 0°C, добавляли (трифторметил)триметилсилан (0,60 мл, 4,2 ммоль) с последующим медленным добавлением (экзотерма) тетрабутиламмонийфторида (0,9 мл, 0,9 ммоль, 1M в ТГФ). Реакционную смесь нагревали до комнатной температуры в течение 1-2 часов и перемешивали в течение ночи. Реакционную смесь гасили путем добавления насыщенного водного раствора NH4Cl (10 мл) и полученную смесь экстрагировали при помощи EtOAc (× 3). Объединенные органические слои концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением соединения I-37-1. 1H ЯМР (CDCl3, 500 МГц): δ 7,55-7,47 (м, 4H), 1,04 (с, 9H).
Следующие соединения, представленные в Таблице 11, были получены способом, аналогичным способу получения соединения I-37-1, описанному выше.
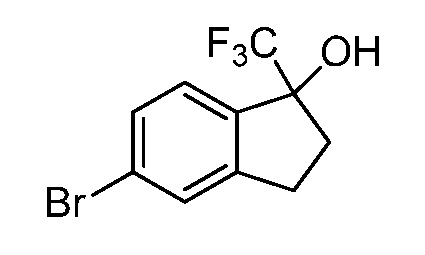
(разделяли при помощи СКЖХ с использованием Chiral Technology AZ-H, 5% MeOH в CO2, Пик 1, Tr = 1,7 минут)

(разделяли при помощи СКЖХ с использованием Chiral Technology AZ-H, 5% MeOH в CO2, Пик 2, Tr = 2,1 минут)
Промежуточное соединение 38
трет-бутил-2-(4-бром-N-метилфенилсульфонамидо)-2-метилпропаноат

Стадия 1: трет-бутил-2-(4-бромфенилсульфонамидо)-2-метилпропаноат

К раствору 4-бромбензол-1-сульфонилхлорида (1 г, 4 ммоль) в DCM (9 мл) при 0°C добавляли триэтиламин (1,3 мл, 9,4 ммоль) и трет-бутил-2-амино-2-метилпропаноат (0,50 г, 3,1 ммоль). Реакционную смесь нагревали до комнатной температуры в течение ночи, гасили насыщенным водным раствором NH4Cl и разбавляли при помощи DCM. Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали через Целит и концентрировали в вакууме с получением указанного в заголовке соединения, которое использовали как таковое на следующей стадии. 1H ЯМР (CDCl3, 500 МГц): δ 7,74 (м, 2H), 7,61 (м, 2H), 5,40 (шир. с, 1H), 1,44 (с, 9H), 1,40 (с, 6H).
Стадия 2: трет-бутил-2-(4-бром-N-метилфенилсульфонамидо)-2-метилпропаноат (I-38)
К раствору трет-бутил-2-(4-бромфенилсульфонамидо)-2-метилпропаноата (815 мг, 2,2 ммоль) в DMF (6,5 мл) при 0°C добавляли гидрид натрия (129 мг, 3,2 ммоль, 60% масс. дисперсия в минеральном масле). Реакционную смесь перемешивали в течение 30 минут, затем добавляли метилиодид (0,40 мл, 6,5 ммоль). Реакционную смесь нагревали до комнатной температуры в течение 1-2 часов, затем гасили насыщенным водным раствором NH4Cl. Реакционную смесь разбавляли при помощи Et2O и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали через Целит и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением соединения I-38. 1H ЯМР (CDCl3, 500 МГц): δ 1H ЯМР (500 МГц, CDCl3): δ 7,86 (м, 2H), 7,63 (м, 2H), 2,72 (с, 3H), 1,48 (с, 15H).
Промежуточное соединение 39-1
(4-бром-2-метилфенил)(4,4-дифторпиперидин-1-ил)метанон

К раствору 4-бром-2-метилбензойной кислоты (0,75 г, 3,5 ммоль) в DMF (9 мл) добавляли HATU (2,6 г, 7,0 ммоль), основание Хунига (2,4 мл, 14 ммоль) и 4,4-дифторпиперидин (0,84 г, 7,0 ммоль). Полученную реакционную смесь перемешивали в течение 16 часов, концентрировали в вакууме и неочищенное масло очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением соединения I-39-1. 1H ЯМР (500 МГц, CDCl3): δ 7,42-7,37 (м, 2H), 7,05 (д, J=8,1 Гц, 1H), 4,02 (м, 1H), 3,82 (м, 1H), 3,36 (м, 2H), 2,30 (с, 3H), 2,11-2,07 (м, 2H), 1,88 (м, 2H).
Таблица 12 раскрывает Примеры, которые были получены аналогично получению соединения I-39-1.
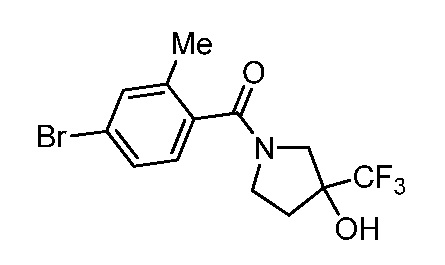
(выделен из Пика 1 посредством СКЖХ: Chiralpak AS-H, 10% MeOH в CO2, Tr = 2,57 минут)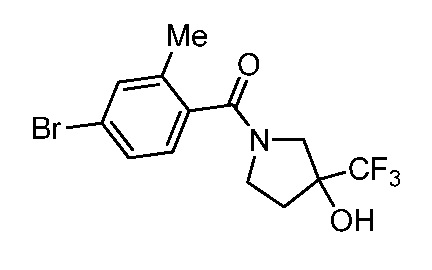
(выделен из Пика 2 посредством СКЖХ: Chiralpak AS-H, 10% MeOH в CO2, Tr = 3,10 минут)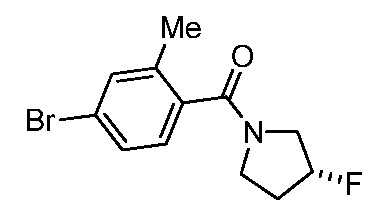





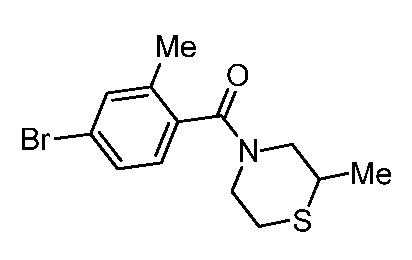


Промежуточное соединение 40-1
8-окса-3-азабицикло[3,2,1]октан-3-ил(4-бром-2-метилфенил)метанон
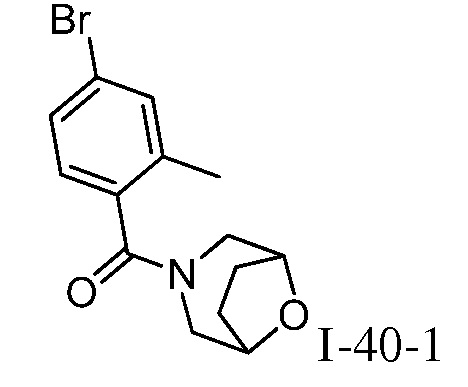
Стадия 1: 4-бром-2-метилбензоилхлорид

4-Бром-2-метилбензойную кислоту (1,40 г, 6,50 ммоль) растворяли в тионилхлориде (20 мл). Смесь перемешивали при 80°C в течение 2 часов и затем концентрировали в вакууме с получением 1,35 г (неочищенный) 4-бром-2-метилбензоилхлорида в виде твердого вещества, которое использовали как таковое на следующей стадии.
Стадия 2: 8-окса-3-азабицикло[3,2,1]октан-3-ил(4-бром-2-метилфенил)метанон I-40-1
4-Бром-2-метилбензоилхлорид (1,24 г, 5,30 ммоль) добавляли к суспензии (1R,5S)-8-окса-3-азабицикло[3,2,1]октана (0,50 г, 4,42 ммоль) и триэтиламина (2,51 мл, 18,0 ммоль) в DCM (10 мл) при температуре окружающей среды. Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов, затем разбавляли при помощи DCM (30 мл) и промывали насыщенным солевым раствором (× 2). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением масла, которое очищали хроматографией на диоксиде кремния, элюируя смесью петролейный эфир/EtOAc (5/1), с получением указанного в заголовке соединения в виде твердого вещества: LRMS (ESI) рассчитано для C14H17BrNO2 [M+H]+: 310 312 (1:1) найдено 310 312 (1:1); 1H ЯМР (300 МГц, CDCl3): δ 7,41 (с, 1H), 7,36 (д, J=8,1 Гц, 1H), 7,08 (д, J=8,1 Гц, 1H), 4,76 (м, 1H), 3,85 (м, 1H), 3,72 (м, 1H), 3,60-3,50 (м, 3H), 2,34 (с, 3H), 2,15-1,86 (м, 4H).
Таблица 13 раскрывает Примеры, которые были получены аналогично получению соединения I-40-1.

Промежуточное соединение 41
1-бром-4-(трет-бутилсульфонил)бензол
К раствору (4-бромфенил)(трет-бутил)сульфана (1,00 г, 4,08 ммоль) в DCM (10,0 мл) добавляли m-CPBA (2,01 г, 8,97 ммоль, 77% масс.) при комнатной температуре. Полученный раствор перемешивали при комнатной температуре в течение одного часа и затем гасили насыщенным водным раствором Na2S2O3 и насыщенным водным раствором Na2CO3. Реакционную смесь экстрагировали при помощи DCM (× 3), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением соединения I-41 в виде твердого вещества. 1H ЯМР (600 МГц, DMSO-d6): δ 7,89 (д, J=8,7 Гц, 2H), 7,75 (д, J=8,7 Гц, 2H), 1,24 (с, 9H).
Промежуточное соединение 42-1
N-(1-(4-бромфенил)-2,2,2-трифторэтил)-2-метилпропан-2-амин
Стадия 1: 1-(4-бромфенил)-2,2,2-трифторэтанол
1-(4-Бромфенил)-2,2,2-трифторэтанон (1,73 г, 6,84 ммоль) растворяли в ТГФ (3,4 мл) и обрабатывали борогидридом натрия (0,285 г, 7,52 ммоль) при 0°C. Реакционную смесь затем нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляли при помощи DCM и промывали водой и насыщенным солевым раствором. Объединенные органические слои сушили над Na2SO4, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5-30% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением указанного в заголовке соединения в виде масла. 1H ЯМР (500 МГц, CDCl3) δ 7,56 (д, J=8,5 Гц, 2H), 7,36 (д, J=8,5 Гц, 2H), 5,06-4,96 (м, 1H), 2,63 (д, J=4,5 Гц, 1H).
Стадия 2: 1-(4-бромфенил)-2,2,2-трифторэтил трифторметансульфонат
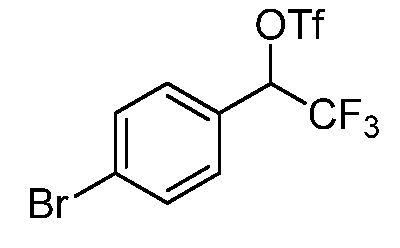
Раствор 1-(4-бромфенил)-2,2,2-трифторэтанола (1,5 г, 5,9 ммоль) и 2,6-лутидина (1,10 мл, 9,41 ммоль) в DCE (12 мл) охлаждали до -15°C и добавляли по каплям трифторметансульфоновый ангидрид (8,82 мл, 8,82 ммоль, 1,0 M в DCM). Реакционную смесь перемешивали при температуре от -15°C до комнатной температуры в течение 1 часа, затем разбавляли при помощи DCM и промывали водой, 1н водным раствором HCl и насыщенным солевым раствором. Объединенные органические слои сушили над Na2SO4, фильтровали и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде жидкости. 1H ЯМР (500 МГц, CDCl3) δ 7,64 (д, J=8,3 Гц, 2H), 7,37 (д, J=8,3 Гц, 2H), 5,85-5,74 (м, 1H).
Стадия 3: N-(1-(4-бромфенил)-2,2,2-трифторэтил)-2-метилпропан-2-амин (I-42-1)
1-(4-Бромфенил)-2,2,2-трифторэтилтрифторметансульфонат (7,59 г, 19,6 ммоль) растворяли в циклогексане (70 мл) и добавляли 2-метилпропан-2-амин (6,23 мл, 58,8 ммоль), DMAP (0,240 г, 1,96 ммоль) и измельченный высушенный карбонат калия (5,42 г, 39,2 ммоль) (сушили в вакууме при 60°C в течение одного часа). Реакционную смесь нагревали до 75°C и перемешивали в течение 48 часов. Реакционную смесь разбавляли при помощи DCM и промывали водой. Объединенные органические слои сушили над Na2SO4, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 2-20% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением соединения I-42-1 в виде жидкости. LRMS (ESI) рассчитано для C12H16BrF3N [M+H]+: 310, найдено 310.
Следуя процедуре получения, аналогичной той, которая описана для Промежуточного соединения I-42-1 выше, были синтезированы следующие промежуточные соединения, представленные в Таблице 14. В отдельных случаях, общую процедуру модифицировали, не используя DMAP, и/или неочищенный продукт использовали как таковой, и/или альтернативно используя 2,0-3,0 эквивалентов амина и/или 1,5-3,0 эквивалентов измельченного высушенного карбоната калия.
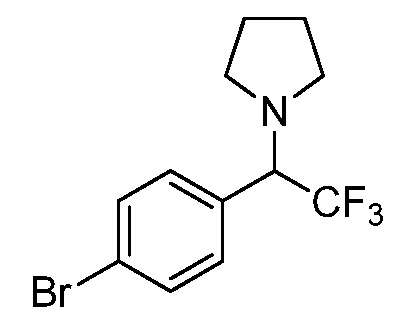

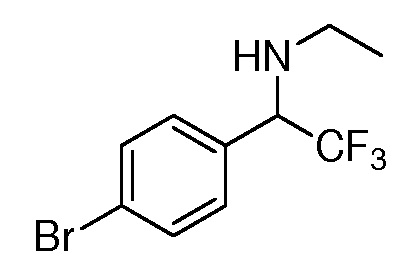

Промежуточное соединение I-43
2-(4-бромфенил)-N-изопропилпропан-2-амин

2-(4-Бромфенил)пропан-2-амин (0,5 г, 2,3 ммоль) растворяли в DCM (20 мл) и ацетоне (2,5 мл). Затем добавляли по порциям триацетоксиборогидрид натрия (1,5 г, 7,0 ммоль) и мутную реакционную смесь перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь затем разбавляли этилацетатом и промывали насыщенным раствором бикарбоната натрия и насыщенным солевым раствором. Объединенные органические слои сушили над Na2SO4, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5-40% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением соединения I-43 в виде жидкости. LRMS (ESI) рассчитано для C12H19BrN [M+H]+: 256, найдено 256.
Промежуточное соединение I-44
трет-бутил-3-((4-бромфенил)сульфонил)-3-метилбутаноат
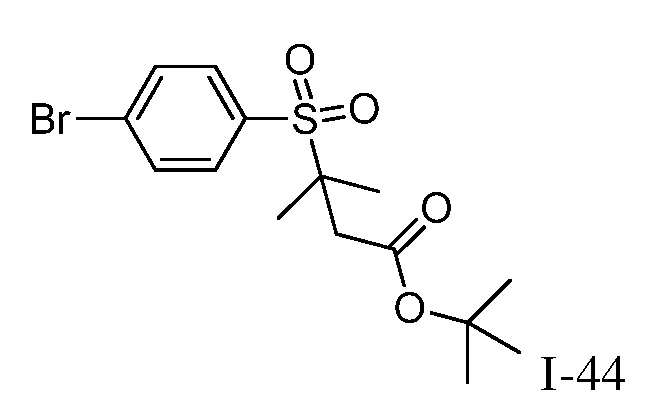
1-Бром-4-(пропан-2-сульфонил)бензол (0,25 г, 0,90 ммоль) растворяли в ТГФ (4,75 мл) и охлаждали до 0°C. Затем добавляли по каплям LDA (0,57 мл, 1,1 ммоль, 2,0 M в ТГФ). Реакционную смесь перемешивали при 0°C в течение 1 часа и затем добавляли трет-бутилбромацетат (0,42 мл, 2,85 ммоль) и реакционную смесь нагревали до комнатной температуры в течение ночи. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором. Объединенные органические слои сушили над Na2SO4, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 2-30% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением соединения I-44 в виде масла. LRMS (ESI) рассчитано для C15H22BrO4S [M+H]+: 377, найдено 377.
Промежуточное соединение I-45
1-(1-(4-бромфенил)этил)пирролидин
1-(4-Бромфенил)этанон (0,50 г, 2,5 ммоль) и пирролидин (1,04 мл, 12,6 ммоль) растворяли в метаноле (8,5 мл) и добавляли цианоборогидрид натрия (0,17 г, 2,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь разбавляли этилацетатом, промывали насыщенным раствором бикарбоната натрия, насыщенным солевым раствором и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5-40% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением соединения I-45. LRMS (ESI) рассчитано для C12H17BrN [M+H]+: 254, найдено 254.
Промежуточное соединение I-46
1-бром-4-((2,2-диметилциклопентил)сульфонил)бензол
Стадия 1: 2,2-диметилциклопентанол
2,2-Диметилциклопентанон (0,56 мл, 4,5 ммоль) растворяли в ТГФ (2,0 мл) и метаноле (0,5 мл) и охлаждали до 0°C. Добавляли борогидрид натрия (0,25 г, 6,7 ммоль) и реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Затем добавляли метанол (1,0 мл) и водный раствор NaOH (2,0 мл, 1,0 н) и реакционную смесь перемешивали в течение ночи. Реакционную смесь разбавляли дихлорметаном и промывали водой и насыщенным солевым раствором. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5-40% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением указанного в заголовке соединения в виде жидкости. 1H ЯМР (500 МГц, CDCl3) δ 3,73-3,64 (м, 1H), 2,10-1,98 (м, 1H), 1,80-1,67 (м, 1H), 1,65-1,50 (м, 3H), 1,42-1,35 (м, 1H), 1,32 (д, J=4,2 Гц, 1H), 0,97 (с, 3H), 0,95 (с, 3H).
Стадия 2: 2,2-диметилциклопентилметансульфонат

2,2-Диметилциклопентанол (257 мг, 2,20 ммоль) растворяли в DCM (4,0 мл) и добавляли триэтиламин (0,94 мл, 6,8 ммоль). Реакционную смесь охлаждали до 0°C и добавляли метансульфонилхлорид (0,26 мл, 3,4 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение двух часов. Добавляли дополнительное количество триэтиламина (0,94 мл, 6,8 ммоль) и метансульфонилхлорида (0,26 мл, 3,4 ммоль) и реакционную смесь перемешивали при 40°C в течение одного часа. Затем добавляли метансульфоновый ангидрид (0,59 г, 3,4 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь разбавляли дихлорметаном и промывали водным раствором HCl (1,0 н) и насыщенным солевым раствором. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5-40% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением указанного в заголовке соединения в виде жидкости. 1H ЯМР (500 МГц, CDCl3) δ 4,61-4,55 (м, 1H), 3,00 (с, 3H), 2,22-2,15 (м, 1H), 1,98-1,92 (м, 1H), 1,89-1,79 (м, 1H), 1,74-1,65 (м, 1H), 1,65-1,59 (м, 1H), 1,50-1,43 (м, 1H), 1,06 (с, 3H), 1,02 (с, 3H).
Стадия 3: (4-бромфенил)(2,2-диметилциклопентил)сульфан

4-Бромбензолтиол (170 мг, 0,900 ммоль), 2,2-диметилциклопентилметансульфонат (190 мг, 0,989 ммоль) и карбонат калия (250 мг, 1,80 ммоль) растворяли в DMF (4,5 мл) и реакционную смесь перемешивали при 60°C в течение 3,5 часов, затем нагревали до 100°C в условиях микроволнового облучения в течение 30 минут. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Объединенные органические слои сушили над Na2SO4, фильтровали и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения, которое было достаточно чистым для использования на следующей стадии без дополнительной очистки. 1H ЯМР (500 МГц, CDCl3) δ 7,44 (д, J=8,5 Гц, 2H), 7,35 (д, J=8,5 Гц, 2H), 3,10 (т, J=8,6 Гц, 1H), 2,26-2,18 (м, 2H), 1,79-1,73 (м, 2H), 1,62 (м, 1H), 1,52-1,46 (м, 1H), 1,08 (с, 3H), 0,99 (с, 3H).
Стадия 4: 1-бром-4-((2,2-диметилциклопентил)сульфонил)бензол (I-46)
(4-Бромфенил)(2,2-диметилциклопентил)сульфан (0,2 г, 0,7 ммоль) растворяли в DCM (2,0 мл) и добавляли mCPBA (0,27 г, 1,5 ммоль, 77% масс. макс.). Реакционную смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь разбавляли дихлорметаном и промывали водным раствором NaOH (1,0 н) и насыщенным солевым раствором. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5-30% EtOAc в гексане, и желаемые фракции концентрировали в вакууме с получением соединения I-46 в виде твердого вещества. LRMS (ESI) рассчитано для C13H18BrO2S [M+H]+: 317, найдено 317.
Промежуточное соединение 47-1
1-бром-4-((2,3-диметилбутан-2-ил)сульфонил)бензол

К раствору 1-бром-4-(изопропилсульфонил)бензола (100 мг, 0,38 ммоль) в безводном ТГФ (2 мл) медленно добавляли LDA (0,19 мл, 0,38 ммоль, 2,9 M в ТГФ/гептане/этилбензоле) при -78°C. Через 1,5 часа добавляли иодэтан (91 мкл, 1,1 ммоль) и смеси давали нагреться до комнатной температуры в течение ночи. Смесь разбавляли насыщенным водным раствором хлорида аммония, экстрагировали этилацетатом (× 3) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-40% этилацетата/гексан, с получением промежуточного соединения I-47-1 в виде твердого вещества. 1H ЯМР (600 МГц, CDCl3): δ 7,71 (д, J=8,8 Гц, 2H), 7,67 (д, J=8,2 Гц, 2H), 1,71 (кв., J=7,6 Гц, 2H), 1,25 (с, 6H), 0,93 (т, J=7,6 Гц, 3H).
Следующие промежуточные соединения, представленные в Таблице 15, были получены аналогичным способом с использованием процедуры, описанной выше для соединения I-47-1.

Промежуточное соединение 48
1-бром-4-((S и R)-пропан-2-илсульфонимидоил)бензол

Стадия 1: (4-бромфенил)(изопропил)сульфан

К 4-бромтиофенолу (1,00 г, 5,29 ммоль) добавляли ТГФ (17,6 мл) и затем NaH (233 мг, 5,82 ммоль, 60% масс. в минеральном масле) и реакционную смесь перемешивали при 0°C в течение 1 часа, затем добавляли 2-бромпропан (1,24 г, 10,1 ммоль). Реакционную смесь перемешивали в течение ночи, фильтровали через Целит и концентрировали в вакууме. Остаток затем очищали на диоксиде кремния, элюируя смесью 2-30% EtOAc/гексан, с получением желаемого продукта в виде масла. 1H ЯМР (600 МГц, CDCl3) δ 7,41 (д, J=8,4 Гц, 2H), 7,25 (д, J=8,4 Гц, 2H), 3,34 (септет, J=6,6 Гц, 1H), 1,29 (д, J=6,6 Гц, 6H).
Стадия 2: 1-бром-4-(изопропилсульфинил)бензол
К (4-бромфенил)(изопропил)сульфану (1,25 г, 5,40 ммоль) добавляли CH2Cl2 (18,0 мл) и затем m-CPBA (1,21 г, 5,40 ммоль, 77% масс. макс.) при 0°C. Реакционную смесь перемешивали в течение ночи, затем гасили путем добавления насыщенного раствора NaHCO3 и раствора сульфита натрия. Раствор затем перемешивали в течение 15 минут, экстрагировали при помощи DCM (× 3) и органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали на диоксиде кремния, элюируя смесью 2-40% EA/гексан, с получением масла. 1H ЯМР (600 МГц, CDCl3) δ 7,65 (д, J=8,4 Гц, 2H), 7,46 (д, J=8,4 Гц, 2H), 2,81 (септет, J=6,6 Гц, 1H), 1,23 (д, J=6,6 Гц, 3H), 1,12 (д, J=6,6 Гц, 3H).
Стадия 3: 4-метил-N-[(R и S)-изопропилоксидо-(4-бромфенил)-λ4-сульфанилиден]-бензолсульфонамид

Дегазированный трифторметансульфонат меди(II) (21 мг, 0,057 ммоль) и ацетонитрил (17,2 мл) вместе с 1-бром-4-(изопропилсульфинил)бензолом (175 мг, 0,708 ммоль) перемешивали в атмосфере аргона в течение 10 минут, затем добавляли [N-(p-толуолсульфонил)имино]фенилиодинан (378 мг, 1,01 ммоль) и реакционную смесь перемешивали при 25°C в течение ночи и затем при 50°C в течение 7 часов. Реакционную смесь концентрировали в вакууме и нагружали непосредственно на диоксид кремния и элюировали смесью 0-40% EtOAc/гексан. Концентрирование желаемых фракций давало указанное в заголовке соединение в виде пенистого вещества. LRMS (ESI) рассчитано для C16H19NO3S2Br [M+H] +: 416, найдено 416. 1H ЯМР (600 МГц, CDCl3) δ 7,80 (м, 4H), 7,73 (д, J=7,5 Гц, 2H), 7,24 (м, 2H), 3,60 (септет, J=6,6 Гц, 1H), 2,37 (с, 3H), 1,35 (д, J=6,6 Гц, 3H), 1,25 (д, J=6,6 Гц, 3H).
Стадия 4: 1-бром-4-((S и R)-пропан-2-илсульфонимидоил)бензол (I-48)
К 4-метил-N-[(R и S)-изопропилоксидо-(4-бромфенил)-λ4-сульфанилиден]-бензолсульфонамиду (1,39 г, 3,34 ммоль) добавляли концентрированную серную кислоту (20 мл) при 0°C и реакционную смесь перемешивали при этой температуре в течение 45 минут, затем давали нагреться до комнатной температуры в течение 15 минут. Реакционную смесь затем разбавляли при помощи CH2Cl2 и гасили путем медленного добавления насыщенного раствора бикарбоната натрия. Нейтрализованный раствор затем экстрагировали при помощи CH2Cl2 (× 3), затем EtOAc (× 2) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Очистка на диоксиде кремния с элюированием смесью 5-80% EtOAc в гексане давала масло. 1H ЯМР (600 МГц, CDCl3): δ 7,80 (м, 4H), 7,81 (д, J=8,4 Гц, 2H), 7,69 (д, J=8,4 Гц, 2H), 3,27 (септет, J=6,6 Гц, 1H), 1,33 (д, J=7,2 Гц, 3H), 1,28 (д, J=6,6 Гц, 3H).
Промежуточное соединение 49
1-(4-бромфенил)-3,5-диметил-1H-пиразол

Стадия 1: (4-бромфенил)гидразин

К суспензии 4-броманилина (100 г, 0,581 моль) в воде (500 мл) и концентрированной HCl (1,0 л) добавляли по каплям раствор NaNO2 (40 г, 0,58 моль) в воде (250 мл) при 0°C в течение 30 минут и полученную реакционную смесь перемешивали при 0°C в течение 30 минут. Реакционную смесь затем добавляли к раствору SnCl2 (523 г, 2,32 моль) в концентрированной HCl (1,0 л) при 0°C в течение 30 минут. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, затем охлаждали до 5°C и осажденные твердые вещества фильтровали и сушили при 40°C с получением указанного в заголовке соединения в виде твердого вещества. 1H ЯМР (300 МГц, DMSO-d6): δ 10,40 (шир. с, 3H), 7,45 (д, J=8,7 Гц, 2H), 6,96 (д, J=8,7 Гц, 2H).
Стадия 2: 1-(4-бромфенил)-3,5-диметил-1H-пиразол (I-49)
К раствору (4-бромфенил)гидразина (95 г, 0,42 моль) в EtOH (950 мл) добавляли KOAc (42 г, 0,42 моль) и пентан-2,4-дион (51 г, 0,51 моль) при комнатной температуре и смесь нагревали до температуры кипения с обратным холодильником в течение 3 часов. Реакционную смесь затем концентрировали при пониженном давлении и разбавляли водой (500 мл) и экстрагировали при помощи MTBE (× 2). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали в вакууме. Остаток суспендировали в гексане (500 мл) и фильтровали и фильтрат концентрировали в вакууме с получением соединения I-49 в виде жидкости. 1H ЯМР (400 МГц, CDCl3): δ 7,58−7,55 (м, 2H), 7,34−7,30 (м, 2H), 6,01 (с, 1H), 2,30 (д, J=5,2 Гц, 6H).
Промежуточное соединение 50
1-(4-бром-2-метилфенил)-1H-пиразол

5-Бром-2-иодтолуол (0,144 мл, 1,01 ммоль), пиразол (68,8 мг, 1,01 ммоль), оксид меди(I) (7,2 мг, 0,051 ммоль), (1S,2S)-бис(пиридин-2-илметилен)циклогексан-1,2-диамин (59,1 мг, 0,202 ммоль) и карбонат цезия (658 мг, 2,02 ммоль) объединяли в герметично закрываемом микроволновом сосуде и растворяли в ацетонитриле (1,4 мл). Реакционную смесь перемешивали при 82°C в течение ночи и затем охлаждали до комнатной температуры и фильтровали через Целит, промывая слой Целита дихлорметаном. Раствор концентрировали в вакууме и неочищенное вещество очищали хроматографией на диоксиде кремния, элюируя с градиентом 0-25% этилацетата в гексане. LRMS (ESI) рассчитано для C10H10N2Br [M+H] +: 237, 239 (1:1), найдено 237, 239 (1:1). 1H ЯМР (500 МГц, CDCl3): δ 7,72 (с, 1H), 7,57 (с, 1H), 7,47 (с, 1H), 7,40 (д, J=8,0 Гц, 1H), 7,19 (д, J=8,5 Гц, 1H), 6,44 (с, 1H), 2,22 (с, 3H).
Промежуточное соединение 51-1
6-бром-N,N-диметилхинолин-2-амин

6-Бром-2-хлорхинолин (200 мг, 0,825 ммоль) и диметиламин (2,0 мл, 4,0 ммоль, 2M в ТГФ) объединяли в микроволновом сосуде и нагревали при 60°C в течение ночи. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Органический слой сушили при помощи MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C11H12BrN2 [M+H]+: 251, 253 (1:1), найдено: 251, 253 (1:1). 1H ЯМР (500 МГц, Ацетон-d6): δ 7,96 (д, J=9,4 Гц, 1H), 7,84 (с, 1H), 7,61 (дд, J=8,9, 2,2 Гц, 1H), 7,56 (д, J=8,9 Гц, 1H), 7,11 (д, J=9,4 Гц, 1H), 3,21 (с, 6H).
Следующие соединения, представленные в Таблице 16, были получены с использованием процедуры, аналогичной той, которая описана для Промежуточного соединения 51-1 выше.



Промежуточное соединение 52
6-бром-N,N-диметилхинолин-2-карбоксамид
Стадия 1: 6-бромхинолин-2-карбоновая кислота
6-Бром-хинолин-2-карбонитрил (250 мг, 1,07 ммоль) растворяли в MeOH (4,5 мл) в микроволновом сосуде и добавляли 5н водный раствор гидроксида натрия (1,5 мл, 2,25 ммоль). Реакционную смесь нагревали при 100°C в течение 20 минут, затем охлаждали до комнатной температуры и концентрировали в вакууме. Остаток подкисляли до pH 5 с использованием 1M водного раствора HCl и реакционную смесь экстрагировали с использованием этилацетата (× 1). Органический слой затем сушили с использованием MgSO4, фильтровали и концентрировали в вакууме, с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, DMSO-d6): δ 13,58 (шир. с, 1H), 8,57 (д, J=8,5 Гц, 1H), 8,46 (д, J=2,2 Гц, 1H), 8,19 (д, J=8,5 Гц, 1H), 8,13 (д, J=9,3 Гц, 1H), 8,02 (дд, J=9,3, 2,2 Гц, 1H).
Стадия 2: 6-бром-N,N-диметилхинолин-2-карбоксамид
6-Бромхинолин-2-карбоновую кислоту (40 мг, 0,16 ммоль) и HATU (121 мг, 0,317 ммоль) растворяли в DMF (0,50 мл) и перемешивали при комнатной температуре в течение 5 минут. Затем добавляли отдельно полученный раствор DMF (0,50 мл), диметиламина (0,159 мл, 0,317 ммоль, 2M в ТГФ)) и DIPEA (0,083 мл, 0,48 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем разбавляли при помощи EtOAc и промывали водой. Органический слой затем сушили с использованием MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, CDCl3): δ 8,17 (д, J=8,2 Гц, 1H), 8,02 (с, 1H), 7,98 (д, J=8,2 Гц, 1H), 7,82 (д, J=8,2 Гц, 1H), 7,74 (д, J=8,2 Гц, 1H), 3,20 (с, 3H), 3,16 (с, 3H).
Промежуточное соединение 53
6-бромхинолин-2-карбоксамид

Карбонат калия (59,3 мг, 0,429 ммоль) и пероксид водорода (0,31 мл, 3,0 ммоль) растворяли в ацетонитриле (2,0 мл). Затем добавляли 6-бром-хинолин-2-карбонитрил (100 мг, 0,429 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и затем к реакционной смеси добавляли дополнительно количество пероксида водорода (0,22 мл, 2,2 ммоль), затем смесь нагревали при 50°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водой, насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, CDCl3): δ 8,33 (д, J=8,5 Гц, 1H), 8,25 (д, J=8,5 Гц, 1H), 8,07 (д, J=2,1 Гц, 1H), 8,03 (шир. с, 1H), 8,00 (д, J=8,8 Гц, 1H), 7,85 (дд, J=8,8, 2,5 Гц, 1H), 5,74 (шир. с, 1H).
Промежуточные соединения I-54A и I-54B
(R или S)-2-(4-бромфенил)-2-(трифторметил)пиперидин

Стадия 1: 4-бромбензоилхлорид
Раствор 4-бромбензойной кислоты (10,0 г, 49,7 ммоль) в дихлориде серы (59,2 г, 0,50 моль) нагревали при 80°C в течение 16 часов. Смесь затем концентрировали в вакууме с получением указанного в заголовке соединения, которое использовали на следующей стадии без дополнительной очистки.
Стадия 2: трет-бутил-3-(4-бромбензоил)-2-оксопиперидин-1-карбоксилат
Бис(триметилсилил)амид лития (2,11 мл, 2,11 ммоль, 1,0 M в ТГФ) добавляли к раствору трет-бутил-2-оксопиперидин-1-карбоксилата (0,20 г, 1,0 ммоль) в ТГФ (2 мл) при -78°C. Полученную смесь перемешивали в течение 10 минут, затем добавляли 4-бромбензоилхлорид (0,22 г, 1,0 ммоль). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 1 часа, затем добавляли насыщенный водный раствор хлорида аммония (20 мл). После гашения реакционную смесь экстрагировали при помощи EtOAc (× 3) и объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на диоксиде кремния, элюируя смесью 0-1% EtOAc в гексане, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для: C17H21BrNO4 [M+H]+: 382, 384 (1:1), найдено 382, 384 (1:1).
Стадия 3: 6-(4-бромфенил)-2,3,4,5-тетрагидропиридин
трет-бутил-3-(4-бромбензоил)-2-оксопиперидин-1-карбоксилат (2,00 г, 5,23 ммоль) объединяли с HCl (8,0 M, 43,6 мл, 0,52 моль) при температуре окружающей среды. Полученный раствор нагревали при 80°C в течение 16 часов. Реакционную смесь затем выливали в насыщенный водный раствор Na2CO3 (50 мл) и экстрагировали при помощи EtOAc (× 3). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на диоксиде кремния, элюируя смесью 0-1% EtOAc в гексане, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для: C11H13BrN [M+H]+: 238, 240 (1:1), найдено 238, 240 (1:1); 1H ЯМР (300 МГц, CDCl3) δ 7,66-7,63 (м, 2H), 7,52-7,47 (м, 2H), 3,90 (м, 2H), 2,59 (м, 2H), 1,88-1,79 (м, 2H),1,78-1,66 (м, 2H).
Стадия 4: (R или S)-2-(4-бромфенил)-2-(трифторметил)пиперидин и (R или S)-2-(4-бромфенил)-2-(трифторметил)пиперидин (I-54A и I-54B)
К раствору 6-(4-бромфенил)-2,3,4,5-тетрагидропиридина (1,0 г, 4,2 ммоль) в ацетонитриле (10 мл) последовательно добавляли трифторметансульфоновую кислоту (3,30 г, 22,0 ммоль), гидрофторид калия (3,94 г, 50,4 ммоль) и триметил(трифторметил)силан (5,97 г, 42,0 ммоль) при 0-4°C. Полученную смесь перемешивали при температуре окружающей среды в течение 48 часов. Реакционную смесь затем гасили насыщенным водным раствором NaHCO3 (50 мл) с последующим экстрагированием при помощи EtOAc (× 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на диоксиде кремния, элюируя смесью 0-1% DCM в петролейном эфире, с получением рацемического указанного в заголовке соединения. Указанные в заголовке соединения затем разделяли при помощи СКЖХ с использованием колонки Chiralpak IA, элюируя смесью 15% i-PrOH в CO2, с получением Пика A (I-54A) (Tr = 4,7 минут) и Пика B (I-54B) (Tr = 5,5 минут). LRMS (ESI) рассчитано для C12H14BrF3N [M+H]+: 308, 310 (1:1), найдено 308, 310 (1:1); 1H ЯМР (300 МГц, CDCl3): δ 7,66 (м, 2H), 7,59 (м, 2H), 3,16-3,03 (м, 1H), 2,73-2,63 (м, 1H), 2,50-2,42 (м, 1H), 2,25-1,93 (м, 1H), 1,75 (м, 1H), 1,67-1,53 (м, 3H), 1,33 (м, 1H).
Промежуточные соединения I-55A и I-55B
(R) и (S)-2-(4-бромфенил)-2-(трифторметил)пирролидин

Стадия 1: 3-(4-бромбензоил)-1-винилпирролидин-2-он

Трет-бутоксид калия (6,26 г, 55,80 ммоль) добавляли к раствору 1-винилпирролидин-2-она (6,20 г, 55,8 ммоль) и метил-4метил-4-бромбензоата (10,00 г, 46,50 ммоль) в ТГФ (150 мл). Смесь перемешивали при температуре окружающей среды в течение 1 часа, после этого добавляли воду (200 мл) и pH доводили до 7 при помощи водного раствора хлористоводородной кислоты (1 M). Полученную смесь экстрагировали при помощи EtOAc (× 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-20% EtOAc в петролейном эфире, с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) рассчитано для C13H13BrNO2 [M+H]+: 294, 296 (1:1), найдено 294, 296 (1:1); 1H ЯМР (300 МГц, CDCl3): δ 7,90 (д, J=6,6 Гц, 2H), 7,65 (д, J=6,6 Гц, 2H), 7,06-6,97 (м, 1H), 4,53 (м, 3H), 3,77-3,68 (м, 1H), 3,59 (м, 1H), 2,80-2,71 (м, 1H), 2,37-2,28 (м, 1H).
Стадия 2: 5-(4-бромфенил)-3,4-дигидро-2H-пиррол

Суспензию 3-(4-бромбензоил)-1-винилпирролидин-2-она (5,00 г, 17,0 ммоль) в водном растворе HCl (20 мл, 8 M) нагревали при температуре кипения с обратным холодильником в течение 16 часов. Смесь охлаждали до температуры окружающей среды и экстрагировали при помощи EtOAc (× 3). Водный слой подщелачивали до pH=13 при помощи NaOH (15% водный раствор) и затем экстрагировали при помощи DCM (× 5). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-20% EtOAc в петролейном эфире, с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) рассчитано для C10H11BrN [M+H]+: 224, 226 (1:1), найдено 224, 226 (1:1); 1H ЯМР (300 МГц, CDCl3): δ 7,74-7,69 (м, 2H), 7,54 (м, 2H), 4,06 (м, 2H), 2,96-2,88 (м, 2H), 2,10-2,00 (м, 2H).
Стадия 3: (S) и (R)-2-(4-бромфенил)-2-(трифторметил)пирролидин
К охлажденному льдом раствору 5-(4-бромфенил)-3,4-дигидро-2H-пиррола (0,80 г, 3,6 ммоль) в безводном ацетонитриле (3 мл) последовательно добавляли трифторметансульфоновую кислоту (0,67 г, 4,5 ммоль), гидрофторид калия (0,840 г, 10,7 ммоль) и триметил(трифторметил)силан (5,08 г, 35,7 ммоль). Реакционный раствор нагревали до температуры окружающей среды и перемешивали в течение 48 часов, затем гасили насыщенным водным раствором NaHCO3 до достижения pH > 7. Раствор экстрагировали при помощи EtOAc (× 3) и объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-20% DCM в петролейном эфире, с получением указанного в заголовке соединения в виде масла. LRMS (ESI) рассчитано для C11H12BrF3N [M+H]+: 294, 296 (1:1), найдено 294, 296 (1:1); 1H ЯМР (300 МГц, CDCl3): δ 7,49 (д, J=5,4 Гц, 2H), 7,42 (д, J=5,4 Гц, 2H), 3,29-3,21 (м, 1H), 3,16-3,08 (м, 1H), 2,60-2,51 (м, 1H), 2,25-2,16 (м, 1H), 2,08-1,94 (м, 1H), 1,89-1,75 (м, 1H). Эту рацемическую смесь разделяли методом хиральной ВЭЖХ с использованием колонки Chiralpak AD-H и метанола (с 0,2% DEA модификатора) с получением Пика 1 (I-55A, время удерживания = 4,4 минут) и Пика 2 (I-55B, время удерживания = 5,2 минут).
Промежуточное соединение 56
трет-бутил-4-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)пиперидин-1-карбоксилат

Стадия 1: 4-бром-2-(бромметил)бензол-1-сульфонилхлорид
К раствору N-бромсукцинимида (26,4 г, 148 ммоль) и 4-бром-2-метилбензол-1-сульфонилхлорида (20,0 г, 74,2 ммоль) в тетрахлориде углерода (1,00 л) добавляли 2,2’-азобис(2-метилпропионитрил) (2,43 г, 14,8 ммоль) при температуре окружающей среды. Реакционную смесь перемешивали при 80°C в течение 16 часов в атмосфере аргона, затем охлаждали и твердые вещества фильтровали. К фильтрату затем добавляли еще одну порцию N-бромсукцинимида (26,4 г, 148 ммоль) и 2,2'-азобис(2-метилпропионитрила) (2,43 г, 14,8 ммоль) и реакционную смесь перемешивали при 80°C еще в течение 16 часов в атмосфере аргона. Твердые вещества снова фильтровали и фильтрат концентрировали в вакууме. Остаток использовали на следующей стадии без дополнительной очистки.
Стадия 2: трет-бутил-4-(4-бром-2-(бромметил)фенилсульфонамидо)пиперидин-1-карбоксилат

К раствору 4-бром-2-(бромметил)бензол-1-сульфонилхлорида (60,0 г, 172 ммоль) в DCM (1,00 л) добавляли раствор трет-бутил-4-аминопиперидин-1-карбоксилата (20,7 г, 103 ммоль) и триэтиламина (34,8 г, 344 ммоль) в DCM (100 мл) при температуре окружающей среды. Смесь перемешивали при температуре окружающей среды в течение 3 часов, затем гасили водой (500 мл), экстрагировали при помощи DCM (× 3) и объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя смесью 25% EtOAc в петролейном эфире, с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) рассчитано для C13H17Br2N2O4S [M -t-Bu+H ]+: 455, 457, 459 (1:2:1) найдено 455, 457, 459 (1:2:1).
Стадия 3: трет-бутил-4-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)пиперидин-1-карбоксилат (I-56)
К имеющему комнатную температуру раствору of трет-бутил-4-(4-бром-2-(бромметил)фенилсульфонамидо)пиперидин-1-карбоксилата (50,0 г, 98,0 ммоль) в ацетонитриле/воде (3/1, 400 мл) добавляли бикарбонат натрия (24,6 г, 293 ммоль). Смесь перемешивали при 80°C в течение 16 часов и затем концентрировали в вакууме. Остаток разбавляли водой (200 мл), экстрагировали при помощи EtOAc (× 3) и объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя смесью 20% этилацетата в петролейном эфире, с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) рассчитано для C13H16BrN2O4S [M -t-Bu+H ]+: 375, 377 (1:1) найдено 375, 377 (1:1); 1H ЯМР (400 МГц, CD3OD): δ 7,76 (с, 1H), 7,74 (д, J=8,4 Гц, 1H), 7,65 (д, J=8,4 Гц, 1H), 4,44 (с, 2H), 4,08 (д, J=13,5 Гц, 2H), 3,78-3,71 (м, 1H), 2,98-2,83 (м, 2H), 2,00-1,94 (м, 2H), 1,85-1,73 (м, 2H), 1,43 (с, 9H).
Промежуточное соединение 57
5-бром-2-(N-трифторэтилпиперидин-4-ил)циклогексил-2,3-дигидробензо[d]изотиазол 1,1-диоксид

Стадия 1: 5-бром-2-(пиперидин-4-ил)циклогексил-2,3-дигидробензо[d]изотиазол 1,1-диоксид

К 5-бром-2-(N-трет-бутил карбоматпиперидин-4-ил)циклогексил-2,3-дигидробензо[d]изотиазол 1,1-диоксиду (Промежуточное соединение 56) (0,10 г, 0,23 ммоль) добавляли раствор газообразного хлористого водорода в EtOAc (5 мл) при температуре окружающей среды. Реакционную смесь поддерживали при этой температуре еще в течение часа, после этого собирали осадок путем фильтрованич и промывали при помощи EtOAc с получением указанного в заголовке соединения в форме HCl соли в виде твердого вещества. Это вещество затем использовали на следующей стадии без дополнительной очистки. LRMS (ESI) рассчитано для C12H16BrN2O2S [M+H]+: 331, 333 (1:1), найдено 331, 333 (1:1).
Стадия 2: 5-бром-2-(N-трифторэтилпиперидин-4-ил)циклогексил-2,3-дигидробензо[d]изотиазол 1,1-диоксид (I-57)
5-Бром-2-(пиперидин-4-ил)циклогексил-2,3-дигидробензо[d]изотиазол 1,1-диоксид (50 мг, 0,15 ммоль), диизопропилэтиламин (60 мг, 0,47 ммоль) и 2,2,2-трифторэтилтрифторметансульфонат (0,10 г, 0,43 ммоль) объединяли с ацетонитрилом (15 мл) при температуре окружающей среды. Полученный раствор поддерживали при этой температуре в течение 16 часов и затем концентрировали в вакууме. Остаток растворяли в воде (30 мл) и экстрагировали при помощи EtOAc (× 3). Органические слои объединяли, сушили над Na2SO4, фильтровали, концентрировали в вакууме и остаток очищали хроматографией на диоксиде кремния, элюируя смесью EtOAc/петролейный эфир (2/5), с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) рассчитано для C14H17BrF3N2O2S [M+H]+: 413, 415 (1:1), найдено 413, 415 (1:1); 1H ЯМР (400 МГц, CDCl3): δ 7,67 (м, 2H), 7,58 (с, 1H), 4,38 (с, 2H), 3,76-3,68 (м, 1H), 3,13-3,02 (м, 4H), 2,68-2,56 (м, 2H), 2,05 (м, 4H).
Промежуточное соединение 58
(R и S)-1-бензил-3-(4-бромфенил)-3-(трифторметил)пирролидин

Стадия 1: 1-бром-4-(3,3,3-трифторпроп-1-ен-2-ил)бензол

К раствору метилтрифенилфосфонийбромида (6,35 г, 17,8 ммоль) в ТГФ (13,2 мл) в атмосфере азота при 0°C добавляли бис(триметилсилиламид) лития (17,8 мл, 17,8 ммоль, 1M в ТГФ). Реакционную смесь перемешивали в течение 30 минут, затем охлаждали до -78°C. Затем добавляли 1-(4-бромфенил)-2,2,2-трифторэтанон (3 г, 11,86 ммоль) и реакционной смеси давали нагреться до комнатной температуры в течение 1 часа. Затем реакционную смесь выливали в смесь 1:1 ледяная вода/NH4Cl и водный слой экстрагировали при помощи EtOAc (× 3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (600 МГц, CDCl3): δ 7,50 (д, J=8,3 Гц, 2H), 7,30 (д, J=8,2 Гц, 2H), 5,96 (с, 1H), 5,75 (с, 1H).
Стадия 2: (R и S) 1-бензил-3-(4-бромфенил)-3-(трифторметил)пирролидин (I-58)

К раствору 1-бром-4-(3,3,3-трифторпроп-1-ен-2-ил)бензола (0,25 г, 1,0 ммоль) и N-бензил-1-метокси-N-((триметилсилил)метил)метанамина (0,51 мл, 2,0 ммоль) в DCM (5 мл) при 0°C добавляли трифторуксусную кислоту (7,7 мкл, 0,1 ммоль). Реакционную смесь перемешивали и нагревали до комнатной температуры в течение 3 часов. Затем реакционную смесь гасили насыщенным водным раствором NaHCO3 (20 мл) и водный слой экстрагировали при помощи EtOAc (× 3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (600 МГц, CDCl3): δ 7,45 (д, J=8,2 Гц, 2H), 7,29-7,35, (м, 4H), 7,19-7,23 (м, 3H), 3,65-3,67 (м, 2H), 3,18 (м, 1H), 2,77 (м, 1H), 2,58 (м, 1H), 2,37 (м, 1H),1,25 (м, 1H), 0,85 (м, 1H).
Пример 1-1
трет-бутил-3-(цианометил)-3-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилат

3-(Фениламино)-1H-пиразоло[4,3-c]пиридин-4(5H)-он (11,3 мг, 0,0499 ммоль) и трет-бутил-3-(цианометилен)азетидин-1-карбоксилат (17,0 мг, 0,088 ммоль) растворяли в DMF (1,0 мл). Добавляли DBU (14 мкл, 0,093 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Через 18 часов реакционную смесь разбавляли в EtOAc и промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Объединенные водные слои обратно экстрагировали смесью 3:1 хлороформ/изопропанол (× 1) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя с градиентом 10-100% EtOAc/изогексан, затем 0-5% MeOH/EtOAc, с получением соединения 1-1. LRMS (ESI) рассчитано для C22H25N6O3 [M+H]+: 421, найдено 421. 1H ЯМР (600 МГц, DMSO-d6): δ 11,28 (с, 1H), 8,06 (с, 1H), 7,62-7,56 (м, 2H), 7,28-7,19 (м, 3H), 6,86 (дд, J=7,2, 6,6 Гц, 1H), 6,36 (дд, J=7,2, 1,8 Гц, 1H), 4,46 (д, J=8,4 Гц, 2H), 4,25 (д, J=6,6 Гц, 2H), 3,41 (с, 2H), 1,36 (с, 9H).
Следующие примеры, представленные в Таблице 17, были получены аналогичным способом с использованием общей процедуры, описанной выше для Примера 1-1, с использованием 1,2 эквивалента DBU, 1,5 эквивалента акцептора Михаэля в DMF (0,15 M) при 50°C.
Пример 2-1
трет-бутил-4-(цианометил)-4-[3-(этиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат

Стадия 1: трет-бутил-4-(4-(бензилокси)-3-(этиламино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат

К раствору трет-бутил-4-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил]-4-(цианометил)пиперидин-1-карбоксилата (20 мг, 0,043 ммоль) в дихлорэтане (0,30 мл) добавляли раствор ацетальдегида (3,0 мкл, 0,054 ммоль) и уксусной кислоты (2,5 мкл, 0,043 ммоль) в дихлорэтане (0,24 мл). Эту смесь перемешивали при комнатной температуре в течение 10 минут, затем добавляли триацетоксиборогидрид натрия (16 мг, 0,076 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5,5 часа, затем разбавляли при помощи EtOAc и промывали 1н раствором NaOH и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-100% EtOAc/гексан, с получением соединения Примера 2-1a. LRMS (ESI) рассчитано для C27H35N6O3 [M+H]+: 491, найдено 491.
Стадия 2: трет-бутил-4-(цианометил)-4-[3-(этиламино)-4-оксо-4,5-дигидро-1H-пиразоло-[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилат
трет-бутил-4-(4-(бензилокси)-3-(этиламино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат (2-1a) (9,0 мг, 0,018 ммоль) растворяли в EtOAc (2,0 мл) и EtOH (0,20 мл). Добавляли Pd/C (10 мг, 0,094 ммоль) и реакционную смесь перемешивали под давлением 1 атм водорода в течение 2 часов. Реакционную смесь затем фильтровали через Целит и промывали при помощи DCM и фильтрат концентрировали в вакууме. Неочищенную реакционную смесь очищали хроматографией на диоксиде кремния, элюируя при помощи 100% EtOAc. Концентрирование желаемых фракций давало соединение 2-1. LRMS (ESI) рассчитано для C20H29N6O3 [M+H]+: 401, найдено 401. 1H ЯМР (600 МГц, DMSO-d6): δ 10,93 (д, J=5,0 Гц, 1H), 7,01 (т, J=6,6 Гц, 1H), 6,49 (д, J=7,5 Гц, 1H), 5,42 (т, J=5,8 Гц, 1H), 3,68 (д, J=13,8 Гц, 2H), 3,18 (дт, J=13,4 Гц, 6,8, 2H), 3,10 (с, 2H), 2,98 (шир. с, 2H), 2,57 (д, J=13,9 Гц, 2H), 1,85 (т, J=10,2 Гц, 2H), 1,35 (с, 9H), 1,12 (т, J=7,1 Гц, 3H).
Следующие Примеры, представленные в Таблице 18, были получены аналогично способу получения соединения Примера 2-1, описанному выше:


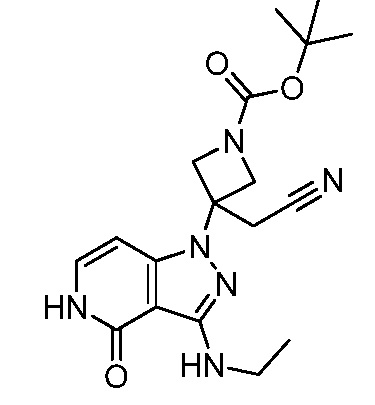

Пример 3
трет-бутил-3-(цианометил)-3-[3-(циклопропиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]азетидин-1-карбоксилат

Стадия 1: трет-бутил-3-[4-(бензилокси)-3-иод-1H-пиразоло[4,3-c]пиридин-1-ил]-3-(цианометил)азетидин-1-карбоксилат

К раствору трет-бутил-3-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил]-3-(цианометил)азетидин-1-карбоксилата (250 мг, 0,575 ммоль) в дихлорэтане (10 мл) добавляли I2 (365 мг, 1,44 ммоль). Смесь перемешивали в течение 10 минут в атмосфере азота и затем охлаждали до 0°C и добавляли по каплям трет-бутилнитрит (0,137 мл, 1,15 ммоль). Реакционную смесь перемешивали при 0°C в течение 10 минут, затем нагревали до комнатной температуры и перемешивали еще в течение 2 часов. Реакционную смесь разбавляли при помощи EtOAc (100 мл) и промывали водным раствором NaHSO3, насыщенным солевым раствором, насыщенным водным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-75% EtOAc в гексане, с получением соединения 3a. LRMS (ESI) рассчитано для C23H25IN5O3 [M+H]+: 546, найдено 546. 1H ЯМР (600 МГц, CDCl3): δ 7,96 (д, J=6,0 Гц, 1H), 7,58 (д, J=7,8 Гц, 2H), 7,38 (т, J=7,8 Гц, 2H), 7,31 (т, J=7,2 Гц, 1H), 6,87 (д, J=6,6 Гц, 1H), 5,59 (с, 2H), 4,66 (д, J=9,6 Гц, 2H), 4,33 (д, J=9,0 Гц, 2H), 3,16 (с, 2H), 1,44 (с, 9H).
Стадия 2: трет-бутил-3-[4-(бензилокси)-3-(циклопропиламино)-1H-пиразоло[4,3-c]пиридин-1-ил]-3-(цианометил)азетидин-1-карбоксилат

В сосуд, снабженный мешалкой, загружали CuI (4,4 мг, 0,023 ммоль), треохосновной фосфат калия (24,3 мг, 0,115 ммоль), L-пролин (5,3 мг, 0,046 ммоль), трет-бутил-3-[4-(бензилокси)-3-иод-1H-пиразоло[4,3-c]пиридин-1-ил]-3-(цианометил)азетидин-1-карбоксилат (25 мг, 0,046 ммоль) и DMSO (460 мкл). Смесь продували азотом в течение 2 минут и затем добавляли циклопропиламин (22 мкл, 0,32 ммоль). Смесь продували азотом еще в течение 2 минут и затем сосуд герметично закрывали и нагревали до 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли при помощи EtOAc и органические слои промывали водой, насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали в вакууме. Очистка остатка хроматографией на диоксиде кремния с элюированием смесью 0-100% EtOAc в гексане и последующей дополнительной очисткой препаративной тонкослойной хроматографией (ПТСХ) с 2% MeOH/CH2Cl2 (3 элюирования) давали соединение 3b. LRMS (ESI) рассчитано для C26H31N6O3 [M+H]+: 475, найдено 475. 1H ЯМР (600 МГц, CDCl3): δ 7,82 (д, J=6,0 Гц, 1H), 7,42 (д, J=7,2 Гц, 2H), 7,38 (т, J=7,2 Гц, 2H), 7,33 (т, J=7,2 Гц, 1H), 6,64 (д, J=6,0 Гц, 1H), 5,51 (с, 2H), 5,06 (с, 1H), 4,65 (д, J=9,6 Гц, 2H), 4,26 (д, J=9,0 Гц, 2H), 3,08 (с, 2H), 2,63 (м, 1H), 1,45 (с, 9H), 0,71 (м, 2H), 0,51 (м, 2H).
Стадия 3: трет-бутил-3-(цианометил)-3-[3-(циклопропиламино)-4-оксо-4,5-дигидро-1H-пиразоло-[4,3-c]пиридин-1-ил]азетидин-1-карбоксилат
К раствору трет-бутил-3-[4-(бензилокси)-3-(циклопропиламино)-1H-пиразоло[4,3-c]пиридин-1-ил]-3-(цианометил)азетидин-1-карбоксилата (3,0 мг, 0,0063 ммоль) в EtOAc (1 мл) добавляли 10% Pd/C (5 мг). Реакционную смесь перемешивали под давлением 1 атм водорода при комнатной температуре в течение 2 часов. Баллон водорода удаляли и реакционную смесь фильтровали через Целит (промывая при помощи DCM) и фильтрат концентрировали в вакууме. Остаток очищали препаративной тонкослойной хроматографией (ПТСХ) с 4% MeOH/CH2Cl2 с получением соединения 3. LRMS (ESI) рассчитано для C19H25N6O3 [M+H]+: 385, найдено 385. 1H ЯМР (600 МГц, DMSO-d6): δ 10,98 (д, J=6,0 Гц, 1H), 7,09 (дд, J=7,2, 6,0 Гц, 1H), 6,20 (д, J=7,2 Гц, 1H), 5,67 (д, J=2,4 Гц, 1H), 4,41 (м, 2H), 4,19 (м, 2H), 3,29 (с, 2H), 2,54 (м, 1H), 1,36 (с, 9H), 0,59 (м, 2H), 0,48 (м, 2H).
Пример 4-1
трет-бутил-3-(цианометил)-3-(4-оксо-3-((2-(трифторметил)пиридин-4-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилат
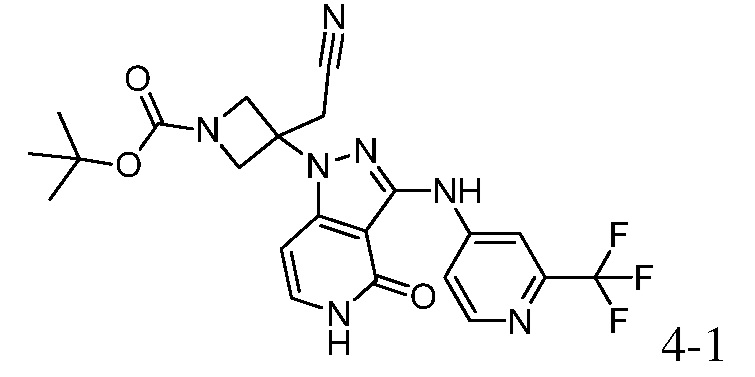
В сосуд загружали трет-бутил-3-(3-амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-(цианометил)азетидин-1-карбоксилат (35 мг, 0,10 ммоль), 4-бром-2-трифторметилпиридин (34,5 мг, 0,152 ммоль), Pd2(dba)3 (4,65 мг, 5,08 мкмоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (12 мг, 0,020 ммоль) и Cs2CO3 (66,2 мг, 0,203 ммоль). Добавляли диоксан (0,68 мл) и смесь продували аргоном в течение 5 минут. Сосуд затем герметично закрывали и нагревали при 90°C в течение 3 часов. Смесь охлаждали и фильтровали через Целит с использованием 3:1 CHCl3:IPA и полученный раствор концентрировали в вакууме. Остаток поглощали в DMSO и очищали масс-индуцируемой обращенно-фазовой ВЭЖХ, элюируя смесью ацетонитрил/вода, содержащей 0,1% TFA модификатор. Фракции, содержащие желаемый продукт, разбавляли при помощи EtOAc, промывали насыщенным водным раствором NaHCO3, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением соединения 4-1. LRMS (ESI) рассчитано для C22H23F3N7O3 [M+H]+: 490, найдено 490. 1H ЯМР (600 МГц, DMSO-d6): δ 11,36 (с, 1H), 9,20 (с, 1H), 8,42 (д, J=4,8 Гц, 1H), 8,17 (с, 1H), 7,87 (м, 1H), 7,25 (м, 1H), 6,40 (д, J=7,2 Гц, 1H), 4,47 (м, 2H), 4,27 (д, J=8,4 Гц, 2H), 3,45 (с, 2H), 1,36 (с, 9H).
Следующие Примеры, представленные в Таблице 19, были получены аналогично получению соединения Примера 4-1:
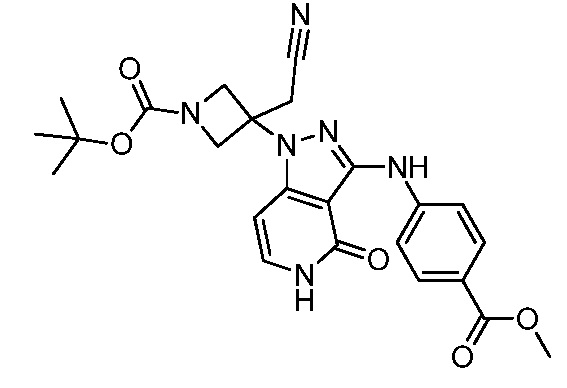
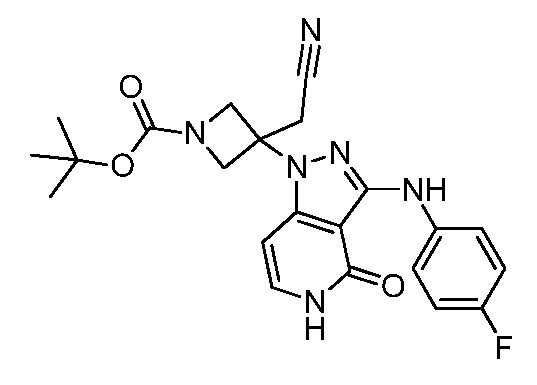
Пример 5-1
трет-бутил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат
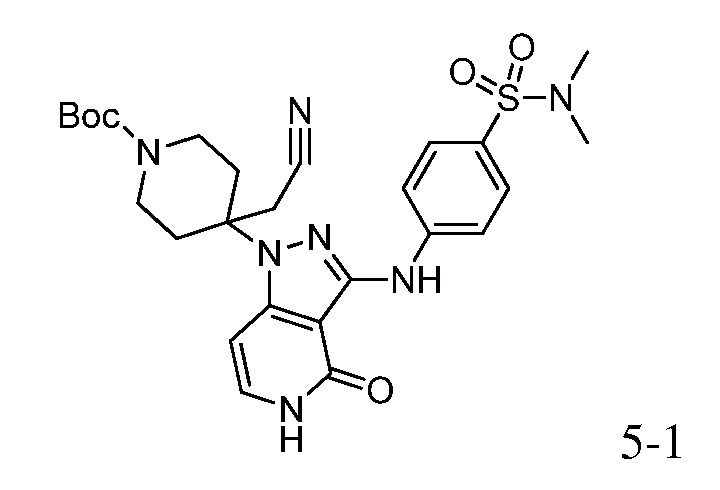
Стадия 1: трет-бутил-4-(4-(бензилокси)-3-((4-(N,N-диметилсульфамоил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат

К трет-бутил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилату (3,00 г, 6,49 ммоль), 4-бром-N,N-диметилбензолсульфонамиду (3,43 г, 13,0 ммоль), Pd2dba3 (0,594 г, 0,649 ммоль), 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенилу (0,935 г, 1,95 ммоль) и треохосновному фосфату калия (2,75 г, 13,0 ммоль) в дегазированном герметично закрываемом микроволновом сосуде добавляли трет-амиловый спирт (86 мл) и реакционную смесь дегазировали снова путем вакуумирования/заполнения аргоном снова (×3) и нагревали до 75°C в течение ночи. Реакционную смесь концентрировали и очищали хроматографией на диоксиде кремния, элюируя смесью 10-80% EtOAc в гексане. Желаемый продукт, 5-1a, собирали и концентрировали в вакууме с получением желаемого продукта в виде твердого вещества. LRMS (ESI) рассчитано для C33H40N7O5S [M+H]+: 646, найдено 646. 1H ЯМР (600 МГц, DMSO-d6): δ 8,53 (с, 1H), 7,85 (д, J=6,0 Гц, 1H), 7,68 (д, J=9,0 Гц, 2H), 7,60 (д, J=9,0 Гц, 2H), 7,46 (д, J=7,8 Гц, 2H), 7,35 (м, 3H), 7,28 (м, 1H), 5,57 (с, 2H), 3,75 (д, J=14,4 Гц, 2H), 3,28 (с, 2H), 3,03 (шир. с, 2H), 2,74 (д, J=14,4 Гц, 2H), 2,47 (с, 6H), 2,03 (т, J=10,8 Гц, 2H), 1,37 (с, 9H).
Стадия 2: трет-бутил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат
К трет-бутил-4-(4-(бензилокси)-3-((4-(N,N-диметилсульфамоил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилату (3,37 г, 5,22 ммоль) добавляли Pd/C (10% масс. Pd нагрузка, 0,27 г) и этилацетат (26 мл). Суспензию затем вакуумировали и снова наполняли водородом и реакционную смесь перемешивали под давлением 1 атм водорода в течение ночи при комнатной температуре. Реакционную смесь фильтровали через Целит и фильровальную лепешку промывали при помощи DCM и органические растворители концентрировали в вакууме. Твердое вещество очищали хроматографией на диоксиде кремния, элюируя смесью 0-6% метанола в DCM, с получением соединения 5-1 в виде зеленого твердого вещества, которое растирали в порошок с DCM, с получением аналитически чистого твердого вещества. LRMS (ESI) рассчитано для C21H26N7O3S [M-Boc+H]+: 456, найдено 456. 1H ЯМР (600 МГц, DMSO-d6): δ 11,33 (с, 1H), 8,68 (с, 1H), 7,82 (д, J=9,0 Гц, 2H), 7,60 (д, J=9,0 Гц, 2H), 7,17 (д, J=7,8 Гц, 1H), 6,67 (д, J=7,8 Гц, 1H), 3,70 (д, J=13,8 Гц, 2H), 3,24 (с, 6H), 3,05 (шир. с, 2H), 2,64 (д, J=13,8 Гц, 2H), 2,45 (с, 6H), 1,99 (кажущийся т, J=12,0 Гц, 2H), 1,35 (с, 9H).
Следующие примеры, представленные в Таблице 20, были получены аналогичным способом с использованием общей процедуры, описанной выше для Примера 5-1. В отдельных случаях, общая процедура может быть модифицирована с альтернативным использованием KOAc основания, 2-ди-трет-бутилфосфино-2′,4′,6′-триизопропил-1,1′-бифенильного лиганда, [(2-ди-трет-бутилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил)-2-(2′-амино-1,1′-бифенил)]палладий(II) метансульфоната (t-BuXPhos Pd G3) в качестве пред-катализатора вместо отдельного источника фосфина и палладия, и/или 2-пропанола аместо трет-амилового спирта. Кроме того, в некоторых случаях реакцию перекрестного связывания можно осуществить в термических условиях при температуре 70-90°C или в условиях микроволнового облучения при 105°C. В некоторых случаях, общую процедуру для гидрогенолиза можно модифицировать с использованием подходящего альтернативного растворителя (такого как MeOH, EtOH и т.д.) или включающего их со-растворителя, с использованием EtOAc для обеспечения растворения субстрата. В некоторых других случаях, таких как, получение Примеров 5-224 - 5-226, удаление Bn защитной группы альтернативно можно осуществить через гидролиз в 1,4-диоксане (0,04 M) с использованием концентрированного водного раствора HCl (~2:1 отношение по объему 1,4-диоксан:конц. HCl) или насыщенного раствора HCl в этилацетате при комнатной температуре (как, например, использовали для Примеров 5-271, 5-272, 5-277 и 5-278).

Хиральное разделение на свободном пиридоне с использованием СКЖХ, Chiralpak IA, 29% MeOH в CO2 Tr = 4,4 минут.

Хиральное разделение на свободном пиридоне с использованием СКЖХ, Chiralpak IA, 29% MeOH в CO2 Tr = 3,7 минут.
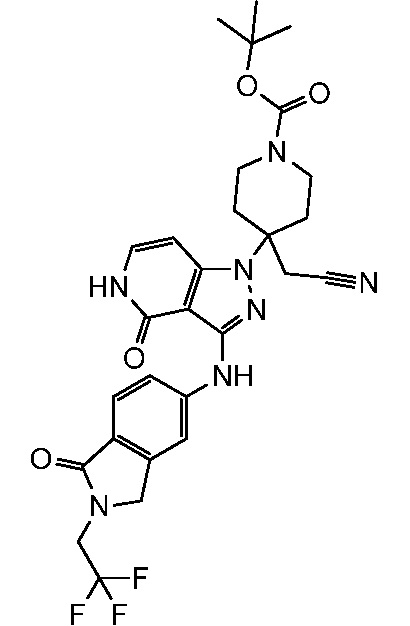


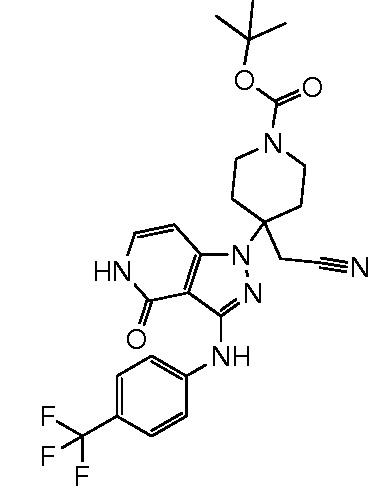

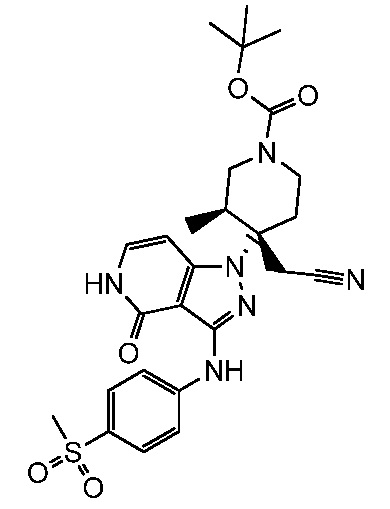


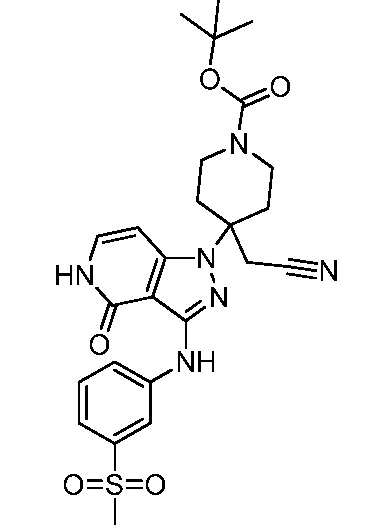

(из I-7-1A)

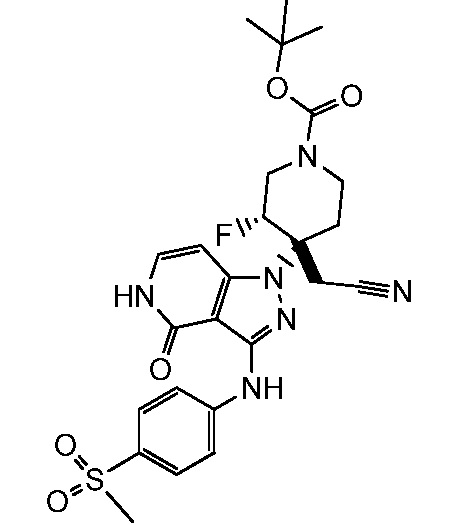
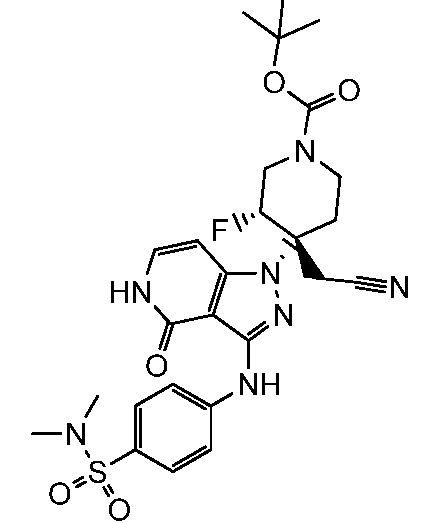



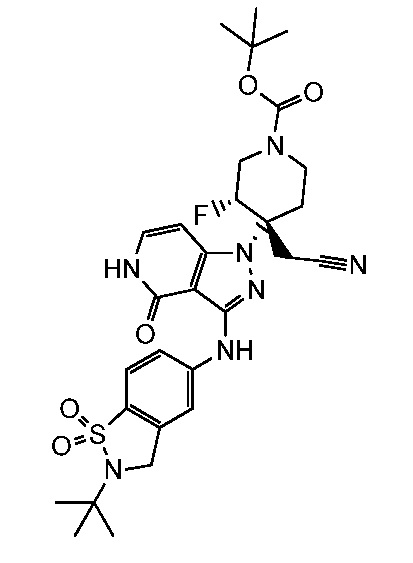


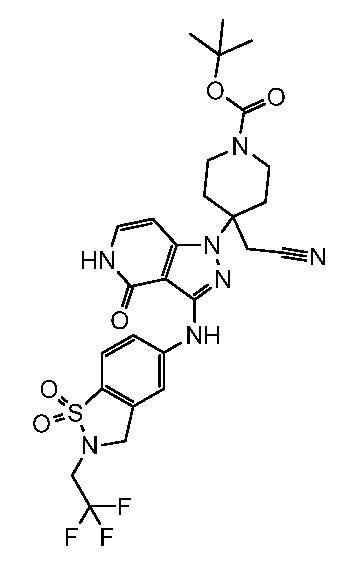



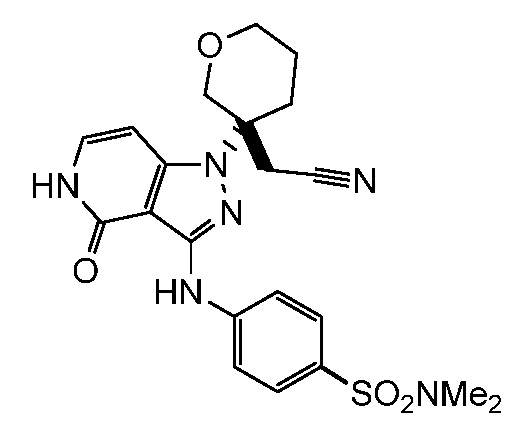



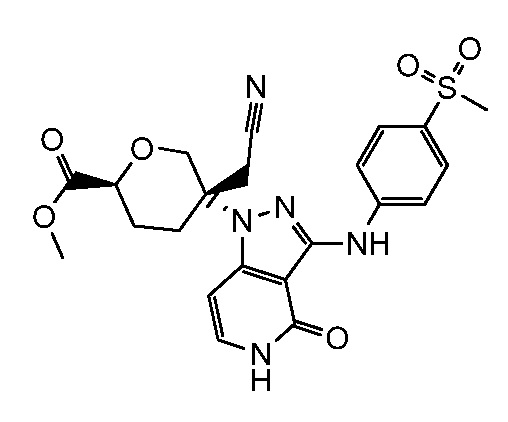
Хиральное разделение на свободном пиридоне с использованием СКЖХ, AD-H колонки, 35% MeOH в CO2 Tr = 5,9 минут.
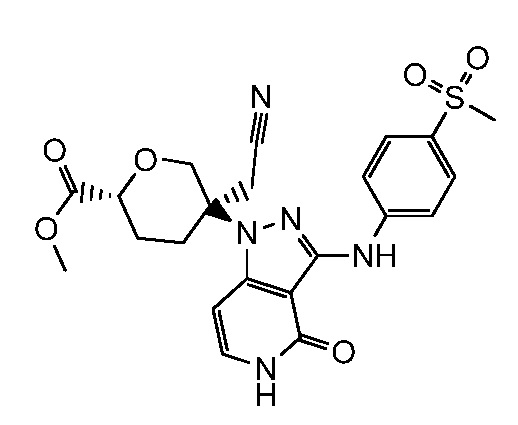
Хиральное разделение на свободном пиридоне с использованием СКЖХ, AD-H колонки, 35% MeOH в CO2 Tr = 7,5 минут.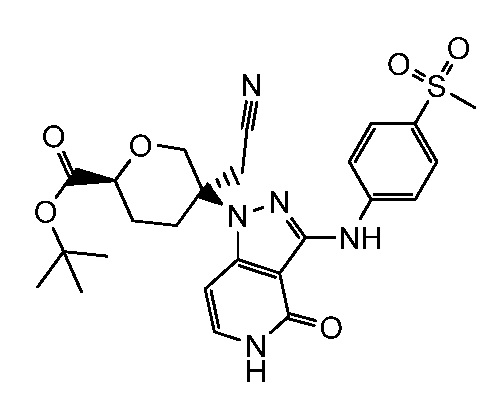

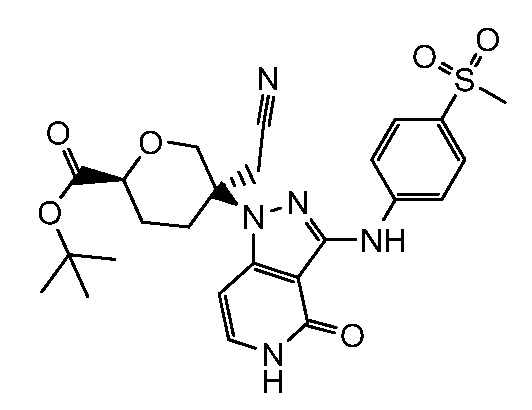
Хиральное разделение свободного пиридона с использованием СКЖХ, AD-H колонки, 25% MeOH в CO2 Tr = 3,8 минут.

Хиральное разделение свободного пиридона с использованием ЖХ колонки, IB колонка, 40% MeOH /EtOH = 3:2, 60% гептана, Tr = 8,1 минут.

Хиральное разделение свободного пиридона с использованием ЖХ колонки, IB колонка, 40% MeOH /EtOH = 3:2, 60% гептана, Tr = 9,6 минут.





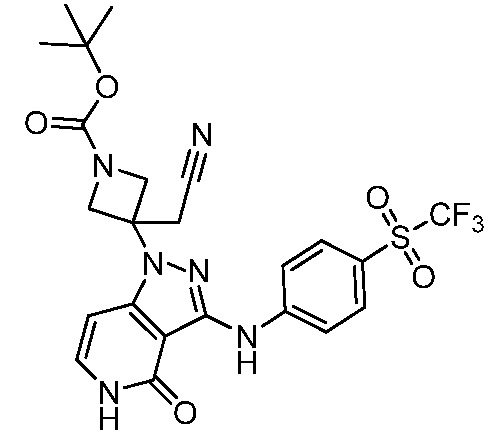


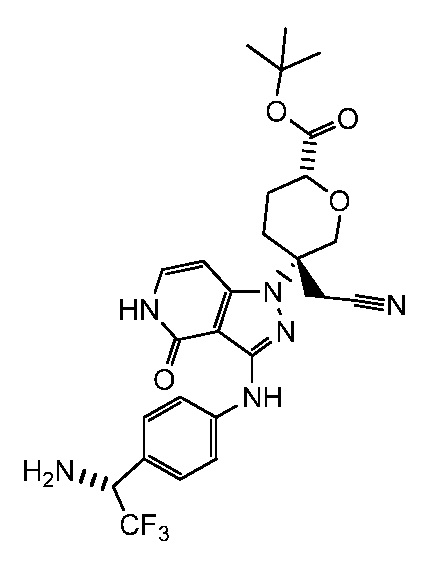





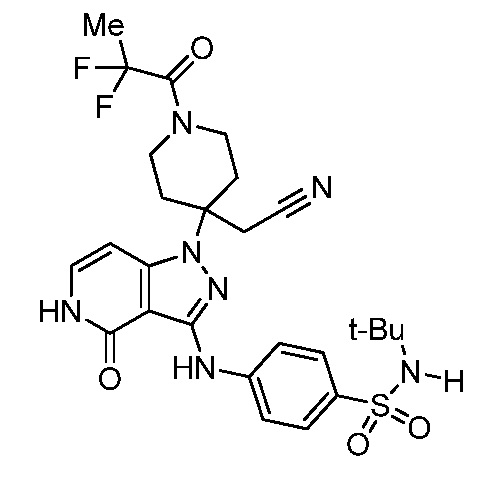
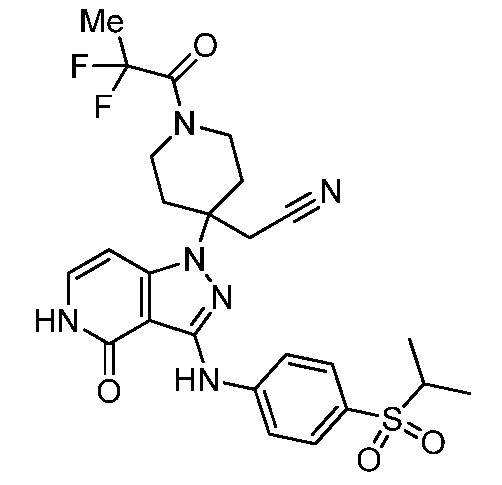

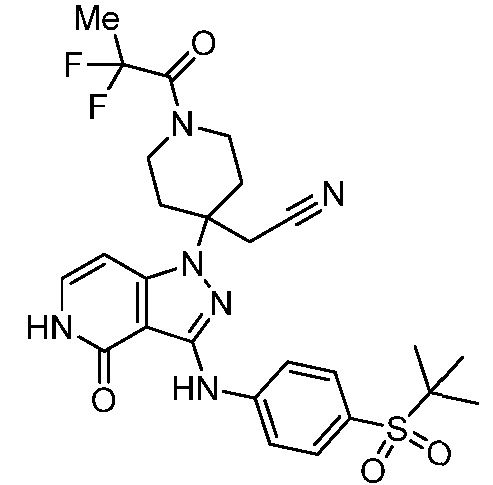


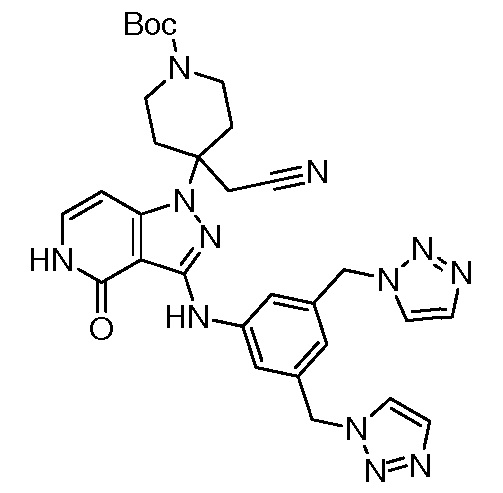






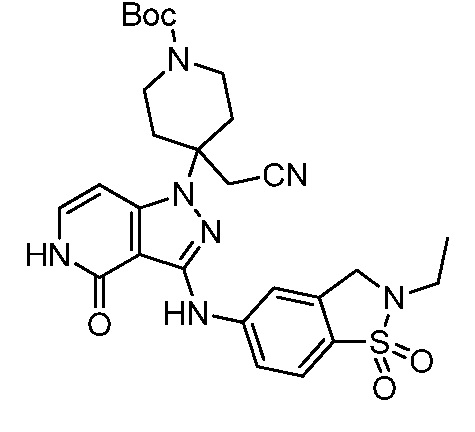
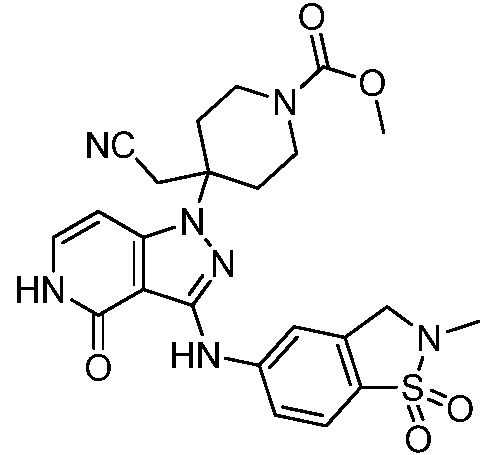


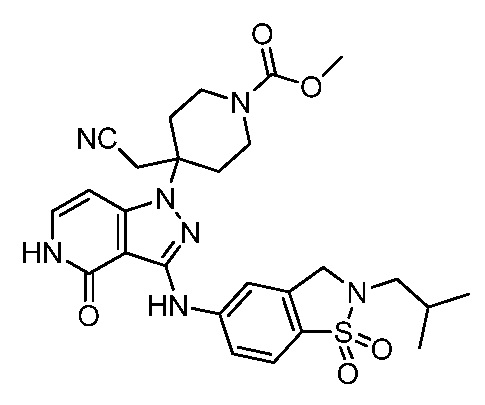



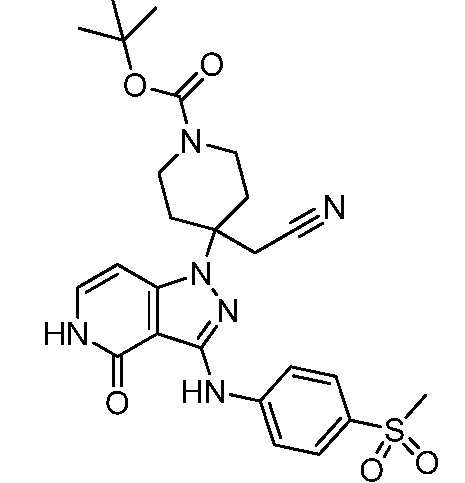

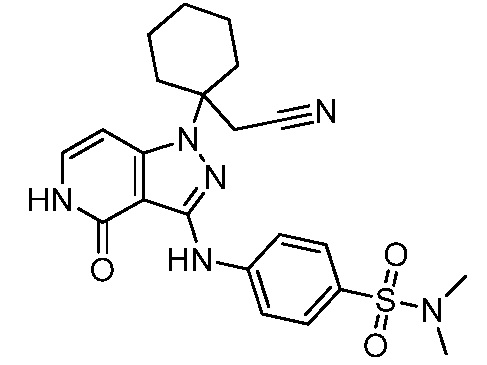
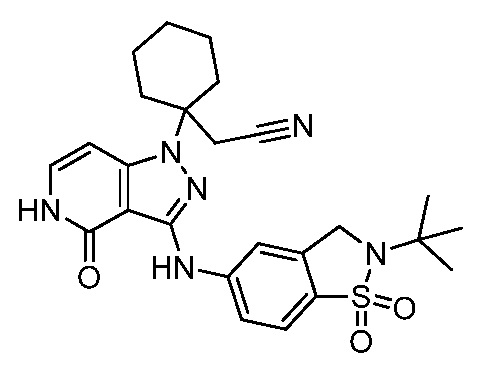


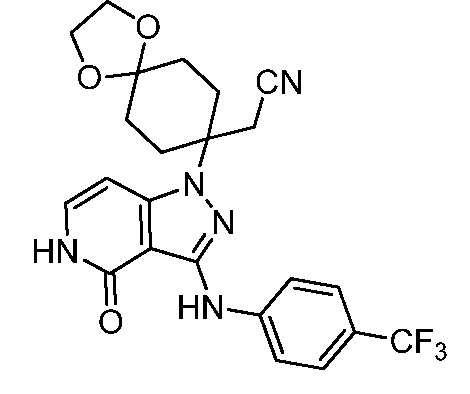
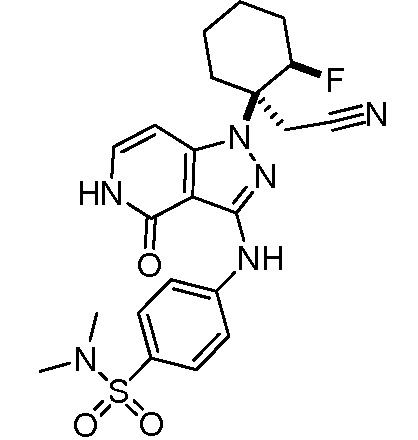




(полученный из арилбромида I-29A)




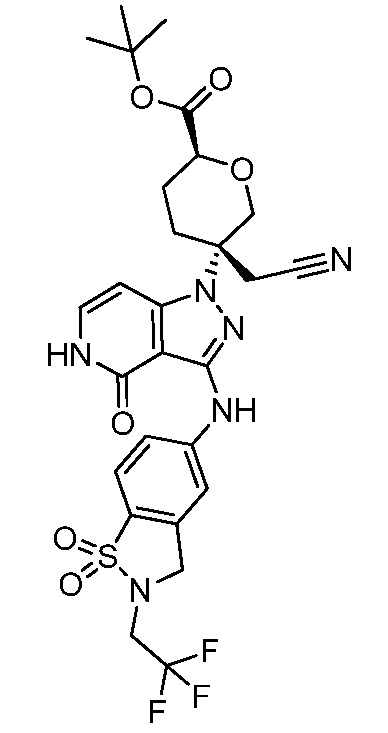


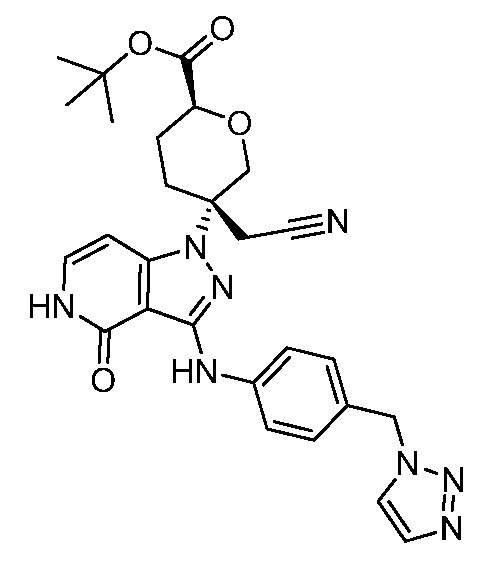
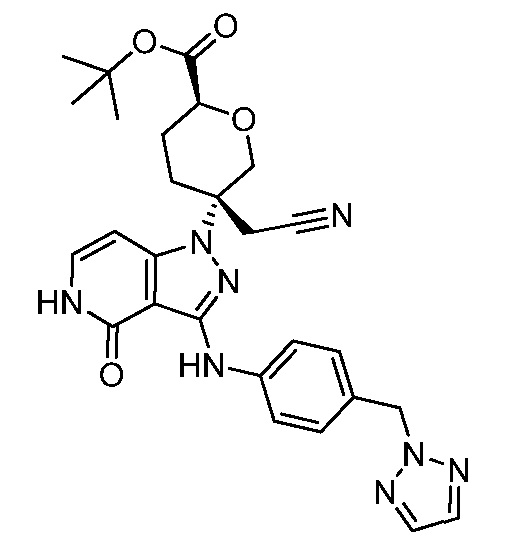
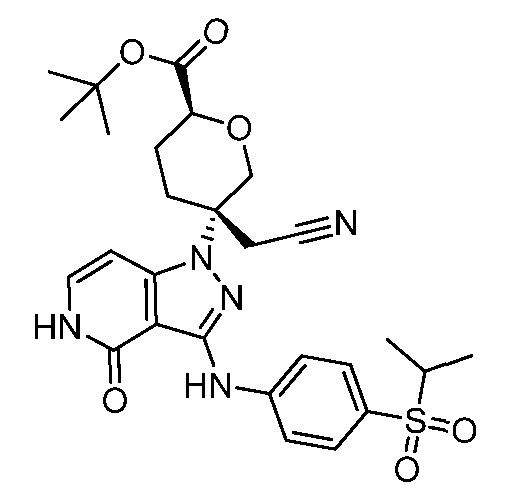










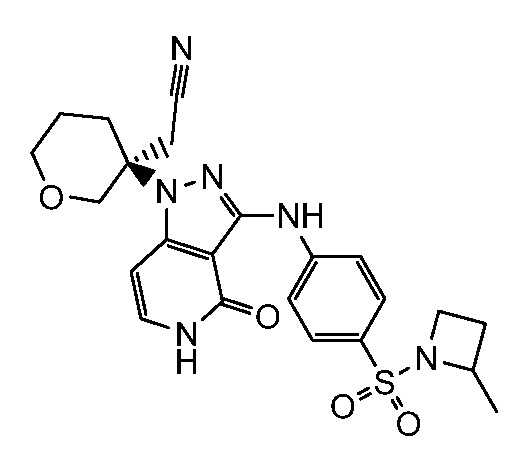



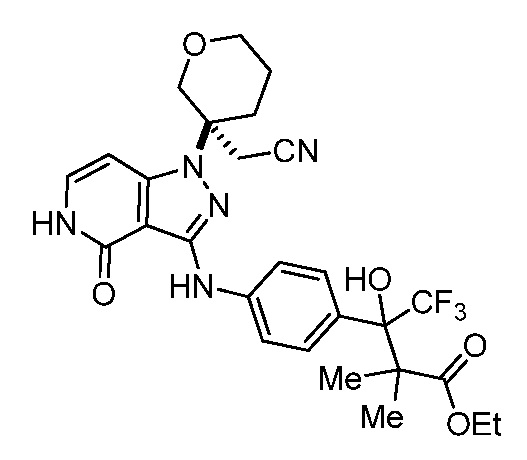
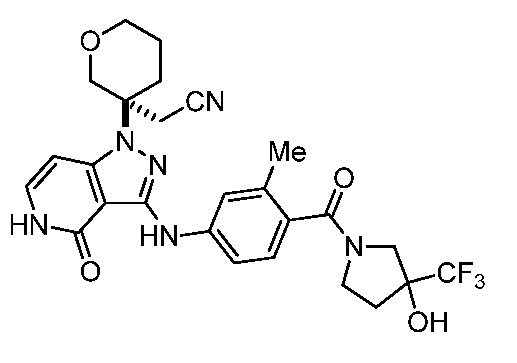


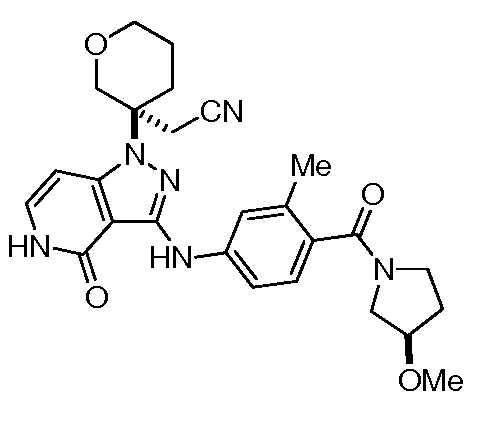

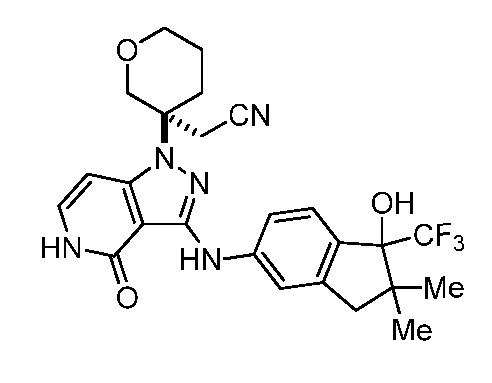
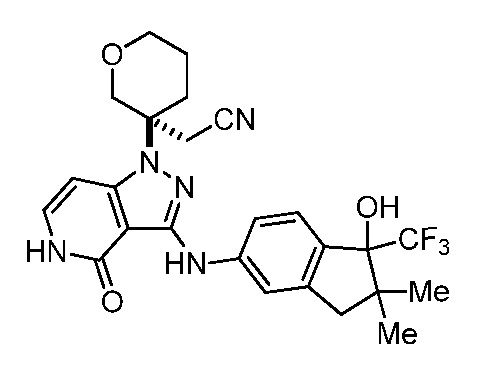

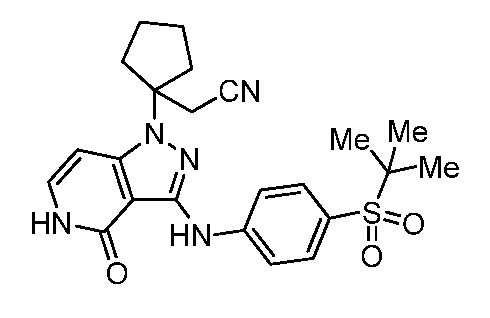

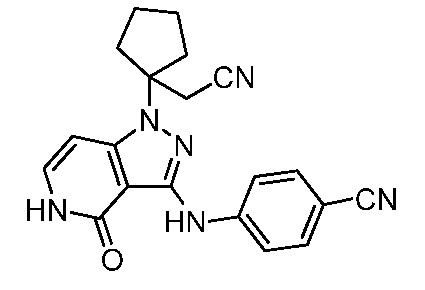


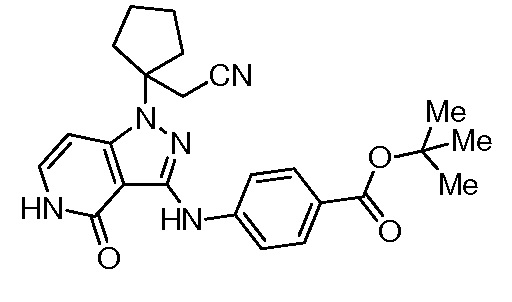

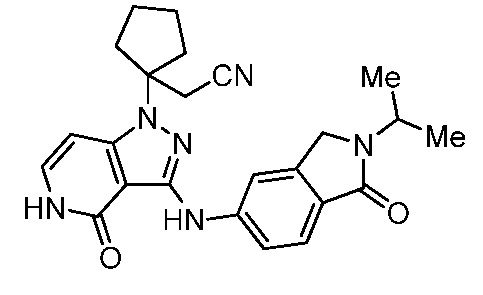
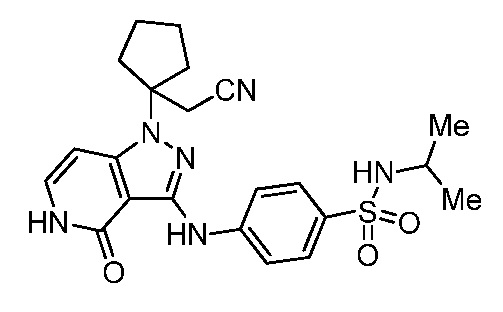

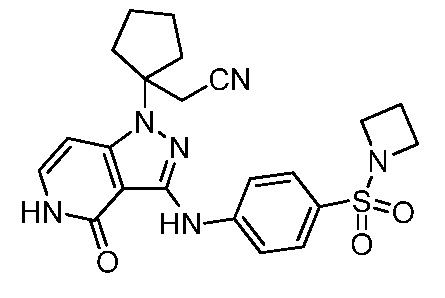
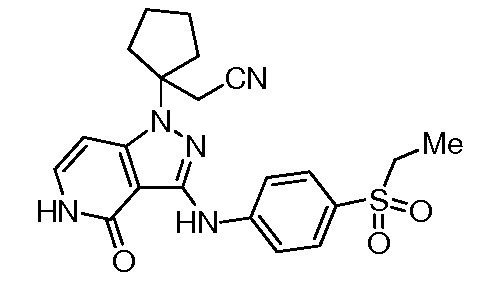

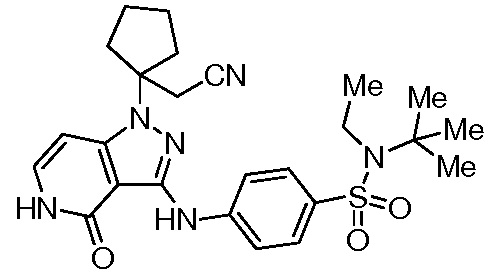

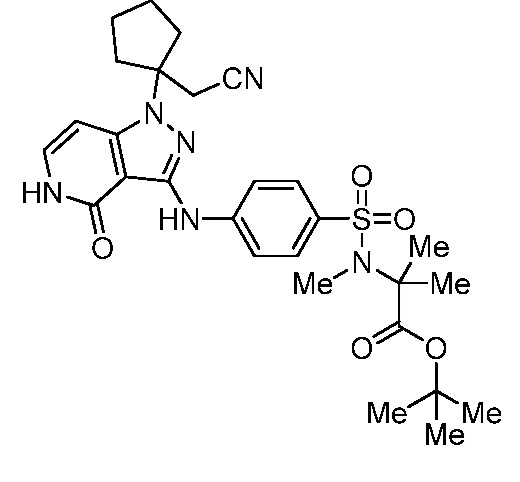

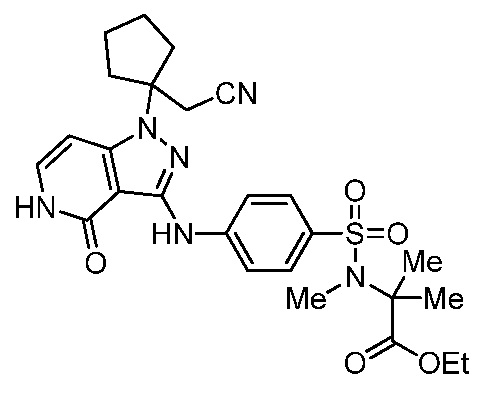
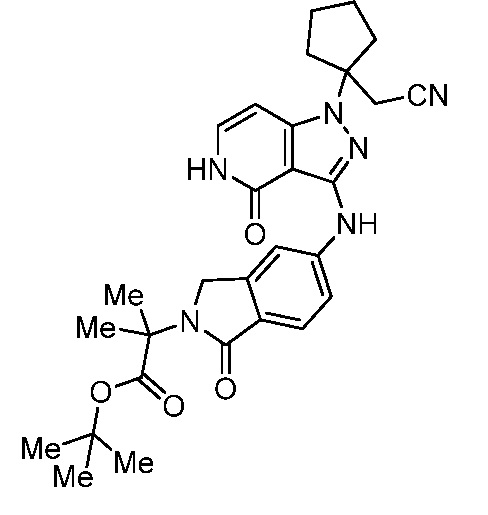

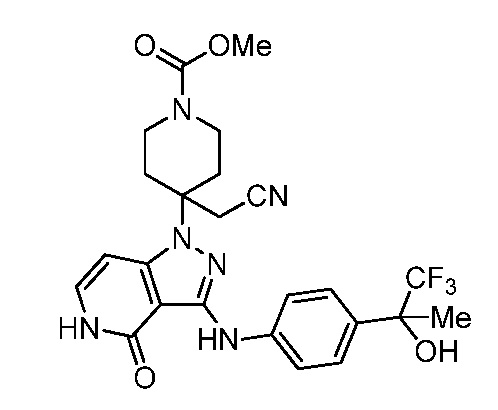








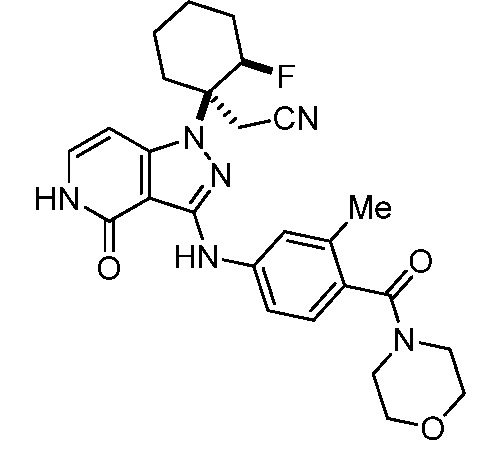



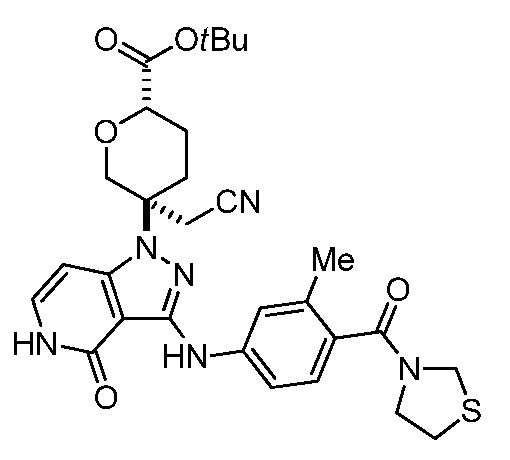
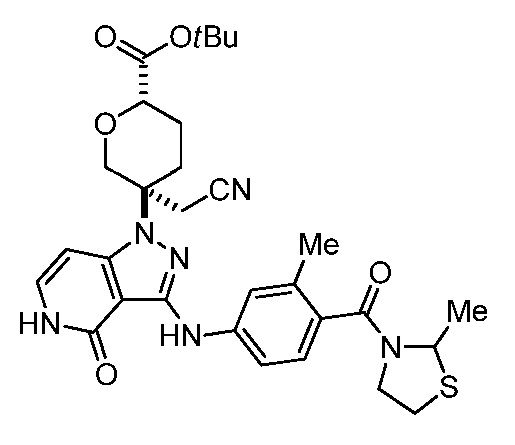






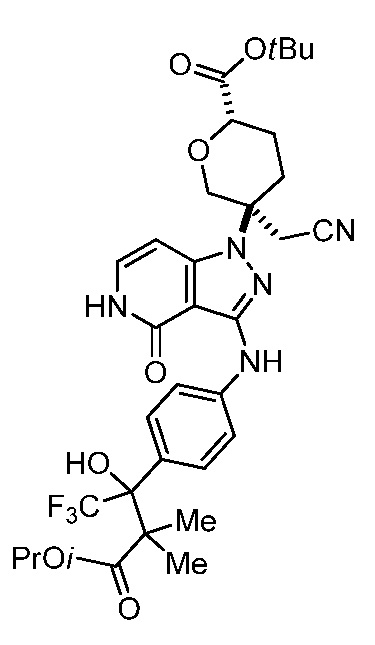
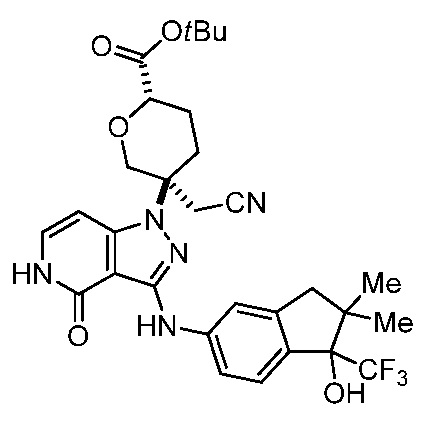

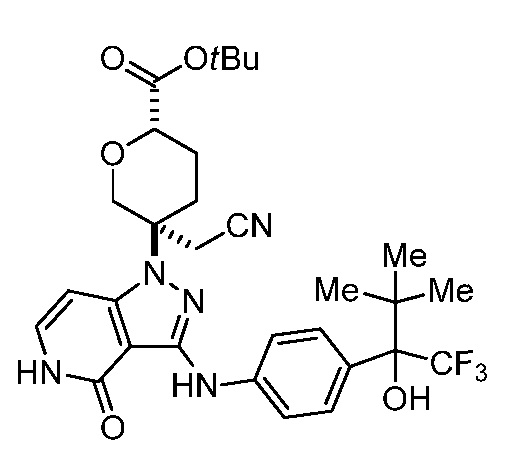
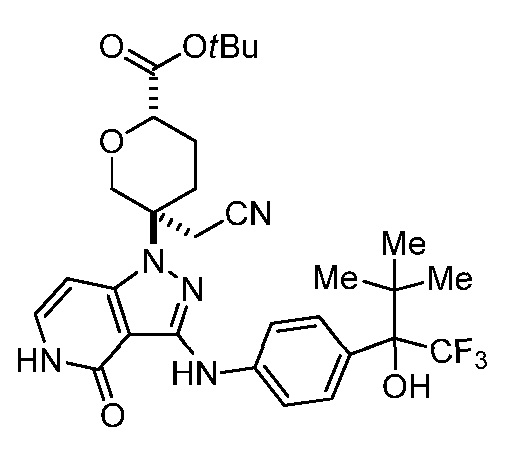
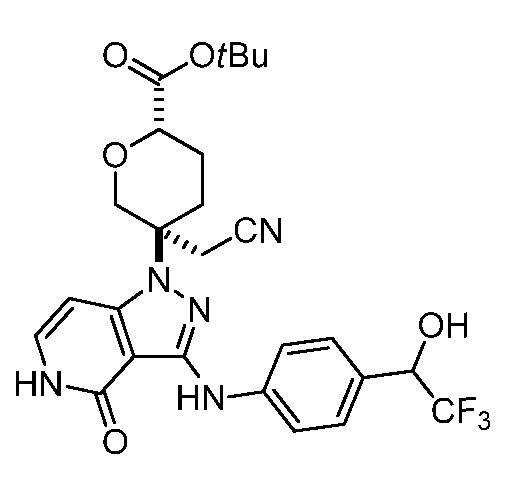

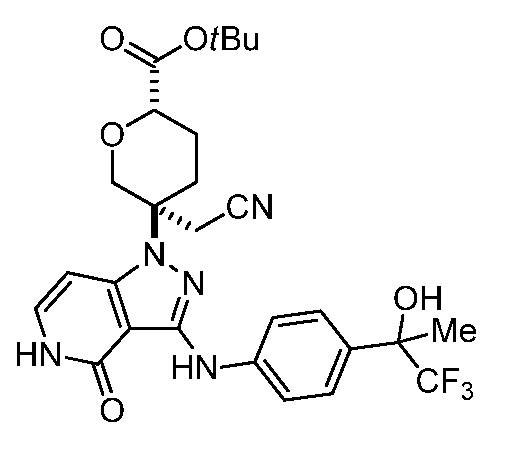

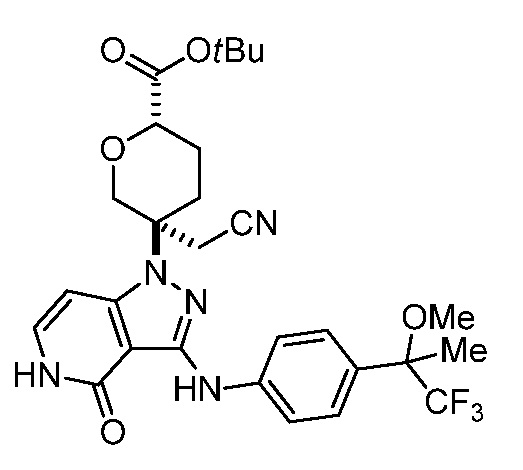




(из I-19A и I-29A)
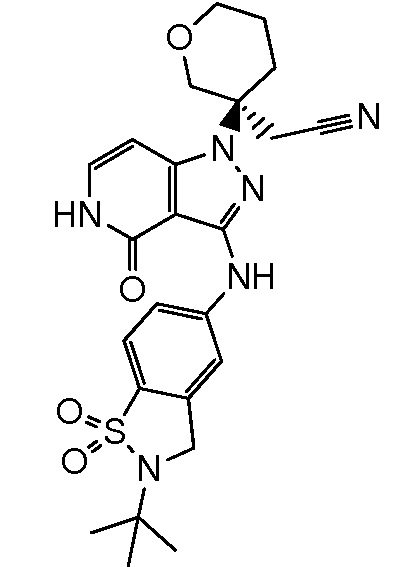







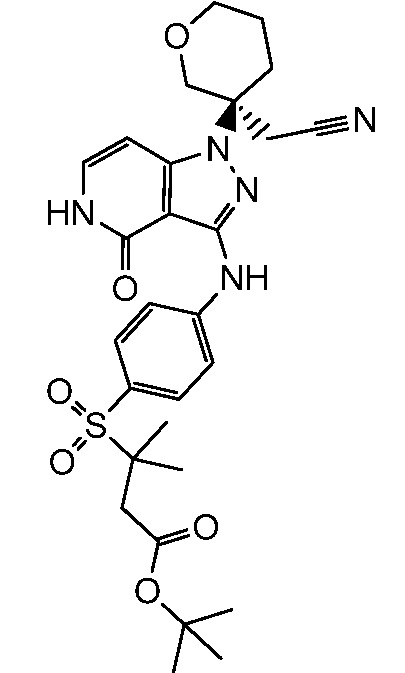
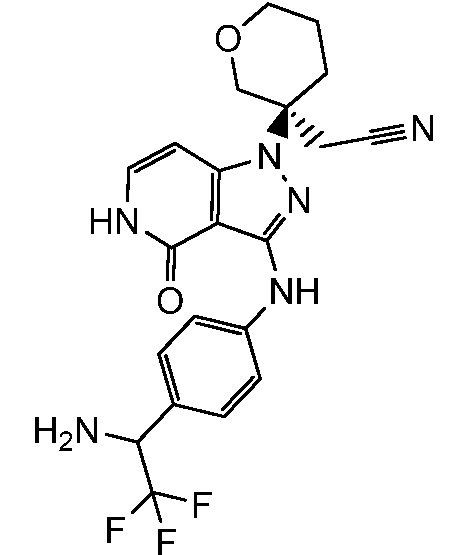

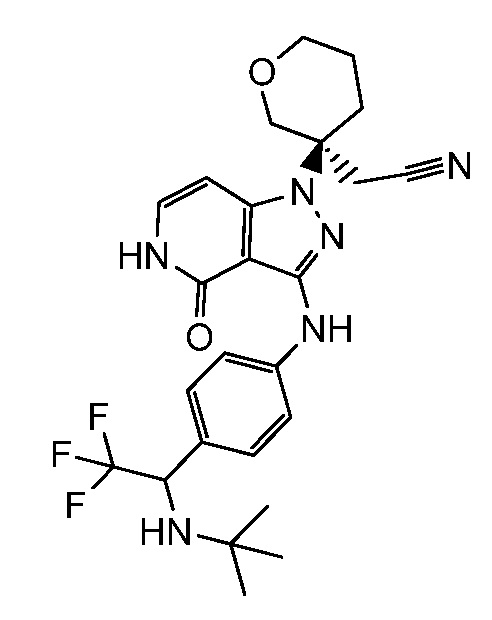












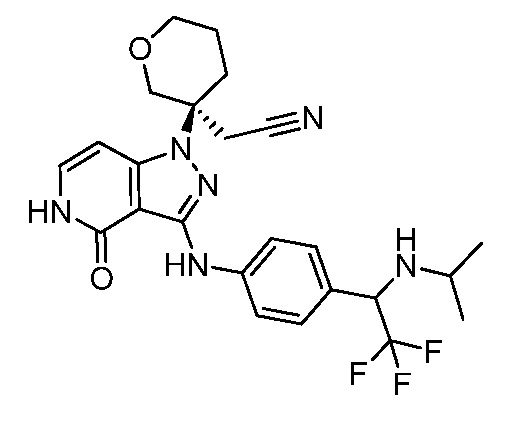



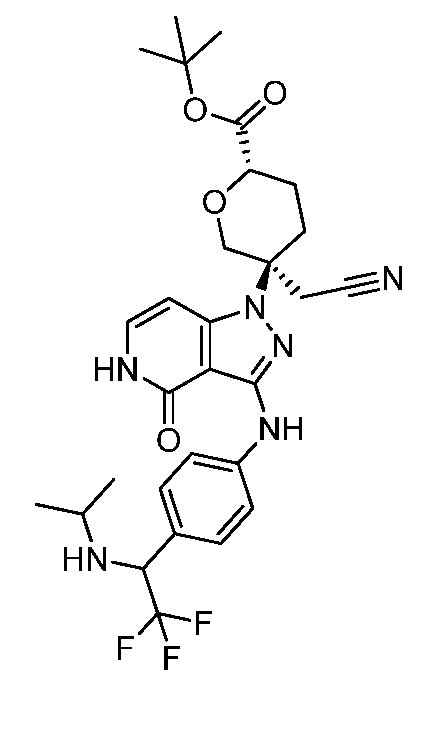



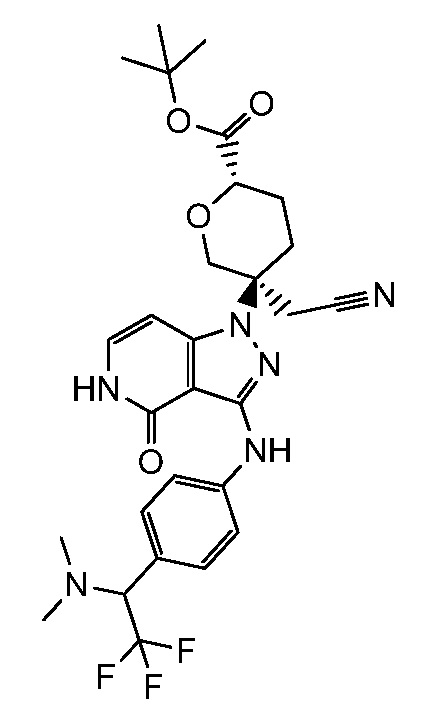




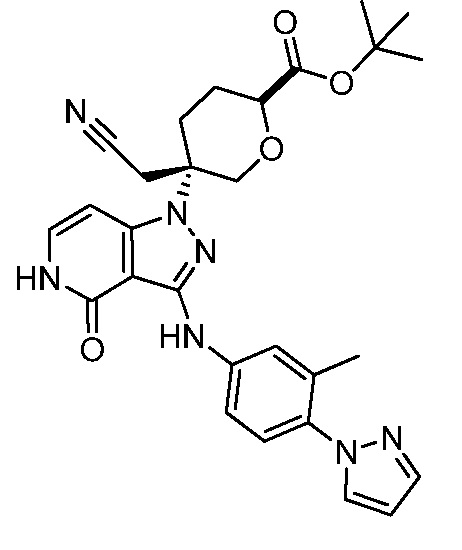

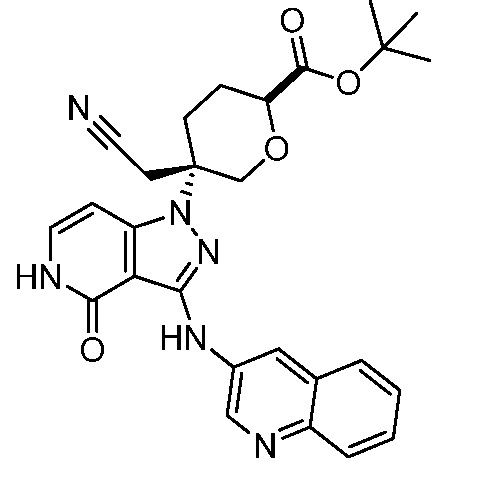
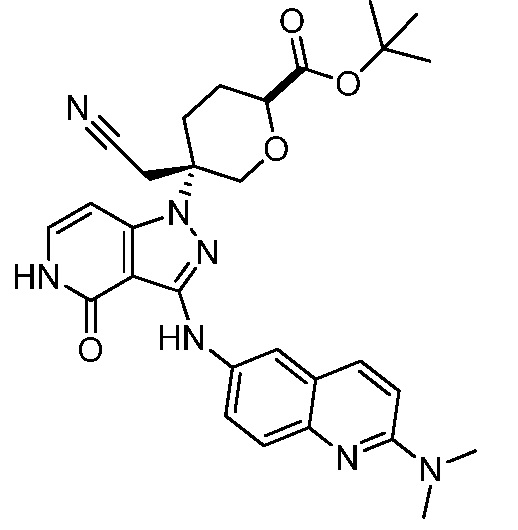


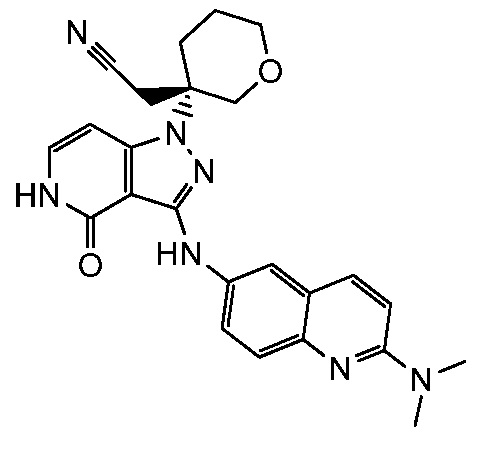




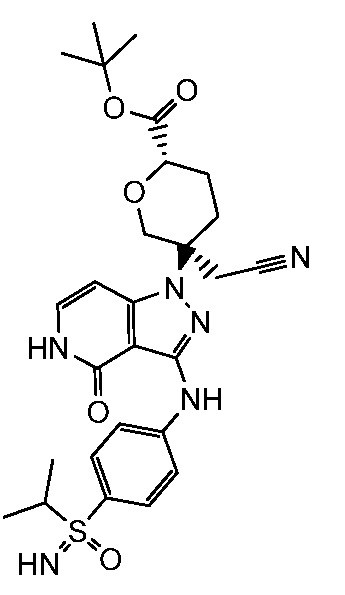


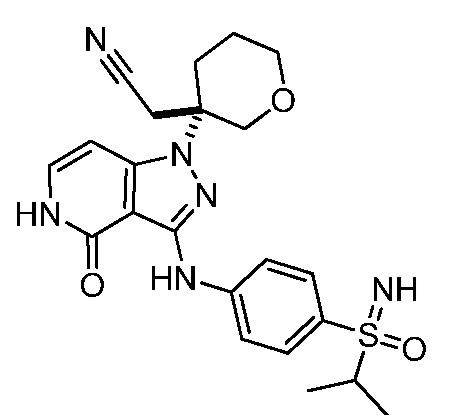
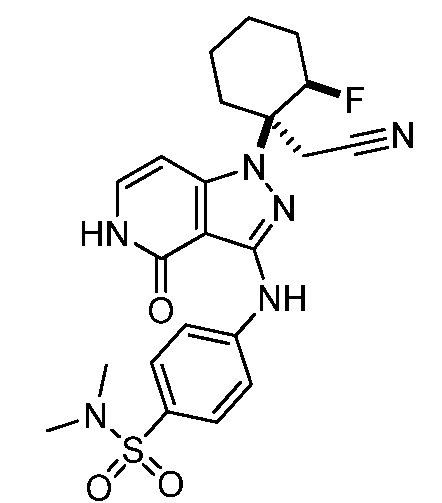


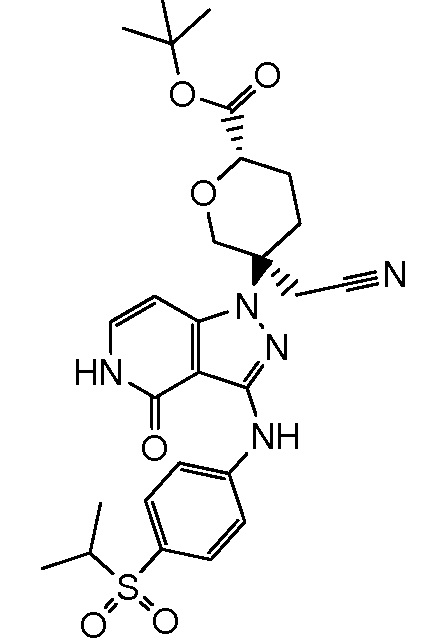
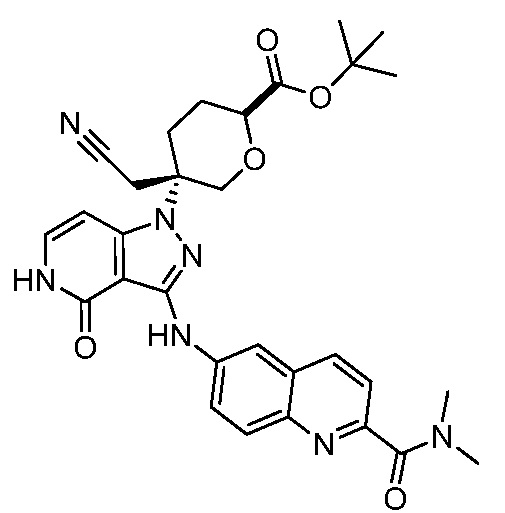


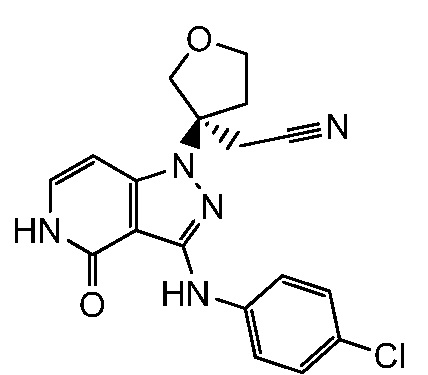

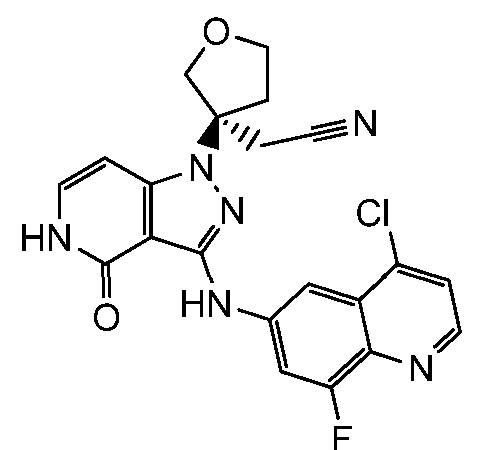












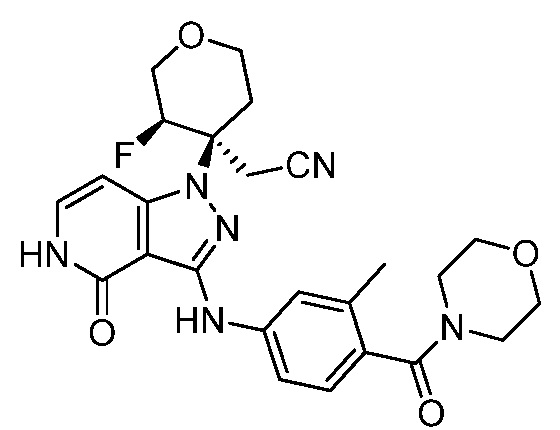
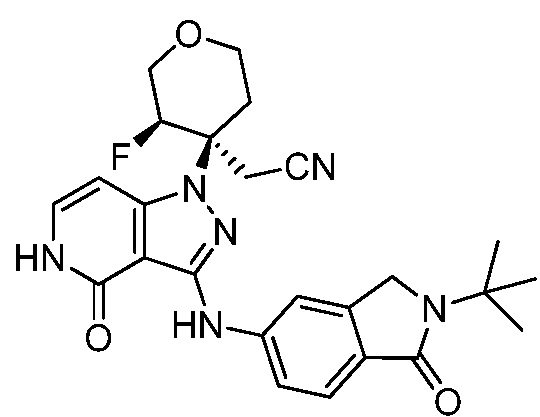

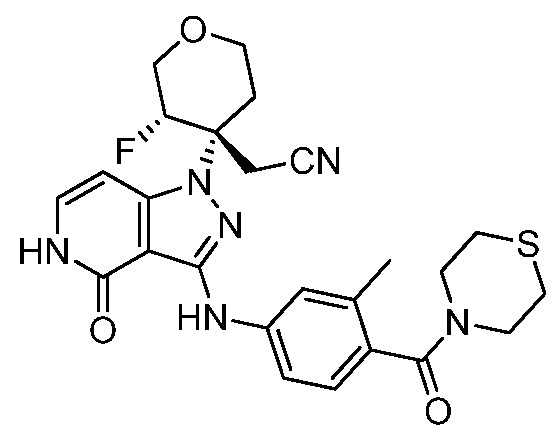
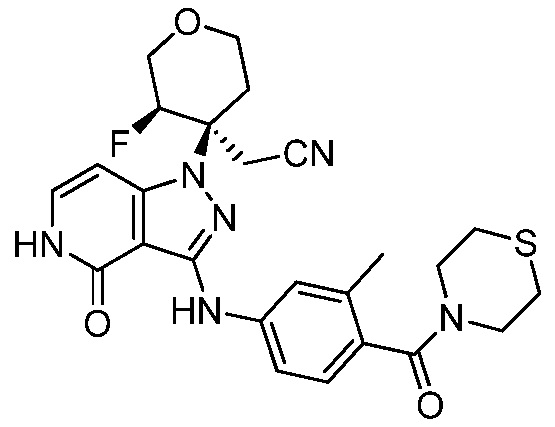


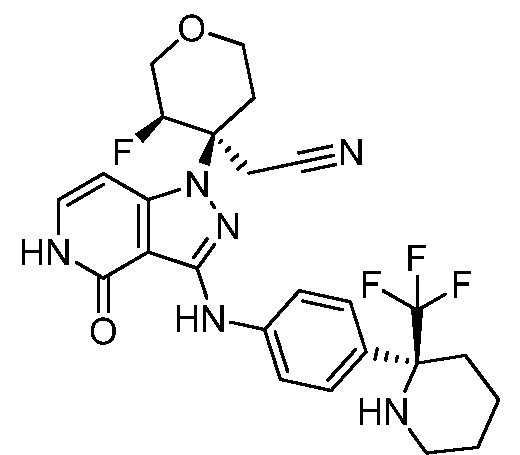



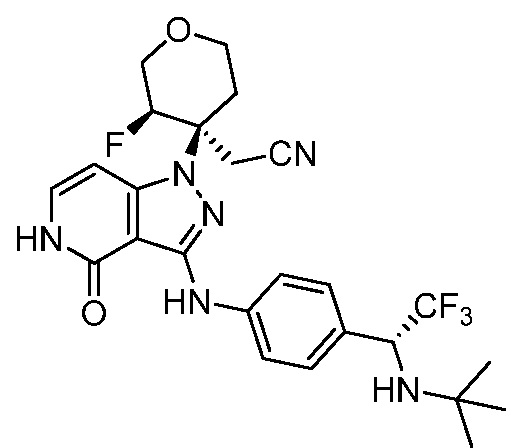






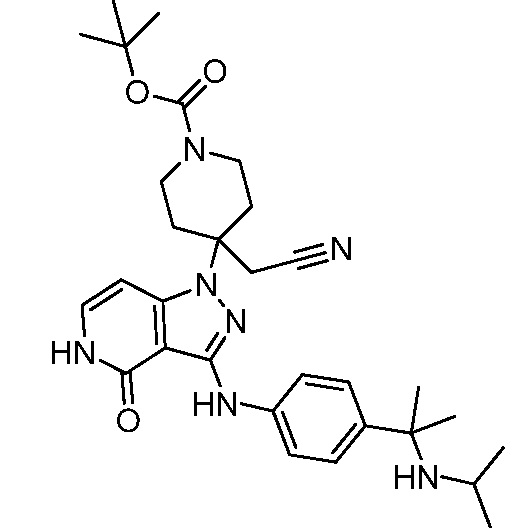






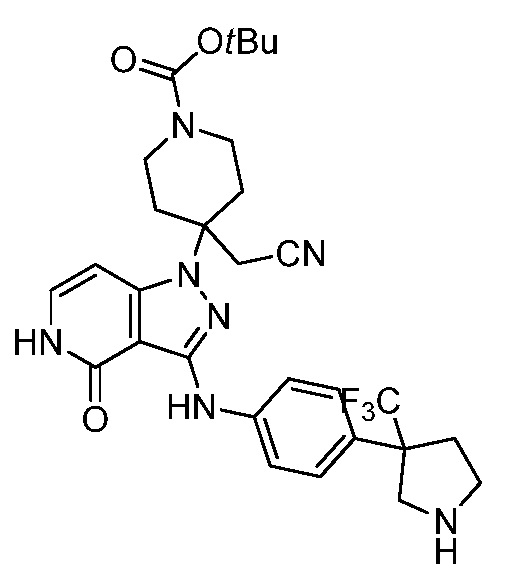
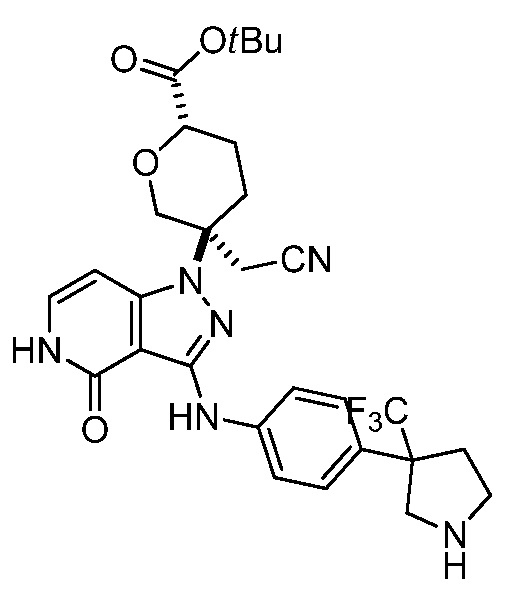
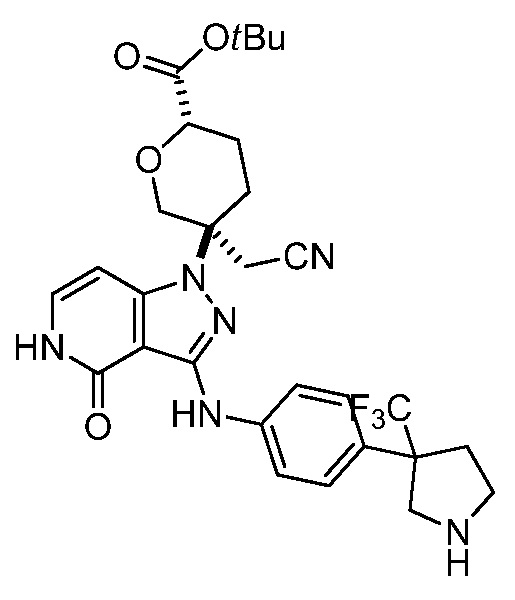


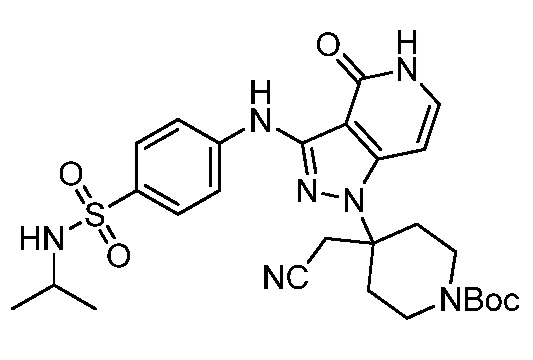





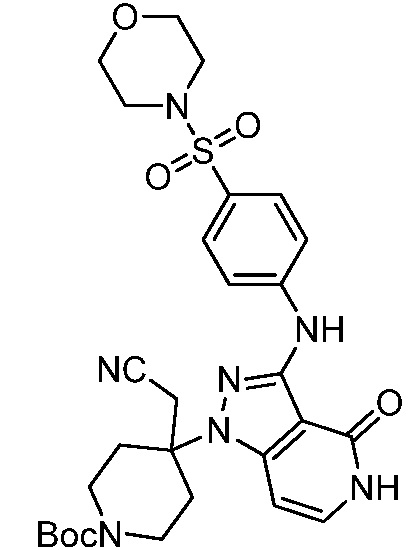

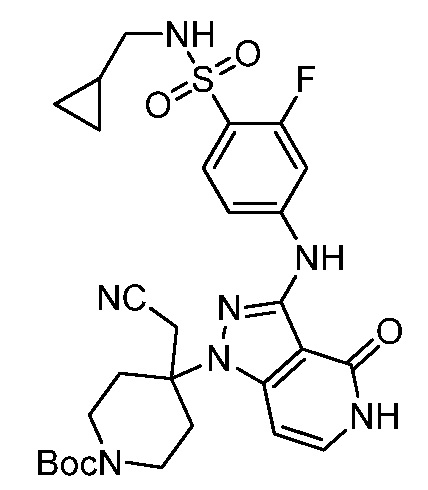
Пример 6
(4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил)ацетонитрил

Стадия 1: (4-{4-(бензилокси)-3-[(4-фторфенил)амино]-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил)ацетонитрил

К раствору трет-бутил-4-{4-(бензилокси)-3-[(4-фторфенил)амино]-1H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)пиперидин-1-карбоксилата (Пример 5-48, стадия 1) (32 мг, 0,057 ммоль) в CH2Cl2 (1 мл) добавляли TFA (0,10 мл, 1,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, разбавляли EtOAc и затем промывали 1н раствором NaOH и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенное указанное в заголовке соединение использовали как таковое на следующей стадии. LRMS (ESI) рассчитано для C26H26FN6O [M+H]+: 457, найдено 457.
Стадия 2: (4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил)ацетонитрил (6)
К раствору неочищенного (4-{4-(бензилокси)-3-[(4-фторфенил)амино]-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил)ацетонитрила (28 мг, 0,061 ммоль) в EtOAc (0,5 мл) и EtOH (0,5 мл) добавляли 10% масс. Pd/C (5 мг). Реакционную смесь помещали под давление 1 атм водорода и интенсивно перемешивали при комнатной температуре в течение 2 часов. Атмосферу водорода удаляли и затем катализатор удаляли фильтрованием через Целит. Фильтрат концентрировали в вакууме и остаток очищали масс-индуцируемой обращенно-фазовой ВЭЖХ, элюируя смесью ацетонитрил/вода, содержащей 0,1% TFA модификатора. Фракции, содержащие желаемый продукт, лиофилизировали с получением соединения 7 в виде TFA соли. LRMS (ESI) рассчитано для C19H20FN6O [M+H]+: 367, найдено 367. 1H ЯМР (600 МГц, DMSO-d6): δ 11,35 (д, J=6,0 Гц, 1H), 8,40-8,55 (м, 2H), 8,20 (с, 1H), 7,63 (м, 2H), 7,21 (т, J=6,6 Гц, 1H), 7,07 (т, J=8,4 Гц, 2H), 6,66 (д, J=7,2 Гц, 1H), 3,26-3,34 (м, 4H), 2,97 (м, 2H), 2,82 (м, 2H), 2,19 (м, 2H).
Пример 7
[1-(циклопропилкарбонил)-4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил]ацетонитрил

Стадия 1: [4-{4-(бензилокси)-3-[(4-фторфенил)амино]-1H-пиразоло[4,3-c]пиридин-1-ил}-1-(циклопропилкарбонил)пиперидин-4-ил]ацетонитрил

К раствору неочищенного (4-{4-(бензилокси)-3-[(4-фторфенил)амино]-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил)ацетонитрила (Пример 6, Стадия 1) (21 мг, 0,046 ммоль) в CH2Cl2 (1,0 мл) добавляли DIPEA (24,0 мкл, 0,138 ммоль) с последующим добавлением циклопропанкарбонилхлорида (6,3 мкл, 0,069 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут и затем разбавляли при помощи EtOAc и промывали насыщенным водным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Очистка остатка с использованием хроматографии на диоксиде кремния с элюированием смесью 0-100% EtOAc в гексане давала указанное в заголовке соединение. LRMS (ESI) рассчитано для C30H30FN6O2 [M+H]+: 525, найдено 525.
Стадия 2: [1-(циклопропилкарбонил)-4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил]ацетонитрил (7)
К раствору [4-{4-(бензилокси)-3-[(4-фторфенил)амино]-1H-пиразоло[4,3-c]пиридин-1-ил}-1-(циклопропилкарбонил)пиперидин-4-ил]ацетонитрила (12 мг, 0,024 ммоль) в EtOAc (1,5 мл) и EtOH (0,5 мл) добавляли Pd/C (5,0 мг, 10% масс.). Реакционную смесь помещали под давление 1 атм водорода и интенсивно перемешивали при комнатной температуре в течение 2 часов. Атмосферу водорода удаляли и реакционную смесь фильтровали через Целит и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 0-5% MeOH в EtOAc, с получением соединения 7. LRMS (ESI) рассчитано для C23H24FN6O2 [M+H]+: 435, найдено 435. 1H ЯМР (600 МГц, CD3OD): δ 8,06 (с, 1H), 7,60 (м, 2H), 7,19 (д, J=7,2 Гц, 1H), 7,01 (т, J=8,4 Гц, 2H), 6,73 (д, J=7,8 Гц, 1H), 5,47 (с, 1H), 4,25 (м, 2H), 3,51 (м, 1H), 3,14 (с, 2H), 2,86-3,15 (м, 3H), 1,95-2,18 (м, 3H), 0,74-0,90 (м, 4H).
Пример 8-1
4-({1-[1-бензил-4-(цианометил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид
Стадия 1: 3-((4-(бензилокси)-1-(4-(цианометил)пиперидин-4-ил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид

К раствору трет-бутил-4-(4-(бензилокси)-3-((3-(N,N-диметилсульфамоил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата (5-1a) (3,50 г, 5,42 ммоль) в CH2Cl2 (46 мл) при 0°C добавляли комплекс тетрафторборная кислота-диэтиловый эфир (1,55 мл, 11,4 ммоль). Реакционную смесь перемешивали и нагревали до комнатной температуры в течение 4 часов. Реакционную смесь гасили насыщенным водным раствором NaHCO3 и разбавляли при помощи CH2Cl2. Слои разделяли и водный слой экстрагировали при помощи CH2Cl2 (× 3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 7,93 (д, J=6,5 Гц, 1H), 7,73-7,70 (м, 3H), 7,56-7,44 (м, 6H), 6,98 (д, J=6,5 Гц, 1H), 5,60 (с, 2H), 3,21-3,10 (м, 2H), 3,02-2,96 (м, 6H), 2,69 (с, 6H), 2,28-2,24 (м, 2H).
Стадия 2: 4-({1-[1-бензил-4-(цианометил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,Nдиметилбензолсульфонамид (8-1)
В высушенный в печи реакционный сосуд загружали 3-((4-(бензилокси)-1-(4-(цианометил)пиперидин-4-ил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид (20 мг, 0,037 ммоль), DMF (0,19 мл, 0,2 M), бензальдегид (3,8 мг, 0,037 ммоль), TFA (18,8 мг, 0,165 ммоль) и триацетоксиборогидрид (39 мг, 0,183 ммоль). Реакционный сосуд герметично закрывали и нагревали до 50°C в течение ночи. После охлаждения до комнатной температуры добавляли HCl в диоксане (0,10 мл, 2M) и реакционную смесь перемешивали еще в течение 4 часов. Неочищенную реакционную смесь фильтровали и очищали с использованием масс-направленной обращенно-фазовой колоночной хроматографии с получением соединения Примера 8-1. LRMS (ESI) рассчитано для C28H32N7O3S [M+H]+: 546, найдено 546. 1H ЯМР (600 МГц, DMSO-d6): δ 11,31 (с, 1H) 8,68 (с, 1H), 7,83 (д, J=8,5 Гц, 2H), 7,59 (д, J=8,5 Гц, 2H), 7,26 (м, 3H), 7,18 (м, 1H), 7,16 (м, 1H), 6,67 (м, 1H), 6,51 (м, 1H), 3,71 (шир. с, 1H), 2,65 (д, 2H), 2,54 (с, 6H), 2,08 (м, 1H), 1,36 (с, 2H).
Следующие соединения, представленные в Таблице 21, были получены аналогично получению соединения Примера 8-1, описанному выше.








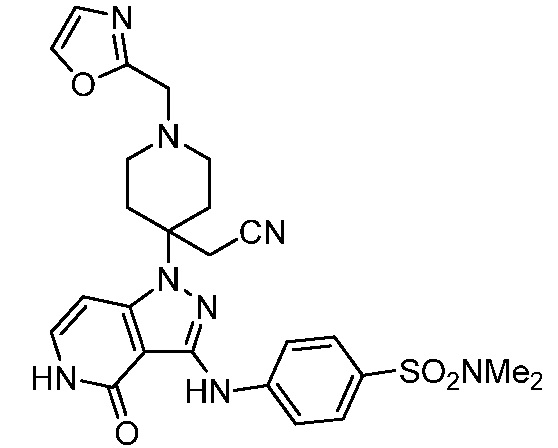







Пример 9-1
4-({1-[4-(цианометил)-1-пропаноилпиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид

В высушенный в печи реакционный сосуд загружали PS-CDI (97 мг, 0,137 ммоль) и DMF (0,55 мл, 0,1 M) и встряхивали в течение 5 минут. К этой суспензии добавляли HOBt (11 мг, 0,082 ммоль), 3-((4-(бензилокси)-1-(4-(цианометил)пиперидин-4-ил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид (Пример 8-1, Стадия 1) (30 мг, 0,055 ммоль) и пропионовую кислоту (4,1 мг, 0,055 ммоль), с последующим добавлением DIPEA (14 мг, 0,11 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли HCl в диоксане (0,20 мл, 2M) и реакционную смесь перемешивали при комнатной температуре еще в течение 2 часов. К этой реакционной смеси добавляли Si-Карбонат (250 мг, 0,11 ммоль) и дополнительное количество DMF (1,0 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали и неочищенное вещество, содержащее соединение 9-1, очищали с использованием масс-направленной обращенно-фазовой колоночной хроматографии. LRMS (ESI) рассчитано для C24H30N7O4S [M+H]+: 512, найдено 512. 1H ЯМР (600 МГц, DMSO-d6): δ 11,33 (д, J=5,9 Гц, 1H), 8,68 (с, 1H), 7,83 (д, J=8,6 Гц, 2H), 7,61 (д, J=8,6 Гц, 2H), 7,19 (т, J=6,7 Гц, 1H), 6,70 (д, J=7,6 Гц, 1H), 4,00 (м, 1H), 3,73 (м, 1H), 3,29-3,23 (м, 3H), 3,05-3,01 (м, 1H), 2,69-2,65 (м, 2H), 2,54 (с, 6H), 2,34-2,30 (м, 2H), 2,05 (м, 1H), 1,96 (м, 1H), 0,94 (т, J=7,4 Гц, 3H).
Следующие соединения, представленные в Таблице 22, были получены аналогично получению соединения Примера 9-1.


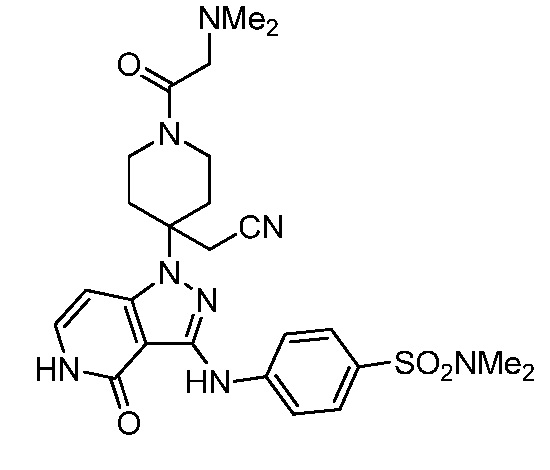





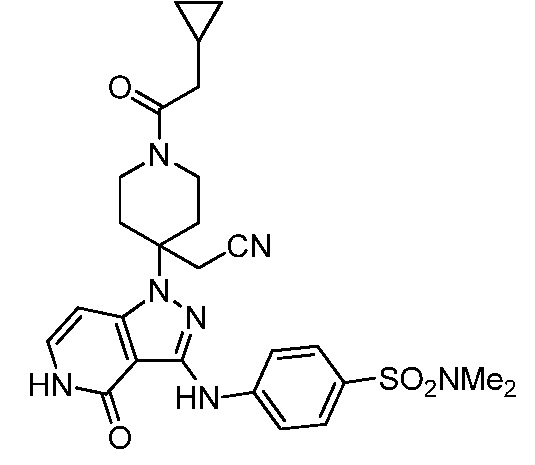


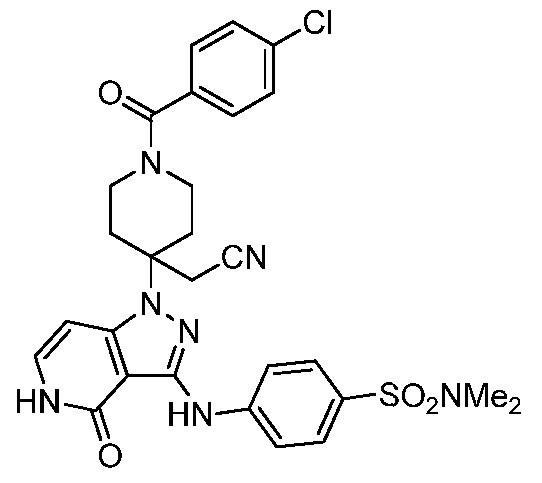
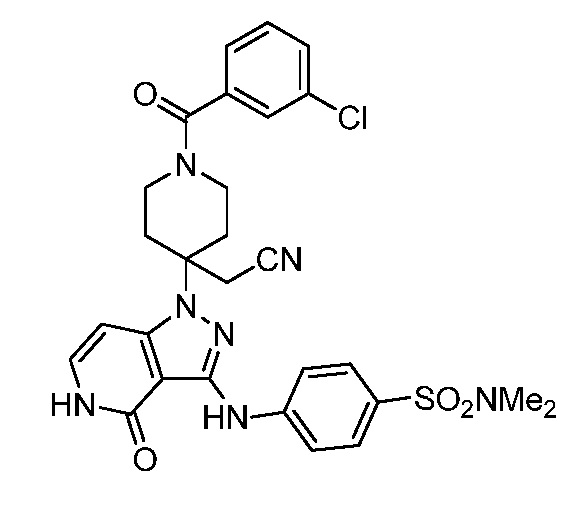




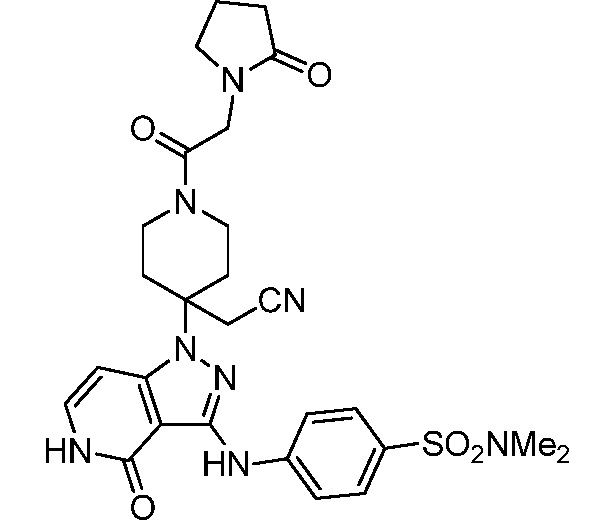





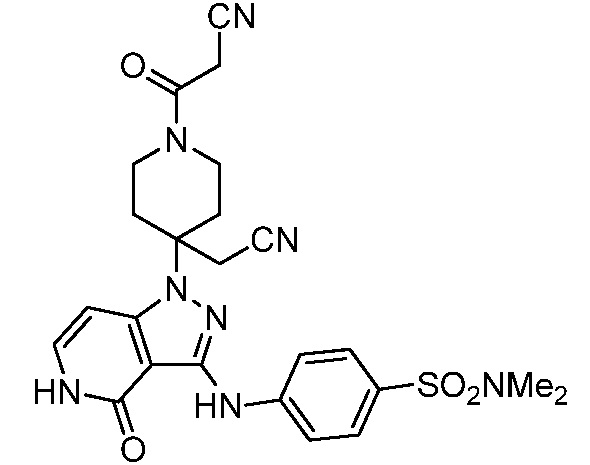
Пример 10-1
метил-4метил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат

К раствору 3-((4-(бензилокси)-1-(4-(цианометил)пиперидин-4-ил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида (Пример 8-1, Стадия 1) (25 мг, 0,046 ммоль) в CH2Cl2 (0,2 M) добавляли 2,6-лутидин (12,3 мг, 0,115 ммоль). Реакционную смесь охлаждали до 0°C и добавляли метилхлорформиат (4,76 мг, 0,050 ммоль). Реакционную смесь перемешивали при комнатной температуре вплоть до завершения реакции, согласно данным ЖХ/МС, в этот момент смесь охлаждали до 0°C и добавляли 0,2 мл TFA. Реакционную смесь фильтровали и очищали с использованием масс-направленной обращенно-фазовой хроматографии. LRMS (ESI) рассчитано для C23H28N7O5S [M+H]+: 514, найдено 514. 1H ЯМР (600 МГц, DMSO-d6): δ 11,33 (д, J=5,9 Гц, 1H), 8,71 (с, 1H), 7,85 (д, J=8,6 Гц, 2H), 7,63 (д, J=8,6 Гц, 2H), 7,19 (м, 1H), 6,70 (м, 1H), 3,82-3,78 (м, 2H), 3,58 (с, 3H), 3,31 (м, 1H), 3,29 (м, 1H), 3,21-3,13 (м, 1H), 2,72-2,64 (м, 1H), 2,57 (с, 6H), 2,48-2,44 (м, 2H), 2,10-2,02 (м, 2H).
Следующие соединения, представленные в Таблице 23, были получены аналогично получению соединения Примера 10-1.
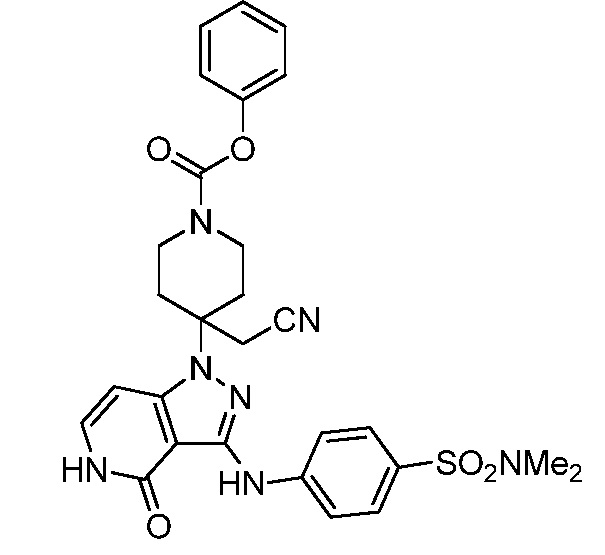
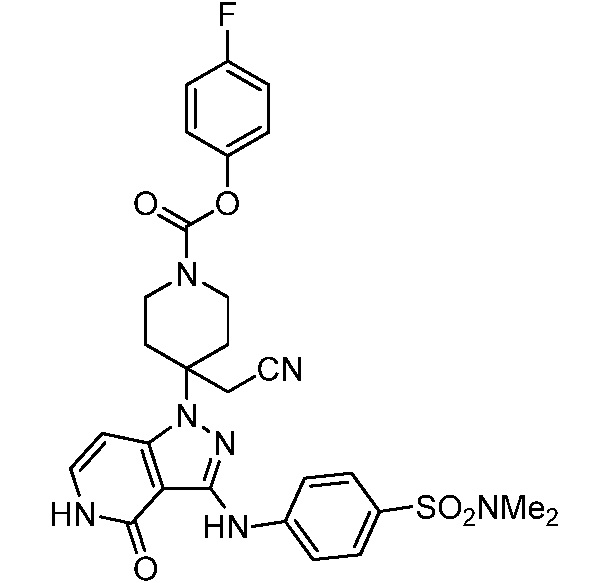


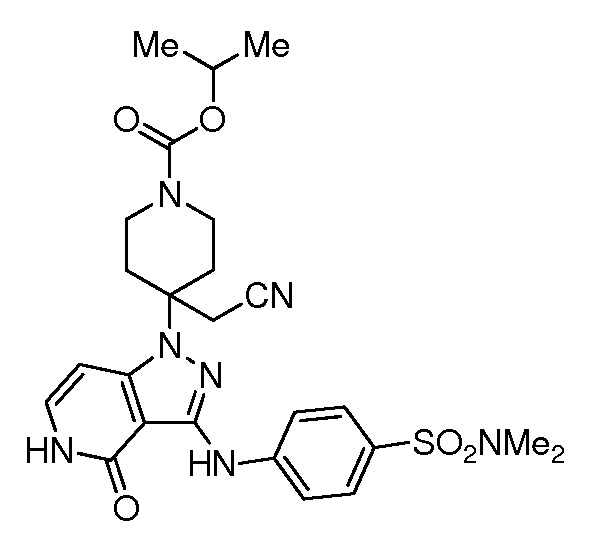
Пример 11-1
метил-4метил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат

К DMSO раствору (0,5 M) триэтиламина (46 мг, 0,45 ммоль) и 2-метоксиэтанола (11 мг, 0,15 ммоль) добавляли N,N'-дисукцинимидилкарбонат (38 мг, 0,15 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, затем добавляли DMSO (0,5 M) раствор 3-((4-(бензилокси)-1-(4-(цианометил)пиперидин-4-ил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида (Пример 8-1, Стадия 1) (41 мг, 0,075 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили путем добавления TFA (0,10 мл) и затем нейтрализовали, после отщепления бензилового эфира, путем добавления PS-Карбоната (300 мг). Реакционную смесь фильтровали и очищали с использованием масс-направленной обращенно-фазовой хроматографии с получением соединения 11-1. LRMS (ESI) рассчитано для C25H32N7O6S [M+H]+: 558, найдено 558. 1H ЯМР (600 МГц, DMSO-d6): δ 11,31 (д, J=5,9 Гц, 1H), 8,71 (с, 1H), 7,85 (д, J=8,6 Гц, 2H), 7,63 (д, J=8,6 Гц, 2H), 7,19 (м, 1H), 6,70 (м, 1H), 3,85-3,65 (м, 4H), 3,47-3,37 (м, 4H), 3,32 (с, 3H), 2,72-2,64 (м, 2H), 2,57 (с, 6H), 2,10-2,02 (м, 2H), 1,85-1,75 (м, 2H).
Следующие соединения, представленные в Таблице 24, были получены аналогично получению соединения Примера 11-1.
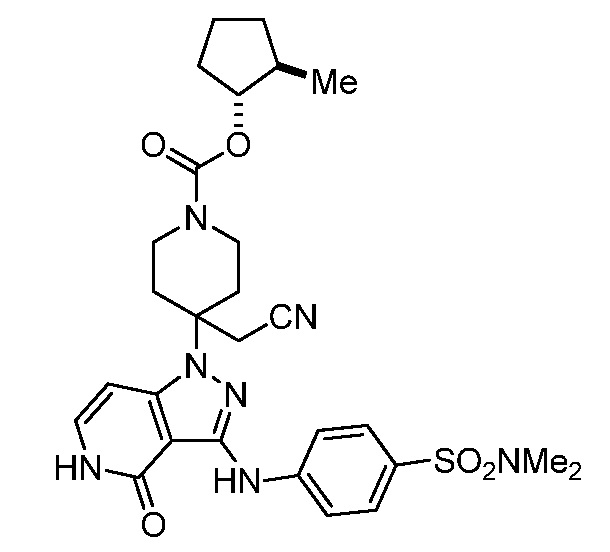


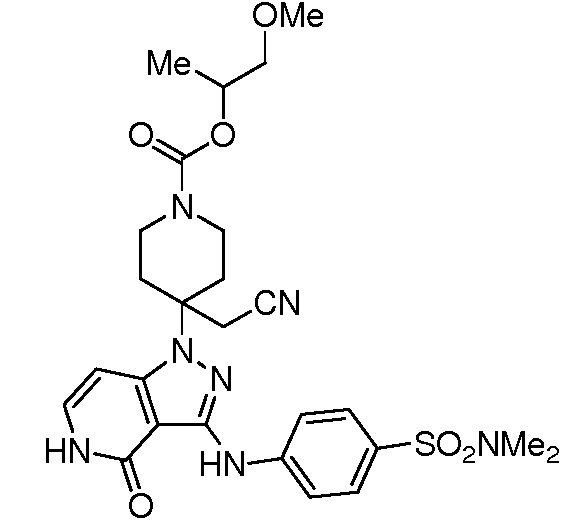






Пример 12
2,2,2-трифторэтил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат

К раствору 4-((1-(4-(цианометил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида (Пример 8-1, Стадия 1) (82 мг, 0,25 ммоль) в DMF (1,0 мл) добавляли 2,2,2-трифторэтанол (50 мг, 0,50 ммоль) и Et3N (50 мг, 0,50 ммоль). Раствор охлаждали до -20°C, затем добавляли трифосген (4,0 мг, 1,3 ммоль) и полученный раствор перемешивали при -20°C в течение 4 часов. Смесь фильтровали и фильтрат концентрировали в вакууме и очищали обращенно-фазовой ВЭЖХ с использованием смеси вода/ацетонитрил с 0,225% муравьиной кислоты в качестве модификатора, с получением соединения 12 в виде твердого вещества. LRMS (ESI) рассчитано для C24H27F3N7O5S [M+H]+: 582, найдено 582. 1H ЯМР (400 МГц, DMSO-d6): δ 11,37 (с, 1H), 8,72 (с, 1H), 7,85 (д, J=8,8 Гц, 2H), 7,66-7,64 (м, 2H), 7,24-7,21 (м, 1H), 6,74 (д, J=7,6 Гц, 1H), 4,71-4,69 (м, 2H), 3,86-3,82 (м, 2H), 3,28 (с, 2H), 2,73-2,73 (м, 2H), 2,59 (с, 6H), 2,13-1,97 (м, 4H).
Пример 13-1
изопропил-4-(цианометил)-4-(3-(2-фторпиридин-4-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат

Стадия 1: трет-бутил-4-(4-(бензилокси)-3-((2-фторпиридин-4-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат

К трет-бутил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилату (0,20 г, 0,44 ммоль), 4-бром-2-фторпиридину (93 мг, 0,54 ммоль), ди-трет-бутил(2',4',6'-триизопропилбифенил-2-ил)фосфину (37 мг, 0,090 ммоль), продукту присоединения трис(дибензилиденацетон)дипалладий(0)-хлороформ (46 мг, 0,050 ммоль) и ацетату калия (88 мг, 0,90 ммоль) добавляли изопропанол (30 мл). Смесь дегазировали путем продувки азотом и затем нагревали до 80°C в течение 6 часов. Раствор охлаждали и добавляли воду (10 мл). Смесь экстрагировали этилацетатом (× 3) и объединенные органические слои промывали насыщенным солевым раствором (× 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью этилацетат/петролейный эфир (1/3), с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) рассчитано для C30H33FN7O3 [M+H]+: 558, найдено 558.
Стадия 2: 2-(4-(3-((2-фторпиридин-4-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрил

К раствору трет-бутил-4-(4-(бензилокси)-3-(2-фторпиридин-4-иламино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата (0,21 г, 0,37 ммоль) в дихлорметане (20 мл) добавляли TFA (0,42 г, 3,70 ммоль). Реакционную смесь перемешивали в течение 2 часов при температуре окружающей среды, затем концентрировали в вакууме с получением твердого вещества, которое использовали как таковое на следующей стадии. LRMS (ESI) рассчитано для C18H19FN7O [M+H]+: 368, найдено 368.
Стадия 3: изопропил-4-(цианометил)-4-(3-(2-фторпиридин-4-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилат (13-1)
К раствору 2-(4-(3-(2-фторпиридин-4-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрила (30 мг, 0,06 ммоль) в метаноле (5 мл) добавляли изопропилхлорформиат (9 мг, 0,07 ммоль) и карбонат натрия (20 мг, 0,18 ммоль). Смесь перемешивали в течение 2 часов при температуре окружающей среды, затем охлаждали и гасили путем добавления воды (10 мл). Смесь экстрагировали этилацетатом (× 2) и объединенные органические слои промывали насыщенным солевым раствором (× 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали в вакууме. Неочищенный продукт очищали обращенно-фазовой хроматографией с использованием воды (с 0,05% бикарбоната аммония в качестве модификатора) и ацетонитрила. Желаемые фракции концентрировали в вакууме с получением твердого вещества. ЖХ/МС (ESI) рассчитано для C22H25FN7O3 [M + H]+: 454, найдено 454; 1H ЯМР (400 МГц, DMSO-d6): δ 11,40 (шир. с, 1H), 9,02 (с, 1H), 7,97 (д, J=6,0 Гц, 1H), 7,52 (д, J=6,0 Гц, 1H), 7,39 (д, J=1,5 Гц, 1H), 7,25-7,21 (м, 1H), 6,73 (д, J=7,5 Гц, 1H), 4,77 (м, 1H) 3,78 (м, 2H), 3,18 (м, 2H), 2,67 (м, 2H), 2,50 (м, 2H), 2,11-2,05 (м, 2H), 1,18 (д, J=8,0 Гц, 6H).
Следующие примеры, представленные в Таблице 25, были получены способом, аналогичным описанному выше, с использованием подходящего хлорформиатного реагента.
Пример 14-1
4-((1-(4-(цианометил)-1-((2,2,2-трифторэтил)сульфонил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид
К CH2Cl2 раствору (0,51 мл, 0,1 M) 2,6-лутидина (28 мг, 0,257 ммоль) и 3-((4-(бензилокси)-1-(4-(цианометил)пиперидин-4-ил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида (Пример 8-1, Стадия 1) (28 мг, 0,051 ммоль) добавляли 2,2,2-трифторэтансульфонилхлорид (12 мг, 0,063 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 часов с последующим добавлением TFA (0,2 мл). Реакционную смесь перемешивали при комнатной температуре еще в течение 4 часов. Реакционную смесь гасили PS-Карбонатом (250 мг), фильтровали и очищали с использованием масс-направленной обращенно-фазовой колоночной хроматографии, с получением соединения 14-1. LRMS (ESI) рассчитано для C23H27F3N7O5S2 [M+H]+: 602, найдено 602. 1H ЯМР (500 МГц, DMSO-d6): δ 11,31 (д, J=5,9 Гц, 1H), 8,71 (с, 1H), 7,85 (д, J=8,6 Гц, 2H), 7,63 (д, J=8,6 Гц, 2H), 7,19 (м, 1H), 6,70 (м, 1H), 4,49-4,41 (м, 2H), 3,75-3,65 (м, 2H), 3,47-3,37 (м, 2H), 3,30-3,23 (м, 2H), 2,89-2,82 (м, 2H), 2,57 (с, 6H), 2,24-2,12 (м, 2H).
Следующее соединение, представленое в Таблице 27, получали способом, аналогичным способу получения соединения Примера 14-1:
Пример 15-1
2-(4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил
Стадия 1: трет-бутил-4-(4-(бензилокси)-3-((4-(метилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилат

К суспензии трет-бутил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата (0,69 г, 1,5 ммоль) и KOAc (200 мг, 2,04 ммоль) в i-PrOH (4,0 мл) добавляли 4-бромфенилметилсульфон (0,47 г, 2,0 ммоль), с последующим добавлением Pd2(dba)3 (140 мг, 0,153 ммоль) и 2-ди-трет-бутилфосфино-2′,4′,6′-триизопропилбифенила (60 мг, 0,15 ммоль) в атмосфере азота. Полученную суспензию нагревали до 105°C в условиях микроволнового облучения в течение 1 часа. Смесь затем охлаждали до комнатной температуры и фильтровали. Фильтрат очищали препаративной ТСХ, элюируя смесью 50% EtOAc в гексане, с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) рассчитано для C32H37N6O5S [M+H]+: 617, найдено 617. 1H ЯМР (400 МГц, CDCl3): δ 7,95 (д, J=6,4 Гц, 1H), 7,86 (д, J=7,2 Гц, 2H), 7,76 (шир. с, 1H), 7,56-7,42 (м, 7H), 6,99 (д, J=6,4 Гц, 1H), 5,61 (с, 2H), 4,10-3,92 (м, 2H), 3,21-3,10 (м, 2H), 3,04 (с, 3H), 2,99-2,95 (м, 2H), 2,92 (с, 2H), 2,14-2,08 (м, 2H), 1,49 (с, 9H).
Стадия 2: 2-(4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрил (HCl соль)
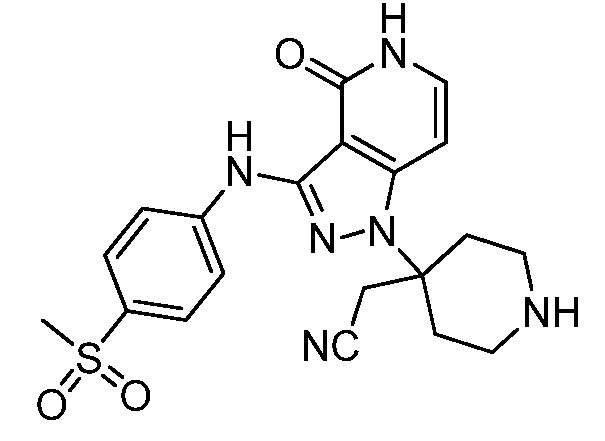
К суспензии трет-бутил-4-(4-(бензилокси)-3-((4-(метилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил) пиперидин-1-карбоксилата (160 мг, 0,260 ммоль) в EtOAc (2 мл) добавляли HCl (2 мл, 4M в EtOAc, 8 ммоль). Полученную суспензию перемешивали в течение 4 часов при комнатной температуре. Смесь затем фильтровали и твердое вещество промывали при помощи EtOAc и сушили с получением указанного в заголовке соединения в виде HCl соли. LRMS (ESI) рассчитано для C20H23N6O3S [M+H]+: 427, найдено 427. 1H ЯМР (400 МГц, DMSO-d6): δ 11,46 (д, J=5,6 Гц, 1H), 8,90 (шир. с, 2H), 8,77 (с, 1H), 7,87 (д, J=8,8 Гц, 4H), 7,80 (д, J=9,2 Гц, 2H), 7,30-7,26 (м, 1H), 6,79 (д, J=7,6 Гц, 2H), 3,34-3,29 (м, 2H), 3,27 (с, 2H), 3,12 (с, 3H), 3,04-2,98 (м, 2H), 2,91-2,88 (м, 2H), 2,30-2,25 (м, 2H).
Стадия 3: 6-(4-(цианометил)-4-(3-((4-((дифторметил)сульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрил
К раствору 2-(4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрила (0,10 г, 0,24 ммоль) в DMF (1,0 мл) добавляли 2-хлор-4-(трифторметил)пиридин (56 мг, 0,31 ммоль) и DIPEA (61 мг, 0,48 ммоль). Реакционную смесь герметично закрывали и нагревали до 120°C в течение 16 часов, затем охлаждали и фильтровали и фильтрат очищали обращенно-фазовой ВЭЖХ. LRMS (ESI) рассчитано для C26H25N7O3SF3 [M+H]+: 572, найдено 572. 1H ЯМР (400 МГц, DMSO-d6): δ 11,41 (шир. с, 1H), 8,75 (с,H), 8,34 (д, J=4,8 Гц, 1H), 7,89 (д, J=8,8 Гц, 2H), 7,81 (д, J=8,8 Гц, 2H), 7,28-7,23 (м, 1H), 7,15 (с, 1H), 6,86 (д, J=4,8 Гц), 6,75 (д, J=7,6 Гц, 1H), 4,18-4,09 (м, 2H), 3,44-3,28 (м, 4H), 3,16 (с, 3H), 2,81-2,72 (м, 2H), 2,18-2,04 (м, 2H).
Следуя процедурам, аналогичным тем, которые описаны для Примера 15-1 выше, были получены следующие соединения, представленные в Таблице 28. В некоторых случаях удаление защитной Boc группы (Стадия 2) можно осуществить на свободном пиридоновом соединении типа, описанного в Примере 5, представленного в Таблице 20, с использованием TFA в DCM при комнатной температуре до осуществления SNAr реакции. В некоторых случаях SNAr реакцию можно осуществить с использованием альтернативных подходящих оснований, такие как, например, TEA, типично при температурах >80°C.


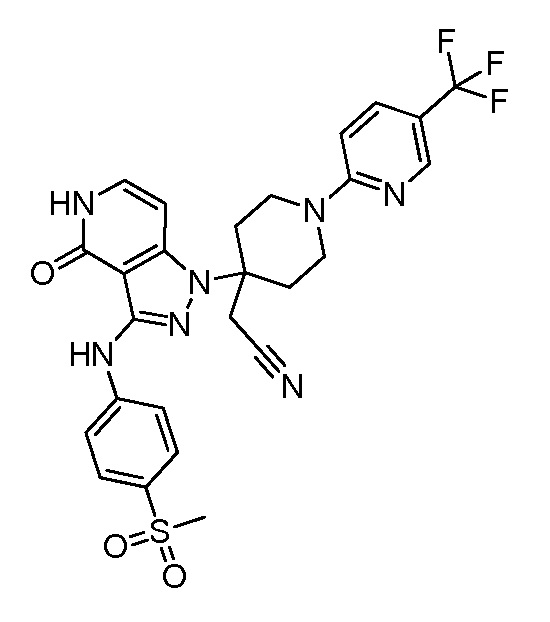
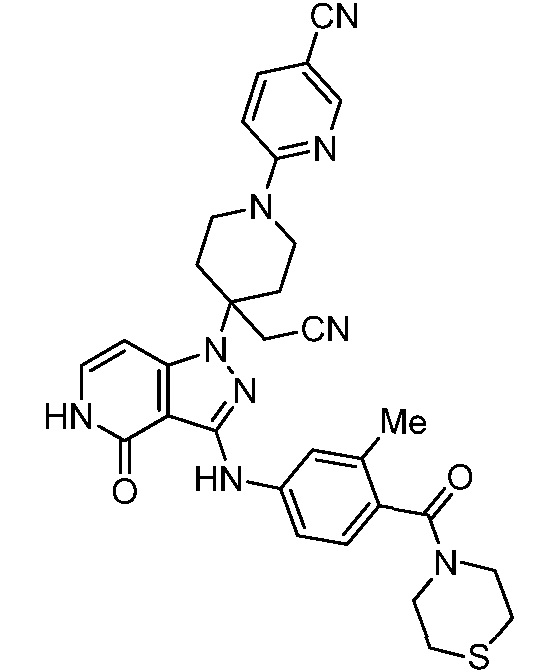

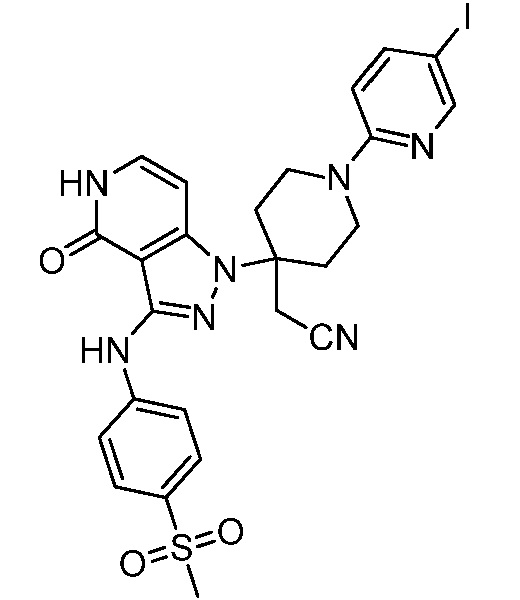

Пример 16-1
2-(4-(3-(3-метил-4-(тиоморфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил

Стадия 1: 2-(4-(3-амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрил гидрохлорид
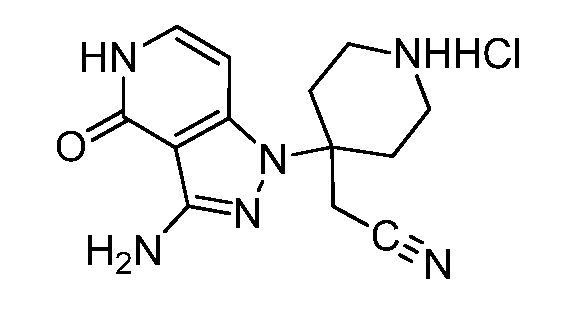
К трет-бутил-4-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилату (0,50 г, 1,1 ммоль) добавляли раствор хлористого водорода (80 мл, 160 ммоль, 2M в EtOAc). Смесь перемешивали в течение 6 часов при температуре окружающей среды, затем концентрировали в вакууме с получением неочищенного указанного в заголовке соединения, которое использовали непосредственно на следующей стадии. LRMS (ESI) рассчитано для C13H17N6O [M+H]+: 273, найдено 273.
Стадия 2: 2-(4-(3-амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил

К раствору гидрохлорида 2-(4-(3-амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрила (0,37 г, 1,2 ммоль) в DMF (4 мл) добавляли 2-фтор-4-(трифторметил)пиридин (0,24 г, 1,4 ммоль) и триэтиламин (0,24 г, 2,4 ммоль). Смесь перемешивали в течение 4 часов при 110°C, затем охлаждали и разбавляли водой и экстрагировали при помощи EtOAc (× 2). Объединенные органические слои промывали водой (× 2), насыщенным солевым раствором (× 2), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 25% EtOAc в петролейном эфире, с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) рассчитано для C19H19F3N7O [M+H]+: 418, найдено 418. 1H ЯМР (400 МГц, DMSO-d6): δ 10,95 (с, 1H), 8,33 (с, 1H), 7,19-7,13 (м, 1H), 7,09-7,01 (м, 1H), 6,88 (м, 1H), 6,56 (д, J=7,2 Гц, 1H), 5,46 (шир. с, 2H), 4,11 (м, 2H), 3,27-3,18 (м, 4H), 2,68 (м, 2H), 2,09-2,01 (м, 2H).
Стадия 3: 2-(4-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрил
К перемешиваемому раствору 2-(4-(3-амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрила (30 мг, 0,070 ммоль) в 2-пропаноле (10 мл) при температуре окружающей среды в атмосфере азота добавляли ацетат калия (14 мг, 0,14 ммоль), продукт присоединения трис(дибензилиденацетонил)бис-палладий(0)-хлороформ (10 мг, 0,010 ммоль), ди-трет-бутил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфин (8 мг, 0,02 ммоль) и (4-бром-2-метилфенил)(тиоморфолинo)метанон (24 мг, 0,080 ммоль). Реакционную смесь перемешивали при 80°C в течение 4 часов, затем охлаждали и гасили водой и экстрагировали при помощи EtOAc (× 2). Объединенные органические слои промывали насыщенным солевым раствором (× 2), сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали в вакууме. Продукт очищали обращенно-фазовой ВЭЖХ с использованием воды (с 0,05% NH4HCO3 модификатора) и ацетонитрила. Желаемые фракции объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС (ESI) рассчитано для C31H32F3N8O2S [M+H]+: 637, найдено 637. 1H ЯМР (400 МГц, DMSO-d6): δ 11,34 (шир. с, 1H), 8,35 (м, 1H), 8,27 (с, 1H), 7,58-7,50 (м, 2H), 7,24-7,13 (м, 3H), 6,88 (д, J=6,8 Гц, 1H), 6,72 (д, J=10,0 Гц, 1H), 4,17-4,29 (м, 2H), 3,88 (м, 2H), 3,46-3,37 (м, 2H), 3,30 (м, 4H), 2,79-2,67 (м, 6H), 2,27 (с, 3H), 2,21-2,01 (м, 2H).
Следуя процедурам, аналогичным тем, которые описаны для Примера 16-1 выше, были получены следующие соединения, представленные в Таблице 29.



Пример 17
2-(1-(2,2-дифторпропаноил)-4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрил
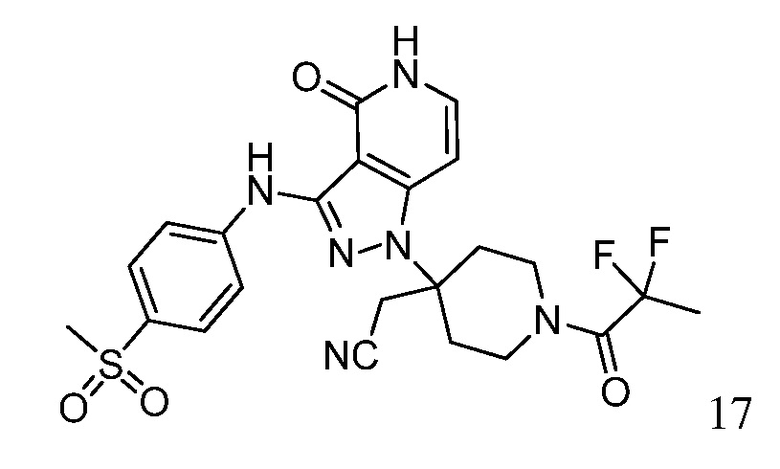
К суспензии 2-(4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрила (Пример 15-1, Стадия 2) (0,10 г, 0,22 ммоль) в DMF (2,0 мл) добавляли HATU (20 мг) и 2,2-дифторпропановую кислоту (24 мг, 0,023 ммоль). Полученную суспензию перемешивали в течение 4 часов при комнатной температуре, затем распределяли между водой и DCM и органическую фазу промывали насыщенным солевым раствором и концентрировали в вакууме. Остаток очищали обращенно-фазовой ВЭЖХ, элюируя смесью вода/ацетонитрил с 0,225% муравьиной кислоты в качестве модификатора, с получением соединения 17. LRMS (ESI) рассчитано для C23H24F2N6O4S [M+H]+: 519, найдено 519. 1H ЯМР (400 МГц, DMSO-d6): δ 11,40 (д, J=4,4 Гц, 1H), 8,75 (с, 1H), 7,88 (д, J=8,8 Гц, 1H), 7,81 (д, J=8,8 Гц, 2H), 7,26-7,22 (м, 1H), 6,75 (д, J=7,6 Гц, 1H), 4,13-4,02 (м, 2H), 3,45-3,40 (м, 2H), 3,31 (с, 2H), 3,15 (с, 3H), 2,88-2,77 (м, 2H), 2,16-2,12 (м, 2H), 1,86 (т, J=20 Гц, 3H).
Примеры 18-1 и 18-2
(цис и транс) 2-(4-(3-фторазетидин-1-ил)-1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил


Пример 18-1
Пример 18-2
Стадия 1: 2-(4-оксо-1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил

К суспензии 2-(8-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1,4-диоксаспиро[4,5]декан-8-ил)ацетонитрила (Пример 5-83) (0,30 г, 0,63 ммоль) в ТГФ (3,2 мл) добавляли водный раствор 2,0 M HCl (0,64 мл, 1,3 ммоль). Реакционную смесь перемешивали при 75°C в течение 2 часов, затем реакционную смесь нейтрализовали водным раствором 2M карбоната натрия. Реакционную смесь затем очищали хроматографией на диоксиде кремния, элюируя смесью 0-6% MeOH в DCM, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C21H19F3N5O2 [M+H]+: 430, найдено 430. 1H ЯМР (600 МГц, DMSO-d6): δ 11,34 (д, J=5,6 Гц, 1H), 8,59 (с, 1H), 7,81 (д, J=8,6 Гц, 2H), 7,57 (д, J=8,6 Гц, 2H), 7,20 (дд, J=7,4, 5,9 Гц, 1H), 6,73 (д, J=7,5 Гц, 1H), 3,30 (с, 2H), 3,00-2,94 (м, 2H), 2,40-2,28 (м, 6H).
Стадия 2: (цис и транс) 2-(4-(3-фторазетидин-1-ил)-1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил
К суспензии 2-(4-оксо-1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила (0,12 г, 0,27 ммоль) в смеси ТГФ (1,1 мл) и MeOH (1,1 мл) добавляли 3-фторазетидин гидрохлорид (0,75 г, 0,67 ммоль) и уксусную кислоту (0,12 мл, 2,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 минут, затем добавляли цианоборогидрид натрия (0,42 г, 0,67 ммоль) и реакционную смесь оставляли для перемешивания еще в течение 30 минут при комнатной температуре. Реакционную смесь концентрировали в вакууме с получением остатка, который очищали хроматографией на диоксиде кремния, элюируя смесью 0,5-5% MeOH в DCM, с получением чистого транс соединения 18-1 (диастереомер 1). LRMS (ESI) рассчитано для C24H25F4N6O [M+H]+: 489, найдено 489. 1H ЯМР (600 МГц, DMSO-d6): δ 11,27 (д, J=5,6 Гц, 1H), 8,55 (с, 1H), 7,80 (д, J=8,5 Гц, 2H), 7,56 (д, J=8,7 Гц, 2H), 7,16-7,13 (м, 1H), 6,64 (д, J=7,6 Гц, 1H), 5,20-5,04 (м, 1H), 3,57-3,48 (м, 2H), 3,16 (с, 2H), 3,05-3,01 (м, 1H), 3,01-2,96 (м, 1H), 2,40-2,33 (м, 2H), 2,25-2,21 (м, 1H), 2,13 (т, J=10,0 Гц, 2H), 1,53-1,38 (м, 4H). Цис соединение 18-2, (диастереомер 2) подвергали последующей очистке методом обращенно-фазовой хроматографии с использованием AcCN в воде с 0,1% TFA модификатора. Желаемые фракции разбавляли при помощи EtOAc и нейтрализовали насыщенным водным раствором NaHCO3 и органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. LRMS (ESI) рассчитано для C24H25F4N6O [M+H]+: 489, найдено 489. 1H ЯМР (600 МГц, DMSO-d6): δ 11,27 (д, J=5,7 Гц, 1H), 8,56 (с, 1H), 7,80 (д, J=8,6 Гц, 2H), 7,56 (д, J=8,7 Гц, 2H), 7,16 (дд, J=7,4, 5,9 Гц, 1H), 6,63 (д, J=7,5 Гц, 1H), 5,10-4,94 (м, 1H), 3,48-3,39 (м, 2H), 3,13 (с, 2H), 3,01-2,91 (м, 2H), 2,73 (д, J=13,7 Гц, 2H), 2,19-2,12 (м, 1H), 1,84-1,72 (м, 2H), 1,68 (дд, J=9,9, 3,9 Гц, 2H), 1,08-0,97 (м, 2H).
Следующие примеры, представленные в Таблице 30, были получены аналогично получению соединений Примеров 18-1 и 18-2, которые описаны выше, и относительную стереохимию приписывали либо на основании данных ЯМР, либо по аналогии на основании биохимической активности. В следующих примерах, цис и транс стереохимия относится к относительной ориентации пирролoпиримидиноновых и аминовых заместителей. В некоторых случаях, Стадию 1 последовательности можно осуществить с использованием путем замещения t-BuXphos лиганда, i-PrOH и KOAc, используя при этом микроволновое облучение.

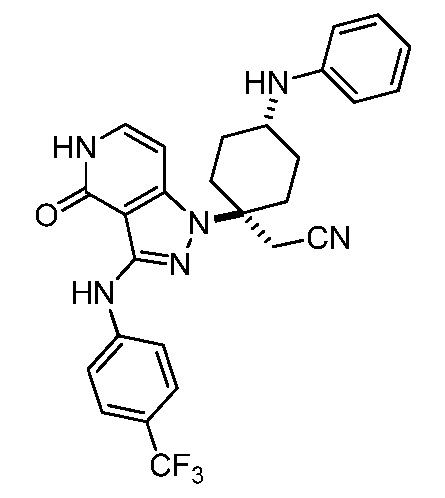

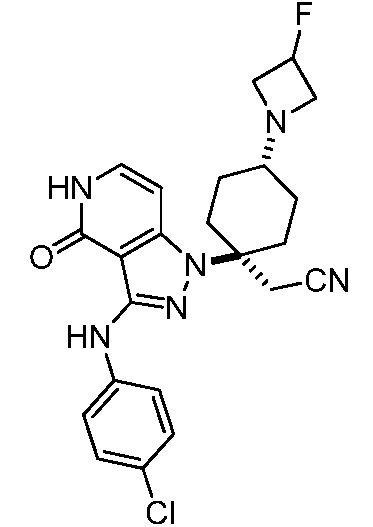
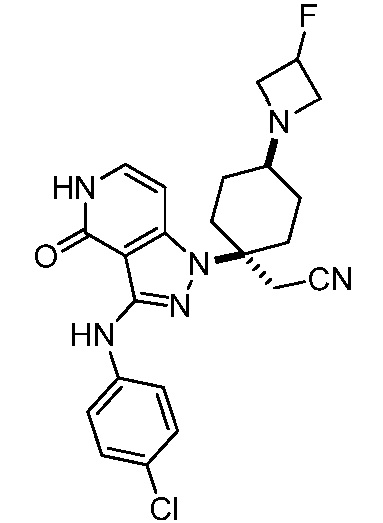





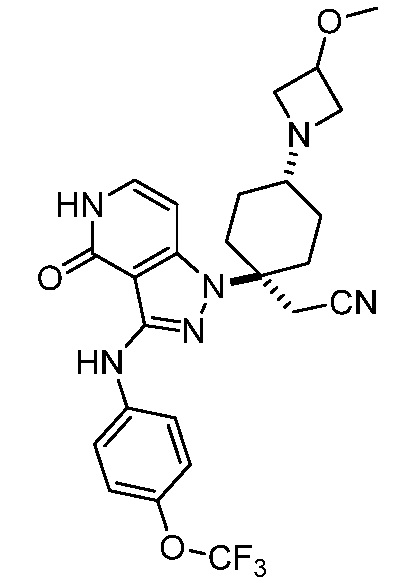



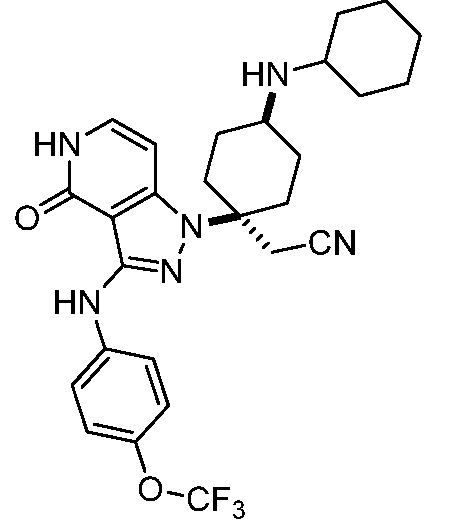
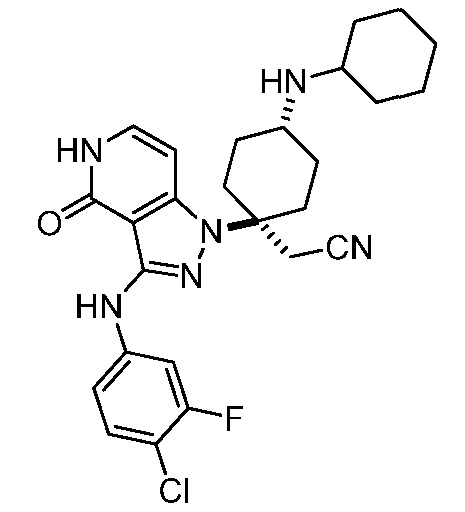



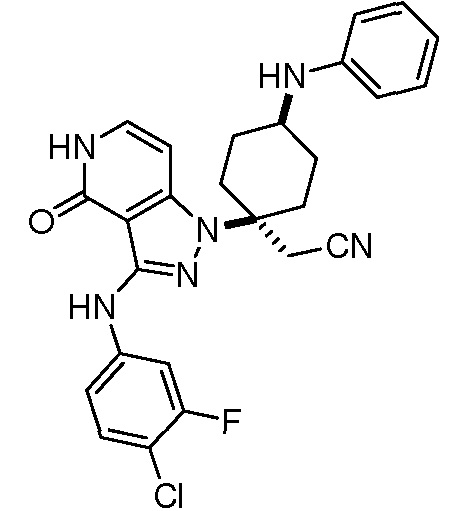

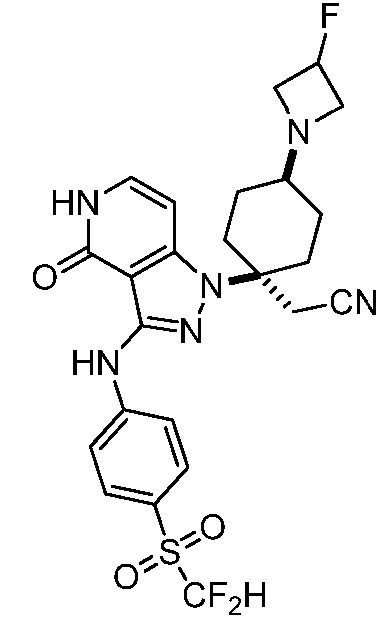

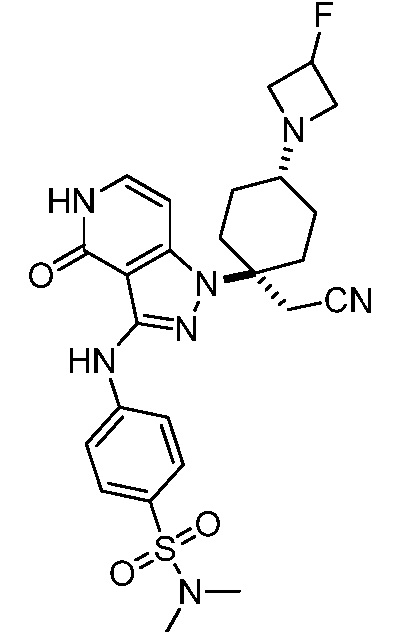


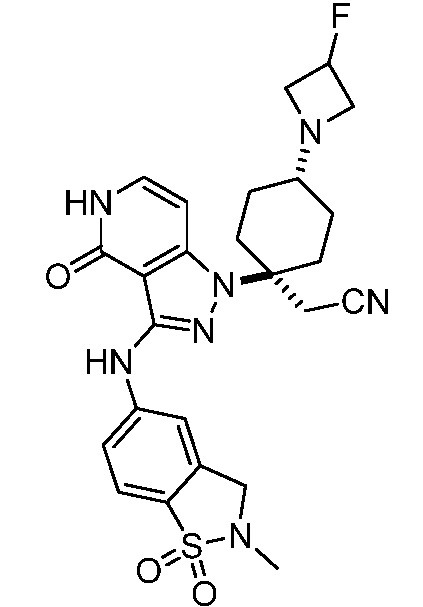







Пример 19-1
(2S,5S)-N-(трет-бутил)-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксамид

Стадия 1: (2S,5S)-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоновая кислота
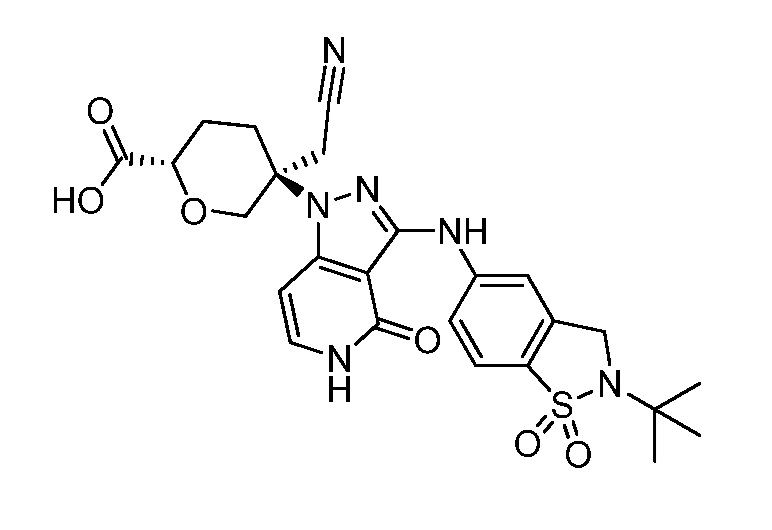
К раствору (2S,5S)-трет-бутил-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата (Пример 5-41) (390 мг, 0,654 ммоль) в DCM (6,5 мл) добавляли TFA (0,50 мл, 6,5 ммоль) по порциям при 25°C. Реакционный раствор перемешивали в течение ночи, разбавляли в DCM и гасили путем добавления насыщенного раствора хлорида аммония. Реакционную смесь экстрагировали при помощи iPA/CHCl3 (× 3). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, с получением указанного в заголовке соединения в виде твердого вещества.
Стадия 2: (2S,5S)-N-(трет-бутил)-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксамид (19-1)
К (2S,5S)-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоновой кислоте (30 мг, 0,046 ммоль) в DMF (0,4 мл) добавляли трет-бутиламин (24 мкл, 0,23 ммоль), DIPEA (40 мкл, 0,229 ммоль) и HATU (52,4 мг, 0,138 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, затем концентрировали и очищали масс-индуцируемой обращенно-фазовой ВЭЖХ с использованием ацетонитрила в воде с 0,1% TFA модификатора, с получением соединения 19-1. LRMS (ESI) рассчитано для C29H38N7O5S [M+H]+: 596, найдено 596. 1H ЯМР (600 МГц, DMSO-d6): δ 11,32 (д, J=5,8 Гц, 1H), 8,66 (с, 1H), 7,64-7,62 (д, J=7,1 Гц, 1H), 7,56-7,54 (д, J=8,2 Гц, 1H), 7,19 (т, J=5,8 Гц, 1H), 6,90 (с, 1H), 6,73-6,72 (д, J=7,6 Гц, 1H), 4,46 (с, 1H), 4,42-4,40 (д, J=11,7 Гц, 1H), 3,88 (д, J=11,2 Гц, 2H), 3,85-3,84 (д, J=11,2 Гц, 1H), 3,48 (д, J=11,7 Гц, 2H), 2,63-2,62 (д, J=12,9 Гц, 2H), 2,97-2,94 (д, J=15,8 Гц, 2H), 1,69 (м, 2H), 1,42 (с, 9H), 1,27 (с, 9H).
Следующие примеры, представленные в Таблице 31, были получены аналогичным способом с использованием общей процедуры, описанной выше.


Пример 20-1
(S)-2-(3-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил

Стадия 1: (S)-4-((4-(бензилокси)-1-(3-(цианометил)тетрагидро-2H-пиран-3-ил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2-метилбензойной кислот

В высушенную в печи колбу высокого давления, снабженную магнитной мешалкой, в атмосфере азота загружали (S)-2-(3-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил (I-17B) (1,5 г, 4,1 ммоль), 4-бром-2-метилбензойную кислоту (1,6 г, 7,4 ммоль), ацетат калия (1,10 г, 11,4 ммоль) и пред-катализатор t-BuXPhos 3-его поколения (0,36 г, 0,50 ммоль). Колбу дегазировали путем последовательного вакуумирования/заполнения азотом (× 3) и добавляли трет-амиловый спирт (41,3 мл). Реакционную смесь нагревали до 90°C в течение 16 часов, затем концентрировали в вакууме и очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C28H28N5O4 [M+H]+: 498, найдено 498. 1H ЯМР (CDCl3, 500 МГц): δ 8,08 (д, J=8,64 Гц, 1H), 7,93 (д, J=6,5 Гц, 1H), 7,63 (с, 1H), 7,60-7,57 (м, 2H), 7,55-7,46 (м, 3H), 7,36 (д, J=8,8 Гц, 1H), 7,19-7,14 (м, 2H), 5,67 (с, 2H), 4,37 (д, J=12,0 Гц, 1H), 4,19 (д, J=12,2 Гц, 1H), 3,88 (м, 1H), 3,77 (м, 1H), 3,24 (д, J=17,1 Гц, 1H), 3,10 (д, J=17,1 Гц, 1H), 2,78 (м, 1H), 2,66 (с, 3H), 2,53 (м, 1H), 1,88-1,74 (м, 2H).
Стадия 2: (S)-4-((1-(3-(цианометил)тетрагидро-2H-пиран-3-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2-метилбензойная кислота
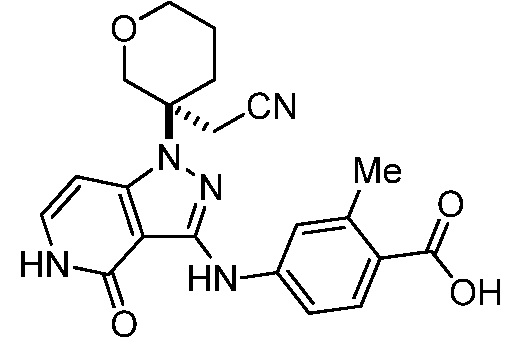
К раствору (S)-4-((4-(бензилокси)-1-(3-(цианометил)тетрагидро-2H-пиран-3-ил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2-метилбензойной кислоты (440 мг, 0,9 ммоль) в EtOAc (9 мл) добавляли Pd/C (188 мг, 0,2 ммоль, 10% масс.). Реакционную смесь перемешивали в атмосфере H2 в течение 4 часов, разбавляли при помощи EtOAc и фильтровали через слой Целита. Концентрирование в вакууме давало остаток, который очищали хроматографией на диоксиде кремния, элюируя с градиентом гексан/EtOAc, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C21H22N5O4 [M+H]+: 408, найдено 408.
Стадия 3: (S)-2-(3-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил (20-1)
В реакционный сосуд с магнитной мешалкой загружали (S)-4-((1-(3-(цианометил)тетрагидро-2H-пиран-3-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2-метилбензойную кислоту (15 мг, 0,040 ммоль), HATU (28 мг, 0,070 ммоль), основание Хунига (26 мкл, 0,15 ммоль), DMF (0,13 мл) и 4,4-дифторпиперидин (9 мг, 0,07 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов и затем очищали обращенно-фазовой хроматографией с использованием ацетонитрила в воде с 0,1% TFA модификатора, с получением соединения 20-1. LRMS (ESI) рассчитано для C26H29F2N6O3 [M+H]+: 511, найдено 511. 1H ЯМР (DMSO, 500 МГц): δ 11,29 (с, 1H), 8,28 (с, 1H), 7,54 (д, J=11,4 Гц, 2H), 7,19-7,15 (м, 2H), 6,68 (д, J=7,5 Гц, 1H), 4,32 (д, J=12,1 Гц, 1H), 3,96-3,92 (м, 4H), 3,69-3,65 (м, 2H), 3,37-3,20 (м, 4H), 2,64 (м, 1H), 2,21 (с, 3H), 2,05-2,01 (м, 4H), 1,70 (м, 1H), 1,60 (м, 1H).
Таблица 32 раскрывает Примеры, которые были получены аналогично получению соединения 20-1, с использованием подходящего исходного вещества. В некоторых случаях на последней стадии можно использовать другой амидный связывающий реагент, такой как HOBt и EDC.


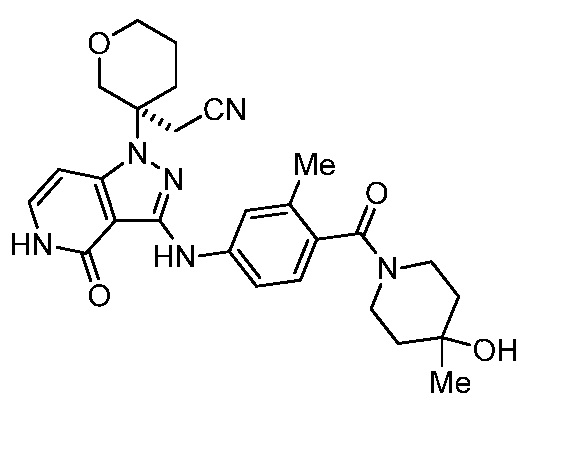
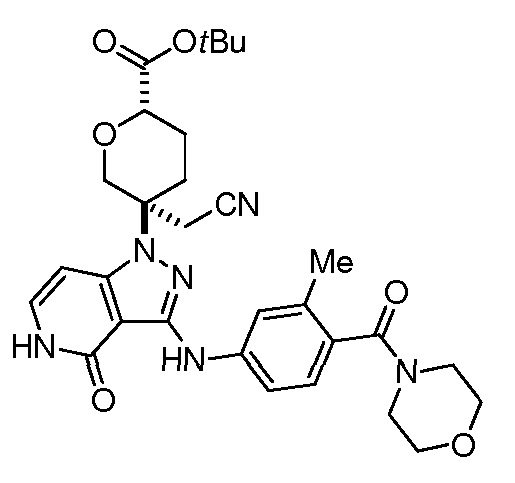



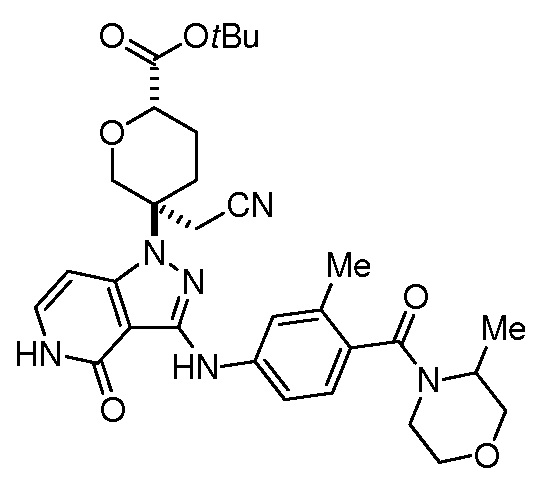




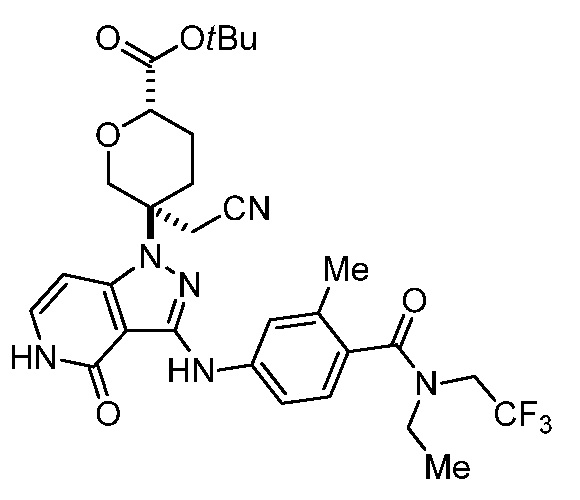
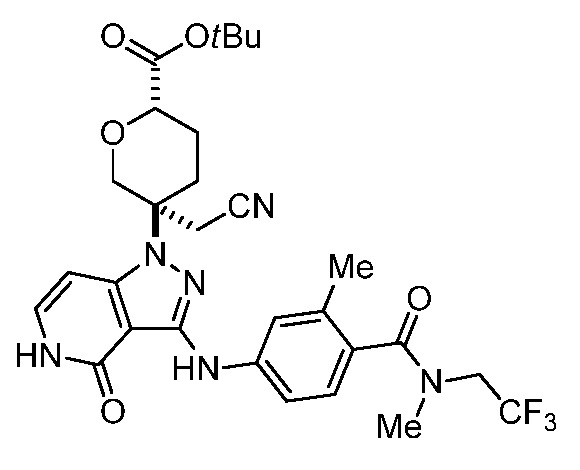

Пример 21-1
(2S,5S)-трет-бутил-5-(цианометил)-5-(3-((2-метилбензо[d]тиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат

Стадия 1: (2S,5S)-трет-бутил-5-(3-амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат

К раствору (2S,5S)-трет-бутил-5-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата (4,64 г, 10,0 ммоль) в смеси EtOAc (66,7 мл) и MeOH (33,3 мл) при комнатной температуре добавляли палладий на углероде (1,06 г, 10% масс.). Колбу герметично закрывали и вакуумировали и снова заполняли водородом (× 3). Реакционную смесь затем перемешивали при комнатной температуре в течение 18 часов под давлением 1 атм водорода. Реакционную смесь затем разбавляли при помощи MeOH, фильтровали через Целит и фильтровальную лепешку промывали дополнительным количеством MeOH. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества. LRMS (ESI) Рассчитано для C26H29N6O4S [M+H]+: 521, найдено 521.
Стадия 2: (2S,5S)-трет-бутил-5-(цианометил)-5-(3-((2-метилбензо[d]тиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилат (21-1)
(2S,5S)-трет-бутил-5-(3-амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилат (93 мг, 0,25 ммоль), 6-бром-2-метилбензо[d]тиазол (62,7 мг, 0,275 ммоль), Pd2(dba)3 (27,5 мг, 0,030 ммоль), t-Bu-X-Phos (26 мг, 0,060 ммоль) и ацетат калия (49,1 мг, 0,500 ммоль) добавляли в 5-мл Biotage микроволновой сосуд, с последующим добавлением 2-пропанола (2,50 мл). Сосуд герметично закрывали и дегазировали путем вакуумирования/заполнения аргоном снова (× 3) и нагревали до 85°C в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток поглощали в DMSO (2,50 мл), фильтровали и полученный раствор очищали непосредственно масс-направленной обращенно-фазовой ВЭЖХ (5-50% ацетонитрила в воде с 0,1% TFA модификатора). Фракции, содержащие чистый продукт, замораживали и лиофилизировали, с получением указанного в заголовке соединения в форме TFA соли и в виде твердого вещества. LRMS (ESI) Рассчитано для C18H24N5O4 [M+H]+: 374, найдено 374. 1H ЯМР (DMSO-d6, 500 МГц): δ 8,44 (д, J=2,3 Гц, 1H), 8,38 (с, 1H), 7,77 (д, J=8,5 Гц, 1H), 7,59 (дд, J=8,5, 2,5 Гц, 1H), 7,20 (дд, J=7,5, 6,0 Гц, 1H), 6,74 (д, J=7,5 Гц, 1H), 4,35 (д, J=11,7 Гц, 1H), 4,22 (дд, J=9,4, 4,2 Гц, 1H), 4,12 (д, J=12,2 Гц, 1H), 3,43 (AB, J=17,4 Гц, 1H), 3,38 (AB, J=17,4 Гц, 1H), 2,74 (с, 3H), 2,56 (м, 1H), 2,44 (м, 1H), 1,92 (м, 2H), 1,46 (с, 9H).
Следующие примеры, представленные в Таблице 32, были получены аналогичным способом с использованием общей процедуры, описанной выше для Примера 21-1. В отдельных случаях, общая процедура альтернативно может быть модифицирована с использованием K3PO4 основания, [(2-ди-трет-бутилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил)-2-(2′-амино-1,1′-бифенил)]палладий(II) метансульфоната (t-BuXPhos Pd G3) в качестве пред-катализатора вместо отдельного источника фосфина и палладия, и/или трет-амилового спирта. Кроме того, в некоторых случаях реакцию перекрестного связывания можно осуществить при температуре 70-90°C.

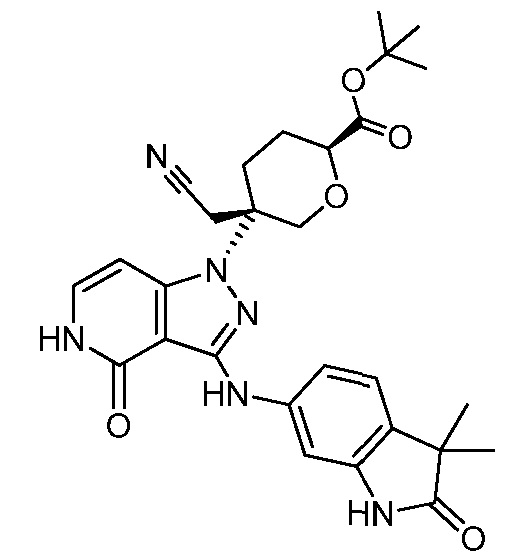


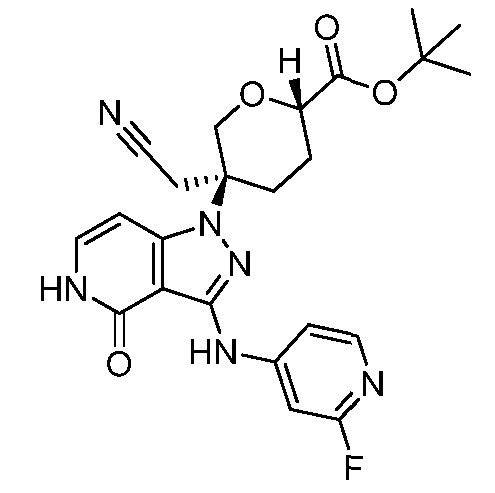

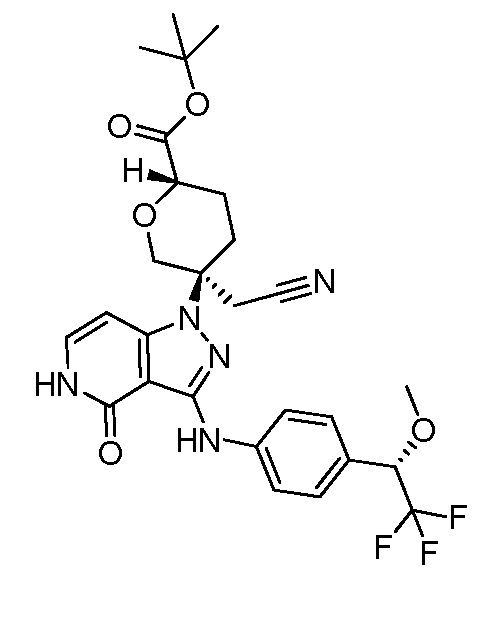

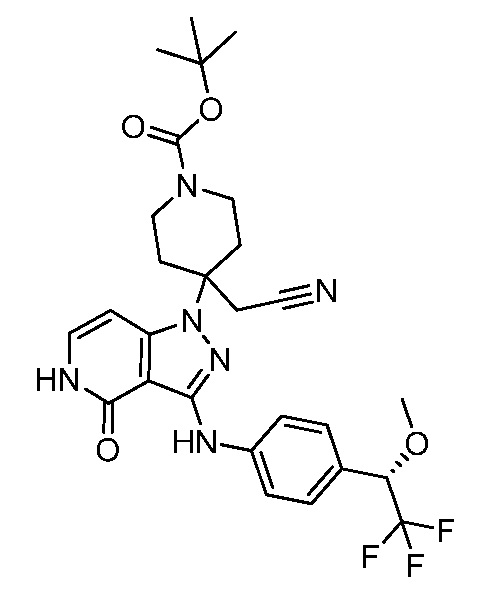






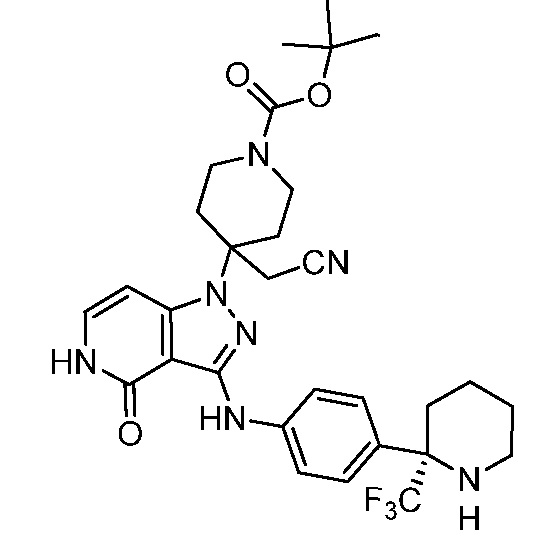

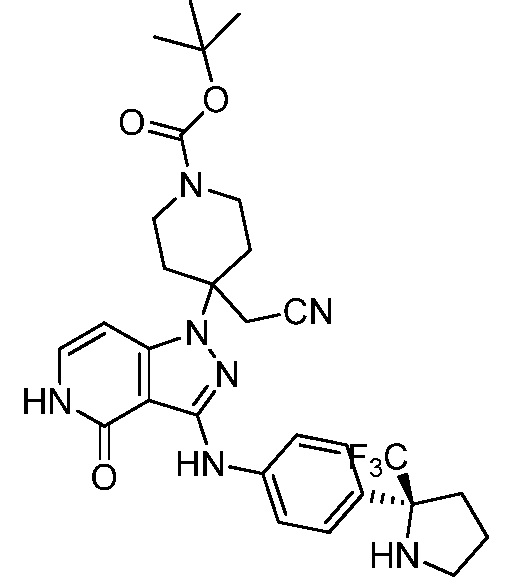

Пример 22
(2S,5S)-5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)-N-(метилсульфонил)тетрагидро-2H-пиран-2-карбоксамид

К раствору 1,1'-карбонилдиимидазола (76 мг, 0,467 ммоль) в ТГФ (0,80 мл) добавляли раствор (2S,5S)-5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоновой кислоты (Промежуточное соединение 20) (100 мг, 0,234 ммоль) в ТГФ (0,80 мл). Реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 30 минут, охлаждали и затем добавляли метансульфонамид (44,5 мг, 0,467 ммоль), с последующим добавлением раствора DBU (0,070 мл, 0,467 ммоль) в ТГФ (0,80 мл). Реакционную смесь перемешивали при комнатной температуре в течение двух часов и затем концентрировали в вакууме. Неочищенное вещество растворяли в DMSO (3,0 мл), фильтровали и подвергали масс-инициируемой ВЭЖХ очистке. Лиофилизация желаемых фракций давалв желаемое указанное в заголовке соединение в виде TFA соли. LRMS (ESI) рассчитано для C21H22ClN6O5S [M+H]+: 505, найдено: 505. 1H ЯМР (500 МГц, DMSO-d6): δ 11,76 (с, 1H), 11,37 (д, J=6,2 Гц, 1H), 8,34 (с, 1H), 7,74 (д, J=9,0 Гц, 2H), 7,34 (д, J=9,0 Гц, 2H), 7,25 (дд, J=7,4, 6,0 Гц, 1H), 6,77 (д, J=7,4 Гц, 1H), 4,42 (д, J=12,5 Гц, 1H), 4,25 (дд, J=13,8, 3,3 Гц, 1H), 4,12 (д, J=11,3 Гц, 1H), 3,60 (AB, J=11,3 Гц, 1H), 3,55 (AB, J=11,3 Гц, 1H), 3,34 (с, 3H), 2,65 (м, 1H), 2,43 (м, 2H), 2,00 (м, 1H), 1,89 (м, 1H).
Пример 23
(2S,5S)-5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)-N,N-диметилтетрагидро-2H-пиран-2-карбоксамид
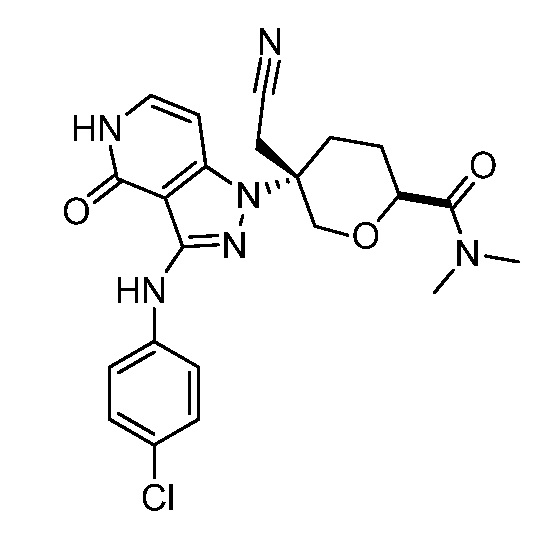
(2S,5S)-5-(3-((4-Хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоновую кислоту (Промежуточное соединение 20) (30 мг, 0,070 ммоль) и HATU (53,3 мг, 0,140 ммоль) растворяли в DMF (0,5 мл) и перемешивали при комнатной температуре в течение 5 минут. Затем добавляли диметиламин (0,070 мл, 0,140 ммоль, 2M в ТГФ) и DIPEA (0,037 мл, 0,21 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Раствор разбавляли при помощи DMSO (0,5 мл) и подвергали масс-инициируемой обращенно-фазовой очистке. Желаемые фракции концентрировали в вакууме, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C22H24ClN6O3 [M+H]+: 455, найдено: 455. 1H ЯМР (500 МГц, DMSO-d6): δ 11,36 (д, J=6,0 Гц, 1H), 8,34 (с, 1H), 7,73 (д, J=8,8 Гц, 2H), 7,35 (д, J=8,8 Гц, 2H), 7,25 (дд, J=5,9, 7,6 Гц, 1H), 6,80 (д, J=7,6 Гц, 1H), 4,51 (дд, J=10,4, 3,6 Гц, 1H), 4,35 (д, J=11,6 Гц, 1H), 4,17 (д, J=11,6 Гц, 1H), 3,41 (с, 2H), 3,08 (с, 3H), 2,89 (с, 3H), 2,66 (м, 1H), 2,49 (м, 1H), 1,97 (м, 1H), 1,82 (м, 1H).
Пример 24
2-((3S,6S)-3-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-6-(2-гидроксипропан-2-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил

Стадия 1: (2S,5S)-5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)-N-метокси-N-метилтетрагидро-2H-пиран-2-карбоксамид

(2S,5S)-5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоновую кислоту (Промежуточное соединение 20) (840 мг, 1,96 ммоль) и HATU (1,49 г, 3,93 ммоль) растворяли в DMF (4,0 мл) и перемешивали при комнатной температуре в течение 5 минут, затем добавляли раствор N,O-диметилгидроксиламин гидрохлорида (383 мг, 3,93 ммоль) и DIPEA (1,03 мл, 5,89 ммоль) в DMF (2,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем разбавляли этилацетатом и промывали водой, насыщенным солевым раствором и сушили над MgSO4. Растворитель фильтровали и концентрировали в вакууме и затем очищали хроматографией на диоксиде кремния, элюируя с градиентом 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C22H24ClN6O4 [M+H]+: 471, найдено: 471.
Стадия 2: 2-((3S,6S)-6-ацетил-3-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил

(2S,5S)-5-(3-((4-Хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)-N-метокси-N-метилтетрагидро-2H-пиран-2-карбоксамид (100 мг, 0,212 ммоль) растворяли в ТГФ (2,0 мл) и колбу затем герметично закрывали, продували аргоном и охлаждали до -78°C. Затем добавляли метилмагнийбромид (0,283 мл, 0,849 ммоль, 3M в диэтиловом эфире). Реакционную смесь перемешивали в течение 2 часов, доводя до 0°C, и затем перемешивали еще в течение часа, затем гасили водой. Реакционную смесь затем экстрагировали этилацетатом (× 3) и объединенный органический слой сушили с использованием MgSO4, фильтровали, концентрировали в вакууме. Неочищенное вещество очищали хроматографией на диоксиде кремния, элюируя с градиентом 0-10% метанола в дихлорметане, с получением указанного в заголовке соединения. LRMS (ESI) рассчитано для C21H21ClN5O3 [M+H]+: 426, найдено: 426.
Стадия 3: 2-((3S,6S)-3-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-6-(2-гидроксипропан-2-ил)тетрагидро-2H-пиран-3-ил)ацетонитрил (Пример 24)
Раствор 2-((3S,6S)-6-ацетил-3-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила (26 мг, 0,061 ммоль) в ТГФ (2,0 мл) герметично закрывали, продували аргоном и охлаждали до -78°C. Затем добавляли метилмагнийбромид (0,081 мл, 0,244 ммоль, 3M в диэтиловом эфире) и реакционную смесь перемешивали в течение 2 часов, затем гасили насыщенным водным раствором NH4Cl. Реакционную смесь затем экстрагировали с использованием этилацетата (× 3) и объединенные органические слои промывали насыщенным солевым раствором, сушили при помощи MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали с использованием масс-инициируемой обращенно-фазовой ВЭЖХ. Фракции объединяли и концентрировали в вакууме с получением соединения Примера 24. LRMS (ESI) рассчитано для C22H25ClN5O3 [M+H]+: 442, найдено: 442 1H ЯМР (500 МГц, Ацетон-d6): δ 10,27 (д, J=4,2 Гц, 1H), 8,29 (с, 1H), 7,78 (д, J=8,9 Гц, 2H), 7,36 (д, J=8,9 Гц, 2H), 7,32 (д, J=7,1 Гц, 1H), 6,81 (д, J=7,1 Гц, 1H), 4,61 (д, J=11,0, 2,8 Гц, 1H), 3,99 (д, J=11,0 Гц, 1H), 3,49 (с, 2H), 3,41 (д, J=11,1 Гц, 1H), 2,93 (м, 1H), 2,51 (м, 1H), 2,03 (м, 1H), 1,86 (м, 1H), 1,26 (3H), 1,24 (с, 3H).
БИОЛОГИЧЕСКИЕ АНАЛИЗЫ
Протокол биохимического HTRF анализа Jak
Способность соединений ингибировать активность JAK1, JAK2, JAK3 и Tyk2 измеряли с использованием рекомбинантного очищенного GST-меченного каталитического домена для каждого фермента (Invitrogen JAK1 №M4290, JAK2 №M4290, JAK3 №M4290, Tyk2 №M4290) в HTRF формате биохимического анализа. В реакциях использовали обычный пептидный субстрат, LCB-EQEDEPEGDYFEWLW-NH2 (внутрифирменный). Основной протокол анализа следующий: Сначала 250 нл разбавленных соединений в DMSO распределяли в лунки сухого 384-луночного черного планшета (Greiner №781076) с использованием акустического дозирующего устройства Labcyte Echo 555. Для последующих добавлений реагентов использовали Agilent Bravo. Затем 18 мкл 1.11X фермента и 1.11X субстрата в 1X буфере для анализа (Invitrogen киназный буфер № PV3189, 2 мМ DТТ, 0,05% BSA) добавляли в лунки и встряхивали и затем осуществляли предварительную инкубацию в течение 30 минут при комнатной температуре для уравновешивания связывания с соединением. После уравновешивания добавляли 2 мкл 10X ATP в 1X буфере для анализа для инициации киназной реакции и планшеты встряхивали и затем инкубировали при комнатной температуре в течение 120 минут. По окончании инкубации добавляли 20 мкл 2X стоп буфера (стрептавидин-Dylight 650 (Thermo №84547B/100 мл), Eu-меченное pY20 антитело (Perkin Elmer №AD0067), EDTA, HEPES и Triton) для гашения реакции. Планшеты встряхивали и центрифугировали и затем инкубировали 60 минут при комнатной температуре и затем считывали на Perkin Elmer Envision (λex = 337 нм, λem = 665 и 615 нм, TRF время задержки = 20 мксек). HTRF сигнал = 10000 * 665 нм считывание / 615 нм считывание. После нормализации к необработанным контролям рассчитывали процент ингибирования HTRF сигнала при каждой концентрации соединения. График процента ингибирования против log концентрации соединения приводили с соответствие с 4-параметровым уравнением доза-ответ для расчета значений ИК50.
Конечные реакционные условия были следующими:
(нМ)
(мкМ)
(мкМ)
Испытываемые концентрации соединений составляли 1496, 499, 175, 49,9, 18,7, 6,2, 2,1, 0,75, 0,24, 0,075 и 0,0125 нМ, с 1,25% остаточного DMSO.
БИОЛОГИЧЕСКИЕ ДАННЫЕ
Примеры по настоящему изобретению оценивали в in vitro анализах связывания JAK1 и JAK2, описанных выше. Следующая Таблица представляет JAK1 ИК50 значения и JAK2 ИК50 значения, раскрытые для настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-(2-ЦИАНОГЕТЕРОЦИКЛИЛ)ПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2669922C2 |
| ЦИКЛОАЛКИЛНИТРИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2655380C2 |
| НОВОЕ ИМИДАЗОЛЬНОЕ ПРОИЗВОДНОЕ, ОБЛАДАЮЩЕЕ JNK ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ, И ЕГО ПРИМЕНЕНИЕ | 2017 |
|
RU2702749C1 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТИХ СОЕДИНЕНИЙ | 2007 |
|
RU2478635C2 |
| ПИРАЗОЛО[3,4-С]ПИРИДИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2638116C2 |
| АМИНОТРИАЗОЛОПИРИДИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2009 |
|
RU2552642C2 |
| N-СОДЕРЖАЩИЕ ГЕТЕРОАРИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ JAK3 КИНАЗЫ | 2010 |
|
RU2553681C2 |
| ПУРИНОВЫЕ ИНГИБИТОРЫ ЧЕЛОВЕЧЕСКОЙ ФОСФАТИДИЛИНОЗИТ 3-КИНАЗЫ ДЕЛЬТА | 2013 |
|
RU2658006C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ И ОЧИСТКИ ГЕТЕРОАРИЛЬНЫХ СОЕДИНЕНИЙ | 2010 |
|
RU2557242C2 |
В настоящем изобретении описывается соединение формулы I или его фармацевтически приемлемая соль или стереоизомер, где значения R1-R5 определены в формуле изобретения, которое является ингибитором JAK. Описывается также фармацевтическая композиция, способ лечения и применение для получения лекарственного средства для лечения заболевания или расстройства, которое можно облегчить путем ингибирования Janus киназ JAK1 и JAK2 у млекопитающего, где состояние выбрано из артрита, астмы и обструктивных заболеваний дыхательных путей, аутоиммунных заболеваний или расстройств и рака, путем введения млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли или стереоизомера. 7 н. и 8 з.п. ф-лы, 33 табл., 24 пр.
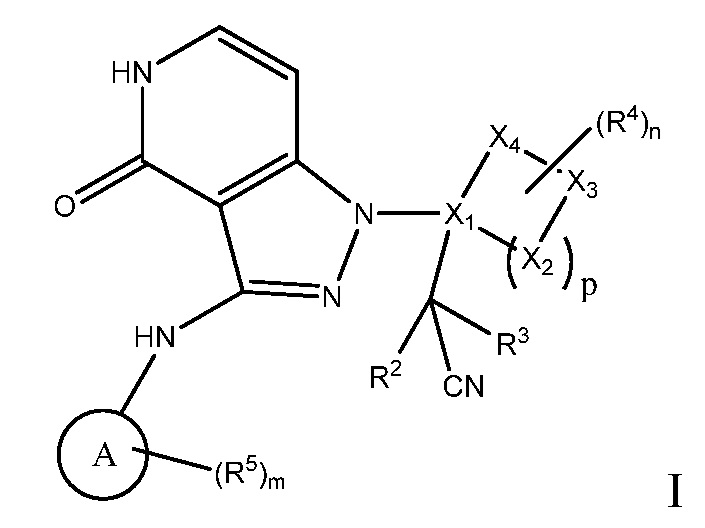
1. Соединение формулы I или его фармацевтически приемлемая соль или стереоизомер:
A выбран из фенила, C1-6алкила, (C3-6)циклоалкилC(0-6)алкила, гетероарила, выбранного из изоиндолинила, бензо[d]тиазолила,  ,
,  , 2,3-дигидро-1H-инденила, хинолинила, пиридинила и индолинила;
, 2,3-дигидро-1H-инденила, хинолинила, пиридинила и индолинила;
R2 и R3, каждый независимо, представляют собой водород;
X1 представляет собой C;
X2, X3 и X4, каждый независимо, выбраны из O, N и C, и при условии, что образованная кольцевая система содержит 0, 1 или 2 атома, выбранных из O и N;
n имеет значение 0, 1 или 2;
m имеет значение 0, 1, 2, 3 или 4;
p имеет значение 1, 2 или 3;
R4 выбран из:
галогена,
оксо (=O),
гетероарил C0-6 алкил(окси)0-1(карбонил)0C0-1 алкила,
C0-4 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C0-6 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкиларил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-6 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-8 циклоалкилC0-3 алкил(окси)0-1(карбонил)0-1C0-3 алкила,
C3-8 циклогетероалкилC0-3 алкилоксикарбонила,
C1-4 алкиламино(карбонил)0C0-4 алкила,
C1-4 алкиламиноC0-4 алкила(карбонил),
C3-6 циклоалкиламино,
C3-8 циклоалкилсульфонила,
фениламино,
-SO2N(C1-6алкил)2,
(C3-6)циклогетероалкилC0-4 алкилсульфамоила,
(C1-4 алкил)1-2амино,
C1-4 алкилсульфинила,
гидрокси,
где два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо;
где «гетероалкил» относится к алкильной группе, где по меньшей мере один атом углерода замещен гетероатомами, независимо выбранными из N, S и/или O;
где «циклогетероалкил» относится к циклоалкильной группе, где по меньшей мере один атом углерода замещен гетероатомами, независимо выбранными из N, S и/или O;
где «гетероарил» представляет собой 5- или 6-членное моноциклическое ароматическое кольцо или 9-членное бициклическое ароматическое кольцо, которое состоит из атомов углерода и одного или двух гетероатомов, выбранных из N и/или O;
где «арил» представляет собой фенил или бициклическую кольцевую систему, в которой одно кольцо представляет собой бензол, а другое является насыщенным 5-членным кольцом, с присоединением через любой атом углерода, что обеспечивает стабильное соединение; 2,3-дигидро-инденил;
R5 выбран из:
галогена,
оксо (=O),
C1-4 алкил(окси)0-1(карбонил)0C0-4 алкила,
C3-8 циклоалкил C0-4 алкил(окси)0(карбонил)0C0-4 алкила,
гетероарил C0-4 алкил(окси)0(карбонил)0C0-4 алкила,
(C3-8)гетероциклоалкил C0-4 алкил(окси)0-1(карбонил)0-1C0-4 алкила,
C0-4 алкил(окси)0-1(карбонил)0-1аминоC0-6 алкила,
C0-4 алкиламино(карбонил)0-1C0-6 алкила,
(C1-6 алкил)1-2 амино,
-SF5,
C1-6 алкилсульфонила,
(C3-6)циклогетероалкилC0-6алкилсульфонила,
(C3-6)циклоалкилC0-6алкилсульфонила,
C0-6 алкилсульфамоила,
-SO2NH2,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)2,
(C0-6 алкил)1-2 амино,
-CO2(C0-6 алкил),
-SO2CF3,
C1-6 алкилсульфинила,
-(C1-6 алкил)OH,
C1-6 алкоксиC0-6 алкила,
циано и
C1-6галогеналкила;
где «циклогетероалкил» относится к циклоалкильной группе, в которой 1 или 2 атома углерода замещены гетероатомом, независимо выбранным из N, S или O;
где «гетероалкил» относится к алкильной группе, где по меньшей мере один атом углерода замещен гетероатомами, независимо выбранными из N, S и/или O;
где «гетероарил» представляет собой 5- или 6-членное моноциклическое ароматическое кольцо или 8-членное бициклическое ароматическое кольцо, которое состоит из атомов углерода и одного, двух или трех гетероатомов, выбранных из N и/или O;
где «арил» представляет собой фенил или 2,3-дигидро-инденил;
и где R4 и R5, каждый, необязательно замещен 1, 2 или 3 заместителями R6, и R6 независимо выбран из:
галогена,
арил C0-6 алкил(окси)0-1(карбонил)0-1C0-6 алкила,
C3-8 циклоалкил C0 алкил(окси)0-1(карбонил)0C0 алкила,
гетероарил C0 алкил(карбонил)0-1оксиC0 алкила,
(C3-8)гетероциклоалкил C0 алкил(карбонил)0оксиC0-6 алкила,
-CO2(C0-10 алкил),
оксо (=O),
амино,
гидрокси,
циано и
C1-6галогеналкила; и
R6 необязательно замещен 1 или 2 заместителями R7, выбранными из водорода, гидрокси, (C1-6)алкила, C1-6 алкоксиC0-6алкила, галогена, -(C0-6)алкилCN, трифторметокси и оксо (O=);
где «арил» включает фенил или представляет собой бициклическую кольцевую систему, в которой одно кольцо представляет собой бензол, а другое является насыщенным 5-членным кольцом, с присоединением через любой атом углерода, что обеспечивает стабильное соединение;
где «гетероалкил» относится к алкильной группе, где атом углерода замещен гетероатомом, независимо выбранным из N, или O, или S;
где «гетероарил» представляет собой 5- или 6-членное моноциклическое ароматическое кольцо, которое состоит из атомов углерода и 1-3 гетероатомов, выбранных из N и/или O.
2. Соединение по п.1, где R4 выбран из трет-бутилкарбонила, метоксикарбонила, метилкарбонила, циклопропилметила, циклопропилметилкарбонила, циклопропилэтилкарбонила, циклопропилкарбонила, циклобутилкарбонила, циклопентилоксикарбонила, изопропилоксикарбонила, фенилметила, фенилпропила, фенилметилкарбонила, фенилэтилкарбонила, фенилоксикарбонила, фенилкарбонила, оксазолилметила, 1,3-оксазолилметила, индолилметила, 1-фенилэтила, пиридинилметила, циклогексилкарбонила, фтора, 2,2,2-трифторэтила, этила, 2-гидроксиэтила, неопентилкарбонила, неопентилоксикарбонила, этилкарбонила, этилоксикарбонила, метоксиметилкарбонил (метиламино)метилкарбонила, 2,3-дигидро-1H-инденилкарбонила, пирролидинилметилкарбонила, тетрагидро-2H-пиранилкарбонила, тетрагидро-2H-тиопиранилоксикарбонила, тетрагидро-2H-пиранилоксикарбонила, 1-(пиридинил)этилоксикарбонила, адамантилкарбонила, тетрагидрофуранилоксикарбонила, трифторэтилсульфонила, диметиламино, трет-бутилоксикарбонила, метила, трет-бутиламинокарбонила, аминокарбонила, азетидинила, циклогексиламино, оксо, гидрокси, метиламинокарбонила, циклопропилсульфонила, метокси, фениламино, пиридинила, гидроксиизопропила, гидроксиэт-2-ила, трифторметила, 2-(метилтио)эт-2-илкарбонила, метилсульфонила, этилкарбонила, метиламино, изопропилоксикарбонил и гидроксиизопропила; где R4 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6, и где два R4 вместе с кольцевым атомом, с которым каждый связан, необязательно могут образовывать насыщенное кольцо.
3. Соединение по п.2, где вариант осуществления R5 выбран из: метоксикарбонила, трет-бутилсульфонила, трет-бутилсульфамоила, трет-бутил(метил)сульфамоила, трет-бутил(этил)сульфамоила, пентафторсульфанила, метокси, диметиламино, оксо, амино, фтора, изобутила, изопропила, сульфамоила, диметилсульфамоила, метилсульфонила, этилсульфонила, трифторметилсульфонила, трет-бутилоксикарбонил(1-метил)этила, диэтилсульфамоила, этилсульфамоила, пирролидинилсульфонила, метила, трет-бутиламинометила, метиламинокарбонила, метиламинометила, этила, (1-гидрокси)этила, пиперидинилсульфонила, пиперидинила, тиоморфолинилкарбонила, тиазолидинилкарбонила, тиоморфолинилметила, пирролидинилкарбонила, пиперидинилкарбонила, этиламинокарбонила, морфолинилкарбонила, трет-бутила, циклопентилметила, циклогексила, циклогексилсульфонила, циклогексилсульфамоила, циклопентила, циклопентилсульфонила, бензила, гидроксиметила, 8-окса-3-азабицикло[3,2,1]октанила, 8-окса-3-азабицикло[3,2,1]октан-3-карбонила, 3-окса-8-азабицикло[3,2,1]октан-8-илкарбонила, этоксикарбонил(диметилэт-2-ил), гидрокси, трифторметила, азетидинилсульфонила, циклопропилсульфонила, циклопропила, хлора, этиламинометила, пирролидинилметила, 1-пирролидин-1-илэтила, циклопропилметила, пиразолилметила, морфолинилсульфонила, изопропиламинометила, пиразолила, пирролидинила, метилсульфонила, изопропилсульфонила, изопропилсульфамоила, метилсульфамоила, бензилсульфамоила, циклопропилметила, циклобутила, трет-бутилсульфонила, трет-бутилоксикарбонила, трет-бутилоксикарбонилметила, метоксиметила, 2-окса-5-азабицикло[2,2,1]гептан-5-карбонила, метоксиэт-2-ила, триазолилметила, 1,2,3-триазолилметила, аминометила, этиламинометила, аминокарбонила, морфолинила, изопропила, изопропил(метил)сульфамоила, сульфонила, циано, 2,2,2-трифторэтила, этиламинокарбонила, трет-бутиламинометила, изопропилоксикарбонил(диметилэт-2-ил), 1,1,1-трифтор-3,3-диметилбут-2-ила, (1,1,2-триметилпропил)сульфонила, (1,1-диметилпропил)сульфонила, изопропилсульфонимидоил метилсульфонила, этилкарбонила, 2,3-дигидро-1H-инденила, этилметилсульфамоила, неопентила, метиламинометил диметиламино, 2-(изопропиламино)пропан-2-ила, 2,2-диметилпропила, гидроксиметила, гидроксиэт-2-ила, трет-бутилоксикарбонил(2-метилпроп-2-ил), метокси, этиламинокарбонила, метиламинокарбонила и метоксиметила; и где R5 необязательно замещен 0, 1, 2, 3 или 4 заместителями R6.
4. Соединение по п.1 или его фармацевтически приемлемая соль или стереоизомер, выбранные из:
трет-бутил-3-(цианометил)-3-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-[3-(этиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-{3-[(циклопропилметил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-[3-(циклобутиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилата;
трет-бутил-3-(цианометил)-3-[3-(этиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]азетидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-[3-(метиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилата;
трет-бутил-3-(цианометил)-3-[3-(циклопропиламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]азетидин-1-карбоксилата;
трет-бутил-3-(цианометил)-3-(4-оксо-3-((2-(трифторметил)пиридин-4-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилата;
трет-бутил-3-(цианометил)-3-(3((4(метоксикарбонил)фенил) амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилата;
трет-бутил-3-(цианометил)-3-(3-((4-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c] пиридин-1-ил)азетидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-[4-оксо-3-({4-[2,2,2-трифтор-гидроксиэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-{4-оксо-3-[(4-сульфамоилфенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-{[1-оксо-2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-3-фтор-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-{3-[(2-метил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-{[4-(пентафторсульфанил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-3-фтор-4-{3-[(2-метил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-3-метил-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-((1-оксо-2,3-дигидро-1H-инден-5-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-{[3-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-3-фтор-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-{[4-(диметилсульфамоил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фторпиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-3-фтор-4-[4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-3-фтор-4-[4-оксо-3-({4-[2,2,2-трифтор-1-гидроксиэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилата;
трет-бутил-4-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)-3-фторпиперидин-1-карбоксилата;
трет-бутил-4-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-{[1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фторпиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
2-(4-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)ацетонитрила;
2-(3-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
4-((1-(3-(цианометил)тетрагидро-2H-пиран-3-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
2-(3-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
метил-5-(цианометил)-5-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-3-(цианометил)-3-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)азетидин-1-карбоксилата;
трет-бутил-3-(цианометил)-3-{3-[(2-фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}азетидин-1-карбоксилата;
трет-бутил-3-(цианометил)-3-[4-оксо-3-({4-[(трифторметил)сульфонил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]азетидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-5-(3-((4-1-амино-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
N-(трет-бутил)-4-((1-(4-(цианометил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензолсульфонамида;
2-(1-(2,2-дифторпропаноил)-4-(3-((4-(изопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрила;
N-(трет-бутил)-4-((1-(4-(цианометил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензолсульфонамида;
2-(4-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(2,2-дифторпропаноил)пиперидин-4-ил)ацетонитрила;
трет-бутил-4-(3-(3,5-бис((1H-пиразол-1-ил)метил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-(3,5-диметилфениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(3-(3,5-бис((1H-1,2,3-триазол-1-ил)метил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(3-(3,5-бис((2H-1,2,3-триазол-2-ил)метил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(3-(3-((1H-1,2,3-триазол-1-ил)метил)-5-((2H-1,2,3-триазол-2-ил)метил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(3-(м-толуидино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-(изоиндолин-5-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-{[2-(циклопропилметил)-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-{3-[(2-этил-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил)амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-[3-[(2-метил-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил)амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилата;
метил-4-{3-[(2-трет-бутил-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил)амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)пиперидин-1-карбоксилата;
метил-4-{3-[(2-этил-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил)амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил}-4-(цианометил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-{[2-(2-метилпропил)-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-{[2-(циклопропилметил)-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-{[2-(циклопентилметил)-1,1-диоксо-2,3-дигидро-1,2-бензотиазол-5-ил]амино}-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-[4-оксо-3-({4-[(трифторметил)сульфонил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-{3-[(2-фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
4-(1-(1-(цианометил)циклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-иламино)-N,N-диметилбензолсульфонамида;
2-(1-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(1-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
трет-бутил-4-(цианометил)-4-(3-((1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
2-(8-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1,4-диоксаспиро[4,5]декан-8-ил)ацетонитрила;
4-({1-[1-(цианометил)-2-фторциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
{2-фтор-1-[4-оксо-3-({4-[2,2,2-трифтор-1-гидрокси-1-метилэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексил}ацетонитрил
{2-фтор-1-[3-({4-[(1-метилэтил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексил}ацетонитрила;
2-(1-(3-((4-(1-амино-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрила;
трет-бутил-5-(3-((4-(N-(трет-бутил)-N-метилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(N-изопропил-N-метилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(N-этил-N-метилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(N-метилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((1-оксо-2-(2,2,2-трифторэтил)изоиндолин-5-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(3-((4-((1H-1,2,3-триазол-1-ил)метил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(3-((4-((2H-1,2,3-триазол-2-ил)метил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(изопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(циклопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(3-((2-(трет-бутил)-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-циклогексил-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-циклопентил-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(3-((4-(1-амино-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
[3-(3-{[4-(азетидин-1-илсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрила;
{3-[3-({4-[(3-метилазетидин-1-ил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
{3-[3-({4-[(2,2-диметилпирролидин-1-ил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
[3-{3-[(4-{[2-метилазетидин-1-ил]сульфонил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрила;
{3-[4-оксо-3-({4-[2,2,2-трифтор-1-гидрокси-1-метилэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
этил-3-(4-((1-(3-(цианометил)тетрагидро-2H-пиран-3-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноата;
2-(3-(3-((4-(3-гидрокси-3-(трифторметил)пирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((4-(3-фторпирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((4-(3-метоксипирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((4-(3-метоксипирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((3-метил-4-(морфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((1-гидрокси-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(1-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрила;
2-(1-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрила;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензонитрила;
2-(1-(4-оксо-3-((1-оксо-1,3-дигидроизобензофуран-5-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрила;
(1-{3-[(3,3-диметил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклопентил)ацетонитрила;
трет-бутил-4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензоата;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензамида;
2-(1-(3-((2-изопропил-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрила;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-изопропилбензолсульфонамида;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензолсульфонамида;
2-(1-(3-((4-(азетидин-1-илсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрила;
2-(1-(3-((4-(этилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрила;
N-(трет-бутил)-4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензолсульфонамида;
N-(трет-бутил)-4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-этилбензолсульфонамида;
4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диэтилбензолсульфонамида;
трет-бутил-2-(4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилфенилсульфонамидо)-2-метилпропаноата;
2-(1-(4-оксо-3-((1-оксо-2-(2,2,2-трифторэтил)изоиндолин-5-ил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентил)ацетонитрила;
этил-2-(4-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилфенилсульфонамидо)-2-метилпропаноата;
трет-бутил-2-(5-((1-(1-(цианометил)циклопентил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1-оксоизоиндолин-2-ил)-2-метилпропаноата;
метил-4-(цианометил)-4-(4-оксо-3-((4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-((1-гидрокси-1-(трифторметил)-2,3-дигидро-1H-инден-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-((4-цианофенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-((4-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(4-оксо-3-(хинолин-6-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-((4-(изопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
2-(2-фтор-1-(3-((3-метил-4-(морфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(2-фтор-1-(3-((2-фторпиридин-4-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(1-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-2-фторциклогексил)ацетонитрила;
2-(2-фтор-1-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(тиазолидин-3-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(2-метилтиазолидин-3-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(2-метилтиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(3-гидрокси-3-(трифторметил)пирролидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1,1,1-трифтор-2-гидрокси-4-изопропокси-3,3-диметил-4-оксобутан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((1-гидрокси-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1,1,1-трифтор-2-гидрокси-3,3-диметилбутан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2,2,2-трифтор-1-гидроксиэтил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1,1,1-трифтор-2-метоксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
{1-[3-({4-[1-(этиламино)-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]-2-фторциклогексил}ацетонитрила;
[2-фтор-1-{3-[(4-{1-метил-1-[(1-метилэтил)амино]этил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексил]ацетонитрила;
{1-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]-2-фторциклогексил}ацетонитрила;
[3-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрила;
{3-[3-({4-[(1-метилэтил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
4-({1-[3-(цианометил)-4-фтортетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
N-трет-бутил-4-({1-[3-(цианометил)тетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-метилбензолсульфонамида;
[3-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрила;
N-трет-бутил-4-({1-[3-(цианометил)тетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамида;
трет-бутил[5-({1-[3-(цианометил)тетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензизотиазол-2(3H)-ил]ацетата;
трет-бутил-3-{[4-({1-[3-(цианометил)тетрагидро-2H-пиран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]сульфонил}-3-метилбутаноата;
{3-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
{3-[3-({4-[1-(трет-бутиламино)-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
[3-(3-{[4-(циклопентилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрила;
{3-[4-оксо-3-({4-[(1,1,2-триметилпропил)сульфонил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
[3-(3-{[4-(циклогексилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрила;
трет-бутил-5-(3-((4-(1-(трет-бутиламино)-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
{3-[3-({4-[(1,1-диметилпропил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
[3-{3-[(2-циклопентил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрила;
{3-[4-оксо-3-({4-[2,2,2-трифтор-1-пирролидин-1-илэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
{3-[4-оксо-3-({4-[1-пирролидин-1-илэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
{3-[3-({4-[(2,2-диметилциклопентил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]тетрагидро-2H-пиран-3-ил}ацетонитрила;
трет-бутил-5-(цианометил)-5-(3-((4-(морфолинoсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
[3-(3-{[4-(морфолин-4-илсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил]ацетонитрила;
[3-{4-оксо-3-[(4-{2,2,2-трифтор-1-[(1-метилэтил)амино]этил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрила;
трет-бутил-5-(цианометил)-5-(3-((4-(1-(этиламино)-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2,2,2-трифтор-1-(изопропиламино)этил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(1-(пирролидин-1-ил)этил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(1-(диметиламино)-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-(хинолин-6-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-цианохинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-метилхинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(3,5-диметил-1H-пиразол-1-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(1H-пиразол-1-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(2,2-диметилморфолин-4-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-(хинолин-3-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-(диметиламино)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(3-((2-карбамоилхинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
2-(3-(4-оксо-3-((4-(1-(трифторметил)циклопропил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((2-(диметиламино)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((2-метилхинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
трет-бутил-5-(цианометил)-5-(3-((2-морфолинoхинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-(2-метилморфолинo)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(3-((2-(8-окса-3-азабицикло[3,2,1]октан-3-ил)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(пропан-2-ил-сульфонимидоил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
2-(3-(4-оксо-3-((4-(пропан-2-илсульфонимидоил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
4-({1-[1-(цианометил)-2-фторциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
трет-бутил-5-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(циклопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(изопропилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-(диметилкарбамоил)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
4-({1-[3-(цианометил)тетрагидрофуран-3-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензонитрила;
[3-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидрофуран-3-ил]ацетонитрила;
[3-{3-[(4-хлор-8-фторхинолин-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидрофуран-3-ил]ацетонитрила;
[3-{3-[(4-фторхинолин-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидрофуран-3-ил]ацетонитрила;
2-(3-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидрофуран-3-ил)ацетонитрила;
2-(3-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидрофуран-3-ил)ацетонитрила;
2-(4-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-4-ил)ацетонитрила;
2-(4-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-4-ил)ацетонитрила;
N-(трет-бутил)-4-((1-(4-(цианометил)тетрагидро-2H-пиран-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N-метилбензолсульфонамида;
4-((1-(4-(цианометил)тетрагидро-2H-пиран-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
2-(4-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрила;
2-(3-фтор-4-(3-(3-метил-4-(морфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-тетрагидро-2H-пиран-4-ил)ацетонитрила;
2-(4-(3-((2-(трет-бутил)-1-оксоизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрила;
2-(3-фтор-4-(3-(3-метил-4-(тиоморфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-тетрагидро-2H-пиран-4-ил)ацетонитрила;
2-(3-фтор-4-(4-оксо-3-((4-(2-(трифторметил)пиперидин-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-4-ил)ацетонитрила;
2-(4-(3-((4-(1-(трет-бутиламино)-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрила;
2-[4-(3-{[1,1-диоксо-2-(пиперидин-4-ил)-3H-1,2-бензотиазол-5-ил]амино}-4-оксо-5H-пиразоло[4,3-c]пиридин-1-ил)-3-фтороксан-4-ил]ацетонитрила;
трет-бутил-4-(цианометил)-3-фтор-4-{3-[(4-{1-метил-1-[(1-метилэтил)амино]этил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(2-(изопропиламино)пропан-2-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-4-(цианометил)-3-фтор-4-(3-{[4-(1-метоксиэтил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-{3-[(4-{1-метил-1-[(1-метилэтил)амино]этил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
2-(4-(3-((1,1-диоксидо-2-(1-(2,2,2-трифторэтил)пиперидин-4-ил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-3-фтортетрагидро-2H-пиран-4-ил)ацетонитрила;
трет-бутил-4-(цианометил)-3-фтор-4-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(3-((4-(1-бензил-3-(трифторметил)пирролидин-3-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-((4-(3-(трифторметил)пирролидин-3-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(3-(трифторметил)пирролидин-3-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2-(трифторметил)пиперидин-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-((4-(((2,2,2-трифторэтил)амино)метил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(N-изопропилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(3-((4-(N-бензилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(N-(циклопропилметил)сульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(N-(2-метоксиэтил)сульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(N-циклогексилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-((4-(пиперидин-1-илсульфонил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(морфолинoсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((3-фтор-4-(N-изопропилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(N-(циклопропилметил)сульфамоил)-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
(4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил)ацетонитрила;
[1-(циклопропилкарбонил)-4-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-4-ил]ацетонитрила;
4-({1-[1-бензил-4-(цианометил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(4-метилбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-[(1-{4-(цианометил)-1-[4-(трифторметил)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-[(1-{4-(цианометил)-1-[4-(1-метилэтил)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-[(1-{4-(цианометил)-1-[4-(1-метилэтил)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-[(1-{4-(цианометил)-1-[4-(1метилэтокси)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(4-фторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(3-фторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(2-фторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(2,6-дифторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(2,3,6-трифторбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(1,3-оксазол-2-илметил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(4-изоксазол-3-илбензил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-[(1-{4-(цианометил)-1-[4-(2-оксопирролидин-1-ил)бензил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(3-фенилпропил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(1H-индол-4-илметил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-((1-(4-(цианометил)-1-(1-(2,6-дифторфенил)этил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
4-((1-(4-(цианометил)-1-фенетилпиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
3-({1-[4-(цианометил)-1-(пиридин-3-илметил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-пропаноилпиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(3,3,3-трифторпропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(метоксиацетил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(N,N-диметилглицил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(2,2-диметилпропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(циклопропилкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-[(1-{4-(цианометил)-1-[(3,3-дифторциклобутил)карбонил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(циклогексилкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-[(1-{4-(цианометил)-1-[трицикло[3.3.1.13,7]дец-1-илкарбонил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(циклопропилацетил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(3-циклопропилпропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(фенилкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-[(1-{1-[(4-хлорфенил)карбонил]-4-(цианометил)пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-[(1-{1-[(3-хлорфенил)карбонил]-4-(цианометил)пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-[(1-{1-[(2-хлорфенил)карбонил]-4-(цианометил)пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-{[4-(трифторметил)фенил]ацетил}пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(3-фенилпропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(2,3-дигидро-1H-инден-2-илкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-[(1-{4-(цианометил)-1-[(2-оксопирролидин-1-ил)ацетил]пиперидин-4-ил}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино]-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(тетрагидро-2H-пиран-4-илкарбонил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(4,4,4-трифторбутаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(3-цианопропаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[4-(цианометил)-1-(3,3-диметилбутаноил)пиперидин-4-ил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-((1-(4-(цианометил)-1-(2-(метилтио)пропаноил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
4-((1-(1-(2-цианоацетил)-4-(цианометил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
метил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
фенил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
4-фторфенил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
неопентил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
этил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
2-метилциклопентил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
2-(метилтио)этил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
тетрагидро-2H-тиопиран-4-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
1-метоксипропан-2-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
тетрагидрофуран-3-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
тетрагидро-2H-пиран-4-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
1,1,1-трифторпропан-2-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
1-(пиридин-2-ил)этил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
1-цианоэтил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
тетрагидрофуран-3-ил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
2,2,2-трифторэтил-4-(цианометил)-4-(3-((4-(N,N-диметилсульфамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(цианометил)-4-(3-(2-фторпиридин-4-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
метил-4-(цианометил)-4-(3-(2-фторпиридин-4-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
4-((1-(4-(цианометил)-1-((2,2,2-трифторэтил)сульфонил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
4-((1-(4-(цианометил)-1-(циклопропилсульфонил)пиперидин-4-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
2-(4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрила;
6-(4-(цианометил)-4-(3-((4(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрила;
6-(4-(цианометил)-4-(3-((4((дифторметил)сульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрила;
2-(4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-1-(5(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрила;
6-(4-(цианометил)-4-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрила;
6-((3R,4R)-4-(цианометил)-3-фтор-4-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-ил)никотинонитрила;
2-(1-(5-иодпиридин-2-ил)-4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрила;
2-(1-(5-бромпиридин-2-ил)-4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрила;
2-(4-(3-(3-метил-4-(тиоморфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрила;
(R или S)-2-(4-(4-оксо-3-(4-(2,2,2-трифтор-1-гидроксиэтил)фениламино)-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрила;
2-(4-(3-(4-(4,4-дифторпиперидин-1-карбонил)-3-метилфениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-1-(4-(трифторметил)пиридин-2-ил)пиперидин-4-ил)ацетонитрила;
2-(1-(2,2-дифторпропаноил)-4-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-4-ил)ацетонитрила;
2-(4-(3-фторазетидин-1-ил)-1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(фениламино)циклогексил)ацетонитрила;
2-(4-гидрокси-1-(4-оксо-3-((4-(трифторметил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(3-фторазетидин-1-ил)циклогексил)ацетонитрила;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(3-метоксиазетидин-1-ил)циклогексил)ацетонитрила;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-((2,2,2-трифторэтил)амино)циклогексил)ацетонитрила;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-гидроксициклогексил)ацетонитрила;
2-(1-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(фениламино)циклогексил)ацетонитрила;
2-(4-(3-метоксиазетидин-1-ил)-1-(4-оксо-3-((4-(трифторметокси)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(1-(4-оксо-3-((4-(трифторметокси)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(фениламино)циклогексил)ацетонитрила;
2-(4-(циклогексиламино)-1-(4-оксо-3-((4-(трифторметокси)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(1-(3-((4-хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(циклогексиламино)циклогексил)ацетонитрила;
2-(1-(3-((4-хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(3-метоксиазетидин-1-ил)циклогексил)ацетонитрила;
2-(1-(3-((4-хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(фениламино)циклогексил)ацетонитрила;
2-(1-(3-((4-((дифторметил)сульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(3-фторазетидин-1-ил)циклогексил)ацетонитрила;
4-((1-(1-(цианометил)-4-(3-фторазетидин-1-ил)циклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
2-(4-(3-фторазетидин-1-ил)-1-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(4-(диметиламино)-1-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо-[d]изотиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(4-(3-фторазетидин-1-ил)-1-(3-((2-метил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрила;
2-(1-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(диметиламино)циклогексил)ацетонитрила;
4-((1-(1-(цианометил)-4-оксоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида;
N-(трет-бутил)-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксамида;
N-трет-бутил-5-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-(цианометил)-N-метилтетрагидро-2H-пиран-2-карбоксамида;
изопропил-5-(3-((2-(трет-бутил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
2-(3-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((3-метил-4-(2-метилпиперидин-1-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((3-метил-4-(2-метилпиперидин-1-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
2-(3-(3-((4-(4-гидрокси-4-метилпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(морфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(тиоморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(пирролидин-1-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(3-метилморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(2-метилморфолин-4-карбонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(2,6-диметилморфолин-4-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((4-(этил(2,2,2-трифторэтил)карбамоил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((3-метил-4-(метил(2,2,2-трифторэтил)карбамоил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(3-((4-(2-окса-5-азабицикло[2,2,1]гептан-5-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(3-((2-метилбензо[d]тиазол-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
[1-{3-[(3,3-диметил-2-оксо-2,3-дигидро-1H-индол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-2-фторциклогексил]ацетонитрила;
трет-бутил-5-(цианометил)-5-(3-((3,3-диметил-2-оксоиндолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
[3-{3-[(3,3-диметил-2-оксо-2,3-дигидро-1H-индол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрила;
[3-{3-[(2-метил-1,3-бензотиазол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}тетрагидро-2H-пиран-3-ил]ацетонитрила;
трет-бутил-5-(цианометил)-5-(3-((2-фторпиридин-4-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2,2,2-трифтор-1-метоксиэтил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-5-(цианометил)-5-(4-оксо-3-((4-(2,2,2-трифтор-1-метоксиэтил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)тетрагидро-2H-пиран-2-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(3-((4-(8-окса-3-азабицикло[3,2,1]октан-3-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4-(цианометил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-{3-[(5-метил-4-{3-окса-8-азабицикло[3,2,1]октан-8-илкарбонил}циклогекса-1,3,5-триен-1-ил)амино]-4-оксо-5H-пиразоло[4,3-c]пиридин-1-ил}пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-(3-метил-4-(тиоморфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-((1,1-диоксидо-2-(1-(2,2,2-трифторэтил)пиперидин-4-ил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-(4-(2-(трифторметил)пиперидин-2-ил)фениламино)-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(4-оксо-3-(4-(2-(трифторметил)пирролидин-2-ил)фениламино)-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
трет-бутил-4-(цианометил)-4-(3-(3-метил-4-(морфолин-4-карбонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)пиперидин-1-карбоксилата;
5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)-N-(метилсульфонил)тетрагидро-2H-пиран-2-карбоксамида;
5-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(цианометил)-N,N-диметилтетрагидро-2H-пиран-2-карбоксамида; и
2-(3-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-6-(2-гидроксипропан-2-ил)тетрагидро-2H-пиран-3-ил)ацетонитрила.
5. Фармацевтическая композиция для ингибирования Janus киназ JAK1 и JAK2, содержащая соединение по п.1 в терапевтически эффективном количестве или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
6. Способ лечения JAK-опосредованного заболевания, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
7. Способ лечения состояния у млекопитающего, которое можно облегчить путем ингибирования Janus киназ JAK1 и JAK2, где состояние выбрано из артрита, астмы и обструктивных заболеваний дыхательных путей, аутоиммунных заболеваний или расстройств и рака, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли или стереоизомера.
8. Способ по п.7, где указанное состояние представляет собой артрит.
9. Способ по п.7, где указанное состояние выбрано из ревматоидного артрита, ювенильного артрита и псориатического артрита.
10. Способ по п.7, где указанное состояние представляет собой астму или обструктивные заболевания дыхательных путей.
11. Способ по п.10, где указанное состояние выбрано из: хронической астмы, астмы с поздним началом, сверхчувствительности дыхательных путей, бронхита, бронхиальной астмы, аллергической астмы, наследственной бронхиальной астмы, приобретенной бронхиальной астмы, астматической реакции на пыль, рецидивирующей обструкции дыхательных путей и хронической обструктивной болезни легких (ХОБЛ) и эмфиземы.
12. Способ по п.7, где указанное состояние представляет собой аутоиммунные заболевания или расстройства.
13. Способ лечения астмы у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
14. Способ лечения артрита у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
15. Применение соединения по п.1 или его фармацевтически приемлемой соли или стереоизомера для получения лекарственного средства для лечения заболевания или расстройства, которое можно облегчить путем ингибирования Janus киназ JAK1 и JAK2.
| WO 2012066061 A1, 24.05.2012 | |||
| WO 2013036611 A1, 14.03.2013 | |||
| WO 2012030924 A1, 08.03.2012 | |||
| EP 2857400 A4, 09.12.2015 | |||
| WO 2013180265 A1, 05.12.2013 | |||
| WO 2011130146 A1, 20.10.2011 | |||
| US 20100105661 A1, 29.04.2010 | |||
| WO 2013192125 A1, 27.12.2013 | |||
| WO 2012135799 A1, 04.10.2012 | |||
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
Авторы
Даты
2018-08-20—Публикация
2014-03-19—Подача