ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению антитела против PD-1 в лечении опухоли. В частности, настоящее изобретение относится к: применению антитела против PD-1 в лечении солидной опухоли, предпочтительно рака пищевода, более предпочтительно плоскоклеточного рака пищевода (ПРП); применению антитела против PD-1 в изготовлении лекарственного средства для лечения солидной опухоли, предпочтительно рака пищевода, более предпочтительно плоскоклеточного рака пищевода (ПРП); способу прогнозирования терапевтического эффекта антитела против PD-1 на солидную опухоль, предпочтительно рак пищевода, более предпочтительно плоскоклеточный рак пищевода (ПРП) с использованием биомаркеров; и применению комбинированной терапии, включающей антитело против PD-1, или композиции, содержащей антитело против PD-1, в лечении солидной опухоли.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ускользание от иммунного ответа является одним из характерных свойств рака. В Ahmadzadeh, М. et al., Blood, 114: 1537-44 раскрыто, что опухольспецифичные Т-лимфоциты часто присутствуют в опухолевом микроокружении, дренирующих лимфатических узлах и в периферической крови, но они обычно не способны контролировать прогрессирование опухоли из-за сети иммуносупрессивных механизмов, присутствующей в опухолевом микроокружении. CD8+ опухоль-инфильтрирующие Т-лимфоциты (TIL) обычно экспрессируют ингибирующие рецепторы, индуцированные активацией, включая CTLA-4 и PD-1, в то время как опухолевые клетки часто экспрессируют иммуносупрессивные лиганды, включая лиганд 1 PD-1 (PD-L1, также называемый В7-Н1 или CD274), ингибирующий активацию и эффекторные функции Т-клеток. В этом ингибирующем механизме PD-1 и его лиганды стали важным путем, посредством которого опухолевые клетки подавляют активированные Т-клетки в опухолевом микроокружении.
Рецептор запрограммированной гибели 1-го типа (PD-1) играет важную роль в иммунной регуляции и поддержании периферической толерантности. PD-1 экспрессируют главным образом активированные Т- и В-клетки, и он функционирует, подавляя активацию лимфоцитов, что является нормальным механизмом толерантности иммунной системы к периферическим тканям, который предотвращает чрезмерные иммунные реакции. Тем не менее, в активированных Т-клетках, инфильтрирующих опухолевое микроокружение, экспрессия молекул PD-1 высока, а воспалительные факторы, секретируемые активированными лейкоцитами, могут индуцировать высокие уровни экспрессии лигандов PD-1 PD-L1 и PD-L2 в опухолевых клетках, что приводит к постоянной активации пути PD-1 в активированных Т-клетках опухолевого микроокружения и подавлению функции Т-клеток по уничтожению опухолевых клеток. Терапевтические антитела к PD-1 могут блокировать этот путь, частично восстанавливать функцию Т-клеток и позволяют активированным Т-клеткам постоянно уничтожать опухолевые клетки.
За последние десять лет было доказано, что блокировка пути PD-1/PD-L1 является эффективным способом получения продолжительного противоопухолевого ответа при различных видах рака. Моноклональные антитела (mAb), блокирующие путь PD/PD-L1, могут усиливать активацию и эффекторные функции опухольспецифичных Т-клеток, снижать опухолевую нагрузку и улучшать показатели выживаемости.
Рак пищевода (РП) является одной из наиболее распространенных злокачественных опухолей у людей, и обусловленные им заболеваемость и смертность продолжают расти на протяжении последних нескольких десятков лет, приводя в настоящее время к 400000 летальных исходов по всему миру ежегодно. Плоскоклеточный рак пищевода (ПРП) является наиболее распространенным гистологическим подтипом рака пищевода в развивающихся странах и основным гистологическим подтипом рака пищевода среди населения Южной Америки и Восточной Азии. Потребность в лечении этой опухоли остается неудовлетворенной по всему миру. В Китае РП является третьим по распространенности видом рака, занимая четвертое место среди ведущих причин летальных исходов, связанных с раком. На ПРП приходится более 90% всех случаев рака пищевода в Китае, и его обычно лечат с применением химиотерапии и лучевой терапии. Химиотерапевтическими агентами, чаще всего применяемыми при метастатическом ПРП, являются цисплатин, 5-фторурацил и таксаны. Показатель 5-летней выживаемости у пациентов с ПРП низкий и составляет 15%-20%. Стандартной терапии для пациентов с РП, рефрактерным к химиотерапии, в настоящее время не существует. Недавно, в Clin Cancer Res 2018; 24(6) 1296-304, было раскрыто, что антитело против PD-1 SHR-1210 обладает контролируемой безопасностью и эффективной противоопухолевой активностью при лечении пациентов с ПРП, рефрактерным к химиотерапии, в Китае, и было обнаружено, что при PD-L1-положительных опухолях частота объективного ответа была выше, чем при PD-L1-отрицательных опухолях, и что опухолевая мутационная нагрузка (ОМН) и число потенциальных неоантигенов, обусловленных мутациями, связаны с улучшением терапевтического ответа. Кроме того, в J Clin Oncol 2019; 37, 2019 (suppl 4; abstr 2) раскрыта значительная общая выживаемость у пациентов с распространенным ПРП и прогрессированием заболевания после терапии первой линии при лечении памтузумабом в сравнении с химиотерапией в популяции с комбинированным положительным показателем (combined positive score, CPS) PD-L1 10 или более. Таким образом, несмотря на то, что предшествующие исследования продемонстрировали эффективность терапии, направленной на PD-1, в субпопуляциях пациентов с метастатическим ПРП, эффективные прогностические биомаркеры для иммунотерапии антителом против PD-1 пока не установлены.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте настоящего изобретения предложено применение антитела против PD-1 или его антигенсвязывающего фрагмента, которые вводят сами по себе или в комбинации с дополнительным противораковым агентом, в изготовлении лекарственного средства для лечения рака.
В одном или более чем одном воплощении дополнительный противораковый агент, описанный здесь, представляет собой низкомолекулярный противораковый агент направленного действия. В одном воплощении дополнительный противораковый агент, описанный здесь, выбран из ингибитора CDK (циклин-зависимые киназы)4/6 и ингибитора FGF/FGFR (фактор роста фибробластов/рецептор фактора роста фибробластов).
В одном или более чем одном воплощении лекарственное средство содержит антитело против PD-1 или его антигенсвязывающий фрагмент и ингибитор CDK4/6. В одном или более чем одном воплощении лекарственное средство содержит антитело против PD-1 или его антигенсвязывающий фрагмент и ингибитор FGF/FGFR.
В одном или более чем одном воплощении согласно настоящему изобретению предложено применение антитела против PD-1 или его антигенсвязывающего фрагмента в изготовлении лекарственного средства для лечения пациента, имеющего рак, в комбинации с ингибитором CDK4/6 или ингибитором FGF/FGFR.
В одном или более чем одном воплощении согласно настоящему изобретению предложено применение антитела против PD-1 или его антигенсвязывающего фрагмента в комбинации с ингибитором CDK4/6 или ингибитором FGF/FGFR в изготовлении лекарственного средства для лечения пациента, имеющего рак.
В одном или более чем одном воплощении рак, описанный здесь, представляет собой солидную опухоль.
В одном или более чем одном воплощении рак включает, без ограничения, рак желудка, рак пищевода, рак носоглотки, плоскоклеточный рак головы и шеи, рак молочной железы, рак мочевого пузыря и рак толстой кишки.
В одном или более чем одном воплощении рак предпочтительно представляет собой рак пищевода. В одном или более чем одном предпочтительном воплощении рак представляет собой плоскоклеточный рак пищевода. В одном или более чем одном предпочтительном воплощении рак представляет собой распространенный ПРП. В одном или более чем одном предпочтительном воплощении рак представляет собой ПРП, рефрактерный к химиотерапии. В других воплощениях плоскоклеточный рак пищевода представляет собой распространенный, метастатический и/или рефрактерный плоскоклеточный рак пищевода.
В одном или более чем одном воплощении солидная опухоль не имеет амплификации генов хромосомной области 11q13.
В одном или более чем одном воплощении согласно настоящему изобретению предложено применение антитела против PD-1 (предпочтительно торипалимаба) в комбинации с ингибитором CDK4/6 (предпочтительно рибоциклибом или палбоциклибом, более предпочтительно палбоциклибом) в изготовлении лекарственного средства для лечения рака пищевода или рака толстой кишки; в некоторых воплощениях согласно настоящему изобретению предложено применение антитела против PD-1 (предпочтительно торипалимаба) в изготовлении лекарственного средства для лечения рака пищевода.
В определенных воплощениях индивид получал предшествующее лечение. В определенных воплощениях предшествующее лечение включает, без ограничения, химиотерапию или лучевую терапию. В определенных воплощениях индивид получал системное лечение. В одном или более чем одном предпочтительном воплощении предшествующее лечение или системное лечение проводили по меньшей мере дважды. В определенных воплощениях у индивида нет аутоиммунного заболевания или аутоиммунного заболевания в анамнезе. В определенных воплощениях у индивида нет никакого сопутствующего заболевания, при котором необходимо длительное лечение иммуносупрессивными лекарственными средствами. В определенных воплощениях индивид не получал предшествующего лечения каким-либо блокатором иммунных контрольных точек.
В некоторых воплощениях антитело против PD-1 или его антигенсвязывающий фрагмент вводят сами по себе или в комбинации с дополнительным противораковым агентом для получения продолжительного клинического ответа у индивида.
В одном или более чем одном воплощении, при лечении антителом против PD-1 или его антигеневязывающим фрагментом самими по себе или в комбинации с дополнительным противораковым агентом, антитело против PD-1 или его антигенсвязывающий фрагмент вводят внутривенной инфузией в терапевтически эффективной дозе от примерно 0,1 мг/кг массы тела до примерно 10,0 мг/кг массы тела примерно один раз в 2 недели. В некоторых воплощениях антитело против PD-1 или его антигенсвязывающий фрагмент вводят в дозе примерно 1 мг/кг массы тела, 3 мг/кг массы тела или 10 мг/кг массы тела или в фиксированной дозе 240 мг/кг один раз в 2 недели.
В одном или более чем одном воплощении антитело против PD-1 или его антигенсвязывающий фрагмент вводят в однократной дозе, составляющей от примерно 0,1 мг/кг массы тела до примерно 10,0 мг/кг массы тела, например, примерно 0,1 мг/кг массы тела, примерно 0,3 мг/кг массы тела, примерно 1 мг/кг массы тела, примерно 2 мг/кг массы тела, примерно 3 мг/кг массы тела, примерно 5 мг/кг массы тела или 10 мг/кг массы тела, или выбранной из фиксированной дозы от примерно 120 мг до примерно 480 мг, например, фиксированной дозы 120 мг, 240 мг, 360 мг или 480 мг.
В одном или более чем одном воплощении антитело против PD-1 или его антигенсвязывающий фрагмент вводят с частотой примерно один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели или один раз в месяц, предпочтительно один раз в две недели.
В одном или более чем одном воплощении антитело против PD-1 или его антигенсвязывающий фрагмент вводят в однократной дозе 1 мг/кг массы тела, 3 мг/кг массы тела или 10 мг/кг массы тела или в фиксированной дозе 240 мг один раз в две недели.
В одном или более чем одном воплощении антитело против PD-1 или его антигенсвязывающий фрагмент вводят парентерально, например посредством внутривенной инфузии, в жидкой лекарственной форме, например инъекции.
В одном или более чем одном воплощении антитело против PD-1 или его антигенсвязывающий фрагмент могут быть введены в течение периода продолжительностью в одну неделю, две недели, три недели, один месяц, два месяца, три месяца, четыре месяца, пять месяцев, полгода или более, возможно, продолжительности каждого периода введения могут быть одинаковы или различны и интервалы между каждым периодом введения могут быть одинаковы или различны.
Во втором аспекте настоящего изобретения предложен набор для лечения индивида, имеющего рак, содержащий: (а) моноклональное антитело или его антигенсвязывающий фрагмент, специфически связывающиеся с PD-1 и ингибирующие его, и возможно дополнительный противораковый агент, отличный от антитела против PD-1 или его антигенсвязывающего фрагмента; и (б) инструкции по введению антитела против PD-1 или его антигенсвязывающего фрагмента, специфически связывающихся с PD-1 и ингибирующих его, самих по себе или в комбинации с дополнительным противораковым агентом для лечения рака у индивида. Рак представляет собой солидную опухоль. В качестве предпочтительного воплощения, рак включает, без ограничения, рак желудка, рак пищевода, рак носоглотки, плоскоклеточный рак головы и шеи, рак молочной железы, рак мочевого пузыря и рак толстой кишки. В качестве предпочтительного воплощения, рак предпочтительно представляет собой рак пищевода. В качестве предпочтительного воплощения, рак представляет собой плоскоклеточный рак пищевода. В качестве другого предпочтительного воплощения, рак представляет собой ПРП. В качестве предпочтительного воплощения, солидная опухоль не имеет амплификации генов хромосомной области 11q13.
В одном или более чем одном воплощении дополнительный противораковый агент, описанный здесь, представляет собой низкомолекулярный противораковый агент направленного действия. В одном воплощении дополнительный противораковый агент, описанный здесь, выбран из одного или более чем одного из ингибитора CDK4/6 и ингибитора FGF/FGFR.
В одном или более чем одном воплощении набор содержит антитело против PD-1 или его антигенсвязывающий фрагмент и ингибитор CDK4/6. В одном или более чем одном воплощении набор содержит антитело против PD-1 или его антигенсвязывающий фрагмент и ингибитор FGF/FGFR.
В третьем аспекте настоящего изобретения предложено применение ингибитора CDK4/6 или ингибитора FGF/FGFR в изготовлении лекарственного средства для лечения рака.
В четвертом аспекте настоящего изобретения предложен способ лечения рака, включающий секвенирование индивида до лечения, где: индивиду, не имеющему амплификации хромосомной области 11q13, вводят антитело против PD-1 или его антигенсвязывающий фрагмент сами по себе, возможно в комбинации с одним из или в комбинации с более чем одним из ингибитора CDK4/6 и/или ингибитора FGF/FGFR; индивиду, имеющему амплификацию хромосомной области 11q13, вводят одно из или комбинацию более чем одного из ингибитора CDK4/6 и/или ингибитора FGF/FGFR сами по себе, возможно, в комбинации с антителом против PD-1 или его антигенсвязывающим фрагментом.
В применениях, способах, лекарственных средствах и наборах, описанных здесь, индивид представляет собой человека.
В одном или более чем одном предпочтительном воплощении индивид, описанный здесь, представляет собой человека и рак представляет собой солидную опухоль. В одном или более чем одном предпочтительном воплощении индивид, описанный здесь, представляет собой человека, и рак выбран, без ограничения, из рака желудка, рака пищевода, рака носоглотки, плоскоклеточного рака головы и шеи, рака молочной железы, рака мочевого пузыря и рака толстой кишки. В предпочтительном воплощении индивид, описанный здесь, представляет собой человека, и рак представляет собой рак пищевода. В предпочтительном воплощении индивид, описанный здесь, представляет собой человека, и рак представляет собой ПРП. В одном или более чем одном воплощении индивид, описанный здесь, представляет собой индивида, имеющего рак пищевода и не получал предшествующей иммунотерапии.
В пятом аспекте настоящего изобретения предложен способ прогнозирования терапевтического эффекта антитела против PD-1 у пациента с опухолью, включающий определение наличия у пациента амплификации генов хромосомной области 11q13, где отсутствие амплификации генов хромосомной области 11q13 указывает на то, что пациент с опухолью является подходящим для лечения антителом против PD-1.
В применениях, способах, лекарственных средствах и наборах, описанных здесь, антитело против PD-1 представляет собой моноклональное антитело или его антигенсвязывающий фрагмент. В определенных воплощениях антитело против PD-1 специфически связывается с PD-1 и блокирует связывание PD-L1 или PD-L2 с PD-1. В определенных воплощениях антитело против PD-1 специфически связывается с PD-L1 и/или PD-L2 и блокирует связывание PD-L1 и/или PD-L2 с PD-1.
В одном или более чем одном воплощении антитело против PD-1 содержит участки, определяющие комплементарность (CDR), где участки, определяющие комплементарность, легкой цепи (LCDR) содержат аминокислотные последовательности, представленные в SEQ ID NO: 1, 2 и 3, и участки, определяющие комплементарность, тяжелой цепи (HCDR) содержат аминокислотные последовательности, представленные в SEQ ID NO: 4, 5 и 6.
В одном или более чем одном воплощении антитело против PD-1 содержит вариабельную область легкой цепи (VL), представленную в SEQ ID NO: 7, и вариабельную область тяжелой цепи (VH), представленную в SEQ ID NO: 8.
В одном или более чем одном воплощении антитело против PD-1 содержит легкую цепь и тяжелую цепь, где легкая цепь содержит аминокислотную последовательность, представленную в SEQ ID NO: 9, и тяжелая цепь содержит аминокислотную последовательность, представленную в SEQ ID NO: 10.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ. 1 показано следующее. (А) Максимальное изменение размера опухоли по сравнению с исходным по оценке исследователей в соответствии с RECIST v1.1 (n равно 46, у субъектов проведены исходная визуализационная оценка и по меньшей мере одна визуализационная оценка после лечения). Длина столбика указывает на максимальное уменьшение или минимальное увеличение целевого очага. Цвет столбика указывает на результаты предшествующего системного лечения. Синий - 3L или более; оранжевый - 2L; зеленый - 1L. У 5 пациентов (отмеченных #) наилучшее изменение целевого очага по сравнению с исходным уровнем превышает 30%, но ответ не позволяет подтвердить возможное появление новых очагов. У 5 пациентов (отмеченных +) наилучшим изменением целевого очага по сравнению с исходным уровнем является рост опухоли менее чем на 20%, но выявлено прогрессирование заболевания (ПЗ) вследствие появления новых очагов или прогрессирования нецелевых очагов.
(B) Изменения опухолевой нагрузки у каждого индивида с течением времени согласно оценке, проводимой исследователями в соответствии с RECIST v1.1 (n равно 46, у субъектов проведены исходная рентгенологическая оценка и по меньшей мере одна рентгенологическая оценка после лечения). * Предельное значение процента изменения составляет 100%.
(C) Выживаемость без прогрессирования у всех пациентов, включенных в исследование.
(D) Общая выживаемость у всех пациентов, включенных в исследование. Показан процент выживших пациентов в указанных временных точках. Цензурированные пациенты отмечены « | ». Число пациентов с риском в заданной временной точке показано под осью X.
На ФИГ. 2 показаны клинические ответы, связанные с опухолевой экспрессией PD-L1 или опухолевой мутационной нагрузкой (ОМН).
(A) PD-L1-положительный статус определяют как присутствие опухолевых клеток или иммунных клеток с интенсивностью окрашивания мембраны 1% или более при ИГХ-окрашивании SP142.
(B) ОМН-статус, определенный полноэкзомным секвенированием опухолевых биоптатов и парных им МКПК.
(C) Сравнение ВВП (выживаемость без прогрессирования) у PD-L1-положительных пациентов и PD-L1-отрицательных пациентов.
(D) Сравнение ОВ у PD-L1-положительных пациентов и PD-L1-отрицательных пациентов.
(E) Сравнение ВВП у пациентов с высокой ОМН и пациентов с низкой ОМН.
(F) Сравнение ОВ у пациентов с высокой ОМН (12 или более) и пациентов с низкой ОМН (менее 12). Показан процент выживших пациентов в указанных временных точках. Цензурированные пациенты отмечены « | ». Число пациентов с риском в заданной временной точке показано под осью X.
На ФИГ. 3 показаны мутации у пациентов с распространенным ПРП.
Согласно геномной карте WES, 5 наиболее частыми мутациями в опухолевых биоптатах ПРП являются миссенс-мутации или усечения ТР53 (р53) (76%), RYR2 (22%), NOTCH1 (20%), LRP1B (17%) и TRIO (17%).
На ФИГ. 4 показана амплификация генного локуса 11 q 13 и анализ экспрессии РНК у пациентов с ПРП, включенных в исследование.
(A) Геномное профилирование, проведенное секвенированием нового поколения с использованием FFPE-образцов опухолей и парных им образцов периферической крови от 51 доступного пациента. Амплификация 11q13 присутствует у 24 пациентов. Сверху показана хромосомная область 11q13 и кодирующие гены. Для определения амплификации применены три алгоритма. У каждого индивида есть амплифицированный ген. Также отмечены мутации или делеции амплифицированного гена.
(B) Анализ экспрессии матричной РНК амплифицированной 11q13. У доступных пациентов проведены секвенирование мРНК и определение профиля экспрессии. У каждого индивида уровень экспрессии мРНК связан с амплификацией гена.
На ФИГ. 5 показана корреляция клинического ответа со статусом амплификации генов хромосомной области 11q13.
(A) 11q13-статус опухоли, определенный полноэкзомным секвенированием опухолевых биоптатов и парных им МКПК.
(B) Выживаемость без прогрессирования у пациентов с 11q13 дикого типа в сравнении с пациентами с 11q13 амплифицированного типа.
(C) Общая выживаемость у пациентов с 11q13 дикого типа в сравнении с пациентами с 11q13 амплифицированного типа. Показан процент выживших пациентов в указанных временных точках. Цензурированные пациенты отмечены « | ». Число пациентов с риском в заданной временной точке показано под осью X.
На ФИГ. 6 показан ход клинического исследования NCT02915432 по оценке эффекта торипалимаба у пациентов с распространенным РЖ, ПРП, НФР и ПРГШ.
На ФИГ. 7 показаны результаты исследования ингибирующего эффекта антитела против PD-1 и ингибитора CDK4/6 на опухолевый рост у мышей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения опухолей. Способ по настоящему изобретению включает введение пациенту, нуждающемуся в этом, антитела против PD-1 или его антигенсвязывающего фрагмента самих по себе или включает введение пациенту, нуждающемуся в этом, антитела против PD-1 или его антигенсвязывающего фрагмента в комбинации с дополнительным противораковым агентом. Настоящее изобретение также относится к способу прогнозирования терапевтического эффекта антитела против PD-1 у пациента, имеющего рак, предпочтительно пациента, имеющего рак пищевода, с использованием биомаркеров.
Терминология
Для облегчения понимания настоящего изобретения некоторые технические и научные термины определены особым образом ниже. Если прямо не определено иное, все технические и научные термины, используемые здесь, имеют такое же значение, в каком их обычно понимают специалисты в области, к которой относится настоящее изобретение.
«Введение», «прием» и «лечение» относятся к помещению композиции, содержащей терапевтический агент, в организм субъекта с применением любого из множества способов или систем доставки, известных специалистам в данной области. Пути введения антитела против PD-1 включают внутривенный, внутримышечный, подкожный, внутрибрюшинный, спинальный или другие парентеральные пути введения, такие как инъекция или инфузия. «Парентеральное введение» относится к способам введения, кроме энтерального или местного введения, обычно инъекционным, включая, без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрилимфатическую, внутриочаговую, внутрикапсулярную, интраорбитальную, интракардиальную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, интраартикулярную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную инъекцию и инфузию и электропорацию in vivo.
«Нежелательное явление» (НЯ), описанное здесь, представляет собой любой нежелательный и часто неблагоприятный признак, симптом или заболевание в связи с введением лекарственного средства. Например, нежелательное явление может быть связано с активацией иммунной системы или ростом числа клеток иммунной системы в ответ на введение лекарственного средства. Введение лекарственного средства может приводить к одному или более чем одному связанному с ним НЯ, и степени тяжести каждого НЯ могут быть одинаковы или различны.
Термин «субъект» включает любой организм, предпочтительно животное, более предпочтительно млекопитающее (такое как крыса, мышь, собака, кошка и кролик), и наиболее предпочтительно человека. Термины «субъект», «пациент» и «индивид» использованы здесь взаимозаменяемо.
«Антитело», описанное здесь, относится к любой форме антитела, достигающей желаемой биологической или связывающей активности. Таким образом, оно использовано в наиболее широком смысле, включая, без ограничения, моноклональные антитела, поликлональные антитела, мультиспецифичные антитела, гуманизированные, полноразмерные человеческие антитела, химерные антитела и камелизированные однодоменные антитела, специфически связывающиеся с антигеном и содержащие по меньшей мере две тяжелые (Н) и две легкие (L) цепи, связанные друг с другом дисульфидными связями, или их антигенсвязывающие фрагменты. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (VH) и константную область тяжелой цепи, содержащую три константных домена CH1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (VL) и константную область легкой цепи, содержащую один константный домен CL. Области VH и VL можно разделить далее на гипервариабельные участки, называемые участками, определяющими комплементарность (CDR), расположенные среди более консервативных областей, называемых каркасными областями (FR). Обычно как вариабельные домены легкой цепи, так и вариабельные домены тяжелой цепи содержат FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4, от N-конца к С-концу. Аминокислоты обычно относят к каждому домену, исходя из следующих определений: Sequences of Proteins of Immunological Interest, Kabat et al.; National Institutes of Health, Bethesda, Md.; 5th edition; NIH publication No. 91-3242 (1991): Kabat (1978) Adv. Prot. Chem. 32:1-75; Kabat et al., (1977) J. Biol. Chem. 252:6609-6616; Chothia et al., (1987) J Mol Biol 196:901-917; или Chothia et al., (1989) Nature 341:878-883.
С-концевое положение тяжелой цепи может определять константную область, наиболее важную для эффекторной функции. Человеческие легкие цепи обычно классифицируют как цепи κ и λ. Человеческие тяжелые цепи обычно классифицируют как μ, δ, γ, α или ε, а изотипы антител определяют как IgM, IgD, IgG, IgA и IgE, соответственно. Подкласс IgG хорошо известен специалистам в данной области и включает, без ограничения, IgG1, IgG2, IgG3 и IgG4.
Термин «антитело» включает: естественные и искусственные антитела; моноклональные и поликлональные антитела; химерные и гуманизированные антитела; человеческие антитела или антитела, не являющиеся человеческими; полностью синтетические антитела; и одноцепочечные антитела. Антитела, не являющиеся человеческими, могут быть гуманизированы рекомбинантными методами для снижения их иммуногенности у людей.
Если прямо не указано иное, «фрагмент антитела» или «антигенсвязывающий фрагмент», описанный здесь, относится к антигенсвязывающему фрагменту антитела, то есть к фрагменту антитела, сохраняющему способность полноразмерного антитела к специфическиму связыванию с антигеном, например, к фрагменту, сохраняющему один или более чем один CDR-участок. Примеры связывающих фрагментов антитела включают, без ограничения: Fab-, Fab'-, F(ab')2- и Fv-фрагменты; диатело; линейное антитело; молекулу одноцепочечного антитела; и наноантитело и мультиспецифические антитело, образованное из фрагментов антитела.
«Химерное антитело» относится к антителу или его фрагменту, где часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антитела, имеющего происхождение от определенного вида (например, человека) или принадлежащего к определенному классу или подклассу антител, в то время как остальная часть цепи идентична или гомологична соответствующим последовательностям антитела, имеющего происхождение от другого вида (например, мыши) или принадлежащего к другому классу или подклассу антител, при условии, что они демонстрируют желаемую биологическую активность.
«Человеческое антитело» относится к антителу, содержащему только последовательности человеческих иммуноглобулинов. Человеческое антитело может содержать мышиную углеводную цепь, если оно получено в мышах, мышиных клетках или гибридомах, имеющих происхождение от мышиных клеток. Сходным образом, «мышиное антитело» или «крысиное антитело» относится к антителу, содержащему только последовательности мышиных или крысиных иммуноглобулинов, соответственно.
«Гуманизированное антитело» относится к форме антитела, содержащей последовательности как антител, не являющихся человеческими (например, мышиных), так и человеческих антител. Такие антитела содержат минимальные последовательности, имеющие происхождение от иммуноглобулинов, не являющихся человеческими. Обычно гуманизированное антитело будет содержать практически все из по меньшей мере одного и обычно двух вариабельных доменов, в которых все или практически все гипервариабельные петли соответствуют гипервариабельным петлям иммуноглобулина, не являющегося человеческим, и все или практически все FR-области представляют собой FR-области человеческого иммуноглобулина. Гуманизированное антитело, возможно, также содержит по меньшей мере одну часть константной области (Fc) иммуноглобулина, обычно константную область человеческого иммуноглобулина.
Термин «рак», используемый здесь, относится к широкому спектру заболеваний, характеризующихся неконтролируемым ростом аномальных клеток в организме. Нерегулируемое деление и рост клеток приводят к развитию злокачественных новообразований, которые прорастают в соседние ткани и могут также метастазировать в отдаленные области организма через лимфатическую систему или ток крови. Примеры рака включают, без ограничения, рак, лимфому, лейкоз, бластому и саркому. Более конкретные примеры рака включают плоскоклеточный рак, миелому, мелкоклеточный рак легкого, немелкоклеточный рак легкого, глиому, лимфому Ходжкина, неходжкинскую лимфому, острый миелолейкоз, множественную миелому, рак желудочно-кишечного тракта, рак почки, рак яичника, рак печени, лимфобластный лейкоз, лимфоцитарный лейкоз, колоректальный рак, эндометриальный рак, рак почки, рак предстательной железы, рак щитовидной железы, меланому, хондросаркому, нейробластому, рак поджелудочной железы, мультиформную глиобластому, рак шейки матки, рак головного мозга, рак желудка, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишке и рак головы и шеи. Другое воплощение рака включает рак пищевода. Другое конкретное воплощение рака включает ПРП. Другое конкретное воплощение рака включает ПРП, рефрактерный к химиотерапии. Другое конкретное воплощение рака включает распространенный ПРП. В определенных воплощениях рак, описанный здесь, включает виды рака, характеризующиеся тем, что секвенируемый индивид имеет амплификацию генов хромосомной области 11q13. Рак, описанный здесь, включает виды рака, характеризующиеся тем, что секвенируемый индивид не имеет амплификации генов хромосомной области 11q13.
Термин «рак пищевода» или «РП» является одной из наиболее распространенных злокачественных опухолей у людей. Он является частой опухолью желудочно-кишечного тракта и по гистологическим и патологическим типа может быть разделен на плоскоклеточный рак, аденокарциному и мелкоклеточный рак. Среди них «плоскоклеточный рак пищевода» или «ПРП» является наиболее распространенным типом РП в развивающихся странах, и прогноз при лечении этого рака крайне неблагоприиятен при показателе 5-летней общей выживаемости лишь 20%-30%.
Термин «иммунотерапия» относится к лечению субъекта с заболеванием или с риском инфекции или рецидива заболевания способом, включающим индукцию, усиление, подавление или иную модификацию иммунного ответа. «Лечение» или «терапия» субъекта относится к вмешательству или процедуре любого типа, проводимым у субъекта, или к введению активного агента субъекту с целью достижения обратного развития, облегчения, уменьшения степени выраженности, замедления или предотвращения начала, прогрессирования, степени тяжести, или рецидивирования симптомов, осложнений или состояний, или биохимических индикаторов, связанных с заболеванием.
«Рецептор запрограммированной гибели 1-го типа (PD-1)» относится к иммуносупрессивному рецептору, принадлежащему к семейству CD28. In vivo PD-1 экспрессирован главным образом на ранее активированных Т-клетках и связывается с двумя лигандами, PD-L1 и PD-L2. Термин «PD-1», используемый здесь, включает человеческий PD-1 (hPD-1), варианты, изотипы и видовые гомологи hPD-1 и аналоги, имеющие по меньшей мере один общий эпитоп с hPD-1.
«Терапевтически эффективное количество» или «терапевтически эффективная доза» лекарственного средства или терапевтического агента представляет собой любое количество лекарственного средства, которое, при его использовании самого по себе или в комбинации с дополнительным терапевтическим агентом, защищает субъекта от начала заболевания или стимулирует обратное развитие заболевания, свидетельством чего является уменьшение степени выраженности симптомов заболевания, увеличение частоты и продолжительности бессимптомной фазы заболевания или предотвращение травмы или нетрудоспособности, обусловленных развитием заболевания. Способность терапевтического агента стимулировать обратное развитие заболевания может быть оценена с применением множества способов, известных специалистам в данной области, например, у людей в клинических исследованиях, в модельных системах у животных, позволяющих прогнозировать эффективность у человека, или посредством определения активности агента в анализе in vitro.
Терапевтически эффективное количество лекарственного средства включает «профилактически эффективное количество», представляющее собой любое количество лекарственного средства, которое, при его использовании самого по себе или в комбинации с противоопухолевым агентом, ингибирует развитие или рецидивирование рака у субъекта с риском развития рака или субъекта с рецидивом рака.
«Биотерапевтический агент» относится к биологической молекуле, такой как антитело или слитый белок, блокирующей лиганд/рецепторную передачу сигналов в любом биологическом пути, способствующем поддержанию и/или росту опухоли или ингибирующем противоопухолеый иммунный ответ.
Если прямо не указано иное, «CDR», используемый здесь, относится к участку, определяющему комплементарность, вариабельной области иммуноглобулина, определенному с применением системы нумерации Kabat.
«Противораковый агент» относится к любому терапевтическому агенту, который может быть использован в лечении рака. Противораковые агенты включают, без ограничения, алкилирующие агенты, антиметаболиты, ингибиторы киназ, фитоалкалоидные веретенные яды, цитотоксические/противоопухолевые антибиотики, фотосенсибилизаторы, антиэстрогены и селективные модуляторы рецепторов эстрогенов, антипрогестины, ингибиторы ароматазы, ингибиторы CDK4/6, ингибиторы FGF/FGFR и тому подобное, а также антисмысловые олигонуклеотиды, ингибирующие экспрессию генов, вовлеченных в аномальную пролиферацию клеток или опухолевый рост.
Термин «примерно» относится к значению или композиции в пределах приемлемого диапазона погрешности для данного значения или композиции, как определено специалистами в данной области, который отчасти зависит от способа измерения или определения значения или композиции, то есть от ограничений системы измерения. Например, согласно практике, принятой в данной области, «примерно» может относиться к нахождению в пределах 1 или более чем 1 стандартного отклонения. Альтернативно, «примерно» может относиться к диапазону до 10% или 20% (то есть плюс/минус 10% или плюс/минус 20%). Например, примерно 3 мг/кг может включать любое число от 2,7 мг/кг до 3,3 мг/кг (применительно к 10%) и от 2,4 мг/кг до 3,6 мг/кг (применительно к 20%). Когда здесь приведено какое-либо конкретное значение или композиция, если прямо не указано иное, следует считать, что значение «примерно» входит в приемлемый диапазон погрешности для данного конкретного значения или композиции.
«Терапевтическое моноклональное антитело против PD-1» относится к антителу, специфически связывающемуся со зрелой формой конкретного PD-1, экспрессированной на поверхности определенных клеток млекопитающих. Зрелый PD-1 не имеет секреторной лидерной последовательности или лидерного пептида. Термины «PD-1» и «зрелый PD-1» использованы здесь взаимозаменяемо, и их следует понимать как одну и ту же молекулу, если иное не определено прямо или не очевидно из контекста.
Терапевтическое антитело против человеческого PD-1 или антитело против hPD-1, описанное здесь, относится к моноклональному антителу, специфически связывающемуся со зрелым человеческим PD-1.
«Каркасная область» или «FR», описанная здесь, относится к вариабельной области иммуноглобулина, за исключением CDR-участков.
«Выделенное антитело или его антигенсвязывающий фрагмент» относится к молекуле, представленной в очищенном состоянии, и, в данном случае, практически свободной от других биомолекул, таких как нуклеиновые кислоты, белки, липиды, углеводы и другие вещества (такие как клеточный дебрис или питательная среда).
«Пациент» или «субъект» относится к любому отдельному субъекту, нуждающемуся в проведении медицинской процедуры или принимающему участие в клиническом исследовании, эпидемиологическом исследовании или являющемуся контрольным, включая людей и млекопитающих, таких как лошади, коровы, собаки или кошки.
В последующих абзацах различные аспекты настоящего изобретения описаны более подробно.
Антитело против PD-1
«Антитело против PD-1» относится к любому химическому соединению или биомолекуле, связывающимся с рецептором PD-1, блокирующим связывание PD-L1, экспрессированного на раковых клетках, с PD-1, экспрессированным на иммунных клетках (Т-, В- и NK-клетках), и, предпочтительно, блокирующим связывание PD-L2, экспрессированного на раковых клетках, с PD-1, экспрессированным на иммунных клетках. Альтернативные названия или синонимы PD-1 и его лигандов включают: PDCD1, PD1, CD279 и SLEB2 для PD-1; PDCD1L1, PDL1, В7-Н1, В7Н1, В7-4, CD274 и В7-Н для PD-L1; и PDCD1L2, PDL2, B7-DC и CD273 для PD-L2. В любых терапии, лекарственном средстве и применении, описанных здесь для лечения индивида, являющегося человеком, антитело к PD-1 блокирует связывание человеческого PD-L1 с человеческим PD-1 и предпочтительно блокирует связывание как человеческого PD-L1, так и человеческого PD-L2 с человеческим PD-1. Аминокислотная последовательность человеческого PD-1 представлена в NCBI под номером локуса NP_005009. Аминокислотные последовательности человеческих PD-L1 и PD-L2 представлены в NCBI под номерами локусов NP-054862 и NP-079515.
Антитело против PD-1, которое может быть использовано в любом из применений, вариантов терапии, лекарственных средств и наборов, описанных здесь, включает моноклональное антитело (mAb) или его антигенсвязывающий фрагмент, специфически связывающиеся с PD-1 и предпочтительно специфически связывающиеся с человеческим PD-1. mAb может представлять собой человеческое антитело, гуманизированное антитело или химерное антитело и может содержать человеческую константную область. В некоторых воплощениях константная область выбрана из константных областей человеческого IgG1, IgG2, IgG3 и IgG4, и в предпочтительных воплощениях константная область представляет собой константную область человеческого IgG4.
В любом из воплощений применений, вариантов терапии, лекарственных средств и наборов, описанных здесь, антитело к PD-1 представляет собой моноклональное антитело или его антигенсвязывающий фрагмент, содержащие: (a) CDR легкой цепи, содержащие аминокислотные последовательности, представленные в SEQ ID NO: 1, 2 и 3; и CDR тяжелой цепи, содержащие аминокислотные последовательности, представленные в SEQ ID NO: 4, 5 и 6.
В любом из воплощений применений, вариантов терапии, лекарственных средств и наборов, описанных здесь, антитело к PD-1 представляет собой моноклональное антитело, специфически связывающееся с человеческим PD-1, и содержит: (а) вариабельную область легкой цепи, представленную в SEQ ID NO: 7, и (б) вариабельную область тяжелой цепи, представленную в SEQ ID NO: 8.
В любом из воплощений применений, вариантов терапии, лекарственных средств и наборов, описанных здесь, антитело к PD-1 представляет собой моноклональное антитело, специфически связывающееся с человеческим PD-1, и содержит: (а) вариабельную область легкой цепи, представленную в SEQ ID NO: 9, и (б) тяжелую цепь, представленную в SEQ ID NO: 10.
В любом из воплощений применений, вариантов терапии, лекарственных средств и наборов, описанных здесь, антитело к PD-1 представляет собой моноклональное антитело или его антигенсвязывающий фрагмент, и в Таблице А ниже приведен перечень аминокислотных последовательностей типичного mAb против PD-1, использованного в применениях, вариантах терапии, лекарственных средствах и наборах, описанных здесь.

Пример антител против PD-1, которые связываются с человеческим PD-1 и могут быть использованы в применениях, вариантах терапии, лекарственных средствах и наборах, описанных здесь, описан в WO 2014206107. mAb к человеческому PD-1, которые могут быть использованы в качестве антител против PD-1 в применениях, вариантах терапии, лекарственных средствах и наборах, описанных здесь, включают любое из антител против PD-1, описанных в WO 2014206107, включая торипалимаб (Toripalimab) (гуманизированное mAb IgG4, имеющее структуру, описанную в WHO Drug Information, 32(2):372-373 (2018), и содержащее аминокислотные последовательности легкой и тяжелой цепи, представленные в SEQ ID NO: 9 и 10). В определенных воплощениях антитела против PD-1, которые могут быть использованы в применениях, вариантах терапии, лекарственных средствах и наборах, описанных здесь, также включают ниволумаб и памтузумаб, утвержденные FDA, и синтилимаб, утвержденный NMPA, и SHR-1210 и тислелизумаб, проходящие клинические исследования, а также любое химическое соединение или биомолекулу, блокирующие связывание PD-L1, экспрессированного на раковых клетках, с PD-1, экспрессированным на иммунных клетках (Т-, В- и NK-клетках), и, предпочтительно, блокирующие связывание PD-L2, экспрессированного на раковых клетках, с PD-1, экспрессированным на иммунных клетках, проходящие доклинические и клинические исследования.
В определенных воплощениях антитела против PD-1, которые могут быть использованы в применениях, вариантах терапии, лекарственных средствах и наборах, описанных здесь, также включают моноклональные антитела против PD-L1, специфически связывающиеся с PD-L1, блокируя связывание PD-L1 с PD-1, такие как атезолизумаб, авелумаб, дурвалумаб, или любое химическое соединение или биомолекулу, специфически связывающиеся с PD-L1, блокируя связывание PD-L1 с PD-1.
Экспрессия «PD-L1» или экспрессия «PD-L2», описанные здесь, относятся к любому выявляемому уровню экспрессии белка определенного PD-L на поверхности клетки или мРНК определенного PD-L в клетке или ткани. Экспрессия белка PD-L может быть выявлена при ИГХ-анализе срезов опухолевой ткани или проточной цитометрией с использованием диагностических антител к PD-L. Альтернативно, экспрессия белка PD-L опухолевыми клетками может быть выявлена ПЭТ-визуализацией с использованием связывающего агента, специфически связывающегося с желаемой PD-L-мишенью (такой как PD-L1 или PD-L2).
Методы количественной оценки экспрессии белка PD-L1 при ИГХ-анализе срезов опухолевой ткани описаны, без ограничения, в Thompson, R.H. et al., PNAS 101(49):17174-17179 (2004), Taube, J.М. et al., Sci Transl Med 4, 127ra37 (2012), и Toplian, S.L. et al., New Eng. J. Med. 366(26): 2443-2454 (2012), и в подобных им источниках.
В одном методе применяют простую бинарную конечную точку положительной или отрицательной экспрессии PD-L1, где положительную экспрессию PD-L1 определяют по проценту опухолевых клеток, демонстрирующих гистологические признаки окрашивания поверхностной клеточной мембраны. Случай, когда такие опухолевые клетки на срезе опухолевой ткани составляют по меньшей мере 1% общего числа опухолевых клеток, определяют как PD-L1-положительный.
В другом методе количественную оценку экспрессии PD-L1 на срезе опухолевой ткани проводят в опухолевых клетках, а также в инфильтрирующих иммунных клетках. Процент опухолевых клеток и инфильтрирующих иммунных клеток, демонстрирующих окрашивание мембраны, учитывают по отдельности как менее 1%, от 1% до 50% и от 50% до 100%. Для опухолевых клеток экспрессию PD-L1 считают отрицательной при показателе менее 1% и положительной при показателе более 1%.
В некоторых воплощениях настоящего изобретения экспрессия PD-L1 1% или более в срезе опухолевой ткани субъекта не обеспечивает достижения лучшего полезного эффекта по сравнению с экспрессией PD-L1 в срезе опухолевой ткани субъекта менее 1%. В некоторых предпочтительных воплощениях рак представляет собой солидную опухоль. В некоторых конкретных воплощениях рак представляет собой рак пищевода. В качестве предпочтительного воплощения, рак представляет собой ПРП.
«Критерии эффективности RECIST 1.1», описанные здесь, относятся к определению целевого очага и нецелевых очагов, описанному в Eisenhauver et al., Е.А. et al., Eur. J Cancer 45:228-247(2009), в контексте исходных измерений.
Термин стандартный показатель «ECOG» представляет собой индикатор общего состояния здоровья и переносимости лечения у пациентов, исходя из их физической силы. При оценке физической силы стандартный показатель ECOG составляет 0 баллов, 1 балл, 2 балла, 3 балла, 4 балла и 5 баллов. Показатель 0 означает полное сохранение нормальной способности к передвижению без отличий от способности к передвижению до начала заболевания. Показатель 1 означает, что человек может свободно ходить и переносить легкую физическую нагрузку, включая обычную домашнюю или офисную работу, но не тяжелую физическую нагрузку.
«Продолжительный ответ» относится к продолжительному терапевтическому эффекту после прекращения лечения терапевтическим агентом или комбинированной терапии, описанных здесь. В некоторых воплощениях продолжительность продолжительного ответа по меньшей мере равна продолжительности лечения или превышает продолжительность лечения по меньшей мере в 1,5, 2,0, 2,5 или 3 раза.
«Срез ткани» относится к отдельной части или фрагменту образца ткани, такому как тонкий слой ткани, отсеченный от образца нормальной ткани или опухоли.
При использовании здесь «лечение» рака относится к применению схемы лечения, описанной здесь (например, к введению антитела против PD-1 или к проведению комбинированной терапии антителом против PD-1 с ингибитором CDK4/6 или ингибитором FGF/FGFR), у субъекта, имеющего рак, или у субъекта, у которого диагностирован рак, для достижения по меньшей мере одного положительного терапевтического эффекта (например, уменьшения числа раковых клеток, уменьшения объема опухоли, уменьшения интенсивности инфильтрации периферических органов раковыми клетками или уменьшения интенсивности метастазирования опухоли или роста опухоли). Положительные терапевтические эффекты при раке могут быть измерены множеством методов (см. W.A. Weber, J. Nucl. Med., 50:1S-10S (2009)). Например, согласно критериям NCI, минимальным уровнем противоопухолевой активности является Т/С для ингибирования роста опухоли 42% или менее. Принято считать, что Т/С (%) равно отношению медианного объема опухоли при лечении к медианному объему опухоли в контроле, умноженному на 100. В некоторых воплощениях терапевтический эффект, достигаемый с применением комбинации по настоящему изобретению, представляет собой любое из ЧО, ПО, ОО, ВБП, ВБЗ и ОВ. ВБП (также называемая «временем до прогрессирования опухоли») относится к продолжительности времени в течение и после лечения, на протяжении которого рак не растет, и включает время, на протяжении которого у пациента отмечают ПО или ЧО, и время, на протяжении которого у пациента отмечают СЗ. ВБЗ относится к продолжительности времени в течение и после лечения, на протяжении которого у пациента нет заболевания. ОВ относится к продолжительности жизни в сравнении с ожидаемой исходно или продолжительностью жизни индивида или пациента, не получавшего лечения. В некоторых воплощениях ответ на комбинацию по настоящему изобретению представляет собой любое из ЧО, ПО, ВБП, ВБЗ, ОО и ОВ согласно оценке с применением критериев оценки эффективности RECIST 1.1. Схема введения комбинации по настоящему изобретению, эффективная в лечении пациента, имеющего рак, может варьировать в зависимости от множества факторов, таких как состояние заболевания, возраст, масса тела пациента и способность терапии вызывать противораковый ответ у субъекта. Воплощения настоящего изобретения могут не достигать эффективного положительного терапевтического эффекта у каждого субъекта, но должны быть эффективны и достигать положительного терапевтического эффекта у статистически значимого числа субъектов.
Термины «способ введения» и «схема введения» использованы взаимозаменяемо и относятся к дозе и времени применения каждого терапевтического агента в комбинации по настоящему изобретению.
«Опухоль», применительно к субъекту у которого диагностирован или подозревают рак, относится к злокачественной или потенциально злокачественной опухоли или опухолевой массе любого размера и включает первичные опухоли и вторичные опухоли. Солидные опухоли обычно не содержат областей аномального роста или масс ткани в областях кист или скопления жидкости. Различные типы солидных опухолей называют по типу образующих их клеток. Примерами солидных опухолей являются саркомы, рак и лимфомы. Опухоли крови обычно не образуют солидных опухолей.
«Опухолевая нагрузка» относится к общему количеству опухолевой массы, распределенной по организму. Опухолевая нагрузка относится к общему числу раковых клеток или общему размеру опухоли в организме. Опухолевая нагрузка может быть определена множеством методов, известных в данной области, таких как измерение размера опухоли с использованием штангенциркулей после удаления опухоли у субъекта или с применением методик визуализации (например, ультразвукового исследования, остеосцинтиграфии, компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ)) при нахождении опухоли in vivo.
Термин «размер опухоли» относится к общему размеру опухоли, который может быть измерен как длина и ширина опухоли. Размер опухоли может быть определен множеством методов, известных в данной области, таких как измерение размера опухоли с использованием штангенциркулей после удаления опухоли у субъекта или с применением методик визуализации (например, остеосцинтиграфии, ультразвукового исследования, КТ или МРТ) при нахождении опухоли in vivo.
Термин «опухолевая мутационная нагрузка (ОМН)» относится к общему числу ошибок кодирования генов, замен оснований, генных вставок или делеционных ошибок, выявленных в соматической клетке на миллион оснований. В некоторых воплощениях настоящего изобретения опухолевую мутационную нагрузку (ОМН) оценивают анализом соматических мутаций, включая замены кодирующих оснований и вставки на миллион пар оснований в изучаемых панельных последовательностях. В некоторых воплощениях настоящего изобретения опухолевая мутационная нагрузка (ОМН) у субъекта, составляющая 12 или более мутаций на м.п.о., не обеспечивает достижения лучшего полезного эффекта по сравнению с опухолевой мутационной нагрузкой (ОМН) у субъекта, составляющей менее 12 мутаций на м.п.о. В некоторых предпочтительных воплощениях рак представляет собой солидную опухоль. В некоторых конкретных воплощениях рак представляет собой рак пищевода. В качестве предпочтительного воплощения, рак представляет собой ПРП.
Термин «амплификация генов» относится к процессу, при котором происходит избирательное увеличение числа копий гена, кодируемого определенным белком, без пропорционального увеличения числа других генов. В естественных условиях амплификация генов происходит посредством вырезания повторяющихся последовательностей гена из хромосомы с последующей внехромосомной репликацией в плазмиде или посредством транскрипции всех повторяющихся последовательностей рибосомальной РНК с получением РНК-транскриптов и их последующей транскрипцией с получением дополнительных копий исходной молекулы ДНК. В некоторых примерах настоящего изобретения раскрыто секвенирование генов. В некоторых воплощениях настоящего изобретения субъект, описанный здесь, имеет определенные уникальные амплификации генов. В некоторых предпочтительных воплощениях субъект имеет амплификацию генов хромосомной области 11q13. В некоторых других предпочтительных воплощениях субъект имеет амплификацию генов CDK4/6; в некоторых других предпочтительных воплощениях субъект имеет амплификацию генов FGF3/4/19. В качестве предпочтительного воплощения, субъект с раком пищевода имеет амплификацию генов CDK4/6. В качестве предпочтительного воплощения, субъект с раком пищевода имеет амплификацию генов FGF3/4/19. В некоторых воплощениях пациент с опухолью имеет амплификацию генов хромосомной области 11q13, указывающую на лучший терапевтический эффект при лечении (а) ингибитором CDK4/6 и/или ингибитором FGF/FGFR самими по себе или (б) антителом против PD-1 или его антигенсвязывающим фрагментом в комбинации с одним из или в комбинации с более чем одним из ингибитора CDK4/6 и/или ингибитора FGF/FGFR. В некоторых воплощениях пациент с опухолью имеет амплификацию генов хромосомной области 11q13, указывающую на лучший терапевтический эффект при лечении посредством (а) введения антитела против PD-1 или его антигенсвязывающего фрагмента самих по себе или (б) введения антитела против PD-1 или его антигенсвязывающего фрагмента в комбинации с одним из или в комбинации с более чем одним из ингибитора CDK4/6 и/или ингибитора FGF/FGFR.
Термин «CDK (циклинзависимые киназы)» представляет собой группу сериновых/треониновых протеинкиназ, которые управляют клеточным циклом посредством фосфорилирования сериновых/треониновых белков в результате синергического взаимодействия с циклином и являются важными факторами регуляции клеточного цикла. Семейство CDK имеет 8 типов, включающие CDK1-8, каждый из которых связывается с разными типами циклинов, образуя комплекс, регулирующий переход клеток из фазы G1 в фазу S или из фазы G2 в фазу М и выход из фазы М. В настоящее время ингибиторы CDK4/6, утвержденные FDA для коммерческого использования, включают главным образом рибоциклиб и палбоциклиб, и многие ингибиторы CDK4/6 находятся на стадии клинических исследований.
Термин «FGF» представляет собой семейство белков, являющихся факторами роста фибробластов, включающее в общей сложности 23 представителя, а именно FGF1-23. Исходя из их различных механизмов действия, FGF можно разделить на три типа: эндокринные (FGF15/19/21/23), паракринные (FGF1-10, FGF16-18, FGF20, FGF22) и цитокринные (FGF11/12/13/14). Паракринные FGF регулируют биологическую активность с использованием HS в качестве кофактора, специфически связываясь с рецепторами FGF (рецепторы факторов роста фибробластов, FGFR) на поверхностях клеток. FGFR включают 4 основных типа: FGFR1, FGFR2, FGFR3 и FGFR4. Ингибиторов FGF/FGFR в настоящее время в продаже нет; ингибитору VEGFR/PDGFR/FGFR от Boehringer Ingelheim нинтеданибу, предназначенному для лечения рака печени, немелкоклеточного рака легкого и идиопатического фиброза, FDA присвоило статус прорывной терапии в 2014 г., а луцитаниб проходит в настоящее время клинические исследования в Китае.
Термин «иммуногистохимия (ИГХ)» относится к методу определения антигенов (полипептидов и белков) в клетках ткани посредством проявления хромогенных агентов (флуоресцеинов, ферментов, ионов металлов, изотопов), которыми мечены антитела, с применением химического взаимодействия, основанного на принципе специфическиго связывания антигенов и антител, и проведения локализованных качественных и относительных количественных исследований этих антигенов. В некоторых воплощениях настоящего изобретения образец опухолевой ткани субъекта анализируют на предмет экспрессии PD-L1 перед лечением антителом против PD-1, проводя окрашивание антителом против человеческого PD-L1 SP142 от Roche (номер по каталогу М4422). В некоторых воплощениях опухолевые клетки с окрашиванием мембраны 1% или более определяют как PD-L1-положительные.
Фармацевтическая композиция и доза
Терапевтический агент по настоящему изобретению может входить в состав фармацевтической композиции, такой как фармацевтическая композиция, содержащая антитело против PD-1, описанное здесь, и/или дополнительный противораковый агент, отличный от антитела против PD-1, и дополнительный фармацевтически приемлемый носитель. При использовании здесь «фармацевтически приемлемый носитель» включает все и любые растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты, агенты, задерживающие всасывание, и тому подобные, являющиеся физиологически совместимыми. Предпочтительно, носитель, подходящий для композиции, содержащей антитело против PD-1, подходит для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения, такого как инъекционное или инфузионное введение, в то время как носитель, подходящий для композиции, содержащей дополнительный противораковый агент, подходит для парентерального введения, такого как пероральное введение. Фармацевтическая композиция по настоящему изобретению может содержать одно или более чем одно из фармацевтически приемлемых солей, антиоксидантов, воды, неводных носителей и/или адъювантов, таких как консервант, увлажняющий агент, эмульгатор и диспергатор.
Схему введения корректируют для обеспечения оптимального желаемого ответа, такого как максимальный терапевтический ответ и/или минимальный нежелательный эффект. Доза антитела против PD-1 при введении в комбинации с другим противораковым агентом может входить в диапазон от примерно 0,01 мг/кг массы тела до примерно 20 мг/кг массы тела, от примерно 0,1 мг/кг массы тела до примерно 10 мг/кг массы тела, или может представлять собой фиксированную дозу 120 мг, 240 мг, 360 мг или 480 мг. Например, доза может составлять примерно 0,1 мг/кг массы тела, примерно 0,3 мг/кг массы тела, примерно 1 мг/кг массы тела, примерно 2 мг/кг массы тела, примерно 3 мг/кг массы тела, примерно 5 мг/кг массы тела или примерно 10 мг/кг массы тела. Схемы введения обычно разрабатывают для достижения экспозиции, приводящей к продолжительной занятости рецепторов (receptor occupancy, RO), исходя из типичных фармакокинетических свойств антитела. Типичная схема введения может включать введение примерно один раз в неделю, примерно один раз в две недели, примерно один раз в три недели, примерно один раз в четыре недели, примерно один раз в месяц или более продолжительный период времени. В некоторых воплощениях антитело против PD-1 вводят индивиду примерно один раз в две недели.
Схема введения дополнительного противоракового агента варьирует для разных лекарственных средств.
В некоторых воплощениях настоящего изобретения схема введения ингибитора CDK4/6 или ингибитора FGF/FGFR варьирует для разных подтипов. В некоторых воплощениях, для комбинированной терапии антителом против PD-1 с ингибитором CDK4/6 или ингибитором FGF/FGFR, ингибитор CDK4/6 или ингибитор FGF/FGFR вводят в его утвержденной или рекомендованной дозе, и лечение продолжают до появления клинических эффектов или до неприемлемой токсичности или прогрессирования заболевания.
Способ по настоящему изобретению
Настоящее изобретение относится к способам лечения пациента, имеющего рак, включающим введение пациенту, имеющему рак, (а) терапевтически эффективного количества антитела против PD-1 или его антигенсвязывающего фрагмента самих по себе или (б) терапевтически эффективного количества антитела против PD-1 или его антигенсвязывающего фрагмента, возможно, в комбинации с одним из или в комбинации с более чем одним из дополнительных противораковых агентов, отличных от антитела против PD-1 и его антигенсвязывающего фрагмента.
В определенных воплощениях пациент, имеющий рак, подходящий для введения (а) терапевтически эффективного количества антитела против PD-1 или его антигенсвязывающего фрагмента самих по себе или (б) терапевтически эффективного количества антитела против PD-1 или его антигенсвязывающего фрагмента, возможно, в комбинации с одним из или в комбинации с более чем одним из дополнительных противораковых агентов, отличных от антитела против PD-1 и его антигенсвязывающего фрагмента, описанный здесь, предпочтительно представляет собой пациента, имеющего рак, у которого не выявлено амплификации генов хромосомной области 11q13. Таким образом, в некоторых воплощениях способ лечения рака также включает секвенирование пациента, имеющего рак.
В определенных воплощениях настоящее изобретение относится к способу лечения пациента, имеющего рак, включающему введение пациенту, имеющему рак, (а) терапевтически эффективного количества дополнительного противоракового агента самого по себе или (б) терапевтически эффективного количества антитела против PD-1 или его антигенсвязывающего фрагмента, возможно, в комбинации с одним из или в комбинации с более чем одним из дополнительных противораковых агентов, отличных от антитела против PD-1.
В определенных воплощениях пациент, имеющий рак, подходящий для введения (а) терапевтически эффективного количества дополнительного противоракового агента или (б) терапевтически эффективного количества антитела против PD-1 или его антигенсвязывающего фрагмента, возможно, в комбинации с одним из или в комбинации с более чем одним из дополнительных противораковых агентов, отличных от антитела против PD-1, описанный здесь, предпочтительно представляет собой пациента, имеющего рак, у которого выявлена амплификация генов области 11q13, в частности пациента, имеющего рак, с амплификацией генов CDK4/6 или амплификацей генов FGF3/4/19. Таким образом, в некоторых воплощениях способ лечения рака также включает секвенирование пациента, имеющего рак.
В определенных воплощениях дополнительный противораковый агент представляет собой терапевтически эффективное количество ингибитора CDK4/6 и/или ингибитора FGF/FGFR.
В определенных воплощениях согласно настоящему изобретению предложен способ лечения индивида/пациента с раком пищевода. В некоторых воплощениях способ включает введение индивиду терапевтически эффективной дозы комбинации: (а) антитела или его антигенсвязывающего фрагмента, специфически связывающихся с рецептором PD-1 и ингибирующих активность PD-1; и (б) другой противораковой терапии. В одном воплощении способ включает введение индивиду эффективного количества комбинации: (1) стандартной терапии для лечения рака пищевода, как раскрыто здесь в другом разделе; или (2) дополнительного противоракового агента. В некоторых воплощениях дополнительный противораковый агент выбран из ингибитора CDK4/6 и/или ингибитора FGF/FGFR. Поскольку наиболее распространенным гистологическим подтипом рака пищевода у пациентов с раком пищевода является плоскоклеточный рак пищевода (ПРП), в некоторых воплощениях рак пищевода представляет собой плоскоклеточный рак пищевода (ПРП). В определенных воплощениях способ также включает секвенирование пациента перед введением терапевтического агента; исходя из результатов секвенирования, индивиду, не имеющему амплификации хромосомной области 11q13, вводят антитело против PD-1 или его антигенсвязывающий фрагмент сами по себе, возможно, в комбинации с одним из или в комбинации с более чем одним из ингибитора CDK4/6 и/или ингибитора FGF/FGFR, индивиду, имеющему амплификацию хромосомной области 11q13, в частности имеющему амплификацию генов CDK4/6 или амплификацию генов FGF3/4/19, вводят одно из или комбинацию более чем одного из ингибитора CDK4/6 и/или ингибитора FGF/FGFR сами по себе, возможно, в комбинации с антителом против PD-1 или его антигенсвязывающий фрагментом.
Антитело против PD-1, подходящее для способа по настоящему изобретению
Антитело к PD-1, подходящее для способа по настоящему изобретению, оказывает иммуносупрессивный эффект, достигаемый связыванием с PD-1 с высокой специфичностью и аффинностью, блокировкой связывания PD-L1/2 с PD-1 и ингибированием передачи сигналов PD-1. В любом из вариантов терапии, раскрытых здесь, антитело против PD-1 включает антигенсвязывающий участок или фрагмент, связывающийся с рецептором PD-1 и демонстрирующий функциональные свойства, сходные с интактным антителом, применительно к ингибированию связывания с лигандом и повышающей регуляции иммунной системы. В некоторых воплощениях антитело против PD-1 или его антигенсвязывающий фрагмент представляет собой антитело против PD-1 или его антигенсвязывающий фрагмент, перекрестно конкурирующие с торипалимабом за связывание с человеческим PD-1. В других воплощениях антитело против PD-1 или его антигенсвязывающий фрагмент представляет собой химерное, гуманизированное или человеческое антитело или его антигенсвязывающий фрагмент. В определенных воплощениях для лечения индивида, являющегося человеком, антитело представляет собой гуманизированное антитело.
В некоторых воплощениях антитело против PD-1 или его антигенсвязывающий фрагмент содержит константную область тяжелой цепи человеческого IgG1 или IgG4. В некоторых воплощениях последовательность константной области тяжелой цепи IgG4 антитела против PD-1 или его антигенсвязывающего фрагмента содержит мутацию S228P, заменяющую сериновый остаток шарнирной области на пролиновый остаток, обычно присутствующий в соответствующем положении антитела изотипа IgG1. В определенных воплощениях любого из способов лечения, описанных здесь, включающих введение антитела против PD-1, антитело против PD-1 представляет собой торипалимаб. В некоторых воплощениях антитело против PD-1 выбрано из гуманизированных антител 38, 39, 41 и 48, описанных в WO 2014206107. В некоторых воплощениях антитело против PD-1 соответствует описаниям, приведенным в разделе «Антитело против PD-1» выше.
Ингибиторы CDK4/6, подходящие для способа по настоящему изобретению
В некоторых воплощениях настоящего изобретения для лечения опухолей дополнительный противораковый агент, то есть противораковый агент, отличный от антитела против PD-1, вводимый сам по себе или в комбинации с антителом против PD-1, представляет собой ингибитор CDK4/6. Ингибиторы CDK4/6, утвержденные в настоящее время FDA для коммерческого применения, включают главным образом: Verzenio (абемациклиб) от Eli Lilly, применяемый главным образом для лечения взрослых пациентов с распространенным или метастатическим раком молочной железы, положительным по рецепторам гормонов (HR) и отрицательным по рецептору эпидермального фактора роста человека 2-го типа (HER2), с прогрессированием заболевания после проведения эндокринной терапии; Kisqali (рибоциклиб) от Novartis, применяемый в комбинации с ингибитором ароматазы в качестве терапии первой линии у пациенток в постменопаузе с HR-положительным и HER2-отрицательным распространенным метастатическим раком молочной железы; и Ibrance (палбоциклиб) от Pfizer, применяемый в комбинации с летрозолом для лечения женщин в постменопаузе с метастатическим раком молочной железы, положительным по рецепторам эстрогенов (ER) и отрицательным по рецептору эпидермального фактора роста человека 2-го типа (HER2).
Ингибиторы FGF/FGFR, подходящие для способа по настоящему изобретению
В некоторых воплощениях настоящего изобретения для лечения опухолей дополнительный противораковый агент, то есть противораковый агент, отличный от антитела против PD-1, вводимый сам по себе или в комбинации с антителом против PD-1, представляет собой ингибитор FGF/FGFR. Ингибиторов FGF/FGFR в настоящее время в продаже нет; ингибитору VEGFR/PDGFR/FGFR от Boehringer Ingelheim нинтеданибу, предназначенному для лечения рака печени, немелкоклеточного рака легкого и идиопатического фиброза, FDA присвоило статус прорывной терапии в 2014 г., а луцитаниб проходит в настоящее время клинические исследования в Китае. Применения, варианты терапии, лекарственные средства и наборы
В одном аспекте настоящего изобретения предложен способ лечения рака у индивида, включающий проведение у индивида комбинированной терапии, включающей антитело против PD-1 или его антигенсвязывающий фрагмент и одно из или комбинацию более чем одного из ингибитора CDK4/6 и ингибитора FGF/FGFR.
Комбинированная терапия может также включать один или более чем один дополнительный терапевтический агент. Дополнительный терапевтический агент может представлять собой химиотерапевтический агент или биотерапевтический агент, отличный от ингибитора CDK4/6 и ингибитора FGF/FGFR.
В соответствии со стандартной фармацевтической практикой, каждый терапевтический агент в комбинированной терапии по настоящему изобретению может быть введен сам по себе или в фармацевтической композиции, содержащей терапевтический агент и один или более чем один фармацевтически приемлемый носитель, эксципиент и разбавитель.
Каждый терапевтический агент в комбинированной терапии по настоящему изобретению может быть введен одновременно или последовательно в любом порядке. Терапевтические агенты в комбинированной терапии вводят в разных лекарственных формах, например, одно лекарственное средство представляет собой таблетку или капсулу, а другое лекарственное средство представляет собой стерильную жидкость, и/или в разное время, например, химиотерапевтический агент вводят по меньшей мере один раз в сутки, а биологический терапевтический агент вводят нечасто, например, один раз в неделю, или один раз в две недели, или один раз в три недели.
В некоторых воплощениях ингибитор CDK4/6 и ингибитор FGF/FGFR вводят перед введением антитела против PD-1, в то время как в других воплощениях ингибитор CDK4/6 и ингибитор FGF/FGFR вводят после введения антитела против PD-1.
В некоторых воплощениях по меньшей мере один из терапевтических агентов в комбинированной терапии вводят с применением такой же схемы введения (доза, частота, продолжительность лечения), как при применении этого лекарственного средства в виде монотерапии для лечения того же вида рака.
Каждый низкомолекулярный терапевтический агент в комбинированной терапии, описанной здесь, может быть введен перорально или парентерально (например, внутривенным, внутримышечным, внутрибрюшинным, подкожным, ректальным, местным или трансдермальным путем введения).
Комбинированная терапия, описанная здесь, может быть проведена до или после хирургического вмешательства и может быть проведена до, во время или после лучевой терапии.
В некоторых воплощениях комбинированную терапию, описанную здесь, проводят у пациента, не получавшего предшествующего лечения биологическим агентом или химиотерапевтический агентом. В других воплощениях комбинированную терапию проводят у пациента, у которого не удалось достичь продолжительного ответа после лечения биологическим агентом или химиотерапевтическим агентом.
Комбинированная терапия по настоящему изобретению может быть применена в лечении опухолей, обнаруженных пальпацией или методиками визуализации, известными в данной области, такими как МРТ, ультразвуковое исследование или КТ.
Схемы введения для комбинированной терапии по настоящему изобретению выбирают в зависимости от ряда факторов, включая, без ограничения, показатель серологической или тканевой конверсии, степень выраженности симптомов, иммуногенность и доступность целевых клеток, тканей и органов у индивида, проходящего лечение. Предпочтительно, схема введения разработана для доставки максимального количества каждого терапевтического агента пациенту, исходя из приемлемой степени побочных эффектов. Таким образом, доза и частота введения каждого из биотерапевтических агентов и химиотерапевтических агентов в комбинированной терапии зависит от конкретного терапевтического агента, степени тяжести рака, по поводу которого проводят лечение, и характеристик пациента.
Антитело против PD-1 или его антигенсвязывающий фрагмент, описанные здесь, и одно из или комбинация более чем одного из ингибитора CDK4/6 и ингибитора FGF/FGFR могут быть представлены в форме набора, содержащего первый контейнер, второй контейнер и листок-вкладыш.
Первый контейнер содержит по меньшей мере одну дозу лекарственного средства, содержащего антитело против PD-1 или его антигенсвязывающий фрагмент, второй контейнер содержит по меньшей мере одну дозу лекарственного средства, содержащего одно из или комбинацию более чем одного из ингибитора CDK4/6 и ингибитора FGF/FGFR, и листок-вкладыш или этикетка содержат инструкции по применению лекарственного средства в лечении рака. Набор может дополнительно содержать другие материалы, которые могут быть использованы при введении лекарственного средства, такие как разбавители, фильтровальная бумага, пакеты для проведения внутривенного введения, а также нити, иглы и шприцы. Способ прогнозирования терапевтического эффекта антитела против PD-1 на рак
Способ прогнозирования эффекта антитела против PD-1 или его антигенсвязывающего фрагмента, в частности торипалимаба, при их введении самих по себе или в комбинации для лечения рака у индивида, описанный здесь, включает секвенирование индивида перед лечением. В некоторых воплощениях рак представляет собой рак пищевода; в других предпочтительных воплощениях рак представляет собой ПРП.
В одном воплощении способ прогнозирования, описанный здесь, представляет собой генетическое исследование индивида перед лечением для оценки наличия или отсутствия амплификации генов хромосомной области 11q13. В одном воплощении индивид не имеет амплификации генов хромосомной области 11q13. В другом воплощении индивид имеет амплификацию генов хромосомной области 11q13. В одном воплощении индивид имеет амплификацию гена CCND1 и/или амплификацию генов FGF/FGFR. В одном воплощении индивид имеет амплификацию генов CDK4/6 и/или амплификацию генов FGF3/4/19.
Настоящее изобретение также включает способ прогнозирования терапевтического эффекта у пациента с опухолью, которому вводят антитело против PD-1 или его антигенсвязывающий фрагмент сами по себе или в комбинации, с использованием генов хромосомной области 11q13. Отсутствие амплификации генов хромосомной области 11q13 указывает на то, что пациент с опухолью является подходящим для лечения введением антитела против PD-1 или его антигенсвязывающего фрагмента самих по себе или в комбинации.
В определенных воплощениях согласно настоящему изобретению также предложено применение реагента для выявления биомаркеров в изготовлении набора для прогнозирования терапевтического эффекта антитела против PD-1 на рак. Такие реагенты включают, например, реагенты для выявления присутствия или отсутствия амплификации генов хромосомной области 11q13 в генах индивида. Предпочтительно, такие агенты включают, например, агенты для выявления присутствия или отсутствия амплификации гена CCND1 и/или амплификации генов FGF/FGFR в генах индивида. Более предпочтительно, такие реагенты включают, например, реагенты для выявления присутствия или отсутствия амплификации генов CDK4/6 и/или амплификации генов FGF3/4/19 в генах индивида.
Настоящее изобретение также включает применение реагента для выявления генов хромосомной области 11q13 в изготовлении набора для прогнозирования терапевтического эффекта антитела против PD-1 на рак. Такие реагенты включают, без ограничения, реагенты, обычно используемые в анализах, включая, без ограничения, праймеры, зонды, реагенты, необходимые для ПЦР, и тому подобное.
Сокращения
В описании и примерах настоящего изобретения использованы следующие сокращения.
Далее настоящее изобретение пояснено следующими примерами, которые не следует трактовать как ограничивающие настоящее изобретение. Содержание всех источников, процитированных в данной заявке, прямо включено сюда посредством ссылки.
ПРИМЕРЫ
Пример 1. Клиническое исследование антитела против PD-1 самого по себе для лечения опухолей
Критерии включения: подходящие субъекты должны (1) быть в возрасте от 18 до 75 лет, (2) иметь гистологически и/или цитологически подтвержденный распространенный и/или метастатический ПРП, (3) представлять собой пациентов со все еще прогрессирующим распространенным ПРП, прошедших один или по меньшей мере один курс лечения (включая, без ограничения, химиотерапию или лучевую терапию), (4) иметь показатель ECOG 0 или 1.
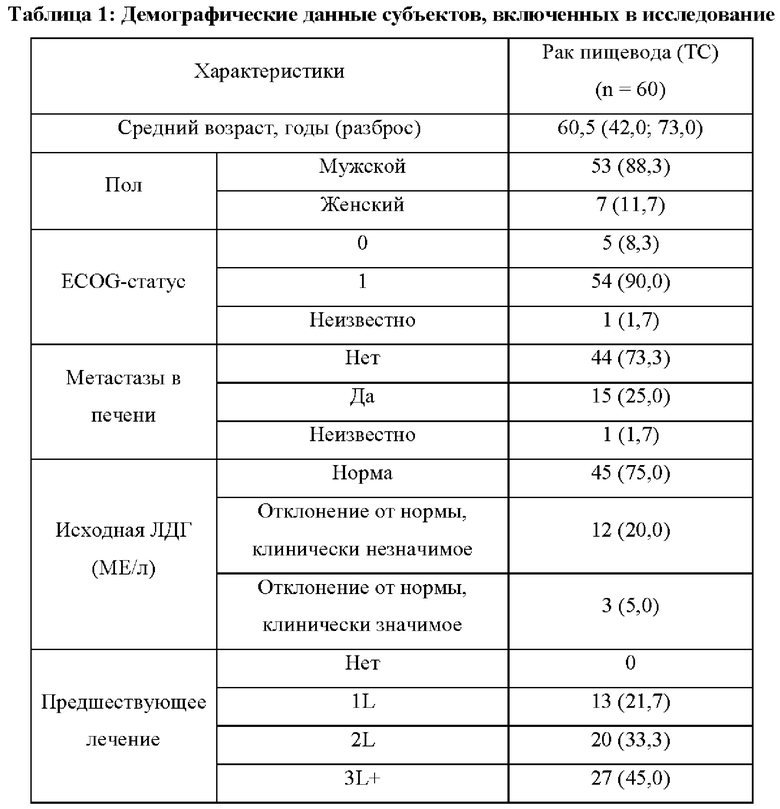
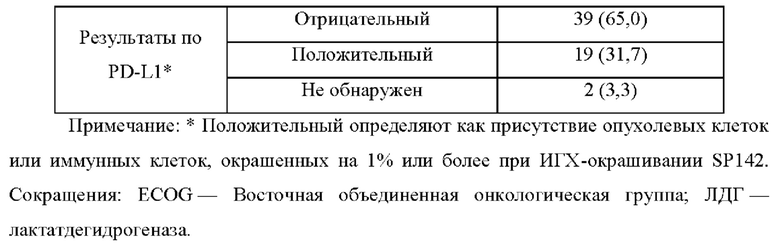
Субъекты должны иметь очаг, поддающийся оценке по критериям RECIST v1.1, не иметь других предшествующих или сопутствующих злокачественных опухолей, не иметь каких-либо активных аутоиммунных заболеваний или аутоиммунных заболеваний в анамнезе, не иметь сопутствующих заболеваний, требующих длительной иммуносупрессивной лекарственной терапии, не иметь предшествующего лечения антителами против CTLA4, против PD-1 или против PD-L1, не иметь активного инфекционного гепатита В или С, не быть беременными и не кормить грудью и не должны проходить противоопухолевую терапию, лучевую терапию или какое-либо хирургическое лечение в течение последних 4 недель перед включением в исследование. Демографические данные субъектов, включенных в исследование, показаны в Таблице 1.
Исследуемое лекарственное средство: антитело против PD-1 торипалимаб (Toripalimab) (WO 2014206107).
Группы введения антитела против PD-1 для данного исследования: сначала группа введения в дозе 3 мг/кг. После включения в исследование субъекты будут получать лечение один раз в 2 недели (Q2W) на протяжении цикла продолжительностью 4 недели до прогрессирования заболевания, появления непереносимой токсичности, отзыва согласия субъектом, отсутствия дальнейшей пользы по мнению исследователя или летального исхода.
Дизайн клинического исследования
Данное исследование представляет собой открытое многоцентровое клиническое исследование Ib/II фазы, разделенное на 8 независимых когорт, и содержание настоящего изобретения сосредоточено на получении результатов когорты 2 для оценки безопасности, переносимости и противоопухолевой активности антитела против PD-1 в лечении распространенного ПРП, рефрактерного к химиотерапии.
С 9 марта 2017 г. до 24 августа 2017 г. в исследование были включены в общей сложности 60 субъектов с распространенным ПРП, 59 из которых получили лечение торипалимабом, а 1 отозвал согласие до начала лечения.
Плановая доза составляла 3 мг/кг один раз в 2 недели.
1.1. Исследование безопасности
По состоянию на 31 декабря 2018 г., через 16 месяцев после включения последнего пациента, в анализ безопасности были включены 59 пациентов, у которых было проведено по меньшей мере одно введение торипалимаба. Нежелательные явления, связанные с лечением (TRAE), были отмечены у 56 из 59 пациентов (94,9%), но большинство из этих TRAE были 1 или 2 степени (Таблица 2). Частые TRAE включают уменьшение массы тела (18,6%), анемию (18,6%), потерю аппетита (18,6%), лихорадку (16,9%), кашель (16,9%), лейкопению (15,3%), повышение ACT (13,6%), гипотироидизм (13,6%), повышение АЛТ (11,9%), общую слабость (11,9%), тошноту (11,9%), повышение общего билирубина (10,2%), низкое содержание гемоглобина (10,2%) и запор (10,2%) (Таблица 2). TRAE 3 и более высокой степени наблюдали у 19 (32,2%) пациентов. Из них у 11 (18,6%) пациентов развились TRAE 3 степени, включая 2 случая анемии, 2 случая гипонатриемии, 1 случай гипертензии, 1 случай анорексии, 1 случай дисфагии, 1 случай стеноза пищевода, 1 случай общей слабости, 1 случай гидроперикарда, 1 случай гиперкальциемии, 1 случай лейкопении, 1 случай инфекции верхних дыхательных путей и 1 случай инфекции шеи. TRAE 4 степени наблюдали у 2 (3,4%) пациентов, включая 1 случай гиперурикемии и 1 случай параплегии. Все шесть летальных исходов, связанных с лечением, были, вероятно, не связаны с лечением, включая 1 случай кахексии, 2 случая пневмонии и 3 случая неизвестной этиологии. У 14 (23,7%) пациентов вследствие TRAE лечение было полностью прекращено; у 6 (10,2%) пациентов вследствие TRAE была снижена доза. Видно, что торипалимаб имеет контролируемую безопасность у пациентов с ПРП.
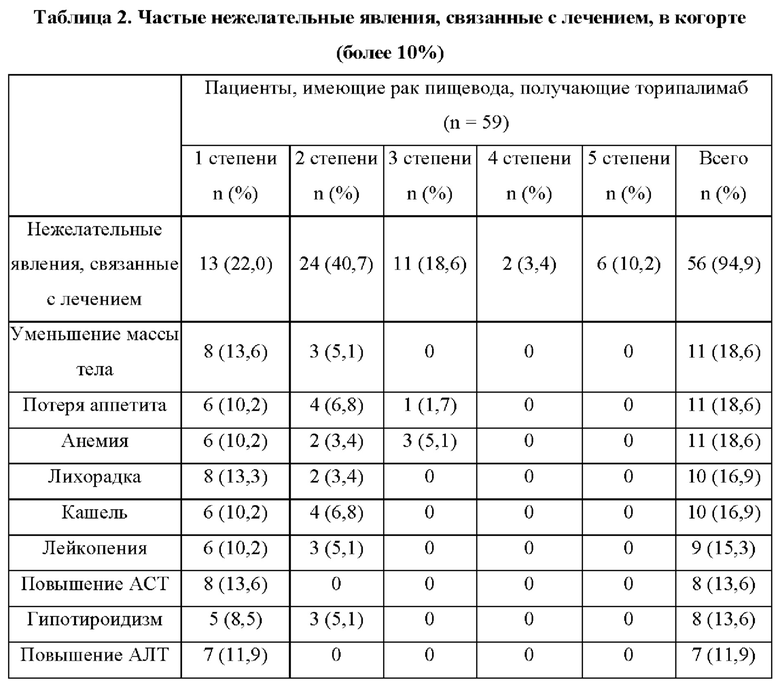
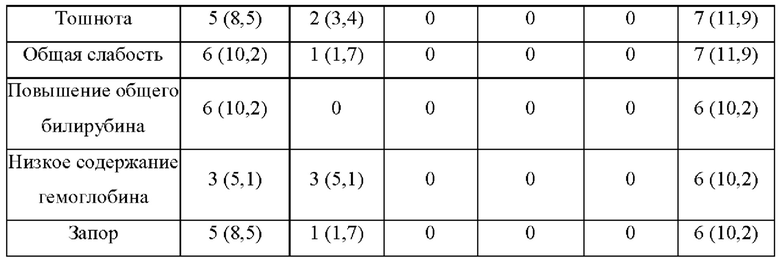
1.2. Исследование противоопухолевой активности
По состоянию на 31 декабря 2018 г. умерли 67,8% (40/59) субъектов. 5,1% (3/59) были недоступны для дальнейшего наблюдения, 11,9% (7/59) отозвали согласие, у 74,5% (44/59) лечение было прекращено, и 8,5% (5/59) продолжали участие в исследовании.
Медианная продолжительность лечения составила 3,5 месяца (от 0,1 до 19,1 месяца).
По состоянию на дату прекращения сбора данных у 59 пациентов были отмечены 1 случай ПО, 10 случаев ЧО (включая 2 случая недиагностированного ЧО) и 17 случаев СЗ, согласно оценке, проводимой исследователями с применением RECIST v1.1. Частота оптимального ответа составляла 18,6% (95%-й ДИ от 9,7 до 30,9), и ЧКЗ составляла 47,5% (95%-й ДИ от 34,3 до 60,9). У пациента с ПО ранее был проведен 1 курс химиотерапии без лучевой терапии. У 10 пациентов с ЧО ранее была проведена лучевая терапия, у 4 из них были проведены 2 предшествующих курса системной химиотерапии, а у других 6 пациентов были проведены 3 или 4 предшествующих курса химиотерапии. Выживаемость без прогрессирования и общая выживаемость
Подтвержденная ЧОО составляла 15,3% (95%-й ДИ от 7,2 до 27,0). Среднее время ответа составляло 1,8 месяца. Медианная продолжительность ответа составляла
11.2 месяца. Произвольное уменьшение размера целевых очагов относительно исходного уровня наблюдали у 25 (42,4%) субъектов (ФИГ. 1А и 1В). Медианная ВБП составляла 2,1 месяца, и медианная ОВ составляла 6,9 месяца (ФИГ. 1С и 1D).
Пример 2. Исследование связи между экспрессией PD-L1 и терапевтическим эффектом антитела против PD-1 на опухоли Перед лечением торипалимабом в клиническом исследовании, описанном в Примере 1, у субъектов проводили архивную или свежую биопсию опухоли. PD-L1 выявляли в образцах опухолевой ткани, фиксированной в формалине и заключенной в парафин (FFPE), иммуногистохимическими (ИГХ) методами и верифицировали с использованием системы VENTANA Benchmark Ultra в лаборатории клинического центра (лаборатория Q2, Пекин). Иммуногистохимическое выявление PD-L1 проводили с использованием кроличьего моноклонального антитела против человеческого PD-L1 Spring Bioscience (Roche) (клон SP142, номер по каталогу М4422). Экспрессию PD-L1 на опухолевых клетках (ОК) и опухоль-инфильтрирующих иммунных клетках (ПК) оценивали сертифицированные патологи, используя окрашенную опухолевую ткань. PD-L1-положительный статус определяют как присутствие опухолевых клеток с интенсивностью окрашивания мембраны 1% или более или наличие интенсивности окрашивания PD-L1 в иммунных клетках, инфильтрирующих опухоль, занимающих 1% или более площади связанной с опухолью смежной околораковой стромальной области в опухоли, занятой опухолевыми клетками.
Определение экспрессии PD-L1 проводили в биоптатах опухолей, полученных у 57 субъектов из Примера 1. Были идентифицированы 19 (33,3%) образцов с положительной экспрессией PD-L1 и 38 (66,7%) образцов с отрицательной экспрессией PD-L1 (ФИГ. 2А).
PD-L1-положительный определяют как присутствие опухолевых клеток (ОК) или иммунных клеток (ИК), положительных на 1% или более при ИГХ-окрашивании SP142.
В данном исследовании значимых различий по ЧОО (15,8% против 18,4%) или ОВ (6,7 месяца против 6,9 месяца) между PD-L1-положительными пациентами и PD-L1-отрицательными субъектами не было (ФИГ. 2А, 2С и 2D). Медианная ВБП у PD-L1-положительных субъектов была численно больше, чем у PD-L1-отрицательных субъектов (3,4 месяца против 2,0 месяцев), однако это различие не было статистически значимым (р равно 0,85) (ФИГ. 2С).
Лишь у 5 (8,8%) субъектов в данном исследовании положительная экспрессия PD-L1 в биоптатах опухоли составляла более 5% (ФИГ. 2А). Клинический ответ у субъектов с экспрессией PD-L1 более 5% был лучше, чем у пациентов с низкой экспрессией или без экспрессии PD-L1 (ЧОО 40% и ЧКЗ 100% у PD-L1-положительных субъектов против ЧОО 15,4% и ЧКЗ 42,3% у отрицательных субъектов). Различие ЧОО не было статистически значимым (р равно 0,21), а различие ЧКЗ было статистически значимым (р равно 0,019).
Пример 3. Исследование связи между опухолевой мутационной нагрузкой (ОМН) и терапевтическим эффектом антитела против PD-1 на опухоли
Во время клинического исследования, описанного в Примере 1, биоптаты опухолей, полученные у 50 субъектов, подвергали полноэкзомному секвенированию (whole exome sequencing, WES). ОМН определяли анализом соматических мутаций в кодирующих областях генома человека. Достоверные результаты по ОМН были получены у 47 пациентов (Таблица 3).
В данном исследовании пациенты с ПРП обычно имели меньшую ОМН. Ни в одном из биоптатов не было более 20 мутаций на миллион пар оснований, и только в 13 биоптатах было по 10-20 мутаций на миллион пар оснований.
При пороговом значении 12 мутаций/м.п.о. у пациентов с ОМН, равной или превышающей 12 мутаций/м.п.о. (n равно 11), и у пациентов с ОМН менее 12 мутаций/м.п.о. (n равно 36) ЧОО была сходной (18,2% против 19,4%) (ФИГ. 2В). В группе с высокой ОМН (12 или более) ВБП (4,0 месяца против 1,9 месяца) и ОВ (11,5 месяца против 6,7 месяца) численно превосходили ВБП и ОВ в группе с низкой ОМН (менее 12), однако эти различия не были статистически значимыми (ФИГ. 2Е и 2F).
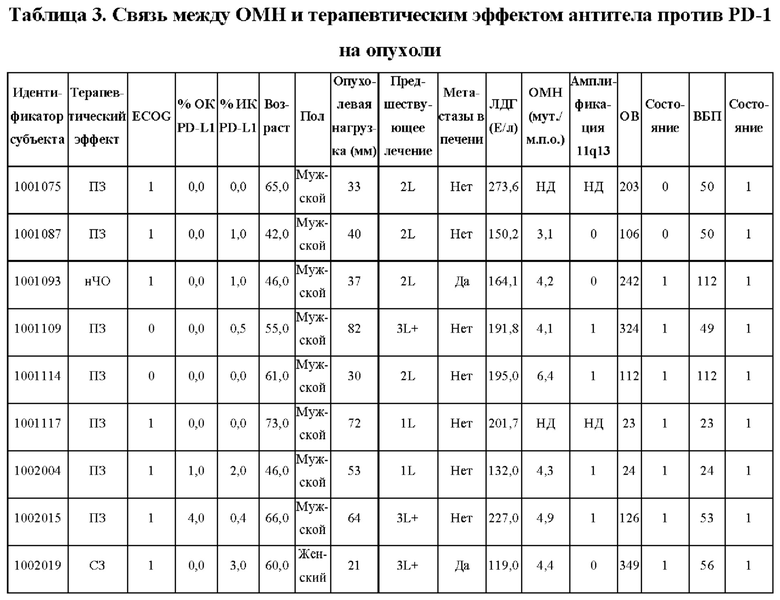
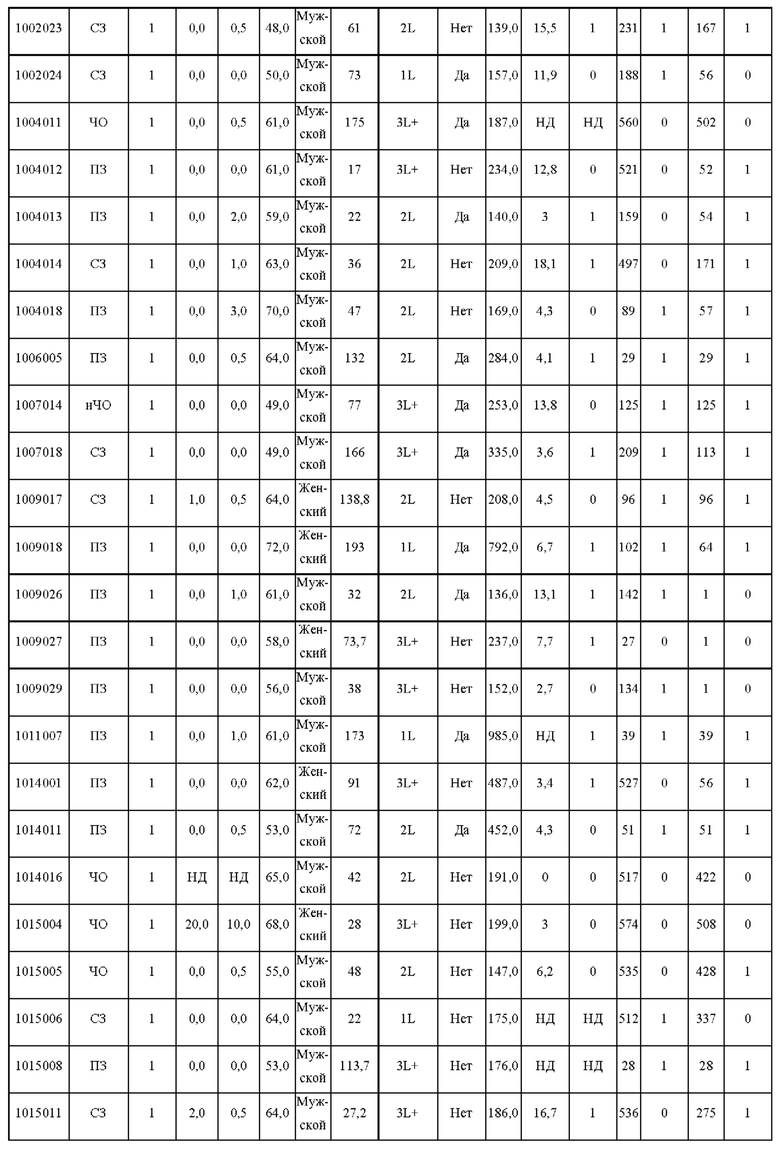
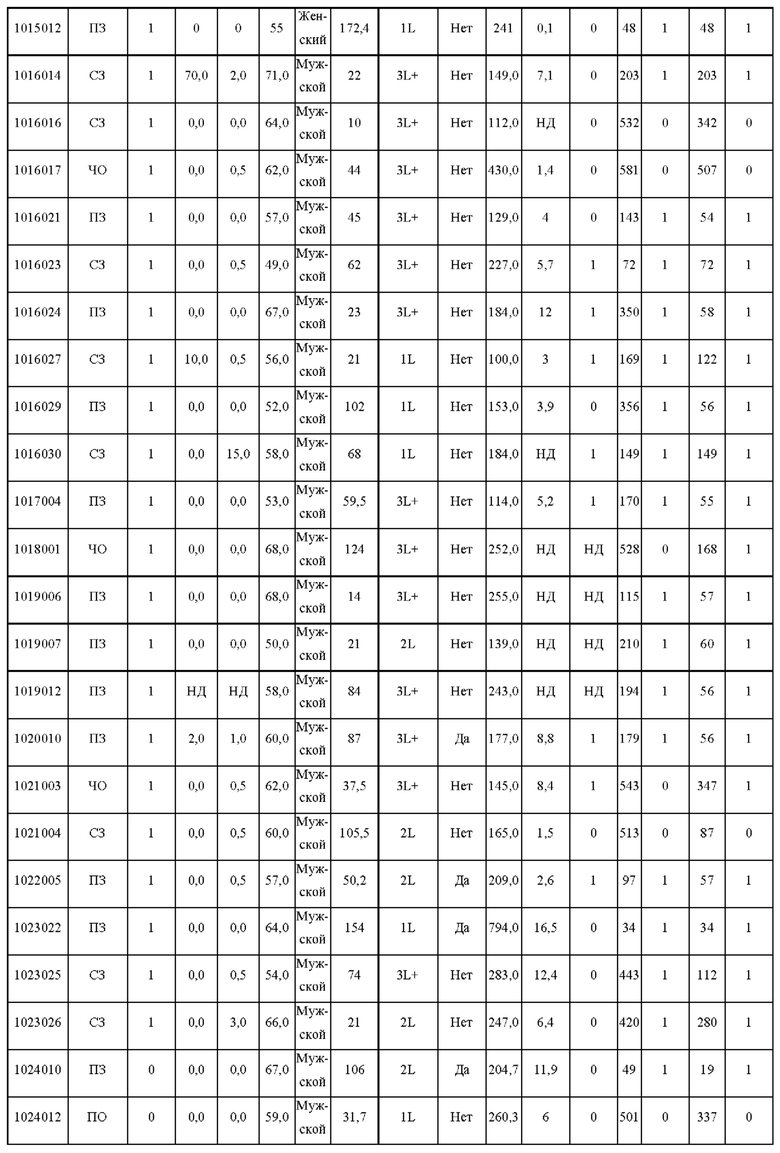
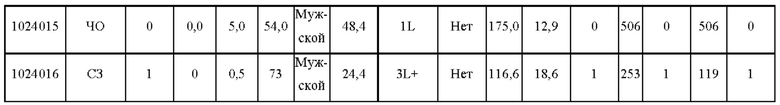
Пример 4. Мутационный профиль для лечения антителом против PD-1 и его связь с терапевтическим эффектом
4.1. Полноэкзомное секвенирование (WES) и анализ данных
Получали образцы опухолевой ткани и соответствующие образцы МКПК, проводили патологическое исследование 4 мкм срезов FFPE-образцов, окрашенных гематоксилином и эозином, для подтверждения того, что в каждом образце более 80% клеток имели ядро, а содержание опухолевой ткани составляло не менее 20%. Используя достаточное количество неокрашенных FFPE-срезов, выделяли не менее 200 нг ДНК. В качестве контроля использовали примерно 200 мкл МКПК, что обычно соответствует получению 1-5 мкг ДНК.
Получение библиотеки проводили ультразвуковой фрагментацией двуцепочечной ДНК до 250 п.о. Библиотеку конструировали концевой репарацией, добавлением dA и адаптерным лигированием с использованием набора SureSelect XT Library Prep или набора KAPA Hyper Prep (KAPA Biosystems) и затем проводили ПЦР-амплификацию и количественный анализ с использованием Qubit. Захват целевых областей проводили гибридизацией, следуя протоколу, и получали библиотеки. Считывание последовательностей проводили с использованием Illumina NovaSeq 6000 (Illumina Inc., Сан-Диего, штат Калифорния, США). Проводили проверку и контроль качества данных и применяли специально разработанные биоинформационные каналы для поиска SNV, длинных и коротких вставок и делеций, CNA, генных перестроек, ТМВ и MSI. В завершение, проводили клинический анализ всех выявленных мутаций в сравнении с собственной внутренней базой данных аннотаций. В соответствии с аннотированными мутациями, будет составлен подробный отчет, исходя из клинических исследований и литературы.
4.2. Идентификация соматического отношения сигнала к шуму, короткой индентации и изменений числа копий (SCNA)
Исходные прочитанные последовательности выравнивали с эталонной последовательностью генома человека (hg19) с использованием секвенатора Барроуза-Уилера (Burrows-Wheeler sequencer) и ПЦР-повторы удаляли с применением алгоритма маркерной репликации Пикара (Picard marker replication). Исходные сигналы SNV и S-вставок/делеций (S-indel) формировались по внутреннему алгоритму. Для подтверждения возможного сигнала было необходимо по меньшей мере 5 прочтений. Вариации с глубиной прочтения менее 50х, смещением цепи менее или более 90%, VAF менее 1% удаляли. SNP обычно определяют как частоты, превышающие 1,5%, из базы данных dbSNP (версия 147) или из проекта Exome Sequencing Project 6500 (ESP6500) или частоты, превышающие 1,5%, из проекта 1000 Genomes Project, которые исключают из дальнейшего рассмотрения. Продукты, обусловленные ошибками секвенирования или секвенируемыми популяциями, также исключают.
Для определения SCNA-событий результаты выравнивания в каждой экзонной области нормализовали, и полученные результаты дополнительно корректировали с учетом содержания GC и возможности картирования эталонного генома с использованием CNVKIT (версия 0.9.1). Полученный показатель репликации разбивали с применением циклического алгоритма двоичного разбиения. Долю аберрантных опухолевых клеток оценивали по аллельной частоте более чем 4000 секвенированных SNP (однонуклеотидных полиморфизмов) согласно ASCAT. Показатель числа копий в опухолевой ткани и соответствующем образце обычной крови рассчитывали посредством нормализации глубины и коррекции с учетом содержания GC и возможности картирования. Фрагмент считали увеличенным или делетированным, если log2 (показатель числа копий) составлял более 0,8 или не более -1.
Согласно геномной карте WES, в данном исследовании 5 основными мутациями в опухолевых биоптатах ПРП были миссенс-мутации или усечения ТР53 (р53) (76%), RYR2 (22%), NOTCH 1 (20%), LRP1B (17%) и TRIO (17%) (ФИГ. 3). Тем не менее, миссенс-мутации или усечения этих пяти генов или утрата других функциональных мутаций не были связаны с клиническим ответом.
Пример 5. Связь между амплификацией генов 11q13 и резистентностью к лечению антителом против PD-1
Полнотранскриптомное секвенирование (РНК-последовательность) проводили следующим методом. РНК выделяли из неокрашенных FFPE-срезов с использованием набора miRNeasy Kit (номер по каталогу 217504, Qiagen) и проводили дополнительную обработку для удаления рРНК с использованием набора NEBNext® rRNA Depletion Kit (номер по каталогу E6310L, New England Biolabs). кДНК первой и второй цепи синтезировали с использованием обратной транскриптазы M-MLV RT RNase (Н-) (номер по каталогу М3683, Promega) и набора NEB Second Strand mRNA Synthesis Kit (номер по каталогу E6111L, New England Biolabs), соответственно. кДНК-продукт обрабатывали ультразвуком с получением фрагмента размером примерно 200 п.о. (Covaris Е220). Библиотеку, лигированную с адаптером, конструировали из кДНК с использованием набора КАРА HyperPrep Kit (номер по каталогу 07962363001, Roche) и секвенировали на платформе NovaSeq 5000/6000. Относительную частоту каждого аннотированного транскрипта выражали в транскриптах на миллион (ТРМ) с log2-трансформацией перед анализом.
WES-анализ по Примеру 4 показал, что 24 (48,0%) из 50 биоптатов содержали амплификацию хромосомной области 11q13 (ФИГ. 4А). Анализ экспрессии матричной РНК дополнительно подтвердил амплификацию геномной ДНК, и уровни мРНК коррелировали с состоянием амплификации соответствующих генов данной области, включая CCND1 (циклин D1) и представителей семейства FGF (FGF3/4/19) (ФИГ. 4В). Важно, что у пациентов без амплификации 11q13 (n равно 26) частота объективного ответа (30,8% против 4,2%, р равно 0,024) (ФИГ. 5А) и ВБП (3,7 месяца против 1,0 месяца, ОР равно 0,47 (95%-й ДИ от 0,24 до 0,91), р равно 0,025) статистически превосходили ЧОО и ВБП у пациентов с амплификацией 11q13 (n равно 24). Медианная ОВ у пациентов без амплификации 11q13 также была больше (11,5 месяца против 5,6 месяца, ОР равно 0,60 (95%-й ДИ от 0,30 до 1,20)) (ФИГ. 5С).
Пример 6. Анализ других биомаркеров и подгрупп
Анализ других биомаркеров или подгрупп, связанных с клиническими эффектами, включает возраст, пол, показатель ECOG, предшествующее лечение, исходное наличие метастазов в печени, объем опухоли и исходные уровни ЛДГ в сыворотке. Среди них у пациентов с показателем ECOG 0, малым исходным объемом опухоли и исходными уровнями ЛДГ, превышающими верхнюю границу нормы, ЧОО была численно выше. Тем не менее, ни одно из этих различий не было статистически значимым (Таблица 4).
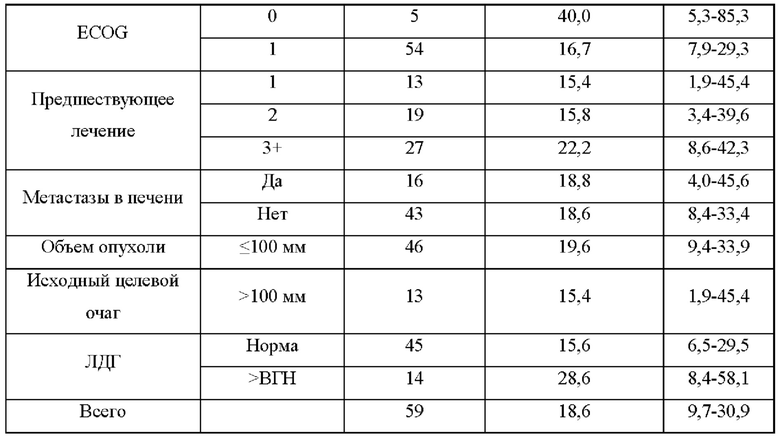
Пример 7. Исследование ингибирующего эффекта антитела против PD-1 и ингибитора CDK4/6 на опухолевый рост у мышей
Клетки СТ-26 высевали подкожно в правый бок hPD-1-гуманизированных самок мышей в концентрации 2,5×105 клеток/0,1 мл, и мышей группировали случайным образом, исходя из объема опухоли, когда опухоли вырастали примерно до 93 мм3, по 7 мышей на группу, с получением в общей сложности 4 групп:
G1 - группа отрицательного контроля hIgG4 против KLH (1 мг/кг);
G2 - группа торипалимаба (Toripalimab) (1 мг/кг);
G3 - палбоциклиб (100 мг/кг);
G4 - торипалимаб (1 мг/кг) в комбинации с палбоциклибом (100 мг/кг).
hIgG4 против KLH и торипалимаб вводили внутри брюшинной инъекцией два раза в неделю, проводя три последовательных введения, а палбоциклиб вводили перорально один раз в сутки. Эксперимент завершали через 11 суток после первого введения. Объем опухоли и массу тела мышей измеряли и записывали два раза в неделю. В конце эксперимента животных умерщвляли и рассчитывали ингибирование роста опухолей (TGITv%).
Результаты показаны в Таблице 5 и на ФИГ. 7. Исследуемое лекарственное средство палбоциклиб оказывает определенный ингибирующий эффект на опухолевый рост; по сравнению с введением торипалимаба (1 мг/кг) и палбоциклиба (100 мг/кг) самих по себе, введение торипалимаба (1 мг/кг) в комбинации с палбоциклибом (100 мг/кг) оказывает более выраженный ингибирующий эффект на опухолевый рост.
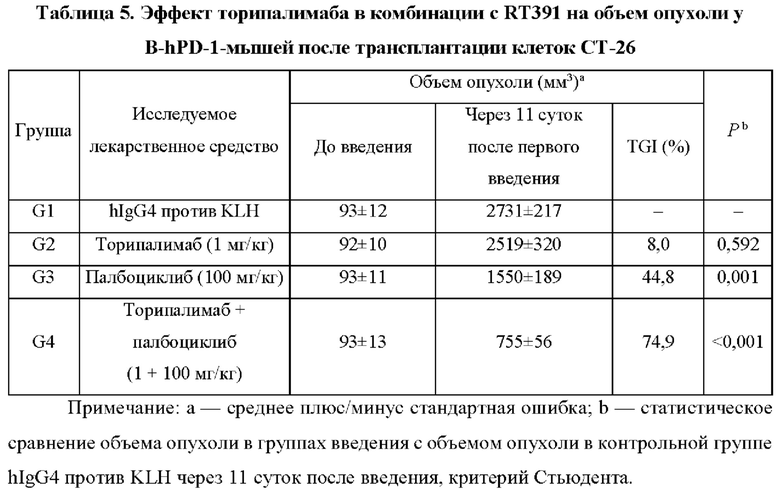
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
--->
<110> Shanghai Junshi Biosciences Co., Ltd.
<120> USE OF ANTI-PD-1 ANTIBODY IN PREPARATION OF MEDICAMENT FOR TREATING SOLID TUMORS
<130> 193139
<150> CN 201910310345.X
<151> 2019-4-17
<160> 10
<170> SIPOSequenceListing 1.0
<210> 1
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR1
<400> 1
Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR2
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR3
<400> 3
Phe Gln Gly Ser His Val Pro Leu Thr
1 5
<210> 4
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR1
<400> 4
Asp Tyr Glu Met His
1 5
<210> 5
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR2
<400> 5
Val Ile Glu Ser Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 6
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR3
<400> 6
Glu Gly Ile Thr Thr Val Ala Thr Thr Tyr Tyr Trp Tyr Phe Asp Val
1 5 10 15
<210> 7
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность VL антитела против PD-1
<400> 7
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 8
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность VH антитела против PD-1
<400> 8
Gln Gly Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Ile His Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Glu Ser Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ile Thr Thr Val Ala Thr Thr Tyr Tyr Trp Tyr Phe
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 9
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность легкой цепи антитела против PD-1
<400> 9
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 10
<211> 452
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность тяжелой цепи антитела против PD-1
<400> 10
Gln Gly Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Ile His Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Glu Ser Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ile Thr Thr Val Ala Thr Thr Tyr Tyr Trp Tyr Phe
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser
130 135 140
Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys
195 200 205
Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215 220
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Leu Gly Lys
450
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способы лечения рака с помощью анти-PD-1-антител и анти-CTLA4-антител | 2019 |
|
RU2825835C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745707C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2834309C2 |
| СЛИТЫЙ БЕЛОК, СОДЕРЖАЩИЙ РЕЦЕПТОР TGF-БЕТА, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2776204C1 |
| АНТИ-PD-1 АНТИТЕЛА | 2017 |
|
RU2752832C2 |
| ИНГИБИТОРЫ ПУТИ IL-4/IL-13 ДЛЯ ПОВЫШЕННОЙ ЭФФЕКТИВНОСТИ ПРИ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2020 |
|
RU2836467C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩИЕ СВЯЗЫВАЮЩИЕ TIGIT АГЕНТЫ | 2017 |
|
RU2765410C2 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
| БИСПЕЦИФИЧНОЕ АНТИТЕЛО ПРОТИВ PD-L1/ПРОТИВ 4-1ВВ В ГЕТЕРОДИМЕРНОЙ ФОРМЕ, ПОДОБНОЕ ПО СТРУКТУРЕ ПРИРОДНОМУ АНТИТЕЛУ, И ЕГО ПОЛУЧЕНИЕ | 2022 |
|
RU2825838C1 |
| Антитела против TIGIT и их применение | 2019 |
|
RU2750705C1 |
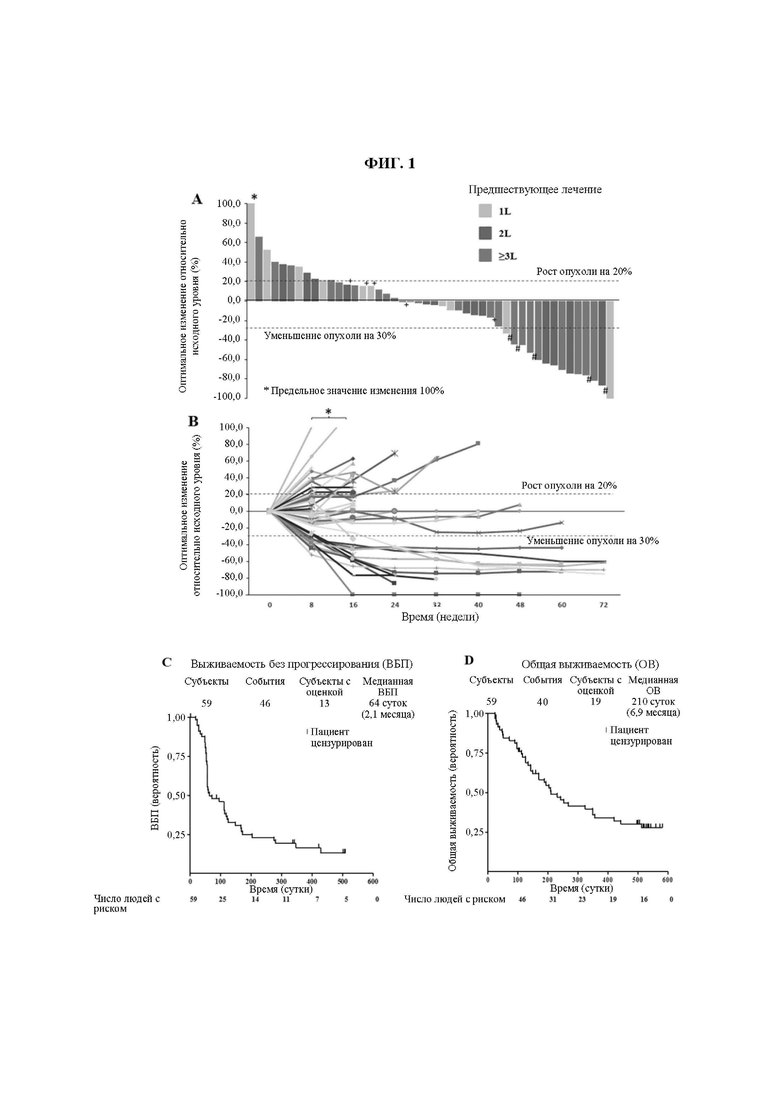
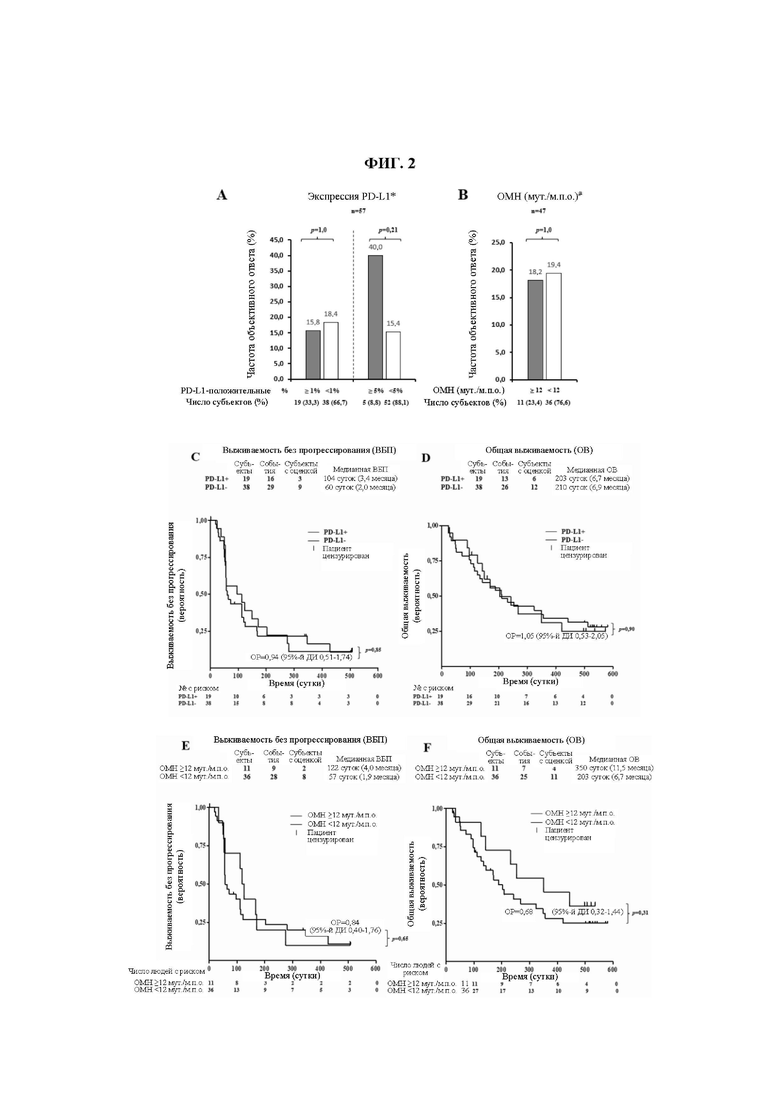


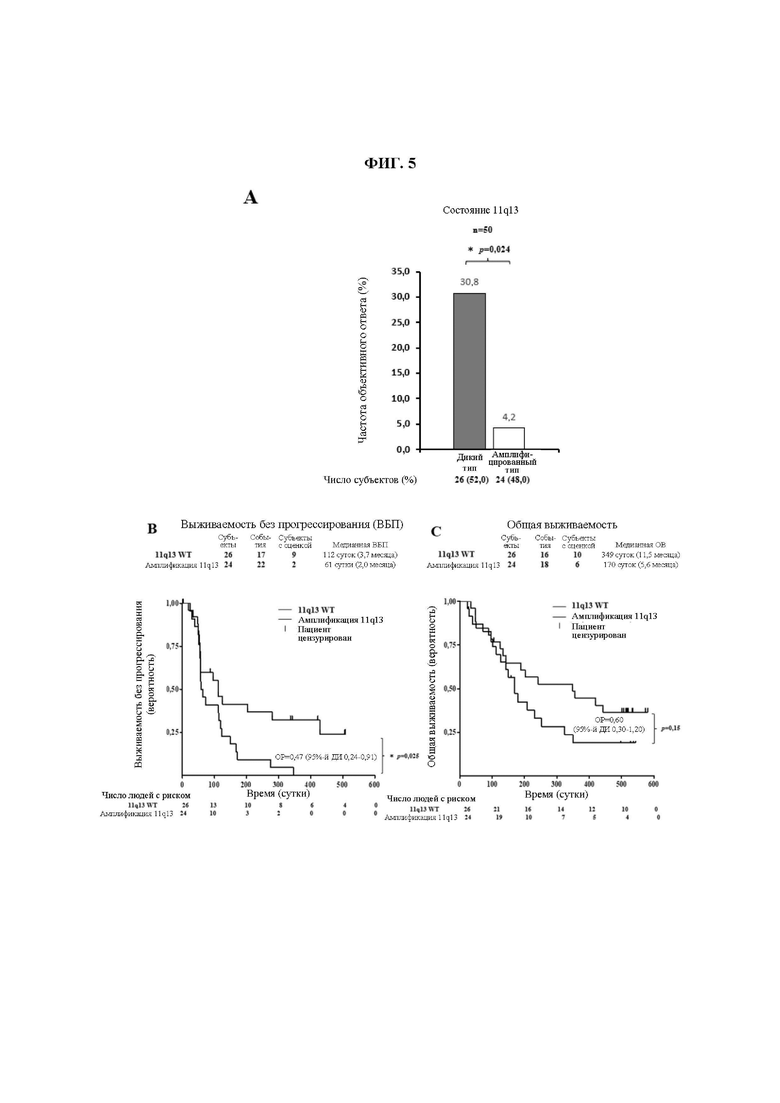
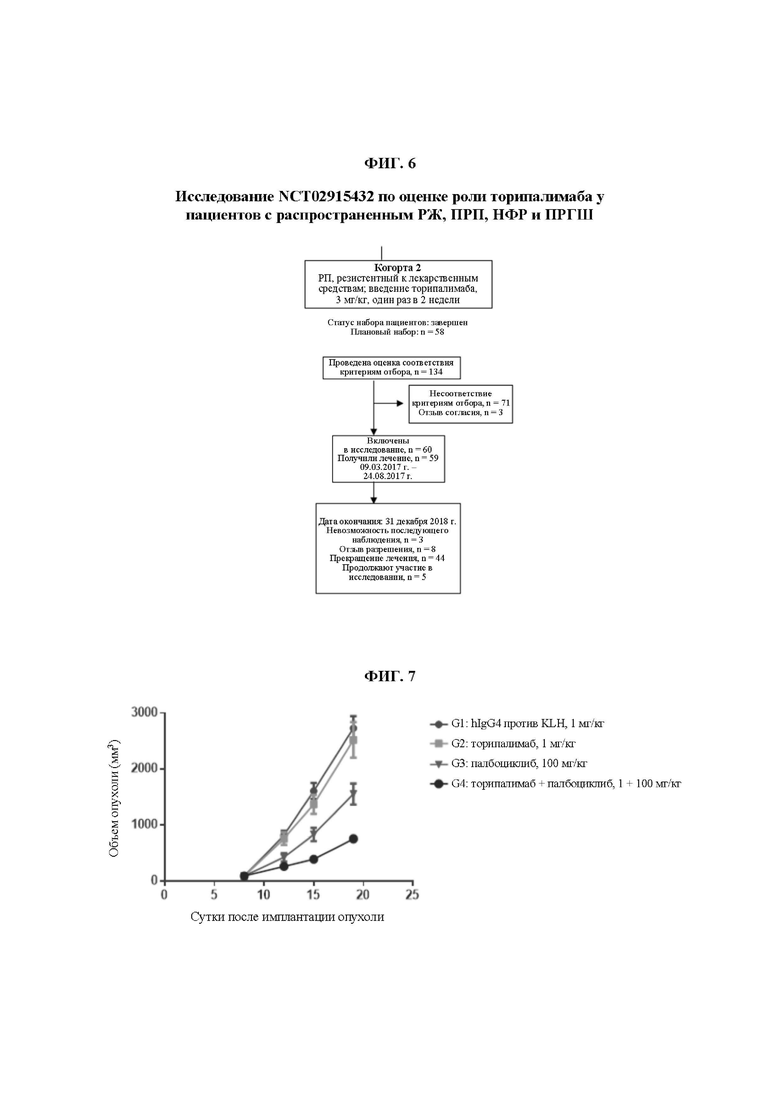
Группа изобретений относится к области медицины и фармацевтики. 1 объект представляет собой применение антитела против PD-1 или его антигенсвязывающего фрагмента самих по себе или в комбинации с дополнительным противораковым агентом, выбранным из одного или более чем одного из ингибитора CDK4/6 и ингибитора FGF/FGFR, для лечения плоскоклеточного рака пищевода, не имеющего амплификации генов хромосомной области 11q13. 2 объект – применение реагента для выявления амплификации генов хромосомной области 11q13 для прогнозирования терапевтического эффекта антитела против PD-1 или его антигенсвязывающего фрагмента у пациента с плоскоклеточным раком пищевода. Технический результат заключается в определении того, каких пациентов с плоскоклеточным раком пищевода можно эффективно лечить антителом против PD-1. 2 н. и 18 з.п. ф-лы, 7 ил., 5 табл., 7 пр.
1. Применение антитела против PD-1 (рецептор запрограммированной гибели 1-го типа) или его антигенсвязывающего фрагмента самих по себе или в комбинации с дополнительным противораковым агентом, выбранным из одного или более чем одного из ингибитора CDK(циклин-зависимые киназы)4/6 и ингибитора FGF/FGFR (фактор роста фибробластов/рецептор фактора роста фибробластов), для лечения солидной опухоли, не имеющей амплификации генов хромосомной области 11q13; где участок, определяющий комплементарность, легкой цепи антитела против PD-1 содержит аминокислотные последовательности, представленные в SEQ ID NO: 1, 2 и 3, и участок, определяющий комплементарность, тяжелой цепи антитела против PD-1 содержит аминокислотные последовательности, представленные в SEQ ID NO: 4, 5 и 6; и где солидная опухоль представляет собой плоскоклеточный рак пищевода.
2. Применение по п. 1, где ингибитор CDK4/6 выбран из рибоциклиба и палбоциклиба.
3. Применение по п. 1, где в антителе против PD-1 вариабельная область легкой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, и вариабельная область тяжелой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 8.
4. Применение по п. 1, где в антителе против PD-1 легкая цепь содержит аминокислотную последовательность, представленную в SEQ ID NO: 9, и тяжелая цепь содержит аминокислотную последовательность, представленную в SEQ ID NO: 10.
5. Применение по п. 1, где антитело против PD-1 представляет собой торипалимаб.
6. Применение по любому из пп. 1-5, где антитело против PD-1 или его антигенсвязывающий фрагмент вводят в дозе, составляющей от 0,1 мг/кг до 10,0 мг/кг массы тела, или в фиксированной дозе от 120 мг до 480 мг.
7. Применение по п. 6, где антитело против PD-1 или его антигенсвязывающий фрагмент вводят в дозе, составляющей 0,1 мг/кг массы тела, 0,3 мг/кг массы тела, 1 мг/кг массы тела, 2 мг/кг массы тела, 3 мг/кг массы тела, 5 мг/кг массы тела или 10 мг/кг массы тела, или в фиксированной дозе 120 мг, 240 мг, 360 мг или 480 мг.
8. Применение по п. 6, где антитело против PD-1 или его антигенсвязывающий фрагмент вводят с частотой примерно один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели или один раз в месяц, предпочтительно один раз в две недели.
9. Применение по п. 6, где антитело против PD-1 или его антигенсвязывающий фрагмент вводят в дозе 1 мг/кг массы тела, 3 мг/кг массы тела или 10 мг/кг массы тела или в фиксированной дозе 240 мг или 480 мг один раз в две недели.
10. Применение по п. 6, где антитело против PD-1 или его антигенсвязывающий фрагмент вводят парентерально в жидкой лекарственной форме.
11. Применение по п. 10, где антитело против PD-1 или его антигенсвязывающий фрагмент вводят посредством внутривенной инфузии.
12. Применение по п. 10, где жидкая лекарственная форма является инъекцией.
13. Применение по п. 6, где антитело против PD-1 или его антигенсвязывающий фрагмент вводят в течение периода продолжительностью в одну неделю, две недели, три недели, один месяц, два месяца, три месяца, четыре месяца, пять месяцев, полгода или более, возможно, продолжительность каждого периода введения является одинаковой или разной, и интервал между каждым периодом введения является одинаковым или разным.
14. Применение по п. 1, где плоскоклеточный рак пищевода представляет собой плоскоклеточный рак пищевода, рефрактерный к химиотерапии.
15. Применение по п. 1, где плоскоклеточный рак пищевода представляет собой распространенный, метастатический и/или рефрактерный плоскоклеточный рак пищевода.
16. Применение реагента для выявления амплификации генов хромосомной области 11q13 для прогнозирования терапевтического эффекта антитела против PD-1 или его антигенсвязывающего фрагмента у пациента с опухолью; где участок, определяющий комплементарность, легкой цепи антитела против PD-1 содержит аминокислотные последовательности, представленные в SEQ ID NO: 1, 2 и 3, и участок, определяющий комплементарность, тяжелой цепи антитела против PD-1 содержит аминокислотные последовательности, представленные в SEQ ID NO: 4, 5 и 6; и где солидная опухоль представляет собой плоскоклеточный рак пищевода.
17. Применение по п. 16, где вариабельная область легкой цепи антитела против PD-1 содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, и вариабельная область тяжелой цепи антитела против PD-1 содержит аминокислотную последовательность, представленную в SEQ ID NO: 8.
18. Применение по п. 16, где легкая цепь антитела против PD-1 содержит аминокислотную последовательность, представленную в SEQ ID NO: 9, и тяжелая цепь антитела против PD-1 содержит аминокислотную последовательность, представленную в SEQ ID NO: 10.
19. Применение по любому из пп. 16-18, где плоскоклеточный рак пищевода представляет собой плоскоклеточный рак пищевода, рефрактерный к химиотерапии.
20. Применение по любому из пп. 16-18, где плоскоклеточный рак пищевода представляет собой распространенный, метастатический и/или рефрактерный плоскоклеточный рак пищевода.
| KEAM S | |||
| J | |||
| Toripalimab: first global approval // Drugs | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| - Vol | |||
| Цилиндрический сушильный шкаф с двойными стенками | 0 |
|
SU79A1 |
| - P | |||
| Котел для водяного отопления с внутренним перегревателем воды для побуждения циркуляции в сети и с регулятором наружной температуры котла | 1924 |
|
SU573A1 |
| CN 102676650 B, 05.08.2015 | |||
| WO 2016040892 A1, 17.03.2016 | |||
| TERASHIMA M | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2024-09-02—Публикация
2020-04-16—Подача