Перекрестная ссылка на связанные заявки
В этой международной заявке PCT заявляется преимущество и приоритет предварительной заявки на патент США № 62/395832, которая была подана 16 сентября 2016 г. В этой международной заявке PCT также заявляется преимущество и приоритет предварительной заявки на патент США № 62/519590, которая была подана 14 июня 2017 г. Содержание каждой из этих заявок включено в настоящее описание ссылкой.
Перечень последовательностей
Настоящая заявка включает перечень последовательностей, который был представлен в электронном виде в формате ASCII и настоящим полностью включен посредством ссылки. Указанная копия ASCII, созданная 19 сентября 2017 года, называется 000020_000004PCT-LF_SL.txt и имеет размер 40 346 байт.
Область техники, к которой относится изобретение
Изобретение в целом относится к анти-PD-1 антителам и способам их применения при лечении рака человека.
Предшествующий уровень техники
Белок Запрограммированной смерти-1 (Programmed Death-1, PD-1) является ключевым рецептором иммунного чекпоинта, экспрессируемого активированными T- и В-клетками и опосредует иммуносупрессию. PD-1 является представителем семейства рецепторов CD28, которое включает CD28, CTLA-4, ICOS, PD-1 и BTLA. Для PD-1 на клеточной поверхности были идентифицированы два гликопротеиновых лиганда, лиганд-1 белка запрограммированной смерти (PD-L1) и лиганд-2 белка запрограммированной смерти (PD-L2), которые экспрессируются на антигенпрезентирующих клетках и на многих раках человека, и, как было показано, подавляют активацию Т-клеток и секрецию цитокинов при связывании с PD-1 (Freeman et al., 2000; Latchman et al., 2001). В отличие от CTLA-4, PD-1 в основном функционирует в периферических тканях, где активированные T-клетки могут сталкиваться с иммуносупрессивными лигандами PD-L1 (B7-H1) и PD-L2 (B7-DC), экспрессируемыми опухолевыми и/или стромальными клетками (Flies et al., 2011; Topalian et al., 2012a). Ингибирование взаимодействия PD-1/PD-L1 опосредует мощную противоопухолевую активность в доклинических моделях (патенты США № 8008449 и 7943743), а применение антительных ингибиторов взаимодействия PD-1/PD-L1 для лечения окнологических заболеваний проходит клинические испытания (Brahmer et al., 2010; Flies et al., 2011; Topalian et al., 2012b; Brahmer et al., 2012).
Таким образом, существует потребность в разработке противораковой терапии, направленной против PD-1.
Настоящее изобретение удовлетворяет эту и другие потребности.
Сущность изобретения
В изобретении предлагаются анти-PD-1 антитела и/или их антигенсвязывающие фрагменты. В определенных воплощениях анти-PD-1 антитело по изобретению представляет собой химерное анти-PD-1 антитело c1G4 и/или гуманизированное анти-PD-1 h1G4, включающее последовательность вариабельного домена легкой цепи (LC) (1) CDR-L1, включающую аминокислотную последовательность KASQDVTTAVA (SEQ ID NO: 9); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11) и последовательность вариабельного домена тяжелой цепи (HC), включающую (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность VSYYYGIDF (SEQ ID NO: 14).
Изобретение дополнительно обеспечивает аффинно-зрелые антитела против гуманизированного анти-PD-1 антитела h1G4. В определенных воплощениях, созревшее анти-PD-1 антитело (например, анти-PD-1 антитело 33В) по изобретению включает последовательность вариабельного домена легкой цепи (LC), включающую (1) CDR-L1, включающую аминокислотную последовательность KASTDVTTAVA (SEQ ID NO: 15); (2) CDR-L2, включающую аминокислотную последовательность WASLRHT (SEQ ID NO: 16); и (3) CDR-L3, включающую аминокислотную последовательность QQHYGIPWT (SEQ ID NO: 17), и последовательность вариабельного домена тяжелой цепи (НС), включающую (1) CDR-H1, включающую аминокислотную последовательность FRFSNYGMS (SEQ ID NO: 18); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNAY (SEQ ID NO: 19); и (3) CDR-H3, включающую аминокислотную последовательность TSYYYGIDF (SEQ ID NO: 20).
В других воплощениях зрелое анти-PD-1 антитело (например, анти-PD-1 антитело 66E) по изобретению включает последовательность вариабельного домена легкой цепи (LC), включающую (1) CDR-L1, включающую аминокислотную последовательность KAKQDVTTAVA (SEQ ID NO: 21); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYWIPWT (SEQ ID NO: 22), и последовательность вариабельного домена тяжелой цепи (HC), включающую (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO:12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность VSYYYGIDL (SEQ ID NO: 23).
В некоторых воплощениях зрелое анти-PD-1 антитело (например, анти-PD-1 антитело 711D) по изобретению включает последовательность вариабельного домена легкой цепи (LC), включающую (1) CDR-L1, включающую аминокислотную последовательность KASQDVTNAVA (SEQ ID NO: 24); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11), и последовательность вариабельного домена тяжелой цепи (НС), включающую (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность SSYYYGIDL (SEQ ID NO: 25).
Последовательности CDR, указанные в настоящем документе, представлены в таблице 1 ниже.
Таблица 1
В некоторых воплощениях анти-PD-1 антитело включает последовательность вариабельного домена легкой цепи (LC), включающую (1) CDR-L1 включающую аминокислотную последовательность выбранную от группы состоящий из SEQ ID NO: 9, 21 и 24; (2) CDR-L2, включающую аминокислотную последовательность SEQ ID NO: 10 или 16; (3) CDR-L3, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, 17, 22, и последовательность вариабельного домена тяжелой цепи (HC), включающую (1) CDR-H1, включающую аминокислотную последовательность SEQ ID NO: 12 или 18; (2) CDR-H2, включающую аминокислотную последовательность SEQ ID NO: 13 или 19; и (3) CDR-H3, включающую аминокислотную последовательность выбранную от группы, состоящей из SEQ ID NO: 14, 20, 23 и 25.
Изобретение также относится к анти-PD-1 антителу или его антигенсвязывающему фрагменту, включающему последовательность тяжелой цепи, включающую аминокислотную последовательность, представленную в (SEQ ID NO: 4) и последовательность легкой цепи, включающую аминокислотную последовательность, представленную в SEQ ID NO: 2).
Изобретение также относится к гуманизированному анти-PD-1 антителу или его антигенсвязывающему фрагменту, включающим аминокислотную последовательность, тяжелой цепи представленную в (SEQ ID NO: 8) и последовательность легкой цепи, включающую аминокислотную последовательность, представленную в SEQ ID NO: 6).
В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, антитело включает последовательность Fc из IgG человека. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, антигенсвязывающий фрагмент выбирается из группы, состоящей из Fab, Fab', F(ab)'2, одноцепочечного Fv (scFv), фрагмента Fv, диатела и линейного антитела. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, антитело является мультиспецифичным антителом.
В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, анти-PD-1 антитело или его антигенсвязывающий фрагмент конъюгируют с терапевтическим агентом. В некоторых воплощениях в соответствии с (или в применении к) любым из вышеприведенных воплощений, анти-PD-1 антитело или его антигенсвязывающий фрагмент конъюгированы с меткой. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, метка выбрана из группы, состоящей из радиоизотопа, флуоресцентного красителя и фермента.
Изобретение относится к выделенной молекуле нуклеиновой кислоты, которая кодирует анти-PD-1 антитело или его антигенсвязывающий фрагмент в соответствии с (или в применении к) любым из приведенных выше воплощений. Также предлагается экспрессирующий вектор, кодирующий молекулу нуклеиновой кислоты в соответствии с (или в применении к) любым из приведенных выше воплощений. Клетки, содержащие экспрессирующий вектор в соответствии с (или в применении к) любым из приведенных выше воплощений также предлагаются в изобретении. Изобретение также относится к способу получения антитела, включающему культивирование клетки в соответствии с (или в применении к) любым из приведенных выше воплощений и извлечение антитела или его антигенсвязывающего фрагмента из клеточной культуры. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений клетка представляет собой клетку млекопитающего. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений клетка млекопитающего представляет собой клетку CHO. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, клетка является стабильной клеточной линией млекопитающего. В некоторых воплощениях в соответствии с (или в применении к) любой из стабильных клеточных линий млекопитающих является клеточная линия CHO.
В изобретении предлагается композиция, включающая анти-PD-1 антитело или его антигенсвязывающий фрагмент в соответствии с (или в применении к) любым из приведенных выше воплощений и фармацевтически приемлемый носитель.
В изобретении предлагается способ обнаружения белка PD-1 в образце из пациента путем контакта анти-PD-1 антитела или его антигенсвязывающего фрагмента в соответствии с (или в применении к) любым из приведенных выше воплощений с образцом и обнаружение анти-PD-1 антитела, связанного с белком PD-1. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, анти-PD-1 антитело или его антигенсвязывающий фрагмент используют в иммуногистохимическом анализе (IHC) или в анализе ELISA.
Также предлагается способ лечения рака у объекта, включающий введение эффективного количества композиции в соответствии с (или в применении к) любым из приведенных выше воплощений для объекта. Также предлагается состав, включающий анти-PD-1 антитело или его антиген-связывающий фрагмент в соответствии с (или в применении к) любым из приведенных выше воплощений для применения при лечении рака. Предусмотрено применение анти-PD-1 антитела или его антигенсвязывающего фрагмента в соответствии с (или применительно к) любому из приведенных выше воплощений при производстве лекарственного средства для лечения рака. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений рак выбран из меланомы, рака головы и шеи, рака уротелия, рака молочной железы (например, тройного негативного рака молочной железы, TNBC), рака желудка, классической лимфомы Ходжкина (cHL), неходжкинской лимфомы первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиомы, рака яичника, рака легкого (например, мелкоклеточного рака легкого и немелкоклеточного рака легкого (NSCLC), рака пищевода, назофарингеальной карциномы (NPC), рака желчных путей, колоректального рака, рака шейки матки, рака щитовидной железы и рака слюнных желёз. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, объекту дополнительно вводят терапевтический агент, выбранный из группы, состоящей из антинеопластического агента, химиотерапевтического агента, агента, ингибирующего рост, и цитотоксического агента. В некоторых воплощениях в соответствии с (или в применении к) любым из приведенных выше воплощений, объект дополнительно получает лучевую терапию. В некоторых воплощениях в соответствии с (или в применении к) любым из указанных выше воплощений объекту дополнительно вводят терапевтическое антитело против VEGF, VEGFR2 или EGFR.
Краткое описание чертежей
Фигуры 1А-1B. Связывание c1G4 с рекомбинантным белком PD-1. На фиг. 1А показаны результаты ELISA, выполненного для сравнения связывания анти-PD-1 антитела c1G4 и референсного анти-PD-1 антитела с PD-1-His. На фиг. 1В показаны результаты второго набора ELISA, выполненного для сравнения связывания анти-PD-1 антитела c1G4 и референсного анти-PD-1 антитела с PD-1-AP. Данные указывают, что c1G4 и референсное анти-PD-1 антитела способны связываться как с PD-1-His, так и с PD-1-AP.
Фигуры 2А-2В. Блокирование и конкуренция связывания лиганда PD-1 с c1G4. На фиг. 2А показаны результаты ELISA, выполненного для сравнения способности анти-PD-1 антитела c1G4 и референсного анти-PD-1 антитела блокировать связывание PD-L1 и PD-1. Было обнаружено, что и антитело c1G4, и референсное анти-PD-1 антитело блокируют связывание PD-L1 с PD-1. На фиг. 2B показаны результаты ELISA, выполненного для определения способности анти-PD-1 антитела c1G4 конкурировать с референсным анти-PD-1 антителом за связывание с PD-1-His. Данные указывают на то, что как антитело c1G4, так и референсное анти-PD-1 антитело способны блокировать связывание PD-L1 с PD-1, а c1G4 способно конкурировать с референсным анти-PD-1 антителом за связывание с PD-1-His.
Фигуры 3А-3В. Связывание c1G4 с PD-1-экспрессирующими клетками CHO-S. Связывание антитела c1G4 с клетками CHO-S (фиг. 3A) и трансфицированными PD-1 клетками CHO-S (фиг. 3B) тестировали проточной цитометрией. Референсные анти-PD-1 и анти-PD-L1 антитела использовали в качестве положительного и отрицательного контроля, соответственно. Данные указывают на то, что c1G4 связывается с клетками СНО, трансфицированными PD-1 человека, но не с нетрансфицированными клетками СНО.
Фигура 4. Блокирование связывания лиганда с PD-1 выбранным антителом c1G4. Анти-PD-1 антитело c1G4 тестировали на способность блокировать связывание лиганда PD-L1 с PD-1-экспрессирующими клетками CHO-S с использованием проточной цитометрии. Референсные анти-PD-1 и анти-PD-L1 антитела использовали в качестве положительного и отрицательного контроля, соответственно. Моноклональное анти-PD-1 антитело c1G4 блокировало связывание PD-L1 с PD-1-трансфицированными клетками CHO-S, что измеряли по средней интенсивности флуоресценции (MFI) окрашивания. Эти данные демонстрируют, что анти-PD-1 антитело c1G4 блокирует связывание лиганда PD-L1 с клеточной поверхностью PD-1.
Фигуры 5А-5В. Влияние анти-PD-1 антитела c1G4 на выработку цитокинов в смешанной лейкоцитарной реакции (MLR). Моноклональное антитело c1G4 против PD-1 человека стимулирует секрецию IFN-γ и секрецию IL-2 в смешанной лейкоцитарной реакции. Референсное анти-PD-1 антитело и Авастин (анти-VEGF) использовали в качестве положительного и отрицательного контроля, соответственно. Фиг. 5А с помощью столбчатой диаграммы иллюстрирует зависимую от концентрации секрецию IL-2; фиг. 5B с помощью столбчатой диаграммы иллюстрирует зависимую от концентрации секрецию IFN-γ.
Фигура 6. Влияние анти-PD-1 антитела c1G4 на пролиферацию Т-клеток в смешанной лейкоцитарной реакции (MLR). Моноклональное антитело c1G4 против PD-1 человека способствует пролиферации CD4+ и CD8+ Т-клеток в смешанной лейкоцитарной реакции. Референсное анти-PD-1 антитело и Авастин (анти-VEGF) использовали в качестве положительного и отрицательного контроля, соответственно. Фиг. 6А иллюстрирует гистограмму, показывающую пролиферацию CD4+ Т-клеток при различных концентрациях антител; фиг. 6B иллюстрирует гистограмму, показывающую пролиферацию CD8+ T-клеток при различных концентрациях антител.
Фигура 7. Активность ингибирования опухолевого роста антителом c1G4. Мышам (n = 4 на группу) подкожно приживляли смесь клеточных линий рака толстой кишки человека НТ29 и свежевыделенных PBMC человека (опухолевые клетки: РВМС = 2:1). Анти-PD-1 антитела вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Кривые роста опухоли показаны на фиг. 7А. Объем отдельной опухоли на 28 день представлен на фиг. 7В. Все точки данных являются средними ± SEM.
Фигура 8. Выравнивание последовательностей для c1G4 и h1G4. На фиг. 8А показано выравнивание аминокислотной последовательности легких цепей c1G4, гуманизированного h1G4, вариабельной области легкой цепи зародышевой линии человека IGKV1-39*01 и Ниволумаба (NIV) (SEQ ID NO: 27-30, соответственно, в порядке появления). На фиг. 8B показано выравнивание аминокислотных последовательностей тяжелых цепей c1G4, гуманизированного h1G4, вариабельной области тяжелой цепи человеческой зародышевой линии IGHV3-11*04 и Ниволумаба (NIV) (SEQ ID NO: 31-34, соответственно, в порядке появления). CDR (области, определяющие комплементарность), привитые из c1G4 для гуманизации, были выделены жирным и подчеркнутым текстом.
Фигура 9. Связывание гуманизированного анти-PD-1 антитела с PD-1-экспрессирующими клетками CHO-S. Связывание гуманизированного h1G4 и исходного антитела c1G4 с PD-1 на поверхности клетки проверяли проточной цитометрией. Референсные анти-PD-1 и анти-PD-L1 антитела использовали в качестве положительного и отрицательного контроля, соответственно.
Фигура 10. Блокирование связывания лиганда с PD-1 гуманизированным антителом h1G4. Гуманизированное анти-PD-1 h1G4 тестировали на способность блокировать связывание лиганда PD-L1 с PD-1-экспрессирующими клетками CHO-S с использованием проточной цитометрии. Референсные анти-PD-1 и анти-PD-L1 антитела использовали в качестве положительного и отрицательного контроля, соответственно. Как c1G4, так и h1G4 блокировали связывание PD-L1 с PD-1-трансфицированными клетками CHO-S, что измерялось по средней интенсивности флуоресценции (MFI) окрашивания.
Фигуры 11А-11D иллюстрируют межвидовую перекрестную реактивность h1G4 к белкам PD-1 человека (фиг. 11А), яванского макака (фиг. 11В), мыши (фиг. 11С) и крысы (фиг. 11D). Все точки данных являются средним значением трех повторов ± SD.
Фигура 12. Связывание гуманизированного анти-PD-1 антитела с активированными Т-клетками человека. Связывание гуманизированного h1G4 с Т-клетками человека проверяли с помощью проточной цитометрии. Референсное анти-PD-1 антитело и Авастин (анти-VEGF) использовали в качестве положительного и отрицательного контроля, соответственно.
Фигура 13. Влияние h1G4 на продукцию цитокинов в смешанной лейкоцитарной реакции (MLR). Гуманизированное антитело h1G4 против PD-1 человека стимулирует секрецию IFN-γ и секрецию IL-2 в анализе смешанной лейкоцитарной реакции. Референсное анти-PD-1 антитело и Авастин (анти-VEGF) использовали в качестве положительного и отрицательного контроля, соответственно. Фиг. 13А с помощью столбчатой диаграммы иллюстрирует зависимую от концентрации секрецию IL-2; фиг. 13B с помощью столбчатой диаграммы иллюстрирует зависимую от концентрации секрецию IFN-γ.
Фигура 14. Влияние h1G4 на пролиферацию Т-клеток в смешанной лейкоцитарной реакции (MLR). Гуманизированное антитело h1G4 против PD-1 человека способствует пролиферации CD4+ и CD8+ T-клеток в смешанной лейкоцитарной реакции. Референсное анти-PD-1 антитело и Авастин (анти-VEGF) использовали в качестве положительного и отрицательного контроля, соответственно. Фиг. 14А иллюстрирует гистограмму, показывающую пролиферацию CD4+ Т-клеток при различных концентрациях антител; фиг. 14B иллюстрирует гистограмму, показывающую пролиферацию CD8+ T-клеток при различных концентрациях антител.
Фигура 15. Активность ингибирования опухолевого роста антитела h1G4 в модели ксенотрансплантата HT29/PBMC. Мышам (n = 4 на группу) подкожно приживляли смесь клеточных линий рака толстой кишки человека НТ29 и свежевыделенных РВМС человека (раковые клетки: РВМС = 3:1). Анти-PD-1 антитела вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Кривые роста опухоли показаны на фиг. 15А. Объем отдельной опухоли на 21 день представлен на фиг. 15В. Все точки данных являются средними ± SEM.
Фигура 16. Активность ингибирования опухолевого роста антитела h1G4 в модели ксенотрансплантата NCI-H292/PBMC. Мышам (n = 4 на группу) подкожно приживляли смесь клеточных линий NSCLC человека NCI-H292 и свежевыделенных PBMC человека (раковые клетки: PBMC = 3:1). Анти-PD-1 антитела вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Кривые роста опухоли показаны на фиг. 16А. Объем отдельной опухоли на 25 день представлен на фиг. 16В. Все точки данных являются средними ± SEM.
Фигура 17. Активность ингибирования опухолевого роста антитела h1G4 у мышей hPD1 KI. Мышам с нокином PD-1 человека (hPD1 KI) (n = 4 на группу), подкожно приживляли клетки MC38-huPD-L1 (MC38, трансфицированные PD-L1 человека). Обработку антителами начинали, когда объемы опухолей достигали около 75 мм3. Анти-PD-1 антитела вводили мышам внутрибрюшинно два раза в неделю. Все точки данных являются средними значениями ± SD.
Фигура 18. Исследование эффективности h1G4 на модели ксенотрансплантата клеточной линии тройного негативного рака молочной железы (TNBC) у гуманизированных мышей NSG. Гуманизированных мышей NSG (n = 9/группу) подкожно инокулировали клетками MDA-MB-231. Обработку антителами начинали, когда объемы опухолей достигали около 60-150 мм3. Дни введения доз указаны стрелками. Все точки данных являются средними ± SEM.
Фигура 19. Влияние антител против PD-1 человека на выработку цитокинов в смешанной лейкоцитарной реакции (MLR). Человеческие моноклональные антитела против PD-1 человека стимулируют секрецию IFN-γ и IL-2 в анализе смешанной лейкоцитарной реакции. Референсное анти-PD-1 антитело и Авастин (анти-VEGF) использовали в качестве положительного и отрицательного контроля, соответственно. Фиг. 19А с помощью столбчатой диаграммы иллюстрирует зависимую от концентрации секрецию IL-2; фиг. 19B с помощью столбчатой диаграммы иллюстрирует зависимую от концентрации секрецию IFN-γ.
Фигура 20. Активность ингибирования опухолевого роста антител против PD-1 человека в модели ксенотрансплантата HT29/PBMC. Мышам (n = 4 на группу) подкожно приживляли смесь клеточной линии рака толстой кишки человека НТ29 и свежевыделенных PBMC человека (раковые клетки: РВМС = 3:1). Анти-PD-1 антитела вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Объем опухоли измеряли два раза в неделю. Все точки данных являются средними ± SEM.
Фигура 21. Комбинация моноклонального анти-PD-1 антитела и анти-VEGF антитела в модели ксенотрансплантата HT29/PBMC. Мышам (n = 4 на группу) подкожно приживляли смесь клеточной линии рака толстой кишки человека НТ29 и свежевыделенных PBMC человека (раковые клетки: РВМС = 3:1). Анти-PD-1 mAb, анти-VEGF mAb (HLX04) или анти-PD-1 mAb плюс анти-VEGF mAb вводили мышам внутрибрюшинно. Дни введения доз указаны стрелками. Объем опухоли измеряли два раза в неделю. Все точки данных являются средними ± SEM.
Фигура 22. Активность ингибирования опухолевого роста анти-PD-1 mAb плюс анти-VEGF mAb на модели мышей с ксенотрансплантатом NSCLC. Мышам (n = 4/группу) подкожно приживляли смесь клеток NSCLC человека NCI-H292 и свежевыделенных PBMC человека (раковые клетки: PBMC = 3:1). Антитела против PD-1 (h1G4) и против VEGF (HLX04) вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Кривые роста опухоли показаны на фиг. 22А. Объем отдельной опухоли на 21 день был представлен на фигуре 22B. Все точки данных являются средними ± SEM.
Фигура 23. Активность ингибирования опухолевого роста анти-PD-1 mAb плюс анти-VEGFR2 mAb на модели мышей с ксенотрансплантатом NSCLC. Мышам (n = 4/группу) подкожно приживляли смесь клеток NSCLC человека NCI-H292 и свежевыделенных PBMC человека (раковые клетки: PBMC = 3:1). Антитела против PD-1 (h1G4) и против VEGFR2 (HLX06) вводили мышам внутрибрюшинно дважды в неделю с 1 дня. Кривые роста опухоли показаны на фигуре 23А. Объем отдельной опухоли на 21 день был представлен на фигуре 23В. Все точки данных являются средними ± SEM.
Фигура 24. Активность ингибирования опухолевого роста анти-PD-1 mAb плюс анти-EGFR mAb на модели мышей с ксенотрансплантатом NSCLC. Мышам (n = 4/группу) подкожно приживляли смесь клеток NSCLC человека NCI-H292 и свежевыделенных PBMC человека (раковые клетки: PBMC = 3:1). Антитела против PD-1 (HLX10) и против EGFR (HLX07) вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Кривые роста опухоли показаны на фигуре 24А. Объем отдельной опухоли на 21 день был представлен на фигуре 24В. Все точки данных являются средними ± SEM.
Фигура 25. Активность ингибирования опухолевого роста mAb против PD-1 плюс mAb против EGFR на модели мышей с ксенотрансплантатом HT-29 (KRASWT, BRAFV600E). Мышам (n = 5 на группу) подкожно приживляли смесь клеток рака толстой кишки человека НТ-29 и свежевыделенных PBMC человека (раковые клетки: РВМС = 3:1). Анти-PD-1 (HLX10) и анти-EGFR (HLX07) антитела вводили мышам внутрибрюшинно дважды в неделю с 1 дня. Кривые роста опухоли показаны на фигуре 25А. Индивидуальный объем опухоли на 21 день был представлен на фигуре 25В. Все точки данных являются средними ± SEM.
Подробное описание изобретения
Настоящее изобретение относится к новым анти-PD-1 антителам и/или их антигенсвязывающим фрагментам. Авторы изобретения неожиданно обнаружили, что анти-PD-1 антитела, например химерные антитела c1G4 и гуманизированные h1G4, описанные в данном документе, а также их аффинно-зрелые антитела, например 33B, 66E и 711D, усиливают секрецию IL-2 и IFNγ Т-клетками и пролиферацию CD4+ и CD8+ Т-клеток. Анти-PD-1 антитела, описанные в данном документе, также проявляют повышенную эффективность и/или противоопухолевую активность по сравнению с OPDIVO® (Nivolumab), которое является одобренным FDA гуманизированным моноклональным анти-PD-1 антителом IgG4, используемым для лечения рака.
Также предлагаются иммуноконъюгаты, нуклеиновые кислоты, кодирующие новые анти-PD-1 антитела, описанные в данном документе, и композиции (такие как фармацевтические композиции). Изобретение также предлагает способы применения новых анти-PD-1 антител для обнаружения PD-1 в образце (таком как образец in vivo или ex vivo), композиции, содержащие такие антитела для применения при лечении рака, и применения таких антител при изготовлении лекарственного средства для лечения рака.
Определения
Используемый в данном документе термин «лечение» или «лечить» представляет собой подход для получения полезных или искомых результатов, включая клинические результаты. Для целей настоящего изобретения полезные или искомые клинические результаты включают, без ограничения указанным, одно или несколько из следующего: ослабление одного или нескольких симптомов, возникающих в результате заболевания, уменьшение степени заболевания, стабилизация заболевания (например, предотвращение или задержку ухудшения заболевания), предотвращение или задержку распространения (например, метастазирования) заболевания, предотвращение или задержку рецидива заболевания, задержку или замедление прогрессирования заболевания, улучшение состояния заболевания, обеспечение ремиссии (частичной или полной) заболевания, уменьшение дозы одного или нескольких других лекарств, необходимых для лечения заболевания, задержку прогрессирования заболевания, повышение или улучшение качества жизни, увеличение набора массы и/или продление выживаемости. Термин «лечение» также включает уменьшение патологических последствий рака (таких как, например, объем опухоли). Способы, представленные в настоящем документе, предусматривают любой один или несколько из этих аспектов лечения.
Термины «повторное проявление», «рецидив» или «рецидивировать» относятся к возвращению рака или заболевания после клинической оценки исчезновения заболевания. Диагноз отдаленного метастазирования или местного рецидива можно считать рецидивом.
Термин «рефракторный» или «резистентный» относится к раку или заболеванию, которые не поддаются лечению.
Термин «адъювантная терапия» относится к лечению, которое проводится после первичной терапии, обычно после операции. Адъювантная терапия рака или заболевания может включать иммунотерапию, химиотерапию, лучевую терапию или гормональную терапию.
Термин «поддерживающая терапия» относится к запланированному повторному лечению, которое проводится для поддержания эффекта предыдущего лечения. Поддерживающая терапия часто назначается для того, чтобы помочь сохранить рак в состоянии ремиссии или продлить ответ на специфическую терапию независимо от прогрессирования заболевания.
Термин «инвазивный рак» относится к злокачественной опухоли, которая распространилась за пределы слоя ткани, в которой она возникла, в нормальные окружающие ткани. Инвазивные раки могут быть метастатическими или неметастатическими.
Термин «неинвазивный рак» относится к очень ранней стадии рака или злокачественной опухоли, которая не распространилась за пределы ткани происхождения.
Термин «выживаемость без прогрессирования» в онкологии относится к отрезку времени во время и после лечения, когда рак не растет. Выживаемость без прогрессирования включает количество времени, в течение которого пациенты испытывали полный или частичный ответ, а также количество времени, в течение которого заболевание у пациентов стабилизировалось.
Термин «прогрессирующее заболевание» в онкологии может относиться к росту опухоли более чем на 20 процентов с момента начала лечения - либо из-за увеличения массы, либо из-за распространения опухоли.
«Расстройство» - это любое состояние, при котором оказывается благоприятное воздействие в результате лечения антителом. Например, млекопитающие, которые страдают или нуждаются в профилактике против аномальной активности PD-1. Расстройство включает хронические и острые расстройства или заболевания, включая те патологические состояния, которые предрасполагают млекопитающее к рассматриваемому расстройству. Неограничивающие примеры заболеваний, подлежащих лечению, включают рак (такие как рак головы и шеи, рак горла, колоректальный рак, рак легкого и т.д.).
«Опухоль» в контексте настоящего описания относится ко всем видам неопластического роста клеток и их пролиферации, как злокачественных, так и доброкачественных, а также ко всем предзлокачественным и злокачественным клеткам и тканям.
Термин «антитело» используется в самом широком смысле и в частности охватывает, например, единичные моноклональные антитела (включая антитела-агонисты, антитела-антагонисты и нейтрализующие антитела), композиции антител с полиэпитопной специфичностью, поликлональные антитела, одноцепочечные анти-антитела и фрагменты антитела (см. ниже), если они специфически связывают нативный полипептид и/или проявляют биологическую активность или иммунологическую активность по настоящему изобретению. Согласно одному воплощению антитело связывается с олигомерной формой белка-мишени, например тримерной формой. В соответствии с другим воплощением антитело специфически связывается с белком, связывание которого может быть ингибировано моноклональным антителом по настоящему изобретению (например, депонированным антителом по настоящему изобретению и т.д.). Фраза «функциональный фрагмент или аналог» антитела представляет собой соединение, обладающее качественной биологической активностью, общей с антителом, к которому оно относится. Например, функциональный фрагмент или аналог антитела по данному изобретению может представлять собой фрагмент, который может специфически связываться с PD-1. В одном воплощении антитело может предотвращать или существенно снижать способность PD-1 индуцировать пролиферацию клеток.
«Выделенное антитело» представляет собой антитело, которое было идентифицировано и отделено и/или извлечено из компонента его естественной среды. Загрязняющие компоненты его естественной среды представляют собой материалы, которые будут мешать диагностическому или терапевтическому применению антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных воплощениях антитело будет очищено (1) до более чем 95 масс.% антитела, при определении способом Лоури, и наиболее предпочтительно более чем до 99 масс.% (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом или (3) до гомогенности, определяемой с помощью SDS-PAGE в восстановливающих или невосстановливающих условиях с использованием Кумасси синего или, предпочтительно, серебряного красителя. Выделенное антитело включает антитело in situ в рекомбинантных клетках, так как, по меньшей мере, один компонент природной среды антитела будет отсутствовать. Обычно, однако, выделенное антитело будет получено, по меньшей мере, с помощью одной стадии очистки.
Элемент основного 4-цепочечного антитела представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей (антитело IgM состоит из 5 основных гетеротетрамерных единиц вместе с дополнительным полипептидом, называемым J-цепью, и поэтому включает 10 участков связывания антигена, в то время как секретируемые антитела IgA могут полимеризоваться с образованием поливалентных агрегатов, включающих 2-5 основных 4-цепных звеньев вместе с J-цепью). В случае IgG 4-цепочечная единица обычно имеет массу около 150000 дальтон. Каждая L-цепь связана с Н-цепью одной ковалентной дисульфидной связью, в то время как две Н-цепи связаны друг с другом одной или несколькими дисульфидными связями, в зависимости от изотипа H-цепи. Каждая H- и L-цепь также имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая Н-цепь имеет на N-конце вариабельный домен (VH), за которым следуют три константных домена (СН) для каждой из цепей α и γ и четыре домена СН для изотипов µ и ε. Каждая L-цепь имеет на N-конце вариабельный домен (VL), за которым следует константный домен (CL) на другом конце. VL выровнен с VH, а CL выровнен с первым константным доменом тяжелой цепи (CH1). Считается, что конкретные аминокислотные остатки образуют интерфейс между вариабельными доменами легкой цепи и тяжелой цепи. Спаривание VH и VL вместе образует один антигенсвязывающий участок. О структуре и свойствах различных классов антител см., например, Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr и Tristram. G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, стр. 71 и Глава 6.
L-цепь любого вида позвоночных может быть отнесена к одному из двух четко различимых типов, называемых каппа и лямбда, на основе аминокислотных последовательностей их константных доменов. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей (СН) иммуноглобулины могут быть отнесены к разным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющих тяжелые цепи, обозначенные α, δ, γ, ε и µ, соответственно. Классы γ и α далее подразделяются на подклассы на основании относительно незначительных различий в последовательности и функции СН, например, люди экспрессируют следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Термин «вариабельный» относится к тому факту, что определенные сегменты вариабельных доменов сильно различаются по последовательности среди антител. V-домен опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако вариабельность неравномерно распределена по участку вариабельных доменов из 110 аминокислот. На самом деле V-области состоят из относительно инвариантных участков, называемых каркасными областями (FR) из 15-30 аминокислот, разделенных более короткими областями экстремальной вариабельности, называемых «гипервариабельными областями», каждая из которых имеет длину 9-12 аминокислот. Каждый из вариабельных доменов нативных тяжелых и легких цепей включает четыре FR, в значительной степени принимающих конфигурацию бета-листа, соединенных тремя гипервариабельными областями, которые образуют петли, соединяющие и в некоторых случаях являющиеся частью структуры бета-листа. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости с помощью FR и, вместе с гипервариабельными областями из другой цепи, способствуют образованию антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD.1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
Используемый в данном документе термин «CDR» или «область, определяющая комплементарность» предназначен для обозначения несмежных антигенсвязывающих сайтов, обнаруженных в вариабельной области полипептидов как тяжелой, так и легкой цепи. Эти конкретные области были описаны Kabat et al., J. Biol. Chem. 252:6609-6616 (1977); Kabat et al., U.S. Dept. of Health and Human Services, “Sequences of proteins of immunological interest” (1991); by Chothia et al., J. Mol. Biol. 196:901-917 (1987); и MacCallum et al., J. Mol. Biol. 262: 732-745 (1996), где определения включают перекрывающиеся или подмножества аминокислотных остатков при сравнении друг с другом. Тем не менее, подразумевается, что применение любого определения для обозначения CDR антитела или привитых антител или их вариантов входит в объем термина, который определен и используется в настоящем документе. Аминокислотные остатки, которые охватывают CDR, как определено в каждом из приведенных выше источников, приведены ниже в Таблице 2 для сравнения.
Таблица 2
Используемый в данном документе термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, то есть отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными и направлены против одного антигенного участка. Кроме того, в отличие от составов поликлональных антител, которые включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. В дополнение к их специфичности моноклональные антитела имеют то преимущество, что они могут быть синтезированы без загрязнения другими антителами. Модификатор «моноклональный» не следует истолковывать как требующий получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые в настоящем изобретении, могут быть получены с помощью методики гибридом, впервые описанной Kohler et al. Nature. 256:495 (1975), или могут быть получены с использованием методов рекомбинантной ДНК в клетках бактерий, эукариотических животных или растений (см., например, патент США № 4816567). «Моноклональные антитела» также могут быть выделены из библиотек фаговых антител с использованием методик, например, описанных в Clackson et al., Nature, 352: 624-628. (1991), Marks et al., J. Mol. Biol., 222: 581-597 (1991), и приведенных ниже примеров.
Моноклональные антитела в данном документе включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из определенного вида или принадлежащих к определенному классу или подклассу антител, тогда как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител, при условии, что они проявляют биологическую активность по данному изобретению (см. Патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Представляющие интерес химерные антитела в данном документе включают «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученные из примата, не являющегося человеком (например, обезьяны Старого Света, человекообразной обезьяны и т.д.), и последовательности константной области человека.
«Интактным» антителом является антитело, которое включает антигенсвязывающий участок, а также CL и, по меньшей мере, константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены с нативной последовательностью человека) или варианты их аминокислотной последовательности. Предпочтительно интактное антитело имеет одну или несколько эффекторных функций.
«Фрагменты антител» включают часть интактного антитела, предпочтительно антигенсвязывающую или вариабельную область интактного антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; димеры; линейные антитела (см. патент США № 5641870, Пример 2; Zapata et al., Protein Eng. 8 (10): 1057-1062 [1995]); молекулы одноцепочечных антител; и мультиспецифичные антитела, образованные из фрагментов антител. Выражение «линейные антитела» обычно относится к антителам, описанным в Zapata et al., Protein Eng., 8 (10): 1057-1062 (1995). Вкратце, эти антитела включают пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифичными или моноспецифичными.
При расщеплении антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых фрагментами «Fab», и остаточный фрагмент «Fc», названный так из-за способности легко кристаллизоваться. Фрагмент Fab состоит из всей L-цепи вместе с доменом вариабельной области Н-цепи (VH) и первым константным доменом одной тяжелой цепи (CH1). Каждый фрагмент Fab является одновалентным в отношении связывания антигена, то есть он имеет один антигенсвязывающий участок. Обработка антитела пепсином дает один большой фрагмент F(ab')2, который примерно соответствует двум дисульфидно-связанным фрагментам Fab, и обладает двухвалентной антигенсвязывающей активностью, и все еще способен к перекрестному связыванию антигена. Fab'-фрагменты отличаются от Fab-фрагментов наличием дополнительных нескольких остатков на карбокси-конце домена СН1, включающего один или несколько цистеинов из шарнирной области антитела. Fab'-SH представлен в данном документе обозначением Fab', в котором остаток(ки) цистеина константных доменов несут свободную тиоловую группу. Фрагменты антитела F(ab')2 первоначально были получены в виде пар фрагментов Fab', которые имеют шарнирные цистеины между ними. Также известны другие химические сочетания фрагментов антител.
Фрагмент Fc включает карбоксиконцевые части обеих Н-цепей, удерживаемые вместе с помощью дисульфидов. Эффекторные функции антител определяются последовательностями в Fc-области, причем эта область также является частью, распознаваемой рецепторами Fc (FcR), обнаруженными в определенных типах клеток.
«Вариант Fc-области» включает аминокислотную последовательность, которая отличается от последовательности Fc-области с нативной последовательностью благодаря, по меньшей мере, одной «аминокислотной модификации», определенной в данном документе. Предпочтительно, вариант Fc-области имеет, по меньшей мере, одну аминокислотную замену по сравнению с Fc-областью с нативной последовательностью или Fc-областью исходного полипептида, например, от около одной до около десяти аминокислотных замен и предпочтительно от около одной до около пяти аминокислотных замен в Fc-области с нативной последовательностью или в Fc-области исходного полипептида. В одном воплощении вариант Fc-области в данном документе будет обладать, по меньшей мере, около 80% гомологии, по меньшей мере, около 85% гомологии, по меньшей мере, около 90% гомологии, по меньшей мере, около 95% гомологии или, по меньшей мере, около 99% гомологии с нативной последовательностью Fc-области. В соответствии с другим воплощением вариант Fc-области в данном документе будет обладать, по меньшей мере, около 80% гомологии, по меньшей мере, около 85% гомологии, по меньшей мере, около 90% гомологии, по меньшей мере, около 95% гомологии или, по меньшей мере, около 99% гомологии с Fc-областью родительского полипептида.
Термин «полипептид, содержащий Fc-область» относится к полипептиду, такому как антитело или иммуноадгезин (см. определения в другом месте в настоящем документе), который включает Fc-область. С-концевой лизин (остаток 447 согласно системе нумерации EU) Fc-области может быть удален, например, во время очистки полипептида или путем рекомбинантного конструирования нуклеиновой кислоты, кодирующей полипептид. Соответственно, композиция, содержащая полипептиды, включая антитела, имеющие Fc-область по данному изобретению, может включать популяции полипептидов со всеми удаленными остатками K447, популяции полипептидов без удаленных остатков K447 или популяции полипептидов, имеющие смесь полипептидов с остатком K447 и без него.
«Эффекторные функции» антитела относятся к биологическим активностям, относящимся к Fc-области (Fc-область с нативной последовательностью или Fc-область с вариантной аминокислотной последовательностью) антитела, и варьируются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимая цитотоксичность; Связывание с Fc-рецептором; антителозависимая клеточно-опосредованная цитотоксичность (ADCC); фагоцитоз; подавление рецепторов клеточной поверхности; и активация B-клеток. «Fc-область с нативной последовательностью» включает аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, встречающейся в природе. Примеры последовательностей Fc описаны, например, без ограничения указанным, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)).
«Fv» представляет собой минимальный фрагмент антитела, который включает полный сайт узнавания и связывания антигена. Этот фрагмент состоит из димера одного домена вариабельной области тяжелой и одной легкой цепи в тесной нековалентной ассоциации. В результате свертывания этих двух доменов образуются шесть гипервариабельных петель (по 3 петли на каждой из цепей H и L), которые вносят аминокислотные остатки для связывания антигена и придают антителу специфичность связывания антигена.
Однако даже один вариабельный домен (или половина Fv, содержащего только три CDR, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем весь сайт связывания.
«Одноцепочечный Fv», также сокращенно обозначаемый как «sFv» или «scFv», представляет собой фрагменты антител, которые включают домены антител VH и VL, связанные в одну полипептидную цепь. Предпочтительно, полипептид sFv дополнительно включает полипептидный линкер между доменами VH и VL, который позволяет sFv образовывать искомую структуру для связывания антигена. Для обзора sFv, см. Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrebaeck 1995, ниже.
Термин «диатела» относится к небольшим фрагментам антител, полученным конструированием фрагментов sFv (см. предыдущий абзац) с короткими линкерами (около 5-10 остатков) между доменами VH и VL, так что межцепочечное, но не внутрицепочечное спаривание V-доменов, в результате чего получается двухвалентный фрагмент, т.е. фрагмент, имеющий два антигенсвязывающих сайта. Биспецифичные диатела представляют собой гетеродимеры двух «перекрестных» фрагментов sFv, в которых домены VH и VL двух антител присутствуют в разных полипептидных цепях. Диатела описаны более полно, например, в ЕР 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci.USA, 90:6444-6448 (1993).
«Гуманизированные» формы нечеловеческих (например, из грызунов) антител представляют собой химерные антитела, которые включают минимальную последовательность, полученную из нечеловеческого антитела. По большей части гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области вида, отличного от человека (антитела-донора), такого как мыши, крысы, кролика или примата, отличного от человека, имеющие искомую специфичность, аффинность и характеристики антител. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками.
Кроме того, гуманизированные антитела могут включать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти модификации сделаны для дальнейшего улучшения эффективности антитела. В общем, гуманизированное антитело будет включать, по существу, все, по меньшей мере, один, и, как правило, два вариабельных домена, в которых все или, по существу, все гипервариабельные петли соответствуют таковым у нечеловеческого иммуноглобулина, и все или, по существу, все FR происходят из последовательности человеческого иммуноглобулина. Гуманизированное антитело необязательно также будет включать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно часть иммуноглобулина человека. Для получения дополнительной информации см. Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
«Процент (%) идентичности аминокислотной последовательности» или «гомология» по отношению к полипептиду и последовательностям антител, указанным в данном документе, определяется как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в сравниваемом полипептиде после выравнивания последовательностей, рассматривая любые консервативные замены как часть идентичности последовательности. Выравнивание в целях определения процента идентичности аминокислотной последовательности может быть достигнуто различными способами, которые известны специалисту в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего описания значения % идентичности аминокислотной последовательности получают с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была создана Genentech, Inc., а исходный код был зарегистрирован вместе с документацией пользователя в Бюро регистрации авторских прав США, Вашингтон, округ Колумбия, 20559, где она зарегистрирована под регистрационным номером авторского права США TXU510087. Программа ALIGN-2 общедоступна у Genentech, Inc., Южный Сан-Франциско, Калифорния. Программа ALIGN-2 должна быть скомпилирована для использования в операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не изменяются.
Термины «Fc-рецептор» или «FcR» используются для описания рецептора, который связывается с Fc-областью антитела. В одном воплощении FcR по настоящему изобретению представляет собой тот, который связывает антитело IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые отличаются, главным образом, их цитоплазматическими доменами. Активирующий рецептор Fc RIIA включает иммунорецепторный мотив активации на основе тирозина (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIB включает иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в своем цитоплазматическом домене (см. обзор M. in Daëron, Annu. Rev. Immunol. 15:203-234 (1997)). Термин включает аллотипы, такие как аллотипы FcγRIIIA: FcγRIIIA-Phe158, FcγRIIIA-Val158, FcγRIIA-R131 и/или FcγRIIA-H131. FcR рассматриваются в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al.,J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, включая те, которые будут определены в будущем, охватываются термином «FcR» в данном документе. Термин также включает неонатальный рецептор FcRn, который отвечает за перенос материнских IgG к плоду (Guyer et al., J. Immunol . 117: 587 (1976) и Kim et al., J. Immunol . 24:249 (1994)).
Термин «FcRn» относится к неонатальному Fc-рецептору (FcRn). FcRn структурно сходен с основным комплексом гистосовместимости (MHC) и состоит из α-цепи, нековалентно связанной с β2-микроглобулином. Множественные функции Fc-рецептора новорожденных FcRn рассматриваются в Ghetie and Ward (2000) Annu. Rev. Immunol. 18, 739-766. FcRn играет роль в пассивной доставке иммуноглобулинов IgG от матери и в регуляции уровня сывороточных IgG. FcRn может действовать как рецептор реутилизации, связывая и транспортируя пиноцитозированные IgG в интактной форме как внутри, так и между клетками, и спасая их от стандартного пути деградации.
«Домен CH1» Fc-области IgG человека (также называемый «C1» домена «H1») обычно простирается от аминокислоты 118 до аминокислоты 215 (система нумерации EU).
«Шарнирная область» обычно определяется как участок от Glu216 до Pro230 IgG1 человека (Burton, Molec. Immunol.22:161-206 (1985)). Шарнирные области других изотипов IgG могут быть выровнены с последовательностью IgG1 путем размещения первого и последнего остатков цистеина, образующих связи SS между тяжелыми цепями, в тех же положениях.
«Нижний шарнирный участок» из Fc-области обычно определяется как участок остатков сразу к С-концу от шарнирной области, т.е. остатки 233-239 Fc-области. В предыдущих сообщениях связывание с FcR обычно относили к аминокислотными остаткам в нижней шарнирной области Fc-области IgG.
«Домен CH2» Fc-области IgG человека (также называемый «C2» домена «H2») обычно простирается от около 231 аминокислоты до около 340 аминокислоты. Домен CH2 уникален тем, что не связан тесно с другим доменом. Скорее, два N-связанных разветвленных углеводных цепи расположены между двумя доменами CH2 интактной нативной молекулы IgG. Предполагается, что углевод может заменить парное соединение домен-домен и помочь стабилизировать домен CH2. Burton, Molec Immunol. 22:161-206 (1985).
«Домен СН3» (также называемый доменом «С2» или «Н3») включает участок остатков С-конца до домена СН2 в Fc-области (то есть от около аминокислотного остатка 344 до С-конца последовательности антитела, обычно до аминокислотного остатка 446 или 447 из IgG).
«Функциональная Fc-область» обладает «эффекторной функцией» Fc-области с нативной последовательностью. Примерные «эффекторные функции» включают связывание C1q; комплемент-зависимую цитотоксичность; связывание с Fc-рецептором; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; подавление рецепторов клеточной поверхности (например, B-клеточного рецептора; BCR) и т.д. Такие эффекторные функции обычно требуют объединения Fc-области со связывающим доменом (например, вариабельным доменом антитела) и могут быть оценены с использованием различных анализов, например, описанных в настоящем документе.
«C1q» представляет собой полипептид, который включает сайт связывания для Fc-области иммуноглобулина. C1q вместе с двумя сериновыми протеазами, C1r и C1s, образует комплекс C1, первый компонент пути комплемент-зависимой цитотоксичности (CDC). C1q человека может быть приобретен коммерчески, например, в Quidel, Сан-Диего, Калифорния.
Термин «связывающий домен» относится к области полипептида, которая связывается с другой молекулой. В случае FcR домен связывания может включать часть его полипептидной цепи (например, его альфа-цепи), которая отвечает за связывание Fc-области. Одним полезным доменом связывания является внеклеточный домен альфа-цепи FcR.
Антитело с вариантом Fc из IgG с «измененной» аффинностью связывания FcR или активностью ADCC представляет собой антитело, которое обладает либо повышенной, либо пониженной активностью связывания с FcR (например, FcγR или FcRn) и/или активностью ADCC по сравнению с исходным полипептидом или полипептидом, содержащим Fc-область с нативной последовательностью. Вариант Fc, который «обладает повышенным связыванием» с FcR связывает, по меньшей мере, один FcR с более высокой аффинностью (например, ниже кажущимся Kd или значения IC50) по сравнению с исходным полипептидом или нативной последовательностью Fc из IgG. Согласно некоторым воплощениям улучшение связывания по сравнению с исходным полипептидом составляет около 3- кратное, предпочтительно около 5-, 10-, 25-, 50-, 60-, 100-, 150-, 200-, до 500-кратное или от около 25% до 1000% улучшения связывания. Вариант полипептида, который «проявляет пониженное связывание» с FcR, связывает, по меньшей мере, один FcR с более низкой аффинностью (например, с более высокой кажущимся Kd или более высоким значением IC50), чем у исходного полипептида. Снижение связывания по сравнению с исходным полипептидом может составлять около 40% или более снижения связывания.
«Антитело-зависимая клеточно-опосредованная цитотоксичность» или «ADCC» относится к форме цитотоксичности, при которой секретированный Ig, связанный с Fc-рецепторами (FcR), присутствующими на определенных цитотоксических клетках (например, клетках естественных киллерах (NK), нейтрофилах и макрофагах), позволяет этим цитотоксическим эффекторным клеткам специфически связываться с антиген-несущей клеткой-мишенью, и впоследствии убивать клетку-мишень цитотоксинами. Антитела «вооружают» цитотоксические клетки и абсолютно необходимы для такого уничтожения. Первичные клетки, опосредующие ADCC, NK, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки активности ADCC интересующей молекулы может быть проведен анализ ADCC in vitro, такой как анализ, описанный в патенте США № 5500362 или 5821337 или в приведенных ниже примерах. Пригодные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и клетки естественные киллеры (NK). В ином случае или дополнительно, активность ADCC интересующей молекулы может быть оценена in vivo, например, на модели животного, такой как раскрыта в Clynes et al. PNAS (USA) 95:652-656 (1998).
Полипептид, содержащий вариантную Fc-область, которая «проявляет повышенную ADCC» или опосредует антителозависимую клеточно-опосредованную цитотоксичность (ADCC) в присутствии эффекторных клеток человека более эффективно, чем полипептид, имеющий Fc из IgG дикого типа, или родительский полипептид, представляет собой полипептид, который in vitro или in vivo существенно более эффективен в опосредовании ADCC, когда количества полипептида с вариантной Fc-областью и полипептида с Fc-областью дикого типа (или исходного полипептида) в анализе по существу одинаковы. Как правило, такие варианты будут идентифицироваться с использованием любого анализа ADCC in vitro, известного в данной области, такого как анализы или способы определения активности ADCC, например, на животной модели и т.д. В одном воплощении предпочтительный вариант является от около 5 до около 100 раз, например, от около 25 до около 50 раз более эффективным в опосредовании ADCC, чем Fc дикого типа (или родительский полипептид).
«Комплементзависимая цитотоксичность» или «CDC» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны с их когнатным антигеном. Для оценки активации комплемента, может быть проведен анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol.Methods 202:163 (1996). Варианты полипептида с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной способностью связывания C1q описаны в патентах США № 6194551 В1 и WO 99/51642. Содержание этих патентных публикаций специально включено в данный документ ссылкой. См. также Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
«Эффективное количество» анти-PD-1 антитела (или его фрагмента) или композиции, описанной в настоящем документе, представляет собой количество, достаточное для достижения конкретной заявленной цели. «Эффективное количество» может быть определено опытным путем и известными способами, относящимися к заявленной цели. Термин «терапевтически эффективное количество» относится к количеству анти-PD-1 антитела (или его фрагмента) или композиции, как описано в настоящем документе, эффективное для «лечения» заболевания или расстройства у млекопитающего (так называемого пациента). В случае рака терапевтически эффективное количество анти-PD-1 антитела (или его фрагмента) или композиции, описанных в настоящем документе, может уменьшить количество раковых клеток; уменьшить размер или массу опухоли; ингибировать (то есть замедлять до некоторой степени и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) метастазирование опухоли; ингибировать до некоторой степени рост опухоли; и/или ослабить до некоторой степени один или несколько симптомов, связанных с раком. В той степени, в какой анти-PD-1 антитело (или его фрагмент) или композиция, как описано в настоящем документе, может предотвращать рост и/или убивать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. В одном воплощении терапевтически эффективное количество представляет собой количество, ингибирующее рост. В другом воплощении терапевтически эффективное количество представляет собой количество, которое повышает выживаемость пациента. В другом воплощении терапевтически эффективное количество представляет собой количество, которое повышает выживаемость пациента без прогрессирования заболевания.
«Ингибирующее рост количество» анти-PD-1 антитела (или его фрагмента) или композиции, как описано в настоящем документе по настоящему изобретению, представляет собой количество, способное ингибировать рост клетки, особенно опухоли, например, раковой клетки, либо in vitro, либо in vivo. «Ингибирующее рост количество» полипептида, антитела, антагониста или композиции по настоящему изобретению для целей ингибирования роста неопластических клеток может быть определено эмпирически и известными способами или с помощью примеров, представленных в настоящем документе.
«Цитотоксическое количество» анти-PD-1 антитела (или его фрагмента) или композиции по настоящему изобретению представляет собой количество, способное вызывать разрушение клетки, особенно опухоли, например раковой клетки, либо in vitro, либо in vivo. «Цитотоксическое количество» анти-PD-1 антитела (или его фрагмента) или композиции по настоящему изобретению для целей ингибирования роста неопластических клеток может быть определено эмпирически и способами, известными в данной области.
«Ингибирующее рост количество» анти-PD-1 антитела (или его фрагмента) или композиции по настоящему изобретению представляет собой количество, способное ингибировать рост клетки, особенно опухолевой, например раковой клетки, либо in vitro, либо in vivo. «Ингибирующее рост количество» анти-PD-1 антитела (или его фрагмента) или композиции по настоящему изобретению для целей ингибирования роста неопластических клеток может быть определено эмпирически и известными способами или с помощью примеров, представленных в настоящем документе.
Используемый в данном документе термин «фармацевтически приемлемый» или «фармакологически совместимый» означает материал, который не является биологически или иным образом нежелательным, например, материал может быть включен в фармацевтическую композицию, вводимую пациенту, не вызывая каких-либо значительных нежелательных биологических эффектов или не взаимодействуя вредным образом с любым другим компонентом композиции, в которой материал содержится. Фармацевтически приемлемые носители или эксципиенты предпочтительно соответствуют требуемым стандартам токсикологических и производственных испытаний и/или включены в Руководство по неактивным ингредиентам, подготовленное Управлением по контролю за продуктами и лекарствами США.
Термин «обнаружение» предназначен для включения определения наличия или отсутствия вещества или количественного определения количества вещества (такого как PD-1). Таким образом, термин относится к применению материалов, композиций и способов по настоящему изобретению для качественных и количественных определений. В общем, конкретная методика, используемая для обнаружения, не является критичной для практического применения изобретения.
Например, «обнаружение» согласно изобретению может включать: наблюдение наличия или отсутствия продукта гена PD-1, молекул мРНК или полипептида PD-1; изменение уровней полипептида PD-1 или количества, связанного с мишенью; изменение биологической функции/активности полипептида PD-1. В некоторых воплощениях «обнаружение» может включать обнаружение уровней PD-1 дикого типа (например, уровней мРНК или полипептида). Обнаружение может включать количественную оценку изменения (увеличения или уменьшения) любого значения от 10% до 90% или любого значения от 30% до 60% или более 100% по сравнению с контролем. Обнаружение может включать количественную оценку изменения любого значения от 2 до 10 раз, включительно или более, например, в 100 раз.
Слово «метка» при использовании в настоящем документе относится к обнаруживаемому соединению или композиции, которые прямо или косвенно конъюгированы с антителом. Сама метка может быть обнаруживаемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химическое изменение соединения или композиции субстрата, которое можно обнаружить.
Ссылка на «около» в отношении значения или параметра в данном документе относится к обычному диапазону ошибок для соответствующего значения, хорошо известного специалисту в данной области техники. Ссылка на «около» в отношении значения или параметра в данном документе включает (и описывает) аспекты, которые направлены на это значение или параметр per se. Например, описание, относящееся к «около X», включает описание «X».
Понятно, что аспекты и воплощения изобретения, описанные в данном документе, включают «содержащий», «состоящий» и «состоящий по существу из» аспектов и воплощений.
Все источники, процитированные в данном документе, включая заявки на патент и публикации, полностью включены в настоящее описание ссылкой.
Антитела против PD-1
Настоящее изобретение основано на идентификации новых антител, которые связывают рецептор PD-1 (PD-1). Антитела против PD-1 можно использовать в различных терапевтических и диагностических способах. Например, анти-PD-1 антитела можно использовать отдельно или в комбинации с другими агентами при лечении заболевания, характеризующегося аномальной экспрессией PD-1 или аномальной активностью PD-1, включая, например, меланому, рак головы и шеи, рак уротелия, рак молочной железы (например, тройной негативный рак молочной железы, TNBC), рак желудка, классическую лимфому Ходжкина (cHL), неходжкинскую лимфому первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиому, рак яичника, рак легкого (например, мелкоклеточный рак легкого), рак пищевода, назофарингеальную карциному (NPC), рак желчных путей, колоректальный рак, рак шейки матки, рак щитовидной железы и рак слюнных желёз. Представленные в данном документе антитела также можно использовать для обнаружения белка PD-1 у пациентов или в образцах пациентов путем введения анти-PD-1 антител пациентам и выявления анти-PD-1 антител, связанных с белком PD-1, в образце из пациента (например, in vivo или ex vivo) или путем контакта анти-PD-1 антител с образцами пациентов и качественного или количественного определения анти-PD-1 антитела, связанного с белком PD-1.
Белок 1 запрограммированной смерти (также известный как PD-1 и CD279 (кластер дифференцировки 279)) - это белок, который у людей кодируется геном PDCD1. PD-1 является рецептором клеточной поверхности, который принадлежит к суперсемейству иммуноглобулинов и экспрессируется на Т-клетках и про-В клетках. PD-1 связывает два лиганда, PD-L1 и PD-L2. PD-1, функционирующий в качестве иммунного чекпоинта, играет важную роль в подавлении иммунной системы путем предотвращения активации Т-клеток, что, в свою очередь, снижает аутоиммунитет и способствует аутотолерантности. Ингибирующий эффект PD-1 достигается благодаря двойному механизму стимуляции апоптоза (программируемой гибели клеток) в антигенспецифических Т-клетках в лимфатических узлах, одновременно снижая апоптоз в регуляторных Т-клетках (Т-клетках-супрессорах).
Антитело против PD-1 представляет собой антитело, которое связывается с PD-1 с достаточной аффинностью и специфичностью. Предпочтительно анти-PD-1 антитело, представленное в настоящем документе (или его антигенсвязывающий фрагмент), можно использовать в качестве терапевтического средства для направленного воздействия и предотвращения заболеваний или состояний, в которые вовлечена активность PD-1. Антитело против PD-1 обычно не связывается с другими суперсемействами иммуноглобулинов. Предпочтительно анти-PD-1 антитело представляет собой рекомбинантное гуманизированное моноклональное анти-PD-1 антитело.
В соответствии с одним воплощением анти-PD-1 антитело включает CDR, вариабельную область тяжелой цепи и/или вариабельную область легкой цепи любого из антител, раскрытых в данном документе. В некоторых воплощениях анти-PD-1 антитело по изобретению представляет собой химерное анти-PD-1 антитело c1G4 и/или гуманизированное анти-PD-1 антитело h1G4, включающее последовательность вариабельного домена легкой цепи (LC), включающую (1) CDR-L1, включающую аминокислотную последовательность KASQDVTTAVA (SEQ ID NO: 9); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11) и последовательность вариабельного домена тяжелой цепи (HC), включающую аминокислотную последовательность (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO:12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность VSYYYGIDF (SEQ ID NO: 14). В некоторых воплощениях вариант включает, по меньшей мере, 1, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5, по меньшей мере, 6, по меньшей мере, 7, по меньшей мере, 8, по меньшей мере, 9 или, по меньшей мере, 10 аминокислотных замен в одном или нескольких из SEQ ID NO: 9-14.
Полноразмерные аминокислотные и нуклеотидные последовательности легких и тяжелых цепей c1G4 и h1G4 и их последовательности CDR представлены в Перечне последовательностей ниже.
Изобретение также относится к анти-PD-1 антителу или его антигенсвязывающему фрагменту, включающему последовательность тяжелой цепи, включающую аминокислотную последовательность, представленную в (SEQ ID NO: 4), и последовательность легкой цепи, включающую аминокислотную последовательность, представленную в SEQ ID NO: 2).
Изобретение также относится к гуманизированному анти-PD-1 антителу или его антигенсвязывающему фрагменту, включающему аминокислотную последовательность, тяжелой цепи представленную в (SEQ ID NO: 8), и к последовательности легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 6).
Изобретение, кроме того, обеспечивает аффинно-зрелые антитела против гуманизированного анти-PD-1 антитела h1G4. В некоторых воплощениях зрелое анти-PD-1 антитело (например, анти-PD-1 антитело 33B) по изобретению включает последовательность вариабельного домена легкой цепи (LC), включающую (1) CDR-L1, включающую аминокислотную последовательность KASTDVTTAVA (SEQ ID NO: 15); (2) CDR-L2, включающую аминокислотную последовательность WASLRHT (SEQ ID NO: 16); и (3) CDR-L3, включающую аминокислотную последовательность QQHYGIPWT (SEQ ID NO: 17) и последовательность вариабельного домена тяжелой цепи (HC), включающую (1) CDR-H1, включающую аминокислотную последовательность FRFSNYGMS (SEQ ID NO:18); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNAY (SEQ ID NO: 19); и (3) CDR-H3, включающую аминокислотную последовательность TSYYYGIDF (SEQ ID NO: 20).
В других воплощениях зрелое анти-PD-1 антитело (например, анти-PD-1 антитело 66E) по изобретению включает последовательность вариабельного домена легкой цепи (LC), включающую (1) CDR-L1, включающую аминокислотную последовательность KAKQDVTTAVA (SEQ ID NO: 21); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYWIPWT (SEQ ID NO: 22), и последовательность вариабельного домена тяжелой цепи (HC), включающую (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO:12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность VSYYYGIDL (SEQ ID NO: 23).
В некоторых воплощениях зрелое анти-PD-1 антитело (например, анти-PD-1 антитело, 711D) по изобретению включает последовательность вариабельного домена легкой цепи (LC), включающую (1) CDR-L1, включающую аминокислотную последовательность KASQDVTNAVA (SEQ ID NO: 24); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11) и последовательность вариабельного домена тяжелой цепи (HC), включающую (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность SSYYYGIDL (SEQ ID NO: 25).
Вариабельные домены тяжелой и легкой цепей и CDR объединяют во всех возможных парных комбинациях для получения ряда анти-PD-1 антител.
В определенных воплощениях аминокислотная замена (замены) представляет собой консервативную аминокислотную замену (замены). В некоторых воплощениях аминокислотные замены существенно не снижают способность антитела связываться с антигеном. Например, могут быть сделаны консервативные изменения (например, консервативные замены, представленные в настоящем документе), которые существенно не снижают аффинность связывания с PD-1. Аффинность связывания вариантов анти-PD-1 антител можно оценить, используя способы, описанные в примерах ниже.
Консервативные замены приведены в Таблице 3 под заголовком «консервативные замены». Более существенные изменения представлены в Таблице 3 под заголовком «примерные замены» и дополнительно описаны ниже со ссылкой на классы боковых цепей аминокислот. Аминокислотные замены могут быть введены в интересующее антитело, и продукты будут подвергнуты скринингу на искомую активность, например, сохраненное/улучшенное связывание с PD-1, пониженную иммуногенность или улучшенную ADCC или CDC.
Таблица 3: КОНСЕРВАТИВНЫЕ ЗАМЕНЫ
Неконсервативные замены повлекут за собой замену члена одного из этих классов на другой класс. Типичным вариантом замены является антитело со зрелой аффинностью, которое может быть получено удобным образом, например, с использованием методов созревания аффинности на основе фагового дисплея, таких как описанные в данном документе. Вкратце, один или несколько остатков CDR мутируют, и варианты антител презентируются на фаге и подвергаются скринингу на предмет определенной биологической активности (например, аффинности связывания). Изменения (например, замены) могут быть сделаны в HVR, например, для улучшения аффинности антитела. Такие изменения могут быть сделаны в «горячих точках» HVR, то есть остатках, кодируемых кодонами, которые подвергаются мутации с высокой частотой в процессе соматического созревания (см., например, Chowdhury, Methods Mol. Biol. 207: 179-196 (2008)) и/или SDR (a-CDR), причем полученный вариант VH или VL тестируют на аффинность связывания. Было описано созревание аффинности путем конструирования и повторного выбора из вторичных библиотек, например, в Hoogenboom et al. в Methods in Molecular Biology 178: 1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001).
В некоторых воплощениях аффинного созревания разнообразие вводят в вариабельные гены, выбранные для созревания, любым из множества способов (например, ПЦР пониженной точности, шаффлинг цепей или олигонуклеотид-направленный мутагенез). Затем создается вторичная библиотека. Затем библиотеку подвергают скринингу для выявления любых вариантов антител с искомой аффинностью. Другой способ введения разнообразия включает HVR-ориентированные подходы, в которых несколько остатков HVR (например, 4-6 остатков за раз) рандомизированы. Остатки HVR, участвующие в связывании антигена, могут быть конкретно идентифицированы, например, с помощью сканирующего мутагенеза аланином или моделирования. В частности, мишенями часто являются CDR-H3 и CDR-L3.
В некоторых воплощениях анти-PD-1 антитело включает последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, 21 и 24; (2) CDR-L2, включающую аминокислотную последовательность SEQ ID NO: 10 или 16; (3) CDR-L3, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, 17, 22, и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающую аминокислотную последовательность SEQ ID NO: 12 или 18; (2) CDR-H2, включающую аминокислотную последовательность SEQ ID NO: 13 или 19; и (3) CDR-H3, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 14, 20, 23 и 25.
Вариабельные домены тяжелой и легкой цепей объединяют во всех возможных парных комбинациях для получения ряда анти-PD-1 антител.
В некоторых воплощениях анти-PD-1 антитело может не иметь мотива N-гликозилирования в вариабельной области тяжелой цепи или легкой цепи, который может вызывать различия внутри партии антител, что приводит к измененной функции, иммуногенности или стабильности. Способы анализа гликозилирования антител включают, без ограничения указанным, например, хроматографию (такую как катионообменная хроматография (CEX) или жидкостная хроматография), масс-спектрометрию (такую как масс-спектрометрия с ионизацией электрораспылением) и капиллярный электрофорез с додецилсульфатом натрия. Такие способы описаны, например, в Jung et al. (2011) Curr Op Biotechnol. 22(6):858-67; Cummings RD, Etzler ME. Antibodies and Lectins in Glycan Analysis. In: Varki A, Cummings RD, Esko JD, et al., editors. Essentials of Glycobiology. 2nd edition. Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press; 2009. Chapter 45; Mulloy B, Hart GW, Stanley P. Structural Analysis of Glycans. In: Varki A, Cummings RD, Esko JD, et al., editors. Essentials of Glycobiology. 2nd edition. Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press; 2009. Chapter 47; Leymarie, et al. (2012) Anal Chem. 84(7): 3040-3048; Fernandez (2005) European Biopharmaceutical Review. pp 106-110; и Raju, T. (2013) Methods Mol Biol. 988: 169-180.
В некоторых воплощениях анти-PD-1 антитело обладает более сильной аффинностью связывания с PD-1, чем с гомологом этого PD-1. Обычно анти-PD-1 антитело «специфически связывается» с PD-1 (т.е. имеет значение аффинности связывания (Kd) не более, чем около 1 × 10-7 М, предпочтительно, не более, чем около 1 × 10-8 и наиболее предпочтительно не более чем около 1 × 10-9 М), но имеет аффинность связывания для представителя семейства PD-1, которая составляет, по меньшей мере, в около 50 раз или, по меньшей мере, в около 500 раз или, по меньшей мере, в около 1000 раз слабее, чем его аффинность к PD-1. Анти-PD-1 антитело, которое специфически связывается с PD-1, может представлять собой любой из различных типов антител, определенных выше, но предпочтительно представляет собой гуманизированное антитело или антитело человека.
В некоторых воплощениях степень связывания анти-PD-1 антитела с нецелевым белком составляет менее чем около 10% от связывания антитела с PD-1, определенная способами, известными в данной области, такими как ELISA, анализ флуоресцентной сортировкой клеток (FACS) или радиоиммунопреципитация (RIA). Специфическое связывание может быть измерено, например, путем определения связывания молекулы по сравнению со связыванием контрольной молекулы, которая обычно представляет собой молекулу сходной структуры, которая не обладает активностью связывания. Например, специфическое связывание может быть определено путем конкуренции с контрольной молекулой, которая похожа на мишень, например, с избытком немеченой мишени. В этом случае специфическое связывание указывается, если связывание меченой мишени с зондом конкурентно ингибируется избытком немеченой мишени. Используемый в данном документе термин «специфическое связывание» или «специфически связывается с» или «специфичный для» конкретного полипептида или эпитопа на конкретной полипептидной мишени может быть продемонстрирован, например, молекулой, имеющей Kd для
-6
мишени, по меньшей мере, около 10-4 М, альтернативно, по меньшей мере, около 10-5 М, альтернативно, по меньшей мере, около 10-6 М, альтернативно, по меньшей мере, около 10-7 М, альтернативно, по меньшей мере, около 10-8 М, альтернативно, по меньшей мере, около 10-9 М, альтернативно, по меньшей мере, около 10-10 М, альтернативно, по меньшей мере, около 10-11 М, альтернативно, по меньшей мере, около 10-12 М или более. В одном воплощении термин «специфическое связывание» относится к связыванию, в котором молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или полипептидным эпитопом.
Антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC) представляет собой механизм действия терапевтических антител против опухолевых клеток. ADCC является клеточно-опосредованной иммунной защитой, посредством которой эффекторная клетка иммунной системы активно лизирует клетку-мишень (например, раковую клетку), чьи антигены на поверхности мембраны были связаны специфическими антителами (например, такими как анти-PD-1 антитело, описанное в данном документе). В некоторых воплощениях анти-PD-1 антитело проявляет эффекторную функцию, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC), сходную с OPDIVO® или Ниволумабом, демонстрируемую, например, в анализах, описанных в Примере.
Например, в определенных воплощениях активность эффекторной функции ADCC анти-PD-1 антитела, описанного в настоящем документе, составляет, по меньшей мере, около 80%, по меньшей мере, около 85%, по меньшей мере, около 90%, по меньшей мере, около 91%, по меньшей мере, около 92 %, по меньшей мере, около 93%, по меньшей мере, около 94%, по меньшей мере, около 95%, по меньшей мере, около 96%, по меньшей мере, около 97%, по меньшей мере, около 98%, по меньшей мере, около 99%, по меньшей мере, около 100%, или более 100% (например, около 105%, около 106%, около 107%, около 108%, около 109%, около 110%, около 111%, около 112%, около 113%, около 114%, около 115%, около 116%, около 117%, около 118%, около 119%, около 120%, около 121%, около 122%, около 123%, около 124%, около 125% или около 130%) активности эффекторной функции ADCC у OPDIVO® (Ниволумаба), включая любой диапазон между этими значениями.
В некоторых воплощениях анти-PD-1 антитело проявляет сходную аффинность связывания с PD-1, что и OPDIVO®. В некоторых воплощениях связывание с PD-1 демонстрируют с помощью ELISA, как описано в примерах. Например, аффинность связывания анти-PD-1 антитела с PD-1 составляет около 1%, около 5%, около 10%, около 15%, около 20%, около 30%, около 40%, около 50%, около 60%, около 70%, около 80%, около 90%, около 95%, около 96%, около 97%, около 98%, около 99%, около На 100% или более чем на 100% выше (например, около 105%, около 106%, около 107%, около 108%, около 109%, около 110%, около 111%, около 112%, около 113%, около 114%, около 115%, около 116%, около 117%, около 118%, около 119%, около 120%, около 121%, около 122%, около 123%, около 124%, около 125% или более чем около 125%), чем аффинность связывания OPDIVO® (Ниволумаба) с PD-1.
В некоторых воплощениях анти-PD-1 антитело связывает PD-1 человека с Kd от около 0,1 до 200 пМ (0,2 нМ), например, около 0,1 пМ, около 0,25 пМ, около 0,5 пМ, около 0,5 пМ, около 0,75 пМ, около 1 пМ, около 5 пМ, около 10 пМ, около 20 пМ, около 30 пМ, около 40 пМ, около 50 пМ, около 60 пМ, около 70 пМ, около 80 пМ, около 90 пМ, около 100 пМ, около 110 пМ, около 120 пМ, около 130 пМ, около 140 пМ, около 150 пМ, около 160 пМ, около 170 пМ, около 180 пМ, около 190 пМ или более чем около 190 пМ, включая любой диапазон между этими значениями. В некоторых воплощениях аффинность связывания анти-PD-1 антитела с PD-1 более чем на около 1%, около 5%, около 10%, около 15%, около 20%, около 30%, около 40%, около 50 %, около 60%, около 70%, около 80%, около 90%, около 95%, около 96%, около 97%, около 98%, около 99%, около 100% или более чем на около 100% выше (например, на около 105%, около 110%, около 120% или около 130% выше), чем аффинность связывания OPDIVO® (Ниволумаба) с PD-1. В некоторых воплощениях аффинность связывания анти-PD-1 с PD-1 в около 1,1 раза, около 1,2 раза, около 1,3 раза, около 1,4 раза, около 1,5 раза, около 1,6 раза, около 1,7 раза, в около 1,8 раза, в около 1,9 раза, в около 2 раза, в около 2,25 раза, в около 2,5 раза, около 2,75 раза, около 3 раза, около 3,25 раза, около 3,5 раза, около 3,75 раза, около 4 раза, около 4,25 раза, около 4,5 раза, около 4,75 раза или более чем в 4,75 раза выше, чем аффинность связывания OPDIVO® (Ниволумаба) с PD-1, включая любой диапазон между этими значениями.
В некоторых воплощениях анти-PD-1 антитела, представленные в настоящем документе, имеют более длительные периоды полувыведения in vivo по сравнению с OPDIVO®. В некоторых воплощениях период полувыведения in vivo анти-PD-1 антитела, описанного в данном документе, не короче периода полувыведения in vivo OPDIVO®.
В определенных воплощениях анти-PD-1 антитела, представленные в настоящем документе, проявляют фармакокинетические свойства, которые аналогичны свойствам OPDIVO® (Ниволумаба) или его биоподобных. В определенных воплощениях анти-PD-1 антитела, представленные в настоящем документе, имеют AUC (площадь под кривой), которая составляет около 50%, около 55%, около 60%, около 65%, около 70%, около 75%, около 80%. около 85%, около 90%, около 95% или более 95% (например, около 96%, около 97%, около 98%, около 99% или более чем около 99%) профилей зависимости концентрации в сыворотке от времени для OPDIVO® (Ниволумаб) или его биоподобного, включая любой диапазон между этими значениями.
В некоторых воплощениях антитело включает последовательность Fc из IgG человека, например, IgG1 человека или IgG4 человека. В некоторых воплощениях последовательность Fc была переделана или иным образом изменена таким образом, что в ней отсутствует эффекторная функция антителозависимой клеточной цитотоксичности (ADCC), часто связанная со связыванием Fc с рецепторами Fc (FcR). Существует много примеров изменений или мутаций в последовательностях Fc, которые могут изменять эффекторную функцию. Например, WO 00/42072 и Shields et al. J Biol. Chem. 9(2): 6591-6604 (2001) описывает варианты антител с улучшенным или уменьшенным связыванием с FcR. Содержание этих публикаций специально включено в данный документ ссылкой. Антитело может быть в форме Fab, Fab', F(ab)'2, одноцепочечного Fv (scFv), фрагмента Fv; диатела и линейного антитела. Также антитело может представлять собой полиспецифическое антитело, которое связывается с PD-1, но также связывает одну или несколько других мишеней и ингибирует их функцию. Антитело может быть конъюгировано с терапевтическим агентом (например, цитотоксическим агентом, радиоизотопом и химиотерапевтическим агентом) или меткой для обнаружения PD-1 в образцах пациентов или in vivo путем визуализации (например, радиоизотоп, флуоресцентный краситель и фермент). Другие модификации включают конъюгирование токсинов с анти-PD-1 антителами, представленными в данном документе.
Также рассматриваются молекулы нуклеиновой кислоты, кодирующие анти-PD-1 антитела, экспрессирующие векторы, содержащие молекулы нуклеиновой кислоты, кодирующие CDR и/или вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи, описанные в данном документе, и клетки, содержащие молекулы нуклеиновой кислоты. Эти антитела могут быть использованы в описанной в данном документе терапии и для обнаружения белка PD-1 в образцах пациентов (например, с помощью FACS, иммуногистохимии (IHC), анализов ELISA) или в пациентах.
Моноклональные антитела
Моноклональные антитела могут быть получены, например, с использованием гибридомных способов, таких как описанные Kohler and Milstein, Nature, 256: 495 (1975), или могут быть получены способами рекомбинантных ДНК (патент США № 4816567) или могут быть получены с помощью способов, описанных в данном документе в примерах ниже. В гибридомном способе обычно иммунизируют хомяка, мышь или другого подходящего животного-хозяина иммунизирующим агентом для индукции лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с иммунизирующим агентом. В ином случае лимфоциты могут быть иммунизированы in vitro.
Иммунизирующий агент обычно включает полипептид или гибридный белок представляющего интерес белка или композицию, содержащую белок. Обычно используют либо лимфоциты периферической крови («PBL»), если желательны клетки человеческого происхождения, либо клетки селезенки или клетки лимфатических узлов, если желательны источники-млекопитающие не являющиеся человеком. Затем осуществляют слияние лимфоцитов с иммортализованной клеточной линией с использованием подходящего агента, вызывающего слияние, такого как полиэтиленгликоль, для образования клетки гибридомы (Goding, MONOCLONAL ANTIBODIES: PRINCIPLESAND PRACTICE, New York: Academic Press, 1986, pp. 59-103). Бессмертные клеточные линии обычно представляют собой трансформированные клетки млекопитающих, особенно клетки миеломы грызунов, коровы и человека. Обычно используются линии клеток миеломы крысы или мыши. Клетки гибридомы можно культивировать в подходящей культуральной среде, которая предпочтительно включает одно или несколько веществ, которые ингибируют рост или выживание не слитых иммортализованных клеток. Например, если в родительских клетках отсутствует фермент гипоксантин-гуанин-фосфорибозилтрансфераза (HGPRT или HPRT), культуральная среда для гибридом обычно включает гипоксантин, аминоптерин и тимидин («среда HAT»), которые препятствуют росту HGPRT-дефицитных клеток.
Предпочтительными иммортализованными клеточными линиями являются те, которые эффективно сливаются, поддерживают стабильную экспрессию антител высокого уровня выбранными антителопродуцирующими клетками и чувствительны к среде, такой как среда HAT. Более предпочтительными иммортализованными клеточными линиями являются линии мышиной миеломы, которые можно получить, например, в Центре распределения клеток Института Солка, Сан-Диего, Калифорния, и в Американской коллекции типовых культур, Манассас, Вирджиния. Линии клеток миеломы человека и гетеромиеломы мыши-человека также были описаны для получения человеческих моноклональных антител (Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al. MONOCLONAL ANTIBODY PRODUCTION TECHNIQUES ANDAPPLICATIONS, Marcel Dekker, Inc.: New York, 1987, pp. 51-63).
Культуральная среда, в которой культивируются клетки гибридомы, может быть затем проанализирована на наличие моноклональных антител, направленных против полипептида. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, может быть определена иммунопреципитацией или анализом связывания in vitro, таким как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Такие методы и анализы известны в данной области. Аффинность связывания моноклонального антитела можно, например, определить с помощью анализа Скэтчарда из Munson and Pollard, Anal. Biochem., 107:220 (1980).
После того, как искомые гибридомные клетки идентифицированы, клоны могут быть субклонированы путем ограничения процедур разведения и выращены стандартными способами. Goding, выше. Подходящие культуральные среды для этой цели включают, например, модифицированную по Дульбекко среду Игла и среду RPMI-1640. В ином случае, клетки гибридомы можно выращивать in vivo в виде асцита у млекопитающего.
Моноклональные антитела, секретируемые субклонами, могут быть выделены или очищены из культуральной среды или асцитной жидкости с помощью обычных процедур очистки иммуноглобулина, таких как, например, хроматография на сефарозе с протеином А, хроматография на гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография.
Моноклональные антитела также могут быть получены способами рекомбинантной ДНК, такими как описанные в патенте США № 4816567. ДНК, кодирующая моноклональные антитела, представленные в данном документе, может быть легко выделена и секвенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). Клетки гибридомы, представленные в данном документе, служат предпочтительным источником такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируются в клетки-хозяева, такие как обезьяньи клетки COS, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые иначе не продуцируют белок иммуноглобулина, для получения синтеза моноклонального антитела в рекомбинантных клетках-хозяевах. ДНК также может быть модифицирована, например, путем замены кодирующей последовательности константных доменов тяжелой и легкой цепи человека вместо гомологичных мышиных последовательностей (патент США № 4816567; Morrison et al., выше) или путем ковалентного присоединения к кодирующей последовательности иммуноглобулина полностью или частично кодирующей последовательности для полипептида неиммуноглобулина. Такой неиммуноглобулиновый полипептид может быть заменен константными доменами антитела, представленного в настоящем документе, или может быть заменен вариабельными доменами одного антигенсвязывающего сайта антитела, предоставленного в настоящем документе, для создания химерного двухвалентного антитела.
В некоторых воплощениях анти-PD-1 антитело, предлагаемое в изобретении, экспрессируется стабильной клеточной линией млекопитающих. В некоторых воплощениях анти-PD-1 антитело, обеспечиваемое изобретением, экспрессируется из стабильной клеточной линии млекопитающих при титре около 2,0 г/л, около 2,5 г/л, около 3,0 г/л, около 3,5 г/л, около 4,0 г/л, около 4,5 г/л, около 5,0 г/л, около 5,5 г/л, около 6 г/л, около 6,5 г/л, около 7,0 г/л или более чем около 7,0 г/л, включая любой интервал между этими значениями. В некоторых воплощениях стабильная клеточная линия млекопитающих, которая экспрессирует анти-PD-1 антитело, обеспечиваемое изобретением, представляет собой клеточную линию СНО.
В определенных воплощениях антитела представляют собой моновалентные антитела. Способы получения моновалентных антител известны в данной области. Например, один способ включает рекомбинантную экспрессию легкой цепи иммуноглобулина и модифицированной тяжелой цепи. Тяжелая цепь обычно усекается в любой точке Fc-области, чтобы предотвратить сшивание тяжелой цепи. В ином случае, соответствующие остатки цистеина замещены другим аминокислотным остатком или удалены, чтобы предотвратить сшивание.
Способы in vitro также подходят для получения моновалентных антител. Расщепление антител для получения их фрагментов, в частности, фрагментов Fab, может быть выполнено с использованием, без ограничения указанным, способов, известных в данной области.
Человеческие и гуманизированные антитела
Антитела могут быть гуманизированными антителами или антителами человека. Гуманизированные формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые обычно включают минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Гуманизированные антитела включают иммуноглобулины человека (антитело-реципиент), в которых остатки из CDR реципиента заменены остатками из CDR не являющегося человеком вида (антитело-донор), такого как мышь, крыса или кролик, имеющего искомую специфичность, аффинность и функциональная активность. В некоторых случаях каркасные остатки Fv человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Гуманизированные антитела также могут включать остатки, которые не обнаружены ни в реципиентном антителе, ни в импортированных CDR или каркасных последовательностях. В общем, гуманизированное антитело может включать, по существу, все, по меньшей мере, один, и обычно два, вариабельных домена, в которых все или по существу все области CDR соответствуют областям иммуноглобулина, отличного от человека, и все или по существу все области FR представляют собой области консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело предпочтительно также будет включать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно из иммуноглобулина человека. Jones et al. Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-329 (1988); Presta, Curr. Op. Struct. Biol., 2:593-596 (1992).
Как правило, гуманизированное антитело имеет один или несколько аминокислотных остатков, введенных в него из источника, который не является человеком. Эти нечеловеческие аминокислотные остатки часто называют «импортированными» остатками, которые обычно берут из «импортного» вариабельного домена. Согласно одному воплощению гуманизация может быть по существу выполнена по методу Winter и его коллег (Jones et al. Nature, 321: 522-525 (1986); Riechmann et al. Nature, 332: 323-327 (1988); Verhoeyen et al. Science, 239: 1534-1536 (1988)), путем замены CDR или последовательностей CDR грызунов соответствующими последовательностями человеческого антитела. Соответственно, такими «гуманизированными» антителами являются антитела (патент США № 4816567), в которых существенно меньше, чем интактный вариабельный домен человека, было замещено соответствующей последовательностью из не являющегося человеком вида. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR замещены остатками из аналогичных участков в антителах грызунов.
В качестве альтернативы гуманизации можно получать человеческие антитела. Например, теперь возможно получить трансгенных животных (например, мышей), которые способны после иммунизации производить полный репертуар человеческих антител в отсутствие продукции эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция гена области присоединения тяжелой цепи антитела (JH) у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продукции эндогенных антител. Перенос массива генов иммуноглобулина зародышевой линии человека таким мышам-мутантам по зародышевой линии приведет к выработке человеческих антител при заражении антигеном. См., например, Jakobovits et al. PNAS USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al.Year in Immunol., 7:33 (1993); пат. США No. 5545806, 5569825, 5591669; 5545807; и WO 97/17852.
В ином случае, человеческие антитела могут быть получены путем введения локусов человеческого иммуноглобулина у трансгенных животных, например мышей, у которых гены эндогенного иммуноглобулина были частично или полностью инактивированы. При заражении наблюдается продуцирование человеческих антител, которое очень похоже на то, что наблюдается у людей во всех отношениях, включая перестройку генов, сборку, и репертуар антител. Этот подход описан, например, в патентах США № 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016 и Marks et al., Bio/Technology, 10: 779-783 (1992); Lonberg et al., Nature, 368: 856-859 (1994); Morrison, Nature, 368: 812-813 (1994); Fishwild et al. Nature Biotechnology, 14: 845-851 (1996); Neuberger, Nature Biotechnology, 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol., 13: 65-93 (1995).
В ином случае, для получения человеческих антител и фрагментов антител in vitro из репертуара генов вариабельного (V) домена иммуноглобулина из неиммунизированных доноров может использоваться технология фагового дисплея (McCafferty et al., Nature 348: 552-553, 1990). Согласно одному воплощению этого способа последовательности V-домена антитела клонируют в рамке в ген основного или минорного белка оболочки нитевидного бактериофага, такого как M13 или fd, и презентируют в виде функциональных фрагментов антитела на поверхности частицы фага. Фаговая презентация может быть выполнена во множестве форматов, например, как описано ниже в разделе «Примеры», или как описано, например, в Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3: 564-571 (1993). Для фагового дисплея могут быть использованы несколько источников сегментов V-гена. Clackson et al., Nature, 352: 624-628 (1991) выделили разнообразный набор антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученных из селезенки иммунизированных мышей. Можно создать репертуар V-генов от неиммунизированных человеческих доноров, а антитела к разнообразному множеству антигенов (включая аутоантигены) могут быть выделены, по существу, следуя методам, описанным Marks et al., J. Mol. Biol. 222:581-597 (1991) или Griffith et al., EMBO J. 12:725-734 (1993). См. Также патенты США № 5565322 и 5573905.
Как обсуждалось выше, человеческие антитела могут также вырабатываться активированными in vitro B-клетками (см. Патенты США 5567610 и 5229275).
Человеческие антитела также могут быть получены с использованием различных методов, известных в данной области, включая библиотеки фагового дисплея. Hoogenboom and Winter, J. Mol. Biol., 227: 381 (1991); Marks et al., J. Mol. Biol., 222: 581 (1991). Методы Cole et al. и Boerner et al. также доступны для получения человеческих моноклональных антител. Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985) и Boerner et al., J. Immunol., 147(1): 86-95 (1991).
Мультиспецифичные антитела
Мультиспецифичные антитела представляют собой моноклональные, предпочтительно человеческие или гуманизированные, антитела, которые имеют специфичность связывания для двух или более различных антигенов (например, биспецифичные антитела имеют специфичность связывания, по меньшей мере, с двумя антигенами). Например, одна из специфичностей связывания может быть для белка a5~1, а другая может быть для любого другого антигена. Согласно одному предпочтительному воплощению другой антиген представляет собой белок клеточной поверхности или рецептор или субъединицу рецептора. Например, белок клеточной поверхности может представлять собой рецептор клетки-естественного киллера (NK). Таким образом, согласно одному воплощению биспецифическое антитело по данному изобретению может связывать как PD-1, так и, например, второй рецептор клеточной поверхности.
Подходящие способы получения биспецифичных антител хорошо известны в данной области. Например, рекомбинантная продукция биспецифичных антител основана на коэкспрессии двух пар тяжелой цепи/легкой цепей иммуноглобулина, где две тяжелые цепи имеют различную специфичность. Milstein and Cuello, Nature, 305: 537-539 (1983). Из-за случайного ассортимента тяжелых и легких цепей иммуноглобулина эти гибридомы (квадромы) продуцируют потенциальную смесь из десяти различных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка правильной молекулы обычно осуществляется с помощью стадий аффинной хроматографии. Подобные процедуры раскрыты в WO 93/08829 и в Traunecker et al., EMBO, 10: 3655-3659 (1991).
Вариабельные домены антител с искомой специфичностью связывания (сайты объединения антитело-антиген) могут быть слиты с последовательностями константного домена иммуноглобулина. Предпочтительно, чтобы слияние происходило с константным доменом тяжелой цепи иммуноглобулина, включающим, по меньшей мере, часть областей петли, СН2 и СН3. Предпочтительно иметь первую константную область тяжелой цепи (СН1), содержащую участок, необходимый для связывания легкой цепи, присутствующий, по меньшей мере, в одном из гибридов. ДНК, кодирующие гибриды тяжелой цепи иммуноглобулина и, если желательно, легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы и совместно трансфицируют в подходящий организм-хозяин. Дополнительные подробности получения биспецифичных антител см., например, Suresh et al., Methods in Enzymology, 121: 210 (1986).
Также были описаны различные способы получения и выделения фрагментов биспецифичных антител непосредственно из культуры рекомбинантных клеток. Например, биспецифичные антитела были получены с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии из белков Fos и Jun были связаны с Fab'-частями двух разных антител слиянием генов. Гомодимеры антител восстанавливали в шарнирной области с образованием мономеров, а затем повторно окисляли с образованием гетеродимеров антител. Этот способ также может быть использован для получения гомодимеров антител. Технология «диател», описанная Hollinger et al., PNAS USA, 90: 6444-6448 (1993), предоставила альтернативный механизм получения биспецифичных фрагментов антител. Фрагменты включают VH, соединенный с VL с помощью линкера, который слишком короткий, чтобы позволить спаривание между двумя доменами в одной цепи. Соответственно, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, тем самым образуя два антигенсвязывающих сайта. Также сообщалось о другой стратегии получения фрагментов биспецифичных антител с использованием одноцепочечных димеров Fv (sFv). См. Gruber et al., J. Immunol., 152:5368 (1994).
Предусматриваются антитела с более чем двумя валентностями. Например, могут быть получены триспецифичные антитела. Tutt et al. J. Immunol. 147: 60 (1991).
Гетероконъюгатные антитела
Гетероконъюгатные антитела состоят из двух ковалентно связанных антител. Такие антитела, например, были предложены для нацеливания клеток иммунной системы на нежелательные клетки (патент США № 4676980) и для лечения ВИЧ-инфекции. WO 91/00360; WO 92/200373; EP 03089. Предполагается, что антитела могут быть получены in vitro с использованием известных способов химии синтетических белков, в том числе с использованием сшивающих агентов. Например, иммунотоксины могут быть получены с использованием реакции дисульфидного обмена или путем образования тиоэфирной связи. Примеры подходящих реагентов для этой цели включают иминотиолат и метил-4-меркаптобутиримидат и те, которые раскрыты, например, в патенте США № 4676980.
Инженерия эффекторных функций
Желательной может быть модификация антитела, представленного в настоящем документе, в отношении эффекторной функции для того, чтобы повысить, например, эффективность антитела при лечении рака. Например, остаток (остатки) цистеина может быть введен в Fc-область, что позволяет образовывать межцепочечные дисульфидные связи в этой области. Полученное таким образом гомодимерное антитело может обладать улучшенной способностью к интернализации и/или повышенным комплемент-зависимым уничтожением клеток и антителозависимой клеточной цитотоксичностью (ADCC). См. Caron et al., J. Exp. Med., 176: 1191-1195 (1992) и Shapes, J. Immunol., 148: 2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью также могут быть получены с использованием гетеробифункциональных сшивающих агентов, как описано в Wolff et al., Cancer Research, 53: 2560-2565 (1993). В ином случае, может быть сконструировано антитело, которое имеет двойные Fc-области и может, таким образом, иметь улучшенные возможности комплемент-зависимого лизиса и ADCC. См. Stevenson et al., Anti-Cancer Drug Design 3: 219-230 (1989).
Для улучшения связывания с FcR могут быть сделаны мутации или изменения в последовательностях Fc-области (например, FcγR, FcRn). Согласно одному воплощению антитело по данному изобретению имеет, по меньшей мере, одну измененную эффекторную функцию выбранную из группы, состоящей из ADCC, CDC и улучшенного связывания FcRn по сравнению с нативным IgG или родительским антителом. Примеры нескольких полезных специфических мутаций описаны, например, в Shields, RL et al. (2001) JBC 276(6)6591-6604; Presta, L.G., (2002) Biochemical Society Transactions 30(4):487-490; и WO 00/42072.
Согласно одному воплощению мутация рецептора Fc представляет собой замену, по меньшей мере, в одном положении, выбранном из группы, состоящей из: 238, 239, 246, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322 324, 326, 327, 329, 330, 331, 332, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430 434, 435, 437, 438 или 439 Fc-области, где нумерация остатков в Fc-области соответствует системе нумерации EU. В некоторых воплощениях мутация рецептора Fc представляет собой замену D265A. В некоторых воплощениях мутация рецептора Fc представляет собой замену N297A. Дополнительные подходящие мутации изложены в патенте США № 7323281.
Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, токсин (например, ферментативно активный токсин бактериального, грибного, растительного или животного происхождения или их фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают А-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. Для получения радиоконъюгированных антител доступны различные радионуклиды. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re. Типичные химиотерапевтические агенты, полезные для получения таких иммуноконъюгатов, включают те, которые описаны в данном документе в другом месте.
В определенных воплощениях анти-PD-1 антитело, представленное в настоящем документе, конъюгировано с майтансином, майтансиноидом или калихеамицином. В определенных воплощениях анти-PD-1 антитело, представленное в настоящем документе, конъюгировано с мейтансиноидом DM1.
Конъюгаты антитела и цитотоксического агента получают с использованием множества бифункциональных белковых связующих агентов, таких как N-сукцинимидил-3- (2-пиридилдитиол) пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметил адипимидат) HCl), активные сложные эфиры (такие как дисукцинимидил суберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис (п-азидобензоил) гександиамин), производные бисдиазония (такие как бис- (п-диазонийбензоил) -этилендиамин) диизоцианаты (такие как 2,6-диизоцианат толуола) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al., Science, 238: 1098 (1987). Меченная углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является типичным хелатирующим агентом для конъюгации радионуклеотида с антителом. См. WO94/11026.
В другом воплощении антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для применения при предварительном направленном воздействии на опухоль, где конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязанного конъюгата из кровотока с использованием очищающего агента и с последующим введением «лиганда» (например, авидина), который конъюгирован с цитотоксическим агентом (например, радионуклеотидом).
Ковалентные модификации
Ковалентные модификации анти-PD-1 антител и их фрагментов включены в объем данного изобретения. Один тип ковалентной модификации включает взаимодействие целевых аминокислотных остатков полипептида с органическим дериватизирующим агентом, который способен реагировать с выбранными боковыми цепями или N- или C-концевыми остатками полипептида. Дериватизация с помощью бифункциональных агентов полезна, например, для сшивания полипептида с нерастворимым в воде носителем или поверхностью для применения в способе очистки антител, и наоборот. Обычно используемые сшивающие агенты включают, например, сложные эфиры 1,1-бис (диазоацетил) -2-фенилэтана, глутаральдегида, N-гидроксисукцинимида, например, сложные эфиры с 4-азидосалициловой кислотой, гомобифункциональные сложные имидоэфиры, включая сложные дисукцинимидильные эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-октан, и агенты, такие как метил-3-[(п-азидофенил)дитио]пропиоимидат.
Другие модификации включают дезамидирование глутаминильных и аспарагинильных остатков до соответствующих глутамильных и аспартильных остатков, соответственно, гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треонильных остатков, метилирование α-аминогрупп боковой цепи лизина, аргинина и гистидина (T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевого амина и амидирование любой С-концевой карбоксильной группы.
Другой тип ковалентной модификации полипептида включает связывание полипептида с одним из множества небелковых полимеров, например, полиэтиленгликолем (PEG), полипропиленгликолем или полиоксиалкиленами, способом, изложенным в патентах США № 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337.
Химерные молекулы
Анти-PD-1-антитело и/или его фрагмент по настоящему изобретению также могут быть модифицированы, если это выгодно, способом образования химерной молекулы, включающей полипептид, слитый с другим, гетерологичным полипептидом или аминокислотной последовательностью (например, иммуноадгезином или пептителом).
В одном воплощении такая химерная молекула включает слияние полипептида с доменом белковой трансдукции, который направляет полипептид для доставки в различные ткани и, более конкретно, через гематоэнцефалический барьер, используя, например, домен белковой трансдукции белка TAT вируса иммунодефицита человека (Schwarze et al., 1999, Science 285: 1569-72).
В другом воплощении такая химерная молекула включает слияние полипептида с меченым полипептидом, который обеспечивает эпитоп, с которым антитело против метки может селективно связываться. Эпитопная метка обычно размещается на амино- или карбоксильном конце полипептида. Присутствие таких меченых эпитопом форм полипептида можно обнаружить с использованием антитела против полипептида-метки. Кроме того, обеспечение эпитопной метки позволяет легко очищать полипептид путем аффинной очистки с использованием антитела против метки или другого типа аффинной матрицы, которая связывается с эпитопной меткой. Различные полипептиды-метки и их соответствующие антитела известны в данной области. Примеры включают метки полигистидин (поли-His) или полигистидин-глицин (поли-His-Gly); полипептид HA-метки гриппа и его антитело 12CA5 (Field et al., Mol. Cell. Biol., 8: 2159-2165 (1988)]; метка c-myc и антитела к ней 8F9, 3C7, 6E10, G4, B7 и 9E10 (Evan et al., Molecular and Cellular Biology, 5: 3610-3616 (1985)] и метку гликопротеина D вируса простого герпеса (gD) и его антитело (Paborsky et al., Protein Engineering, 3 (6): 547-553 (1990)]. Другие полипептиды-метки включают Flag-пептид (Hopp et al., BioTechnology, 6: 1204-1210 (1988)]; эпитопный пептид KT3 (Martin et al., Science, 255: 192-194 (1992)]; эпитопный пептид α-тубулина (Skinner et al., J. Biol. Chem., 266: 15163-15166 (1991)]; и пептидную метку белка гена 10 из T7 (Lutz- Freyermuth et al., Proc. Natl. Acad. Sci. USA, 87:6393-6397 (1990)).
В альтернативном воплощении химерная молекула может включать слияние полипептида с иммуноглобулином или конкретной областью иммуноглобулина. Для двухвалентной формы химерной молекулы (например, «иммуноадгезина») такое слияние может происходить с Fc-областью молекулы IgG. Ig-гибриды по данному изобретению включают полипептиды, которые включают около или только остатки 94-243, остатки 33-53 или остатки 33-52 человека вместо, по меньшей мере, одной вариабельной области в молекуле Ig. В особенно предпочтительном воплощении гибрид иммуноглобулина включает области шарнира, СН2 и СН3 или шарнира, СН1, СН2 и СН3 из молекулы IgG1. Для получения иммуноглобулиновых гибридов см. также патент США N 5428130, выданный 27 июня 1995 года.
Иммунолипосомы
Антитела, раскрытые в данном документе, также могут быть включены в состав в виде иммунолипосом. Липосомы, содержащие антитело, получают способами, известными в данной области, такими как описанные в Epstein et al., PNAS USA, 82: 3688 (1985); Hwang et al., PNAS USA, 77: 4030 (1980); и пат. США № 4485045 и 4544545. Липосомы с увеличенным временем циркуляции раскрыты в патенте США № 5013556.
Особенно полезные липосомы могут быть получены способом испарения с обращенной фазой с липидной композицией, содержащей фосфатидилхолин, холестерин и PEG-дериватизированный фосфатидилэтаноламин (PEG-PE). Липосомы экструдируют через фильтры с определенным размером пор, чтобы получить липосомы с искомым диаметром. Fab'-фрагменты антитела по настоящему изобретению могут быть конъюгированы с липосомами, как описано в Martinet al., J. Biol. Chem., 257: 286-28 (1982) с помощью реакции дисульфидного обмена. Антинеопластический агент, агент, ингибирующий рост, или химиотерапевтический агент (такой как доксорубицин) необязательно также содержится в липосоме. См. Gabizon et al., J. National Cancer Inst., 81 (19): 1484 (1989).
Лечение с использованием анти-PD-1 антител
Антитела против PD-1 и/или их фрагменты и/или композиции, представленные в настоящем документе, можно вводить объектам (например, млекопитающим, таким как люди) для лечения заболеваний и расстройств, связанных с аномальной активностью PD-1, включая, например, рак (например, рак головы и шеи, рак горла, колоректальный рак, рак легкого и т.д.). В определенных воплощениях изобретение относится к анти-PD-1 антителам, описанным в настоящем документе (или их фрагментам), для применения при получении лекарственного средства для лечения у объекта рака (такого как меланома, NSCLC, рак головы и шеи, рак уротелия, рак молочной железы (например, тройной негативный рак молочной железы, TNBC), рак желудка, классическая лимфома Ходжкина (cHL), неходжкинская лимфома первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиома, рак яичника, рак легкого (например, мелкоклеточный рак легкого), рак пищевода, назофарингеальная карцинома (NPC), рак желчных путей, колоректальный рак, рак шейки матки, рак щитовидной железы). В определенных воплощениях изобретение относится к анти-PD-1 антителам, описанным в настоящем документе (или их фрагментам), для применения при лечении у объекта рака (такого как меланома, NSCLC, рак головы и шеи, рак уротелия, рак молочной железы (например, тройной негативный рак молочной железы, TNBC), рак желудка, классическая лимфома Ходжкина (cHL), неходжкинская лимфома первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиома, рак яичника, рак легкого (например, мелкоклеточный рак легкого), рак пищевода, назофарингеальная карцинома (NPC), рак желчных путей, колоректальный рак, рак шейки матки, рак щитовидной железы).
В определенных воплощениях изобретение относится к фармацевтическим композициям, содержащим анти-PD-1 антитело, представленное в настоящем документе (или его фрагменты), для применения при лечении у объекта рака (меланомы, NSCLC, рака головы и шеи, рака уротелия, рака молочной железы (например, тройного негативного рака молочной железы, TNBC), рака желудка, классической лимфомы Ходжкина (cHL), неходжкинской лимфомы первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиомы, рака яичника, рака легкого (например, мелкоклеточного рака легкого), рака пищевода, назофарингеальной карциномы (NPC), рака желчных путей, колоректального рака, рака шейки матки, рака щитовидной железы). В некоторых воплощениях объектом, подлежащим лечению, является млекопитающее (например, человек, примат, не являющийся человеком, крыса, мышь, корова, лошадь, свинья, овца, коза, собака, кошка и т.д.). В определенных воплощениях объектом является человек. В определенных воплощениях объект является клиническим пациентом, добровольцем клинического испытания, экспериментальным животным и т.д. В некоторых воплощениях объект подозревается на наличие или имеет риск развития рака (такого как меланома, NSCLC, рак головы и шеи, рак уротелия, рак молочной железы (например, тройной негативный рак молочной железы, TNBC), рак желудка, классическая лимфома Ходжкина (cHL), неходжкинская лимфома первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиома, рак яичника, рак легкого (например, мелкоклеточный рак легкого), рак пищевода, назофарингеальная карцинома, рак желчных путей, колоректальный рак, рак шейки матки, рак щитовидной железы или у объекта диагностирован рак или любое другое заболевание, имеющее аномальную экспрессию или активность PD-1.
Многие способы диагностики рака (такого как меланома, NSCLC, рак головы и шеи, рак уротелия, рак молочной железы (например, тройной негативный рак молочной железы, TNBC), рак желудка, классическая лимфома Ходжкина (cHL), неходжкинская лимфома первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиома, рак яичника, рак легкого (например, мелкоклеточный рак легкого), рак пищевода, назофарингеальная карцинома (NPC), рак желчных путей, колоректальный рак, рак шейки матки, рак щитовидной железы) или любые другие заболевания, проявляющие аномальную активность PD-1, и клиническое определение этих заболеваний известны в данной области. Такие способы включают, без ограничения указанным, например, иммуногистохимию, ПЦР, флуоресцентную гибридизацию in situ (FISH). Дополнительные подробности, касающиеся способов диагностики аномальной активности или экспрессии PD-1, описаны, например, в Gupta et al. (2009) Mod Pathol. 22(1): 128-133; Lopez-Rios et al. (2013) J Clin Pathol. 66(5): 381-385; Ellison et al. (2013) J Clin Pathol 66(2): 79-89; и Guha et al. (2013) PLoS ONE 8(6): e67782.
Введение может осуществляться любым подходящим путем, включая, например, внутривенный, внутримышечный или подкожный. В некоторых воплощениях анти-PD-1 антитела (или их фрагменты) и/или композиции, представленные в настоящем документе, вводят в комбинации со вторым, третьим или четвертым агентом (включая, например, антинеопластический агент, агент, ингибирующий рост, цитотоксический агент или химиотерапевтический агент) для лечения заболеваний или расстройств, связанных с аномальной активностью PD-1. Такие агенты включают, например, доцетаксел, гефитиниб, FOLFIRI (иринотекан, 5-фторурацил и лейковорин), иринотекан, цисплатин, карбоплатин, паклитаксел, бевацизумаб (анти-VEGF-антитело), FOLFOX-4, инфузионный флуороурацил, лейковорин и оксалиплатин, афатиниб, гемцитабин, капецитабин, пеметрексед, тивантиниб, эверолимус, CpG-ODN, рапамицин, леналидомид, вемурафениб, эндостатин, лапатиниб, PX-866, Импрайм PGG и ирлотинибм. В некоторых воплощениях анти-PD-1 антитела (или их фрагменты) конъюгированы с дополнительным агентом.
В определенных воплощениях анти-PD-1 антитела (или их фрагменты) и/или композиции, представленные в настоящем документе, вводят в сочетании с одним или несколькими дополнительными видами терапии, такими как лучевая терапия, хирургическое вмешательство, химиотерапия и/или таргетная терапия. В определенных воплощениях анти-PD-1 антитела (или их фрагменты) и/или композиции, представленные в настоящем документе, вводят в сочетании с лучевой терапией. В определенных воплощениях комбинация анти-PD-1 антитела (или его фрагмента) и/или композиции, представленной в настоящем документе, и лучевой терапии используется для лечения рака, выбранного из группы, состоящей из меланомы, NSCLC, рака головы и шеи, рака уротелия, рака молочной железы (например, тройного негативного рака молочной железы, TNBC), рака желудка, классической лимфомы Ходжкина (cHL), неходжкинской лимфомы первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиомы, рака яичника, рака легкого (например, мелкоклеточного рака легкого), рака пищевода, назофарингеальной карциномы, рака желчных путей, колоректального рака, рака шейки матки и рака щитовидной железы.
В зависимости от показаний, подлежащих лечению, и факторов, относящихся к дозировке, с которой знаком специалист в данной области, анти-PD-1 антитела или их фрагменты, представленные в настоящем документе, будут вводиться в дозировке, эффективной для лечение этого показания при минимизации токсичности и побочных эффектов. Для лечения онкологического заболевания (такого как меланома, NSCLC, рак головы и шеи, рак уротелия, рак молочной железы (например, тройной негативный рак молочной железы, TNBC), рак желудка, классическая лимфома Ходжкина (cHL), первичная неходжкинская лимфома первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиома, рак яичника, рак легких (например, мелкоклеточный рак легкого), рак пищевода, назофарингеальная карцинома (NPC), рак желчных путей, колоректальный рак, рак шейки матки, рак щитовидной железы), типичная доза может составлять, например, от 0,001 до 1000 мкг; однако дозы ниже или выше этого примерного диапазона находятся в пределах объема изобретения. Суточная доза может составлять от около 0,1 мкг/кг до около 100 мг/кг от общей массы тела (например, около 5 мкг/кг, около 10 мкг/кг, около 100 мкг/кг, около 500 мкг/кг, около 1 мг/кг, около 50 мг/кг или диапазон, определенный любыми двумя из вышеуказанных значений), предпочтительно от около 0,3 мкг/кг до около 10 мг/кг от общей массы тела (например, около 0,5 мкг/кг, около 1 мкг/кг, около 50 мкг/кг, около 150 мкг/кг, около 300 мкг/кг, около 750 мкг/кг, около 1,5 мг/кг, около 5 мг/кг. кг или диапазон, определенный любыми двумя из вышеуказанных значений), более предпочтительно, от около 1 мкг/кг до 1 мг/кг от общей массы тела (например, около 3 мкг/кг, около 15 мкг/кг, около 75 мкг/кг, около 300 мкг/кг, около 900 мкг/кг или диапазон, определенный любыми двумя из вышеуказанных значений), и еще более предпочтительно от около 0,5 до 10 мг/кг массы тела на день (например, около 2 мг/кг, около 4 мг/кг, около 7 мг/кг, около 9 мг/кг или диапазон, определяемый любыми двумя из вышеуказанных значений, включая любой диапазон между вышеуказанными значениями). Как отмечалось выше, терапевтическая или профилактическая эффективность может контролироваться путем периодической оценки пациентов, проходящих лечение. Для повторных введений в течение нескольких дней или дольше, в зависимости от состояния, лечение повторяют до тех пор, пока не произойдет искомое подавление симптомов заболевания. Однако другие схемы дозировки могут быть полезны и находятся в пределах объема изобретения. Искомая доза может быть введена однократным болюсным введением композиции, многократным болюсным введением композиции или непрерывным инфузионным введением композиции.
Фармацевтическую композицию, содержащую анти-PD-1 антитело или его фрагмент, можно вводить один, два, три или четыре раза в день. Композиции также можно вводить реже, чем ежедневно, например, шесть раз в неделю, пять раз в неделю, четыре раза в неделю, три раза в неделю, два раза в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, раз в месяц, раз в два месяца, раз в три месяца или раз в шесть месяцев. Композиции могут также вводиться в составе с замедленным высвобождением, например в имплантате, который постепенно высвобождает композицию для использования в течение определенного периода времени и который позволяет вводить композицию менее часто, например один раз в месяц, один раз каждые 2-6 месяцев, один раз в год или даже за одно введение. Устройства с замедленным высвобождением (такие как гранулы, наночастицы, микрочастицы, наносферы, микросферы и тому подобное) могут вводиться путем инъекции.
Антитело (или его фрагмент) можно вводить в однократной суточной дозе, или общую суточную дозу можно вводить в разделенных дозировках два, три или четыре раза в день. Композиции также можно вводить реже, чем ежедневно, например, шесть раз в неделю, пять раз в неделю, четыре раза в неделю, три раза в неделю, два раза в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, раз в месяц, раз в два месяца, раз в три месяца или раз в шесть месяцев. Антитело (или его фрагмент) также можно вводить в составе с замедленным высвобождением, таком как имплантат, который постепенно высвобождает композицию для использования в течение определенного периода времени и который позволяет вводить композицию менее часто, например один раз в месяц, один раз каждые 2-6 месяцев, один раз в год или даже за одно введение. Устройства с замедленным высвобождением (такие как гранулы, наночастицы, микрочастицы, наносферы, микросферы и тому подобное) могут вводиться путем инъекции или имплантироваться хирургически в различных местах.
Лечение рака может оцениваться, например, без ограничения указанным, по регрессии опухоли, уменьшению массы или размера опухоли, времени до прогрессирования, продолжительности выживания, выживаемости без прогрессирования, общей частоты ответа, продолжительности ответа, качества жизни, экспрессии белка и/или активности. Могут быть использованы подходы к определению эффективности терапии, включая, например, измерение ответа с помощью радиологической визуализации.
В некоторых воплощениях эффективность лечения измеряют как процент ингибирования роста опухоли (% TGI), рассчитанный с использованием уравнения 100- (T/C x 100), где T - средний относительный объем опухоли обработанной опухоли, и C средний относительный объем опухоли необработанной опухоли. В определенных воплощениях % TGI составляет около 10%, около 20%, около 30%, около 40%, около 50%, около 60%, около 70%, около 80%, около 90%, около 91%, около 92 %, около 93%, около 94%, около 95% или более 95%. В некоторых воплощениях % TGI анти-PD-1 такой же или больше, чем% TGI OPDIVO®, например, более чем в около 1,1 раза, в около 1,2 раза, в около 1,3 раза, в около 1,4 раза, в около 1,5 раза, в около 1,6 раза, в около 1,7 раза, в около 1,8 раза, в около 1,9 раза, в около 2 раза, в около 2,1 раза, в около 2,2 раза, в около 2,3 раза, в около 2,4 раза, в около 2,5 раза, в около 2,6 раза, в около 2,7 раза, включая любой диапазон между этими значениями, или более чем в 2,7 раза больше, чем % TGI для OPDIVO®.
Фармацевтические составы
Антитела против PD-1 (или их фрагменты) могут быть составлены с подходящими носителями или эксципиентами, пригодными для введения. Подходящие составы антител получают путем смешивания антитела (или его фрагмента), имеющего искомую степень чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форма лиофилизированных составов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмоний хлорид; гексаметоний хлорид; бензалконий хлорид, бензетоний хлорид; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белков); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Типичные составы антител описаны в WO 98/56418, специально включенном в настоящий документ ссылкой. Лиофилизированные составы, адаптированные для подкожного введения, описаны в WO 97/04801. Такие лиофилизированные составы могут быть восстановлены подходящим разбавителем до высокой концентрации белка, и восстановленный состав может быть введен подкожно млекопитающему, которое подвергается лечению согласно данному документу.
Композиция в данном документе может также включать более одного активного соединения, которое необходимо для конкретного показания, подвергаемого лечению, предпочтительны те соединения, которые обладают дополнительными активностями, которые не оказывают побочных эффектов друг на друга. Например, может быть желательно дополнительно предоставить антинеопластический агент, агент, ингибирующий рост, цитотоксический агент или химиотерапевтический агент. Такие молекулы подходящим образом присутствуют в комбинации в количествах, которые эффективны для предполагаемой цели. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в составе, типа заболевания или расстройства или лечения и других факторов, обсуждаемых выше. Они обычно используются в тех же дозировках и с путями введения, которые описаны в данном документе, или около от 1 до 99% от используемых ранее дозировок. Активные ингредиенты также могут быть захвачены в микрокапсулы, приготовленные, например, методами коацервации или межфазной полимеризациии, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметацилат)ные микрокапсулы, соответственно, в системах доставки коллоидных лекарственных средств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методы раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980). Могут быть приготовлены составы с замедленным высвобождением. Подходящие примеры составов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антагонист, причем матрицы имеют форму профилированных изделий, например, пленок или микрокапсул. Примеры матриц замедленного высвобождения включают сложные полиэфиры, гидрогели (например, поли (2-гидроксиэтилметакрилат) или поли (виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, недеградируемый этилен-винил, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляную кислоту.
Липофектины или липосомы могут быть использованы для доставки полипептидов и антител (или их фрагментов) или композиций по настоящему изобретению в клетки. При использовании фрагментов антител предпочтительным является наименьший ингибирующий фрагмент, который специфически связывается с доменом связывания целевого белка. Например, на основе последовательностей вариабельной области антитела могут быть сконструированы пептидные молекулы, которые сохраняют способность связывать последовательность белка-мишени. Такие пептиды могут быть синтезированы химически и/или получены с помощью технологии рекомбинантных ДНК. См., Например, Marasco et al., PNAS USA, 90: 7889-7893 (1993).
Активные ингредиенты также могут быть захвачены в микрокапсулы, приготовленные, например, методами коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметацилат)микрокапсулы, соответственно, в коллоидных системах доставки лекарственных средств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методы раскрыты в Remington's PHARMACEUTICAL SCIENCES, выше.
Могут быть приготовлены составы с замедленным высвобождением. Подходящие примеры составов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело (или его фрагмент), причем эти матрицы имеют форму профилированных изделий, например пленок или микрокапсул. Примеры матриц замедленного высвобождения включают сложные полиэфиры, гидрогели (например, поли (2-гидроксиэтилметакрилат поздний) или поли (виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил- L-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT TM (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляную кислоту. Хотя такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, обеспечивают высвобождение молекул в течение более 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. Когда капсулированные антитела остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°C, что приводит к потере биологической активности и возможным изменениям в иммуногенности. Для стабилизации могут быть разработаны рациональные стратегии в зависимости от используемого механизма. Например, если обнаружено, что механизмом агрегации является межмолекулярное образование SS-связей посредством тиодисульфидного обмена, стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контроля содержания влаги с использованием соответствующих добавок и разработки специальных композиций полимерной матрицы.
В некоторых воплощениях композиция включает анти-PD-1 антитело, описанное в настоящем документе, в концентрации более чем около 0,5 мг/мл, более чем около 1 мг/мл, более чем около 2 мг/мл, более чем около 3 мг/мл. мл, более чем около 4 мг/мл, более чем около 5 мг/мл, более чем около 6 мг/мл, более чем около 7 мг/мл, более чем около 8 мг/мл, более чем около 9 мг/мл, более чем около 10 мг/мл, более чем около 11 мг/мл, более чем около 12 мг/мл, более чем около 13 мг/мл, более чем около 14 мг/мл, более чем около 15 мг/мл и более чем около 16 мг/мл, более чем около 17 мг/мл, более чем около 18 мг/мл, более чем около 19 мг/мл, более чем около 20 мг/мл, более чем около 21 мг/мл, более чем около 22 мг/мл, более чем около 23 мг/мл, более чем около 24 мг/мл, более чем около 25 мг/мл, более чем около 26 мг/мл, более чем около 27 мг/мл, более чем около 28 мг/мл мл, более чем около 29 мг/мл или более чем около 30 мг/мл, включая любой диапазон между этими значениями.
В некоторых воплощениях анти-PD-1 антитело включено в состав (например, в концентрации более чем около 0,5 мг/мл, более чем около 1 мг/мл, более чем около 5 мг/мл, более чем около 10 мг/мл. более чем около 15 мг/мл, более чем около 20 мг/мл, или более чем около 25 мг/мл, включая любой диапазон между этими значениями) с буфером, содержащим цитрат, NaCl, ацетат, сукцинат, глицин, полисорбат 80 (Твин 80) или любую комбинацию вышеперечисленного. В некоторых воплощениях анти-PD-1 антитело включено в состав (например, в концентрации более чем около 0,5 мг/мл, более чем около 1 мг/мл, более чем около 5 мг/мл, более чем около 10 мг/мл. более чем около 15 мг/мл, более чем около 20 мг/мл или более чем около 25 мг/мл, включая любой диапазон между этими значениями) с буфером, содержащим от около 100 мМ до около 150 мМ глицина. В определенных воплощениях анти-PD-1 антитело включено в состав с буфером, содержащим от около 50 мМ до около 100 мМ NaCl. В некоторых воплощениях анти-PD-1 антитело включено в состав (например, в концентрации, более чем около 1 мг/мл, более чем около 1 мг/мл, более чем около 5 мг/мл, более чем около 10 мг/мл, более чем около 15 мг/мл, более чем около 20 мг/мл или более чем около 25 мг/мл, включая любой диапазон между этими значениями) с буфером, содержащим от около 10 мМ до около 50 мМ ацетата. В определенных воплощениях анти-PD-1 антитело включено в состав с буфером, содержащим от около 10 около до 50 мМ сукцината. В некоторых воплощениях анти-PD-1 антитело включено в состав (например, в концентрации, более чем около 0,5 мг/мл, более чем около 1 мг/мл, более чем около 5 мг/мл, более чем около 10 мг/мл. более чем около 15 мг/мл, более чем около 20 мг/мл или более чем около 25 мг/мл, включая любой диапазон между этими значениями) с буфером, содержащим от около 0,005% до около 0,02% полисорбата 80. В некоторых воплощениях анти-PD-1 антитело включено в состав с буфером, имеющим рН от около 5,1 до 5,6. В некоторых воплощениях анти-PD-1 антитело включено в состав с буфером, содержащим 10 мМ цитрата, 100 мМ NaCl, 100 мМ глицина и 0,01% полисорбата 80, где состав имеет рН = 5,5.
В определенных воплощениях состав (такой как состав, включающий буфер, содержащий 10 мМ цитрата, 100 мМ NaCl, 100 мМ глицина и 0,01% полисорбата 80, где состав имеет pH = 5,5), содержащий антитело к PD-1, описанное в настоящем документе (например, в концентрации более чем около 0,5 мг/мл, более чем около 1 мг/мл, более чем около 5 мг/мл, более чем около 10 мг/мл, более чем около 15 мг/мл, более чем около 20 мг/мл или более чем около 25 мг/мл, включая любой диапазон между этими значениями) является стабильным при комнатной температуре (например, при температуре около 20-25ºC в течение около 0,5 недели, 1,0 недели, 1,5 недели, 2,0 недели, 2,5 недели, 3,5 недели, 4,0 недели, 4,5 недели или 5,0 недели, включая любую диапазон между этими значениями. В некоторых воплощениях композиция (такая как композиция, включающая буфер, содержащий 10 мМ цитрата, 100 мМ NaCl, 100 мМ глицина и 0,01% полисорбата 80, где композиция имеет рН = 5,5), включает анти-PD-1 антитело, описанное в данном документе (например, в концентрации более чем около 0,5 мг/мл, более чем около 1 мг/мл, более чем около 5 мг/мл, более чем около 10 мг/мл, более чем около 15 мг/мл, более чем около 20 мг/мл мл или более чем около 25 мг/мл, включая любой интервал между этими значениями), является стабильным в форсированных условиях (таких как хранение при температуре около 37ºC) в течение около 0,5 недели, 1,0 недели, 1,5 недели, 2,0 недели, 2,5 недели, 3,5 недели, 4,0 недели, 4,5 недели или 5,0 недель, включая любой диапазон между этими значениями.
Эксклюзионная хроматография (SEC) является хорошо известным и широко используемым способом, используемым в исследованиях стабильности белка для выявления потенциальной фрагментации и агрегации, соответствующей физической и химической нестабильности. В некоторых воплощениях композиция, содержащая 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в данном документе, показывает увеличение меньше чем около на 1,6%, 1,4%, 1,2%, 1,0%, 0,8%, 0,6%, 0,4%, 0,2% или 0,1% у высокомолекулярных веществ (HMWS) через 1 неделю при 37ºC относительно исходного % высокомолекулярных веществ, измеренного с использованием SEC, включая любой диапазон между этими значениями. В определенных воплощениях состав, содержащий 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл, анти-PD-1 антитела, описанного в настоящем документе, показывает менее чем около 2,0%, 1,8%, 1,6%, 1,4%, 1,2%, 1,0%, 0,8%, 0,6%, 0,4%, 0,2% или 0,1% увеличения высокомолекулярных соединений через 2 недели при 37ºC по сравнению с исходным % высокомолекулярных веществ, измеренных с использованием SEC, включая любой интервал между эти значениями. В некоторых воплощениях композиция, содержащая 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл антитела против EFGR, описанного в настоящем документе, имеет менее чем около 3,3%, 3,2%. 3,1%, 3,0%, 2,9%, 2,8%, 2,7%, 2,6%, 2,5%, 2,4%, 2,2%, 2,0%, 1,8%, 1,6%, 1,4%, 1,2%, 1,0%, 0,8%, 0,6%, 0,4%, 0,2% или 0,1% увеличения содержания высокомолекулярных веществ через 4 недели при 37ºC относительно исходного % высокомолекулярных веществ, измеренного с использованием SEC, включая любой диапазон между этими значениями.
В определенных воплощениях состав, включающий 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, показывает менее чем около 1,6%, 1,4%, 1,2%, 1,0%, 0,8%, 0,6%, 0,4%, 0,2% или 0,1% увеличения низкомолекулярных веществ (LMWS) через 1 неделю при 37ºC по сравнению с исходным % низкомолекулярных веществ, измеренного с использованием SEC, включая любой диапазон между этими значениями. В некоторых воплощениях состав, включающий 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в данном документе, показывает менее чем 2,0%, 1,8%, 1,6%, 1,4%, 1,2%, 1,0%, 0,8%, 0,6%, 0,4%, 0,2% или 0,1% увеличения низкомолекулярных соединений через 2 недели при 37ºC, относительно исходного % низкомолекулярных веществ, измеренного с использованием SEC, включая любой диапазон между этими значениями. В определенных воплощениях состав, содержащий 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, показывает менее чем около 2,4%, 2,2%, 2,0%, 1,8%, 1,6%, 1,4%, 1,2%, 1,0%, 0,8%, 0,6%, 0,4%, 0,2% или 0,1% увеличения низкомолекулярных веществ через 4 недели при 37ºC относительно исходного % низкомолекулярных соединений, измеренного с использованием SEC, включая любой диапазон между этими значениями.
В определенных воплощениях состав, включающий 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, показывает не более чем около 0,2%, 0,4%, 0,6%, 0,8%, 0,9%, 1,0%, 1,1%, 1,2%, 1,3%, 1,4%, 1,6%, 1,7%, 1,8%, 1,9%, 2%, 2,1%, 2,2%, 2,3%, 2,4%, 2,5%, 2,6%, 2,7%, 2,8%, 2,9%, 3,0%, 3,1%, 3,2%, 3,3%, 3,4% или 3,5% уменьшения мономера через 1 неделю при 37ºC относительно исходного % мономера, измеренного с использованием SEC, включая любой диапазон между этими значениями. В некоторых воплощениях состав, включающий 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в данном документе, показывает не более чем около 0,2%, 0,4%, 0,6%, 0,8%, 0,9%, 1,0%, 1,1%, 1,2%, 1,3%, 1,4%, 1,6%, 1,7%, 1,8%, 1,9%, 2,0%, 2,1%, 2,2%, 2,3%, 2,4%, 2,5%, 2,6%, 2,7%, 2,8%, 2,9%, 3,0%, 3,1%, 3,2%, 3,3%, 3,4% или 3,5% уменьшения мономера через 2 недели при 37ºC относительно исходного % мономера, измеренного с использованием SEC, включая любой диапазон между этими значениями. В определенных воплощениях состав, включающий 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл антитела против EFGR, описанного в настоящем документе, показывает не более чем около 0,2%, 0,4. %, 0,6%, 0,8%, 0,9%, 1,0%, 1,1%, 1,2%, 1,3%, 1,4%, 1,6%, 1,7%, 1,8%, 1,9%, 2,0%, 2,1%, 2,2%, 2,3%, 2,4%, 2,5%, 2,6%, 2,7%, 2,8%, 2,9%, 3,0%, 3,1%, 3,2%, 3,3%, 3,4% или 3,5% снижения мономера через 2 недели при 37ºC относительно начального % мономера, измеренного с использованием SEC, включая любой диапазон между этими значениями.
Катионообменная хроматография (CEX) является хорошо известным и широко используемым инструментом для выявления случаев деградации белка, таких как деамидирование или окисление (Moorhouse et al. (1997) J. Pharm. Biomed. Anal. 16, 593–603). Продукты деградации обычно называются кислыми или основными соединениями. Кислые соединения - это варианты, которые элюируются раньше, чем основной пик из CEX, в то время как основные соединения - это варианты, которые элюируются позже, чем основной пик из CEX. В определенных воплощениях фракция кислого пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, не более чем около 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14% или 15% от общего белка через 1 неделю при 37ºC, измеренного с использованием CEX, включая любой диапазон между этими значениями. В определенных воплощениях фракция кислого пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, составляет не более чем около 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17% или 18% от общего белка через 2 недели при 37ºC, измеренного с использованием CEX, включая любой диапазон между этими значениями. В определенных воплощениях фракция кислого пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, составляет не более чем около 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26% или 27% от общего белка через 2 недели при 37ºC, который измерен с использованием CEX, включая любой диапазон между этими значениями.
В некоторых воплощениях фракция основного пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в данном документе, составляет не более чем около 39%, 40%, 41%, 42%, 43%, 44%, 45% или 46% от общего белка после 1 недели при 37ºC, измеренного с использованием CEX, включая любой диапазон между этими значениями. В определенных воплощениях фракция основного пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, составляет не более чем около 39%, 40%, 41%, 42%, 43%, 44%, 45% или 46% общего белка через 2 недели при 37ºC, измеренного с использованием CEX, включая любой диапазон между этими значениями. В некоторых воплощениях фракция основного пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в данном документе, составляет не более чем около 39%, 40%, 41%, 42%, 43%, 44%, 45% или 46% от общего белка через 4 недели при 37ºC, измеренного с использованием CEX, включая любой диапазон между эти значениями.
В некоторых воплощениях фракция основного пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, составляет не менее чем около 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45% или 46% от общего белка через 1 неделю при 37ºC, измеренного с помощью CEX, включая любой диапазон между этими значениями. В некоторых воплощениях фракция основного пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, составляет не менее чем около 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45% или 46% от общего белка через 2 недели при 37ºC, измеренного с использованием CEX, включая любой диапазон между этими значениями. В некоторых воплощениях фракция основного пика композиции, включающей 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл или 25 мг/мл анти-PD-1 антитела, описанного в настоящем документе, составляет не менее чем около 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45% или 46% от общего белка через 4 недели при 37ºC, измеренного с помощью CEX, включая любой диапазон между этими значениями.
Составы, используемые для введения in vivo, должны быть стерильными. Это легко достигается, например, фильтрацией через стерильные фильтрующие мембраны.
Способы диагностики и визуализации с использованием анти-PD-1 антител
Меченые анти-PD-1 антитела, их фрагменты и их производные и аналоги, которые специфически связываются с полипептидом PD-1, можно использовать в диагностических целях для обнаружения, диагностики или мониторинга заболеваний и/или нарушений, связанных с экспрессией, аберрантной экспрессия и/или активностью PD-1. Например, анти-PD-1 антитела (или их фрагменты), представленные в настоящем документе, можно использовать для in situ, in vivo, ex vivo и in vitro диагностических анализов или анализов изображений. Способы обнаружения экспрессии полипептида PD-1, включающие (а) анализ экспрессии полипептида в клетках (например, ткани) или жидкости организма индивидуума с использованием одного или нескольких антител данного изобретения и (b) сравнение уровня экспрессии гена со стандартным уровнем экспрессии гена, в результате чего увеличение или уменьшение уровня экспрессии анализируемого гена по сравнению со стандартным уровнем экспрессии указывает на аберрантную экспрессию.
Дополнительные воплощения, представленные в настоящем документе, включают способы диагностики заболевания или расстройства, связанного с экспрессией или аберрантной экспрессией PD-1 у животного (например, млекопитающего, такого как человек). Способы включают обнаружение молекул PD-1 у млекопитающего. В некоторых воплощениях диагностика включает: (а) введение эффективного количества меченого анти-PD-1 антитела (или его фрагмента) млекопитающему (b) ожидание интервала времени после введения для того, чтобы дать маркированному анти-PD-1 антителу (или его фрагменту), преимущественно сконцентрироваться в участках в объекте, где экспрессируется молекула PD-1 (и для очистки несвязанной меченой молекулы до фонового уровня); (с) определение уровня фона; и (d) обнаружение меченой молекулы у объекта, так что обнаружение меченой молекулы выше фонового уровня указывает на то, что у объекта есть конкретное заболевание или расстройство, связанное с экспрессией или аберрантной экспрессией PD-1. Уровень фона может быть определен различными способами, включая сравнение количества обнаруженной меченой молекулы со стандартным значением, предварительно определенным для конкретной системы.
Анти-PD-1 антитела (или их фрагменты), представленные в настоящем документе, можно использовать для анализа уровней белка в биологическом образце с использованием классических иммуногистологических способов, известных специалистам в данной области (например, см. Jalkanen, et al., J. Cell. Biol. 101:976-985 (1985); Jalkanen, et al., J. Cell. Biol. 105:3087-3096 (1987)). Другие основанные на антителах способы, полезные для обнаружения экспрессии белковых генов, включают иммуноанализы, такие как твердофазный иммуноферментный анализ (ELISA) и радиоиммуноанализ (RIA). Подходящие метки для анализа антител известны в данной области и включают ферментные метки, такие как глюкозооксидаза; радиоизотопы, такие как йод (131I, 125I, 123I, 121I), углерод (14C), сера 35S), тритий (3H), индий (115mIn, 113mIn, 112In, 111In) и технеций (99Tc, 99mTc), таллий 201Ti ), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Mo), ксенон (133Xe), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 188Re 142Pr, 105Rh, 97Ru; люминол; и флуоресцентные метки, такие как флуоресцеин и родамин, и биотин.
Методы, известные в данной области, могут быть применены к меченым антителам (или их фрагментам), представленным в данном документе. Такие методы включают, без ограничения указанным, использование бифункциональных конъюгирующих агентов (см., например, патенты США № 5765065; 5714631; 5696239; 5652361; 5505931; 5489425; 5435990; 5428139; 5342604; 5274119; 4994560 и 5808003).
В ином случае или дополнительно можно измерять уровни нуклеиновой кислоты или мРНК, кодирующей полипептид PD-1, в клетке, например, с помощью флуоресцентной гибридизации in situ с использованием зонда на основе нуклеиновой кислоты, соответствующей нуклеиновой кислоте, кодирующей PD-1, или комплементарной ей; (FISH; см. WO 98/454 79, опубликованный в октябре 1998 г.), методы Саузерн-блоттинга, нозерн-блоттинга или полимеразной цепной реакции (ПЦР), такой как количественная ПЦР в реальном времени (ОТ-ПЦР). Можно также изучить сверхэкспрессию PD-1 путем измерения слущенного антигена в биологической жидкости, такой как сыворотка, например, с использованием анализов на основе антител (см. также, например, патент США № 4933294, выданный 12 июня 1990 г.; W091/05264, опубликованный 18 апреля, 1991; патент США № 5401638, выданный 28 марта 1995 г., и Sias et al., J. Immunol. Methods 132:73-80 (1990)). Помимо вышеуказанных анализов, квалифицированный специалист может предложить различные анализы in vivo и ex vivo. Например, можно подвергать клетки в теле млекопитающего воздействию антитела, которое необязательно помечено детектируемой меткой, например, радиоактивным изотопом, и связывание антитела с клетками можно оценить, например, с помощью внешнего сканирования на радиоактивность или путем анализа образца (например, биопсии или другого биологического образца), взятого у млекопитающего, предварительно подвергшегося воздействию антитела.
Изделия и наборы
Другое воплощение, представленный в настоящем документе, представляет собой изделие, содержащее материалы, полезные для лечения рака, такого как меланома, NSCLC, рак голова и шея, рак уротелия, рак молочной железы (например, тройной негативный рак молочной железы, TNBC), рак желудка, классическая лимфома Ходжкина (cHL), неходжкинская лимфома первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиома, рак яичника, рак легкого (например, мелкоклеточный рак легкого), рак пищевода, назофарингеальная карцинома (NPC), рак желчных путей, колоректальный рак, рак шейки матки, рак щитовидной железы и рак слюнных желёз. Изделие может включать контейнер и этикетку или листок-вкладыш на контейнере или ассоциированные с контейнером. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Как правило, контейнер включает композицию, которая эффективна для лечения состояния и может иметь стерильный порт доступа (например, контейнер может представлять собой мешок для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций). По меньшей мере, один активный агент в композиции представляет собой анти-PD-1 антитело (или его фрагмент), представленное в данном документе. На этикетке или листке-вкладыше указано, что композиция используется для лечения конкретного состояния. Этикетка или листок-вкладыш будут дополнительно включать инструкции по введению композиции антител пациенту. Также рассматриваются изделия и наборы, содержащие комбинаторную терапию, описанную в данном документе.
Листок-вкладыш относится к инструкциям, обычно включаемым в коммерческие упаковки терапевтических продуктов, которые включают информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях относительно применения таких терапевтических продуктов. В одном воплощении листок-вкладыш указывает, что композиция используется для лечения рака (такого как рак головы и шеи, рак легкого или колоректальный рак).
Кроме того, изделие может дополнительно включать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), физиологический раствор с фосфатным буфером, раствор Рингера и раствор декстрозы. Кроме того, изделие может включать другие материалы, желательные с коммерческой и пользовательской точек зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Также предлагаются наборы, которые полезны для различных целей, например, для выделения или детекции PD-1 у пациентов, необязательно в комбинации с изделиями. Для выделения и очистки PD-1 набор может включать анти-PD-1 антитело (или его фрагмент), предлагаемое в настоящем документе, связанное с гранулами (например, гранулами SEPHAROSETM). Также предлагаются наборы, которые включают антитела (или их фрагменты) для детекции и количественного определения PD-1 in vitro, например, с помощью ELISA или вестерн-блоттинга. Как и в случае с изделием, набор включает контейнер и этикетку или листок-вкладыш на контейнере или ассоциированные с контейнером. Например, контейнер включает композицию, содержащую, по меньшей мере, одно анти-PD-1 антитело, предлагаемое в данном документе. Могут быть включены дополнительные контейнеры, которые включают, например, разбавители и буферы, контрольные антитела. Этикетка или листок-вкладыш могут включать описание композиции, а также инструкции для предполагаемого применения in vitro или для диагностики.
ПРИМЕРЫ
ПРИМЕР 1
Разработка анти-PD1 антител
Разработка анти-PD-1 антител сводится к следующему. Положительные клоны анти-PD-1 антител идентифицировали путем скрининга библиотеки Fab-фагов, созданной из гибридом, сконструированных из мышей, иммунизированных антигеном PD-1 (очищенный рекомбинантный антиген 6xHis-меченный PD-1_ECD) («6xHis» описан как SEQ ID NO: 26). Для описания клонов были выполнены функциональные анализы in vitro, более подробно описанные ниже.
Вкратце, серийные разведения гибридомных клонов инкубировали в планшетах, покрытых белком PD1-His, в течение одного часа при комнатной температуре, и активность связывания PD1 контролировали при 450 нм. Планшеты блокировали 5% молоком в фосфатно-солевом буфере (PBS) в течение 1 часа при комнатной температуре и промывали PBS-tween 20 (PBST) перед добавлением разведений гибридом.
После инкубации с клонами гибридом планшеты промывали PBST, инкубировали с 1:4000 HRP-меченного антитела против IGG мыши при комнатной температуре в течение 1 часа, промывали PBST, окрашивали тетраметилбензидином (TMB), в заключение использовали H2SO4 для остановки реакции и измеряли оптическую плотность при 450 нм.
Проточная цитометрия показала, что клоны с идентификационными номерами 11, 12, 14, 16, 18, 20, 24, 27 и 28 могут связывать PD-1. Условия проточной цитометрии для оценки связывания PD-1 включают стадии: 1) 4E+05 клеток CHO-S, экспрессирующих PD-1, дважды промывали PBS (2% FBS); 2) добавляли надосадочную жидкость гибридомы, инкубировали при 4 °С в течение 30 мин; 3) центрифугировали клетки в течение 5 минут при 500 мкг; 4) дважды промывали PBS (2% FBS); 5) добавленные разведенные 1:150 FITC-меченные козьи антитела против IgG человека инкубировали 30 мин при 4 °С; 6) дважды промывали клетки PBS (2% FBS); и 7) суспендированные в 50 мкл 1x PBS клетки анализировали проточной цитометрией.
Проточную цитометрию использовали для оценки способности надосадочных жидкостей гибридом блокировать связывание между PD-L1 и PD1. Результаты показали, что клон # 11 блокировал связывание, эквивалентное референсному анти-PD-1 антителу, например, Ниволумабу. Проведенный анализ связывания с помощью проточной цитометрии включает стадии: 1) 4E+05 клеток на образец, дважды промывали PBS (2% FBS); 2) смешивали 8 мкг/мл биотина-PDL1 и надосадочной жидкости гибридомы, при этом объемное соотношение составляло 1:1; 3) добавляли 60 мкл смеси со стадии 2 к клеткам и инкубировали в течение 30 мин при 4 °С; 4) дважды промывали клетки PBS (2% FBS); 5) инкубировали клетки с авидин-FITC (разведение 1:65) в течение 30 мин при 4 °С; и 6) дважды промывали клетки PBS (2% FBS).
Одну положительную колонию PD-1 (c1G4) идентифицировали в компетентных клетках SS320. Характеристики и последовательности клона c1G4 представлены ниже.
ПРИМЕР 2
Получение гуманизированного анти-PD-1 антитела 1G4 (h1G4)
Гуманизированное анти-PD-1 антитело 1G4 (h1G4) получали с использованием вариабельной области легкой цепи зародышевой линии человека IGKV1-39*01 и вариабельной области тяжелой цепи зародышевой линии человека IGHV3-11*04. Вкратце, гуманизацию осуществляли путем прививки остатков CDR от легкой цепи и тяжелой цепи химерного c1G4 в сходные каркасы легкой цепи и тяжелой цепи человеческого иммуноглобулина. Библиотеки CDR-привитого гуманизированного антитела могут быть получены для дальнейшего созревания аффинности на основе фагового дисплея in vitro для усиления аффинности к его антигену.
Выравнивание последовательностей для c1G4 и h1G4 показано на фигурах 8А и 8В. На фиг. 8А показано выравнивание аминокислотной последовательности легких цепей химерного c1G4, гуманизированного h1G4, вариабельной области легкой цепи зародышевой линии человека IGKV1-39*01 и Ниволумаба (NIV). На фиг. 8B показано выравнивание аминокислотной последовательности тяжелых цепей химерного c1G4, гуманизированного h1G4, вариабельной области тяжелой цепи зародышевой линии человека IGHV3-11 * 04 и Ниволумаба (NIV). CDR (определяющие комплементарность области), привитые из c1G4 для гуманизации, выделены жирным и подчеркнутым текстом.
ПРИМЕР 3
Определение равновесной константы диссоциации (KD) для c1G4 и h1G4
Аффинность и кинетику связывания измеряли с использованием поверхностного плазмонного резонанса (SPR). Антитело против Fc из IgG человека сначала иммобилизовали на сенсорном чипе, а затем захватывали референсное анти-PD-1 антитело, c1G4 и h1G4 с Rmax ~ 150 RU. Эксперименты проводились при 25 оС, а измерения проводили с серийными разведениями PD-1-His от 58,8 нМ до 7,35 нМ, пропуская через захваченные антитела в буфере HBS-P + с добавлением 0,1% (мас./об.) BSA. Все данные были проанализированы с помощью оценочного программного обеспечения, при этом кривые соответствовали модели связывания Ленгмюра 1:1.
Кинетику ассоциации и диссоциации, а также рассчитанную аффинность (KD) измеряли с помощью поверхностного плазмонного резонанса (SPR). Улучшение аффинности у c1G4 и h1G4 в отличие от референсного анти-PD-1 антитела также показано в таблице 4 ниже. Данные представляют два независимых эксперимента, выполненных в двух повторах.
Таблица 4
ПРИМЕР 4
Характеристики связывания химерного антитела c1G4 и гуманизированного антитела h1G4
Связывание c1G4 с рекомбинантным белком PD-1
Для оценки связывания химерного антитела c1G4 и референсного анти-PD-1 антитела с PD-1 проводили ELISA-анализы. Серийные разведения химерного c1G4 и референсного анти-PD-1 фиксировали с помощью PD-1-His в лунках планшета для микротитрования. Количество захваченного антитела в каждой лунке определяли количественно с использованием вторичного HRP-конъюгированного антитела против Fc из IgG человека. HRP-конъюгированное вторичное антитело добавляли в лунки и после инкубации избыток вторичного антитела вымывали. ТМВ добавляли в лунки, и после инкубации реакцию останавливали и измеряли активность HRP, контролируя увеличение поглощения при 450 нм. Результаты ELISA, выполненных для сравнения связывания анти-PD-1 антител, химерного антитела c1G4 и референсного анти-PD-1 антитела с PD-1-His, показаны на фиг. 1А.
На фиг. 1В показаны результаты второго набора ELISA, выполненного для сравнения связывания химерного анти-PD-1 антитела c1G4 и референсного анти-PD-1 антитела с PD-1-AP. Серийные разведения химерного c1G4 и референсного анти-PD-1 антитела захватывали антителом против Fc из IgG человека в лунках планшета для микротитрования. Количество захваченного антитела в каждой лунке определяли с использованием AP-конъюгированного PD-1. После инкубации избыток PD-1-AP вымывали. В лунки добавляли субстрат щелочной фосфатазы, и после инкубации реакцию останавливали и измеряли активность АР путем мониторинга увеличения поглощения при 405 нм.
Результаты показывают, что химерный c1G4 и референсное анти-PD-1 антитело способны связываться как с PD-1-His, так и с PD-1-AP.
Блокирование и конкуренция связывания с лигандом PD-1 в случае c1G4
Серийные разведения химерного c1G4 и референсного анти-PD-1 антитела инкубировали с PD-L1-AP при комнатной температуре в течение 2 часов. Каждую смесь антитело: антиген добавляли в покрытые PD-1-His лунки планшета для микротитрования. После инкубации и промывания в лунки добавляли pNPP и инкубировали в течение 1 часа для обнаружения связанного PD-L1-AP. Активность АР измеряли путем мониторинга увеличения оптической плотности при 405 нм. На фиг. 2А показаны результаты ELISA, выполненного для сравнения способности химерного анти-PD-1 антитела c1G4 и референсного анти-PD-1 антитела блокировать связывание PD-L1 с PD-1. Было обнаружено, что как химерное c1G4, так и референсное анти-PD-1 антитело блокируют связывание PD-L1 с PD-1.
На фиг. 2B показаны результаты ELISA, выполненные для определения способности химерного анти-PD-1 антитела c1G4 конкурировать с референсным анти-PD-1 антителом за связывание с PD-1-His. Серийные разведения химерного антитела c1G4 и референсного анти-PD-1 антитела предварительно смешивали с фиксированной концентрацией PD-1-His (0,1 мкг/мл) при комнатной температуре в течение 2 часов и затем связывали с фиксированной концентрацией референсного анти-PD-1 антитела (4 мкг/мл), нанесенного в виде покрытия на планшет. Количество связанного PD-1-His в каждой лунке количественно определяли с использованием вторичного антитела, конъюгированного с His-HRP. После инкубации избыток вторичного антитела вымывали. В лунки добавляли TMB, и после инкубации реакцию останавливали и измеряли активность HRP для отслеживания увеличения оптической плотности при 450 нм. Фиксированную концентрацию PD-1-His (0,1 мкг/мл) добавляли к фиксированной концентрации NIV (4 мкг/мл), нанесенного в виде покрытия на планшет, и инкубировали при комнатной температуре в течение 1 часа и затем в лунки добавляли серийные разведения химерного антитела c1G4 и референсного анти-PD-1 антитела. После инкубации и отмывки количество связанного PD-1-His в каждой лунке определяли с использованием вторичного антитела, конъюгированного с His-HRP.
Эти данные указывают на то, что как химерное антитело c1G4, так и референсное анти-PD-1 антитело способны блокировать связывание PD-L1 с PD-1, а химерное антитело c1G4 способно конкурировать с референсным анти-PD-1 антителом за связывание с PD-1-His.
Связывание c1G4 и h1G4 с PD-1-экспрессирующими клетками CHO-S
Клеточные линии яичника китайского хомячка (СНО), которые экспрессируют рекомбинантный PD-1 человека на клеточной поверхности, были разработаны и использованы для определения специфичности человеческих моноклональных антител к PD-1 с помощью проточной цитометрии. Клетки СНО трансфицировали экспрессирующими плазмидами, содержащими полноразмерную кДНК, кодирующую трансмембранные формы PD-1. Связывание моноклональных анти-PD-1 антител c1G4 и h1G4 оценивали путем инкубации трансфицированных клеток с серийно разведенными моноклональными анти-PD-1 антителами в буфере FACS (PBS с 1% FBS). Клетки промывали проточным буфером, и связывание определяли с помощью меченного биотином кроличьего анти-IgG человека Fcγ Ab и стрептавидин-PE. Проточные цитометрические анализы были выполнены с использованием Cytomics FC 500 (Beckman Coulter Inc.).
На фигурах 3А и 3В с помощью проточной цитометрии показано связывание антитела c1G4 с клетками СНО-S (фиг. 3А) и трансфицированными PD-1 клетками СНО-S (фиг. 3B). Референсные анти-PD-1 и анти-PD-L1 антитела были использованы в качестве положительного и отрицательного контроля, соответственно. Результаты показывают, что c1G4 связаны с клетками СНО, трансфицированными PD-1, но не с клетками СНО, которые не были трансфицированы PD-1 человека.
Характеристики связывания гуманизированного h1G4 и исходного антитела c1G4 с PD-1 на клеточной поверхности показаны на фигуре 9.
Блокирование связывания лиганда с PD-1 выбранными антителами c1G4 и h1G4
Анти-PD-1 антитела c1G4 и h1G4 были протестированы на способность блокировать связывание лиганда PD-L1 с PD-1-экспрессирующими клетками CHO-S, с помощью анализа проточной цитометрией. Антитела против PD-1 и против PD-L1 использовали в качестве положительного и отрицательного контроля, соответственно. Клетки CHO-S, экспрессирующие PD-1, суспендировали в буфере FACS (PBS с 1% FBS). Различные концентрации анти-PD-1 антител c1G4 и h1G4, референсных анти-PD-1 и анти-PD-L1 антител добавляли к суспензии клеток и инкубировали при 4°С в течение 30 минут. Вымывали несвязанное антитело, добавляли меченный биотином гибридный белок PD-L1-Fc и инкубировали при 4°С в течение 30 минут. Клетки промывали и затем окрашивали стрептавидином-РЕ при 4°С в течение 30 минут. Проточные цитометрические анализы проводили с использованием Cytomics FC 500 (Beckman Coulter Inc.).
Моноклональное анти-PD-1 антитело c1G4 блокировало связывание PD-L1 с PD-1-трансфицированными клетками CHO-S, что было измерено по средней интенсивности флуоресценции (MFI) окрашивания. Эти данные демонстрируют, что и c1G4, и h1G4 блокировали связывание PD-L1 с PD-1-трансфицированными клетками CHO-S, что было измерено по средней интенсивности флуоресценции (MFI) окрашивания (фигуры 4 и 10).
Связывание гуманизированного анти-PD-1 антитела с активированными T-клетками человека
Человеческие Т-клетки выделяли из РВМС с использованием набора для обогащения Т-клеток человека MagniSortTM (eBioscience). Выделенные Т-клетки активировали 5 мкг/мл фитогемагглютинина (PHA) в течение 3 дней, чтобы стимулировать экспрессию PD-1. Активированные Т-клетки собирали и инкубировали в буфере FACS (PBS с 2% FBS) с блокатором Fc человека (eBioscience) в течение 20 минут при 4°C.
Связывание моноклонального анти-PD-1 антитела оценивали путем инкубации активированных Т-клеток с серийно разведенными моноклональными анти-PD-1 антителами в буфере FACS. Клетки промывали проточным буфером, и связывание детектировали с помощью FITC-меченого кроличьего антитела против Fcγ из IgG человека. Проточные цитометрические анализы проводили с использованием Cytomics FC 500 (Beckman Coulter Inc.). Референсное анти-PD-1 антитело и Авастин (анти-VEGF) использовали в качестве положительного и отрицательного контроля, соответственно.
Результаты связывания гуманизированного анти-PD-1 антитела h1G4 с активированными человеческими Т-клетками показаны на фигуре 12.
ПРИМЕР 5
Влияние анти-PD-1 c1G4 и h1G4 на выработку цитокинов в смешанной лейкоцитарной реакции (MLR)
Смешанную лейкоцитарную реакцию использовали для демонстрации эффекта блокирования пути PD-1 в лимфоцитарных эффекторных клетках. Т-клетки в анализе тестировали на пролиферацию, секрецию IFN-гамма и секрецию IL-2 в присутствии или в отсутствие анти-PD-1 антитела.
Т-клетки человека очищали из РВМС с использованием Lympho-kwik T (One Lamda, Inc.). Выделенные Т-клетки суспендировали в PBS и метили 1 мкМ CFSE при комнатной температуре в течение 10 минут. После промывания клеток полной средой (RPMI-1640 с 10% FBS) меченные CFSE Т-клетки суспендировали в полной среде в концентрации 1E6/клеток.
Аллогенные дендритные клетки получали из PBMC. Выделенные РВМС инкубировали с 200 ед/мл рекомбинантного человеческого IL-3 (eBioscience) в течение ночи, чтобы позволить популяции моноцитов/макрофагов прикрепиться к планшетам. Неприкрепившиеся клетки удаляли и планшеты дважды промывали полной средой. Затем клетки на планшетах культивировали в полной среде, содержащей 200 ед/мл человеческого IL-4 (eBioscience) и 200 ед/мл человеческого GM-CSF (eBioscience) в течение 6 дней. Полученным из моноцитов дендритным клеткам давали созревать путем добавления TNF-альфа (100 ед/мл) к культуре на 6-й день и инкубации в течение ночи. Зрелые DC трипсинизировали, собирали и суспендировали в полной среде в концентрации 1Е5/клеток.
Каждая реакция содержала 105 CFSE-меченных Т-клеток и 104 аллогенных дендритных клеток в общем объеме 200 мкл. Моноклональные анти-PD-1 антитела c1G4 или h1G4 добавляли в каждую культуру при различных концентрациях антител. В качестве отрицательного контроля не использовалось ни антитело, ни антитело против VEGF (Авастин). В качестве положительного контроля использовали референсное анти-PD-1 антитело. Клетки культивировали в течение 5 дней при 37°С. После дня 5 из каждой культуры отбирали 100 мкл среды для измерения цитокинов. Уровни цитокинов измеряли с использованием набора «Human IFN-γ or IL-2 ELISA MAX™ Deluxe» (BioLegend). Клетки собирали и анализировали на пролиферацию Т-клеток с помощью проточной цитометрии.
На фигуре 5А показана зависимая от концентрации секреция IL-2, стимулируемая моноклональным антителом c1G4 против PD-1 человека, а на фигуре 5В показана зависимая от концентрации секреция IFN-γ моноклональным антителом c1G4 против PD-1 человека.
Фигура 13А иллюстрирует зависимую от концентрации секрецию IL-2, стимулируемую моноклональным антителом h1G4 против PD-1 человека, а фиг. 13B иллюстрирует зависимую от концентрации секрецию IFN-γ моноклональным антителом h1G4 против PD-1 человека.
Моноклональное антитело c1G4 против PD-1 человека стимулирует пролиферацию CD4 + и CD8 + T-клеток в смешанной лейкоцитарной реакции. Фигура 6A иллюстрирует пролиферацию CD4 + Т - клеток при различных концентрациях антитела c1G4, а фиг 6В иллюстрирует пролиферацию CD8 + Т - клеток при различных концентрациях антитела c1G4. Фигура 14А иллюстрирует пролиферацию CD4 + Т-клеток при различной концентрации антитела h1G4, а фигура 14В иллюстрирует пролиферацию CD8 + Т-клеток при различных концентрациях антитела h1G4.
Таким образом, эти результаты показывают, что моноклональные анти-PD-1 антитела c1G4 и h1G4 способствуют пролиферации Т-клеток, секреции IFN-гамма и секреции IL-2. Напротив, культуры, содержащие антитело отрицательного контроля, не показали увеличения пролиферации Т-клеток, секреции IFN-гамма или IL-2.
ПРИМЕР 6
Активность ингибирования опухолевого роста антителами c1G4 и h1G4
Активность in vivo антител против PD-1 человека была исследована в модели ксенотрансплантата мыши с помощью иммунокомпрометированных мышей NOD/SCID (с диабетом без ожирения/с тяжелым комбинированным иммунодефицитом). Раковые клетки и выделенные PBMC человека смешивали непосредственно перед подкожным введением в указанном соотношении эффектор-мишень (E:T). Каждую мышь билатерально инокулировали смесями раковых клеток и PBMC человека. В каждую экспериментальную группу включали по четыре мыши. Первая доза тестируемого изделия вводилась внутрибрюшинно через 1 день после приживления злокачественных/эффекторных клеток. Мыши получали дозы тестируемого изделия два раза в неделю в течение 3-4 недель. Образование опухоли наблюдалось у каждого животного два раза в неделю. Опухоли измеряли штангенциркулем, а объемы опухолей (V) рассчитывали с использованием следующей формулы: V (мм3) = 0,5 × (длина (мм) × ширина (мм) × ширина (мм)/2).
Кривые роста опухолей с антителами c1G4 или h1G4 в модели ксенотрансплантата HT29/PBMC показаны на фигурах 7А и 15А, соответственно. Индивидуальный объем опухоли на 28-й день с c1G4 или на 21-й день с моделью ксенотрансплантата h1G4 HT29/PBMC представлен на фигурах 7В и 15В соответственно. Кроме того, кривые роста опухоли с антителом h1G4 в NCI-H292/PBMC показаны на фигуре 16А. Индивидуальный объем опухоли на 25 день с антителом h1G4 представлен на фигуре 16В. Все точки данных являются средними ± SEM.
Кроме того, также была изучена комбинированная терапия моноклональными антителами против PD-1 и против VEGF на модели ксенотрансплантата HT29/PBMC. Данные, указывающие на усиление ингибирования опухоли комбинацией анти-PD-1 и анти-VEGF, представлены на фигуре 21.
ПРИМЕР 7
Межвидовая перекрестная реактивность h1G4
Рекомбинантные гибридные белки PD-1 человека, крысы, мыши и яванского макака были приобретены у Sino Biological Inc. PD-1/Fc (9 нг на лунку) иммобилизовали путем инкубации в течение ночи при 4°C в 96-луночном планшете для анализа. Сайты неспецифического связывания блокировали с помощью 5% обезжиренного молока в PBS в течение одного часа при комнатной температуре. После трехкратной промывки планшетов PBST указанные концентрации h1G4, референсного анти-PD-1 антитела (положительный контроль) и HLX01 (отрицательный контроль) инкубировали с иммобилизованными белками в течение одного часа при комнатной температуре. Планшеты трижды промывали PBST и затем инкубировали в течение одного часа при комнатной температуре с меченным пероксидазой козьим антителом против F(ab)'2 из IgG (Jackson ImmunoResearch Laboratories), разведенным 1/10000 в PBS. После промывки планшеты окрашивали с помощью TMB (eBioscience). Абсорбцию считывали при длине волны 450 нм с помощью ридера микропланшетов Vmax (Molecular Devices).
На фигурах 11A-11D показана межвидовая перекрестная реактивность h1G4 по отношению к белкам PD-1 человека (фиг. 11A), яванского макака (фиг. 11B), мыши (фиг. 11C) и крысы (фиг. 11D).
ПРИМЕР 8
Активность ингибирования опухолевого роста у антитела h1G4
Активность ингибирования опухолевого роста у антитела h1G4 на мышах hPD1 KI
Активность in vivo антител против PD-1 человека исследовали на мышах C57BL/6 с нокином PD-1 человека (мышах hPD1 KI). Мышам подкожно инокулировали мышиные клетки рака толстой кишки, трансфицированные PD-L1 человека (1E6 клеток на мышь). Лечение антителами начинали, когда объемы опухолей достигали около 75 мм3 (день 9). В каждую экспериментальную группу до обработки были включены по четыре мыши. Животные получали дозы анти-PD-1 антител два раза в неделю в течение 3-4 недель. Образование опухоли наблюдали у каждого животного два раза в неделю.
Опухоли измеряли штангенциркулем, а объемы опухолей (V) рассчитывали по следующей формуле: V (мм3) = 0,5 × (длина (мм) × ширина (мм) × ширина (мм)/2). Активность ингибирования опухолевого роста антитела h1G4 у мышей hPD1 KI показана на фигуре 17.
Исследование эффективности h1G4 на модели ксенотрансплантата клеточной линии тройного отрицательного рака молочной железы (TNBC) в гуманизированных мышей NSG
Гуманизированным мышам NSG (NOD.Cg-Prkdcscid IL2rgtm1Wjl/SzJ) подкожно инокулировали MDA-MB-231 (линия клеток тройного негативного рака молочной железы человека). Мышей рандомизировали на 3 группы (n = 9/группу) на основании объема опухоли в соответствии с таблицей, когда объемы опухоли достигали ~ 60-150 мм3. Мышам вводили внутрибрюшинно h1G4 один раз каждые 7 дней в дни исследований 0, 7, 14, 21 и 28. Keytruda (анти-PD-1) вводили внутрибрюшинно один раз каждые 5 дней в дни исследований 0, 5, 10, 15 и 20. Формирование опухоли наблюдалось у каждого животного каждые 3-4 дня. Опухоли измеряли штангенциркулем, а объемы опухолей (V) рассчитывали по следующей формуле: V (мм3) = 0,5 × (длина (мм) × ширина (мм) × ширина (мм)/2). Фигура 18 иллюстрирует исследование эффективности h1G4 на модели ксенотрансплантата клеточной линии с тройным негативным раком молочной железы (TNBC) в гуманизированных мышей NSG.
ПРИМЕР 9
Определение равновесной константы диссоциации (KD) аффинно-зрелых анти-PD-1 антител 33B, 66E и 711D
Гуманизированное анти-PD-1 антитело h1G4 использовали в экспериментах по созреванию аффинности на основе фагового дисплея in vitro для получения клонов с улучшенными характеристиками связывания. Нуклеотидные библиотеки CDR-L1/CDR-L3/CDR-H3 (с фокусом на 3 CDR) и CDR-L1/CDR-L2/CDR-L3/CDR-H1/CDR-h1G4 H2/CDR-H3 (с фокусом на 6 CDR) получали посредством ПЦР, клонировали в вектор для фагового дисплея и трансформировали в клетки E.coli TG1 или SS320 для получения библиотеки фагов. После трех раундов пэннинга биотинилированным PD-1-His, связанным с магнитными Dynabeads® M-280, покрытых стрептавидином (Thermo Fisher Scientific # 11205D) для обеих библиотек, три клона Fab, то есть 33B, 66E и 711D, были подвергнуты скринингу с помощью ELISA. Другие кинетические характеристики измеряли с помощью поверхностного плазмонного резонанса (SPR) (см. тот же метод SPR, который описан выше для фигуры 9) с использованием полноразмерных IgG 33B, 66E и 711D, и обнаружили, что клоны имеют характеристики связывания, которые эквивалентны или лучше, чем у референсного анти-PD-1 антитела.
В таблице 5 показана аминокислотная последовательность CDR 33B, 66E и 711D, отобранных по созреванию аффинности на основе фагового дисплея, по сравнению с h1G4.
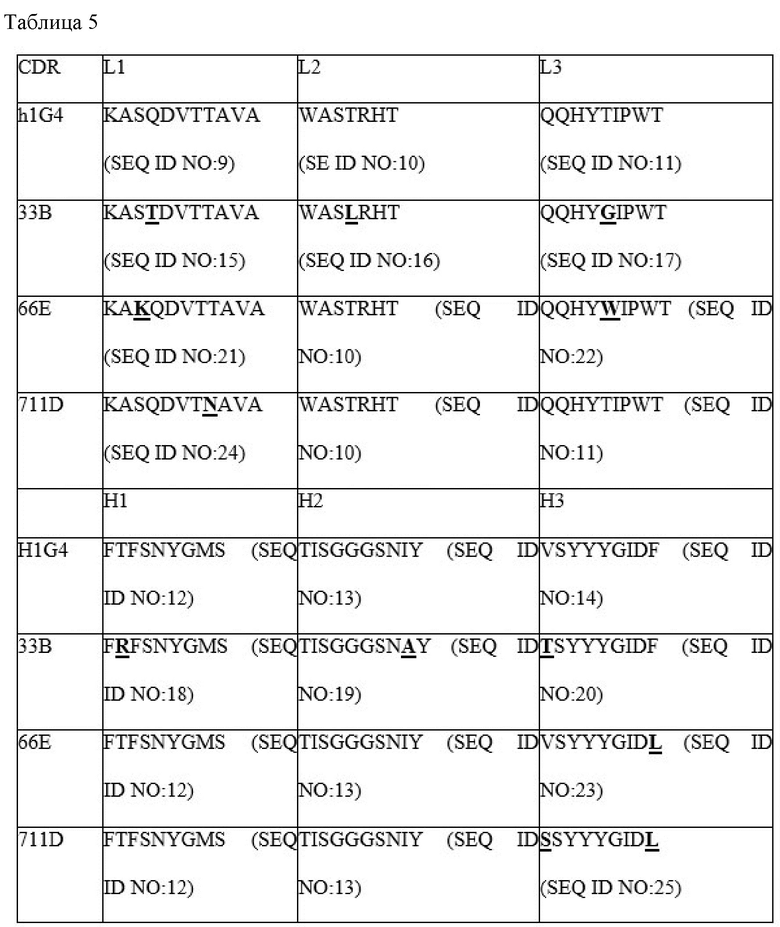
В таблице 6 показана кинетика ассоциации и диссоциации, а также рассчитанная аффинность (KD) для 33B, 66E и 711D, измеренная методом поверхностного плазмонного резонанса (SPR). Улучшение аффинности анти-PD-1 антител в отличие от референсного анти-PD-1 антитела также показано в Таблице 6. Данные представляют два независимых эксперимента, выполненных в двух повторах.
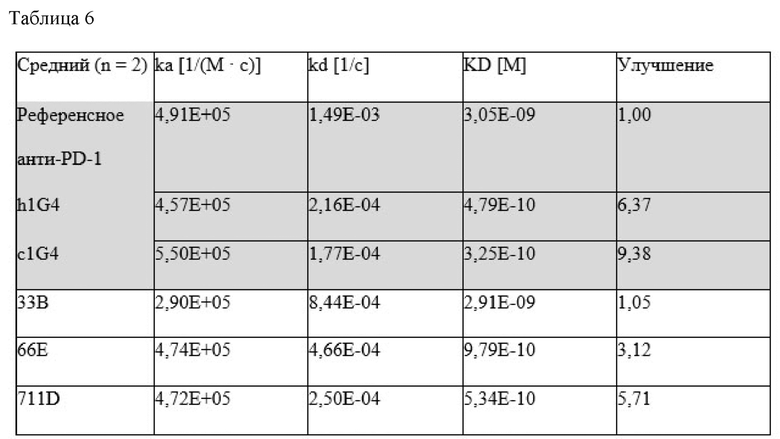
ПРИМЕР 10
Функции аффинно-зрелых антител
Влияние человеческих анти-PD-1 антител (33B, 66E и 711D) на выработку цитокинов в смешанной лейкоцитарной реакции (MLR)
В соответствии с описанным выше способом, это исследование показывает, что человеческие моноклональные антитела против PD-1 человека, такие как 66E и 711D, стимулируют секрецию IFN-γ и IL-2 в анализе смешанной лейкоцитарной реакции. Референсное анти-PD-1 антитело и Авастин (анти-VEGF) использовали в качестве положительного и отрицательного контроля, соответственно. Фигура 19А иллюстрирует зависимую от концентрации секрецию IL-2 антителами со зрелой аффинностью, а фигура 19В иллюстрирует зависимую от концентрации секрецию IFN-γ у антител со зрелой аффинностью.
Активность ингибирования опухолевого роста антител против PD-1 человека на модели ксенотрансплантата HT29/PBMC
В соответствии с описанным выше способом, который описан выше, мышам (n = 4/группу) подкожно приживляли смесь клеток линии рака толстой кишки человека НТ29 и свежевыделенных человеческих РВМС (раковые клетки: РВМС = 3:1). Анти-PD-1 антитела вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Объем опухоли измеряли два раза в неделю. Активность ингибирования опухолевого роста у аффинно-созревших антител против PD-1 человека, в модели ксенотрансплантата HT29/PBMC, показана на фигуре 20. Все точки данных являются средними ± SEM.
ПРИМЕР 11
Комбинированные терапии PD-1
Активность in vivo комбинированной терапии с анти-PD-1 и другими терапевтическими антителами была исследована в мышиной модели ксенотрансплантата с использованием мышей NOD/SCID (с диабетом без ожирения/с тяжелым комбинированным иммунодефицитом). Раковые клетки и выделенные PBMC человека смешивали непосредственно перед подкожным введением в указанном соотношении эффектор-мишень (E:T). Каждую мышь билатерально инокулировали смесями раковых клеток и PBMC человека. В каждую экспериментальную группу включали по четыре или пять животных. Первая доза тестируемого изделия вводилась внутрибрюшинно через 1 день после приживления раковых/эффекторных клеток. Животные получали дозы тестируемого изделия два раза в неделю в течение 3-4 недель. Образование опухоли наблюдалось у каждого животного два раза в неделю. Опухоли измеряли штангенциркулем, а объемы опухолей (V) рассчитывали по следующей формуле:
V(мм3) = 0,5 × (длина (мм) х ширина (мм) × ширина (мм)/2)
Активность ингибирования опухолевого роста у анти-PD-1 mAb плюс анти-VEGF mAb на мышиной модели с ксенотрансплантатом NSCLC
В этих исследованиях мышам (n = 4 на группу) подкожно приживляли смесь клеток NSCLC человека NCI-H292 и свежевыделенных PBMC человека (раковые клетки: PBMC = 3:1). Анти-PD-1 (h1G4) и анти-VEGF (HLX04) антитела вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Кривые роста опухоли показаны на фигуре 22А. Объем отдельной опухоли на 21 день был представлен на фигуре 22B. Все точки данных являются средними ± SEM. Эти данные показывают, что анти-PD-1 mAb, h1G4, в сочетании с анти-VEGF mAb, HLX04, подавляет рост опухоли ксенотрансплантата NCI-H292 более эффективно, чем любой другой агент, используемый отдельно.
В других исследованиях мышам (n = 4/группу) подкожно приживляли смесь клеток NSCLC человека NCI-H292 и свежевыделенных PBMC человека (раковые клетки: PBMC = 3:1). Анти-PD-1 (h1G4) и анти-VEGF (HLX04) антитела вводили мышам внутрибрюшинно дважды в неделю с 1 дня. Кривые роста опухоли показаны на фигуре 23А. Объем отдельной опухоли на 21 день был представлен на фигуре 23В. Все точки данных являются средними ± SEM. Эти данные показывают, что анти-PD-1 mAb, h1G4, в сочетании с анти-VEGFR2 mAb, HLX06, подавляет рост опухоли ксенотрансплантатов NCI-H292 более эффективно, чем любой другой агент, используемый отдельно.
Активность ингибирования опухолевого роста у анти-PD-1 mAb плюс анти-EGFR mAb на мышиной модели с ксенотрансплантатом NSCLC
В соответствии с описанным выше способом, мышам (n = 4 на группу) подкожно приживляли смесь клеток NSCLC человека NCI-H292 и свежевыделенных PBMC человека (раковые клетки: PBMC = 3:1). Анти-PD-1 (HLX10) и анти-EGFR (HLX07) антитела вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Кривые роста опухоли показаны на фигуре 24А. Объем отдельной опухоли на 21 день был представлен на фигуре 24В. Все точки данных являются средними ± SEM. Эти данные указывают на то, что анти-PD-1 mAb, HLX10 (h1G4), в сочетании с анти-EGFR mAb, HLX07, подавляет рост опухоли ксенотрансплантата NCI-H292 более эффективно, чем любой другой агент, используемый отдельно.
Кроме того, мышам (n = 5 на группу) подкожно приживляли смесь клеток рака толстой кишки человека НТ-29 и свежевыделенных РВМС человека (раковые клетки: РВМС = 3:1). Антитела против PD-1 (HLX10) и против EGFR (HLX07) вводили мышам внутрибрюшинно два раза в неделю с 1 дня. Кривые роста опухоли были показаны на фигуре 25А. Индивидуальный объем опухоли на 21 день был представлен на фигуре 25В. Все точки данных являются средними ± SEM.
Эти данные указывают на то, что анти-PD-1 mAb, HLX10 (h1G4), в сочетании с анти-EGFR mAb, HLX07, подавляет рост опухоли ксенотрансплантатов BRAF мутанта в HT-29 более эффективно, чем HLX10, используемые отдельно. Обработка HLX10 плюс HLX07 приводит к несколько большему ингибированию роста опухоли, чем обработка только HLX07. Средняя степень ингибирования роста опухоли при обработке HLX10 плюс HLX07 и при обработке только HLX07 составила 47% и 28%, соответственно.
Предыдущие примеры предлагаются только в иллюстративных целях и никоим образом не предназначены для ограничения объема настоящего изобретения. Различные модификации изобретения в дополнение к тем, которые показаны и описаны в данном документе, станут очевидными для специалистов в данной области из предшествующего описания и попадут в объем прилагаемой формулы изобретения.
Список воплощений
Воплощения, предусмотренные изобретением, включают, без ограничения указанным:
1. Анти-PD-1 антитело или его антигенсвязывающий фрагмент, включающий последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающую аминокислотную последовательность KASQDVTTAVA (SEQ ID NO: 9); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11) и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность VSYYYGIDF (SEQ ID NO: 14).
2. Зрелое анти-PD-1 антитело или его антигенсвязывающий фрагмент, включающие последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающую аминокислотную последовательность KASTDVTTAVA (SEQ ID NO: 15); (2) CDR-L2, включающую аминокислотную последовательность WASLRHT (SEQ ID NO: 16); и (3) CDR-L3, включающую аминокислотную последовательность QQHYGIPWT (SEQ ID NO: 17) и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающую аминокислотную последовательность FRFSNYGMS (SEQ ID NO: 18); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNAY (SEQ ID NO: 19); и (3) CDR-H3, включающую аминокислотную последовательность TSYYYGIDF (SEQ ID NO: 20).
3. Зрелое анти-PD-1 антитело или его антигенсвязывающий фрагмент, включающие последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающую аминокислотную последовательность KAKQDVTTAVA (SEQ ID NO: 21); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYWIPWT (SEQ ID NO: 22) и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность VSYYYGIDL (SEQ ID NO: 23).
4. Зрелое анти-PD-1 антитело или его антигенсвязывающий фрагмент, включающие последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающую аминокислотную последовательность KASQDVTNAVA (SEQ ID NO: 24); (2) CDR-L2, включающую аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающую аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11) и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающую аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающую аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающую аминокислотную последовательность SSYYYGIDL (SEQ ID NO: 25).
5. Антигенсвязывающий фрагмент анти-PD-1 антитела по любому из воплощений 1-4, где антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, Fab', F (ab)' 2, одного -цепь Fv (scFv), фрагмент Fv, диатела и линейного антитела.
6. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из воплощений 1-5, где это антитело является мультиспецифическим антителом.
7. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из воплощений 1-6, конъюгированное с терапевтическим агентом.
8. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из воплощений 1-7, конъюгированные с меткой.
9. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по воплощению 8, где метка выбрана из группы, состоящей из радиоизотопа, флуоресцентного красителя и фермента.
10. Выделенная молекула нуклеиновой кислоты, которая кодирует анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из воплощений 1-4.
11. Экспрессирующий вектор, кодирующий молекулу нуклеиновой кислоты по воплощению 10.
12. Клетка, включающая экспрессирующий вектор воплощения 11.
13. Способ получения анти-PD-1 антитела или его антигенсвязывающего фрагмента, включающий культивирование клетки по воплощению 12 и выделение антитела из клеточной культуры.
14. Композиция, включающая анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из воплощений 1-9 и фармацевтически приемлемый носитель.
15. Способ обнаружения белка PD-1 в образце из пациента путем контакта анти-PD-1 антитела или его антигенсвязывающего фрагмента по любому из воплощений 1-9 с образцом и детекции анти-PD-1 антитела, связанного с белком PD-1.
16. Способ по воплощению 15, где анти-PD-1 антитело или его антигенсвязывающий фрагмент используют в иммуногистохимическом анализе (IHC) или в анализе ELISA.
17. Способ лечения рака у объекта, включающий введение объекту эффективного количества композиции по воплощению 14.
18. Способ по воплощению 17, где рак выбран из группы, состоящей из меланомы, NSCLC, головы и шеи, рака уротелия, тройного негативного рака молочной железы (TNBC), рака желудка, классической лимфомы Ходжкина (cHL), неходжкинской лимфомы первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиомы, рака яичника, рака легкого, рака пищевода, назофарингеальной карциномы (NPC), ракп желчных путей, колоректального рака, рака молочной железы, рака шейки матки, рака щитовидной железы и рака слюнных желёз.
19. Способ по воплощению 18, где объекту дополнительно вводят терапевтический агент, выбранный из группы, состоящей из антинеопластического агента, химиотерапевтического агента, агента, ингибирующего рост, и цитотоксического агента.
20. Способ по воплощению 19, где объекту дополнительно проводят лучевую терапию.
21. Способ по воплощению 18, где объекту дополнительно вводят терапевтическое антитело против VEGF, VEGFR2 или EGFR.
Список последовательностей
SEQ ID NO: 1 (нуклеотидная последовательность c1G4_LC)
CAGCTCGAGGATATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGA GACAGGGTCAGCATCACCTGCAAGGCCAGTCAGGATGTGACTACTGCTGTAGCCTG GTATCAACAAAAACCAGGGCAATCTCCTAAACTACTGATTTACTGGGCATCCACCCG GCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGATTATACTCT CACCATCAACAGTGTGCAGGCTGAAGACCTGGCACTTTATTACTGTCAGCAACATTA CACTATTCCGTGGACGTTCGGTGGAGGCACCAAGCTGGAAATCAAACGTACTGTGG CTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGT CACAAAGAGCTTCAACAGGGGAGAGTGT

SEQ ID NO: 3 (нуклеотидная последовательность c1G4_HC)
GAAGTGATGTTGGTGGAGTCTGGGGGAGGCTTAGTGAAGCCTGGAGGGTCCCTGAA ACTCTCATGTGCAGCCTCTGGATTCACTTTCAGTAACTATGGCATGTCTTGGGTTCGC CAGACTCCGGAGAAGAGCCTGGAGTGGGTCGCAACCATTAGTGGTGGTGGTAGTAA CATCTACTATCCAGACAGTGTGAAGGGGCGATTCACCATCTCCAGAGACAATGCCA AGAACAACCTGTTCCTGCAAATGAGCGGTCTGAGGTCTGAGGACACGGCCCTGTATT ACTGTGTATCGTATTACTATGGAATAGACTTCTGGGGTCAAGGAACCTCAGTCACCG TCTCCTCGGCCTCCACCAAGGGCCCATCGGTCTTCCCGCTAGCACCCTGCTCCAGGA GCACCTCCGAGAGCACAGCCGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAA CCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCC GGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTC CAGCAGCTTGGGCACGAAGACCTACACCTGCAACGTAGATCACAAGCCCAGCAACA CCAAGGTGGACAAGAGAGTTGAGTCCAAATATGGTCCCCCATGCCCACCATGCCCA GCACCTGAGTTCCTGGGGGGACCATCAGTCTTCCTGTTCCCCCCAAAACCCAAGGAC ACTCTCATGATCTCCCGGACCCCTGAGGTCACGTGCGTGGTGGTGGACGTGAGCCAG GAAGACCCCGAGGTCCAGTTCAACTGGTACGTGGATGGCGTGGAGGTGCATAATGC CAAGACAAAGCCGCGGGAGGAGCAGTTCAACAGCACGTACCGTGTGGTCAGCGTCC TCACCGTCCTGCACCAGGACTGGCTGAACGGCAAGGAGTACAAGTGCAAGGTCTCC AACAAAGGCCTCCCGTCCTCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCC CCGAGAGCCACAGGTGTACACCCTGCCCCCATCCCAGGAGGAGATGACCAAGAACC AGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTACCCCAGCGACATCGCCGTGGAGT GGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGAC TCCGACGGCTCCTTCTTCCTCTACAGCAGGCTAACCGTGGACAAGAGCAGGTGGCAG GAGGGGAATGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACA CAGAAGAGCCTCTCCCTGTCTCTGGGTAAA

SEQ ID NO: 5 (нуклеотидная последовательность h1G4_LC)
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACAGAGTC ACCATCACTTGCAAGGCCAGTCAGGATGTGACTACTGCTGTAGCCTGGTATCAGCAG AAACCAGGGAAAGCCCCTAAGCTCCTGATCTATTGGGCATCCACCCGGCACACTGG GGTCCCATCAAGGTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAG CAGTCTGCAACCTGAAGATTTTGCAACTTACTACTGTCAGCAACATTACACTATTCC GTGGACGTTCGGTGGAGGCACCAAGCTGGAAATCAAACGTACTGTGGCTGCACCAT CTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGT GTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATA ACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGAC AGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACA CAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGA GCTTCAACAGGGGAGAGTGT

SEQ ID NO: 7 (нуклеотидная последовательность h1G4_HC)
CAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTCAAGCCTGGAGGGTCCCTGAG ACTCTCCTGTGCAGCCTCTGGATTCACTTTCAGTAACTATGGCATGTCTTGGATCCGC CAGGCTCCAGGGAAGGGGCTGGAGTGGGTTTCAACCATTAGTGGTGGTGGTAGTAA CATCTACTACGCAGACTCTGTGAAGGGCCGATTCACCATCTCCAGGGACAACGCCA AGAACTCACTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTAT TACTGTGTATCGTATTACTATGGAATAGACTTCTGGGGTCAAGGAACCTCAGTCACC GTCTCCTCGGCCTCCACCAAGGGCCCATCGGTCTTCCCGCTAGCACCCTGCTCCAGG AGCACCTCCGAGAGCACAGCCGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGA ACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCC CGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCT CCAGCAGCTTGGGCACGAAGACCTACACCTGCAACGTAGATCACAAGCCCAGCAAC ACCAAGGTGGACAAGAGAGTTGAGTCCAAATATGGTCCCCCATGCCCACCATGCCC AGCACCTGAGTTCCTGGGGGGACCATCAGTCTTCCTGTTCCCCCCAAAACCCAAGGA CACTCTCATGATCTCCCGGACCCCTGAGGTCACGTGCGTGGTGGTGGACGTGAGCCA GGAAGACCCCGAGGTCCAGTTCAACTGGTACGTGGATGGCGTGGAGGTGCATAATG CCAAGACAAAGCCGCGGGAGGAGCAGTTCAACAGCACGTACCGTGTGGTCAGCGTC CTCACCGTCCTGCACCAGGACTGGCTGAACGGCAAGGAGTACAAGTGCAAGGTCTC CAACAAAGGCCTCCCGTCCTCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGC CCCGAGAGCCACAGGTGTACACCCTGCCCCCATCCCAGGAGGAGATGACCAAGAAC CAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTACCCCAGCGACATCGCCGTGGAG TGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGA CTCCGACGGCTCCTTCTTCCTCTACAGCAGGCTAACCGTGGACAAGAGCAGGTGGCA GGAGGGGAATGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACAC ACAGAAGAGCCTCTCCCTGTCTCTGGGTAAA

SEQ ID NO: 9 (CDR-L1 c1G4 и h1G4): KASQDVTTAVA
SEQ ID NO: 10 (CDR-L2 c1G4 и h1G4): WASTRHT
SEQ ID NO: 11 (CDR-L3 c1G4 и h1G4): QQHYTIPWT
SEQ ID NO: 12 (CDR-H1 c1G4 и h1G4): FTFSNYGMS
SEQ ID NO: 13 (CDR-H2 c1G4 и h1G4): TISGGGSNIY
SEQ ID NO: 14 (c1G4 и h1G4 CDR-H3): VSYYYGIDF
SEQ ID NO: 15 (33B CDR-L1): KASTDVTTAVA
SEQ ID NO: 16 (33B CDR-L2): WASLRHT:
SEQ ID NO: 17 (33B CDR-L3): QQHYGIPWT
SEQ ID NO: 18 (33B CDR-H1): FRFSNYGMS
SEQ ID NO: 19 (33B CDR-H2 ): TISGGGSNAY
SEQ ID NO: 20 (33B CDR-H3): TSYYYGIDF
SEQ ID NO: 21 (66E CDR-L1): KAKQDVTTAVA
SEQ ID NO: 22 (66E CDR-L3): QQHYWIPWT
SEQ ID NO: 23 (66E CDR-H3): VSYYYGIDL
SEQ ID NO: 24 (711D CDR-L1): KASQDVTNAVA
SEQ ID NO: 25 (711D CDR-H3): SSYYYGIDL
--->
SEQUENCE LISTING
<110> HENLIX, INC.
HENLIX BIOTECH CO., LTD.
<120> ANTI-PD-1 ANTIBODIES
<130> 000020.000004PCT-LF
<140> PCT/US2017/050851
<141> 2017-09-09
<150> 62/519,590
<151> 2017-06-14
<150> 62/395,832
<151> 2016-09-16
<160> 34
<170> PatentIn version 3.5
<210> 1
<211> 651
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 1
cagctcgagg atattgtgat gacccagtct cacaaattca tgtccacatc agtaggagac 60
agggtcagca tcacctgcaa ggccagtcag gatgtgacta ctgctgtagc ctggtatcaa 120
caaaaaccag ggcaatctcc taaactactg atttactggg catccacccg gcacactgga 180
gtccctgatc gcttcacagg cagtggatct gggacagatt atactctcac catcaacagt 240
gtgcaggctg aagacctggc actttattac tgtcagcaac attacactat tccgtggacg 300
ttcggtggag gcaccaagct ggaaatcaaa cgtactgtgg ctgcaccatc tgtcttcatc 360
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 420
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 480
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 540
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 600
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg t 651
<210> 2
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 2
Gln Leu Glu Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr
1 5 10 15
Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val
20 25 30
Thr Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
35 40 45
Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg
50 55 60
Phe Thr Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Asn Ser
65 70 75 80
Val Gln Ala Glu Asp Leu Ala Leu Tyr Tyr Cys Gln Gln His Tyr Thr
85 90 95
Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 3
<211> 1329
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 3
gaagtgatgt tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcatgtgcag cctctggatt cactttcagt aactatggca tgtcttgggt tcgccagact 120
ccggagaaga gcctggagtg ggtcgcaacc attagtggtg gtggtagtaa catctactat 180
ccagacagtg tgaaggggcg attcaccatc tccagagaca atgccaagaa caacctgttc 240
ctgcaaatga gcggtctgag gtctgaggac acggccctgt attactgtgt atcgtattac 300
tatggaatag acttctgggg tcaaggaacc tcagtcaccg tctcctcggc ctccaccaag 360
ggcccatcgg tcttcccgct agcaccctgc tccaggagca cctccgagag cacagccgcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cgaagaccta cacctgcaac 600
gtagatcaca agcccagcaa caccaaggtg gacaagagag ttgagtccaa atatggtccc 660
ccatgcccac catgcccagc acctgagttc ctggggggac catcagtctt cctgttcccc 720
ccaaaaccca aggacactct catgatctcc cggacccctg aggtcacgtg cgtggtggtg 780
gacgtgagcc aggaagaccc cgaggtccag ttcaactggt acgtggatgg cgtggaggtg 840
cataatgcca agacaaagcc gcgggaggag cagttcaaca gcacgtaccg tgtggtcagc 900
gtcctcaccg tcctgcacca ggactggctg aacggcaagg agtacaagtg caaggtctcc 960
aacaaaggcc tcccgtcctc catcgagaaa accatctcca aagccaaagg gcagccccga 1020
gagccacagg tgtacaccct gcccccatcc caggaggaga tgaccaagaa ccaggtcagc 1080
ctgacctgcc tggtcaaagg cttctacccc agcgacatcg ccgtggagtg ggagagcaat 1140
gggcagccgg agaacaacta caagaccacg cctcccgtgc tggactccga cggctccttc 1200
ttcctctaca gcaggctaac cgtggacaag agcaggtggc aggaggggaa tgtcttctca 1260
tgctccgtga tgcatgaggc tctgcacaac cactacacac agaagagcct ctccctgtct 1320
ctgggtaaa 1329
<210> 4
<211> 443
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 4
Glu Val Met Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Glu Lys Ser Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Ser Asn Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Phe
65 70 75 80
Leu Gln Met Ser Gly Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Ser Tyr Tyr Tyr Gly Ile Asp Phe Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 5
<211> 642
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 5
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca aggccagtca ggatgtgact actgctgtag cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctattgg gcatccaccc ggcacactgg ggtcccatca 180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct 240
gaagattttg caacttacta ctgtcagcaa cattacacta ttccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa acgtactgtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gt 642
<210> 6
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Thr Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Ile Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 7
<211> 1329
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 7
caggtgcagc tggtggagtc tgggggaggc ttggtcaagc ctggagggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt aactatggca tgtcttggat ccgccaggct 120
ccagggaagg ggctggagtg ggtttcaacc attagtggtg gtggtagtaa catctactac 180
gcagactctg tgaagggccg attcaccatc tccagggaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgt atcgtattac 300
tatggaatag acttctgggg tcaaggaacc tcagtcaccg tctcctcggc ctccaccaag 360
ggcccatcgg tcttcccgct agcaccctgc tccaggagca cctccgagag cacagccgcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cgaagaccta cacctgcaac 600
gtagatcaca agcccagcaa caccaaggtg gacaagagag ttgagtccaa atatggtccc 660
ccatgcccac catgcccagc acctgagttc ctggggggac catcagtctt cctgttcccc 720
ccaaaaccca aggacactct catgatctcc cggacccctg aggtcacgtg cgtggtggtg 780
gacgtgagcc aggaagaccc cgaggtccag ttcaactggt acgtggatgg cgtggaggtg 840
cataatgcca agacaaagcc gcgggaggag cagttcaaca gcacgtaccg tgtggtcagc 900
gtcctcaccg tcctgcacca ggactggctg aacggcaagg agtacaagtg caaggtctcc 960
aacaaaggcc tcccgtcctc catcgagaaa accatctcca aagccaaagg gcagccccga 1020
gagccacagg tgtacaccct gcccccatcc caggaggaga tgaccaagaa ccaggtcagc 1080
ctgacctgcc tggtcaaagg cttctacccc agcgacatcg ccgtggagtg ggagagcaat 1140
gggcagccgg agaacaacta caagaccacg cctcccgtgc tggactccga cggctccttc 1200
ttcctctaca gcaggctaac cgtggacaag agcaggtggc aggaggggaa tgtcttctca 1260
tgctccgtga tgcatgaggc tctgcacaac cactacacac agaagagcct ctccctgtct 1320
ctgggtaaa 1329
<210> 8
<211> 443
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 8
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Gly Gly Gly Ser Asn Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Ser Tyr Tyr Tyr Gly Ile Asp Phe Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 9
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 9
Lys Ala Ser Gln Asp Val Thr Thr Ala Val Ala
1 5 10
<210> 10
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 10
Trp Ala Ser Thr Arg His Thr
1 5
<210> 11
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 11
Gln Gln His Tyr Thr Ile Pro Trp Thr
1 5
<210> 12
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 12
Phe Thr Phe Ser Asn Tyr Gly Met Ser
1 5
<210> 13
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 13
Thr Ile Ser Gly Gly Gly Ser Asn Ile Tyr
1 5 10
<210> 14
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 14
Val Ser Tyr Tyr Tyr Gly Ile Asp Phe
1 5
<210> 15
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 15
Lys Ala Ser Thr Asp Val Thr Thr Ala Val Ala
1 5 10
<210> 16
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 16
Trp Ala Ser Leu Arg His Thr
1 5
<210> 17
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 17
Gln Gln His Tyr Gly Ile Pro Trp Thr
1 5
<210> 18
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 18
Phe Arg Phe Ser Asn Tyr Gly Met Ser
1 5
<210> 19
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 19
Thr Ile Ser Gly Gly Gly Ser Asn Ala Tyr
1 5 10
<210> 20
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 20
Thr Ser Tyr Tyr Tyr Gly Ile Asp Phe
1 5
<210> 21
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 21
Lys Ala Lys Gln Asp Val Thr Thr Ala Val Ala
1 5 10
<210> 22
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 22
Gln Gln His Tyr Trp Ile Pro Trp Thr
1 5
<210> 23
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 23
Val Ser Tyr Tyr Tyr Gly Ile Asp Leu
1 5
<210> 24
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 24
Lys Ala Ser Gln Asp Val Thr Asn Ala Val Ala
1 5 10
<210> 25
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 25
Ser Ser Tyr Tyr Tyr Gly Ile Asp Leu
1 5
<210> 26
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
6xHis tag
<400> 26
His His His His His His
1 5
<210> 27
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 27
Gln Leu Glu Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr
1 5 10 15
Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val
20 25 30
Thr Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
35 40 45
Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg
50 55 60
Phe Thr Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Asn Ser
65 70 75 80
Val Gln Ala Glu Asp Leu Ala Leu Tyr Tyr Cys Gln Gln His Tyr Thr
85 90 95
Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 28
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 28
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Thr Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Ile Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 29
<211> 95
<212> PRT
<213> Homo sapiens
<400> 29
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro
85 90 95
<210> 30
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 30
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 31
<211> 393
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 31
Glu Val Met Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Glu Lys Ser Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Ser Asn Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Phe
65 70 75 80
Leu Gln Met Ser Gly Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Ser Tyr Tyr Tyr Gly Ile Asp Phe Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Val Asp His Lys Pro Ser Asn Thr Lys Val
145 150 155 160
Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
165 170 175
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
180 185 190
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
195 200 205
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
210 215 220
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
225 230 235 240
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
245 250 255
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
260 265 270
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
275 280 285
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
290 295 300
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
305 310 315 320
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
325 330 335
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
340 345 350
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
355 360 365
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
370 375 380
Lys Ser Leu Ser Leu Ser Leu Gly Lys
385 390
<210> 32
<211> 393
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 32
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Gly Gly Gly Ser Asn Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Ser Tyr Tyr Tyr Gly Ile Asp Phe Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Val Asp His Lys Pro Ser Asn Thr Lys Val
145 150 155 160
Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
165 170 175
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
180 185 190
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
195 200 205
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
210 215 220
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
225 230 235 240
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
245 250 255
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
260 265 270
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
275 280 285
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
290 295 300
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
305 310 315 320
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
325 330 335
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
340 345 350
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
355 360 365
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
370 375 380
Lys Ser Leu Ser Leu Ser Leu Gly Lys
385 390
<210> 33
<211> 98
<212> PRT
<213> Homo sapiens
<400> 33
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 34
<211> 389
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 34
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
115 120 125
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val
145 150 155 160
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
165 170 175
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
180 185 190
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
195 200 205
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
210 215 220
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
225 230 235 240
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
245 250 255
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
260 265 270
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
275 280 285
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
290 295 300
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
305 310 315 320
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
325 330 335
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
340 345 350
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
355 360 365
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
370 375 380
Leu Ser Leu Gly Lys
385
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К PD-1 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2761640C2 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
| АНТИТЕЛА ПРОТИВ PD-L1 И ИХ ВАРИАНТЫ | 2017 |
|
RU2770590C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732591C2 |
| АНТИТЕЛА К ICOS | 2016 |
|
RU2742241C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2817838C2 |
| АНТИ-PD-L1 АНТИТЕЛА | 2015 |
|
RU2722212C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ИЗ АНТИТЕЛА К ПРОГАСТРИНУ И ИММУНОТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2784604C2 |
| Способы лечения рака с помощью анти-PD-1-антител и анти-CTLA4-антител | 2019 |
|
RU2825835C2 |
| 5-БРОМ-2,6-ДИ-(1Н-ПИРАЗОЛ-1-ИЛ)ПИРИМИДИН-4-АМИН ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745560C2 |
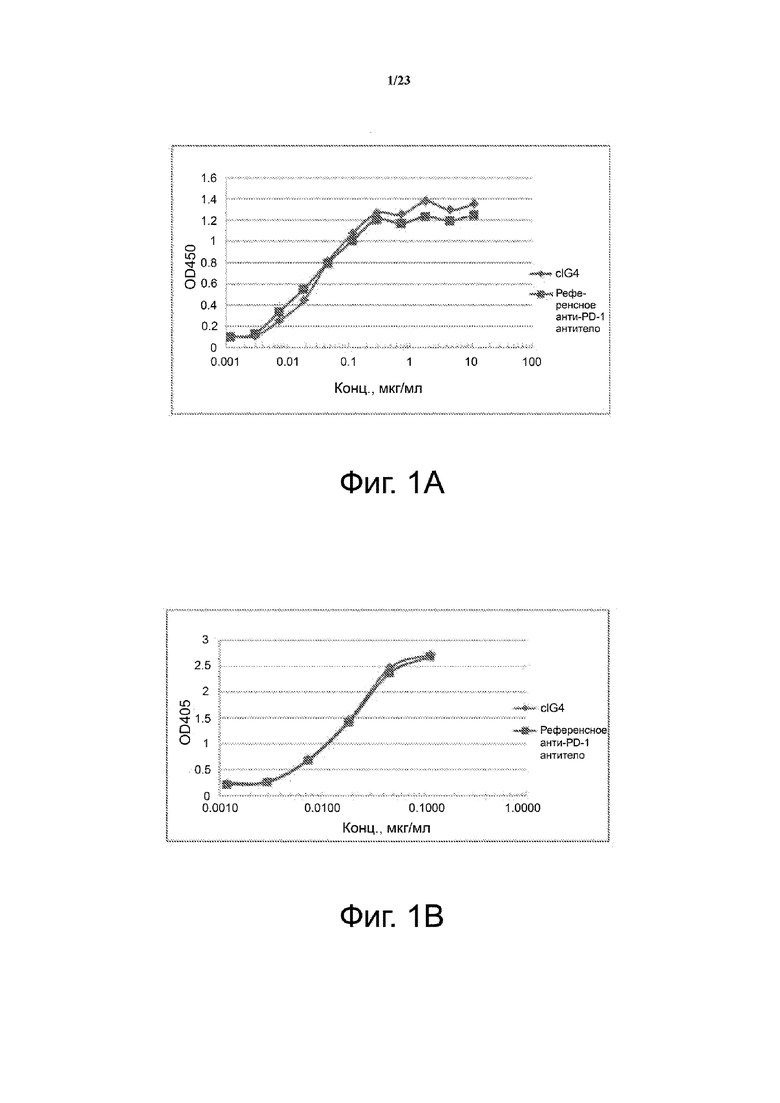
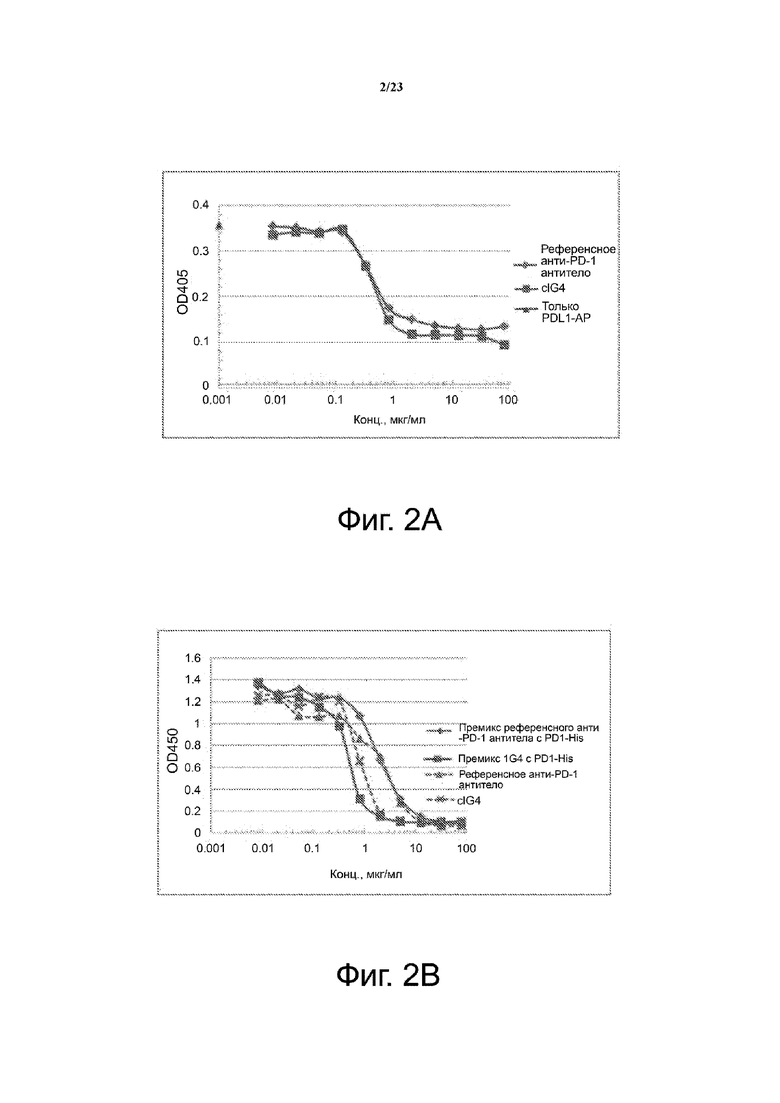
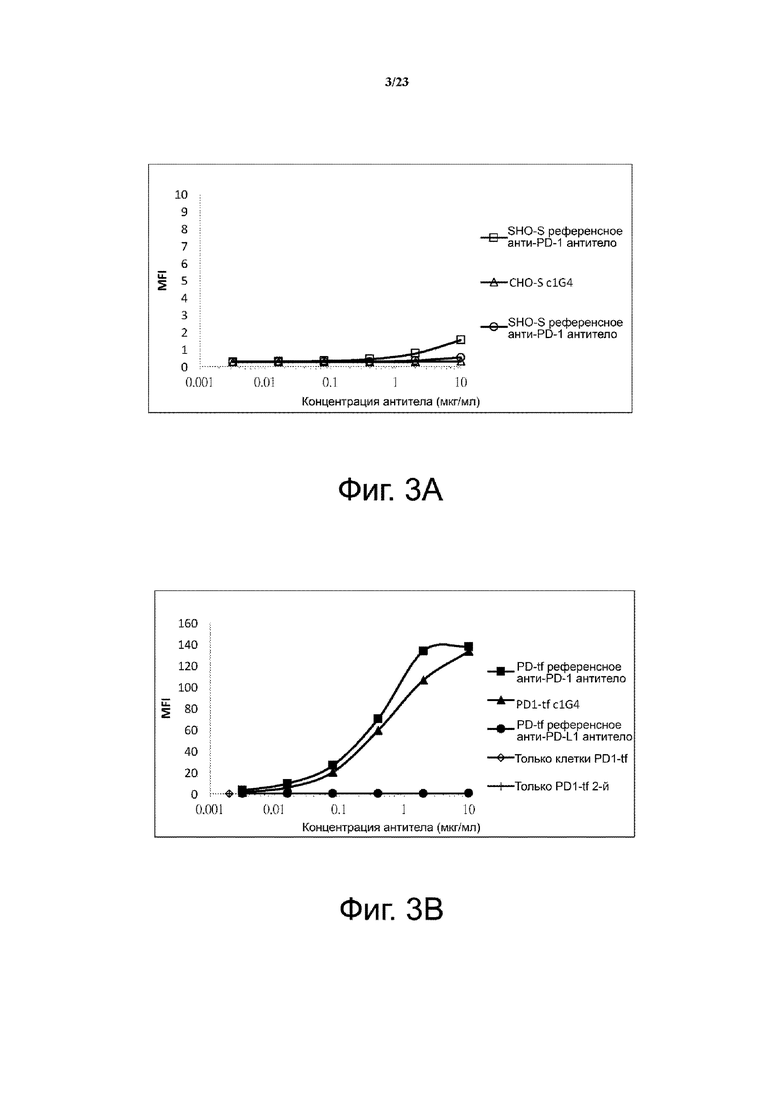
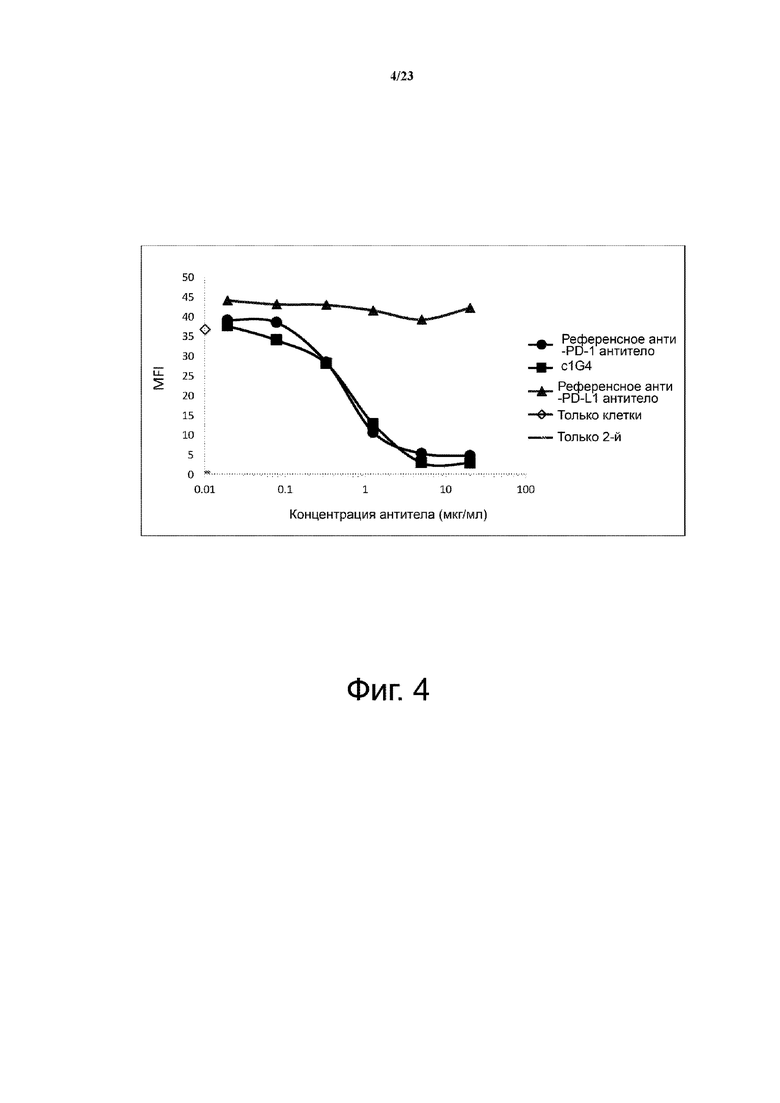
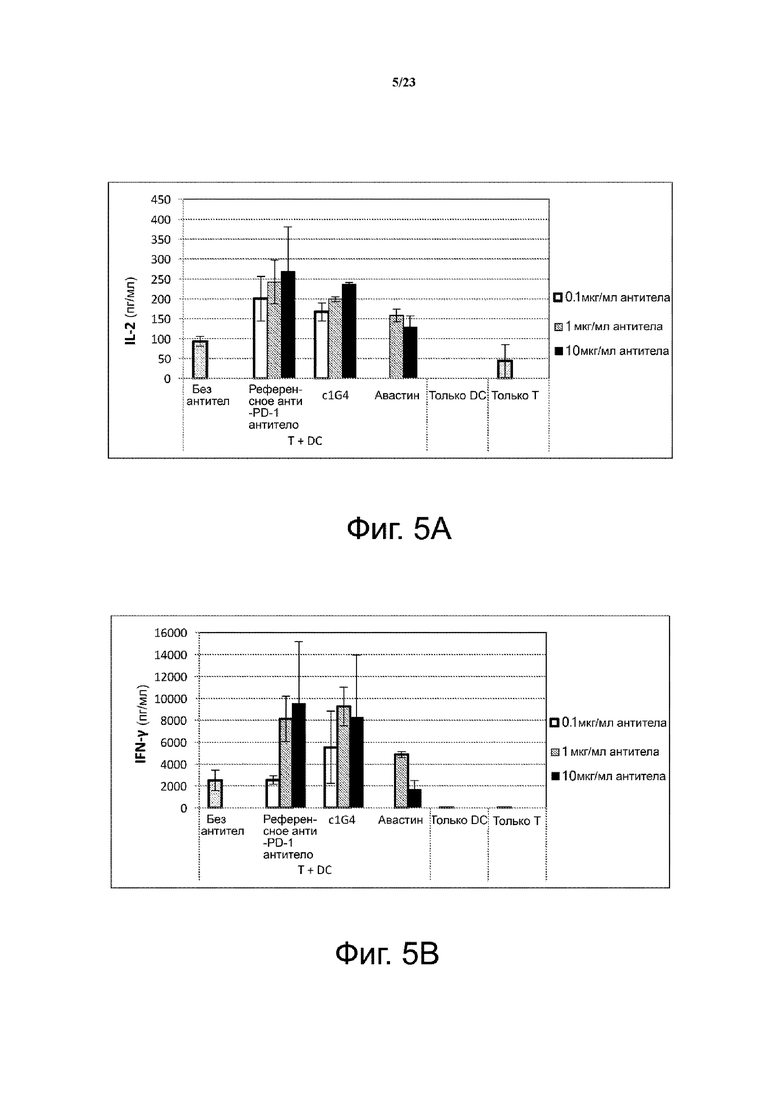
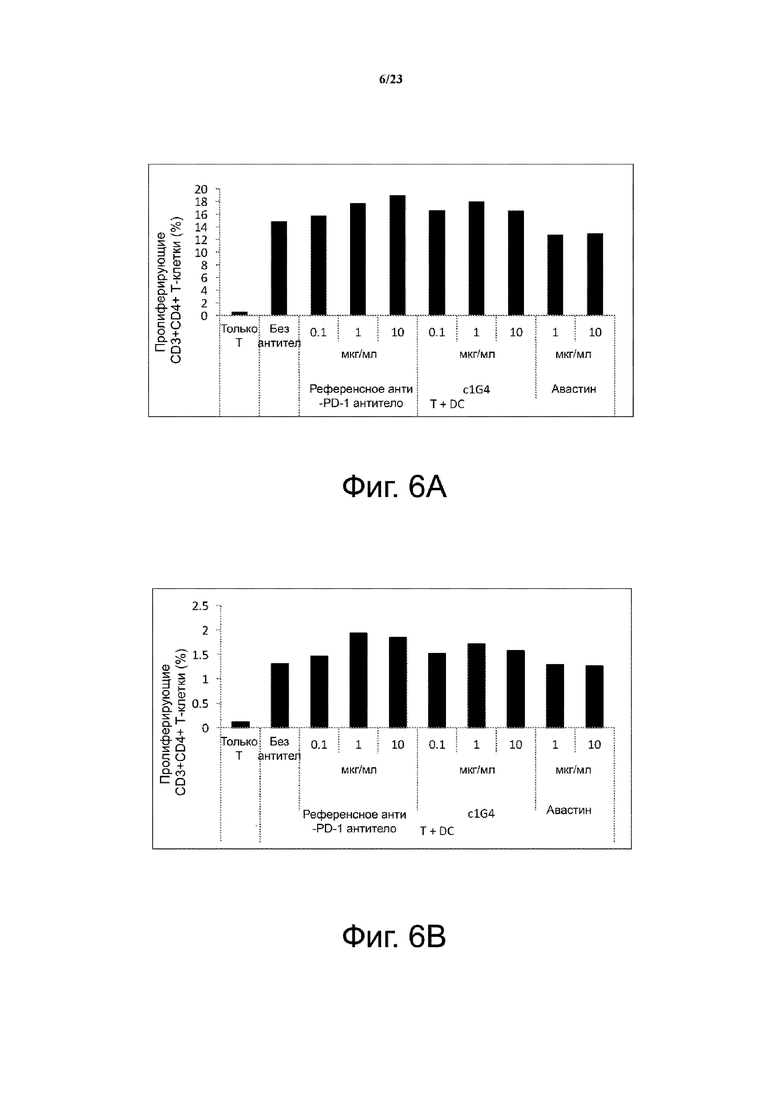
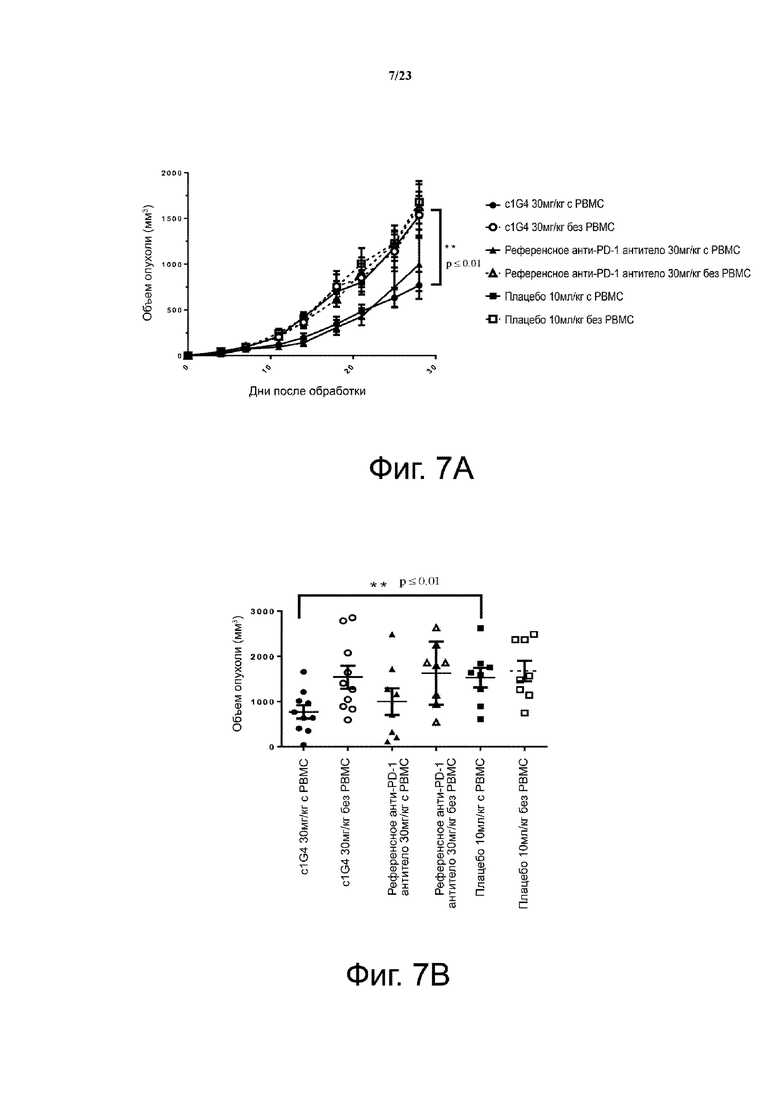


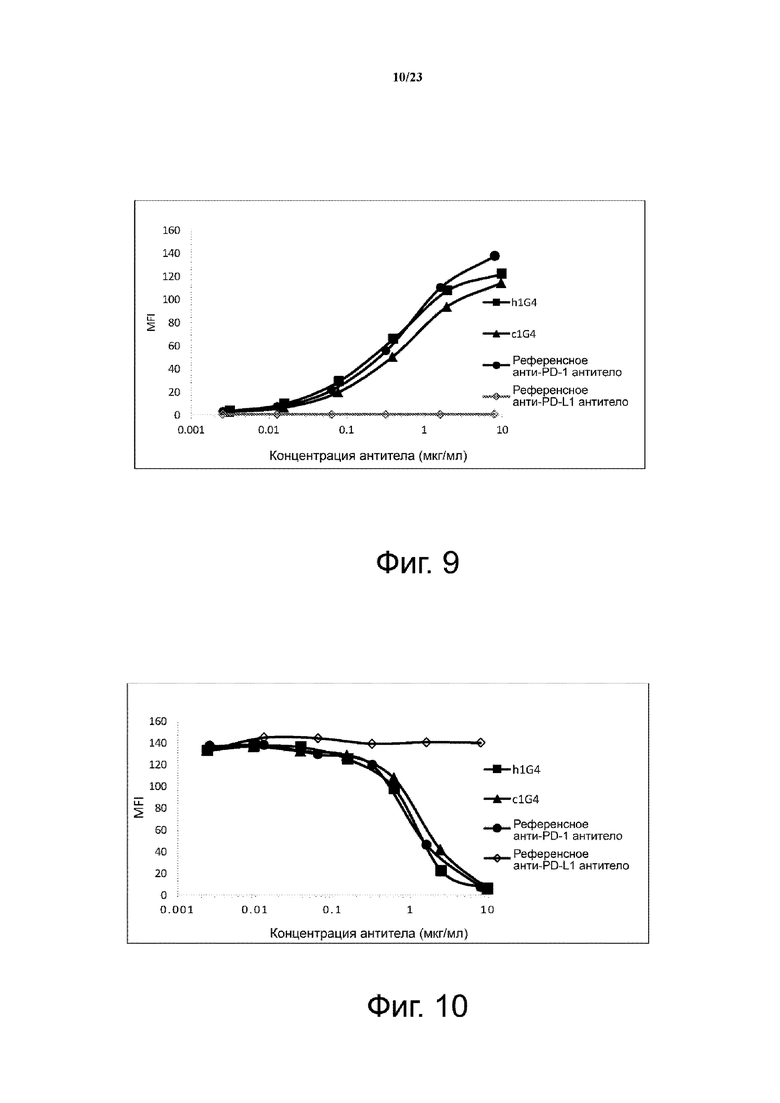
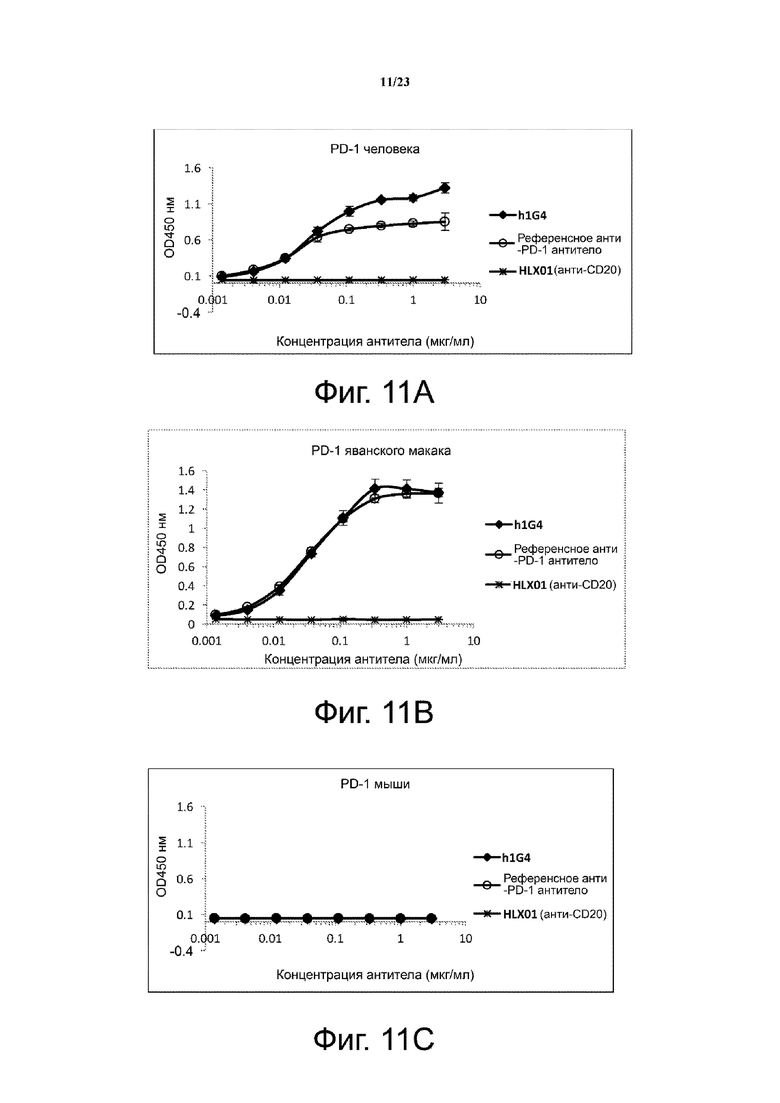
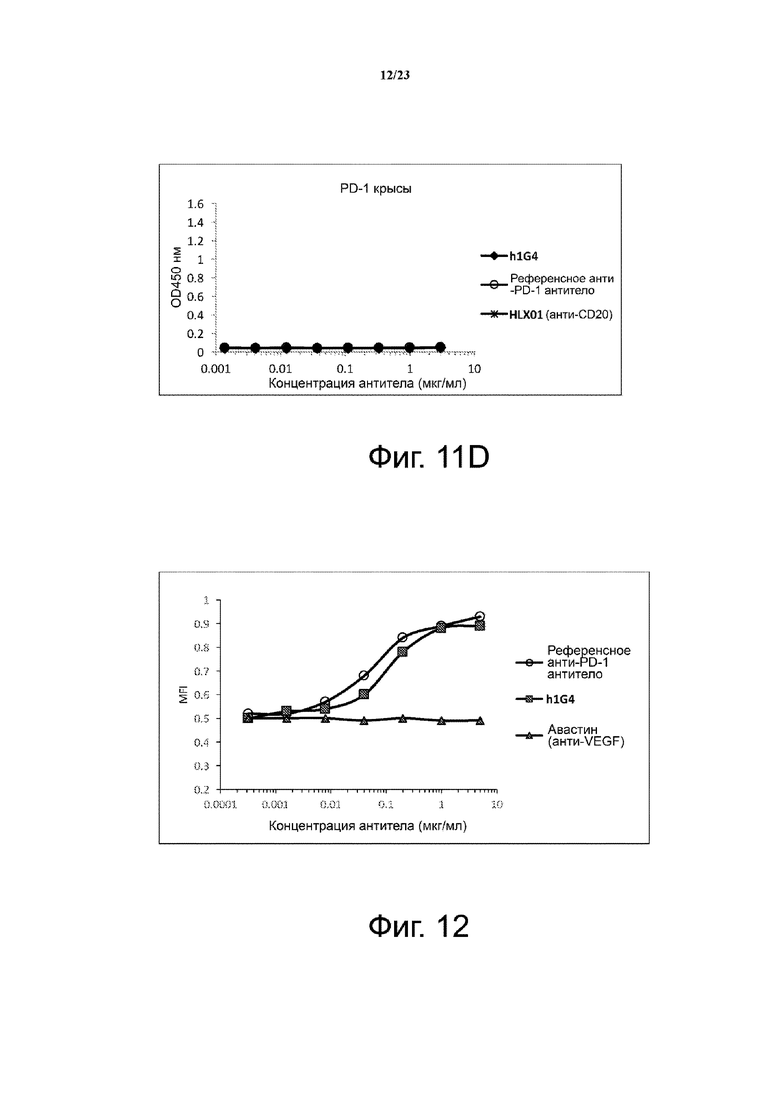
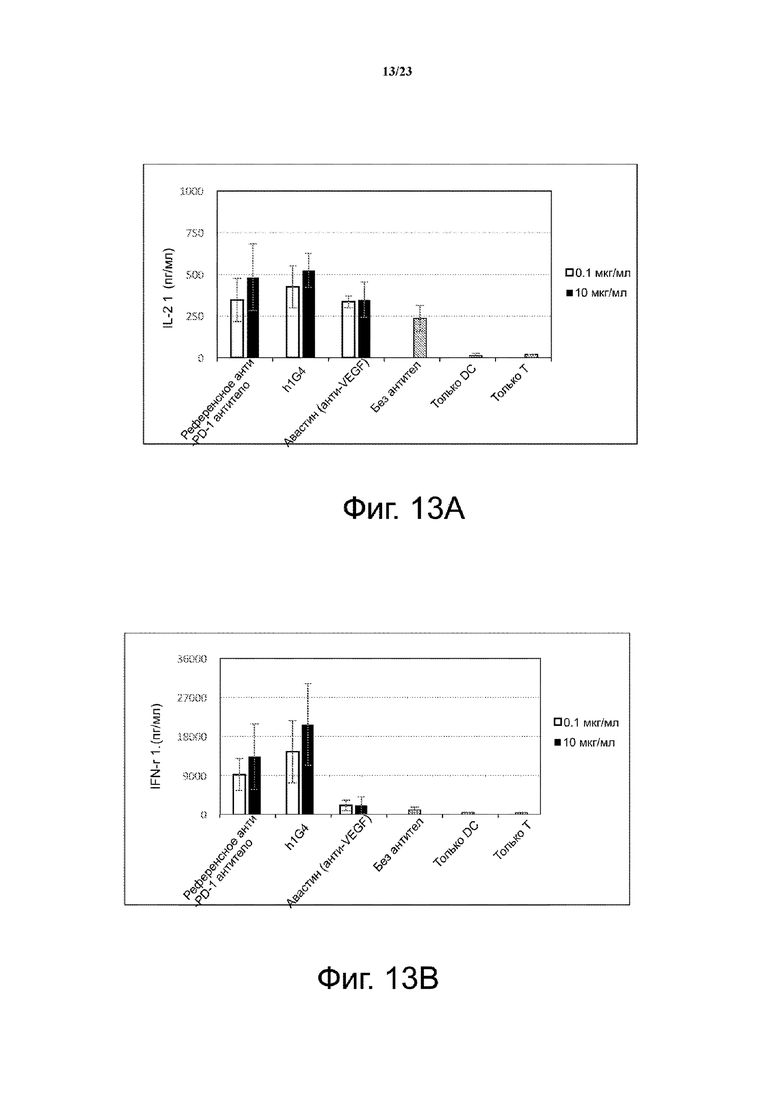
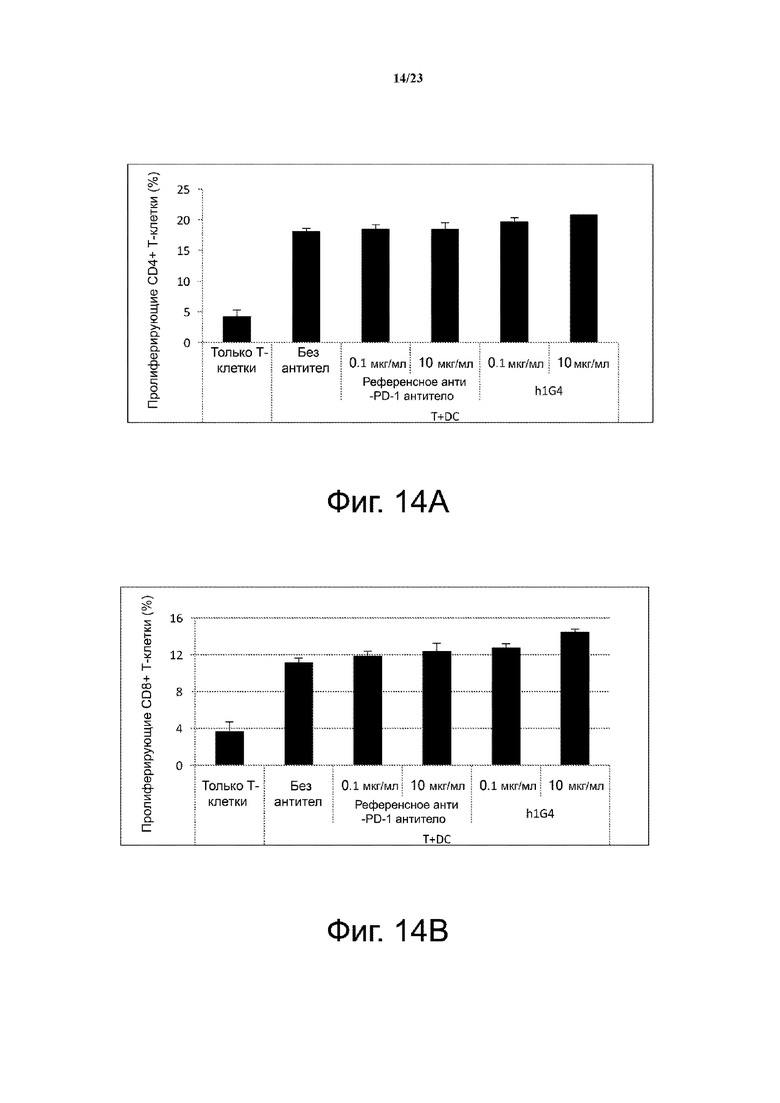
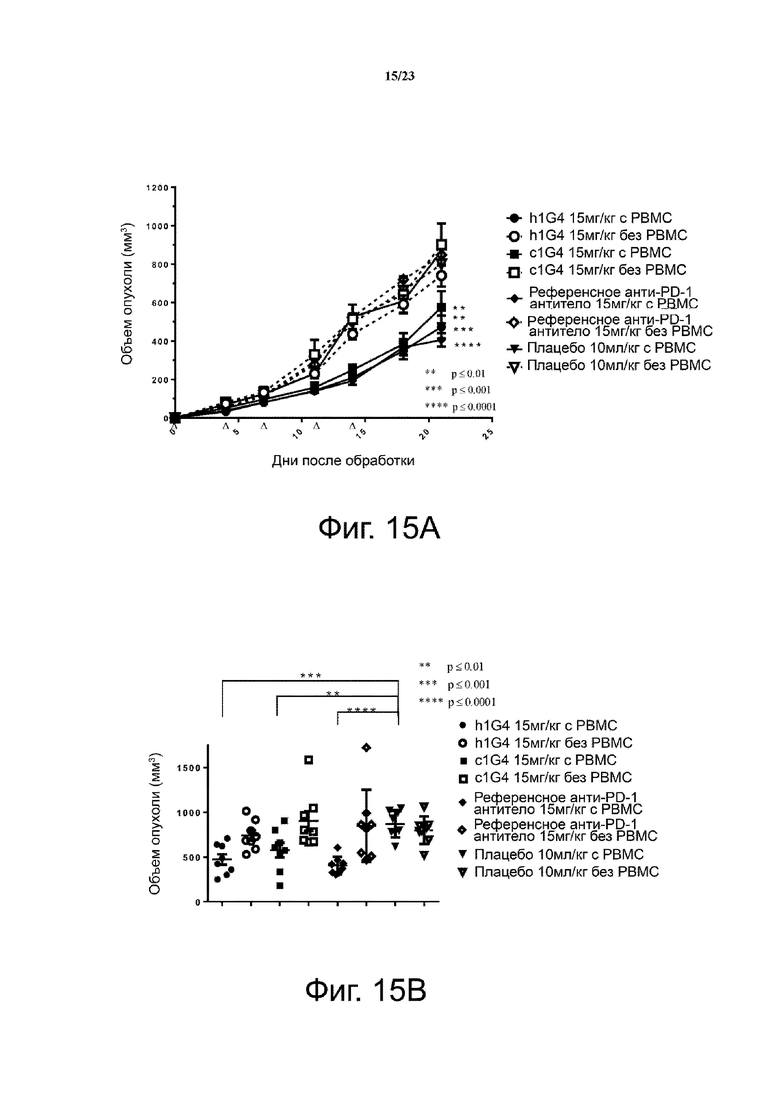
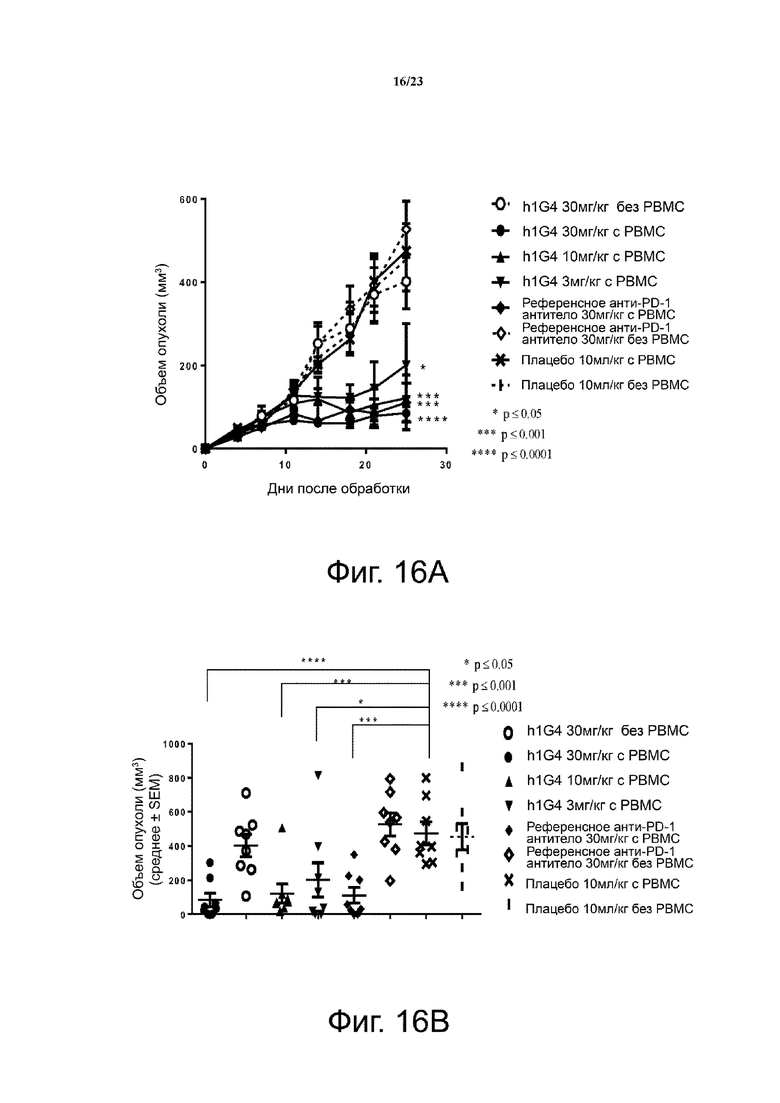
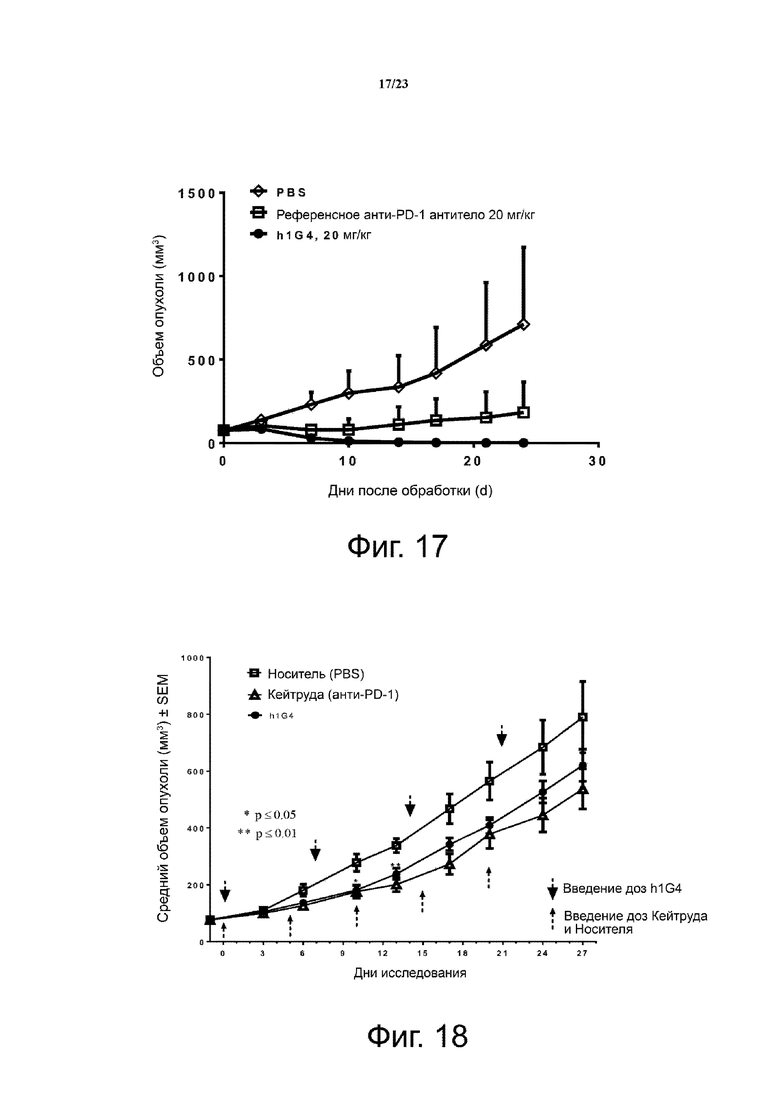
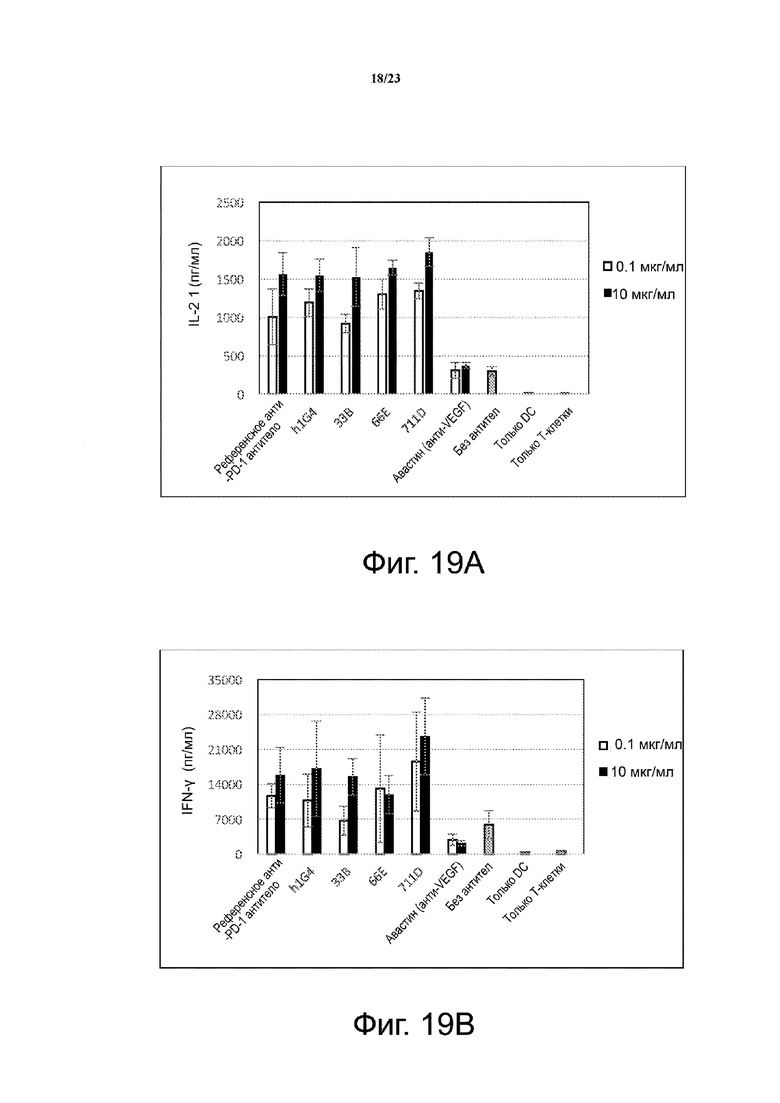
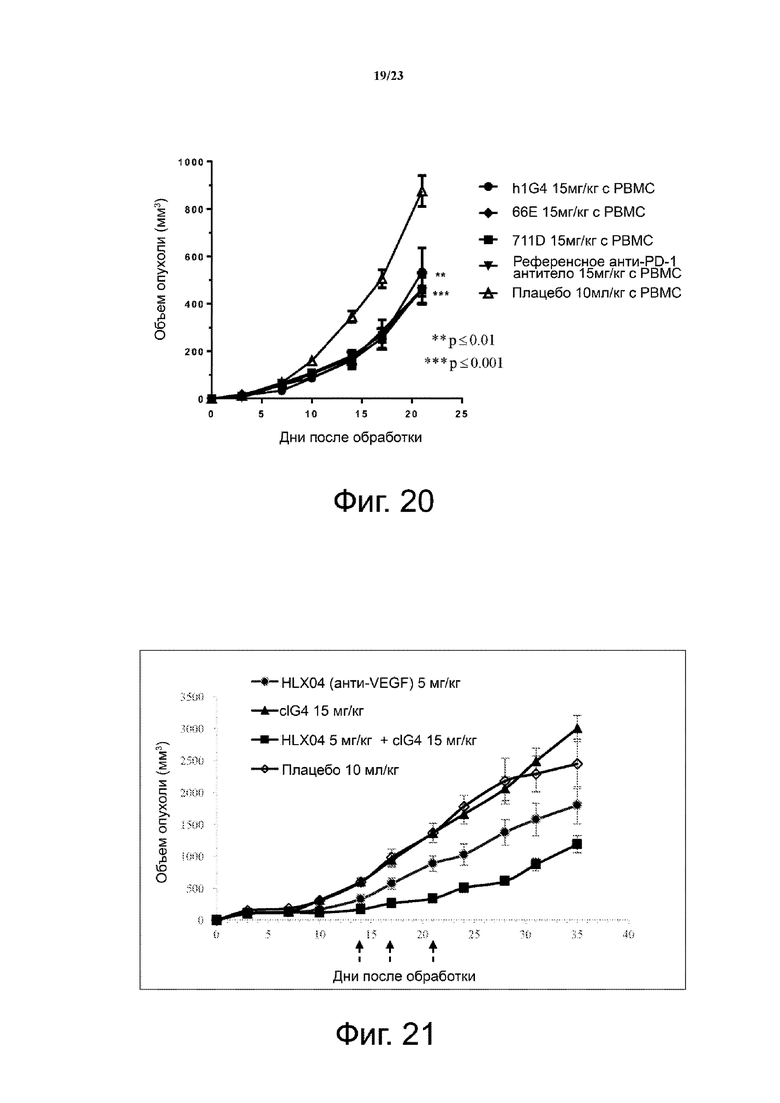
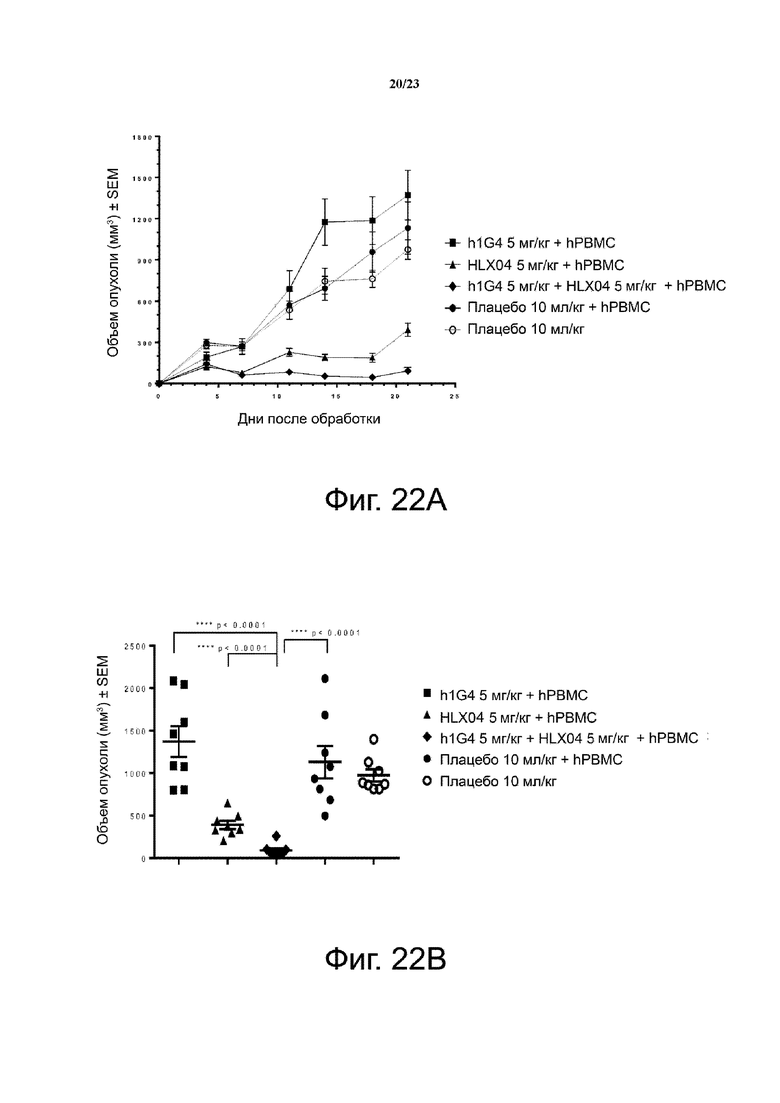
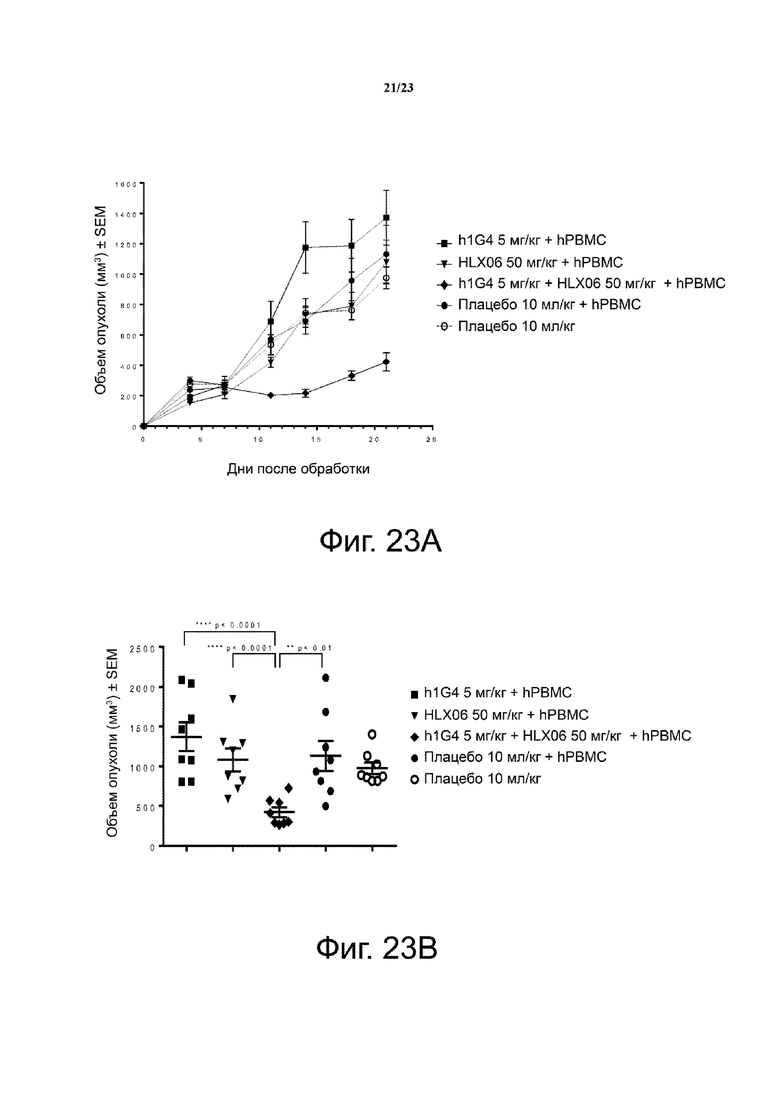
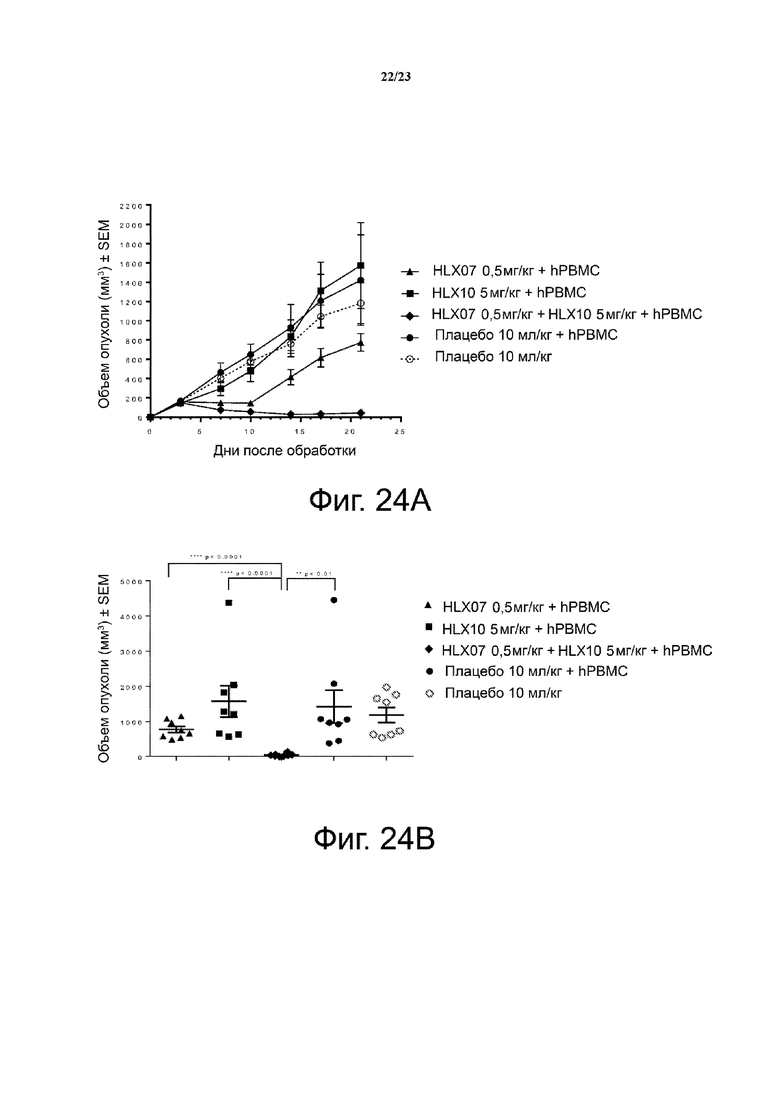
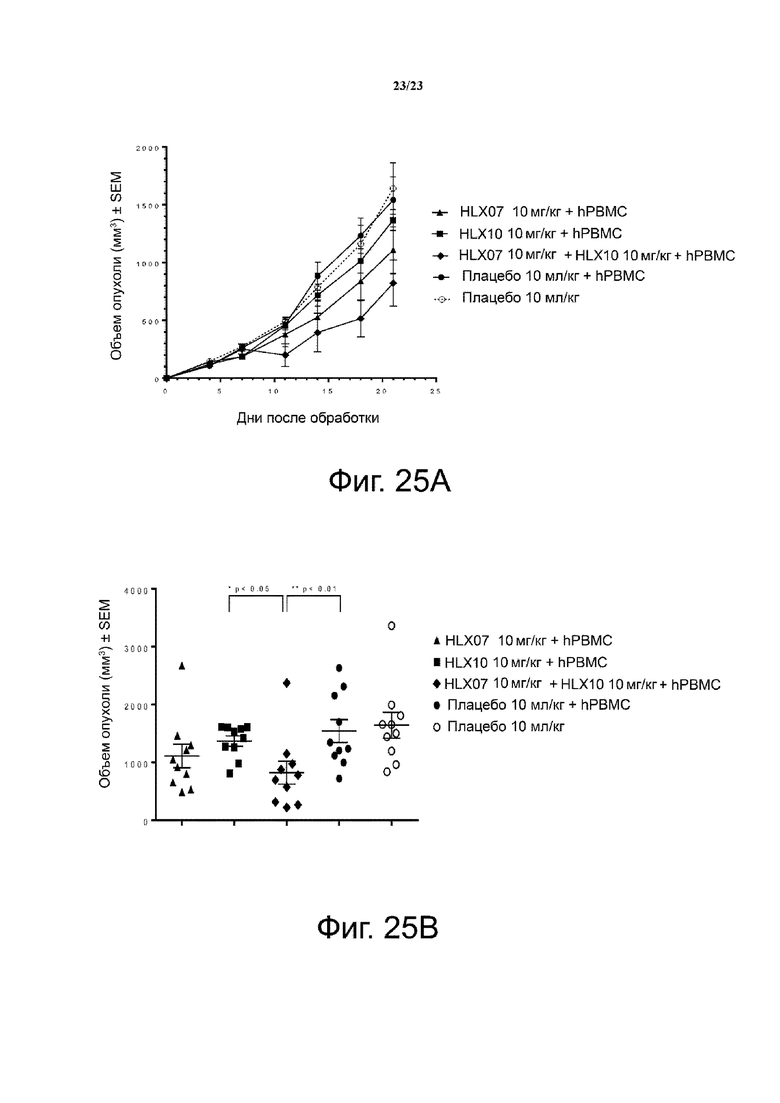
Изобретение относится к области биотехнологии, в частности к антизапрограммированной смерти-1 (PD-1) антителу или его антигенсвязывающему фрагменту, которые специфически связываются с PD-1, кодирующей его молекуле нуклеиновой кислоты, а также к содержащей вышеуказанное антитело или его фрагмент, композиции и иммуноконъюгату. Также раскрыты вектор и клетка, содержащие вышеуказанную молекулу нуклеиновой кислоты. Изобретение также относится к способу получения вышеуказанного анти-PD-1 антитела или его антигенсвязывающего фрагмента, а также к способу обнаружения белка PD-1 в образце из пациента, используя вышеуказанное антитело или его фрагмент. Изобретение позволяет эффективно осуществлять лечение рака. 10 н. и 14 з.п. ф-лы, 25 ил., 6 табл., 11 пр.
1. Анти-запрограммированной смерти-1 (PD-1) антитело или его антигенсвязывающий фрагмент, которые специфически связываются с PD-1, включающие:
(а) последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающий аминокислотную последовательность KASQDVTTAVA (SEQ ID NO: 9); (2) CDR-L2, включающий аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающий аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11), и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающий аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающий аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающий аминокислотную последовательность VSYYYGIDF (SEQ ID NO: 14);
(b) последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающий аминокислотную последовательность KASTDVTTAVA (SEQ ID NO: 15); (2) CDR-L2, включающий аминокислотную последовательность WASLRHT (SEQ ID NO: 16); и (3) CDR-L3, включающий аминокислотную последовательность QQHYGIPWT (SEQ ID NO: 17), и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающий аминокислотную последовательность FRFSNYGMS (SEQ ID NO: 18); (2) CDR-H2, включающий аминокислотную последовательность TISGGGSNAY (SEQ ID NO: 19); и (3) CDR-H3, включающий аминокислотную последовательность TSYYYGIDF (SEQ ID NO:20);
(c) последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающий аминокислотную последовательность KAKQDVTTAVA (SEQ ID NO:21); (2) CDR-L2, включающий аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающий аминокислотную последовательность QQHYWIPWT (SEQ ID NO:22), и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающий аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающий аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающий аминокислотную последовательность VSYYYGIDL (SEQ ID NO:23); или
(d) последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающий аминокислотную последовательность KASQDVTNAVA (SEQ ID NO:24); (2) CDR-L2, включающий аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающий аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11), и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающий аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающий аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающий аминокислотную последовательность SSYYYGIDL (SEQ ID NO:25).
2. Анти-PD-1 антитело его антигенсвязывающий фрагмент по п.1, включающие последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающий аминокислотную последовательность KASQDVTTAVA (SEQ ID NO:9); (2) CDR-L2, включающий аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающий аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11), и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающий аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающий аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающий аминокислотную последовательность VSYYYGIDF (SEQ ID NO: 14).
3. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по п. 1, включающие последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающий аминокислотную последовательность KASTDVTTAVA (SEQ ID NO: 15); (2) CDR-L2, включающий аминокислотную последовательность WASLRHT (SEQ ID NO: 16); и (3) CDR-L3, включающий аминокислотную последовательность QQHYGIPWT (SEQ ID NO: 17), и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающий аминокислотную последовательность FRFSNYGMS (SEQ ID NO: 18); (2) CDR-H2, включающий аминокислотную последовательность TISGGGSNAY (SEQ ID NO: 19); и (3) CDR-H3, включающий аминокислотную последовательность TSYYYGIDF (SEQ ID NO: 20).
4. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по п. 1, включающие последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающий аминокислотную последовательность KAKQDVTTAVA (SEQ ID NO: 21); (2) CDR-L2, включающий аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающий аминокислотную последовательность QQHYWIPWT (SEQ ID NO: 22), и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающий аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающий аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающий аминокислотную последовательность VSYYYGIDL (SEQ ID NO: 23).
5. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по п. 1, включающие последовательность вариабельного домена легкой цепи (VL), включающую (1) CDR-L1, включающий аминокислотную последовательность KASQDVTNAVA (SEQ ID NO: 24); (2) CDR-L2, включающий аминокислотную последовательность WASTRHT (SEQ ID NO: 10); и (3) CDR-L3, включающий аминокислотную последовательность QQHYTIPWT (SEQ ID NO: 11) и последовательность вариабельного домена тяжелой цепи (VH), включающую (1) CDR-H1, включающий аминокислотную последовательность FTFSNYGMS (SEQ ID NO: 12); (2) CDR-H2, включающий аминокислотную последовательность TISGGGSNIY (SEQ ID NO: 13); и (3) CDR-H3, включающий аминокислотную последовательность SSYYYGIDL (SEQ ID NO: 25).
6. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по п. 1 или 2, включающие последовательность тяжелой цепи, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 8, и последовательность легкой цепи, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 6.
7. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по п. 1 или 2, включающие последовательность тяжелой цепи, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 4, и последовательность легкой цепи, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 2.
8. Анти-PD-1 антитело по или его антигенсвязывающий фрагмент по пп. 1-7, где антитело содержит Fc последовательность IgG человека.
9. Анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8, отличающиеся тем, что антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, Fab', F(ab)'2, одноцепочечного Fv(scFv), фрагмента Fv, диатела и линейного антитела.
10. Иммуноконъюгат для лечения рака, содержащий анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9, конъюгированные с терапевтическим агентом.
11. Иммуноконъюгат для лечения рака, содержащий анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9, конъюгированные с меткой.
12. Иммуноконъюгат по п. 11, отличающийся тем, что метка выбрана из группы, состоящей из радиоизотопа, флуоресцентного красителя и фермента.
13. Выделенная молекула нуклеиновой кислоты, которая кодирует анти-PD-1 антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8.
14. Экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты по п. 13.
15. Клетка-хозяин для продуцирования антитела, включающая экспрессирующий вектор по п. 14.
16. Способ получения анти-PD-1 антитела или его антигенсвязывающего фрагмента, включающий культивирование клетки по п. 15 и выделение антитела или его антигенсвязывающего фрагмента из клеточной культуры.
17. Композиция для лечения рака, включающая эффективное количество анти-PD-1 антитела или его антигенсвязывающего фрагмента по любому из пп. 1-12 и фармацевтически приемлемый носитель.
18. Способ обнаружения белка PD-1 в образце из пациента путем контакта анти-PD-1 антитела или его антигенсвязывающего фрагмента по любому из пп. 1-12 с образцом и обнаружения анти-PD-1 антитела, связанного с белком PD-1.
19. Способ по п. 18, отличающийся тем, что анти-PD-1 антитело или его антигенсвязывающий фрагмент используют в иммуногистохимическом анализе (IHC) или в анализе ELISA.
20. Способ лечения рака у объекта, включающий введение объекту эффективного количества композиции по п. 17.
21. Способ по п. 20, отличающийся тем, что рак выбран из группы, состоящей из меланомы, NSCLC, рака головы и шеи, рака уротелия, тройного негативного рака молочной железы (TNBC), рака желудка, классической лимфомы Ходжкина (cHL), неходжкинской лимфомы первичной медиастинальной B-клеточной лимфомы (NHL PMBCL), мезотелиомы, рака яичника, рака легкого, рака пищевода, назофарингеальной карциномы (NPC), рака желчных путей, колоректального рака, рака молочной железы, рака шейки матки, рака щитовидной железы и рака слюнных желёз.
22. Способ по п. 21, отличающийся тем, что объекту дополнительно вводят терапевтический агент, выбранный из группы, состоящей из антинеопластического агента, химиотерапевтического агента, агента, ингибирующего рост, и цитотоксического агента.
23. Способ по п. 22, отличающийся тем, что объекту дополнительно проводят лучевую терапию.
24. Способ по п. 21, отличающийся тем, что объекту дополнительно вводят терапевтическое антитело против VEGF, VEGFR2 или EGFR.
| US 2013136735 A1, 30.05.2013 | |||
| WO 2010022737 A1, 04.03.2010 | |||
| US 2016159905 A1, 09.06.2016 | |||
| US 2016200815 A1, 14.07.2016 | |||
| БОГОЛЮБОВА А.В | |||
| и др | |||
| Иммунотерапия опухолей, основанная на блокировке иммунологических контрольных "точек" ("чекпойнтов"), Медицинская иммунология, 2015, Т.17, N 5, С | |||
| 395-406. |
Авторы
Даты
2021-08-09—Публикация
2017-09-09—Подача