Область техники
Настоящее изобретение относится к химико-фармацевтической промышленности и медицине, к области разработки противовоспалительных препаратов.
Предшествующий уровень техники
Острый респираторный дистресс-синдром является одним из видов дыхательной (легочной) недостаточности в результате большого числа разных заболеваний, которые вызывают накопление жидкости в легких и слишком сильное снижение уровня кислорода в крови.
Острый респираторный дистресс-синдром (ОРДС) является неотложным состоянием. Он может возникнуть у людей, уже страдающих заболеваниями легких, а также у людей с ранее здоровыми легкими. Любое заболевание или состояние, повреждающее легкие, может вызвать ОРДС. Более чем в половине случаев ОРДС развивается вследствие тяжелой, широко распространенной инфекции. Среди некоторых других причин:
- аспирация (вдыхание) кислого содержимого желудка в легкие;
- ожоги;
- некоторые осложнения при беременности;
- травма грудной клетки;
- операция аортокоронарного шунтирования;
- воспаление поджелудочной железы;
- попадание в дыхательные пути большого количества дыма;
- попадание в дыхательные пути другого токсичного газа;
- повреждение легких в результате попадания в дыхательные пути кислорода в высокой концентрации;
- угрожающие жизни или тяжелые травмы;
- передозировка определенными препаратами, например, героином, метадоном, пропоксифеном или аспирином;
- пневмония;
- переливание более 15 единиц крови за короткий период времени.
Без немедленного лечения для ОРДС характерна высокая летальность. Если лечение включает длительные периоды искусственной вентиляции легких (с использованием аппарата, помогающего воздуху попадать в легкие и выходить из них), то больные более склонны к развитию рубцовых изменений в легких. Такие рубцовые изменения могут уменьшиться в течение нескольких месяцев после отключения человека от аппарата искусственной вентиляции легких (ИВЛ). Если рубцовые изменения в легких обширны, они могут необратимо нарушить функцию легких таким образом, что это станет заметно во время определенных видов ежедневной деятельности. Менее обширные рубцовые изменения могут нарушать функцию легких только в периоды нагрузки на легкие, например, во время физических упражнений или болезни.
Пациенты с ОРДС проходят лечение в отделениях реанимации и интенсивной терапии (ОРИТ). Успех лечения обычно зависит от лечения основного заболевания (например, пневмонии). Также применяется оксигенотерапия, которая является жизненно важной для коррекции низкого уровня кислорода в крови.
На основании данных Кохрейновского анализа 48 исследований по 20 различным видам лекарств, в которых приняли участие 6299 человек с ОРДС до 2018 г, до настоящего времени не получено достаточно доказательств, чтобы уверенно определить, был ли какой-либо тип лекарств эффективен для снижения смертности у людей с ОРДС или сокращения времени, в течение которого им требовалась искусственная вентиляция легких [https://www.cochrane.org/CD004477/EMERG_drugs-treat-acute-respiratory-distress-syndrome-adults]. Для основных сравнений в этом анализе было включено пять типов лекарств: кортикостероиды, сурфактанты, N-ацетилцистеин, статины и бета-агонисты. Их сравнивали с плацебо или стандартным лечением.
Несмотря на прогресс в лечении острого респираторного дистресс- синдрома, сохраняется актуальная медицинская проблема, связанная с ограничениями имеющихся вариантов лекарственной терапии.
К настоящему моменту показано, что ряд транс-стильбенов обладает анти-воспалительным действиям. Так, ресвератрол (resveratrol), относящийся к транс-стильбенам, обладает выраженными противовоспалительными свойствами, ингибируя транслокацию в ядро транскрипционного фактора NF-κB и последующую экспрессию таких медиаторов воспаления, как TNF-α, IL-1β, IL-6, матриксных металлопротеиназ (MMPs).
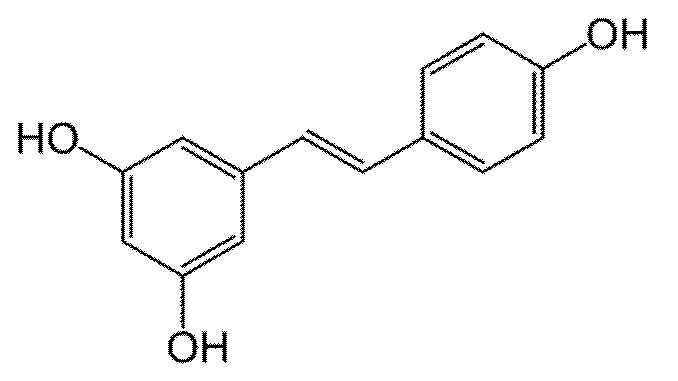
Кроме того, было показано, что ресвератрол, действуя через ряд внутриклеточных сигнальных каскадов, приводит к деградации IκBα, субъединицы транскрипционного фактора NF-κB, что приводит к подавлению воспалительного ответа [Meng T. et al. Anti-inflammatory action and mechanisms of resveratrol //Molecules. - 2021. - Т. 26. - №. 1. - С. 229].
Известно решение по патенту US 6414037B1, направленное на применение фармацевтической композиции, содержащей ресвератрол, для местной терапии воспалительных заболеваний кожи. Недостатком этого решения является местный способ применения, не позволяющий использовать этот способ для терапии ОРДС. Учитывая химическую нестабильность ресвератрола [Francioso A. et al. Chemistry, stability and bioavailability of resveratrol //Medicinal Chemistry. - 2014. - Т. 10. - №. 3. - С. 237-245], попадание его в системный кровоток через кожу невозможно.
Известно техническое решение по заявке WO № 9959561, описывающее препарат на основе ресвератрола и его производных. Применение данного препарата включает, но не ограничено, для терапии хронических воспалительных процессов - атеросклероза, артрита, болезни Альцгеймера, псориаза, гингивита и колита. Применения данного препарата включает терапию острого воспалительного процесса - сепсиса. Изобретение описывает способы введения пероральный в виде таблеток, капсул, растворы, суспензий, аэрозолей или трансдермальный в виде гелей или мазей. К недостаткам изобретения относится известная химическая нестабильность ресвератрола, а также его низкая биодоступность при пероральном применении [Francioso A. et al. Chemistry, stability and bioavailability of resveratrol //Medicinal Chemistry. - 2014. - Т. 10. - №. 3. - С. 237-245].
Транс-стильбен пайсатаннол (piceatannol), гидроксилированное производное ресвератрола, обладает выраженными анти-воспалительными свойствами.
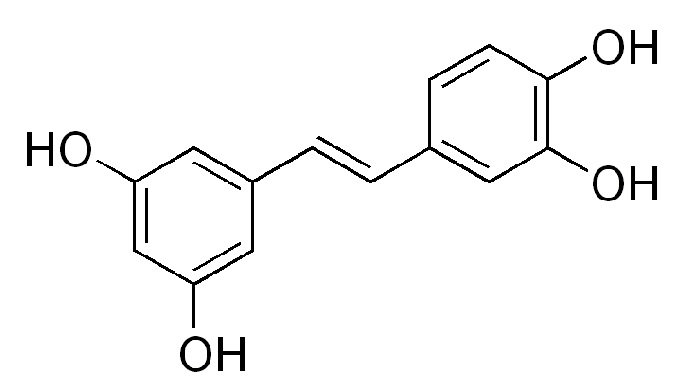
Пайсатаннол является ингибитором Syk - киназы, участвующей, в том числе, в проведении воспалительного сигнала, индуцированного молекулами собственной ткани, выделяемых при некротическом распаде ткани. Было показано, что Syk-киназа, ингибитором которой является пайсаттанол, значительно снижает воспалительный ответ на MERS-коронавирусную инфекцию, в том числе снижает секрецию цитокинов IL6 и TNFa, в регуляции секреции которых принимает участие Syk-киназа [Zhao X. et al. Activation of C-type lectin receptor and (RIG)-I-like receptors contributes to proinflammatory response in middle east respiratory syndrome coronavirus-infected macrophages //The Journal of infectious diseases. - 2020. - Т. 221. - №. 4. - С. 647-659]. Пайсатаннол эффективен для терапии ОРДС. На животной модели липополисахарид-индуцированного ОРДС было показано, что введение пайсатаннола уменьшает отек легких, уменьшает выраженность гистопатологических изменений, и продукцию провоспалительных цитокинов, в том числе путем ингибирования активации транскрипционного фактора NF-κB [Peng L. Y. et al. Protective effect of piceatannol against acute lung injury through protecting the integrity of air-blood barrier and modulating the TLR4/NF-κB signaling pathway activation //Frontiers in Pharmacology. - 2020. - Т. 10. - С. 1613].
Известен способ терапии воспалительных, аутоимунных заболеваний, а также способ терапии отторжения трансплантата, основанный на использовании пайсатаннола, патент US 7811996 B2. Недостатком данного подхода является низкая растворимость пайсатаннола в фармацевтически приемлемых растворителях, а также известная низкая химическая стабильность пайсатаннола [Gill M. T. et al. 3, 3', 5'-Tri-O-methylpiceatannol and 4, 3', 5'-tri-O-methylpiceatannol: improvements over piceatannol in bioactivity //Journal of natural products. - 1987. - Т. 50. - №. 1. - С. 36-40], что ограничивает применение пайсатаннола в качестве лекарственного средства.
Известен способ терапии воспалительных заболеваний, в том числе сепсиса, инсульта и ОРДС, патент US 2017/0143645 A1, заключающийся в использовании альбуминовых наночастиц диаметром от 90 до 110 нм, содержащих пайсатаннол. В соответствии с предложенным подходом, пайсатаннол растворяется в органических растворителях и, в дальнейшем, инкапсулируется в наночастицы, содержащие альбумин [AA Aljabali A. et al. Albumin nano-encapsulation of piceatannol enhances its anticancer potential in colon cancer via down regulation of nuclear p65 and HIF-1α //Cancers. - 2020. - Т. 12. - №. 1. - С. 113., Wang Z. et al. Prevention of vascular inflammation by nanoparticle targeting of adherent neutrophils //Nature nanotechnology. - 2014. - Т. 9. - №. 3. - С. 204-210], что реализуется в проекте NIH [https://grantome.com/grant/NIH/R42-HL126456-05]. Недостатком данного подхода является сложность стандартизации получаемого лекарственного препарата в виде наночастиц, а также известная низкая химическая стабильность пайсатаннола [Gill M. T. et al. 3, 3', 5'-Tri-O-methylpiceatannol and 4, 3', 5'-tri-O-methylpiceatannol: improvements over piceatannol in bioactivity //Journal of natural products. - 1987. - Т. 50. - №. 1. - С. 36-40], что ограничивает применение пайсатаннола в качестве лекарственного средства.
Задачей предлагаемого изобретения является создание фармацевтической композиции, содержащей в качестве действующего вещества соединение в виде химического производного пайсатаннола в количестве, необходимом и достаточном для терапии ОРДС и обладающее биодоступностью, стабильностью, применимостью в качестве лекарственного средства.
Поставленная задача решается за счет синтеза химически модифицированного пайсатаннола, а именно, тетразамещенного гликолевой кислотой пайсатаннола (ТГКП) - (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетата с молекулярной массой 476,09 г/моль.
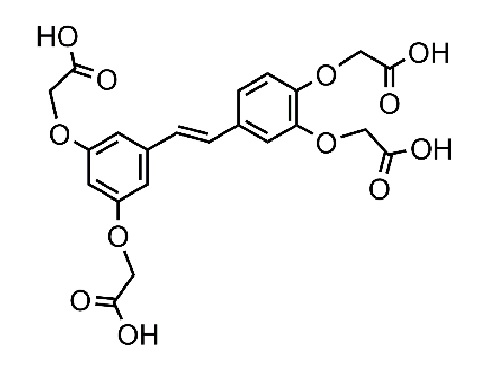
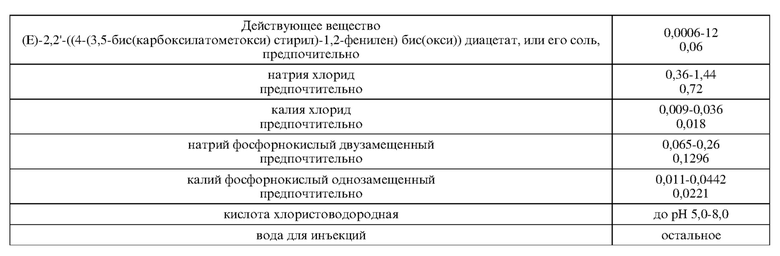
Создана фармацевтическая композиция, включающая действующее вещество в виде химического соединения тетразамещенного гликолевой кислотой пайсатаннола (ТГКП) в виде свободного основания или фармацевтически приемлемой солевой формы, а также фармацевтически приемлемые вспомогательные вещества. При этом солевые формы химического соединения представляют натриевую, или калиевую, или аммонийную или любую фармацевтически приемлемую соль. В качестве фармацевтически приемлемых вспомогательных веществ используют стабилизаторы, модификаторы, разбавители при следующих соотношениях компонентов, масс.%:
Созданная фармацевтическая композиция применяется для лечения системных воспалительных заболеваний и состояний, таких как острый респираторный дистресс-синдром.
Краткое описание фигур
На фигуре 1
представлена химическая структура тетразамещенного гликолевой кислотой пайсатаннола и его солей.
А. Химическая структура тетразамещенного гликолевой кислотой пайсатаннола (мол.масса 476.39).
Б. Химическая структура калиевой соли тетразамещенного гликолевой кислотой пайсатаннола (мол.масса 628.75).
В. Химическая структура натриевой соли тетразамещенного гликолевой кислотой пайсатаннола (мол.масса 564.32).
Г. Химическая структура аммонийной соли тетразамещенного гликолевой кислотой пайсатаннола (мол.масса 544.51).
На фигуре 2
представлена типичная хроматограмма анализа ТГКП методом ВЭЖХ.
А. Хроматограмма в стандартном масштабе.
Б. Увеличенный участок хроматограммы.
На фигуре 3
представлена типичная хроматограмма анализа натриевой соли ТГКП методом ВЭЖХ.
А. Хроматограмма в стандартном масштабе.
Б. Увеличенный участок хроматограммы.
На фигуре 4
представлены типичные масс-спектры ТГКП и его натриевой соли, полученные методом MALDI-масс-спектрометрии в режиме регистрации положительных ионов.
А. Типичный масс-спектр ТГКП, полученный методом MALDI-масс-спектрометрии в режиме регистрации положительных ионов.
Б. Типичный масс-спектр натриевой соли ТГКП, полученные методом MALDI-масс-спектрометрии в режиме регистрации положительных ионов
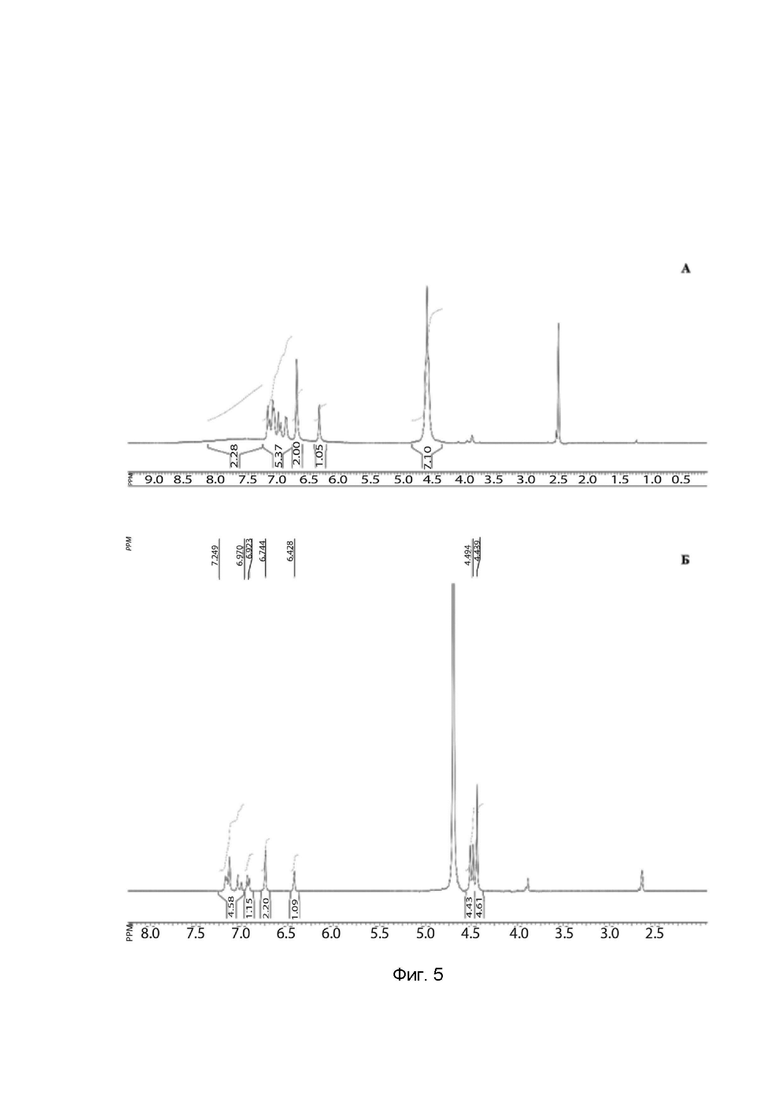
На фигуре 5
представлены типичные ЯМР 1Н спектры ТГКП и его натриевой соли.
А. Типичный ЯМР 1Н спектр ТГКП.
Б. Типичный ЯМР 1Н спектр натриевой соли ТГКП.
Пример 1.
Получение химического (действующего вещества).
Для получения действующего вещества заявляемой фармацевтической композиции осуществляют следующие действия.
На первой стадии в плоскодонную колбу, содержащую 1500 мл абсолютного ацетонитрила в атмосфере аргона, вносили 10,00 г пайсатаннола (0,04 моль), добавляли 33,17 г (0,24 моль) прокаленного карбоната калия и 29,49 г (0,24 моль) этилового эфира 2-хлоруксукной кислоты. Полученную реакционную смесь кипятили при интенсивном перемешивании в течение 8 дней. Контроль химической реакции осуществляли методом ВЭЖХ. По окончании 8 дней реакционную смесь отфильтровали и осадок промыли абсолютным ацетонитрилом, полученный фильтрат упарили. Далее целевое соединение выделяли колоночной хроматографией. В качестве сорбента для хроматографической колонки был выбран силикагель. Разделение производили градиентом за счет изменения состава подвижной фазы от 20% ацетонитрила в хлористом метилене до 50% ацетонитрила в хлористом метилене. Фракцию с целевым соединением - тетраэфиром пайсатаннола упарили. Химические превращения на первой стадии представлены на схеме 1.
Схема 1 - Химические превращения первой стадии

На второй стадии в плоскодонную колбу, снабженную магнитной мешалкой и содержащую 1000 мл этанола в атмосфере аргона, добавили 15,60 г (0,0265 моль) продукта первой стадии и охладили полученный раствор до +5°С. Отдельно готовят раствор лития гидроксила моногидрата путем растворения 1,76 г (0,0042 моль) в 50 мл воды. После чего к реакционной смеси медленно по каплям добавили раствор лития гидроксида моногидрата и проводили реакцию при перемешивании при +15°С в течении 30 минут, затем при +25°С в течение 48 часов. Контроль химической реакции осуществляли методом ВЭЖХ. После чего растворитель упарили досуха, добавили 100 мл воды и раствор 1 Н соляной кислоты до pH 7 и провели экстракцию этилацетатом трижды по 500 мл. После экстракции органический растворитель упарили досуха. В итоге получили 5 г тетразамещенного гликолевой кислотой пайсатаннола в виде бежевого кристаллического вещества. Подлинность подтвердили методами ядерно-магнитным резонансом и высоко эффективной жидкостной хроматографией с масс-спектрометрическим детектированием. Химические превращения на второй стадии отображены на схеме 2.
Схема 2 - Химические превращения второй стадии

На третьей стадии тетразамещенного гликолевой кислотой пайсатаннола (ТГКП) превращают натриевую соль и проводят формулирование в фармацевтическую композицию.
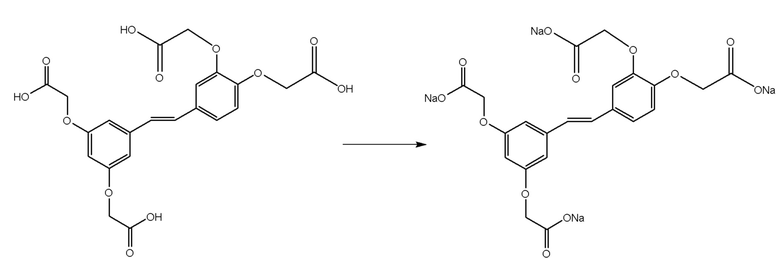
Навеску (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диуксусной кислоты, массой 4,76 г, по частям при интенсивном перемешивании переносят в стеклянный стакан емкостью 2 литра, содержащий 1000 мл воды очищенной. Интенсивное перемешивание обеспечивается магнитным перемешивающим устройством. Оставляют на перемешивание в течение 10 минут, наблюдают образование непрозрачной суспензии коричневого цвета. Затем добавляют при интенсивном перемешивании 40,0 мл 1 М раствора гидроксида натрия, и оставляют на мешалке на 30 минут. Наблюдают растворение непрозрачной коричневой суспензии кислоты и образование прозрачного раствора светло-желтого цвета (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетата, натриевой соли. Контролируют pH, реакция раствора должна быть слабокислой. Данная реакция идет нацело, поскольку происходит изменение агрегатного состояния реагента - из нерастворимого соединения в растворимое. Таким образом, получают натриевую соль ТГКП, или (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетат, натриевую соль, действующий компонент фармацевтической композиции. Химические превращения на третьей стадии отображены на схеме 3.
Схема 3 - Химические превращения третьей стадии
Пример 2.
Характеристика полученных соединений
Определены химические и физические свойства (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диуксусной кислоты и (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетата, натриевой соли.
E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диуксусная кислота (ТГКП) представляет из себя порошок, от светло-серого до светло-коричневого цвета, относится к веществам, очень мало растворимым в воде в соответствии с ОФС 1.2.1.0005.15, на масс-спектрометрическом спектре, полученном методом MALDI-масс-спектрометрии в режиме регистрации положительных ионов детектируется сигнал с соотношением массы к заряду m/z = 476, что соответствует брутто-формуле С22H20О12. ЯМР 1Н спектр не противоречит структуре (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диуксусной кислоты (ТГКП). Молекулярная масса соединения (моноизотопная) составляет 476.09 г/моль, молекулярный вес 476,39. По результатм исследований, обладает химической стабильностью не менее 1 года. По химическим свойствам вещество относится к органическим кислотам, вступает в реакцию нейтрализации с щелочами (гидроксид натрия, гидроксид калия, гидроксид аммония и другие) с образованием растворимых солей. Синтезированная субстанция обладает хроматографической чистотой не менее 98,0 масс%. Условия хранения - в защищенном от света месте, при температуре от 2 до 8 ºС. (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетат, натриевая соль (ТГКП, натриевая соль, действующий компонент фармацевтической композиции) представляет из себя порошок, от желтого до светло-желтого цвета, относится к веществам, растворимым в воде в соответствии с ОФС 1.2.1.0005.15. На масс-спектрометрическом спектре, полученном методом MALDI-масс-спектрометрии в режиме регистрации положительных ионов детектируется сигнал с соотношением массы к
заряду m/z = 564, что соответствует брутто-формуле C22H16Na4O12. ЯМР 1Н спектр не противоречит структуре (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетата, натриевой соли (ТГКП, натриевая соль). Молекулярная масса соединения составляет 564.02 г/моль. По результатам исследований, обладает химической стабильностью как в сухом виде, так и водных растворах не менее 1 года. По химическим свойствам вещество относится к солям органических кислот. Синтезированная субстанция обладает хроматографической чистотой не менее 98,0 масс%. Условия хранения - в защищенном от света месте, при температуре от 2 до 8 ºС.
Пример 3.
Получение фармацевтической композиции
Для получения фармацевтической композиции смешивают полученное действующее вещество, а именно, (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетат, натриевую соль соли (ТГКП, натриевая соль)) с раствором концентрированного десятикратного солевого буферного раствора и водой очищенной. После смешивания производят потенциометрическое измерение pH полученного раствора и при необходимости доводят pH раствора до значения 7.2. Для обеспечения стерильности и удаления видимых и невидимых механических включений формулированный раствор подвергают многостадийной стерилизующей фильтрации через фильтры с диаметром пор 0.2 мкм. После стерилизующей фильтрации препарат разливается во флаконы 10R из темного стелка 1-го гидролитического класса, в качестве укопорочного материала используются резиновые бромбутиловые пробки и колпачки flip-off. Флакон снабжается наклеиваемой этикеткой из писчей бумаги или этикеткой из самоклеящегося материала. Флаконы упаковывают в пачки из картона хром-эрзац. Пачки маркируют типографическим способом или снабжают наклеиваемой этикеткой.
Для приготовления фармацевтической композиции, в которой в качестве приемлемых вспомогательных веществ используют стабилизаторы, модификаторы, разбавители при следующих соотношениях компонентов, масс.%:

Пример 4
Оценка качества фармацевтической композиции.
Оценку качества фармацевтической композиции проводят согласно Государственной Фармакопеи Российской Федерации XIV издания. Контролируют следующие параметры:
описание, подлинность, количественное определение, родственные примеси, прозрачность, цветность, механические включения, pH, извлекаемый объем, стерильность и бактериальные эндотоксины.
Описание фармацевтической композиции оценивают визуально. Фармацевтическая композиция должна представлять собой однородный бесцветный или с желтоватым оттенком прозрачный раствор.
Количественное определение проводят методом высокоэффективной жидкостной хроматографией с применением диодно-матричного детектора по ОФС. 1.2.1.2.0005.15 ГФ РФ XIV. Разделение выполняют в следующих условиях.
Таблица 1. Хроматографические условия
Разделение проводят градиентным методом по следующей схеме.
Таблица 2. Схема проведения разделения
Перед каждой инжекцией хроматографическую колонку уравновешивают в течение 3 минут подвижной фазой А.
Процесс анализа для показателя «Количественное определение», «Подлинность», «Посторонние примеси» проводят по следующей схеме.
Таблица 3. Схема анализа показателя «Количественное определение»
Время удерживания натриевой соли ТГКП составляет 4.7 минут. Время регистрации хроматографии должно не менее чем в 2 раза превышать время удерживания пика натриевой соли ТГКП.
Во время анализа проводят проверку пригодности системы по следующим показателям:
1) эффективность хроматографической колонки, рассчитанная по пику натриевой соли ТГКП на хроматограмме РСО, не менее 10000 теоретических тарелок.
2) фактор асимметрии, рассчитанная по пику натриевой соли ТГКП на хроматограмме РСО, не менее 0.8 и не более 1.5.
3) Относительное стандартное отклонение времени удерживания и площади пика натриевой соли ТГКП на хроматограмме РСО не более 2.0%.
Расчет содержания натриевой соли ТГКПпроизводят по методу внешнего стандарта.
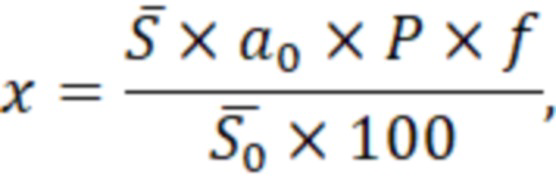
где - средняя площадь натриевой соли ТГКПна хроматограммах испытуемого образца;
- средняя площадь натриевой соли ТГКПна хроматограммах испытуемого образца;
 0 - средняя площадь натриевой соли ТГКПна хроматограммах раствора стандартного образца;
0 - средняя площадь натриевой соли ТГКПна хроматограммах раствора стандартного образца;
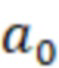 - масса навески, использованной для приготовления раствора стандартного образца;
- масса навески, использованной для приготовления раствора стандартного образца;
P - процентное содержание натриевой соли ТГКПна хроматограммах раствора стандартного образца.
 - фактор разведения исследуемого образца относительно раствора стандартного образца
- фактор разведения исследуемого образца относительно раствора стандартного образца 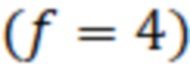 .
.
Содержание натриевой соли ТГКП в растворе должно быть в нормируемых пределах ± 5 %, например, от 0.57 до 0.63 мг/мл.
Подлинность определяют методом высокоэффективной жидкостной хроматографией с применением диодно-матричного детектора согласно описанию методики количественного определения. Для подтверждения подлинности должны выполняться следующие условия:
1) Время удерживания основного пика на хроматограмме испытуемого раствора не должно отличаться от времени удерживания основного пика на хроматограмме раствора стандартного образца более, чем на 2 %;
2) Спектр поглощения основного пика на хроматограммах испытуемого раствора в области длин волн от 210 до 400 нм должен иметь максимум при 324,1±2 нм.
Родственные примеси определяют методом высокоэффективной жидкостной хроматографией с применением диодно-матричного детектора согласно описанию методики количественного определения, с некоторыми изменениями. В данной методике используются дополнительные стандартные образцы - раствор сравнения и раствор для проверки чувствительности системы необходимые для расчета содержания примесей.
Процесс анализа на примеси проводят по следующей схеме.
Таблица 4. Схема проведения анализа на примеси
инжекций
Для анализа на родственные примеси хроматографическая система считается пригодной, если выполняются следующие условия:
• Относительное стандартное отклонение (RSD), времени удерживания натриевой соли ТГКП, рассчитанное по 6 повторным хроматограммам раствора сравнения, должно быть не более 2.0 %;
• Относительное стандартное отклонение (RSD), площади натриевой соли ТГКП, рассчитанное по 6 повторным хроматограммам раствора сравнения, должно быть не более 2.0 %;
• Фактор асимметрии (AS) пика натриевой соли ТГКП раствора сравнения должен быть не менее 0,8 и не более 1,5;
• Соотношение сигнал/шум для пика натриевой соли ТГКП на хроматограмме раствора для проверки чувствительности должен быть не меньше 10.
• На хроматограммах бланк-раствора отсутствуют интерферирующие пики в интервале элюирования натриевой соли ТГКП (RT = 4.7±0.2 минуты).
По хроматограммам испытуемого раствора и хроматограммам раствора сравнения производят расчет содержания для каждой примеси. В расчет не берутся примеси высота и площадь пиков, которых меньше 0,05% от площади основного пика на хроматограмме испытуемого образца.
Процент содержания 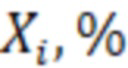 каждой примеси в испытуемом образце рассчитывают по следующей формуле:
каждой примеси в испытуемом образце рассчитывают по следующей формуле:

где 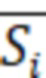 - средняя площадь индивидуальной примеси, на хроматограмме испытуемого образца.
- средняя площадь индивидуальной примеси, на хроматограмме испытуемого образца.
 - средняя площадь основного пика, на хроматограмме раствора сравнения.
- средняя площадь основного пика, на хроматограмме раствора сравнения.
 - средняя площадь основного пика, на хроматограмме раствора сравнения.
- средняя площадь основного пика, на хроматограмме раствора сравнения.
После расчета содержания индивидуальных примесей их суммируют математическим сложением для определения общего количества примесей.
Оценку прозрачности проводят согласно ОФС.1.2.1.0007.15 ГФ РФ XIV. Фармацевтическая композиция должен не отличаться по прозрачности от воды или выдерживать сравнение с эталоном I.
Оценку цветности проводят согласно ОФС.1.2.1.0006.15 ГФ РФ XIV. Цветность фармацевтической композиции не должна превышать эталон Y5.
Исследование видимых механических включений проводят согласно ОФС 1.4.2.0005.15 ГФ РФ XIV. Видимые механические включения должны отсутствовать. Исследование невидимых механических включений проводят счетно-фотометрическим методом согласно ОФС 1.4.2.0006.15 ГФ РФ XIV. В фармацевтической композиции среднее число невидимых частиц размером 10 мкм и более не должно превышать 6000 в 1 флаконе, а среднее число частиц размером 25 мкм не должно превышать 600 в 1 флаконе.
Фармацевтическую композицию исследуют на pH потенциометрическим методом согласно ОФС.1.2.1.0004.15 ГФ РФ XIV. Фармацевтическая композиция должен иметь pH от 6,8 до 7,6.
Испытание «Извлекаемый объем» проводят волюметрическим методом согласно ОФС.1.4.2.0003.15. Измеренный объем содержимого упаковки должен быть не менее номинального.
Стерильность фармацевтической композиции проводят методом прямого посева согласно ОФС.1.2.4.0003.15 ГФ РФ XIV. Фармацевтическая композиция должен быть стерильным.
Испытание на «Бактериальные эндотоксины» проводят гель-тромб тестом (метод А) согласно ОФС.1.2.4.0006.15 ГФ РФ XIV. В фармацевтической композиции бактериальных эндотоксином не должно быть более 40 ЕЭ/мг действующего вещества.
Пример 5.
Оценка стабильности фармацевтической композиции.
Фармацевтическая композиция в виде раствора для внутривенного введения, 0.6 мг/мл) обладает стабильностью при соблюдении условий хранения при +2…+8 °C в темном месте в течении как минимум двенадцати месяцев по результатам ежемесячных испытаний.
Пример 6.
Оценка безопасности фармацевтической композиции (острая токсичность).
Испытания безопасности по критерию «Острая токсичность» проводились в соответствии с Руководством по проведению доклинических исследований лекарственных средств (под ред. Миронова А.Н., М., ФГБУ «НЦЭМСП»- 2012 г., в 2-х томах).
Исследования безопасности фармацевтической композиции проводились в дозах 500 мг/кг, 1000 мг/кг, 2000 мг/кг (по действующему веществу, натриевой соли ТГКП) и плацебо при однократном внутривенном введении на половозрелых аутбредных мышах и крысах обоего пола. Фармацевтическую композицию исследовали в сравнении с физиологическим (изотоническим) раствором натрия хлорида 0,9% при в/в введении, которые вводили животным контрольных группы в эквивалентном объеме.
Все животные, в опытных и контрольной группах при внутривенном введении, выглядели здоровыми, активно поедали корм, адекватно реагировали на раздражители. Из-за отсутствия гибели животных расчёт летальных доз (ЛД10, ЛД16, ЛД50, ЛД84) оказался невозможен. Полученные данные представлены в таблицах ниже.
Таблица 5. Исследование токсичности с однократным приемом на мышах при внутривенном введении
(19 мл/кг, однократное введение)
0/6 ♀
(38 мл/кг, двукратное введение)
0/6 ♀
(76 мл/кг, четырехкратное введение)
0/6 ♀
(76 мл/кг, четырехкратное введение)
0/6 ♀
Таблица 7. Исследование токсичности с однократным приемом на крысах при внутривенном введении
(19 мл/кг, двукратное введение)
0/6 ♀
(38 мл/кг, четырехкратное введение)
0/6 ♀
(76 мл/кг, восьмикратное введение)
0/6 ♀
(76 мл/кг, восьмикратное введение)
0/6 ♀
При внутривенном введении исследуемой фармацевтической композиции в экспериментальных группах, как самок, так и самцов не было зафиксировано статистически значимой разницы в весе животных по сравнению с контрольной группой. Также во всех экспериментальных группах не было зафиксировано статистически значимой разницы в массе органов по сравнению с группой контрольных животных.
На основании отсутствия гибели животных, исследуемая фармацевтическая композиция была отнесена к 4 классу токсичности (малотоксичная) по «Классификации токсичности по Hodge и Sterner (1943)» при внутривенном введении. Определение переносимых и максимально переносимых доз, коэффициента видовой чувствительности в рамках данного исследования было невозможно, по причине отсутствия гибели животных и видимых негативных эффектов.
Влияния исследуемой фармацевтической композиции на динамику набора массы тела животных при внутривенном пути введения не выявлено.
Пример 7.
Оценка безопасности фармацевтической композиции (хроническая токсичность).
Испытания безопасности фармацевтической композиции по критерию «Хроническая токсичность» проводились в соответствии с Руководством по проведению доклинических исследований лекарственных средств (под ред. Миронова А.Н., М., ФГБУ «НЦЭМСП»- 2012 г., в 2-х томах).
В ходе исследования токсичности при многократном ежедневном введении препарата не было отмечено летальных исходов, связанных с исследуемым препаратом нежелательных клинических проявлений или каких-либо находок по органам / тканям / системам. Фармацевтическую композицию исследовали в сравнении с плацебо (физиологический (изотонический) раствор натрия хлорида 0,9%). Не наблюдалось связанных с применением исследуемого препарата эффектов на массу тела, изменения потребления пищи или какие-либо еще параметров.
В исследовании были использованы крысы SD и кролики породы Шиншилла.
Исследование проводили при внутрибрюшинном введении на половозрелых крысах SD в следующих дозах (по действующему веществу, натриевой соли ТГКП): 3 мг/кг, 7,5 мг/кг и 15 мг/кг, плацебо вводили в объеме 5 мл/200 г.
Исследование также проводили при внутривенном введении на половозрелых кроликах породы Шиншилла в следующих дозах: 1,2 мг/кг, 2,4 мг/кг и 4,8 мг/кг, плацебо вводили в объеме 20 мл/200 г.
При ежедневном внутрибрюшинном применении исследуемого препарата в течение 28 дней у крыс и кроликов во всех исследуемых дозах фармацевтическая композиция не вызывала изменений в общем состоянии и поведении животных. В ходе эксперимента не было отмечено изменений со стороны вегетативных реакций. Фармацевтическая композиция не влияет на состояние шерстного покрова, не вызывает изменений глаз, не влияет на состояние слизистых носа и ротовой полости. На протяжении всего эксперимента не наблюдалось влияния исследуемой фармацевтической композиции на аппетит и на характер стула, на характер дыхания, не отмечено изменений в двигательной активности и контактности животных.
Статистический анализ массы тела крыс и кроликов не выявил статистически достоверного влияния исследуемой фармацевтической композиции на темп прироста массы тела самцов и самок крыс и кроликов по сравнению с контрольной группой.
Данные миелограммы свидетельствуют о недозозависимом изменении процента клеток эритроцитарного и лейкоцитарного ростка костного мозга аутбредных крыс обоего пола на сроке 29 и 43 сутки исследования. Изменения находились в рамках нормы, что свидетельствует об отсутствии негативного влияния исследуемой фармацевтической композиции. Статистический анализ миелограммы кроликов не выявил достоверных различий между опытными и контрольной группами.
Результаты статистической обработки данных гематологического анализа крыс выявили не-дозозависимое статистически значимое влияние фармацевтической композиции на лейкоцитарную формулу самцов и самок после 28-дневного введения препарата на 29 сутки исследования.
Анализ гематологических показателей после восстановительного периода на 43 сутки исследования показал компенсаторное повышение процента лимфоцитов и снижение процента средних клеток; также было отмечено изменение параметров и числа эритроцитов и тромбоцитов у самцов экспериментальных групп по сравнению с контролем, однако изменения укладывались в рамки физиологической нормы. Отмеченные изменения связаны с фармакологическим действием исследуемого фармацевтической композиции.
Результаты статистической обработки данных гематологического анализа кроликов выявили недозозависимое статистически значимое влияние фармацевтической композиции на лейкоцитарную формулу самцов и самок после 28-дневного введения фармацевтической композиции на 29 сутки в сторону снижения процента лимфоцитов и увеличения процента гранулоцитов.
Анализ гематологических показателей после восстановительного периода на 43 сутки показал компенсаторное повышение процента лимфоцитов у самцов, получавших исследуемую фармацевтическую композицию в высокой дозе. Колебания остальных гематологических параметров оставались в рамках физиологической нормы. Отмеченные изменения, связаны с фармакологическим действием исследуемого фармацевтической композиции.
Обработка результатов коагулометрического анализа выявила, что фармацевтическая композиция статистически значимо влияет на свертывающую систему крови на 29 сутки с дозозависимым увеличением протромбинового времени у самцов крыс и кроликов и дозозависимым увеличением уровня фибриногена у самок крыс и кроликов, снижением тромбинового времени у самок крыс по сравнению с контрольной группой. После восстановительного периода на 43 сутки значения параметров гемостаза вернулись к норме. Отмеченные изменения, вероятно, связаны с фармакологическим действием исследуемого препарата. Несмотря на то, что в ходе изучения хронической токсичности были зафиксированы статистически значимые отклонения показателей гемостаза опытных групп от контрольной, все отклонения не превышали 5-25%, были обратимыми, находились в пределах физиологической нормы для данного вида животных, и негативного влияния на состояние здоровья подопытных животных не оказали.
Анализ биохимических показателей на 29 и 43 сутки исследования не выявил статистически достоверного влияния исследуемой фармацевтической композиции на белковую, углеводную и ферментативную функции печени. Биохимические показатели самцов и самок крыс и кроликов статистически значимо не отличались от контрольной группы.
Результаты проведения анализа мочи на 28 и 42 сутки экспериментальных животных не выявило статистически значимого влияния фармацевтической композиции на состояние мочевыделительной системы крыс и кроликов.
Статистический анализ показателей сердечно-сосудистой системы на 28 и 42 сутки не выявил достоверных различий между контрольными и опытными группами крыс и кроликов.
Анализ результатов проведения поведенческих тестов на 28 и 42 сутки не показал статистически достоверного влияния исследуемой фармацевтической композиции на двигательную и познавательную активности экспериментальных крыс.
Некропсия, проведенная на 29 и 43 сутки эксперимента, не выявила отклонений в строении тела и структуре внутренних органов у крыс и кроликов опытных групп в сравнении с контрольной группой. Подтверждено отсутствие у исследуемой фармацевтической композиции влияния на массу органов экспериментальных животных.
При сравнительном анализе внутренних органов крыс и кроликов экспериментальных групп на 29 и 43 сутки патоморфологических изменений не выявлено, признаков цитотоксического действия исследуемой фармацевтической композиции - не обнаружено.
Гистологическое строение изучаемых образцов внутренних органов крыс и кроликов соответствует норме - гистоархитектонике внутренних органов подгрупп на 29 и 43 сутки контрольной группе (плацебо).
Подтверждено отсутствие местно-раздражающего действия при ежедневном внутрибрюшинном введении крысам, внутривенном введении кроликам в течение 28 дней.
Таким образом, результаты настоящего доклинического исследования свидетельствуют о безопасности исследуемой фармацевтической композиции для терапии острого респираторного дистресс-синдрома при ежедневном введении аутбредным крысам и кроликам породы Шиншилла обоего пола в течение 28 дней с периодом восстановления 14 суток.
Пример 8.
Оценка безопасности фармацевтической композиции (иммунотоксичность).
Испытания безопасности фармацевтической композиции по критерию «Иммунотоксичность» проводились в соответствии с «Руководством по проведению доклинических исследований лекарственных средств», под ред. Миронова А.Н., М., ФГБУ «НЦЭМСП»- 2012 г., в 2-х томах, том 1, стр. 64-79 ).
Исследования иммунотоксических свойств фармацевтической композиции проводились у мышей F1 (CBAxC57Bl/6), линий CBA и C57Bl/6 при внутрибрюшинном пути введения, как наиболее близком к клиническому пути введения (внутривенном).
Исследуемую фармацевтическую композицию вводили мышам ежедневно в течение 14 суток в двух объемах: 0,1 и 1 мл на 20 г животного. Животным групп контроля вводили плацебо (физиологический (изотонический) раствор натрия хлорида 0,9%) в объеме 1 мл на 20 г животного.
Исследования иммунотоксичности исследуемой фармацевтической композиции у мышей при внутрибрюшинном ежедневном введении в течение двух недель показали, что введение мышам-самцам F1 (CBAxC57BI/6) фармацевтической композиции в дозах 3 мг/кг и 30 мг/кг (по действующему веществу, натриевой соли ТГКП) не оказывает влияния:
• на клеточный иммунный ответ, обнаруживаемый в реакции гиперчувствительности замедленного типа;
• на фагоцитарную активность их перитонеальных макрофагов;
Однако, введение фармацевтической композиции мышам-самцам F1 (CBAxC57BI/6) в дозах 3 мг/кг и 30 мг/кг (по действующему веществу, натриевой соли ТГКП) по сравнению с показателями группы животных, получавших плацебо влияет на массу тимуса и массу их тела.
Более того, введение фармацевтической композиции мышам-самцам F1 (CBAxC57BI/6) в дозах 3 мг/кг и 30 мг/кг (по действующему веществу, натриевой соли ТГКП) по сравнению с показателями группы животных, получавших плацебо, вызывает:
• снижение общего количества лейкоцитов, лимфоцитов, и процентного содержания лимфоцитов;
• повышение процентного содержания смеси моноцитов, эозинофилов, базофилов, незрелых клеток, и процентного содержания гранулоцитов в тимусе;
• снижение процентного содержания смеси моноцитов, эозинофилов, базофилов, незрелых клеток и повышение процентного содержания гранулоцитов в селезенке;
• снижение общего количества лейкоцитов, лимфоцитов, и увеличение процентного содержания гранулоцитов в костном мозге;
• снижение процентного содержания гранулоцитов в лимфатических узлах;
• снижение общего количества лейкоцитов, лимфоцитов, смеси моноцитов, эозинофилов, базофилов, незрелых клеток в селезенке;
• гуморальный иммунный ответ на Т-зависимый антиген (эритроциты барана), оцениваемый в реакции гемагглютинации у мышей линий СВА и C57BI/6. Обоснованием статистических различий между высокой дозой исследуемого препарата (30 мг/кг) и группой контроля и отсутствием различий между низкой дозой исследуемого препарата (3 мг/кг) и группой контроля скорее всего является механизм супрессии чрезмерным количеством антигена или же механизм супрессии комплексом антитело-антиген.
Пример 9.
Оценка безопасности фармацевтической композиции (аллергизирующие свойства).
Испытания безопасности созданной фармацевтической композиции по критерию «Аллергизирующие свойства» проводились в соответствии с «Руководством по проведению доклинических исследований лекарственных средств», под ред. Миронова А.Н., М., ФГБУ «НЦЭМСП»- 2012 г., в 2-х томах, том 1, стр. 51-63.
Аллергизирующие свойства фармацевтической композиции исследовали на морских свинках (исследования общей анафилаксии и конъюктивальной пробы), на аутбредных (беспородных) мышах (исследование активной кожной анафилаксии), на мышах линии CBA (реакция гиперчувствительности замедленного типа и реакция воспаления на конканавалин А). Для постановки непрямой реакции дегрануляции тучных клеток использовали аутбредных крыс.
При постановке реакции общей анафилаксии на морских свинках альбиносах, у исследуемой фармацевтической композиции, в сравнении с плацебо и положительным контролем (овальбумин), не было обнаружено анафилактогенных свойств. Полученные в результате постановки реакции активной кожной анафилаксии данные указывают на отсутствие гиперчувствительности немедленного типа у мышей в данной модели.
При постановке реакции гиперчувствительности замедленного типа у мышей линии CBA не было выявлено статистически значимых различий при сравнении индекса реакции между исследуемыми группами.
Постановка теста «Конъюнктивальная проба» на морских свинках показала отсутствие реакции через 15 мин. (быстрая реакция) и через 48 ч (замедленного типа).
При постановке реакции непрямой реакции дегрануляции тучных клеток позволило сделать вывод, что при ежедневном в/б введении морским свинкам альбиносам фармацевтической композиции в данной дозе (10 мг/кг/5 мл на 300 г животного, доза указана по действующему веществу, натриевой соли ТГКП) в течение 14 суток, исследуемая фармацевтическая композиция обладает аллергизирующим действием (при постановке пробы с исходным исследуемым препаратом средний ПДТК составил 1,18).
При постановке реакции воспаления на конканавалин А у мышей линии CBA не было выявлено статистически значимых различий при сравнении индекса реакции между исследуемыми группами.
Пример 10.
Оценка безопасности фармацевтической композиции (репродуктивная токсичность).
Испытания безопасности по критерию «Репродуктивная токсичность» проводились в соответствии с «Руководством по проведению доклинических исследований лекарственных средств», под ред. Миронова А.Н., М., ФГБУ «НЦЭМСП»- 2012 г., в 2-х томах, том 1, стр. 80-93.
Исследование проводили на половозрелых аутбредных крысах обоего пола в следующих дозах при внутривенном введении: 3 мг/кг и 15 мг/кг (по действующему веществу, натриевой соли ТГКП).
1. При изучении репродуктивной функции самок исследуемая лекарственная композиция вводили половозрелым виргинным самкам ежедневно в течение 15-ти дней (3 эстральных цикла). Введение исследуемой фармацевтической композиции не приводит к уменьшению фертильности. Процент гибели эмбрионов на всех стадиях развития у самок, получавших исследуемую фармацевтическую композицию, не отличался от контрольных значений. Достоверных различий с контролем в массе и размерах плодов также не выявлено (p>0,05, критерий Краскела-Уоллиса). Количество резорбций статистически не отличалось от контрольных значений.
При макроскопическом и гистологическом исследовании яичников самок, получавших исследуемую фармацевтической композиции в течение 15 дней до спаривания, никаких признаков патологических изменений не выявлено. Яичники крыс всех групп темно-красного цвета, с неровной поверхностью, умеренно плотные. В корковом веществе яичников самок видны фолликулы разной величины и степени созревания. Фолликулярный эпителий не изменен, ядра светлые, четкие, мозговое вещество яичников полнокровное.
В опытных группах роды прошли нормально у всех беременных самок. Интегральные и специфические показатели постнатального развития крысят от опытных крыс-самок не отличались статистически значимым образом от контрольных значений (p>0,05, критерий Краскела-Уоллиса). Продолжительность беременности у опытных самок находилась на уровне контроля и физиологической нормы для данного вида животных. Течение родов было без особенностей. Все крысята родились жизнеспособными, гибели крысят в первый месяц жизни не было зафиксировано. Физическое развитие потомства протекало без каких-либо отклонений от нормы.
2. При исследовании репродуктивной функции самцов крыс исследуемой фармацевтической композиции вводили животным ежедневно в течение 49-и дней (период сперматогенеза).
При макроскопическом и гистологическом исследовании репродуктивных органов (семенников, придатков семенника, семенных пузырьков и предстательной железы) самцов, получавших внутривенные инъекции исследуемой фармацевтической композиции в дозах 3 и 15 мг/кг (по действующему веществу, натриевой соли ТГКП), никаких патологических изменений не выявлено. У животных всех групп семенники без изменений, овальной формы, бледно-серого цвета, выраженность кровеносных сосудов - умеренная, хорошо выражено дольчатое строение. Паренхима представлена извитыми семенными канальцами, стенка которых включает клетки сперматогенного эпителия на разных стадиях дифференцировки (сперматогенеза), клетки Сертоли, а также миоидные клетки.
Статистически значимых различий в индексе сперматогенеза и показателях функционального состояния сперматозоидов для групп самцов, которым вводили исследуемую фармацевтическую композицию в дозах 3 и 15 мг/кг, и контрольной группы также не обнаружено.
Также показано, что введение фармацевтической композиции самцам крыс как в дозе 3 мг/кг, так и в дозе 15 мг/кг, ежедневно в течение 49 дней не оказывает токсического действия на эмбрионы, развивающиеся у оплодотворенных ими самок, и на развитие их потомства.
3. В рамках доклинического изучения эмбрио- и фетотоксического действия исследуемой фармацевтической композиции у крыс, регистрируемого в антенатальном и постнатальном периодах развития потомства, подтверждено, что внутривенные инъекции фармацевтической композиции в дозах 3 и 15 мг/кг (по действующему веществу, натриевой соли ТГКП) беременным самкам крыс ежедневно с 1 по 15-й день беременности не оказывают эмбриотоксического и тератогенного действия.
Результаты проведенных исследований на крысах показывают, что иссследуемая фармацевтическая композиция для терапии острого респираторного дистресс-синдрома не обладает токсичностью в отношении органов и функции репродуктивной системы аутбредных крыс обоего пола.
Пример 11.
Оценка безопасности фармацевтической композиции (генетическая токсичность и мутагенность).
Испытания безопасности фармацевтической композиции по критерию «Генетическая токсичность и мутагенность» проводились в соответствии с Руководством по проведению доклинических исследований лекарственных средств (под ред. Миронова А.Н., М., ФГБУ «НЦЭМСП»- 2012 г., в 2-х томах, том 1, стр. 94 -113).
Изучение мутагенных свойств фармацевтической композиции в чашечном тесте Эймса было проведено с использованием тестерных штаммов Salmonella typhimurium ТА97, ТА98, ТА100. О наличии мутагенного действия препарата судили по возрастанию частоты реверсий к прототрофности по гистидину у индикаторных штаммов.
Выявление и количественную оценку потенциальной цитогенетической активности, исследуемой фармацевтической композиции проводили в полихроматофильных эритроцитах костного мозга при однократном и многократном введениях мышам линии (CBAxC57BL/6) F1 в дозах 1,5 и 15 мг/кг. В качестве положительного контроля вводили Циклофосфамид в дозе 20 мг/кг, в качестве отрицательного контроля - физиологический раствор.
Проверка возможной мутагенной активности исследуемой фармацевтической композиции с использованием теста Эймса и цитогенетической активности, исследуемой готовой лекарственной формы в полихроматофильных эритроцитах костного мозга при однократном и многократном введениях мышам, показала, что исследуемая фармацевтическая композиция мутагенной активностью не обладает.
Таким образом, на основании результатов доклинических исследований эффективности и результатов токсикологических исследований было установлено, что исследуемая фармацевтическая композиция является нетоксичной.
Пример 12.
Исследование противовоспалительного действия фармацевтической композиции на культурах клеток.
В экспериментах, направленных на изучение противовоспалительного действия фармацевтической композиции для терапии ОРДС на клеточной модели было изучено изменение уровня секреции двух белков-медиаторов воспаления, а именно, интерлейкина 6 и интерлейкина 8, в ответ на добавление препарата или плацебо к первичной культуре эндотелиальных клеток человека, предварительно простимулированных бактериальным липополисахаридом (эндотоксином). В качестве тест-системы использовалась первичная культура клеток эндотелия человека - коммерчески доступные клетки HCAEC, поставщик Cell Applications, США, кат. номер 300-05а. Активация эндотелиальных клеток различными стимулами (фрагментами бактерий, вирусов, молекулами, высвобождаемыми из некротизированной ткани) является ключевым патогенетическим звеном ОРДС, а клетки HCAEC используется для моделирования ОРДС in vitro [Qian Y. et al. Direct activation of endothelial cells by SARS-CoV-2 nucleocapsid protein is blocked by Simvastatin //Journal of Virology. - 2021. - Т. 95. - №. 23. - С. e01396-21.]. В качестве стимула использовался бактериальный липополисахарид (ЛПС).
Исследование включало в себя следующие операции: подготовку культуры клеток, подготовку бактериального липополисахарида, подготовку препаратов, добавление к культуре клеток бактериального липополисахарида, и добавление к культуре клеток фармацевтической композиции или плацебо. После инкубации в течение 24 часов, супернатанты были отобраны и использованы для измерения концентрации двух медиаторов воспаления: интерлейкина 6 и интерлейкина 8 методом иммуноферментного анализа (ИФА). С тем, чтобы определить степень жизнеспособности клеток, после отбора супернатантов был проведен МТТ тест. В асептических условиях (в лабораторном ламинаре) с использованием в качестве разбавителя культуральной среды, готовили методом последовательных 4-х кратных разведений препарат в концентрации 1000 микромолей (мкМ), 250 мкМ, 63 мкМ, 16 мкМ и 4 мкМ (по действующему веществу, натриевой соли ТГКП). По 20 мкл приготовленных препаратов добавляли к лункам культурального планшета, содержащего клетки в 170 мкл культуральной среды и 10 мкл добавленного раствора бактериального эндотоксина. Таким образом, финальная концентрация препарата в лунках составляла 100 мкМ, 25 мкМ, 6,3 мкМ, 1,6 мкМ, 0,4 мкМ и 0 мкМ (плацебо), по действующему компоненту, натриевой соли ТГКП. После 24 часов инкубации, супентанты были отобраны, и концентрация IL6 и IL8 (после разбавления) была определена с помощью метода ИФА, в соответствии с инструкцией к коммерчески доступным наборам.
В результате эксперимента была показана концентрационно зависимая, статистически значимая способность исследуемой фармацевтической композиции подавлять уровень продукции эндотелиальными клетками двух ключевых медиаторов воспаления, интерлейкина 6 и интерлейкина 8. Цитотоксического эффекта в данном исследовании зафиксировано не было.
С целью изучение молекулярных механизмов, опосредующих терапевтическое действие фармацевтической композиции, было проведено исследование с использованием современных молекулярных методов. В рамках данного исследования на клеточной модели были определены гены, для которых экспрессия отличается в группе терапии исследуемой фармацевтической композиции от их экспрессии в группе плацебо. Работа предполагала изучение транскриптома методом секвенирования следующего поколения, Next Gene Sequencing, NGS, и количественную оценку дифференциально-экспрессированных генов в группе терапии препаратом по сравнению с группой плацебо на модели индуцированного гипервоспаления. Используя первичную культуру эндотелиальных клеток человека, предварительно простимулированных бактериальным липополисахаридом (эндотоксином), было показано, что терапия исследуемой фармацевтической композицией статистически значимо подавляет экспрессию различных медиаторов воспалительного ответа:
- провоспалительных цитокинов (IL6 - интерлейкин 6, IL32 - интерлейкин 32);
- рецепторов провоспалительных цитокинов (TNFRSF9 - рецептор семейства TNF (факторов некроза опухолей) 9; TNFSF15 - рецептор семейства TNF (факторов некроза опухолей) 16);
- хемокинов (CCL2- синоним MCP1; CXCL8 - интерлейкин 8, CXCL1 - хемокин CXCL1, синоним GRO alpha; CCL20 - хемокин CCL20, синоним MIP-3 alpha; CXCL2 - хемокин CXCL2, синоним MIP-2 alpha; CXCL3 - хемокин CXCL3, синоним GRO3);
- молекул эндотелиально-лейкоцитарной клеточной адгезии (SELE - Е - селектин; ICAM1; VCAM1);
- матриксных металлопротеаз (MMP10 - матриксная металлопротеаза 10; ADAMTSL1 - дезитегрин и металлопротеаза с тромбоспондиновым мотивом);
- гена RELB, субъединицы NF-kB, основного транскрипционного фактора, регулирующего экспрессию пула провоспалительных факторов;
- гена STAT5A (signal transducer and activator of transcription 5A) - основного медиатора, реализующего SYK-зависимую STAT5A-опосредованную активность, белка, регулирующего активность Syk-киназы.
В последующих экспериментах была оценена способность исследуемой фармацевтической композицией влиять на уровень фосфорилирования NF-kB, ключевого транскрипционного фактора, опосредующего воспалительный ответ, и Syk киназы, одной из ключевых киназ, участвующих в биохимическом каскаде проведения воспалительного сигнала. Фосфорилирование указанных молекул означает придает им функциональную активность. Работа предполагала изучение степени фосфорилирования NF-kB и Syk киназы в группе терапии препаратом по сравнению с группой плацебо на клеточной модели индуцированного гипервоспаления, с использованием метода вестерн-блота. В соответствии с полученными данными, препарат уменьшает степень фосфорилирования (а, следовательно, и функциональную активность) транскрипционного фактора NF-kB и Syk-киназы, что соответствует литературным данным, свидетельствующим об ингибирующей активности пайсатаннола в отношении данных молекулярных регуляторов воспаления.
Пример 13.
Исследование терапевтической активности
фармацевтической композиции на животных моделях.
Исследование терапевтической активности фармацевтической композиции проводили на модели ОРДС in vivo, в которой гипервоспалительный ответ был индуцирован введением бактериального эндотоксина (липополисахарида). Была изучена терапевтическая активность тестируемой фармацевтической композиции (препарата) по сравнению с плацебо, оценено влияние препарата на продукцию медиаторов воспаления и на морфологические признаки воспаления, фиксируемые гистологически. Модель ОРДС, вызванной введением бактериального липополисахарида на мышах, общепринята, хорошо изучена, и широко используется в исследованиях терапевтической активности [Kim S. M. et al. Methyl p-hydroxycinnamate exerts anti-inflammatory effects in mouse models of lipopolysaccharide-induced ARDS //Molecular Medicine Reports. - 2022. - Т. 25. - №. 1. - С. 1-9; Zhang P. et al. PCTR1 improves pulmonary edema fluid clearance through activating the sodium channel and lymphatic drainage in lipopolysaccharide‐induced ARDS //Journal of cellular physiology. - 2020. - Т. 235. - №. 12. - С. 9510-9523; Xiao M. et al. Emodin ameliorates LPS-induced acute lung injury, involving the inactivation of NF-κB in mice //International journal of molecular sciences. - 2014. - Т. 15. - №. 11. - С. 19355-19368; Peng J. et al. Punicalagin ameliorates lipopolysaccharide-induced acute respiratory distress syndrome in mice //Inflammation. - 2015. - Т. 38. - С. 493-499].
Через час после моделирования ОРДС, начинали проводить терапию. Терапия состояла во внутрибрюшинном введении плацебо или фармацевтической композиции в различных дозировках: 0,5, 1,5, 4, 6 мг/кг (по действующему веществу, натриевой соли ТГКП). Терапию проводили трижды в сутки (временной интервал между введениями шесть часов) на протяжение трех суток. Продукция медиаторов воспаления IL6 и КС (гомолог интерлейкина 8, отсутствующего у мышей) была определена в гомогенатах легких методом иммуноферментного анализа. Полученные результаты представлены в таблицах ниже.
Измеренные концентрации медиаторов воспаления (KC и IL-6), характеризующие их уровень продукции, представлен в таблицах ниже.
Таблица 8. Уровень продукции KC в легких подопытных животных (модель ОРДС, индуцированная эндотоксинемией)
Таблица 9. Уровень продукции IL-6 в легких подопытных животных (модель ОРДС, индуцируемая эндотоксинемией)
В соответствии с полученными экспериментальными данными, применение фармацевтической композиции по сравнению с плацебо, дозозависимо и статистически значимо подавляет продукцию провоспалительных медиаторов, интерлейкина 6 и KC в тканях легких.
Для количественной оценки использовали распространенную шкалу для гистологической оценки моделей ОРДС [Matute-Bello G. et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals //American journal of respiratory cell and molecular biology. - 2011. - Т. 44. - №. 5. - С. 725-738]. Поскольку у мышей не образуются гиалиновые мембраны при остром респираторном дистресс-синдроме, этот показатель был исключен из шкалы.
Количественная оценка морфологических изменений (количества нейтрофилов в альвеолярном пространстве, инфильтация нейтрофилов в легочный интерстиций, наличие белкового дебриса в альвеолах, утолщение стенок альвеол) показало дозозависимое статистически значимое уменьшение морфологических воспалительных признаков при терапии препаратом по сравнению с терапией плацебо. Полученные результаты представлены в таблице ниже.
Таблица 10. Суммарная таблица гистологической оценки (скоринга) для модели ОРДС, индуцированного эндотоксинемией
Таблица 11. Уровень продукции KC в легких подопытных животных на модели ОРДС, индуцированного интратрахеальным введением Pseudomonas aeruginosa
Таблица 12. Уровень продукции IL-6 в легких подопытных животных на модели ОРДС, индуцированного интратрахеальным введением Pseudomonas aeruginosa
На модели in vivo, в которой ОРДС был смоделирован интратрахеальным введением синегнойной палочки, была изучена терапевтическая активность тестируемого препарата по сравнению с плацебо, оценено влияние препарата на продукцию медиаторов воспаления и на морфологические признаки воспаления, фиксируемые гистологически. Модель ОРДС, вызванная интратрахеальным введением синегнойной палочки, Pseudomonas aeruginosa введением бактериального липополисахарида на мышах, является общепринятой и хорошо изученной, и широко используется в исследованиях терапевтической активности [Kumar V. S. et al. Pseudomonas aeruginosa induced lung injury model //Journal of visualized experiments: JoVE. - 2014. - №. 92; Lee C. C. et al. Effects of ibuprofen on a pig Pseudomonas ARDS model //Journal of Surgical Research. - 1986. - Т. 40. - №. 5. - С. 438-444]. Через час после моделирования ОРДС, начинали проводить терапию. Терапия состояла во внутрибрюшинном введении плацебо или лекарственного препарата в дозировке 1,5 мг/кг. Терапию проводили трижды в сутки (временной интервал между введениями шесть часов) на протяжение трех суток. Продукция медиаторов воспаления IL6 и КС (гомолог интерлейкина 8, отсутствующего у мышей) была определена в гомогенатах легких методом иммуноферментного анализа.
Для количественной оценки использовали наиболее распространенную шкалу для гистологической оценки моделей ОРДС [Matute-Bello G. et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals //American journal of respiratory cell and molecular biology. - 2011. - Т. 44. - №. 5. - С. 725-738]. Поскольку у мышей не образуются гиалиновые мембраны при остром респираторном дистресс-синдроме, этот показатель был исключен из шкалы. Полученные экспериментальные данные представлены в таблице ниже.
Таблица 13. Суммарная таблица гистологической оценки (скоринга) для модели ОРДС, индуцированного интратрахеальным введением Pseudomonas aeruginosa
В соответствии с полученными экспериментальными данными, применение фармацевтической композиции по сравнению с плацебо статистически значимо подавляет продукцию провоспалительных медиаторов, интерлейкина 6 и KC в тканях легких. Количественная оценка морфологических изменений (количества нейтрофилов в альвеолярном пространстве, инфильтация нейтрофилов в легочный интерстиций, наличие белкового дебриса в альвеолах, утолщение стенок альвеол) показало статистически значимое уменьшение морфологических воспалительных признаков при терапии препаратом по сравнению с терапией плацебо.
Таким образом, полученные данные свидетельствуют об эффективности тестируемой фармацевтической композиции in vivo и in vitro, на двух различных моделях ОРДС.
В соответствии с полученными данными, согласующимися с литературными источниками, механизм действия препарата заключается в ингибировании Syk киназы и последующем NF-kB-опосредованном подавлении уровня секреции медиаторов воспаления. Препарат может быть рекомендован для проведения клинических исследований.
Данное вещество имеет ряд преимуществ перед исходным соединением пайсатаннолом, а именно:
- пайсатаннол, относится в соответствии с ОФС.1.2.1.0005.15 «Растворимость» к веществам, очень мало растворимым в водных растворах https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/266/037/p0453pis.pdf]. Химически модифицированный пайсатаннол - соль тетразамещенного гликолевой кислотой пайсатаннола (ТГКП) обладает значительно лучшей растворимостью в фармацевтически приемлемых водных растворах, что позволяет оценить терапевтические эффекты на животных моделях;
- пайсатаннол на основании литературных данных [Gill M. T. et al. 3, 3', 5'-Tri-O-methylpiceatannol and 4, 3', 5'-tri-O-methylpiceatannol: improvements over piceatannol in bioactivity //Journal of natural products. - 1987. - Т. 50. - №. 1. - С. 36-40] является химически не стабильным соединением; проявляя антиоксидантные свойства, он легко и быстро начинает окисляться в водных в растворах. Предлагаемое соединение обладает химической стабильностью, что позволяет наработать серии препарата и провести их контроль качества для доклинических исследований, в том числе, терапевтической активности.
Предложенная химическая модификация позволяет сообщить соединению хорошую растворимость химическую стабильность при сохранении биологической активности.
Все вышесказанное подтверждает выполнение технической задачи, а именно - создание фармацевтической композиции, содержащей в качестве действующего вещества соединение в виде химического производного пайсатаннола в количестве, необходимом и достаточном для терапии ОРДС и обладающее биодоступностью, стабильностью, применимостью в качестве лекарственного средства.
Промышленная применимость
Все приведенные примеры подтверждают промышленную применимость.
СПИСОК СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ТЕРАПИИ ХРОНИЧЕСКИХ РАН | 2018 |
|
RU2701737C1 |
| Вакцина на основе вирусоподобных частиц (VLP) для профилактики COVID-19 для интраназального применения | 2024 |
|
RU2828323C1 |
| КОМПОЗИЦИЯ ТРАДИЦИОННОЙ КИТАЙСКОЙ МЕДИЦИНЫ, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2806632C1 |
| Средство, обладающее противоопухолевым действием, для лечения онкологических заболеваний | 2018 |
|
RU2761429C2 |
| НОВАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА N,N'-БИС-[2-(1Н-ИМИДАЗОЛ-4-ИЛ)ЭТИЛ]ПРОПАНДИАМИДА И ЕЕ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2022 |
|
RU2823162C2 |
| Способ профилактики язвы желудка с использованием лекарственного средства на основе низкомолекулярного соединения фенольной природы в эксперименте | 2018 |
|
RU2696205C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 2022 |
|
RU2801579C1 |
| Способ коррекции стрептозотоцин-индуцированного сахарного диабета у крыс с использованием лекарственного средства на основе амида гетероциклических кислот | 2018 |
|
RU2687979C1 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА АЛЬФА1-ПРОТЕИНАЗЫ (АЛЬФА1-АНТИТРИПСИНА) ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ОСТРОГО РЕСПИРАТОРНОГО ДИСТРЕСС СИНДРОМА И СПОСОБ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ОСТРОГО РЕСПИРАТОРНОГО ДИСТРЕСС СИНДРОМА С ИСПОЛЬЗОВАНИЕМ АЛЬФА1-АНТИТРИПСИНА | 2020 |
|
RU2757875C1 |
| Фармацевтическая композиция пролонгированного действия на основе 5-этокси-2-[2-(морфолино)-этилтио] бензимидазола дигидрохлорида и/или основания (Афобазола) | 2017 |
|
RU2694837C2 |




Настоящее изобретение относится к химико-фармацевтической промышленности и медицине, к области разработки противовоспалительных препаратов. Предложено химическое соединение - тетразамещенный гликолевой кислотой пайсатаннол (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетат: 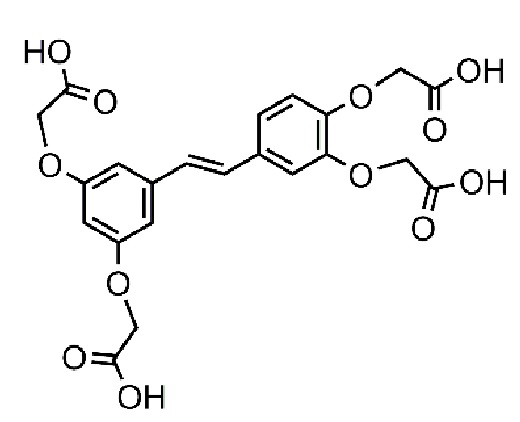 . Также предложены фармацевтическая композиция, включающая действующее вещество в виде указанного выше химического соединения или его фармацевтически приемлемой солевой формы и фармацевтически приемлемые вспомогательные вещества, и ее применение для лечения острого респираторного дистресс-синдрома. Изобретение позволяет получить фармацевтическую композицию, которая применяется для лечения системных воспалительных заболеваний и состояний, таких как острый респираторный дистресс-синдром. 3 н. и 2 з.п. ф-лы, 5 ил., 13 табл., 13 пр.
. Также предложены фармацевтическая композиция, включающая действующее вещество в виде указанного выше химического соединения или его фармацевтически приемлемой солевой формы и фармацевтически приемлемые вспомогательные вещества, и ее применение для лечения острого респираторного дистресс-синдрома. Изобретение позволяет получить фармацевтическую композицию, которая применяется для лечения системных воспалительных заболеваний и состояний, таких как острый респираторный дистресс-синдром. 3 н. и 2 з.п. ф-лы, 5 ил., 13 табл., 13 пр.
1. Химическое соединение тетразамещенный гликолевой кислотой пайсатаннол (E)-2,2'-((4-(3,5-бис(карбоксилатометокси) стирил)-1,2-фенилен)бис(окси)) диацетат

2. Фармацевтическая композиция для лечения острого респираторного дистресс-синдрома, включающая действующее вещество в виде химического соединения по п. 1 или его фармацевтически приемлемой солевой формы, а также фармацевтически приемлемые вспомогательные вещества.
3. Фармацевтическая композиция по п. 2, отличающаяся тем, что солевые формы химического соединения по п. 1 представляют собой натриевую, или калиевую, или аммонийную или другую фармацевтически приемлемую соль.
4. Фармацевтическая композиция по п. 2, отличающаяся тем, что в качестве фармацевтически приемлемых вспомогательных веществ используют стабилизаторы, модификаторы, разбавители при следующих соотношениях компонентов, масс.%:

5. Применение фармацевтической композиции по пп. 2-4 для лечения острого респираторного дистресс-синдрома.
| US 20170143645 A1, 25.05.2017 | |||
| US 7811996 B2, 12.10.2010 | |||
| WO 9959561 A2, 25.11.1999 | |||
| US 6414037 B1, 02.07.2002 | |||
| НОВЫЙ СПОСОБ СИНТЕЗА (Е)-СТИЛЬБЕНОВЫХ ПРОИЗВОДНЫХ, КОТОРЫЙ ПОЗВОЛЯЕТ ПОЛУЧИТЬ РЕСВЕРАТРОЛ И ПИСАТАННОЛ | 2007 |
|
RU2443671C2 |
Авторы
Даты
2024-09-11—Публикация
2023-09-29—Подача