Изобретение относится к области молекулярной биологии и биотехнологии, а именно к способу разделения органической и водной фаз при выделении и очистке дезоксирибонуклеиновой кислоты (ДНК) фенол-хлороформным методом.
Уровень техники
Известен классический метод выделения ДНК методом фенол-хлороформной экстракции (Маниатис Т., Фрич Э. и Сэмбрук Дж. Молекулярное клонирование. 1984. Перевод с английского под редакцией акад. А.А. Баева и д.б.н. Скрябина К.Г.), описывающий один из основных этапов выделения и очистки ДНК экстракцией смесью фенол-хлороформа.
Известен метод разделения органической и водной фаз на твердом носителе –(заявка США US20080053911A1), в котором твердофазная система содержит один или несколько водонерастворимых полимеров из группы, состоящей из поли(винилполипирролидона), поли(этилен-коакриловой кислоты), натриевой соли акриловой кислоты 5 мас.%, поли(винилидена) фторид), поли(тетрафтортилен), поли(4-винилфенол) и поли(стирол-малеиновый ангидрид). Твердофазная система дополнительно может содержать среду для гель-фильтрации, которая способна адсорбировать соли из водной фазы. Стадию разделения проводят центрифугированием. Данный метод обладает рядом недостатков: 1 – необходимость использования колонок, в которые помещается твердая фаза, что усложняет и удорожает процесс очистки нуклеиновых кислот, 2 – перед использованием полимеры необходимо гидратировать в буфере в течение ночи (~ 16 часов), что усложняет процесс очистки за счет увеличения времени на подготовку колонок, 3 – для эффективного удаления фенола необходимо использовать большой объем полимера, который занимает большую часть объема колонки, что существенно снижает объем образца, который можно очистить.
Раскрытие сущности изобретения.
Проблема, на решение которой направлено заявляемое изобретение, является стабильное разделение водной и органической фаз в процессе выделения ДНК фенол-хлороформным методом, что позволяет увеличить выход ДНК без риска контаминации фенолом и интерфазой.
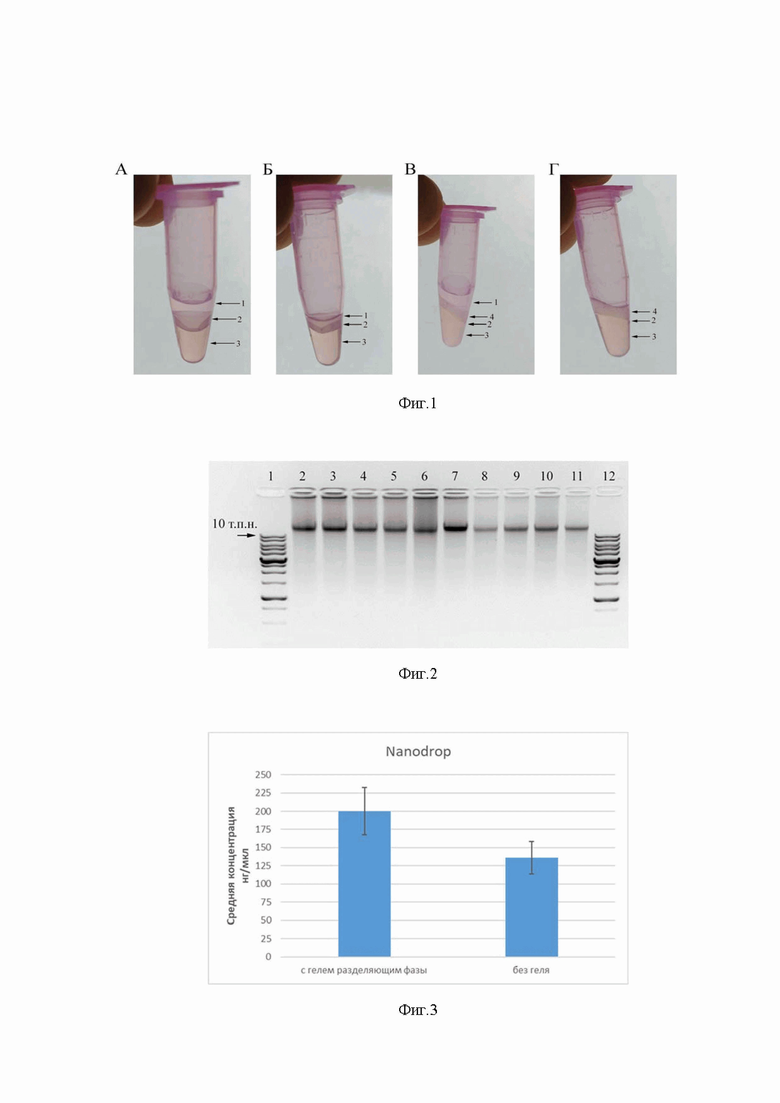
Экстракция смесью фенол-хлороформа является одним из основных этапов выделения и очистки ДНК. Для этого лизат клеток или раствор ДНК смешивают с равным объемом фенол-хлороформа (в соотношении 1:1) и перемешивают до образования эмульсии. В ходе этого процесса белки денатурируют и частично растворяются в фенол-хлороформе при этом полярные молекулы ДНК, имеющие отрицательный заряд, остаются растворенными в водном растворе. Для более быстрого разделения водной и органической фаз раствор центрифугируют. В результате в нижнюю органическую фазу (фенол-хлороформ) попадают частично белки, липиды и жирные кислоты, в промежуточную интерфазу на границе водной и органической фаз, белки, и в водную фазу нуклеиновые кислоты (Фиг. 1А). Далее водную фазу отбирают и нуклеиновые кислоты осаждают этанолом или изопропанолом. Однако отбор водной фазы требует определенного опыта, и полностью собрать водную фазу практически невозможно, так как в процессе отбора легко захватить интерфазу и/или фенол (Фиг. 1Б). Контаминация нуклеиновых кислот фенолом и/или белками из интерфазы снижает качество ДНК и может привести к ингибированию последующих реакций. В свою очередь если проявить излишнюю осторожность и не полностью отобрать водную фазу, то снижается выход ДНК, что крайне нежелательно особенно если количество исходного материала ограничено.
Техническим результатом изобретения является обеспечение стабильного разделения водной и органической фаз при очистке ДНК фенол-хлороформным методом, с увеличением выхода ДНК и снижением вероятности контаминации очищаемой ДНК фенолом и белками.
Указанный технический результат достигается тем, что при разделении водной и органической фаз в процессе очистки ДНК смесью фенол-хлороформа, добавляют 100 мкл геля, содержащего масс%: 85% полидиметилсилоксана (CAS 63148-62-9), 10% аморфного диоксида кремния (CAS 7631-86-9) и 5% диметилсилоксана с концевыми гидроксильными группами (CAS 70131-67-8). В процессе центрифугирования гель формирует плотный слой между органической фазой, интерфазой и водной фазами (Фиг. 1В). В результате чего можно легко и полностью отобрать водную фазу, содержащую нуклеиновые кислоты, не захватывая органическую фазу и интерфазу (Фиг. 1Г).
Результаты процесса разделения органической и водной фаз в процессе очистки ДНК фенол-хлороформным методом проиллюстрированы на фиг.1-5.
Фиг. 1. Разделение органической и водной фаз в процессе очистки ДНК фенол-хлороформным методом. Стандартный подход до отбора водной фазы - А и после отбора водной фазы - Б, предлагаемый подход с использованием геля, разделяющим фазы, до отбора водной фазы - В и после отбора водной фазы - Г. 1 - водная фаза, 2 - интерфаза, 3 - органическая фаза и 4 – гель, разделяющий фазы.
Фиг. 2. Электрофорез геномной ДНК выделенной из клеток линии HeLa. Дорожки 1 и 12 - ДНК маркер молекулярного веса 1kb, СибЭнзим, SE-M11, дорожки 7-11 геномная ДНК очищенная по стандартному фенол-хлороформному методу (образцы 6-10), 2-6 геномная ДНК очищенная фенол-хлороформным методом с использованием геля для разделения водной и органической фаз (образцы 1-5).
Фиг. 3. Средняя концентрация геномной ДНК выделенной из клеток HeLa фенол-хлороформным методом с применением и без геля для разделения водной и органической фаз.
Фиг. 4. Средняя концентрация двухцепочечной ДНК выделенной из клеток HeLa фенол-хлороформным методом с применением и без геля для разделения водной и органической фаз.
Фиг.5. Анализ продуктов ПЦР. 1 и 13 - ДНК маркер молекулярного веса 100 bp + 1.5 Kb, СибЭнзим, SE-M23, дорожки 2-6 - продукты ПЦР с геномной ДНК HeLa выделенной фенол-хлороформным методом с использованием геля для разделения фаз, дорожки 7-11 - продукты ПЦР с геномной ДНК HeLa выделенной стандартным фенол-хлороформным методом, 12 - отрицательный контроль.
Осуществление изобретения.
Заявляемый способ осуществляют следующим образом: предварительно 1 млн клеток линии HeLa лизируют в 100 мкл буфера PBND (50 мМ KCl, 2,5 мМ MgCl2, 10 мМ Tris-HCl (pH = 8.0), 0,45 v/v Nonidet P40, 0,45 v/v Tween 20, 0,1 мг/мл Желатин, 0,4 мг/мл Протеиназа К) и инкубируют 30 мин при температуре 55⁰ С на шейкере. Реакцию инактивируют нагреванием 95⁰ С 10 мин и охлаждают до комнатной температуры. К лизату добавляют 100 мкл воды и ДНК очищают фенол-хлороформным методом. При этом, к лизатам клеток добавляют равный объем (200 мкл) смеси фенол-хлороформ, приготовленный в соотношении 1 к 1 (соответственно фенол : хлороформ), и к образцам 1-5 (Таб. 1,2) добавляли 100 мкл геля для разделения фаз (состав геля мас%: 85% полидиметилсилоксана (CAS 63148-62-9), 10% аморфного диоксида кремния (CAS 7631-86-9) и 5% диметилсилоксана с концевыми гидроксильными группами (CAS 70131-67-8)). Образцы центрифугируют 5 мин с ускорением 13000 g при комнатной температуре. На фиг. 1А и 1В представлены результаты разделения фаз после центрифугирования с гелем и без, (соответственно 1В - с гелем, и 1А – без геля). Водную фазу отбирают и переносят в новую 1,5 мл пробирку, добавляют равный объем хлороформа (для того чтобы удалить остатки фенола), перемешивают и центрифугируют 5 мин с ускорением 13000 g при комнатной температуре. Далее водную фазу переносят в новые 1,5 мл пробирки, ДНК осаждают добавлением 1/10 объема 3М ацетата натрия pH 5.2 и 2,5 объемов 96% этилового спирта, перемешивают и центрифугируют 5 мин с ускорением 13000 g при температуре 4° С. Затем надосадочную жидкость удаляют и осадок промывают добавлением 500 мкл 70% этанола и центрифугируют 5 мин с ускорением 13000 g при температуре 4⁰ С. Надосадочную жидкость удаляли, осадок высушивали при комнатной температуре в течение 15 мин и растворяли в 10 мкл деионизованной воды.
В качестве примера были выделены 10 образцов (в Табл.1 и Табл.2 представлены данные по измерению в образцах концентрации ДНК) геномной ДНК каждый из 1 млн клеток линии HeLa, при этом, из них представлены 5 стандартным способом (образцы 6-10) и 5 с использованием геля для разделения фаз (образцы 1-5) в процессе очистки ДНК фенол-хлороформным методом.
Целостность геномной ДНК оценивали в 1,2 процентном агарозном геле (Фиг. 2). Видно, что независимо от способа очистки геномной ДНК все образцы обладают подвижностью в геле соответствующей ДНК с высокой молекулярной массой. Таким образом это говорит о том, что использование геля для разделения фаз при очистке геномной ДНК фенол-хлороформным методом не приводит к фрагментированию ДНК и позволяет выделять высокомолекулярную геномную ДНК аналогично стандартному подходу. Концентрацию ДНК в выделенных образцах геномной ДНК определяли спектрофотометрическим методом на спектрофотометре Nanodrop 2000 (Таб. 1). Для измерения использовали 2 мкл геномной ДНК. Во всех образцах выделенных стандартным фенол-хлороформным методом очистки (образцы 6-10) концентрация ДНК была ниже чем в образцах выделенных с использованием геля для разделения фаз (образцы 1-5) (Таб.1). При этом показатель 260/280 (отношение поглощения раствора ДНК на длинах волн 260 нм и 280 нм), характеризующий степень очистки образцов ДНК от белков, во всех образцах был идентичный и соответствовал высокой степени очистки ДНК - 1,8 у.е (условные единицы). Таким образом использование геля для разделения фаз дает в среднем увеличение выхода ДНК на 47% процентов (Фиг. 3) при этом степень очистки не изменяется.
Увеличение выхода ДНК подтверждается тем, что при равном объеме, концентрация образцов выделенных с применением геля (образцы 1-5) выше, т.е. общее количество выделенной ДНК в них больше.
Таблица 1. Концентрация ДНК в выделенных образцах геномной ДНК клеток HeLa измеренная спектрофотометрическим методом (Nanodrop). Образец 1-5 - ДНК выделенная с использованием геля для разделения фаз, 6-10 - ДНК выделенная стандартным методом.
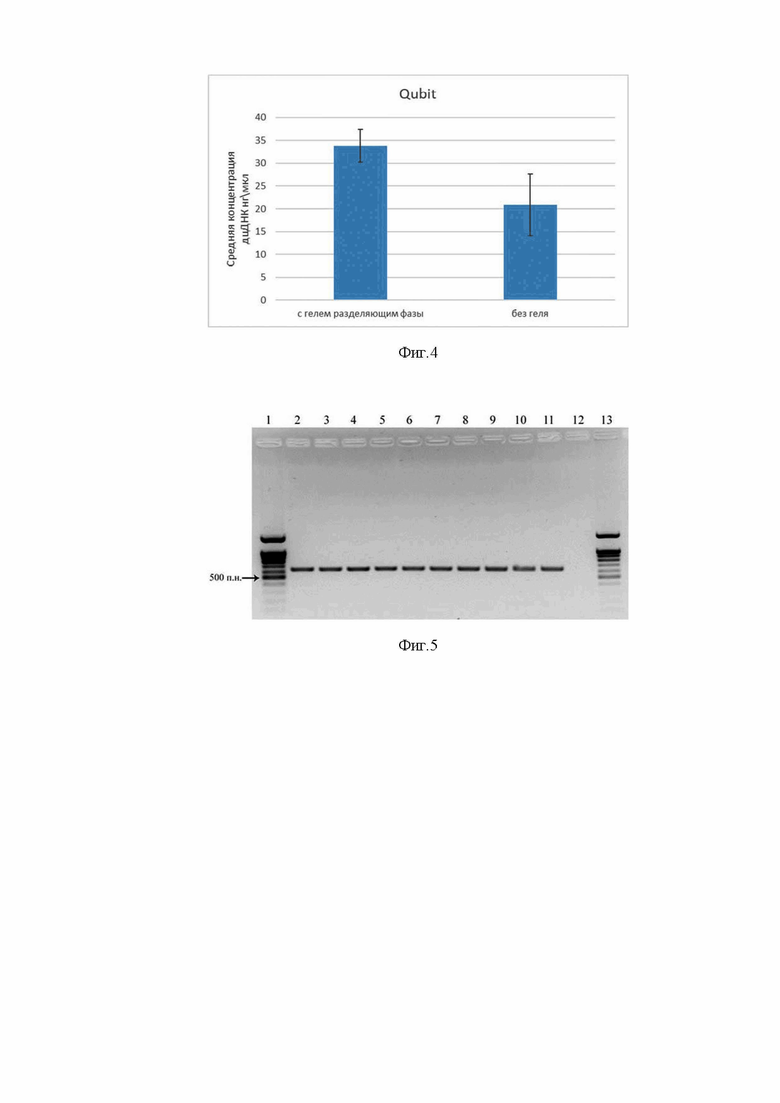
Показатель отношения поглощения раствора ДНК на длинах волн 260 и 280 нм
(у.е.)
Помимо ДНК в клетках присутствует большое количество РНК, которая также выделяется стандартным фенол-хлороформным методом вместе с ДНК. Поэтому концентрацию двухцепочечной ДНК в выделенных образцах дополнительно измеряли при помощи флуориметрии на приборе Qubit 4 (Таб. 2). Измерение концентрации дцДНК проводили с использованием набора реагентов Qubit dsDNA HS Assay Kit (Q32854, Thermo Fisher) согласно инструкции фирмы изготовителя. В результате концентрация дцДНК во всех образцах выделенных с использованием геля для разделения фаз (образцы 1-5) была выше чем в образцах выделенных стандартным методом (образцы 6-10). Таким образом использование геля для разделения фаз дает в среднем увеличение выхода дцДНК на 21% процент (Фиг. 4).
Таблица 2. Концентрация двухцепочечной ДНК в выделенных образцах геномной ДНК клеток HeLa измеренная с помощью флуориметрии (Qubit). Образец 1-5 - ДНК выделенная с использованием геля для разделения фаз, 6-10 - ДНК выделенная стандартным методом.
нг/мкл
Оценку контаминации образцов ДНК белком проводили при помощи флуориметрии. Измерение концентрации белка проводили с использованием набора реагентов QuDye Protein (25102, Lumiprobe) согласно инструкции производителя. Ни в одном из образцов не был обнаружен белок (таблица 3), что подтверждает высокую степень очистки ДНК.
Таблица 3. Концентрация белка в выделенных образцах геномной ДНК клеток HeLa измеренная с помощью флуориметрии (Qubit).
нг/мкл
Для оценки влияния очистки ДНК фенол-хлороформным методом с использованием геля на ферментативные реакции, проводили амплификацию фрагмента геномной ДНК методом полимеразной цепной реакции (ПЦР). В качестве матрицы в ПЦР использовали выделенные образцы геномной ДНК клеток HeLa. Фрагмент гена SLC26A4 длинной 636 п.н. амплифицировали с использованием праймеров PDS_Ex7-8_F 5`-CATGGTTTTTCATGTGGGAAGATTC-3` и PDS_Ex7-8R 5`-CAAATGGCTTGACGTTTATCTACACAC-3`. ПЦР проводили с использованием полимеразы Q5® Hot Start High-Fidelity DNA Polymerase (#M0493L, NEB), реакционную смесь смешивали согласно рекомендациям производителя. ПЦР проводили на амплификаторе T30 (LongGene) со следующим температурным профилем: денатурация при 98°С в течение 30 сек; затем 45 циклов: плавление при 98°С – 5 сек, отжиг праймеров при 60°С – 20 сек и элонгация при 72°С – 20 сек; досинтез 72°С - 2 мин; хранение 12°С. Продукты ПЦР анализировали в 1,2% агарозном геле. На фиг. 5 представлены результаты анализа продуктов ПЦР в агарозном геле. Во всех случаях детектируется специфический продукт ожидаемой длины. Таким образом очистка ДНК фенол-хлороформным методом с использованием геля для разделения водной и органической фаз не ингибирует ПЦР.
В итоге изобретение позволяет получить раствор ДНК высокого качества и высокой концентрации, пригодный для лабораторных исследований, в том числе проведения ПЦР.
| название | год | авторы | номер документа |
|---|---|---|---|
| Универсальный способ выделения ДНК и лизирующая смесь для его осуществления | 2022 |
|
RU2807254C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДНК ИЗ ЯЙЦЕКЛЕТОК РЫБ | 2015 |
|
RU2632649C2 |
| Способ прогнозирования развития детского ожирения в Республике Башкортостан | 2022 |
|
RU2794991C1 |
| СМЕННЫЙ МИКРОФЛЮИДНЫЙ МОДУЛЬ ДЛЯ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ И СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2008 |
|
RU2380418C1 |
| Способ выделения рибонуклеиновой кислоты вируса из спинномозговой жидкости для молекулярно-биологических исследований | 2022 |
|
RU2808832C1 |
| Способ выделения ДНК из растений, пригодный для постановки ПЦР | 2017 |
|
RU2672378C1 |
| БИОЛОГИЧЕСКИЙ МАРКЕР ДЛЯ ОПРЕДЕЛЕНИЯ ПОРОДЫ РЫБ, НАБОР И СПОСОБ ОПРЕДЕЛЕНИЯ ПОРОДНОЙ ПРИНАДЛЕЖНОСТИ РЫБ | 2005 |
|
RU2294633C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МАРКЕРОВ НАЛИЧИЯ ОПУХОЛЕВЫХ Т-ЛИМФОБЛАСТОВ | 2016 |
|
RU2674994C2 |
| СПОСОБ СПЕЦИФИЧЕСКОГО ВЫДЕЛЕНИЯ ПОЛНОГО ДНК-СОДЕРЖИМОГО БАКТЕРИАЛЬНЫХ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИИ | 2010 |
|
RU2567809C2 |
| БИОЛОГИЧЕСКИЙ ДНК МАРКЕР ДЛЯ ОПРЕДЕЛЕНИЯ СОРТОВ КАРТОФЕЛЯ, НАБОР И СПОСОБ СОРТОВОЙ ИДЕНТИФИКАЦИИ КАРТОФЕЛЯ | 2009 |
|
RU2413774C1 |
Изобретение относится к области молекулярной биологии и биотехнологии. Предложен способ разделения органической и водной фаз при выделении и очистке ДНК фенол-хлороформным методом. Лизат клеток смешивают с равным объемом смеси фенол-хлороформ при соотношении фенол : хлороформ 1:1 по массе. В раствор добавляют 100 мкл геля следующего состава масс.%: 85 полидиметилсилоксана, 10 аморфного диоксида кремния и 5 диметилсилоксана с концевыми гидроксильными группами. Проводят центрифугирование полученного раствора. Изобретение обеспечивает стабильное разделение водной и органической фаз при очистке ДНК фенол-хлороформным методом с увеличением выхода ДНК и снижением вероятности контаминации очищаемой ДНК фенолом и белками. 2 з.п. ф-лы, 5 ил., 3 табл.
1. Способ разделения смеси органической и водной фаз при очистке раствора ДНК фенол-хлороформным методом, при котором лизат клеток смешивают с равным объемом смеси фенол-хлороформ и проводят центрифугирование полученного раствора, характеризующийся тем, что после смешивания лизата клеток с равным объемом смеси фенол-хлороформ до центрифугирования в раствор добавляют 100 мкл геля следующего состава масс.%: 85 полидиметилсилоксана, 10 аморфного диоксида кремния и 5 диметилсилоксана с концевыми гидроксильными группами.
2. Способ по п.1, отличающийся тем, что используют смесь фенол-хлороформа при соотношении фенол : хлороформ 1:1 по массе.
3. Способ по п.1, отличающийся тем, что полученный раствор центрифугируют в течение 5 мин с ускорением 13000 g при комнатной температуре.
| TILZER, L., THOMAS, S., & MORENO, R | |||
| F | |||
| Use of silica gel polymer for DNA extraction with organic solvents | |||
| Analytical Biochemistry, 1989, 183(1), p.13-15 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| US5175271 A, 29.12.1992 | |||
| US 20080053911 A1, 06.03.2008 | |||
| Универсальный способ выделения ДНК и лизирующая смесь для его осуществления | 2022 |
|
RU2807254C1 |
| Способ выделения рибонуклеиновой кислоты вируса из спинномозговой жидкости для молекулярно-биологических исследований | 2022 |
|
RU2808832C1 |
Авторы
Даты
2024-10-21—Публикация
2023-12-12—Подача