Изобретение относится к области органической химии, к новым биологически активным веществам класса 4-замещенных 3,5-дигидрокси-5-(трихлорметил)фуран-2(5H)-онов (1-6), формулы:
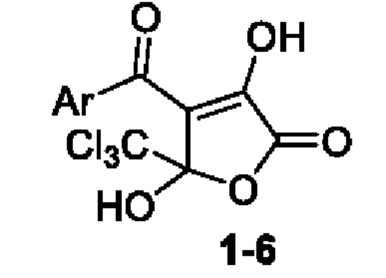
Ar=Ph (1); Ar=4-СН3С6Н4(2); Ar=3,4-(CH3O)2С6Н3 (3); Ar=4-ClC6H4 (4); Ar=4-BrC6H4 (5); Ar=нафт-2-ил (6)
обладающим противомикробной активностью, что позволяет предположить их использование в медицине в качестве противомикробных препаратов.
Аналогом по структуре заявляемым соединениям является этиловый эфир 2,4-дигидрокси-5-оксо-2-трифторметил-2,5-дигидрофуран-3-карбоновой кислоты 7, [Прядеина М.В., Бургарт Я.В., Суслова К.И., Салоутин В.И. Получение 4-ацил(алкоксикарбонил)-3,5-дигидрокси-5-фторалкилфуран-2(5H)-онов // Известия Академии наук. Серия химическая. 2002. №9. С.1585-1587] формулы:
Структурный аналог 7 не изучен на наличие противомикробной активности.
В качестве эталона сравнения противомикробной активности выбран антибактериальный препарат диоксидин [Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции // Инфекции и антимикробная терапия. - 2001. - №. 5. - С.105-155], который широко применяются в лечебной практике и является аналогом по действию.
Целью предлагаемого изобретения является поиск в ряду замещенных 3,5-дигидрокси-5-(трихлорметил)фуран-2(5H)-онов веществ с выраженной противомикробной активностью.
Поставленная задача достигается получением 4-замещенных 3,5-дигидрокси-5-(трихлорметил)фуран-2(5H)-онов, которые обладают противомикробной активностью.
Заявляемые вещества (1-6) синтезируют взаимодействием 5-замещенных 4-(2,2,2-трихлорацетил)фуран-2,3-дионов (8-13) с водой при перемешивании в среде абсолютного диоксана с последующим выделением целевого продукта известными методами по схеме, описанной в работе [Lisovenko, N.Y., Nasibullina, E.R., Kharitonova, S.S., Myshkina, O.A. Simple Synthesis of Substituted 3-Нуегохупггап-2(5H)-опе8 Synthesis, 2021, 53(11), pp.1955-1961]
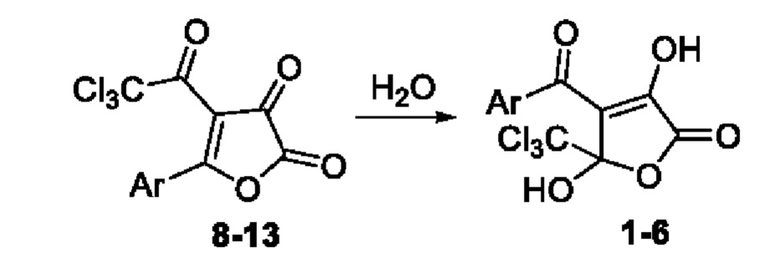
1-6, 8-13: Ar=Ph (1,8); Ar=4-CH3C6H4 (2,9); Ar=3,4-(СН3О)2С6Н3 (3,10); Ar=4-ClC6H4 (4,11); Ar=4-BrC6H4 (5,12); Ar=нафт-2-ил (6,13)
Технический результат заключается в расширении арсенала средств воздействия на живой организм.
Изобретение иллюстрируется следующими примерами:
Пример 1. Общая методика получения соединений 1-6.
К раствору соединений 8-13 (1 ммоль) в безводном диоксане (20 мл) добавляли воду (1 ммоль). Реакционную массу перемешивали на магнитной мешалке при комнатной температуре в течение 4 ч. Растворитель выпаривали, полученный осадок перекристаллизовывали из толуола.
Пример 2. Соединение 1 синтезировано из фуран-2,3-диона 8. Бесцветные кристаллы, выход 0.29 г (85%), Тразложения 153-154°С; ИК (vmax, см-1): 3293 (ОН), 1771 (C2=О), 1690 (COC6H5). 1Н ЯМР (DMSO-d6, 400 МГц, δ, м.д.) 7.56 (2Н, т, J=8 Гц, С6Н5), 7.67 (1Н, т, J=8 Гц, С6Н5), 7.88-7.90 (2Н, д, J=8 Гц, С6Н5), 9.41(1Н, уш.с, ОН); 13С ЯМР (DMSO-d6, 100 МГц, δ, м.д.) 101.6, 107.1, 118.4, 128.6, 129.1, 133.6, 136.5, 148.4, 165.2 (С=О), 188.7 (С=О); Посчитано для C12H7Cl3O5 (337.55): С, 42.70; Н, 2.09; С1, 31.51%. Найдено: С, 42.77; Н, 2.05; С1, 31.18%.
Пример 3. Соединение 2 синтезировано из фуран-2,3-диона 9. Бесцветные кристаллы, выход 0.32 г (90%), Тразложения157-158°С; ПК (vmax, см-1): 3317 (ОН), 1766 (С2=O), 1693 (СОС6Н4СН3-4). 1Н ЯМР (DMSO-d6, 400 МГц, δ, м.д.) 2.39 (3Н, с, СН3), 7.34-7.36 (2Н, д, J=8 Гц, С6Н4), 7.78-7.80 (2Н, д, J=8 Гц, СбН4), 9.17 (1H, уш.с, ОН); 13С ЯМР (DMSO-d6, 100 МГц, δ, м.д.) 21.2, 101.3, 107.0, 119.2, 129.2, 129.3, 133.9, 144.5, 147.4, 160.82, 165.2 (С=O), 188.1 (С=O); Посчитано для C13H9Cl3O5 (351.57): С, 44.41; Н, 2.58; С1, 30.25%. Найдено: С, 44.69; Н, 2.69; Cl, 30.70%.
Пример 4. Соединение 3 синтезировано из фуран-2,3-диона 10. Бесцветные кристаллы, выход 0.32 г (80%), Тразложения165-166°С; ПК (vmax, см-1): 3406 (ОН), 3333 (ОН), 1797 (С2=O), 1688 (СО). 1Н ЯМР (DMSO-d6, 400 МГц, δ, м.д.) 3.81 (3Н, с, ОСН3), 3.88 (3Н, с, ОСН3), 7.13-7.11 (1Н, д, J=8 Гц, С6Н3), 7.43 (1Н, с, С6Нз), 7.56-7.58 (1Н, д, J=8 Гц, С6Н3), 9.45 (2Н, уш.с, ОН); 13С ЯМР (DMSO-d6, 100 МГц, δ, м.д.) 55.5, 55.8, 101.4, 106.9, 111.0, 111.1, 119.7, 124.9, 129.2, 146.8, 148.7, 153.8, 165.2 (С=O), 186.9 (С=O); Посчитано для C14H11Cl3O7 (397.59): С, 42.29; Н, 2.79; Cl, 26.75%. Найдено: С, 42.41; Н, 2.84; С1, 26.39%.
Пример 5. Соединение 4 синтезировано из фуран-2,3-диона 11. Бесцветные кристаллы, выход0.35 г (93%), Тразложения166-167°С; ПК (vmax, см-1): 3466 (ОН), 1790 (С2=O), 1686 (СО). 1Н ЯМР (DMSO-d6, 400 МГц, δ, м.д.) 7.61-7.63 (2Н, д, J=8 Гц С6Н4), 7.86-7.88 (2Н, д, J=8 Гц, С6Н4), 9.26 (2Н, уш.с, ОН); 13С ЯМР (DMSO-d6, 100 МГц, δ, м.д.) 101.7, 107.0, 117.2, 128.8, 130.9, 135.3, 138.5, 149.4, 165.1 (С=O), 187.3 (С=O); Посчитано для C12H6Cl4O5 (371.99): С, 38.75; Н, 1.63; Cl, 38.12%. Найдено: С, 38.72; Н, 1.41; Cl, 38.22%.
Пример 6. Соединение 5 синтезировано из фуран-2,3-диона 12. Бесцветные кристаллы, выход 0.35 г (83%), Тразложения 154-155°С; ИК (vmax, см-1): 3269 (ОН), 1786 (С2=O), 1690 (СО). 1Н HMP(DMSO-d6, 400 МГц, δ, м.д.) 7.76-7.81 (4Н, м, С6Н4), 9.45 (2Н, уш.с, ОН); 13СЯМР (DMSO-d6, 100 МГц, δ, м.д.) 101.7, 107.0, 117.4, 127.8, 131.0, 131.8, 135.6, 149.4, 165.1 (С=O), 187.6 (С=O); Посчитано для C12H6BrCl3O5 (416.44): С, 34.61; Н, 1.45; Br, 19.19; Cl, 25.54%. Найдено: С, 34.44; Н, 1.49; Вг, 19.28; С1, 25.62%.
Пример 7. Соединение 6 синтезировано из фуран-2,3-диона 13. Светло-желтое кристаллическое вещество, выход 0.37 г (89%), Тразожения 152-154°С; ИК (vmax, см-1): 3473 (ОН), 3332 (ОН), 1772 (С2=O), 1688 (СО). 1Н ЯМР (DMSO-d6, 400 МГц, δ, м.д.) 7.61-7.72 (2Н, м, 2-naphthyl) 7.93-8.15 (4Н, м, 2-naphthyl) 8.52 (1Н, с, 2-naphthyl) 9.13 (2Н, уш.с, ОН); 13С ЯМР (DMSO-d6, 100 МГц, δ, м.д.) 101.5, 107.0, 118.9, 124.2, 126.9, 127.6, 128.3, 128.9, 129.7, 131.8, 132.1, 133.9, 135.3, 148.3, 165.2 (С=O), 188.6 (С=O); Посчитано для C16H9Cl3O5 (387.60): С, 49.58; Н, 2.34; Cl, 27.44%. Найдено: С, 49.31; Н, 2.21; Cl, 27.23%.
Пример 8. Противомикробная активность соединений (1-6).
Для изучения антимикробной активности заявляемых соединений (1-6) использовали общепринятый метод двукратных серийных разведений в жидкой питательной среде микрометодом [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ - М.: И-во Медицина, 2005].
В качестве тест-микроорганизмов использовали Staphylococcus aureus (штамм 906), Escherichia coli (штамм 1257), полученных в Федеральном государственном бюджетном учреждении «Научный центр экспертизы средств медицинского применения» (ФГБУ «НЦЭСМП» Минздрава России, г. Москва).
Культуры выращивали в пробирках на скошенной питательной среде (мясопептонный агар). Для приготовления рабочей взвеси микроорганизмов производили смыв выросшей культуры изотоническим раствором хлорида натрия и устанавливали плотность по стандарту мутности (ОСО) на 5 ME с использованием денситометра. После ряда разведений конечная концентрация клеток в опыте составляла 2,5×105 клеток/мл.
В лунках стерильного 96 луночного плоскодонного микропланшета готовили два параллельных ряда двукратных серийных разведений заявляемых соединений (1-6), в бульоне МПБ. В каждой лунке содержалось 150 мкл определенной концентрации испытуемого вещества, и 150 мкл инокулята культуры. В последних рядах содержалась питательная среда и культура в равных объемах (контроль). Максимально испытанная концентрация соответствовала 1000,0 мкг/мл, минимальная - 1,0 мкг/мл. Микропланшет помещали в термостат спектрофотометра Epoch и замеряли оптическую плотности (ОП) при длине волны 540 нм. Через 24 часа и 7 суток вновь регистрировали ОП культуральной жидкости.
Результаты оценивали с помощью программного обеспечения Gen 5 спектрофотометра для микропланшет Epoch. Последняя лунка ряда с задержкой роста и показателями ОП равной оптической плотности контрольной лунки соответствует минимальной подавляющей концентрацией соединения.
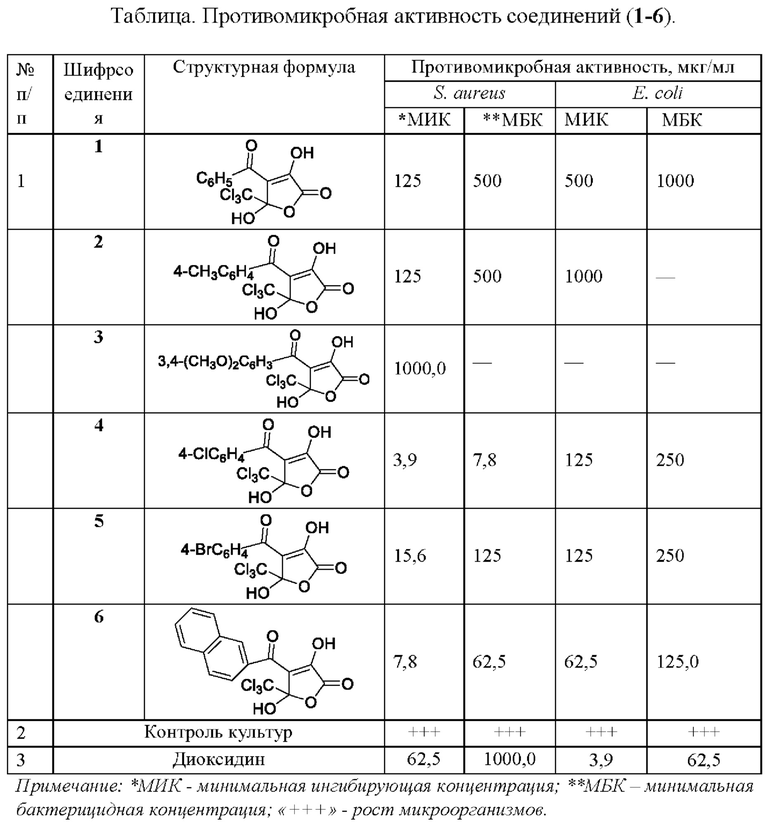
Анализ полученных данных показал, что большинство соединений (1-6) класса 4-замещенных 3,5-дигидрокси-5-(трихлорметил)фуран-2(5H)-онов обладают противомикробным действием в отношении исследуемых культур.
Умеренную противомикробную активность проявили соединения (1,2) торможение роста культуры S. aureus от воздействия соединений наступает в концентрации 125 мкг/мл, бактерицидный эффект достигнут в концентрации 500 мкг/мл, бактериостатическое действие в отношении Е. coli показано в концентрациях 500 - 1000 мкг/мл.
Выраженный противомикробный эффект проявили соединения (4-6), обладающие избирательным действием, ингибируя рост бактерий S. aureus в концентрациях 3,9 - 15,6 мкг/мл, что активнее препарата сравнения в несколько раз. Подавление роста культур Е. coli наступает в концентрации 62,5 - 125 мкг/мл. Бактерицидное действие соединений (4-6) в отношении культуры S. aureus показано в концентрациях 7,8 - 125 мкг/мл, гибель бактерий Е. coli наступает от концентраций 125 - 250 мкг/мл.
Заявленные соединения (1-6), обладающие противомикробной активностью, могут найти применение в фармакологии, медицине и ветеринарии.
Изобретение относится к области органической химии и фармакологии, а именно к применению 4-замещенного 3,5-дигидрокси-5-(трихлорметил)фуран-2(5H)-она формулы: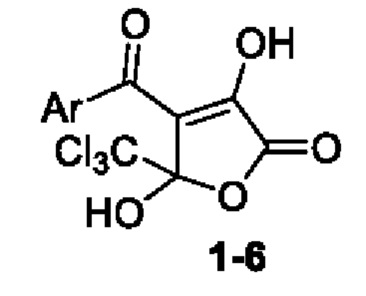 , где Ar=Ph (1); Ar=4-CH3C6H4(2); Ar=3,4-(CH3O)2C6H3 (3); Ar=4-ClC6H4 (4); Ar=4-BrC6H4 (5); Ar=нафт-2-ил (6), в качестве средства, обладающего противомикробной активностью в отношении S. aureus. Технический результат – противомикробная активность в отношении S. aureus соединений формулы 1-6. 1 табл., 8 пр.
, где Ar=Ph (1); Ar=4-CH3C6H4(2); Ar=3,4-(CH3O)2C6H3 (3); Ar=4-ClC6H4 (4); Ar=4-BrC6H4 (5); Ar=нафт-2-ил (6), в качестве средства, обладающего противомикробной активностью в отношении S. aureus. Технический результат – противомикробная активность в отношении S. aureus соединений формулы 1-6. 1 табл., 8 пр.
Применение 4-замещенного 3,5-дигидрокси-5-(трихлорметил)фуран-2(5H)-она формулы:
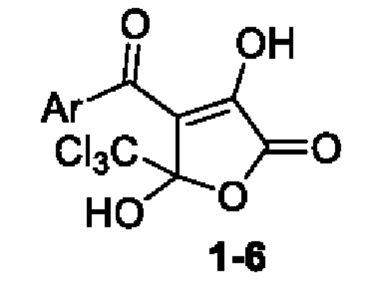
Ar=Ph (1); Ar=4-CH3C6H4(2); Ar=3,4-(CH3O)2C6H3 (3); Ar=4-ClC6H4 (4); Ar=4-BrC6H4 (5); Ar=нафт-2-ил (6),
в качестве средства, обладающего противомикробной активностью в отношении S. aureus.
| 4-[(4-БРОМФЕНИЛ)((4-НИТРОФЕНИЛ)АМИНО)МЕТИЛИДЕН]-5-ГИДРОКСИ-5-(ТРИХЛОРМЕТИЛ)ДИГИДРОФУРАН-2,3-ДИОН, ОБЛАДАЮЩИЙ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ | 2022 |
|
RU2783242C1 |
| Lisovenko N | |||
| Yu | |||
| et al., Simple Synthesis of Substituted 3-Hydroxyfuran-2(5H)-ones | |||
| Synthesis, 2021 v.53, p.1955-1961 | |||
| Нурана Нараддин Кызы Гахраманова и др., Синтез и взаимодействие с водой 5-арил-4-(трихлорацетил)фуран-2,3-дионов | |||
| Вестник молодых ученых ПГНИУ | |||
| Сборник научных трудов, Пермь, 2015, выпуск 5, | |||
Авторы
Даты
2024-12-03—Публикация
2023-03-16—Подача