Изобретение относится к биотехнологии, микробиологической промышленности, изготовлению композиции из смеси пробиотических штаммов, составляющих в итоге готовое пробиотическое средство, которое может быть использовано как лекарственный препарат и биологически активная добавка в качестве пробиотика, а также для терапии и профилактики патологических состояний, возникающих на фоне нарушения регуляции взаимодействий оси «кишечник-мозг».
Уровень техники
Известен штамм Lactobacillus plantarum KBL396 (KCTC13278BP) для повышения секреции серотонина [RU 2764639 C1 19.01.2022]. Также предложены фармацевтические композиции, содержащие указанный штамм или культуру этого штамма и применяемые для повышения секреции серотонина или для профилактики или лечения неврологических заболеваний. Также предложены пищевая композиция, добавка к корму животных, композиция, предназначенная для получения профилактического или терапевтического лекарственного препарата для профилактики или лечения неврологических заболеваний, содержащие указанный штамм или его культуру. Также предложен способ профилактики или лечения неврологических заболеваний, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества указанного штамма или культуры этого штамма. Группа изобретений обеспечивает улучшение когнитивной способности, улучшение способности к восстановлению после стресса, а также улучшение состояния депрессии при использовании штамма Lactobacillus plantarum KBL396 (KCTC13278BP), способного повышать секрецию серотонина.
Однако известный штамм отличается от предложенных геномной последовательностью, а также фармацевтическая композиция на его основе включает в себя лишь один пробиотический штамм. В отличие от аналога предлагаемое изобретение содержит новые штаммы Bifidobacterium longum subsp. longum 202_21 и Lacticaseibacillus paracasei subsp. paracasei 29n_21, которые депонированы во Всероссийской коллекции микроорганизмов под регистрационными номерами VKM B-3717D и VKM B-3711D соответственно.
Изобретение представляет собой фармацевтическую композицию, включающую в себя новые штаммы бактерий Bifidobacterium longum subsp. longum VKM B-3717D и Lacticaseibacillus paracasei subsp. paracasei VKM B-371 ID, которые отличаются от известных штаммов микроорганизмов геномными последовательностями и характеристиками, а именно обладают пробиотическими свойствами, характеризуются высокой антагонистической активностью в отношении патогенных, условно-патогенных, в том числе полирезистетных к антибактериальным препаратам микроорганизмов, в том числе в отношении токсинпродуцирующих штаммов Clostridioides difficile, обладают адгезивными свойствами и антибиотикорезистентностью к нескольким лекарственным препаратам, а также синтезируют ряд соединений, которые потенциально могут воздействовать на ось «кишечник-мозг».
Технические условия заключались в подборе перспективных кандидатных штаммов композиции пробиотика для профилактики и терапии хронических неинфекционных заболеваний, в частности, депрессивных расстройств и способов получения такой композиции, состоящей из штаммов, обладающих пробиотическими свойствами, а также синтезирующих ряд соединений, которые потенциально могут воздействовать на ось «кишечник-мозг».
Техническим результатом изобретения является создание композиции на основе новых штаммов микроорганизмов, выделенных из естественного биотопа кишечника человека, обладающих уникальным сочетанием свойств, обеспечивающей комплексный эффект на психоэмоциональное состояние человека, на депрессивные расстройства различного генеза, возникающих на фоне нарушения регуляции взаимодействий оси «кишечник-мозг» при дисбалансе состава микробиоты кишечника, вызванного расстройством пищевого тракта.
Технический результат изобретения достигается тем, что предлагаемая композиция пробиотического средства представляет собой лиофилизат живых клеток двух пробиотических штаммов бактериальных культур Bifidobacterium longum subsp. longum VKM B-3717D и Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D, выделенных из естественного биотопа кишечника человека, в сахаро-желатиновой среде или в среде с добавлением 20% обезжиренного молока. Лиофилизат представляет собой кристаллическую или пористую массу желтовато-бежевого или беловато-серого цвета различной интенсивности со специфическим запахом, содержащей в 2 см3 лиофилизата 1 терапевтическую дозу лекарственного средства, который при ресуспендировании в пенициллиновом флаконе 5 см3 физиологического раствора содержит 7⋅107 КОЕ жизнеспособных Bifidobacterium longum subsp. longum VKM B-3717D и Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D.
Для стимуляции совместного роста потенциально полезных микроорганизмов (как в составе патентуемой композиции, так и между компонентами композиции и микробиотой кишечника) в состав фармацевтической композиции добавляют пребиотик, например, N-ацетилглюкозамин или лакто-N-биозу (C14H25NO11), до конечной концентрации в среде не менее 0,1 мг/мл.
Для защиты микроорганизмов от воздействия желудочного сока лиофилизат расфасовывают в кишечнорастворимые капсулы, например, в количестве 1 терапевтическая доза фармацевтической субстанции в 1 желатиновую капсулу №3. Предварительно к лиофилизату фармацевтической субстанции добавляют наполнитель капсул, содержащий по меньшей мере один из следующих компонентов или все: мукоадгезивный компонент, связующий компонент, разрыхлитель, стабилизатор, например, на 1 желатиновую капсулу №3 добавляют 30 мг хитозана, 50 мг сахарозы, 70 мг лактозы.
Возможность использовать в составе композиции пробиотического средства вспомогательных компонентов расширяет возможности способа, повышает биодоступность и стабильность препаратов на основе фармацевтической композиции.
Применение предложенной композиции пробиотического средства позволит снизить расходы на терапию антидепрессантами, транквилизаторами, нейролептиками и другими дорогостоящими препаратами, позволит избежать развития побочные эффектов, вызываемых препаратами указанных групп, а также позволит проводить профилактику и терапию хронических неинфекционных заболеваний. Таким образом, предлагаемое изобретение решает важную задачу здравоохранения по расширению спектра применения предлагаемого препарата.
Сущность изобретения поясняется примерами.
Пример 1. Характеристика штамма Lacticaseibacillus paracasei subsp. paracasei 29n_21 или Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D - регистрационный номер депонирования во Всероссийской коллекции микроорганизмов
Штамм Lacticaseibacillus paracasei subsp. paracasei 29n_21 идентифицирован до вида с помощью микробиологических методов, таксономическое положение уточнено до подвида методами молекулярной биологии и биоинформатики (амплификация нуклеиновых кислот, секвенирование для подтверждения стабильности и уникальности генома штамма). Для in silico подтверждения таксономической принадлежности вплоть до подвида был использован мультилокусный анализ (120 бактериальных генов), имплементированный в пайплайн GTDB-Tk. Для поиска совпадений с существующими сигнатурами штаммов Lacticaseibacillus paracasei subsp. paracasei использовался StrainSeeker, который использует алгоритмы машинного обучения для сопоставления генетической информации анализируемого штамма с информацией из базы данных NCBI RefSeq, описывающей широкий диапазон бактериальных штаммов. В ходе анализа не было обнаружено совпадений сигнатур с известными штаммами Lacticaseibacillus paracasei subsp. paracasei, что служит дополнительной валидацией новизны разработанного пробиотического организма.
Для культивирования используется среда следующего состава: 20,0 г декстроза, 10,0 г бактериологический пептон, 8,0 г мясной экстракт, 5,0 г ацетат натрия, 4,0 г дрожжевой экстракт, 2,0 г K2HPO4, 2,0 г цитрат аммония, 1,0 г твин 80, 0,2 г сульфат магния, 0,05 г сульфат марганца, 10,0 г бактериологический агар. Для приготовления среды в 1 литре дистиллированной воды развести ингредиенты для приготовления среды, хорошо перемешать и нагреть и часто помешивая довести до кипения. Кипятить в течение минуты до полного растворения. Стерилизовать 12 минут при 121°С. Охладить до 45-50°С, тщательно перемешать и разлить в чашки Петри. Готовая среда имеет янтарный цвет, слегка опалесцирует, должна храниться при температуре 2-8°С. Конечная величина рН 6,2±0,2 при 25°С.
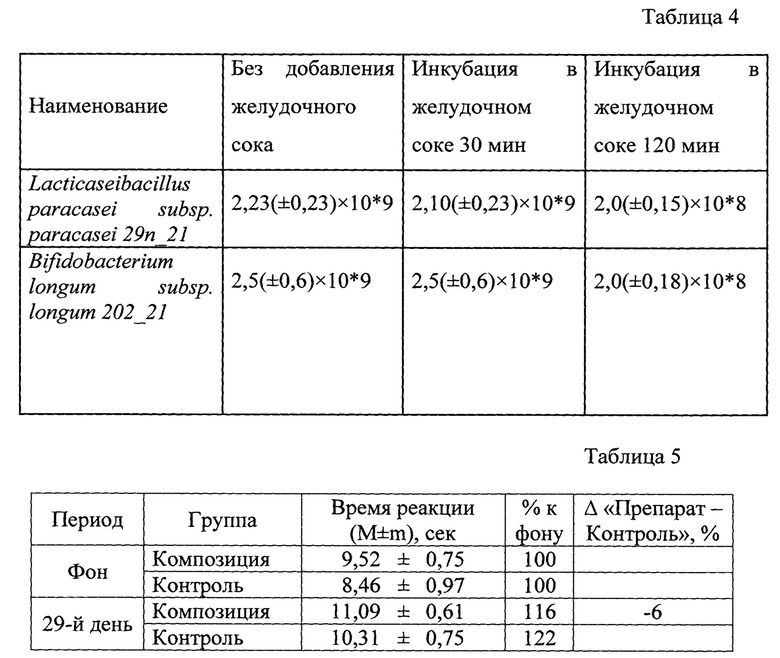
Через 48 часов культивирования на питательной среде микроорганизмы формируют колонии белого цвета, небольшого размера, гладкие, непрозрачные, выпуклые, сферические. На Фиг. 1 изображены колонии Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) на агаризованной среде MPC. По данным окрашивания по методу Грама Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) имеет форму палочек с закругленными концами, расположенных одиночно или собранных в цепочки различной длины от (0,7-1,1) мкм до (3,0-8,0) мкм. Клетки по форме напоминают прямые палочки с четкими контурами и прямыми или слегка закругленными полюсами. Длина основной массы клеток составляет (1,0-1,5) мкм, диаметр (0,6-0,8) мкм.
Хранение штамма осуществляется в криопробирках в среде для хранения триптиказо-соевый бульон (Trypcase Soy broth, BioRad, США) с добавлением 10% глицерина.
Штамм не имеет R-плазмид, транспозонов, конвертируемых бактериофагов (профагов). Устойчивость данного штамма к антибиотикам обусловлена хромосомной природой. Штамм Lacticaseibacillus paracasei subsp. paracasei 29n_2l (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) резистентен к амикацину, пиперециллину-тазобактаму, ампициллину, пиперациллину, тедизолиду, ципрофлоксацину, ванкомицину, цефексиму, метронидазолу, меропенему, цефотитану и чувствителен к тигециклину, клиндамицину, левофлоксацину, азитромицину. В классификации микроорганизмов по группам патогенности СанПиН 1.2.3685-21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания» данный вид (род) не значится не значится, а значит может быть использован в качестве пробиотического штамма. Штамм Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) обладает однородными морфологическими, тинкториальными, культуральными свойствами без признаков диссоциации. У него отсутствует способность образовывать слизистые колонии и капсулы, которые являются признаками вирулентности бактериальных культур. Он однороден по физиолого-биохимическим свойствам. Штамм Lacticaseibacillus paracasei subsp. paracasei 29n_21 относится к хемоорганотрофам, не продуцирует ферменты, относящиеся к факторам патогенности, например, каталазу, гиалуронидазу, фибринолизин, плазмокоагулазу, гемолизин, летициназу С, нейраминидазу. Менахинон не образует. Активность кислотообразования, определенная титриметрическим методом, при выращивании в среде MRS-1 не ниже 200°Т по Тернеру. Производственный штамм Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D), расфасованный в первичную упаковку (флаконы), в лиофилизированном виде хранится при температуре плюс (6±2)°С, что обеспечивает его стабильность.
Пример 2. Характеристика штамма Bifidobacterium longum subsp. longum 202_21 или Bifidobacterium longum subsp. longum VKM B-3717D - регистрационный номер депонирования во Всероссийской коллекции микроорганизмов
Систематическое положение штамма Bifidobacterium longum subsp. longum 202__21 (Bifidobacterium longum subsp. longum VKM B-3717D) идентифицировано до вида с помощью микробиологических методов и дополнено методами молекулярной биологии и биоинформатики (амплификация нуклеиновых кислот, секвенирование для подтверждения стабильности генома штамма). Для in silico подтверждения таксономической принадлежности вплоть до подвида был использован мультилокусный анализ (120 бактериальных генов), имплементированный в пайплайн GTDB-Tk. Для поиска совпадений с существующими сигнатурами штаммов Bifidobacterium longum subsp. longum использовался StrainSeeker, который использует алгоритмы машинного обучения для сопоставления генетической информации анализируемого штамма с информацией из базы данных NCBI RefSeq, описывающей широкий диапазон бактериальных штаммов. В ходе анализа не было обнаружено совпадений сигнатур с известными штаммами Bifidobacterium longum subsp. longum, что служит дополнительной валидацией новизны разработанного пробиотического организма.
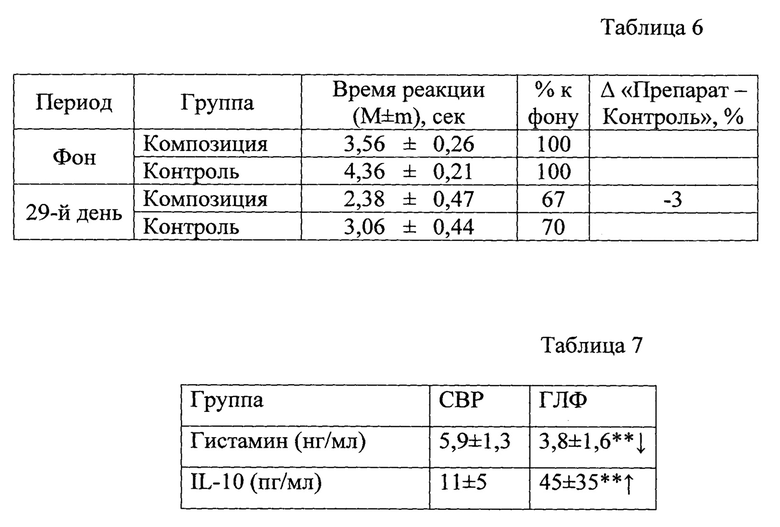
Для культивирования используется среда следующего состава: 5,0 г глюкоза, 5,0 г натрия хлорид, 1,0 г крахмал водорастворимый, 23,0 г пептон специальный, 0,30 г L-цистеин гидрохлорид, 15,0 г бактериологический агар. В 1 литре дистиллированной воды развести ингредиенты или 49,3 г готового порошка среды, хорошо перемешать и нагреть и часто помешивая довести до кипения. Кипятить в течение минуты до полного растворения. Стерилизовать 15 минут при 121°С при 1 атм. Охладить до 45-50°С, тщательно перемешать и разлить в чашки Петри. Штамм культивировали на агаре для роста анаэробных бактерий (CONDA, Италия). Инкубировали посевы в условиях анаэробного бокса (Bactron anaerobic chamber, США) в атмосфере трехкомпонентной газовой смеси (N2-80%; СО2-10%; Н2-10% в течение 48 часов). На Фиг. 2 изображены колонии Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) на Бруцелла-агаре. По характеристике клетки данного штамма грамположительны, каталазоотрицательны, неподвижны, не образуют спор. Форма клеток палочковидная, микроорганизмы являются облигатными анаэробами, при выращивании на среде штамм образует белые, глянцевые колонии выпуклой формы. В классификации микроорганизмов по группам патогенности СанПиН 1.2.3685-21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания» данный вид (род) не значится, а значит может быть использован в качестве пробиотического штамма.
Хранение штамма осуществляется в криопробирках в среде для хранения триптиказо-соевый бульон (Trypcase Soy broth, Bio Rad США), с добавлением 10% глицерина.
Штамм не имеет R-плазмид, транспозонов, конвертируемых бактериофагов (профагов), поэтому может быть использован при производстве пробиотиков. Устойчивость данного штамма к антибиотикам обусловлена хромосомной природой. Bifidobacterium longum subsp. longum 202_21 ((Bifidobacterium longum subsp. longum VKM B-3717D)) устойчив к амикацину и чувствителен к пиперациллину, цефотитану, цефексиму, ванкомицину, левофлоксацину амикацину, меропенему, метронидазолу, пиперециллину-тазобактаму, ампициллину, тигециклину, клиндамицину, азитромицину, тедизолиду, ципрофлоксацину. Штамм Bifidobacterium longum subsp. longum 202_21 ((Bifidobacterium longum subsp. longum VKM B-3717D) обладает однородными морфологическими, тинкториальными, культуральными свойствами без признаков диссоциации. У него отсутствует способность образовывать слизистые колонии и капсулы, которые являются признаками вирулентности бактериальных культур. Клетки активно сбраживают углеводы с образованием в основном уксусной и молочной кислоты в молярном соотношении 3:2. Образуются примеси муравьиной и янтарной кислот, а также этанола. Являются хемоорганотрофами, активно сбраживают сахарозу, галактозу, фруктозу, мальтозу, мелибиозу, раффинозу, лактозу. Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) не продуцирует каталазу, не образует индол и сероводород, не восстанавливает нитраты, не разжижает желатин, не продуцирует фенол, не образует аммиак из аргинина. Предельная активность кислотообразования достигает 120-130°Т. Производственный штамм Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D), расфасованный в первичную упаковку (флаконы), в лиофилизированном виде хранится при температуре плюс (6±8)°С, что обеспечивает его стабильность.
Пример 3. Анализ биохимической активности штаммов
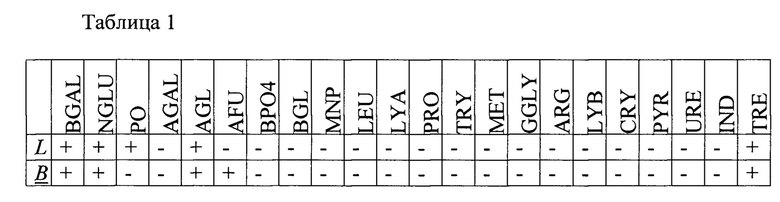
Результаты исследований биохимической активности отобранных пробиотических штаммов представлены в таблице 1. В таблице указаны следующие субстраты: BGAL- р-Нитрофенил-β-D-Галактопиранозид, NGLU-р-Нитрофенил-N-Ацетил-β-D-Глюкозаминид, AFU - р-Нитрофенил-α -D-Фукопиранозид, MNP - р-Нитрофенил-α -D-Маннопиранозид, URE - Мочевина, AGAL - р-Нитрофенил-α-D-Галактопиранозид, AGL - р-Нитрофенил-α-D-Глюкопиранозид, NIT - Нитрат, IND - Индол, BGL -о-Нитрофенил- -D-Глюкопиранозид, ВРО4 - бис-р-Нирофенил-фосфат, TRE - Трегалоза, РО4 - Р-Нирофенил-фосфат, LEU - L-Лейцин-β-Нафтиламид, МЕТ - DL-Метионин- β -Нафтиламид, LYB - L-Лизин- β -Нафтиламид (щелочь), LYA - L-Лизин- β -Нафтиламид (кислота), GGLY - Глицилглицин-β-Нафтиламид, GLY-Глицин- β -Нафтиламид, PRO - L-Пролин- β -Нафтиламид, ARG - L-Аргинин- β -Нафтиламид, PYR - L-Пирролидонил- β -Нафтиламид, TRY -L-Триптофан-β-Нафтиламид, IDX - 3-Индоксил фосфат. В таблице приведены сокращенные наименования субстратов, в отношении которых тестировалась биохимическая активность тестируемых культур микроорганизмов исключительно для удобства чтения данной таблицы. В таблице используются обозначения штаммов: L - Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D), В - Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D).
-D-Глюкопиранозид, ВРО4 - бис-р-Нирофенил-фосфат, TRE - Трегалоза, РО4 - Р-Нирофенил-фосфат, LEU - L-Лейцин-β-Нафтиламид, МЕТ - DL-Метионин- β -Нафтиламид, LYB - L-Лизин- β -Нафтиламид (щелочь), LYA - L-Лизин- β -Нафтиламид (кислота), GGLY - Глицилглицин-β-Нафтиламид, GLY-Глицин- β -Нафтиламид, PRO - L-Пролин- β -Нафтиламид, ARG - L-Аргинин- β -Нафтиламид, PYR - L-Пирролидонил- β -Нафтиламид, TRY -L-Триптофан-β-Нафтиламид, IDX - 3-Индоксил фосфат. В таблице приведены сокращенные наименования субстратов, в отношении которых тестировалась биохимическая активность тестируемых культур микроорганизмов исключительно для удобства чтения данной таблицы. В таблице используются обозначения штаммов: L - Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D), В - Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D).
По результатам исследований для штамма Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) получена следующая характеристика. Метаболизирует р-нирофенил-фосфат, L-лейцин-β-нафтиламид, р-нитрофенил-α-D-фукопиранозид, р-нитрофенил-α-D-маннопиранозид, 3-индоксил фосфат, мочевина, D-L-метионин-β-нафтиламид, L-аргинин-β-нафтиламид, р-нитрофенил- β-D-галактопиранозид, р-нитрофенил-α-D-глюкопиранозид, L-лизин-β-нафтиламид(щелочь), L-лизин-β-нафтиламид (кислота), глицилглицин-β-нафтиламид, глицин-β-нафтиламид, L-пролин-β-нафтиламид, L-пирролидонил- β-нафтиламид, L-триптофан- β-нафтиламид, трегалозу. Не ферментирует р-нитрофенил-N-ацетил- β-D-глюкозаминид, р-нитрофенил-α-D-галактопиранозид, нитрат, индол, бис-р-нирофенил-фосфат, о-нитрофенил-β-D-глюкопиранозид.
По результатам исследований для штамма Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) получена следующая характеристика. Метабилизирует мочевину, D-L-метионин-β-нафтиламид, L-аргинин-β-нафтиламид, р-нитрофенил- β-D-галактопиранозид, р-нитрофенил-N-ацетил- β-D-глюкозаминид, L-лизин-β-нафтиламид(щелочь), L-лизин-β-нафтиламид (кислота), глицилглицин-β-нафтиламид, глицин-β-нафтиламид, L-пролин-β-нафтиламид, L-пирролидонил-β-нафтиламид, L-триптофан- β-нафтиламид, трегалоза, L-лейцин-β-нафтиламид. Не ферментирует р-нитрофенил-α-D-галактопиранозид, индол, р-нирофенил-фосфат.
Пример 4. Анализ антагонистической активности штаммов
Оценка антагонистической активности и ассоциированных с ней фенотипических и молекулярно-генетических характеристик штаммов Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM В-3711D) и Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) проводилась в соответствии с методикой, приведенной в патенте на изобретение RU 2670585 С1, 23.10.2018 «Комбинированная система культивирования (КСК)». Результаты оценивались по степени задержки роста тестируемой культуры.
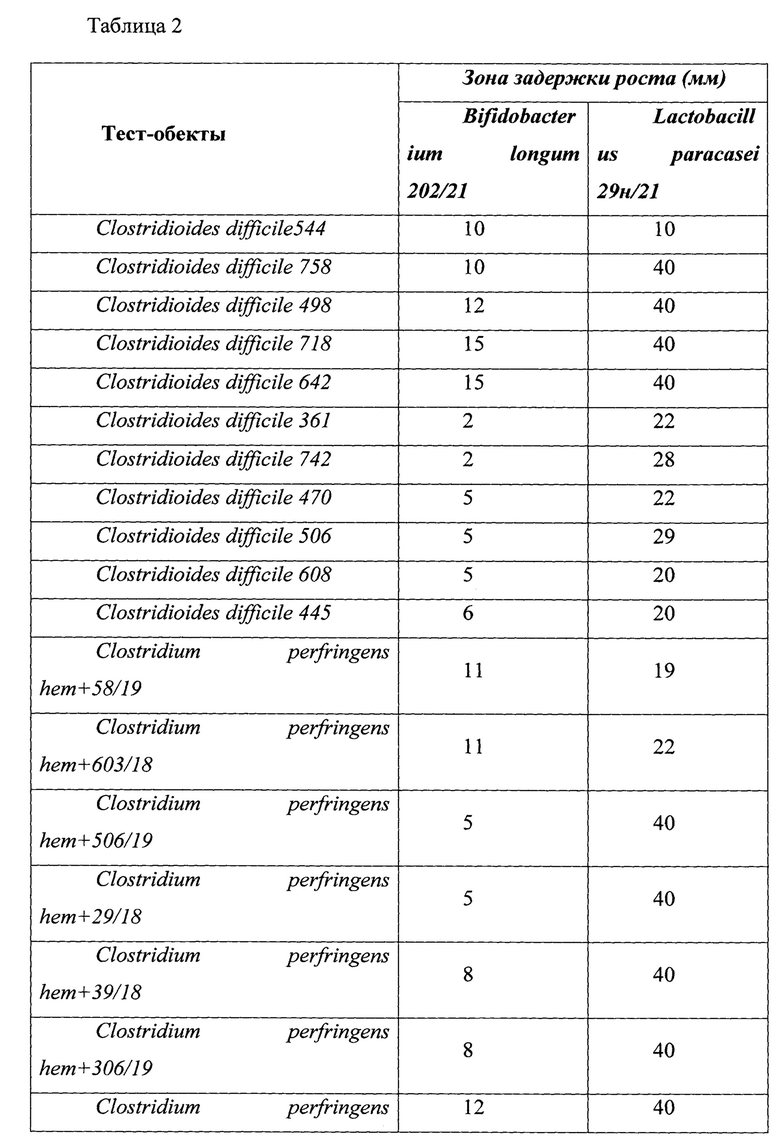
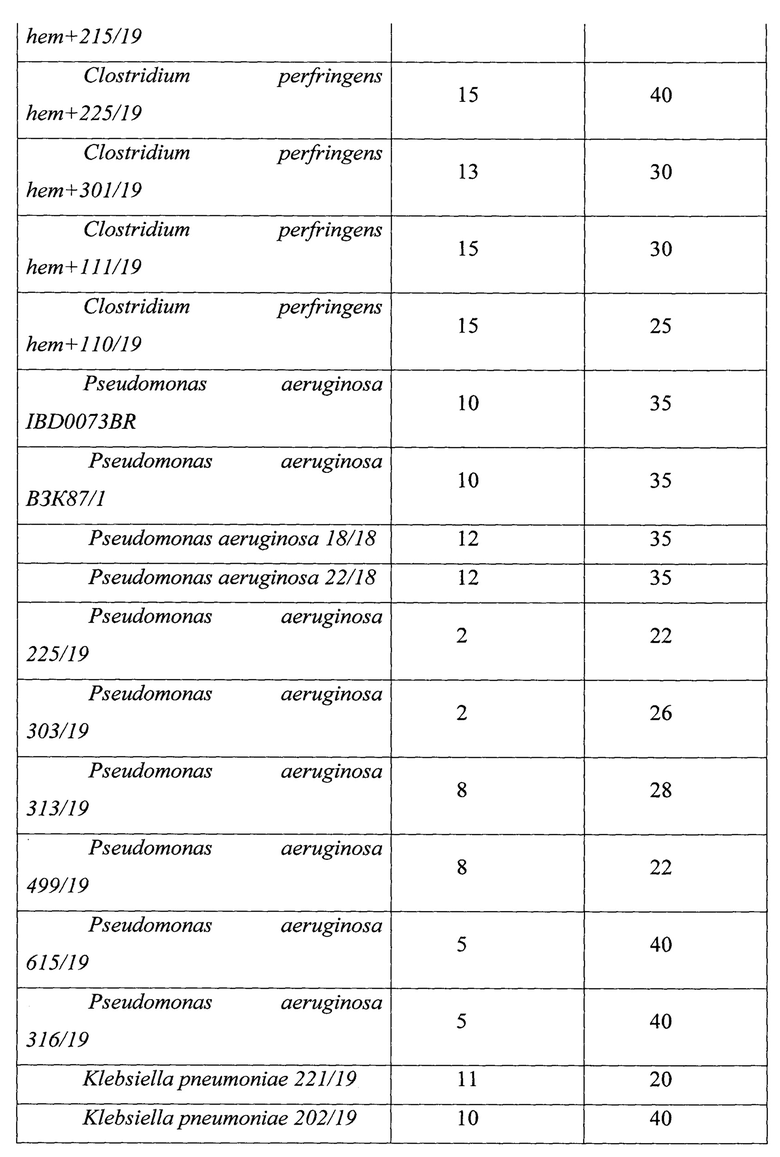
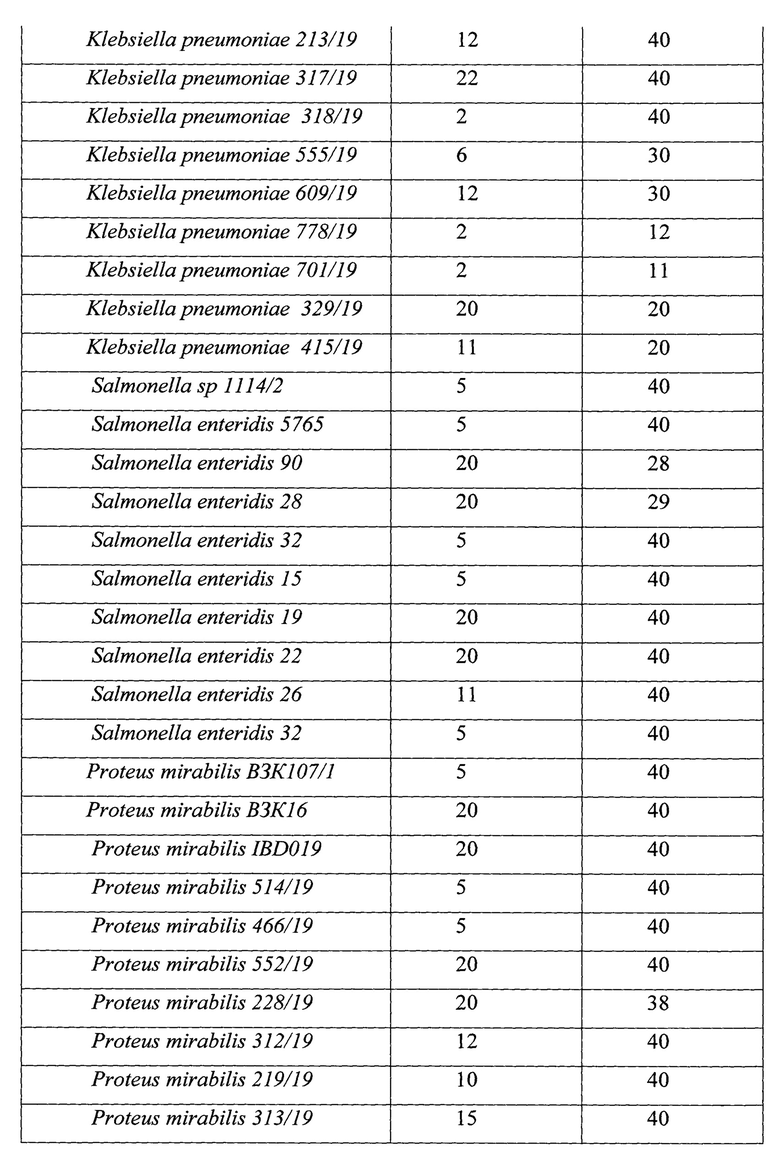
Результаты определения антагонистической активности представлены в табл. 2.
Как видно из данных, представленных в табл. 2, у штаммов, отобранных в качестве кандидатных пробиотических штаммов, определяется более высокая активность в отношении токсигенных штаммов Clostridioides difficile и панрезистентных штаммов микроорганизмов, выделенных от пациентов с гнойно-воспалительными осложнениями после перенесенных оперативных вмешательств и являющихся этиологическими агентами гнойно-воспалительных процессов. Пробиотически активные штаммы проявляли высокую антагонистическую активность в отношении патогенных микроорганизмов.
Штаммы Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) и Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) обладают высокой антагонистической активностью в отношении 71% токсигенных штаммов Clostridioides difficile.
Таким образом, результаты эксперимента показывают, что отобранные штаммы пробиотических микроорганизмов Lacticaseibacillus paracasei subsp. paracasei 29n_27 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) и Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) обладают высокой антагонистической активностью в отношении патогенных и условно-патогенных микроорганизмов, вместе с тем устойчивы к действию продуцируемых ими веществ, обуславливающих антагонистические свойства, а это означает, что их можно использовать в составе комбинированного пробиотического препарата.
Пример 5. Анализ совместимости штаммов друг с другом
При создании пробиотического поливалентного препарата, состоящего из нескольких штаммов микроорганизмов, большое значение имеет их совместимость, а также отсутствие антагонистической активности друг против друга, что определяет отсутствие подавления роста штаммов, входящих в консорциум микроорганизмов, составляющих пробиотический препарат.
Для определения совместимости штаммов Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) и Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp.longum VKM B-3717D) была исследована антагонистическая активность монокультур пробиотических штаммов в отношении друг друга в условиях in vitro. Антагонистическая активность тест-штаммов относительно друг друга оценивалась в рамках разработанной ad hoc, методики, базирующейся на принципе двухэтапного культивирования микроорганизма-антагониста и тестируемой культуры в условиях комбинированной системы.
Комбинированная система культивирования (КСК) конструировалась следующим образом: изготовленная традиционным способом пластинка агара Де Манна-Рогоза-Шарпе (MRS-агара) или Brucella agar с 5% бараньих эритроцитов, заключенная в рабочее пространство пластиковой вентилируемой чашки Петри диаметром 90 мм однократного применения, рассекалась стерильным скальпелем строго по диаметру чашки, после чего одна из двух половин агаровой пластинки удалялась, и освободившееся таким образом, пространство заливалось расплавленным MRS-агаром до уровня, однозначно заданного толщиной пластинки первоначального агара.
Данные по антагонистической активности тестируемых штаммов Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) и Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) в отношении друг друга представлены в табл. 3.
По результатам изучения межштаммовых взаимоотношений исследуемые штаммы проявили биосовместимые взаимоотношения, т.е. не обладали антагонистической активностью друг против друга.
Пример 6. Анализ устойчивости штаммов к действию желудочного сока
Было проведено определение устойчивости пробиотического лекарственного средства на основе пробиотических штаммов Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) и Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) к действию желудочного сока. Для определения использовали образцы 48-часовой культуры штаммов микроорганизмов, которую суспендировали в 0,9% растворе натрия хлорида до получения мутности бактериальной взвеси 1McF и по 1 мл полученной суспензии добавляли к 9 мл желудочного сока. После 30 и 120 минут инкубации при температуре (37±1)°С в анаэробной атмосфере определяли количество жизнеспособных клеток, используя метод десятикратных разведений с высевом по 100 мкл на соответствующие питательные среды с последующим учетом колоний после 48 часов инкубации при температуре (37±2)°С в анаэробных атмосферных условиях.
Результаты оценки устойчивости пробиотических штаммов к действию желудочного сока представлены в табл. 4. Результаты эксперимента показывают высокий уровень устойчивости Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) и Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) к действию желудочного сока, что означает высокий уровень сохранности количественного состава данных пробиотических штаммов при прохождении через кислую среду желудка.
Пример 7. Пробиотический эффект штаммов
Для доказательства пробиотического эффекта композиции на основе пробиотичских штаммов Lacticaseibacillus paracasei subsp. paracasei 29n_21 (Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D) и Bifidobacterium longum subsp. longum 202_21 (Bifidobacterium longum subsp. longum VKM B-3717D) было проведено следующее исследование. Экспериментальным животным (крысам стока Wistar) однократно перорально вводили пробиотическую композицию и ежедневно собирали пробы фекалий (до введения пробиотической композиции, через 24 и 48 часов после введения). На Фиг. 3 представлены результаты мониторинга композиционного состава кишечной микрофлоры с помощью анализа вариабельных областей 16S рРНК для четырех крыс. По результатам анализа было показано, что однократное введение композиции вызывает изменения в составе микробиомов и оказывает пробиотический эффект.
Пример 8. Влияние введения пробиотической композиции на улучшение когнитивных способностей животных
Влияние введения пробиотической композиции на когнитивные способности животных тестировали в модели умеренного хронического стресса. Моделирование стресса проводили путем комплексного (совместного) воздействия следующих факторов: световой десинхроноз (круглосуточное освещение в комнате содержания животных в течение первых 14 дней эксперимента), умеренная депривация корма и воды (изъятие кормушек и поилок сутки через сутки - в 1, 3, 5, 7, 9, 11, 13 дни эксперимента), электрокожное раздражение/плавание (пятикратно в течение эксперимента, 1 раз в 7 дней, в режиме поведенческих тестов). Результаты биохимических исследований и поведенческих тестов подтвердили, что такая схема воздействия к 15-ым суткам эксперимента приводит к формированию у животных стрессового состояния. В исследовании были сформированы 2 группы животных: группа экспериментальных животных, которым в течение следующих 14 суток после моделирования стрессового состояния ежедневно перорально вводили физиологический раствор и группа животных, которым в течение следующих 14 суток после моделирования стрессового состояния ежедневно перорально вводили пробиотическую композицию.
Для анализа когнитивных способностей животных использовали установку «Темная/светлая камера» в тестировании условного рефлекса активного избегания (УРАИ). Каждое животное помещается в камеру «Шелтер». К программному обеспечению фирмы-производителя применяется следующий сценарий: 5 секунд - свет; 2 секунды - звук, 5 секунд - электрораздражение на электродный пол камеры. Суммарный цикл (12 секунд) повторяется 5 раз. Таким образом, общее время теста составляет 1 минуту, после чего крыса извлекается из камеры и возвращается в клетку. При первом тестировании (фоновые данные) крысы обучаются переходить из одного отсека камеры в другой таким образом, чтобы не получить электрокожного раздражения, запоминая, что в отсеке камеры, где они находятся, поочередно включаются свет, звук и электроток. В аналогичном режиме с опытной группой тестируется контрольная группа, являющаяся объектом сравнения. Регистрируется время реакции по каждому циклу в секундах, а также суммарное перемещение (пройденный путь) в метрах. Вычисляется среднее значение по времени реакции и перемещению, ошибка среднего, % к фоновым данным и разница с учетом аналогичного результата в контрольной группе.
Результаты исследований отражены в Табл. 5 и 6.
После двух недель введения пробиотической композиции (29-й день) по сравнению с группой Контроль детектируется снижение времени реакции, свидетельствующее об улучшении когнитивных функций и консолидации памяти. Наблюдаемые эффекты сопряжены со снижением локомоторной активности. Таким образом, по анализу когнитивных функций установлено позитивное терапевтическое (противострессовое, ноотропное) действие фармацевтической композиции.
Пример 9. Антидепрессивный эффект пробиотической композиции
Антидепрессивный эффект пробиотической композиции тестировали в модели умеренного хронического стресса у крыс. Моделирование стресса проводили путем комплексного (совместного) воздействия следующих факторов: световой десинхроноз (круглосуточное освещение в комнате содержания животных в течение первых 14 дней эксперимента), умеренная депривация корма и воды (изъятие кормушек и поилок сутки через сутки - в 1, 3, 5, 7, 9, 11, 13 дни эксперимента), электрокожное раздражение/плавание (пятикратно в течение эксперимента, 1 раз в 7 дней, в режиме поведенческих тестов). Результаты биохимических исследований и поведенческих тестов подтвердили, что такая схема воздействия к 15-ым суткам эксперимента приводит к формированию у животных стрессового состояния. В исследовании были сформированы 2 группы животных: группа экспериментальных животных, которым в течение следующих 14 суток после моделирования стрессового состояния ежедневно перорально вводили физиологический раствор и группа животных, которым в течение следующих 14 суток после моделирования стрессового состояния ежедневно перорально вводили пробиотическую композицию.
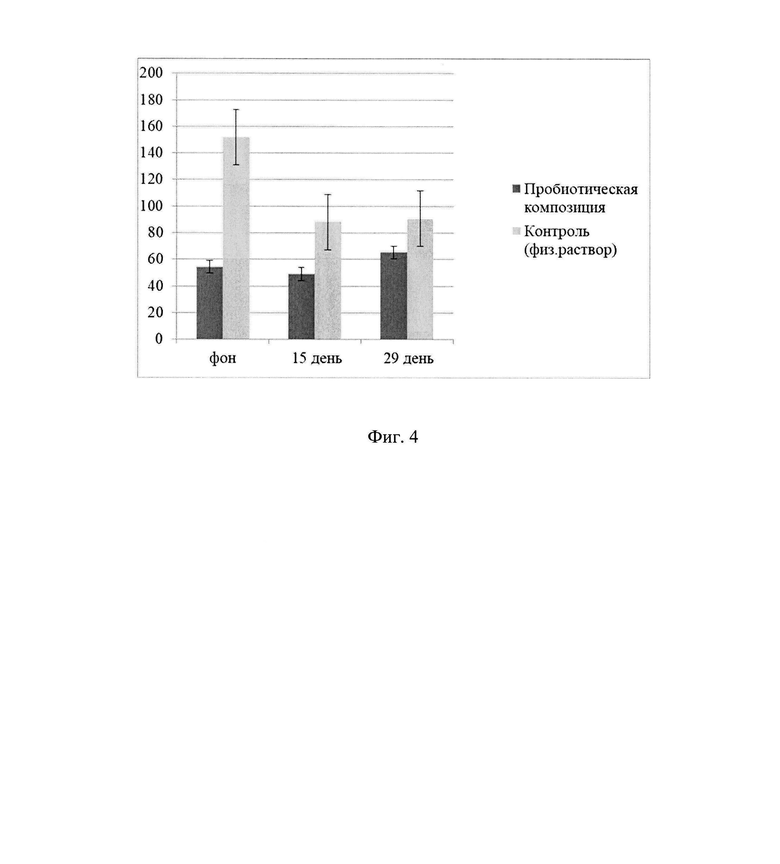
Для оценки депрессивного поведения (в частности, «отчаяния») применяли классический тест принудительного плавания (по Порсолту). При тестировании крыс без резких движений на 6 минут погружали в прозрачный пластиковый цилиндр, наполненный водой (температура 26-28°С) таким образом, чтобы животное не имело возможности опереться задними конечностями или хвостом о дно цилиндра. При начале активных плавательных движений животного включали секундомер, при завершении секундомер ставили на паузу. Поведенческим показателем в данном тесте служило соотношение периодов активности и полной недвижимости - индекс депрессивности (ИД).
Результаты исследований отражены на Фиг. 4. На 15 день исследования длительность активного плавания экспериментальных животных снижается по сравнению с фоновыми данными, что свидетельствует о пребывании животных в стрессовом состоянии. На 29 сутки эксперимента показатели активного плавания животных преимущественно восстанавливаются.
Пример 10. Влияние введения пробиотической композиции на воспалительный процесс
Противовоспалительное действие пробиотической композиции показано в следующем эксперименте. Крысам стока Wistar в дополнение к стандартному корму для лабораторных грызунов, в течение 28 дней внутрижелудочно вводили 2 г жиров и 1 г сахарозы в виде смеси в физиологическом растворе (4 мл), индуцируя первичное висцеральное ожирение. Далее под общим изофлурановым кратковременным наркозом путем одноразового ректального введения 1 мл смеси 3% раствора уксусной кислоты и этанола вызывали химически индуцированное воспалительное заболевание толстой кишки, индуцируя острое воспаление толстого кишечника. Корм на сутки убирали. После этого в течение 3-х дней внутрижелудочно вводили 1 мл раствора смеси антибиотиков (амоксициллина, метронидазола и кларитромицина) в суточной дозе по 15 мг каждого препарата, провоцируя антибиотик-индуцированный дисбиоз. После этого вводили пробиотическую композицию 1 раз в сутки перорально в течение 7 суток. Животным контрольной группы по аналогичной схеме вводили физиологический раствор.
Для исследований производили забор крови из задней полой вены животных и анализировали содержание маркеров воспаления (Таблица 7). В таблице указаны средние показатели (у.е.) ИФА-исследований крови крыс, значком «**» обозначены статистически значимые отличия в группе животных, которым вводили пробиотическую композицию (ГЛФ) по отношению к группе с моделированием системного воспаления (СВР), знаком «↓» отмечено значимое уменьшение, знаком «↑» - значимое увеличение показателя. По результатам иммуноферментного анализа было показано статистически значимое увеличение концентрации интерлейкина 10 и уменьшение концентрации гистамина в крови, что свидетельствует о противовоспалительном эффекте пробиотической композиции.

| название | год | авторы | номер документа |
|---|---|---|---|
| Композиция пробиотического средства на основе штаммов бактериальных культур Pediococcus acidilactici VKM B-3708D (Pediococcus acidilactici 385,) Lacticaseibasillus paracasei VKM B-3709D (Lacticaseibasillus paracasei CTR079) и Weisella cibaria VKM B-3710D (Weisella cibaria 079_18), предназначенного для профилактики и терапии антибиотико-ассоциированной инфекции и терапии функциональных заболеваний кишечника | 2023 |
|
RU2831863C1 |
| Способ получения готовой лекарственной формы пробиотического средства на основе штаммов Bifidobacterium longum subsp. longum и Lacticaseibacillus paracasei subsp. paracasei | 2023 |
|
RU2829576C1 |
| Способ повышения эффективности ингибиторов иммунных контрольных точек при помощи терапевтической композиции на основе производных индола и пробиотика | 2023 |
|
RU2826495C1 |
| ШТАММ LACTOBACILLUS PARACASEI SUBSPECIES PARACASEI, ОБЛАДАЮЩИЙ АНТИМИКРОБНЫМИ И ИММУНОМОДУЛИРУЮЩИМИ СВОЙСТВАМИ, И ПИЩЕВОЙ ПРОДУКТ НА ЕГО ОСНОВЕ | 2009 |
|
RU2501850C2 |
| ШТАММ БАКТЕРИЙ LACTICASEIBACILLUS PARACASEI SUBSP. PARACASEI 1338 ВКМ B-3753D ДЛЯ ПРОИЗВОДСТВА КИСЛОМОЛОЧНЫХ ПРОДУКТОВ И В КАЧЕСТВЕ ПРОБИОТИКА | 2023 |
|
RU2816652C1 |
| ШТАММ LACTOBACILLUS PARACASEI SUBSP. PARAСASEI, ПИЩЕВОЙ ПРОДУКТ И НАТУРОПАТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЕ ЭТОТ ШТАММ | 1998 |
|
RU2205871C2 |
| ПРИМЕНЕНИЕ LACTOBACILLUS PARACASEI CNCM I-2116 ДЛЯ ЛЕЧЕНИЯ СИНДРОМА РАЗДРАЖЕННОГО КИШЕЧНИКА | 2003 |
|
RU2490325C2 |
| ШТАММ БАКТЕРИЙ BIFIDOBACTERIUM LONGUM Z4 ДЛЯ ПРИГОТОВЛЕНИЯ БАКТЕРИЙНЫХ ПРЕПАРАТОВ, НОРМАЛИЗУЮЩИХ МИКРОФЛОРУ ПРИ НАРУШЕНИЯХ МИКРОБИОЦЕНОЗА ВЛАГАЛИЩА | 1998 |
|
RU2151606C1 |
| ПРОБИОТИЧЕСКИЙ ШТАММ Bifidobacterium longum, ПРОБИОТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЯ ШТАММА Bifidobacterium longum | 2008 |
|
RU2466185C2 |
| СИНБИОТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ КОРРЕКЦИИ ДИСБИОТИЧЕСКИХ НАРУШЕНИЙ МИКРОБИОЦЕНОЗА ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2015 |
|
RU2592988C1 |
Изобретение относится к биотехнологии. Предложена композиция пробиотического средства, предназначенного для терапии и профилактики патологических состояний, возникающих на фоне нарушения регуляции взаимодействий оси «кишечник-мозг», содержащая лиофилизат живых клеток двух пробиотических штаммов бактериальных культур Bifidobacterium longum subsp. longum VKM B-3717D и Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D в сахаро-желатиновой среде или в обезжиренном молоке с добавлением перед лиофилизацией N-ацетилглюкозамина или лакто-N-биозы (C14H25NO11) до конечной концентрации в среде не менее 0,1 мг/мл и все или один из компонентов - 30 мг хитозана, 50 мг сахарозы, 70 мг лактозы, размещенная в одном пенициллиновом флаконе или в 1 кишечнорастворимой желатиновой капсуле №3, при этом 1 терапевтическая доза содержит 7⋅107 КОЕ жизнеспособных штаммов Bifidobacterium longum subsp. longum VKMB-3717D и Lacticaseibacillus paracasei subsp. paracasei VKMB-3711D. Изобретение расширяет арсенал пробиотических средств, обладающих антагонистической активностью в отношении патогенных, условно-патогенных микроорганизмов. 4 ил., 7 табл., 10 пр.
Композиция пробиотического средства, предназначенного для терапии и профилактики патологических состояний, возникающих на фоне нарушения регуляции взаимодействий оси «кишечник-мозг», содержащая лиофилизат живых клеток двух пробиотических штаммов бактериальных культур Bifidobacterium longum subsp. longum VKM B-3717D и Lacticaseibacillus paracasei subsp. paracasei VKM B-3711D в сахаро-желатиновой среде или в обезжиренном молоке с добавлением перед лиофилизацией N-ацетилглюкозамина или лакто-N-биозы (C14H25NO11) до конечной концентрации в среде не менее 0,1 мг/мл и все или один из компонентов - 30 мг хитозана, 50 мг сахарозы, 70 мг лактозы, размещенная в одном пенициллиновом флаконе или в 1 кишечнорастворимой желатиновой капсуле №3, при этом 1 терапевтическая доза содержит 7⋅107 КОЕ жизнеспособных штаммов Bifidobacterium longum subsp. longum VKMB-3717D и Lacticaseibacillus paracasei subsp. paracasei VKMB-3711D.
| ШТАММ KBL396 LACTOBACILLUS PLANTARUM И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764639C1 |
| КОМПЛЕКСНЫЙ ПРОБИОТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2491079C1 |
| RU 2755083 C2, 15.09.2021 | |||
| FROLOVA M | |||
| et al | |||
| Lacticaseibacillus paracacei: occurrence in the human gut microbiota and r-mer-based assessment of intraspecies diversity; Life, 2021, N 11, 1246, p | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2024-12-09—Публикация
2023-12-06—Подача