Изобретение относится к области медицины и касается средства коррекции дисбиотических нарушений микробиоценоза желудочно-кишечного тракта.
На протяжении многих десятилетий внимание клиницистов разных стран приковано к проблеме изучения состава нормальной микрофлоры и ее возможных нарушений, что неслучайно, так как нарушения микрофлоры встречаются все чаще, сопровождаются самой разнообразной симптоматикой, носят массовый характер и выявляются практически среди всех слоев населения. Многие исследователи наблюдаемое увеличение частоты и тяжести острых инфекционных заболеваний, торпидное течение и хронизацию воспалительных процессов объясняют развивающимися или уже имевшими место нарушениями микробиоты, сопровождающими основную болезнь. В связи с этим, в настоящее время большое внимание уделяется нарушениям микроэкологии человека, и в первую очередь, нарушению нормофлоры одного из наиболее сложных микробиоценозов - микробиоты кишечника, так как возникшие нарушения микробного пейзажа кишечника играют немаловажную, а порой и решающую роль в развитии и течении широкого спектра заболеваний местного и общего характера.
Столь пристальное внимание в современной медицинской науке к микрофлоре кишечника и ее значению в жизнедеятельности человека связано с тем, что она составляет основу микроэкологии макроорганизма и оказывает непосредственное влияние на его состояние, выполняя ряд жизненно важных функций. Это обменная и синтетическая функции, функция деток-сикации, участие в процессах пищеварения и формирования естественного иммунитета человека, обеспечение колонизационной резистентности и другие. Изменение качественного и/или количественного состава кишечного микробиоценоза приводит к нарушению процессов усвоения нутриентов и минорных компонентов пищи и уменьшению поступления в организм человека целого ряда биологически активных веществ (БАВ) и витаминов, что проявляется, в первую очередь, в виде кишечных расстройств, изменений статуса питания и психоэмоциональных дисфункций.
При коррекции дисбиотических нарушений микрофлоры кишечника проводят комплекс мероприятий с учетом клинических проявлений основного заболевания и степени выраженности дисбиотических нарушений кишечного микробиоценоза, а также данных лабораторных исследований микрофлоры указанного биотопа и состояния реактивности организма. При этом нормальная микрофлора кишечника рассматривается как качественное и количественное соотношение популяций микробов, а ее нарушения - клинико-лабораторный синдром, характеризующийся изменением качественного и/или количественного состава нормофлоры биотопа, а также метаболическими и иммунными нарушениями, сопровождающимися у части пациентов клиническими симптомами [1].
Причины возникновения кишечного дисбактериоза самые разнообразные и носят экзогенный и эндогенный характер. Достаточно распространенными в настоящее время являются нарушение режима питания, переедание или перекусы на бегу, плохая экология, курение, стресс и переутомление, хронические заболевания и многое другое. Ввиду того, что микробиоценоз является эволюционно сложившейся и четко интегрированной системой, которая обеспечивает слаженную работу всех органов и систем и базируется до известной степени на принципе саморегуляции, то возникающие изменения симбиотической микрофлоры в ряде случаев восстанавливаются самопроизвольно. В более отягощенных ситуациях, ассоциированных с возникновением дисбактериоза 1 степени выраженности возникших нарушений, для нормализации микрофлоры кишечника предусматривается курс заместительной терапии. Значимую роль при этом играет дифференцированное применение различных иммунобиологических препаратов.
Спектр иммунобиологических препаратов для коррекции дисбиотических нарушений кишечника достаточно широк. Большой интерес в клинической практике представляют биологические препараты из группы пробиотиков, включающие определенные виды непатогенных для человека микроорганизмов и вещества микробного происхождения, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма через оптимизацию и стабилизацию его микроэкологического статуса [2]. К их числу относятся, прежде всего, бифидо- и лакто-содержащие средства для регулирования равновесия кишечной микрофлоры, так как бифидо- и лактобактерии играют важнейшую роль в обеспечении нормального функционирования кишечника. В случае возникновения дисбиотических нарушений указанные анаэробные бактерии претерпевают изменения в первую очередь. Поэтому чрезвычайно важно использование препаратов на их основе.
Препаратами выбора в ряде клинических ситуаций являются пробиотические комплексы Линекс и Бифиформ [3, 4], действующим началом которых являются живые бактерии. Так, в состав Линекса, производимого фармацевтической фирмой «Лек» (Словения), включен сбалансированный комплекс молочнокислых бактерий: лактобактерии Lactobacillus acidophilus, бифидобактерии Bifidobacterium infantis и энтерококки Enterococcus faecium. В отличие от Линекса в состав Бифиформа, производимого датской фармацевтической компанией «Ферросан Интернейшнл А/С», помимо бифидобактерий Bifidobacterium longum (штамм АТСС 15707) и энтерококков Enterococcus faecium (штамм SF68) от микробиологической лаборатории «Кристиан Хансен» (Дания) включена особая питательная среда для их питания, роста и размножения. Кроме того, Бифиформ не содержит лактозу, вследствие чего показан пациентам с ее непереносимостью.
Входящие в состав препаратов бактерии предназначены для регулирования физиологического равновесия кишечной микрофлоры путем продукции молочной кислоты, в меньшей степени уксусной и пропионовой кислот. Создаваемая в результате кислая среда является неблагоприятной для развития патогенных и условно-патогенных микроорганизмов. Полезные бактерии лиофильно высушены и расфасованы в специальные защитные капсулы, что обеспечивает их надежную защиту от разрушения под воздействием желудочного сока и позволяет донести в неизмененном виде непосредственно до кишечника и там высвободить.
Однако, помимо благоприятных эффектов препаратам Линекс и Бифиформ характерен ряд существенных недостатков, ограничивающих возможности их широкого применения в клинической практике. Прежде всего, нельзя утверждать, что входящие в их состав бактерии близки представителям собственной индигенной микрофлоры различных отделов кишечника и способны в нем размножаться. Одной из основных причин этого является их недостаточная биосовместимость с резидентными бактериями кишечника. Индивидуальная биосовместимость микроорганизмов, вносимых в составе указанных препаратов, и их приживаемость не гарантированы. Искусственно введенные в составе Линекса и Бифиформа микроорганизмы, как правило, стойко не приживаются в организме и после прекращения их приема быстро элиминируются из кишечника и замещаются случайной микрофлорой. Соответственно, низка вероятность выполнения указанными бактериями, внесенными в макроорганизм извне, своей основной функции (заместительной) и тем более за короткий промежуток времени.
Кроме того, механизм действия входящих в состав указанных препаратов микроорганизмов носит транзиторный характер, они не колонизируют в кишечнике, в связи с чем их благоприятный эффект продолжается практически только в период курсового приема. Поэтому, как правило, назначают их достаточно длительно (не менее 3-4 недель) и рекомендуют прием по 1-2 капсулы не реже 3 раз в день. А так как стоимость указанных препаратов достаточно велика (300-400 рублей за 30 капсул), то данное обстоятельство, связанное с необходимостью их длительного приема, также существенно ограничивает доступность Линекса и Бифиформа для широких слоев населения.
Линекс и Бифиформ рекомендуют для лечения и профилактики дисбиотических нарушений различной этиологии. При этом используют их в схемах коррекции подобных нарушений кишечника лишь на втором этапе с целью заместительной терапии. В составы указанных препаратов включены штаммы бактерий с достаточно высоким уровнем антибиотикорезистентности и зачастую рекомендуют их применение одновременно с антибиотиками. Однако, опыт использования указанных средств в клинической практике с широким спектром антибактериальных препаратов при рекомендуемых схемах их назначения показал, что большая часть бактерий при таком сочетанном назначении гибнет, а активность попавших в кишечник в жизнеспособном состоянии чрезвычайно низка.
Известно также, что одним из перспективных направлений профилактики нарушений состава микробиоты кишечника является использование препаратов, которые в своем составе содержат не живые микроорганизмы (например, Бифидобактерин, Лактобактерии, Споробактерин, Ламинолакт, Линекс, Бифиформ и др.), а метаболиты пробиотических штаммов микроорганизмов [5,6].
В клинической практике для восстановления и поддержания оптимальных микроэкологических параметров в кишечнике из числа подобных средств достаточно широкое применение находит пробиотический комплекс Бактистатин [7], в состав которого включены (мас. %): стерилизованная культуральная жидкость (СКЖ), полученная при культивировании бактерий вида Bacillus subtilis и содержащая их метаболиты (1,0), гидролизат соевой муки (20,0), природный минерал цеолит (78,0) и стеарат кальция (СК) или аэросил (1,0). Указанный пробиотический комплекс по составу, механизму воздействия на организм и достигаемому благоприятному эффекту наиболее близок к заявляемой синбиотической композиции и принят в качестве средства-прототипа.
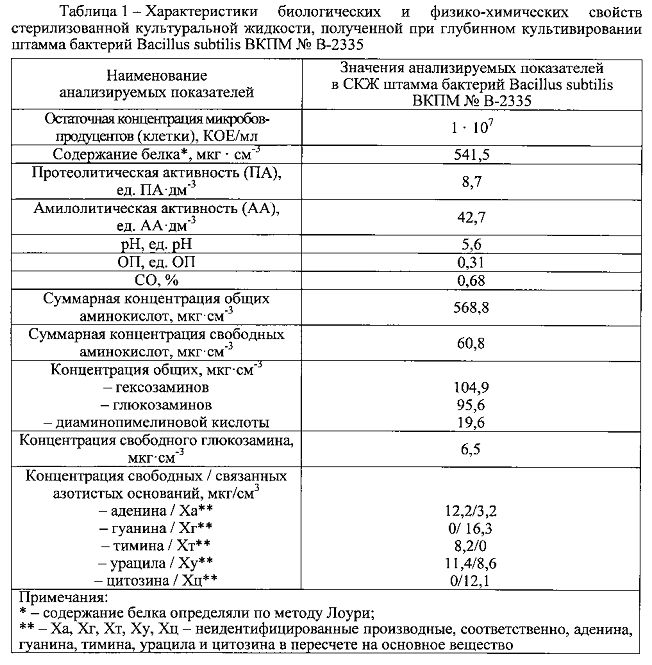
Основу средства-прототипа составляют иммобилизованные на цеолите БАВ, синтезируемые бактериями Bacillus subtilis при глубинном выращивании, которые и обусловливают благоприятный эффект данного пробиотического комплекса. Перечень их достаточно обширен и включает разнородные по химическому составу и биологическим свойствам вещества: протеолитические и амилолитические ферменты, аминокислоты, полисахариды (гексозамин, глюкозамин), витамины группы В (пиридоксина гидрохлорид, рибофлавин), азотистые основания и их производные (аденин, гуанин, тимин, урацил, цитозин) [8-10]. Перечисленные БАВ, синтезируемые бактериями Bacillus subtilis, оказывают положительное влияние на макроорганизм в целом. Среди них особую значимость имеют природные антибактериальные субстанции (бактериоцины, лизоцим и др.), которые селективно подавляют рост и размножение патогенных и условно-патогенных микроорганизмов в кишечнике, не влияя при этом на симбионтную микрофлору.
Цеолит, входящий в состав средства-прототипа, выполняет функции адсорбента метаболитов бацилл Bacillus subtilis и их носителя. Основное его предназначение заключается в иммобилизации метаболитов, синтезируемых бациллами при культивировании и сконцентрированных в культуральной жидкости, и доставке их в качестве носителя в кишечник.
Важная составная часть средства-прототипа - ГСМ - является, с одной стороны, частью защитной среды метаболитов, во многом отвечающей за прочность их сорбции на поверхности цеолита, а с другой стороны, - источником аминокислот, обеспечивающим питательные потребности нормальной микрофлоры кишечника и клеток макроорганизма. Основной компонент ГСМ - соевый олигосахарид (SOE) - обладает бифидогенными свойствами [11].
СК или аэросил включены в состав средства-прототипа в качестве технологической добавки.
Основным предназначением средства-прототипа является восстановление и поддержание оптимальных микроэкологических параметров в кишечнике путем введения в организм веществ, сдерживающих развитие патогенов и стимулирующих развитие полезных микроорганизмов. Так, практически доказана возможность применения средства-прототипа при коррекции нарушений состояния микробиоты и лечения ряда заболеваний ЖКТ путем нормализации микроэкологических условий в кишечнике. Кроме улучшения соматических симптомов у больных на фоне проведения терапии снижался уровень депрессии и невротизации [12].
Вместе с тем, наряду с указанными благоприятными эффектами для средства-прототипа характерен ряд недостатков:
- ограниченная биологическая активность, выражающаяся в недостаточных уровнях специфической антагонистической активности в отношении ряда патогенов и иммунобиологической реактивности организма, что связано с использованием в его составе только одного вида микроорганизмов (Bacillus subtilis);
- невозможность концентрирования культуральной жидкости, полученной на соевой среде с использованием ГСМ, ввиду ее высокой вязкости;
- использование в технологическом процессе получения средства-прототипа в качестве питательной среды нативной соевой муки не позволяет в полной мере использовать питательные свойства исходного сырья. Требуется дополнительное проведение химического или ферментативного гидролиза соевой муки, что существенно усложняет технологию получения средства-прототипа;
- использование для обеспечения питательных потребностей нормальной микрофлоры кишечника и клеток макроорганизма труднодоступного и неполноценного по аминокислотному составу дорогостоящего пищевого продукта - ГСМ, содержащего в своем составе только две незаменимые аминокислоты (лизин и метионин), причем в весьма незначительных количествах (0,2% и 0,096%, соответственно).
Отмеченные недостатки существенно ограничивают возможности широкого использования средства-прототипа при коррекции дисбиотических нарушений микробиоценоза кишечника.
Целью изобретения явилось повышение эффективности коррекции дисбиотических нарушений микробиоценоза кишечника за счет использования поликомпонентной синбиотической композиции на основе сбалансированного комплекса биологически активных веществ, обеспечивающих благоприятное влияние на индигенную составляющую микрофлоры кишечника, достаточные уровни специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов и неспецифической резистентности организма, не содержащей опасные для здоровья вещества, нетоксичной, не обладающей сенсибилизирующим действием, способностью к кумуляции, токсическим влиянием на репродуктивную функцию, мутагенным эффектом и отдаленными негативными последствиями, стабильной при хранении и доступной для широких слоев населения.
Достижение поставленной цели возможно за счет создания поликомпонентной синбиотической композиции, качественный и количественный состав которой позволит нормализовать микробиоценоз кишечника как за счет обеспечения специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов и поддержания его естественной индигенной составляющей, так и путем повышения неспецифической резистентности организма
При формировании качественного и количественного состава заявляемой синбиотической композиции, предназначенной для коррекции дисбиотических нарушений микробиоценоза кишечника, исходили из того, что основные ее компоненты должны:
- оказывать эффективное благоприятное влияние на индигенную составляющую микрофлоры кишечника;
- обеспечивать достаточный уровень специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов, с которыми, как правило, ассоциированы д исбиотические нарушения биотопа;
- оказывать влияние на факторы неспецифической резистентности организма и стимулировать функциональную активность иммунокомпетентных клеток.
Для этого в состав заявляемой синбиотической композиции включены: пробиотическая составляющая, представляющая собой рациональную комбинацию живых пробиотических микроорганизмов и метаболитов пробиотических микроорганизмов, пребиотическая составляющая с иммуномодулирующей активностью, адсорбент-носитель и вспомогательная технологическая добавка.
Важной отличительной особенностью заявляемой синбиотической композиции является то, что входящие в ее состав компоненты подобраны с учетом их индивидуальных свойств и комплексного воздействия. Так, в ее составе пробиотическая составляющая представлена рациональной комбинацией штаммов пробиотических бактерий, имеющих большое значение для организма, прежде всего, за счет синтезируемых ими БАВ. В отличие от средства-прототипа в обеспечении комплексного благоприятного воздействия на состояние кишечного микробиоценоза, специфического антагонистического эффекта по отношению к широкому спектру патогенов и стимулирования функциональной активности иммунокомпетентных клеток участвуют БАВ не одного вида микроорганизмов (Bacillus subtilis), а дополнительно еще трех, а именно, Enterococcus faecium, Lactobacillus delbrueckii и Lactobacillus fermentum.
Используемые пробиотические штаммы бактерий Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 представлены в составе заявляемой синбиотической композиции своими метаболитами, синтезированными в процессе их культивирования. При этом штамм бактерий Bacillus subtilis ВКПМ № В-2335 введен в виде стерилизованной высушенной культуральной жидкости, так как именно в ней сконцентрирован уникальный набор БАВ, синтезируемых бациллами в процессе их выращивания. Из числа БАВ ценность представляют природные субстанции, которые вносят весомый вклад в способность заявляемой синбиотической композиции оказывать влияние на факторы неспецифической резистентности организма и стимулировать функциональную активность иммунокомпетентных клеток.
Способность бацилл Bacillus subtilis повышать фагоцитарную активность макрофагов и тем самым проявлять иммуномодулирующий эффект связана также с синтезом при их глубинном выращивании азотистых оснований и их производных (аденин, гуанин, тимин, урацил, цитозин), которые представляют отдельную группу иммуномодулирующих веществ и содержатся в СКЖ в значительных количествах (таблица 1). Для заявляемой синбиотической композиции это имеет большое значение, так как указанные БАВ способствуют восстановлению функциональной активности единой макрофагальной системы организма, угнетенной вследствие воздействия патогенов, и существенному повышению эффективности неспецифической защиты.
Введение в состав заявляемой синбиотической композиции стерилизованной высушенной культуральной жидкости, содержащей метаболиты пробиотического штамма энтерококков Enterococcus faecium L-3 (энтероцины А и В) [13] также способствует повышению эффективности коррекции нарушений микробиоценоза ЖКТ. Указанные бактериоцины обеспечивают способность заявляемой синбиотической композиции селективно подавлять рост и размножение условно-патогенных микроорганизмов, не оказывая ингибирующего действия на лактобациллы. Кроме того, в составе заявляемой синбиотической композиции метаболиты Enterococcus faecium L-3 представляют бифидогенный фактор и способны оказывать благоприятное воздействие на бифидобактерии собственной индигенной микрофлоры кишечника, стимулируя их рост и размножение.
Лиофилизированные пробиотические штаммы бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 (Россия) активно синтезируют метаболиты с протеиновым компонентом - бактериоцины, а именно, лактоцин В [14,15]. Данное и обусловливает их существенный вклад в обеспечение специфической антагонистической активности заявляемой синбиотической композиции к широкому спектру условно-патогенных микроорганизмов.
Пробиотические штаммы бактерий подобраны таким образом, что биосовместимы и не проявляют взаимного антагонистического воздействия. Комбинированное же введение живых пробиотических штаммов бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 вместе с метаболитами пробиотических штаммов бактерий Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 приводит к появлению дополнительных комплексных эффектов, что обусловливает специфическую антагонистическую активность заявляемой синбиотической композиции к широкому спектру условно-патогенных микроорганизмов. При этом также значимо, что метаболиты Bacillus subtilis ВКПМ № В-2335 как лактогенный фактор стимулируют рост, размножение и активность лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, входящих в состав заявляемой синбиотической композиции. Данное способствует тому, что значительное количество попавших в кишечник жизнеспособных и активных лактобацилл оказывает там благоприятное воздействие. Кроме того, метаболиты Bacillus subtilis ВКПМ № В-2335 стимулируют рост и размножение лактобацилл Lactobacillus plantarum 8R-A3, близких естественной составляющей индигенной микрофлоры кишечника.
Адсорбент в составе заявляемой синбиотической композиции предназначен, прежде всего, для иммобилизации метаболитов, продуцируемых бациллами Bacillus subtilis в процессе их культивирования и сконцентрированных в СКЖ. Целесообразность использования цеолита в качестве компонента заявляемой синбиотической композиции определена уникальным химическим строением его молекул, что оптимально способствует выполнению функций адсорбента и носителя метаболитов Bacillus subtilis. Цеолит, не всасываясь в ЖКТ и проходя транзитом, выполняет транспортировку иммобилизованных на нем метаболитов по всему протяжению кишечника. Постепенное высвобождение метаболитов позволяет достаточно длительный промежуток времени (до 1 суток) поддерживать необходимый уровень активности заявляемой синбиотической композиции. Частицы цеолита имеют размеры не более 500 мкм и овальную форму кристалла, что исключает образование микротравм в кишечнике и полностью безопасно [16-18].
Существенное отличие заявляемой синбиотической композиции от средства-прототипа состоит и в том, что в качестве пребиотической составляющей она содержит овсяные хлопья, которые не только выполняют свое основное предназначение, заключающееся в обеспечении питательных потребностей кишечной нормофлоры (в том числе бифидо- и лактобактерий), а также клеток макроорганизма, но и проявляют иммуномодулирующую активность. Овсяные хлопья оптимально обеспечивают восстановление микрофлоры кишечника, так как доля пищевой клетчатки в них составляет 11%, которая на 35% представлена очень ценными для человеческого организма β-глюканами. При коррекции дисбиотических состояний кишечника несомненна роль средств, отличающихся высоким содержанием пищевых волокон и позволяющих оптимизировать условия вегетирования симбионтов. Пищевые волокна (совокупность различных водорастворимых полисахаридов) не перевариваются (не расщепляются на моносахариды) эндогенными секретами ЖКТ человека и в неизмененном виде достигают толстой кишки, где метаболизируются анаэробной симбионтной микрофлорой до короткоцепочечных жирных кислот. Коротко-цепочечные жирные кислоты (ацетат, пропионат, бутират, валерат), в свою очередь, являются основным энергетическим субстратом для эпителиоцитов слизистой оболочки толстой кишки [19], стимулирующим пролиферацию, дифференциацию клеток и образование муциновой слизи. Помимо этого, пищевые волокна, фиксируя на своей обширной поверхности симбионтные микроорганизмы и вносимые в составе заявляемой синбиотической композиции штаммы лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, способствуют значительному увеличению их содержания в единице внутрикишечного объема и возрастанию суммарной метаболической активности индигенной микрофлоры кишечника.
Иммуномодулирующее воздействие β-глюкана, поступающего в организм в составе используемого пребиотика, обусловлено тем, что он транспортируется через эпителиальный барьер клеток кишечного тракта в лимфу, в которой взаимодействует с ключевыми клетками иммунной системы (макрофагами) путем прикрепления к специфическим рецепторам, находящимся на их клеточных мембранах. Воздействуя на макрофаги, β-глюкан усиливает их фагоцитарную активность (подвижность), а также способность находить и устранять чужеродные, в том числе условно-патогенные микроорганизмы. Кроме того, β-глюкан стимулирует и такие клетки как нейтрофилы NK (натуральные клетки-киллеры) и LAK (лимфокиноактивированные клетки-киллеры), за счет чего дополнительно повышает антагонистическую активность заявляемой синбиотической композиции.
Для улучшения технологичности процесса получения заявляемой синбиотической композиции в качестве вспомогательной технологической добавки используют СК или аэросил.
Действие заявляемой синбиотической композиции, выполненной в капсулированной форме, начинается уже в желудке, где происходит растворение защитной капсулы под воздействием желудочного сока. Благодаря тому, что живые пробиотические культуры, входящие в состав заявляемой синбиотической композиции, устойчивы к действию факторов, которые могут вызвать их деградацию в ходе транзита по ЖКТ (в том числе кислая и сменяющая ее щелочная среда, присутствие желчи и т.п.) [14,15], значительное их количество попадает в кишечник, где и проявляет свое благоприятное воздействие.
Как видно, ингредиенты подобраны таким образом, что заявляемая синбиотическая композиция представляет собой сбалансированный комплекс, а количество их в одной капсуле составляет, масс. %:
Возможность достижения цели изобретения подтверждается результатами проведенных исследований, представленными в следующих примерах.
Пример 1. Получение заявляемой синбиотической композиции в виде капсулированной твердой дозированной формы для перорального введения.
Заявляемая синбиотическая композиция выполнена в виде капсулированной твердой дозированной формы для перорального введения, что не только существенно упрощает ее использование, но и обеспечивает надежную защиту входящих в ее состав компонентов от воздействия факторов, которые могут вызвать их деградацию.
Получают заявляемую синбиотическую композицию вначале в виде порошка, для чего выполняют следующий алгоритм действий. Выращивают микроорганизмы Bacillus subtilis ВКПМ № В-2335 методом глубинного культивирования в биологическом реакторе (ферментере). После окончания процесса культивирования СКЖ с микроорганизмами подвергают центрифугированию для отделения и последующего удаления живых клеток микроорганизмов, а затем стерилизуют. Перед стерилизацией СКЖ смешивают с адсорбентом - цеолитом, предварительно измельченным до частиц размером не более 500 мкм. Полученную смесь подвергают лиофилизации, при которой происходит иммобилизация биологически активных метаболитов продуцента на частицах цеолита. Далее в массу добавляют смесь лиофилизатов пробиотических штаммов бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus delbrueckii TS 1-06, стерилизованной высушенной культуральной жидкости с метаболитами пробиотического штамма бактерий Enterococcus faecium L-3, овсяных хлопьев, а также СК или аэросила и помещают в резервуар установки для гранулирования с целью смешивания и досушивания. Затем массу просеивают на вибросите и передают на стадию капсулирования. Наполнение твердых желатиновых капсул осуществляют на автомате для наполнения капсул.
Лиофилизаты пробиотических штаммов бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus delbrueckii TS1-06 вводят в виде сухого продукта «Авена-Л» (ООО «Авена», Санкт-Петербург) [20].
Стерилизованную высушенную культуральную жидкость с метаболитами пробиотического штамма бактерий Enterococcus faecium L-3 вводят в виде сухого продукта «Авена» (ООО «Авена», Санкт-Петербург) [21].
В состав заявляемой синбиотической композиции входят овсяные хлопья, включающие пищевые волокна (11%), которые на 35% представлены β-глюканами [22].
В качестве адсорбента используют цеолит природный - натуральный микропористый силикатный минерал Холинского месторождения (Бурятия) (ООО «КРАФТ», Санкт-Петербург) [23,24].
В качестве вспомогательной добавки используют СК [25] или аэросил [26].
Как видно, процесс получения заявляемой синбиотической композиции в капсулированной твердой дозированной форме для перорального введения отличается простотой, а используемые при этом ингредиенты выпускаются в промышленных условиях, доступны и недороги.
Пример 2. Оценка безопасности заявляемой синбиотической композиции.
Безопасность заявляемой синбиотической композиции оценивали по результатам санитарно-химического анализа, микробиологических исследований, а также путем определения ряда токсикологических и других характеристик: острой токсичности, хронической токсичности и способности к кумуляции, возможного местно-раздражающего действия на слизистую пищевода, раздражающего действия на кожу и глаза, ингаляционного воздействия пылью, сенсибилизирующего действия, возможных отдаленных последствий.
Санитарно-химический анализ.
Подготовку проб проводили по ГОСТ 26929-94 «Сырье и продукты пищевые. Подготовка проб. Минерализация для определения токсичных элементов. Межгосударственный стандарт». Свинец и кадмий определяли по ГОСТ 30178-96 «Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов. Межгосударственный стандарт». Мышьяк определяли согласно ГОСТ 26930-86 «Сырье и продукты пищевые. Метод определения мышьяка». Ртуть определяли согласно «Методическим указаниям по обнаружению и определению содержания общей ртути в пищевых продуктах методом беспламенной атомной абсорбции» (№5178-90).
Содержание хлорорганических пестицидов (токсикантов) определяли согласно «Методическим указаниям по определению остаточных количеств хлорорганических пестицидов» (№1766-77) и официальным методам анализа АО AC («Official methods of analysis of the AOAC», 1984, 14th ed., Chapter 29, P. 537-538).
Исследования проводили с использованием весов лабораторных ВЛР-500, газожидкостного хроматографа «Карло Эрба» (модель HRGC 5700), обменных клеток итальянской фирмы «Texnoplast».
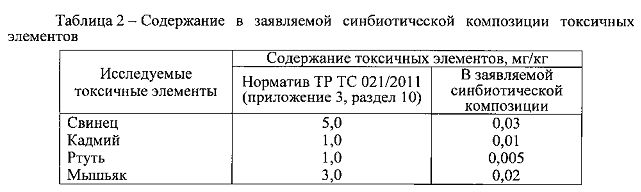
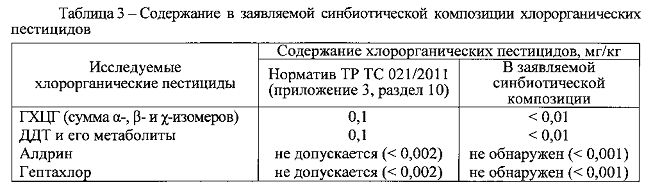
Результаты проведенных измерений представлены в таблицах 2 и 3 и свидетельствуют, что в заявляемой синбиотической композиции содержание токсикантов (хлорорганические пестициды ГХЦТ и ДДТ) и опасных для здоровья веществ (свинец, кадмий, ртуть, мышьяк) не превышает допустимые уровни, установленные Техническим регламентом Таможенного союза TP ТС 021/2011 «О безопасности пищевой продукции» (приложение 3, раздел 10) [27]. Такие же пестициды как алдрин и гептахлор в заявляемой синбиотической композиции не обнаружены.
Микробиологические исследования.
Микробиологические исследования проводили в соответствии с требованиями методических указаний МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов», МУК 2.3.2.721-98 «Определение безопасности и эффективности биологически активных добавок к пище», ГОСТ Р 52814-2007 «Продукты пищевые. Метод выявления бактерий рода Salmonella», ГОСТ Р 52816-2007 «Продукты пищевые. Метод выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)», ГОСТ 10444.12-88 «Продукты пищевые. Метод определения дрожжей и плесневых грибов», ГОСТ 30726-2001 «Продукты пищевые. Методы выявления и определения количества бактерий вида Escherichia coli».
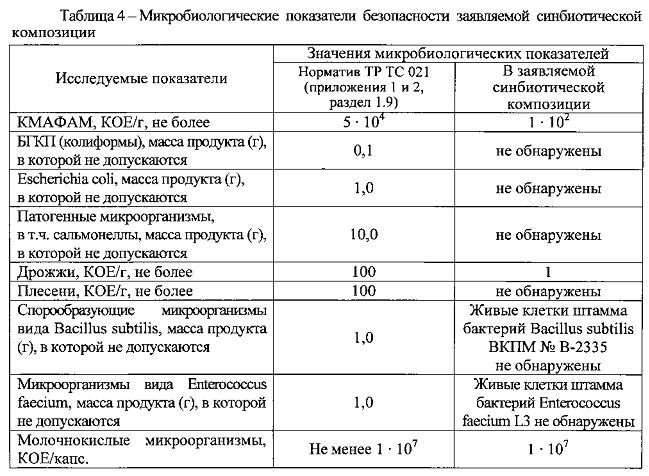
Результаты оценки микробиологических показателей безопасности представлены в таблице 4 и свидетельствуют, что по микробиологическим показателям безопасности заявляемая синбиотическая композиция соответствует требованиям, установленным Техническим регламентом Таможенного союза TP ТС 021/2011 «О безопасности пищевой продукции» (приложения 1 и 2, раздел 1.9).
Исследование острой токсичности.
Заявляемую синбиотическую композицию вводили здоровым беспородным белым крысам обоих полов массой тела 130-150 г и 180-200 г внутрижелудочно в виде водных суспензий через металлический атравматичный зонд, медленно погружая его до желудка. Исследования проводили с использованием пробит-анализа по Литчфилду-Уилкоксону в модификации З. Рота [28]. В ходе эксперимента были сформированы две группы по 10 животных в каждой: опытная (вводили заявляемую синбиотическую композицию два раза в день в максимально переносимой дозе, составляющей 15 г/кг) и контрольная (вводили эквивалентные объемы дистиллированной воды). Животные распределялись по группам случайным образом методом рандомизации. В качестве критериев приемлемости рандомизации считали отсутствие внешних признаков заболеваний и гомогенность групп по массе тела (±10%).
Наблюдение за подопытными животными осуществляли в течение 14 сут с регистрацией показателей: летальность, время гибели животных, симптоматика отравления, результаты ежедневного наблюдения общего состояния, поведения и взвешивания, результаты контроля потребления корма и воды, результаты вскрытия и макроскопического описания погибших и выживших животных в конце исследования (эвтаназия осуществлялась передозировкой эфира), результаты определения массовых коэффициентов (МК) внутренних органов.
Введение заявляемой синбиотической композиции в максимально переносимых дозах не вызывало гибели подопытных животных. Не отмечали и какие-либо другие признаки негативного действия заявляемой синбиотической композиции. В частности, не отмечали какие-либо диспепсические явления. Во все дни наблюдения по общему состоянию и поведению животные опытной и контрольной групп не отличались.
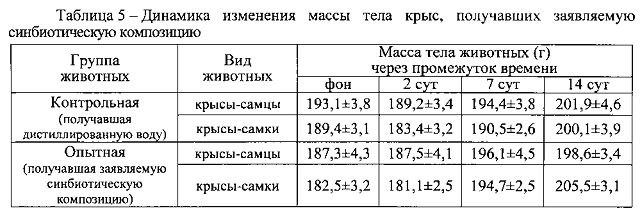
Результаты изучения динамики изменения массы тела подопытных животных, получавших заявляемую синбиотическую композицию, в течение 14 сут наблюдения за ними позволили установить, что динамика массы тела животных опытной и контрольной групп практически не различалась (таблица 5).
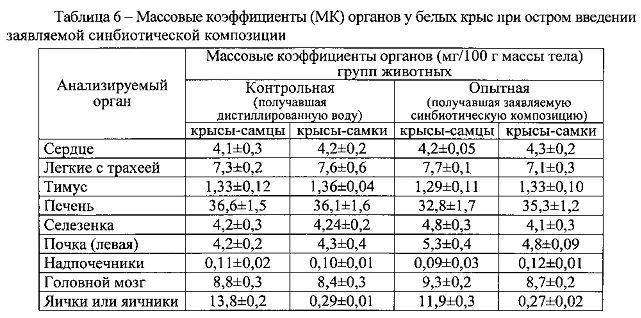
Анализ величин МК органов белых крыс позволил установить, что острое введение им заявляемой синбиотической композиции в максимально переносимой дозе не вызывало какие-либо достоверные отличия по сравнению с контрольной группой животных, получавших дистиллированную воду (таблица 6).
Таким образом, результаты токсикометрии, данные наблюдений за подопытными животными на протяжении 14 сут после острого введения позволяют отнести заявляемую синбиотическую композицию к нетоксичным (относительно безвредным по С.Д. Заугольникову) и малоопасным (IV класс опасности по ГОСТ 12.1.007) веществам.
Исследование хронической токсичности и способности к кумуляции.
Исследования хронической токсичности проводили на белых нелинейных крысах-самцах массой 180-200 г при введении заявляемой синбиотической композиции внутрижелудочно через атравматичный металлический зонд в течение 30 дней при суточной дозе 1,5 г/кг. Животные контрольной группы получали дистиллированную воду в аналогичном объеме.
Измерение основных физиологических показателей осуществляли через 30 дней хронического ежедневного введения заявляемой синбиотической композиции.
В течение всего периода наблюдения летальных эффектов не наблюдали. Общее состояние и поведение подопытных животных оставалось нормальным и не отличалось от контрольной группы в течение всего эксперимента.
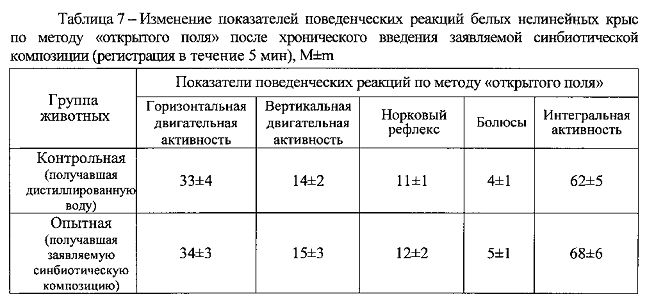
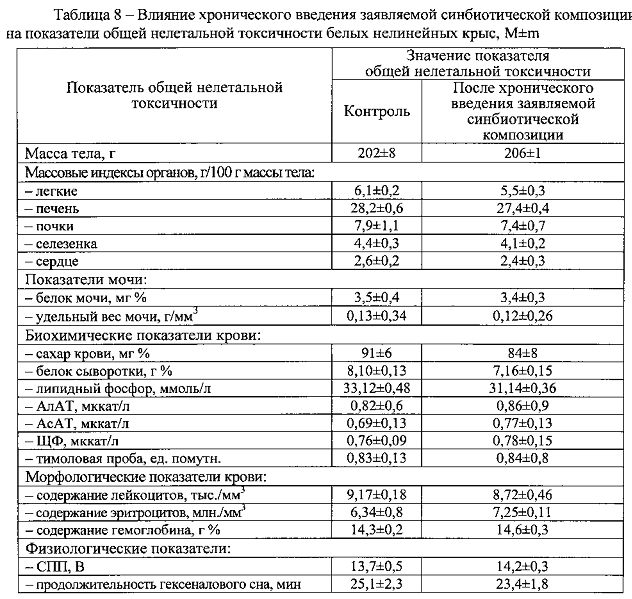
Результаты изучения интегральных показателей общей токсичности, представленные в таблицах 7 и 8, свидетельствуют, что ни по одному из анализируемых показателей не было выявлено статистически значимых различий с контрольной группой животных, получавших дистиллированную воду (р>0,05 при 95% уровне вероятности) или патологических отклонений за пределы варьирования физиологической нормы.
Вскрытие крыс, умерщвленных на следующий день после последнего введения заявляемой синбиотической композиции, показало, что размеры, форма и окраска их внутренних органов не имели макроскопических изменений по сравнению с контрольной группой. Слизистая оболочка желудка и тонкого кишечника были блестящими, бледно-розовыми, без признаков раздражения или воспаления.
При гистологическом исследовании препаратов легких, миокарда, печени, почек и слизистой желудка подопытных животных, получавших заявляемую синбиотическую композицию, дистрофические, воспалительные или некробиотические изменения органов не выявлены.
Эпителий альвеол и внутрилегочных бронхов изменений не имел, альвеолы были воздушными. Ателектазы либо отек легочной ткани не наблюдали. Поперечная исчерченность миофибрилл миокарда отчетливая. Строение печени без нарушений. Границы гепатоцитов отчетливые, цитоплазма зернистая, слабобазофильная, ядра светлые с тонкой мембраной и отчетливыми ядрышками. Нефроэпителий с оксифильной зернистой цитоплазмой и светлыми четкими ядрами. Эпителий слизистой желудка сохранен, главные и обкладочные клетки желез желудка без изменений.
Следовательно, хроническое внутрижелудочное поступление заявляемой синбиотической композиции в организм подопытных животных не вызывало дистрофических или деструктивных изменений паренхиматозных органов и не сопровождалось раздражением слизистых оболочек ЖКТ. Таким образом, по интегральному показателю кумуляции и показателям общей нелетальной токсичности заявляемая синбиотическая композиция не обладает способностью к кумуляции и нетоксична.
Исследование возможного местно-раздражающего действия.
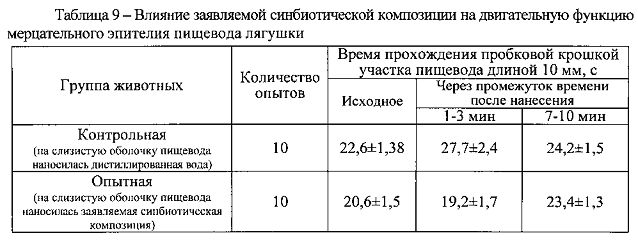
Местно-раздражающее действие заявляемой синбиотической композиции оценивали на модели мерцательного эпителия пищевода лягушки. Цитотоксический эффект изучали на болотных лягушках Rana temporaria массой тела 25 г. После обездвиживания путем разрушения спинного мозга и фиксации животных на пробковом столе вскрывали грудную клетку, выделяли пищевод и рассекали в каудалъном направлении. Над глоточной частью пищевода устанавливали две штанги. В ходе эксперимента регистрировали время прохождения пробковой крошкой участка пищевода длиной 10 мм, ограниченного штангами, до и после нанесения на слизистую оболочку пищевода дистиллированной воды или заявляемой синбиотической композиции в виде порошка в количестве 50 мг. Продолжительность воздействия составляла 1 мин.
Экспериментально установлено, что нанесение на слизистую оболочку пищевода заявляемой синбиотической композиции в виде порошка не влияет на двигательную функцию мерцательного эпителия пищевода лягушки (таблица 9). Таким образом, заявляемая синбиотическая композиция не оказывает местно-раздражающее действие.
Исследование действия на кожу и глаза
Действие на кожу и кожно-резорбтивное действие изучалось на белых крысах-самках массой тела 130-150 г. После помещения животных в специальные домики их хвосты на 2/3 помещали на 4 ч в кашицу, которую получали, смешивая заявляемую синбиотическую композицию в виде порошка с холодной водой в количествах, соответственно, 90% и 10%. Через 1 ч и 16 ч после окончания однократной аппликации не отмечалось эритемы или отека кожи хвостов (величина отека оценивалась путем измерения толщины хвоста в средней части при помощи толщинометра типа ТР-1-10). Установлено, что 20-кратная аппликация не вызывала гибели подопытных животных и не выявляла раздражающего действия на кожу в течение последующего 5-дневного срока наблюдения.
Морфологически кожа хвостов в месте нанесения порошка изменений не имела. Эпидермис и придатки кожи также без изменений. Слои эпидермиса отчетливо выражены, базальная мембрана сохранена. Эпителиальные клетки наружных и внутренних корневых влагалищ волосяных фолликулов и соединительно-тканная сумка хорошо выражены.
Макроскопические и микроскопические изменения внутренних органов у подопытных животных отсутствовали.
Изучение морфологических, биохимических, гематологических и физиологических показателей белых крыс не выявило достоверных отличий от контрольной группы животных, хвосты которых помещали в воду.
Следовательно, заявляемая синбиотическая композиция не обладает раздражающим действием на кожу и кожно-резорбтивным действием, то есть, нетоксична при попадании на кожу или при контакте с ней.
Исследовали также раздражающее действие заявляемой синбиотической композиции на слизистую оболочку глаза кролика. В ходе эксперимента установлено, что через 1 мин после однократного внесения заявляемой синбиотической композиции в виде порошка в количестве 50 мг в конъюнктивальный мешок глаза кролика появились умеренная гиперемия и слезотечение, сопровождавшиеся непродолжительным блефароспазмом, что можно расценить как реакцию на индифферентное механическое инородное тело. Полнокровие сосудов сохранялось не более 20 мин, а через 40-45 мин все возникшие явления раздражения полностью прошли. Следовательно, заявляемая синбиотическая композиция обладает слабым раздражающим действием на слизистую оболочку глаза кролика, как любая механическая пыль.
Исследование ингаляционного воздействия пылью.
Однократное динамическое ингаляционное воздействие заявляемой синбиотической композиции в виде порошка на белых крыс-самок массой тела 130-150 г производили в течение 2 ч в стандартных камерах Б.А. Курляндского объемом 200 л при скорости подачи воздуха 60 л/мин и температуре 20°С. Максимально возможные концентрации пыли, которые в ходе эксперимента определяли гравиметрическим методом, достигали с помощью пылевых распылителей. Пробы воздуха отбирали через каждые 30 мин. В ходе эксперимента средняя концентрация пыли составила 53,4±3,1 г/м3.
Как в ходе воздействий, так и после них у подопытных животных не наблюдалось летальных исходов, а лишь признаки пылевого (механического) раздражения верхних дыхательных путей (чихание, груминг) и глаз (лакримация), а также беспокойство.
После вскрытия умерщвленных животных изменения не выявлены, кроме умеренного полнокровия внутренних органов. В дыхательных путях определялись частички порошка заявляемой синбиотической композиции.
Следовательно, острое ингаляционное воздействие пылью заявляемой синбиотической композиции не представляет опасности, так как не вызывает признаков отравления и как любая механическая пыль лишь незначительно раздражает верхние дыхательные пути и глаза.
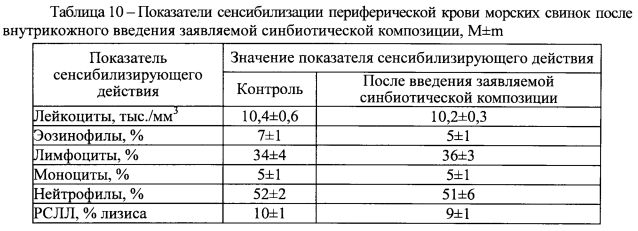
Исследование сенсибилизирующего действия.
Изучение сенсибилизирующего действия заявляемой синбиотической композиции проводили на морских свинках. Для этого в кожу наружной поверхности уха животных туберкулиновым шприцем вводили однократно 0,02 мл водного разведения заявляемой синбиотической композиции в дозе 10 мг/кг, а через 10 дней на предварительно выстриженные участки кожи боковой поверхности спины размером 2×2 см наносили и фиксировали заявляемую синбиотическую композицию в виде порошка из расчета 20 мг/см2. Забор крови у животных осуществляли через 3 ч после постановки кожных проб.
Результаты оценки влияния заявляемой синбиотической композиции на показатели сенсибилизирующего действия представлены в таблице 10 и свидетельствуют об отсутствии признаков сенсибилизации в периферической крови - эозинофилии или увеличения уровня лизиса в реакции специфического лизиса лейкоцитов (РСЛЛ) по сравнению с контролем. При осмотре кожи спины подопытных животных признаков раздражения не отмечалось. Следовательно, заявляемая синбиотическая композиция при эпикутанном контакте не обладает сенсибилизирующим действием, то есть не провоцирует развитие аллергии.
Исследование возможных отдаленных последствий.
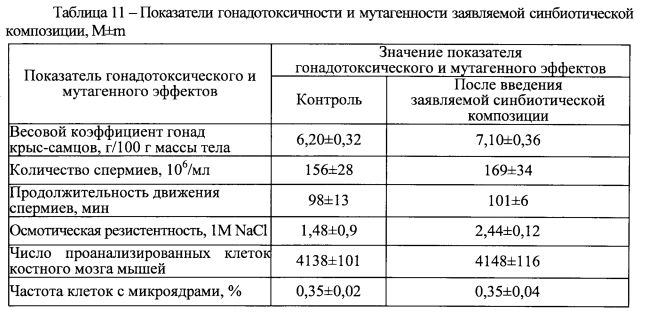
Изучение возможного гонадотоксического эффекта проводили в соответствии с методическими рекомендациями по показателям, обязательным при первичной оценке химических веществ [29, 30]. Изучение мутагенной активности проводили по частоте образования микроядер в полихроматофильных эритроцитах костного мозга (из бедренной кости) белых мышей в соответствии с методическими рекомендациями [31, 32].
Результаты изучения возможных гонадотоксического и мутагенного эффектов заявляемой синбиотической композиции при введении ее в течение 10 дней в дозе 1 г/кг, проведенного через 15 дней после окончания ее введения, свидетельствуют об отсутствии достоверно значимых сдвигов показателей гонадотоксичности и мутагенности (таблица 11). Угнетения сперматогенеза или увеличения частоты мутаций также не наблюдалось.
Следовательно, заявляемая синбиотическая композиция не обладает токсическим влиянием на репродуктивную функцию и не оказывает мутагенного эффекта. Это свидетельствует о ее безопасности в плане развития отдаленных негативных последствий у человека.
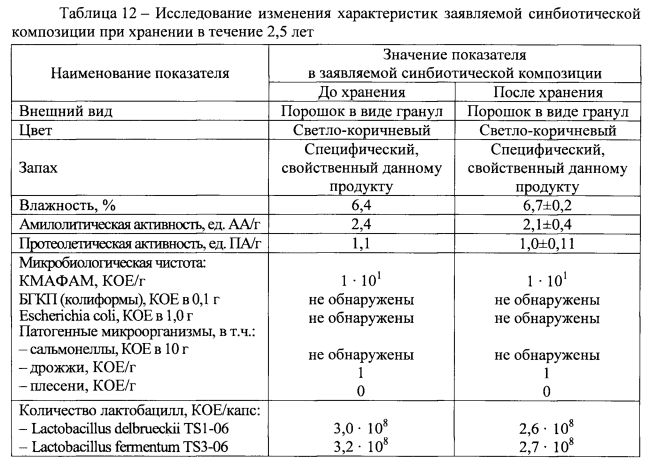
Пример 3. Оценка стабильности заявляемой синбиотической композиции в процессе хранения.
Исследовали возможность сохранения активности и безопасности заявляемой синбиотической композиции в виде порошка и устанавливали гарантированный срок годности в случае хранения при различных температурах и без использования специального оборудования.
В ходе эксперимента порошок закладывали в 100 потребительских упаковок в виде двойных полиэтиленовых пакетов и хранили их в течение 2,5 лет при температурах 5±2°С, 10±3°С, 25±5°С, 35±5°С (на каждый температурный режим хранения по 25 упаковок). Через каждые 6 месяцев хранения отбирали по 5 упаковок от соответствующего температурного режима и определяли характеристики порошка: влажность, амилолитическую и протеолитическую активности, содержание живых лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, микробиологическую чистоту. Для оценки возможных изменений указанных характеристик при хранении определяли их значения в начале исследований.
Данные, представленные в таблице 12, свидетельствуют о том, что при выбранных для испытаний температурных режимах хранения (от 5 до 40°С) оцениваемые показатели практически не изменяются в течение 2,5 лет. Средние значения показателей составили: влажность - 6,7±0,2%, амилолитическая активность - 2,1±0,4 ед. АА/г, протеолитическая активность - 1,0±0,11 ед. ПА/г. Микробиологическая чистота заявляемой синбиотической композиции, оцениваемая отсутствием в ней КМАФАМ, БГКП, Escherichia coli, патогенных микроорганизмов (сальмонеллы, дрожжи и плесени), сохранялась в течение 2,5 лет, то есть весь период исследований.
Таким образом, гарантированный срок хранения заявляемой синбиотической композиции, выполненной в твердой форме в виде порошка, составляет не менее 2,5 лет при температуре не выше 40°С при условии соблюдения сохранности упаковки. Особые температурные условия хранения или использование специального оборудования при этом не требуются.
Пример 4. Исследование совместимости компонентов, входящих в состав заявляемой синбиотической композиции.
Так как компоненты, входящие в состав заявляемой синбиотической композиции и представляющие ее пробиотическую составляющую, должны быть совместимы, in vitro исследовали антагонистическую активность метаболитов Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 в отношении живых лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, а также влияние метаболитов на рост и размножение лактобацилл.
Исследования проводили с использованием:
- метода прямого антагонизма путем нанесения стерильных метаболитов исследуемых штаммов бактерий (Bacillus subtilis ВКПМ № В-2335 или Enterococcus faecium L-3) в лунки или на поверхность твердой питательной среды (агар МРС-4) сразу же после посева в нее лактобацилл (Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06) с последующей инкубацией в течение 24 ч при температуре 37°С;
- метода двухслойного агара [33], при котором в нижний слой твердой питательной среды (агар МРС-4) вносили суспензию метаболитов Bacillus subtilis ВКПМ № В-2335 или Enterococcus faecium L-3, а в верхний слой засевали лактобациллы.
Метаболиты Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 вводили в концентрациях 1 г или 0,1 г в 10 мл питательной среды.
Лактобациллы засевали в различных количествах, составляющих 7 lg КОЕ/мл - 2 lg КОЕ/мл.
После нанесения стерильных метаболитов Bacillus subtilis ВКПМ № В-2335 или Enterococcus faecium L-3 в лунки или на поверхность агара, засеянного лактобациллами Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, с использованием метода прямого антагонизма установлено, что метаболиты как Bacillus subtilis ВКПМ № В-2335, так и Enterococcus faecium L-3 не проявляют антагонистическую активность в отношении исследуемых штаммов лактобацилл, зоны подавления роста лактобацилл отсутствуют.
Использование метода двухслойного агара также подтвердило, что метаболиты Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 при введении в указанных концентрациях не оказывают ингибирующий эффект на рост Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 в верхнем слое питательной среды.
Таким образом, экспериментально установлено, что компоненты, входящие в пробиоти-ческую составляющую заявляемой синбиотической композиции, совместимы, так как метаболиты Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 не проявляют антагонистическую активность и ингибирующий эффект в отношении используемых лактобацилл при их совместном присутствии в составе заявляемой синбиотической композиции.
Кроме того, метаболиты Bacillus subtilis ВКПМ № В-2335 стимулируют рост и размножение лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06. Выражается это в том, что в присутствии метаболитов Bacillus subtilis ВКПМ № В-2335 в указанных концентрациях вырастало большее (в три и более раз) количество лактобацилл (таблица 13).
Установлено также, что колонии лактобацилл при посеве 50 колоний на чашку Петри и росте в присутствии метаболитов Bacillus subtilis ВКПМ № В-2335 в 2 раза крупнее, их диаметр увеличивается с 1 мм до 2 мм по сравнению с контролем (без добавления метаболитов указанного штамма бактерий).
Пример 5. Исследование влияния метаболитов Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 на рост и размножение пробиотических лактобацилл Lactobacillus plantarum 8R-A3.
В ходе эксперимента исследовали in vitro влияние метаболитов Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 на рост и размножение лактобацилл Lactobacillus plantarum 8R-A3, близких естественной составляющей индигенной микрофлоры кишечника.
Исследования проводили с использованием методов прямого антагонизма и двухслойного агара, как описано в примере 4. Метаболиты Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 вводили в концентрациях 1 г или 0,1 г в 10 мл питательной среды. Лактобациллы Lactobacillus plantarum 8R-A3 засевали в различных количествах, составляющих 7 lg КОЕ/мл -2 lg КОЕ/мл.
Экспериментально, с использованием метода прямого антагонизма, установлено, что метаболиты как Bacillus subtilis ВКПМ № В-2335, так и Enterococcus faecium L-3 не проявляют антагонистическую активность и в отношении данного штамма лактобацилл, зоны подавления роста лактобацилл отсутствуют.
Использование метода двухслойного агара позволило установить, что метаболиты пробиотических штаммов бактерий в указанных концентрациях не оказывают ингибирующий эффект в отношении лактобацилл Lactobacillus plantarum 8R-A3. При этом метаболиты Bacillus subtilis ВКПМ № В-2335 стимулируют рост и размножение пробиотических лактобацилл Lactobacillus plantarum 8R-A3 (таблица 14). В присутствии указанных метаболитов в пришлых концентрациях вырастало большее количество лактобацилл Lactobacillus plantarum 8R-A3 (в четыре и более раз).
Таким образом, экспериментально установлен лактогенный эффект метаболитов Bacillus subtilis ВКПМ № В-2335, выражающийся в стимулировании роста и размножения пробиотических лактобацилл Lactobacillus delbrueckii TS1-06, Lactobacillus fermentum TS3-06 и Lactobacillus plantarum 8R-A3.
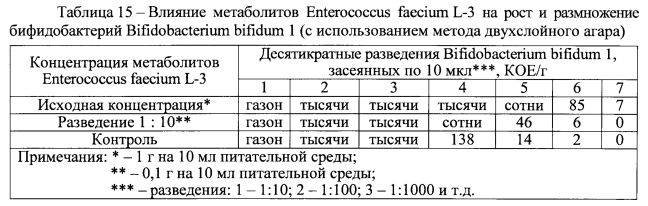
Пример 6. Исследование влияния метаболитов Enterococcus faecium L-3 на рост и размножение пробиотических бифидобактерий.
В ходе эксперимента исследовали in vitro влияние метаболитов Enterococcus faecium L-3 на рост и размножение пробиотических бифидобактерий Bifidobacterium bifidum 1 и Bifidobacterium longum GT15, близких естественной составляющей индигенной микрофлоры кишечника.
Исследования проводили с использованием метода двухслойного агара, как описано в примере 4. Метаболиты Enterococcus faecium L-3 вводили в концентрациях 1 г или 0,1 г в 10 мл питательной среды для бифидобактерий. Индикаторные штаммы бифидобактерий Bifidobacterium bifidum 1 и Bifidobacterium longum GT15 засевали в различных количествах, составляющих 7 lg КОЕ/мл -2 lg КОЕ/мл.
Экспериментально, с использованием метода двухслойного агара установлено, что метаболиты пробиотического штамма бактерий Enterococcus faecium L-3 в указанных концентрациях не оказывают ингибирующий эффект в отношении бифидобактерий Bifidobacterium bifidum 1 и Bifidobacterium longum GT15 и даже стимулируют их рост и размножение (таблицы 15 и 16). В присутствии указанных метаболитов в принятых концентрациях вырастало большее количество бифидобактерий Bifidobacterium bifidum 1 (в три и более раз) и Bifidobacterium longum GT15 (в четыре и более раз).
Таким образом, экспериментально установлен бифидогенньш эффект метаболитов Enterococcus faecium L-3, выражающийся в стимулировании роста и размножения пробиотических бифидобактерий Bifidobacterium bifidum 1 и Bifidobacterium longum GT15.
Пример 7. Исследование специфической антагонистической активности заявляемой синбиотической композиции в отношении условно-патогенных микроорганизмов.
В ходе эксперимента исследовали in vitro специфическую антагонистическую активность заявляемой синбиотической композиции, включающей комплекс метаболитов пробиотических штаммов бактерий Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 и лиофилизатов живых лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, в отношении условно-патогенных микроорганизмов.
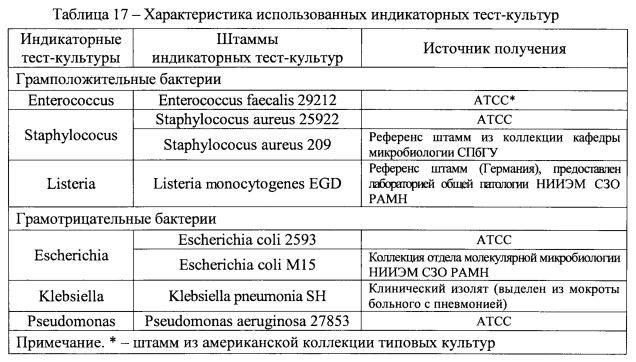
В качестве индикаторных тест-культур использовали грамположительные (энтерококки, стафилококки, листерии) и грамотрицательные бактерии (эшерихии, клебсиеллы, псевдомонады) (таблица 17). Культуры микроорганизмов, используемых в качестве индикаторных, соответствуют тем, которые, как правило, выявляют при диагностике дисбиотических нарушений микробиоценоза ЖКТ.
Засевали индикаторные тест-культуры микроорганизмов в ходе эксперимента на питательной среде в различных количествах, составляющих 7 lg КОЕ/мл - 2 lg КОЕ/мл.
В качестве питательной среды использовали твердую агаризованную среду МРС-4.
Исследования предусматривали определение задержки роста указанных индикаторных тест-культур условно-патогенных бактерий при воздействии:
- смеси живых лиофилизированных лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06;
- заявляемой синбиотической композиции.
Исследование специфической антагонистической активности заявляемой синбиотической композиции (комплекса метаболитов бактерий Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3, а также смеси лиофилизатов лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06) в отношении условно-патогенных микроорганизмов проводили с использованием:
- метода прямого антагонизма путем прямого нанесения заявляемой синбиотической композиции или входящей в ее состав смеси живых лактобацилл в лунки или на поверхность твердой питательной среды сразу же после посева индикаторных тест-культур с последующей инкубацией в течение 24 ч при температуре 37°C.
- метода двухслойного агара, при котором в нижний слой твердой питательной среды вносили заявляемую синбиотическую композицию или смесь живых лиофилизированных лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, а в верхний слой засевали индикаторные тест-культуры условно-патогенных микроорганизмов.
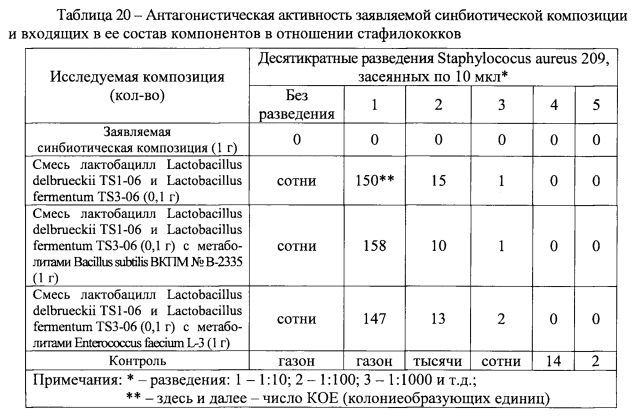
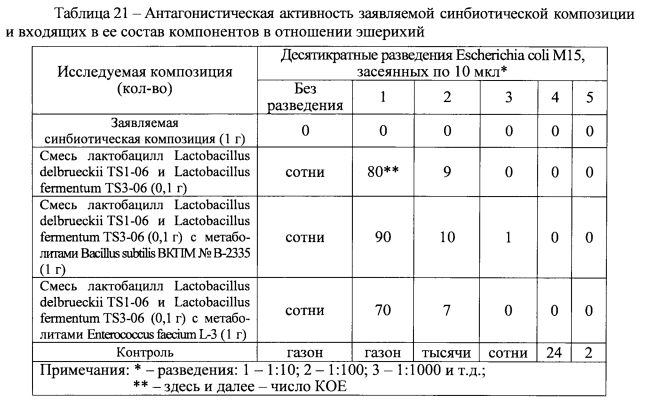
При использовании метода прямого антагонизма установлено, что заявляемая синбиотическая композиция проявляет специфический антагонистический эффект в отношении псевдомонад (таблица 18) и листерий (таблица 19). Причем, антагонистический эффект заявляемой синбиотической композиции более выражен, чем у отдельных входящих в ее состав компонентов, а именно, смеси метаболитов бактерий Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 или смеси лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06.
С использованием метода двухслойного агара оценивали антагонистическую активность как заявляемой синбиотической композиции, так и ее отдельных компонентов и их сочетаний с целью выявления комплексных эффектов. Для этого в нижний слой агара вносили: заявляемую синбиотическую композицию (0,1 г), смесь лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 (0,1 г), смесь лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 (0,1 г) с метаболитами Bacillus subtilis ВКПМ № В-2335 (1 г) и смесь лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 (0,1 г) с метаболитами Enterococcus faecium L-3 (1 г). В верхний слой агара при этом вносили индикаторные тест-культуры условно-патогенных микроорганизмов.
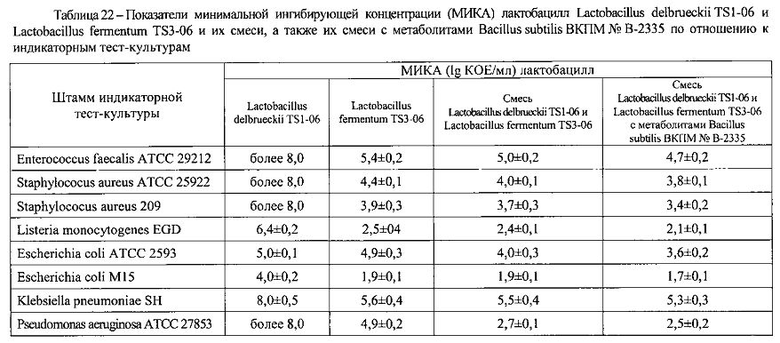
Наиболее значимые результаты сравнительного исследования антагонистических эффектов заявляемой синбиотической композиции и входящих в ее состав компонентов, представленные в таблицах 20 и 21, свидетельствуют, что рост индикаторных тест-культур условно-патогенных микроорганизмов отсутствует при добавлении в нижний слой агара 1 г заявляемой синбиотической композиции.
Результаты исследований с использованием метода двухслойного агара, позволившие определить минимальную ингибирующую концентрацию лактобацилл (МИКА), представлены в таблице 22. Как видно, исследуемые штаммы лактобацилл, входящие в состав заявляемой синбиотической композиции, обладают антагонистической активностью в отношении широкого спектра патогенов, чем обусловлена ее специфическая антагонистическая активность. Лактобациллы ингибируют рост грамотрицательных и грамположительных бактерий и в большей степени эшерихий и стафилококков. Причем, антагонистическая активность их смеси превосходит указанную характеристику каждой монокультуры в отдельности. В присутствии метаболитов Bacillus subtilis ВКПМ № В-2335 антагонистическая активность смеси лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 выше.
Таким образом, экспериментально установлено, что заявляемая синбиотическая композиция обладает достаточным уровнем специфической антагонистической активности в отношении широкого спектра патогенов, что связано с продукцией антимикробных факторов лактобациллами Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, а также стимулирующим влиянием метаболитов Bacillus subtilis ВКПМ № В-2335 на антагонистическую активность смеси лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06. Наиболее значимые эффекты наблюдали в отношении тест-культур псевдомонад (частых возбудителей гнойно-воспалительных заболеваний) и листерий (возбудителей кишечных и урогенитальных инфекций).
Пример 8. Исследование влияния средства-прототипа и заявляемой синбиотической композиции на факторы неспецифической резистентности организма.
Исследования предусматривали оценку способности средства-прототипа и заявляемой синбиотической композиции оказывать влияние на факторы неспецифической резистентности организма.
Исследования выполнены на белых беспородных лабораторных мышах (питомник «Рапполово» РАМН) массой 18-23 г. Всего было использовано 120 животных, распределенных на три группы по 40 особей в каждой: контрольную (получали изотонический раствор хлорида натрия) и первую и вторую опытные, в которых животным вводили, соответственно, средство-прототип или заявляемую синбиотическую композицию.
Средство-прототип и заявляемую синбиотическую композицию вводили перорально 1 раз в сутки в дозе 150 мкг/мышь каждого.
Вводили средство-прототип и заявляемую синбиотическую композицию в течение 7 сут. Оценку эффекта воздействия использованных средств осуществляли через 1, 3 и 7 сут. Для этого до введения препаратов (контроль), а также спустя 1, 3 и 7 сут после введения у животных каждой из групп проводили забор крови для исследования. На каждом этапе исследования забор материала проводили от 10 животных из группы, индивидуально от каждой мыши после ее декапитации.
Динамика изменений факторов неспецифической резистентности оценивалась путем определения функционального состояния клеток фагоцитарной системы (переваривающей активности гранулярных лейкоцитов), а также концентрации в сыворотке крови лизоцима и миелопероксидазы, обладающих не только прямым бактерицидным действием, но и являющихся медиаторами межклеточного взаимодействия при развитии иммунного ответа на любое антигенное воздействие.
Переваривающую активность гранулярных лейкоцитов периферической крови подопытных животных оценивали по методу Зеленовой Е.Г. и Никифорова В.А. (1972). Сыворотку получали по стандартной методике, отделяя сгусток крови от жидкой фазы. Для оценки функционального состояния фагоцитирующих клеток кровь забирали в пробирки, предварительно обработанные силиконом (Serva, Германия) и содержащие раствор гепарина из расчета 20 ЕД на 1 мл крови.
Фагоцитарный индекс (Фи), представляющий отношение выраженности поглотительной и переваривающей функций фагоцитирующих клеток, определяли через 15 мин и 30 мин инкубации с тест-объектом фагоцитоза - тест-микробом (Micrococcus lysodeicticus), выращенном на мясопептонном агаре в термостате при температуре 37°C в течение 24 ч. В качестве оцениваемого показателя служил индекс переваривающей активности гранулярных лейкоцитов (ИП), представляющий отношение количества фагоцитирующих клеток в мазке через 30 мин инкубации крови с тест-объектом фагоцитоза к количеству фагоцитирующих клеток в мазке через 15 мин инкубации крови с тест-объектом фагоцитоза.
Значения ИП определяли по формуле:

где А - количество фагоцитирующих клеток на 100 просчитанных в мазке гранулярных лейкоцитов, поглотивших тест-микроб в течение 15 мин инкубации;
В - количество фагоцитирующих клеток на 100 просчитанных в мазке гранулярных лейкоцитов, поглотивших тест-микроб в течение 30 мин инкубации.
Величину ИП выражали в условных единицах (фиг. 1). Об удовлетворительном функционировании гранулярных лейкоцитов периферической крови свидетельствуют те значения ИП, которые больше 1. Полученные экспериментальные данные свидетельствуют, что применение как средства-прототипа, так и заявляемой синбиотической композиции способствует повышению функциональной активности гранулярных лейкоцитов периферической крови, так как в обоих случаях значения ИП превышают уровень показателя контрольной группы (различия с группой «контроль» достоверны при р<0,05). При этом применение заявляемой синбиотической композиции способствует более существенному повышению функциональной активности гранулярных лейкоцитов периферической крови (различия с группой «средство-прототип» достоверны при р<0,05), так как значения ИП более значимо превышают уровень показателя группы «контроль» (в 1,7-2,4 раза).
Концентрацию лизоцима в сыворотке крови определяли по методу Бухарина О.В. с соавт. (1974). Для этого кровь подопытного животного собирали в центрифужную пробирку и получали сыворотку. Затем 0,1 мл сыворотки крови переносили в бактериологическую пробирку и добавляли 0,9 мл физиологического раствора. Полученную смесь перемешивали и добавляли к ней 1,5 мл суспензии тест-микроба, которую предварительно стандартизовали на фотоэлектроколориметре ФЭК-56М до экстинкции 0,66.
Готовую суспензию, содержащую тест-микроб и исследуемую сыворотку, перемешивали и помещали в термостат на 30 мин при температуре 37°C. По истечении времени инкубации пробирки вынимали из термостата и определяли экстинкцию материала. Полученные величины экстинкций с помощью специальных таблиц переводили в значения, характеризующие концентрацию лизоцима в сыворотке крови, и выражали в мкг/мл.
Уровень миелопероксидазы (МПО) в сыворотке крови определяли по методу, разработанному на основании общепринятых подходов к выявлению этого субстрата в сыворотке крови и иммунокомпетентных клетках (Gell P.G.H. и др. (1968); Page R.C. и др. (1978)). Для определения концентрации МПО в сыворотке крови в 96-луночные планшеты для иммунологических реакций с плоским дном, начиная со второй лунки ряда А, разливали по 0,1 мл сывороток, взятых от подопытных животных. Затем в них добавляли по 0,1 мл реактива, представляющего собой смесь бензидина и 3% перекиси водорода. В первую лунку ряда А панели (контроль) вместо сыворотки наливали 0,1 мл физиологического раствора. После добавления реактива панели встряхивали, помещали в термостат и выдерживали при температуре 37°C в течение 60 мин. По прошествии времени инкубации панели вынимали из термостата и просматривали на вертикальном спектрофотометре «Dynatech» (Германия) при длине волны 495 нм. Концентрацию фермента в сыворотке крови получали в единицах экстинкции и выражали в условных единицах.
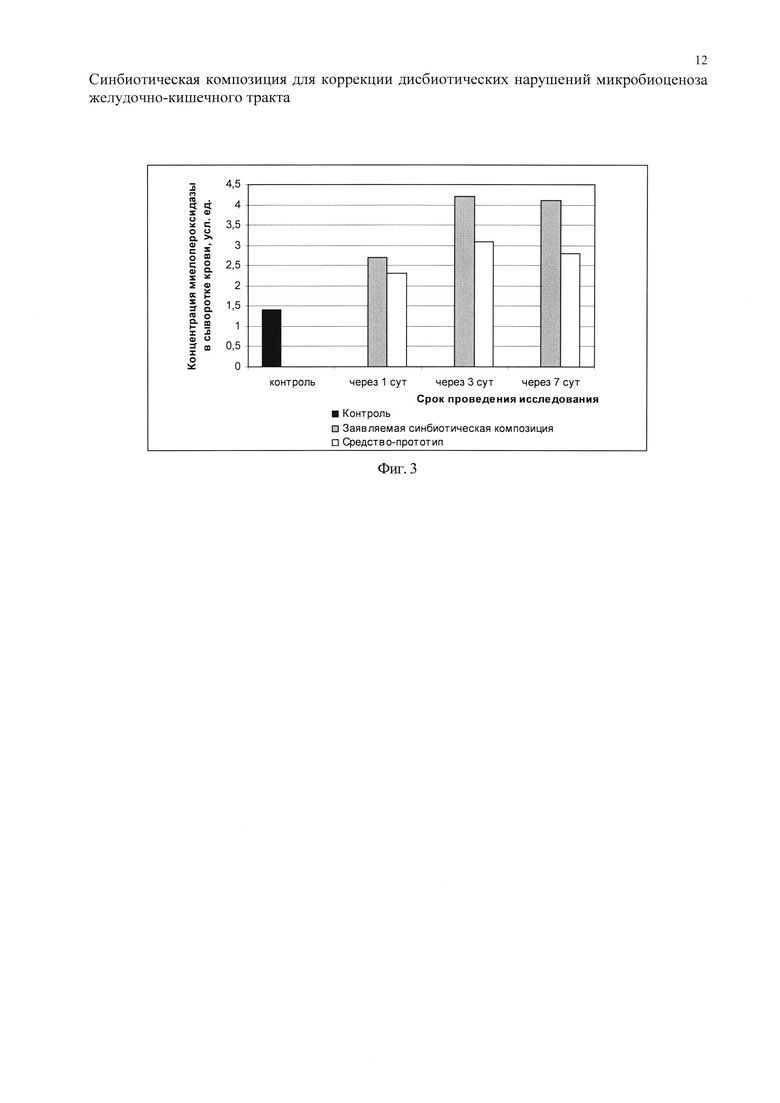
Как свидетельствуют представленные на фиг. 2-3 данные, эффекты средства-прототипа и заявляемой синбиотической композиции на факторы неспецифической резистентности организма проявляются на уровне клеток фагоцитарной системы крови и процессов, связанных с синтезом и секрецией в кровь ферментов лизоцима и миелопероксидазы. Динамика изменений значений факторов неспецифической резистентности подопытных животных экспериментальных групп, которым вводили средство-прототип или заявляемую синбиотическую композицию, практически одинакова, о чем свидетельствует отсутствие статистически значимых различий (р>0,05). Выявленные эффекты, заключающиеся в достоверном повышении функциональной активности факторов неспецифического иммунитета, регистрировали уже через 1 сут после введения указанных средств и длились они как минимум 7 сут от момента введения. При этом стимулирующее действие как средства-прототипа, так и заявляемой синбиотической композиции на механизмы иммунологической резистентности имело место уже после однократного их введения.
Введение средства-прототипа в течение 1, 3 и 7 сут приводило к достоверному повышению активности факторов неспецифической резистентности по сравнению с контролем. Проявляется это как в увеличении индекса переваривающей активности гранулярных лейкоцитов, так и в повышении концентрации лизоцима и миелопероксидазы. Достаточно существенное повышение функциональной активности указанных факторов наблюдается после однократного введения средства-прототипа уже в течение первых суток. С одной стороны, это свидетельствует об активации факторов неспецифического иммунитета и возможности обеспечения быстрой неспецифической защиты организма от патогенов. С другой стороны, это означает, что первичные механизмы действия средства-прототипа связаны не только с его прямым влиянием на микрофлору ЖКТ, но и с непосредственным воздействием на компоненты местного иммунитета, которые, в том числе, связаны с регуляцией баланса эндогенных цитокинов, усиливающих защитные реакции.
В случае использования заявляемой синбиотической композиции, дополнительно включающей β-глюкан в составе овсяных хлопьев, прослеживался более высокий уровень ее эффективности в установленных эффектах в сравнении со средством-прототипом. Так, заявляемая синбиотическая композиция оказывала достоверно более выраженное влияние на клетки фагоцитарной системы крови и их кислородзависимьш бактерицидный механизм (повышалась концентрация миелопероксидазы в сыворотке крови). Вместе с тем, известно, что увеличение концентрации сывороточной миелопероксидазы свидетельствует не только об активации неспецифической иммунологической резистентности, но и повышении вероятности ее активирующего влияния на иммунокомпетентные клетки, поскольку на их мембране имеется соответствующий специфический рецептор.
Заявляемая синбиотическая композиция по активности превосходит средство-прототип и в отношении собственно бактерицидных механизмов действия сыворотки крови, к которым относится активность сывороточного лизоцима.
Использование заявляемой синбиотической композиции способствует более эффективному повышению неспецифической резистентности организма.
Таким образом, проведенные исследования показали, что:
1. Заявляемая синбиотическая композиция, представляющая сбалансированный комплекс биологически активных веществ, обеспечивает достаточный уровень специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов, в том числе за счет стимулирующего действия метаболитов Bacillus subtilis ВКПМ № В-2335 на антагонистическую активности смеси лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06;
2. Установлен ряд благоприятных эффектов заявляемой синбиотической композиции на естественные составляющие индигенной микрофлоры кишечника. Так, метаболиты Bacillus subtilis ВКПМ № В-2335 проявляют лактогенный эффект и стимулируют рост и размножение пробиотических лактобацилл Lactobacillus plantarum 8R-A3, близких естественной составляющей индигенной микрофлоры кишечника.
А метаболиты Enterococcus faecium L-3 обусловливают бифидогенный эффект и стимулируют рост и размножение пробиотических бифидобактерий Bifidobacterium bifidum 1 и Bifidobacterium longum GT15, близких естественной составляющей индигенной микрофлоры кишечника;
3. Заявляемая синбиотическая композиция способствует эффективному повышению неспецифической резистентности организма.
Кроме того, заявляемая синбиотическая композиция не содержит токсичные и опасные для здоровья компоненты в количествах, превышающих допустимые уровни, нетоксична, не обладает способностью к кумуляции и не имеет нежелательные побочные эффекты.
Заявляемое изобретение удовлетворяет критерию «новизна», так как впервые для коррекции нарушений микробиоценоза ЖКТ предлагается использовать высокоэффективную синбиотическую композицию, представляющую сбалансированный комплекс биологически активных веществ, совместное комплексное воздействие которых обеспечивает высокий уровень антибактериального эффекта как за счет специфической антагонистической активности к широкому спектру условно-патогенных микроорганизмов, так и путем повышения неспецифической резистентности организма, выполненную в твердой капсулированной дозированной форме для перорального введения.
Заявляемое изобретение соответствует критерию «изобретательский уровень», так как из доступной информации не представлялась очевидной целесообразность включения в состав заявляемой синбиотической композиции метаболитов пробиотических штаммов бактерий Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 совместно с живыми лиофилизированными штаммами лактобацилл, возможность обеспечения лактогенного и бифидогенного эффектов ее отдельных компонентов, в совокупности обеспечивших достижение высокого уровня антагонистического эффекта в отношении широкого спектра условно-патогенных микроорганизмов и повышение неспецифической резистентности организма.
Соответствие заявляемого изобретения критерию «пригодность для применения» подтверждается приведенными результатами многочисленных исследований, показавшими несложную технологию производства заявляемой синбиотической композиции в твердой капсулированной дозированной форме для перорального введения, ингредиенты которой выпускаются в промышленных условиях, доступны и недороги, а заявляемая синбиотическая композиция обладает высокой стойкостью при хранении, безопасна, обеспечивает специфическую антагонистическую активность в отношении широкого спектра патогенов, способствует повышению неспецифической резистентности организма за счет существенной активации факторов неспецифическаго иммунитета.





Литература
1. Отраслевой Стандарт «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004-2003, утвержден приказом Министерства здравоохранения Российской Федерации от 09.06.2003 г. №231).
2. Шендеров Б.А. Микрофлора человека и животных и ее функции. - М.: Грантъ, 1998. - С. 416.
3. Регистрационное удостоверение № П N012084/01 от 06.08.2007.
4. Регистрационное удостоверение №013677/01 от 01.12.2006.
5. Воробейчиков Е.В., Василенко А.Ж., Синица А.В и др. Методологические аспекты применения пробиотиков и антибиотиков для экстренной профилактики инфекционных заболеваний // Сб. научн. тр. III съезда общества биотехнологов России им. Ю.А. Овчинникова. - М: МаксПресс, 2005. - С. 35-36.
6. Ткаченко Е.И., Авалуева Е.Б., Успенский Ю.П. и др. Эрадикационная терапия, включающая пробиотики: консенсус эффективности и безопасности // Клиническое питание, 2005. - №1. - С. 14-20.
7. RU 2287335 С1, 20.11.2006
8. Волков М.Ю. Новый пробиотик Бактистатин - продукт современных биотехнологий // Сб. науч. тр. II Междунар. научно-практ. конф. МЕДБИОТЕК «Перспективы развития биотехнологии в России». - Пущино: МаксПресс, 2005. - С. 21-22.
9. Лазарева Д.Н., Алехин Е.К. Стимуляторы иммунитета. - М: Медицина, 1985.
10. Волков М.Ю., Тухбатов И.А. Влияние нового пробиотика на обменные процессы и показатели иммунитета // Нива Урала, 2006. - №7. - С. 14-15.
11. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Микрофлора человека и животных и ее функция. - М.: Грантъ, 1998. - 288 с.
12. Ткаченко Е.И., Успенский Ю.П. Питание, микробиоценоз и интеллект человека. - М., 2006. - 590 с.
13. RU 220199 С1, 27.12.2003.
14. RU 2391393 С1, 10.06.2010.
15. RU 2391395 С1, 10.06.2010.
16. Авраменко В.А., Василевский В.А. Новые сорбенты на основе модифицированных цеолитов и их применение в экологии, сельском хозяйстве и медицине // Цеолиты Приморья. Тезисы докладов научно-практической конференции. - Владивосток, 1994. - С. 16-19.
17. Паничев А.М., Гульков А.Н. Природные минералы и причинная медицина будущего. - Владивосток: Издательство ДВГТУ, 2001. - 216 с.
18. Пылев Л.Н., Васильева Л.А., Валамина И.Е. Анализ биологической агрессивности цеолитов различных месторождений РФ // Природные минералы на службе человека. Материалы научно-практической конференции. - Новосибирск, 1999. - С. 68-70.
19. Andoh A., Tsujikawa Т., Fujiyama Y. Role of dietary fiber and short-chain fatty acids in the colon. Curr. Pharm. Des. 2003; 9(4):347-358.
20. ТУ 9229-006-57935236-10. Технические условия «Закваска кисломолочная «Авена-Л»».
21. ТУ 9229-001-57935236-03. Технические условия «Закваска кисломолочная «Авена» для производства продуктов лечебного питания».
22. ГОСТ 21149-93 «Хлопья овсяные. Технические условия».
23. ТУ 9197-001-56264254-11. Технические условия «Цеолит природный молотый - сырье для производства биологически активных добавок к пище».
24. Пылев Л.Н. Заключение Комиссии по канцерогенным факторам при МЗ РФ, 1998.
25. ТУ 6-09-4233-76. Технические условия «Кальций стеариновокислый, 1-водный (кальций стеарат)».
26. ГОСТ 14922-77 «Аэросил. Технические условия».
27. Технический регламент Таможенного союза TP ТС 021/2011 «О безопасности пищевой продукции» (приложения 1 и 2, раздел 1.9, приложение 3, раздел 10). - 242 с.
28. Гланц Э. Медико-биологическая статистика. - М.. 1999.
29. Методы экспериментальных исследований по установлению порогов действия промышленных ядов на генеративную функцию. Методические рекомендации. - М., 1969. - 25 с.
30. Методы экспериментальных исследований по установлению порогов действия промышленных ядов на генеративную функцию с целью гигиенического нормирования. Методические рекомендации 1744-77. - М., 1978. - 35 с.
31. Оценка мутагенной активности химических веществ микроядерным методом. Методические рекомендации 28/10. - М., 1984. - 21 с.
32. Критерии оценки и методы прогнозирования отдаленных последствий действия на организм вредных веществ в воздухе рабочей зоны. Информационное письмо. НИИ гиг. тр. и проф. забол. - М., 1985. - 15 с.
33. Ермоленко Е.И., Исаков В.А., Ждан-Пушкина С.Х., Тец В.В. Количественная оценка антагонистической активности лактобацилл. // Журн. микробиол., эпидем., иммунобиол. - 2004. - №5. - С. 94-98.

Изобретение относится к области медицины и касается средств для коррекции дисбиотических нарушений микробиоценоза желудочно-кишечного тракта. Предлагаемая синбиотическая композиция выполнена в твердой дозированной форме в виде капсул и включает, мас. %: пробиотическую составляющую, представляющую рациональную комбинацию лиофилизатов пробиотических штаммов бактерий Lactobacillus delbraeckii TS1-06 (2,5) и Lactobacillus fermentum TS3-06 (2,5), по 107 клеток/капс. каждого штамма, а также стерилизованных высушенных культуральных жидкостей с метаболитами пробиотического штамма бактерий Bacillus subtilis ВКПМ № В-2335 (1,9) и метаболитами пробиотического штамма бактерий Enterococcus faecium L-3 (8,4), пребиотическую составляющую в виде овсяных хлопьев (20,1), цеолит в качестве адсорбента-носителя (64,3) и стеарат кальция или аэросил в качестве технологической добавки (0,3). Состав композиции обеспечивает достаточный уровень специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов, благоприятное воздействие на индигенную составляющую микрофлоры кишечника, способствует эффективному повышению неспецифической резистентности организма. 3 ил., 22 табл., 8 пр.
Синбиотическая композиция для коррекции дисбиотических нарушений микробиоценоза желудочно-кишечного тракта, включающая пробиотическую и пребиотическую составляющие, адсорбент-носитель и вспомогательную технологическую добавку, в которой в качестве пробиотической составляющей используют стерилизованную высушенную культуральную жидкость, содержащую метаболиты пробиотического штамма бактерий Bacillus subtilis ВКПМ № В-2335, в качестве адсорбента-носителя используют природный минерал цеолит, в качестве вспомогательной технологической добавки используют стеарат кальция или аэросил, отличающаяся тем, что пробиотическая составляющая представляет собой рациональную комбинацию живых пробиотических микроорганизмов и метаболитов пробиотических микроорганизмов и дополнительно включает лиофилизаты пробиотических штаммов бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 и стерилизованную высушенную культуральную жидкость, содержащую метаболиты пробиотического штамма бактерий Enterococcus faecium L-3, в качестве пребиотической составляющей используют овсяные хлопья, выполнена при этом в твердой дозированной форме в виде капсул, а количество ингредиентов в одной капсуле составляет, масс. %:
Авторы
Даты
2016-07-27—Публикация
2015-04-10—Подача