Изобретение касается нового спо соба получения новых химических соединений, относящихся к классу о-хинонов, производных 1,2-диоксо-3-хлорнафталина или 4,5-диокср-6-хлориндола, замещенных в положени 4 нафталина или 7 индола остатко р-дикарбонильного соединения, обще формулы ci , иос-сц-сог где К и К каждый атом водорода . К - метил, фенил; метил. этоксигруппа; X - группа - СН СНи при метил, К - карбэтоксигруппа, К - метил, R - этоксиРруппа, X - группа ; М-М ; которые являются полупродуктами в синтезе потенциальных биологически активных соединений. Известно, что 2,3-дихлор-с гнафтохинон легко вступает в р- акции с нуклеофильными реагентами в присутствии оснований. При этом в зависимости, от концентрации реагентов происх.одит замещение одного или двух атомов хлора. Например, реакция нат рийацетоуксусного. эфира с дихлор-ot-нафтохиноном в избытке нуклеофила идет в две стгодии
No CCHsCOCHCOfCfHs
ci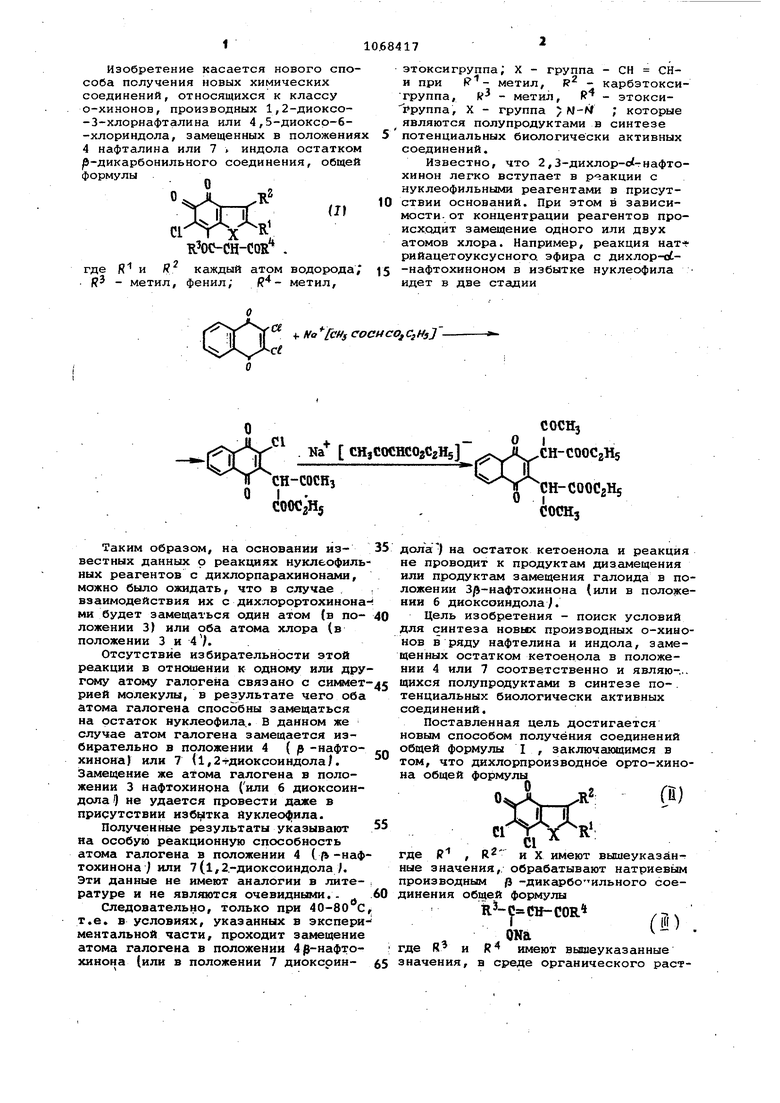

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных @ -тиофенуксусной кислоты | 1978 |
|
SU753091A1 |
| 2-Замещенные 3-окси-5-метил-4-тиофенуксусные кислоты,обладающие противовоспалительной и анальгетической активностью и способ их получения | 1981 |
|
SU1015622A1 |
| ФОТОХРОМНЫЕ ОКСАЗИНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРОИЗВОДСТВА | 2002 |
|
RU2315042C2 |
| ПРОИЗВОДНЫЕ 5-ЗАМЕЩЕННЫХ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2007 |
|
RU2387642C2 |
| Композиция для регулирования роста растений | 1972 |
|
SU518102A3 |
| ХЛОРИДЫ ХЛОРПИРИДИНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2138481C1 |
| Состав для покрытий | 1977 |
|
SU651710A3 |
| Способ получения замещенных ненасыщенных алифатических эфиров | 1972 |
|
SU500751A3 |
| ФТОРИРОВАННЫЕ ПРОИЗВОДНЫЕ 1,4-НАФТОХИНОНА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА В КУЛЬТУРЕ | 2010 |
|
RU2443678C1 |
| Способ получения 2-(аминофенилолимино)3-аза-1-тиациклоалканов | 1972 |
|
SU455544A3 |
1. СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,2-ДИОКСО-3-Х-ЛОРНАФТАЛИНА ИЛИ 4,5-ДИОКСОИНДОЛА общей формулы f 0 , R OC-CH-COR где R и R - каждый атом водорода R - метил, фенил, R, - метил, этоксигруппа; X - группа - СИ СН - ; и при R -метил; R -карбэтоксигруппа; Р -метил, .R- этоксигруппа; X - группа М-Н ; заключающийся в том,что дихлорпроизгде R , R, У имеют вышеуказанные значения, обрабатывают натриевым производным 0 -дикарбрнильного соединения общей формулы Ш Ri-OCH-COR I ОКа где R и Я имеют вышеуказанные-. 2 значения, в среде органического растворителя при 40-80с. 2. Способ получения по п.1, заключающийся в том, что в .. зь качестве органического растворителя используют бензол или диоКсан. 00 IP
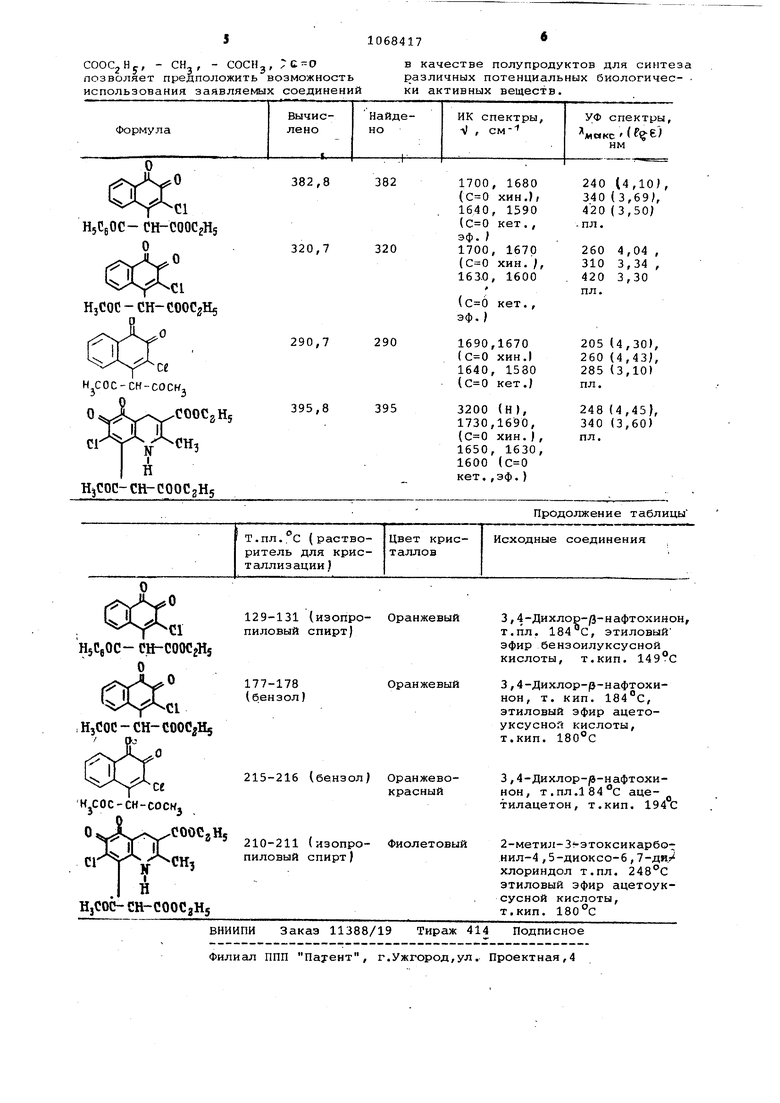
Таким образом, на основании известных данных о реакциях нуклеофиль ных реагентов с дихлорпарахинонами, можно было ожидать, что в случае взаимодействия их с дихлорортохинона ми будет замещаться один атом (в положении 3) или оба атома хлора (в положении 3 и 4 V. Отсутствие избирательности этой реакции в отношении к одному или дру гому атому галогена связано с рией молекулы, в результате чего оба атома галогена способны замещаться на остаток нуклеофила.. В данном же случае атом галогена замещается избирательно в положении 4 ( р -нафтохинона) или 7 (1,2-гдиоксоиндола/. Замещение же атома галогена в положении 3 нафтохинона (или 6 диоксоиндола1 не удается провести даже в присутствии избытка йуклео41ила. Полученные результаты указывают на особую реакционную способность атома галогена в положении 4 { | -наф тохинона J или 7(1,2.-диоксоиндола Л Эти данные не имеют аналогии в литературе и не являются очевидными.. Следовательно, только при 40-80 С т.е. в условиях, указанных в экспери ментальной части, проходит замещение атома галогена в положении 4Э нафтохинона (или в положении 7 диоксриндола) на остаток кетоенола и реакция не проводит к продуктам дизамещения или продуктам замещения галоида в положении 3 -нафтохинона (или в положении б диоксоиндолаj. Цель изобретения - поиск условий для синтеза новых производных о-хинонов в ряду нафталина и индола, замещенных остатком кетоенола в положении 4 или 7 соответственно и являю-.,. щихся полупродуктами в синтезе по-. тенциальных биологически активных соединений. Поставленная цель достигается новым способом получения соединений общей формулы I , заключающимся в том, что дихлорпроизводное орто-хинона общей формулы 0%.л , f « где Р , R и X имеют вышеуказанные значения, обрабатывают натриевым производным р -дикарбо-ильного соединения общей формулы k -0 CTJ-COR rifi) , ,ONa где R и R имеют вышеуказанные значения, в среде органического растворителя при 40-80 С. Предпочтитель но в качестве органического растворителя используют бензол илч диоксан. Реакция идет по схеме О ПГ 4- -г«- ° ROC- CH-COR где R, R, R, R и X имеют вышеуказанные значения. Структура полученных соединений подтверждена элементным анализом и спектральными характеристиками, В масс-спектрах соединений общей формулы I значения массовых чисел молекулярных ионов соответствуют ма совым весам соединений общей формулы I . В ИК-спектрах соединений общей формулы Г имеются полосы поглощени в области 1600-1700 см, указывающ , на наличие сложноэфирной и карбонил ной групп.. . Соединения общей формулы I пред ставляют собой кристаллические вещества оранжевого (производные нафталина) и фиолетового (производные индола цвета, растворимые в хлороформе, уксусьой кислоте, диоксане, ацетоне, бензоле и спирте. Исходные соединения. - орто-хинон с общей формулой l доступны и получ ются известными способами. П р им ер 1. Получение oi-(1,2 -диоксо-З-хлорнафт-4-ил )бензоилуксу ного эфира (la ). , К раствору 2,27 г (о,01 моль) 3,4-дихлор-р-нафтохинона в 80 мл бе зола, нагретому до 40-50 С, прибавляют при перемешивании 2,57 г 10,012 моль) натриевого производног этилового эфира бензоилуксусной кис лоты. Выпадает в небольшом количест ве черный осадок. Реакционную массу перемешивают 10-15 мин при нагреван на водяной бане, а затем оставляют 30 мин без нагревания. Черный осадо представляющий собой натриевое производное 1а, отфильтровывают и бенз упаривают. Остаток - оранжевого цве та масло - при охлаждении полность превргидается в кристаллы. Получают 2,8 г (73%) оС-(1,2-дио со-З-хлорнафт-4-ил ) бензоилуксусног эфира (Iq) в виде кристаллов оранже вого цвета, растворимых в хлороформе, диоксане,. ацетончз, т.пл. 129131 С (из изопропилового спирта ). Вычислено, %: С 65,89, Н 3,95, С1 9,26. 21 15 f Найдено, %: С 65,89, Н 4,10, С1 9,04. В условиях, аналогичных примеру 1, получены соединения 16, в /-(1,2-диоксо-3-хлорнафт-4--ил )-ацетоуксусный эфир (1 б/ получен с выходом 80,62%. Вычислено, %: С 59.92, Н 4,09, CI 11,05. . Найдено, %; С 60,01, Н 4,23, CS 10,77. cL- (1,2-диоксо-3-хлорнафт-4-ил - . -ацетилацетон (1 в) получен с выходом 83%. Вычислено, %: С 61,97, Н 3,81, С1 12.20. .,,С104. Найдено, %: С 61,62, Н 3,64, С1 11,90. Пример 2. Получение оС.-(2-метил-З-карбэтокси-4,5-диоксо-6-хлориндол-7-ил )-ацетоуксусного эфира (г). Суспензию 2,67 г (0,01 моль) 2-метил-З-карбэтокси- 4,5-диоксо-6,7-дихлориндола в 200 мл диоксана нагревают до 70-80°С и убирают нагрев. К образовавшемуся раствору добавляют при перемешивании 1,68 г (0,011 моль) натриевого производного ацетоуксусного эфира. Реакционную массу перемешивают без нагревания 30 мин, затем обрабатывают 5 мл концентрированной соляной кислоты и добавляют 20 мл метилового спирта и 200 мл воды. Полученный It из реакционной массы экстрагируют бензолом, бензольные вытяжки промывают водой до нейтральной реакции, сушат сульфатом натрия и упаривают в вакууме. К остатку в виде густого масла фиолетового цвета добавляют 15-20 мл изопропилового спирта и смесь охлаждают льдом. Выкристаллизовавшийся осадок отфильтровывают, промывают изопропнловым спиртом. Получают 1,9 г (48%) ot -(2-метил-З-карбэтокси-4,5-диоксо-6-хлориндол-7-ил ) ацетоуксусного эфира в виде кристаллов фиолетового цвета,- растворимых в уксусной кислоте, спиртах, бензоле, хлороформе, диоксане, т.пл. 210-211С (из изопропилового спирта). й ачислено, %: С 54,62, Н 4,58, С1 8,96, N 3,54. C gl gClNO. Найдено, %: С 55,00, Н 4,47, С1 9,02, N 3,47. Полученные данные сведены в таблицу. Положительный эффект данного способа состоит в том, что наличие в молекулах соединений общей формулы I таких функциональных групп, как ;c-o
, , - COCHg,
COOCjHc, - CH
позволяет предположить возможность
использования заявляемых соединений
в качестве полупродуктов для синтеза различных потенциальных биологичес- ки активных веществ.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| II Reaction with Ethyl Acetoacetate, J | |||
| Org.Chem | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
Авторы
Даты
1984-01-23—Публикация
1981-11-30—Подача