Изобретение относится к фосфорорганической химии, а именно к новому химическому соединению 2-метилгепт-2-ен-6-ил-трифенилфосфонийбромиду формулы
I +
PlCgHsbBF ш
которое может быть использовано в ка честве полупродукта в синтезе убихинона-10.
-Убихинон-10 является природным соединением, содержащимся в животйых клетках и участвукщим в дыхательных электронотранспортных системах митохондрий, применяется также в качестве кардиотонического средства при ишемической болезни сердца для уменьшения кардиотоксичности сердечньпс препаратов, при нарушениях биоэнергетических процессов
РРЬзНВг
Ш) Фосфониевая соль (lit) не вьщеленаЗО в индивидуальном состоянии и не описаны ее физико-химические свойства. Возможность получения вторичной фосфониевой соли (III) обусловлена на- личием сопряженной диеновой системы, 35 оказывакжей активирукицее действие на ход реакции. Однако данный способ не ножет быть использован для синтеза .соли (I). ввиду отсутствия методов избиратель- 40 ного восстановления оС, fi -двойной свяОМеО , NaBH 11и f MeoVvV H™ О
(Г) О R . К, СО, МеОН
Ш)
(Ш)
и для усиления иммунной активности lj.
.Предлагаемая фосфониевая сапь(1) , ее свойства и способ получения, а также способ получения изопреноидов, в частности убихинона-10, с использованием вторичных фосфониевых солей и методы наращивания изопреноидной цепи на восьмиуглеродный фрагмент, в литературе не описаны.
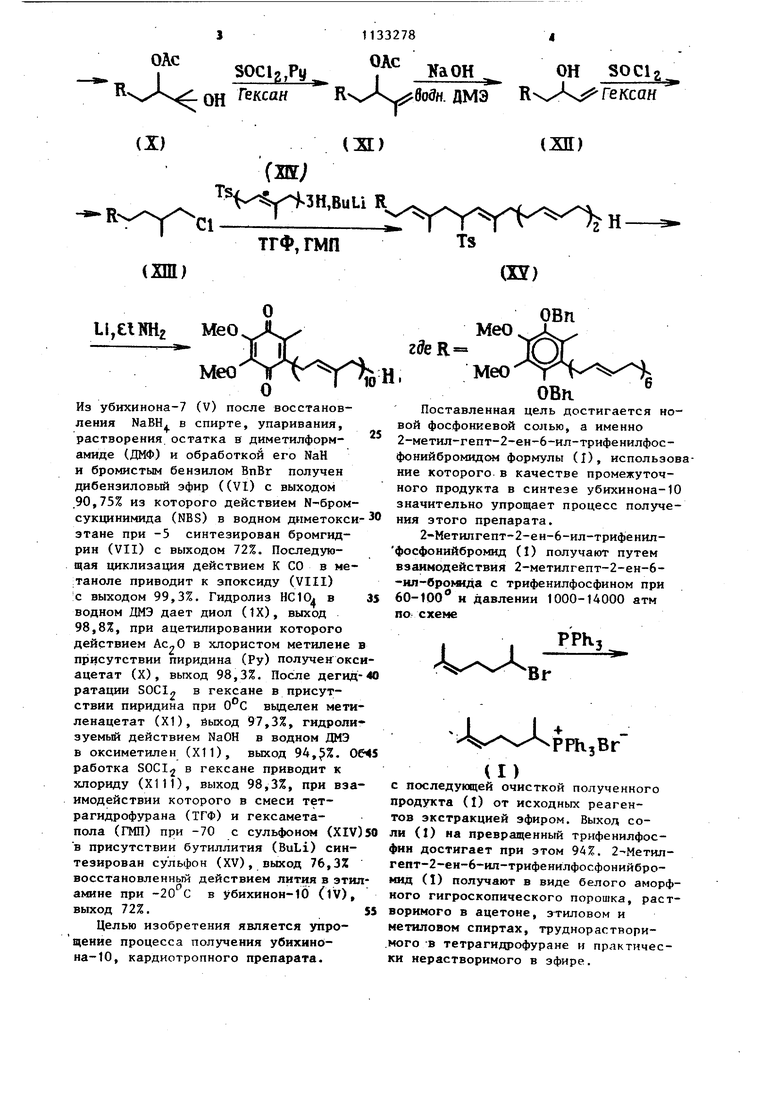
Известен способ получения вторичной фосфониевой соли (111), как структурного аналога фосфониевой соли (I), синтезируемой из псевдоионола (11, содержащего 13 атомов углерода ио,Л-у,5 -диеновую систему с гидробромидом трифеннлфосфина в ацетонитриле при комнатной температуре и атмосферном давлении 2 по схеме
РРЬзВг
(Ж)
(К) зи в случае выхода к аналогу соли (Т) формулы ЧоХЧ.ХХ р РРКЛг Известен десятистадийный метод З получения убихинона-10 (IV) из трудно доступного убихинона-7 (V) с исполь эованием в качестве промежуточного продукта п-толштфарнезилсульфона (XIV по схеме УВ$-5 wi .д Мн. ДМэ .ДМЭ 1 AcgOtPy нею/
(Х)(Ж)
(ж;
,BuLi R
r ciLi
ТГФ, ГМП (ХШ) LijElKHz MeO Из убихинона-7 (V) после восстановления NaBH. в спирте, упаривания. растворения остатка в диметилформамиде (ДМФ) и обработкой его NaH и бромистым бензилом ВпВг получен дибензиловый эфир ((VI) с выходом .90,75% из которого действием N-бромсукцинимида (NBS) в водном диметокси этане при -5 синтезирован бромгидрин (VII) с выходом 72%. Последующая циклизация действием К СО в ме:таноле приводит к эпоксиду (VIII) ;с выходом 99,3%. Гидролиз НС 10. в водном ДМЭ дает диол (IX), выход 98,8%, при ацетилировании которого действием в хлористом метилене присутствии пиридина (Ру) получен окс ацетат (X), выход 98,3%. После дегид ратации SOCI2 в гексане в присутствии пиридина при вьзделен нети ленацетат (Х1), йыход 97,3%, гидроли зуемьй действием NaOH в водном ДМЭ в оксиметилен (XII), выход 94,%. 0 работка SOCI в гексане приводит к хлориду (Х111), выход 98,3%, при вза имодействии которого в смеси тетрагидрофурана (ТГФ) и гексаметас сульфоном (XIV пола (ГМП) при -70 в присутствии бутиллития (BuLi) синтезирован сульфон (XV), выход 76,3% восстановленный действием лития в эти амине при -20 С в убихиион-10 (lV), выход 72%. Целью изобретения является упрощение процесса получения убихинона-10, кардиотропного препарата.
(511)
Ts
(XY) МеО . МеО Поставленная цель достигается новой фосфониевой солью, а именно 2-метил-гепт-2-ен-6-ил-трифенилфосфонийбромидом формулы (I), использование которого в качестве промежуточного продукта в синтезе убихинона-10 значительно упрощает процесс получения зтого препарата. 2-Метилгепт-2-ен-6-ил-трифенилфосфонийбромид (1) получают путем взаимодействия 2-метилгепт-2-ен-6-ил-броьмда с трифенилфосфином при 60-100° н давлении 1000-14000 атм но схеме . -PPhjBr (I) с последующей очисткой полученного продукта (I) от исходных реагентов экстракцией эфиром. Выход соли (1) на превращенный трифенилфосфин достигает при этом 94%. 2-Метилгепт-2-ен-6-11п-трифенилфосфонийбромид (I) получают в виде белого аморфного гигроскопического порошка, растворимого в ацетоне, этиловом и метиловом спиртах, труднорастворимого -в тетрагидрофуране и практически нерастворимого в эфире.
511332786
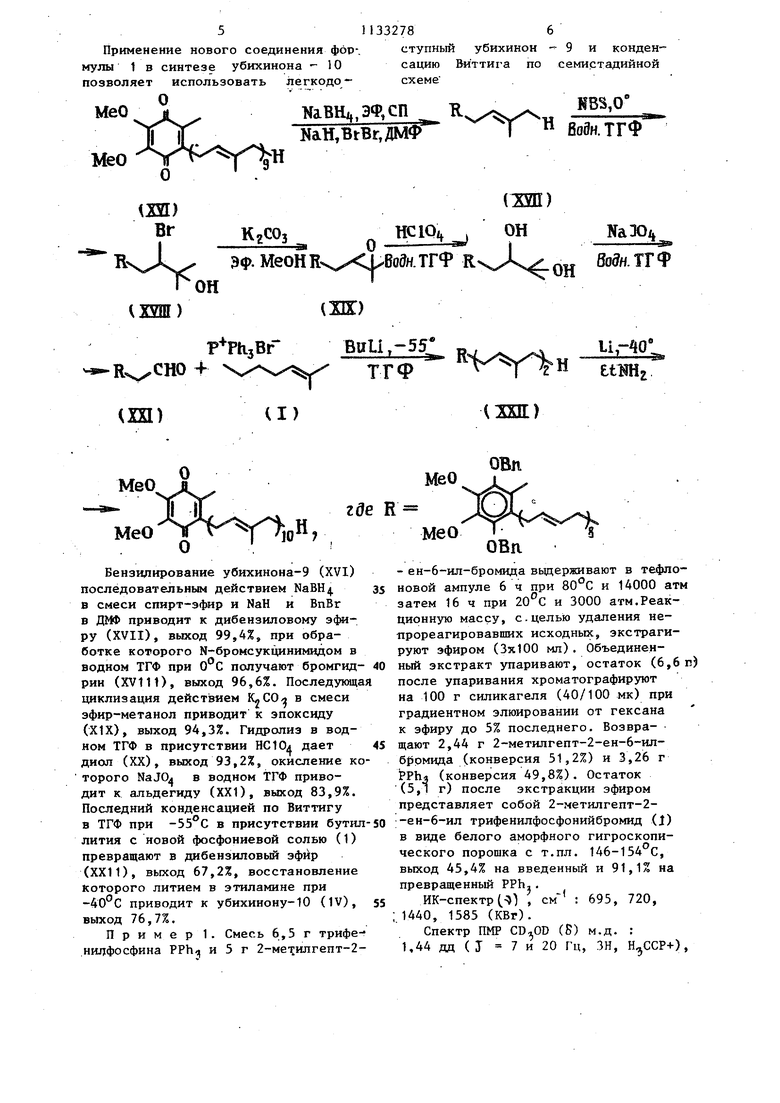
Применение нового соединения фор-. ступный убихинон - 9 и конденмулы 1 в синтезе убихинона --10 сацию Виттига по семистадийной позволяет использовать легкодо- схеме JE 5ii25 L КаН,ВгВг,ДМФт 1X21) Вг КгСОз Эф- МеоН Кхх ЬВоЗн. ТГФ ОН ХШ)) F PhjBrR CHO 4
(I)
(Ш) HClQj BuU,-55 ТГФ
:
13Ж) ° . ЙОЙН.ТГФ (2Ш) ОН NaJOft Ч QH am.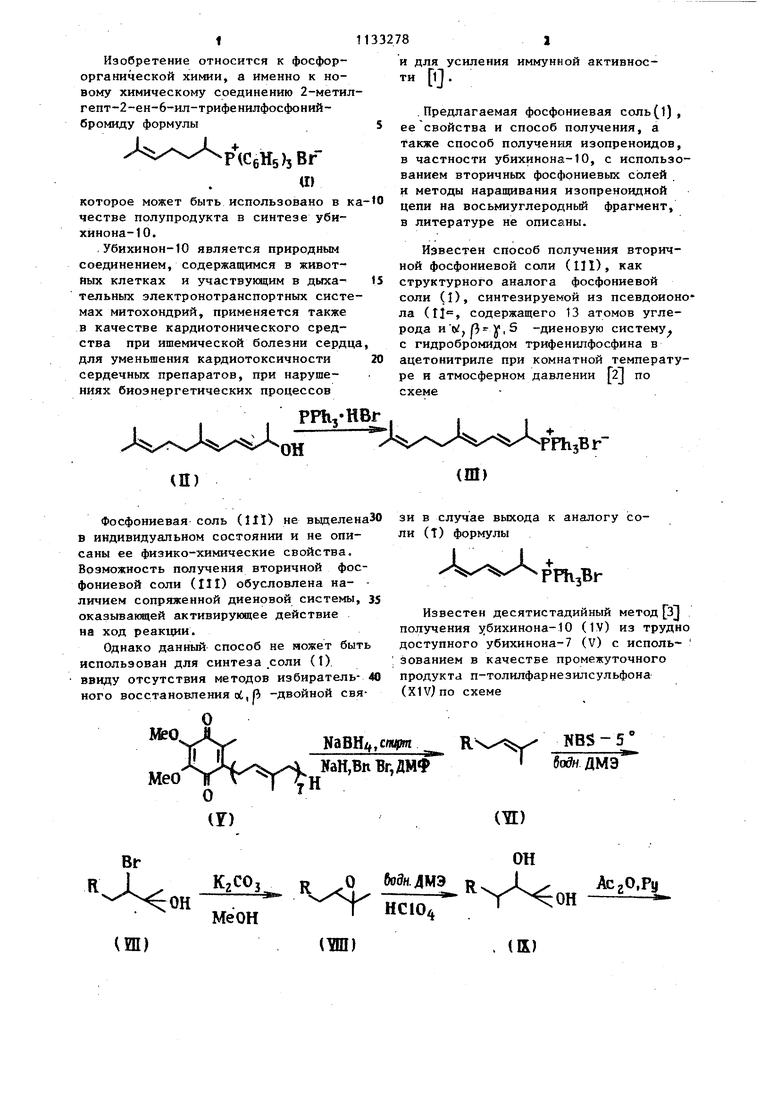

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения (4R,8R)-4,8-диметилдеканаля | 1986 |
|
SU1343759A1 |
| Способ получения производных метаболитов витамина А | 1980 |
|
SU1004350A1 |
| РАСТВОРИМЫЕ В ВОДЕ ФОСФОНООКСИМЕТИЛОВЫЕ ЭФИРЫ ЗАТРУДНЕННЫХ СПИРТОВ ИЛИ ФЕНОЛОВ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ, СПОСОБ АНЕСТЕЗИИ И СПОСОБ ЛЕЧЕНИЯ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 1999 |
|
RU2235727C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕТИЧНЫХ АМИНОВ, СОДЕРЖАЩИХ ЭТЕНИЛБЕНЗИЛЬНЫЕ ЗАМЕСТИТЕЛИ | 2015 |
|
RU2732296C2 |
| АЛКИЛАМИНОКЕТОНЫ | 1994 |
|
RU2141942C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 1992 |
|
RU2054006C1 |
| Способ получения производных простациклина или их солей | 1979 |
|
SU1003754A3 |
| Способ получения 13 С -мочевины | 2016 |
|
RU2638837C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕНЗИЛБУТИЛОВОГО ЭФИРА | 2012 |
|
RU2536486C2 |
| ПРОЛЕКАРСТВА 3-АЦИЛ-2-ОКСИНДОЛ-1-КАРБОКСАМИДОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124514C1 |
2-Метилгепт-2-ен-6-ил-трифенилфосфонийбромид формулы Н5)зВг в качестве промежуточного продукта в синтезе убихинона-10.
MeO
MeO
Бензилирование убихинона-9 (XVI) последовательным действием NaBH в смеси спирт-эфир и NaH и ВпВг в ДМФ приводит к дибензиловому э ру (XVII), выход 99,4%, при обработке которого N-бромсукцинимидом в водном ТГФ при 0°С получают бромгидрин (XV111), выход 96,6%. Последующа 1щклизация действием K«CO в смеси эфир-метанол приводит к эпоксиду (XIX), выход 94,3%. Гидролиз в водном ТГФ в присутствии HC10i дает диол (XX), выход 93,2%, окисление которого NaJO в водном ТГФ приводит к альдегиду (XXI), выход 83,9%. Последний конденсацией по Виттигу в ТГФ при -55°С в присутствии бутил лития с новой фосфониевой солью (1) превращают в дибензиловый эфир (XXI1), выход 67,2%, восстановление Которого литием в этиламине при приводит к убихинону-10 (IV), выход 76,7%.
Пример 1. Смесь 6,5 г трифенилФосфина PPh и 5 г 2-ме5илгепт-2MeO
где R
МеО
ОВл
- ен-б-ил-бромида вьщерживают в тефлоновой ампуле 6ч при 80°С и 14000 атм затем 16 ч при 20с и 3000 атм.Реакционную массу, с.целью удаления непрореагировавших исходных, экстрагируют эфиром (3x100 мл). Объединенный экстракт упаривают, остаток (6,6 после упаривания хроматографируют на 100 г силикагеля (40/100 мк) при градиентном элюировании от гексана к эфиру до 5% последнего. Возвращают 2,44 г 2-метилгепт-2-ен-6-илбррмида (конверсия 51,2%) и 3,26 г PPh« (конверсия 49,8%). Остаток (3,1 г) после экстракции эфиром представляет собой 2-метилгепт-2-ен-6-ил трифенилфосфонийбромид (J) в виде белого аморфного гигроскопического порошка с т.пл. 146-154°С, выход 45,4% на введенный и 91,1% на превращенный PPh,,
ИК-спектр() , см : 695, 720, ;1440, 1585 (КВг).
Спектр ПМР (Б) м.д. : 1,44 дд ( I 7 и 20 Гц, ЗН, ), 1,62 с (3H,t uc-MeC-):1,72 с (ЗН, транс-МеС), 1,95 м (2Н, ), 2,34 м (2Н, СН,С-), 4,1 м (1Н, НСР 7 Гц, НС-), 7,9 м 5,18 т (1H,4J (15 Н, Ph). Найдено, % Р 6,70. с;, &лчислено, %: Р 6,83. П р и м е р 2. Смесь 885 мг PPh и 645 мг 2-метилгепт-2-ен-6-ил-бромида вьщерживают в тефлоновой ампуле 6 ч при 60°С и 14000 атм, затем 16 ч при 20°С и 3000 атм. Ре акционную массу экстрагируют эфиром (3x60 мл). Объединенный экстракт уп ривают, остаток (1,35 г) после упаривания хроматографируют на 30 г снликагеля (40./100 мк) при градиентном элкдаровании от гексана к эфиру до 5% последнего. Возвращаю 540 мг 2-метш1гепт-2-ен-6-ил-бромида (конверсия 16,2%) и 780 мг PPh (конверсии 11,8%). Остаток (170 мг) после экстракции эфиром представляет собой 2-метилгепт-2тен-6-ил-трифенилфосфонийбромид (1) t выход 11,1% на введенный и , на превращенный PPlv Примерз. Смесь 885 мг PPh и 550 мг 2-метш1гепт-2-ен-6-ил-бромида вьздерживают в тефлоновой ампуле b ч при 80°С и 12000 атм, затем 16 ч при 20 С и 3000 атм. Реакционную массу экстрагирзгют э4 1ром (3x60 мл)..Объединенный экстракт упаривают, остаток (1,15 г) по ле упаривания хроматографируют на 30 г силикагеля (40/100 мк) при градиентном элюировании от гексана к до 5% последнего. Возвращают 360 мг 2-метил-гепт-2-ен-6-ил-бромида (конверсия 34,6%) и 510 мг PPhj (конверсия-42,5%). Остаток (510 мг) после экстракции эфиром представляет собой 2-метилгепт-2-ен-6-ил-трифенш1фосфонийбромид (1), выход 33,4% на введенный и 78,5% на превращенньй PPh П р и м е р 4. Смесь 885 мг PPh и 550 мг 2-метш1гепт-2-ен-6-ил бромида вьрерживают в тефлоновой ампуле 3 часа при 100 и 10000 атм, затем 16 час при 20 и 3000 атм. Реакционную массу экстрагируют эфиром (3x60 мл).Объединенный экстракт упаривают, остаток (1,35 г) после упаривания хроматографируют на 30 г силикагеля (40/100 мк) при градиентном элюировании от гексана к эфиру до 5% последнего. Возвращают 330 мг 2-метилгепт-2-ен-6-ил-еромида (конверсия 40%) и 470 мг PPh (конверсия 47%). Остаток (500 мг) после экстракции эфиром представляет собой 2-метилгепт-2-ен-6-ил-трифенилфосфонийбромид(1), выход 32,8%, в виде темного порошка. Фосфониевая соль (I), получаемая одностадийным синтезом с хорошим выходом и высокой степенью чистоты из 2-метш1-гепт-2-ен-6-ил-бромида, является доступным продуктом, так как синтезируется из доступных исходных реагентов. Известный в лабораторной практи-. ке сульфоновый синтез убихинона-10 из труднодоступного убихинона-7 предполагает в качестве реагента для наращивания изопреноидной цепи П -толилфарнезилсульфон. Последний является труднодоступным соединением, так как его семистадийный синтез из линапоола приводит с низким выходом к смеси , траис -изомеров, что обусловливает необходимость дополнительных трудоемких операций по вьаделению чистого транс -изомера З . Применение 2-метилгепт-2-ен-6-ил-трифенилфосфонийбромида в качестве промежуточного продукта в синтезе убихинона-10 позволяет использовать в качестве исходного реагента доступный убихинон-9, а также сократить количество стадий получения убихинона-10 с десяти до семи.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Коган Л.М | |||
| и др | |||
| Убихиноны: перспективы применения в медицине | |||
| Химико-фармацевтический журнал, 1983, 17, 4, с | |||
| Способ включения усилителя в трансляцию | 1923 |
|
SU403A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Escheimnosfet W | |||
| Uebelhart P | |||
| Eugster С.Н | |||
| Synthese und Chiralitat &ОП | |||
Авторы
Даты
1985-01-07—Публикация
1983-04-21—Подача