оэ
Од 4 О9 4
113646342
Изобретение относится к биохимий и 1,2 ма раствора гемоглобина (3,37х
и биотехнологии, а именно к определению активности одного из важнейших ферментов метаболизма липидов - фосфо- g глобина 2,9-10 М) , В опытную и
хЮ- М) в 0,01 М трис-НС буфере рН 7,4 (конечная концентрация гемолипазы А
г
Цель изобретения - упрощение способа определения активности фосфоли- пазы
Способ заключается в том, что анализируемую пробу, содержащую фосфо- липазу А, помещают в одну из кювет, в которых находятся мицеллярная.форма субстрата (яичный лецитин и холат натрия в соотношении 1:2-4), кофактор - соль кальция и гемоглобин, с последующей регистрацией разностных спектров гемопротеида на двухлучевом спектрофотометре. При этом интенсивность спектра между максимумом при 423 нм и минимумах при 405 им пропорциональна количеству жирной кислоты, освобождаемой в результате ферментативной реакциио
контрольную кюветы помещают по 2 мл реакционной смеси, прописывают на приборе Specord нулевую линию. Реакцию начинают добавлением в опытную
10 кювету возрастающего количества
фермента - 2,4,8,12,18 мкл (исходная концентрация ФЛА 0,011 мкг/мкл) Через 10 мин записывают изменение интенсивности между максимумом и ми1Е нимумом в разностном спектре гемоглобина в каждом случае отдельно Сразу же реакцию останавливают добавлением 0,1 мл 0,25 М ЭДТУ для того, чтобы провести параллельно опре20 деление активности фермента уже известным хроматографическим способом. Для этого к содержимому опытной кюветы добавляют двойной объем смеси хлороформа с метанолом в соотнощеглобина 2,9-10 М) , В опытную и
хЮ- М) в 0,01 М трис-НС буфере рН 7,4 (конечная концентрация гемоглобина 2,9-10 М) , В опытную и
контрольную кюветы помещают по 2 мл реакционной смеси, прописывают на приборе Specord нулевую линию. Реакцию начинают добавлением в опытную
кювету возрастающего количества
фермента - 2,4,8,12,18 мкл (исходная концентрация ФЛА 0,011 мкг/мкл) Через 10 мин записывают изменение интенсивности между максимумом и минимумом в разностном спектре гемоглобина в каждом случае отдельно Сразу же реакцию останавливают добавлением 0,1 мл 0,25 М ЭДТУ для того, чтобы провести параллельно определение активности фермента уже известным хроматографическим способом. Для этого к содержимому опытной кюветы добавляют двойной объем смеси хлороформа с метанолом в соотноще

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения активности фосфолипазы С | 1988 |
|
SU1682897A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФОСФОЛИПАЗЫ Д | 1992 |
|
RU2035719C1 |
| ФОСФОЛИПИДНЫЙ ФЛУОРЕСЦЕНТНЫЙ ЗОНД И ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФОСФОЛИПАЗЫ А2 В СЫВОРОТКЕ КРОВИ | 2012 |
|
RU2517538C1 |
| ФЛУОРЕСЦЕНТНЫЙ ЗОНД И ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФОСФОЛИПАЗЫ А2 | 2012 |
|
RU2517746C1 |
| Способ определения концентрации гемоглобина в крови | 1986 |
|
SU1386901A1 |
| СПОСОБ ДИАГНОСТИКИ ФИБРОЗНОГО ПРОЦЕССА В ПЕЧЕНИ ПРИ ХРОНИЧЕСКОМ ВИРУСНОМ ГЕПАТИТЕ | 2004 |
|
RU2270451C1 |
| СПОСОБ ДИАГНОСТИКИ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2000 |
|
RU2167424C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНТИОКСИДАНТНОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 2011 |
|
RU2465593C1 |
| ПРОИЗВОДНЫЕ ДИАМИНОТРИФТОРМЕТИЛПИРИДИНА ИЛИ ИХ СОЛИ СО ЩЕЛОЧНЫМИ ИЛИ ЩЕЛОЧНОЗЕМЕЛЬНЫМИ МЕТАЛЛАМИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ФОСФОЛИПАЗУ A | 1991 |
|
RU2057123C1 |
| БЕЛОК | 2005 |
|
RU2380414C2 |

Изобретение относится к области биохимии и биотехнологии,в частности к определению активности одного из важнейших ферментов липидного метаболизма - фосфолипазы А{. Целью изобретения является повьшение точности и упрощение способа определения. Способ осуществляется путем добавления в измерительную кювету спектрофотометра, содержащую мицеллярную форму субстрата яичный лецитин и холат натрия в соотношении 1:2-4 , анализируемой фосфолипазы и кофакто- .ра-соль кальция, а в контрольную кювету - раствора гемоглобина и регистрации разностных спектров на двухлу- чевом спектрофотометре. При этом интенсивность спектра между максимумом при 423 нм и минимумом при 405 нм пропорциональна количеству жирной кислоты, освобождаемой в результате ферментативной реакции. Отличительным признаком способа является специфичность комплексообразования жирной кислоты с гемоглобином, приводящего к изменению спектральных характеристик гемопротеидао 3 ил ш со
Пример 1о К 4 мг димиристоил- 25 нии 2:1, интенсивно встряхивают 5фосфатидилхолина приливают 0,04 мл 20%-ного холата Na (молярное соотно- щение.липид/детергент 1;4) и 12,8 ми 0,01 М трис-НС рН 7,4, интенсивно встряхивают, добавляют 0,12 мл 0,1 М CaClj и 1,2 мл раствора гемоглобина (3,37-10 М) в 0,01 М трис- НС , рН 7о4„ В опытную и контрольную кюветы помещают по 2 мл реакционной смеси, прописывают нулевую линию на приборе Specord, Реакцию начинают добавлением в опытную кювету 22 мкл раствора фермента (исходная концентрация фермента 0,01 мкг/мл ), через
10 мин, центрифупируют 10 мин при 3000 об/мин, нижний хлороформный слой .отбиргиот, упаривают и- продукты реакции - ЛФХ, ФХ и жирные кислоты
30 разделяют с помощью тонкостойной хроматографии на силикагелевых плас тинах в системе растворителей хлороформ: метанол (65:25:4 V/V) Пятна, соответствующие лизодимири35 стоилфосфатидилхолину (ЛФХ) и димн- ристоилфосфатидилхолину (ФХ), прояв ляют в парах 1, отмечают их грани цы, дают испариться. Пятна выскреба ют Затем проводят количественное
2,4,6,8 и 10 мин регистрируют измене- 40 определение неорганического фосфата
НИН интенсивности между максш-1умом и минимумом в разностном спектре ге- . моглобина. На фиг,1 показано изменение интенсивности между максимумом и минимумом, которое через 2,4,6,8 и 10 мин равно 0,02 D, 0,035D, 0,060, О,ID, G,145D соответственно.
Наблюдают рост интенсивности между максимумом и минимумом в разностном спектре гемоглобина в зависимости от времени ферментативной реакЦИИ(ФИГ(,1),
Пример 2о Построение калибровочной кривой, К 4 мг дикшристоил- фосфатидилхолина приливают 0,04 мл 20% холата Na (молгярное соотношение липид детергент 1:4), 12,8 млО,01М трис-НС1 рН 7,4, интенсивно встряхивают,, добавляют 0,12 мл 0,1 М CaClj м
10 мин, центрифупируют 10 мин при 3000 об/мин, нижний хлороформный слой .отбиргиот, упаривают и- продукты реакции - ЛФХ, ФХ и жирные кислоты разделяют с помощью тонкостойной хроматографии на силикагелевых пластинах в системе растворителей хлороформ: метанол (65:25:4 V/V) Пятна, соответствующие лизодимиристоилфосфатидилхолину (ЛФХ) и димн- ристоилфосфатидилхолину (ФХ), проявляют в парах 1, отмечают их границы, дают испариться. Пятна выскребают Затем проводят количественное
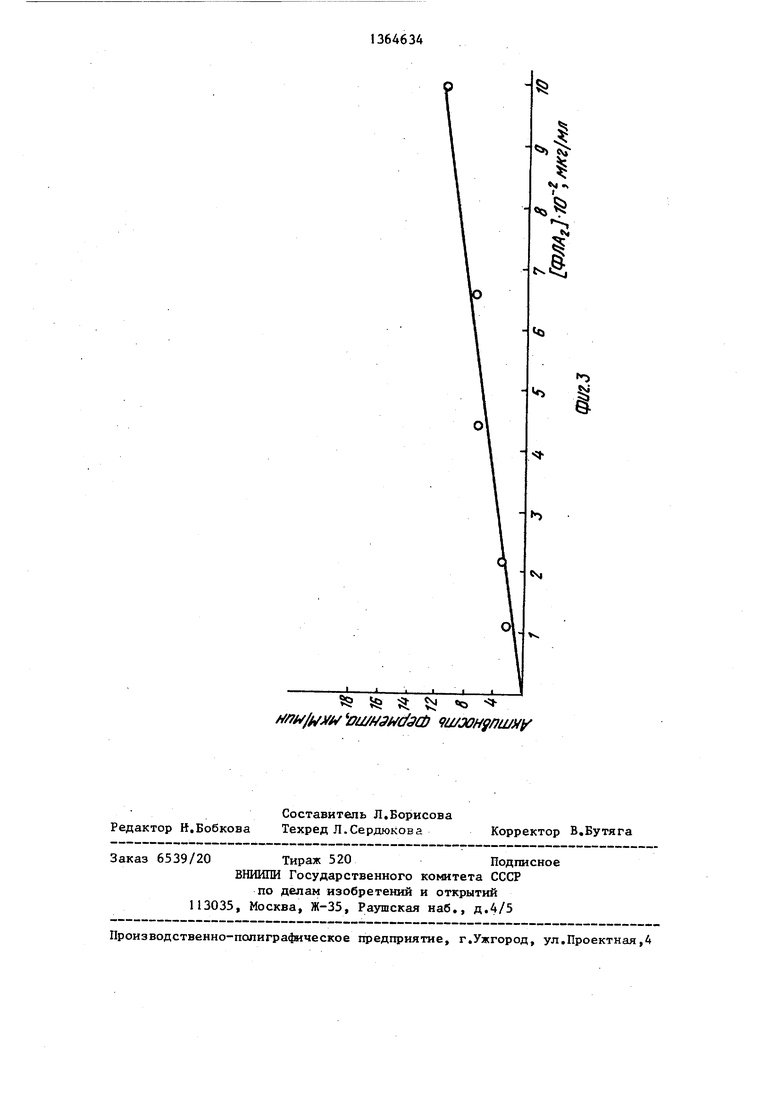
по методу Васьковского. К пробам добавляют 0,2 мц концентрированной нею 4 и нагревают 10 мин на песчаной бане, к остывшим-пробам приливают по 4,8 мл реагента Васьковского, . помещают в кипя1ЕСую водяную баню на 15 мин и колориметрируют на СФ-26 при А 825 нм. Исходя из полученных данных строят зависимость изменения интенсивности между максимумом и минимумом ( J D) в разностном спектре гемоглобина от концентрации фосфо- ипазы А2(фиг,2) и зависимость скорости накопления продукта реакции
(ЛФХ) от концентрации фосфолипазы А 2 (фиГоЗ), Из этих графиков находят корреляционные, коэффициенты К кК.
Определение К , из графика на фиг,3, бсцисса ордината
6 1 d-i
3,5- 10- 5 -107-10-3 0,85-10; : 4 -10- 0,87-10;
10
10- 0,83-10;
Среднее значение (0,85+0,02)10 Определение К из графика на фаг,2,
ордината : 5-10- ,1 : 6-10 ,1; 3,8-10- ,05; 1,8-10 ,К Среднее значение ,1 Из этих же графиков выводят KI- JD 1,1 - uD (фиг.2); 15 ФПАг А 0,85 -10 А, где А - количество продукта, образованного в единицу времени, выраженное мкМ (активности фермента)о
Кг- dD
известной концентрации предлагаемым способом и ранее применишшмся хрома- тографическим способом полу1 еьш1 5 сравнимые значения.
Определение активности фосфоиитаАбсцисса5,5 10- 6,6-10 4-10- : 2-10 :
зы АЗ описанным способом поы-шгшг специфичность опредален Я, поскольку не зависит от внешних факторов.
20
Отсюда К - А К„ лD А
или
А idD
8,5
8,5-А 1,1 П р
Л D.
Таким образом, способ отличается простотой, позволяет проводить ки-г нетические исследования непосредственно в кювете спектрофотометра, обладает высокой чувствительностью и точностью, В ходе определения активности фосфолипазы не происходит закисления среды, так как реакцию проводят в буферном растворе. Определение не требует уникального оборудования.
Способ может быть легко адаптироК ван для определения активности других липолитических ферментов, в результате действия которых освобожда-. 25 ется жирная кислота (липаза, липо- протеидлипаза и др.).
Способ может найти широкое применение в биохимических исследованиях кинетических закономерностей механизма действия фосфолипазы А, а также в биотехнологии для контроля активности фермента на разных стадиях очистки при промьшшенном выделении из природных источников.
30
им е р 3. Определение активности фо.сфолипазы А,,
Реакционную смесь готовят как в примере 1 и 2. К 2 МП реакционной смеси в опытную кювету добавляют 1 мкл раствора фосфолипазы А } неизвестной концентрации и через 10 мин 35 записывают изменения интенсивности между максиг мом и минимумом в разностном спектре гемоглобина. Оно равно 0,060D, что согласно рассчитанной в примере 2 формулы, соответству- 40 проведение фосфолипазной реакции ет активности 7,7-10 мкМ/мин. Од-анализируемой пробы в присутствии
Формула изобретения
Способ определения активности фосфолипазы А2, предусматриваю1ций
повременно оканчивают реакцию добавлением в опытную кювету 0,1 мл 0,25 М ЭДТУ. Продукты реакции экстрагируют двойным объемом смеси хлороформа с метанолом в соотношении 2:1, встряхивают, слои разделяют центрифугированием, нижний хлороформный слой упаривают и проводят определение , количества образовавшегося продукта хроматографическим способом и количественным определением неорганического фосфора по методу Вась- ковского. Получено при колориметри- ровании значение D ЛФХ, что соответствует активности фермента, равной 7,.-10 мкМ/мин. Из описанного следует, что при расчете активности фосфолипазы А7 не1364634
известной концентрации предлагаемым способом и ранее применишшмся хрома- тографическим способом полу1 еьш1 5 сравнимые значения.
Определение активности фосфоиитазы АЗ описанным способом поы-шгшг специфичность опредален Я, поскольку не зависит от внешних факторов.
10
15
15
20
30
проведение фосфолипазной реакции анализируемой пробы в присутствии
Формула изобретени
Способ определения активности фосфолипазы А2, предусматриваю1ций
соли кальция и мицеллярной субстрата - яичного лецитина с хола- том натрия с последующим измерением
количества жипной кислоты, отщепляющейся от фосфолипида, отличающийся тем, что, с целью упрощения способа анализируемую пробу, содержащую фосфолипазу А, помещают
в одну из двух кювет, в которые дополнительно вводят раствор гемоглобина, соль кальция и мицеллярную форму субстрата, количество жирной кислоты определяют спектрофотометрически по увеличению расстояния между максимумом и минимумом в разностном спектре гемоглобина, а активность фермента оценивают по калибровочному графикуо
550
Ш
500
600 700
28 26 2 22 20 /8 f6 / (Pu2.1
т JSff seo
ШАннн m ftoNf фиг 2
1364634
500
600 700 X,w
xfOOOcfi
-f
нм
i§ Я: 5ij «о ///УА жх/ йс ла тби 4i jOHynu/)f
| Haas G.HoDe, Postema NoM, Nieurienhuizen W,,Deenen van, Purification and properties of phospholipase A from porcine pancreas | |||
| - Bioch, Biophys | |||
| Acta, 1968, V | |||
| Катодное реле | 1918 |
|
SU159A1 |
Авторы
Даты
1988-01-07—Публикация
1986-02-10—Подача