Изобретение относится к технологии получения глюкозно-фруктозных сиропов .
Цель изобретения - уменьшение образования продуктов распада сахароз в гидролизате и повышение стабильности фермента в процессе изомеризации.
Способ получения сиропа, содержащего глюкозу и фруктозу, заключается в следующем.
Крахмал, полученный из обычного
источника, например влажньм измельчением зерна, промывают и готовят из него водную пульпу - суспензию, содержащую 30-35% сухого крахмального вещества. Предпочтительнее, чтобы суспензия обладала низким ионимм содержанием, т.е. не более 0,2% сухого остатка в сульфатирова нпой золы В качестве источников крахмала используются клубни или злакоЕые, включая картофель, тапиоку, пшеницу, сор1Д
го и кукурузу.
Глюкозосодержащий крахмальньпг гидролизат может быть получен с помощью кислотно-ферментного процесса или фермент-ферментного процесса. В кислотно-ферментном процессе кра.мал сжижают сперва мягкой кислотной обра боткой, после чего применяют фермент для превращения ожиженнюго крахмала в глюкозу. В обычном фермент-ферментном процессе крахмал ожижают обры- боткой ОС-амилазой, после чего применяют глюкоамилазу для превращения сжиженного крахмала в глюкозу. Предпочтительно использовать фермент-ферментный способ получения крахмальног гидролизата, содержащего глюкозу.
Производство крахмального гидролизата, содержащего глюкозу, который н будет подвергаться очистке перед последующей обработкой иммобилизи- рованной глюкозной изомсрапой, требует тщательного контроля условий реакции во время ожижения и псахариваиия Дотаспы применяться такие температуры время реакции и величины рИ, чтобы ингибировать образование значительны количеств таких веществ, которые пагубно влияют на стабильность глюкозной изомеразы.
Также необходимым является сведе
нис к минимуму содержание ионов кальция при изомеризации субстрата. Некоторые составы 1Эу-амилазы требуют присутствия высокого содержания ионов
10
15
30
35
Q
ед . , х 490142
кальция для достижения активности во время стадии ожижения. В том случае, когда во время ожижения имеется высокая концентрация ионов кальция, то перед изомеризацией следует его удалить из гидролизата. Могут применяться любые известные для этой цели способы, такие как обработка глюко- зосодержащей суспензии щавелевой кислотой с последующим фильтрованием ок- салатов кальция.
Поэтому предпочтительнее использовать вид 0 -амилазы, который не требует высокой концентрации ионов кальция для поддержания активности и тepмocтaбильнotти фермента. Удовлетворительные результаты получаются при использовании 0 -амилазы, производимой Bacillus licheniformis (Тег- , mamyl- 60L о -амилаза Novo Enzyme Corp.). Зтот фермент отличается высокой термостабильностью и активностью в широком интервале рН, одновре- он имеет пониженную зависимость от присутствия ионов кальция. Другим типом подходящей о(-амилазы, который быть использован для данной цели, являются Tako-Therm (Miles la- ,1Г.огу, Elkhart, indiana) и ni- Tr:ini.ase (Biocon I no., Lexington,
KP- :I.UCky) .
Иремя, в течение которого осу- щсспзляется ожижентге крахмала, за- от применяемой тем11ерату)Ь . Если крахмальная суспе 1зия нагревается при низких температурах я течение очень короткого времени, то -ъ. кет остаться зпя-штельиое ко;;гг:сг1 но более термоустойчивых частиц крахма20
25
55
ла, которые не будут подпер л .ся воздействию {(-амилазы, как э го требуется для сниженртя БЛЗКОСПи суспен- ,зии. Применение низких п eMnc p;vi ур , ожижения, а именно тте ЪС°С лля зернового крахм.ала, приводит к н. гудоз- летворительным результатам и з-за оставшегося иежелатинизироваиням большого количества крахмала и таким образом практически неприспособленного к воздействию фермента. В том случае, когда ожижение осуществляется в присутствии о(-амилазы, то применя- et-tbie темпср;1туры не должны быть столь высоки, чтобы пагубно сказаться на активности применяемого фермента.
Особенно важным оказывается под- держание таких условий реакции, чтобы
во время ояошения и осахаривания не осуществлять химического или неферментативного образования кетосахаров. В частности, условия реакции должны поддерживаться такими, чтобы обеспечить получение гидролизата с концентрацией ионов кальция не более 100 ч./млн. в основе на массу сухого крахмального вещества и молярным отношением неферментативно образуемых кетозных Сахаров по отношению к гек- созам менее 2.
Предпочтительно также, чтобы гид- ролизат содержал ионы кальция в концентрации не более 30 ч./млн и молярное отношение неферментативно образуемых кетосахаров было менее 1. Молярное отношение выражает количество молей неферментативно производимы кетосахаров на 100 моль гексоз. Поскольку влияние температур, времени и величины рН во время ожижения взаимозависимы, то эти параметры должны контролироваться внутри сравнительно узкого интервала.
Полимерная структура гранулированного крахмала не подвержена сильному воздействиюci-амилазы до тех пор, пока гранулы не подвергнутся желати1 изации. Желатинизация осуществляется при нагревании крахм.гла в воде до температурного интервала, при котором гранулы набухают, и силы, связывающие молекулы крахмала вместе, достаточно ослабевают, что вызывает желатинизацию. Поскольку о(-амилаза термочувствительна и имеет тенденцию денатурироваться при температурах Bbmje 100°С, то для пролонгирования эффективного действия фермента для ожижения применяются температуры ниже 100°С. Поскольку силы, связывающие молекулы крахмала в гранулы, различны по величине, то некоторые гранулы желатинизируются при температурах ниже 100°С и становятся восприимчивыми к действию о(-амилазы, в то время как другие остаются нежелатинизированными и поэтому достаточно устойчивыми к воздействию этого фермента. В результате этого предпочтительно ожижать крахмал о(-амилазой в две стадии с очень короткой промежуточной обработкой в автоклаве. Во время первой стадии крахма1л частично желатинизи- руется и ожижается в ограниченной степени с получением частичного гидролизата. Целью стадии автоклави- рования является дальнейшая желати- низация гранул крахмала, устойчивых к воздействию обработки на первой стадии ожижения. Крахмальный гидроли- зат затем разжижают на второй стадии до требуемого уровня.
Ожижение проводят в две стадии
при рН в интервале от 5,2 до 5,4 и при температурах желатинизации крахмала, подходящих для ферментативного ожижения крахмала. В случае влажно-измельченного зернового крахмала обычно необходимо доводить ве- личи(Гу рН до требуемого диапазона ожижения. Соединения кальция, как например гашеная известь или карбонат кальция, обычно используют для
доведения величины рН на стадии ожижения (Ч-аьтл аз ой, особенно в реакциях, где применяются о(-амилазные составы, зависящие от кальция. Поскольку кальций отрицательно влияет на активность глюкозной изомеразы, то предпочтительно избегать избыточного добавления источника ионов кальция к гидролизату. Однако если ионы кальция все-же добавлены, то их следует удалить до стадии изомеризации, Хотя существует цельш ряд веществ, которые могут устанавливать необходимую величину рН во время стадии ожижения, однако предпочтительнее использовать для этой цели растворимые соединения магния, поскольку глюкозные изомеразы, выделенные из многих микроорганизмов, требуют магний для оптимизации их активности.
Количество оС-амилазы, введенной
в пульпу, зависит от набора факторов, однако обычно определяется по активности ферментативного состава, концеитрации крахмала в пульпе и степени требуемой амилолитической конверсии. Обычно в системе двухстадий- ного ожижения вводят }.д вторую стадию такое же количествп или несколько
меньшее СУ -амилазы, чем на первую стадто. Когда межп;у стадиями осуществляют автокланирорание, то остаточная активность о -амилазы на первой стадии практически разрушается. Обычно на первой стадии добавляется 6-10 ед. о -амилазной активности на 1 г сухого крахмала и 5- 10 ед. на 1 г сухого крахмала на второй стадии ожижения.
U49014
Применяемые температуры ожижения на обоих стадиях предпочтительно ниже , более предпочтительными являются температуры в интервале 82-95°С и наиболее предпочтительным оказывается диапазон между 84 и . При ожижении при температурах внутри вышеуказанных интервалов удовлетворительные результаты достигаются при нагревании в течение 1-3 ч.
Первая стадия ожижения обеспечивает получение частичного гидроли- зата со степенью упругости от около 6 до около 12. После первой стадии ожижения пульпу можно подвергнуть автоклавной обработке для получения частичного гидролизата, который практически свободен от нежелатини- зированного крахмала. Более- продолжительное воздействие на частично ожиженный крахмал в автоклаве приводит к образованию веществ, которые нежелательны для глюКозной изомера- зы и которые необходимо удалять перед стадией изомеризации для удлинения срока действия фермента. Таким образом, время автоклавирования и
ли, представляет собой глюкоамилазу (также обозначаемый как амилоглюкози даза, глюкоамилаза, глюкогенный фермент и т.д.). Глюкоамилаза, вырабаты ваемая рядом микроорганизмов, представляет собой экзо-амилолитический фермент, который катализирует последовательный гидролиз глюкозных час10 тей из невосстановленных концов крахмала или амилодекстриновых молекул. Среди микроорганизмов, производящих глюкоамилазу, имеются определенные
штаммы грибков, относящихся к роду
15 Aspergillus, штаммы рода Rhizopus и штаммы рода Endomyces.
Осахаривание ожиженного крахмального состава осуществляют в условиях, которые приводят к высокой степени
20 превращения крахмала в глюкозу.
Предпочтительно, чтобы гидролизат содержал более 92% глюкозы и более предпочтительно, чтобы содержание глюкозы было более 94%. Условия так25 же должны быть такими, чтобы не про- мотировать повторный синтез олигоса- харидов из молекул освобожденной глюкозы, как это известно случается
при реакциях осахаривания с использотемпература не должны превышать 2 мин 30 ванием глюкоамилазы. и соответственно. Предпочти- Обработку глюкоамилазрй осуществ- тельнее проводить автоклавирование при ляют при разбавлении ожиженнои крах- температуре около , и продолжи- мальной суспензии, если это необ тельности 1 мин.ходимо, до содержания твердьгх веПоскольку Ы -амилаза, присутствую- 35 около 30% и достижении рН ре ,, W лт /I П ПП r VOnrV
щая на первой стадии ожижения, практически инактивнруется за время автоклавной обработки, то необходимо ввести дополнительное количество фермента на вторую стадию ожижения. Обычно вводимое количество о(-амилазы на второй стадии приблизительно равно тому, которое применялось на первой стадии. Во время второй стадии практически все желатинизированные гранулы крахмала готовы взаимодействовать с ферментом в тех же условиях с образованием уточненного гидролизата, имеющего степень упругости от 14 до 20, и который практически свободен от исходного непрореагировавшего крахмала. Обычный гидролизат имеет степень упругости около 16.
Ожиженный крахмальный состав затем обрабатьгоают глюкогенным ферментом при подходящих условиях для ферментативного превращения частично гидро- лизованного крахмала в глюкозу. Обычно фермент, применяемый для этой цеакционной среды от 4,0 до около 5,0, предпочтительно рН 4,6. Затем добавляют достаточное количество г люко- амилазного состава для обеспечения о
40 0,12 до 0,30 глюкоамнлазиык единиц на 1 г сухого крахмального субстрата после чего суспензию нагревают до температуры 54-62°С в течение времени, достаточного для получения не45 обходимой степени конверсии. Предпочтительным является период от около 58 до около 60 ч для обработки суспензии гидролизованного крахмала.
Для получения субстрата, пригодного для изомеризации, гидролизат затем фильтруют для удаления некрахмального остатка и фильтрат предпочтительнее упаривают до около 50% сухого вещества. Может быть добавлена растворимая соль или соли, являющиеся активаторами глюкозной изомеразы, к концентрированному гидролизату, после чего уровень рН
50
55
9014
ли, представляет собой глюкоамилазу (также обозначаемый как амилоглюкози даза, глюкоамилаза, глюкогенный фермент и т.д.). Глюкоамилаза, вырабаты ваемая рядом микроорганизмов, представляет собой экзо-амилолитический фермент, который катализирует последовательный гидролиз глюкозных час0 тей из невосстановленных концов крахмала или амилодекстриновых молекул. Среди микроорганизмов, производящих глюкоамилазу, имеются определенные
штаммы грибков, относящихся к роду
15 Aspergillus, штаммы рода Rhizopus и штаммы рода Endomyces.
Осахаривание ожиженного крахмального состава осуществляют в условиях, которые приводят к высокой степени
20 превращения крахмала в глюкозу.
Предпочтительно, чтобы гидролизат содержал более 92% глюкозы и более предпочтительно, чтобы содержание глюкозы было более 94%. Условия так25 же должны быть такими, чтобы не про- мотировать повторный синтез олигоса- харидов из молекул освобожденной глюкозы, как это известно случается
около 30% и достижении рН ре ,, W лт /I П ПП r VOnrV
акционной среды от 4,0 до около 5,0, предпочтительно рН 4,6. Затем добавляют достаточное количество г люко- амилазного состава для обеспечения от
0,12 до 0,30 глюкоамнлазиык единиц на 1 г сухого крахмального субстрата, после чего суспензию нагревают до температуры 54-62°С в течение времени, достаточного для получения необходимой степени конверсии. Предпочтительным является период от около 58 до около 60 ч для обработки суспензии гидролизованного крахмала.
Для получения субстрата, пригодного для изомеризации, гидролизат затем фильтруют для удаления некрахмального остатка и фильтрат предпочтительнее упаривают до около 50% сухого вещества. Может быть добавлена растворимая соль или соли, являющиеся активаторами глюкозной изомеразы, к концентрированному гидролизату, после чего уровень рН
7
доводят от 7 О до 8,5 добавлением раствора гидроокиси натрия. Обычно гидролизат нагревают до температуры 50-70 С и выдерживают в течение 20-60 мин, после чего осадок отфильтровывают и удаляют суспендированные твердые вещества, которые моли образоваться при более высоких уровнях рН, Предпочтительными условиями является нагревание при температуре около 60°С и выдержка в течение около 30 мин перед стадией повторного фильтрования. Следует избегать более продолжительного нагревания осахаренного раствора или нагревание при температурах выше до стадии изомеризации и особенно не следует доводить значение рН в щелочную область. В щелочлих условиях такое нагревание гидролиза та перед его изомеризадией может привести к разложению вещества и образованию продуктов, которые подавляют активность глюкозной изо- меразы.
Изомеризация неочищенного субстрата преимущественно проводится в непрерывном режиме путем пропускания субс трата при подходяпшх условиях через колонну или колонны, содержащие слои иммобилияоваиной глюкозной изомеразы.
Таким образом, при поддержании условий ожижения и осахаривания для минимального производства нефермен- тативно поя:, чаемьп: кетосахаров происходит максимальное превращение крахмала в глюкозу. Также в результате поддержания низкого содержания з олы в исходной крах тальной пульпе и во время последопателт Ных стадий процесса потребуется меньшая емкость ион-обменной смолы для деминерализации конечного глюкозно-фрукто ного продукта.
Декстрозный эквивалент.
Декстрозный эквивалент (ДЕ) обозначает концентрацию присутствующих редуцирующих Сахаров таких, как дектроза, и рассчитанньЕС как процент от сухого вещества. Определяется с помощью методики Е-26, ог Т1санной в Standard Analytical Methods of the Member Companies of Corn Industry Research Foundation, Inc. 1001, Connecticut Ave, N.W. Washington, B.C. 20036.
A90148
Активность бактериологической 0(-амилазы.
Активность составов бактериологи- 5- ческой 0 -амилазы определяют с помощью модифицированной стандартной методики испытаний ААТСС 103-1965 Bacterial Alpha Amylase Enzyme Used in De- sizing, Assay,of опубликованной в 10 1967 году издательством Технической Документации Американской Ассоциации Текстильных Химиков и Химиков-красителей, т, 43, с. В-17Д,и В-175,
Модификации этого опубликованного 15 теста заключаются в следующем.
Бу фферный раствор крахмального субстрата приготовляют растворением 25,3 г сухого едкого натра и 340 г сухого гранулированного калийдигидро- 20 фосфата в поде и разбавлением раствора до 2 л.
К охлажденному и растертому в пасту крахмальному субстрату добавляют 125 мл буферного раствора, после 25 чего субстрат доводят до 500 мл объема.
Определяют величину рН крахмального субстрата и при необходимости величину рН доводят до 6,,05, 30 0,025 М раствор хлорида кальция используют разбавления образца фермента. Его готовят растворением i1,1 г безводного гранулированного хлорида кальция в воде и доведением 35 жидкости до объема в 4 л.
Формула перевода единиц - ВАИ в ликвофоиы:
БАИх2,65 ликвофоны, 40 Активность глюкоамилазы.
Единицы активности Г11юкоамилазы (СИ) обозначают количество фермента, которое катализирует получение 1 г декстрозы в 1 ч при и рН 4,3 в 45 нижеописанной методике.
10 мл 10%-ного раствора частично гидролизованного крахмала (такого как Maltrin-10, продукт Grain Processing Co., Muscatiiie, Jowa) , co- 50 держащего 20 мМ ацетатного буфера с рН 4,5, переносят пипеткой в закрытый реактор,, подлержипаемый при 60°С. 1 мл глюкоамилазиого раствора, содержащего 0,03-0,15 Gil, добавляют в ре- 55 актор и перемешивают содержимое , после чего смесь оставляют стоять Т5 течение 1 ч при 60°С, В конце первого часа периода инкубации воздействие фермента прекращают добавлением предварительно определенного объема 1 М раствора едкого натра так, чтобы довести величину рН до 8,5-10,5. После этого смесь охлаждают до комнатной температуры.
Полученный таким образом образец гидролизата объемом в 2,5 мл переносят в 25 мл раствора Фелинга, приготовленного как описано в случае определения ДЕ. Смесь затем нагревают до кипения и оттитровывают стандартным декстрозным раствором, содержащим 5 г декстрозы на 1 л, приготовленным в соответствии с методикой определения ДЕ, Контрольную смесь готовят и оттитровывают аналогичным образом как и для образца вышеуказанного гидролизата за исключением того, что к субстрату добавляют 1 мл раствора глюкоамилазы после одночасовой инкубации и после добавления раствора едкого натра. Активность глюкоамилазы рассчитывают спедукядим образом
СИ
г
0,002«V
W
где V - общий объем o6pa3ifa гидролизата (обычно 11,2 мл) ,мл ,
С - объем стандартного декст- розного раствора, применяемого для титрования контрольной смеси, мл1
А - объем стандартного декст- розного раствора, применяемого для титрования образц гидролизата, мл,
W - масса фермента на 1 мл разбавленного ферментного раствора.
Активность иммобилизированной из меразы.
Активность иммобилизированной из меразы определяют согласно следующе методики.
Образец иммобилизированной изоме разы, содержащий 1400-2200 1СТИ, взвешивают. Этот образец промывают 250-миллиметровой колбе 125 мл декс розного раствора (предварительно нагретого до ) и 10 мл 0,1 М раствора трис-(гидроксиметил)амино
метана (ТНАМ) с рН 7,8. Образец дек
строзного раствора содержит 3,33 М декстрозы, 20 мМ сульфата магния, 10 мМ сульфита натрия, 100 мМ ТНАМ 1 мМ хлорида кобальта (рН 7,8). При
А49014
10
30
40
этот раствор имеет рН около 7,0. Колбу помещают на водяную баню при 65°С и встряхивают в течение 1 ч. Смесь затем отфильтровывают в вакууме через 45-миллиметровую грубую керамическую воронку, набитую стекловолокном, предварительно покрытым 1 г ускорителя фильтрования. Колбу
JQ и фермент Промывают небольшой алик- вотой по 100 мл 100 мМ буферного раствора ТНАМ (рН 7,6).
Промытый фермент переносят в 250- миллиметровую колбу, содержащую
15 125 мл раствора декстрозы (предварительно нагретого до 65 С). Промытый фермент затем количественно промывают внутри колбы 10 мл 10 мМ раствора ТНАМ буфера (рН 7,8), после
20 чего колбу встряхивают 60 мин. Затем добавляют 12,0 мл ледяной уксусной кислоты и подкисленный раствор встряхивают еще 15 мин. Смесь отфильтровывают под вакуумом через 45-милли25 метровый керамический фильтр со стекловолокном, покрытым предварительно 1 г ускорителя фильтрования. Колбу и содержимое воронки промывают деминерализованной водой до тех пор, пока не соберут около 400 мл фильтрата. Фильтрат охлаждают до и разбавляют до 500 мл. Оптическое вращение раствора определяют в 2-дециметровой кювете при 25 С и обозначают RQ. Хо2с лостой опыт проводят аналогичным образом за исключением того, что не добавляют фермента. Оптическое вращение в холостом опыте определяют также при и обозначают как R. Степень изомеризации рассчитывают с помощью следующего соотношения
(R ) S . CD 1
где
Ы изменение удельного вращения, когда фруктоза полностью превращается в декстрозу ,
концентрация сахара в растворе (0,15 г/мп); длина поляриметрической трубки (2 дм).
Фиксированные единицы активности (РАИ) изомеразы рассчитывают следуюСр 1 FAH/r IC/Kp-tW,
где К - константа скорости реакции
(1,21 1 РАИ мг глюкозы).
t - время реакции, ч (1 ч)} W - масса образца, ri С - начальная концентрация на 125 мл реакционной смеси
1Д4901412
(75,000 мг глюкозы), мг; I - вьфажение, определяемое следующим образом:













| название | год | авторы | номер документа |
|---|---|---|---|
| Способ изомеризации глюкозы во фруктозу | 1983 |
|
SU1523056A3 |
| Способ получения фруктозы | 1978 |
|
SU1072817A3 |
| СПОСОБ ПОЛУЧЕНИЯ САХАРОВ И СИРОПОВ | 2014 |
|
RU2705243C2 |
| Способ получения фруктозы | 1974 |
|
SU623525A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПАТОКИ ИЗ КРАХМАЛА | 2010 |
|
RU2421525C1 |
| СПОСОБ ОБРАБОТКИ КРАХМАЛА | 2003 |
|
RU2315811C2 |
| СПОСОБ ПОВЫШЕНИЯ ВЫХОДА В ПРОЦЕССЕ ПРОИЗВОДСТВА ДЕКСТРОЗЫ С ИСПОЛЬЗОВАНИЕМ МЕМБРАННОЙ ТЕХНОЛОГИИ | 2013 |
|
RU2646115C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЛЮКОЗЫ | 2006 |
|
RU2314351C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПАТОКИ ИЗ КРАХМАЛА | 2004 |
|
RU2283349C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТОГО КРАХМАЛА И ГЛЮКОЗНОГО СИРОПА | 2012 |
|
RU2528004C1 |
Изобретение относится к технологии получения глюкозно-фруктозных сиропов. Цель изобретения - уменьшение образования продуктов распада Сахаров в гидролизате и повышение стабильности фермента в процессе изомеризации. Способ получения сиропа, содержащего глюкозу и фруктозу, предусматривает пригбтовление крахмаль ной суспензии, ожижение последней при рН 5,2-5,4, последующее ферментативное осахаривание при рН 4-75 и температуре 54-62°С для получения гидролизата, содержащего не более 100 ч./млн. ионов кальция в расчете на массу сухого крахмала и с молярным отношением неферментативно образуемых кетозных Сахаров 0-2 моль на 100 моль гексозных единиц. Для ожижения используют глюкоамилазу, имеющую пониженную зависимость от ионов кальция. Содержание ионов кальция не более 100 ч./млн обеспечивают путем хелатирования избытка кальция перед изомеризацией, Осахаренный раствор подвергают изомеризации при необходимой теьшера туре контактированием его с глюкозоизомеразой, адсорбиг рованной или связанной с ДЕАЕ целлюлозой или анионообменной смолой. 4 з.п. ф-лы., 10 табл. СО t
fl. 1) 12 ф . 1)1 ln() - I,I( - I),
е С„ е Кр J lei Р
I СтК ргде Ig - степень изомеризации
1 моля фруктозы при равновесии (0,513); степень изомеризации в молярной фракции фруцтозы, начальная молярная концент рация глюкозы (3,33 М)j константа Михаэлиса для глюкозы (0,7 М); константа Михаэлиса для фруктозы (1,43 М). Одна ИС1И равна 15,8 РАИ. IGIH - это сокращение Международной Единицы Глюкозной Изомеразы и составляет количество фермента, которое превратит 1 микромоль глюкозы во фруктозу в 1 мин в растворе, преварительно содержащем 2 моль глюкоз в 1 л, 0,02 моль сульфата магния и 0,001 моль хлорида кобальта в 1 л раствора при рН 6,84-6,85 (0,2 М малеат натрия) и при 60°С. Определение глюкозной изомеразы осуществляют с помощью способа, описанного N.Е.Ллойдом и др. в журнале Cereal Chem, 49, № 5, стр. 544-553 (1972). Определение сахаридов. Анализы гидролизатов глюкозы, фруктозы, мальтозы и других сахаридов осуществляют с помощью жидкостной хроматографии высокого давле- ния. Методика описана в Standard Analytical Methods, Corn Refiner s Association, Inc, Method E-61.
Степень изомеризации (% фруктозы Процент фруктозы, получаемый в результате изомеризации, определяют следующим образом.
Аликвоту в 5 мл субстрата (неочищенного гидролизата до его изомеризации) переносят пипеткой в 100-мил лиметровую мерную колбу и разбавляют деионизированной водой до концентрации около 2,5 г сухлго вещества в 100 мл раствора. Аликвоту в 5 МП жидкости, вытекающей из колонн содержащей иммобилизованную глюкоз- ную изомеразу, через которую протекает субстрат, также разбавляют деионизированной водой. Для разбав
ленных субстратов и стока из колонны определяют оптическое вращение.
Константу (К) вычисляют следующим образом
К -г
dxlOO
где
d - разбавление 20,
L - длина поляриметрической
кюветы 0,2000 дм изменение удельного вращения при превращении чистой глюкозы в чистую фруктозу, измеренное с помощью ртутной лампы, : эта величина равна 169,3°; К 59,08.
Отсюда % фруктозы в сухом весе - 59,08(,
где oij - наблюдаемое вращение суб- страта, ° ;
наблюдаемое вращение стока
из колонны, , С - количество сухого вещества
в 1 мл субстрата, г. Определение стабильности глюкозной изомеразы.
Определение скорости реакции (К) и периода полураспада фермента (С). Стабильность или период полураспада фермента реакций изомеризации определяли соответствующим уравнением
1с
I
)
-4693t/t
CR
где Ig - степень изомеризации в
поступающем в реактор потоке, F/(F + G)-,
F - масса фракции фруктозы в
расчете на общую массу сухого углеводного субстрата}
G - масса фракции глюкозы в расчете на общую массу сухого углеводного субстрата
I - степень изомеризацюс в выходящем из реактора стоке, F/(F/G);
13 - 1АД901А1
Ig - величина 1 при равновесии, сухого вещества крахмала 33%, рН 0,514 при 65°С при 0,505 при пульпы доводят до 5,2 добавлением 60°С;MgO и достаточного количества d К, - константа скорости начальной амилазы (Termamyl-60L), чтобы соз-(
Et С
R Т
t реакции, г (F+G) ч -IGIH , активность фермента, IGIH; концентрация субстрата, глюкоза, г/мл;
скорость потока, мл/ч период пол фаспада фермента, ч;
время работы реактора, ч, Величины К| - константу скорости начальной реакции и вел1гчину с можно рассчитать; преобра:гуя вышеуказанное уравнение в следующую форму:
1 , Гн п(---) 1ой- ;;-- - О ,301Q2t/
i е
Зависимость графика логарифма
RlnC---} относитель ю времени I (3 - I -J
равно -О.ЗОЮЗ/ с , следовательно величина L О, 30102/ наклои. Интерполируя ис-чи.-гину (XQ) по времени О, из графика можно получить
Le - 1о
дать активность, -амилазы на 1 г сухого крахмала 7 ед. Пульпу помещают в змеевик из нержавеющей стали и вьщерживают при 8б с в течение 10 2,5 ч. После этой первой стадии термообработки пульпу перекачивают в другой змеевик при температуре в интервале 115-130 с и давлении 3,5- 7,0 кг/см в течение приблизительно
Rln(:
- I
)
. а : 1
.К
1Л1011 скорости реакцил oo;)ei.iOM,
С1 С -ll
ЁГ
35
начальной скорости ре- акщи (Кг) и фактор, вьфажающий период полураспада фермента (t), обеспечивают подходящее указание общей эффективности всего процесса. Чем выше значение, получаемое для К,Т, тем больше эффективность всего про- . цесса в терминах скорости превращения глюкозы во фруктозу и воздействие всего процесса на период полураспада применяемого фермента.
Пример 1. Нилюстрирует предлагаемый способ в неирерывиом режиме, Показана высокая стабильность глю- коизомеразы, которая достигается при осуществлении предлагаеьюго способа, Глюкоизомераза, использованная в этом и последующих примерах, иммобилизиро- вана на ЕАЕ целлюлозе.
Зерновой крахмал, выделенный из зерна при мокром помоле, промывают деионизированной водой и получают таким образом пульпу с содержанием
15 1 мин. Затем пульпу охлаждают до температуры приблизительно 36 С, добавляют такое же количество of- -амилазы, как и на первой стадии термообработки, и направляют пульпу на третью 20 стадию термообработки. В этом змеевике , характеристики которого совпадают с характеристиками первого змеевика, пульпу выдерживают при 86 С в течение 2 ч.
25 Ожижениый крахмал разбавляют до содержания твердого вещества 30% деи- они; ированной водой и подвергают осахариваиию в многоступенчатой системе реакторов, представляющих собой 30 рот фвуары с мешалками. Добавляют ускиритель фильтрования (Dicalite i Cl --t75, GPvKFCO, INC) в количеств
ГС la сухое вещество, и затеп доводят рН до 4,5 добавлением НС1. Ожи/ .енный крпу.мальыый состав т г. ер- вый реактор п реакционной системе, добавляют достаточное количест1ю глюкоа№ лазы (AMG-150, Batch SN 3075, Novo Enzyme Corp,) с тем, чтобы концентрация единиц глюкоамилазы (СИ) составляла 0,27 на 1 г сухого крахмала. Содержимое реактора нагревают до 58 С и затем порциями пропускают через семь дополн1 тельных резисторов при той же температуре. Среднее время пребывания в реакторе- составляет 7,5 ч. В конце цикла осахарива- ния пpoдyl т ,ии или раствор пропускают через фильтр, предварительно 5Q покрытьй ускорителем фильтрования
при пониженном давлении, 254 мм рт.ст. для удаления любых присутствуюп их некрахмальных остатков.
Для получения вещества, пригод- 55 ного для изомеризации с глюкозоизо- меразой, раствор концентрируют до со- дерл1:а 1ия сухого вещества приблизи- тельно 50% в
40
45
непрерывном испарителе. Сначала раствор нагревают до 86 С
амилазы (Termamyl-60L), чтобы создать активность, -амилазы на 1 г сухого крахмала 7 ед. Пульпу помещают в змеевик из нержавеющей стали и вьщерживают при 8б с в течение 2,5 ч. После этой первой стадии термообработки пульпу перекачивают в другой змеевик при температуре в интервале 115-130 с и давлении 3,5- 7,0 кг/см в течение приблизительно
Для получения вещества, пригод- ного для изомеризации с глюкозоизо- меразой, раствор концентрируют до со- дерл1:а 1ия сухого вещества приблизи- тельно 50% в
непрерывном испарителе. Сначала раствор нагревают до 86 С
фильтровывают и фильтрат доводят до содержания Mg(HSOj) 0,0025 М. рН этого субстрата доводят до 6,0 с помощью MgO, а затем до 7,8 с помощью NaOH. Субстрат С готовят, растворяя достаточное количество кристаллической декстрозы в деионизированной воде, при этом получают раствор, содержащий 50% сухой декстрозы. Раствор доводят до содержания Mg(HSO,),j 0,0025 М и рН 6,0 с помощью MgO, а затем до рН 7,8 с помощью NaOH.
Затем субстраты подвергают изомеризации пропусканием их через стеклянные колонки, оборудованные
Т а о .п и
Влияние условий ожижения и ic ахаривании га состав сахари зов а иных г.убстратоп и устоГ МИ1 : глюкоз сиз омера г-ы
Глюкоза, % сухой массы 96,6
Мальтоза, % сухой массы
1 Сетоза, молярное отношение
Константа скорости, i
Период полураспада фермента,
Эффективность фермента, С К
г (G+F) IGIH -ч
.
г (G+F) IGIH
Данные табл.3 свидетельствуют о том, что наивысшая устойчивость ферментов и эффективность конверсии достигается в том случае, когда не- очищенньБ 1 субстрат содержит малое количество мальтулозы. Существенно более низкие значения для устойчивости и эффективности получаются при использовании неочищенного субстрата В, содержащего большее количество мальтулозы и приготовленного при более высоких значениях рН и вы
рубашкой при 65 С. Каждая содержит около 800 IGIH иммобилизованной глю- коизомеразы. Субстраты вводят в колонки сверху вниз при скорости потока 0,3 МЛ/МЗ-1Н. Изомеризацию осуществляют непрерывно а протяжении 17 дней. ЕЬкедневно тбирают образцы субстратов и растворов, выходящих из колонки, с целью определения концентраций фруктозы и глюкозы в субстратах и вычисляют кинетические : параметры реакций изомеризации. Ни субстрат А, пи субстрат В не подвергают процессам счистки перед осу- ществ Ле шем изомеризации.
Результагы приведены в табл.3.
L; а
3
96,6
99,8
0,
0.
0.05
0,iS
0,0/5
0,022 0,02
7000
470
585
17,4
10,1
U,7
с оких температурах пьтоклаиирог аиия.
снязанных : Vf.-i,iJ .i, п.лучен- г ,-чу:., г.чтьг реак
иг 1,.. ЧОГК1;|ИСМ .прозы ;; FuT4fCTТ.е. при
с ИCПOЛЬЗOвaИl . А
ной из в,subti1i: . uvnt H3OMepii3nu n . кристаллической JH ве субстрата указ: этот материал не быч свободе от р,.и, пода;:ЛЯ.ЮЕШХ активность гпю.оз ииог гразы и, таким образом, поз) еыо раз подчерк21 1449014-22
нуть важность условий, при которых жают, используя Tennamyl-60L ot-ами- готовится неочишенмый субстрат. лазу по днухстадийному способу при
Пример 3. Иллюстрирует влияние рН и температуры автоклави- рования, используемых во время ожижения крахмала, на стабильность изоме- ризукщих ферментов и на эффективность реакции конверсии.
Пять одинаковых образцов зернового ю табл.4.
крахмала (33% сухого вещества) ожиТаблица 4
JlClJjr 114 Д V- л щыг- - f
различных значениях рН и условиях автоклавирования.
Образцы ожижают при условиях (продолжительности, температуре, содержании фермента), приведенных в
. «
Количество фер мента (ликво- фоны в -амилаПримечание. Время автоклавирования между стадиями 1 мин.
Растворы анализируют на содержание глюкозы и мальтозы и молярное отношение кетосахаров.
20 л каждого из ожиженных.образцов крахмала осахаривали с использованием глюкоамилазного состава (АИС-150 Batch SN 3068, Novo Ensyme Corp.) при концентрации 0,41 СИ . Образюоадово- , дят до рН 4,3 и нагревают при 58 С те- чёние 32 ч. Осахаренные растворы отфильтровывают и упаривают до содержания сухого вещества 50%, рН доводят до 6,5 с помощью MgO. Затем в каждом образце создают концентрацию MgCHSOj) . . 0,0025 М и наконец доводят рН до 7,8 Результаты изомеризации приведены
(определено при 25 С) с помощью NaOH. в табл.5.
Таблица 5
Влияние рН ожижения и температуры автоклавирования на стабильность глюкозной изомеразы и на эффективность
превращения
Неочищенные растворы изомеризуют 35 пропусканием через стеклянные колонки, находящиеся при 60°С и содержащие иммобилизованную глюкозоизомера- зу при скорости потока 0,3 мл/мин . активность фермента в каждой колонке составляет 800 IGIH.
жают, используя Tennamyl-60L ot-ами лазу по днухстадийному способу при
табл.4.
JlClJjr 114 Д V- л щыг- - f
различных значениях рН и условиях автоклавирования.
Образцы ожижают при условиях (продолжительности, температуре, содержании фермента), приведенных в
. «
. . Результаты изомеризации приведены
Неочищенные растворы изомеризуют 35 пропусканием через стеклянные колонки, находящиеся при 60°С и содержащие иммобилизованную глюкозоизомера- зу при скорости потока 0,3 мл/мин . активность фермента в каждой колонке составляет 800 IGIH.
U490U
16
глюкозоизомеразы. Количество глюкозо- изомеразной активности в каждом реактора изменяется в пределах от 2,300 g до 5,000 IGIH, Реакторы работают следующим образом. Отработанные реакторы, стоящие в начале цепи, удаляются и заменяются чистыми реакторами, стоящими в конце цепи. Изомеризацию
15
и выдерживают при этой температуре в течение 4 мин, затем осуществляют упаривание при 58 с и давлении 625 мм рт.ст. Добавляют Mg(HSOj) в таком количестве, чтобы концентрация его составляла 0,002 моль, затем доводят рН раствора до 7,8 (определено при ) раствором NaOH. Затем
раствор перекачивают через смеситель- ю осуществляют при скорости введения ный змеевик и фильтр с фильтровальной потока 2,4 мл вещества в 1 мин, при бумагой при 58 С.этом концентрация фруктозы в конечном
Изомеризацию осуществляют, перека- вытекающем потоке составляет 42-А6%. чивая отфильтрованный субстрат через После заверщения времени пребывания четыре реактора со слоями катализато- 15 в каадом реакторе отбирают пробу вира, соединенных сериями, и находящих- текаюй1его потока дпя получения срав- ся при 60 С. Реакторы представляют нительных данных.
собой стеклянные колонки диаметром Результаты изомеризации неочищен- 2,54 СМИ длиной 15,24 см, содержащие ного гидролизата представлены в переменные количества иммобилизованной табл.1.
Таблица
Непрерывный процесс ферментативной изомеризации гидролизатов; влияние на стабильность фермента
г (G+F).4- V г (G+F)IGIH ;
Реактор 1 убрали из начальной позиции в /20 ч работы и после этого в конец цепи реактор 5.
Периодический анализ изомеризо- ванного раствора дает следующие значения в расчете на массу сухого вещества:
U490U
16
глюкозоизомеразы. Количество глюкозо- изомеразной активности в каждом реактора изменяется в пределах от 2,300 до 5,000 IGIH, Реакторы работают следующим образом. Отработанные реакторы, стоящие в начале цепи, удаляются и заменяются чистыми реакторами, стоящими в конце цепи. Изомеризацию
осуществляют при скорости введения потока 2,4 мл вещества в 1 мин, при этом концентрация фруктозы в конечном
Фруктоза, % 44,3 Глюкоза, % 51,6 DPj (включает ди- и полисаха17
1449014
41 30
0,28 48,6
РИДЫ), %
Кальций, ч/млнСульфатированная
зола, %
Сухое вещество.
Приведенные данные, а также данные, приведенные в табл,1, указывают, что глюкоэно-фруктозный си- роп, содержащий большой процент фрук тозы, можно получить, подвергая неочищенный крахмальный гидролизат, полученный при описанных условиях, изомеризации с иммобилизованной глюкозоизомеразой. Эти данные указывают также, что при описанных условиях ферменты имеют высокую устойчивость или период полужизни () и высокую степень ферментной активности
().
Пример 2. Иллюстри рует действие различных условий на ожижение и осахаривание крахмала, на образование неферментно полученных кетозосахаров в глюкозосодержащем субстрате и на устойчивость глюко- зоизомеразы, используемой для изомеризации глюкозы в фруктозу.
Крахмал ожижают в отдельных опытах, в одном из которых используют ei-амилазный состав, полученньй из B.licheniformis, и в другом опыте используютлй-амилазный состав, полученный из B43ubtilus, активность которого в. большей степени зависит от содержания кальция. Ожижение производят в две стадии при ферментной обработке с промежуточным автоклави- рованием с целью получения частичног гидролизата, практически свободного от гранулированного или нежелатинизи рованного крахмала.
Готовят две идентичные крахмальные пульпы, каждая из которых содержит 33% сухого вещества. Одну пульпу субстрат А, обрабатываютot-амилазой полученной из B.licheniformis, при условиях ожижения, описанных в изобретении. Другую пульпу, субстрат В, обрабатываютоС-амилазой, полученной из B.subtilis (Dex-Lo-HC. Wallerste Со), и ожижение осуществляют в тех
Для изомеризации с иммобилизованной Глюкозоизомеразой готовят три субстрата. Субстрат А был 0,0025 М по Mg(HSO:j) и рН доводят до 7,8 с помощью раствора NaOH. Субстрат В сначал
условиях, которые обычно используются
для ожижения крахмала с использовани- 55 обрабатьгоают стехиометрическим количество щавелевой кислоты при рН 4,8. Содержание кальция в субстрате понижают до 30 ч/мпн в расчете на сухое вещество. Раствор затем повторно отем ферментного состава.
Условия, в которых осуществляют ожижение, показаны в табл.2.
18
Т а б л и
Ц а
рн
рН устанавливали
Первая стадия
Ликвофо- ны,
Температура,с
14 86
6,6
СаО
33
88
Время, ч Автоклавирование
Температура, с
125
150
10
11
Температура, с
86
88
Время, ч
Каждый из ожиженных крахмальных составов разбавляют до содержания сухого вещества 30%, рН доводят до 4,3 и добавляют 0,41 ОИ г глюко- амилазы. Осахаривание осуществляют при 58 С в течение 32 ч (для субстрата А) и 55 ч (для субстрата В). Осахаренные растворы отфильтровывают и упаривают до содержания сухого вещества 50% в вакууме при 35°С.
Для изомеризации с иммобилизованной Глюкозоизомеразой готовят три субстрата. Субстрат А был 0,0025 М по g(HSO:j) и рН доводят до 7,8 с помощью раствора NaOH. Субстрат В сначала
обрабатьгоают стехиометрическим количество щавелевой кислоты при рН 4,8. Содержание кальция в субстрате понижают до 30 ч/мпн в расчете на сухое вещество. Раствор затем повторно отМолей кетозы на 100 моль дегидрогексозы; г (G+F) IGIH- .
Содержание мальтозы в субстратах зависит как от значения рН при ожижении, так и от температуры автоклави- рования. Как показано данными табл.5 содержание мальтулозы изменяется противоположно периоду полураспада изо- меразы, что указывает на то, что условия ожижения, промотирукицие неферментное образование предшественников мальтулозы, неблагоприятно сказываются на устойчивости фермента. Эти данные свидетельствуют также о том, что количество глюкозы, образующееся во время осахаривания, уменьшается с увеличением содержания мальтозы.
Пример 4. Иллюстрирует влия- ние температуры, при которой выдерживают неочищенный субстрат до изомеризации на устойчивость глюкозоизо- меразы и эффективность реакции изомеризации.
Крахмал ожижают при условиях, приведенных в примере 3. Осахарениый раствор фильтруют с использованием ускорителя фильтрования Dicalite, фильтрат упаривают до содержания сухого вещества 50%. К сконцентриро35
ванному раствору добавляют такое количество 5%-ного раствора Mg(HSOj) чтобы субстрат бып 0,0025 М, и рН доводят до 7,8 при с помощью
30 NaOH.
Раствор порциями перекачивают через колонку с рубашкой, поддерживаемую при какой-либо температуре, указанной в табл.6. После 30-минутногс пребывания в колонке при одной из указанных температур субстраты охлаждают, отфильтровывают и анализируют на содержание глюкозы и ке- тосахаров. Аналогично анализируют
Q порцию щелочного субстрата, которую не подвергают нагреванию.
Порции субстрата изомеризуют по отдельности без предварительной очистки пропусканием через стеклян g ные колонки с рубашками, поддерживаемые при температуре 65°С, каждая из которых содержит слой иммобилизованной глюкозоизомеразы с активностью 800 IGIHi Изомеризацию осуществляют
gQ в течение 500 ч при скорости введения потока в колонку 0,3 мл/мин. Результаты приведены в табл.6.
Таблиц
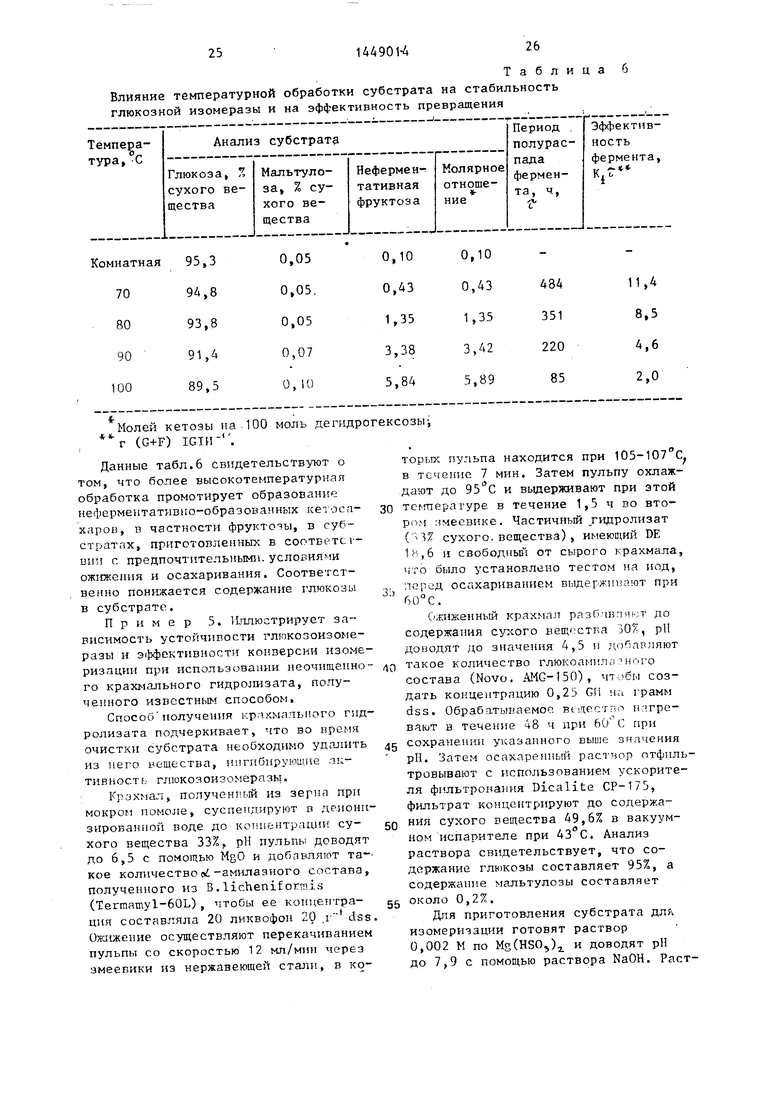
Влияние температурной обработки субстрата на стабильность глюкозной изомеразы и на эффективность превращения
«Молей кетоэы на. 100 моль дегндрогексозыг (G+F) IGIH
Данные табл.6 свидетельствуют о том, что более высокотемпературная обработка промотирует образование нефермеитативио-образованных кетоса- харов, в частности фруктозы, в субстратах, приготовленных в соответсг- ВИ31 с предпочтительнымз. условиями ожижения и осахаривания. Соответственно понижается содержание глюкозы в субстрате.
Пример 5. Иллюстрирует зависимость устойчивости глюкозоизоме- разы и эгЙсктивности конверсии изоме30
3i
торых пульпа находится при 105-107 С в течение 7 мин. Затем пульпу охлаждают до и вьщерживают при этой температуре в течение 1,5 ч во втором ; меевике. Частичный гидролизат (, сухого, вещества) , имеюп1ий DE U,6 и свободный от сырого крахмала, что было установлено тестом на иод, перед осахариванием выдержииают при .
0/шкенный крахмал разКчвпяк.т до содержания су:сого вещества 30%, рН доводят до значения 4,5 и добавляют
и ci dbl t1 - -lJUJt rv i,riUiiwv-i. -.г-
ризации при использовании неочищенно- ,о такое соз- го .lьнoгo гидро.шзата, полу- состава (Hovo,
дать концентрацию U,2b ьи а i рамм dss. Обрабатываемое впдестпо нагревают в течение 48 ч при 60 С при сохранении указанного выше значения рН. Затем осахаренньш раствор отфильтровывают с использованием ускорителя фильтрования Dicalite СР-175,
ченного известным способом.
Способ получения крахмального гид- ролизата подчеркивает, что во время очистки субстрата необходимо удалить из него вещества, ингибирующие активность глюкозоизомеразы.
Крахмал, полученный из зерна при мокром номоле, суспендируют в деиони- зированной воде до концентрации сухого вещества 33%, рН пульпь : доводят до 6,5 с помощью MgO и добавляют та-- кое количествоoi-амилазного состава, полученного из В,licheniformis (Termamyl-60L), чтобы ее концентрация составляла 20 ликвофон 20 . dss. Ожижение осуществляют перекачиванием пульпы со скоростью 12 мл/мин через змеевики из нержавеющей стали, в ко45
50
55
фильтрат концентрируют до содержания сухого вещества 49,6% в вакуумном испарителе при 43 С. Анализ раствора свидетельствует, что содержание глюкозы составляет 95%, а содержание мальтулозы составляет около 0,2%.
Для приготовления субстрата для изомеризации готовят раствор 0,002 М по Mg(HSO,).j и доводят рН до 7,9 с помощью раствора NaOH. Раст
торых пульпа находится при 105-107 С в течение 7 мин. Затем пульпу охлаждают до и вьщерживают при этой температуре в течение 1,5 ч во втором ; меевике. Частичный гидролизат (, сухого, вещества) , имеюп1ий DE U,6 и свободный от сырого крахмала, что было установлено тестом на иод, перед осахариванием выдержииают при .
дать концентрацию U,2b ьи а i рамм dss. Обрабатываемое впдестпо нагревают в течение 48 ч при 60 С при сохранении указанного выше значения рН. Затем осахаренньш раствор отфильтровывают с использованием ускорителя фильтрования Dicalite СР-175,
0
5
фильтрат концентрируют до содержания сухого вещества 49,6% в вакуумном испарителе при 43 С. Анализ раствора свидетельствует, что содержание глюкозы составляет 95%, а содержание мальтулозы составляет около 0,2%.
Для приготовления субстрата для изомеризации готовят раствор 0,002 М по Mg(HSO,).j и доводят рН до 7,9 с помощью раствора NaOH. Раст27
вор выдерживают при в течение 20 мин и затем отфильтровьгеают.
Субстрат подвергают изомеризадии иммобилизованной глюкозоизомеразой без предварительного рафинирования или очистки. Изомеризацию осуществляют пропусканием субстрата через колонку, находящуюся при 65 С и соТаблица
Влияние предварительной очистки гидролизата на стабильность глюкозной изомеразы и эффективность превращения без очистки
Контроль
99,8
,10
Молей кетозы на 100 моль дегидрогексозы; (G+F) ч- ;
««
г (G+F) IGIH .
Результаты свидетельствуют о том что субстрат с низким содержанием кальция и неферментативно образуемыми кетозосахарами не требует глубокого рафинирования перед изомеризацией. Этот факт находится в прямом противоречии с ранее известным в данной области.
Пример 6. Иллюстрирует изомеризацию нерафинированного крахмального гидролизата, приготовленного способом кислотно-ферментативного превращения.
Крахмал, полученньй из зерна путем мокрого помола, суспендирова- ли в деионизированной воде до содержания сухого вещества 33%, рН пульпы доводят до 2,2 концентрированной соляной кислотой. Ожижение осуществляют перекачиванием пульпы под давлением через змеевик из нержавеющей стали со скоростью 22 мл/мин, пульпа при этом находится при температуре 135-140 С в течение приблизительно 4 мин, затем давление приводят к атмосферному. рН доводят до
14490U .
Держащую слой иммобилизованной глю- козоизомеразы с активностью 1000 IGIH со скоростью потока 0,4 мл/мин. Изомеризацию осуществляют в течение 570 ч. Раствор кристаллической декстрозы изомеризуют при тех же усло- ниях в качестве контрольного опыта. Результаты приведены в табл.7.
0,05
0,026
528
13,7
значения 4,0-4,4 непрерывным добавлением гидроокиси натрия и температуру понижают до 60°G. Среднее значение D.E. ожиженного крахмала составляет 18.
Приблизительно 70 л ожиженного
крахмала осахаривают, фильтруют и концентрируют, как описано в примере 5, за исключением того, что значение рН поддерживают на уровне 4,4, а общее время осахаривания составляет 62 ч. Осахаренный раствор с содержанием сухого вещества 50,3% доводят до значения MgCHSO) , чтобы концентрация последнего составляла 0,002 моль, затем рП доводят до
значения 7,8 с помощью раствора гидроокиси натрия. Осахаренный раствор подвергают дальнейшей термообработке, ильтруют и изомеризуют в условиях, описанных в примере 5. Изомеризацию
осуществляют в течение 667 ч.
Результаты, приведенные в табл.8, сравнивают субстрат изомеризованной кристаллической декстрозы с неочиенным кислотно-ферментативным суб- 29
стратом. Эти результаты свидетельствуют о том, что крахмальный гидролиз at, полученный способом кислотно-ферментативного превращения, дшо- Изомеризация неочищенного гидролизата крахмапа, обработанного
кислотой и ферментом
Кристаллическаза
кая декстро-„ „ г, mj: ; )« п 7
(контроль) 99,8- COJO 0,05 0,026 528 13,7
Кислотно- ферментативная обработка
90,6 0,10 0,05 0,023 551
Молей кетозы на 100 моль дегидрогексозы; г (G+F) ч 1СЛИ- -, (G+F) .
Пример. Иллюстрирует использование глюкозоизомеразы, полученной из Bacillus coagulans микроорганизмов для изомеризации глюкозы в фруктозу в соответствии с предлагаемым способом.
Готовят два крахмальных гидролизата в тех случаях, которые бьши описаны в примере 3, за исключением значения рН ожижения и температуры автоклавирования. Эти условия, использованные для каждого из составов А и В, приведены в табл.9.
Таблица 9
I-. - -.- - -- - - Состав А Состав В
Значение рН ожижения
5,2
6,7
Температура автоклавирования,Ч 125 150-160
1АД9014-
щего низкий выход неферментно полученных кетосахаров, можно успешно подвергать изомеризации без предварительного рафинирования.
Таблица 8
12,7
35
Результаты анализов крахмальных гидролизатов на содержание мальтуло- зы дают 0,1% для состава А и среднее значение 1,10% для состава В.
Каждый состав отфильтровывают и концентрируют до содержания сухого вещества 50% в вакууме, затем создают концентрацию 0,0025 М по MgCHSOj) после чего рН доводят до значения 40 7,9 с помощью раствора гидроокиси . натрия. Оба состава неочищенных крахмальных гидролизатов непрерь.вно пропускают через змеевик, находящийся при , со скоростью 0,Д мл/мин, 45 время прохождения змеевика составляет 20 мин. Составы фильтруют и затем подвергают изомеризации пропусканием через стеклянную колонку с рубашкой, поддерживаемую при 65°С при скорости потока 0,4 мл/мин. Каждая колонка содержит слой иммобилизованной глюкозоизомеразы (Sweetzyme-Type S.Batch № 70122, производимой фирмой Novo Inductrie, Denmark), обладающей 55 общей активностью 800.
Результаты приведены в табл.10.
50
Иг
If
Молей кетозы на 100 моль дегидр
IGIH ,-I
(G+F) г (G+F) IGIH
Данные табл.10 показывают важность поддержания условий, приводящи к низкой концентрации мальтулозы в нерафинированном гидролизате.
Позитивное воздействие на стабильность глюкозоизомеразы и на эффективность общей конверсии, происходящие вследствии использования реакции изомеризации крахмального гид- ролизата, полученного по предлагаемому способу, позволяет избежать необходимость рафинирования гидролизат до стадии изомеризации. При тщатель
ном контроле условий ожижения крахма- 30 неферментатиино образуемых кетозных
ла, сахарификации и хранения получают субстраты, для которых уровень веществ, вредно влияющих на устойчивость глюкозоизомеразы, таков, что становится возможным экономичное получе}ше глюкозно-фруктозных сиропов из нерафинированных гидролизатов
Фо. рмула изобретения
отличающийся тем, что, с целью уменьшения продуктов распада Сахаров в гидролизате и повышения
стабильности фермента в процессе изомеризации, процесс ферментативного ожижения крахмальной суспензии осуществляют при рН 5,2-5,4, а ферментативное осахаривание ожиженной суспензии - при рН 4-5 и температуре 54-62 С для получения гидролизата, содержащего не более 100 ч,/млн.ионов кальция в расчете на массу сухого крахмала и с молярным отношением
Сахаров менее 2 моль на 100 моль гексозных ед,
используют глюкоамилазу, имеющую по Н1тженную зависимость от ионов кальция.
ионов капьция не более 100 ч./млн обеспечивают путем хелатировамия избытка кальция перед изомеризацией.
проводят при содержании ионов кальция не более 30 ч./млн.

| Патент США № 4025389, кл | |||
| Регулятор давления для автоматических тормозов с сжатым воздухом | 1921 |
|
SU195A1 |
| Патент США № 4230802, кл | |||
| Способ получения твердых неплавких и нерастворимых продуктов уплотнения формальдегида с фонолами | 1925 |
|
SU435A1 |
| Die starke, том 31, 1979, с | |||
| Нефтяной конвертер | 1922 |
|
SU64A1 |
Авторы
Даты
1988-12-30—Публикация
1982-04-26—Подача