Изобретение относится к биотехнологии и может быть использовано в химико-фармацевтической промышленности.
Аристолохиевые кислоты обладают противоопухолевым действием. Комплекс аристолохиевых кислот входит в состав растения кирказон маньчжурский Aristolochia manshuriensis Kom.
Цель изобретения увеличение выхода целевого продукта и получение воспроизводимого источника сырья.
Способ состоит в том, что для получения аристолохиевых кислот, продуцируемых растением Aristolochia manshuriensis, включающего экстрагирование их из сухого сырьевого материала, в качестве сухого материала используют каллусы Aristolocgia manshurinsis, которые индуцируют из эксплантатов интактного растения и культивируют первоначально на инициальной питательной среде следующего состава, мг/л воды: NH4NO3 1145-1850 KNO3 1490-2100 CaCl2 ˙ 2H2O 420-500 MgSO4 ˙ 7H2O 350-400 KH2PO4 150-210 Н3БО3 4,2-8,0 MnSO4 ˙ 4H2O 15,6-26,7 ZnSO4 ˙ 7H2O 6,0-10,3 KI 0,53-0,90 Na2MoO4 ˙ 2H2O 0,15-0,30 CoCl2 ˙ 5H2O 0,030-0,075 FeSO4 ˙ 7H2O 25,0-30,0 Na2EDTA ˙ 2H2O 26,1-40,1 CuSO4 ˙ 5H2O 0,030-0,075 Тиамина гидро- хлорид 0,15-0,25 Пиродоксина гидро- хлорид 0,40-0,60 Никотиновая кислота 0,40-0,60 Мезо-инозит 50,0-100,0 L-Цистеина гидро- хлорид 4,0-6,0 6-Бензиламино- пурин 0,2-1,0 Индолилуксусная кислота 1,0-3,0 Сахароза 2,5 ˙ 104-3,5 ˙ 104 Бакто-агар 5,5 ˙ 103-6,5 ˙ 103 при рН 5,2-6,2 с последующим отбором наиболее продуктивных каллусных линий, которые затем культивируют на продукционной питательной среде, активизирующей синтез аристолохиевых кислот следующего состава, мг/л воды: KNO3 1900-4400 CaCl2 ˙ 2H2O 110-1470 MgSO4 ˙ 7H2O 350-400 KH2PO4 150-210 H3BO3 4,2-8,0 MnSO4 ˙ 4H2O 15,6-26,7 ZnSO4 ˙ 7H2O 6,0-10,3 KI 0,53-0,90 Na4MoO4 ˙ 2H2O 0,15-0,30
CuSO4 ˙ 5H2O 0,03-0,075 CuCl2 ˙ 2H2O 0,03-0,075 FeSO4 ˙ 7H2O 25,0-30,0
Na2EDTA ˙ 2H2O 32,6-50,1 Тиамина гидро- хлорид 0,15-0,25 Пиридоксина гидро- хлорид 0,40-0,60 Никотиновая кислота 0,40-0,60 Мезо-инозит 50,0-100,0 L-Цистеина гидро- хлорид 4,0-6,0 6-Бензиламино- пурин 1,0-5,0 Индолилуксусная кислота 0,5-1,0 Сахароза 3,5 ˙ 104-4,5 ˙ 104 Бакто-агар 5,5 ˙ 103-6,5 ˙ 103 при рН 5,6-5,8.
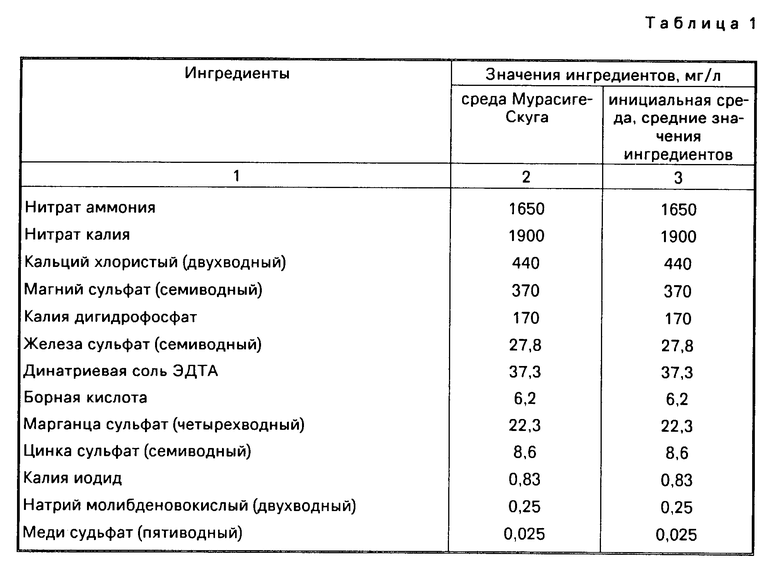
Инициальная среда составлена на основе прописи Мурасиге и Скуга с необходимыми изменениями. В табл.1 приведены составы сред Мурасиге-Скуга и инициальной.
При инкубации эксплантатов А.manshuriensis на среде Мурасиге-Скуга получаются первичные слабые каллусы, которые некротизируют при пересадке. После изучения каждого компонента питательной среды по отдельности, испытывая в каждом опыте его развертку (макро- и микросоли оставлены по прописи Мурасиге-Скуга), получили указанные выше среды.
Приведены прописи сред с минимальными, средними и максимальными содержаниями ингредиентов. Эти содержания соответствуют концентрации веществ в интервале их оптимального действия.
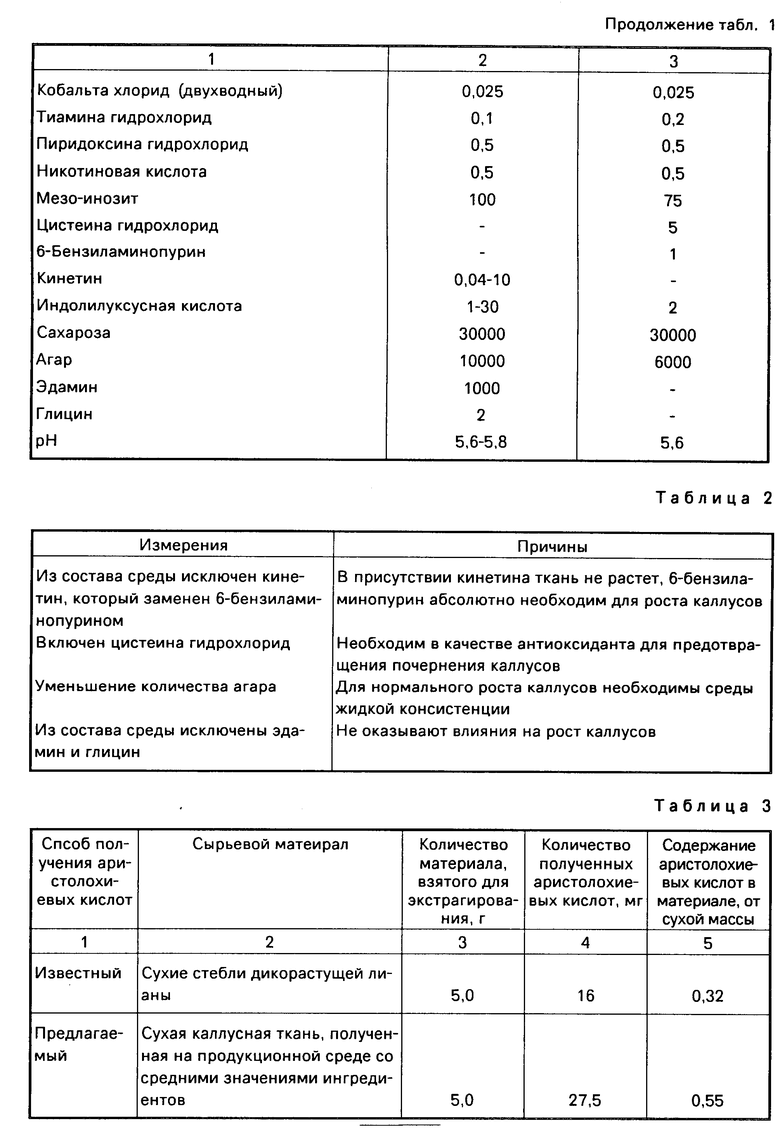
В табл.2 приведены основные изменения по сравнению с первоначальной средой Мурасиге-Скуга и причины, по которым эти изменения были сделаны.
Продукционная среда разработана на основе инициальной и модифицирована для синтеза аристолохиевых кислот. При разработке продукционной среды каждый ингредиент испытывался отдельно, при этом определялась его лучшая концентрация. Затем выяснялись взаимодействия компонентов среды путем постановки полных факторных экспериментов ПФЭ 24. На основе этих опытов среды оптимизировались. Ниже приведены следующие основные отличия продукционной среды от инициальной.
Исключен нитрат аммония, так как это вещество ингибирует синтез апристолохиевых кислот, нитрат калия вносится в концентрации 1900-4400 мг/л; хлористый кальций вносится в концентрации 110-1470 мг/л; комплекс железо ЭДТА дается в молярном соотношении 1:1,25, а не 1:1 (как в инициальной среде) для предупреждения выпадения осадка фосфата железа, количество 6-бензиламинопурина увеличено до 1-5 мг/л, а индолилуксусной кислоты снижено до 0,5-1,0 мг/л, количество сахарозы увеличено до 35-45 г/л.
П р и м е р ы 1-3. Однолетние побеги дикорастущей лианы кирказона маньчжурского, собранные в июне 1986 года в Надеждинском районе Приморского края, стерилизуют в 0,2%-ном растворе диоцида (этанолмеркурия хлорид и цетилпиридиния хлорид) в течение 8 мин. После трехкратного отмывания в стерильной дистиллированной воде из побегов вычленяют эксплантаты диаметром 4-5 и толщиной 2-3 мм. Эксплантаты помещают в пробирки 200 х 20 мм, содержащие по 20 мл инициальной среды с минимальными, средними и максимальными значениями ингредиентов, по 10 эксплантатов на каждый вариант среды. Используются питательные среды указанного выше состава.
Через 10 дней культивирования в темноте при 25оС и относительной влажности воздуха 70% из эксплантатов образуется по 7 первичных каллусов на каждой среде (количество образующихся каллусов составляет 70 + 10% от числа эксплантатов).
Через месяц со дня посадки каллусы отделяют от эксплантата и среды инициации и пассируют на свежие питательные среды такого же состава для получения устойчивых каллусных линий и достижения необходимого масштаба и размножения каллусов. Полученные каллусные линии содержат 0,03 ± 0,01% аристолохиевых кислот от сухой массы. Затем активируют синтез аристолохиевых кислот путем культивирования полученных каллусов на продукционной среде, также выполненной в трех вариантах с минимальным, средним и максимальным значениями ингредиентов. Для этого каллусы разрезают в стерильных условиях на инокуляты размером 4 х 4 х 5 мм, что соответствует начальной массе 80 мг. Полученные инокуляты помещают в пробирки 200 х 20 мм, содержащие по 20 мл продукционной среды с минимальными, средними и максимальными значениями ингредиентов, по 20 инокулятов на каждый вариант. Используют питательные среды указанного выше состава.
Культуры инкубируют в климатической камере при 25оС и относительной влажности воздуха 70% в темноте в течение 7 недель, за это время в каллусах накапливается максимальное количество аристолохиевых кислот (1 1,2 мг на каллус).
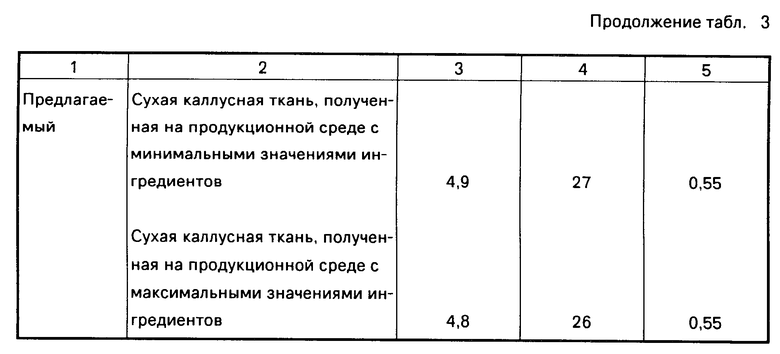
По истечении периода культивирования каллусы извлекают из культуральных сосудов, высушивают при 60оС в течение 24 ч и взвешивают. Получают 5,0 г сухих каллусов со среды, имеющей средние значения ингредиентов. Эти каллусы измельчают до размера частиц 1-2 мм и экстрагируют трехкратно по 50 мл метиловым спиртом в течение 9 дней, по три дня каждая экстракция. Извлечения объединяют и после фильтрации отгоняют растворитель при пониженном давлении, используя ротационный испаритель. Получают густой коричневый сироп, который растворяют в 150 мл бутилового спирта. Полученный раствор экстрагируют пятикратно по 50 мл насыщенным водным раствором гидрокарбоната натрия. Объединенные щелочные извлечения подкисляют до рН 7 5%-ным раствором соляной кислоты и вновь экстрагируют тремя порциями по 50 мл бутилового спирта. Экстракты выпаривают под вакуумом досуха и получают 27,5 мг аристолохиевых кислот.
Подобным образом проводят выделение аристолохиевых кислот из каллусов, выращенных на средах, имеющих минимальные и максимальные содержания ингредиентов. В табл.3 представлены результаты получения аристолохиевых кислот по известному и данному способам.
Таким образом, предлагаемый способ позволяет увеличить выход аристолохиевых кислот.
Преимущество предлагаемого способа состоит в том, что он позволяет получить постоянно воспроизводимый источник сырья для выработки аристолохиевых кислот, а также открывает возможность повышать содержание целевого продукта относительно интактного растения путем селекции продуктивных каллусных линий. Кроме того, использование предлагаемого способа позволит избежать уничтожения редкого растения Arictolochia manshuriensis при использовании его в качестве сырья.
Работы по получению культуры каллусов Aristolochia manshuriensis начались в марте 1986 года. Материал части растения Aristolochia manshuriensis заготавливался в следующих местах:
Надеждинский район Приморского края, река Нежинка, 22 км западнее села Нежино;
Уссурийский район Приморского края, Горно-таежная станция ДВО АН СССР;
Приморский край, г.Владивосток, Ботанический сад ДВО АН СССР.
Материал заготавливался ежемесячно в течение полутора лет. Часть его использовалась для получения каллусов, другая часть для химического анализа и фармакологических испытаний.
В течение полутора лет проводились опыты по получению каллусов, в результате которых выявлена сезонная динамика каллусообразования. Каждая каллусная линия анализировалась на содержание аристолохиевых кислот. Анализ содержания аристолохиевых кислот проводился в Биолого-почвенном институте и параллельно в Тихоокеанском институте Биоорганической химии. Результаты количественных определений содержания аристолохиевых кислот в тканях интактных растений и в каллусах представлены в табл.4. Отмечается высокая стабильность содержания аристолохиевых кислот в интактных дикорастущих растениях. Так, их содержание в растениях из Надеждинского района составляет 0,29-0,36% из Уссурийского района 0,29-0,34% из пригорода Владивостока 0,28-0,36% Растения в январе содержат 0,32-0,34% аристолохиевых кислот, в апреле 0,34-0,36% в июле 0,29-0,30% а в октябре 0,28-0,31%
Во всех каллусных культурах также накапливается примерно одинаковое количество аристолохиевых кислот. Содержание их в каллусах, полученных от растений из Надеждинского района, составляет 0,52-0,66% из Уссурийского района 0,46-0,69% из пригорода Владивостока 0,45-0,61% Каллусы из растений, собранных в январе, содержат 0,46-0,52% аристолохиевых кислот, в апреле 0,53-0,66% в июле 0,45-0,69% в октябре 0,40-0,66%
Таким образом, приведенные результаты количественного определения содержания аристолохиевых кислот в тканях интактных растений, заготовленных в различное время года и в различных местах, и в каллусных тканях, полученных из этих растений, показывают, что из содержащих примерно равные количества аристолохиевых кислот дикорастущих растений получаются каллусы, также содержащие примерно одинаковые количества аристолохиевых кислот.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм каллусной культуры АRISтоLоснIа маNSнURIеNSIS - продуцент аристолохиевых кислот | 1988 |
|
SU1551736A1 |
| СПОСОБ ПОЛУЧЕНИЯ СОМАТИЧЕСКИХ ЭМБРИОИДОВ В КУЛЬТУРЕ IN VITRO ЛЕВЗЕИ САФЛОРОВИДНОЙ | 1997 |
|
RU2130709C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЛУСНОЙ КУЛЬТУРЫ БОЛИГОЛОВА ПЯТНИСТОГО (Conium maculatum L) | 2015 |
|
RU2590586C1 |
| Штамм культивируемых клеток растений АRISтоLоснIа маNSнURIеNSIS Ком., используемый для получения препарата, обладающего кардиотропной активностью | 1990 |
|
SU1708836A1 |
| Способ получения растений-регенерантов эспарцета | 1988 |
|
SU1630707A1 |
| Способ получения микрорастений лекарственного растения Stephania glabra (Roxb.) Miers | 2021 |
|
RU2757318C1 |
| Способ получения каллусной культуры борца бородатого (Aconitum barbatum Patr. ex Pers.) | 2016 |
|
RU2631927C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ РАПСА IN VITRO | 2008 |
|
RU2374834C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ МИКОБАКТЕРИЯМИ, ШТАММ КАЛЛУСНОЙ КУЛЬТУРЫ Ungernia victoris UV-22-ПРОДУЦЕНТ БИОЛОГИЧЕСКИ АКТИВНОГО КОМПЛЕКСА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ МИКОБАКТЕРИЯМИ, И СПОСОБ ЕГО КУЛЬТИВИРОВАНИЯ (ВАРИАНТЫ) | 2009 |
|
RU2425687C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ - АДАПТОГЕНОВ В КЛЕТОЧНОЙ КУЛЬТУРЕ РОДИОЛЫ РОЗОВОЙ (RHODIOLA ROSEA L.) | 2019 |
|
RU2726067C1 |

Изобретение относится к биотехнологии и может быть использовано в химико-фармацевтической промышленности. Аристолохиевые кислоты, обладающие противоопухолевым действием, содержатся в растении кирказон маньчжурский. Целью изобретения является увеличение выхода целевого продукта и получение воспроизводимого источника сырья. Способ состоит в том, что для получения аристолохиевых кислот используют каллусы растения Aristolochia menshuriens, полученные при культивировании ткани на специально подобранных питательных средах при специфических условиях культивирования. 4 табл.
СПОСОБ ПОЛУЧЕНИЯ АРИСТОЛОХИЕВЫХ КИСЛОТ, включающий экстрагирование их растворителем из растительного сырья, отличающийся тем, что, с целью увеличения выхода целевого продукта и получения воспроизводимого источника сырья, в качестве растительного сырья используют каллусы Aristolochia manshuriensis, которые индукцируют из эксплантатов интактного растения и культивируют первоначально на инициальной питательной среде следующего состава, мг/л воды:
NH4NO3 1145 1850
KNO3 1490 2100
CaCl2 · 2H2O 420 500
CuSO4 · 5H2O 0,030 0,075
MgSO4 · 7H2O 350 400
KH2PO4 150 210
H3BO3 4,2 8,0
MnSO4 · 4H2O 15,6 26,7
ZnSO4 · 7H2O 6,0 10,3
KI 0,53 0,90
Na2MoO4 · 2H2O 0,15 0,30
CoCl2 · 5H2O 0,030 0,075
FeSO4 · 7H2O 25 30
Na2EDTA · 2H2O 26,1 40,1
Тиамина гидрохлорид 0,15 0,25
Пиридоксина гидрохлорид 0,4 0,6
Никотиновая кислота 0,4 0,6
Мезоинозит 50 100
L-цистеина гидрохлорид 4 6
6-Бензиламинопурин 0,2 1,0
Индолилуксусная кислота 1 3
Сахароза 2,5 · 104 3,5 · 104
Бакто-агар 5,5 · 103 6,5 · 103
при pH 5,2 6,2
с последующим отбором наиболее продуктивных каллусных линий, который затем культивируют на продукционной питательной среде, активизирующей синтез аристолохиевых кислот, следующего состава, мг/л воды:
KNO3 1900 4400
CaCl2 · H2O 110 1470
MgSO4 · 7H2O 350 400
KH2PO4 150 200
H3BO3 4,2 8,0
MnSO4 · 4H2O 15,6 26,7
ZnSO4 · 7H2O 6,0 10,3
KI 0,53 0,90
Na2MoO4 · 2H2O 0,15 0,30
CuSO4 · 5H2O 0,030 0,075
CaCl2 · 2H2O 0,030 0,075
FeSO4 · 7H2O 25 30
Na2EDTA · 2H2O 32,6 50,1
Тиамина гидрохлорид 0,15 0,25
Пиридоксина гидрохлорид 0,4 0,6
Никотиновая кислота 0,4 0,6
Мезо-инозит 50 100
L-цистеина гидрохлорид 4 6
6-Бензиламинопурин 1 5
Индолилуксусная кислота 0,5 1,0
Сахароза 3,5 · 104 4,5 · 104
Бакто-агар 5,5 · 103 6,5 · 103
при pH 5,6 5,8.
| T | |||
| Nakanishi et al | |||
| Phytochemis try, 21, 7, 1759-1762, 1982. |
Авторы
Даты
1995-11-20—Публикация
1987-07-28—Подача