Изобретение относится к биотехнологии и может быть использовано в фармакологической промышленности при получении биологически активных соединений адаптогенного действия, в том числе фенолов (тирозола, салидрозида), а также веществ ароматической природы (розарина, розавина, розина), из клеточной культуры растения invitro.
Rhodiola rosea L. представляет интерес в качестве источника ценных биохимических компонентов для фармакологической промышленности. Из литературных источников известно, что родиола розовая является одним из мощнейших и диапазонных адаптогенных средств. Адаптогены представляют собой особую фармакологическую группу препаратов природного или синтетического происхождения, способных повышать неспецифическую сопротивляемость организма к неблагоприятным факторам внутренней и внешней среды. Родиола розовая, помимо адаптогенных, обладает рядом других фармакологических свойств: антиоксидантными, ноотропными, антидепрессантными, иммуномодулирующими. Поэтому родиола розовая сейчас вызывает высокий интерес исследователей и врачей-клиницистов [Куркин В.А. Родиола розовая (золотой корень): стандартизация и создание лекарственных препаратов: монография. - Самара: ООО «Офорт»; ГБОУ ВПО СамГМУ Минздрава России, 2015. - 240 с.].
Вопросы сырьевой базы для данного растения в настоящее время являются весьма актуальными. Например, отмечается несоответствие возрастающих потребностей промышленности в сырье и возможностей его заготовки. Основным поставщиком считается Россия, однако во многих регионах РФ родиола розовая занесена в Красную книгу. Возможности промышленных заготовок его довольно ограничены в связи с тем, что возобновление зарослей происходит в течение 10-15 лет и для некоторых районов установлены нормы заготовки сырья родиолы розовой с учетом времени восстановления зарослей [Galambosi В. et al. Importance and quality of roseroot growing in the European North // Z. Arznei-Gewurzpfla. - 2010. - Vol.15. - №4. - P. 160-169; Крылов Г.В., Казаринова H.B. Продуктивность золотого корня и его рациональное использование // В кн.: Охрана горных ландшафтов Сибири. Новосибирск, 1973. - С. 162-164.].
Новым решением является использование в качестве альтернативного источника возобновляемого экологически чистого сырья культур клеток лекарственных растений.
Из уровня техники известен штамм культивируемых клеток растений Rubiacordifolia L. - продуцент антрахинонов, полученный в Биолого-почвенном институте ДВО РАН и депонированный во Всероссийской коллекции клеточных культур высших растений при Институте физиологии растений РАН под индексом RC-I (патент РФ №2141525, опубл. 20.11.1999). Штамм RC-I получен из дикорастущего растения марены сердцелистной, собранного в Анучинском районе Приморского края. Штамм представляет собой каллусную ткань рыхлой консистенции желто-оранжевого цвета. Штамм выращивают в накопительном режиме на агаризованной питательной среде. Штамм RC-I является высокопродуктивным источником антрахиноновых пигментов - муньистина и пурпурина. Среднее содержание пигментов составляет 0,89% от массы сухих клеток.
Также известен штамм культивируемых клеток растений Cnidiummonnieri (L.) Cuss, используемый для получения препарата, обладающего рибонуклеазной активностью (патент РФ №2031940, опубл. 27.03.1995). Каллусный штамм Cm-1 получен из дикорастущего растения Cnidiummonnieri (L.) Cuss., заготовленного в Надеждинском районе Приморского края. Ростовой индекс культуры 3030±0,50. Препарат представляет собой белковую фракцию, выделенную из биомассы клеток штамма Cm-1, и имеет следующие характеристики (из расчета на 1 г сухих клеток): суммарная рибонуклеазная активность 52610-79990 ед.; концентрация белка 179-198 опт.ед.; удельная рибонуклеазная активность 270-438 ед./опт.ед. Максимальное накопление рибонуклеазной активности в клетках наблюдается на 35-е сутки культивирования.
В патенте РФ №2639566, опубл. 21.12.2017 описан каллусный штамм культивируемых клеток растения живучка туркестанская Ajugaturkestanica (Regel) Briq. в условиях invitro- продуцент туркестерона. Штамм Ajugaturkestanica (Regel) Briq.At21 депонирован во Всероссийской Коллекции культивируемых клеток высших растений под регистрационным номером 88.
Наиболее близким к заявляемому способу (ближайшим аналогом) является штамм культивируемых клеток растения женьшеня настоящего Pg-1 (Panaxginseng С.А. Меу) в условиях invitro - продуцент гинзенозидов, которые широко используются в фармацевтической промышленности и косметологии в качестве адаптогенов (патент РФ №2415927, опубл. 10.04.2011). Штамм культивируемых в условиях invitro клеток растения женьшеня настоящего Pg-1 (Panaxginseng С.А Меу) депонирован в Российской коллекции культивируемых клеток высших растений при учреждении Российской Академии наук, институте физиологии растений им. К.А.Тимирязева РАН под №68 - продуцент гинзенозидов: соединений групп Rg и Rb. В течение длительного культивирования (6-7 циклов) стабильно присутствовали все семь гинзенозидов, характерных для растений. В штамме Pg-1 активизировался синтез соединений Rb-группы и особенно Регинзенозидa. Отношение соединений Rg/Rb групп было достаточно высоким и оставалось стабильным в течение нескольких последовательных циклов культивирования. Полученный штамм женьшеня настоящего Pg-1 синтезирует полный состав соединений Rg- и Rb-групп гинзенозидов и их значительное количество - до 4% от сухой биомассы клеток. Качественный состав всех соединений гинзенозидов Rb- и Rg-групп и их количество было равно значениям, имеющимся в дикорастущем растении женьшеня настоящего.
Основным недостатком всех известных способов является невозможность регуляции содержания веществ с адаптогенной активностью в полученных культурах клеток.
Известно, что на продукционный процесс в культуре клеток invitro могут воздействовать факторы внешней среды. Так, в некоторых экспериментах показано, что регулятор роста растений 2,4-дихлорфеноксиуксусная кислота в большинстве случаев ингибирует продукцию вторичных метаболитов. Его рекомендуют заменить нафтилуксусной или индолилуксусной кислотой, что будет способствовать увеличению продукции антоцианов в суспензионных культурах Populus (тополь канадский) и D. carota (морковь дикая), бетацианинов в суспензиях Portulaca (портулак), никотина в N. tabacum (табак душистый) и др. Однако 2,4-дихлорфеноксиуксусная кислота вызывала стимуляцию биосинтеза каротиноидов в суспензиях D. carota и продукции антоцианов в каллусных культурах Oxalislinearis (оксалис линейный).
Многими исследователями уже доказано, что решающими факторами накопления вторичных метаболитов культурой клеток растений является концентрация регуляторов роста в питательной среде, а также тип и особенно концентрация ауксина или цитокинина, либо их соотношение. Белорусскими учеными - В.М. Юриным и др. изучена каллусная и суспензионная культуры Syringavulgaris (сирень обыкновенная) при разных режимах освещения, чередования длины дня, разных доз ауксинов и витаминов [Юрин, В.М. Культура растительных клеток и тканей: технология получения, разнообразие фармакологически активных метаболитов и приемы регуляции их синтеза // Труды Белорусского государственного университета: научный журнал. - 2009. - Т. 4. - Ч. 2.]. В процессе эксперимента установлено, что каллусы сирени, выращенные в темноте на среде Мурасиге и Скуга (MS) с добавлением 3 мг/л 3-индолилуксусной кислоты, 0,2 мг/л 2,4-дихлорфеноксиуксусной кислоты, 0,04 мг/л кинетина, 1 мг/л тиамина и 30 г/л сахарозы, имели лучшие ростовые показатели по сравнению с другими питательными средами.
В естественной среде произрастания растения фактически никогда не находятся в оптимальных условиях. Они постоянно испытывают действие стресса разной силы и продолжительности. Некоторые факторы могут действовать в течение короткого времени (порывы ветра, град), а другие - в течение многих дней. К ним относятся: затопление, высокая или низкая температура, повышенная кислотность почвы, заболачивание и др. Зачастую растения испытывают влияние сразу комплекса неблагоприятных факторов: одновременное влияние высокой температуры и дефицита влаги, избыточной влажности, недостатка кислорода и присутствие патогенных микроорганизмов (фитопатогенных грибов, бактерий, вирусов) и энтомофагов.
Первичная стрессовая реакция сопровождается значительными отклонениями в физиолого-биохимических процессах. Возникают симптомы начальных повреждений растений. Одновременно появляются защитные реакции, которые направлены на устранение этих повреждений. Если воздействие стрессора сильное и быстро нарастает, то организм может погибнуть. В противном случае он адаптируется к стрессору. Растение приспосабливается к новым условиям.
В исследованиях Ю.И. Долгова, К.А. Седова в опытах с Arabidopsisthaliana в культуре каллуса на модифицированной питательной среде Мурасиге и Скуга с различным сочетанием ауксинов и цитокининов, с кратковременной инкубацией при повышенной температуре (40°С) и культивировании на среде с повышенным содержанием сульфата меди (CuSO4⋅5H2O) установлено, что незначительные концентрации меди (20-50 мг/л) стимулировали рост каллуса как в первом, так и во втором пассажах. После первого цикла культивирования прирост каллуса по отношению к контролю составил 70%, а после второго - 50-80%. При увеличении концентрации меди до 60 мг/л наблюдали ингибирование каллуса в обоих пассажах. Выдерживание каллуса в условиях повышенной температуры от 3 до 5 часов стимулировало его рост, а начиная с 5 часов наблюдалось ингибирование роста клеток. Поэтому множество экспериментов направлено на получение повышенного количества полезных вторичных метаболитов в культуре invitro через процедуру стресса.
Техническая задача, на решение которой направлено настоящее изобретение, состоит в оптимизации способа получения биологически активных соединений адаптогенного действия.
Технический результат, достигаемый использованием настоящего изобретения, состоит в регулировании накопления фенолов (тирозола, салидрозида), а также веществ ароматической природы (розавина, розина, розарина) в каллусной культуре родиолы розовой (Rhodiolarosea L.).
В предлагаемом способе поставленная цель достигается стимулированием роста каллусной культуры Rhodiolarosea L. под действием предшественников биосинтеза вторичных метаболитов (хитозан) и стрессовых факторов (кратковременное облучение ультрафиолетом).
Способ по изобретению осуществляют следующим образом. Стерильные семена родиолы розовой проращивают на среде Мурасиге-Скуга (MS). Проростки возрастом 14 суток используют для получения каллусной культуры.
Для культивирования каллусной культуры родиолы розовой используют модифицированную питательную среду Мурасиге-Скуга с контролируемым содержанием α-нафтилуксусной кислоты, 2,4-дихлорфеноксиуксусной кислоты и хитозана (таблица 1). Эффективность культивирования и выход биологически активных веществ повышают путем кратковременного обучения каллусной культуры ультрафиолетовым светом среднего диапазона.

Цикл субкультивирования для каллусной культуры составляет 28 суток. Для выращивания каллусной культуры Rhodiolarosea L. используют чашки Петри. Каллус при пересеве делят на 3-7 частей, в зависимости от прироста. Культивирование проводят в стерильных условиях, на свету, при температуре 26°С, влажности 60-70%.
Изобретение иллюстрируется следующими примерами.
Пример 1
Семена растений родиолы розовой промывают детергентом и для стерилизации помещают в 0,1%-ный раствор сулемы (HgCl2) на 1 мин. После стерилизации материал трехкратно отмывают в течение 20 мин в дистиллированной стерильной воде. Стерильные семена проращивают на среде Мурасиге-Скуга (MS). Проростки возрастом 14 суток используют для получения каллусной культуры.
Культивирование каллусной культуры родиолы розовой осуществляют на питательной среде, состав которой соответствует таблице 1. Контроль - питательная среда, не содержащая хитозана. Питательную среду автоклавируют при 15 мин подготовительного и 15 мин основного режима при добавочном давлении 0,7-0,8 атм. Для выращивания каллусной культуры Rhodiolarosea L. используют чашки Петри (диаметр 60 мм). Каллус при пересеве делят на 3-7 частей, в зависимости от прироста. Культивирование проводят в стерильных условиях, на свету (16-часовой световой день), при температуре 26°С, влажности 60-70%. Используемые в работе колбы и инструменты стерилизуют в течение 60 минут при 180°С в сухожаровом шкафу.
Цикл субкультивирования для каллусной культуры составляет 28 суток.
Результаты анализа содержания основных биохимических соединений в каллусных культурах родиолы розовой, выращенных на питательных средах с добавлением хитозана и без добавления хитозана (таблица 1), приведены в таблице 2. Для определения содержания биохимических соединений в каллусных культурах использовали метод высокоэффективной жидкостной хроматографии, совмещенной с масс-спектрометрическим детектором.
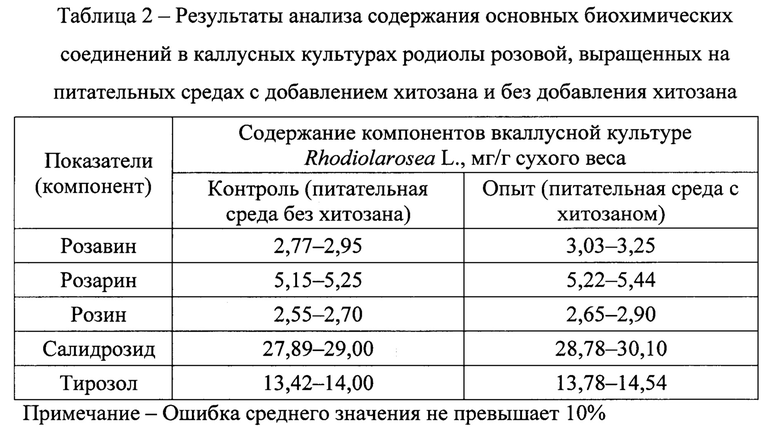
Согласно данным, представленным в таблице 2, добавление в питательную среду такого предшественника биосинтеза вторичных метаболитов, как хитозан, приводит к незначительному повышению биосинтетической активности каллусной культуры родиолы розовой. Так, содержание розавина в опытном варианте увеличивается на 9,4-10,2% по сравнению с контролем, содержание розарина - на 1,3-3,6%, содержание розина - на 3,9-7,4%, содержание салидрозида - на 3,2-3,8%, содержание тирозола - на 2,7-3,9%.
Пример 2
Семена растений родиолы розовой промывают детергентом и для стерилизации помещают в 0,1%-ный раствор сулемы (HgCl2) на 1 мин. После стерилизации материал трехкратно отмывают в течение 20 мин в дистиллированной стерильной воде. Стерильные семена проращивают на среде Мурасиге-Скуга (MS). Проростки возрастом 14 суток используют для получения каллусной культуры.
Культивирование каллусной культуры родиолы розовой осуществляют на питательной среде, состав которой соответствует таблице 1. Питательную среду автоклавируют при 15 мин подготовительного и 15 мин основного режима при добавочном давлении 0,7-0,8 атм. Для выращивания каллусной культуры Rhodiolarosea L. используют чашки Петри (диаметр 60 мм). Каллус при пересеве делят на 3-7 частей, в зависимости от прироста. Эффективность культивирования и выход биологически активных веществ повышают путем кратковременного (15-минутного) обучения каллусной культуры ультрафиолетовым светом (длина волны 315 нм). Культивирование проводят в стерильных условиях, на свету (16-часовой световой день), при температуре 26°С, влажности 60-70%. Контроль - культивирование каллусной культуры без действия стрессового фактора (облучения ультрафиолетом). Используемые в работе колбы и инструменты стерилизуют в течение 60 минут при 180°С в сухожаровом шкафу.
Цикл субкультивирования для каллусной культуры составляет 28 суток.
Результаты анализа содержания основных биохимических соединений в каллусных культурах родиолы розовой, выращенных в условиях наличия и отсутствия стрессового фактора (облучение ультрафиолетом), приведены в таблице 3. 

Из таблицы 3 следует, что облучение каллусной культуры родиолы розовой ультрафиолетом приводит к значительному увеличению ее способности синтезировать биологически активные вещества - адаптогены. Содержание розавина в опытном варианте увеличивается на 45,2-47,0% по сравнению с контролем, содержание розарина - на 25,7-26,8%, содержание розина - на 42,6-49,0%, содержание салидрозида - на 15,2-18,3%, содержание тирозола - на 16,0-19,4%.
Таким образом, техническим результатом заявленного способа является регуляция содержания биологически активных веществ адаптогенного действия в каллусной культуре родиолы розовой путем введения в питательную среду предшественников биосинтеза вторичных метаболитов (хитозана) и действия стрессовых факторов (облучение ультрафиолетовым светом с длиной волны 315 нм).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ повышения эффективности культивирования в условиях in vitro каллусной культуры Базилика Обыкновенного (Ocimum basilicum) | 2022 |
|
RU2797013C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В КЛЕТОЧНОЙ КУЛЬТУРЕ ATRAGENE SPECIOSA WEINM. (КНЯЖИК СИБИРСКИЙ) | 2009 |
|
RU2428473C2 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ КУЛЬТИВИРОВАНИЯ КАЛЛУСНОЙ КУЛЬТУРЫ ЛИМОННИКА КИТАЙСКОГО (SCISANDRA CHINENSIS (TURCZ.) BAILL.) В УСЛОВИЯХ IN VITRO | 2021 |
|
RU2757463C1 |
| Способ регуляции морфогенетической активности каллусной ткани лекарственных растений in vitro | 2022 |
|
RU2798292C1 |
| Способ получения СО-экстракта родиолы розовой | 2021 |
|
RU2792928C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ ЖЕНЬШЕНЯ | 1997 |
|
RU2131924C1 |
| Способ получения биологически активных веществ | 1980 |
|
SU885252A1 |
| СПОСОБ ВЫДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ АНТИМИКРОБНОГО ДЕЙСТВИЯ ИЗ КЛЕТОЧНЫХ КУЛЬТУР ЭЛЕУТЕРОКОККА КОЛЮЧЕГО ELEUTHEROCOCCUS SENTICOSUS RUPR. MAXIM. | 2021 |
|
RU2762431C1 |
| Способ оценки селекционных образцов озимой пшеницы на устойчивость к фузариозной корневой гнили | 2019 |
|
RU2726066C1 |
| Способ получения каллусной культуры цикория (Cichorium intybus L.) | 2023 |
|
RU2804841C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ получения биологически активных веществ - адаптогенов в клеточной культуре радиолы розовой, характеризующийся тем, что предусматривает культивирование клеток растения Rhodiola rosea L. на модифицированной питательной среде Мурасиге-Скуга, содержащей хитозан, с предварительным 15-минутным облучением ультрафиолетовым светом с длиной волны 315 нм, на свету (16-часовой световой день), при температуре 26°С в течение 28 суток. Изобретение позволяет регулировать содержание биологически активных веществ адаптогенного действия в каллусной культуре родиолы розовой путем введения в питательную среду предшественников биосинтеза вторичных метаболитов и действия стрессовых факторов. 3 табл.
Способ получения биологически активных веществ - адаптогенов в клеточной культуре родиолы розовой (Rhodiolarosea L.), характеризующийся тем, что проводят культивирование клеток растения Rhodiolarosea L. на модифицированной питательной среде Мурасиге-Скуга, содержащей нитрат аммония 1,65 г, хлорид кальция 0,44 г, сульфат магния 0,37 г, гидрофосфат калия 0,17 г, нитрат калия 1,90 г, борную кислоту 6,2 мг, хлорид кобальта 0,025 мг, сульфат меди (II) 0,025 мг, сульфат железа (II) 27,8 мг, сульфат марганца (II) 22,3 мг, йодид калия 0,83 мг, молибдат натрия 0,25 мг, сульфат цинка 8,6 мг, натрий железную соль этилендиаминтетрауксусной кислоты 5 мл/л для стокового раствора, содержащего 5,57 г FeSO4⋅7H2O и 7,45 г Na2-ЭДТА на литр воды, сахарозу 30,0 г, инозит 100,0 мг, тиамин 1,0 мг, пиридоксин 1,0 мг, Са-пантетонат 10,0 мг, кинетин 0,05 г, α-нафтилуксусную кислоту 0,1 г, 2,4-дихлорфеноксиуксусную кислоту 0,5 г, воду до 1 л, при культивировании дополнительно вводят в питательную среду хитозан в количестве 1,0 г/л, а культивированию предшествует кратковременное в течение 15 минут облучение выращиваемых растительных клеток ультрафиолетовым светом с длиной волны 315 нм.
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК РАСТЕНИЯ ЖЕНЬШЕНЯ НАСТОЯЩЕГО Pg-1 (Panax ginseng C.A. Mey) В УСЛОВИЯХ IN VITRO - ПРОДУЦЕНТ ГИНЗЕНОЗИДОВ | 2009 |
|
RU2415927C1 |
| Каллусный штамм культивируемых клеток растения живучка туркестанская Ajuga turkestanica (Regel) Briq. в условиях in vitro - продуцент туркестерона | 2016 |
|
RU2639566C1 |
| GALAMBOSI, et al., Importance and quality of roseroot Rhodiola rorea L | |||
| growing in the European North, Z | |||
| Arznei-Gewurzpfla, vol | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
Авторы
Даты
2020-07-08—Публикация
2019-10-16—Подача