Изобретение относится к медицине, в частности к иммунологии, и может быть использовано для улучшения качества анализа фагоцитоза, например, чумного микроба.
Цель изобретения - упрощение способа.
Способ осуществляется следующим образом.
Эукариотические клетки, в том числе и макрофаги, имеют одинаковое количество ДНК: 2 С в диплоидном наборе хромосом. При окраске таких клеток флуорохрамами, специфически связывающимися с ДНК (бромид этидия и митрамицин), и исследовании их на проточном цитофлоуриметре получается гистограмма распределения макрофагов по интенсивности флуоресценции (пропорционально содержанию ДНК) в виде симметричного узкого пика - нормальное Гауссовское распределение. При захвате фагоцитами микробов чумы или при размножении микробов внутри фагоцитов количество ДНК-клетки увеличивается за счет ДНК фагоцитированных (размножающихся) бактерий, и симметричность гистограммы нарушается. Чем интенсивнее захват микроорганизмов, тем больше смещение гистограммы в правую сторону за счет увеличения числа клеток с повышенным содержанием ДНК.
Площадь S'1 , ограниченная левым склоном Гауссовского распределения, представляет собой суммарное количество ДНК половины анализируемых макрофагов (нефлагоцитирующие клетки). Площадь S'1 , ограниченная правым склоном гистограммы - это суммарное количество ДНК половины сосчитанных макрофагов, не содержащих микробы, и фагоцитов, поглотивших микроорганизмы. Указанные площади автоматически определяются регистрирующим устройством - анализатором импульсов.
Получаемые гистограммы дают возможность оценить эффективность фагоцитоза по следующим показателям.
Процент активных фагоцитов (% АФ) подсчитывается следующим образом: разность площадей, ограниченных правым и левым склонами гистограммы, - это число фагоцитов, поглотивших микробы (число активных фагоцитов). Процент этого числа от общего числа фагоцитов в исходной контрольной культуре есть процент активных фагоцитов
% ≳АФ= 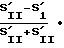 100% .
100% .
Индекс завершенности фагоцитоза (ИЗФ) определяется отношением площади, ограниченной правым склоном гистограммы, к площади, ограниченной левым склоном гистограммы
ИЗФ= 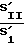 .
.
В контрольной культуре распределения клеток по содержанию ДНК распределение клеток по содержанию ДНК строго симметрично. Значит, отношение площадей, ограниченных правым и левым склонами гистограммы, будет равно единице. В культуре, где произошел захват бактерий, ИЗФ будет больше единицы, при переваривании этот показатель будет уменьшаться, а при размножении увеличиваться. Гистограмма распределения клеток, в которых процесс фагоцитоза полностью завершен, эквивалентна контрольной, т. е. приближение отношения площадей к единице говорит о переваривании микробов.
Процент поврежденных макрофагов (% ПМ) определяется числом клеток с количеством ДНК меньшим, чем в контрольной культуре.
Уменьшение количества ДНК происходит за счет разрушения ядерного аппарата клетки. Вычисляется как разность площадей, ограниченных левыми склонами опытной и контрольной гистограммы, выраженная в процентах от общего числа фагоцитов
% ПМ= 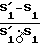 · 100% .
· 100% .
При выделении разрушенных клеток в отдельную популяцию (формирование второго пика гистограммы слева при выраженном цитопатическом эффекте) % ПМ определяется процентом площади под вновь образовавшимся пиком.
П р и м е р. Для изучения процесса фагоцитоза I. pestis EV используют кратковременную культуру перитонеальных макрофагов морской свинки. Животным вводят внутрибрюшинно 10 мл мясопептонного бульона рН 7,2. Через 4 сут морских свинок забивают хлороформом, удаляют кожу с брюшной стенки, инъецируют 10 мл среды Хэма (Fx10) с гепарином (5 ед/мл) в брюшную полость, массируют брюшную стенку в течение 1 мин для отделения макрофагов в суспензию. Используя шприц с толстой иглой, отсасывают жидкость. Определяют содержание макрофагов в экссудате с помощью камеры Горяева и разводят его средой Хэма до концентрации 2 млн клеток в 1 мл. К экссудату добавляют взвесь I. pestis EV из расчета 50 микробов на макрофаг. Контролем служит взвесь макрофагов без микробов. Для предотвращения прилипания фагоцитов к стеклу используют силиконированную посуду.
Через 30 мин, 1,4 и 8 ч инкубации при 37оС (оптимальная температура для выработки полноценных антигенов чумного микроба) забирают по 1 мл опытной и контрольной суспензией, отмывают от микробов, не прикрепившихся к макрофагам, и белков экссудата брюшной полости в 5 мл 0,34 М раствора сахаразы на центрифуге при 900 g. Осажденные клетки ресуспендируют в 0,1 мл раствора Хэнкса и фиксируют 1-3 мл этанола. Через 1 ч фиксации клетки осаждают из спирта, окрашивают 10-15 минут 0,0025% -ным раствором бромида этидия в 0,1 М трис-буфере с 0,6% NaCl рН 7,4 и 5-10 мин в 0,005% -ном растворе митрамицина, содержащего 7,5 мМ MgCl2 и 12,5% этанола рН 5,5 и регистрируют на проточном цитофлуориметре.
Изучают следующие показатели: процент активных фагоцитов (% АФ) вычисляют по формуле
% АФ= 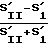 · 100% ;
· 100% ;
индекс завершенности фагоцитоза (ИЗФ) вычисляют по формуле
ИЗФ= 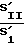 ;
;
цитопатического эффекта от I. pestis EV в исследованные сроки не наблюдалось, процент поврежденных макрофагов (% ПМ) не вычислялся.
Так, например, через 4 ч культивирования макрофагов с I. pestis EV S'1 = 11875, S'll = 18152.
% АФ= 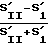 · 100% =
· 100% = 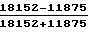 · 100% = 20.90% ,
· 100% = 20.90% ,
ИЗФ=  =
=  = 1.528 .
= 1.528 .
Определение в динамике основных показателей фагоцитоза макрофагами морской свинки приведено в таблице.
Из таблицы видно, что максимальную фагоцитарную активность макрофаги проявляют через 1 ч инкубации с микробами. Существыенное отличие значения ИЗФ от единицы (от контроля) 2,85 ± 0,34 на этот срок указывает на интенсивность процесса, большую загруженность макрофагов микробными клетками. Через 4 ч культивирования количество фагоцитируемого материала уменьшается, падает % АФ. Через 8 ч контакта все микробы переварены (ИЗФ приближается к единицe), и активность фагацитов не наблюдается.
Таким образом, предлагаемый способ дает возможность наблюдать процесс фагоцитоза чумного микроба макрофагами морской свинки в динамике и количественно оценить интенсивность фагоцитоза.
Фагоцитоз чумного микроба предлагаемым методом никогда не оценивался. Способ может быть применен в микробиологии, иммунологии, биохимии и диагностике чумы. (56) Вопросы профилактики природноочаговых инфекций. Саратов, 1983, с. 16-20.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХЕЛПЕРНЫХ ФРАКЦИЙ НЕЙТРОФИЛОКИНОВ, СИНТЕЗИРОВАННЫХ НЕЙТРОФИЛАМИ ПЕРИТОНЕАЛЬНОГО ЭКССУДАТА ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ ПОД ВЛИЯНИЕМ КЛЕТОК ВАКЦИННОГО ШТАММА ЧУМНОГО МИКРОБА | 2007 |
|
RU2341561C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ИММУНОГЕННОСТИ КАПСУЛЬНЫХ АНТИГЕНОВ BURKHOLDERIA MALLEI | 2005 |
|
RU2293993C1 |
| Способ получения мутантов чумного микроба | 1991 |
|
SU1831499A3 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ ВАКЦИОННОГО ШТАММА ЧУМНОГО МИКРОБА | 2019 |
|
RU2727258C1 |
| Способ повышения иммуногенной и протективной активности вакцинного штамма чумного микроба | 2023 |
|
RU2815337C1 |
| СПОСОБ ТЕРАПИИ ТОКСИЧЕСКОГО ШОКА У ЛАБОРАТОРНЫХ ЖИВОТНЫХ ПРИ ЭКСПЕРИМЕНТАЛЬНОЙ ЧУМЕ | 2007 |
|
RU2336897C1 |
| Способ повышения иммуногенности вакцинных штаммов чумного микроба | 1984 |
|
SU1249939A1 |
| СПОСОБ ВЫДЕЛЕНИЯ ЧУМНОГО МИКРОБА БАКТЕРИОЛОГИЧЕСКИМ МЕТОДОМ ИЗ ИССЛЕДУЕМОГО МАТЕРИАЛА (ВАРИАНТЫ) | 2007 |
|
RU2353654C1 |
| Способ восстановления вирулентности чумного микроба | 1990 |
|
SU1717630A1 |
| Способ дифференциации штаммов Yersinia pestis на токсически активные и неактивные | 2017 |
|
RU2663133C1 |

Изобретение относится к медицине, в частности к иммунологии, и может быть использовано для улучшения качества анализа фагоцитоза, например, чумного микроба. Цель изобретения - упрощение способа. Животных с предварительно введенным внутрибрюшинно мясопептонным бульоном забивают и выделяют перитонеальные макрофаги. Полученные фагоциты культивируют in vitro с возбудителем чумы при 37С. Через 30 мин, 1,4 и 8 ч инкубации макрофаги освобождают от неприкрепившихся микробов и белков экссудата брюшной полости, окрашивают флуорохромами, специфически связывающимися с ДНК (бромид этидия и митрамицин) и подвергают автоматическому анализу на импульсном цитофлуориметре. Полученные гистограммы распределения макрофагов по интенсивности флуоресценции (пропорционально содержанию ДНК) дают возможность оценить активность фагоцитарной реакции и завершенность фагоцитоза. 1 табл.
СПОСОБ ОЦЕНКИ ФАГОЦИТОЗА путем добавления микробных клеток к макрофагам морской свинки с последующей регистрацией фагоцитарной реакции, отличающийся тем, что, с целью упрощения способа, регистрацию осуществляют путем определения количества дезоксирибонуклеиновой кислоты в фагоцитирующей клетке и по увеличению этого показателя оценивают фагоцитарную реакцию.
Авторы
Даты
1994-02-28—Публикация
1985-11-19—Подача