Изобретение относится к промышленной микробиологии и касается способов культивирования микроорганизмов.
Цель изобретения - повышение активности целевого продукта и сокращение времени культивирования.
Способ осуществляют следующим образом.
Перед проведением культивирования рабочий ферментер заливают раствором сульфита и определяют скорость массопередачи кислорода при рабочих условиях аэрации и перемешивания. Затем вносят определенное количество проксанола и вновь определяют скорость массопередачи кислорода. По полученным данным вычисляют увеличение скорости массопередачи кислорода в присутствии проксанола. Готовят питательную среду, содержащую источники углерода, азота, фосфора и минеральные соли, засевают ее культурой микроорганизмов, осуществляют периодическое культивирование при аэрации и перемешивании. Одновременно с этим готовят смесь проксанола с дополнительным источником углерода. Каждый из компонентов по отдельности стерилизуют, затем смешивают, причем проксанол берут в количестве 0,001-1 г/л питательной среды, а дополнительный источник углерода - в количестве, пропорциональном увеличению скорости массопередачи кислорода. Полученную смесь вносят в момент начала лимитирования биосинтеза кислородом.
Изобретение поясняется примерами.
П р и м е р 1. Осуществляют периодическое культивирование мицелиального гриба Trichoderma viride 13/10 на питательной среде состава (%):
свекловичный жом 3,0
пшеничные отруби 0,5
солодовые ростки 1,43
КН2РО4 0,2
(NH4)2SO4 0,4
MgSO4 0,03
NaNO3 0,4
Параллельно на той же среде культивируют Trichoderma viride 44. Культивирование проводят в колбах объемом 0,75 л на круговой качалке со скоростью перемешивания 220 об/мин при 28оС.
Изменение выхода целевого продукта оценивают по изменению целлюлолитической активности (гидролиз бумаги по Мандельс-Веберу).
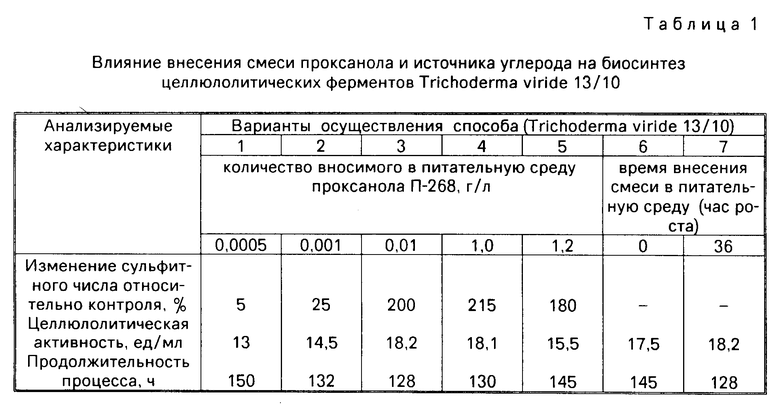
До начала культивирования сульфитным методом определяют изменение скорости массопередачи кислорода в качалке при внесении проксанола в количестве 0,001-1 г/л.
Так, внесение 0,001 г/л проксанола приводит к увеличению скорости массопередачи кислорода по сравнению с контролем на 25% и соответственно перед внесением проксанола в питательную среду готовят смесь из 0,001 г/л проксанола и источников углерода, количество которых на 25% превышает первоначальное.
Для внесения 0,01 г/л проксанола готовят смесь, состоящую из 0,01 г/л проксанола и источников углерода, количество которых в 2 раза превышает первоначальное.
Оптимальный момент внесения смеси в питательную среду определяют, внося смесь сразу после посева культуры (нулевой час роста) и в момент начала лимитирования биосинтеза уровнем растворенного кислорода. Для указанных штаммов-продуцентов и приведенных условий культивирования лимит по кислороду наблюдают на 36 ч роста культуры.
Варианты осуществления способа, а также известных способов и контроля (без внесения ПАВ) приведены в табл. 1, 2.
Как видно из таблиц, внесение в питательную среду смеси проксанола П-268 и источников углерода в момент начала лимитирования биосинтеза кислородом позволяет повысить на 40-50% целлюлолитическую активность целевого продукта и на 23-24% сократить процесс биосинтеза (по сравнению с контролем).
По сравнению с известным способом предлагаемый способ позволяет повысить целлюлолитическую активность продукта на 36% при снижении продолжительности процесса на 23%.
Внесение смеси проксанола и источников углерода, количество которых не было пропорциональным увеличению скорости массопередачи кислорода, приводит к незначительному увеличению выхода целевого продукта и сокращению продолжительности процесса.
П р и м е р 2. Периодическое культивирование Aspergillus foetidus 20-311 продуцентов пектолитических ферментов осуществляют на питательной среде состава (%):
свекловичный жом 3,0
солодовые ростки 0,5
(NH4)2SO4 0,7
KH2PO4 0,1
MgSO4 0,05
Параллельно осуществляют культивирование Aspergillus anamori 16 на среде того же состава. Культивирование проводят в колбах объемом 0,75 л на круговой качалке со скоростью перемешивания 220 об/мин при 30оС.
Изменение выхода целевого продукта оценивают по изменению пектолитической активности (интерферометрический метод).
До начала культивирования сульфитным методом определяют изменение скорости массопередачи кислорода в качалке при внесении проксанола в количестве 0,001-1 г/л.
Так, внесение 0,001 г/л проксанола приводит к 30% увеличению скорости массопередачи кислорода по сравнению с контролем. С учетом этого готовят смесь, состоящую из 0,001 г/л проксанола и источников углерода, количество которых на 30% превышает первоначальное.
Для внесения 0,01 г/л проксанола готовят смесь, состоящую из 0,01 г/л проксанола и источников углерода, количество которых в 2 раза превышает первоначальное.
Оптимальный момент внесения смеси в питательную среду определяют, внося смесь сразу после посева культуры (нулевой час роста), и в момент начала лимитирования биосинтеза уровнем растворенного кислорода.
Для указанных штаммов - продуцентов и приведенных условий культивирования лимит по кислороду наблюдают на 24 ч роста культуры.
Варианты осуществления способа по изобретению, а также известного способа и контроля (без внесения ПАВ) приведены в табл. 3,4.
Таким образом, внесение проксанола в культуральную среду позволяет значительно повысить пектолитическую активность при снижении продолжительности процесса для обоих штаммов Aspergillus.
П р и м е р 3. Периодическое культивирование дрожжей Candida maltoza ВСБ-569 осуществляют в 40-литровом ферментере с рабочим объемом 12 л на питательной среде состава, г/л:
Н3РО4 32
(NH4)2SO4 250
KCl 80
MgSO4 44
FeSO4 3,48
ZnSO4 1,71
MnSO4 1,91 с парафинами нефти в качестве источника углерода в количестве 2 об.%. Засевная концентрация дрожжей - 0,8-1,5 г/л.
Процесс ведут при 33-34оС и поддержания рН среды в пределах 4,0-4,2 путем добавления 6%-ного раствора аммиачной воды. Перемешивание осуществляют самовсасывающей турбоэжекционной мешалкой со скоростью 300 об/мин. Расход воздуха составляет 6 м3/ч, отбор проб проводят со скоростью 2 л/ч. Критерием окончания процесса выращивания дрожжей служит снижение концентрации парафина в среде до 1 г/л и менее.
До начала культивирования сульфитным методом определяют изменение скорости массопередачи кислорода в ферментере при внесении проксанола в количестве 0,001-1 г/л.
Так, внесение 0,05 г/л проксанола приводит к увеличению скорости массопередачи кислорода по сравнению с контролем в 2,3 раза. С учетом этого готовят смесь, состоящую из 0,05 г/л проксанола и 4,6 об.% парафина.
Для внесения 1,0 г/л проксанола готовят смесь, состоящую из 1,0 г/л проксанола и 4,4 об.% парафина.
Оптимальный момент внесения смеси в питательную среду определяют, внося смесь сразу после посева культуры (нулевой час роста) и в момент начала лимитирования биосинтеза уровня растворенного кислорода. Для указанного штамма-продуцента и приведенных условий культивирования лимит по кислороду наблюдают на 4 ч роста культуры (см. табл. 5, варианты 6,7).
Как видно из табл. 5, внесение в питательную среду смеси проксанола П-268 и парафина в момент начала лимитирования биосинтеза кислородом позволяет на 42% повысить выход целевого продукта при уменьшении продолжительности процессов на 33% (по сравнению с контролем).
Внесение смеси проксанола и парафина, количество которого не пропорционально увеличению скорости массопередачи кислорода, не приводит к увеличению выхода целевого продукта и сокращению продолжительности процесса.
Кроме того, осуществление процесса культивирования дрожжей по предлагаемому способу позволяет значительно улучшить все важнейшие показатели роста дрожжей. Так, содержание остаточных углеводородов в культуральной жидкости снижается на 63% по сравнению с контролем, что свидетельствует о наиболее полной утилизации субстрата дрожжами. Концентрация абсолютно сухих дрожжей возрастает на 42%.
П р и м е р 4. Культивирование бактериальных штаммов Bacillus subtilis 72 и Bacillus subtilis 103 осуществляют параллельно в 15-литровых ферментерах фирмы "Биолафит" на 8% крахмала. Крахмал предварительно осахаривают, для чего 12 кг крахмала разводят в 16 л и получают крахмальное молоко, в которое вливают 0,5 л раствора, состоящего из 48 г амилазы и 6 г карбоната кальция. Затем 14,5 л воды нагревают до 90оС и при перемешивании в раствор вливают все приготовленное крахмальное молоко. Температуру в биореакторе поддерживают на уровне 85оС в течение 3 ч. По окончании осахаривания доводят объем раствора до 40 л и рН до 2,5 фосфорной кислотой.
В ферментер вливают 4,4 л осахаренного крахмала, добавляют 30 г сухого гидролизата дрожжей, 22,5 г хлорида калия, 7,5 г сульфита магния, 1,5 г хлорида кальция, 60 мл пеногасителя. Стерилизацию раствора осуществляют при 121оС в течение 2 ч. После охлаждения до 45оС в среду стерильно вливают кукурузный экстракт.
Экстракт готовят следующим образом: в колбу вносят 180 г (NH4)HPO4 и 120 г кукурузного экстракта и доводят объем до 1 л. рН до 7,3-7,5 фосфорной кислотой. Стерилизуют экстракт при 121оС 2 ч.
Перед посевом среду в ферментере перемешивают и аэрируют в течение часа. Посев чистой культурой осуществляют при 45оС. В течение 6 ч после засева постепенно снижают температуру до 37оС и поддерживают ее на этом уровне. Культивирование проводят при скорости вращения мешалки 500 об/мин, рН поддерживают при получении нейтральной протеиназы на уровне 5,6, а при получении амилазы - на уровне 6,1-6,3 добавлением стерильного NH4OH. В течение культивирования периодически через каждые 6 ч отбирают пробы, которые анализируют на протеолитическую или амилолитическую активность. В процессе культивирования в культуральную жидкость вносят смесь проксанола с источниками углерода.
Результаты исследований приведены в табл. 6.
Из таблицы следует, что внесение проксанола в питательную среду позволяет значительно повысить протеолитическую (амилолитическую) активность штаммов B.subtilis 72 и В.subtilis 103 при снижении продолжительности процесса.
П р и м е р 5. Способ осуществляют в соответствии с примером 1 при культивировании продуцента целлюлолитических ферментов Trichoderma viride 13/10, при этом варьируют количество дополнительно вносимого в культуральную жидкость источника углерода, который вводят совместно с проксанолом или без него. Результаты представлены в табл. 7.
Из представленных данных следует, что дополнительное внесение в среду источника углерода без проксанола к улучшению показателей процесса не приводит. Целесообразно вносить в среду проксанол совместно с источником углерода, причем количество последнего должно быть пропорционально увеличению скорости массопередачи кислорода в среде.
Таким образом, изобретение позволяет повысить активность или выход целевого продукта на 42-50% и сократить продолжительность процессов на 20-33% .
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КУЛЬТИВИРОВАНИЯ ДРОЖЖЕЙ ДЛЯ СПИРТОВОГО ПРОИЗВОДСТВА | 2007 |
|
RU2378365C2 |
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ПОЛУЧЕНИЯ ФЕРМЕНТА ЦЕЛЛЮЛАЗЫ ПРИ ЕГО ПРОМЫШЛЕННОМ ПРОИЗВОДСТВЕ МЕТОДОМ ГЛУБИННОГО КУЛЬТИВИРОВАНИЯ ГРИБА TRICHODERMA VIRIDE 44-11-62/3 И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТА ЦЕЛЛЮЛАЗЫ В ЭТОЙ СРЕДЕ | 1999 |
|
RU2165974C2 |
| СПОСОБ БИОСИНТЕЗА L-ЛИЗИНА | 2011 |
|
RU2486248C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ХЛЕБОПЕКАРНЫХ ДРОЖЖЕЙ | 2012 |
|
RU2528872C2 |
| СПОСОБ ГЛУБИННОГО КУЛЬТИВИРОВАНИЯ Bacillus brevis ДЛЯ ПОЛУЧЕНИЯ ГРАМИЦИДИНА С | 2008 |
|
RU2447143C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ ЭНТЕРОБАКТЕРИЙ ESCHERICHIA COLI ИЛИ SALMONELLA В ПРОИЗВОДСТВЕННЫХ БИОРЕАКТОРАХ | 2019 |
|
RU2743396C1 |
| Активатор роста дрожжей, грибов, микроорганизмов и сельскохозяйственных культур | 2019 |
|
RU2734079C1 |
| ШТАММ ДРОЖЖЕЙ YARROWIA LIPOLYTICA - ПРОДУЦЕНТ ЛИМОННОЙ КИСЛОТЫ, СПОСОБ ПОЛУЧЕНИЯ ЛИМОННОЙ КИСЛОТЫ И СПОСОБ ВЫДЕЛЕНИЯ ЦИТРАТА НАТРИЯ | 1996 |
|
RU2090611C1 |
| ШТАММ ДРОЖЖЕЙ YARROWIA LIPOLYTICA - ПРОДУЦЕНТ ЛИМОННОЙ КИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ ЛИМОННОЙ КИСЛОТЫ | 1993 |
|
RU2096461C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ И ЦЕЛЕВЫХ ПРОДУКТОВ СИНТЕЗА С ЗАДАННЫМИ ТЕХНОЛОГИЧЕСКИМИ ПАРАМЕТРАМИ | 2003 |
|
RU2228352C1 |



Изобретение относится к промышленной микробиологии, касается способов культивирования микроорганизмов и может быть использовано в микробиологическом синтезе биологически активных веществ. Цель изобретения - повышение активности целевого продукта и сокращение времени культивирования. Изобретение заключается в том, что микроорганизм - продуцент выращивают в условиях аэрации на питательной среде, содержащей источники углерода, азота, минеральные соли и воду. В момент начала лимитирования биосинтеза кислородом в питательную среду вносят смесь оксиэтилированного полипропиленгликоля (проксанола), взятого в количестве 0,001 - 1 г/л, и источника углерода в количестве, пропорциональном увеличению скорости массопередачи кислорода. Изобретение позволяет на 42 - 50% повысить выход целевого продукта или его активность и на 20 - 33% сократить время культивирования. 7 табл.
СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ в условиях аэрации на питательной среде, содержащей источники углерода и азота, минеральные соли и воду с внесением неионогенного ПАВ, отличающийся тем, что, с целью повышения активности целевого продукта и сокращения времени культивирования, в качестве неионогенного ПАВ используют оксиэтилированный полипропиленгликоль в количестве 0,001 - 1 г/л, который смешивают с источником углерода, взятым в количестве, пропорциональном увеличению скорости массопередачи кислорода, а внесение полученной смеси в среду осуществляют в момент начала лимитирования биосинтеза кислородом.
| Патент США N 3293145, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1995-02-27—Публикация
1988-05-20—Подача