Изобретение относится к медицине и биохимии, в частности может быть широко использовано в клинической медицине и диагностике для тестирования функциональной активности фагоцитов периферической крови человека при определении иммунного статуса организма,
Целью изобретения является повышение чувствительности способа.
Способ заключается в том, что инкубацию каталазы осуществляют с ферментативной пероксидгенерирующей системой, которая содержит глюкозу в количестве 3 - 40 мкг, в пероксидгенерирующую систему (глюкозооксидазную систему - ГОС) добавляют в качестве индикаторного вещества люминол в насыщающей концентрации 5 М, определяют величины хемилюминесценции эталонных проб, по которым строят калибровочную
кривую зависимости величины хемилюминесценции от активности каталазы в эталонных пробах, после чего измеряют хемилюминесценцию искомой пробы и по калибровочной кривой эталонных проб определяют активность каталазы. Способ заключаетсявиспользованиипероксидгенерирующей ферментативной системы ГОС и в регистрации люминолзависи- мой хемилюминесценции, уменьшение значений которой характеризует разложение перекиси водорода каталазой. В используемой биферментной системе происходят следующие реакции: 1) перок- сидгенерирующая система (глюкозоокси- дазная система) в присутствии люминола: глюкоза + Н202 ++02 глюкозооксидаза глюконат + Н202
2) H2U2 + люминол пероксидаза ами- нофталат + Н20 + Na.
О
ел ел ю ю о
NH20
Отношение
InC
близко к 1, что сви
Образующиеся в ходе реакции кванты света регистрируются при помощи люмино- метра или сцинтилляционного счетчика.
Люминол (5-амино-2,3-дигидрофтала- зиндион) при окислении пероксидом в водных основных растворах дает яркую хемилюминесценцию. Структурная формула люминола приведена ниже;
О
f JN
NH2 0 , i.
люминол диазохинон аминофталат (конечный продукт реакции)
Показано, что в процессе его окисления образуются такие продукты, как диазохинон и 3-аминофталевая кислота. Последняя является конечным продуктом окисления. По-видимому, 3-аминофталат является эмиттером света.
При добавлении к пероксидгенерирую- щей системе с люминолом каталазы эффективная концентрация (N202) снижается в результате ферментной реакции: 3) НзОа каталаза НаОа + 02.
Это вызывает снижение квантового выхода в реакции (2) и, следовательно, уменьшение величины хемилюминесценции.
Таким образом, уменьшение величины хемилюминесценции системы 1.+2. при добавлении каталазы за определенный интервал времени соответствует количеству перекиси водорода, разложенного катала- зой за данный интервал времени.
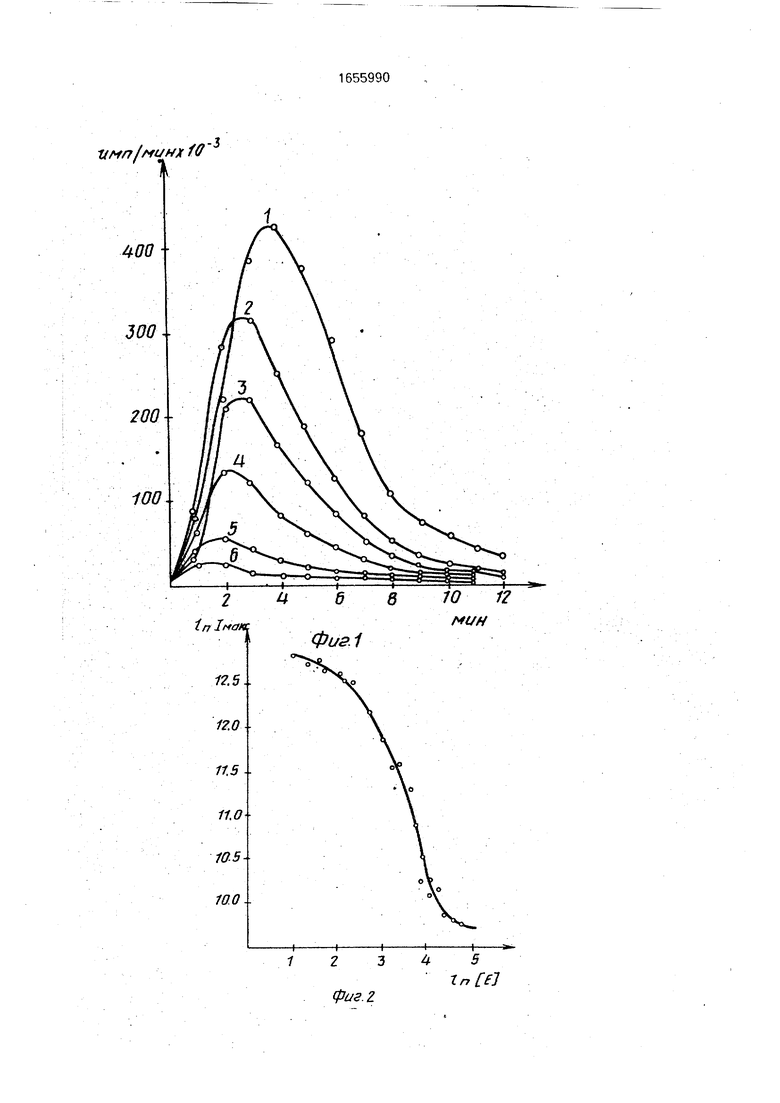
На фиг.1 представлены кривые кинетики хемилюминесценции пероксидгенериру ющей системы с люминолом в отсутствие и в присутствие каталазы представлены. Во всех случаях инкубационная смесь содержит 0,5 мл раствора ГОС, 40 мкг глюкозы. Конечный объем проб 0,6 мл. Кривая 1 соответствует кинетике хемилюминесценции в отсутствие каталазы, а кривые 2 - 6 - в присутствии каталазы соответственно с активность ю 3,9; 3,9x2; 3,9x4; 3,9x8, 3,9x16 ед.активности фермента.
На фиг.2 представлена кривая зависимости величины максимальной интенсивности хемилюминесценции от концентрации каталазы в пробе.
In макс
/-
детельствует в пользу первого порядка ка- талэзной реакции.
20
25
30
35
40
45
50
55
Данная кривая построена на основе кривых фиг.1, т.е. при концентрации глюкозы в системе, равной 40 мкг. Средний участок кривой 2 соответствует значениям активности каталазы 0,78x4 0,78x70 ед. ферментативной активности (т.е. диапазон измеряемых активностей каталазы около 1 порядка). Причем возможность определе- чния предельно низкой активности фермента достигается использованием в пероксидге- нерирующей системе глюкозы в количестве 3 мкг, в то время как стандартная система ГОС содержит 40 мкг, Кривая зависимости величины хемилюминесценции (%) от активности каталазы, вносимой в пробу (фиг.З), построена при концентрации глюкозы в системе 3 мкг/пробу. Активность каталазы 0,42 - 0,65 ед. активности дает снижение величины хемилюминесценции на 10%, что Является достоверным изменением и может служить нижней границей оценки чувствительности данного метода. Использование глюкозы в концентрации ниже 3 мкг на пробу невозможно для данного метода, так как для построения калибровочной кривой зависимости хемилюминесценции от активности каталазы необходим диапазон изменений интенсивности (величины) хемилюминесценции как минимум на 1 порядок, а именно, использование 3 мкг глюкозы в пробе позволяет получить уровень хемилюминесценции, превышающий фоновый на порядок.
С другой стороны, концентрация глюкозы 40 мкг на пробу является верхним предельным значением, позволяющим сохранить высокую чувствительность метода, так как при повышении концентрации глюкозы 40 мкг возрастает интенсивность хемилюминесценции и активность каталазы, способная заингибировать реакцию и снизить хемилюминесценцию, возрастает до значений не менее 2 - 3 ед. активности.
На фиг.4 представлена кривая зависимости интенсивности хемилюминесценции от концентрации люминола в инкубационной среде.
Реакция протекает в условиях насыщения по люминолу, что следует из графика зависимости интенсивности люминесценции от концентрации люминола в инкубационной среде (концентрация глюкозы в пероксидгенерируюцей системе неизменна - 40 мкг ). Квантовый выход реакции достигает максимума при концентрации люминола 2 - 5x10 М и остается неизменным при дальнейшем ее увеличении. Таким образом, рабочей концентрацией выбрана 5.10 5 М Использование более высоких концентраций люминола не приводит к.улучше
нию условий протекания реакции, однако сопровождается повышенным расходом дефицитного компонента инкубационной среды.
П р и м е р. В качестве эталонной используют катадазу фирмы Sen/a N 26900 из печени быка с удельной активностью 39000 ед./мг, Суспензию фермента в воде, насыщенной тимолом, 20 мг/мл предварительно разбавляют в 1000 раз(I ,78ед. активности). В качестве искомой используют каталззу фирмы Реахим из печени крупного рогатого скота марки Б с предполагаемой удельной активностью 41650 ед./мг.
Глюкозооксидазную систему ГОС составляют по Ллойду. Проба содержит 3 или 40 мкг глюкозы. Концентрация люминола - насыщающая 5 10 М. Конечный объем пробы 0,6 мл. Катэлазу вносят в объеме 100 мкл. Конечное объемное соотношение компонентов в смеси - проба: ферментативная система: индикаторное вещество - 0,5:1 0:0,05.
Во всех случаях инкубационная смесь содержит 0,5 мл раствора ГОС. Инкубационную смесь, содержащую все компоненты, включая каталазу, пред инкубируют в темноте в течение 1,5 мин, чтобы исключить эндогенный пероксид. Реакцию инициируют добавлением глюкозы. Измеряют хемилю- минесценцию эталонных проб в течение 10 - 12 мин на жидкостном сцинтилляционном счетчике БЕТА-Г, термостатированном при 37°С, и получают кинетические кривые хемилюминесценции для эталонных проб. На основе полученных кривых кинетики изменения величины хемилюминесценции эталонных проб в отсутствие и в присутствие каталазы (фиг.1) строят калибровочную кривую зависимости максимальной величины (интенсивности) хемилюминесценции от активности каталазы в пробе (фиг 2,3)
Затем, аналогичным образом получают кинетические кривые хемилюминесценции
для искомой пробы, в двух разведениях
Каталазу Реахим с предполагаемой активностью 41650 ед./мг разводят до получения предполагаемых концентраций 80 и 160 ед., а именно каталазу разводят до получения расчетной концентрации 40 ед/мг и далее берут по 2 и 4 мкл.
По графику калибровки оказал ось. что внесение в пробу 2 мкл суспензии катаяазы с искомой активностью дает максимальную
величину хемилюмивесценции на пределе чувствительности, что соответствует 2,7 ед активности, а 4 мкл соответствует 5,5 ед активности, т.е. активность катайазы Реахим упала в 30 раз по сравнению с маркировочными данными, т.е. удельная
2,Тед активность искомого препарата х
ед./мг вместо маркировочных 41650 ед./мг.
Формула изоб р в тения Способ количественного определения активности катэлазы, включающим инкуба цию анализируемого образца в присутствии
пероксидгенерирующей системы, состоящей из глюкозоохсидазы и углеводного субстрата, и пероксид регистрирующей системы, состоящей из пероксидззы и субстрата пероксидазы, отличающийся
тем, что, с целью повышения чувствительности способа, в качестве углеводногъ субстрата глюкоэооксидазы используют глюкозу в количестве 3-40 мкг, а в качестве субстрата пероксидазы - люминол в концентрам 5 М.
Out SOlO U G U
02L
B li


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ПЕРОКСИДАЗ И СУБСТРАТНАЯ СМЕСЬ ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ПЕРОКСИДАЗ | 2012 |
|
RU2525137C2 |
| СПОСОБ ИНТЕГРАЛЬНОЙ ЭКСПРЕСС-ОЦЕНКИ ЗАГРЯЗНЕНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ | 2007 |
|
RU2359036C1 |
| СПОСОБ ДИАГНОСТИКИ НАРУШЕНИЙ МЕТАБОЛИЗМА В ОРГАНИЗМЕ В УСЛОВИЯХ ОКИСЛИТЕЛЬНОГО СТРЕССА | 2010 |
|
RU2436101C1 |
| Способ раздельного определения органических и неорганических гидропероксидов при помощи хемилюминесценции с использованием каталазы | 2018 |
|
RU2700708C1 |
| Способ определения диклофенака натрия в биологической жидкости | 1987 |
|
SU1471131A1 |
| Способ определения содержания глюкозы в биологических жидкостях | 1987 |
|
SU1529122A1 |
| СПОСОБ ЭКСПРЕСС-ОЦЕНКИ ДЕЙСТВИЯ ЗУБНЫХ ПАСТ | 2007 |
|
RU2328740C1 |
| Способ определения холестерина | 1990 |
|
SU1788467A1 |
| СПОСОБ ОЦЕНКИ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТИ ЦИТОКИНОВ | 1999 |
|
RU2150113C1 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ АМИНОАДАМАНТАНА В КАЧЕСТВЕ ИММУНОРЕГУЛЯТОРОВ | 1996 |
|
RU2219916C2 |

Изобретение относится к медицине и биохимии и может быть широко использовано в клинической медицине и диагностике для тестирования функциональной активности фагоцитов периферической крови человека при определении иммунного статуса организма. Целью изобретения является повышение чувствительности способа. Для определения активности каталазы используют пероксидгенерирующую систему, состоящую из глюкозы и глюкозооксидазы, и пе- роксидрегистрирующуюсистему, состоящую из люминола и пероксидазы. Образующиеся в ходе пероксидазной реакции кванты света регистрируют при помощи лю- минометра или сцинтилляционного счетчика. В присутствии каталазы снижается стационарная концентрация пероксида, причем снижение пропорционально активности каталазы. Чувствительность способа 0,42 - 0,65 ед.активности в пробе. 4 фиг. Ё
: и Ј
001
ooi
00Ј
001
QJ. ХНПЫ/иЫК
066S99I
W1,5
Фи&З
Ц1макс В
5- ц..
3
ч17 -6 -5 -4 -J ,
фиг. 4
2,0 М,ед.
Ч1
| Gnllbault G.G | |||
| Handbook of Enzymatic methods of analysis, 1976, Marcel Dekker, New York | |||
| Патент США № 3926732, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1991-06-15—Публикация
1989-03-24—Подача