Изобретение относится к ветеринарной микробиологии и может быть использовано для повышения эффективности своевременной диагностики инфекционной энтеротоксемии животных и организации противоэпизоотических мероприятий.
Известны методы диагностики инфекционной энтеротоксемии животных с выделением возбудителя инфекции - Кл. перфрингенс.
При этом в качестве питательных сред для культивирования инфекционного агента использовали среды Китт-Тароцци, глюкоз- но-кровяной МПА и др. Применяемые при
выделении возбудителя питательные среды требуют для изготовления мясных продуктов, крови животных, трудоемки в изготовлении, нестандартны по качественному составу и не предусматривают ингибирова- ния посторонней микрофлоры.
Известен способ, диагностика по данным которого основана на обнаружении токсина Кл. перфрингенс в исследуемом материале от больных и павших животных с помощью биопробы на белых мышах или выделении культуры возбудителя с последующим изучением ее токсигенности. Выполнение этой методики в значительной мере
xi со
со о
Q
ограничено ее трудоемкостью (многократные пересевы) и применением дорогостоящих питательных сред, не обладающих селективными и дифференцирующими свойствами.
Целью изобретения является разработка способа ускоренного выделения культуры возбудителя инфекционной эн- теротоксемии с применением сконструированных питательных сред, обладающих селективными и дифференцирующими свойствами.
Поставленная цель достигается тем, что выделение культуры Кл. перфрингенс из исследуемого материала (фекалии, содержи- мое кишечника, корма, объекты внешней среды) осуществляют путем высева на жидкую питательную среду накопления на казеиновой основе, содержащую глюкозу, экстракт кормовых дрожжей (ЭКД), гемин, сульфит натрия, ингибиторы роста сопутствующей микрофлоры - гентамицин и эритромицин при следующем соотношении компонентов, г/л:
Витаминный препарат
ЭКД4,5-5,0
Глюкоза,
40%р-р 11-13 мл
Сульфит натрия1,0-1,2
Гемин0,004-0,005
Натрий
. хлористый4,5-5,0
Гентамицин0,0075-0,008
Эритромицин0,00004-0,000045
Ферментативный
гйдролизат казеина (аминный азот
90-100 мг%)До 1л
В последующем выделение и дифференциацию чистой культуры Кл. перфрин- гене проводят путем пересева на плотную диагностическую среду, содержащую ЭКД, глюкозу, сульфит натрия, гемин, натрий хлористый, 2,3,5-трифенилтетразолия хлорид (ТТХ) и агар при следующем соотношении компонентов, г/л: Витаминный
препарат ЭКД4,5-5,0
Глюкоза (40 % р-р)20-25 мл
Сульфит натрия1-1,2
Гемин0,004-0,005
Натрий хлористый4,5-5,0
ТТХ0,025-0,030
Агар13-15
Ферментативный
гйдролизат казеина (аминный азот
170-190 мг%) До 1л Способ осуществляют следующим образом.
Основой казеиновых питательных сред для выделения Кл. перфрингенс является ферментативный гйдролизат казеина средней степени расщепления (аминный азот 450-500 мг %).
Для изготовления ферментативного гидролизата казеина используют казеин пищевой (ОСТ 4970-74 и др.). Для ускоренного гидролиза казеин в количестве 1 кг измельчают с помощью тканевого измельчителя РТ-1 или каким-либо другим способом и заливают 10 л дистиллированной воды. Смесь подщелачивают 20%-ным раствором едкого натзия (ГОСТ 4320-77) до рН 8,0-8,2, подогревают до 80-85°С и при постоянном перемешивании, поддерживая температуру и рН в указанных параметрах, доводят казеин до полного растворения. После этого смесь охлаждают до 45-47°С и вносят 1 кг дважды измельченного фарша поджелудочной железы крупного рогатого скота или свиней (ГОСТ 11285-73). 20%-ным раствором едкого натра доводят рН смеси до 8,0-8,2 и консервируют хлороформом (ГОСТ 20015-74) в количестве 1,0-1,5% к общему объему. Гидролиз казеина проводят при 37-42°С в тече- ние 16-20 часов до достижения концентрации аминного азота 450-500 мг%. После этого гидролиз прекращают подкислением ледяной уксусной кислотой (ГОСТ 61-75) до рН 4,5-5,0 и последующим кипячением в течение 10 минут. Далее гйдролизат оставляют на 2-3 суток при 8-10°С для отстаивания. По истечении этого срока прозрачный гйдролизат казеина сливают, подщелачивают 20%-ным раствором едкого натрия до рН 7,0-7,2, фильтруют через ват- но-марлевый фильтр и стерилизуют при 120°С в течение 30 минут. Стерильный гйдролизат казеина хранят при 8-10°С и используют в работе в течение 5-6 месяцев.
Показатели гидролизата казеина: аминный азот 450-500 мг%, пептон 2-3%, триптофан 180-200 мг%.
Изготовление казеиновой среды накопления.
Для изготовления питательной среды накопления основной гйдролизат казеина (ОГК) разводят дистиллированной водой до концентрации аминного азота 90-100 мг%. Необходимое количество ОГК определяют по формуле:
.
где X - потребное количество ОГК для приготовления питательной среды (л);
А- требуемое количество аминного азота в питательной среде (мг%);
В - концентрации аминного азота в ОГК (мг%);
К - количество питательной среды, которое необходимо приготовить (л),
Разведенный до аминного азота 90-100 мг% гидролизат казеина нагревают до кипения, добавляют сухой экстракт кормовых дрожжей из расчета 5 г/л среды, сульфит натрия (ГОСТ 195-77) - 1 г/л, гемин ГГУ6- 09-10-504-7) - 0,005 г/л и хлористый натрий (ГОСТ 4233-77) - 5 г/л.
Раствор гемина в воде готовят отдельно, для чего навеску препарата в 10 мг предварительно растворяют в колбе емкостью 50-100 мл в 1 мл стерильного 1-нормально- го раствора едкого натрия и добавляют 19 мл стерильной дистиллированной воды. В питательную среду раствор гемина вносят из расчета 10 мл /л. Простерилизованный доведением до кипения раствор гемина пригоден для хранения и последующего использования.
После растворения всех компонентов 20%-ным раствором едкого натрия устанавливают рН среды 7,6-7,8, кипятят в течение 10 минут, фильтруют через ватно-марлевый фильтр, разливают в колбы по 0,250 или 0,5 л и стерилизуют при 120°С в течение 30 минут.
Питательная среда прозрачна, имеет красноватый оттенок и рН 7,4-7,6, концентрация аминного азота 100-110 мг%. Среда при хранении в условиях 4-8°С пригодна для использования в работе в течение 3-4 месяцев.
Перед употреблением в питательную среду для ускорения роста Кл.перфрингенс добавляют глюкозу (ГОСТ 975-75) в виде 40%-ного стерильного раствора из расчета 12,5 мл (0,5% в пересчете на сухое вещество) и для ингибирования посторонней микрофлоры - антибиотики гентамицин из расчета 0,008 г/л (8 мг) и эритромицин - 0,000045 г/л (45 мкг), после чего среду разливают в стерильные пробирки по 10 мл и наслаивают стерильное вазелиновое масло. Готовую среду хранят при 4-8°С и испо.ль- зуют в течение 2 месяцев.
Расчет необходимого количества гента- мицина из потребности 0,008 г/л производится следующим образом.
Гентамицин в ампулах в виде 4%-ного раствора:
1 мл препарата содержит 0,04 г активного вещества
X мл - 0,008 г,
Y 0.008 1 п , Х ЖЫ° 2МЛСледовательно, на 1 л питательной среды необходимо взять 0,2 мл препарата.
Гентамицин в порошке во флаконах, где содержится по 0,08 г (80 мг) активного вещества:
содержимое флакона растворяют в 2 мл стерильной дистиллированной воды. Следовательно, в 1 мл раствора содержится также 0,04 г активного вещества. В дальнейшем расчет производится так, как это описано выше. Водный раствор гентамицина можно использовать в работе в течение 14 дней.
Эритромицин удобно и целесообразно использовать в виде дисков, содержащих по 0,000015 г (15 мкг) активного вещества. Расчет необходимого количества эритромици- на при потребности 0,000045 г/л (45 мкг):
1 эритромициновый диск содержит 0,000015 г вещества X0,000045 г
У 0.000045 1 , А 0,000015
Таким образом, на 1 л питательной среды нужно взять элюат 3 дисков или непосредственно внести стерильно 3 диска.
Если эритромицин (эритромицина ас- корбинат или эритромицина фосфат) в порошке во флаконах, где по 0,05 г препарата, то расчет при той же потребности производится следующим образом.
Содержимое флакона растворяют в 5 мл стерильной дистиллированной воды. Берут 0,1 мл этого раствора (0,001 г) и переносят в пробирку с 4,9 мл стерильной дистиллированной воды. Таким образом, в 1 мл раствора в пробирке содержится 0,0002 г вещества.
В 1 мл содержится 0,0002 г в X мл - - 0,000045 г
40 у 0.000045 0,0002
1
0,225 мл.
Следовательно, на 1 л среды нужно добавить из пробирки 0,23 мл раствора эрит- ромицина. (Водный раствор эритромицина для хранения непригоден).
Конечная структура среды накопления, г/л:
Витаминный
препарат ЭКД4,5-5,0
Глюкоза, 40%-ный
раствор11-1 Змл
Гемин0,004-0,005
Сульфит натрия1-1,2 .
Натрий хлористый4,5-5,0
Гентамицин0,0075-0,008
Эритромицин0,00004-0,000045
Ферментативный
гидролизат казеина
(аминный азот 90-100мг%)До 1л
Изготовление плотной диагностической среды.
Для изготовления плотной диагностической среды основной гидролизат казеина разводят водой до концентрации аминного азота 170-190 мг% по формуле, приведенной ранее. Разведенный гидролизат нагревают до кипения, последовательно из расчета на 1 л среды вносят агара (ГОСТ 16280-70} - 15 г, сульфита натрия - 1 г, раствор гемина - 10 мл (о приготовлении раствора гемина см. выше), хлористого натрия - 5 г. После растворения всех компонентов и доведения рН среды 20%-ным раствором едкого натрия до 7.6-7,8 кипятят в течение 10 минут, фильтруют через ватно- марлевый фильтр и стерилизуют при 120°С в течение 30 мин.
Среда имеет красноватый оттенок, рН 7,4-7,6, концентрация аминного азота 190- 210 мг%.
Перед разливом в чашки Петри в расплавленный и охлажденный до 50-60°С питательный агар добавляют стерильно глюкозу из 40%-ного раствора в количестве 25 мл/л (1 % в пересчете на сухое вещество) и раствор трифенилтетразолия хлорида (ТТХ) из расчета 5 мл/л (0,025 г/л в пересчете на сухое вещество).
Раствор ТТХ готовят отдельно, для чего навеску препарата в 0,05 г растворяют в 10 мл стерильной дистиллированной воды (или 0,02 г в 4 мл в зависимости от потребности), доводят до кипения. Раствор ТТХ пригоден для использования в течение 7-10 дней.
Конечный состав плотной диагностической среды представляется в следующем виде, г/л:
Витаминный препарат
ЭКД4,5-5,0
Глюкоза, 40%-ный
раствор20-25 мл
Гемин0,004-0,005
Сульфит натрия1-1,2
Натрий хлористый4,5-5,0
ТТХ, 0,5%-ный
раствор4-5 мл
Агар 13-15
Ферментативный
гидролизат казеина
(аминный азот
170-190 мг%)До 1л
П р и м е р 1. Оценка эффективности различных вариантов конструкций на казеиновой основе для роста Кл.перфрингенс.
Посевная культура Кл.перфрингенс представляла суспензию агаровой 18-20- часовой культуры в концентрации 1 млрд. м.к./мл, которую вносили в пробирки со средами из расчета 1 мл/10 мл. Посевы
культивировали при 37°С. Рост культуры Кл.перфрингенс оценивали в единицах оптической плотности с помощью ФЭК-М. В результате максимальные показатели
роста Кл.перфрингенс были установлены в среде, содержащей глюкозу, ЭКД, гемин и сульфит натрия (табл. 1).
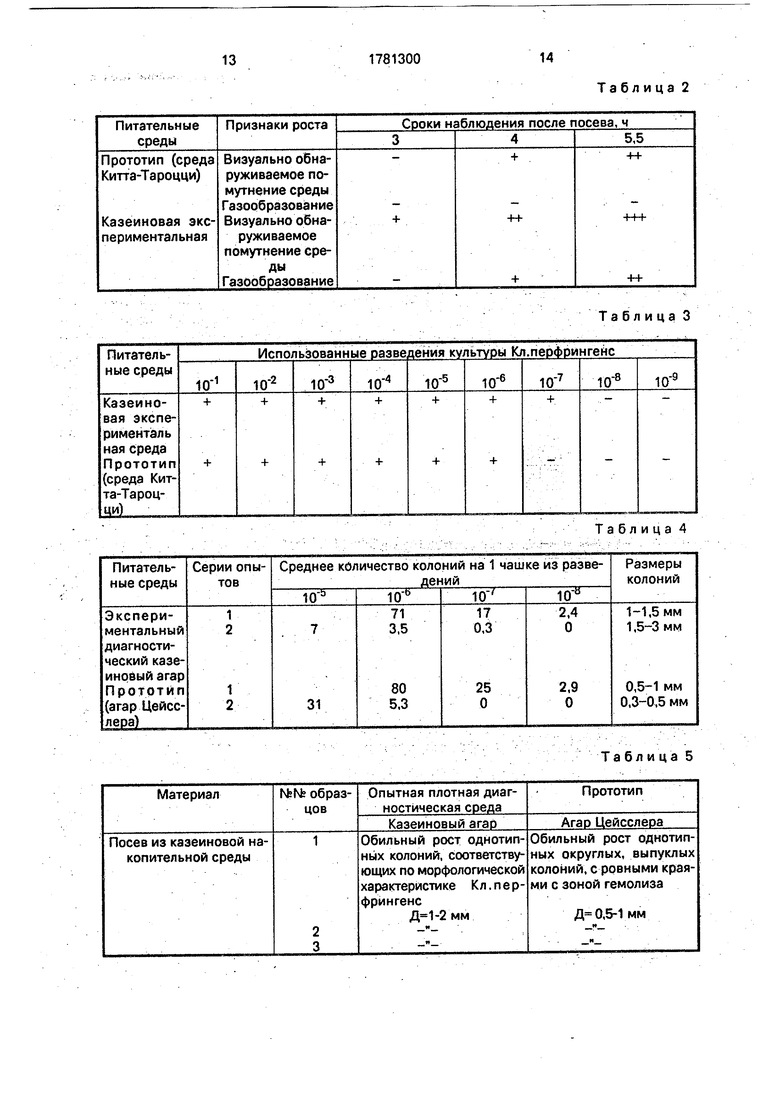
П р и м е р 2. Скорость и характер роста микробных клеток Кл.перфрингенс.
0 При сравнительном изучении скорости и характера роста м.к. эталонных штаммов Кл.перфрингенс использовали 17-18-часовые агаровые культуры, которые вначале разводили до 10 ед. по оптическому стан5 дарту мутности, далее из них готовили разведение 10 с последующим пересевом из расчета 0,5 мл/10 мл в опытную и контрольную среды накопления.
Среды оценивали по времени появле0 ния визуально заметного роста и типичности проявления его (табл. 2). В казеиновой среде визуально заметный рост установлен через 3 часа, в контрольной среде - на 1 час позднее Через 5,5 ч после посева в экспе5 риментальной среде регистрировали интен- сивный рост (сильное помутнение с бурным газообразованием), в контрольной - признаки роста были менее выраженными (слабое помутнение и отсутствие газо0 образования).
П р и м е р 3. Чувствительность жидкой казеиновой среды для микробных клеток Кл.перфрингенс.
Была использована 17-18-часовая ага5 ровая эталонного штамма культура Кл.перфрингенс типа С 392, которую вначале разводили до 10 ед. по оптическому стандарту мутности, затем готовили ее десятикратные последовательные разведения от
0 10 до . Из каждого разведения был сделан посев в пробирки со средами из расчета 1 мл/10 мл. Посевы инкубировали при 37°С в микроанаэростатах в течение 20 ч. Эффективность сред оценивали по появле5 нию роста при соответствующем разведении (табл. 3).
На казеиновой среде регистрировали рост Кл.пеофрингенс при посеве из разведения 10 , в контрольной рост выявлялся
0 при посеве из разведения 1СГ6.
П р и м е р 4. Чувствительность плотных сред для Кл.перфрингенс.
При этом использовали как 16-18-часовые агаровые, так и 6-часовые бульонные
5 культуры Кл.перфрингенс С 392, из разведений которых 10 . , и 10 делали посев по 0,05 мл на чашках Петри с экспериментальной плотной диагностической средой и средой - прототипом (агар Цейсслера). Чашки инкубировали в микроанаэростатах
при 37°С в течение 17-18 ч. Среды оценивали по количеству и размерам колоний (табл.
4).
Опытная плотная диагностическая среда, не уступая среде - прототипу по чувствительности, превосходила ее по размерам колоний.
П р и м е р 5. Эффективность схемы выделения Кл.перфрингенс из материала.
При выделении культуры Кл.перфрингенс исходным материалом служили фекалии и содержимое тонкого отдела кишечника животных. Навеску фекалий в 0,8-1 г суспендировали в 10 мл физиологического раствора хлористого натрия, содержащего 0,05% тиогликолята натрия. Взвеси тщательно перемешивали и выдерживали 30-35 минут в условиях комнатной температуры для оседания грубых частиц, после чего производили обильный посев в экспериментальную казеиновую среду и среду - прототип. Посевы инкубировали в течение 16-17 часов при 37°С. Затем культуры микроско- пировали и производили обильный пересев на плотный диагностический казеиновый агар и агар Цейсслера (прототип) в чашках Петри. Посевы термостатировали в микро- анаэростатах в течение 16-17 ч при 37°С. Оценку роста и дифференцирующих свойств сред производили визуально и с использованием микроскопа МБС-9 при 12- кратном увеличении.
При посеве 22 проб материала в казеиновую среду накопления было выделено 19 культур Кл.перфрингенс, а в среду Китта-Та- роцци-9 (табл.6).
П р и м е р 6. Оценка роста и дифференцирующих свойств плотных сред (табл. 5).
При пересеве культур из казеиновой среды накопления как на плотную казеиновую диагностическую, так и на среду - прототип установлен обильный рост однородных колоний, соответствующих по своей характеристике Кл.перфрингенс. При пересеве из среды Китта-Тароцци в 2 случаях из 3 отмечено незначительное количество колоний Кл.перфрингенс на фоне обильного роста колоний сопутствующей кишечной микрофлоре. Колонии Кл.перфрингенс на опытной плотной диагностической среде резко отличались от колоний других представителей кишечной микрофлоры благодаря присущим им на этой среде признакам (форма, размер, цвет, характер поверхности и края, рельеф, структура, консистенция, включения).
Выделение культуры Кл.перфрингенс.
Выделение культуры Кл.перфрингенс из фекалий и содержимого тонкого отдела кишечника.
Навеску фекалий 0,8-1 г помещают в физиологический раствор хлористого натрия с 0,05% (0,5 г/л) тиогликолята натрия (ТУ 6-09-08-837-74) с соблюдением соотно- шения 1:10. Взвесь тщательно перемешивают и выдерживают при комнатной температуре в течение 30-35 минут для осаждения грубых частиц. После этого из верхнего слоя жидкости делают обильный посев (не менее 0,5 мл) в пробирку со средой накопления. Посевы инкубируют при 36- 37°С в течение 16-17 часов, микроскопиру- ют и при обнаружении крупных полиморфных грамположительных палочек с закругленными концами делают дробный посев на казеиновый диагностический агар в чашках Петри. Чашки с посевами инкубируют в микроанаэростатах при 36-37°С в течение 16-17 часов. Осмотр и отбор коло- ний Кл.перфрингенс производят под микроскопом МБС-9 (или аналогичным) при 12-кратном увеличении.
Морфологическая характеристика колоний Кл.перфрингенс: Величина1-2 мм
Формачаще овальная или
неправильная
Краяровные или волнистые
Поверхность гладкая с незначитель- ным блеском
Рельефвыпуклый, часто до конусовидности
Структуранепрозрачная
Консистенция пастообразная, коло- ния легко снимается
петлей
Цветравномерно коричневый или красновато- коричневый
Включенияв виде кристаллов красного цвета по всей поверхности колонии, на периферии их может быть меньше
Выделение Кл.перфрингенс из органов тканей животных.
Кусочки паренхиматозных органов (печень, почки, селезенка) весом 1-1,5 г растирают в условиях стерильности в фарфоровых ступках, добавляют физиологический раствор хлористого натрия в соотношении 1:10. Взвесь тщательно перемешивают, отстаивают в течение 20-30 минут и из верхнего слоя производят обиль- ный посев (не менее 0,5 мл) в пробирку со средой накопления. Последовательность дальнейшей работы описана выше.
Выделение Кл.перфрингенс из перито- неальной жидкости.
Перитонеальную жидкость, взятую стерильно, в объеме не менее 0,5 мл вносят в пробирку со средой накопления. Последовательность дальнейшей работы приведена выше.
Выделение Кл.перфрингенс из кормов.
Навеску кормов в 4-5 г в колбах емкостью 0,250 или 0,5 л заливают 50 мл физиологического раствора хлористого натрия с 0,05 тиогликолята натрия, тщательно встря- хивают, выдерживают при комнатной температуре 20-30 минут и из верхнего слоя жидкости производят обильный посев в пробирку со средой накопления. Дальнейшая работа производится так, как это опи- сано выше. Вместо тиогликолята натрия можно использовать солянокислый цистеин в количестве 0,1 г/л.
Таким образом, предлагаемый способ ускоренной бактериологической диагностики инфекционной энтеротоксемии у животных по сравнению с прототипом имеет следующие преимущества: сконструированные питательные среды обладают устойчивыми селективными и дифференцирующими свой- ствами, не требуют для изготовления дорогостоящих мясных продуктов, стандартны по качеству, предусматривают использование ингибиторов для посторонней микрофлоры, исключают многократные пересевы при вы- делении и тем самым повышают производительность труда ветспециалистов.
Технико-экономическая эффективность изобретения заключается в повышении эффективности, достоверности и доступности способа диагностики инфекционной энтеротоксемии животных.
Формула изобретения
Способ бактериологической диагностики инфекционной знтеротоксемии живо- тных, включающий посев исследуемого материала в жидкую питательную среду, инкубирование посевов с последующим пересевом на плотную питательную среду, содержащую источник азота, хлористый на-
4,5-5,0
11-13
1,0-1,2
0,004-0,005
4,5-5 О
о о075-0,008
0,00004-0,000045
До 1л
трий, глюкозу, агар, и инкубирование, с последующим учетом результатов по росту микроорганизмов, отличающийся тем, что, с целью повышения точности и ускорения способа, исследуемый материал засевают в жидкую среду следующего состава, г/л:
Витаминный препарат
экстракта кормовых
дрожжей
Глюкоза, 40%-ный
раствор, мл
Сульфит натрия
Гемин
Натрий хлористый
Гентамицин
Эритромицин
Ферментативный
гидролизат казеина
с содержанием аминного азота
90-100 мг% а пересев проводят на плотную среду, дополнительно содержащую витаминный экстракт кормовых дрожжей, сульфит натрия, гемин, трифенилтетразолия хлорид, а в качестве источника азота - ферментативный гидролизат казеина с содержанием аминно- го азота 170-190 мг% при следующем соотношении компонентов, г/л:
Витаминный препарат
экстракта кормовых
дрожжей
Глюкоза, 40%-ный
раствор, мл
Сульфит натрия
Гемин
Натрий хлористый
Трифенилтетразолия
хлорид
Агар
Ферментативный
гидролизат казеина
с содержанием
амикного
азота 170-190 мг% До 1л
Таблица 1
4,5-5,0
20,0-25,0 1,0-1,2 0,004-0,005 4,5-5,0
0,025-0,03 13,0-15,0
Таблица 2





| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПАНКРЕАТИЧЕСКОГО БЕЛКОВОГО ГИДРОЛИЗАТА И ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БИФИДОБАКТЕРИЙ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2002 |
|
RU2253673C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ ДЛЯ ХРАНЕНИЯ МИКРОБА ЧУМЫ | 2017 |
|
RU2681116C2 |
| Способ получения питательной среды для выделения гемокультуры при диагностике инфекции кровотока | 2017 |
|
RU2660708C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВОССТАНОВЛЕНИЯ ЧИСЛЕННОСТИ АНАЭРОБНЫХ БАКТЕРИЙ ПОСЛЕ НИЗКОТЕМПЕРАТУРНОГО ХРАНЕНИЯ | 2017 |
|
RU2678123C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫРАЩИВАНИЯ МИКРООРГАНИЗМОВ | 1973 |
|
SU382682A1 |
| СПОСОБ СЕЛЕКТИВНОГО ВЫДЕЛЕНИЯ АУТОШТАММОВ LACTOBACILLUS SPP. ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2018 |
|
RU2675315C1 |
| СПОСОБ ВЫДЕЛЕНИЯ БАКТЕРИЙ РОДА LACTOBACILLUS ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2000 |
|
RU2178171C1 |
| Сердечно-мозговая питательная среда для диагностики инфекции в кровотоке и способ ее получения | 2017 |
|
RU2650863C1 |
| ТРАНСПОРТНАЯ ЖИДКАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ СБОРА, КУЛЬТИВИРОВАНИЯ И ТРАНСПОРТИРОВКИ КРОВИ БОЛЬНЫХ, ПОДОЗРЕВАЕМЫХ НА ЗАБОЛЕВАНИЕ БРУЦЕЛЛЕЗОМ | 2003 |
|
RU2247775C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ НА ОСНОВЕ ВТОРИЧНОГО ПРОДУКТА ГИДРОЛИЗАТА ГОВЯЖЬЕГО МЯСА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ | 2017 |
|
RU2681499C1 |
Использование: ветеринарная микробиология. Сущность изобретения: способ бактериологической диагностики, инфекционной энтеротоксемии животных заключается в посеве исследуемого материала в жидкую питательную среду следующего состава: витаминный препарат экстракта кормовых дрожжей 4,5-5,0 г, глюкоза, 40%-ный раствор 11-13 мл, сульфат натрия 1,0-1,2 г, гемин 0,004-0,005 г, натрий хлористый 4,5- 5,0 г, гентамицин 0,0075-0,008 г, эритромицин 0,00004-0,000045 г, ферментативный гидролизат казеина с содержанием аминно- го азота 90-100 мг % до 1 л, в инкубировании посевов, в пересеве на плотную питательную среду, содержащую: витаминный препарат экстракта кормовых дрожжей 4,5-5,0 г. глюкоза, 40%-ный раствор 20,0- 25,0 мл, сульфат натрия 1,0-1,2 г, гемин 0,004-0,005 г, натрий хлористый 4,5-5,0 г. трифенилтетразолия хлорид 0,025-0,03 г, агар 13,0-15,0 г, ферментативный гидролизат казеина с содержанием аминного азота 170-190 мг% до 1 л, с последующим инкубированием посевов и учетом результатов по росту микроорганизмов. 6 табл. (Л С
Таблица 3
Таблица 4
Таблица 5
Примечание. В числителе - показатели экспериментальной среды. В знаменателе cpefla-npQTomrv
Редактор
Составитель Л. Кольцова
Техред М.МоргенталКорректор О. Юрковецкая
Продолжение табл. 5
Таблицей
| Методические указания по лабораторной диагностике инфекционной энтеротоксемии животных и анаэробной дизентерии ягнят, утвержденные ГУВ МСХ СССР, 1984 г | |||
| Ветеринарная микробиология./ Под ред | |||
| Е | |||
| В | |||
| Козловского, П | |||
| А | |||
| Емельяненко, М.: Колос, 1982, с | |||
| Приспособление для нагрузки тендеров дровами | 1920 |
|
SU228A1 |
Авторы
Даты
1992-12-15—Публикация
1990-12-13—Подача