Изобретение относится к области получения новых производных сахара, которые могут найти применение в качестве физиологически активных соединений.
Известно применение алкилгалогенидов в качестве алкилирующих агентов.
Применяя известную реакцию алкилирования и также известные методы разделения смеси Сахаров, автором получен ряд новых соединений.
Предложен способ получения эфиров Д.2о,22. буфатриенолидрамнозида формулы
где R - метильная или формильная группа; RI, Rs - атом водорода, алкил с Ci-e или ацеСН
тильная группа, или Ri вместе с R2- /С
СН
Rs - атом водорода, ацетильная группа или алкил с Ci-6, причем по меньшей мере один из радикалов Ri, R2 и Rs - алкил, отличающийся тем, что производное А2о.22.буфатриенолидрамнозида формулы
В I
/ч1Лу1
лТг
R,0О
-0.
где R, Rs имеют указанные значения;
R/, R2 - атом водорода или R/ вместе с
/СНз R2- /Сч, нодвергают взаимодействию
СНз
с алкилгалогенидом в среде инертного органического растворителя в присутствии основания с последующим разделением полученных смесей путем хроматографии на колонне, и/или кристаллизацией, и/или противоточного распределения и отщеплением радикала «зопропилидена, и/или ацетилированием свободных оксигруппу сахарного радикала.
В качестве алкилгалогенида для этой реакции цримепяют алкилйодиды. Соответствующие бромиды и хлориды, в частности метиловые и этиловые соединения, можно использовать.
В качестве оснований для реакции преимущественно можно применять гидроокиси и окиси щелочноземельных металлов, гидрид натрия и окис серебра. При применении для реакции гидроокисей или окисей щелочноземельных металлов в качестве растворителя преимущественно можно применять диметилформамид. При применении в качестве основания окиси серебра реакцию обменного разложения можно провести, например, в ацетоне, тетрагидрофуране или диоксаие.
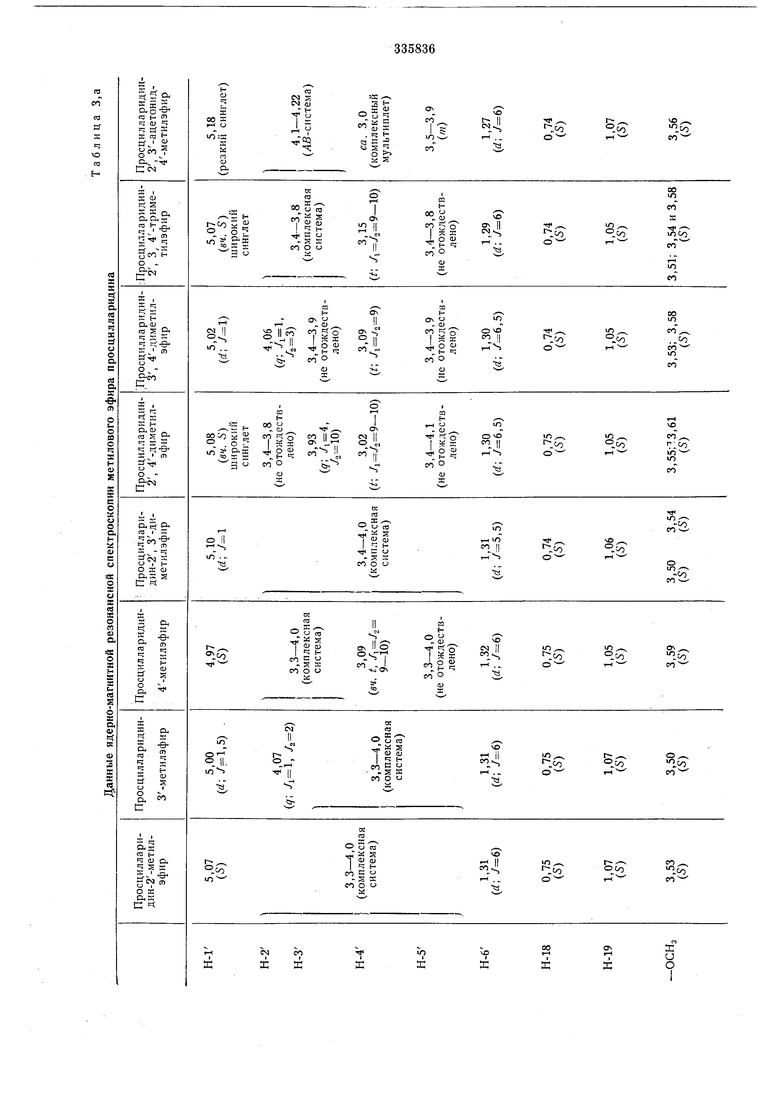
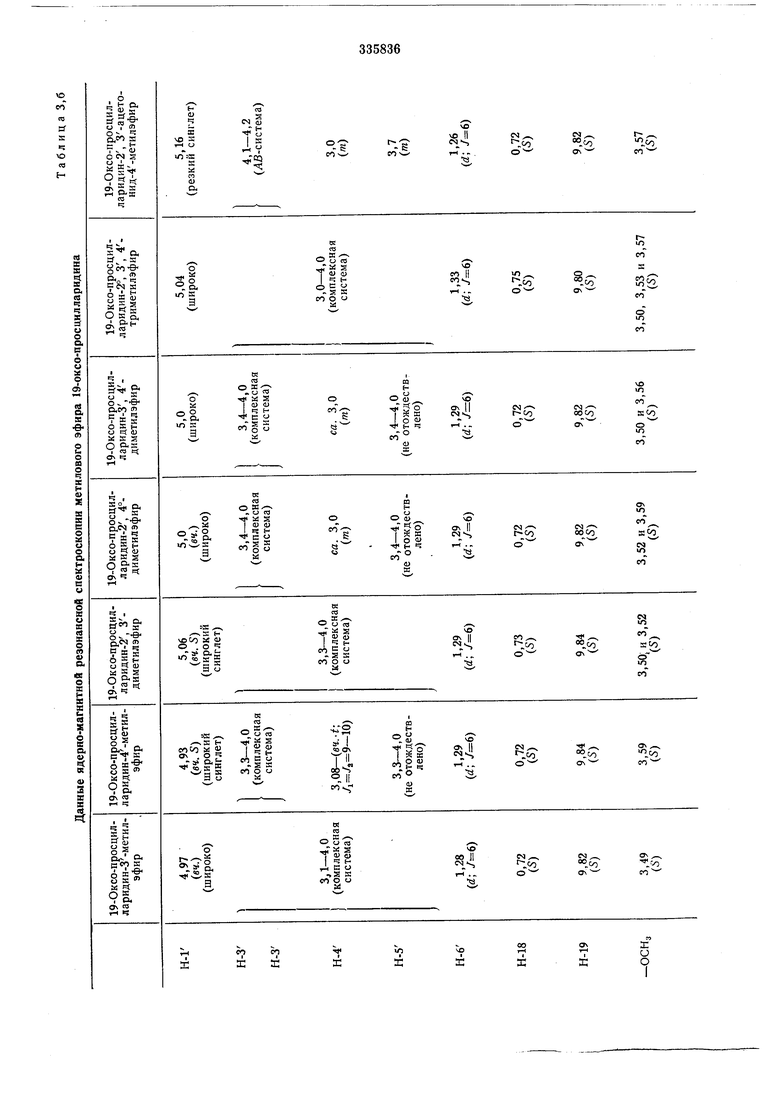
Определение структуры просцилларидина и 19-оксо-просцилларидинмоноэфиров осуществляли путем ядерно-магнитной резонансной спектроскопии, обработки перйодатом натрия и образования ацетонида. Определение структуры диметиловых эфиров просцилларидина и 19-оксо-просцилларидина проводили путем целенаправленного синтеза из чистых монометиловых эфиров и путем сравнения при помощи тонкослойной хроматографии реакционных продуктов и ядерно-магнитной резонансной спектроскопии. Для определения структуры всех эфиров просцилларидина применяли и ядерно-магнитные резонансные спектры ацетилированных эфиров.
При помощи ядерно-магнитной резонансной спектроскопии можно анализировать и смеси просцилларидина или 19-оксо-просцилларидметилэфир: для этого необходимы ядерно-магнитные резонансные спектры смеси метилового эфира и-после ацетилировапия небольщой пробы смеси - ацетата смеси из метилового эфира. Например, можно определить состав смеси просцилларидин-монометилэфира (в %) таким образом:
содержание 4-метнлэфира в смеси
поверхность 4-ОСНз-оигнала X ЮО
псжерхность всех ОСНз-Спгналов
содержание З-метилэфира в смеси
поверхность З-ОСНз-сигнала смесн-диацетата X ЮО
поверхность всех ОСНз-слгналов в смеси-диацетате %-ное содержание 2-метилэфира в смеси 100% - (%гное содержание 3- и 4-метилэфира)
Состав смеси просцилларидин-диметилэфира (в .%,) можно определить следующим образом;
содержание 2,3-диметилэфира в смеси
поверхность 4 О-ацетил-,ситнала в ацетате смеси из ., димети.дового эфира X 100
общая поверхность О-ацетил-сигналов в ацетагг смеси из диметнлового эфира.
%-ное содерл ание 2,4-метилэфира в смеси
100% - (%-ное содержание 2,3- и 3,4-диметилэфира).
Смеси из моно- и диметилэфиров, кроме того, можно анализировать при помощи препаративной тонкослойной хромотографии, проявления элюированием и количественного определения путем УФ-спектроскопии. При смесях монометила или этилэфира для определения З-эфира можно применять и расщепление с перйодатом натрия и титрование отработанного реагента или количественную тонкослойную хроматографию.
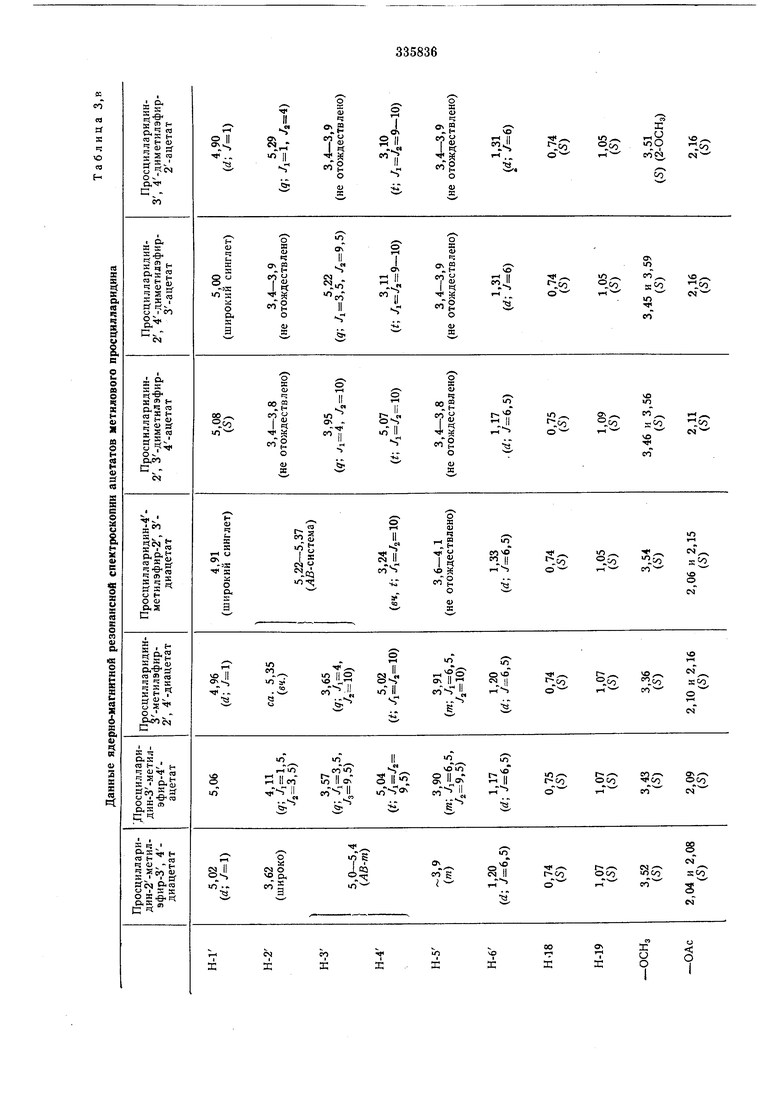
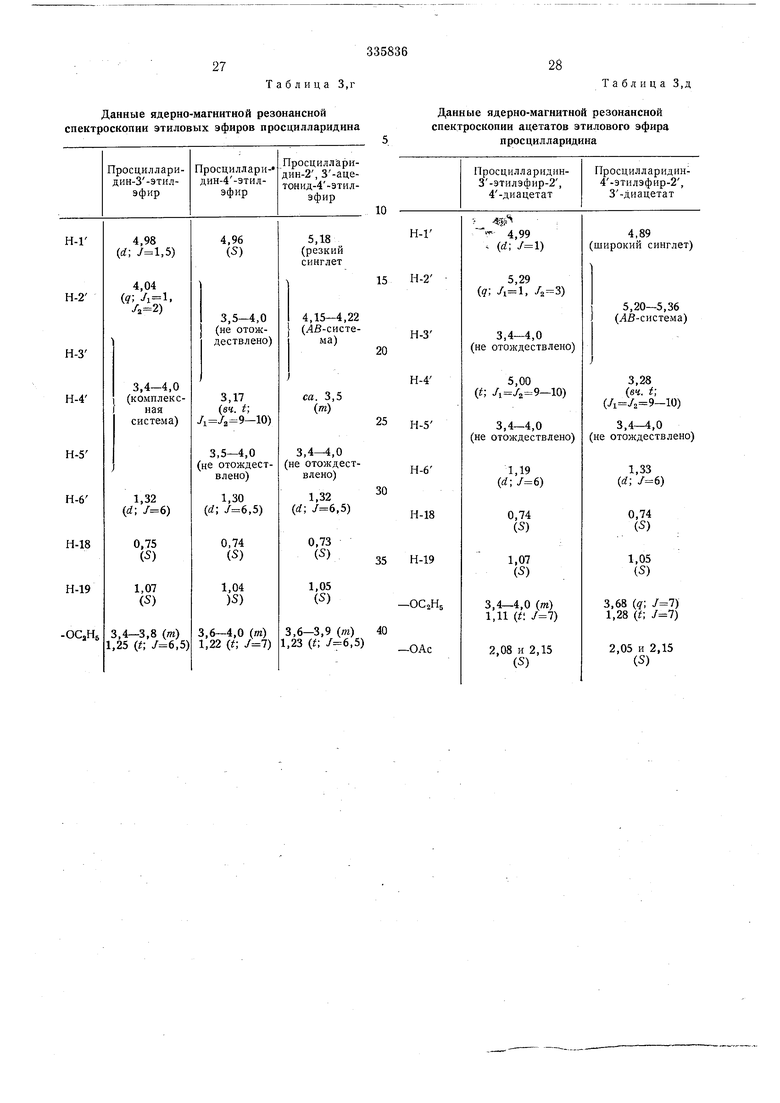
Необходимые для определения структуры и анализа смесей данные приведены в табл. 1-3.
Новые вещества можно изготовить в таблетках, драже, капсулах, растворах и т. д.
Пример 1. 5 г просцилларидина перемещивают в 100 мл диоксана с 20 мл метилйодида и 10 г окиси серебра в течение 6 час при
20°С.
Исходную смесь фильтруют, остаток тщательно промывают этиловым эфиром уксусной кислоты, фильтрат упаривают и остаток хроматографируют по системе хлорофорМ-ацетон
2 : 1 на колонне 110x5 см из дезактивированного силикагеля.
Получено 0,58 г смеси из просцилларидина и диметилового эфира (11% от теории), Rf 0,47-0,59 в сложном этиловом эфире уксусной
кислоты; 2,76 г смеси из просцилларидина и монометилэфира (547о от теории), RJ 0,28- 0,37 в сложном этиловом эфире уксусной кислоты; 1,22 г просцилларидина (24% от исходного продукта). Кристаллизация 2,76 г смеси
из просцилларидина и монометилэфира из 25 мл сложного этилового эфира уксусной кислоты дает 1,29 г кристаллического просцилларидин-З-метилэфира, точка вспыщки 235- 242°С, RJ 0,30 в сложном этиловом эфире уксусной кислоты.
Пример 2. 5г просцилларидина перемещивают в 100 мл диметилформамида с 30 г окиси серебра и 30 M/i метилйодида в течение 2 час при 20°С. Исходный продукт фильтруют,
остаток тщательно промывают этиловым эфиром уксусной кислоты и фильтрат выпаривают. После хроматографии на колонне 100X6 слг из дезактивированного силикагеля системой сложного этилового эфира уксусной кислоты
получено 1,30 г смеси из просцилларидин-монометилэфира (25% от теории), 0,28-0,37 в сложном этиловом эфире уксусной кислоты. Пример 3. 5г просцилларидина нагревают до кипения в 50 мл ацетона с 1 г борной
лаждают до 40°С, прибавляют 20 мл метилйоднда и 10 г окиои серебра и перемешивают в течение 16 час при 40°С. Исходный продукт фильтруют, остаток тщательно промывают этиловым эфиром уксусной кислоты и фильтрат выпаривают. Хроматографией на колонне 90x5 см из дезактивированного силнкагеля получено 0,84 г смеси из просцилларидин-диметилэфира (16% от теории), R/ 0,47-0,59 в сложном этиловом эфире уксусной кислоты и 3,04 г смеси из просцилларидин-монометилэфира (59% от теории), 0,28-0,37 в сложном этиловом эфире уксусной кислоты.
После кристаллизации из 30 мл сложного этилового эфира уксусной кислоты получено 1,84 г кристаллического просцилларидин-З-метилэфира (36% от теории), Rf 0,30 в сложном этиловом эфире уксусной кислоты, точка вспышки 231-240°С.
Пример 4. 5 г просцилларидина перемешивают в 100 мл тетрагидрофурана с 20 мл этилйодида и 10 г окиси серебра в течение 6 час при 20°С. Исходный продукт перерабатывают, как описано в примере 1.
После хроматографии на колонне 110x5 см из дезактивированного силикагеля системой хлороформ-ацетон 4:1 получено 2,26 г смеси из просцилларидин-моноэтилэфира (43% от теории или 90% от теории в отношении нрореалировавшего исходного материала), R/ 0,47 в сложном этиловом эфире уксусной кислоты; 2,63 г просцилларидина (53% от исходного продукта).
Кристаллизация смеси из просцилларидинмоноэтилэфира из 10 мл сложного этилового эфира уксусной кислоты дает 0,77 г просцилларидин-З-этилэфира (15% от теории или 31% от теории в отношении прореагировавшего исходного материала), Rf 0,47 в сложном этиловом эфире уксусной кислоты, точка вспышки 238-249°С.
Пример 5. 5 г просцилларидина перемешивают в 100 Л1Л диметилформамида с 33 мл метилйодида и 2,5 г мелкоизмельчечной дигидроокиси бария в течение 70 мин нри 20°С. Исходный продукт поглонл,ают 500 мл этилового эфира уксусной кислоты, экстрагируют его путем встряхивания два раза с 5%-ной водной соляной кислотой, два раза с 5%-ным водным раствором едкого натра и в конце концов два ipaaa с водой; 01рга1НИ1чеС|куюфазу высушивают и выпаривают над безводным сульфатом натрия.
После хроматографии на колонне 80x5 см из дезактивированного силикагеля системой хлороформ-ацетон 3 : 1 получено 0,98 г смеси из просцилларидин-диметилэфира (19% от теории), Rf 0,47-0,59 в сложном этиловом эфире уксусной кислоты; 3,46 г смеси из иросцилларидин-монометилэфира (67% от теории), Rf 0,28-0,37 в сложном этиловом эфире уксусной кислоты.
Кристаллизация смеси из просцилларидинмонометилэфира из 35 мл сложного этилового эфира уксусной кислоты дает 2,23 г кристаллического просцилларидин-З-метилэфира (44%
от теории), Rf 0,30 в сложном этиловом эфире у ксу:сной 1КИслоты, точка вспышки 248-25,5°СПример 6. 5 г просцилларидина перемешивают в 50 мл диметилформамида с 5 мл метилйодида и 3,5 г мелкоизмельченного дигидроокиси бария в течение 1 час при 20°С. Переработку проводят, как в примере 5. После хроматографии на колонне получено 1,61 г смеси из просцилларидин-диметилэфира (31% от теории), Rf 0,47-0,59 в сложном этиловом эфире уксусной кислоты; 2,34 г смеси из просцилларидин-монометилэфира (46% от теории), Rf 0,28-0,37 в сложном этиловом эфире уксусной кислоты.
Кристаллизация смеси из просцилларидинмонометилэфира из 25 мл сложного этилового эфира уксусной кислоты дает 1,68 г просцилларидин-З-метилэфира (33% от теории), Rf 0,30 в сложном этиловом эфире уксусной кислоты, точка вспышки 233-240°С.
Пример 7. 5г просцилларидина нагревают до кипения в 100 мл диметилформамида с 33 мл метилйодида, 33 г мелкоизмельченной окиси бария и 1,4 г мелкоизмельченной гидроокиси бария, затем перемешивают еш,е 2 часа при 20°С. Переработку проводят, как в примере 5.
После хроматографии на колонне получено 1,27 г неполярных частей, состояших из просцилларидин-три- и диметилэфиров и других неполярных побочных продуктов; 1,35 г смеси из просцилларидин-моноэтилэфира (26% от теории); Rf 0,28-0,37 в сложном этиловом эфире уксусной кислоты.
Кристаллизация смеси из просцилларидинмоноэтилэфира из 50 лы эфира уксусной кислоты дает 0,77 г кристаллического просцилларидин-З-метилэфира (15% от теории), Rf 0,30 в сложном этиловом эфире уксусной кислоты, точка вспышки 233-239,5°С.
Пример 8. 2,5 г мелкоизмельченной дигидроокиси бария перемешивают в 100 мл диметилформамида в течение 16 час при 20°С. Затем добавляют 5 г просцилларидина и 33 мл метилйодида и перемешивают исходный продукт еше 60 мин при 20°С. Переработку проводят, как в примере 5. После хроматографии на колонне получено 0,36 г смеси из просцилларидин-диметилэфира (7% от теории), Rf 0,47-0,59 в сложном этиловом эфире уксусной кислоты; 2,79 г смеси из просцилларидинмонометилэфира (54% от теории), Rf 0,28- 0,37 в сложном этиловом эфире уксусной кислоты.
Кристаллизация смеси из просцилларидинмонометилэфира из 30 мл сложного эфира уксусной кислоты дает 1,58 г кристаллического просцилларидин-З-метилэфира (31% от теории), Rf 0,30 в сложном этиловом эфире уксусной кислоты, точка вспышки 234-240°С.
Пример 9. 3 г мелкоизмельченного дигидроксида бария перемешивают в 50 мл диметилформамида в течение 16 час при 20°С. Потом добавляют 5 г, просцилларидина и 5 мл метилйодида и перемешивают исходный продукт еще 45 мин при 20°С. Переработку .проводят, как в примере 5. После хроматографии на колонне получено 1,06 г смеси из просцнлларидин-диметилэфира (20% от теории), RJ 0,47-0,59 в сложном этиловом эфире уксусной кислоты; 3,91 г смеси из просцилларидин-монометилэфира (76% от теории), Rt 0,28-0,37 в сложном этиловом эфире уксусной кислоты. Кристаллизация смеси из просцилларидинмонометилэфира -из 40 мл сложного этилового эфира уксусной кислоты дает 2,75 г кристаллического просцилларидин-З-метилэфира (54% от теории), Ri 0,30 в сложном этиловом эфире уксусной кислоты, точка вспышки 246-252°С. Десять дальнейших аналогичных исходных продуктов - время реакции 20-30 мия - дают 0,79-1,39 г смеси диметилэфира (15-27% от теории) и 3,33-4,01 г смеси из просцилларидин-монометилэфира (65-78% от теории) или после кристаллизации из сложного этилового эфира уксусной кислоты - 2,40-2,99 г кристаллического просцилларидин-З-метилэфира (47-58% от теории). Аналогично получена смесь 19-оксо-просцилларидин-монометилэфира, RJ 0,23-0,27 в сложном этиловом эфире уксусной кислоты и после кристаллизации из этилового эфира уксусной кислоты - чистый 19-оксо-просцилларидин-З-метилэфира, точка вспышки 226-230 С, R} 0,23 в сложном этиловом эфире уксусной кислоты. Пример 10. 9,91 г смеси «з иросцилларндин-монометилэфира (из маточных шелочей кристаллизации просцилларидин-З-метилэфира, пример 9) распределяют в 100 элементах через 2000 приемов системой четыреххлористый углерод-хлороформ-метанол-вода 2 : : 2 : 3 : 1 (V 25/25 мл,,, t 20°С); после 100 приемов основного процесса применяют способ переменно-фазового отбора при соотношении взятых верхних фаз к нижним фазам приблизительно 3:2 (в целом 1234 приемов верхних фаз и 766 приемов нижних фаз). Получено в элементах: О-38: 1,21 г смеси из иросцилларид:-1Н-2- и 4-метилэфира, Rf 0,28 и 0,37 в сложном этиловом эфире уксусной кислоты; 39-74: 1,37 г просцилларидии-2-метилэфира, RJ 0,28 в сложном этиловом эфире уксусной кислоты, точка вспышки 151,5 -158,5°С; 75-100: 0,52 г смеси из просцилларидин-2и З-метилэфира, Rf 0,28-0,30 в сложном этиловом эфире уксусной кислоты. Вытекающие верхняя и нижняя фазы содержат просцилларидин-4- и З-метилэфир. Пример 11. 5г просцилларидина перемешивают в 100 мл диметилформамида с 25 мл этилйодида и 0,5 г приблизительно 50%-ной суспензии из гидрида натрия и масла в течение 1 час при 20°С. Исходный продукт поглощают 500 мл этилового эфира уксусной кислоты, экстрагируют путем встряхивания три раза с 500 Мл воды и все водные фазы еще раз дополнительно промывают 500 мл этилового эфира уксусной кислоты. Органические фазы высушивают безводным сульфатом натрия, выпаривают и остаток хроматографируют на колонне 100x5 см из дезактивированного силикагеля системой хлороформ-ацетон от 4 : 1 до 1 : 1. Получено 0,48 г смеси просцилларидин-диэтилэфира, RJ 0,5 в системе хлороформ-ацетон 4:1; 2,17 г смеси из просцилларидин-моноэтилэфира, RJ 0,47 в сложном этнловом эфире уксусной кислоты; 1,77 г просцилларидина (35% от неизменного исходного магериала). При применении 1,0 г 50%-ной суспензии гидрата натрия - масла получают вместо 0,5 г при обычных идентичных условиях 0,30 г просцилларидин-триэтилэфира, Rf 0,9 в системе хлороформ-ацетон 4: 1; 1,06 г смеси просцилларидин-диэтилэфира; 2,82 г смеси просцилларидин-моноэтилэфира, 0,24 г просцилларидина (5% от неизменного исходного материала). Аналогично получено из просцилларидина с пропилйодидом или пентилйодидом незначительные выходы смеси просцилларидин-монопропилэфира (Rf 0,55 в сложном этиловом эфире уксусной кислоты) и смеси просцилларидин-монопентилэфира (Rj 0,60 в сложном этиловом эфире уксусной юислоты). При метилировании просцилларидина суспензию гидрата натрия-масла можно заменить метилатом натрия. Выходы смеси просцилларндин-монометилэфира однако меньше, чем при применении гидрата натрия. Пример 12. 2,5 г просцилларидин-2,3ацетонида перемешивают в 50 мл диметилформамида с 15 метилйодида и 15 г окиси серебра в течение 20 час при 20°С. Переработку проводят, как в примере 2. После хроматографии на колонне 100x4 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир уксусной кислоты 16 : 1 получено 1,90 г просцилларидин-2,3-ацетонид-4метилэфира (74% от теории) аморфн., 0,67 в системе хлороформе-сложный этиловый эфир уксусной кислоты 1:1. Пример 13. 10 г просцилларидин-2,3-ацетонида в течение 5 час нагревают до кипения в 200 мл ацетона с 200 мл этилйодида и 50 г окиси серебра. Переработку проводят, как в примере 1. После хроматографии па колонне 140x3 см из езактивированного силикагеля системой хлооформ-сложный этиловый эфир уксусной ислоты от 4: I до 1: 1 получено 1,63 г просилларидин-2,3-ацетон1ид-4-этилового эфира (66% от теории исходного материала) аморфн,. i 0,71 в системе хлороформ-этиловый эфир ксусной кислоты 1:1. 7,64 г просцилларидин,3-ацетонида можно регенерировать в неизенном виде. Пример 14. 1 г просцилларидин-2,3-ацеонид-4-простого этилового эфира перемешиают в 50 мл 0,2 н. соляной кислоты в тетраидрофуране в течение 8 час при 20°С. Исходый продукт поглощают 200 мл сложного этилевого эфира уксусной кислоты, органическую фазу экстрагируют путем встряхивания один раз с 200 мл 5%-ной водной натровой щелочи и два раза с водой, высушивают и выпаривают над безводным сульфатом натрия. Остаток хроматографируют на колонне 100X3 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир уксусной кислоты 4:1.
Получено 0,14 г просц-илларт1дин-2,3,4-простого этилового эфира (14% от неизменного исходного материала), Ri 0,71 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1;
0,46 г просцилларидин-4-простого этилового эфира (48% от теории), /, 0,48 в сложном этиловом эфире уксусной кислоты, кристаллы из сложного этилового эфира уксусной кислоты, точка вспышки 182 192°С. Пример 15. 5 г просцилларидин-2,3-ацетонида растворяют в 50 мл диметилформамида и перемешивают с 10 мл метилйодида и 1 г 50%-ной суспензии гидрата натрия-масла в течение 15 мин при 20°С. После переработки согласно примеру 10 и хроматографии на колонне 120X5 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир уксусной кислоты 5 : 1 получено 3,83 г просцилларидин-2,3 - ацетонид-4-метилового эфира (75% от теории) аморфн., Rf 0,67 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1.
Пример 16. 5 г просц:илларидин-2,3-ацетонида растворяют в 50 мл диметилформамида и перемешивают с 10 мл этилйодида и 1 г 50%-ной суспензии гидрата натрия-масла в течение 15 мин при 20°С. После переработки согласно примеру 10 и хроматографии на -колонне 140x5 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир уксусной кислоты 5: 1 получено 1,50 г просцилларидин-2,3-ацетонид-4-простого этилового эфира (29% от теории) аморфн., Rt 0,71 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1.
Аналогично получены из просцилларидин-2, З-ацетонида с пропилйодидом или пентилйодидом незначительные выходы просцилларидин2,3-ацетонид-4-пропилового эфира, Rf 0,74 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1 : 1 или просцилларидин-2, 3-ацетонид-4-пент1ИЛОвого эфира, RJ 0,75 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1.
Пример 17. Четыре загрузки по 10 г просцилларидин-2,3-ацетонида, 100 мл диметилформамида, 20 мл метилйодида и 6 г мелкоизмельченной гидроокиси бария перемешивают в течение 3 час при 20°С.
Исходные продукты соединяют и перерабатывают, как в примере 5.
рированный исходный продукт метилируют еш,е раз упомянутыми способами.
Всего получено после трех метилирований и трех хроматографии на колонне 26,82 г просцилларидин-2,3-ацетонид-4-метилового эфира (65% от теории или 76% от теории в отношении превращенного исходного материала) аморфн., Rj 0,67 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1,
5,64 г просцилларидин-2,3-ацетонида (14% от исходного продукта).
Аналогично получают 19-оксо-просцилларидин-2,3-ацетонид-метиловый эфир аморфн., RJ 0,26 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1.
Пример 18. 25 г просцилларидин-2,3-ацетонид-4-метилового эфира перемешивают в 1,25 мл 0,2 н. соляной кислоты в тетрагидрофуране в течение 18 час при 20°С. Исходный
продукт перерабатывают, как описано в примере 14, и полученный остаток от выпаривания хроматографируют на колонне 160X6 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир уксусной
кислоты 1 : 1 до получения чистого сложного эфира уксусной кислоты.
Получено 8,93 г просцилларидин-4-метилового эфира (39% от теории), Rf 0,37 в сложном этиловом эфире уксусной кислоты, кристаллы из сложного этилового эфира уксусной кислоты, точка вспышки 197-204,5°С.
Пример 19. 1,8 г 19-оксо-просцилларидин2,3-ацетонид-4-метилового эфира перемешивают в 90 мл 0,2 н. соляной кислоты в тетрагидрофуране в течение 6 час при 20°С. Исходный продукт перерабатывают, как в примере 14, -и полученный остаток от выпаривания хроматографируют на колонне 100X4 см из дезактивированного силикагеля системой сложный
этиловый эфир уксусной кислоты.
Получено 0,37 г 19-оксо-просциллаоидин-2, 3-ацетонид-4-метилового эфира (21 % от исходного материала), ,25 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1 : 1, 0,96 г 19-оксо-просцилларидин-4-метилового эфира (57% от теории), Ri 0,27 в сложном этиловом эфире уксусной кислоты, кристаллы из сложного этилового эфира уксусной кислоты, точка вспышки 222-229°С.
Пример 20. 5 2 просцилларидина растворяют в 100 мл диметилформамида и перемешивают с 20 мл метилйодида и 2,0 г приблизительно 50%-ной суспензии из гидрата натрия-масла в течение 1 час при 20°С. После переработки согласно примеру 10 и хроматографии на колонне 120X4 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир 2: 1 получено 1,74 г просцилларидин-триметилэфира (32% от теории),
Ri 0,40 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1, кристаллы из метанола, точка вспышки 121-124°С: 2,19 г смеси просцилларидин-диметилэфира (42% от теории), RJ 0,47-0,59 в сложном этиловом ларидин-монометилэфира(7% от теории), Ri 0,28-0,37 в сложном этиловом эфире уксусной кислоты. Пример 21. Юг просцилларидина перемешивают в 200 мл диметилформамида с 60 мл метилйодида и 12 г мелкоизмельчекного гидрокоида бария в течение 3 час при 20°С. Исходный продукт перерабатывают, как в примере 5, и остаток хроматографируют на колонне 120x5 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир 4:1. Получено 3,02 г просцнлларидин-2,3,4-триметилового эфира (28% от теории), 0,40 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1, кристаллы из метанола, точка вспышки 119-123°С. 6,15 г смеси из просцилларидина диметилового эфира (58% от теории) содержит после тонкослойной хроматографии приблизительно 90% просцилларидин-2,3-диметилового эфира, Rf 0,47-0,59 в сложном этиловом эфире уксусной кислоты. Повторное метилирование смеси диметилового эфира упомянутыми способами дает после переработки и хроматографии на колонне 120x5 см системой хлороформ-сложный этиловый эфир уксусной кислоты 4 : 1 дальнейшие 1,98 г просцилларидин - 2,3,4-триметилового эфира (всего 46% от теории), Rf 0,40 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1. Кроме того, получено 3,36 г просцилларидин-2,3-димегилового эфира (32% от теории), Rf 0,47 в сложном этиловом эфире уксусной кислоты, кристаллы из небольшого количества сложного этилового эфира уксусной кислоты, точка вспышки 136- 140,5°С. Аналогично получены из 19-оксо-просцилларидина 19-оксо-просцилларидин-2,3,4-триметиловый эфир аморфн., Rf 0,23 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1 и 19-оксо-просцилларидин-2,3диметиловый эфир аморфн., Rt 0,34 в сложном этиловом эфире уксусной кислоты. Пример 22. 5 г просцилларидин-4-метилового эфира перемешивают в 50 мл диметилформамида с 5 мл метилйодида и 2 г мелкоизмельченного гидроксила бария в течение 80 мин при 20°С. Переработку проводят, как в примере 5. После хроматографии на колонне 10x5 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир уксусной кислоты 1 : 1 получено 0,90 г просцилларидин-2,3,4-триметилового эфира (17% от теории), Rf 0,40 в системе хлороформсложный этиловый эфир уксусной кислоты 1:1, кристаллы из метанола, точка вспышки 124- 129°С; 2,68 г смеси просцилларидин-2,4- и 3,4-диметилового эфира (15% от теории), Rf 0,55-0,59 в сложном этиловом эфире уксусной кислоты; 0,23 г просцилларидин-4-метилового эфира (5% от исходного продукта), R/ 0,37 в сложном этиловом эфире уксусной кислоты. Аналогично получена из 19-оксо-просцилларидин-4-метилового эфнра смесь из 19-оксопросцилларидин-2,4- и 3,4-диметилового эфира, Rif 0,41 в сложном этиловом эфире уксусной кислоты. Из просцилларидин-2-метилового эфира получена смесь просцилларидина-2,3- и 2,4-диметиловых эфиров, Rf 0,47 и 0,55 в сложном этиловом эфире уксусной кислоты. После тонкослойной хроматографии смесь содержит около 90% просо,илларидин-2,4-ди метилового эфира. Путем хроматографии на колонне ее можно разделить на чистые компоненты. Таким же образом из просцилларидин-З-метилового эфира получена смесь просцилларидин-2,3- и 3,4-диметиловых эфиров; Rf 0,47 и 0,59 в сложном этиловом эфире уксусной кислоты. После тонкослойной хроматографии смесь содержит около 90% просцилларидин-2, З-диметилового эфира и 10% просцилларидин3,4-Д|Иметилового эфира. Путем хроматографии на колонне ее можно разделить на чистые комионенты. Пример 23. 2,68 г смеси просцилларндин2,4- и 3,4-димети, эфиров (получеиной но примеру 20) распределяют в ста элементах через 550 приемов системой четыреххлористый углерод-хлороформ-метанол-вода 3: 1 : 3:1 (У 25/25 ягл, t 20°С), после 100 приемов основного процесса и 50 приемов верхнефазового отбора применяют способ переменнофазового отбора при соотношении взятых верхних фаз к нижним фазам приблизительно 13: 7 (в целом 405 приемов верхних фаз и 145 приемов нижпих фаз). Получено в элементах: 18-47 : 0,89 г просцилларидин-3,4-диметилового эфира, Rf 0,59 в сложном этиловом эфире уксусной кислоты; кристаллы из сложного этилового эфира уксусной кислоты; точка вспышки 218,5-223°С. 48-63 : 0,80 г смеси просцилларидин-2,4- и 3,4-диметиловых эфиров, Rf 0,55 и 0,59 в сложном этиловом эфире уксусной кислоты. 64-99 : 0,82 г просцилларидин-2,4-диметилового эфира Ri 0,55 в сложном этиловом эфире уксусной кислоты; кристаллы из сложного этилового эфира уксусной кислоты, точка вспышки 210,5-214°С. Подобным образом смесь 19-оксо-просцилларидин-2,4- и 3,4-диметилового эфира можно разделить на чистые компоненты. При м е р 24. 200 мг просцилларидин-4метилового эфира в 5 мл абсолютного пиридина примешивают к 5 мл уксусного ангидрида и оставляют на 24 час при 20°С. К реакционной смеси добавляют с целью разложения избыточного уксусного ангидрида 10 мл метанола. После часа при 20°С поглощают 200 мл уксусного эфира, промывают органическую фазу два раза с 200 мл 5%-ной соляной кислоты, ва раза с 200 мл 5%-ной водной натровой щелочи и два раза с 200 мл воды, высушива13
паривают. Хроматография остатка выпаривания на колонне 60x2 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир уксусной кислоты 4 : 1 дает 202 Ata просцилларидин-4-метиловый эф«р-2, З-диацетата (88% от теории) аморфн., Rf 0,55 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1.
Аналогичным образом нолучены: из просцилларидин-2-метилового эфира-нросцилларидин-2-метиловый эфир-3,4-диацетат аморфн., Rf 0,51 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1; из просцилларидин-З-метилового эфира-просцилларидинЗ-метиловый эфир-2,4-диацетат аморфн., RJ 0,59 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1; из просдилларидин-2,3-диметилового эфира - просцилларидин-2,3-диметиловый эфир-4-ацетат аморфн., Rf 0,38 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1; из просцилларидин-2,4-диметилового эфира-просцилларидин - 2,4 - диметиловый эфир - 3 - ацетат аморфн., Rf 0,50 в системе хлорофорМ-сложный этиловый эфир уксусной кислоты 1:1; из просцилларидин-3,4-метилового эфира-просЦ|илларидин-3,4-диметиловый эфир-2-ацетат аморфн., Rf 0,49 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1, из просцилларидин-З-иростого этилового эфира- просцилларидин-З-простой этиловый эфир-2, 4-диацетат аморфн., Rf 0,57 в системе хлороформ-сложный эфир уксусной кислоты 1:1; из просцилларидин-4-простого этилового эфира - просцилларидин-4-простой этиловый эфир-2,3-диацетат аморфн., R,- 0,56 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1.
Аналогично из 19-оксо-просцилларидин-метиловых эфиров можно получить соответствующие ацетаты 19-оксо-просцилларидин-метилового эфира.
Пример 25. 1 г смеси просцилларидиндиметилэфира (содержит около 80% нросцилларидин-2,3-диметилэфира) в 10 мл абсолютного пиридина примешивают к 10 мл уксусного ангидрида и оставляют на 24 час при 20°С. Переработку проводят, как в примере 24.
После хроматографии на колонне 120X3 см из дезактивированного силикагеля системой хлороформ-сложный этиловый эфир уксусной кислоты 4 : 1 получено 0,12 г смеси иросцилларидин-2,4-диметилэфир-3-ацетата и 3,4-диметилэфир-2-ацетата (11% от теории), Rf 0,50 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1; 0,73 г просцилларидин2,3-диметилэфир-4-ацетата (68% от теории), Rf 0,38 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1.
Пример 26. 10 2 просцилларидин-З-метилэфира в 100 мл абсолютного пиридина примешивают к 10 мл уксусного ангидрида и оставляют стоять на 2 час при 20°С. Переработку проводят, как в примере 24,
14
После хроматографии на колонне 120x5 см из дезактивированного силикагеля системой хлороформ-ацетон 3: 1 получено 1,62 г просцилларидин-3-метилэфир-2,4-диацетата (14%
от теории) аморфн., RJ 0,54 в системе хлороформ-сложный этиловый эфир уксусной кислоты 1:1; 0,36 г иросцилларидин-З-метилэфир2-ацетата (3% от теории) аморфн., Rf 0,72 в сложном этиловом эфире уксусной кислоты;
5,39 г просцилларидин-3-метилэфир-4-ацетата (50% от теории) аморфн., Rj 0,69 в сложном этиловом эфире уксусной кислоты; 2,92 г нросцилларидин-З-метилэфира (29% регенерированного исходного материала), Rf 0,30 в сложном этиловом эфире уксусной кислоты.
Подобным образом получают из просцилларидин-2-метилэфира - смесь из просцилларидин-2-метилэфир-3-ацетата и 2-метилэфир-4ацетата, Rf 0,70-0,72 в сложном этиловом эфире уксусной кислоты; из просцилларидин4-метилэфира-смесь из просцилларидин-4метилэфир-2-ацетата и 4-метилэфир-3-ацетата, Rf у обеих 0,72 в сложном этиловом эфире уксусной кислоты.
Предмет изобретения
30
Способ получения эфиров .аг.буфатр еполидрамнозида формулы
35
40
45
50
(I)
55
где R - метильная или формильная группа; RI, Rs - атом водорода, алкил с Ci-e или адеСНз
/
тильная группа, или Ri вместе с На- /С.
СНз
15
Д4,20,22.буфачающийся тем, что производное триенолидрамнозида формулы
16
где R, Кз имеют указанные значения;
R/, Кг - атом водорода или R/ вместе с
СН,
R2- /
подвергают взаимодейстСН,
ВИЮ с алкилгалогенидом в среде инертного органического растворителя в присутствии основания с последующим разделением полученных смесей путем хроматографии на колонне, и/или кристаллизацией, и/или противоточного распределения и отщеплением радикала изопропилидена, и/или ацетилированием свободных оксигрупп у сахарного радикала.
Значения коэффициента R/ моно-и диароизводных просцилларидина или 19-оксо-просцилларидина, Силикагель {HF-Мерк степень чистоты) без насыщения в камере
Приложение в табл. 1-3 Таблица 1, а






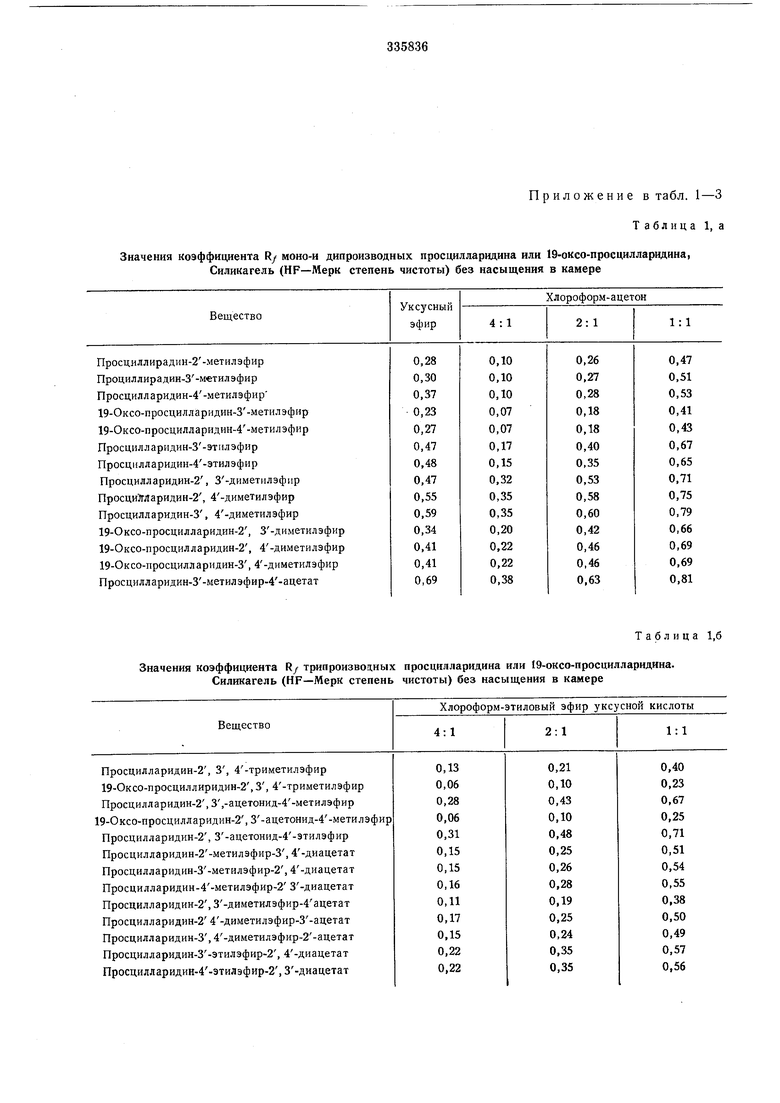
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения солей мурамилпептидов | 1983 |
|
SU1299516A3 |
| СПОСОБ ПОЛУЧЕНИЯ АЦИЛАТОВ Д42022. БУФАТР И ЕНОЛ ИДРАМНОЗИДА | 1970 |
|
SU425392A3 |
| Способ получения производных простанкарбоновой кислоты | 1971 |
|
SU439962A1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДОВ КАРБОНОВЫХ ИЛИ СУЛЬФОНОВЫХ КИСЛОТ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ СОВМЕСТИМЫХ СОЛЕЙ | 1990 |
|
RU2072986C1 |
| Способ получения 4-окси-2н-нафто (2,1-е) -1,2-тиазин-3-карбоксамид-1,1-диоксидов или их солей | 1975 |
|
SU575027A3 |
| ПРОИЗВОДНЫЕ ПИРИДОНБИФЕНИЛА И ИХ СОЛИ | 1993 |
|
RU2118956C1 |
| ПРОИЗВОДНЫЕ 1,4-ДИГИДРОПИРИДИНА С ЦИКЛИЧЕСКИМ МОСТИКОМ В ПОЛОЖЕНИЯХ 1,2 В ФОРМЕ СМЕСИ ИХ ИЗОМЕРОВ | 1995 |
|
RU2155765C2 |
| ПРОИЗВОДНЫЕ АРИЛСУЛЬФОНАМИДА, ИХ СМЕСИ ИЗОМЕРОВ ИЛИ ИНДИВИДУАЛЬНЫЕ ИЗОМЕРЫ И ИХ ФИЗИОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ АДДИТИВНЫЕ СОЛИ С ОСНОВАНИЯМИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИТРОМБИЧЕСКОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2096405C1 |
| ПРОИЗВОДНЫЕ 2,8-ДИЗАМЕЩЕННОГО ХИНАЗОЛИНОНА ИЛИ ИХ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ВОЗДЕЙСТВУЮЩЕЙ НА УРОВЕНЬ КГМП И КАМП АКТИВНОСТЬЮ НА ИХ ОСНОВЕ | 1996 |
|
RU2158733C2 |
| Способ получения производных простановой кислоты | 1973 |
|
SU648088A3 |

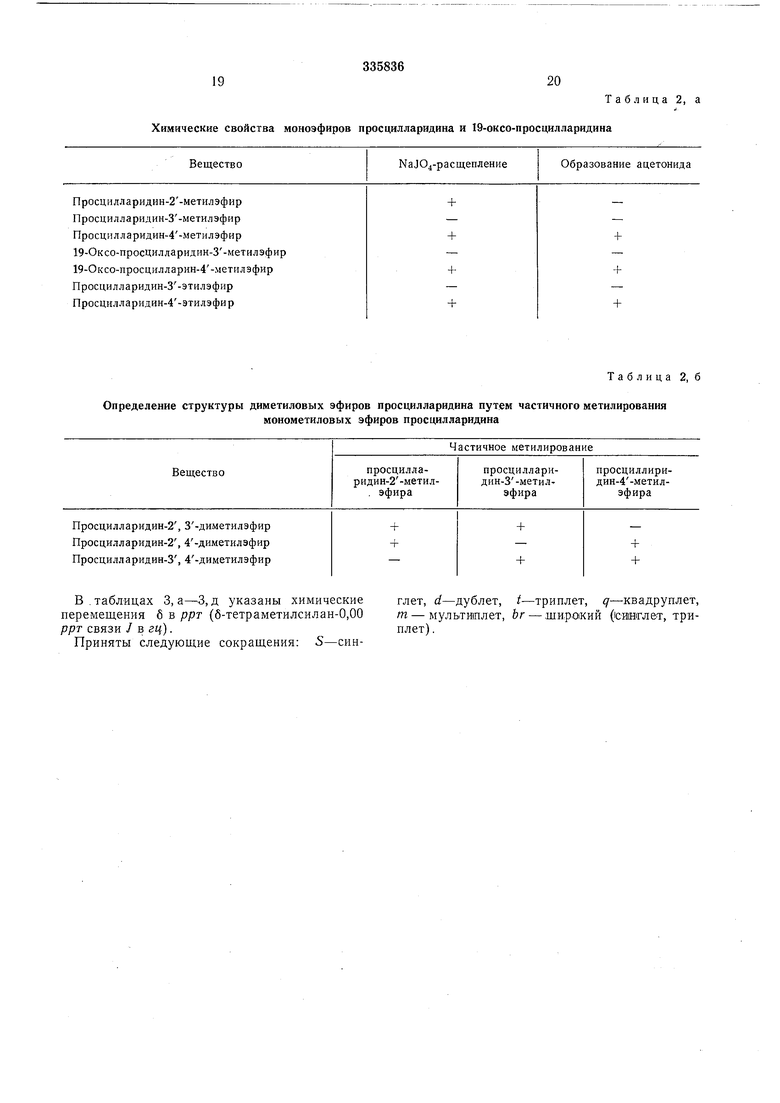
Значения коэффициента R/ трипроизвоцных Силикагель (HF-Мерк степень Таблица 1,6 просцилларидина или 19-оксо-просцилларидина. чистоты) без насыщения в камере Хлороформ-этиловый эфир уксусной кислоты Химические свойства моноэфиров просцилларидина и
Вещество
Просцилларидин-2-метилэфир
Просцилларидин-З-метилэфир
Прасцилларидин-4-метилэфир
19-Оксо-просЦилларидин-3-метилэфир
19-Оксо-просцилларин-4-метилэфир
Просцилларидин-З-этилэфир
Просцилларидин-4-этилэфир Определение структуры
В. таблицах 3, , д указаны химические перемещения б в ррт (б-тетраметилсилан-0,00 ррт связи / в гц).
Приняты следующие сокращения: S-синОбразование ацетонида
NaJO4-pacщeплeниe
+ + + +
глет, d-дублет, t-триплет, д-кваярупп&т, т - мультиплет, Ьг - щирокий (сииглет, триплет). диметиловых эфиров просцилларидина путем частичного метилирования моиометиловых эфиров просцилларидина Таблица 2, а 19-оксо-просцилларидина Таблица 2, б
я in
Cf 3 1 ю
о
со
га СГ S
VO
га Н
Авторы
Даты
1972-01-01—Публикация