(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИНДОЛА , ИЛИ ИХ СОЛЕЙ



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения конденсированных гетероциклическмх производных азаиндола | 1973 |
|
SU512713A1 |
| НОВЫЕ ИНДОЛИЗИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2013 |
|
RU2646223C2 |
| НОВЫЕ ИНДОЛИЗИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2693629C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗО[7,8]АЗОНИНО[5,4-b]ИНДОЛОВ, 7,9-ЭТЕНОАЗЕЦИНО[5,4-b]ИНДОЛОВ И 7,9-ЭТАНОАЗЕЦИНО[5,4-b]ИНДОЛОВ | 2009 |
|
RU2397984C1 |
| Способ получения гексагидро - -карболинов или их солей | 1978 |
|
SU873883A3 |
| Способ получения производных гексагидро-1 -пиРидО-(3,4-B)-иНдОлА или иХ СОлЕй | 1976 |
|
SU845785A3 |
| НОВЫЕ ФОСФАТНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2617682C2 |
| ПИПЕРАЗИНО[1,2-А]ИНДОЛ-1-ОНЫ И [1,4]ДИАЗЕПИНО[1,2-А]ИНДОЛ-1-ОН | 2014 |
|
RU2628126C2 |
| Способ получения пиридоиндолов | 1974 |
|
SU592359A3 |
| ПРОИЗВОДНЫЕ АРОИЛПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2258702C2 |

1
Предлагается способ получения новых производных индола, которые могут найти применение в фармацевтической промышленности.
Использование известной реакции алкилирования аминов, привело к получению новых производных индола, которые являются ценными продуктами, обладающими высокой физиологической активностью.
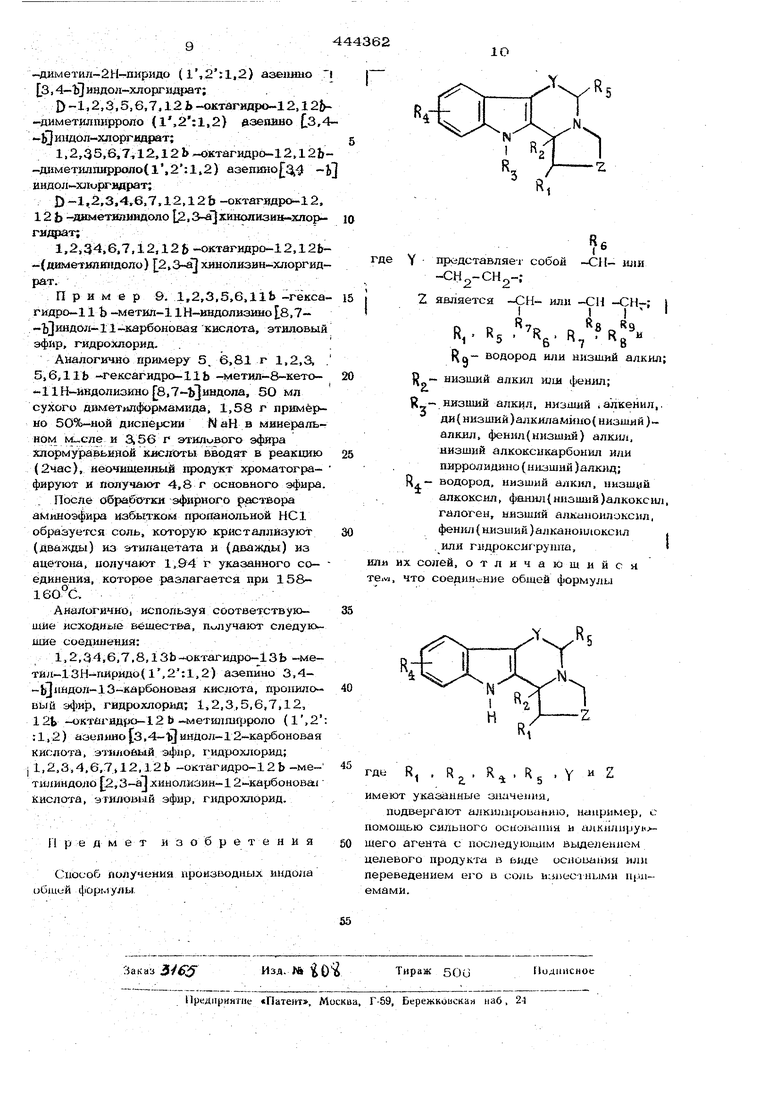
Прёдлагаемы.й способ получения производных ирдола общей формулы
.
дe Y представляет собой -СН или
-СН2-СН2-;
является -СН- или -СИ-СИ-: III
«7
6
Ч8
водород или низший алкил;
R р - низший алкил или фенил; п - НИЗШИЙ алкид, низший алкенил, 3 ди(низший)алкиламино(низший)алкил, фенил(низший)алкил, низший алкоксикарбонил или пиррол идино( низший) алкил;
R- - водород, низший алкил, низший алкоксил, фенил(низший )алкоксил, галоген, низший алканоилоксил, фенил (низший )алканоилокснл или гидроксигруппа,
или их солей, заключается в том, что на coeAHHejHHe общейфо рмулы
20 R
25 где ft .RoRii SV имею указанные значения, действуют апкилирующим агентом в прнсутстшш сильного ocHc ваняя в среде шер-гного растворителя. Целевой продукт выделяют в виде основ ния или переводят его в соль известнрми приемами./ Процесс может быть вьшолне вторично для превращения, например, алкенильной группы R в алкильную группу Я ката оу литическим гидрированием, белэилоксигруп {, в оксигрукпу S каталитическим гид рированием и при необходимости оксигруппа может этерифицироваться, давая алкано илокси- или аралканоилоксигруппу. В качестве сильного Основания исполь- зуют щелочной металл, алкоксйд щелочного металла, гидрид или амид щелочного метал ла, особенно гидрид натрия. В качестве алкилирующего агента при- меняют алкилгалогенид, сульфат, сульфонат или подобный им алкильный эфир минераль ной кислоты, который может давать заместитель R „ , или алкилгалоичформиат. Полученные соединения могут быть переведены в соль с помощью органических или минеральных кислот. Предлагаемым способом модшо получит следующие соединения: 2, 3, 5, 6, 11. lib -гексагидро-11, lib -диметил-1Н-ивдолизиио- 8, 7- ЬЗ индол; 2, 3, 5, 6, 11, lib -гексагидро-11, lib-диметил-1Н-индолизино 8, 7-Ь индол-хлоргидрат; d--2, 3, 5, 6, 11, lib-гексйгидр -11. lib -диметил-lH-индолизшш 8, 7-ЬЗ индол-хлоргидрат; 1, 2, 3, S, 6, 11, lib -гексагидро-11, lib -диметил-1Н-ивдолизино 8, 7- Ь индол-хлоргидрат; (1-2. 3, 5, 6, 11, lib -.гексагидро-11. lib -диметил-1Н-индолизино 8, 7- bj -индол, 2R : ЗЯ -тартрат; 1.2, 3, 5. 6, 11, 11Ь -гексагидро-1 Н-индолизино 8. 7-ЬЗ индол, 2S : 3S -тартрат; d -2. 3, 5, 6, 11, lib-1ексагидро-11, lib-Дим тил-1 Н-индолизино 8, 7-Ь шдол; 1, 2, 3, 5, 6, 11. lib -гексагадро-11, lib -диметмл-1Н-индолизиио 8, 7-bj лндол; 11-этил-2, 3, 5, 6, 11. 11Ь -гексагидро-1 1Ь -метш1-11 -индолизино 8, 7- Ь1 индол; И-этил-2, 3, 5, 6, 11, 11Ь-гексагндри- 1Ь -метил-1 Н-индолизино 8, 7-ь} индол-хяоргидрат; 2. 3 5, 6, 11, lib -Гексагидро- lib -метил-11 -пропил-1 Н-индолизино 8, индол; 2. 3. 5, 6, 11, 11 Ь-гексагидро-11Ь-мет1И1-1Н-индолизт1О 8. 7-Ь}и.чдол; 11-децил-2, 3, 5, 6, 11, lib -гексагидро-11Ь метил 1Н-индопизино 8, Т-ЬЗинДОл , 3, 5, 6, 11, lib -гексагидро «метйл-,1Н-.индолизино- 8. Т-ЬТиндопг 11(3)-йиметиламш,опропш1-2, 3, 5, 6. ..i, ць -герсагвдро-11Ь -метил- Н-Ш1ДО. 7-ьЗиндол| 11-бензил-2. 3. 5, , 11, lib -гексагидро-11Ь -метил-1Нч-индолизйыо в, 7-ь|индол; 2, 3, 5, 6, 1-1, 11 Ь гексагидро-8-метокси-11, lib -диметил 1Н-индолизино 8, 7-bj индол; |.1й-этил-2, 3,5, 6, 11, lib -гексагидро- 11-метил-1 Н-индолизино 8, 7-Ь ииДол; 2,3. 5, 6, 11. lib -гексагидро-11-метаял-llj) -пропил-1 Н-индолизино |j5, 7-bj дадол; 2, 3, 5, 6, 11, lib -гексагвдро-11Ь -метил-11- (2-пирролидиноэтил) -1Нтиндолиэино 8, 7-Ь|индол; ИЬ -этил-2, 3.5, 6, 11, 11Ь -гексагидро-8-метокси 11-метил-1 Н-индолизино 8, 7-Ь}индол; 8-ХЛОР-2. 3, 5, 6. 11. lib-гексагидро-11, lib -диметил-1 Н-индолизино 8, 7- индол; 11-бензил-2, 3, 5, 6, 11, llfc-гексагидро-8-метокси-11Ь -метил-1 Н-индолизиио 8, индол; 8-фтор-2, 3, S. 6, 11, lib -гексагидро-11-. 11Ь-ДИметил-1Н-индолизшю 8, 7-Ь ищ10л; 2, 3. 5, 6, 11, 22Ь-гек;сагидро-8, 11, ИЬ Триметип- Н-индолизино 8, 7-bj индол; 1, 2, а 5, 6, life-гексагидро-lib -меТИЛ--1 Н-индолизино 8, 7-|)индол-11-карбоновая 1 ислота, этиловый эфир. Пример 1. 112,15 г триптамина, 85,6 мл (97,6 г) левулиновой кислоты и 1 п бутшшеллюлозы нагревают с обратным холодильником в атмосфере азота в течение 16 час, растворитель удапяечх я. Осадок хорошо промьша т водой, разбавленным водным раствором N аОН. водой, раэбав- . ленным водным растворомНС 1, водой и :i сущат.-В результате растирания в порощок неочищенного продукта, разложения при 252-. 262 С с метанолом, а затем с бензолом , и сушки получают- 12О,4 г соединения ука3анной формулы, разложение црк макс ) 6,01; 6,17; 13.38 мк. Аналогично ар использовании соответствующих исходньщ веществ синтезирую : lib -зтил-1. 2, 3, 5. 6, 11. lib -гексагидро-ЗН-индолизино 8, 7-Ь1 индол-3-юн, перекристаллизации из метиленхлорида и этанола с последующей нерекристаллизацией с метанолом т. пл. 244246°С {размш-чается при 240°С); 1, 2, 5, 6, 11, 11 Ь-гексагидро-lib -н-пропил-ЗН-индолизино 8, 7-Ь индол-3-он, после перекристаллизации из этанола т. пл. 194 196 С; lib -бутил-1, 2, 5, 6, 11, lib-гексагидро-3Н-индолизино 8, 7-Ь индол. Пр и м ер 2. 8-ФТОР-1, 2, 5, 6, 11. 11 Ь -гексагидро-11Ь -метил-ЗН-индолизино 8, 7-ii} HflOfl-3-oH. . Раствор 21,47 г хлоргидрата 5-фтортриптамина в 1ОО мл метанола охлаждаю на водно-ледяной бане и обрабатывают 5,40 г метилата натрия. Через 0,25 час метанол удаляется, добавляют 400 мл бутилцеллюлоэы и 12,2 мл (13.94 г) левулиновой кислоты и смесь нагревают с отгонкой летучйх вещесч-в до тех пор, пока температ ра нагревания с обратным хо лодильником не достигает 168 С. Нагревание с обратным холодильником продолжают в тече.ие 18,5 час, а затем растворитель удаляется.. В результате растирания в порошок остатка с водой, г н. НС 1, водой, 1 и. МаОН, водой и тщательной сушки получают 17,3 г твердо го вещества, т. пл. 221-225 С (размягч ется при 220°С). Две перекристаллизации (порции по 3,00 г) из смеси ацетона с этилацетатом дают 1,03 г целевого соединения, т, пл. 241-242°С (размягчается при 238°С). Аналогично при взаимодействии 5-метокситриптамина с 4-кетогексановой кислотой получают 11Ь-этил-1, 2, 5, 6, ,jll, lib -гексагидро-3-метокси-ЗН-индо.лизкно1 8, 7-Ь иидол-3-он, т. пл. 200203 С после перекристаллизации из ацетина. П р и м е р 3. 1, 2, 5, 6, 11, lib -гексагидро-8, lib -ллметил-ЗН-индолизиио 8, 7-Ь ивдол-З-он. 5,88 г 5 метилтриптамина, 4,69 г певулиновой KHCJiOTbi. и 9О мл бутилцелло- зольва вводят в реакцию по примеру 1 (период нагреваяия с обратным холодильНИКОМ 5 час), получают 7,8 г неочишенно го указанног-о соедииелия, макс (СНС1 о ): 2,9а- ,05; 6,О2 мк; ЯМР (CDCl,}: (5 1,58 ppm (силглет, lib-метил), 2,45 ррпт- (, 8-метил). Пример 4. 1, 2, 5, 6, 7, 8, 13, 13Ь-Октагидро.-18 Ь-метил-411-Шфи до(1,2 1,2)-с1С)епино 2,4-ьЗиядол-4-он В результате взаимодейстния 5,6 г 2-кето -в-метил-2,3-дигидропирана с 8,7 3-(Зч1МН1ю)1фоаилиндола получают 12,0 г неоч1ш.1енного 3-ацетнл-Н - 3-(1шдол-3-ил)пропил бутиламида, Я(KBt ) 3,04; 5.83. 6,13 мк. Раствор 12,0 г указанного кеТоамида в 480 мл метанола и 12 мл концентрированной 11С1 выдерживаю при /v 25 С в течение трех дней и концентрируют приI мерно до общего объема 80 мл. Твердое вещество, которое отделяечхтя, | пер)екристаллизовываюа- из этанола, обра- зуется 2,2 г названного соединения. Я(KB):3,lli т. пл. макс / 6,22 мк; ЯМР (дейтеродиметилсульфоксид): : 5 ppm (синглет, 13Ь-метил). Пример 5. ЗО мл сухого димитилформамида,. 1,81 г 2,3, 5, 6, 11, 11Ь-гексагидро-11 Ь-метил-1Н-индолизина 8,7-Ь индола и 0.43 г 50%-ной дисперсии гидрида натрия в минеральном масле смешивают в течение 0,5 час. Реакционную смесь охлаждают на водно-ледяной бане и к ней добавляют по каплям 0,55 мл йодистого метила в 3 мл сухого диметил- j формамида. После перемешивания в течение 0,2 5 час ,при О С смесь выдерживают при 25 С в течение 7 час. Растворитель удаляют в вакууме и остаток, растооренньш в эфире, промывают видой, рассолом и сушат сульфатом натрия.. После отгонки растворителя и очистки остатка на 60 г нейтральной окиси алюминия (активность 111) получают из бензол- гексанового злюата (1:1) белое твердое вещество. Этот амин растворяют в 2 н. НС1, промывают эфиром и кислый раствор подщелачивают конце41трированной гидро- i окисью аммония. Осажденное основашге экстрагируют эфиром, промывают водой, рассолом и сушат сульфатом натрия. После удаления растворителя остается 1,07 г 2,а5,6,11,11Ь -гексагидро-11, lib -диметил-1Ь-индолизино 8,7 Ь}ш1ДОла, т. пл. 66-68°С. П р им е р 6. 1,2,а4,6,7,12Д2Ь -Октагидро-12,12 Ь -диметилиндол Г2,3-а Хинолизин. Осуществляют N-метилирование индол 1,0 г 1,2,а4,6,7,12,12Ь -октагидро-12 ь-метилиндоло 2,3-а хиноллзина с помощью 0,24 г примерно 5О%-ной дисперсии гидрида натрия в Млнеральном масле и 0,71 г йодистого метила по способу, описанному в примере 5, период реакции 2 час, получают 5ОО мг осногшния. Очистку данного вещества с помощью хроматографии проводят на пластинах из силикагеля (20x20 мм) с применением дихлорметан/бензол/триэтышмина (6; 3:1) в качестве проявляющей системы. В результате экстракции соответствующих порций дихлорметаном и удаления растворителя из зксчрактов иыделяют 300 мг каучукообразного основания. Пример 7. 1,2,3,5,6,7,12,12Ь -1 -Окгагидро-12.12.Ь -диметилпирроло | {1,2:1,2) азепиноГз,4-ь|индол, хлоргид-, рат, гидрат.,J Осушествляют | -метилирование индолу г,2.а5,6,7.12,12Ь -ок вгяиро-12Ь-м&- тилшфроло (1,2: 1,2)аэепино 3,4-bl дола по способу; описанному в npiiMe ie 5,-, получают основание, которое раетворяют ; в эфире и обрабатывают излишком иэипро-; паноловой НС1, образуется целевое соединение, разложение при 249С. Подобным образом, используя соответ-1 ствуюшие исходные вещества, получают I следующие соединения:I |9-хлор-1,5-диэтил-1,5,6,7,12.121) -гек- f сагидро-12Ь -фенил 12 прошшпирроло Г (1,2:1,2)азешшо 3,4-Ь индол; 2 бутил,-12-этил-1,5,6,7,12,12Ь-гексагидро-9-; -метокси-12 b -фенипирроло (1, 2: 1,2) - j азешшо 3,4-Ь индол; 1О-бром-12-(2-Диэтиламиноэтил)-,5,6,7,12,i2 -гекса- -, гидро-1-метил-12 Ь -фенилпирроло( 1,2: : :1,2) азешшо 3,4-ь индол; 5,1О-диэтил-1,5.6,7,12,12Ь-метил-12(2-пирроли.г д ИНОЭТШ1) пирроло (l, 2: 1,2) азепино кЗ, 4-ti)jиндол; 1,2,5,6,7Д2,12Ь -октагмдро-12-метил-12 |з-фенилпирроло {1,2:1,2)ааепино ,4-Ь1 индол. I Пример 8. Оптические изомеры ; 2,3,5,6.11,11 Ь-гексагидро-11Л1Ь - -диметил-1 Н-индолизино {8,7-Ь индола, ; хлоргидрата. Декстро-изомер. Теплый раствор (5О С) 15 г (О,.1О моль) 2R ; ЗЯ-винноЙ кислоты ( . 24+j 2,7°, ,05, ) в вОО мл ацетона обрабатывают теплым раствором (5О°С) 24,ОЗ г (0,10 моль) 2, а 5,6,11,11Ь -гексагидро-11, lib -диметил-1Н-индолизино 8,7-5 индола в : 40 мл метанола.; После затравливания положительно вращаюшим изомером раствор вьщерживают ,при 25°С в течение 66 час. Выделившееся твердое вещество, окрашенное в кре-: мовый цвет, сушат и трижды перекристаллизовывают на ацетинитрила, получают 8,95 г 1 -2,a5,6,ll,llb-гексагидро-11,11Ь -днметил 1Н-индолйзино 8,7-bjиндола, 2R ;3R -соль виног эадной кислоты (моно) разлагается при 156-158°С; + 66,4° (с 1,044, МеОН), } Раствор 7О г указанной соля в 5О мл вишд пошпепачввают водиык раствором NiaOH и основание экстрагируют толуоло. Обьедивеяяые экстракты промывают водо1{, I рассоле и сушат сульфатом натрия, В | результате удаления рас:творителя получают 4,1 г основания в виде желтого мае- ла; + 99.1 (,982, МеОН). - D РастБорениё а 93 г основания в 100 мл безводного эфира, следующее за . добавлением избыточного количества изопропанольиой НС1, вызывает осаждение соли, которая кристаллизуется из дихлор- метанацетона. Белый кристаллический ) -2.3,5,6, 11,11 Ь -гексагидро-11,11Ь -диметил-1Н-индолизино|В,7-Ь иыдол-хлоргидрат (3,65 г), выделенны.й таким образом, iQ24 .(Разлагается при 247,5-249,5 С; Г(П - +72,5° (,О38, МеОН). Лево-изомер. Ацетон-метанольный фильтрат, остающийся после отделения неочишенного продукта - 2 R : 3 R -соли виноградной кислоты, - освобождают от растворителя и остаток растворяют в 25О мл воды. Коричневый раствор подщелачивают водным растоором при экстракции толуолом и объединенные экстракты промывают водой, рассолом, сушат сульфатом натрия, растворитель выделяется. Раствор оставшейся коричневой смолы в 25 мл метанола добавляют в тешюму раствору (5О°С) 8,96 г (0,06 мо№ 2S : 3S-шшоградной кислоты, wr- I - 12,8 (с 19,99, ), в 35О мл ацетона. После затравливания отрицательно вращающим изомером раствор выдерживаю при в течение 16 час. Отделенное твердое вещество сушат и трижды перекристаллизовывают из ацетонитрила, получают 1О,7 г 1,2,5,6,11, Hi -диметил 1Н-шгдолизино 8,7-Ь индола. 2 S : 3 S -соль виноградной кислоты (моно) разлагается при 156-158 0, foil - 66,7°, (с 1,035, МеОН). 8,0 г соли Превращают точно по указанному способу в 4,81 г основания. - 96,3 ,92, МеОН), и затем - в 4,32 г белого кристаллического-1,2, 3,5,6,11,11 Ь -гексагидро-11,11 Ь -ДИмеТИЛ--1Н-ИНДОЛИЗИНО 8,7-Ь индола-хлоргидрата, разлагается 247,7-249,5°С; ос(Ч d - 23 (,О59, МеОН). Аналогично, используя соответствующие исходные вещества, получают следующие соединеияя: 1) -1,3,4,6,7,8,13,12Ь -октагидро-1 а 13 Ь -димётил-2Н-пиридо- (1,2:1,2) азепино з,4-1 }иадол-хлоргидрат; 1,3,4,6,7,8,13131 -олтагидро-1а13Ь 
Авторы
Даты
1974-09-25—Публикация
1970-07-06—Подача