ШВНэ/etAer
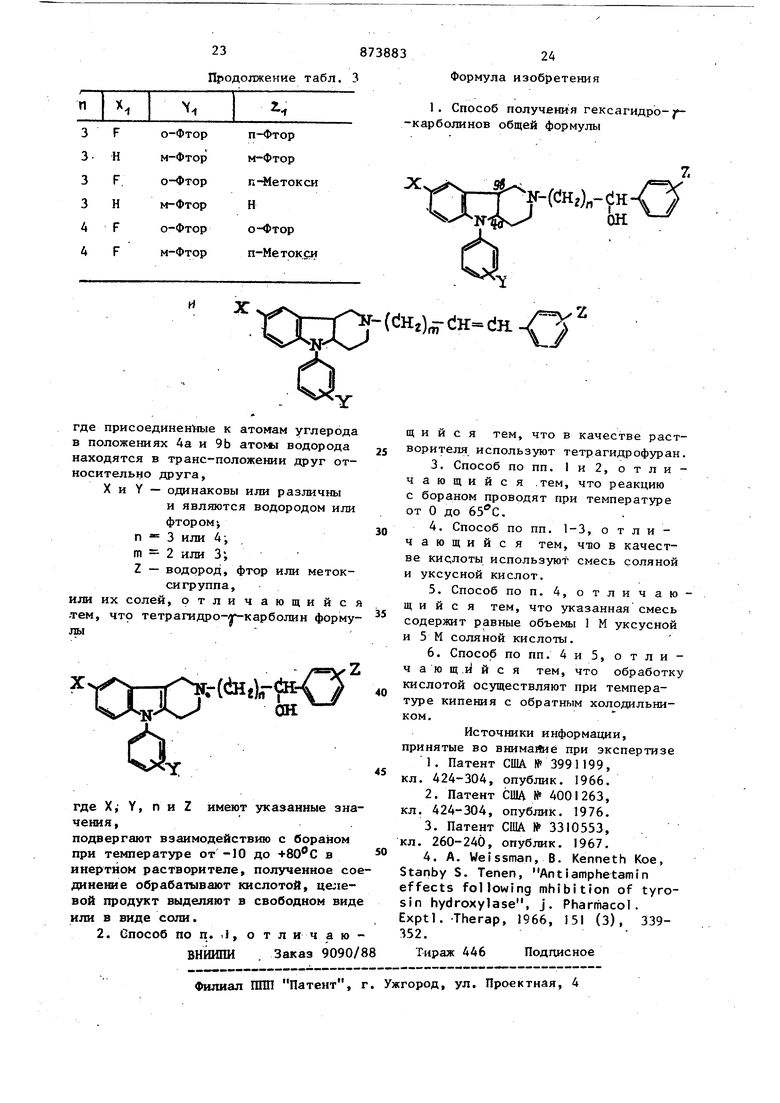
н-(й1г)-ен/ r-(eil2);r(iH.Cili где X, Y, Z, п и m имеют указанные вьше значения.. Относительные количества продуктов (II) и (III) могут меняться в з висимости от количества кислоты, на пример соляной кислоты, и времени нагревания при температуре кипения с обратным холодильником после того как было проведено восстановление с помощью борана. Большие количества кислоты и более длительное кипячени при температуре кипения с обратным холодильником способствуют дегидрир ванию и образованию продукта формулы III, тогда как соответственно ме шие количества кислоты и меньшая пр должительность кипячения способствует образованию продукта формулы И Соединение формулы II может такж служить предшественником свободного основания формулы; Такую реакцию проводят, использу например, этилхлорформиат с последу щим щелочным гидролизом для получения свободных оснований. 36 . При окислении соединений формулы II с применением реагентов и условий, которые известны специалистам для селективного превращения вторйчных спиртов в соответствующие кетоны, получают новые соединения формулы:чщО где X, Y, И.и п имеют указанные значения. В качестве окисляющих агентов можно использовать перманглнат калия, дихромат калия и трехокись хрома, причем предпочтительной является трехокись хрома в присутствии пиридина. При проведении этой реакции исходный спирт формулы II в реакционноинертцом растворителе, например, дихлорметане, хлороформе или бензоле, добавляют к CMecii, содержащей вплоть до 10-кратного молярного избытка трехокиси хрома и, соответственно, большой молярный избыток пиридина,, полученную смесь перемешивают обычно при комнатной температуре до тех пор, пока реакция практически не заканчивается (от 15 мин до 1 ч). Полученный проду1 т выделяют, например, путем фильтрования нерастворимого материала, зкстрагирования фильтрата разбавленной водной щелочью (например, -J{aOH) , органический слой сушат и выпаривают досуха. Исходные тетрагидро- карболины (I) получают известнымы способами 2. Основные соединения изобретения могут образовьгоать соли присоединения кислот. Указанные основные соединения превращают в соли присоединения кислот при взаимодействии основания с кислотой либо в водной, либо в неводной среде. Аналогичным образом обработка соли присоединения кислоты эквивалентным количеством бодного раствора основания, например гидроокиси щелоч ных металлов, карбонатов щелочных металлов и бикарбонатов щелочных металпов либо эквивалентным количеством катионов металла, которые образуют нерастворимый осадок с анионами кислоты, приводит к восстановлению форм свободного основания. Восстановленны таким образом основания можно снова превратить в те же саъаю или другие соли присоединения кислоты. При использовании хемотерапевтической активности указанных солей ил соединений предпочтительно использовать фармацевтически приемлемые соли Хотя нерастворимость в воде, высокая токсичность или отсутствие кристалли ческой формы могут привести к тому, что использование этой конкретной со ли будет невозможным или. менее желательным для данного фармацевтического применения, водонерастворимые или токсичные соли можно превратить в со ответствующие фармацевтически приемлемые основания путем разложения соли, как было указано рйнее, или их можно превратить в любую нужную фармацевтически приемлемую соль присоединения кислоты. Примерами кислот, которые дают фармацевтически приемлемые анионы, являются соляная, бромистоводородная иодистоводородная, азотная, серная, сернистая, фосфорная, уксусная, молочная, лимонная, винная, янтарная, малеиновая и глюконовая кислоты. Соединения изобретения легко приспособить для терапевтического использования в качестве транквилизато ров для млекопитающих, кроме того предлагаемые;транквилизаторы снимают такие проявления щизофрении у челове ка, как галлюцинации, враждебность, подозрительность, эмоциональные или социальные срьшы, тревогу, возбуждение и напряженность. Стандартной про цедурой определения и сопоставления активности соединений этой серии в качестве транквилизаторов и соединений, для которых имеется отличная корреляция с действенностью на человека, является противодействие симпт мам, вызванным амфетамином у крыс по методике А. Вейссмана Г. 7 -Карболины и их фармацевтически приемлемые соли, которые являются по лезнь ш транквилизаторами, можно при нимать либо как самостоятельные терапевтические агенты, либо как смеси терапевтических агентов. Их можно вводить отдельно, однако обычно их принимают с фармацевтическим носителем, выбранным на основании .обычного способа применения и обычной фармацевтической практики. Напримео,. их можно принимать орально в виде таблеток или капсул, содержащих такие добавки, как крахмал,, молочньй сахар,или определенные типы глин и т.д. Их можно принимать в виде эликсиров или суспензий для орального приема, когда активный ингредиент соединен с эмульгирующим или суспендирующим агентами. Их можно вводить парэнтерально путем инъекций, для этого их или соответствующие производные можно получить в виде стерильных водных растворов, в которые следует вводить соответствующий буфер в случае необходимости, и они должны содержать другие растворы, например, физиологический раствор или глюкозу для придания нужной изотоничности. Хотя использование предлагаемого изобретения направлено на лечение млекопитающих, предпочтительными объектами являются люди. Врачи дОлжны точно определить дозу, которая будет наиболее подходящей для конкретного индивидуума,.и доза эта будет зависеть от возраста, веса и чувствительности конкретного пациента, от природы и силы симптомов и фармакодинамических характеристик конкретного агента, который следует вводить. Первоначально следует давать небольшие дозы с постепенным увеличением дозировки до определения оптимального уровня. При оральном приеме композиции, как обнаружено.потребуются большие количества активного ингредиента для достижения того же самого уровня, который можно достичь при парэнтеральном введении меньших количеств . С учетом изложенного вьше принято, что дневная доза соединений для людей приблизительно 0,5-100 мг, предпочтительно от 1 до 25 мг. Все соединения формулы I содержат, по крайней мере, два асимметричных центра, образующих при восстановлении двойной связи 4а, 9Ь транс-конденсированные системы. Изобретение включает как рацематы, так и индивидуальные энантиомеры. Кроме того, если заместитель (R) в положении 2 содержит группировку, которая может существовать в стереоизомерных формах, все получающиеся при этом стереоизомеры также вклзрчены в изобретение.
Пример 1. Хлоргидрат d-транс -8-фтор-5-(п-фторфенил)-2- 4-окси-4- (п-фторфенил) бутил; -2,3,4, 4а, 9Ь-гекеагидро-1Н-пцридо t4,,3-b индола и Хлоргидрат d-тpaнc-8-фтop-5-(п-фторфенил) 4-(п-фторфенил)-3-бутенил -2,3,4,4а,5,9Ь-гексагидро-1Н-пиридо 4,3-Ь индола,
В реакционный сосуд ёмкостью , 1000 мл, снабженный магнитной мешалкой и заполненный азотом, помещают 177 мл Оj94.молярного борана в тетрагидрофуране. Раствор охлаждают в ледяной бане и к охлажденному раствору добавляют за промежуток времени бодее 30 мин раствор (25 г, 0,0555 моль 8-фтор-5-(п-фторфенил)-2- Г4 окси-4 - (п-фторфенил) бутил}-2,3,4,5-тетрагидропиридо - Г4,З-Ь индола в 295 мл тетрагидрофурана. Полученную смесь перемешивают при температуре окружающей среды в течение 20 мин, затем нагревают при температуре кипения с обратным холодильником в течение.2 ч. Реакционную смесь охлаждают и.концентрируют в вакууме до получения жидкого остатка, к которому добавляют смесь 500 мл уксусной кислоты и столько же 5 н. соляной кислоты, после чего имеет место интенсивное выделение газа. Смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч, охлаждают до комнатной температуры и фильтруют. Фильтрат охлаждают на льДУ и после этого подщелачивают, добавляя раствор гидроокиси натрия (500 вес/вес).
Основную смесь экстрагируют порциями хлороформа по 150 мл, соединенные органические слои высушивают над сульфатом магния и выпаривают досуха в вакууме, в результате чего получают желтую твердую пену (25 г). После разделения с помощью тонкослойной хроматографии (ТСХ) на силикагеле, используя в качестве растворителя систему гексангэтилацетат (1:1 по объему), получают два продукта. Пенообразное твердое в ещество хроматографируют на колонке с силикагелем, элюируя смесью гёксангэтилацетат (1:1 по объему) и контролируя фракции с помощью ТСХ. Фракции, которые содержат тблько один более быстро выходящий продуктj например 8-фтор-5-(п-фторфенил)-2-t4-(й-фторфенил)-3-бутенил -2,3,4,4а,9Ь-гексагидро-1Н-пирйдо t4,3-ЬЗ индол, выпаривают
досуха, помещают в .ацетон и превращают в Хлоргидрат, добавляя безвод:ный хлористый водород в ацетоне, выделяя полученное твердое белое вещество фильтрованием, в результате чего получают 1,5 г 3-бутенильного соединения с температурой плавления 270273°С.
Фракции, которые содержат только медленно выходящий продукт 8-фтор0-5-(п-фторфенил)-2- 4-окси-4-(п-фторфенил ) -бутил - 2 , 3 , 4 , 4а , 5 , 9 Ь- гексагидро-1 Н-пиридо - Г4, З-Ь индол,концентрируют, помещают в этиловый эфир
5 и превращают в хлоргидрат, добавляя безводный .хлористый водород, в результате чегополучают 10,8 г этого продукта (температура плавления 241245°С).
0
Содержание более быстро выходящего 3-бутенильного соединения повышается вплоть до 100% при соответствующем увеличении кислотности и времени нагревания при температуре кипения с
5 обратным холодильником в смеси уксусной и соляной кислоты.
Пример 1а. При повторении процедуры примера 1, однако исходя из 8-фтор-5-(о-фторфенил)-2- 4-окси0-4-(п-фторфенил)-бутил}-2,3,4,5-тетрагидропиридо 4,3-Ь индола, ту компоненту, которая более быстро выходит при хроматографировании на силикагеле, идентифицируют как транс-8-фтор5-5-(о-фторфенил)(п-фторфенил)-3-бутенил -2,3,4,4а,5,9Ь-гексагидро-1 Н-пиридо Г4, З-Ь индол (температура йлавления 141-142°С). Та компонента, которая выходит позднее,
0 идентифицирована как транс-8-фтйр-5-(о-фторфенил)-бутил-2,3,4,4а,5,9Ь-гексагидро-1Н-пиридо 4,3-Ь индол (температура плавления 195-197с) .
Пример 2. Используя в качестве исходных соединений примера 1 подходящие соединения формулы I,,получают и выделяют указанные 4а,9Ь-транг.-продукты формулы I I и III (m п - 1). Данные приведены в
табЛ. 1.
б л и ц .а 1 71родолжение табл. 1 3. Хлоргидрат d-транс Пример -8-ФТОР-5- (п-фторфенил) -2-метил-2,3, 4,4а,5,9Ь-гексагадро-Ш-пиридоС4,3-Ь индола. A.В колбу емкостью 25 мл, снабженную мешалкой, капельной воронкой и устройством для впуска азота, поме щают 573 мГ (2,0 ммоль) 8-фтор-5-(п-фторфенил)-2,3,4,4а,5,9Ь-гексагид ро-1Н- пирйдо 4,3-Ь индола, 8 мл дихлорметана и 0,323 мл (4 ммоль) сухого пиридина. К полученному раствору при комнатной температуре по каплям добавляют 0,219 мл (2,3 ммоль) этилхлорформата. После того, как добавление этого раствора закончено, смесь перемешивают в течение 1ч. Затем полученную смесь выпаривают в вакууме, в резуль тате чего получают смолу. Эту смолу разделяют между Ю мл ,10%-ной соляной кислоты и 25 мл э4ира. Органический, слой промывают водой (10 мл), высушивают над сульфатом магния и вьшаривают досуха, в результате чего получают 707 мг 8-ФТОР-5-(п-фторфенил) -2-этоксикарбонил-2,3,4,4а,5,9Ь-гексагидро- 1Н-пиридо 4,3-bJ индола,.который используют на следующей B.В колбу емкостью 100 мл, снаб женную магнитной мешалкой, капельной воройкой и устройством для ввода азо та, помещают 10 мл этилового эфира 524 мг (13,8 ммоль) литииалюминийгидрида. Суспензию охлаждают с помощью ледяной бани.. После перемешивания в атмосфере азота в течение 5 мин раствор продукта, полученного в части А, 707 мг (1,97 ммоль) в 5 мл эфира добавляют по каплям за время свыше 5 мин. Затем полученную смесь перемешивают при комнатной температуре в течение 1 ч, после чего добавляют 3 г безводного сульфата . натрия и (медленно) около 1 мп воды. После перейепшвания в течение 30 мин полученную смесь отфильтровывают ,и собранное твердое белое вещество промывают эфиром. Полученный фильтрат выпариваю-т досуха, снова растворяют в эфире и добавляют насьпценный раствор безводного хлористого водорода в эфире до тех пор, пока не завершается образование осадка. Полученный осадок выделяют фильтрованием, в результате чего получают 481 мг искомого соединения Строение полученного соединения подтверждается данными ЯМР-, масс- и ИК-спектроскопии. Пример 4. Если продукты подвергают взаимодействию с этилхлорФорматом в присутствии пиридина и растворителя и полученные 2-этоксиffIкарбонильные производные восстанавливают, то получают следующие рацемические 4а,9Ь-тр.анс-соединения: if-CHj Пример 5. Хлор гидр ат d-транс-4-фенил-2-ГЗ-(п-фторбензоил)-пропилЗ-2,3,4,4а,5,9Ь-гексагидро -1 Н-пиридо Г4,3-Ь индола. В реакционный сосуд емкостью 25 мл, снабженный магнитной мешалкой, в котором поддерживают атмосферу азота 3 помещают 0,828 мл (8,0 мг,10,3 ммоль сухого пиридина и 10 мл дихлорметана К этому раствору добавляют 517 мг (5,17 ммоль) трехокиси хрома, и полу ченную темно-красную суспензию перемешивают в течение 15 мин при комнат ной температуре. Затем в виде одной порции добавляют раствор 359 мг (0,862 ммоль) d-тpaнc-5-фeнил-2-Г4-oкcи-4-(п-фтopфeнил)бyтилi-2,,3,4, 4а, 5,9 Ь-гексагидро-1 Н-пиридо Г4 ,3-bJ индола в виде свободного основания в5 мл дихлорметана. Реакционная смесь быстро превращается в коричневую суспензию. Ее перемешивают при комнатной температуре в течение 30 мин. Нерастворимый материал от- . фильтровывают, проъывают дихлорметаном и объединенные фильтраты и промывки экстрагируют 20 мл 10%-ного раствора гидроокиси натрия. Органический слой высушивают (MgSOi) и выпаривают досуха в-вакууме, в результате чего получают смолу, которую очищают на хроматографической колонке с силикагелем, элюируя смесью гек сана с этилацетатом (1:1 по объемуJ. Фракции, содержащие целевой продукт, соединяют, выпаривают до желтой смолы, полученную смолу помещают в этиловый :эфир и обрабатывают безводным хлористым водородом. Полученную суспензию выпаривают досуха и получают ее взвесь в 3 мл холодного дихлор метана. Образовавшееся при этом бес Цветное твердое вещество выделяют фильтров.анием и высушивают, в резуль тате чего получают 20 мг искомого соединения (температура плавления 244-246°С). П р и м а р 6. Используя соответствующие исходные материалы и окисляя их по методике примера 5, полу чают следующие 4а,9Ь-транс-сое;:(инения (см. табл. 2).,. Т а б л и 14 3 Продолжение табл. 2 ЭЬ-гекссшдро-Ш-пиридо 4,3-Ь индола. 5 граммов хлоргидрата d-TpaHC-8-фтор-5-(п-фторфенил)-2- 4-оксй-4-(п-фторфенил)бутил -2,3,4,4а,5,9Ь -гексагидро-1 Н-пиридо 4,3-Ь индола в 75 мл воды обрабатывают 3 мл воды, содержащей 1,0 г гидроокиси натрия, и освобожденное свободное основание экстрагируют 150 мл диэтилового эфира. Э4 1рный слой выделяют, высушивают над сульфатом магния и образовьтают 1 мл ледяной уксусной кислоты. Органический растворитель и избыток уксусной кислоты удаляют при пониженном давлении и полученный остаток растирают с гексаном и отфильтровывают. Аналогичным образом можно попучи-ць и другие соли присоединения, особен15но те, которые являются фармацевтически приемлемыми. Пример 8. Тестовые методики и результаты, Эффективиость соединений предлагаемого изобретения при симптомах, вызванных амфетамином, изучалась на крысах. Группы из 5 крыс помещают в покрытую пластиком клетку размеро приблизительно 26x42x16 см. После непродолжительного промежутка време ни акклиматизации в клетке крысам к дой группы, подкожно вводят тестовые соединения. Затем, спустя 1, 2 и 24 им внутрибрюшияно вводят d-амфетами сульфат. Спустя час после введения амфетамина каждую крысу .наблюдают н предмет характерного для амфетамина поведения при движении вокруг клетк На основании данных о чувствитель.ности дозы после приема амфетамина оказалось возможным определить эффе тивную дозу соединения, необходимую для противодействия или блокирования характерного для амфетамина пов дения при движении вокруг клетки дл 50% испытываемых крыс (ЭДд-). Время оценки выбирают в соответствии с пиком действия амфетамина, которое составляет 60-80 мин после введения этого агента. Пример 9. Основа для табле ток приготавливается путем смешения следующих ингредиентов в указанном соотношении по весу: Сахароза (производство США)80,3 Крахмал тапиоки13,2 Стеарат магния6,5 В полученное таким обр.азом основание для таблеток примешивают достаточное количество хлоргидрата транс-8-фтор-5-(п-фторфенил)-2-Г4-(п-фторфенил)-4-оксибутилЗ г2,3,4,4 5 9Ь-гексагидро-1 Н-пиридо 4,3-bJ индола для получения таблеток, содержащих 1,0; 1,5, 5,0 и 10 мг активно ингредиента на таблетку. Кажд; из этих композиций запрессовывают обыч ным способом в таблетки, каждая из к торых .весит 360 мг. Пример 10. Приготавливают смесь, содержащую следующие ингредиенты:Карбонат кальция (производство США)17,6 капьцийфосфат18,8 Трисиликат магния (прсмзводство США)5 3 Лактоза (производство США)3,2 Картофельный крахмал 5,2 Стеарат магния0,8 К этой смеси добавляют вторую порцию стеарата магния (0,35 г) и достаточное количество хлоргидрата гранс-5-фенил-2-(4-окси-4-фенилбутил) -2,3,4,4а,5,9Ь-гексагидро-1Н-пиридо Г4,3-Ь3индола для получения капсул, содержащих 1,0; 2,5; 5,0 и 10 мг активного ингредиента на капсулу. Этими композициями заполняют обычные твердые желатиновые капсулы в количестве 350 мг на каждую капсулу. Пример 11. Суспензию транс-8-фтор-5- (п-фторфенил)-2- Г4-окси-4-(п-метоксифенил)бутил -2,3,4,4а, 5,9Ь-гексагидро-1 Н-пиридо 4,3-ЬЗиндолацетата получают в следующей композиции : Эффективный 25,00 ингредиент, г 70% водньй сорби741,29 тол, г Глицерин (производство США), г 185,35 Смола акации (10%-ный растврр),мл 100,00 Поливинил0,50 пирролидон, г Дистиллир ованДо 1 литра ная вода К этой суспензии добавляют различные подсластители и отдушки для улучшения вкуса суспензии. Эта сусгшнзия содержит приблизительно 25 мг эффективного агента на миллилитр. Пример 12. Кунжутное масло стерилизуют, нагревая до 120 С в течение 2 ч. К этому маслу добавляют, распыляя хлоргидрat транс-8-фтор-5-(п-фторфенил)-2 (п-фторфенил)-4-оксибутилЗ -2,3,4,4а,5,9b-гeкcaгидpo-lH-пиpидot4,3-bЗиндoлa для получения 0,025 вес.% суспензии. Твердый продукт тщательно гируют в масле с использованием коллоидной мельницы. После этого суспензию фильтруют через сито 100-250 мешей разливают в стерильные ампулы и запаивают. Получение А. 2-Вензил-5-фенил-1,2,354-тетрагидро- карболин. Сьфой Н,М-дифенилгидразин(100 г) подщелачивают водной гидроокисью калия и полученную смех:ь экстрагируют этилацетатом. Органический слой пеегоняют до получения 39,7 г (о,216 моль) М,М-дифенилгидразина, свободного основания (температура кипения 130-135°С при давлении 1,1 мм рт.ст.). Полученный продукт растворяют в 500 мл абсолютного эта нола и к нему добавляют 40,8 г (0,216 моль) М-бензил-4-пиперидона в 500 мл абсолютного этанола. Полученную смесь нагревают до 65С и до бавляют сухой газообразный хлористы водород для подкисления смеси, кото рую затем кипятят с обратным холоди ником в течение 5 ,ч. После выдерживания, при комнатной температуре в т чение ночи растворитель выпаривают и остаток подщелачивают раствором гидроокиси натрия, экстрагируют хлороформом, высушивают над MgSO. и вы паривают досуха. Полученный остаток растворяют в этиловом эфире, отфиль ровывают и полученный фильтрат подкисляют эфирным раствором хлористого водорода для того, чтобы осадить сы рую соль хлористоводородной кислоты Затем эту соль превращают в свободное основание, разделяя между водной гидроокисью натрия и этилацетатом. Органические слои высушивают, концентрируют до -небольшого объема и вводят в хроматографическую колонку заполненную 300 г силикагеля, элюируя смесью гексан/этилацетат (5:5 по объему), в результате чего получают 12,0 г (33%) целевого продукта (температура плавления 150-155 с). Получение В. 8-фтор-5-(п-фторфенил)-1,2,3,4-тетраГидро-7 -карболин. I. 8-фтор-2-карбэтокси-1,2,3,4-тетр агидро- Г карболин. Смесь 15,9 г (0,093 моль) N-карбэтокси-4-пиперидона и 15,1 г (0,093 моль) хлоргидрата пара-фторфенил гидразина в 150 мл этанола нагревают до кипения с обратным холодильником в течение 2ч, Реакционную смесь красноватого цвета охлажда ют и отфильтровывают, собранную твер дую часть пром 1вают небольшим количеством холодного 95%-ного этанола, в результате чего получают 21,3 г (88%) продукта (температура плавления 169-170°С). Аналитический образец перекристаллизовывают из смеси, этанол-вода, (температура плавления .169-170с). Найдено: С 63,8, Н 5,8, N 10,6 , Вычислено; С 64,1, Н 5,8, N 10,7 318 II. 8-фтор-5-(п-фторфенил)-2-карбэтокси-1,2,3,4-тетрагидро- -карболин. К 30 мл М-метил-2-пирролидона добавляют 3,45 г (0,013 моль) 8 тор-2-карбэтокси-,2,3,4-тетрагидро -карболина, 7,8 т (0,045 моль) пара-тфторбромбензола, 4,14 г (0,014 моль) бромистой меди и 1,5 г (0,U14 моль) карбоната натрия, полученную смесь нагревают на масляной бане при тем-пературе 200с в течение 6 ч.Затем смеси дают остыть до комнатной температуры в течение ночи, декантируют в 300 мл воды,содержащей 60 мл этилендиамина. Добавляют бензол(200 мл) и двухфазную систему отфильтровывают через очень тонкий фильтр. Полученный фильтрат последовательно экстрагируют несколько раз бензолом (общее количество которого 700 мл). Бензольные экстракты объединяют, промывают последовательно водой и насыщенным рассолом, высушивают над безводным сульфатом натрия. После удаления растворителя .получают неочищенный продукт в виде темного маслянистого остатка. Полученный сырой продукт, растроренный в бензоле, помещают в хроматографическую колонку с силикагелем, используя в качестве элюента 10%-ный этилацетат/бензол. Фракции с 1 до 16, каждая кз которых содержит 10-25 мл, и содержание пара-фторбёнзол собирают и сливают. Фракции с 16 по 38 объединяют и концентрируют в вакууме до маслянистого остатка,который при стоянии в течение ночи при затвердевает. Полученный продукт(3,5 г 76% выход) растирают с пентаном и Отфильтровывают. Аналитический обраец перекристаллизовывают из пентана (температура плавления 118-120 с). Найдено: С 67,4, Н 5,2, N 7,8. Вычислено: С 67,4, Р 5,1, N 7,9. III. 8-фтор-5-(п-фторфенил)-1,2, 3,4-тетрагидро- 3 карболин. Суспензию 3,56 г (0,01 моль) 8-фтор-5-(п-фторфенил)-2-карбэтокси-I,2,3,4-тетрагидро-у-карболина и 8,2 г (0,146 моль) гидроокиси калия в 53 мл этанола, содержащего 5 мл оды, нагревают при кипении с обратным хблодильником в течение ночи. ополнительно добавляют 3,0 г гидоокиси калия и нагревание продолжают в течение 23 ч. Коричневатый раствор охлаждают, концентрируют в вакууме досуха и разделяют между водой и ди; этиловым эфиром. Водный слой далее экстрагируют эфиром и эфирные слои объединяют, проьывают насьщенным. рассолом и вцгсупмвают над сульфатом магния. После удаления растворителя получают целевой продукт в виде твер дого вещества оранжевого цвета (2,6 г, температура плавления 125127с). Аналитический обраэец перекристаллизовывают из пентана (температура плавления 127-128°С). f Найдено: С 71,Б, Н 5,1, N 10,2 C,7H,N,Fi. Вычислено: С 71,8; Н 5,0, N.9,9. Хлористоводородную соль по1г1учают пропуская хлористый водород через раствор свободного основания в диэтиловом эфире (температура плавления 270-272С). Получение С. 2-Бензил-8-фтор-5- (п-фторфенил)-1,2,3,4-тетрагидро-карболин. К перемешиваемому раствору 1,4 г (4,9 ммоль) 8-фтор-5-(п-фторфенил)-1,2,3,4-тетрагидрЬ- -карболина и 1,02 г (7,4 ммоль) карбоната калия в 10 мл диметилформамида, нагретому до температуры , по каплям добав ляют 1 ,01 г (5.,9 ммоль) бромистого бензола в 10 мл того же самого растворителя . После нагревания в течение 1 ч реакционную смесь декантируют в 200 мл водного 2%-ного раствора карбоната калия и полученный раствор последовательно .экстрагируют (3 X 200 мл) бензолом. Объединенные экстракты промывают последовательно водой и насьпценньм рассолом и сушат над сульфатом магния. Затем растворитель отгоняют в вакууме и полученное в остатке масло, которое кристал лизуется при йтояшда, растирают с гексаном и фильтруют. Получение Ь.Хлоргидрат 8-фтор-5- (п-фторфенил) -2- 4- п-фторфенил) -4-оксибутилЗ-1,2,3,4-тетрагидро-7 -карболина. . Из перемешиваемой суспензии 2,84 г (OiQl моль) 8-фтор-5-(п-фторфенил)- 1,2,3,4-тeтpaгидpo-f-кapбoлина, 2,8 г (0,01 моль)и -хлор-п-фторг бутярофенона, 3,15 г (0,03 моль) кар боната натрия и следов (50 мг) иоди да калия в 50 мл 4-метил-2-пентонона после нагревания. при температуре кипения с обратным холодильником в течение 15 ч с последующей обработкой реакционной смеси, как описано в получении С, получают 2,6 г 8-фтор-5-(п-фторфенил )-4- ГЗ- (п-фторбенэоил) пропил)- ,2,3,4-тетрагидро-ЗГ- карболина в виде свободного основания (температура плавления 150-155с). К 846 г (22,4 ммоль) боргидрида натрия в 50 мл этанола по каплям добавляют 2,5 г (5,6 ммоль)-карболина, полученного ранее, в теплом растворе 80 мл этанола и 20 мл тетрагидрофурана с такой скоростью, чтобы поддерживалось при этом равномерное кипение с обратным холодильником. После завершения добавления смесь нагревают при температ,уре кипения с обратным холодильником в течение дополнительного часа и охлаждают до комнатной температуры. Надосадочный слой декантируют в 300 мл воды и органический растворитель удаляют из водной фазы, выпарив-ая в вакууме. Полученный остаток экстрагируют дихлорметаном .и объединенные экстракты промывают насыщенным рассолом и высупшвают над сульфатом магния. Затем растворитель выпаривают в вакууме и остаток растворяют в смеси этилового, эфира и дихлорметана. Затем в раствор, осторожно пропускают газообразный хлористый водород до прекращения выпадения осадка. Искомое соединениевьщеляют фильтрованием и высушивают (температура плавления 249-250 с). Получение Е. Когда 2-карбэтокси-1,2,3,4.-тетрагидро-3-карбо.пинил и 8-фтор-2-карбэтокси-1,2,3,4-тетрагидро- -карболин подвергают взаимо- . действию с орто-фторбрЬмбен5олом -или мета-фторбромбензолом по способу получения В части И и полученный 5-(о- или м-фторфенил)-2-карбэтокси-1,2,3,4-тетрагидро-2-карболин гидролизуют и декарбоксилируют по спо-. собу, описанному в части III получе-. ния В, то получают следующие соеди нения:-О U 21 JLI Hо-Фтор H м-Фтор Fo-Фтор Fм-Фтор Получение F. 5-(п-Фторфенил)-1 ,2,3,4-тетрагидро-З карболин. Эквимолярные количеств - фенилгидразина и М-карбэтокси-4-пиперидана подвергают рзаимодействию по способу получения В части I, в результате чего получают 2-карбоэтокси-1,2,3,4-тетрагидро-1Г-карболин. Затем его подвергают взаимодействию с п-фторбромбензолом в соответствии с методи кой В части II и полученный продукт гидролизуют по способу,описанному в части III получения В, в результате чего получают искомое соединение. Получение G. 8-Фтор-5-фенил-1,2, 3,4-тетрагидро- -карболин. Если п-ара-фторбромбензол заменяют эквивалентным количеством бромбензола в части II получения В и полученный 2-карбэтокси-8-фтор-5-фенил-1,2, 3,4-тетрагидро-зг-карболин гидролизую по способу, описанному в части III получения В, то получают искомое сое динение. Получение Н. 3 ения С, то аналогичным образом полуают следующие продукты: OgQ Получение J. Используя соответствующим образом замещенный 5-фенил-1,2,3,4-тетрагидро- карболин и (CH)f,-A, где А - зслор или бром, в качестве исходных материалов, в каждом случае в процедуре получения D, аналогичным образом получают следующие соединения (см. табл. З). ТаблицаЗ









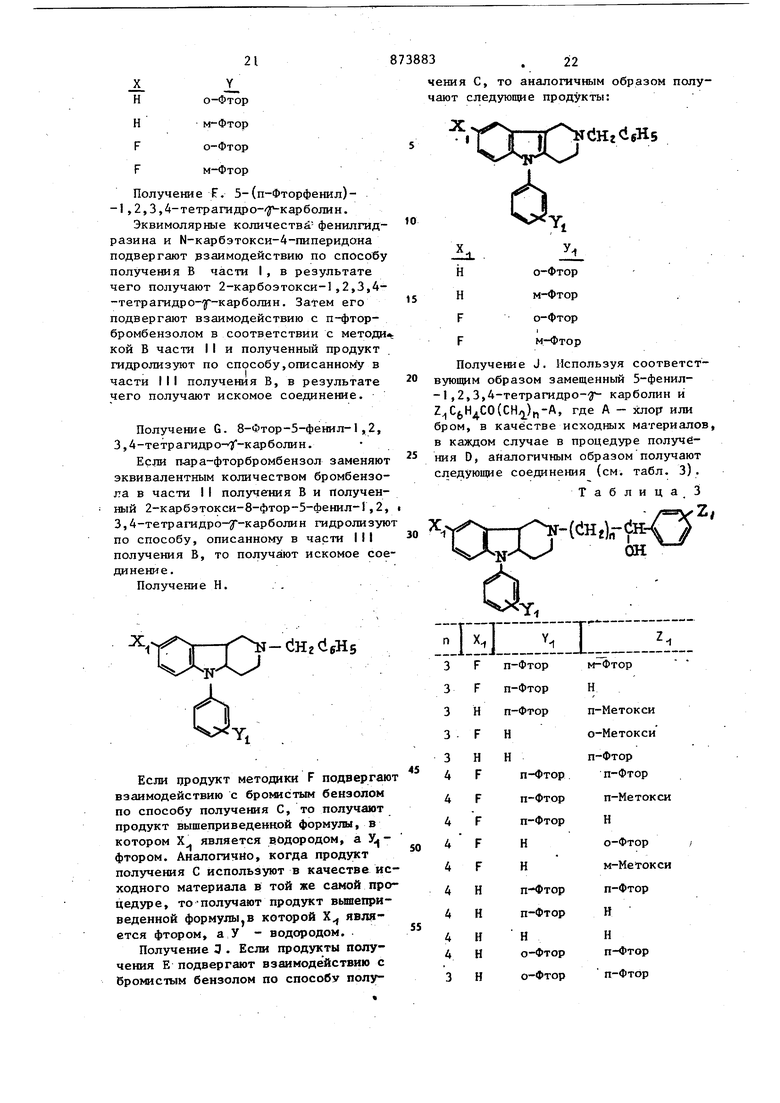

еНг С1,Н5
N
Если цродукт методики F подвергают взаимодействию с бромистым бензолом по способу получения С, то получают продукт вышеприведенной формулы, в котором X . является водородом, а У фтором. Аналогично, когда продукт получения С испольэуют в качестве исходного материала в той же самой процедуре, тоПолучают продукт вьшеприведенной формулыjв которой Х является фтором, а У - водородом.
Получение 3. Если продукты получения Е подвергают взаимодействию с бромистым бензолом по способу полу
45
50
55
Авторы
Даты
1981-10-15—Публикация
1978-05-18—Подача