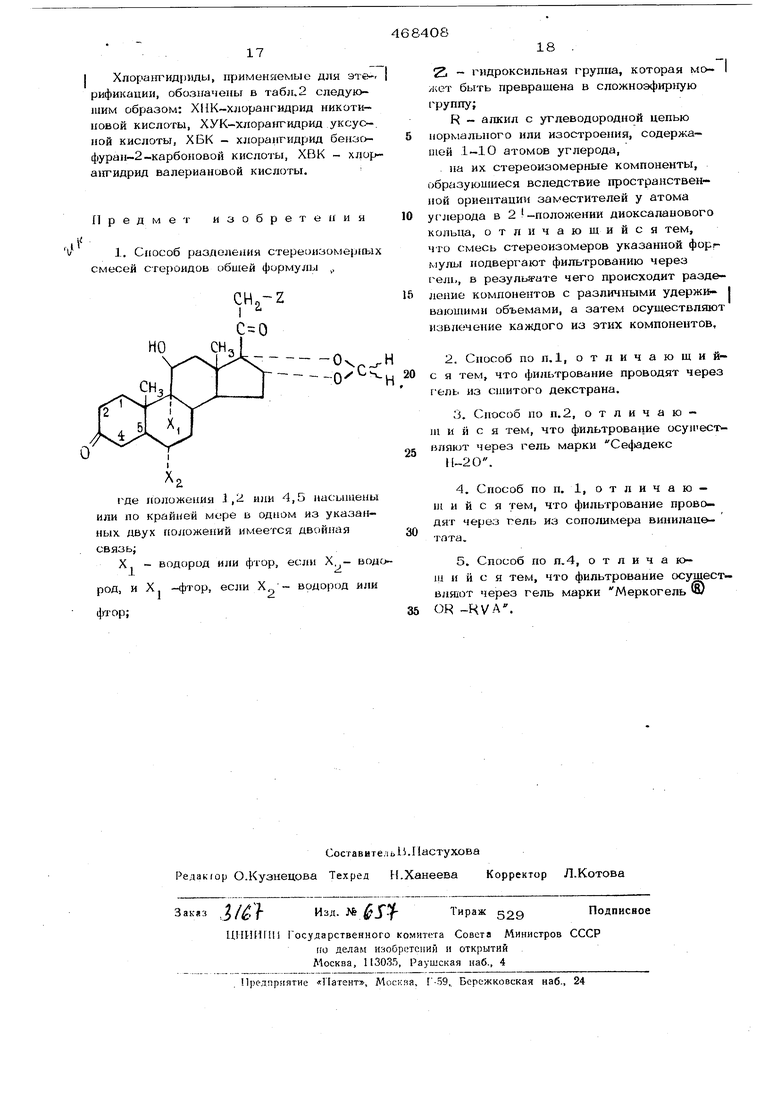
где положения 1,2 и 4,5 насыщены или по крайней мере в одном из указаииых положений имеется двойная связь ,
R алкил нормального или изостроения, содержащий 1-10, предпочтительно 1-6, атомов углерода;
Х - водород или фтор, если Х водород, и Х - фтор, если радикал Х„водород или фтор;
2L - гвдроксильная группа, которая может быть превращена в сложноэфирную
группу,
на их стереоизомерные компоненты, образующиеся вследствие пространственной ориенташш заместителей у атома углерода в 2 - положении диоксаланового кольца, заключающийся в том, что смесь стереоизомеров указанной формулы подвергают фильтрованию через гель, в результате чего происходит разделение компонентов с различными удерживающим объемами, а затем осуществляют извлечение каждого из этих компонентов.
Фильтрование можно осуществлять чэрез гели различного типа. Одним типом таких материалов явля5отся оксипропилиро ванные сщитые декстрановые гели типа f Сефадекс LH, на пример Сефадекс
LH - 2О с мол.в. 1ОО-4ООО, дающие хорощее фракционирование. Другой тип полезных гелей представляет собой сополимеры винилацетата с мол.в. до -vlOOO, а именно Меркогель® типа . Гели используют в виде равновесной системы с подходящим растворителем. В качес - ве элюирующего средства можно применят галогенированные углеводороды, простые : или сложные эфиры или их смеси, причем наилучшие результаты получают при применении хлороформа, дихлорметана, дихлорэтана, тетрагидрофурана, диоксана и этил1 ацетата. В результате достигают вполне удовлетворительног о отделения ст ёотЁзомера А от стереоизомера В, причем смесь изомеров А и В можно также с успехом отделять от побочных продуктов, образующихся при синтезе стероидов.
В приведенной формуле гвдроксильная группа в положении 21 может быть этерифицирована жирной кислотой. Такая жирная кислота может в своей структуре иметь углеводородную цепь нормального или изостроения и предпочтительно содержит 1-12 атомов углерода. В качестве примера подходящей кислоты можно назвать уксусную, пропноновую и так далее илн гетероциклическую карбоновую кислоту
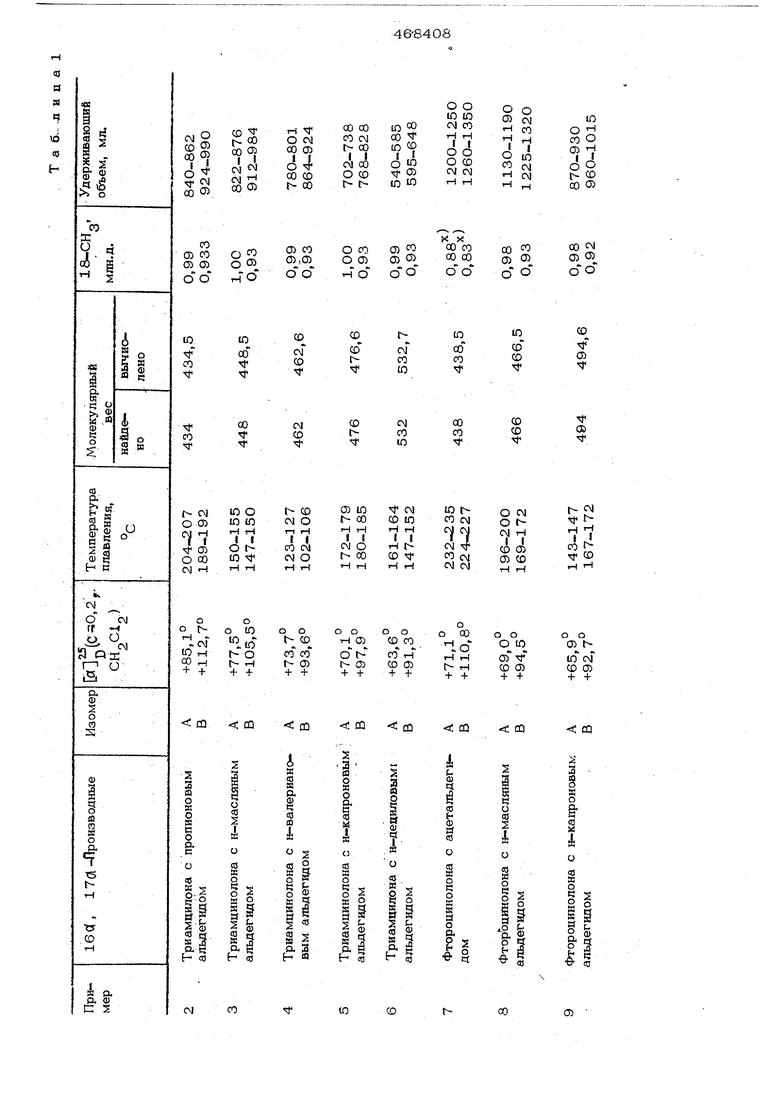
Стероиды указанной формулы в виде циклических ацеталей можно синтезировать известным способом: взаимодействием 16, 17-диоксистероидов с альдегидом в присутствии кислого катализатора, например хлорной кислоты, rt-толуолсульфокислоты, хлористоводородной кислоты и тому подобное, в среде диоксана или другого подхо- . дящего растворителя. В результате реакции получают смесь стереоизомеров А и В с од инаковыми молекулярными весами и практически одинаковой растворимостью, причем эти стереоизомеры, как было найдено, с больщим трудом поддаются раздеI лению обычными способами разделения стереоизомеров, например перекристалли- зацией.
Для гель-фильтрации применяют колонку длиной 85 см с внутренним диаметром 2,5 см при скорости потока 1 мл/ мин. Удерживающие объемы, приведенные в примерах, получены при применении хлороформа в качестве элюируюя1его средства.
При фильтрации через геЛь на колонке неочищенного продукта более легко отделяются побочные продукты от смеси изомеров, чем изомеры друг от друга, так как в первом случае имеет место боль- щая разница в удерживающих объемах. Найдено также, что растворимость неочищенного продукта, а также растворимость очищенной изомерной смеси понижается, в то время, как повыщается степень разделения по мере уменьшения полярности растворителей. Это особенно проявляется у производных, замещенных короткой боковой непью у атома углеро да в положении 2 диоксоланрвого коль ца. Поэтому при хроматографическом разделении, описанном в примерах, рекоме1Щуется сначала отделять смесь изомеров от побочных продуктов, содержащихся в неочищенном продукте, с по мощью немного более nofinpHoro растворителя, а затем - изомеры друг от друга с помощью растворителя, обладающего меньщей полярностью. Можно использовать всю мощность колонки и в каждом процессе отделять побочные продукты от значительных количеств неочищенного продукта или возможное частичное использование мощности колонки вследствие ограниченной растворимости смеси изомеров в растворителях с меньщей полярностью может быть компенсировано пов торной хроматографией .на колонке, проводимой через относительно короткий промежуток времени без удаления ранее загруженной смеси из колонки. I С помошью растворителей, которые являются высокоактивными при предварительном разделении, таких как дихлор метан, дихлорэтан, тетрагидрофуран и этилацетат, вполне удовлетворительно разделяют изомеры в то время, как хлороформ и диоксан дают лучшие результаты для изомеров, с трудом поддающихся разделению. Во всех примерах молокулярш.ю веса определяют посредством масс -спектросл-.ко ПИИ, а во всех исследованиях ядерно-магнитного резонанса в качестве внутреннего эталона применяют тетраметилсилан. Температуру плавления определяют с помощью микроскопа Рейхерта для определения тем ператур плавления. Пример. 160( , 17d - {2йодород-2-метил)метиле1ЩИОкси-9-фторпрегнадиен-1,4-диол-11 Э , 21 дион-3,2О К раствору 112,0 мг свежеотогнанног паральдегида и О,2 мл хлорной кислоты в 75 мл хорошо очи1не1П10го и высушешгого диоксана добавляют по частям 500,0 Ml триамцилона в течение 40 мин . Р еакцио}Н(ую смесь перемешива ют еще 5,5 час при комнатной темпера- , туре, после чего ее разбавляют 20О мл дихлорметана. Раствор промывают дважды раствором бикарбоната натрия и трижды водой, а затем высушивают. Растворители упаривают под вакуумом, остаток обрабатывают эфигроы и осаждают петролейньгм эфиром. Высушенный неочищенный продукт (533,0 мг) хроматографируют на колонке, заполненной оксипропилированным сшитым декстрановым гелем Сефадекс® L.H-20 (мол.в. 1004000), с применением дихлорметана в качестве элюирующего растворителя. Полу чают 431,7 мг (81%) чистой смеси изомеров, т.пл. примерно 207-222°С; и 5 +107,20° (с 0,3, ); .| МОЛ.В. 420 (теоретический 42О,5).1 Смесь изомеров (338,2 мг) хромато-л графируют на колонке, заполненной гелем Сефадекс® LH-2O, с применением хлоро-, форма в качестве, элюирующего средства. / Получают два разных изомера (Л и В) 1ба , 17а - (2-водс од -2-мeтил)мeтилeндиoкc -9-фторпрегнадиен-1, 4-диол-11 , 21-диона -3,2О. Выход изомера А 123,4 мг (37%); Т.ПЛ.217-2190С; &7,4°(,3, СН С1 ); МОЛ.В. 420 (теоретический 420,5); удерживающий объем 920-990 мл.. Выход .изомера В 194,7 мг (58%|j т.пл. 224-2280С; ,8О (,3, ).; МОЛ.В. 42О (теоретический 420,5); удерживающий объем 1О2О-110Омл Чистоту изомеров А и В (98%) устанавливают по ЯМР - спектроскопии, изучая сиг-нал для 18.-СН , расположенный при (S 1,00 млн.д,(СДС1 ) для А и при 6 0,92 млн.д.(СДСЦ) для В. Аналогичные результаты по разделению изомеров получают с применением геля иа сополимера винилацетата (Меркогель® OH-HVA 2000, мол.в, до 1ООО), а также с использованием (кроме хлороформа и дихлорметана, дихлорэтана, этилацетата, тётч рагидрофурана и диоксана в качестве элк ирующих средств на обоих типах гелей. Примеры 2-15. Аналогично методике, описанной в примере 1, синтезируют смеси различных изомеров, и по методике разделения, описанной там же, получают изомеры, приведенные в табл. 1. Иссле дования ЯМР проводят в среде СДС1 , если не указана другая среда.
in о r
CO о ООН
о о
г- CD
со 05





| название | год | авторы | номер документа |
|---|---|---|---|
| СЛОЖНЫЕ ЭФИРЫ 16 АЛЬФА 17 АЛЬФА - АЦЕТАЛЬЗАМЕЩЕННОЙ АНДРОСТАН-17 БЕТА - КАРБОНОВОЙ КИСЛОТЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ | 1991 |
|
RU2081879C1 |
| Способ получения производных кортикостероидов | 1973 |
|
SU470954A3 |
| Способ получения производных 4-прегнена или смеси их стереоизомеров или 22-эпимеров | 1981 |
|
SU1156600A3 |
| СТЕРОИДНЫЕ ЭФИРЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2112775C1 |
| ПРОИЗВОДНЫЕ ПИРИДОНКАРБОНОВОЙ КИСЛОТЫ И КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1993 |
|
RU2100351C1 |
| Способ получения производных прегнановой кислоты | 1973 |
|
SU524523A3 |
| ПРОИЗВОДНОЕ МОРФОЛИНА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1994 |
|
RU2123496C1 |
| ПРОИЗВОДНЫЕ ТРИ- ИЛИ ТЕТРА-ЗАМЕЩЕННОГО-3-АМИНОПИРРОЛИДИНА | 2006 |
|
RU2420524C2 |
| ТРИАЗОЛОВЫЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ПРОТИВОГРИБКОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2146250C1 |
| 22R- ИЛИ 22S-ЭПИМЕРЫ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1992 |
|
RU2111212C1 |

DD
СО
cQ : 03
со
to
СО N 05 Си
о о
со
ф
)
гНН
гсо
Tt со
о о 05 hirToTсо о + +
; cQ
DO
CQ
:а 3
и о
о
I
1° gi
Ф
а
И
СО
О)
11
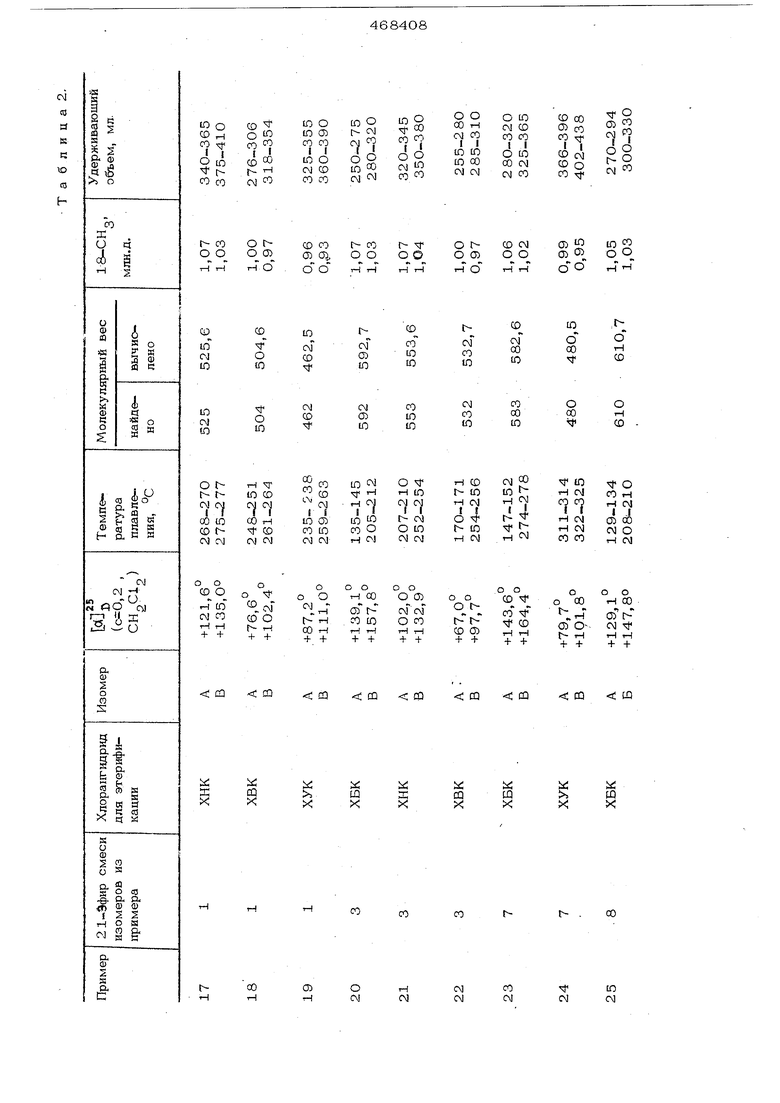
Пример 16. Расшеплеиие 16i 17oi -(2-водород-2-метил)метилендиокси11- окси-214бензофуран-2-.карбонилокси) Э-цфторпрегнадиеи-. ,4.-диопа-3,2О на изомеры.
Раствор 60 мг чистой смеси изомеров 16ri , 17Я -(2 -водород-2-метил)метилендиокси-.9-фторпрегнадиен-1,4-диол-ИД 21-.диоиа-3,2О в 2 мл сухого пиридина добавляют к 72,2 мг хлорангщь рида бензофурам-2-карбоновой кислоты, растворенной в 1 мл сухого диоксана. Реакционную смесь вьщерживают при комнатной температуре в течение ночи, большую часть растворителей упаривают под вакуумом и остаток выливают в 3%-1Ш1й раствор хлористого аммония. Полученный осадок отделяют центрифугированием и растворяют в 1ОО мл хлороформа. Хлоро форме1ппз1й раствор промывают однократно 5% -ным раствором карбоната натрия и три раза водой, высушивают над сульфатом магния и упаривают под вакуумом. Остаток хроматографируют на геле Сефадекс 40 ijH-20 с применением хлороформа в качестве элюеита. Получают два разных изомера (А и В) 16(( ,17С1 (2 -водород-2 -метил)метиле1щиокси-11-окон-21- (бензофуран-2 -карбонилокси ) 9-фторпрегнадиен-1,4-диона-3,20.
Выход изомера А 28,1 мг (35%), т.пл. 250-256°С; dl 158,9О
|{osO, 3, СН Cl); мол.в. 564 (теорети- |
ческий 564,6), удерживающий объем 27090 мл.
Выход изомера В 24,2 мг (ЗО%),
т.пл. 247-250°С; +168,3 . (,2, ); мол.в. 564 (теоретический 564,6); удерживающий объем 300-60 мл.
QЧистоту изомеров А и В (98%) устанавливают с помощью ЯМР-спектроскопии по изучению сигнала для 18-СН„, расположенного при 5 -1,О6 млн.д ССДС )
гО
для А и при б 1,03 млн.д. (СДС1 ) для В,
I
Лналогичньге результаты по разделению
изомеров получают с применением геля Меркогель® OR-RV А 2000, а также с использованием (кроме хлороформа) дигхлорметана, дихлорэтана, этилацетата, тетратидрофурана и диоксана в качестве растворителей для элюирования на гелях обоих типов,
5Примеры 17-27. Получают раз
личные 21-эфиры изомерных смесей, полученных по методике, описанной в примерах 1-15, способом, oпиcaнны в приме- ре 16. Изомеры, полученные с примене-
1нием таких способов очистки и раздел& ния, указаны в табл.2. Исследования по I изучению ЯМР-спектра проводят в среде СДС1 .
О
17
I Хлораш идр1щы, примениемые для эте-г рификации, обозначены в табл.2 следующим образом: ХИК-хлорангидрид никотиновой кислоты, ХУК-хлора1ггидрид уксус-. ной кислоты, ХБК - хлорангидрид бенз: фуран-2-карбоновой кислоты, XEiK - хлорангидрид валериановой кислоты,
Предмет изобретения
СИГ2
сн
где наложения i,2 или 4,5 насыщены или но крайней мере в одном из указанных двух ноложений имеется двойная связь;
X - водород или фтор, если X - водоX -фтор, если X
водород или
род, J фтор;
18
И - гидроксильная группа, которая мо- I жет быть превращена в сложноэфирную группу;
R - алкил с углеводородной цепью 5 нормального или изостроения, содержащей 1-10 атомов углерода,
на их стереоизомерные компоненты, образующиеся вследствие пространственной ориентации заместителей у атома 0 углерода в 2 I -положении диоксаланового кольца, отличающийся тем, что смесь стереоизомеров указанной форг мулы подвергают фильтрованию через ель, в результате чего происходит раздей ление компонентов с различными удержи- I ваюин1ми объемами, а затем осуществляют извлечение каждого из этих компонентов,
5 И-20.
тата,

Авторы
Даты
1975-04-25—Публикация
1973-05-18—Подача