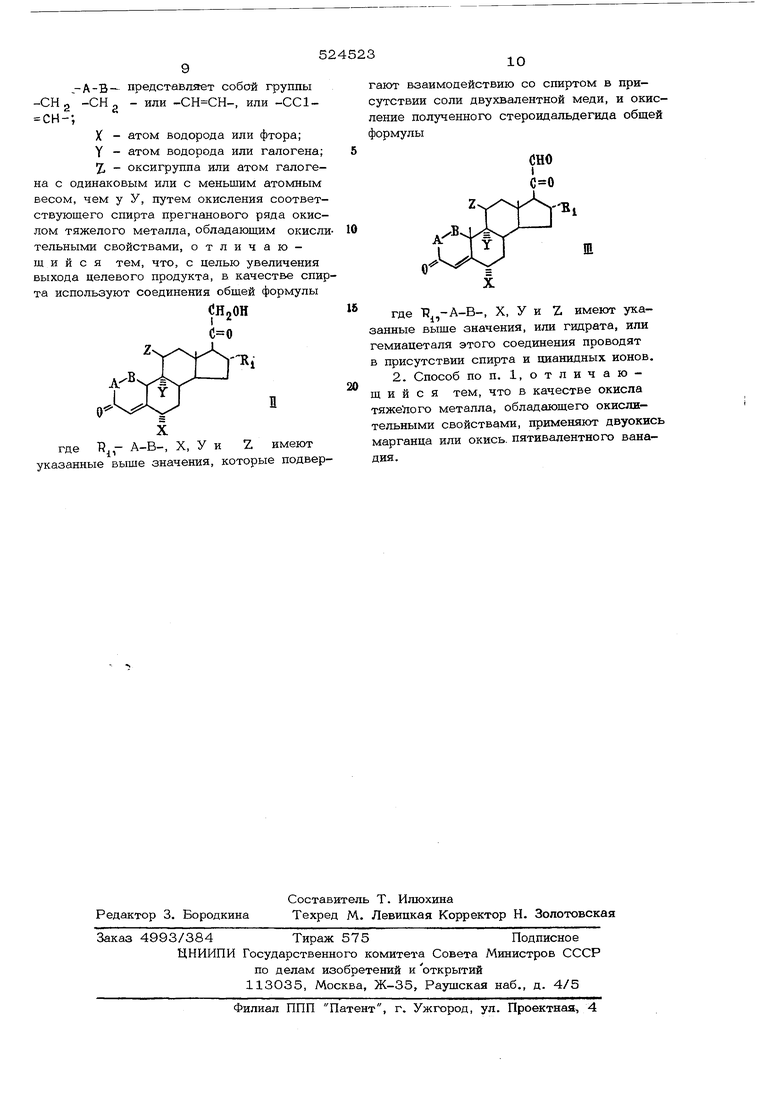
зовать стероидные спирты общей формулы где Pj -А-В-, X, У и Z имеют указанные выше значения, которые подвергают взаимодействию со спиртом в присутст вии соли двуквапентной меди, и дальнейше окисление полученного стероидальдегида общей формулы где Rj, -А-В, X, У и Z имеют указанные выще значения, или гидрата, или гемиадеталя этого соединения проводят в присутствии спирта и цианидных ионов. В приведенных выще формулах под атомами галогенов У и Z. следует подразуме вать преимущественно атомы фтора или хлора. Радикал R -представляющий собой С Cg -алкил, может иметь линейную и разветвленную структуру. Общий выход целевого продукта по предлагаемому способу, представляющему собой двухстадийный процесс, 60-75% и в самых неблагоприятных случаях не мене 50% от теории. Для проведения любой из двух стадий процесса требуется время, рав ное максимум 2 час в случае, если реакцию проводят при комнатной температуре. Для первой стадии процесса в качестве двухвалентной соли меди наиболее предпоч тительно использовать соли низщих карбоновых кислот, но можно применять также и медные ( II ) соли неорганических кислот. Из солей двухвалентной меди, например, можно использовать муравьинокислую уксуснокислую, пропионовокислую медь ил медную соль масляной кислоты. В качестве спирта для этой стадии про цесса можно использовать спирты общей формулы TRgOH , где Rj имеет указанны выще значения. Наиболее подходящими спи тами являются низшие и средние первичны - „ -......... ...... и вторичные алифатические спирты, содерж жащие 1-8 атомов углерода в спиртовом остатке, например метиловый, этиловый, пропиловый, изопропиловый, бутиловый, изобутиловый, вторичный бутиловый, амиловый или изо амиловый спирт, гексанол, гептанол или октанол. Эти спирты одновременно можно использовать и в качестве растворителя. Однако к редакционной смеси в дополнение к спирту также можно добавить другой инертный растворитель, например такие углеводороды, как бензол, циклогексан или толуол; такие хлорированные углеводороды, как хлористый метилен, хлороформ или четыреххлористый углерод; простые эфиры, например диэтиловый, диизопропиловый или гликольдиметиловый эфир, тетрагидрофуран или диоксан, или диполярные апротонные растворители, например диметилформамид, N -метилацетамид или N -метилпирролидон. Первую стадию процесса наиболее предпочтительно осуществлять при температуре от О до 40 С. Необходимое для проведения этой стадии время зависит от структуры применяемого 21-оксистероида общей формулы 11 и температуры реакции. В среднем время реакции составляет 512О мин. В больщинстве случаев оптимальное время реакции нетрудно определить путем отбора проб из реакционной смеси через некоторые промежутки времени и исследования их с помощью хроматографии в тонком слое. Оптимальным временем реакции является время, в течение которого исходный 21-оксистероид полностью превращается. В зависимости от выбора отдельных условий реакции, а также от того, применяется ли для реакции содержащий воду или безводный спирт, получают свободный стероидальдегид общей формулы Б1 его гидрат, гемиацеталь или смесь этих соединений. Но это не имеет значения для дальнейщего превращения полученного продукта. Как показывают некоторые результаты опытов, превращение стероидальдегида общей формулы III в производное прегнановой кислоты общей формулы I по предлагаемому способу можно осуществить с помощью самых различных окислителей. Так, например, стероидальдегид в присутствии кислоты можно ввести во взаимодействие со спиртом и органическим окислителем, например с 5,6-дихлор-2,3-дицианобензохиноном или трифенилтетразолийхлоридом, с образованием производного прегнановой кислоты. Однако применяемые окислители представляют собой дорогие ве щества и последующая очистка продукта реакции требует очень больших затрат. Стероидальдегид общей формулы III по предлагаемому способу можно окислить также окислами металлов, проявляющими окислительные свойства, или солями мета лов, такими, как окись марганца, окись серебра, хромовая кислота, перманганат и т.д., в присутствии спирта и в некоторых случаях кислоты. Однако при этом реакция протекает относительно медленно и кроме производного прегнановой кислоты образуется значительное количество нежелательных побочных продуктов. Стероидальдегид также можно вводить во взаимодействие с кислородом воздуха в присутствии спирта и пианидного иона. Однако в этом случае реакция .протекает довольно медленно и, кроме того, образуется значительное количество нежелательных побочных продуктов. Для достижения быстроты взаимодействия и получения более высокого выхода целевого продукта целесообразно на второ стадии процесса использовать окислы тяжелых металлов, обладающие окислительными свойствамр, и проводить реакцию в присутствии спирта и цианидных ионов. На второй стадии можно применять те же спирт и растворитель, что и на первой стадии. В качестве окислов тяжелых металлов, обладающих окислительными свойствами, можно употреблять, например, окись сереб ра, окись свинца (IV ), сурик, окись ванадия ( V ), окись марганца (IV ) или окись хрома (VI ), однако последнюю можно исп пользовать лишь в том случае, когда стероидальдегид не содержит в положении Ц р гиароксильной группы. Окисел тяжелого металла применяют в количестве 0,5-50 г преимущественно 1-10 г на 1 г стероидальдегида. Катализатором на второй стади процесса служат цианидные ионы. В качест ве реагентов, дающих цианидные ионы, пре имущественно используют цианиды щелочных металлов, та кие, как цианид натрия или калия, в количестве 0,01-1Омоль, предпочтительно 0,1-1 моль цианида на 1 моль сте роидальдегида. Если в качестве реагента, дающего цианидные ионы, берут цианид щелочного металла, то к реакционной смеси целесообразно дополнительно прибавить минеральную кислоту, например серную, фосфорную или хлористоводородную, сульфокислоту, в частности п-толуолсульфокислоту, или карбоновую кислоту, например муравьи ную или уксусную, в количестве, необходимом для нейтрализации цианида щелочного металла. Реакцию наиболее целесообразно проводить при (-20)-(+10О) С, предпочтительно при (о)-(+50)°С. Время реакции зависит от температуры, при которой она проводится, и от выбора компонентов реакции. Это время в среднем составляет 15120 мин. В отдельных случаях оптимальное время реакции можно легко определить также, как и для первой стадии способа. Преимуществом предлагаемого способа является то, что Стероидальдегид общей формулы III может быстро взаимодействовать с окислом тяжелого металла, проявляющим окислительные свойства, в присутствии цианидных ионов и спирта. Кроме того, такой способ характеризуется более высоким выходом целевого продукта, чем известный. Пример 1. а)1,Ог6о6 -фтор-11 р , 21-ДИОКСИ-16 сзС -метил-1,4-прегнадиен-3,2О-диона растворяют в 125 мл метилового спирта и прибавляют раствор 250 мг уксуснокислой меди ( II ) в 125 мл метилового спирта. Через полученную смесь при перемещивании в течение 15 мин при комнатной температуре пропускают воздух, затем реакционную смесь разбавляют хлористым метиленом, промысают 5%-ным раствором хлористого аммония и водой, сущат на.д сернокислым натрием, после чего отгоняют растворитель в вакууме при 40°С, Выход 6 об -фтор-11 р -окси-3,20-диоксо-16 оС -метил-1,4-прегнадиен-21-аля в виде неочищенного продукта 1,О5. 6) Полученный продукт растворяют в 50 мл бутилового спирта и после прибавления 165 мг цианистого калия, 1,0 мл уксусной кислоты и 5 г окиси марганца ( IV ) раствор перемещивают 30 мин при комнатной температуре. Затем окись марганца (IV ) отфильтровывают, фильтрат разбавляют хлористым метиленом, промывают водой и органическую фазу сущат над сернокислым натрием, после чего раствор упаривают в вакууме до получения сухого остатка. Полученный остаток хроматографируют на силикагеле. Далее 12-15%-ной смесью ацетон-гексан элюируют 840 мг продукта, который после перекристаллизации из смеси ацетон-гексан дает 735 мг бутилового эфира 6 рС -фтор-11 р -окси-3,2О-диоксо-16 оС -метил-l,4-пpeгнa иен-21-овой кислоты, т.пл. 195 С foCj +134 (хлороформ). Пример 2. 95О мг боб-фтор-11 р -окси-3,20-диоксо-16 х -метил-1,4-прегнадиен-21-аля в 20 мл метилового спирта окисляют в условиях примера 16. Неочищенный продукт хроматографируют на силикагеле. Элюированием 1822% ной смесью ацетон-гексан вьщеляют после перекристаллизации из смеси ацетонгексан 699 мг метилового эфира 6 об -фтор-11 ft -окси-3,20-диоксо-16 оС -ме-. тил-1,4-тзегнадиен-21-овой кислоты, . j т.пл. 197°С. оС} +144° (хлороформ). ; П р и м е р 3. В условиях примера 1а: 1,0 г 6 оС-фтор-11/3 , 21-диокси-16оС-; -метил-4-цщегнен-3,2О-диона окисляют до бсС-фтор-llp-окси-3,20-диоксо-16оС -метил-4-прегнен-21-аля, который в усло-J виях; описанных в примере 16, переводят в бутиловый эфир боС-фтор-Ир -окси-3,2О-диоксо-16 оС -метил-4-прегнен-21-овой кислоты. Выход эфира 596 мг, ,
т,плЛ92°С. (хлороформ).
П р и м е-р 4. i,6 г 6 оС , 9-дифтор-11 G ,21-диокси-16 (рС -метил-1,4- -лрегнадиен-3,2О-диона превращают в условиях примера 1 в бутиловый эфир 6 об, 9-дифтор-11 р .-окси-3,2О-дйоксо-16 об -метил-1,4-прегнадиен-21-овой кислоты. Выход эфира 752 мг, т.пл. 194°С. + 122° (хлороформ).° .
Пример 5. 1,1 г боб-Фтор-lip-окси-3,20-гдиоксо-16 оО -метил-1,4-прернадиен-21-аля при соблюдении условий, описанных в примере 16; в изопропиловом спирте переводят в изопропиловый эфир 6 оС -фтор-11 j3 -окси-3,2О-диоксо-16 об -; -метил-1,4-прегнадиен-21-овой кислоты. Выход эфира 649 Wr. т.пл. 225°С. оС + 134 (хлороформ).
Пример 6. В условиях примера 1 а 1,0 г 6 о6-фтор-9-хлор-11 р , 21-диокси-16 сС -метил-1,4-прегнадиен-3,20-диона окисляют до 21-альдёгида к полученный продукт при соблюдении условий, описанных в примере 16, но в метиловом спирте с использованием окиси серебра ( I ) превращают в метиловый эфир 6 сС гч})тор-9-хлор-11 Р -окси-3,2О-диоксо-16 о(, -мётил-1,4-прегнадиен-21-овой кислоты. Выход : эфира 605 мг, т.пл. 225°С. оС, +153° (диоксан).
П ри м е р 7. При соблюдении условий, описанных в примере .1 а, 75О мг боС, 11 |3-дифтDp-9-xлop-21-oкcи-16 об -метил-1,4-прегнадиен-3,2О-диона окисляют до альдегида и полученный продукт в условиях примера 16, но в метиловом спирте с использованием окиси ванадия ( V ) переводят в метиловый эфир.боО 11 Р -дифтор-9-хлор-3,20-диоксо- lG iDC-метил-1,4-прегнадиен-21-овой кислоты. Выхоп nnnnvKTa 51О мг, т.пл. 240°СИ1 + 138° (хлороформ).
8. В условиях примера а
500 мг 6оС-фтор-2-хлор-11,/3 -21-диокси-16 оС -метил-1,4-прегнадиен-3,20-диона окисляют до 21-альдегида и полученный продукт при соблюдении условий, описанных, в примере 16, в пропйловом спирте перево-;
дят в пропиловый эфир 6еС-Фтор-2-хлор-11 Р -окси-3,2О-диоксо-16 оС -метил-1,4-прёгнадиен-21-овой кислоты. Выход
эфира 252 мг, т.пл. 165°С.сС.+107°
(хлороформ)..:
Пример 9. При соблюдении уело-: ВИЙ, описанных в примере 1 а, 55О мг 9-фтор-11 р , 21-ДИОКСИ-16 ос -метйл-1,4-прегнадиён-3,20-диона окисляют до
21-альдегида и полученный продукт в условиях примера 16 в метиловом спирте превращают в метиловый эфир 9-фтор-1 IjJ-6кси-3,20-диоксо-16 ОС -метил-1,4-прегнадиен-21-овой кислоты. Выход продукта
416 мг, т.пл. 215°С. обЗ +140°
(хлооофоом).....
Прим ер 1О. В условиях примера 1а, 750 Мг 11 р , 21-диокси-1,4-прегнадиен-3,20-диона «окисляют до 21-альдегида
и полученный продукт.при соблюдении условий, описанных-в примере 16, в этиловом спирте переводят в этиловый эфир 11 Р -окси-3,2О-диоксо-1,4-прегнадиен-21-овой кислотьг. Выход эфира 382 мг,
Т.ПЛ. 19б°С. сзС +174° (хлороформ).
П р и м е р Г1. При соблюдении условий, описанных в примере 1, 1,О г llp1-диокси-16 .сС -метил-1,4-прегнад иен-3,2О-диона переводят в бутиловый эфир
11 уЗ -ОКСИ-16.0С -метил-3,20-диоксо-16 сС -метйЛ-1,4-прегнадиен--21 -овой кислоты. ЕЫход продукта 67О мг, т.пл. 149 С. оС +153 (хлороформ).
Фо.рмулаизобретения
1. Способ получения производных прегнановой кислоты общей формулы
COOKj
X
i
атом водорода
или метил;
Т.-С,-С
- алкил;
в
представляет собой группы -СН2 -CHg - или , или -СС1 сн-;
)( - атом водорода или фтора;
Y - атом водорода или галогена;
7, - оксигруппа или атом галогена с одинаковым или с меньшим атомным весом, чем у У, путем окисления соответствующего спирта прегнаноБого ряда окислом тяжелого металла, обладающим окислительными свойствами, отличающийся тем, что, с целью увеличения выхода целевого продукта, в качестве спирта используют соединения общей формулы
CHjOH
П
где А-0-, л, -7 и /. имеют указанные выше значения, которые подвергают взаимодействию со спиртом в присутствии соли двухвалентной меди, и окисление полученного стероидальдегида общей формулы
где Тг,-А-В-, X, У и Z. имеют указанные выше значения, или гидрата, или гемиацеталя этого соединения проводят в присутствии спирта и цианидных ионов.
2. Способ по п. 1, отличающий с я тем, что в качестве окисла тяжелого металла, обладающего окислительными свойствами, применяют двуокис марганца или окись, пятивалентного ванадия.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных прегнановой кислоты | 1974 |
|
SU622411A3 |
| Способ получения производных прегнан21-овой кислоты | 1974 |
|
SU646916A3 |
| Способ получения производных прегнановой кислоты | 1972 |
|
SU686623A3 |
| Способ получения производных прегнановой кислоты | 1972 |
|
SU439974A1 |
| Способ получения производных прегнановой кислоты | 1975 |
|
SU609472A3 |
| Способ получения производных прегнановой кислоты | 1975 |
|
SU615863A3 |
| Способ получения кортикоидов или их солей | 1978 |
|
SU668611A3 |
| Способ получения производных прегнановой кислоты | 1975 |
|
SU555856A3 |
| Способ получения производных 6 -фтор-16 ,18-диметил1,4-прегнадиен-3,20-диона | 1971 |
|
SU504493A4 |
| Способ получения кортикоид -21- СульфОпРОпиОНАТОВ или иХ СОлЕй | 1979 |
|
SU818489A3 |


Авторы
Даты
1976-08-05—Публикация
1973-12-04—Подача