3,20-диои, в котором по усмотрению гндролизуют 21-ацетоксигруппу и подвергают полученное соединение микробиологическому окислению по Си, затем ацетилируют 21-оксигруппу и дегидрируют образующееся соединение в А Ч-стероид, взаимодействием которого с бромиоватистой кислотой получают 9а-бром1 lp-оксистероид, последний обрабатывают основанием и образующийся при этом 9,11-эпоксид подвергают взаимодействию с фтористоводородной кислотой и выделяют целевой продукт известными приемами. Бромирование 21-метильной группы проводят предпочтительно в растворе диоксапа, так как в его присутствии окисление 3-оксигруппы бромом минимально, при температуре предпочтительно не выше 75°С. Окисление 21-бром - 3 - оксистероида производят предпочтительно водной хромовой кислотой в смешивающемся с водой эфире или кетоне, например диоксане, тетрагидрофуране или метилэтиловом кетоне, предпочтительно при комнатной температуре или ниже. Ацетоксилирование 21-положения проводят смесью ацетата натрия и ацетата серебра во влажной уксусной кислоте при предпочтительном соотношении количеств соли серебра и 21-бромстероида 1 : 1 и предпочтительно при температуре кипения растворителя. Гидролиз 21-ацетоксигруппы проводят обычпыми способами, папример с помощью карбоната натрия или калия, предпочтительно при комнатной температуре. Микробиологическое гидроксилирование осуществляется известным способом с помощью культур Curvularia linata или Curvularia pallescens. Введение / -cвязи осуществляется после ацетялирования 21-оксигруппы действием Nбромацетамида, двуокиси серы и пиридина. Пример 1. а) Смесь 1 л пиридина и 325 г 3(3, 17сс-диокси-16а-метилпрегн-5-ен-20она обрабатывают через капельную воронку уксусным ангидридом (200 мл), нагревают до 65-70°С, выдерживают при этой температуре в течение 4 ч, охлаждают до комнатной температуры и выливают при сильном перемещивапни в 6 л воды. Через полчаса твердое вещество отфильтровывают и тщательно промывают чистой водой и высущивают до постоянного веса в вакууме при 110-120°С. Получают 350 г 17а-окси-3р-ацетокси-16а-метцлпрегн5-ен-20-он (П1) с выходом 94%. ПМР (CDCU, IMS) при 60 МГЦ, гц: 322 (щирокая полоса, 1, С-6 винил), 134 (S, 3 С-21 СНз), 121 (5,3, ОАС), 61(3, S, С-19 СНз), 54(3, d, 1 7 ГЦ, С-16 СНз), 48(3, S, С-18 СНз). б) К смеси 120 г гидрата паратолуолсульфокислоты в 1 л уксусного ангидрида прибавляют 200 г моноацетата П1. Смесь перемешивают при комнатной температуре в течение 3-5 ч. Ацетилирование при более высокой температуре или более продолжительное время (более 5 ч), способствует нел :елательной Р-гомоизомеризации стероида. Реакционную смесь выливают при перемешивании в о л ьиды и по мере надобности охлаждают льдом так, чтобы температура не превышала 40С. После перемешивания в течение 4 ч воду декантируют с твердого вещества, и заменяют чистой водой. Спустя еще 1 ч твердое вещество отфильтровывают, растворяют в 1,5 л хлористого метилеиа, промывают последовательно насыщенным водным растворо.м бикарбоната натрия и хлористого натрия и высуп1ивают над MgSO,). Получают Зр, 17а-диацетокси- 6а-метилнрегн-5-ен-20-он IV (164 г, выход 67%), т. пл. 173°С (метанол ЯМР , TMS) при 60 МГЦ, гц: 326 (широкая полоса, 1, С-6 вицил), 130(5, 3, С-21 СПз), 122(5 при 500гц 5. W., 6, С-3 и С-17 ОАс), 62(5, 3, С-19 СНз), 54(d, 3, 1 7 ГЦ, С-16 СНз), 42(5. 3, С™18СНз). в) Смесь 75 г диацетата, 300 мл хлористого метилена и 10 г сухого фтористого натрия в полиэтиленовой бутыли продувают азотом через полиэтиленовый барботер, а затем в перемешиваемую смесь вводят 24-27 г фтористого нцтрозила при барботировании в течение 6-8 ч. Реакционную смесь продувают азотом, разбавляют дополнительным количеством хлористого метилена и промывают последовательно насыщенным раствором бикарбоната патрия и хлористого натрия. Раствор затем вынаривают и в результате получают сырой б-нитримипо-Зр, 7а - диацетокси - 5а - фтор-16аметилнрегнап-20-оц IV а, который в бензоле выливают на нейтральный глинозем сорта 3 (1,8 кг), элюируют бензолом (6 л). После кристаллизации из ацетона получают 3(3, 17адиацетокси - оа - фтор - 16а - метилпрегнап6,20-дион V (56 г), т. пл. 254-257°С. ЯМР-HI (CDCb, ТМ5), при 60 МГЦ, гц: (5, 3, С-21 СНз, 121(5 при 500 гц 5. W., 6, С-3 и С-17 ОАС), 54(d, 1 8 гц, 3, С-16 СНз), 50(5, 3, С-19 СНз), 40(5, 3, С-18 СНз). Соеинение VI идентично веществу, приготовленному несколько иным способом и имеющему нриведенный ниже состав. Найдено, %: С 67,26; Н 7,95. С2бНз7РОб. Вычислено, %: С 67,1; Н 8,03. г) Раствор Фторкетона V (75 г) в 300 мл лористого метилена в автоклаве на 1 л обраатывают 7,5 мл воды и охлаждают смесью вердой углекислоты и ацетона. Автоклав эвауируют, добавляют смесь четырехфтористой еры ц фтористого водорода и неремешивают ри 20±1°С в течепне 10 ч. Реакциоппую месь промывают последовательно водой, наыщенным раствором бикарбоната натрия и асыщенным раствором хлористого натрия, ысушивают над Mg5O4, отфильтровывают и наривают. В некоторых случаях полученный (3, 17а - диацетокси - 5а, 6,6 - трифтор-16а етилпрегнан - 20 - он VI достаточно чист для епосредствепной кристаллизации из смеси лористый метилен-метанол. Чаще всего его одвергают хроматографии на «Флоризиле
( кг). В колонку, приготовленную в гексане, вводят раствор стероида в бензоле и элюируют гексаном (2 л), затем смесью 5%ного ацетона в гексане (2 л), и затем смесью 20%-ного ацетона в гексане (15 л). Фракции объединяют на основании данных ЯМР- Обычно элюируемое вещество имеет большое содержание Л-гомотри4)торстероида (отсутствуют С--18 СНз при 43 ГЦ и С-21 СНз при 131 ГЦ, 60 МГЦ ЯМР. Умеренные количества такого стероида легко удаляют из вещества VI кристаллизацией из хлористого метиленаметанола, поскольку иервый легко растворяется в метаноле.
Большую часть соединения VI элюируют смесью 20%-ного ацетона в гексане. Небольшое количество исходного фторкетона V элюируют в последних фракциях. Кристаллизация из хлористого метилена-метанола дает соединение VI (25-40 г, выход 33-53%, т. ил. 263°С). ЯМР(СОСи, TMS), при 60 мгц, гц; (S, 3, ОАс), 121(5, 3, ОАс, 131(5, 3. С-21 СНз), 61. 64. 67(t, 3, С-19 СНз расщепленное F). 54(d, 1 7 ГЦ, 3, С-16 СНз), 43(5, 3, С-18 СЫз). Полученное таким образом вещество VI идентично веществу, нриготовленному в подобных условиях, и имеющему приведенный ниже анализ.
Найдено, %: С 64,10; Н 7,51; F 11,58.
СгеНзуРзОз.
Вычислено, %: С 64,1; Н 7,68; F 11,7.
д)Раствор Зр, 17а-диацетокси-5сб, 6,6-трифтор-16а-метилпрегнан-20-она (трифторстероид VI, 50 г) в тетрагидрофуране 450 мл) добавляют при перемешивании под азотом к смеси 1 Н. раствора NaOH (112 мл) и метанола (300 мл). Суспензию перемещизают в атмосфере азота в течение 18-24 ч при комнатной температуре. Через i ч раствор становится прозрачным, его концентрируют в вакууме приблизительно до 300 мл, выливают в воду и экстрагируют несколько раз этиладетатом, экстракт промывают 5%-ным раствором бикарбоната натрия, затем водой, высушивают и упаривают. Носле кристаллизации из ацетона-гексана и сушки в вакууме при 60°С получают белое т;5ерлое вещество Зр-окси-17а-ацетокси-16а-метил-5а, 6, 6-трифторпрегпан-20он II (44 г. выход 96%, т. пл. 211-215°С), ЯМР подтверждает структуру.
Найдено, %; С 64,62;Н 7,36; F 16,80.
С94Нз5РзО4.
Вычислено, %: С 64,8; Н 7,95; F 12,8.
е)Раствор (44 г) моноацетата II в 400 мл аиоксана выдерживают при 60-63°С, при перемешивании прибавляют по каплям (17,7 г, 5,7 мл) раствор брома в 125 мл диоксана в течение 30-40 мин. Несколько минут после окончания добавления раствор показывает отрицательный результат на влажной индикаторной йодкрахмальной бумаге. Реакционную смесь сразу же охлаждают прттблизительно до 30°С и немедленно упаривают почти досуха в вакууме. Остаточный сироп растворяют в небольшом количестве метанола и опять упаривают в вакууме. В результате получают стекловидное вещество, при кристаллизации которого из метанола (100 мл) и сушки в вакууме в течение 18-24 ч получают чистый 21 - бром - Зр - окси - 17а - ацетокси - 5а, 6, 6трифтор-16а-метилпрегнан-20-он VII (37,4 г, выход 76%, т. пл. 117-119 С).
Соединение VII также можно приготовить бромированием Зр, 17а-диацетата VI при приблизительно 55°С, при этом получают 21-бром Зр, 17а - диацетокси - 5а, 6,6 - трифтор - 16аметилпрегнан-20-он, который гидролизуют с помощью водного раствора хлористого водорода в метаноле.
ж) К раствору 24 г 21-бромстероида VII в 600 мл ацетона нри неремешпвании при комнатной температуре прибавляют по каплям 17 мл хромовой кислоты (смесь 26,7 г трехокиси хрома и 23 мл копцентрированной серной кислоты разбавляют водой до объема 100 мл) до появления легкого янтарного цвета. Затем смесь перемешивают в течение получаса при комнатной температуре, жидкость слнвают с нерастворимого зеленого твердого
вещества, которое смешивают с минимальным количеством воды для растворения неорганических солей, и затем прибавляют при перемешивапии обратно к раствору ацетона. Через 5 мин смесь медленно разбавляют водой до
объема 1,8 л, охлаждают на льду и отфильтровывают кристаллический дикетоп, тщательно промывают его водой i высушивают в вакууме при 60°С в течение 24 ч. получают 21бром - 17ct - ацетокси - 16а - метил - 5а, 6,6 трифторпрегнан - 3,20-диоц VIII (23,68 г, выход 98%). ЯМР (CDCU - ТМ5), при 60 мгц, гц: 233(5, 2, СОСНоВг), 130(5, 3, ОАс), 71, 73(d, 3, С--19 СНз), 57, 50 (d, 3, С-16 СНз), 49(5, С-18 СНз). Идентичное соединение,
приготовленное в подобных условиях, имеет т , нл. 230-234°С.
з) Смесь 35 г ацетата натрия, 500 мл ледяной уксусной кислоты, 25 г ацетата серебра, 2,5 мл воды и 25,6 г дикетона IV нагревают с
обратным холодильником в атмосфере азота и в темноте в течение 1 ч. Нолученную черную смесь охлаждают и отфильтровывают для удаления солей серебра, фильтрат концентрируют в вакууме для удаления большей части
уксусной кислоты. Вязкую массу твердых веществ Н уксусной кислоты смешивают с водой (2 л) 11 отфильтровывают. Выделенный стероид промывают водой и растворяют в этилацетате. Отфильтрованные соли серебра тщательно промывают этилацетатом, и объединенные этцлацетатные растворы промывают взятыми в избытке насыщенным раствором бикарбоната иатрия и насыщенным раствором хлористого натрия, высушивают и выпаривают. Остаточное твердое вещество в бензоле наносят на «Флорнзил (0,45 кг) и элюируют сначала гексаном, затем смесью 20%-ного ацетона в гексане. и получают после кристаллизации из ацетона и промывания небольшим количеством холодного ацетона бесцветные иглы 6,6 - днфтор - 17а - оксн - 21 - ацетокси 16а - метилпрегн - 4 - ен-3,20-циона Х (13,8 г, выход 64%). ЯМР (CDCls, IMS) при 60 мгц; гц: 377, 373(d, 1. С-4 винил), 295, 291 (d, 2, СН, ОАс), 128(3, С-21 ОАс), 76, 74 (d, 3, С-19 СНз), 58, 51 (d, 3, С-16 СНз), 48(5, 3, С-18 СНз). Идентичное соединение, приготовленное в подобных условиях, имеет т. нл. 213-215°С. УФ (Et ОН) 228(12,400); ИК (CHCla), 2,78, 2,87, 3,37, 3,47, 5,73, 5,79, 5,93. Найдено %: С 65,85; И 7,48. С24Нэ2Р2С)5Вычислено, %: С 65,6; М 7,35. и) 7,05 г (5 моль) карбоната калия и 100 мл воды обрабатывают 425 мл метаиола и затем 250 мл тетрагидрофурана, иагревают е обратным холоди.тьником при нронускании азота в течение I ч, охлаждают до комнатной температуры в атмосфере азота, и обрабатывают 21-аиетатом IX (21, 95 г, 50 моль). Смесь перемешивают под азотом в течение 2 ч нри комнатной температуре. Прозрачный желтый раствор подкисляют 5 м;г ледяной уксусной кислоты и концентрируют в вакууме приблизительно до 200 мл, оетаток смешивают с водой и экстрагируют 600 мл хлористого метилена. Экстракт нромывают последовательно 5%-пым раствором бикарбоната натрия и насыш;енным хлористым натрием, высушивают Na2SO.i и концентрируют приблизительно до 300 мл. Затем медленно нрибавляют горячий никлогексан к кипящему хлористому метилену, и смесь концентрируют до объема 200 мл при нродолл ительио1М кипении и сильном перемешнвании. После охлаждения до комнатной температуры и фильтрования получают 6,6-цифтор - 17а - 21 - днокси - 16а - метнлпрегн - 4 - ен - 3,20 - дион X (17,2 г). Путем концентрации маточного раствора приблизительно до 75 мл выделяют дополнительно 1,8 г вещества X. Общий выход 96% носле сушки в течение ночи нри комнатной температуре в вакууме. В полученном таким образом соединении X содержится около 1-3 моль циклогексана па 1 моль стероида. После нагревания соединение X имеет т нл 202-207°С. ЯМР (CDCla, IMS) при 60 мгц, гц: 380, 376(d, 1, С-4 винил), 293, 274, 266, 245 (два дублета А, В, 2, СОСПзОП), 87(5. 3, 78, циклогексан), 76, 74 (d, 3, С-19 СНз), 60, 53(d, 3, С-16 СНз), 48(5. 3, С-18 СН.ч) Найдено, %; С 68,62; Н 8,13; F 8,62. С22НзоР2О4- 1/ЗСбН 2. Вычислено, %; С 68,7; Н 9,90; F 8,95 УФ (EtOH) 228(12500, иснравленное для 1/3 моль цнклогексана), ИК(СНС1з) 2,78, 2,89, 3, 41, 3,48, 5,96, +1°(с 0,5 CHCla). Найдено, масс-спектр: 396, 2118. Вычислено, масс-спектр: 396, 2112. к) Стероид X микробиологически гидроксилируют с номощью культуры Curvularia и получают 6,6 - дифтор - lip, 17а, 21-триокси16а - метилпрегн - 4 - ен - 3,20 - дион XI, т. нл. - 220°С. 5 И) 15 20 25 30 35 40 45 50 55 60 65 л) Стероид XI микробиологически дегидрируют с помощью Arthrobacter simplex, получают 6,6-дифтор-1 ip, 17а, 21-триоксн-16а-метилнрегна-1,4-диен-3,20-дион XII, т. пл. -228°С. УФ (EtOH) 238(14,600). м) Триол XII (I г) в сухом пиридине (15 мл) в атмосфере азота охлаждают на ледяной бане и добавляют уксусный ангидрид (1 M.i). Смесь перемешивают в течение ночи и затем выливают в воду (200 мл), перемешивают в течение получаса и отфильтровывают осадок, нро.мывают водой, сушат нри 00°С в вакууме и нолучают 6,6-дифтор-1 ip, 17а-диоксн-21-ацетокси-1 бо. - метилнрегна - 1,4 - дие1Г 3,20 - дион XIII (0,96 г), т. пл. 230-232°С. н) 0,959 г ацетата XIII и 0,375 г нерекристаллизо1занпого Л -бромацетамида в 11 мл сухого пиридина (выход продукта реакции зависит от степени сухости пиридина) перемешивают при комнатной температуре в течение 30 мин. затем охлаждают примерно до 10°С и добавляют иебольп.юй избыток двуокиси серы, затем по канлям прибавляют 35 .мл воды и смесь выдерживают нри 5°С в течение ночи, фильтруют, про.мывают водой и сушат. Получают белые кристаллы 6,6-дифтор-17а - окси21 - сцетокси - 16а - метилпрегна-1, 4, 9 (11) триен - 3,20 - диона XIV (0,769 г, выход 84%, т. пл. 151-163°С). ЯМР (CDCla) нри 60 мгц, гц: 345(2, d, 1 5 гц. С-11); ТСХ (силикагель. 2: 1 CHCla -эфир), Rt 0,30. о) 1,07 г (2,5 моль) триена XIV в 50 мл диоксана, на содерл ан1его нерекиси, и 1,7 мл 0,5 н. хлорной кнслоты прибавляют ностененно к 0,7 г (5,5 моль) Л-бромацетамида и кристаллизуют из хлороформа-гексана в течение 1 ч. Через 2 ч при комнатной температуре добавляют небольшой избыток водного бикарбоната натрия и реакционную смесь экстрагируют хлористым метиленом. Органический слой нромывают 5%-ным бикарбонатом натрия, высушиварот, вынаривают и в результате нолучают стекловидное вещество (1,44 г). Последнее, как было ноказано ЯМРснектросконией и ТСХ, включает 70% 9абром-6,6 - дифтор - Пр, 17а - диоксн-21-ацетокси-16о..-метилнрегна - 1,4 - диен - 3,20 - диона XV и 20% неизменного вещества XIV. Повторная обработка дает стекловидное вещество, содержащее около 90% 9-бром-11-оксистероида. Это стекловидное вещество растворяют в этаноле н выпаривают досуха перед тем, как перейти к следующей стадии, п) 0,94 г бромгидрина XV (9-бром-П-оксистероид) и 1,5 г сухого ацетата калия в 50 мл этанола нагревают с обратным холодильником в течение 1 ч, затем мл растворителя отгоняют нри атмосферном давлении. Смесь охлаждают на льду и по каплям добавляют 75 мл воды. Твердое вещество отфильтровывают, промывают водой и высушивают при 76°С/0,1 мм рт. ст., в результате нолучают неочищенный 6,6-дифтор-9р, 1 lp-эпoкcи-17a-oкcи - 21 - ацетокси - 16а - метилнрегна - 1,4 диен-3,20-днон XVI (758 мг, выход 95%). По9
следующей кристаллизацией из хлористого метилена-метанола выделяют 499 мг соединения XVI ст. пл. 211-222°С.
Найдено, масс-снектр: 450, 1853.
С24Н28Ь2Об.
Вычислено, масс-спектр: 450, 1854.
В ЯМР-снектре при 94 гц (при 60 мгц) регистрируется острый сииглет, соответствующий метилу С-19, что отличает его от спектров всех других подвергнутых анализу 6,6-дифторстероидов, например 9а-гало-1 lp-олов и 9,11диенов. В их ФЛ Р-сиектре С-19 метилу отвечают дублеты.
Хроматография на «Силикар СС-7 маточных растворов, получаемых кристаллизацией вещества XVI, дает при элюировании гаксаном-хлороформом (1:2) 80 мг соединения XVI, при перекристаллизации которого из метанола получают 39 мг вещества XVI с т. пл. 211-218° С. Общий выход кристаллического соединения XVI 62%.
р) 10 мл смеси фтористого водорода и мочевины из 300 г мочевины и 400 г сухого фтористого водорода в полиэтиленовой бутыли обрабатывают 478 г эпоксида. Реакционную смесь перемеп1ивают при комнатной температуре в течение 3 ч, затем выливают в 35 мл концентрированной гидроокиси аммония, охлажденной льдом, экстрагируют хлористым метилеиом, промывают экстракт водой и выпаривают растворитель. Получают 483 мг сырого продукта, который растворяют в 5 мл хлороформе, обрабатывают 2 каплями уксусного ангидрида и одной каплей пиридина, слегка подогревают и пропускают через колонку «Силикар СС-7 (100 г), с использованием в качестве элюанта смеси этилацетата с хлороформом (1 :9). Кристаллизация из ацетона-циклогексана дает 320 мг 6, 6, 9а-трифтор - Пр, 17а - диокси-21-ацетокси-16а-метилпрегна - 1,4 - диен - 3,20 - диона XVII, выход 64%, т. пл. 227-231°С, гомогеппый по тех на силикагеле (CHCls - эфир, 1:1); УФ (ЕЮН) 233 (14,400).
Найдено, масс-спектр: 470, 1903.
С24Н29РзОб.
Вычислено, масс-спектр: 470, 1916.
Н1--ЯМР (в CDCU) при 60 МГЦ, гц: 52,61 (3, d, 16-СНз), 61(3, S, ), 94,97(3, d, 19-СИз), 296(2, S, 21-СН2), 375, 378(1, d, С-4 винил) 385, 433, 440(2, d. С-1,2 винил).
Пример 2. Следуя общей методике примера 1, (м, р, ж) соединение XI последовательно превращают в 6,6-дифтор-11(3, 17а-диэкси - 21 - апетокси - 16а - метилпрегн - 4-ен120 - дион XVIII, т. пл. 215-218°С, далее в о,6-дифтор-17а - окси - 21 - ацетокси - 16а метилпрегпа - 4,9(11) - диен - 3,20 - дион XIX (выход -90%, т. пл. 207,5-208,5°С). В ЯМР-спектре (в CDCb) - два дублетных, винильных протопа при 335 и 375 гц (60 мгц), далее - в 6,6 - дифтор - 9а - бром - Пр, 17адиокси - 21 - ацетокси - 16а - метилирегн - 4 ей - 3,20 - дион XX (вы.ход , т. пл. 160- 180°С, разложение), далее в 6,6-дифтор-9р,
10
ПР - эпокси - 17а - окси - 21 - ацетокси - 16аметилпрегн - 4 - ен - 3,20 - дион XXI, т. пл. 215-220 С. В ЯМР-спектре (CDCb IMS) - острый синглет при 91 гц (60 мгц), соответствующий С-19 метилу, далее в 6,6,9а - триФТОР - Пр, 17а - диокси - 21 - ацетокси - 16осметилпрегн-4-ен-3,20-дион XXII, кристаллизуемый из метанола (выход , т. пл. 200- 203°С), и наконец, в 6,6,9а-трифтор-1 ip, 17а,
21 - триокси - 16а - метилпрегн - 4 - ен - 3,20 аион 1, кристаллизованный из ацетона-циклогексана, т. пл. 228-233°С; УФ(Е10Н), 233 (13,800). Последний подвергают реакции с хлористым пивалоилом в пиридине при комнатной температуре, и в результате после кр 1сталлизации из метанола получают 6,6,9а-трифтор - 11 р, 17а - диокси - 21 - пивалилокси 16(7, - метилпрегн-4-ен-3,20-дион, т. пл. 203- . гомогенный по ТСХ.
Найдено, масс-спектр: 514, 2520.
C27H27F3O6.
Вычислено, масс-снектр: 514, 2544. Формула изобретен и я
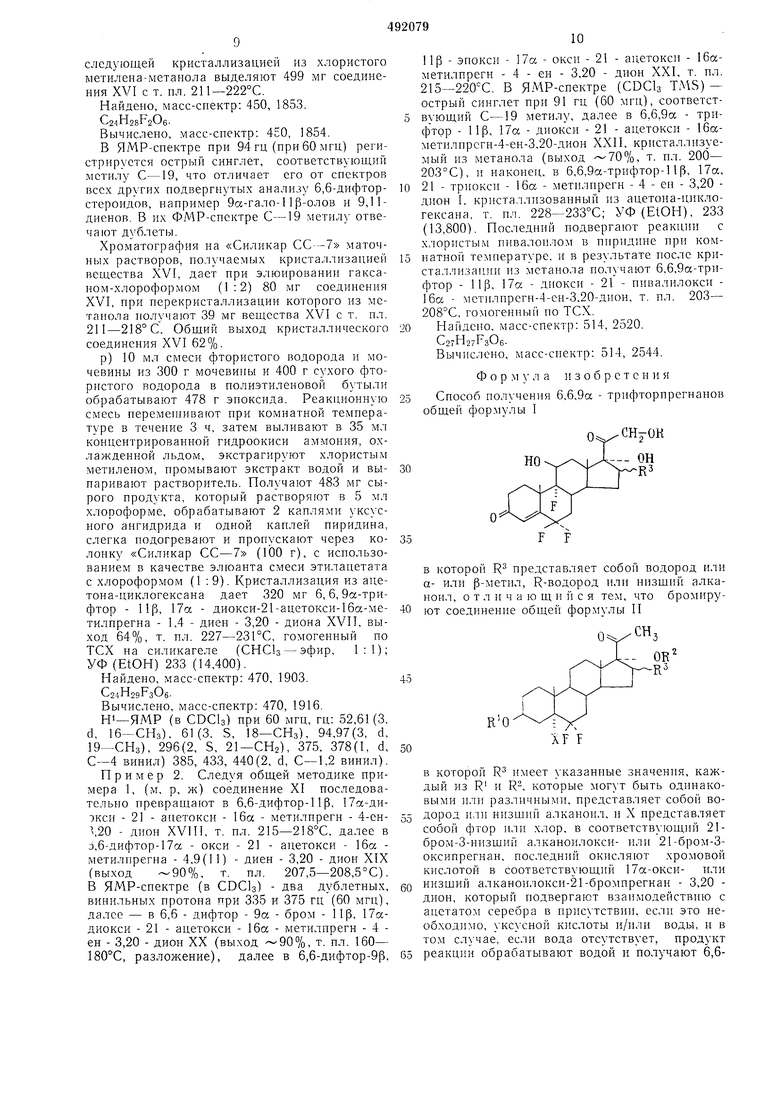
Снособ получения 6,6,9а - трифторнрегнанов общей фор.мулы I
30
35
в которой R3 представляет собой водород или а- или р-метил, R-водород пли низший алканоил, о т л и ч а IO щ н и с я тем, что бромируют соединение общей фор.мулы II
R5
45
RO
50
в которой R2 имеет указанные значения, каждый из R и R, которые могут быть одинаковыми или различными, представляет co6oii водород или низший алканоил, и X представляет собой фтор или хлор, в соответствующий 21бром-3-низщий алканоилокси- или 21-бром-Зоксиирегнаи, последний окисляют хромовой кислотой в соответствующий 17а-окси- или иизщий алканоилокси-21-бромпрегнан - 3,20 дион, который подвергают взаимодействию с ацетатом серебра в присутствии, если это необходимо, уксусной кислоты и/или воды, и в том случае, если вода отсутствует, продукт реакции обрабатывают водой и получают 6,611дифтор - 21 - ацетокси - 17а - оксипрегн - 4ен-3,20-дион, в котором по усмотрению гидролизуют 21-ацетоксигруппу, и подвергают полученное соединение микробиологическому окислению по Сц, и дегидратируют образую-5 щееся соединение в Д -стероид, взаимодейст12вием которого с бромиоватистой кислотой получают 9сс-бром-1 lip - оксистероид, последний обрабатывают основапием и образующийся при этом 9,11-эпоксид подвергают взаимодействию с фтористоводородной кислотой и выделяют целевой продукт известными приемами.




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 6,6-дифтор-11 , 16 ,17 -триокси -4 прегнен-3, 20-диона | 1972 |
|
SU438181A1 |
| СССРОпубликовано 28.XI 1.1972. Бюллетень N° 5за 1973Дата опубликования описания 30.VIII.1973УДК 547.6iS9.6.07(C.S8.8) | 1973 |
|
SU365067A1 |
| Способ получения гетероциклических соединений | 1975 |
|
SU659088A3 |
| Способ борьбы с нежелательной растительностью | 1988 |
|
SU1836021A3 |
| Способ получения октагидро- @ -бензо-(4,5)-фуро-(3,2- @ )-изохинолинов или их солей | 1979 |
|
SU1060114A3 |
| Способ получения @ , @ -дизамещенных ароматических и гетероароматических соединений | 1988 |
|
SU1750425A3 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ДЕГИДРО-6-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663893C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663484C1 |
| Способ получения изоксазолидино-(16альфа,17альфа-d)-стероидов | 1973 |
|
SU491625A1 |
| Способ получения сложных эфиров геста-гЕНОВ | 1977 |
|
SU797585A3 |


Авторы
Даты
1975-11-15—Публикация
1971-04-22—Подача