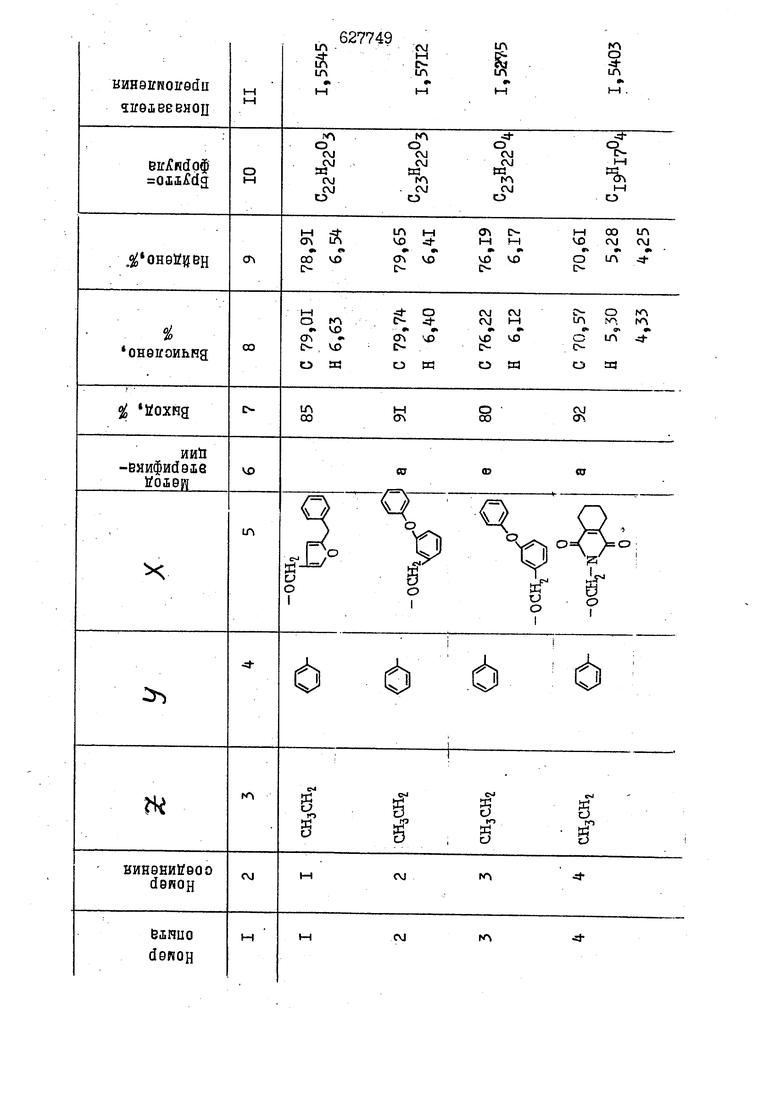
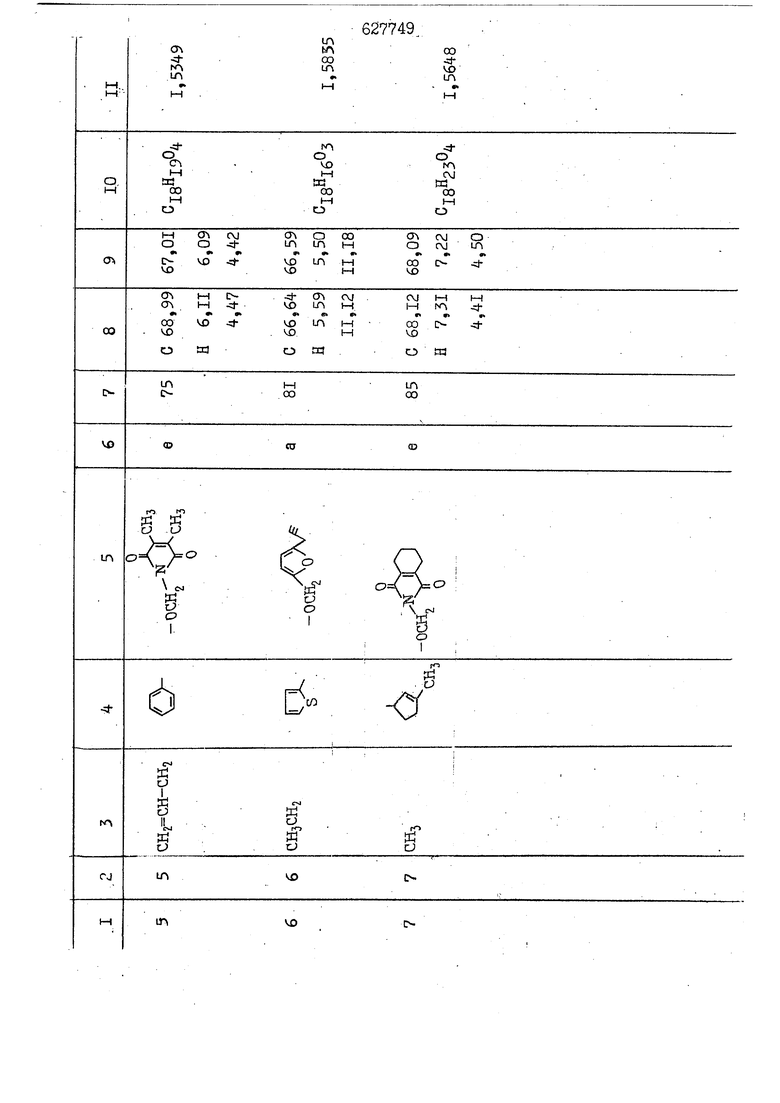
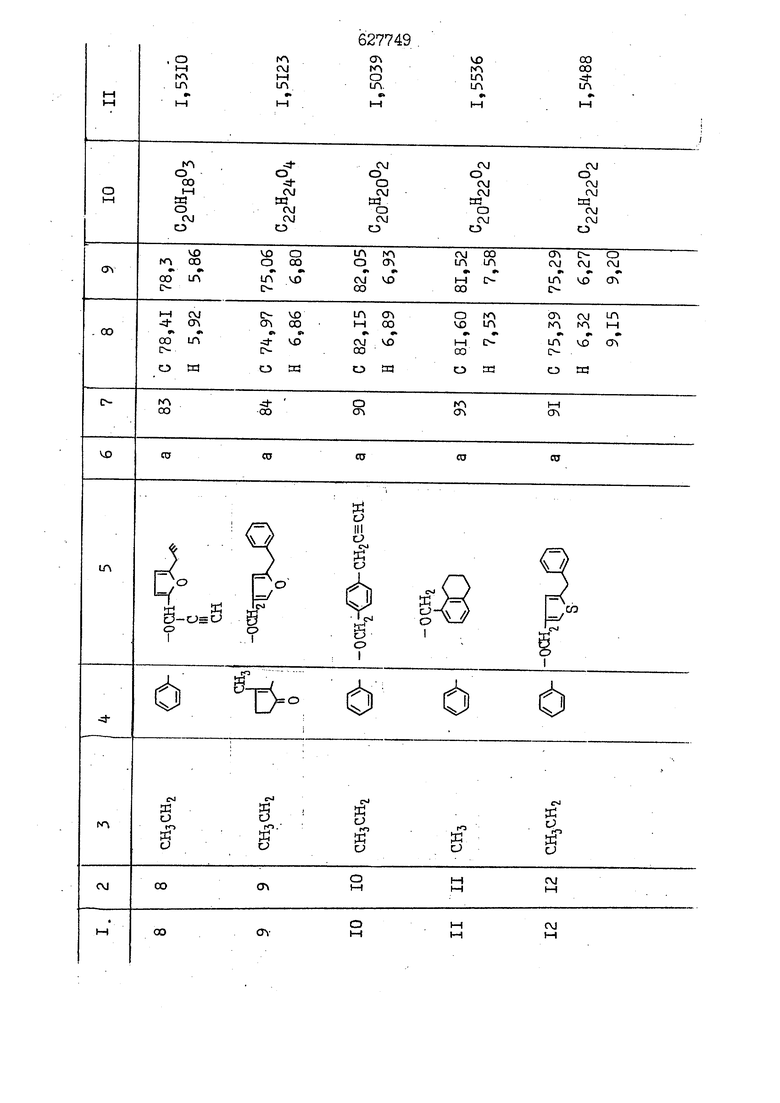
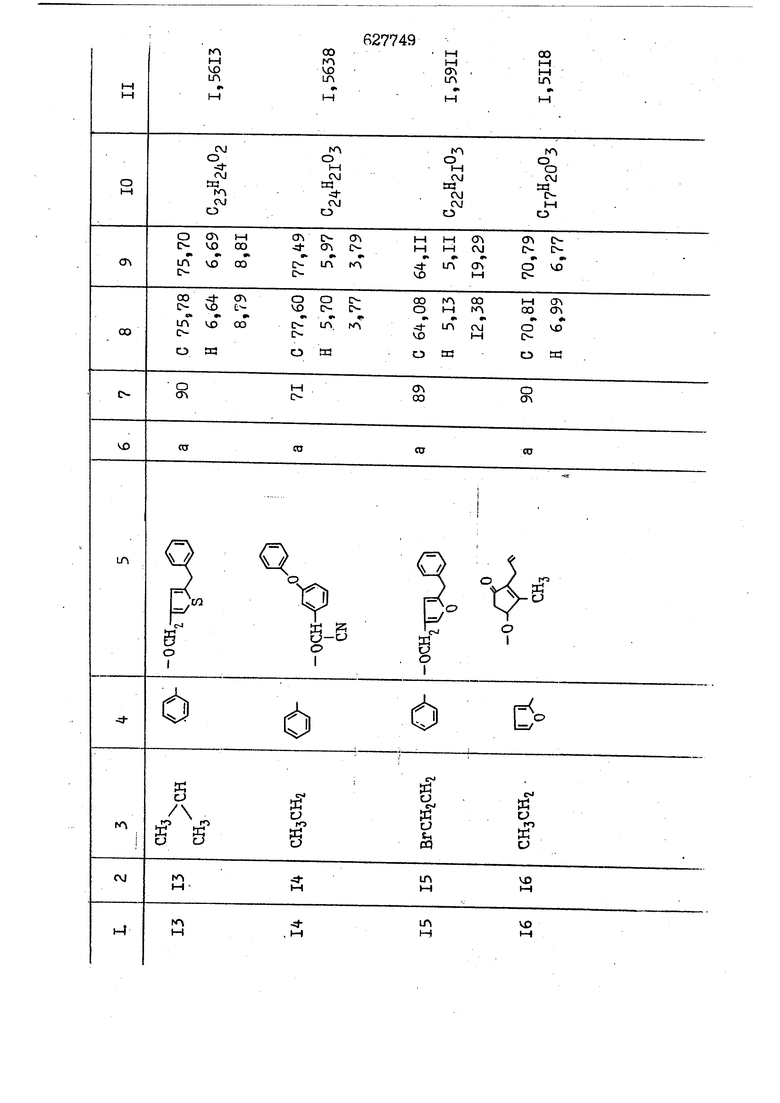
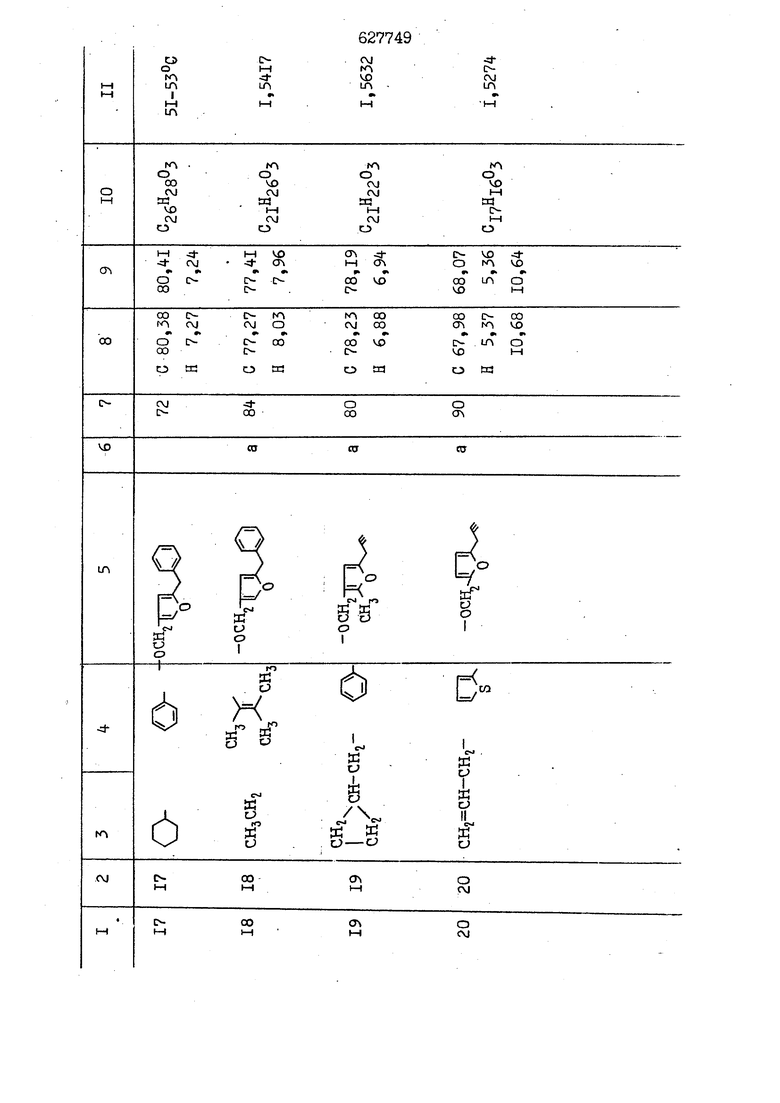
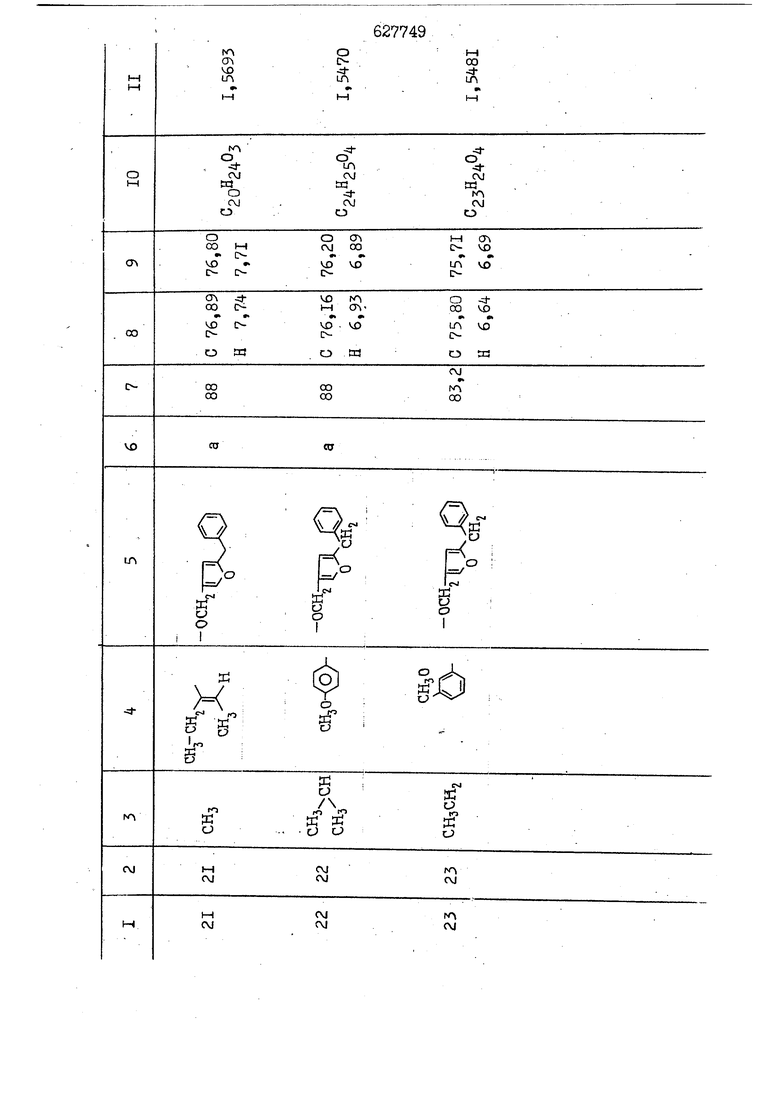
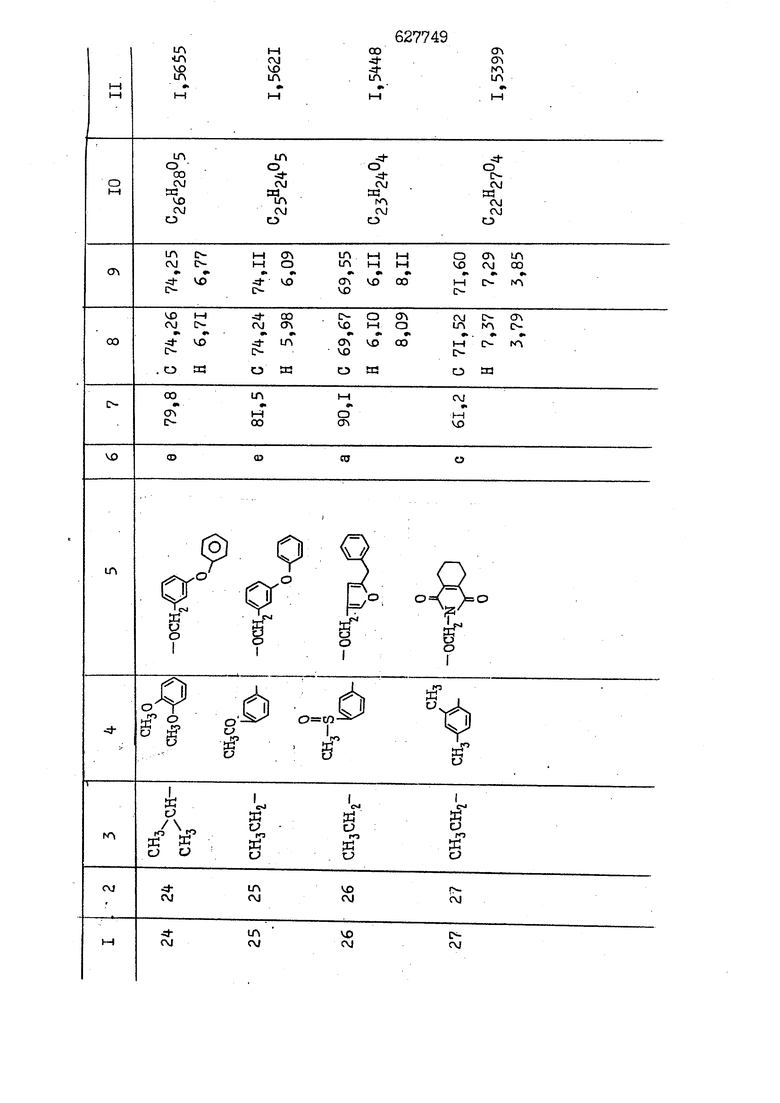
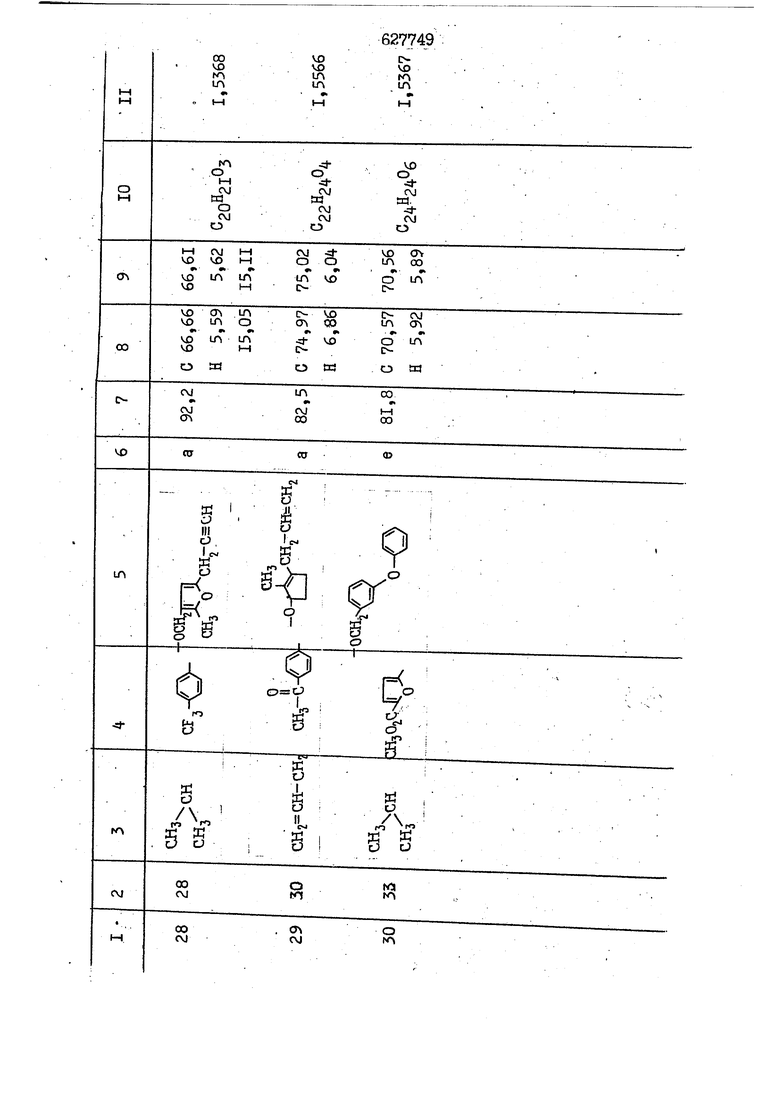
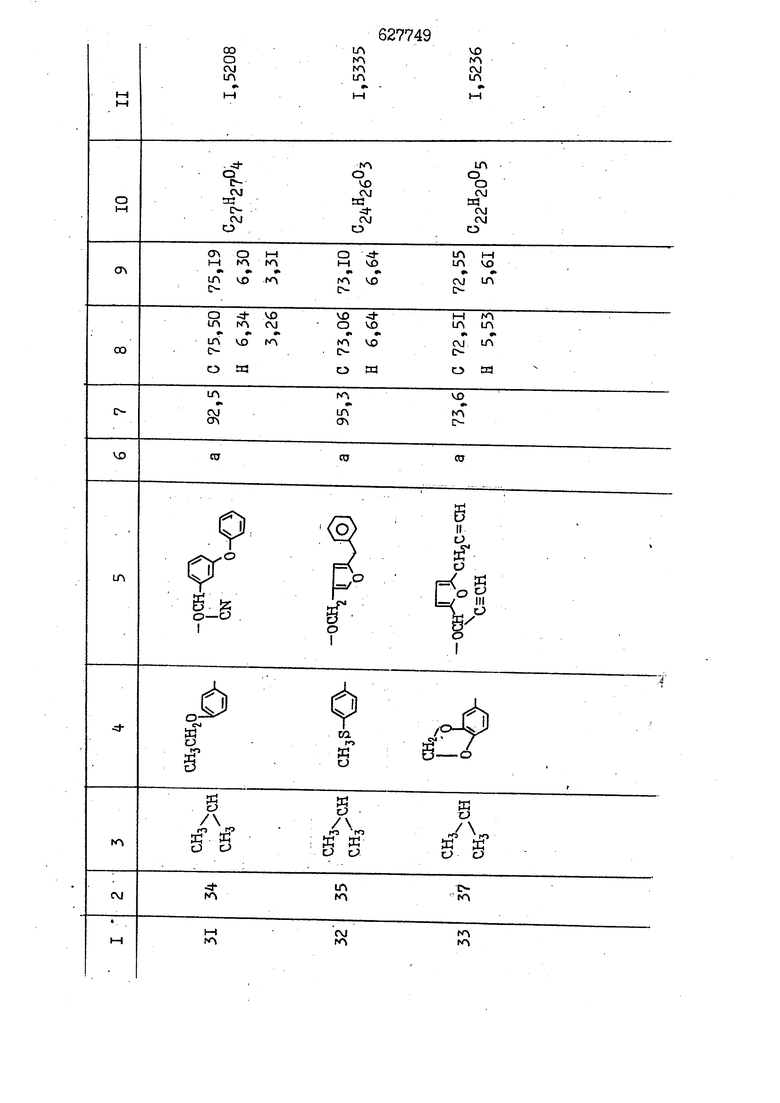
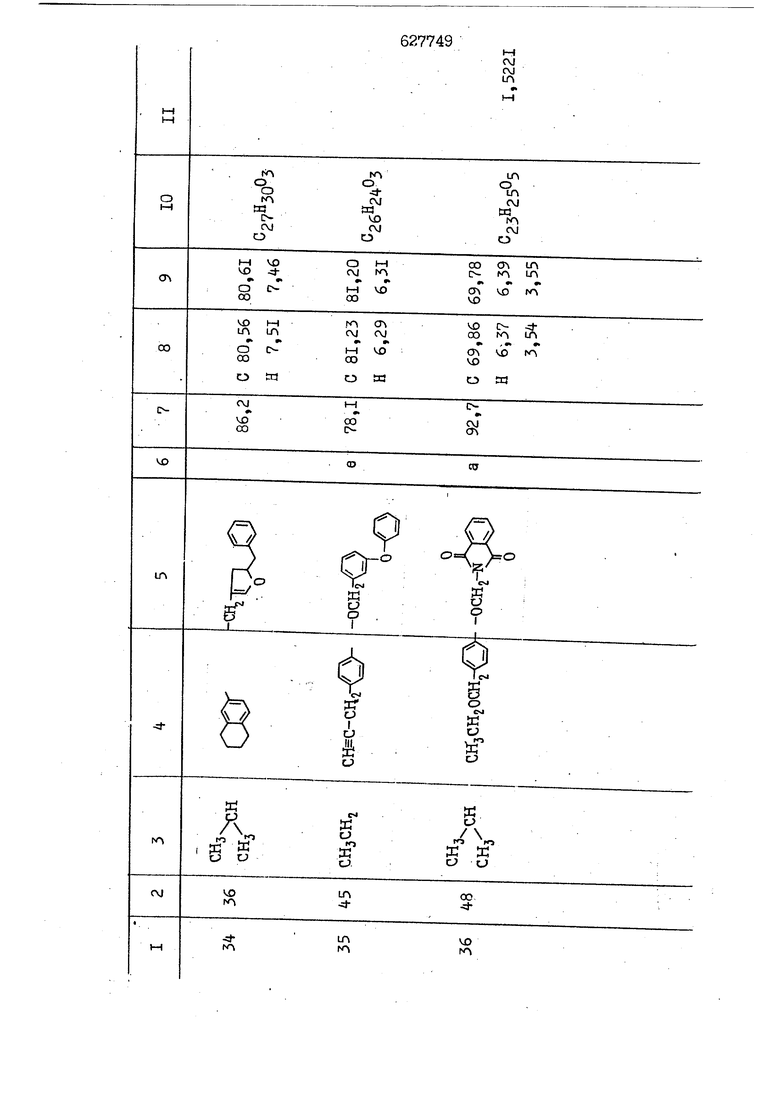
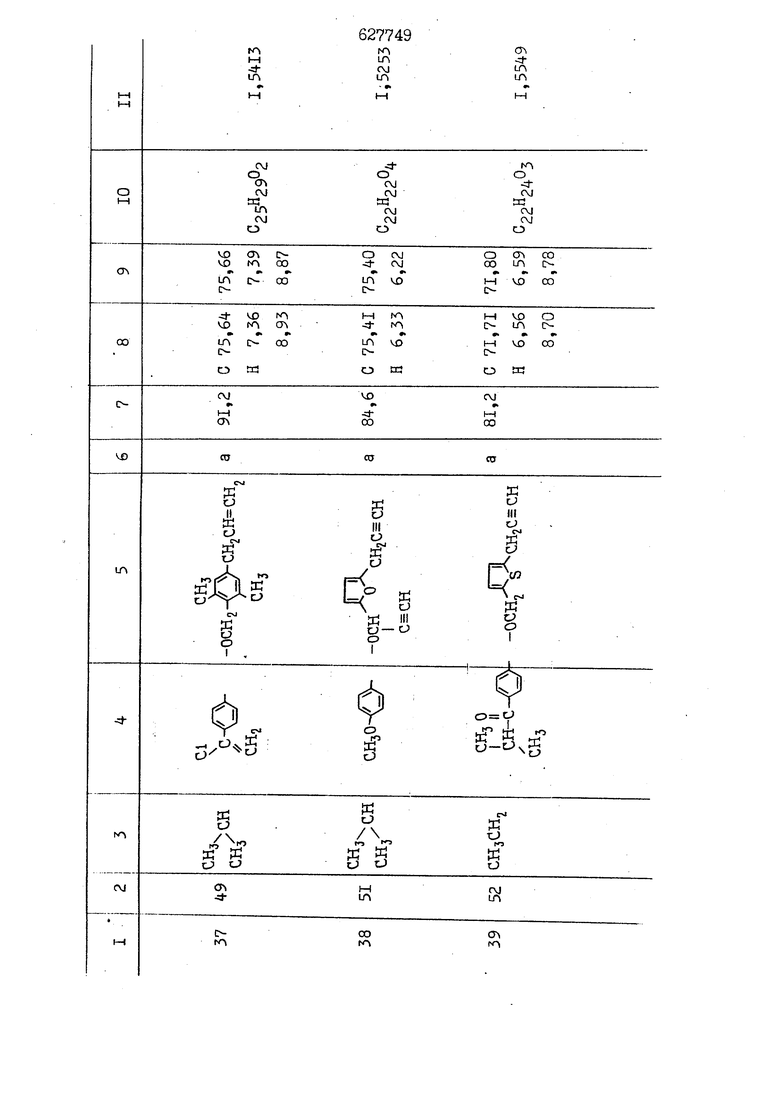
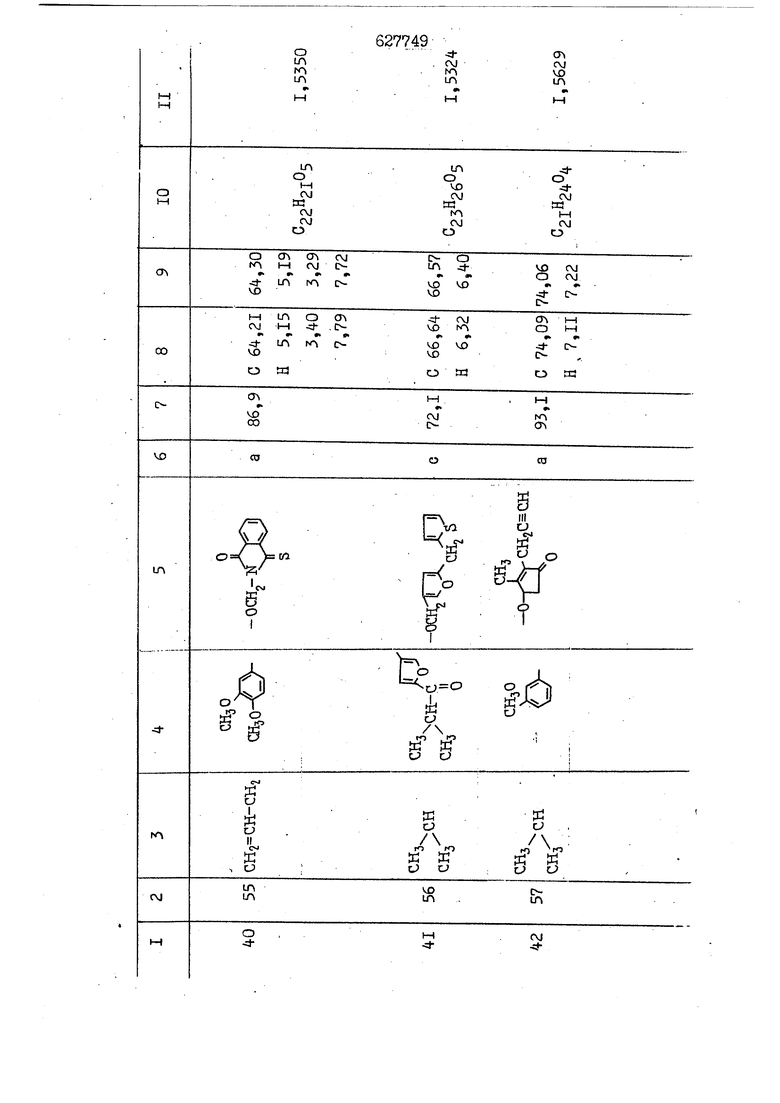
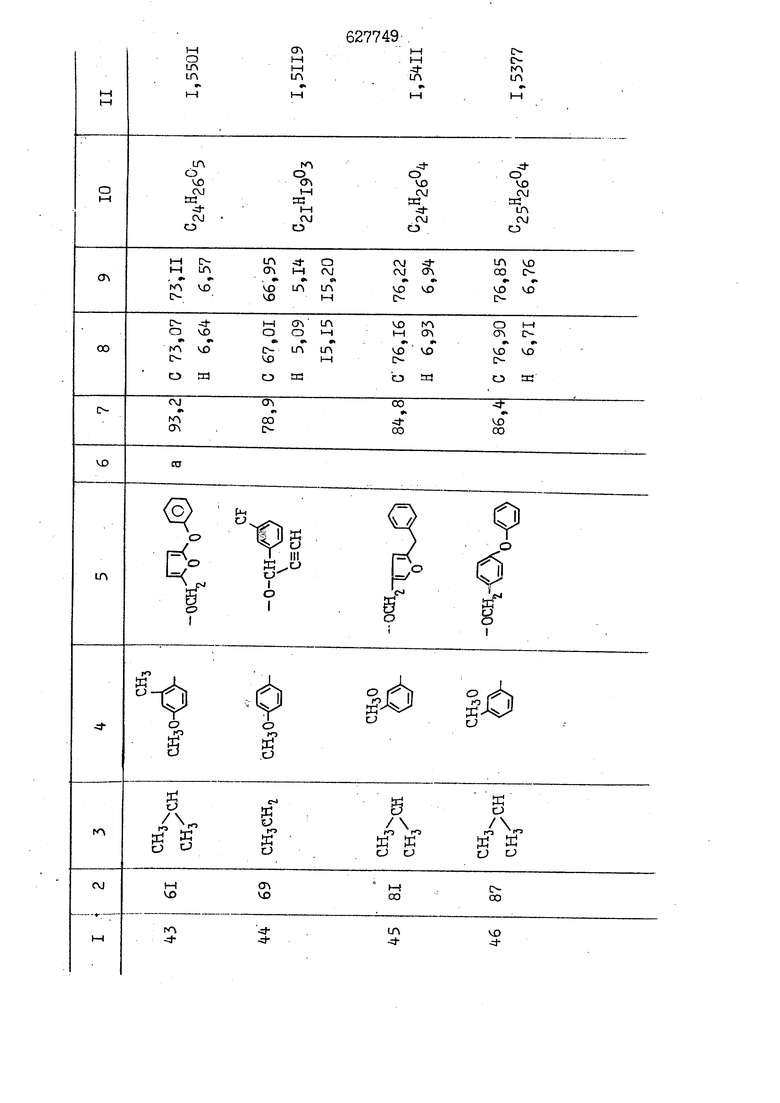
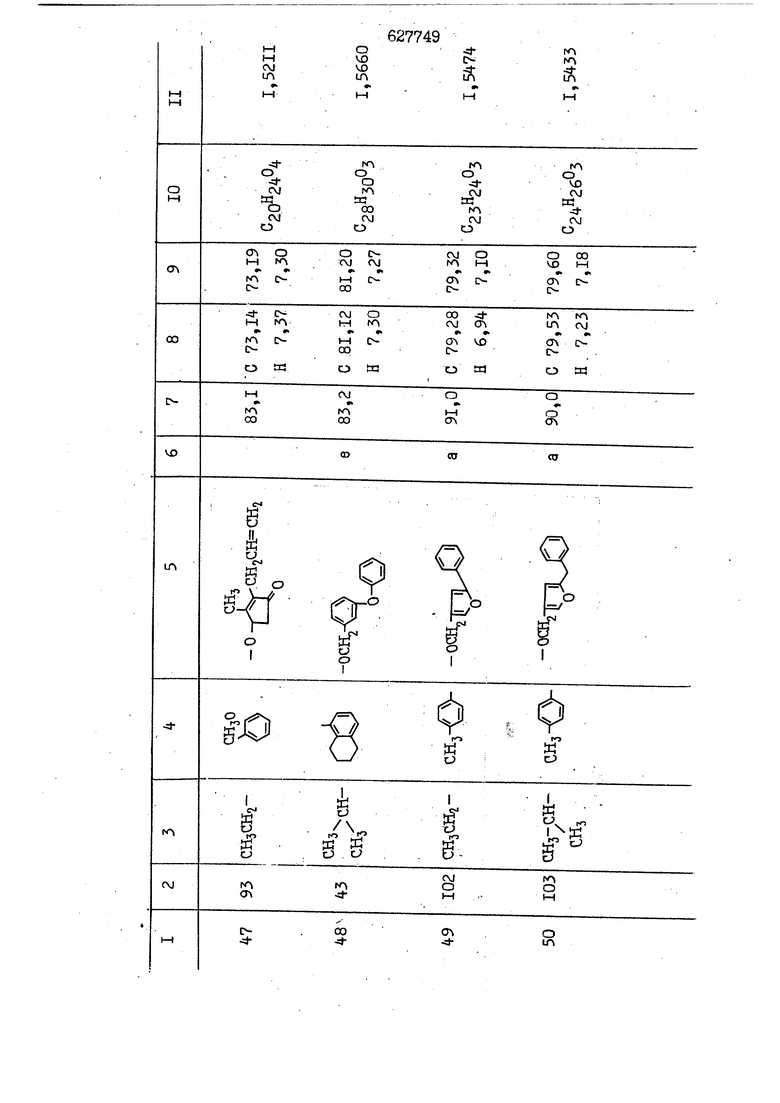
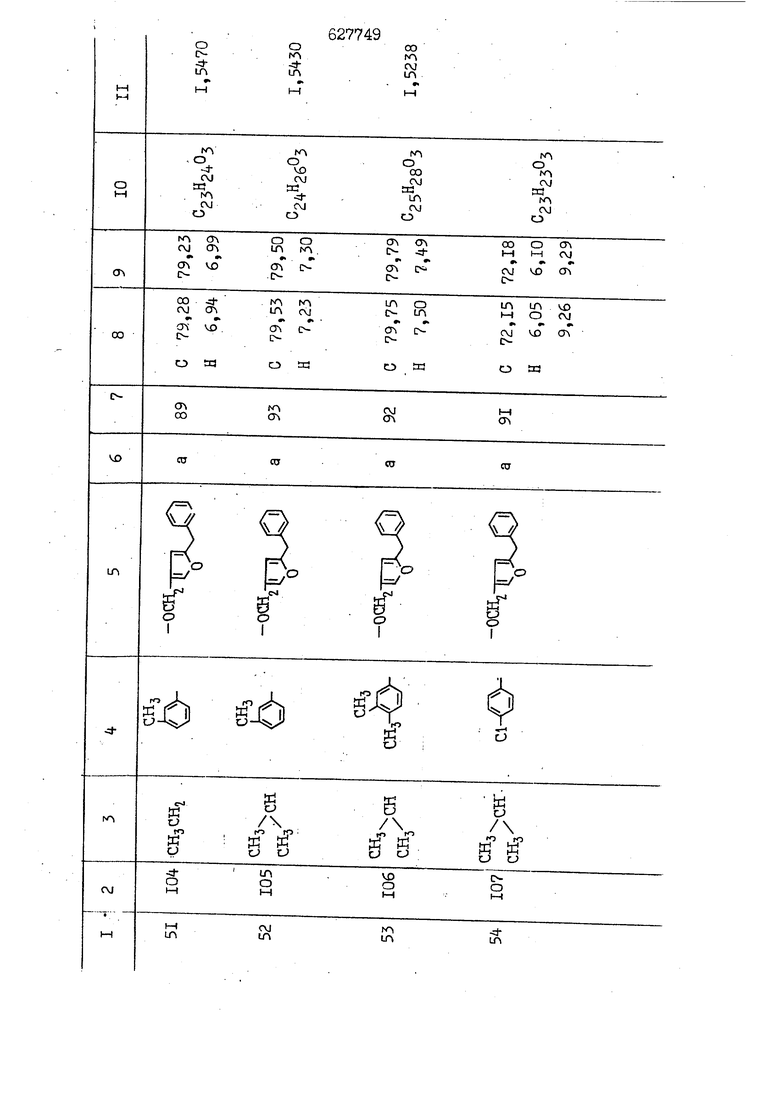
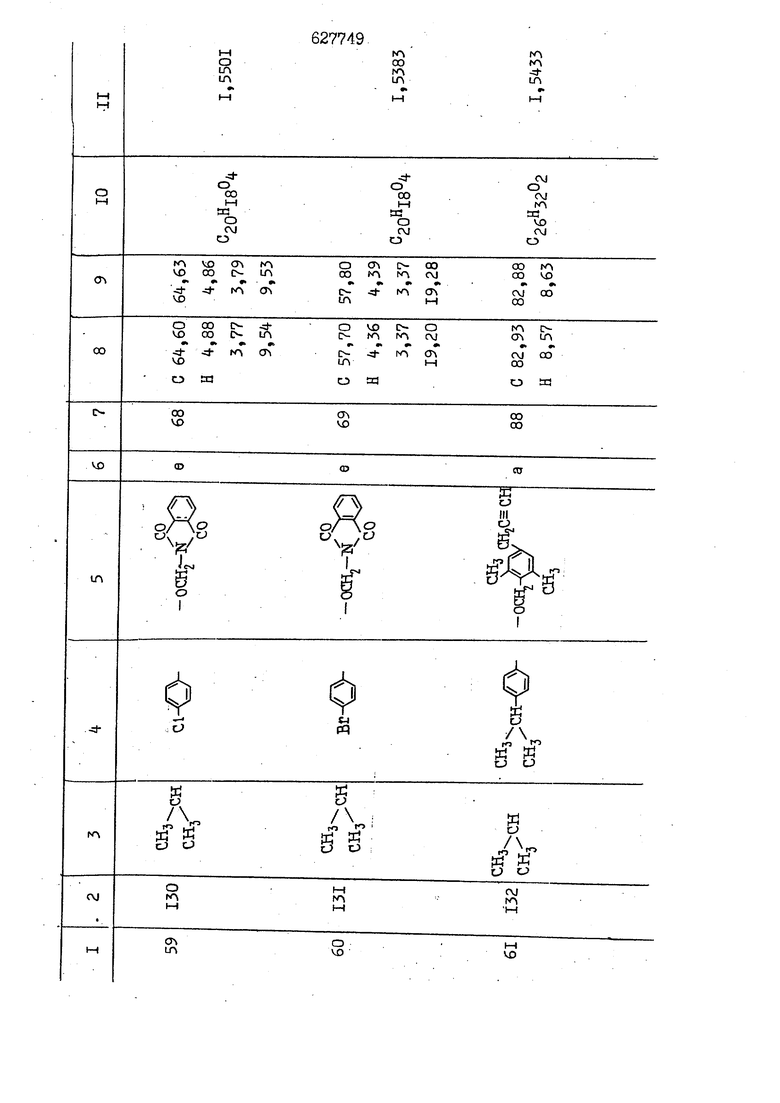
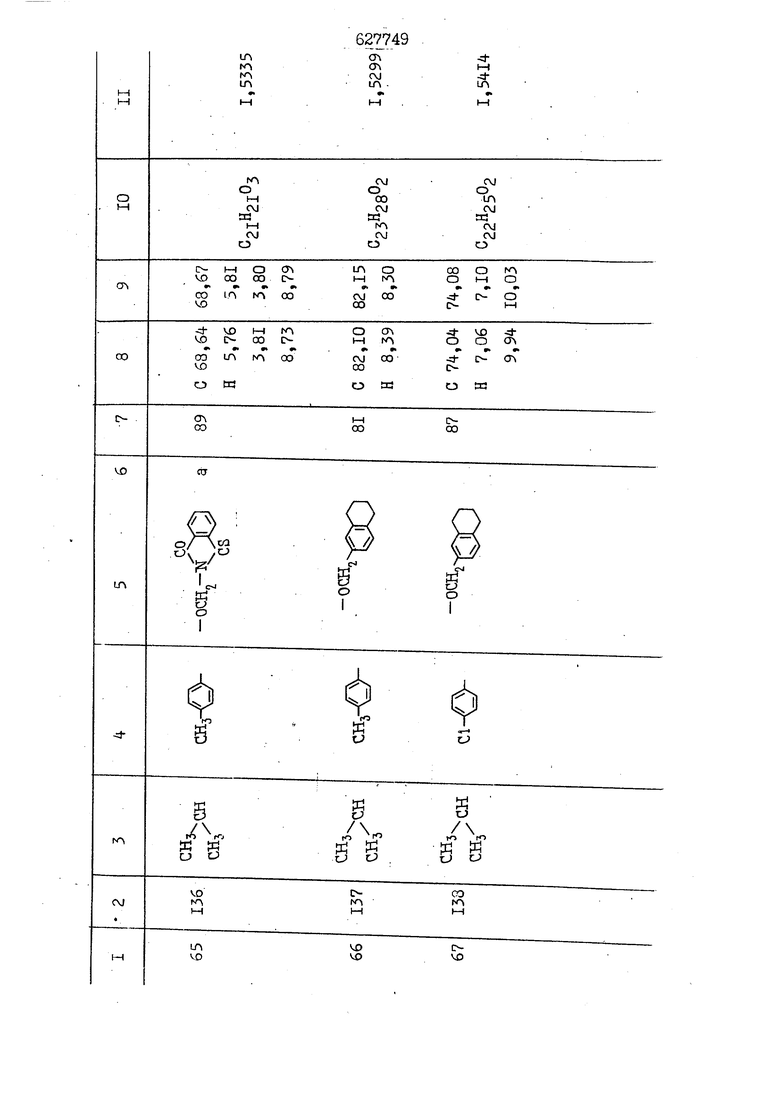
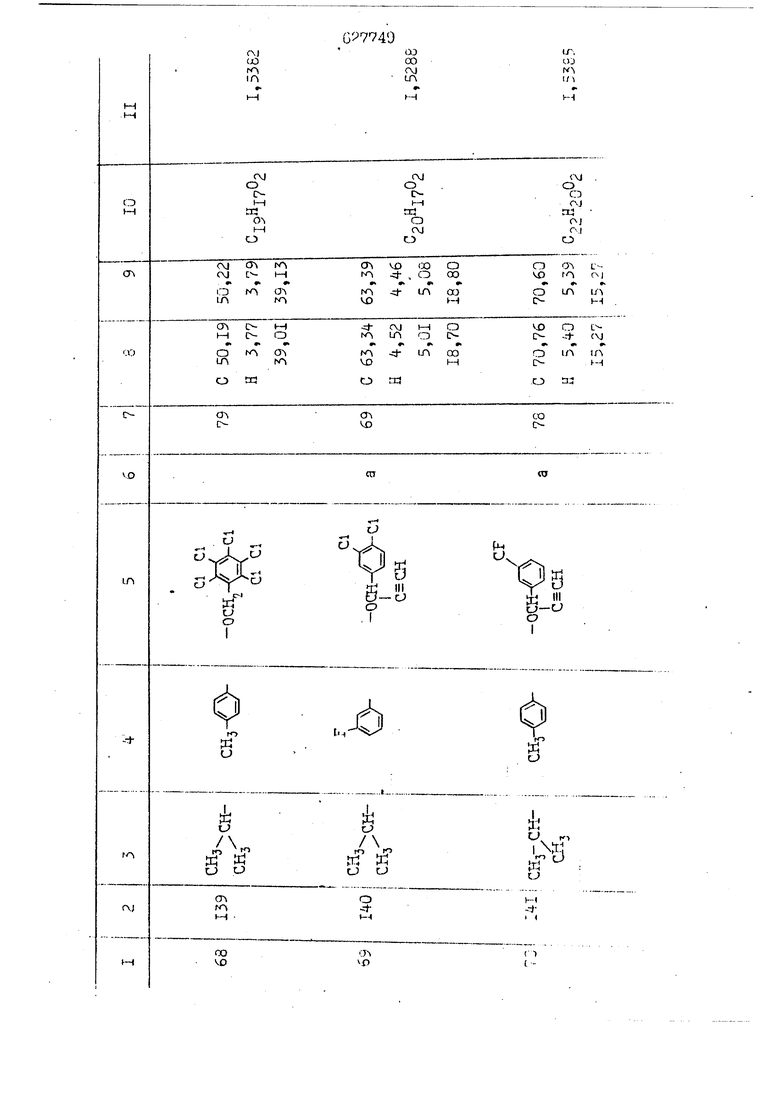
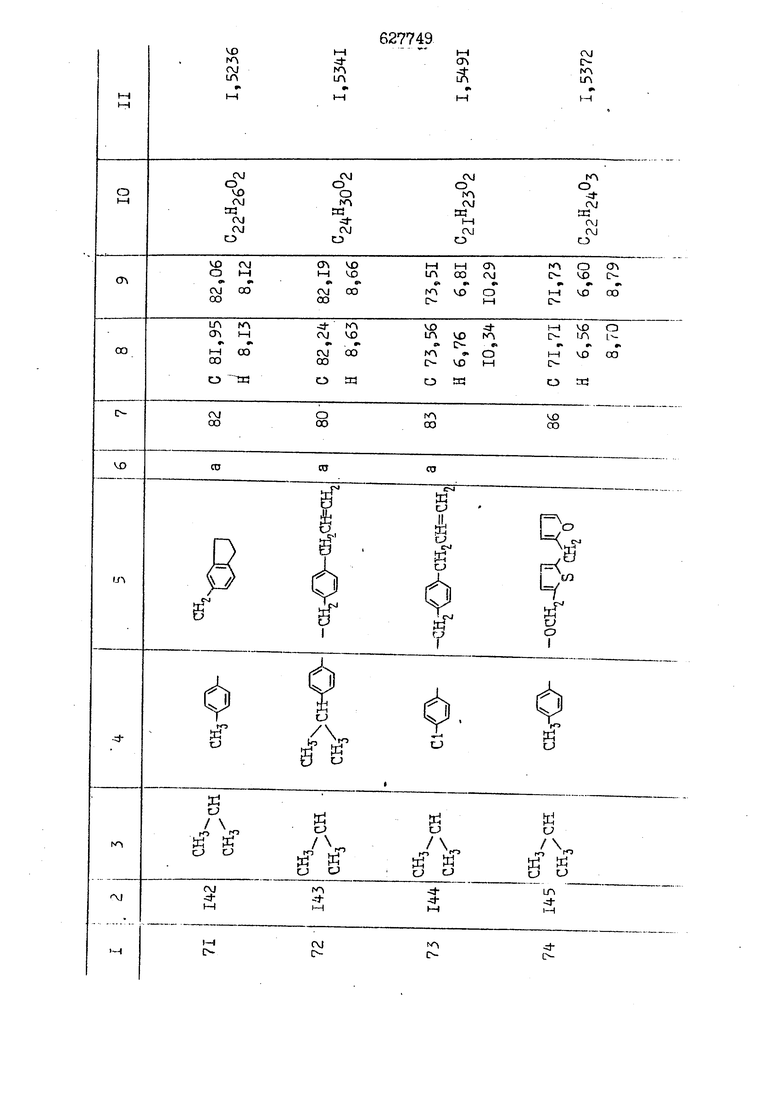
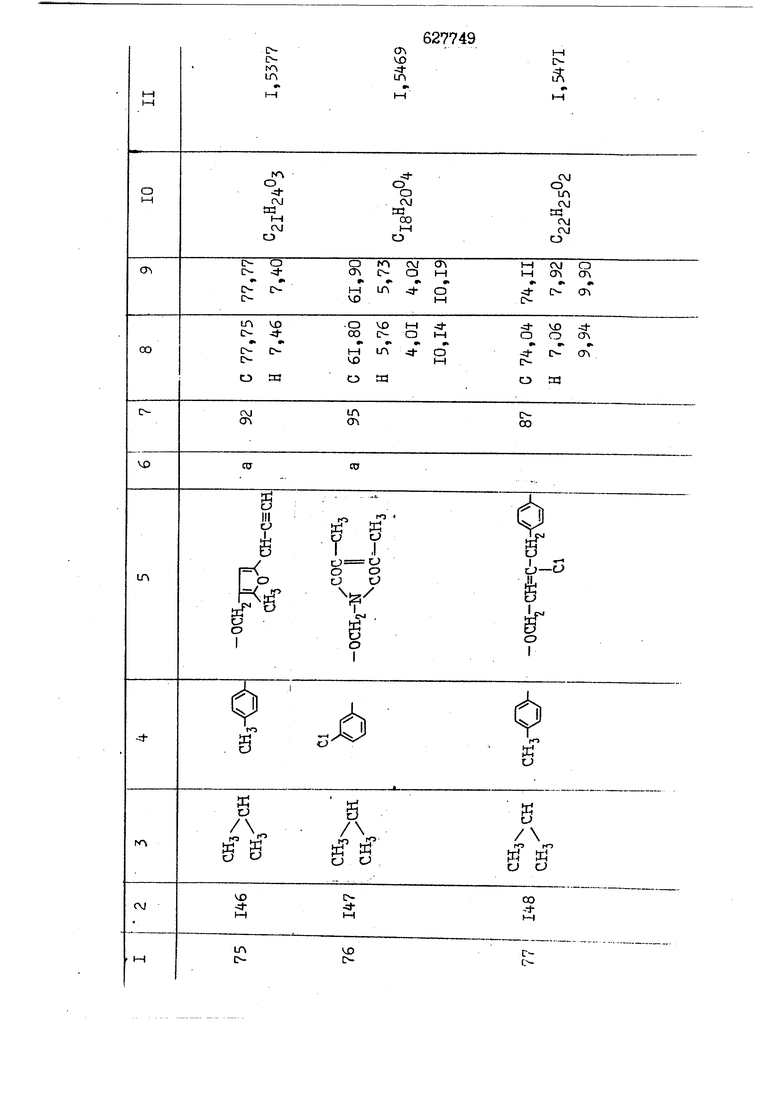
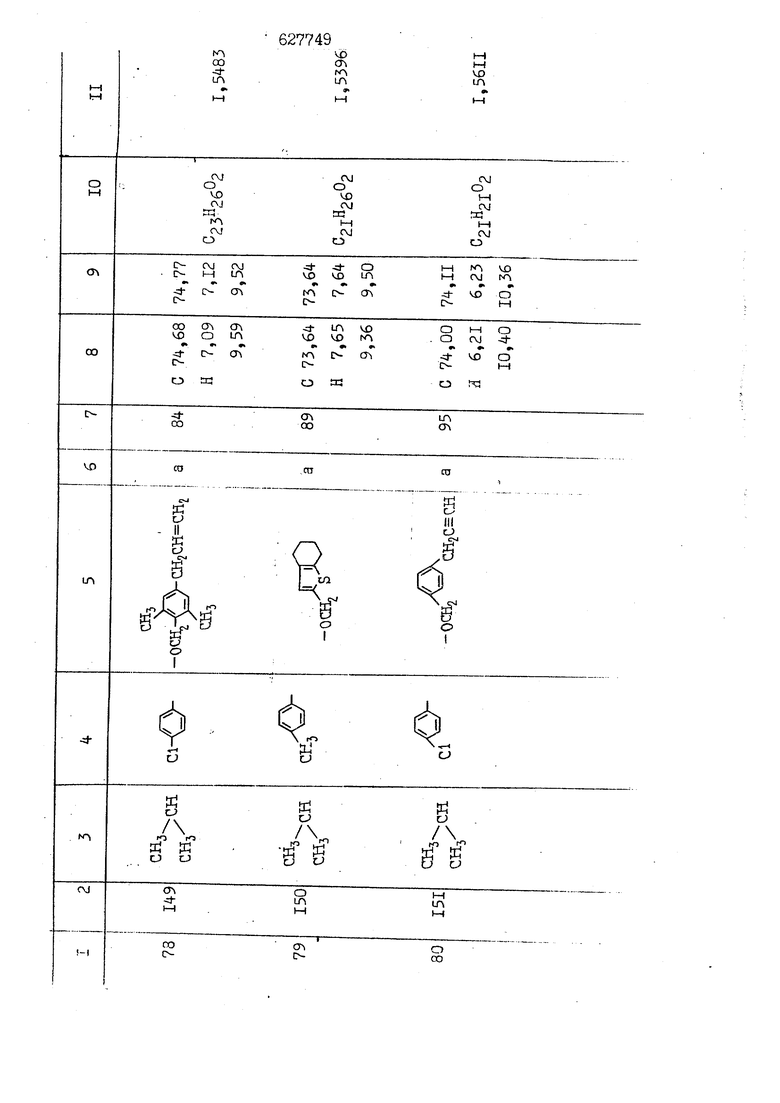
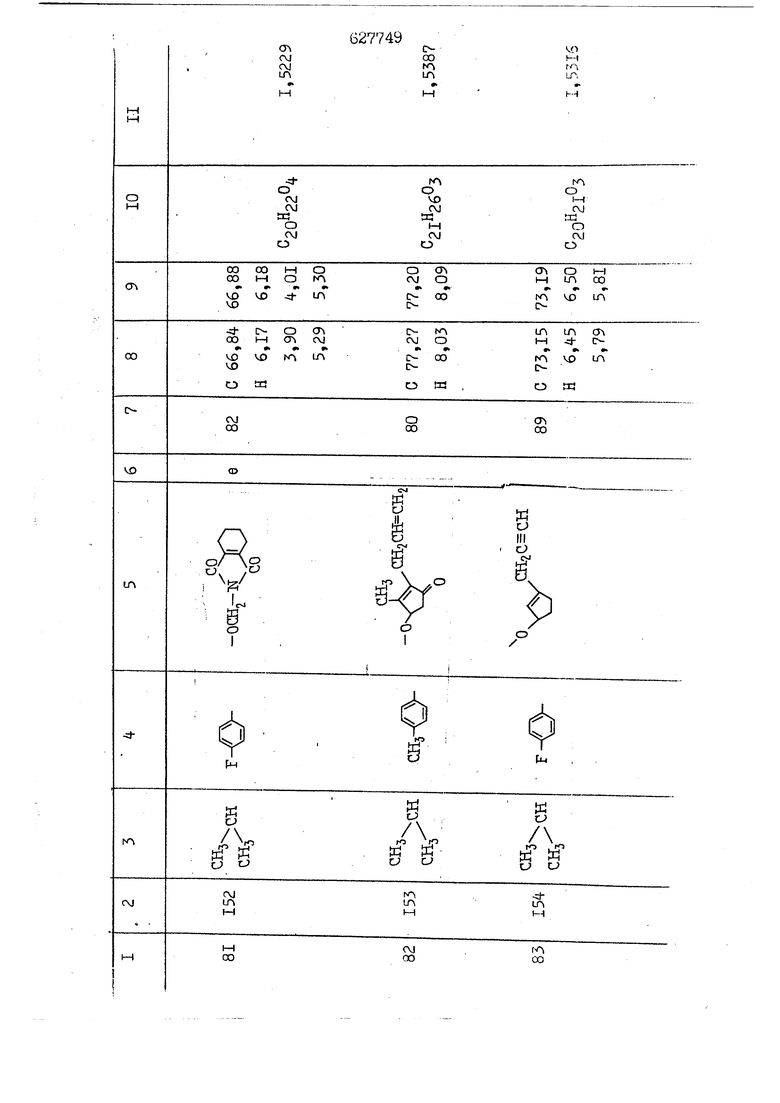
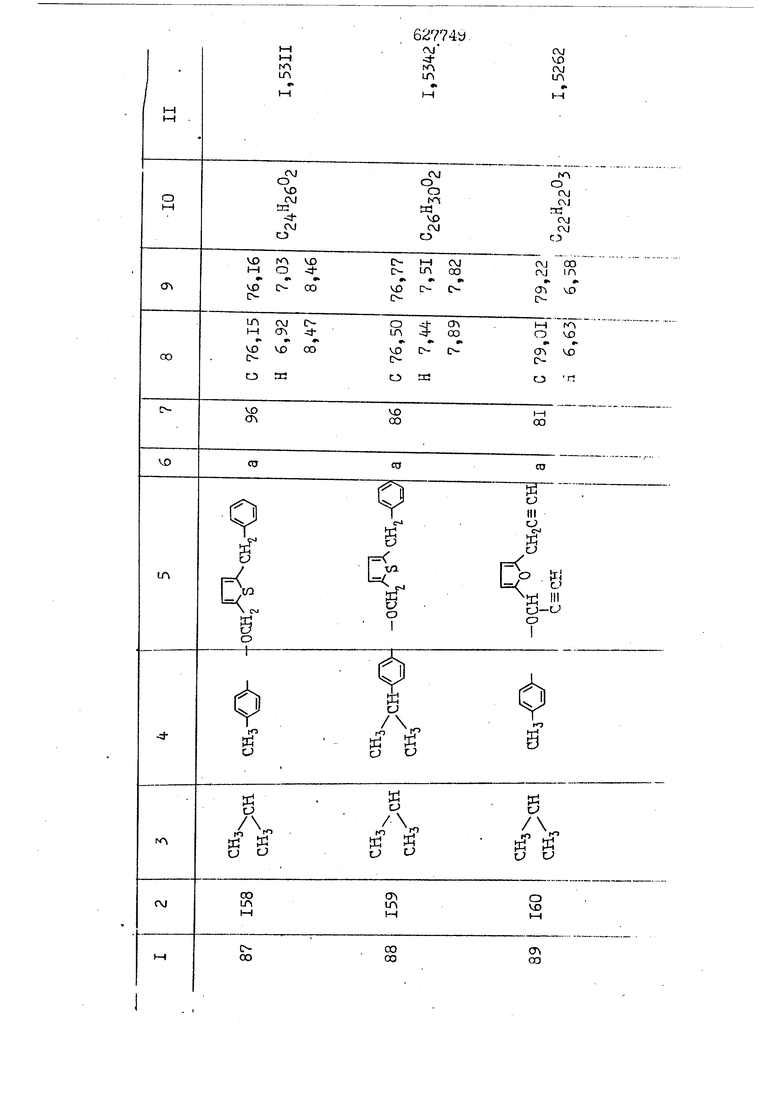
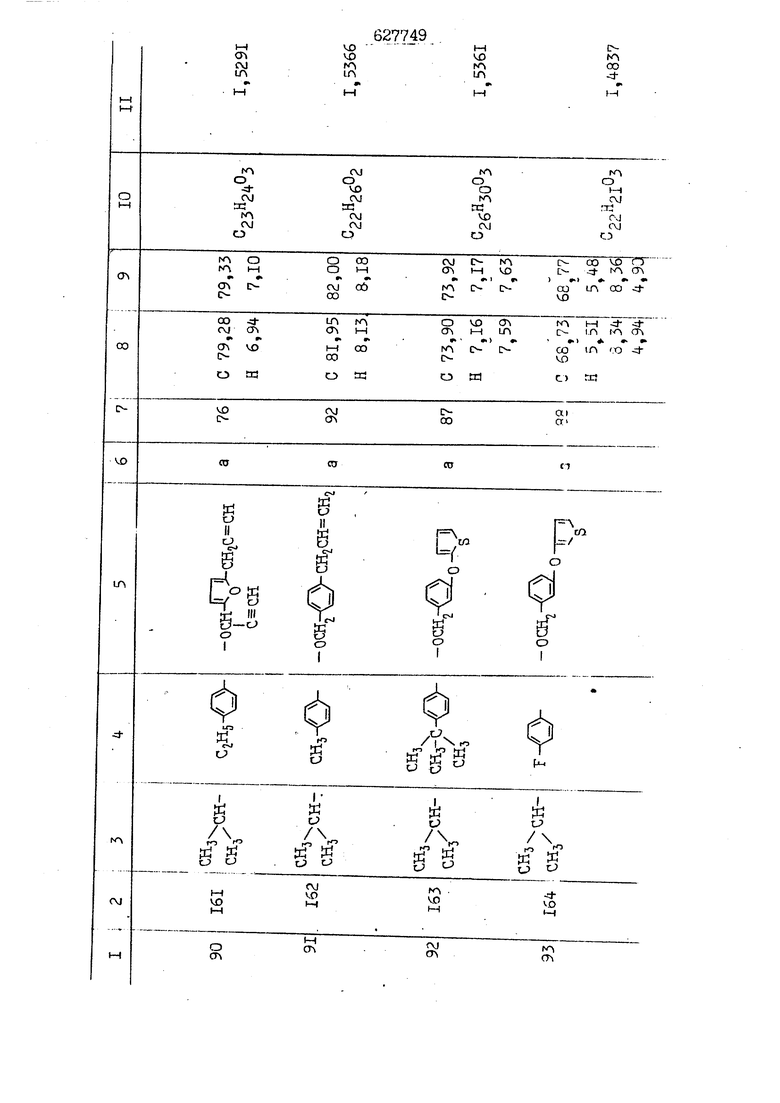
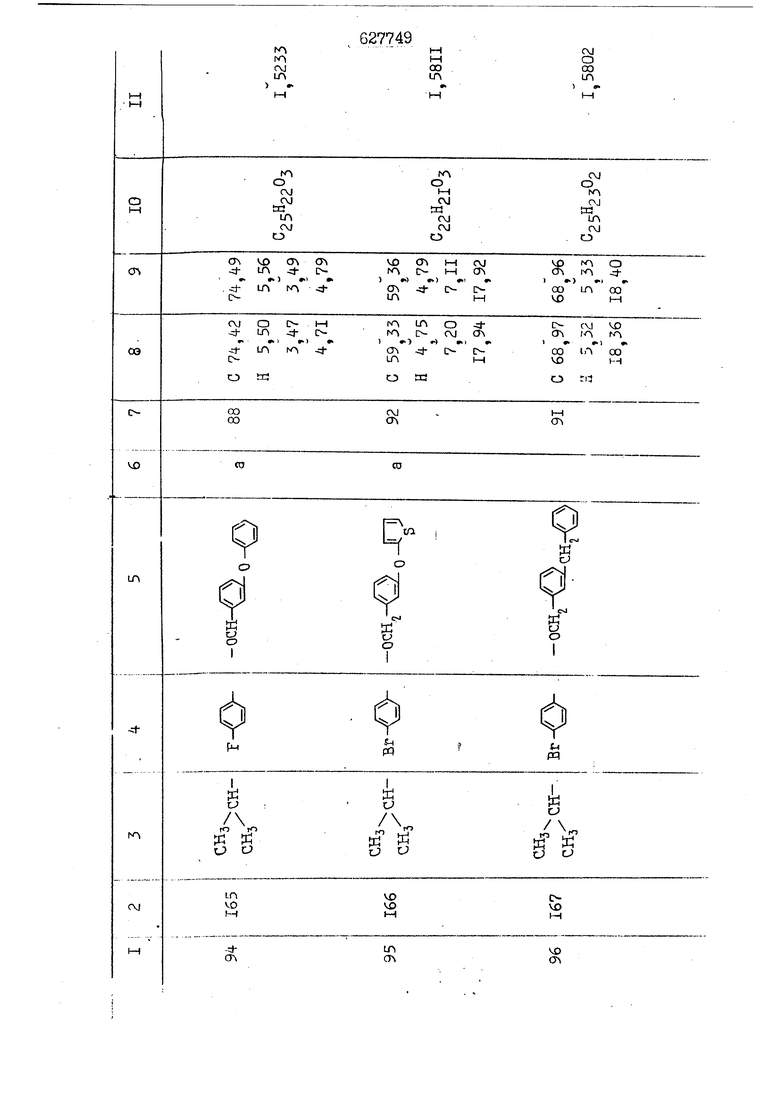
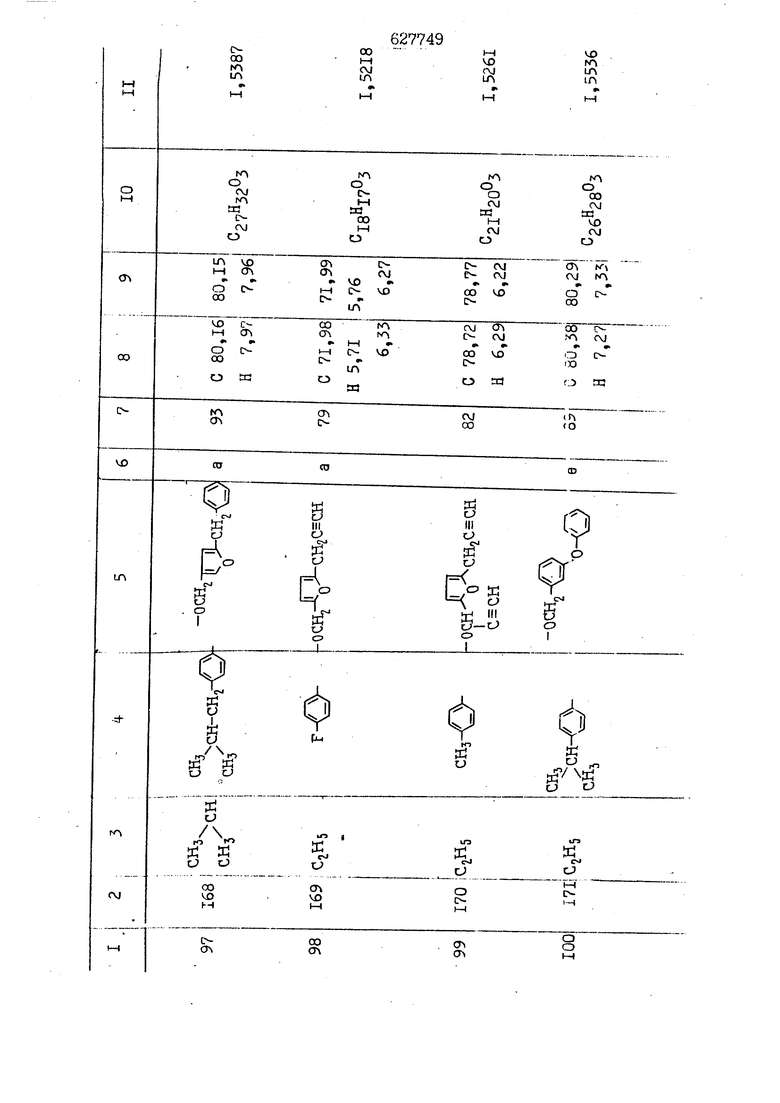
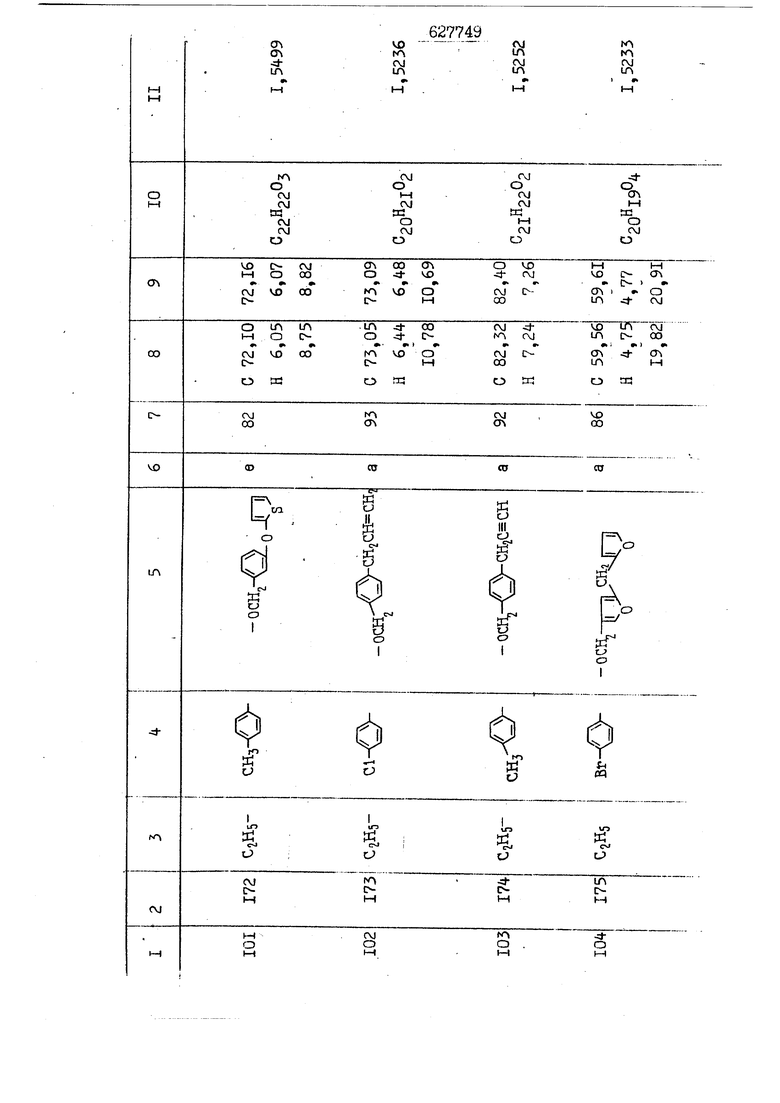
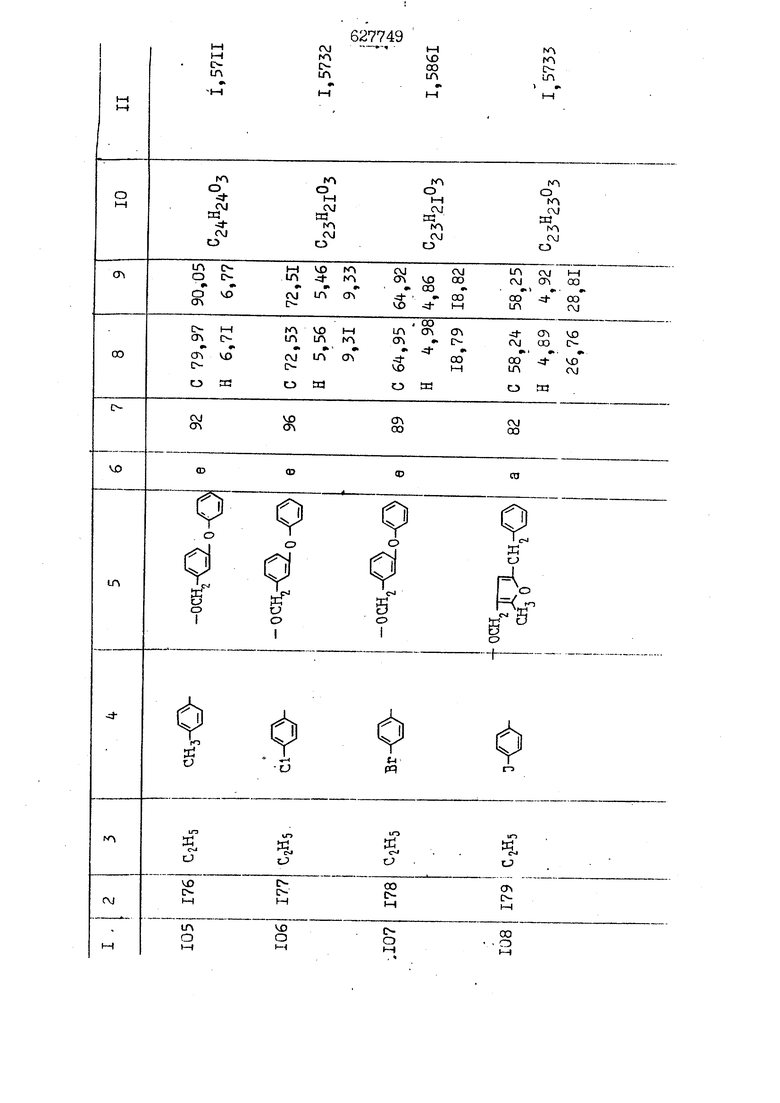
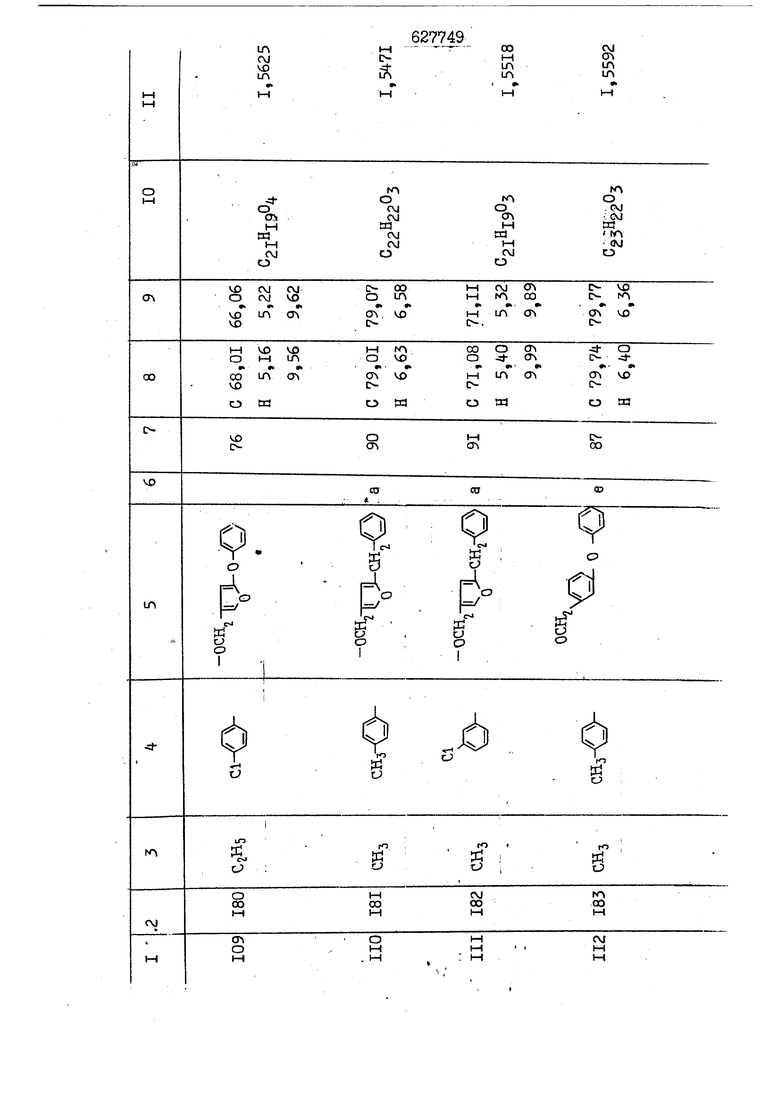
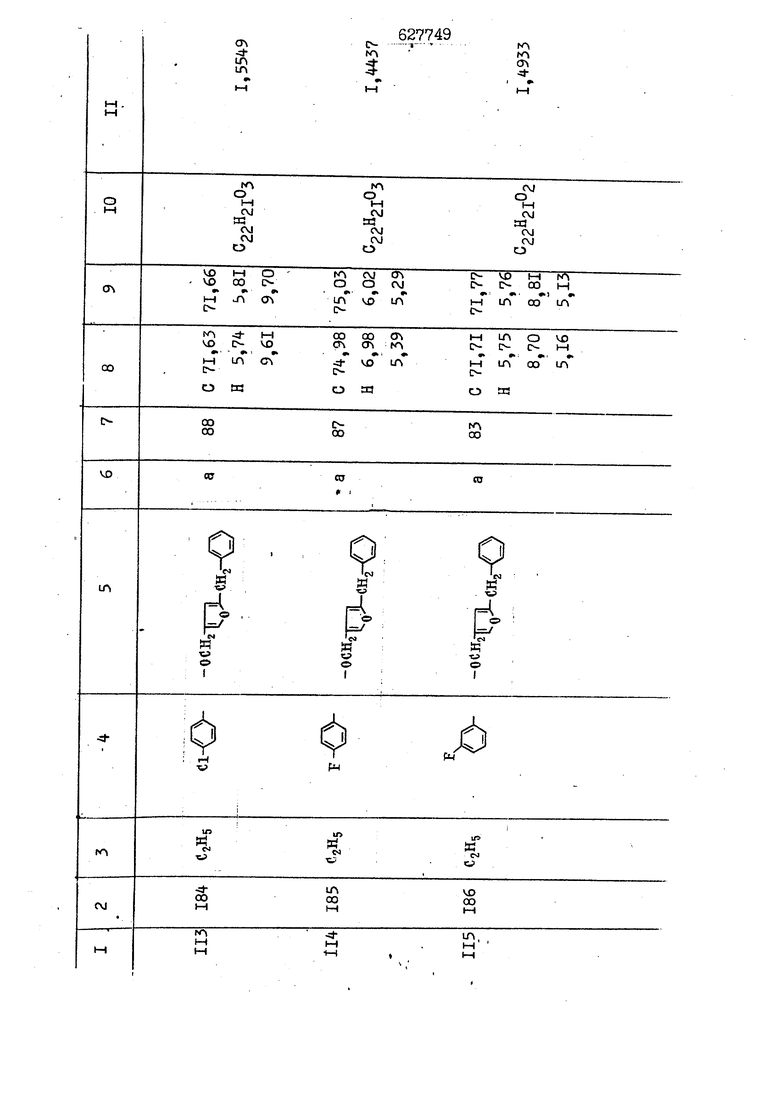
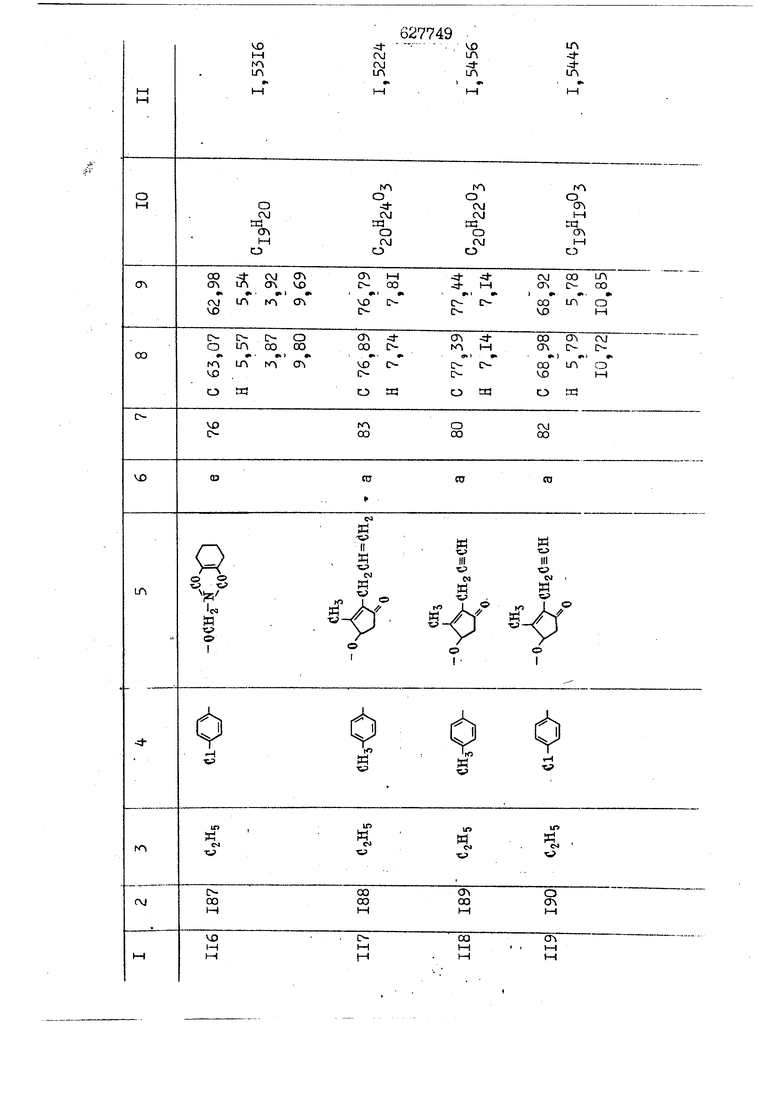
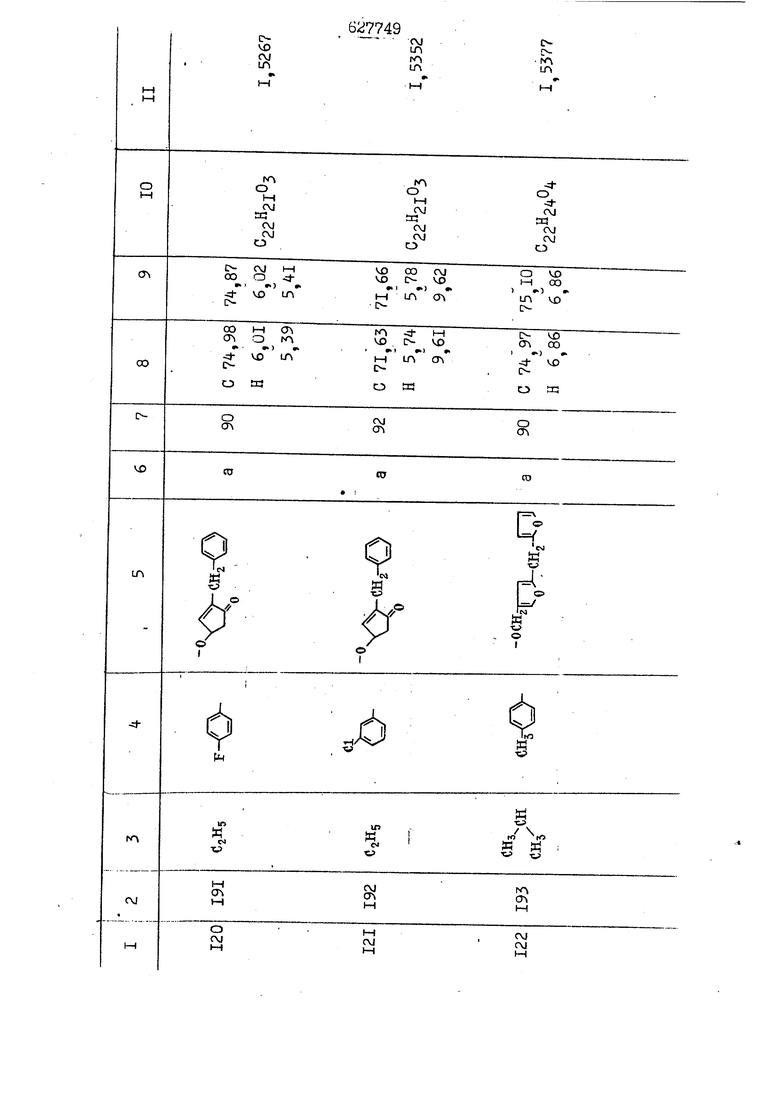
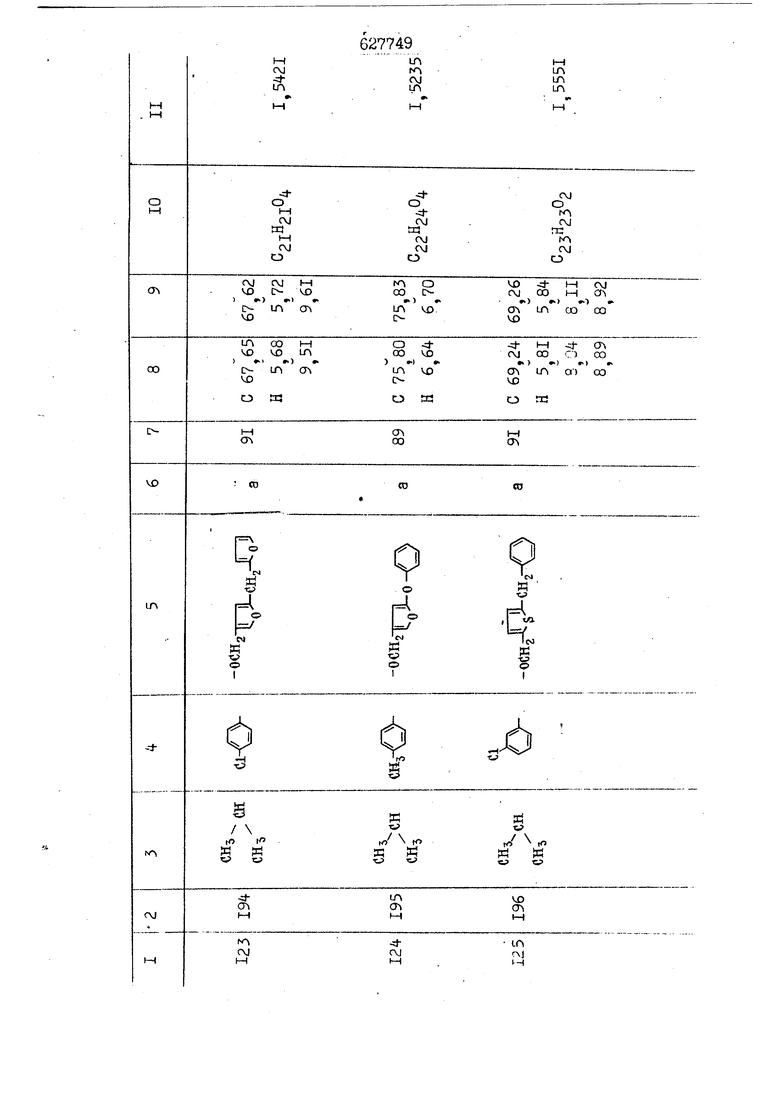
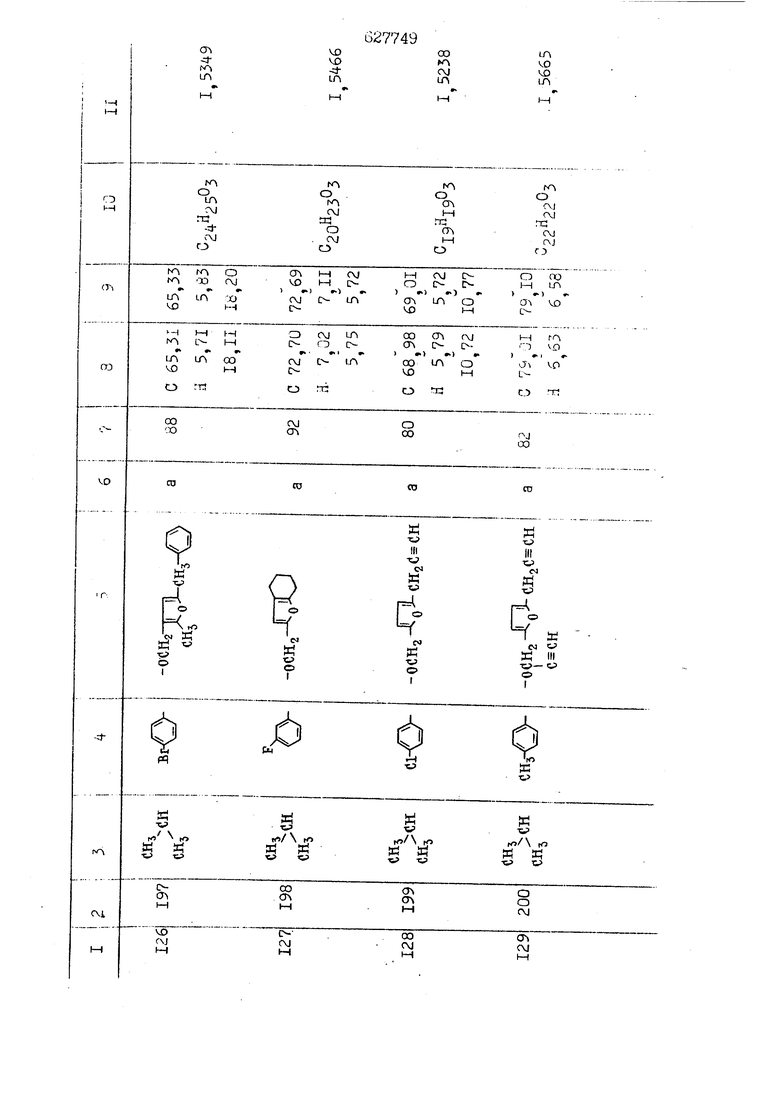
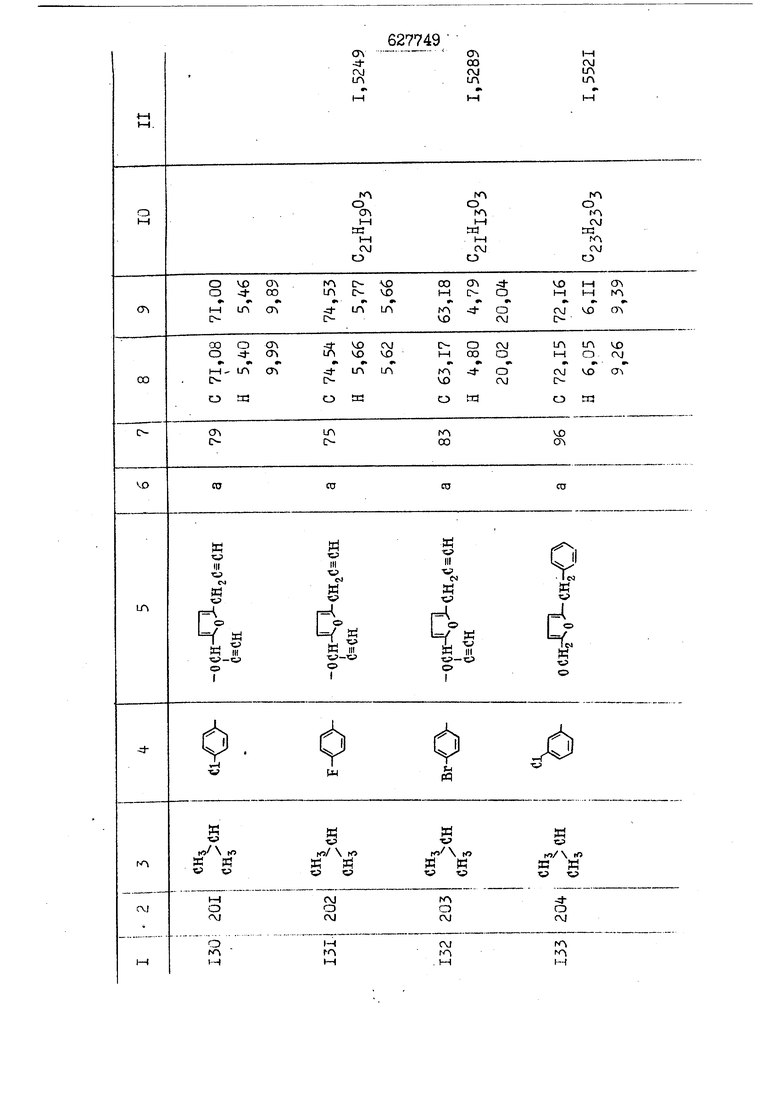
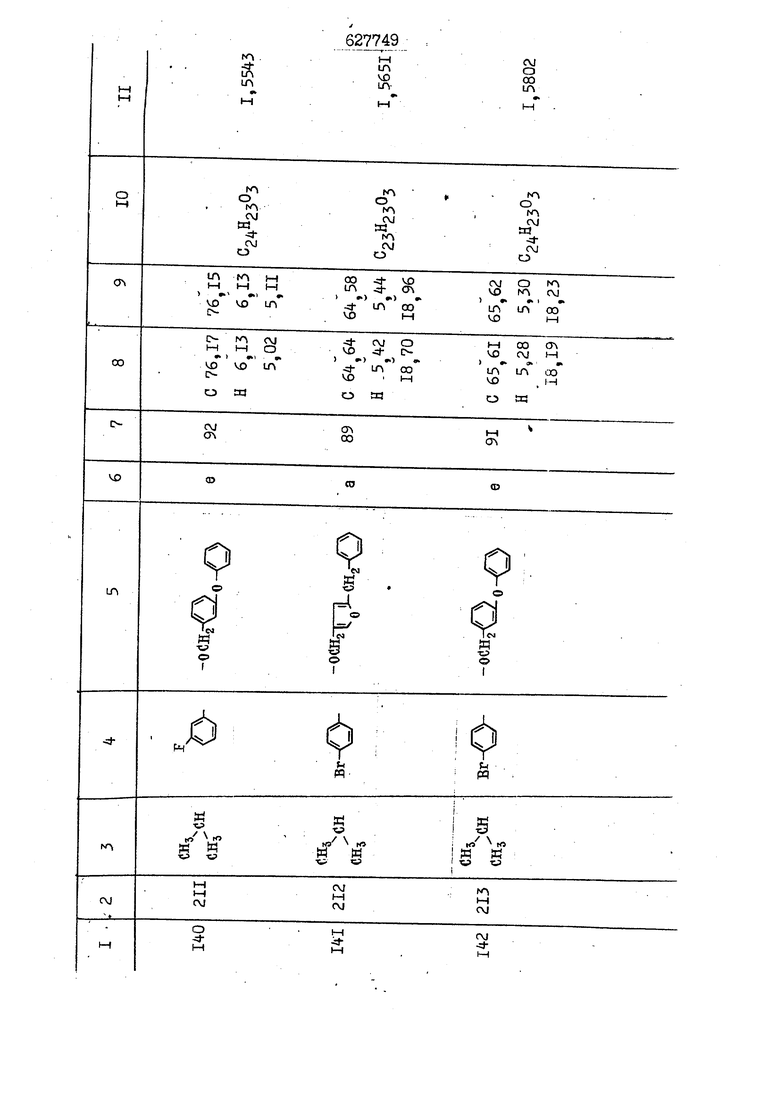
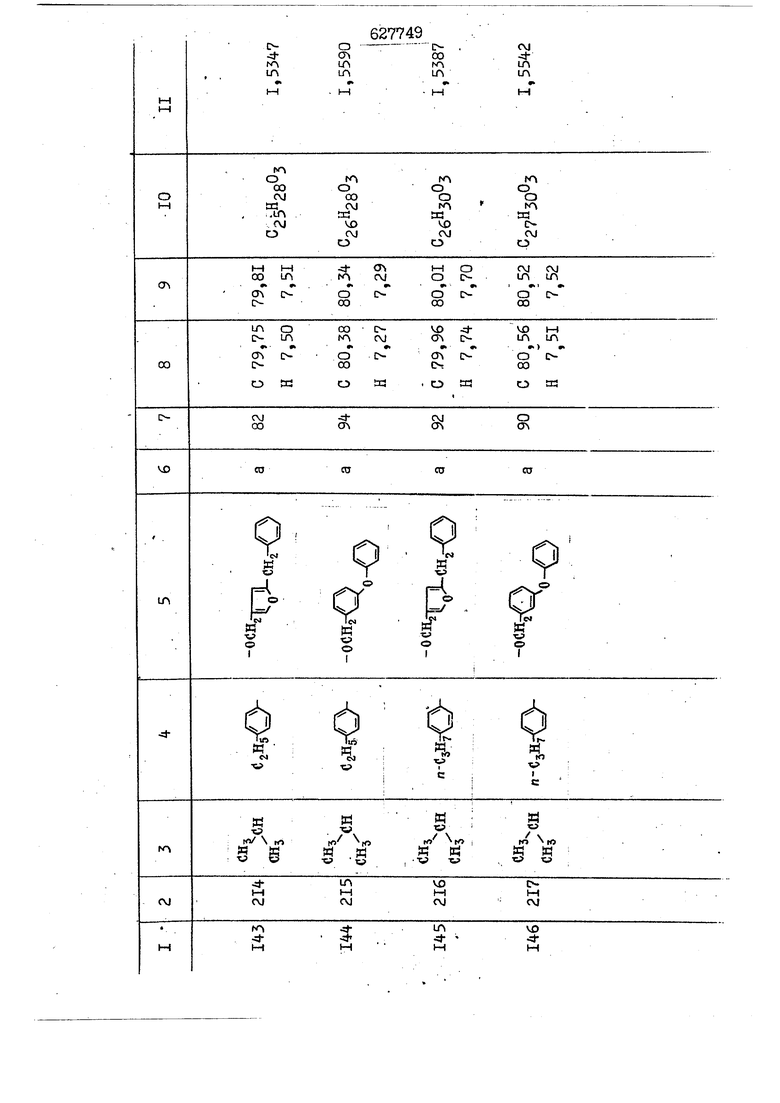
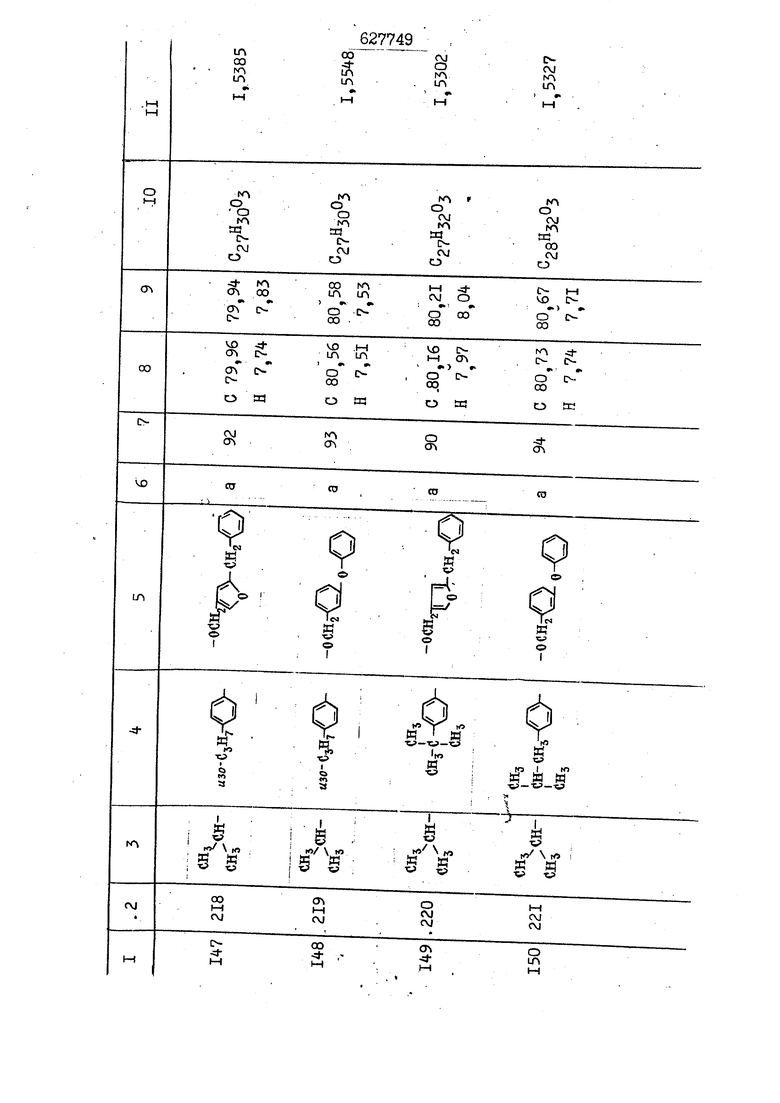
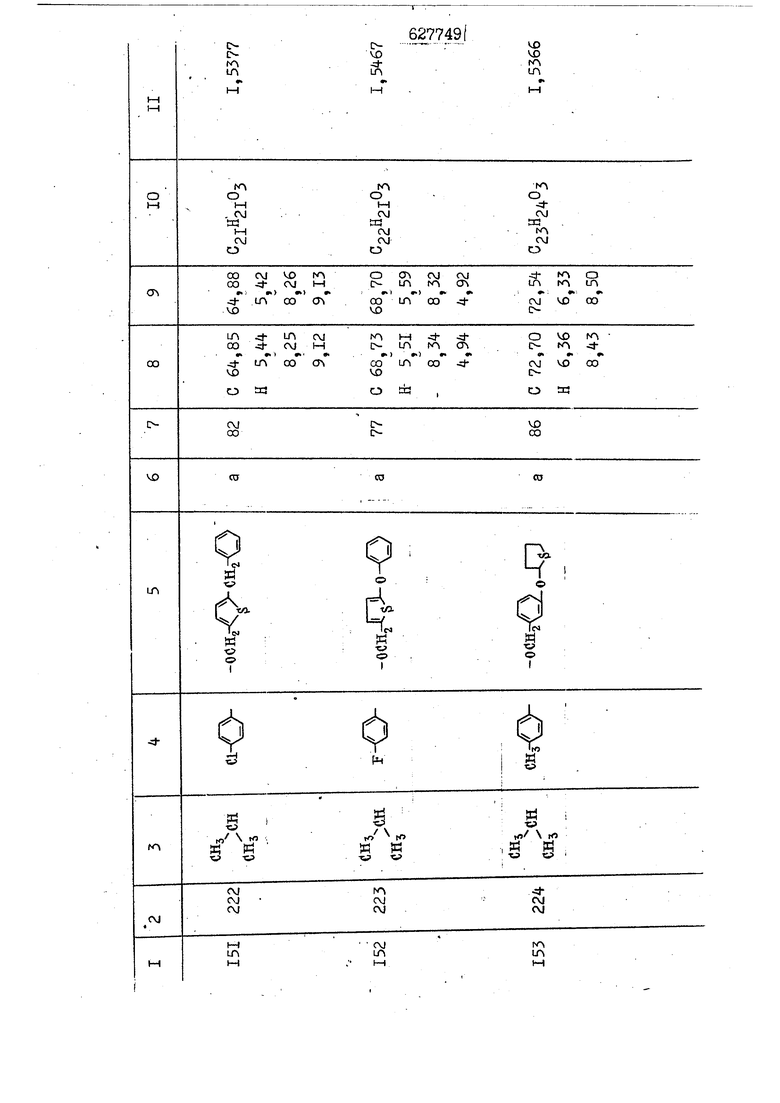
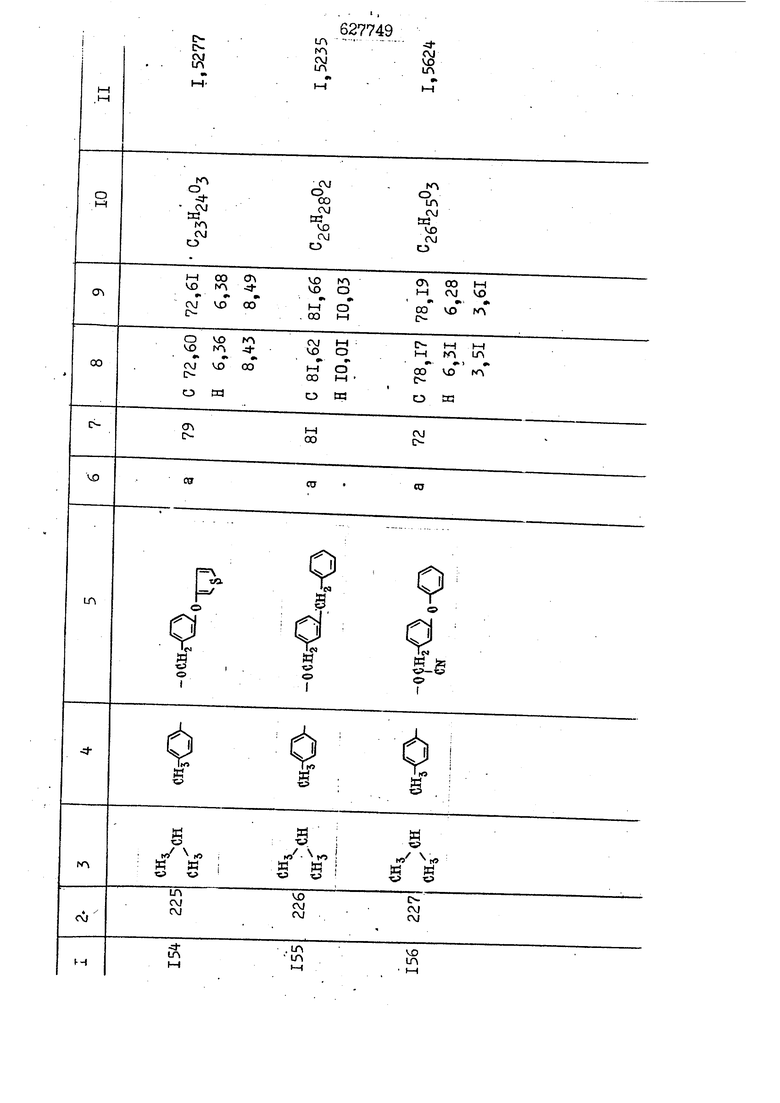
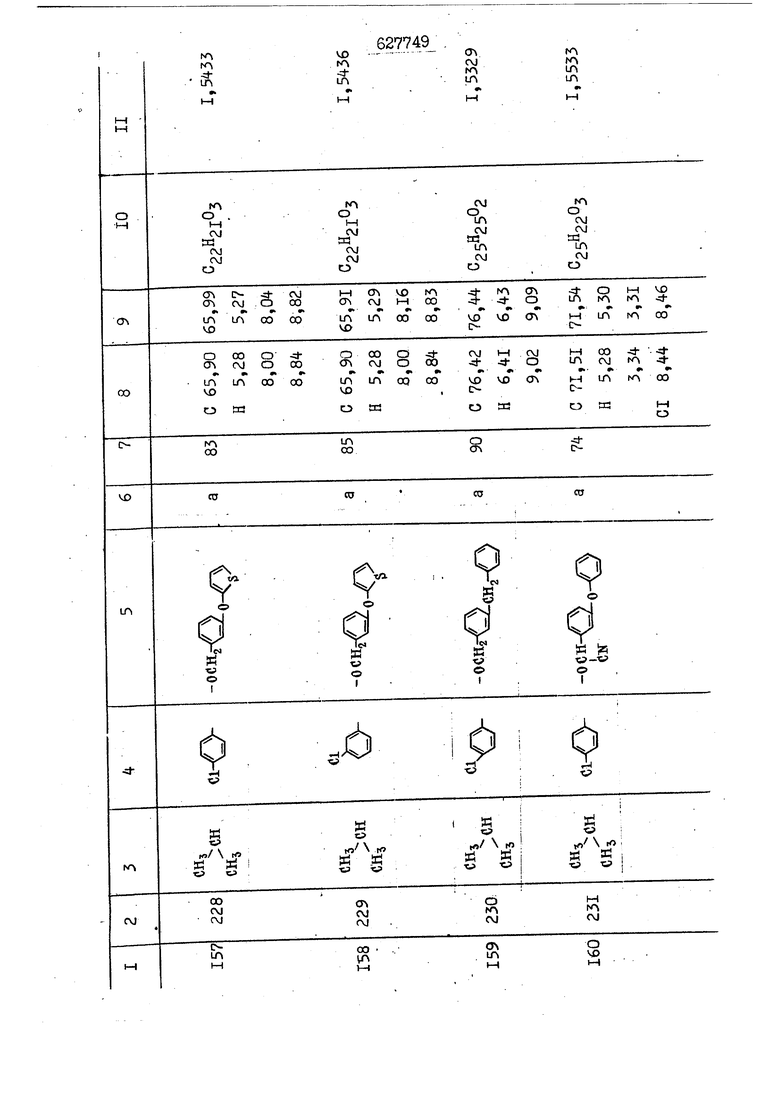
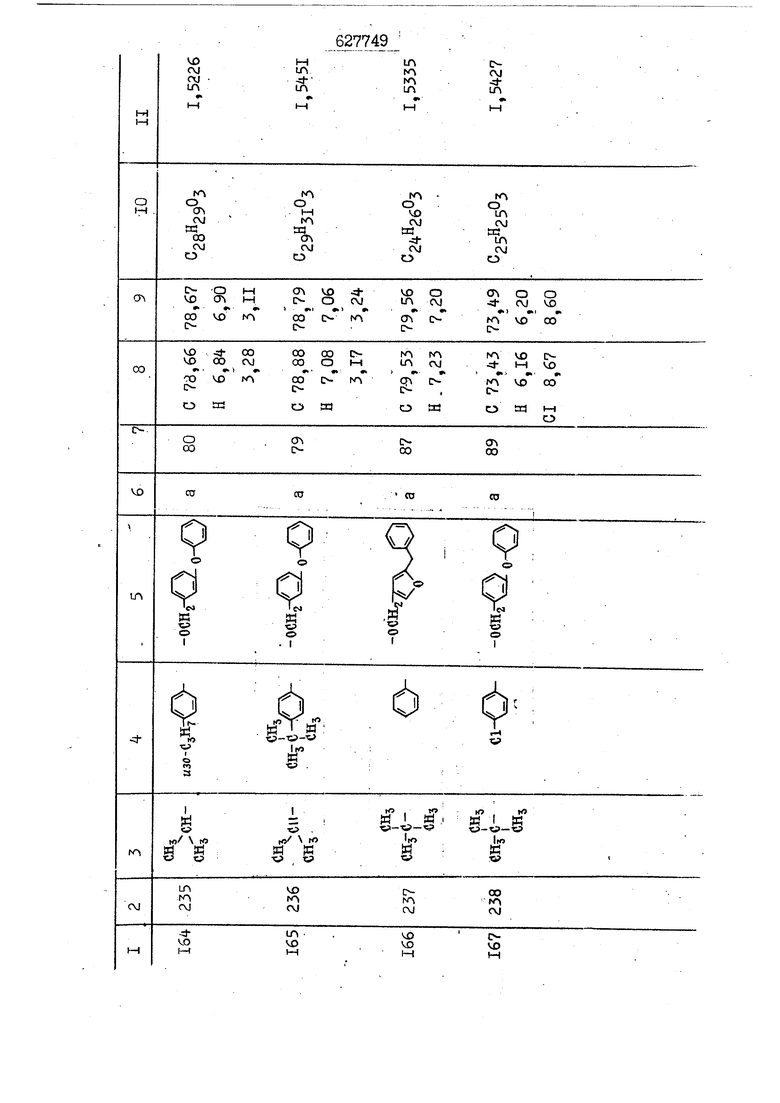
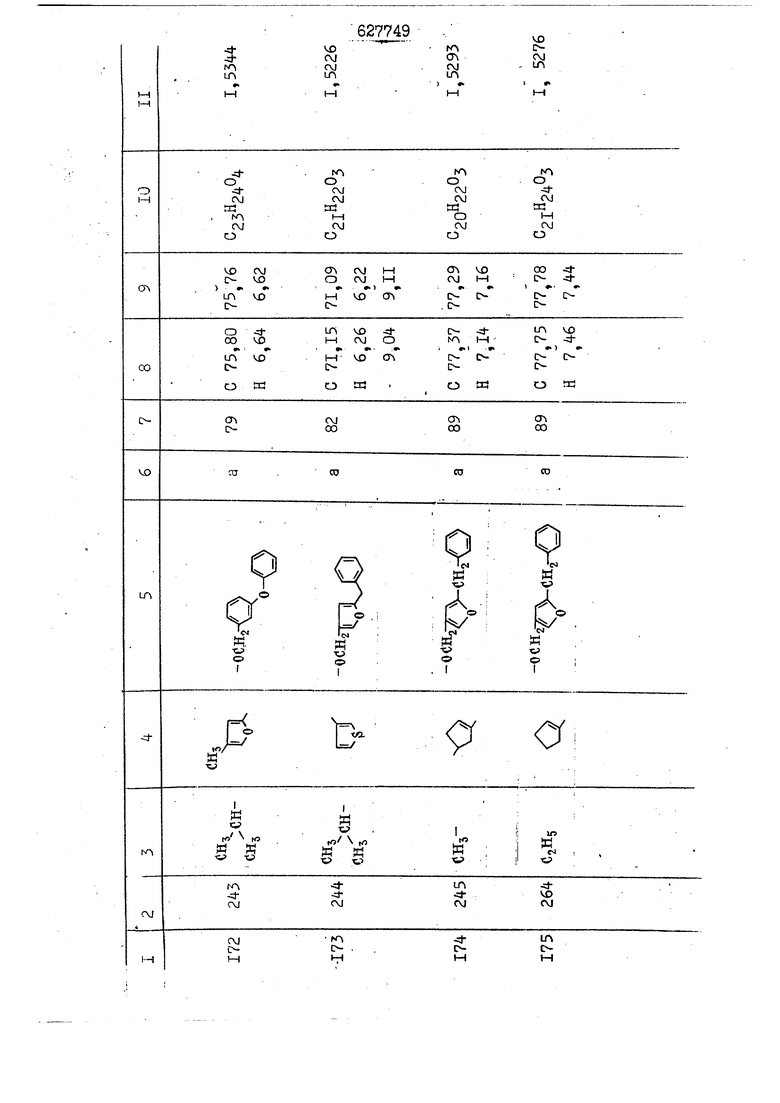
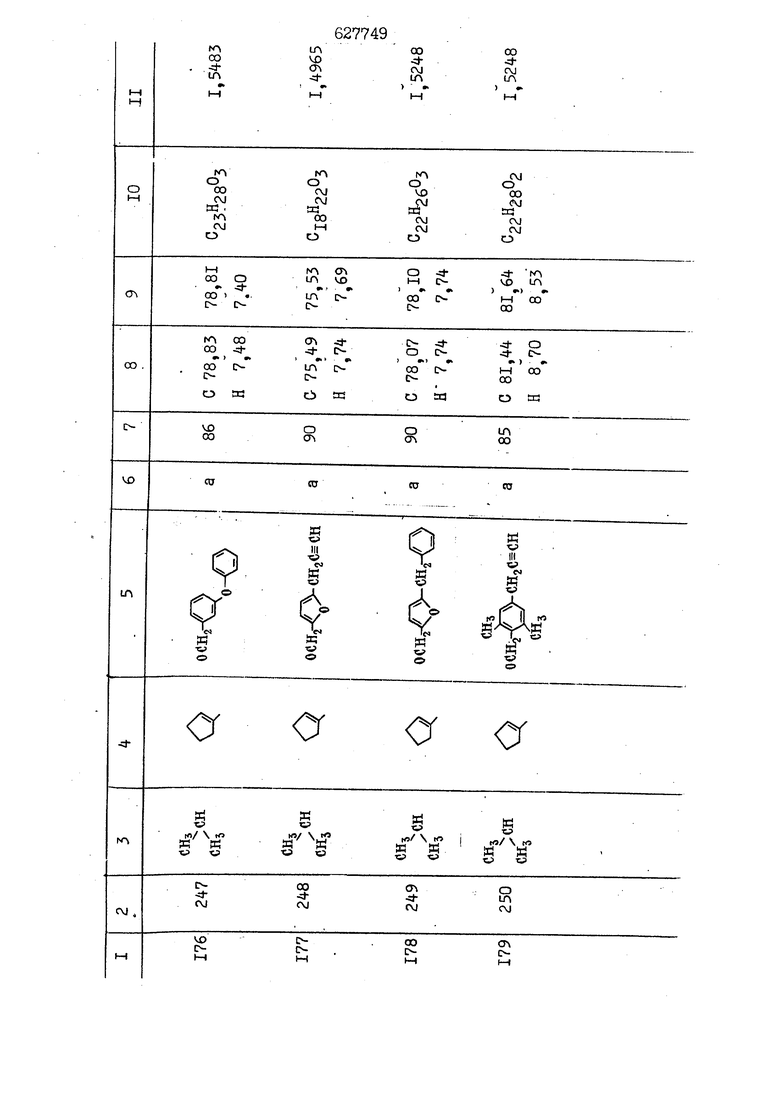
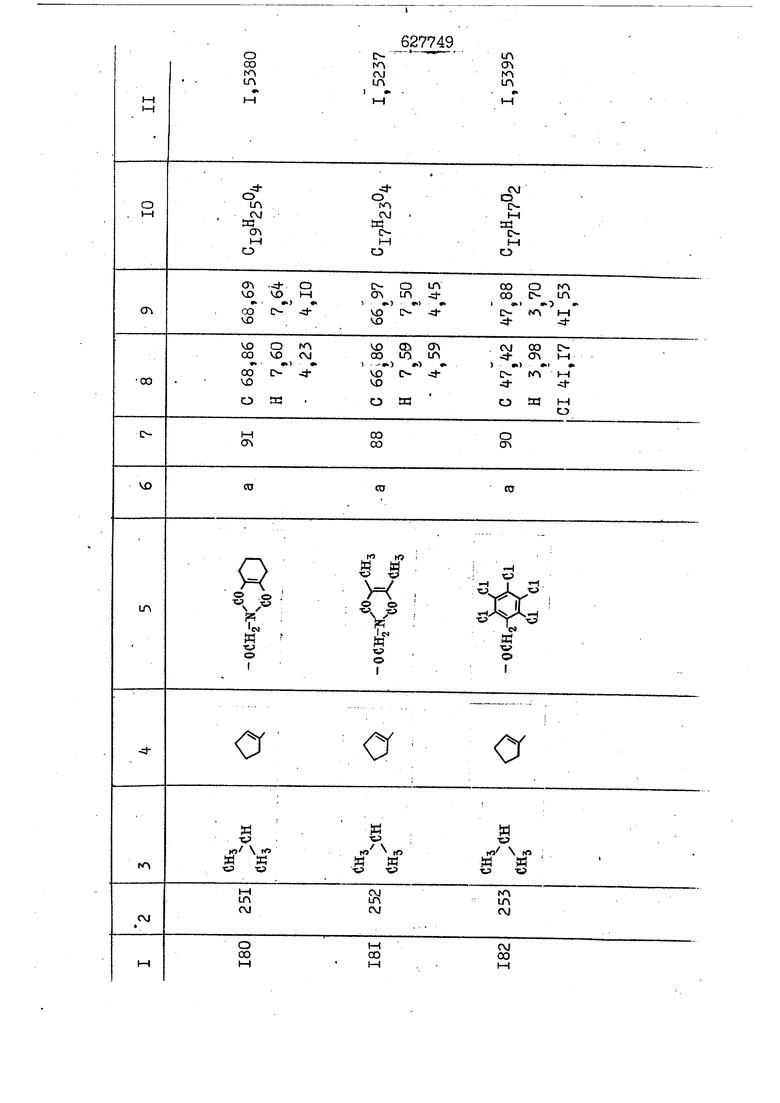
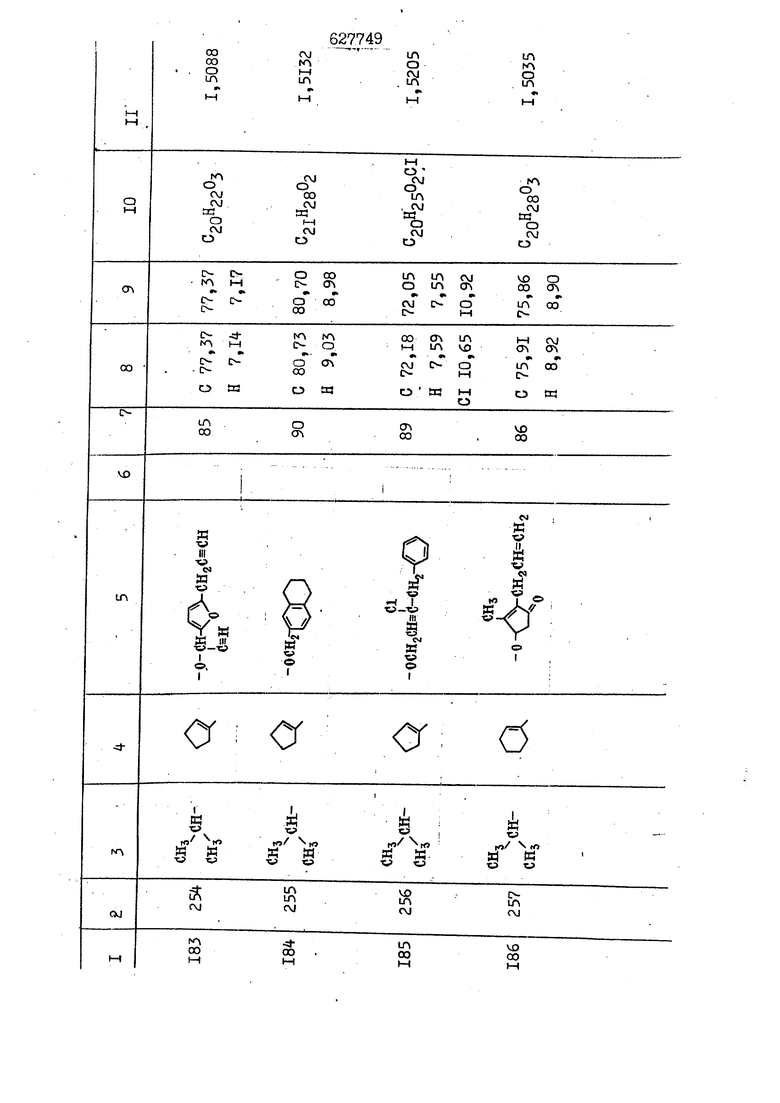
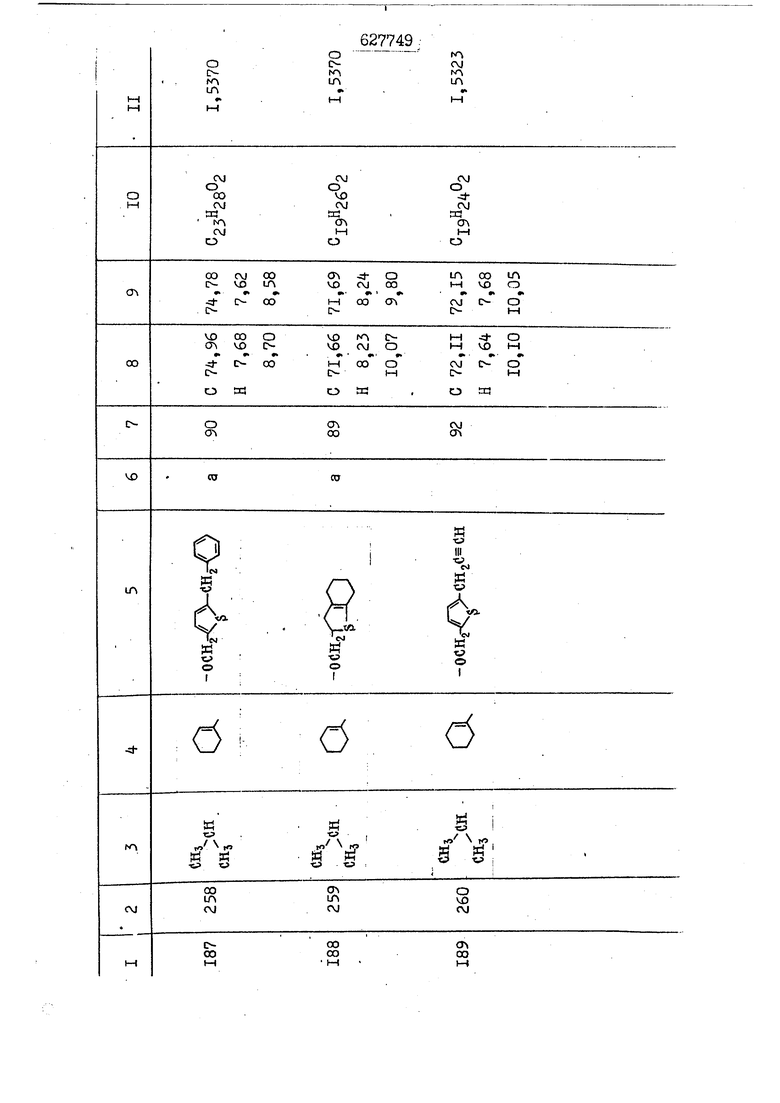
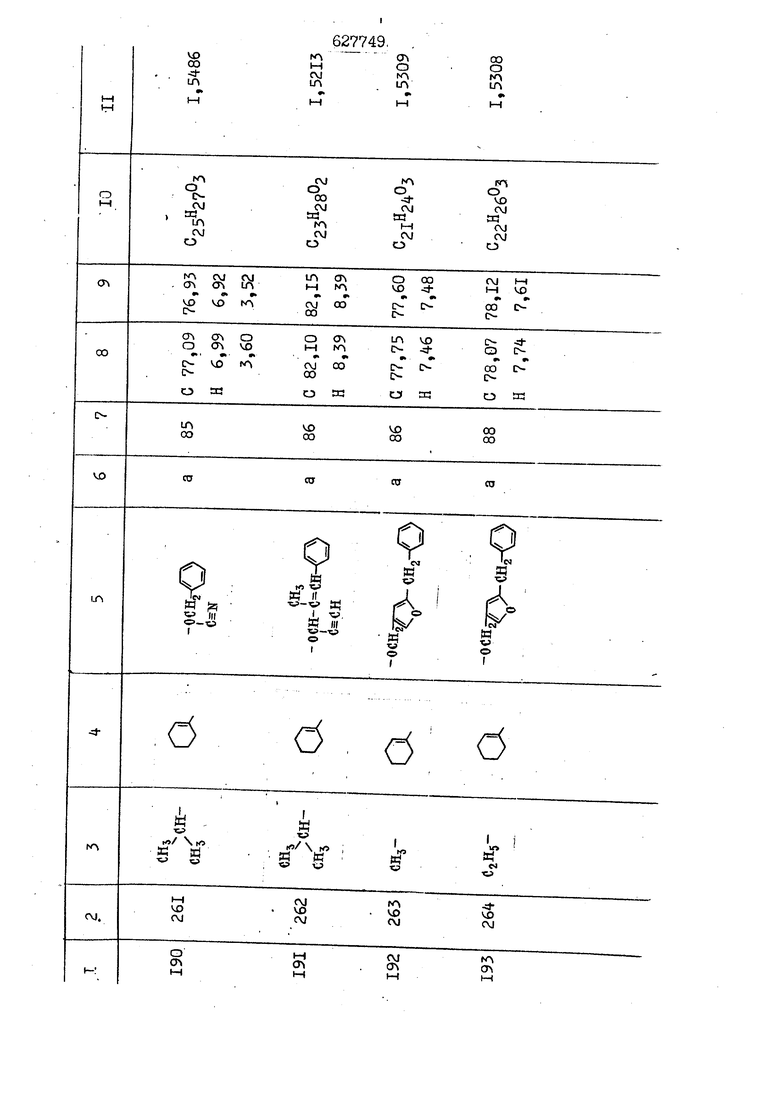
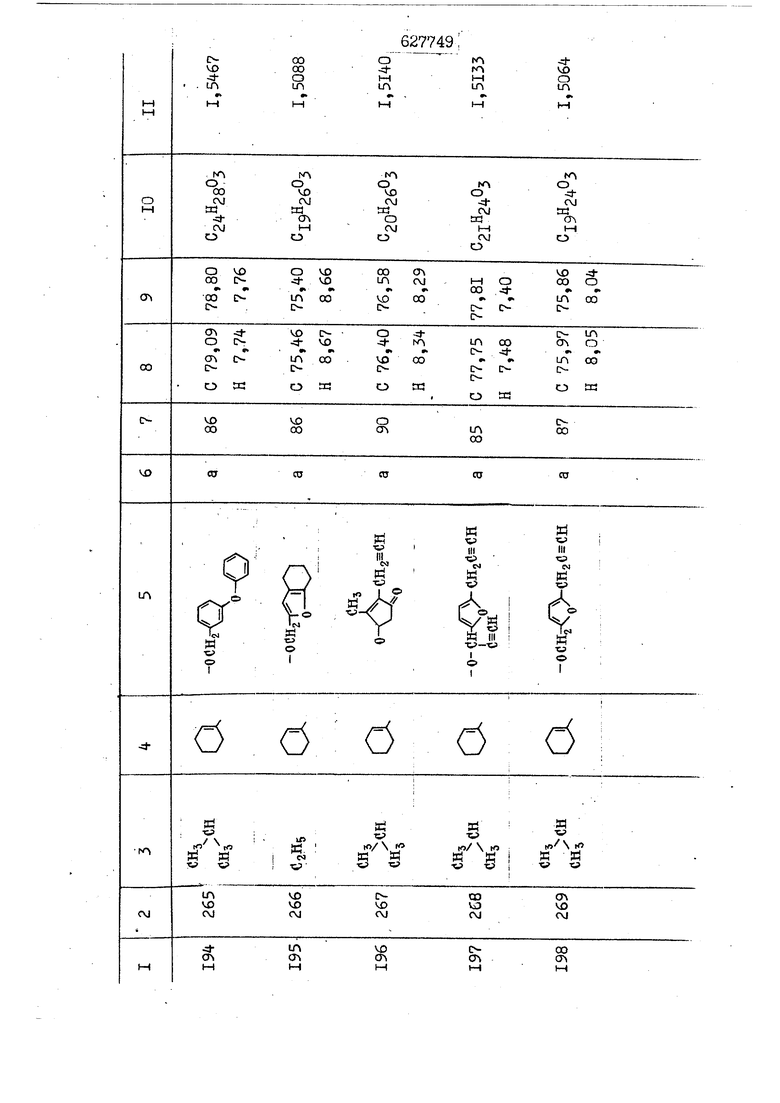
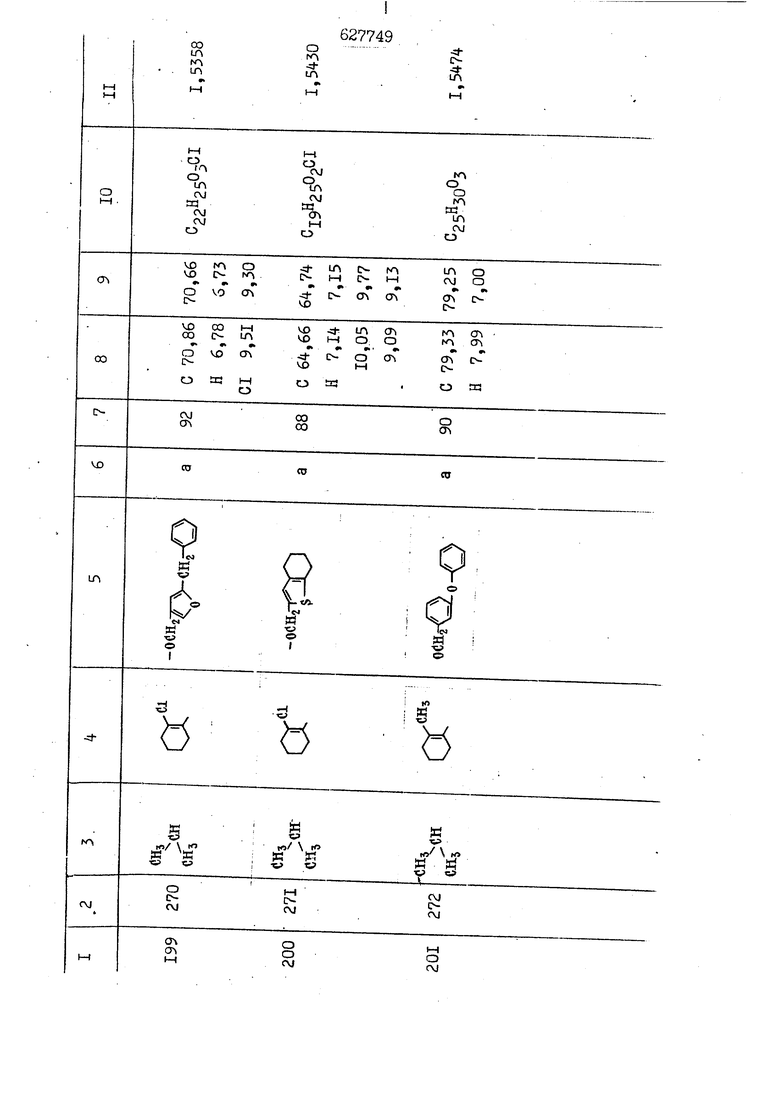
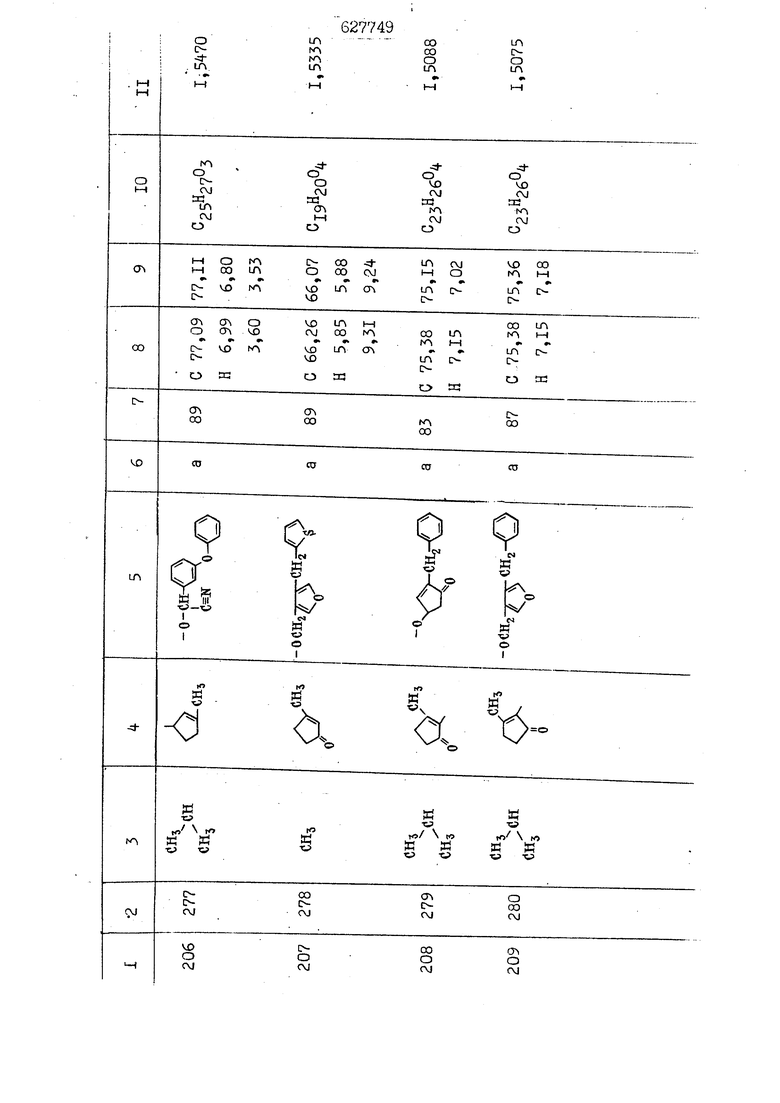
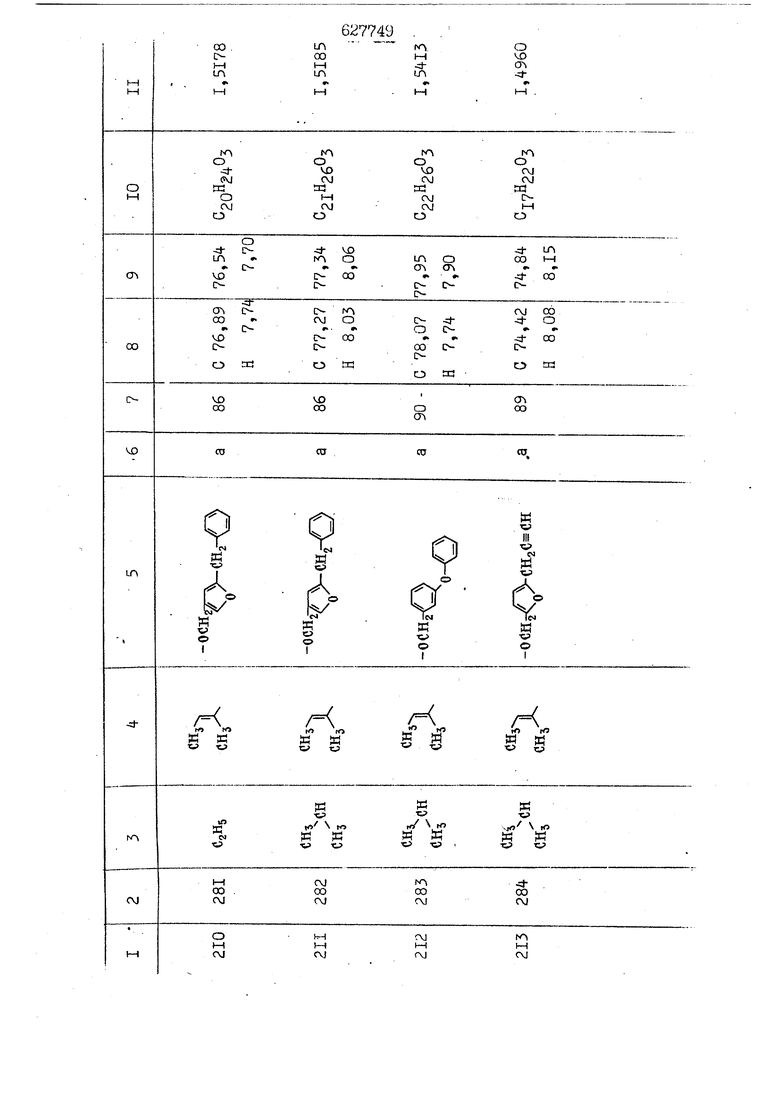
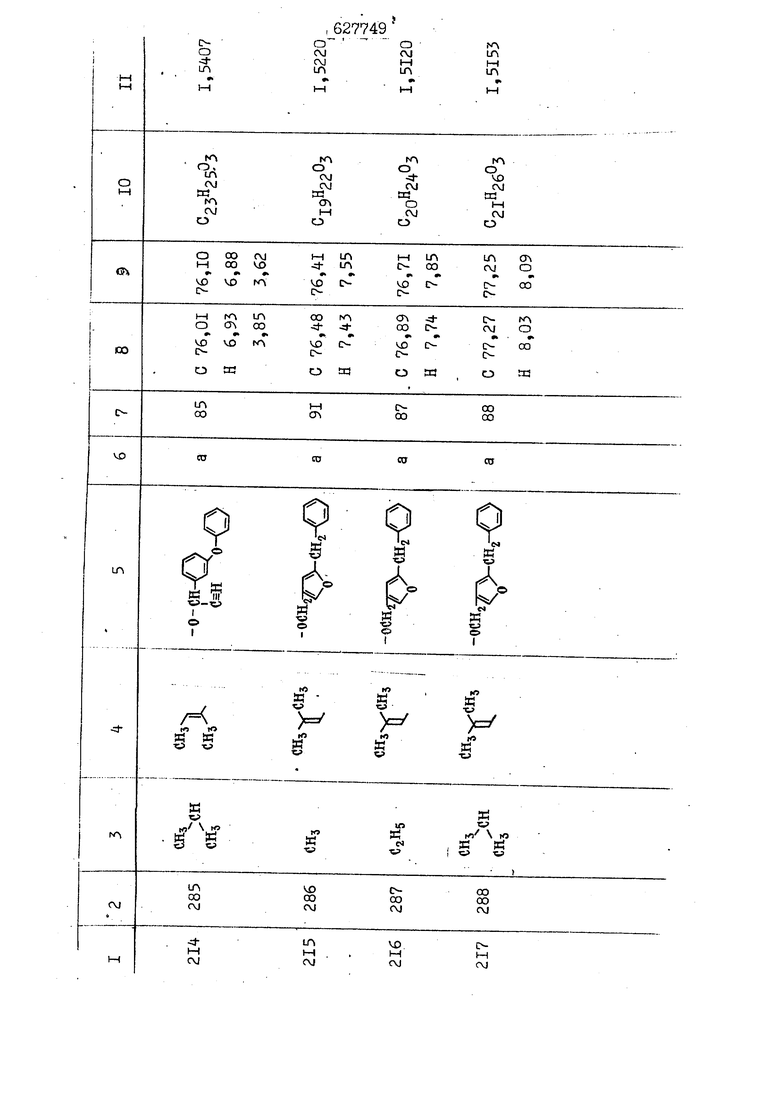
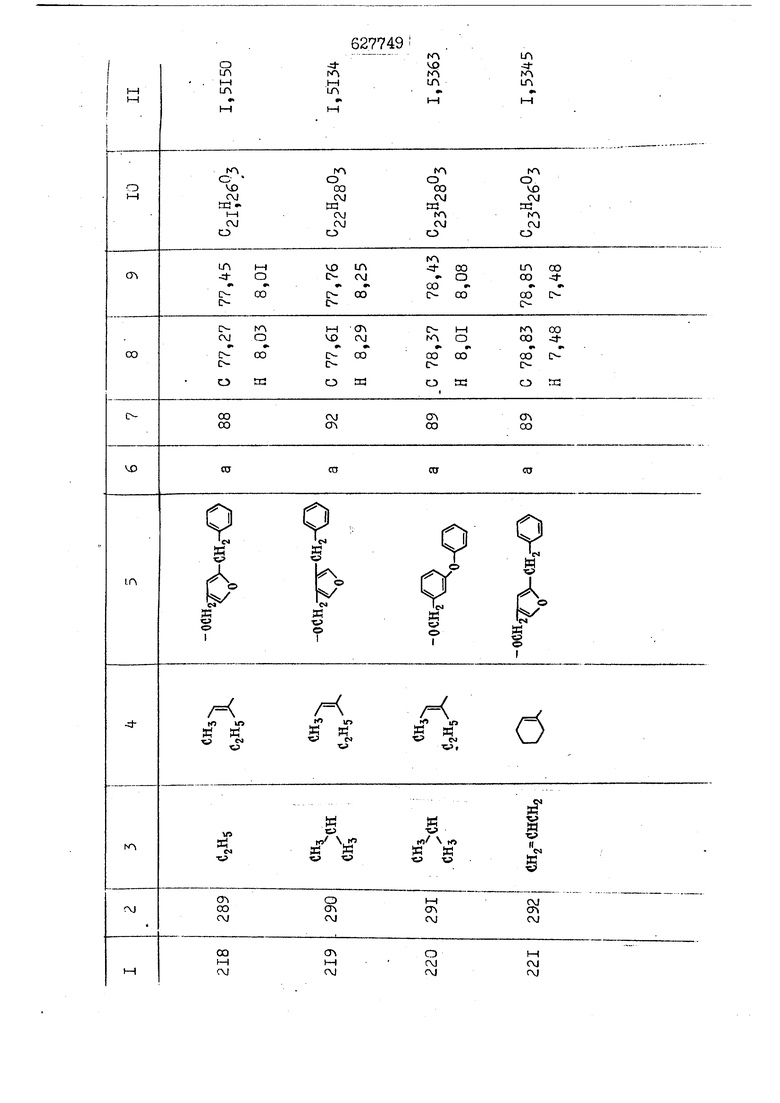
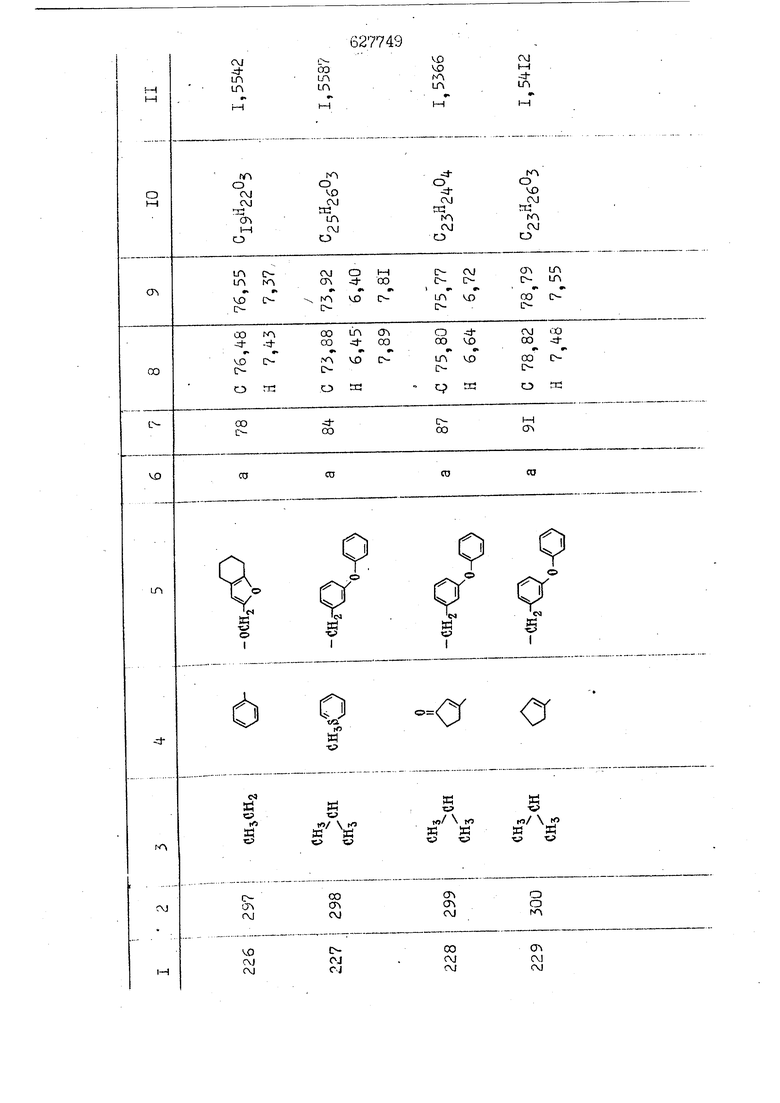
i n. 1-3.; пунктирная линия в формуле /У/ пр ставляет робой двойную 9вязь, находя щуюся в сопряженном или несопряженно Ъоложении с кет оном , или У замещенная .этиленовая группа общей формулы с ® : - ,.. где R, Ro-И Rg образуют плоскость вместе с двойной связью в положении I , J - эфирной группы и представля 1ЮТ coiSoii независимо друг от друга /.i атом водоро;п1а, ниэший ал кил, Щ1зший .алкенип, низший.апшцшп;.атом.галотёна ацильную ипи ацилоксидьную группу; 2 - jc прямой или развет1вленной j цепью низший алкил, низший алкенил, низший алкйнил, низший алкоксил, цианогруппа, галоидзамещенный низший , алкил, галоядэамешенный низший алкен или алициклическая группа, содёржаща от 3 до 7 атомов углерода; X - группа общих формул О I CRji)t W в L где R,n аллил, пропаргил, бензил, тешш, фурилметил, фенокси- или тиогруппа; R.. - атом водорода, .мет трифторметил или атом галогена или R.-. и R.. вместе образуют три- или тетраметиленовую группу; R. 2 - атом водорода, этинил или цианогруппа; I t 1 или 2; R,- - фталимид, тиофталимид, диили тетрагидрофталимид или диалкилма леимид; R , - алкил, пропаргил, бензил ил алкадиенил; R„. - атом водорода или метил; R., - фенил,, тиенил или фурил; В - атом кислорода, серы или груп -СН СН-;, W- метил или атом галогена. Эти соединения обладают ценными би логически активными свойствами, улучше ными по сравнению с ближайшими аналог подобного действия. W Способ основан на известной в органической химии реакции этерификации кислот, их сложных эфиров, ангидридов, галоид ангидридов, солей щелочнь1х метал-/ лов, серебряных ; солей и солей третич-ных аммониевых оснований спиртами или их галогенидами, или сульфоксилатами. Предлагаемый способ заключается в том, что кислоту общей формулы 2 :. У - сн - соон(xi) где У И имеют вышеуказанные значения, или ее функциональные производные:; ;;ангидрид,галоидангидр2 Д. сложный эфир, образованный со спиртом, имеющим низкую температуру кипения, или соль щелочного металла, серебряную соль шщ |СЬпь, образованную с третичным Ьргани ческим основанием, подвергают взаимодействию со спиртом общей формулы; . X - ОН(ХИ) i где X имеет вышеуказанные значения, или с его галогенидом, или сульфоксила-j том в условиях дегидратации, например в присутствии циклогексилкарбодиимида. Эфиры замещенных уксусных кислот | формулы 1 включают оптические изомеры, : обусловленные наличием углеродного атома в рС -положении. Процесс получения таких эфиров путем взаимодействия кислоты формулы XI и спирта формулы ХП предпочтительно проводят в среде подходящего инертного растворителя при комнатной температуре или при повышенной температуре в под- i водящих условиях дегидратации, т. е. в присутствии циклогексилкарбодиимида. В случае, когда в качестве производного кислоты формулы XI используют галоидангидрид кислоты, процесс взаимодействия со спиртом формулы ХП проводят при комнатной температуре с использованием акцептора гацоидводорода, например третичного органического амина, такого, как пиридин или триэтиламин. Галоидангидриды кислот представляют собой галоидангндриды. любого типа, но предпочтительно используют хлорангидриды кислот. Процесс предпочтительно Ттроводш в средё |5аств6 рйтепя,йнертнй-- го по отношению к реагентам и к образующемуся эфиру, например бензола, толуола и нефтяного бензина. В случае, когда в качестве производного кислоты применяют сложный зфир кислоты формулы XI и спирта с низкой температурой кипения, например метаноля или этанола, процесс проводят при | ,L....-. -. -.f нагревании в присутствии соответствую щего основного катализатора, например органического основания, предпочтител но алкоголята щелочного металла, соот ветсувующего спирту с низкой температурой кипения, входящему в состав эфи ра или гидрида натрия, в среде инертн го растворителя, например толуола, пр удалении освобождающегося спирта с низкой температурой кипения, который вьщеляют во время реакции из реакцион ной системы при помощи колонки для фракционированной дистилляции. При использовании ангидрида кислот в качестве производного кислоты форму Х| процесс предпочтительно проводят при комнатной температуре в среде раст ворителя, например толуола или ксилола В случае, когда в качестве производного спирта формулы ХП используют галогенид или сульфоксилат и в качестве производного кислоты формулы XI соль щелочного металла, серебряную соль или соль с третичным органическим основанием /эти соли могут образовываться in. sUu при одновременном вве дении кислоты формулы XI и соответст- вующего основания в реакционную систему/растворителем является бензол, ацетон, диметилформамид и т. п., процесс предпочтительно проводят при нагревании до температуры кипения применяемого растворителя или при более низкой температуре в среде растворителя, например бензола, ацетона или диметилформамида. Предпочтительным галоидом для галогенида спирта формулы ХП является хлор и бром. Пример 1. Получение 5 -бензил-Зфурилметил- -этилфенилацетата /соединение Г/. 6,20 г /0,02 моль/ ангидрида Л этилфенилуксусной кислоты и 3,76 г /0,02 моль/ 5-бензил-З-фурилметилового спирта растворяют в 50 мл безводного пиридина и смесь перемешивают при комнатной, температуре в течение 2 ч. Полученную реакционную смесь вьтивают я 100 г ледяной воды и экстрагируют тремя порциями этилового эфира /по 20 мл/. Объединенньш эфирные экстракты экстрагируют двумя порциями по 20 МП 50%-ного водного раствора гидрата окиси натрия для удаления являющейся побочным продуктом ot -этилфенилуксусной кислоты. Эфирньй слой последовательно про№1вают 10%-ной соляной кис лотой, насыщенным водньш :раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над безводным сульфатом натрия и эфир удаляют при пониженном давлении для получения 0,25-г сырого сложного эфира-в виде светло-желтого маслянистого вещества. Полученное маслянистое вещество очищают методом колоночной хроматографии .с использованием 120 г активированной окиси алюминия 2 с проявлением смес1ыо растворителей бензол-н-гекран /1:3/ для получения г 786% от тео-, ретического выхода/ целевого сложного . эфира в виде бесцветного маслянистого вещества, П.д 1,5545. Длина волны максимального поглощения пленки 3005, 1724, 1550, i . МЭ.КС,, 1180, 806 см . уСС , - Оррш : 7,16 / 5,5Н/, 7,15 /S,5H/, 7,2 /Ш/, 5,79 /&S,m/, 4,.78 /5,2Н/, 3,78 , 3,31 / t,lti., J 1 Гц/, 1,3-2,3 /т.,2Н/, 0,83 / i, ЗН, 7 Гц/. Пример 2. Получение метафеноксибензил-(5.-этилфе1нилацетата /соединение 2/. 1у 2,00 Г/ 0,01 моль/метафеноксиёеизй лового спирта и 1 ,l9 г70,015 моль/ без водного пиридина растворяют в 20 мп бензола и по каплям прибавляют 1,83 г /0,01 модь/ хлорангидрида (;L-этилфенилуксусной кислоты, растворенного в 5 мл безводного бензола при охлаждении льдом. По окончании прибавления смесь перемешивают при комнатной температуре в течение 3 ч для завершения реакции и реакционную смесь выливают в 30 г ледя ° воды. Смесь разделяют и водKJJU слой экстрагируют двумя порциями бензола /по 10 мл/. Объединенные бензольные экстракты последовательноЪромывают 5%-ной соляной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия и бензол удаляют при пониженном , давлении. Полученный сырой сложный эфир загружают в колонку с 40 г активированной окиси алюминия и применяют в качестве элюента смесь бензола с н-гексаном /1:3/ для получения 3,15 г /91% от теоретического выхода /очищенного сложного эфира, п22 1,5712. ) SKC™ 590, 1470, 1260, 1220, 1160 , 4 7,4-5,8 /m, 14Н/, 4,95 /S, 2Н/, 3,48 / t,lH, -} 8 Гц/, 2,3-1,1 /m, 2Н/, 0,85 / i, ЗН, 7 8 Гц/, Пример 3. Получение 5-бензил-3- фурилметил-еС -цикло ексилфешшацетата /соединение 17/, 2,82 г /0,05 моль/ 5-бензил-З-фурил метилового спирта и 2,22 г /0,01 моль/ .этилового эфира d. - циклогексилфенил;уксусной кислоты растворяют в 50 мл безводного толуола и в качестве катализатора прибавляют 0,1 г гидрида натрия. Смесь загружают в ректификационную колонку Тефлон .Спиннинг Бенд и образующийся в качестве побочного продукта этанол удаляют при нагревании и перемешивании. Реакция заканчивается а период времени около 1 ч и реакцион ной смеси дают охладиться до комнатной температуры, после чего ее выливают в 30 г ледяной воды. Слой разделяют для удаления толуольчого слоя и пocлeд шй промывают насыщенным водным раствором хлористого натрия. Толуол удг1Г1яют при пониженном давлении и полученный сырой сложный эфир загружают в колонку с 50 г активированной окиси алюми1-шя, используя в качестве элюента смесь бензола с н-гексаном /1:3/ для получения 2,79 г /72% от теоретического выхода/ онищенногс( cjiomHoro эфира в виде белых т;;.ш1.,.5-.1-5,ЗСС. , ,.(.i кристагшОа ....:-- нужол 3035, 1738,-1606, 1500, 1454 1155 см pp;J 7,3--6,9 /,11П/, 5,80 /fo,H/, 4,77 /АВ-тип, ,2П/, 3,70 / S, 2Н/, 3,0 /о,,2Н, J 10 , 2,1-0,6 /т., ЮН/. Примерз 4. Получение диметилмалеимидометил-0, -аллилфенилацетата /соединение 5/. . 1,74 г /0,01 моль/ Ч-хлорметилдиме тилмалеимида и 2,93 г /0,01 моль/ серебряной соли (Л « аллилфешшуксусной кислоты вводят в 25 мл дрметилформамид и смесь выдерживают в течение ночи при комнатной температуре. Осадившиеся кристаллы отфильтровывают и диметилформамид отгоняют при понижшкгом давлении. Полученный сыройСЛОЖНЫЙ эфир вносят в колонку, с силикагелем /90г/, в качестве элюента применяют смесь хлороформа с четыреххлористым углеродом /2:1/ и получают 2,43 г /75% от теоретическс го выхода/ целевого сложного эфира в виде белого маслянистого вещества, п.д 1,5340, -1) 1780, 1740, 1720, 1640, максV 1600, 1140, 910 см . . CD Ct-. 7,15 / S, 5H/, 6,0-4,9 /m, if-J |ЗН/,,48 / .i,3H, 3 ШГц/, 3,0-3,2 ) /т,2Е/, 2,0 / S, 6Н/. Пример 5, Получение 5-б en зил-3-фур ил метил-ot --изопропил-4-метоксифенилацетата /соединение 22/. 1,90 г /0,01 моль/ 5-бензил-3ФурФурилового спирта и 1,58 г /0,02 моль/ пиридина растворяют в ,50 мл безводного бензола и по каплям прибавляют 2,30 г /0,01 моль/ хлорангидрида I оС. -изопропил-4-метоксифенилуксусной кислоты, растворенного в 5 мл безводного бензола, причем это прибавлеш1е j к раствору капель ведут в течение примерно 30 мин. По окончании прибав- I ления смесь перемешивают при комнатной температуре в 3 ч для завершения реакции. Реакционную смесь выливают в 50 г ледяной воды, после чего бензольный слой отделяют и водный слой экстрагируют двумя порциями бензола /по 20 мл/. Объединенные бен-, зольные слои последовательно промывают 5%-ной соляной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хпористо- , го натрия Образовавшееся желтое мае- . лянистое вещество после удаления бензола вносят в колонку с 25 г активи „ „ „. алюминия и используют в качестве элюента смесь бензола с нгексаиом /1:3/, получая при этом 3,33 г /88,0% от теоретического выхода/ «чищенного сложного эфира в виде бесцветного масля1дастого вещества, п} 1,5470. пленки 1735, 1617, 1515, 1250, 1032, 830, 730 см S 0,65 /i(,.3n , 7 Гц/, 0,95 / , 1 7 ГЦ/, 1,7-2,5 / п , IH/, 2,97 , ПГц/, 3,6775. , 3H/, 3,81 / S. 2H/, 4,78 /of, of , ; H/, 5,83 / & , IH/, 6,90 /d, d, /, 7,1-7,3 /m , 6H/.I Пример 6. Получение 3,4,5,6-тетрашдр офталимид онетил-.сзС -этил-2,4,6-триметилфенилацетата /соединение 27/. j 10,31 г /0,05 моль/с. -3THJ,4,6- ; триметилфенилуксусной кислоты и 9,05 г /0,05 моль/ 3,4,5,6-тeтpaгидpoфтaлймидoмeтшIOлa растворяют в 100 мл безводного бензола и к раствору прибавляют 16,51 г /0,08 моль/ дициклогексилкарбодиимтада. Затем смесь выдерживают в ( ; течение ночи,: в герметически закрытом сосуде, а на следующий день ее нагревают при температуре кипения с обратным холодильником для завершения реакции. После того, как смесь охладит,; осадившуюся дициклогексилмочевину отделяют путем фильтрования. Полу,ченное при концентрировании фильтрата вязкое масляни.стое вещество вносят в колонку с силикагелем /360г/ дпя получения 11,3 г /61,18% от теоретического/ очищенного сложного эфира в виде бесцветного вязкого маслянистого 25, . . вещества,л „ ;1, 53981 Д плеНКй 1780, 1740, 1.720, 151 макс -1 1140 см ppm ° / ,3 //П,2Н/, 2,3 /&,ЭН/, 3,32 /г1,ЗН, 8 Гц/, 1,5-2,0 //Л,4Н/, 2,0-2-,5 ., 5,34 Vd,E(;,2H/, 7,0-7,3 /m,2 Пример 7. Получение;2-..адлил-3метил-2--циклопентек- -.о;н- 4-ил-о(. 3-метоксифенилацетата /соединение 93/ 7,41 г /0,02 моль/ ангидрдца 1ЭТИЛ-3метоксифенилуксусной кислоты и 1,52 г /0,0 моль/ 2-аллил-3-метил-4-окси-2циклопентен-1-она растворяют в 50 мл безводного пиридина и смесь перемешивают в течение ничи при комнатной температуре.. На следующий день реакционную смесь выливают на 100 г ледяной воды и экстрагируют тремя порциями Эшлового эфира /по 20 мл/. Объединенные эфирные слои экстрагируют двумя порциями 5%-ного водного раствора гидрата окиси натрия для удаления образовавшейся в качестве побочного продукта карбоновой кислоты. Эфирный слой последовательно промывают Ш%-ной водной соляной кислотой, нйсыщенным в ным раствором бикарбоната натрия и Ha щенным водным раствором хлористого на рия и сушат над безводным сульфатом натрия. После удаления диэтилового эфира при пониженном давлении получаю 3,2 г сырого сложного эфира. Последний внЪсят в колонку с 20 г активированной окиси алюминия, в качестве элюента бер ,смесь бензола с гексаном Xi : 3/. Г1олу чают 2;УЗ г /93,1% оттеоретического/ целевого сложного эфира. л 1,5211. Ш1ен1си 1730, 1710, 1150, 1140, макс 1000,910 см CCt /t,3H, 8 Гц/, 1,53,0 /т., 11Н/, 3,36 /, 1Н.,ЗГ9 Гц/, 3,67 / .,5,1Н/, 4,7-6,0 //п,ЗН/, 6,5-6,9 /т,4н/. Пример 8. Получение З-феноксибензил-ti,-из опропил-3-метоксифенил ацетат /соединение 87/. 8,01 г /0,004 моль/ метафеноксибензилового спирта и 7,09 г /0,03 моль/ этилового эфира гЛ. -изопропилметоксифенилуксусной кислоты растворяют в 100 мл СбезводвОго дхшхопа и к смесив j качестве катализатора прибавляют 0,1 ri гидрида натрия. После этого смесь загружают в ректификационную колонку Тефлор Спинниг банд длиной 50 см и наТ)еВайт7п и перепешивЧ11ии. Реакция завершается примерно за 3 ч с удалением этанопа/в ввде азеотропной смеси с толуолом из. верхней части колонки. После выдержки и охлаждения смесь вьшивают в холодную воду для разделения слоев. После удаления толуола путем отгонкИ; при пониженном давлении получают 11,3 i. сырого сложного эфира. Продукт вне- Х сят в колонку с 55 г активированной 1 окиси алюминия и элюируют бензола с н-гексанрм /1:3/ для получения 10,12 г /86,4% от теоретического выхода из расчета на загруженный этиле- вый эфир/ целевого сложного эфира, ni 1,5377, пленки 3060, 1733, 1590, 1490, макс 1253, 1145, 775, 690 см 0,70 /ci,3n, у 7 Гц/,-0,97 / d, ЗН, 7 7 Гц/, 0,9-2,6 //71,1Н/, i 3,08 /rt;, 1П, II ГцУ, 3,65 /.г,ЗН/,| 4,95 /АВ-тип, V ,4. 2Н/, 6,5-7,4 / /П. 13Н/. Пример 9. ПолучениеЗ-феноксибенЗШ1-2-/1 , 2, З,4-тетрагидронафталин-8 -ил/-изовалерината /соединение 43/. 3,95 г /0,015 моль/ бромида метафеноксибензила, 2,32 г /0,01 моль/ 2/l-, 2-, З-, 4--тетрагидронафталин3-ил/-изовалериановой кислоты и 2,22 г /0,02 моль/ триэтиламина прибавляют к 50 мл д ;мeтилфopмaмидa и смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в 50 г ледяной воды и экстрагируют тремя порциями этилового эфира /по 30 -МП/. Объединенные слои после- j довательно промывают 5%-ной соляной кислотой, насыщенным вод:ным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия-и сушат над безводным сульфатом натрия, JQ После удаления этилового эфира при пониженном давлении получают сырой слож-, ный эфир, который вносят в колонку с / 20 г активированной окиси алюминия и элюируют смесью бензола и н-гекса- ц на /1:3/ для получения 3,45 г /83,2% от теоретического выхода из расчета на исходную карбоновую кислоту/ целевого сложного эфира в виде бесцветно- го. маслянистого вещества, п 1,5660, Д пленки 3060, 173G, 1588, 1490, макс 690 см , 770, . ррт / ,1,03 /ct,3H, и 7 Гц/, 1,5-2,0 /т., 4Н7,, 2, / d 7, . 11, це на I пр эти ва -2,6 ,1Н/, 2,5-3,0 //72,4Н/, 2,..а , Ш, 3 11 Гц/, 4,74 / 5.2Н/, 5,6 /т, 12Н/. Аналогично описанному в примерах были получены соединения формулы лриведеввыё .в нижеследующей таблигде буквами а, в, с, ct , е о.бозены следующие методы этерификации: а/ этерификация с использованием хлррангидрида кислоты; / этерификация с использованием ангидрида кислоты; с/ дегийра -ационная этерификация кислоты и спирта при помо|ци дицикпогексилкарбодиимида в среде инертного растворителя; dl этерификация путем транс-этерификации с применением в качестве катализатора гидрида натрия в среде толуола; е/ этерификация с использованием : серебряной или риэтиламмониевой соли кислоты и галогенида спирта. В таблице приведены характерные дставители соединений, полученных ми методами, но они не ограничит изобретения.
















| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения эфиров циклопропанкарбоновых кислот | 1973 |
|
SU584759A3 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ГЕТЕРОЦИКЛОМ ПРОИЗВОДНЫХ ПИРИДИНА | 2008 |
|
RU2474581C2 |
| Способ получения сложных эфиров замещенных циклопропанкарбоновых кислот | 1975 |
|
SU727135A3 |
| ПРОИЗВОДНОЕ ТРИАЗОЛА | 2005 |
|
RU2383536C2 |
| ПРОИЗВОДНЫЕ СОЕДИНЕНИЯ КАРБОНОВОЙ КИСЛОТЫ И СРЕДСТВА, СОДЕРЖАЩИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2002 |
|
RU2296760C2 |
| БЕНЗИМИДАЗОЛЬНОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2008 |
|
RU2451017C2 |
| ПРОИЗВОДНЫЕ АМИНОХИНОЛОНА, ЗАМЕЩЕННЫЕ ФЕНИЛЬНОЙ ИЛИ ГЕТЕРОАРОМАТИЧЕСКОЙ ГРУППОЙ | 1993 |
|
RU2124510C1 |
| ПРОИЗВОДНЫЕ 8-ТРИФТОРМЕТИЛХИНОЛИНКАРБОНОВОЙ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ ВИРУСА ИММУНОДЕФИЦИТА | 1995 |
|
RU2140919C1 |
| ПРОИЗВОДНЫЕ 2-АРИЛПРОПИЛОВЫХ ЭФИРОВ | 1992 |
|
RU2045511C1 |
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2007 |
|
RU2456278C2 |

/.
56
1 60
|/,
оэ
1Л N- Ю 1Л
и
1Л
LA
ir
N Формула изобретения 1. Способ получения производных уксусных кислот формулы У - С - СООХ . /1 / где У группа общих формул (IT)Ofl) (1У) где R, и К„ независимо друг от друга атом водорода, галогена, цианегруппа иитрогруппа, низший алкил, низший алкенил, низший апкинил, низший алкоксил, низший алкоксиалкил, галоидзамещенньш низший апкил, галондзамещенньш низший алкенил, галоидзамещенный нйзшиГ алкинил, низшая апкшггиогруппа, низшая алкилсульфоксильная группа, адильная, ацилоксигруппа, низший алкоксикарбонил, низший алкенилоксикарбонил, низший алкинилоксикарбонил или R и R вместе - мётиле диоксигруппа, татра- или триметиленов.эя группа; R- и R, незанисимо друг от друга атом водорода, галогена, цианогруппа нитрогруппа, низший алкил, низший алкенил, низший алкинил, низший апкоксил, низший алкоксиалкил, галоидзамещенный низший алкил, д алоидзамещен ный низший алкенил, галоидзамещенный низший алкинил, низшая алкилтиогрупна, низшая алкилсульфоксильная групп ацильная, ацилоксигруппа, низший алкоксикарбонил, низший алкенилоксикар НИЛ И.ПИ низший алкинш гоксикарбонил; А - атом кислорода или серы; R. - атом водорода,, галогена, циа группа, нитрогруппа или низший алкил т 1-3; Kg - атом водорода, галогена, циа группа, нитрогруппа или низший алкил П- 1-3; пунктирная линия в формуле /У/ представляет собой двойную связь, на ходящугося в сопряженном или несопряж м положении с кетоном , ил У - заме1це1{ная этиленовая группа общ формулы ,Х где R-,, Rg и Е„ образуют ачоскоеть -вместе с двойной связью ь положении й-; у1 - эфирной группы и каждый lU зависимо друг от друга - атом водорода, низший .алкил, низший алкенпл, низший алкинил, атом галогена, ацильнан или ацилоксильная группа; 2 с прямой или рачветьленаой цепью низший алкил, низший алкенил, низший алкинил, низший апкоксил, цианогруппа, галоидзамещенный низший алкил, галоидзамещенный низший алкенил или алициклическая группа с 3-7-атомами углерода; I X - группа общих ф(5рмулi Ши)1° (VII) (УШ) СН2-СН С-СН2-К16 W где К.„ - аллип, проларгил, бензил, тенил, фурилметил, фенокги- или фенилчиогруппа;Я.. - атом водорода, мегил, грифторметил или атом галогена или R „ и R. . вмесге образуют три- или тетрамети .г еновую группу; S2 цианогруппа; J t 1 или 2; В - атом кис-яорода, серы или группа -СН-СИ-; R.- - фталимид, тиофталимид, диили тетрагидрофталим -1д или диалкилмалеимид;S.., - алкил, пропаргил, бензил или алкадиенил;. 1 г атом водорода или метил; R ,. - фенил, тиенил или фурил; v метил или атом галогена, отличанлдийся тем, что кислоту общей формулы2У - сЛ - СООН(XI) где У и Z имеют вышеуказанные значения, или ее функциональртые производные: ангидрид, галоидангвдрид, сложный эфир, образованный со спиртом, имеющим низкую температуру кипения, или соль телочного мета.гша, серебряную соль мли соль, образованнуюС треt органическим основанием, под- i
|вергают взаимодействию со спиртом общей формулы
X - ОН (ХП)
где X имеет вьшеуказанные значения или с его галогенидом, или сульфоксидатом в условиях дегидратации, например в присутствии циклогексилкарбодиимида,
2, Способ по п. -1, отличающийся те.м, что в случае, ко.гда используют галоидаигидрид кислоты формулы XI, процесс проводят в присутствии акцептора галоидоводорода, например пиридина, при комнатной температуре, I 3. Способ по п. I, отличающийся тем, что в случае, когда используют сложный эфир кислоты формулы XI и
i спирта ( р. низкой температуро кипе|Ния, например метанола, процесс проводят в присутствии основного катализатора, например алкоголята щелочного металла, при нагревании,
4,Способ по п. 1, отличающийся тем, что в случае, когда используют соль щелочного металла, серебряную соль или соль с третичным органическим основанием кислоты формулы XI и галогенид или сульфоксилат спирта формулы ХП, процесс проводят при нагревании,
5,Способ по п, I, отличаюищйся тем, что процесс проводят в среде инертного органического растворителя,
например бензола.
Авторы
Даты
1978-10-05—Публикация
1973-07-10—Подача