гдв; f - ал КИП с 1-7 атомами С, или группа , в которой Rj - алкилен с 1-3 атомами С, возможно содержащий двойную связь или замещенный оксигруп пой, а Я - фенил, возможно 1-3 раза замещенный радикалами, выбранными из группы галоген, низщий алкил, окси-, низщий ацилокси-, низший алкилокси ил ннтрогруппами4 нафтил, дифенил или ти енил;Rg - водород или алкил с атом ми С; R g - водород; или их солей, заключающийся в том, что производное тиофена общей формулы Р - водород} или их солей, заключающийся в том, ч производное тиовена общей формулы II UL СН- СН- СК Кз в, Где R „ и R о указаны выще; X - атом водорода, или щелочного металла, или группа MgY где Y - ато галогена, подвергают взаимодействию с галоге сульфоновым производным формулы III «4.о,,г, ш Где S л - алкил или аралкил, возможно замещенные метилом, тригапоидметилом или ацетилом; Z - атом галогена в среде инертн го органического растворителя, причем случае, когда X в соединении общей фор мулы II обозначает водород, то процес ведут в присутствии органического или неорганического основания, полученное соединение общей формулы ОCH-CH-OS02lt4, В-з г Где Б , и R . указаны выше, подвергают взаимод ствию с амино формулы К NHj, V , Где .R указан ше, в среде полярного растворителя, ж латепьно использовать избыточноесКоли чество амина, и образующееся соедине обшей формулы VI СН-Й1-БНЕ иклизуюг при действии формальдегида, озможно в Одну стадию в кислой среде и инертном растворителе, возможно в два последовательных этапа: сначала соединение формулы Vl подвергают взаимодействию с формальдегидом в водной среде с выделением образую1дегося продукта, который циклизуют при действии сухого хлористого водорода в полярном апротонном растворителе, преимущественно циметилформамице, , диметилсульфоксиде, N -метилпир- ролидоне или N , N-диметилацетамиде, и целевой продукт выделяют в виде основания или соли. В качестве галогенсульфонового производного формулы III предпочтительно использовать хлориды метансульфонила, трихлорметансульфонила, трифторметансульфо- нила, бензолсульфонила, п-толуолсульфони- ла, п-бромфенилсульфонила или фторид м- цетилбен золсул ьфонила. Взаимодействие соединений общей формулы II (в случае X - водород) с галогенсульфоновым производным Щ осуществляют в присутствии основания, которое выбирают из числа третичных аминов, например триалкиламин, арилдиалкиламин, пиридин, хинолин, либо неорганических оснований, например карбонат щелочного металла, алкоголят щелочного металла, гидрид щелочного или щелочноземельного металла. Аминирование соединения общей формулы IV обычно ведут с использованием иобьзточного количества амина, который может быть легко выделен и использован в последующих реакциях. Стадию циклизации можно вести в одну или две последовательные стадии. Одностадийную циклизацию соединений общей формулы VI осуществляют в кислой среде в инертном растворителе, таком как вода или спирт, или их смесь, или другом растворителе; стойком в кислой среде. Желательно осуществление процесса при температуре кипения растворителя и Ери использовании эквимопярной смеси производного формулы YI и формальдегида. Выход целевого продукта по этому способу составляет примерно 40%. Другой вариант проведения циклизации, позволяющий получать целевые продукты с более высоким выходом, заключается в том, что на первой стадии соединение формулы VI подвергают взаимодействию с формальдегидом в водной среде, образующийся продукт выделяют в свободном от воды виде {однако этот продукт может использоваться в последующем этапе в виде раствора в инертном растворителе, например бензоле, толуоле, но важно, чтобы этот раствор был безводным), и циклизуют при действии сухого хлористого водорода в полярном апротонном растворителе, преимущественно диметилформамипе, возможно в диметилсульфоксидэ, N -метилпирролидоне, N , N-диметилацетамиде. Желательно выбирать растворитель таким образом, чтобы хлоргидрат соединения I обладал наименьшей возможной растворимостью, что облегчает выделение целевого продукта. Установлено, что часто химическое превращение соединения VI в целевой про дукт является неполным, и этот амин остается в растворе, а большая часть хлор гидрата соединения обшей формулы I осаж дается в виде кристаллов. В таком случае непрореагировавшее соединение VI лег ко подвергается циклизации по второй стадии двустадийного способа. Фильтрат, получаемый при кристаллизации, нейтрализуется водным раствором основания с выделением соецинений формул VI и I , которые вместе экстрагируют растворителем, несмешиваюшимсяос водой Утот экстракт циклизуют в конечный про дукт по двустади ному процессу. Пример 1. 5-( 2-Xлopбeнзил)- -4,5,6,7-тeтjэanшpoтиeнo 3,2-с пиридан. I. 2-( 2-Тиенил)- танол. ЮО моль бутиллития (6,4О кг) в виде раствора в 64 л гексана добавляют к НО моль тио фена (8,75 л), смешанного с 10 л обеэвоженного тетрагидрофурана в инертной атмосфере (в азоте), Экзотермическая реакция протекает при стекании флегмы .введение бутиллития осуществляют в течение 1 ч 30 мин при использовании соответствующего охлаждения. Затем реакционную среду охлаждают до 10 С и к ней добавляют раствор 105 моль (4,62 кг) окиси этилена, растворенного в Ю л тетрагидрофурана. Протекает экзотермическая реакция, и температуру поддерживают не выше 25 С за сче oxiлаждения. Продолжительность этого процесса составляет примерно 1 ч. Осаждается тиеннлалкоголят лития. Затем в р& акционную среду добавляют 6 н. соляную кислоту до тех пор, пока реакционная ср& да не становится нейтральной. Далее DI ганический слой отделяют, упаривают в остаток подвергают п егонке при пониженном давлении. Получают 12,47 кг (выход 79%) 2-(2-тиенил)-этанола. II. п-Толуолсульфонат 2-( 2-тиенил)-STWiB. 8,32 кг (65 моль) 2-(2-тиенил)- -этанола перемешивают с 12,68 кг ( 66,6 моль) хлорпда п толуолсульфонила и 6,8 кг (67,2 моль) триэтиламина и 63 л диизопропнлового эфира при комнатной температуре. После перемешивания в течение 70 ч реакционную смесь выливают в 40 л воды. Органическую, фазу промывали насыщенной углекислотой водой и чистой водой до нейтральной реакции Высушивают над сульфатом натрия. После упаривания растворителя получают 16,62кг (90,6О7о) п-толуолсульфоната 2-(2-тиейил)-этила. П1. Хлоргидрат N-( 2-xлopбeнзил)-2-(2 иeннл)-этнлaминa. 850 г (3 моль) п-толуолсульфоната 2-( 2-тненил)-втила и 85О г (6 моль) о-хлорбензиламнна растворяют Б 3,2 л ац&тонитрила, и смесь нагревают с обратным холодильником в течение 6 ч 30 мин. После охлажде шя 630 г п-толуолсульфонат о-хлорбензиламина отфильтровывают. Фильтрат упаривают и остаточный продукт растворяют в д изопропиловом эфире и 50О мл 2 н. раствора гидрата окиси натрия. Органическую фазу извлекают, затем подкисляют 3 н. соляной кислотой, В осадке получают продукт в форме хлоргидрата, его отделяют фильтровагагем, промывают.ацетоном. Таким образом получ;1ют 684 г целевого продукта (выход 78%). Это соединение может быть также получено непосредственно из производного формулы II следующим образом. В раствор 87,5 мл тиофена (1,1 моль) в ЮО мл тетрагидрофурана при 35-ЗЭ С вводят раствор 64 г бутиллития (1 моль) в 1 л гексана. Смесь охлаждают до icfc и вводят в нее раствор 48 мл окиси этилена (1,О8 моль) Б 5О мл тетрагидрофу- рана с такой скоростью, чтобы температура не превышала 25°С, Затем реакционн1то среду охлаждают до -2ОС и вводят в нее раствор 19О,5Ог (1 моль) хлорида п-толуолсульфонила в . 250 мл тетрагидрофурана, поддерживая при этом температуфу примерно -20 С. Затем доводят температуру смеси до и вводят в нее 282 г (2 моль) о-хлорбензиламина. После нагревания с обратным холодильником в течение 18 ч эту реакционную смесь охлаждают и добавляют 6ОО мл воды. Водную фазу экстрагируют диизопропиловым эфиром и объединенные вместе органические фазы упаривают. Остаточный маслянистый продукт снова подвергают воздействию диизопропилового эфира и 4 н, соляной кислоты. В осадке получают хлоргидрат целевого продукта, после промывки его ацетоном получают 112 г это го продукта (общий выход| рассчитанный из бу1иллития, составлял 39%),, IV . Хлоргидрат 5-( 2-хлорбензил)-4,5, 6,7-тетрагидротиено з,2-е пиридина, 15 г (0,О52 моль) соединения, полученного в п. 1П,1ОО мл воды и 5 мл водного раствора формальдегида концентрацией 35% (0,058 моль) нагревают при в течение 15 мин, после чего добавляют 1ОО мл соляной кислоты (2 н.) и нагревают при 90С еще в течение 1 ч 30 мин После охлаждения образующийся легкий осадок отфильтровывают. Водную фазу подщелачивают 2 н, раствором гидрата окиси натрия, после чего экстрагируют 350 мл диизопропилового эфира. Органическую фазу промывают водой, высушивают над сульфатом натрия и упаривают, в результате получают 11,32 г прозрачного масла оранжевого цвета. Это масло растворяют в изопропиловом эфире, после добавления сухого хлористого водорода осаждается Юг хлорпздрата, который перекристаллизовывают из абсолютного кипящего этанола (выход 64%). П р и м е р 2. 5-( 2-Хлорбензил)-6-метил-4,5,6,7-тетрагидротиено , ридин. 1. Тозилат 1-(2- иенил)« пропанола-2 К охлажденному до заствору 135 г (0,71 моль) хлорида тозила в 36О мл обезвоженного пиридина добавляют по кап лям раствор 98,1 г (0,69 моль) 1-(2- -тиенил)-пропанола-2 в 36О мл обезвоженного пиридина. Смесь выдерживают в холодильнике в течение 65 ч,выливают в 2,5 л холодной воды. Образующийся осадок отфильтровывают, промывают водой и затем вьюушлвают. Выход гфодукта 182,8 г; 89%j т. пл. 68°С. П. Хлоргидрат N-(р-хлррбензил)-1- -мети№-2-(2-тиенил)-этиламина. Смесь 18,2 г (О,О615 моль) тозилата, 1толученного ранее, 17,4 г (0,123 моль) о-хлорбен зилами на и 50 мл толуола нагре вают с обратным холодильником в течение 24 ч. Псх;ле охлаждения добавляют 50 мл воды и 35 мл 2 н. раствора едкого натра и экстрагщэуют эфиром, Эфирь ный экстракт подвергают обработке 6 н. водным раствором соляной кислоты при интенсивном перемешиваниио Образующийся при этом осадок фильтруют, промывают эфиром, высушивают. Выход продукта 11,6 г (66%); т. пл. 166°С. III. 5-(о-Хлорбе11зил)-6-метил-4,5,6,7-тетрагидротиено 3,2-с}пиридина. Смесь 1 г хлоргидрата амина, полученного в п. II, 20 мл воды, 3 мл формалина в водном растворе концентрацией 35%, и 0,5 мл концентрирошзаной соляной кислоты нагревают с обратным холодильником в течение 2 ч 30 мин. После охлаждения подщелачивают 2 н. раствором едкого натра и экстрагируют эфиром. Эфирный экстракт высушивают и упаривают досуха. Полученный осадок очищают на хроматогра- фической колонке, наполненной двуокисью кремния (элюент - смесь бензола с этилацетатом в соотношении 7:3). Полученный 5-( о-хлорбензил)-6-метил-4,5,6,7-тетрагидротиено з,2-е пиркдин растворяют в эфире и о абатывают эквивалентным количеством хлористого водорода, растворенного в эфире. Образующийся хлоргидрат перекристаллизовывают из смеси диизопропилового эфира с изопропи- ловым спиртом. Выход продукта 300 мг, 28%; т.пл. 178-182°С. Пример 3. Хлоргидрат 5-(2-хлорбензил)-4,5,6,7-тетрагидротиено 3,2-е пиридина. 1. К 25 Г5 г (1О моль) N -( 2-хлорбензоил)-2-( 2- иенил)этиламина д бааляют при перемешивании 946 г 35%-«ого раствора формальдегида (11 моль) в во де. Реакция npoTeitaeT быстро и слегка экзотермично. Водную фазу декатируют, промывают водой и органическую фазу азеотропно высушивают. Получают 2780 г промежуточных продуктов этапа I. П. Смесь полученных таким образом сфомежуточных продуктов вводят в 5 л 5 н. раствора хлористого водорода в ди- метилформамиде. Протекает экэотермичеокая реакция и температура повышается до С, которую подд живают за счет внешнего охлаждения. Введение продукта в раствор хлористого водорода, гфодолжа- ют в течение примерно ЗО мин. Через 1О мин начинает выпадать в осадок хлоргидрат 5-( 2-хлорбензил)4,5,6,7-тетрагидрот иен о 3,2-с пиридина. Ег о охла ждают до комнатной температуры, и когда выпадение осадка прекращено, осадок отфильтровывают и промьтают ацетоном. Получают 192О г. Фильтрат содержит еще 330 г целевого продукта и325 г N- 2-хлорбензип) -2- (2-тиенил) -этиламина. Сте пень химического превращения этого амина 87,1%, выход 86%, из которого большая часть находится в виде осадка. Для того, чтобы извлечь непрореагировавший исходный амин и неосажденный целевой продукт, фильтрат подвергают следующей обработке. Фильтрат выливают в воду, содержащую едкий натр, выделенные амины экстрагируют спористым метиленом, который обрабатывают формалином и вновь циклизу- ют согласно способу, описанному выше. Степень химического превращения и вь ходы, рассчитанные по N -( 2-хлорбензил)-2-(2-тиенил)-этиламику, содержащемуся в фильтрате основного этапа, приблизительно Одинаковы. Производные, представленные в табд. 1 и 2, получены аналогично. Таблица 1
II
64О665
, Продолжение табл. 1





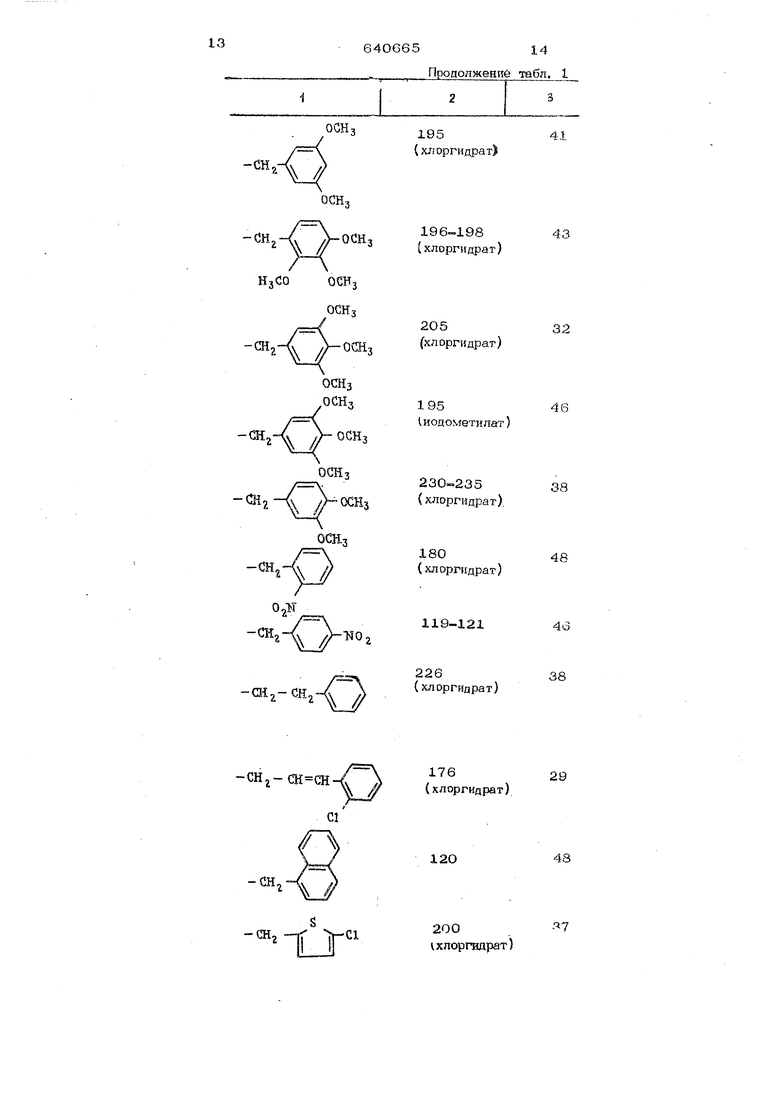



-at,
122
38
ги -f
v // (хлоргидрат)
г ОСОСНз 86
-СН
43
34
90
-(М,
ОШз
OCHj
100
48
(иодометилат)
210
35
(хлоргидрат
13
64066514
Продолжение табл. 1
ООН,
CHi
19541
(хлоргидрат)
л-оси,
-сн.
-ж
-сн,-сн снCl
196-19843
(хлоргндрат)
20532
(хлоргидрат)
19546
1иодометнлат)
230-235
38 {хлоргндрат).
180
48 (хлоргндрат)
119-121
4о
22638
(хлоргидрат)
176
29 (хлоргидрат)
-сн.
48
12О
- СН2 lj
200 хлорпшрат)
15
64066516
Прополжение табл. 1
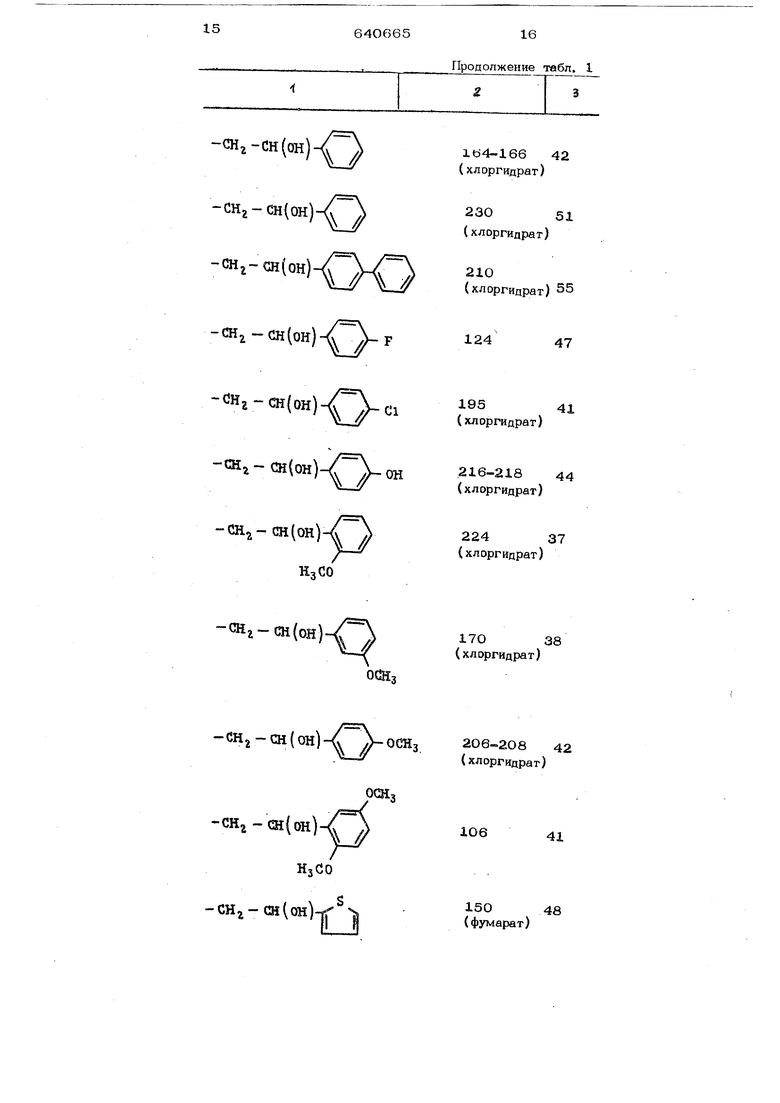
-СНг-Ш(он)
-снг-сн(он)-((
(он)v/ /)
1Ь4-166 42
(хлоргидраг)
23051
(хлоргидрат)
210
(хлоргидрат) 55
(ОН)- Л-F
Нг-сн(он) /г
(он) -cai-i- сн(он)
НзСО
12447
19541
(хлоргидрат)
ОН216-218 44
(хлоргидраг)
22437
(хлоргидрат)
снг-сн(он)
17О38
(хлоргидрат)
--СН2-Сн{он)-4 Л-ОСИ
206-208 42 (хлоргидрат)
-CH -CH{OH)
10641
-CHj- сн(он)
15048
(фумарат) Где R - алкил с 1-7 атомами С, или группа в которой Kg - алкилис с 1-3 атомами С, возможно содержащий двойную связь или замещенный оксигруппой, Pg - фенил, возможно 1-3 раза за мешенный радикалами выбранными из группы галоген, низший алкил, , киэ ший аиилокс№-, низший алкилокси- или нитрогруппами нафтил, дифенил или тиенил;2 водород или алкил с 1-3 ат« мами С; Р 9 - водород} или их солей, из производного тиофена включающий стадию циклизации, отличающийся тем, что, с целью yi рЬш&1ия процесса, производное тиофена обшей формулы II гт сн - сн - ох к. R,
где
и PJ указаны выше; X атом водорода, или иголочного д, или группа MgrY гпе Y - агом
металла. галогена,
подвергают взаимодействию с галоген- сульфоновым производным формулы III
,III
Где R алкил, арил или аралкил, во( но замещенные метилом, тригалоидметилом или ацетилом, а 2 - атом галогена, в среде инертного органического растворителя, полученное соединение обшей форму лы rV
-сн-снOS02R4 IV
RI R,
Где Rg % 4 указаны выше, 20 подвергают взаимодействию с амином формулы iV NH, Y , где i указан выше,
в среде полярного растворителя, и о&разующееся соединение обшей формулы 1
2S
i 1
CH-CH-llHR
j vr R, R, циклизуют при действии формальдегида, и целевой продукт выделяют в виде основания или соли. 2.Способ по п. 1, о т л и ч а ю щ и йс я тем, что взаимодействие соединения общей формулы II , гце X обозначает водород, с соединением общей формулы III ведут в присутствии органического или неорганического основания. 3.Способ по п. 1, D т л к ч а ю ш и и с я тем, что галогенсульфоновое производное формулы DI представляет собой хлорид метансульфонила, трихлорметансулыфонила, трифторметансульфонила, беиэолсульфонила, п-7олуолсульфонила, п-бромфенилсульфонила или фторид м-ацетилбенюлсульфонила. 4.Способ по П.1, о т л и ч а ю щ и йс я тем, что при аминировании используют избыточное количество амина. 5.Способ по п. 1, отличаю щийс я тем, что циклизацию осуществляют в одну стадию в кислой среде в ииертиом растворителе. 6.Способ по п. 1, о т л и ч а ю - ш и и с я тем, что циклизацию осуществляют в два последовательных этапа: сначала соединение формулы 71 подвергают взаимодействию с формальдегидом в водной среде с выделением образующегося продукта, который циклизуют при действии сухого хлористого водорода в полярном апротонном растворителе. 7.Способ по пп. 1 и 6, о тл и ч аю щ и и с я тем, что полярный апротонный растворитель представляет собой дим етилформа МИД. 8..Способ по пп. 1 я 6, о т л и ч аю щи и с я тем, .чтополярный апротонный растворитель представляет собой диметилсульфоксид, N -метилпирролидон или N , N-диметиладетамид. 64 5 Приоритет по признакам: 07.02.75 по пп. 1-5. 30.07.75 по пп. 6-8. Источники информации, принятые во внимание при экспертизе 1. Заявка ФРГ № 2404308, кл. 12р 1/б1, 1974. 2.S.Qhonowiti,E.sanclb6rg-,Thiopheпе isosters oi isoci,uinotine, for Kemi,197-f,т. 32,с.217-227.
Авторы
Даты
1978-12-30—Публикация
1976-02-02—Подача