(54) СПОСОБ ПОЛУЧЕНИЯ АЛКАЛОИДОВ СПОРЫНЬИ :--. 1 . V. .... .,,: ,. Изобретение относится к химико-фа мацевтической прокыишенности, к полу чению алкалоидов спорыньи. Предложенные алкашоиды новые и способ их получения в патентной и на учнб-технической литерату ре не описа Целью изобрё,тенияявляется получе ние алкалоидов спорыньи общей форму Bi он)- NH где Rj( -метил, этил, изопропил,. . , п,«Нг-| 1 -Сн 0- 1 . : -..- -. ., . ; .:: .незамещенная тшиейная С -С -алкильная группа, галогензамещенная линейная Со,-Сб-алкильнаЯ группа, галоген замещенная бутильная группа, , Ra - С -С -алкил, С -С/ -алкокси, галоген и 9,10-дигидропроизводных.: Эта цель достигается тем что штамм Ctaviceps purpurea АТСС 153ВЗ, CIZ.aviceps purpurea АТСС 20103 или cCaviceps purpurea:АТСС 20019, зависимые, от негидроксилированных аминокислот , выращивают на питательной среде, содержащей в качестве предшественника негидроксилированную аминокислоту с последующим вьщелением целевого продукта. Кроме тогр, в качестве негидроксилироваиной аминокислоты используют лейцин, фенилалании; фенилаланин, за:ме1цеиный галогеном, алкилом, радикалом алкокси, тиенилом; {V -пиразолил-, фурил-, пиридилаланин; линейные С С7-.-аминокислоты или галогензайещенные натуральные аминокислоты. Новые алкалоиды спорыньи проявляют фармакологи 1еские свойства (см. даи ные в табл. 1). Фармакологические свойства зависят от типа радикалов R, и R y.f и активность этих алкалои-.
|дов может изменяться в зависимости от того/ присутствует ли двойная связь в положении 9-10 или ее удаляют гидрированием.
Так, например, новые алкалоиды спорыньи общей формулы I, в которой RI - СЙ, а Rg - незамещенный бензил, об ладают сосудосуживающей активностью
и поэтому их можно цспользовать при Мигрени.: Производные, в которых R изопропил, а R замещенный бензил или алифатическая цепочка, имеющая гидрированную двойную бвязь в .положении, 9-10, обладают адренолитйческой активностью и воздействуют на центральную нервную систему, их можно использовать дпя лечения гипертонии.
Таблица 1




| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭРГОКРИСТИНА | 1994 |
|
RU2078084C1 |
| Способ получения алкалоидов спорыньи | 1973 |
|
SU562205A3 |
| Способ получения алкалоидов спорыньи | 1981 |
|
SU1119609A3 |
| СПОСОБ ЭКСТРАКЦИИ АЛКАЛОИДОВ СПОРЫНЬИ ИЗ СПОРЫНЬИ | 2005 |
|
RU2334750C2 |
| Способ получения алкалоидов спорыньи | 1970 |
|
SU542475A3 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКАЛОИДОВ СПОРЫНЬИ | 1971 |
|
SU291458A1 |
| Штамм гриба CLaVIcepS pURpURea-продуцент пептидных эргоалкалоидов | 1985 |
|
SU1342011A1 |
| СПОСОБ ПОЛУЧЕНИЯ АВЕРМЕКТИНА И ШТАММЫ STREPTOMYCES AVERMITILIS - ПРОДУЦЕНТЫ АВЕРМЕКТИНА | 1988 |
|
RU2096462C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН yefM-yoeB | 2005 |
|
RU2312138C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН bolA | 2005 |
|
RU2312139C2 |

Эрготамин
5 -Дибензил-5 -п-хлорбёнзилэрготамин .
Дигидроэрготамин
5 -Дибензил-5 -п-хлорбензилдигидроэрготамин
Дигидроэргркристин
5-Дибензил-5-п-хлорбензилдигидроэргокристин
. Все три новых производных проявляют по сравнению сродственными соединениями повышенную -адренолитическую активность, как при применении in vitro, так и in vivo. С другой стороны, в Некоторой степени понижается острая токсичность. Предлагаемые алкалоиды спорыньи представляют собой амиды лизергиновой кислоты, содержащие циклонпептидный фрагмент, Получаемь1й биосинтетически в результате конденсации 3-аминркислот, одна из которых, т. е. пролин, присутствует во всех веществах. Циклольный фрагмент состоит, соответственно, в случае эрготамина (, R,, СН,,) из одной молекулы фенилаланина и одной молекулы -гиЛроксиаланина; в .случае эргокристина (R CE(CHo,)j а. ) из одной молекулы фенилаланина и одной молекулы -гидроксив.алина; в Случае эргокриптина {Ri , «CHCCHo Ja Ка СНаСН(СНз)а) - нз молекулы лейцина и одной молекулы оС -гидроксивйлина.
Штаммы С. purpurea, предварительна обработанные мутагенным агентом и по. терявшие спосо Ность к росту в отсутствии негидроксилированных аминокислот (т. е. фёнилаланин или лейцин), приобретают способность образовывать алкалоиды, которые содержат в качестве конечной аминокислоты аналог, присутствующий в среде, при росте в присутствии аминокислоты, к действию которой они были мутагенно зависимыми, Или ее аналогов.
Становится возможным получить значительно более высокие выходы алкалоида,, .содержащего аналог аминокислоты в результате добавления небольших количеств аминокислоты, требуемой штамму. На перйой стадии ферментации, называемой .Трофофазой,. и последующего добавления значительных количеств аналога на второй стадии ферментации, называемой идиофазой.
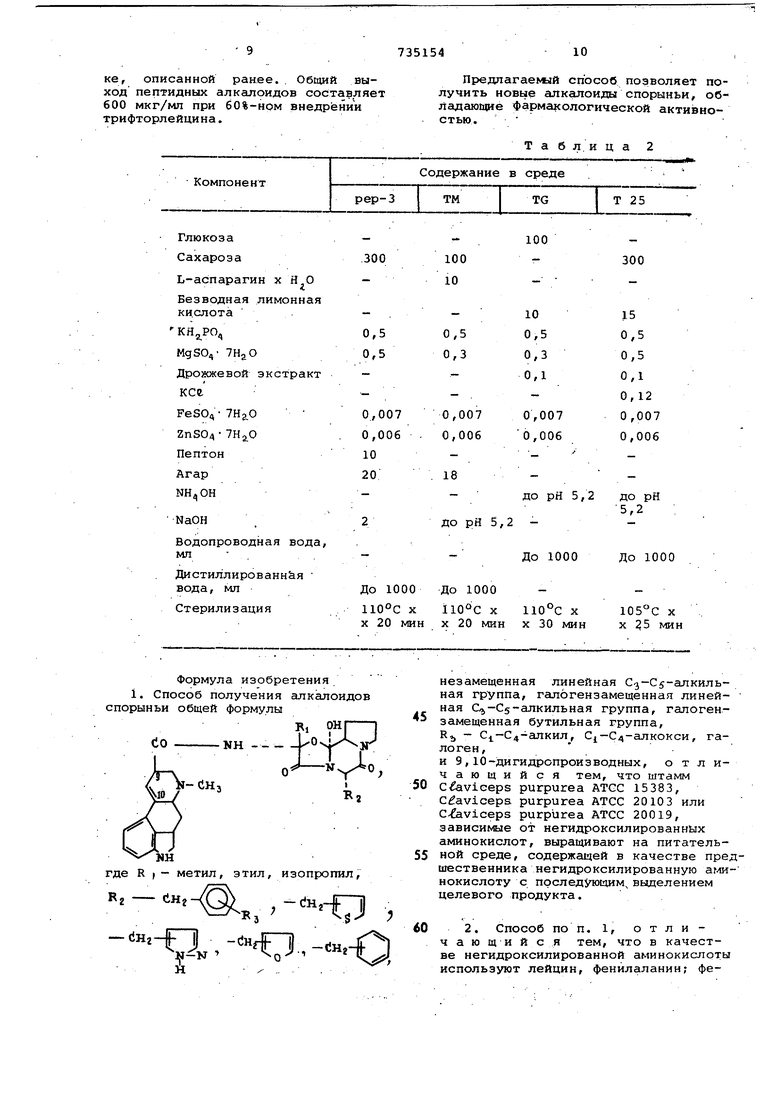
Алкалоиды спорыньи получают следующим образом..
Мицёлиальную пленку скоса со штаммов продуцентов эрготамина или эргокристина или эргокриптина суспендируют в стерильной воде и раздрабливают путем встряхивания в смеси- еле, после чего фильтруют через шелковую ткань,: Фильтрат, содержащий в основном одноклеточные фрагменты, облучают УФ-светом, чтобы добиться 9и-У9% смертности. Суспензию разбавляют стерильной водой и помещают в чашку Петри на твердую среду, is которую дополнительно добавляют аминокислоту, дпя которой отыскивают требуемые мутанты (т. е. лейцин или фенилаланин)..После инкубирования в течение необходимого времени разросшиеся колонии переносят по хорошо известной методике в среду,, не содержащую аминокислоты, для .которой отыскивают требуемые мутанты. Штаммы, способные расти в первой среде и не способные расти во второй среде, являются зависимыми от аминокислоты. Их сохраняют последовательными переносами в среду, содержащую Аминокислоту. Для получения алкалоидов требуемые мутанты выращивают в жидкой среде, со держащей источник углерода, источник азота, источник фосфора, источник серы и несколько минеральных солей, а также аминокислоту, которая требуется штамму. Количество аминокислоты может изменяться в пределах 0,5-2 г/л После инкубирования в течение 3-5 дней в культурл добавляют аминокислоту, требуемую штамму, в количестве 3-6 г/л и затем инкубируют еще в течение 9-1i дней так, чтобы общее время инкубации было 14 дней. Культивирование (ферментацию) можно проводить во встряхиваемых колбах либо в фермен торах различных размеров. . . К концу ферментации бульоны культу содержит аналог алкалоида и небольшие количества обычного алкалоида. Аналог алкалоида экстрагируют следующим образом. Бульон фильтруют и мицелий несколь ко раз экстрагируют 4%-ным водным раствором винной кислоты. После фильтра ции водную фазу подщелачивают, до рН. 9 гидроокисью натрия н экстрагируют гшористым метиленом. Органическуюфазу концентрируют, осаждают и перекристаллйзовывают в виде соли фосфорной кислоты. Из фосфора получают свободное основание и ej7O дополнительно обогащают природньйии алкалоидами путей хроматографированйя на колонке с силикагелем. Затем-, проводят отделение новых про дуктйв от природных продуктов путем .фракционной кристаллизации. Концентрацию алкалоида о/гредёляют спеКтрофотометрически послеподкра-; шивания реагентом Ван Урка, причем расчет ведут при 550 нм. . Соотношение между природными и замещеннЕлми аминокислотами, присутствующими в пептидном фрагменте, определ ют с помощью кислотного гидролиза ал калоида и количественным определением моноаминокислотг. Для. идентификации конечных продук тов применяют обычные методы физико-химического анализа (ЯМР, ИК- и УФспектроскопия, масс-спектрометрия и т. п.) . Фёнилаланинпотребляющие мутанты шчаммов-продуцентов эргокристина или эрготамина могут производить алкалои ды, которые внедряются в фенилаланиновый фрагмент молекулы фенилаланина замещенной в бензольном кольце галог на, алкилами или алкоксйлами. Они также могут производит алкалоиды, внедряясь в фенилаланиновый фрагмент его изоэфиров, таких как тиенилаланин, oL - и Р)-пиразолилаланин, фурилаланин, пиридилалайин. Лейцинпотребляющие мутанты штаммов-прод щентов эргокриптина могут вырабатывать алкалоиды, которые внедряются в лейциновый фрагмент молекулы линейной (-аминокислоты, имиощей 2-7 атомов С. Они также могут производить алкалоиды, внедряясь JB фрагменты лейцина природных аминокислот, замещенных атомами галогена, например . таких Как 5,5, 5- трифторлёйцин. Пример 1. 5-Дибензил-5- -ч-хлорбензилэргокристин. Мицелиальную пленку 12-дневного скоса на твердой среде Ьер 3 (см. прилагаемую табл. 2) штамма АТСС 20103 С. purpurea продуцента эргокристина в погруженной культуре переносят в 50 мл дистиллированной стерильной воды и фрагментируют в смесителе ВаринГс1. в .течение 20 с. Суспензию фильтруют Через шелковую ткань и 5 мл фильтрата выдерживают на свету (520 мкВт/см) УФ-лампы в течение 45 с. Обработанную суспензию после ра-збавления помещают на твердую среду ТМ (см. табл. 2), в которую дополнительно добавляют 1% фенилаланина, в чашки Петри. Чашки инкубируют при 28°С 10-12 дней. Раз гросшиеся колонии переносят хорошо известным способом посе.ва на чашки методом отпечатков на твердую среду ТМ в чашки Петри, и эти чашки инкубируют при 28°С в течение 10-12 дней.. В ходе сортировки 3000 колоний было обнаружено, что четыре штамма не способны расти на минимальнЬм количестве сре,цы ТМ. Эти штаммы подтверждают выделением в среде ТМ, а также в среде ТМ, в которую добавляют фенилаланин и два из них представляют со.бой мутанты, зависимые от фенилашанина. Десять колб на 300 мл, каждая из которых содержит 50 мл среды TG (см. табл. 2), в которую ддбавляют 1 г/л фенилаланина, стерилизуют при 100°С в течение 30 мин и каждую из колб инокулируютмйцелиальной плёнкой, соответствующей приблизительно 1 см среза твердой среды pep 3 штамма мутанта. Эти колбы инкубируют при 23°С 4 дня во вращающейся качалке, при скорости вращения 225 об/мин. Эти колбы соответствуют фазе вегетации. Пятьдесят колб на 300 мл, каждая из йрторых содержит 40 мл среды Т25 (cTvi. табл. 2), в которую добавляют 1 г/л 1-фенилаланйна, стерилизуют при 25 мин, инокулируют 5 мл вегетативной культуры и инкубируют при .23°С в той же качалке, что использовали для фазы вегетации. Через 4 дня в колбы добавляют 4 г/л п-хлорфенилаланина.
Через ID дней инкубирования культуры группируют, в результате чего получают около 2 л бульона, который .
содержит 700 г кг/МГ- пептиднах алкалоидов. Их экстрагируют следующим об- . раз ом .
Бульон культуры фильтруют, фильтрат отбрасывают, а мицелий суспендируют в 5%-ном водном растворе винйой
кислоты. После тцательногр встряхивания и фильтрации осадок экстрагируют еще два раза. Объединенные фильтраты подщелачивают до рН 9с помощью 2iJ%-. -ного раствора NaOH и экйтрагирутот несколько раз хлористым метиленом. Органическую фазу промывают водой, концентрируют и осаждают гексаном. Полученное таким образом необработанное оснрЬание .(0,9 г) обесцвечивают активированным углём, растворяют в 10 мл 95%-ного этанола и добавляют 0,8 мл t5%-Horo раствора . ПолученныЙ15аст1вор нагревают с обратным ХОЛОДИЛЬНИКОМв темноте 30 мин и выдерживают при 3°С 5 дней. . .,
В результате кристаллизуется фосфат (0,5 г), который содержит смесь эргокристина (20%) и 5-дибензил-5-П-хлорбензилэргокристина (80%).-Из фосфат прдщёлачиваниеМ получают необработанное основание, экстрагируют
и пёрёкристаллйзЬваваЙг из ацетона. Закристаллизованный продукт хроматографируюф на колонкё с силикагелём,используя в качесг ве элюанта смесь СНСе, и метанола (исходное соотношение 99 : 1, конечное соотношёни 90 : 10) .После отбрасывания . фракций содержащих декстрчэзойращающие изомеры, выделяют фракцию, обо гащенную 5 -диЬензил-5-Л-хлорбензилэpг6кE иcтkн6м. Последовательной перекристаллизацией из бензола, метанола, ацетона выделяют ис кбмый прбдукт ; (100 г). Кйслбтный гидролиз пейтид- ; ного фрагмента дает, аминокислоты пролйН и п-хлорфенилаланин в .сротнсяяении 1 : 1. В результате щелочного ; . гидролиза получают лизергиновую кислоту и 3,3-диметилпиройиногрйдную
Кислоту. -. -- ./ .. . ;.
п рli ,м е р 2. штамм мутанфа полученный в результате обработки УФJсветом, согласно примеру 1 йспользу- , ют для инокуляций И колб среда ФС при тех же условиях, чтЬ описа;ны в приглерел 1. К концу фазы вегетации содержимое колб объединяют, в результате чего получают 40d мл культуральнбго бульона и его используют для . , инoкyлиpoiвaния 10-литрйвого ферментера, содержащего б л среды Т25, в которую добавляют 1% фёнйлаланина. Ферментер снабжают мешалкой дискотурбинного типа, работающей при аэрации, соответствующей 0,5 л/мин и ско-рости вращения 600 об/мин. ТеМёратура инкубации. . Через четыре
дня после начала фер(ментации в культуру добавляют 4% П -хлорфенилаланина. На 13-й день ферментации с бульона культуры снимают урожай.
Общее содержание пептидных алкаоидов соответствует 600 мкг/мп, 65%
з которых представляет собой 5-дибензил-5-п-хлорбензилэргокрйстин. Экстракцию проводят по методике, Описанно.й в примере 1.
П р и м е р 3. Тот же штамм, что в примере 1, ферментируют в колбах
при тех же условиях, что,в примере 1, как на стадий вегетации, так и на стадий продуцирования, единственное отличие заключается в том, что на
4-й день ферментаци.и добавляют П-фтор-. фёнилал.анин. На 14-й день ферментации экстракцией бульона получают 750 мкг/мг пептидных алкалоидов, причем 80% из этого кбличества.составляет 5-дибензил-5-Л-фторбензилэргокристин. . : . .
П р и м е р 4. Штамм АТСС 15383, продуцент эрготамина, обрабатывают УФ-светом в условиях, описанных в примере 1. В результате обработки
получают два фенилаланинзависимых мутанта на 2000 подсчитанньк колоний. . - . ; . ,. . -. Один ИЗ этих штаммов используют в качестве прививочного материала, который добавляют в колбу ферментации При tex же условиях, что описаны в примере 1, как во время вегетативной,
так и во время продуцентной фаз. На 4-й день продуктивной фазы добавляют 4% п-хлорфенилаланйна. На 14-й день из буйьЬна получают 9GО мкг/мл пептидных алкалоидов, причей 0% из этого количества составляет 5-дибензил-5-П фторбензилэрготамин.
П р и мер 5. Штамм АТСС 20019, продуцент эргокриптина, обрабатывают УФ-светом, как описано в примере 1. В результате обработки получают три лейцинзависимых мутанта из 4000 подсчитаннйх колоний. . ;
Один из ЭТИХ штаммов ферментируют при условиях.ив среде, описанной в примере 1, причем единственное отли.чйе заключается в том, что на фазах вегетации и продуцирования добавляют
1 г/л и 2 г/л L-лейцина, соответственно. На 4-й день фазы прбдуцирования добавляют б г/л L-норвалина. К 14-му дню бульбны содержа т 1000 мкг/мл пептидных, алкалоидов, причем 80% из этого количества составляет 5-диизо-: бутил-5-к-пропилэргокриптин.
Пример 6. Лейцинзависимый
:штамм,. используемый в примере 5, ферментируют в колбах при тех же условиях, как на фазе вегетации, так и На
фазе продуцирования, затем добавляют 3 г/л 5,.5,5-трифторлейцина, на 4-й день фазы продуцирования... На 14-й . ден1ь ферментации бульоны объединяют и экстрагируют согласно общей методике, описанной ранее.. Общий выход пептидных алкалоидов составляет 600 мкг/мп при 60%-ном внедрении трифторлейцина.
Предлагаемой способ позволяет получить новые алкалоиды спорыньи, обладающие фармакологической активностью.
Т а б л. и ц а 2
Формула изобретения 1. Способ получения алкалоидов спорыньи общей формулы
-О
«-О,.,-ен,
S
незамещенная линейная С -С -алкильная группа, галогензамещенная линейная С -С5-алкильная группа, галоген5замещенная бутильная группа, R,, - GI -С4-алкил, Cj-С -алкокси, галоген,
и 9,10-дигидропроизводных, отличающийся тем, что штамм
0 C aviceps purpurea ATGC 15383, C aviceps purpurea ATCC 20103 или C viceps purpurea ATCC 20019, зависи ие от- негидроксилированных аминокислот, выращивают на питатель5ной среде, содержащей в качестве предшественника негидроксилированную агФтнокислоту с пpcлeдS oщим, выделением целевого продукта.
0

Авторы
Даты
1980-05-15—Публикация
1978-04-18—Подача