(54) СПОСОБ ПОЛУЧЕНИЯ м-ФЕНОКСИБЕНЗАЛЪДЕГИДА



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения мета-феноксибензальдегида | 1977 |
|
SU695553A3 |
| Способ получения сложных эфиров 5-хлор-3-хлорсульфонил-2-тиофенкарбоновой кислоты | 1989 |
|
SU1704632A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРХЛОРИРОВАННЫХ МЕТИЛОВЫХ ЭФИРОВ УГОЛЬНОЙ И ХЛОРУГОЛЬНОЙ КИСЛОТ | 2005 |
|
RU2288217C1 |
| 5,6-ДИЗАМЕЩЕННЫЕ 3-ПИРИДИЛМЕТИЛАММОНИЙ ГАЛОГЕНИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБЫ ПОЛУЧЕНИЯ 5-(ЗАМЕЩЕННЫЙ МЕТИЛ)-2,3-ПИРИДИНДИКАРБОНОВЫХ КИСЛОТ | 1993 |
|
RU2090558C1 |
| Способ получения бромпроизводных фурана или тиофена | 1975 |
|
SU603339A3 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТА-ХЛОРБЕНЗОИЛХЛОРИДА | 1992 |
|
RU2041199C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕНЗИЛХЛОРИДА | 2005 |
|
RU2291144C1 |
| Способ получения твердого хлорпарафина | 1977 |
|
SU687060A1 |
| АБСОРБЕРЫ УФ/ВИДИМОГО СВЕТА ДЛЯ МАТЕРИАЛОВ ОФТАЛЬМОЛОГИЧЕСКИХ ЛИНЗ | 2010 |
|
RU2519256C2 |
| Способ получения 2-хлор-5-[ @ -(2 @ ,4 @ -ди-трет-амилфенокси)-бутироиламино]-анилида @ -хлорпивалоилуксусной кислоты | 1988 |
|
SU1574591A1 |

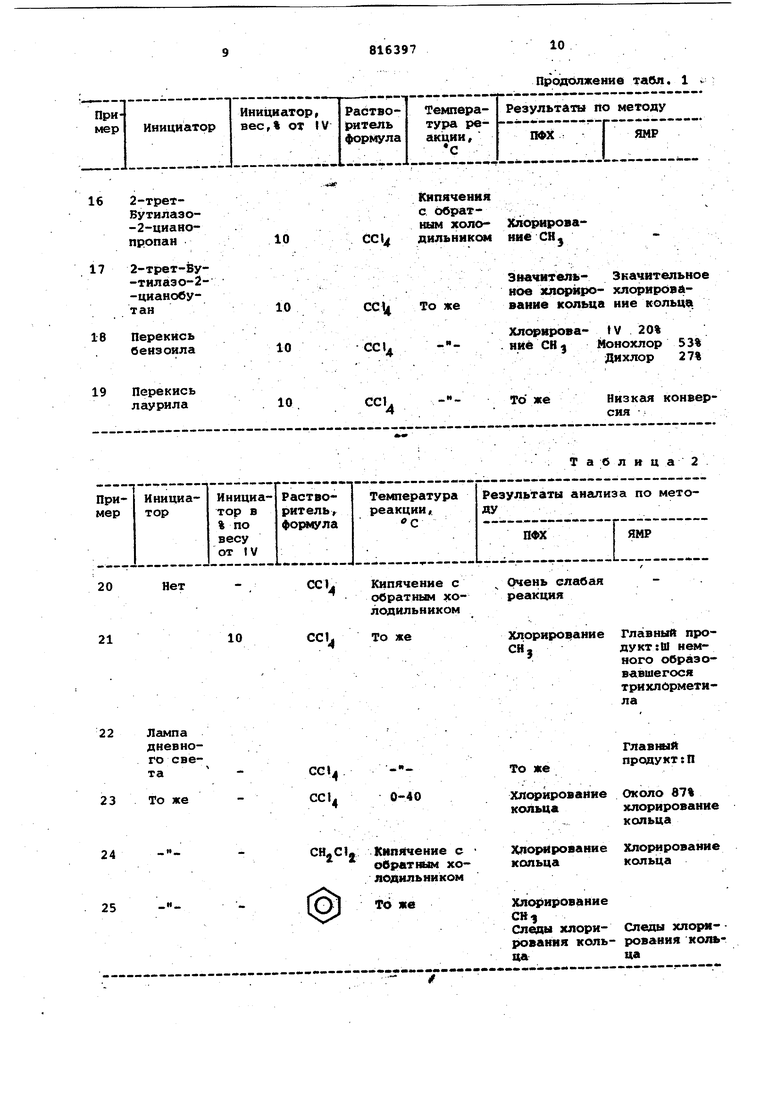
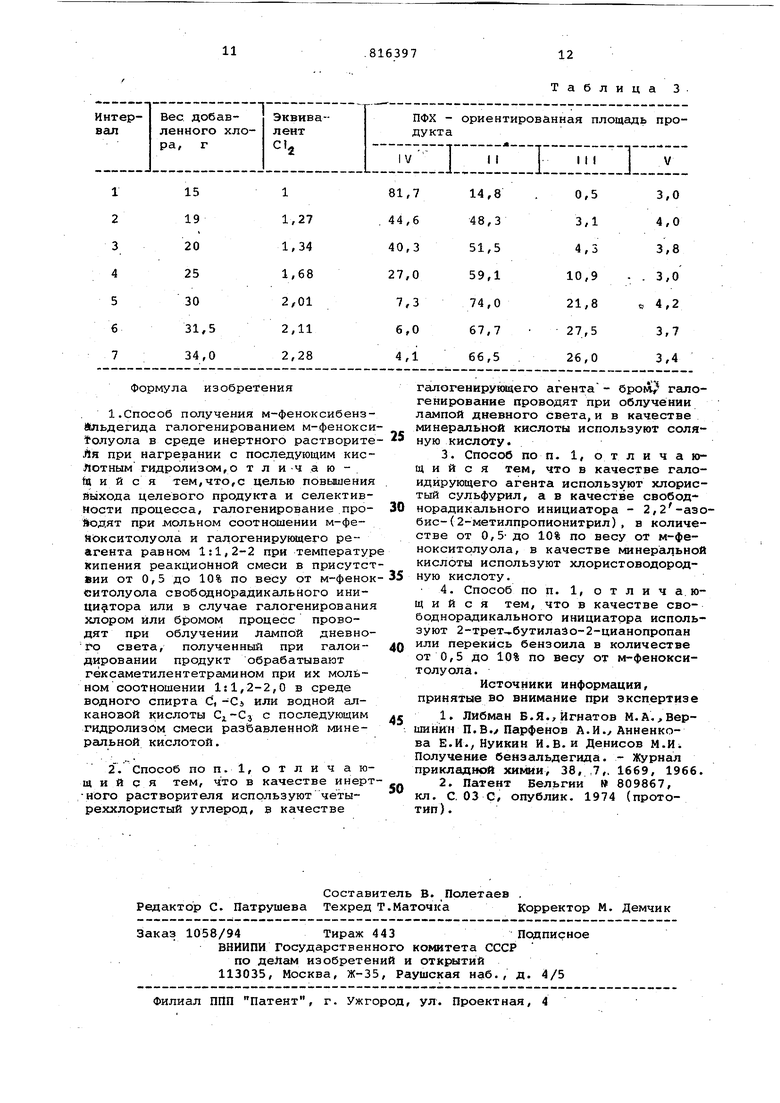
Изобретение относится к органичес кой химии, конкретно к усовершенство ванию способа получения м-феноксибензальдегида, который применяется в качестве ценного полупродукта для синтеза пестицидов пиретрондного типа. Известен способ получения ароматических альдегидов - бензальдегида из смеси бензилиден и бензилхлоридов в воде, при нагревании в течени часа до 10 О С с последукмдим выделе ни ем ректификацией. Выход 93% Однако этим способом,хотя и с вы соким выходом, получено только прос тейшее производное этого ряда бензальдегид. Наиболее близким по технической сущности является способ получения м-феноксибензилового спирта, включа щий прямое галогенирование м-фенокс толуола под действием галогенидов фосфора или гсшоидов в среде раство рителя, например бензола, преимущественно при температуре выше 220 С с последующей обработкой смеси моно и дигалоидпроизводных rHjH .-, ,-лРНЧг О-(О) и (о/О -{о) и уксуснокислы / натрием с уксусной кислотой, водой при кипячении, приводящей к образованию смеси, содержащей м-феноксибензальдегид t2. Недостатком этого способа является получение м-феноксибензальдегида с примесь.ю других ароматических производных без выделения. Кроме того, способ показывает, что на первой стадии при температурах ниже происходит сильное галогеиирование кольца и полученные таким образом продукты в значительной степени загрязняются нежелательными побочными продуктами, например 3-фенокси-б-хлортолуолом. В отличие от действия РС131 использование в реакции галогенирования хлора также приводит к значительным количествам нежелательных продуктов моно- и тригалоидометильных аналогов, дополнительно происходит и галогенирование кольца.Таким образом, обычное галогенирование дает смесь продуктов, так как не все из них могут быть прямо превращены в желаемый м-феиоксибензальдегид, то последний получается с плохими выходами и трудно выделяется в чистом виде. Цель изобретения - повышение выхода м-феноксибензальдегида, а также селективности процесса его получения. Поставленная цель достигается тем что в способе получения м-феноксибензальдегида галогенйрование м-фенокситолуола в среде инертного растворителя проводят при мольном соотно шении м-фенокситрлуола и галогенируKWero реагента равном 1:1,2-2 при температуре кипения реакционной смеси в присутствии от 0,5 до 10% от веса м-фенокситолуола свободнорадикального инициатора или в случае галогенирования хлором или бромом процесс проводят при облучении лампой дневного света, полученный при галоидировании продукт обрабатывают гексаметилентетрамином при их мольном соотношении 1:1,2-2 в среде водного спирта или водной алкановой кислоты с последующим гидролизом смеси разбавленной минеральной кислотой. Предпочтительно в качестве раство рителя, применять четыреххлористый углерод, в качестве галогенирующего агента бром с облучением лампой днев ного света или хлористый сульфурил со свободнорадикальным инициатором 2/2-азобис-(2-метилпропионитрйл), а в качестве минеральной кислоты-соляная или хлористоводородная кислоты. Предпочтительно в качестве свободнорадикального инициатора применять 2-трет-бутилазо-2-цианопропан или перекись бензоила. Можно смесь м-феноксибензилхлорида и м-феноксибензальхлорида вводить во взаимодействие с 1-2 мол-экв. гексаметилентетрамина в горячем водном этаноле или горячей водной уксусной кислоте и смесь гидролизуют разбавленной хлористоводородной кислотой. Согласно предлагаемому способу используют от 1,2 до 2 мол-экв.га-; логенирующего агента и процесс проводят в присутствии свободнорадикального инициатора или источника света, превращение галоидпроизводных м-фенокситолуола проводят под действием гексаметилентетрамина с гидролизом разбавленной минеральной кислотой . Предлагаемый способ позволяет галогенировать м-фенокситолуол в сравнительно мягких условиях, в эффектив ном для реактантов растворителе при температуре предпочтительно около точки кипения выбранного растворителя. К реакционной смеси целесообразно добавлять эффективный свободнорадикальный инициатор например - пере кись лаурила, 2,2-азобис-(2-метилпропионитрил), 2-трет-бутилазо-2-цианопропан, перекись бензоила, в количествах от 0,1 до 10 вес.%, и предпочтительнее от 1,0 до 10 вес.% м-фенокситолуола или вместо инициатора реакционная смесь может облучаться сильным источником света,например лампой дневного света, когда галогенирующим агентом является бром или хлор. К указанной реакционной смеси добавление галогенируюадего агента, например брома, хлора или хлористого сульфурила, в количествах от 1,2 до 2 мол-экв. на моль м-фенокситолуола проводят в течение времени от 1 до 24 ч или пока реакция не закончится почти полностью..Полученный таким образом продукт является смесью моно-(1I) и дигалоидо-(III) производных м-фенокситолуола, почти не содержащей или содержащей только малое количество указанных нежелательных загрязнений. Эта реакция схематически может быть написанатак с/Уу -ь се (вг ааи .. /foV fOl (П) х х (uHUiiuan op (Ш) 1 )(а,вг eu/ibHtiiu идет) Процесс галогенирования по предлагаемому изобретению дает в сравнительно мягких условиях моно- и дигаловдйпроизводные формулы II и И I, не содержащие загрязнений за счет примесей галогенированных в кольцо производных м-фенокситолуола. В связи с этим галогенированная смесь может дальше использоваться без дальнейшей очистки. Пример 1. Получение м-феноксибензальдегида. A.Смесь м-фенокситолуола (36,8г 0,199 моль) и четыреххлористого углерода (150 мл) кипятят с обратным холсщильн{ ком при облучении лампой дневного света (250 Вт) добавляя по каплям бром (64,0 г, 0,400 моль) с такой скоростью, чтобы не происходило усиления окрашивания реакционной смеси, nocjje 4 ч кипячения смесь концентрируют в вакууме и получают 75,Ог светло-коричневого масла. Протонный спектр ЯМР масла снятого в СОСЦ показывает соотношение 9:1 дибромопроизводного (для бензилового npdToaa f 6,55) к монобромопроизводному (для бензилового протона d 4,4). B.Смесь моно- и дибромопроизводных (22,5 г), состоящая соответственно из 20,26 г (0,059 моль) Mi и г (0,00854 моль) II гексаметилентетрамина (19,0 г, 0,135 моль), ледяной уксусной кислоты (2 мл) и воды (27 мл) нагревают с обратным холодильником в течение 2 ч, затем добавляют хлористоводородную кислоту и смесь кипятят с обратным холодильником еще 45 мин. Реакционную смесь охлаждают, экстрагируют эфиром и эфирный экстракт проливают ра§бавленной кислотой, щелочью, после чего высушивают над беэводным сульфатом магнитя, эфир удаляют в вакууме и получают 12,0 г м-феноксибензаль дегида в виде светло-коричневого мас ;ла. Структура соединения подтверждена ЯМР-спектром показавшим наличие альдегидного протона (tf 9,95) и ароматических протонов (d 7,25 муль типлет) в соотношении 1:9 (в COCt. В инфракрасном спектре обнаружена карбонильная группа при частоте 1680 СМ- Пример 2, Получение м-фёноксибензальдегида. A.Смесь, состоящую из м-фенокситолуола (20,0 г, 0,109 моль), 2,2-азобис-2-метилпропионитрила (AIBN, 1,89г) и четыреххлористого углерода (80 мл) нагревают с обратным холодильником в течение более 1,5ч, добавляя по каплям раствор хлористого сульфурила (22,0 г,О,163 моль) в четыреххлористом углероде (80 мл). Реакционная смесь после нагревания с обратным холодильником затем сконцентрирована в вакууме.Получают 25,8 г масла, по данным ЯМР-спектро скопии содержащего 66% монохлора и 29% дихлорпроизводного. B.Смесь этого масла (14,2 г),сос тоящая из 9,37 г (0,0357 моль) II и 4,12 г (0,oi2 моль) 1М, подвергают взаимодействию с гексаметилен- , тетрамином (17,1 г) в 60%-ном водном этаноле (85 мл) при нагревании с обратным холодильником в течение 4 ч. Затем смесь охлаждают, подкисляют хлористоводородной кислотой и экстра гируют эфиром. Экстракт высушивают над безводным сульфатом магния, кон центрируют в вакууме и 10,1 г остав шегося масла перегоняют при темпера туре от 120 до laoc (0,05 мм-Hg). Пжпучают 7,5 г м-феноксибензальдегида.. . Масс-спектр альдегида показывает отсутствие хлора в исследуемом продукте, что указывает на отсутствие хлорированного кольца во время стадии хлорирования. Пример 3. Аналогично примеру 2, но берут 0,1 г (AIBN), вместо 1,89 г получают 23,5 г масла, которое содержит 64% монохлорсоединения и 27% дихлорсоединения. Масло затем обрабатывают аналогично примеру 2 и получают 6,7 г м-феноксибензальдегида. Пример 4. Аналогично примеру 2, но заменяя 60%-ный водный эталол изопррпанолом и разбавленной хлороводородной кислотой с пропионовой кислотой, получают 7,2 г м-феноксибенз ал ьдегида . Пример 5. Аналогично примеру 2, но добавляя .17,68 г (0,13 моль) хлористого сульфурила, вместо 22 г получают 6,9 г м-фёноксибензальдегида. П р и м е р 6. Аналогично примеру 2, с 10,3 г (0,0738 моль) гексаметилентетрамина (2 мол-экв: ), вместо 17,1 г получают 7,6 г м-феноксибензальдегида. Пример 7. Аналогично примеру 2 , но на стадии в берут 14,3 г масла, ссэдержгбцего 0,0357 моль монохлорсоединения, 0,012 люль дихлорсоединения и 6,2 г (0,443 мол1,2 мол-экв.:) гексаметилентетрактна. Получают 6,5 г м-феноксибензальдегида. Пример 8-19. Оценка хлористого сульфурила «ак хлорирующего агента для хлррирования боковой цепи м-фенокситолуола при различных условиях реакции. В опытах применяют м-фенокситолуол, освобожденный от всяких остаточных фенольных загрязнений путем предварительной промывки щелочью и/или фильтрованием через силикагель. К смеси м-фенокситолуола (IV, 5,0г 0,024 моль) и 2,2-азобис-(2-метилпропионитрила) AIBN (0,05г) в четыреххлористом углероде (20 мл) добавляют по каплям хлористый сульфурил (5,45 г, 0,024 моль), затем раствор кипятят с обратным холодильником в течение 18 ч, растворитель удаляют в вакууме и остаток анализируют по (методике парофазной хроматографии (ПФХ) с помощью протонного ЯМР-спектра. По этому методу, применяя раэличные растворители и/или катгшизатооы получены данные,приведенные в табл.1. Примеры 20-25.Оценка газообразного хлора как хлорирующего агента для хлорирования боковой цепи м-фенокситолуола при различных условиях реакции. РАСТВОРмтель се мни илтоР ( i Смесь м-фенокситолуола (IV, 5,0 г) инициатора (если имеется) и выбранного растворителя (20 мл) нагревают с обратным холодильником, после чего через нее пропускают пузырьками газообразный хлор. По окончании пропускания хлора реакционную смесь нагревают с обратным холодильником в течение 18 ч, перед отбором образцов проб. По истечении этого времени отобранные образщл выпаривают в вакууме. Затем определяют процентный состав по методу ПФХ и ЯМР. Анализ по методу ПФХ в колонке 85 х 0,6 dtf. наружный диаметр) с носителем из 10% ОУ-17 на газ-хром при . Время задерживания следуклцее мин: IV 2,4, II 8,0, III 12,4, J 5,6. Структура соединения V согласуется с масс спектром и спектром С ЯМР Химические смещения протона ЯИР для соединений II, III, IV и V (сГ, ЛАД ) : II 4,45, III 6,57, IV 2,25.,V 2,2-2,3 Пример 26. Оценка инициированного светом хлорированиям-фенокситолуола в четыреххлористом углероде при кипячении с обратным холодиль ником с применением газообразного хлора в качестве хлорирукадего агента Раствор м-фенокситолуола (38,5 г, 0,21 моль) нагревают с обратным холодильником, облучая лампой дневного света (275 Вт), затем в кипящий раст вор вводят газообразный хлор и через различные интервалы времени, прерывая реакцию, отбирают образцы для анализа по методу парофазной хроматографии. В это время записывается вес хлора, поступающего из тарирован ного цилиндра, при некоторой его потери записывают. -Данные, полученные методом ПФХ (стеклянная колонка длиной 6 футов, внутренний диаметр 1/4, носитель 3% ОУ-17, температура приведены в табл. 3. После введения 34 г хлора реакционную смесь охлаждают, выпаривают
10
8AIBN
9AIBN 12/AIB 13.AIB 14.AIB 15. AIB
75-80
Хлорирование
Хлорировакольцание кольца
IV-6% МоноCl.
Кипячение Хлорировахлор 5 9 % c обрат- ние СН Дихлор 35% ным холодильникомв вакууме и получают 40,3 г оранжевого масла. Его анализ, методом ЯМРспектроскопии показан следующий состав, вес.%: IV 4,5,11 52,0,111 43,5. Эти данные относятся к 16,5 г из 34 г хлора,использованного в процессе реакции. Как показали примеры 20-25, оба аналитических метода подтверждают низкий уровень хлорирования кольца (менее 5%). Пример . Получение с/-дианобензил сложных эфиров реакцией м-феноксибензальдегида с хлорангидридами кислот в присутствии щелочного цианида. Смесь из 0,05 г-мол м-феноксибензальдегида и 0,05 г-мол хлорангидрида 3,.3-диметилспиро (циклопропан-1,1 -инден)-2-карбоновой кислоты медленно, порциями добавляют к раствору 0,075 г-мол цианида в 100 мл воды при , затем ее перемешивают 1,5 ч при и экстрагируют тремя порциями эфира по 50 мл. Экстракты промывают 10%-ной хлористоводородной кислотой, насыщенным раствором бикарбоната натрия, водой, сушат над сульфатом натрия, после чего удаляют эфир в вакууме и получают в остатке оС-циано м-феноксибензил 3,3-диметилспиро(циклопропан-1,1 -инден)-2-карбоксилат в виде желто-коричневого масла. ;Таблица IV 4% МЬнохлор 61%. Дихлор 35% IV 4% Монохлор Дихлор Хлорирование Хлорирование кольца кольца Монохлор 51% Хлорирование СН, ХлорироваХлорированиекольца ние к,ольца ХлорироваХлорированиение кольца кольца
ССIj Кипячение с
Нет
10
СС1. То же
Продолжение табл. 1
Т а б л н ц а 2 обратным холодильником
Главный продукт :Ш немного образовавшегосятрихлорметилаФормула изобретения 1.Способ получения м-феноксибенз(Лльдегида галогенированием м-фенокси foлyoлa в среде инертного растворите Ля при нагревании с последующим кисЛотным гидролизсм,о т л и -ч а ю - . fa и и с я тем,что,с целью повышения йьахода целевого продукта и селективности процесса, галогенирование проводят при мольном соотношении м-феЯокситолуола и галогенирующего реагента равном 1:1,2-2 при температур кипения реакционной смеси в присутст 8ИИ от 0,5 до 10% по весу от м-фенок ситолуола свободнорадикального иници91тора или в случае галогенирования хлором или бромом процесс проводят при облучении лампой дневно света, полученный при галоидировании продукт обрабатывают гексаметилентетрамином при их мольном соотношении 111,2-2,Q в среде водного спирта С, -С или водной алкановой кислоты с последующим гидролизом смеси разбавленной минеральной кислотой. 2. Способ по п. 1, о т л и ч а ю1Д и и g я тем, что в качестве инерт ного растворителя используют четыреххлористый углерод, в качестве
Таблица 3 галогенируквдего агента - брои галогенирование проводят при облучении лампой дневного света,и в качестве минеральной кислоты используют соляную кислоту. 3.Способ по п. 1, отличающийся тем, что в качестве галоидирующего агента используют хлористый сульфурил, а в качестве свободнорадикального инициатора - 2,2-азобис-(2-метилпропионитрил), в количестве от 0,5 до 10% по весу от м-фенокситолуола, в качестве минеральной кислоты используют хлористоводородную кислоту. 4.Способ по п. 1, отличающийся тем, что в качестве свободнорадикального инициатора используют 2-трет-,бутилаэо-2-цианопропан или Перекись бензоила в количестве от 0,5 до 10% по весу от м-фенокситолуола. Источники информации, принятые во внимание при экспертизе 1.Либман Б.Я., Игнатов М.А,,Вершинин П.В.у Парфенов А.И./ Анненкова Е.И., Нуикин И.В. и Денисов М.И Получение бензальдегида. - Журнал прикладной химии, 38, 7,, 1669, 1966. 2.Патент Бельгии 809867, кл. С. 03 С, опублик. 1974 (прототип) .
Авторы
Даты
1981-03-23—Публикация
1977-09-20—Подача