твердый сульфат аммония до достижени такой точки, которая приближается к точке насыщения растворенной солью, а величину рН доводят до 6-7 добавлением разбавленного водного раствора аммиака. Затем осадок промывают водой, а биологически активное вещество экстрагируют из него 0,1 м раствором трис-буфера с величиной рН 8,0 содержащим 0,5 М хлорида ндтрия.
Полученное биологически активное вещество представляет собой не расплывающийся белый или светло-коричневый продукт, который растворяется в воде при комнатной температуре в концентрации от 3 до 5 мг/мл. При попадании в б н,раствор соляной кислоты он образует нерастворимый белый осадок. Он растворим в пиридине, додецилсульфате натрия, 2-меркаптоэтайоле и цистиновом растворе. Добавление смеси сухого льда с ацетоном или этанолом, трифторуксусной кислоты или раствора-хлористого цинка, или раствора, содержащего металлические ионы некоторых металлов в раствор очищенного биологически активного вещества на хЪлоду (при 4°С приводит к образованию мутно-белого осадка. При попадании в смешанный раствор воды и хлороформа или н-бутанола биологически активное вещество не растворяется и в таком растворе собирается вокруг поверхности раздела между двумя жидкостями.
При нагревании водного раствора вещества до или выше оно становится мутно-белым. Ори растворении вещества в 0,1 М фосфатном буфере при рН 7,0), содержащем 0,5 М хлористый натрий при проведении диализа с использованием дистиллированной воды в качестве внешней жидкости, вещество временно становится мутнобелым, а если диализ продолжать далше, то вещество вновь полностью растворяется. Если высококонцентрированный раствор подвергают тщательном диализу с использованием 0,01 М ацетатного буфера {рН-4,5.), то это вещество приобретает светло-коричневую окраску и растворяется. Молекулярный вес вещества 77000±6400 определен фильтрованием геля через колонку с Биогелем Р-100, уравновешенным 0,1 М фосфатным буфером, который содержит 0,5 М хлористый натрий.
Содержание белка превышает 95 вес.%,а содержание сахарина составляет 1 вес..%.Концентрация липида ниже минимально определяемого предела.
Биологически активное вещество усиливает секрецию инсулина и оказывает улучшанлцее действие на поддержание уровня глюкозы, причем эти действия сохраняются и течение от нескольких недель до нескольких
есяцев после принятые одинаковой
озы. Острая токсичность LD
50 200 мг/кг живого веса.
Пример 1. Получение биологически активного вещества. Лиофилизованный и консервированный микрорганизм- Bordeteu а pertussis подвергают культивированию в чашках использованием среды Борде-Жангу ри температуре 37С в течение 2 ней, а затем с помощью платиновой етли осуществляют инокулирование казанными бактериями в 500-миллилитовой колбе для встряхивания, содерсццей 200 мл ионообменной смолы, одифицированной средой Коен-Веелера (среда KB), состав которой приведен S табл. 1, добавленной с помощью пипетки, после чего проводят процесс культивирования встряхиванием в теение от 20 до 24 ч при температуре 37С. Концентрацию бактерий в питательном растворе измеряют с помощью спектрофотометра (с длиной волны 650 nm); этот раствор добавляют в двухлитровую колбу для культивирования встряхиванием, в которую добавяют с помощью пипетки 1 л ионообменной смолы совместно с введенной в нее средой KB, вследствие -чего конечная концентрация бактерий равна приблизительно 0,lxlO кле ок/мл, а затем проводят процесс культивирования встряхиванием в течение 48 ч (частота встряхивания составляла 97 циклов/мин при температуре ).
При использовании этой жидкой среды ее добавляют совместно с дистиллированной водой, взятой в количестве, достаточном для доведения общего объема до 1000 мл, а после доведения величины рН до 7,2 добавления 20%-ного раствора гидрата окиси натрия в раствор среды дополнительно добавляют 3 г анионообменной смолы, а затем всю смесь подвергают обработке в автоклаве при температуре 121° С в течение 15 мин.
Приготовленный после 48-часового встряхивания раствор с культурой подвергают выдержке при температере 56°С в течение 30 мин, а затем центрифугированию (при скорости вращения 15000 об/мин) при температуре 4°С с целью отделения верхнего слоя и бактериальной клеточной массы, после чего полученный таким образом верхний слой раствора среды используют в. качестве исходного материала для очистки и выделения целевого активно действукндего вещества.
10 л этого верхнего слоя после доведения рН до 6,0 добавлением 1 н. раствора соляной кислоты вводят в гидроксилапатитную колонку (2,5x4 см) при расходе потока 200 мл/ч на первой стадии очистки.
Большая часть белка проходит через колонку без адсорбции в ней, и
целевую секреторную инсулиновую активность определяют с трудом. Концентрацию белка измеряют по методу Лоури.
Для определения адсорбированных веществ колонку вначале промывают 0,01 М фосфатным буфером (при рН 6,0) а затем (после повышения молярной концентрации фосфатного буфера до 0,1 и рН до 7,0) элюируют адсорбированные (.елки. Однако в этих условиях не элюир уют целевое биологически активное вещество. Дополнительное элюирование осуществляют с использованием фосфатного буфера того же состава, но содержащего 0,5 М хлорида натрия . В этих условиях целевое вещество может быть выделено с высокой эффективностью в соответствии с элюированным белком.
Полученное биологически активное I вещество концентрируют и после егЪ помещения в диализную мембрану с максимальным молекулярным весом для проникающих молекул 8000 дважды проводят диализ (в общей сложности в течение 12 ч) с использованием дистиллированной воды и дважды (в общей сложности в течение 12 ч) с использованием 0,01 М фосфатного буфера (с рН 6,0)-. Для дальнейшей очистки раствор, содержащий диализированное биологически активное вещество, пропускают через колонку (1,5x10 см) с карбоксиметилсефарозой CL-6B, уравновешенной 0,01 М фосфатным буфером (с рН 6,0). Продукты, которые не был адсорбированы в этой колонке, не проявляют никакой активности. Затем, после повышения молярной концентраци и рН фосфатного буфера соответственно до 0,1 и 7,0, аналогичное элюирование осуществляют добавлением 0,5 М соли, в результате чего получают целевое биологически активное вещество которое согласовывалось с элюироаанным белком.
Так как этот продукт все еще содержит небольшое количество примесей в дисковом электрсзфоретическом направлении, это в-ещество подвергают дальнейшему концентрированию, а после помещения в диализную мембрану дважды диализируют (в общей сложности в течение 12 ч) с использованием дистиллированной воды и дважды (в общей сложности- в течение 12 ч) с использованием 0,01 М фосфатного буфера (с рН 7,0), а затем диализированный образец пропускают через колонку (1,5x8 см) с КонА-сёфарозой 4В, которую уравновешивают 0,01 М фосфатным буфером (с рН 7,0).
В результате проявления тем же самым буфером элюируют незначительные следы белка, однако этот белковый компонент не обладает никакой активностью. Дальнейшее элюирование.
0,1 М фосфатным буфером (с рН 7,0), содержащим 0,5 М хлористого натрияг позволяет получить вещество, которое соответствует элюированному белку.
Поскольку эта часть все еще содержит незначительное количество примесей в дисковом электрофореткческом направлении, такой белковый компонент собирают, конденсируют и подвергают дигшизу с использованием
0 0,1 М фосфатного буфера (с рН 7,0), который содержит 0,5 М хлористого натрия, после чего диализированный образец подвергают гелевому фильтрованию пропусканием через колонку
5 (2,8x60 см) с Биогелем F-100, уравновешенным тем же самш буфером. В результате этого получают чистое биологически активное вещество, которое соответствует белковому
0 компоненту, характеризовавшемуся наличием пика на уровне молекулярного веса приблизительно 80000.
В табл. 2 представлены данные, характеризующие степень очистки препаратэ.
5
Степень чистоты вещества определяют в соответствии с методом дискового электрофореза с использованием полиакриламидного геля (полиакрила0мидная концентрация - 7,5%, буфер 1 н. гидрат окиси калия - ледяная уксусная кислота с рН 4,3).
Количество образца на гель составляет 30 мкг (в пересчете па белок),
5 причем эксперимент проводят с приложением тока величиной 4мА в течение 2ч, с образованием пятен амидной черни 10 в и удалением пятен с использованием 7%-ного раствора уксус0ной кислоты. Образец, полученный на этой последней стадии, представляет собой единственное вещество, которое совершенно свободно от примесей, а активность в отношении ускорения секреции инсулина, которую определяют
5 в ходе проведения эксперимента, соответствует активности выделенного вещества. Для установления подробного строения биологически активного вещества его подвергают последующему
0 НДС (натрийдодецилсульфатному) полиакриламидному гелевому электрофорезу.
Образец биологически активного вещества в количестве 50 мкг/пробир5ку (в пересчете на белок) добавляют в смесь 1% НДС, 1% 2-меркаптоэтанола и 4 моль мочевины, а после двухчасовой инкубации при температуре 37 С эту смесь помещают в 1Ь%-ный поли0акриламидный гель, который содержит 1% НДС. Затем, после чотырехчасопсго пропускания тока 8мА/гель, получают пятна с использованием Coomass гоЛу бого с последующим удалением пятен
5 7,5%-ной уксусной кислотой. Пример 2. Лиофилизованный и консервированный микроорганизм BordeteKfa pertussis (штамм 1Н 114/3779В/) подвергают культивированию встряхиванием с последующим выделением по.аналогии примера 1, в результате чего получают 10 л поверхностного слоя культуры в жидкой среде. Полученный таким образом поверхностный слой далее разделяют на две части, одну из которых пропускают через колонку с гидроксиапатитом (2,5x4 см) с расходом потока 200 мл/ после доведения величины рН поверхностного слоя до 6,0 добавлением 1 н. соляной кислоты. Эту колонку промывают водой, а затем адсорбированное вещество элюируют 0,1 сфосфатным буфером, который содержит 0,5 М хлористого натрия (с величиной рН 7,0). Полученный таким образом элюат помещают в диализную мембрану с проницаемостью для веществ максималь ного молекулярного веса 8000 и трижды проводят диализ с использованием дистиллированной воды (в общей сложности в течение 18 ч), в результате чего получают биологически активное вещество. После этого полученное вещество подвергают обработке сушкой с вымораживанием, вследствие получают тонкодисперсный порошкообразный белок коричневато-белого цвета, который ускоряет секрецию инсулина. . В другие 5 л поверхностного слоя культуры в жидкой среде добавляют до 90%-ной степени насыщения сульфат аммония (доведя рН до 6,5 добавлением слабого водного раствора аммяака), -в результате чего все белковые вещества выпадают в осадок. Затем осадок полностью промывают водой и подвергают выщелачиванию буфером 0,1 м трис-0,5 хлористого натрия (с величиной рН 9) с получением экстра ого раствора. Этот приготовленный экстрактный раствор вначале нейтрализуют 1 н. раствором соляной кислоты, а затем подвергают трехкратном дисшизу (в общей сложности в течение 18 ч) с использованием дистиллированной воды и вышеупомянутой диализной мембраны для получения биологиче ки активного вещества, в результате чего получили 11,2 мг высушенного вымораживанием пороика (образец В). Пример З.С использованием лиофилизованного и консервированног микроорганизма BordeteWa pertussis (штамм Маепо, фаза 1) повторяют экс перимент, описанный в примере 1, в результате чего получают 23,6 мг и 10,8 мг каждого из лиофилизованны порошкообразных образцов биологичес активных веществ (образцы С и Д). Удельная активность каждого обазца приведена в табл. 3. Острая токсичность (IDjQ ) для каждого образца при внутривенном ввеении мышам приведена в табл. 4. Таким образом, порошкообразные образцы биологически активных веществ могут быть использованы в качестве лекарственных или профилактических средств при диабетах, причем их эффективная дозировка находится в интервале 1-100 мкг/кг живого веса. Пример 4. Микроорганизм Bordeteje а pertussis (штамм Тояма, фаза 1) подвергают культивированию по. аналогии примера 1, а верхний слой культуры в жидкой среде, приготовленный выделением из микроорганизма, используют в качестве исходного материала. Ацетон, который предварительно охлаждают сухим льдом, по каплям добавляют в 100 л встряхиваемого поверхностного слоя с охлаждением сухим льдом до конечной концентрации 60%. После этого осадок собирают с помсядью сепараторной центрифуги непрерывного действия (скорость вргицения - 5000 об/мин, температура 4с) . Полученный таким образом остаток высушивают с получением продукта, который растворяют в 500 мл 0,01 М фосфатного буфера (с рН б,«), а затем пропускают через колонку (5x4 см) с гидроксилапатитом. Биологически активное вещество накоплено в компоненте, который элюируют 0,1 М форфатным буфером (с рН 7,0), содержсшщм 0,5 М хлористого натрия. Элюированное вещество собирают, конденсируют и подвергают диализу с использованием 0,01 М фосфатного буфера (с рН 6,0), а затем пропускают через колонку с СМ- Сефарозой CL-6B (2f5x25 см), которую уравновешивают тем же самым буфером, а биологически активное вещество элюируют 0,1 М фосфатным буфером, содержащим 0,5 М хлористого натрия. В дальнейшем биологически активное вещество,элюированное таким образом, собирают, конденсируют и подвергают диализу с использованием 0,1 М фосфатного буфера (с рН 7,0),содержавшего 0,5 М хлористого натрия. После этого вещество помещают в колонку с Биогелем Р-150 (2x105 см), который уравновешивеиот 0,1 М фосфатным буфером, содержсшим 0,5 М хлористого натрия и 4 М мочевины. Это биологически активное вещество представляет собой белок, который характеризуется нали-. чием пика для молекулярного веса приблизительно 80000 причем получают 38 мг его лиофилизованного порошка. Полученный таким образом продукт характеризуется нижеследующим химическим составом: 95 вес.% и больше белка, 1-2 вес.% углеводов, причем не обнаружено никакого липида.
Удельная активность продукта составляет 930 ед/мкг.
Пример 5. Лиофилизованный и консервированный микроорганизм Bordete t а pertussis (штамм Тояма, фаза 1) подвергают культивированию встряхиванием по аналогии с изложенным в примере 4, а выделением бактериёшьной клеточной массы из культуры в жидкой среде получают 100 л поверхностного слоя. В полученный поверхностный слой добавляют 50%-ногр водного раствора хлористого цинка со встряхиванием при комнатной температуре до доведения величины рН до 6,0 (конечная концентрация 1%). Этот осадок растворяют в 10%-ном вторичном фосфате натрия, а затем помещают в диёшизную мембрану, подвергаю диализу с использованием воды с последующим уравновешиванием 0,01 М фосфатным буфером. Затем этот раствор пропускгдат через колонку (10x5 с с гидроксилапатитом, после чего промывают 0,1 М фосфатным буфером (с рН 7,0) с последующим элюированием 0,1 М фосфатным буфером, содержавшим 0,5 М хлористого натрия. Полученный элюат конденсируют и пропускают чере колонку (2,5x100 см) с Сефакрилом S-200, а затем элюируют 0,1 М с фосфатным буфером (с рН 7,0), который содержит 0,5 М хлористого натрия и 4 М мочевины. После этого проводят гелевое фильтрование с получением биологически активного вещества.
Молекулярный вес полученного вещества равен приблизительно 7200 (с помощью гелевого фильтрования), причем получают 40 мг сухого порошка. Полученный продукт характеризуется нижеследующим химическим составом приблизительно 95 вес.% или больше белка, 1-2 вес.% углеводов, причем не было обнаружено никакого липида. Удельная активность составляла 890 ед/мкг.
Пример 6. Микроорганизм BordeteCfca pertussis (штамм Тояма, фаза 1 подвергают культивированию в среде Борде-Жангу при температуре в течение 2 дней, а затем в скошенной среде Борде-Жангу при темпера туре 37°С в течение 20-24С, после чего с помощью платиновой петли указанными бактериями инокулируют модифицированную твердую среду Коен-Веелера с добавленным в нее древесного угля (среда KB), состав которой приведен в табл. 5, с последующим культивированием в течение 48 ч при температуре . 5 кг полученной влажно бактериальной клеточной массы суспендируют в 5 л дистиллированной воды и выдерживают в ней при температуре 56°С в течение 1ч.
После охлаждения в суспензию добавляют thimerosaE- до достижения ее конечной концентрации 0,01% и ее
подвергают центрифугированию (скорость вращения 15000 об/мин) в течение 30 мин для отделения бактериальной клеточной массы. Собранную клетоную массу суспендируют в дистиллированной воде, которая содержит 4 мо мочевины и 1 моль хлористого натрия, а затем подвергают обработке в ультразвуковом оборудовании при низкой температуре () для уничтожения живых клеток бактерий.
Полученную суспензию подвергают центрифугированию (при скорости вращения 15000 об/мин) в течение 30 мин а не содержащий осадка поверхностный слой подверггиот диализу с использованием воды с последующим уравновешиванием 0,1 М фосфатным буфером (с рН 0,6), после чего пропускают через колонку (10x5 см) с гидроксилапатитом. После выгФлвания адсорбированных рримесей 0,01 М фосфатным буфером (с рН 0,6) и 0,1 М фосфатным буфером (с рН 7,0) целевое вещество элюируют 0,1 М фосфатным буфером (с рН 7,0), который содержит 0,5 М хлористого натрия.
Полученное таким образом биологически активное вещество уравновешивают 0,01 М фосфатным буфером (с рН 6,0), а затем пропускают через колонку (2,5x30 см) с СМ-Сефарозой CL-6B. Эту колонку вначале про1 ывают 0,05 М фосфатным буфером с рН 6,0, а затем элюируют 0,1 М фосфатным буфером (с рН 7,0), который содержит 0,5 М хлористого натрия, с элюированием биологически активного вещества. Затем это элюированное вещество конденсиру:эт и растворяют в 0,1 М фосфатном буфере (с рН 7,1), который содержит 4 М мочевины и 0,5 М хлористого натрия, после чего пропускают через колонку (2,5x115 см с Сефакрилом S-200.
После этой операции проводят элюирование растворителем с получением 40 мг целевого вещества.
На основании результатов и:::.;ераний путем гелевого фильтрования вычисляют, что молекулярный вес равен 74000, причем продукт характеризуется нижеследующим химическим составом: свыше 95 вес.% белка, 2 вес.% углеводов, причем не было обнаружено никакого липида. Удельная активность составляет 920 ед/мкг.
Состав среды КБ приведен в табл.5. (При использовании, этой твердой среды ее растворяют нагреванием после доведения величины рН до 7,2, а затем в среду добавляют 5 г порошкообразного древеСного угля и подвергают ее обработке в автоклаве при температуре в течение 20 мин),
В качестве эффективного получения биологически активного вещества могут быть различные хроматографические обработки. Осуществление такого
метода при его соответствующем включении в последовательный ряд операций процесса получения, как это описано в примере 1, позволяет частично исключить стадии получени. В дальнейшем как очистку, так и получение при осуществлении такого метода проводят по аналогии с тем, как это изложено в примере 1. Этот метод изложен более подробно ниже.
Пример 7. Лиофилизованный и консервированный микроорганизм BordeteBSa p3rtussis (штамм Тояма, фаза 1) подвергают культивированию (как описано в примере 1). 10 л полученного поверхностного слоя культуры в жидкой среде пропускают через колонку ( размеры колонки 5x2 см, расход потока материала 60 мл/ч) с огидрокс;илапатитом, а затем промывают 300 мл 0,01 М фосфатного буфера (с рН 7,0). После этого через неё пропускают 0,1 М фосфатный буфер (с рН 7,0), который содержит О,5 М хлористого натрия, с расходом потока 15 мл/ч, с целью элюировать биологически активное вещество. Полученное вещество конденсируют до объема примерно 15 мл с использованием продукта Фикол-400 с последующим его четырехкратным диализом в общей сложности, в течение 24-часового промежутка времени с использованием 2 л дистиллированной воды, а затем его подвергают вновь четырехкрр.тному диализ в течение в общей сложности 24-часового промежутка времени с использованием 1 л 0,01 М ацетатного буфер (с рН 4,5), который содержит 0,1 М хлорида натрия или 0,1 М хлорида лития-хлористого водорода (с рН 4,5) для уравновешивания. Этот продукт пропускают через колонку с п-ацетоксиртутьанилин-Сефарозой бМВ (размеры колонки 1,2x8 см), которую уравновешивают тем же самым буфером, что упомянут выше, с расходом потока 5 мл/ч а после тщательной промывки тем же самым буфером адсорбированное вещество элюируют тем же самым буфером, к которому добавляют 0,01 ML -цистеин Полученное вещество собирают, а зате конденсируют до объема приблизительн 5 мл .с помощью продукта Фикол-100 с пйследующим трехкратным диализом в общей сложности в течение 12-часового периода с использованием 0,1 М фосфатного буфера (с рН 7,0) в количестве 2 л, который содержит 4 мол мочевины и 0,5 моль хлористого натри для уравновешивания, после чего его подвергают дальнейшему уравновешиванию с использованием того же самого буфера. Гелевое фильтрование осуществляют в колонке с Сефакрилом S-200 (2,8x95 см).
Биологически активное вещество получают в виде продукта с одним пиком молекулярного веса 65000±7000
(как это в дальнейшем определяют по истечению эталонного белка), совпадёиощим с пиком активности., Это вещество подвергают диализу (с использованием 2 л дистиллированной воды, 5 раз в течение в общей сложности 48 ч), а затем лиофилизируют с получением 2,1 мг белого порошка.
Этот продукт характеризуется единственной полосой при полиакриламидном гелевом электрофорезе (с рН геля 4,8) и нижеследующим химически составом: свыше 98 вес.% белка, причем не было обнаружено ни углеводов, ни липида.
Пример 8. Лиофилизованный и консервированный микроорганизм Bordeteee а pertussis (штамм Тояма, фаза 1), подвергают культивированию (как в примере 1), а затем 10 л полученного таким образом поверхностного слоя культуры в жидкой среде пропускают через колонку (колонка с размерами 5x2 см, расход потока 60 мл/ч с гидроксилапатитом с послдующей промывкой 300 мл 0,01 М фосфатного буфера (с рН 7,0), после чего через колонку пропускают 0,1 М фосфатный буфер (с рН 7,0) при расходе потока 15 МП/ч.
Полученное активнодействующее вещество конденсируют до 15 мл с помощью продукта Фикол-400, а затем подвергают четырехкратному диализу в течение 24-часового периода с использованием 2 л дистиллированн воды с последующим четырехкратным диализом в течение в общем 24-часовго промежутка времени с использованием 1 л 0,01 М фосфатного буфера (с рН 7,0) для уравновешивания.
Биологически активное вещество пропускают через колонку с анти-БАО-антитело-Сефарозой 4В (колонка с pa3MepaNM 1,8x13 см), а затем тщательно промывают приблизительно 20 0,01 М фосфатного буфера (с величиной рН 7,0), который содержит 0,1 М хлористого натрия, с последующим элюированием 0,1 М глицин-хлористог водорода (с рН 3,0), который содержит 2 ммоль ЭДТК и 0,15 М хлористог натрия, с расходом потока 60 мл/ч.
Элюат сразу нейтрализуют 1 М глициновым буфером (с рН 11,5) .
Биологически активное вещество собирают и подвергают трехкратному диализу в общей сложности в течение 48 ч с использованием 5 л дистиллированной воды с получением 1,9 мг белого порошка.
Молекулярный вес этого вещества составляет 70000±5000 с получением единственной полосы при полиакриламидном гелевом электрофорезе (гель с рН 4,3). Продукт характеризуется следующим химическим составом: 97 вес.% или больше белка, 1% или менее углеводов, причем не обнаруже но никакого липида. Пример 9. Фармакологическо действие белкового биологически активного вещества. Определение способности ускорять секрецию инсулина. Способность повышать скорость се реции инсулина у биологически актив ного вещества можно определить по реакции животного на стимуляторы секреции инсулина различных типов, причем обычно в качестве стимулятор для этой цели используют глюкозуi Подопытные животные. Самцы крыс Wistar (с весом от 13 до 140 г). Грубо очищенные или очищенные биологически активные вещества различной силы растворяют в физиологическом солевом растворе и внутривен вводят по 0,2 МП каждого из этих растворов под эфирной анестезией в бедренную вену подопытной крысы, по ле чего по истечении трех дней изм ряют для кг1ждого вещества секреторн инсулиновую активность. За 18-20 ч до начала эксперимента крыс привязы вают. Для измерения активности из концентрация инсулина плазме после введения глюкозы (мкед/мп) 1/G (мкед/мг) Концентрация глюкозы крови после введения глюкозы (мг/мп) Использование содержания глюкозы в, крови для расчета активности обусловлено той причиной, что количество Декретируемого инсулина в значительной степени определяется содержанием в крови сахара. Средняя величина соотношения л1/лС для животных, в организм которых вводят эксперименталь Единица вещества
Средняя величина Д1/ДХЗ для контрольной группы
Удельную активность для каждого вещества получают делением единицы на количество белка (метод Лоури и др.).
Единица и дозировка (в пересчете на белок) биологически .активного вещества, полученного по примеру 1,.указаны в табл. 6.
Образец очищенного биологически активного вещества показывает.сигмоидную. связь между реакцией и дозировкой, однако для расчета в единице и стадии очистки как для вещества, так и для его эквивалента был выбран максимально возможно линейный участок.
Это вещество позволяет-ускорять
секрецию инсулина,однако оно обладает также другими фармакологически полезными свойствами, в частности улучшенной глюкозной толерантностью, улучшенной реакциёй, состойщея в секреции инсулина,ускоренным лечением
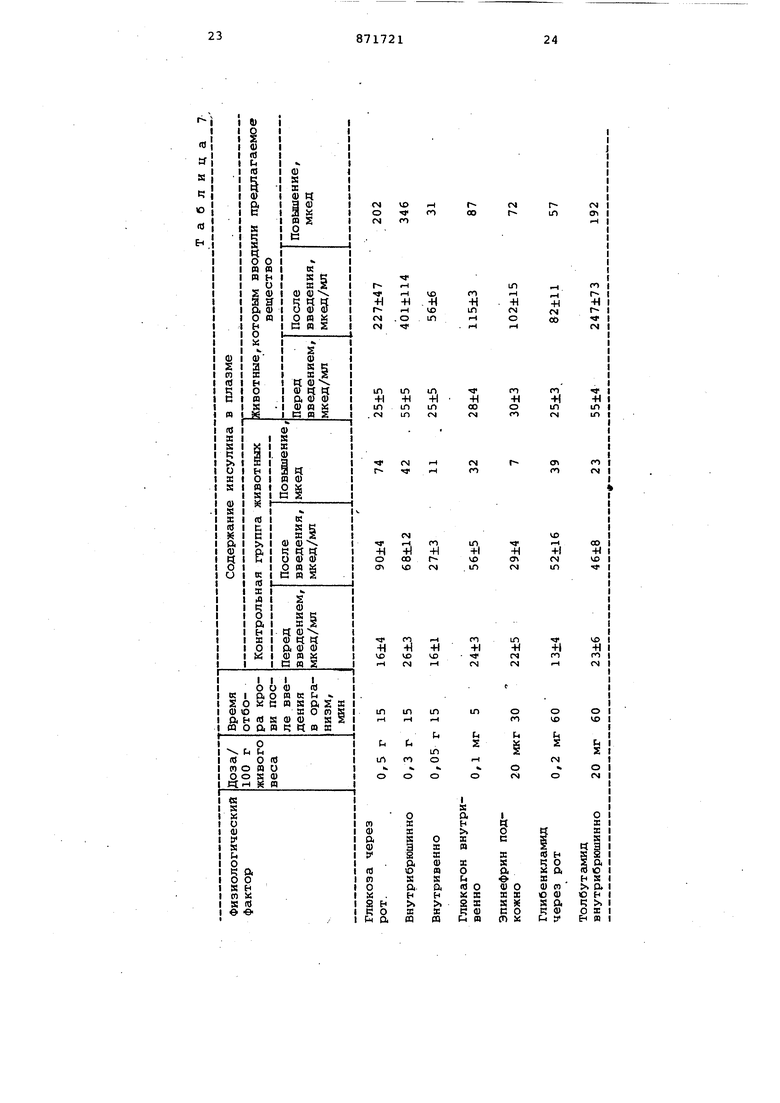
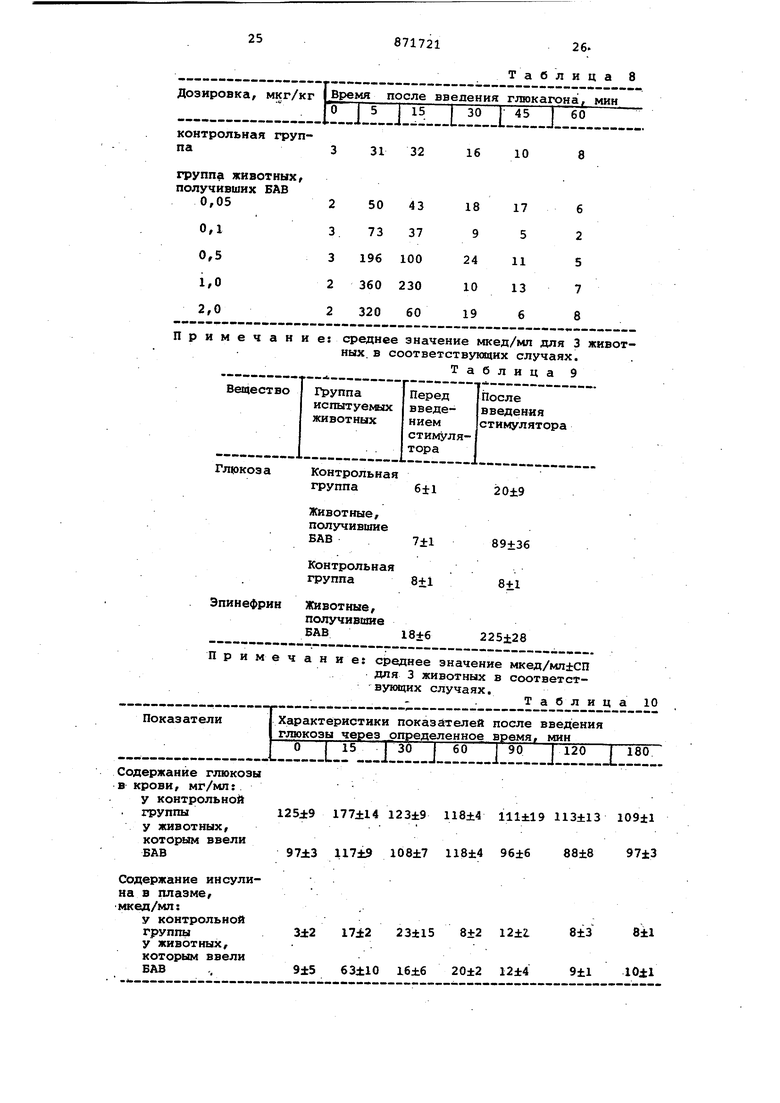
диабета, вызываемого стрептозотоцином и улучшенной глюкозной толерантностью при наследственном диабете. Это действие сохраняется в течение от нескольких недель до нескольких месяцев при единовременном введении в организм такого вещества. Это наблюдали у всех подопытных животных, включая мышей, крыс и собак, фармакологическое действие такого вещества не хвостовой вены каждой крысы отбираиот по 0,1 мл крови, непосредственно после чего внутрибркхиинно вводят 30%ный глюкозный раствор в количестве 1 МП на Кс1ждые 100 г веса тела и точно по истечении.15 мин после этого по аналогии с вышеизложенньш вновь отбирают по 0,1 мл крови. Секреторную инсулиновую активность определяют по разнице содержания глюкозы в крови и по концентрации в крови инсулина перед введением глюкозы и после введения глюкозы. Концентрацию глюкозы в крови измеряют согласно глюкозоксидазному методу, а концентрацию инсулина измеряют по двойному методу антител. Парентеральный раствор для внутривенного введения, используекый для последующего фармакологического эксперимента, готовят в соответствии с вьааеприведенным составом. Методика расчета инсулиновой секреторной активности. Вначале величины соотношений л.1/д6 активнодействуквдего вещества для группы животных, в организм которых его вводят, и для контрольной группы животных получают с прмощью следующего уравнения: Концентрация инсулина в плазме перед введением глюкозы (мкед/мл) Концентрация глюкозы в крови перед введением глюкозы (мг/мп) Единицу для каждого активнодействующего вещества можно получить с помощью нижеследующего уроннения:Средняя величина соотношения Д1/ЛС для животных контрольной группы изменяется в сколько-нибудь существенной степени в зависимости от различий видов животных. Вещество находит применение в качестве средства для лечения диaбe тов. В настоящее время процесс лечения диабетов зависит от инъекции инсулина или введения через рот антидиабетических лекарственных препаратов, однако при этом лечение является просто симптоматическим, и (как считается в настоящее время) диабеты можно назвать неизлечимым заболеванием. Более того, пациейт вынужден ежедневно приходить в больницу для инъекции инсулина, причем в этих случаях введение антидиабетических лекарственных препаратов всегда сопряжено с опасностью вызват ненормальное отклонение содержания глюкозы в крови от необходимого уровня. Достоинство этого вещества состоит в том, что оно не только само по себе обладает исключительно ценным действием, вызывающим секрецию инсулина, но также характеризуется действием, вызывакяцим повьоаение концентрации инсулина в крови толь тогда, когда содержание глюкозы в крови в определенных условиях повышается (гипергликемическое состояни в особенности при попадании в организм, глюкозы, в частности, при приеме пищи), вследствие чего содержание глюкозы в крови быстро возвращается -от повышенного к нормальному уровню, кроме того, его действие сохраняется в течение промежутка времени от нескольких недель до нес кольких месяцев после единовременно го введения в организм. Таким образом, в том случае, когда секреторна инсулиновая реакция на уровень глюко зы в крови отклоняется, введение эт го вещества в организм приводит к нормальной инсулиновой секреторной активности. Благодгфя таким свойствам это вещество находят более широ кое применение, т.е. оно является полезным не только в качестве лекар ственного средства для лечения диабета, его осложнений и старческих заболеваний, порожденных диабетами, но также оказывается э ЬФектив ным в применении на преддиабетическ стадиях заболевания ил1Гв качестве профилактического средства, лечебного или диагностического средства на начальной стадии диабета, для ко торой все еще отсутствуют лекарственные средства. Действие ускоряющее инсулиновую секрецию, предлагаемого биологическ активного вещества было испытано на крысах (сёишы крыс штамма Wistar) и собаках (как на Сс1мцах, так и самка собак ПС7РОДЫ ищейка или коротконога гончая собака). При введении крысам глюкозы, котоая является наиболее физиологическим актором, наблюдсши заметное повышеие концентрации инсулина в крови о сравнению с тем, что имеет место в контрольной группе животных независимо от пути введения глюкозы в организм. Было также отмечено заетное повышение реакционной способности в отношении стимуляторов горона, .в частности глюкогона (1 мг/кг) и эпинефрина (200 мкг/кг). Наблюдали также повышение инсулиновой секреторной активности толбутамида (20 мг/кг) и глибенкламида (мг/кг), которые в настоящее время используют в качестве клинических антидиабетических средств. На основании этих результатов было установлено, что введение в организм предлагаемого вещества позволяет заметно улучшить реакционную способность организма на попадание в него стимуляторов инсулиновой секреции. Данные стимулирования реакционной способности в отношении различных стимулятсфов инсулиновой секреции в организме крас, которым предварительно ввели биологически активное вещество, приведены в табл. 7. 1 мкг вещества вводят «нутривенно за 3 дня до начала эксперимента. В вышеприведенной таблице представлены средние величины и стандартные погрешности (СП) для 5 животных. Биологически активные вещества были введены внутривенно собакам и спустя 3 дня для проверки способности стимулировать инсулиновую секрецию в их организм вводили глюкагон (внутривенной инъекцией а дозировке 25 мкг/кг живого веса). За 18 ч до начала эксперимента подопытных животных привязали. Эксп«эриментальные результаты для введения глюкагона приведены в табл.8. Ускорение, хотя и незначительное/ инсулиновой секрецииотметили по сравнению с контрольными животными в течение 5 мин после введения глюкагона в дозировке 50 пг (в пересчете на белок); то же самое во всех остальных случаях, на килогракок живого веса, причем инсулииовая секреция ускорялась пропорционгшьно увеличению дозировки, достигая практически максимёшьной степени реашщи при дозировке 1 мкг/кг. Ангшогичную способность усиливать внсулиновую секреторную активность отметили при., введении глюкозы (через рот или внутривенной инъекцией), а также при введении эпинефрина (см. табл. 9). Эти результаты показывают, что при введении вещества у собак также наблюдается заметное повшоение реакционной способности в отношении стимуляторов инсулиновой секреции. Данные об усилении инсулиновой секреции после введения глюкагона в организм собак, которым предварительно ввели биологически активное вещество БАВ, приведены в табл. 8. Данные об усилении инсулиновой рекреции после введения глюкозы и эпинефрина через 5 мин после внутривенного введения инъекцией в организ собак, которым предварительно ввели БАВ, приведены в табл. 9. Действие в отношении улучшения глюкозной толерантности. Глюкозу вводили через рот крысам ,и собакам и производили измерения снижения содержания глюкозы и концентрации инсулина в крови животных для определения глюкозной толерантности. Глюкозу крысам давгши в дозировке 0,5 г/100 г живого веса (кр сы), и собакам в дозировке 15 г/животное, причем животных предварител но за 18-20 ч до начала эксперимент привязгши. Б организме крыс и собак, которы предварительно ввели БАВ, рост концентрации глюкозы в крови заметно подавлялся при одновременном повыше нии содержания инсулина в крови, од нако эта концентрация инсулина быст вернулась до того.уровня, на которо она находилась до введения в организм глюкозы, в соответствии с норм лизацией концентрации в крови глюко зы, вследствие чего благодаря усиле нию секреции инсулина не было отмечено никакого отклонения концентрац глюкозы в крови от нормального уров (см. табл. 10 и 11). Эти результаты продемонстрировали заметное улучшег ние глюкозной толерантности у живот ных, которым ввели БАВ. Изменения концентрации глюкозы в крови и инсулина в плазме собак пос ле введения в их организм глюкозы приведены в табл. 10. Животным, которым дали БЛВ, в ор ганизм вводили внутривенно в дозировке 1 мкг (в пересчете на белок) БАВ/кг за 3 дня до начала эксперимента. Изменения концентрации глюкозы в крови и инсулина в плазме в организме крыс после введения в него глюкозы приведены в табл. 11. Животным,, получившим БАВ, ввели его в организм внутривенно в дозировке 0,5 мкг БАВ за 3 дня до .начат этого эксперимента. Предотвращение диабета, который вызывается стрептозотоцином, предва рительным введением БАВ. Известно, что введение стрептозотоцина в дальнейшем сокращенно называемого СТЗ, вызывает у экспериментальных животньрс диабет за счет заметного разрушения В-клетки островка Лангерганса Однако було установлено,что у крыс, которым ввели БАВ, диабет, вызванный СТЗ, быстро излечивёшся, а в беспривязном состоянии содержание глюкозы в крови и глюкозная толерантность приходили в норму. Эксперимент проводят по такому методу, согласно которому в организм крыс вначгше вводят 1 мкг БАВ, а затем, спустя 3-5 дней, им вводили СТЗ (в дозировке 5 мг/100 г живого веса внутривенной инъекцией). По истечении 24 ч после введения СТЗ гипергликемию наблюдали у животных как контрольной группы, так и той группы, которой вводили БАВ, однако у животных, которым вводили БАВ, содержание-глюкозы в крови постепенно достигало нормального уровня на пятый и седьмой дни после введения СТЗ, а кЬнцентрация инсулина в крови бьлла также значительно более высокой, чем у животных контрольной группы (табл. 12). Более того, на седьмой день после введения СТЗ повторили эксперимент с введением в организм животных глю-, козы и исследовали глюкозную толерантность (табл.13). В этом случае, когда крысы были привязаны, концентрация глюкозы в крови становилась,такой же как для животных контрольной группы (которым вводили только СТЗ), так и для той группы, которым вводили БАВ, однако у животных контрольной группы наблюдсши четко заметное ухудшение глюкозной толерантности по сравнению с животными нормальной группы. С другой стороны, у животных, которым ввели БАВ, глюкозная толерантность была улучшена до такой степени, что ее можно было сопоставить с глюкозной толерантностью животных нормальной группы, а содержание инсулина в плазме в ответ на введение в организм глюкозы превышало его содержание у -животных нормальной группы. Животные, которым предварительно ввели БАВ,были извлечены от диабета,, вызываемого введенным СТЗ. в табл. 12 приведены данные о предотвращении диабета, вызываемого стрептозотоцином, предварительным введением БАВ. Данные об улучшении глюкозной толерантности при диабете, который вызван стрептозотоцином, предварительным введением БАВ, приведены в табл. 13. Улучшение глюкозной толерантности посредством введения БАВ при самопроизвольном диабете у мышей (млиь КК), анало.гичном .диабыу человека. Проводят следующий эксперимент. В качестве подопытных животных для проведения такого эксперимента используют мышей КК. Эксперимент про-. водят следующим образом. Глюкозу, вводят через рот (в дозировке 0,15 г/20 г живого веса) мышам в возрасте от 20 до 25 недель,после чего отбирают 5 животных,которые демонстрируют определенный недостаток глюкозной толерантности по сравнению с животными нормальной группы (штамм ddy). Как показано в табл. 14 у этих ьслшей не наблюдалось снижения содержания глюкозы после ее введения ;в организм, вследствие чего зтих живот ных можно было.с :0пределенностью считать больными диабетом. Животным этой группы (шшей КК вновь ввели через рот глюкозу на третий день после инъекции в хвостовую вену предлагаемого вещества. В результате установили, что их глюкозная толеранто ность была в значительной степени улучшена в сравнении с тем, что имел место до введения предлагаемого вещества. Глюкозная толергштность таки мышей является более высокой, чем у мышей нормальной гРУппы. Таким образом, можно считать, что введение в организм БАВ приводит к удовлетворительному терапевтическому эффекту при лечении сси«7произвольного диабета. Данные об улучшении глюкозной толерантности у квлией КК путем введени в их организм БАЗ приведены в табл.1 Фармакологическая активность БАВ проявляется по истечении нескольких часов после его введения в организм, достигает максимального уровня в период от 3 до 7 дней, а затем постепенно снижается. Ниже приведены результаты экспериментов по определени продолжительности действия в организ ме крыс (0,5 мкг) и собак (1,0 мкг/к У собак исследования производились по определению глюкозной толерантности в ответ на введение в орТаблица 1
Казаминовая кислота,г Дрожжевой экстракт, г Первичный кислый фосфат калия, г Растворимый крахмгш,г
0,5%-ныйраствор сульфата меди, мл
1%-ный раствор хлористого кальция, мл 4%-ный раствор хлорида магния, МП Полипептон, г 1%-ный раствор цистина,
МП
0,5%-ный раствор сульфа железа, мл
Хлористый натрий, г
2,5 ганизм глюкозы путем внутривенной инъекции на 15-ый день после введения БАВ, а также по определению действия, вызывающего секрецию инсулина в ответ на введение зпинефрина и глюкагона на 29-ый и 42-ой дни (соответственно) после введения БАВ. В результате на 42-ой день наблюдают достаточную активность (табл. 15). У крыс приблизительно 50%-ную активность по сравнению с максимальной активностью (по истечении 3 дней после введения БАВ) отмечают на 28-ой день после введения. На основании этих результатов можно сделать вывод о том, что фармакологическое действие БАВ сохраняется в течение от нескольких недель о нескольких месяцев, хотя сила такого действия вследствие дозировки является неопределенной. Данные об усилении инсулиновой секреции у собак, вызванном введением внутривенной инъекции 25 мкг/кг глюКагона на 42-ой день после введения в организм БАВ, приведены в табл. 15. Эффективная доза и способ введения в организм. Эффективная доза БАВ для лечения человека составляет от 10 мг/кг живого веса до 1 мкг/кг живого веса в случае очищенного образца вещества, однако это вещество можно также единовременно вводить в доЭ1ах, которые достигают 2 мкг/кг живого веса и даже больше. Наиболее эффективным способом, введения в организм является внутривенная инъекция, однако предлагаемое вещество можно также вводить другими путями. Предлагае1«лй способ позволяет получить биологически активное вещество, обладающее способностью усиливать секрецию инсулина и улучшать глюкозную толерантность. f Продолжение табл. 1
Таблица 2












| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения протеинового комплекса,стимулирующего секрецию инсулина | 1978 |
|
SU1012786A3 |
| ОКСИНТОМОДУЛИН ЧЕЛОВЕКА, ЕГО ПРИМЕНЕНИЕ, ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ И СПОСОБ ПРИМЕНЕНИЯ ПРЕПАРАТА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГИПЕРГЛИКЕМИИ | 2009 |
|
RU2524204C2 |
| СРЕДСТВО ГЕМОРЕОЛОГИЧЕСКОЕ, СНИЖАЮЩЕЕ ИНСУЛИНОРЕЗИСТЕНТНОСТЬ И ВОССТАНАВЛИВАЮЩЕЕ ТОЛЕРАНТНОСТЬ ОРГАНИЗМА К ГЛЮКОЗЕ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2007 |
|
RU2386634C2 |
| СПОСОБ ОЦЕНКИ СООТНОШЕНИЯ ГОРМОНАЛЬНОГО И ГЕНОТОКСИЧЕСКОГО ЭФФЕКТА ГЛЮКОЗЫ | 2007 |
|
RU2357255C2 |
| Водная композиция инсулина аспарта и инъецируемый инсулиновый препарат | 2022 |
|
RU2832344C2 |
| Средство для стимуляции дифференцировки панкреатических предшественников бета-клеток в продуцирующие и секретирующие инсулин бета-клетки при инсулинзависимом сахарном диабете | 2016 |
|
RU2636044C1 |
| СПОСОБ КОРРЕКЦИИ КОМПЛЕКСА МЕТАБОЛИЧЕСКИХ И ГОРМОНАЛЬНЫХ ПОКАЗАТЕЛЕЙ ПРИ САХАРНОМ ДИАБЕТЕ 2 ТИПА С ПОМОЩЬЮ ИНТРАНАЗАЛЬНО ВВОДИМОГО ИНСУЛИНА | 2023 |
|
RU2827354C1 |
| ПРЕПАРАТ, СОДЕРЖАЩИЙ ИНСУЛИН, НИКОТИНАМИД И АМИНОКИСЛОТУ | 2010 |
|
RU2533217C2 |
| ПРИМЕНЕНИЕ АНАЛОГОВ СИБУТРАМИНА ДЛЯ ПРОФИЛАКТИКИ САХАРНОГО ДИАБЕТА | 1997 |
|
RU2245709C2 |
| СПОСОБ СОВМЕСТНОГО ПРИМЕНЕНИЯ ИНТРАНАЗАЛЬНО ВВОДИМОГО ИНСУЛИНА И ПЕРОРАЛЬНО ВВОДИМОГО МЕТФОРМИНА ДЛЯ ВОССТАНОВЛЕНИЯ МЕТАБОЛИЧЕСКИХ И ГОРМОНАЛЬНЫХ ПОКАЗАТЕЛЕЙ ПРИ САХАРНОМ ДИАБЕТЕ 2 ТИПА И МЕТАБОЛИЧЕСКОМ СИНДРОМЕ | 2023 |
|
RU2824275C1 |

Верхний слой питательной 10000 2000 22000 среды Гидрокс и ап атитная колоночная хрома125 159 19,9 тография СМ-Сефарозная колоночная 45 251 11,3 хроматография
607 0,318 100 193,0 55 221,0 Примечание:
люкоза
Контрольная группа б±1
Животные,
получившие
БАВ
Контрольная группа 8±1
пинефрин животные, получившие БАВ 18±б
Примечание: среднее значение мкед/мл±СП Содержание глюкозы в крови, мг/мп: у контрольной 125±9 177±14 123±9 группы у животных, которым ввели 97±3 117±9 108±7 Содержание инсулина в плазме, мкед/мл: у контрольной 3±2 17±2 23±15 группы у животных, которым ввели 9±5 63±10 1б±б
Таблица 8
20i9
7±1
89±3б 8+1
225±28
для 3 животных в соответствующих случаях.
Та блица 10 среднее значение мкед/мл для 3 животных, в соответствуквдих случаях. Таблица 9 18±4 111±19 113±13 109±1 18±4 96±6 88±8 97±3 8±2 12±Z 8±з 8±1 9±1 lOil 20±2 12±4
Концентрация глюкозы , в крови, мг/мп:
контрольная группа б8±1 102±9
животные, получив51±1 72±б шие БАВ
Содержанке инсулина в плазме, мкед/мп:
контрольная группа 19±2
жи вот ные, получив25±4 126i9 шие БАВ
Животные контрольной группы. Содержание глюкозы в крови мкед/мл 94+3 375+20 360+16 355±8 351±4
Содержание инсулина
в плазме, мкед/мл 20±3 30±3 26±4
Животные, которым предварительно ввели БАВ
Содержание глюкозы
в крови, мг/мл 98±2 358±19 250+35 I99t41 145±22
Содержание инсулина
в плазме,мкед/мл 69±5 54+6
Примечание: среднее значение±СП для 5 животных
в соответствукндих случаях. Животные контрольной группы83±7 14±18 291±27 (18±2П22±5) Животные, которым . ввели БАВ82+6 159±16 177±14 82+6 159±16 (14±2П49+2Г Животные нормальной 82±3 l30tlJ 161±5 t3 , группы 7+lf( (17+1Г(42±4Г
Содержание глюкозы в крови (мг/мп)
Концентрация инсулина в плазме (мкед/мл)
Таблица 11
108+4
114±4120+4
48±5
б2±669±7
47±6
41±2
41+555±5
б9±7104±18
б1±б
24±2
62±4
Таблица13 327±23 264±32 173±lO l4l±13 155±4 138±7 Животные нормальной группы (мыши штамма ddy) Животные, боАьные диабетом, (кыши штамма ddy) до введения в организм 117±б 300±33 БАВ
После введения в организм БАВ72±3 150±11 118±9
Формула изобретения Способ получения биологически активного вещества, обладающего спо- е собностью усиливать секрецию инсулина и улучшать глюкозную толерантность, заключающийся в том, что патогенный штамм Bordete Ea ; pertussis выргицивают в питательТаблица 14 98±7 214±1б
90±8 63±11
. Таблиц
15ной среде, содержащей источник углерода, азота, минеральные соли и стимуляторы роста, с последующим выделением из культуральной жидкости белковой фракции с молекулярным весом 77000±6400, определяемым с помощью гельгфильтрации и ;очисткой целевого продукта. 339±13 192±9 144±14 За8±21 32б±40 310±39
Авторы
Даты
1981-10-07—Публикация
1978-01-31—Подача