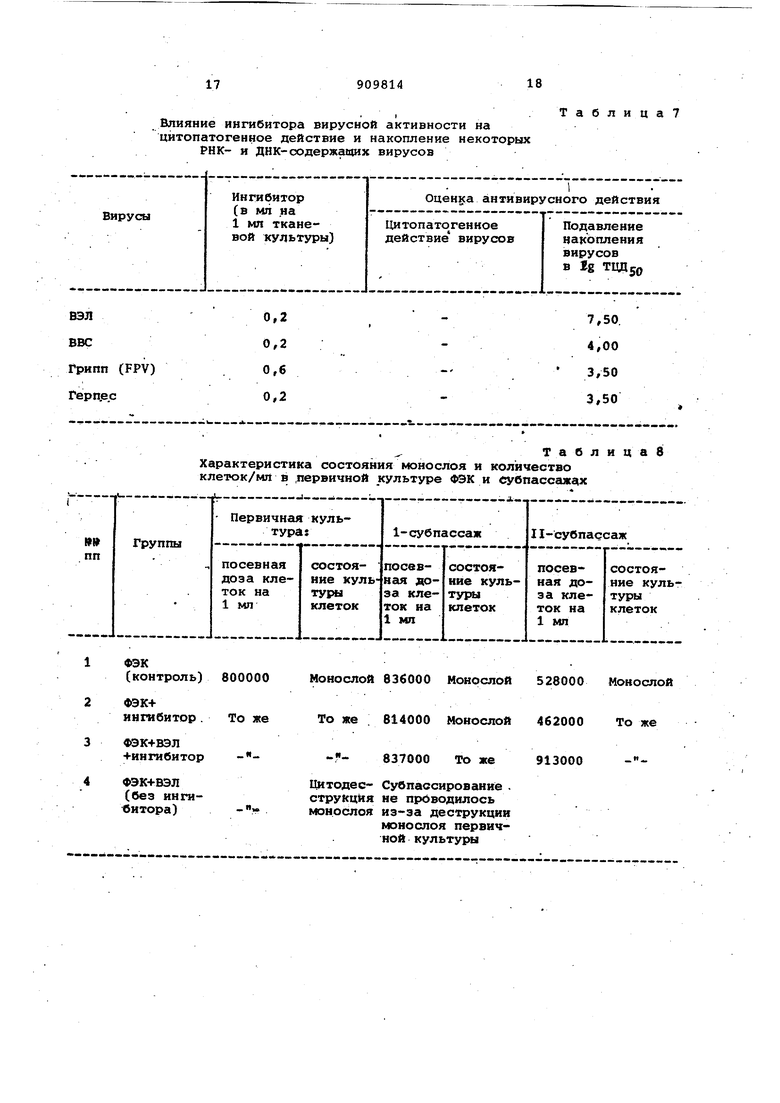
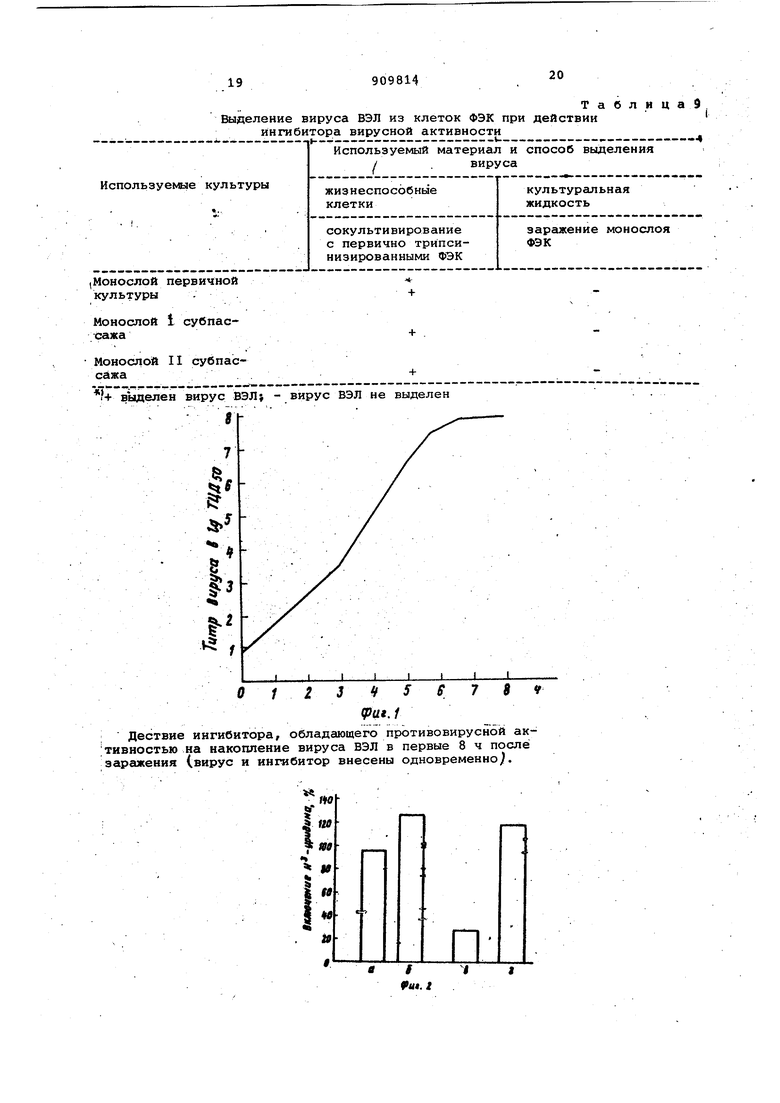
изобретение относится к области биологической химии и вирусологии, а именно к получению макромолекуляр ных биологически активных: веществ, так как известно, что последние могут активно проникать в клетку и оказывать влияние на синтез инфекционных ВИРУСНЫ35- частиц.. Наиболее близким к предлагаемому веществу по своим свойствам являетс интерферон, который подавляет размн жение разнообразных вирусов в ткане вых культурах, чувствителен к проте литичёским ферментам, термостабилен С 56 - 80°С )/ обладает рибонуклеазной активностью; молекулярная мае,са, индуцированная вирусами в культ .ре ткани или аминотической жидкости находится в пределах 25000-1600bO Однако: интерферон обладает рядом недостатков, Которые связаны со сложностью его получения, способностью подавлять репродукцию вируса лишь -при невысокой множественнос ти инфицирования и наличием профилактического, опосредованного через Клетку действия на вирус. Целью изобретения является повышение выхода ингиби-Гора и его эффек тивности, получение ингибитора с вы сокой вирусингибирующей активностью обладающего прямым действием как на РНК-, так и на ДНК - содержащие вирусы. : . Ингибитор, обладающий противовирирвой активностью, имеет элементны срстав,%: . , С 1,38 ± 0,2 Н 2,24 + 0,2 N 28,90 ±0,2 .S 1,20 ±0,2 , , Р 5,78 ±0,2 О Остальное , Молекулярный вес 190000 Дальтон. Максимум поглощения в УФ-спектре 274 нм. Прозрачная светло-розовая жидкость, хорошо растворима в воде, ростойЫх питательных средах, термостабнльна, при лиоФилизации - светло-розовый порсжюк. Блокирует развитие цитодеструктивных изменений в инфицированных вирусами клетках и подавляет .накопление инфекционных вирусных частиц; чувствителен к трипсину; обладает рибонуклеазной активностью, сохраняет ее после обработки антителами к рибонуклеазе, но теряет при этЭм вирусингибирующие свойства; вирусингибирующее действие не связано с нарушением биосинтетических клеточных процессов или синтезо интерфёр она, подавляет репродукцию как РНК-, так и ДНК-содержащих вирусов j сохраняет вирусйнгибирующие действия поЬле лиоФилизации, обладает, гемагглютинирующей активностью Для получения ингибитора, обла дающего противовирусной активностью инкубируют вирус с рибонуклеазой, центрифугируют и отделяют конечный продукт - супернатант, причем ингибитор, обладающий противовирусной активностью, получают путем совместного инкубирования клеточной вируссодержащей суспензии, например вируса вен есуэльск.рго знцефаломиелита лошадей (ВЭЛ ), и панкреатической рибонуклеазы при температуре 56-95 С в течение 20-60 мин, после чего центрифугируют до образования плотного осадка, выдерживают на холоду при температуре в течение 24-72 ч и затем отделяют конечный продукт - супернатант, обладающий противовирусной активностью и рибог нуклеазной активностью. Инкубирование клеточной вируссодёржащей суспензии с рибокуклеазой при температуре 56-95 С в течение , мин обеспечивает полную инактцвацию инфекционных свойств вируса и изменение физико-химических свойстр суспензии, в частности появление агрегатов, которые затем центрифугированием переводятся в осадокf выдержит ванне на холоде повышает вирусингибирующую активность супернатанта. Пример. Для накопления, например, вируса ВЭЛ использовались первично трипсинизированные фиброобласти эмбриона кур (ФЭК, которые готовились по общепринятой методике. Через 48 ч после засева клеток и образования сплошного моноспоя производилась смена среды культивирования на поддерживающую, в качестве которой использована среда 199 с исключением сыворотки, и культура инфицировалась вирусом ВЭЛ из расчета 0,1 на клетку. Через 24 ч после появления вирусспецифической цитодеструкции монослоя культура ФЭК шестикратно замораживалась и размораживах1ась с целью разрушения клеток. Затем производилось центрифуглрование культуры для осаждения разрушенных клеток (ЗООО об/мин, 10 мин )и получался вируссодержащий супернатант, который использовался для инкубирования с рибонуклеазой. При применении, например, панкреатической рибонуклеазы Ленинградского завода мед. препаратов, последняя использовалась в концентрации 1,750 мкг на 1 мл полученного.супернатанта (один флакон официального препарата панкреатической рибонуклеазы, содержс1щий 25 мг фермента разводился, например, в 14 мл супер-натанта вируссодержащей суспензии ВЭЛ исходное значение рН 6,8 ). Пос ле этого вируссодержащая суспензия и рибонуклеаза инкубиррвались .совместно при 92 С в течение 20 мин, осаждались появившиеся в процессе инкубации агрегаты путем центрифуги рования при 3000 об/мин в течение 10 мин, и суспензия,выдерживалась при 4°С в течение 48 ч. Затем отдел ся конечный продукт - супернатант, который обладал антивирусной активностью в бъеме 0,2 мл на 1 мл 48-ч совой культуры клеток ФЭК и который имел после лиофилизации следующий элементарный состав,%{ С., 13,38 ± о ,2 Н. 2,24 + 0,2 N 28,90 +0,2 S 1,20 + 0,2 Р 5,78 ± 0,2 О Остальное Молекулярная масса - 190000 Даль тон. Максимум поглощения в УФ-спектре 274 нм. Полученный ингибитор облада рибонуклеаэной активностью (см, табл. 1 ), а также гемагглютинирующей активностью (см. табл. 2 ). Макромолекулярная природа ингибитора иллюстрируется, помимо молекулярной массы и максимума поглощения в УФ-спектре, характерного для белка (274 нм Ь следующими данными. Полученный продукт был чувствителен к трипсину, который инактивировал его активируемое действие (см. табл. 3 ). Инактивация антивирусного действия наблюдалась и в случае действия на ингибитор антисыворотки против рибонуклеазы (сМ. табл.4 Макромолекулярная природа ингибитор подтверждалась также и высоким соде жанием N и Р, что не исключает присутствия в нем олигонуклеотидов вирусного и клеточного происхожде-: ния. Пример 2. Вируссодержащий супернатант, полученный, как указано в примере 1, инкубировался с рибонулеазой при 95°С в течение 60 ми и после 6сс1ждения образовавшихся аг регатов выдерживался при 5°С в течение 72 ч. Затем, как в примере 1, отделялся конечный продукт - супернатант , обладающий же свойствами, что и в примере 1, но меньшей антивирусной активностью по сра нению с примером 1. П Р и м е Р 3. Вируссодержащий супернэтант, полученный, как указано в примере 1, инкубировался с р бону-клеазой при в течение 20 мин и после осаждения образовавшихся агрегатов выдерживался при 3° в течение 24 ч. Затем, как и в примере 1, отделялся конечный продукт .супернатант, который облещал теми i же свойствами, что в примерах 1 и 2 i но меньшей антивирусной активностью С целью изучения вирусингибирующего действия макромолекулярного ин гибитора, полученного по предложенному способу, исследовалось влияние супернатантов из неинфицированньЬс клеток, приготовленных с использованием рибонуклеазы по предлагаемому способу, на действие термической обработанной и необработанной (нативной )рибонуклеаз в дозе 350 мкг и-1000 мкг на 1 МП инфицируемой вирусом БЭЛ культуры ФЭК (т.е. в тех же дозах в пересчете на 1 мл, в каких рибонуклеаза могла присутствовать в макромолекуля ом ингибиторе, будучи добавленной при его получении, и трехкратно больших ), а также действие вирусосодержащих суспензий, полученных по предлагаемому способу, но без инкубации с рибонуклеазой. Кроме того, действие макромолекулярного ингибитора вирусной активности сравнивалось с интерфероном, полученным из клеток ФЭК при помощи вируса болезни Ньюкасла, так как примеси интерферона могли быть в препарате, пoлyчaeмo f из инфицированных вирусом клеток, и который заведомо в больших количествах,как и все исследуемые ингредиенты, вносился одновременно с инфицированием культуры вирусом ВЭЛ. Как видно из данных, представленных в табл, 5, вирусингибирующее действие , проявляющееся как в защите монослоя ( блокирование цитопатогенного действия вируса, так и подавлении репликации вируса, оказывают только макромолекулярные ингибиторы, полученные по предлагаемому способу, причем антивирусное действие не было связано с их прямой рибонуклеазной активностью. Защитное действие макромолекулярного ингибитора вирусной активности, проявляющееся в блокировании цитодеструктивных изменений в монослое, вызываемых вирусом ВЭЛ, и подавлении его накопления в культуре клеток ФЭК, не связано с синтезом интерферона, так как последний в культуре клеток ФЭК отсутствовал (см: табл. б ). Гидролитическое действие макромолекулярного ингибитора в отношении РНК не снималось актисывороткой, хотя, как у-казывалось выше, сыворотка против рибонуклеазы блокировала его антивирусное действие. Ингибитор, полученный по -способу, описанному в примере 1 ( с вирусом ВЭЛ ), обладал антивирусной актив «остью и в отношении.других РНК- и ДНК-содержащих вирусов. Дествие ингибитора в отношении вирусов с фрагментированным геномом наблюдалось лишь при трехкратном увеличении дозы по сравнению с вирусами с нефрагментированным геномом (см. табл. 7 }. Ингибитор п зоявляет антивирусное действие, при добавлении лишь в те- . чёние 0,5 ч после заражения монослоя, действуя на этапы репликативного цикла вируса (фиг. 1 }. . -. На фиг. 2 представлены данные о влиянии макромолекулярнрго ингибитора на синтетические процессы в нормальных и инфицированных вирусом ВЭЛ клетках ФЭК, оцениваемые по включению Н -уридина; ингибитор вирусной активности не снижает синтеза РНК в нормальной клетках v3K (фиг, 2, б) и вызывает полную нормализацию синтеза в клетках ФЭК, инфицированных вирусов ВЭЛ (фиг. 2,г| На фиг. 3 показано подавление вирусиндуцированных синтезов ( б ) при действии ингибитора на фоне актиномицина Д.
В табл. 1 представлены данные об изучении гидролитической (рибонук леазной активности ингибитора BRрусной активности, полученного по заявленному способу, в отношении дрожжевой РНК в сравнении с таковой панкреатической рибонуклеазы, котдрая использовалась в процессе получения ингибитора вирусной активности. -Из данных, представленных в 1 следует, что ингибитор вирусной активности осуществляет гидролиз дрожжевой РНК в равной мере с используемой для его получения рибонуклеазой, которая не подвергалась термическим воздействиям. Последнее обстоятельство находится в соответствии с литературными данньами о термостабильности рибонуклеазы. и, казалось, может свидетельствовать в пользу того, что антивирусное действие ингибитора связано с сохраняющейся в нем рибонуклеазной активностью. Однако используемая нами в контрольных опытах рибонуклеаза, применяемая также в концентрации 350 мкг на 1 МП инфицированной культуры, не оказывала никакого антивирусного действия (см. табл. 4, группы 4-10 ). Задержка развития цитопатического действия вирусов была получена при использовании рибонуклеазы в концентрации 1000 мкг/мл С см. табл. 5,№ п.п 11J. ;
Таким образом, предложенный ингибитор вирусной активности представляет собой новую макромолекулярную структуру.
Антивирусное действие ингибитора не связано с синтезом интерферона , подавлением метаболизма клеток или с непосредственным гидроло-. гическим действием нуклеазы на вирусную нуклеиновую кислоту. Антивирусные свойства ингибитора находятся, как видно, в зависимости от присутствия в нем субстанций белковой природа являющихся составными частями зараженных клеток и рибонуклеазы, объединенных в макромолекулярный комплекс. Присутствие в ингибиторе относительно большого 1 оличества азота и фосфора не -исключает наличия в нем олигонуклеотидов вирусного и клеточного троисхождения. Заявляемый макромолекулярный ингибитор вирусной активности действует как на РНК-, так и ДНК-содержащие вирусы,нетоксичен и не снижает синтез клеточных макромолекул, прост в получении, вызывает защиту клеточного
5 монослоя от цитОпатическогл действия вирусов и подавление репродукции вирусов; вызывает полную нормализацию синтеза РНК вирусинфицированных клеток/ чувствителен к трипсину,
Q обладает рибонуклеазной активностью, термостабилен {95°С, 60 мин/.
П р и м е р 4. Вышеуказанные свойства вещества найдут широкое применение в вирусологических исследовас НИЯХ.
Моделирование хронической инфекции и персистирование вирусных агентов в культуре ткани.
В качестве примера приводим данные о персистировании вируса
0 ВЭЛ в культуре ФЭК, полученные при использовании ингибитора вирусной активности. 48-часовую культуру ФЭК инфицировали вирусом ВЭЛ (О,О001 ТЦЦ на клетку) без макромолекулярного
5 ингибитора вирусной активности и в присутствии последнего, который вносили в объеме 0,2 мл на 1 мл культуральной среды. Имелись соответствующие безвирусные контроли,
0 где культивирование ФЭК проводили в присутствии одной культуральной среды и культурашьной среды е ингибитором вирусной активности. Первый субпассаж в группах 1-3 см. табл.8
с проводили после развития цитодеструк. тивных изменений в группе 4, где инфицирований клеток осуществляли без добавления макромолекулярного ин гибитора вирусной активности; последующие субпассажи проводили после образования монослоя в группах
1-3. В субпассажах повторное, добавление ингибитора проводили на следующие сутки после пересева культуры в объеме 0,04 .мл на 1 мл культу5 ральной среды. Вирусологические исследования проводили путем сокультивирования субпассируеквах клеток с первично трипсинизированными клетками ФЭК; кроме того, на наличие вируQ са исследовали бесклеточную культуральн5 жидкость из перевиваемых тканевых культур, инфицированных вирусом ВЭЛ при добавлении ингибитора вирусной активности (данные
, вирусологических, исследований отражены в табл. 9 ).
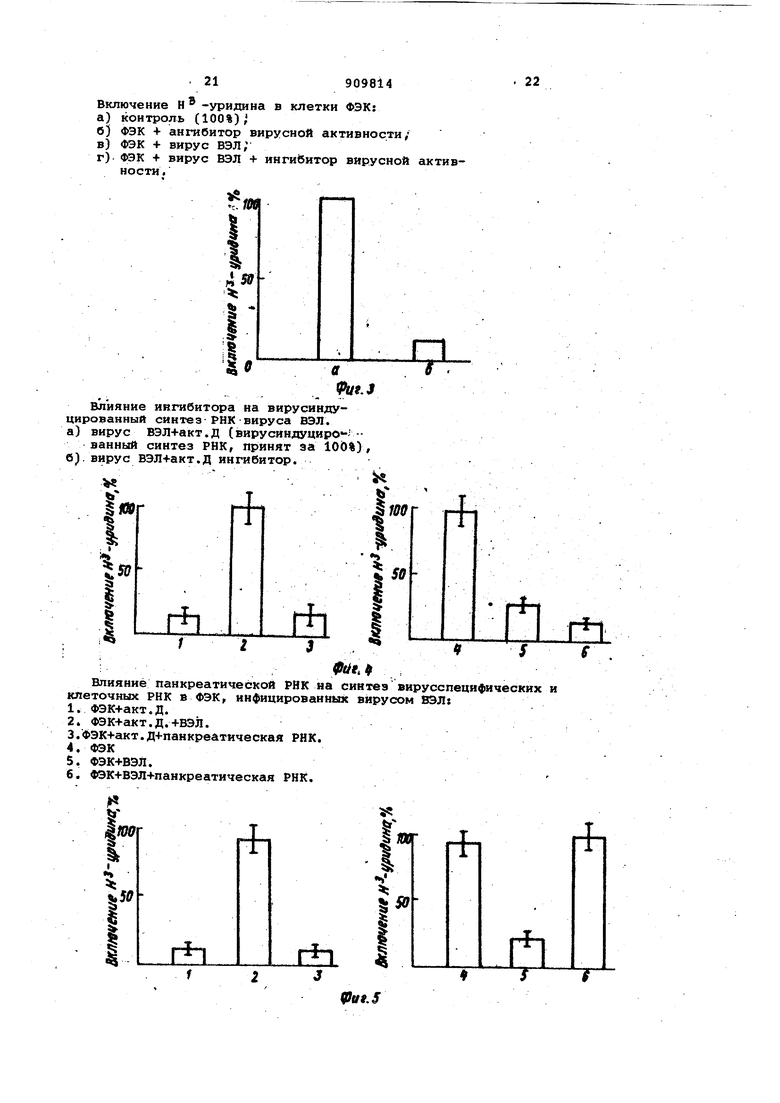
Как видно из данных, представленных в табл. 8, вирус ВЭЛ, вносимый без макромолекедярного ингибитора вирусной активности, вызывает развитие цитопатических изменений и деструкцию клеточного монослоя первичной культуры ФЭК, исключая тем самым возможность последующего куль тивирования клеток. Добавление ингибитора вирусной активности полностью блокирует развитие цитодест руктивных изменений в первичной культуре, что позволяет осуществить дальнейшее субпассирование первично трипсинизированных клеток ФЭК. Блокирование цитодеструктивных изменений в этой группе подтверждается и данными по концентрации клеток на 1 МП снятого трипсином монослоя (поскольку клетки пересевались в отношении 1:1,. то посевная доза, указанная в субпассажах, отражает урожай клеток предшествующего моно слоя |. Видно, что количество клето при снятии монослоя первичной культуры ФЭК в группе 3 (ВЭЛ + ингибито вирусной активности / практически такое же, как и в основной контрол ной группе, где не проводилось инцифирование вирусом ВЭЛ rf не добав лялся макромолекулярный ингибитор ( соответственно 837000 и 836000 клеток/мл ). Образование монослоя происходило if при последующем субпассировании культуры, несмотря на персистирова ние вируса ВЭЛ в клетках ФЭК, что подтверждается данными вирусологических исследований (,см. табл. 9/. Представленные в табл. 9 резуль туты указывают на то, что имеет ме то персистирование вируса ВЭЛ в кле как ФЭК, так как из культуральной жидкости вирус выделен не был. Таким образом, результаты представленные в табл. 8 и 9, указываю на наличие персистентной инфекции в клетках ФЭК и свидетельствуют о возможности использо.вания ингибитора вирусной активности для изу -. чения молекулярно-биологических механизмов хронических вирусных инфекций. Характеристика РНК-полимеразных реакций вирусных агентов. Исследования проведены с вирусом гриппа А (FPV) Rostoc/34. Установлено, что макромолекулярный ингибитор вирусной активности, внесенны в культуру ФЭК сразу после заражения ее вирусом, при последующем анализе (invitro) полимера:зной активности микросомальной фракции вирусинфицированных клеток проявил 95%-ное ингибирование синтеза вирус специфической РНК по сравнению с контролем. Кроме/того, ингибитор ак .тивно утилизируется клетками, так как внесение его в культуру за 30 м до заражения вирусом практически не влияло на полимеразную активность микросомальной фракции вирусинфицированных клеток. Указанные свойства ингибитора ви русной активности позволяют наме.тить пути и способы блокирования РНК-полимеразных реакций вирусных агентов при .помощи биологически активных клеточных метаболитов. Избирательное подавление синтеза вирусной РНК (ингибитор вирусной . активности как модулятор нуклеолитической активности, направляющий действие фермента на блокирование синтеза вирусных, но не клеточных РНК ). Ниже представлены данные, свидетельствующие о возможности использования ингибитора вирусной активности для избирательного подавления синтеза вирусных РНК. Нуклеолитическая активность ингибитора вирусной активности и панкреатической рибонуклеазы, используемой для его получения, является одинаковой (см. табл. 1 ;. В этой связи исследованы особенности действия фермента (панкреатической рибонуклеазы )и ингибитора на синтез вирусспецифических и клеточных РНК в клетках ФЭК, инфицированных вирусом. ВЭЛ. Вирусспецифические синтезы изучались на фоне актиномицина Д/ .клеточные - без использования указанного антибиотика. Результаты исследований представлены на фиг. 4 и 5. Панкреатическая рибонуклеаза (, фиг. 1, группа 3 резко подавляет (Р 0,0pl) синтез вирусспецифической РНК. вируса ВЭЛ. Однако это не сопровождается восстановлением синтеза РНК инфицированных клеток - в присутствии вируса ВЭЛ и панкреатической рибонуклеазы он достоверно ниже, чем при инфицировании клеток только вирусом ВЭЛ (фиг. 4, соответственно группы 6 и 5 /. Совершенно другие закономерности в отношении синтеза клеточной РНК в вирусинфицированных клетках были установлены при действии ингибитора вирусной активности, который, как указывалось выше, по нуклео-. литической активности не отличался от панкреатической рибонуклеазы. Как видно из данных, представленных на фиг. 5, группа 6, добавление ингибитора вирусной активности при инфицировании клеток вирусом ВЭЛ приводит к сохранению синтеза клеточной РНК на уровне неинфицированного контроля (фиг. 5, группа 4 - не инфицированный контроль). При этом следует заметить, что синтез вирусоспецифической РНК вируса ВЭЛ ингибитор вирусной активности угнетает гакже, как панкреатическай рибонуклеаза (фиг. 5. группа 3. Таким Образом, представленные данные свидетельствуют о способности ингибитора вирусной активности избирательно подавлять синтез гетерогенных для клетки нуклеиновых кислот, что указывает на возможность создания биологически активных ве- ществ, контролирующих клеточную инивидуальность на генном уровне. Изучение начальных этапов репродукции вирусных агентов. Клетки ФЭК заражали вирусом гриппа А (FPV) Rostoc/34 и через 30 мин обрабатывали ингибитором вирусной активности. В результате последующего фракционирования клеток, проведенного .через 60 мин после заражения, установлено, что испольСравнительная харак активности ингибито нуклеазы по отнош
Развэления ингредиентов, и количество
ингредиенты РНК-азы, используемой для гидро-лиза РНК
нук0,25 мл
Количество распавшейся РНК (на 1000 мкг) после инкубации с исследуемыми ингредиентами, мкг
10000 раз 0,25 мл 43 нг
850
10000 раз 43 нг
845 зуемый ингибитор снизил содержание меченых вирусных структур в цитоплазматической фракции клеток на 76% и в ядерной на 69%. Полученные данные позволяют заключить; что ядерная и цитоплазматическая фазы репродукции вируса гриппа обладают одинаковой чувствительностью к виру сии гибирующим веществам макромолекулярной природы. Таблица стика гидролитической панкреатической рибок дрожжевой РНК








| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВОВИРУСНОЕ, ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО | 2001 |
|
RU2202547C2 |
| ВОДОРАСТВОРИМОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ И ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ, НА ОСНОВЕ СОЕДИНЕНИЯ ИОННОГО СЕРЕБРА С МЕТИЛЕНОВЫМ СИНИМ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2390343C1 |
| ШТАММ ЭНТЕРОВИРУСА А71 ТИПА СУБГЕНОТИПА С4, ИСПОЛЬЗУЕМЫЙ ДЛЯ ДИАГНОСТИКИ И ИЗУЧЕНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2014 |
|
RU2565811C1 |
| Адамантовые эфиры -окиси изоникотиновой кислоты, проявляющие антивирусную активность | 1977 |
|
SU654614A1 |
| ПРИМЕНЕНИЕ ОКСИМА (3-ХЛОР-1-АДАМАНТИЛ)МЕТИЛКЕТОНА В КАЧЕСТВЕ ИНГИБИТОРА ВИРУСА ГЕРПЕСА ПРОСТОГО ТИПА 1 И ВИРУСА ГРИППА А | 2001 |
|
RU2205000C2 |
| ШТАММ РЕКОМБИНАНТНОГО ВИРУСА ОСПОВАКЦИНЫ, ЭКСРЕССИРУЮЩИЙ СТРУКТУРНЫЕ БЕЛКИ ВИРУСА ВЕНЕСУЭЛЬСКОГО ЭНЦЕФАЛОМИЕЛИТА ЛОШАДЕЙ И ПРИГОДНЫЙ ДЛЯ ПРОИЗВОДСТВА ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2091489C1 |
| ПРОИЗВОДНЫЕ 4-АЦЕТИЛ-ИМИДАЗО(4,5-В)ИНДОЛ-2-ТИОНА, ОБЛАДАЮЩИЕ ПРОТИВОГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ И ВИРУСИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ВЕНЕСУЭЛЬСКОГО ЭНЦЕФАЛОМИЕЛИТА ЛОШАДЕЙ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2091382C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО НА ОСНОВЕ СУММЫ ФЛАВОНОИДОВ ИЗ Alchemilla vulgaris L. | 2015 |
|
RU2580304C1 |
| Вирусный ингибитор | 1976 |
|
SU647940A1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО НА ОСНОВЕ ШТАММА НЕМАТОФАГОВОГО ГРИБА Duddingtonia flagrans F-882 | 2011 |
|
RU2475531C2 |

1. Ингибитор, обладающий противовирусной активностью, имеет элементарный состав,%: С 13,38 t Н 2,24 ± 0,2 N 28,90 i 0,2 S, 1,20 i 0,2 Р 5,78 ±0,2 О - Остальное Молекулярный вес 190000 Дальтон. Максимум поглощения в УФ-спекхре 274 нм. Прозрачная светло-розовая жидкость, хорошо растворима в воде, ростовых питательных средах, термостабильна, после лиофилизации - светлорозовый порошок. Блокирует развитие цитодеструктивных изменений в инфицированных вирусакм клетках и подавляет накопление инфекционных вирусных частиц, чувствителен к трипсину, обладает рибонуклеазной активностью, рохраняет ее после обработки антителами к рибонуклеазе, но теряет при этом вирусингибируюцие свойства, вирусингибирующее действие не связано с HapsmieHHeM биосинтетических клеточных процессов или синтезом интерферрна, подавляет репродукцию как РНК-, так и ДНК-содержащих вирусов , сохраняет вирусингибируюцие действия после лиофилизации, обладает гемагглютинирующей активностью. 2. Способ получения ингибитора, обладающего противовирусной актив(Л ностью, включающий инкубацию вируса с р рибонуклеазой, центрифугирование и отделение конечного продукта - супернатанта, отличающийся а тем, что, с целью повышения выхода ъ О СО 00 ингибитора и его эффективности, инкубируют, например, венесуэльского энцефиломиелита лошадей (ВЭЛ ) с панкреатической рибонуклеазой при в течение 20-60 мин, после чего центрифугируют до образования плотного осадка, выдерживают на холо.де при 3-5 С в течение 24-72 ч и здтем отделяют конечный продукт - су,1;ернатант.
Прим
++++
суспенВсе исследуемое ингредиенты инкубировались
++++
+++++ечани е - указано ожидаемое количество РНК-азы, исходя из расчета добавляемсГго количества фермента при изготовлении ингибитора вирусной активности. Характеристика гемагглютинируювдей активности ингибитора и составляющих его компонентов Таблица2при 30 мин. Влияние тр Исследуемые ингредиент Ингибитор. Ингибитор + трипсин Примечание; Влияние антиса вирусингибирую Исследуемые ингредиенты Ингибитор Ингибитор 4- антисыворотка против РНК-азы Ингибитор + нормальная сыворотка Примечание;
ТаблицаЗ ипсина на вирусингибирующие свойства ы цитопатЬгенное дай- подавление накопствие вируса ВЭЛ ления вируса ВЭЛ исследование проведено с вирусом ВЭЛ, трипсин использовался в концентрации 250 мкг/мп,не оказывающей токсического действия на культуру 4 леток ФЭК., . воротки к панкреатической рибонуклеазе на щую и ферментативную активность Оценка антивирусногоКоличество Т РНК (из 1000 мкг) цитопатоген- подавлениепосле инкубации нов действие накопленияс исследуеьшми вируса ЮЛ вируса ВЭЛингредиентакш, -7,50845-И-Н-О890-7,50. 850 разведения исследуемых ингреда1ентов и их объем, используекЕяй для гидролиза с РНК, так и в таблице . ингибитора Оценка активного действия в Ig TUflj -7,50 ++++О Таблица 4 ингибитора1 ле ствия распавшейся (в 2g TUajo) Вирусингибирующее действие ингибиторов, как описано в примерах 1-3
#сследуемые пп и н гре дие нтыт (груп1 3)
1 Ингибитор,-полученный
из инфицированных клеток по примеру 1 (РНК-аза, 92°С, 30 мин)
из инфицированных клеток по примеру 2 (РНК-аза,. , 60 мин/
по примеру 3 (РНК-аэа, , 20 мин )
онтроли опытным руппам группы 4-15/
(РНК-аза, , 60 мин;
«I
56°С, 20 мии)
при 95°С, 60 мин (350 мкг )
10,Нативная РНК-аза ( 350 мкг)
1000 мкг ,
Оценка антивирусного действия
подавление накопления вируса ВЭЛ B-gg ТЦДдо
7,50
7,00
4,00
-и-Н+++4+-И-+
++++
++++
0
о
1,00 ТаблицаЗ полученных,
Исследуемые
ttW ингредиенты пп
Вируссодержащая суспензия, инкубированная при 92 С 30 мин
(без РНК-азы)-Н-++
Вируссодержащая суспензия, инкубируемая
при 96 С 60 мин
(без РНК-азы /++++
Вируссодержащая суспензия, инкубируемая при 20 мин
Л без. РНК-азы
Интерферон 16 ед/мл ++++
клетках ФЭК со средой 199-8,5 Ig ТПДуд П р и м е ч а н
Определение интерферона в клетках ФЭК после внесения ингибитора вирусной активности и вируса болезни Нъюклела (ВБН )
Исследуемые ингредиенты
ВБН
Ингибитор
вирусной
активности
Продолжение табл. 5
Оценка антивирусного действия
подавление накопления вируса ВЭЛ в Ig ТЦД
О О
Т а б л и -ц а 6
Время определения и титр интерферона, ед/мл
48
24
16 исследуекыё ингредиенты вносились в 48-часовую культуру ткани ФЭК одновременно с инфицированным вирусом ВЭЛ в дозе 10000 ТЦД /Q д .. Ингредиенты 1-14 вносились в объеме 0,2 мл на 1,мп тканевой культуры ФЭК, в пп 15 вместо среды 199 внесен интерферон в объеме 1,2 мл. Учет цитопатогенного действия {+ миним., f+-H- максимальное, - отсутствие J и накопление вируса оценивалось через 48 ч после инфицирова-ния. Подавление: накопления вируса ВЭЛ оценивалось по разности титров в группах 1-15 с титром вируса в группе 16 (фЭК+ВЭЛ+среда 199).
Влияние ингибитора вирусной активности на цйтопатогенное действие и накопление некоторых РНК- и ДНК-содержащих вирусов
Характеристика состояния монослоя и количество клетюк/мп в .первичной культуре ФЭК и еубпассгшг х
Монослой 836000 Монослой 528000 Монослой
То же 814000 Монослой 462000
-.
Субпассированиё не пр водилось из-за деструкции
Таблица
Т а б л и ц а 8
То же
837000
913000
- И
То же монослоя первичной культуры Шлделение вируса ВЭЛ из клеток ФЭК при ингибитора вирусной активности
|Монослой первичной культуры
Монослой I субпассажа
Монослой II субпассажа
Т
+ выделен вирус ВЭЛ .... .-; Дествие ингибитора, обладающего противовирусной активностью на накопление вируса ВЭЛ в первые 8 ч после заражения (вирус и ингибитор внесены одновременноJI. ТаблицаЭ действии
21 Включение Н ® в клетки
урндина
а)контроль (100%),
б)ФЭК + ангибитор вирусной ак
в)ФЭК 4- вирус вэл;
ФЭК + вирус ЮЛ + ингибитор г) ности.
45 « «
I.
.J
Влияние ингибитора на вирусиндуцированный синтез РНК вируса ВЭЛ. а) вирус ВЭЛ+акт.Д (вирусяндуциро-ванный синтез РНК, принят за 10d%), вирус ВЭЛ4-акт.Д ингибитор.
б)
«
: - - ; , 9tit ..., Влияние панкреатической РНК на синтез вирусспецифических клеточных РНК в ФЭК, инфицированных вирусом ВЭЛ:
§
I
5
22
п
(put. 5
2390981424
Влияние ингибитора вирусной активности на синтез вирусспецифических и клеточных РНК в ФЭК, инфицированных вирусом ВЭЛ.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Соловьев В.Д., Бетемиров Т.Д | |||
| Интерферон в теории и практике медицины | |||
| М., 1970, с | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
Авторы
Даты
1983-06-07—Публикация
1980-04-15—Подача