Изобретение относится к биотехнологии, в частности к генетической инженерии и представляет собой вектор для молекулярного клонирования в бактериях рода Рseudomonas и способ его конструирования.
Известны векторы, сконструированные на основе плазмиды широкого круга хозяев RSF1010 (incQ) (Bagdasarian et al. , Gene, 1981, v. 16, р. 237), которые способны к мобилизации конъюгативными плазмидами. Однако векторы этого типа имеют достаточно большие размеры (10-13 тпо) и содержат относительно небольшое число уникальных сайтов для клонирования.
Известны также векторы на основе плазмиды широкого круга хозяев Sa (inc W) (Close et al. , Plasmid, 1984, v. 12, р. 111), которые содержат достаточное количество уникальных свойств, способны к мобилизации конъюгативными плазмидами, однако подавляют рост клетки-хозяина.
Известны векторы на основе плазмиды Pseudomonas pVS1 (Itoh & Haase, Gene, 1985, v. 35, p. 27), имеющие небольшие размеры, однако не способные реплицироваться в Е. соli.
Целью изобретения является повышение стабильности наследования вектора рРS5.
Вектор рРS7 состоит из следующих элементов: - ЕсоRI-РstI фрагмента вектора рBR322, размером 3,5 тпо; - РstI фрагмента ДНК (2,5 тпо) критической плазмиды рМКI из штамма Рseudomonas sp. 65, содержащего область, ответственную за репликацию в бактериях Pseudomonas и мобилизацию вектора посредством конъюгативной плазмиды рRK2013 или RР4 Кms; - РstI фрагмента плазмиды рUС4К, содержащего ген, детерминирующий устойчивость к канамицину (1,4 тпо); - фрагмент ДНК (1,1 тпо) плазмиды рМТ2 несущего раr-локус, повышающий стабильность наследования вектора.
Для достижения цели используют способ конструирования вектора, заключающийся в том, что смесь плазмидной ДНК рРS5 и рМТ2 подвергают гидролизу рестриктазой ЕсоRI, образовавшиеся фрагменты соединяют ДНК-лигазой, затем полученной смесью трансформируют клетки Е. соli, транформанты высеивают на среду с тетрациклином. Отбирают клоны, несущие вектор рРS5 со вставкой ЕсоRI фрагмента. Гибридные плазмиды передают в клетки Р. рutida и отбирают среди них вариант с раr-локусом плазмиды рМТ2, стабильно поддерживающийся на протяжении 120 генераций. Полученную таким образом плазмиду рР36 укорачивают с помощью рестриктазы StuI и нуклеазы Ваl 31.
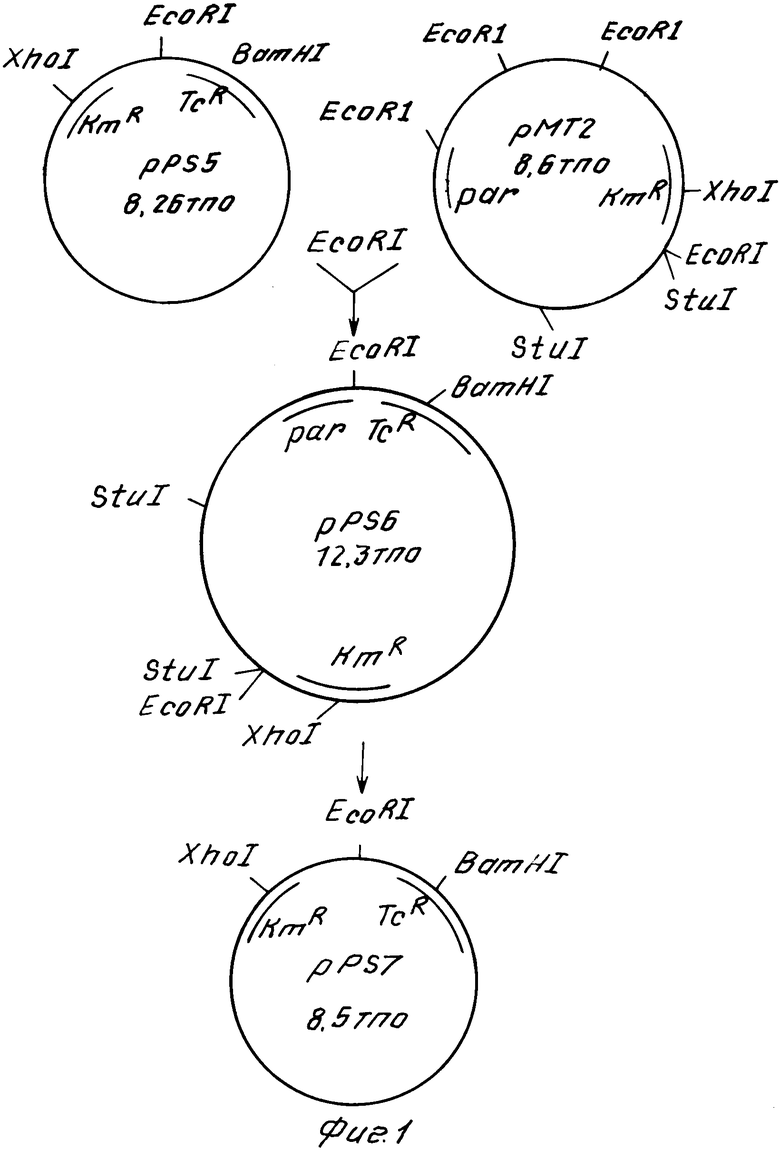
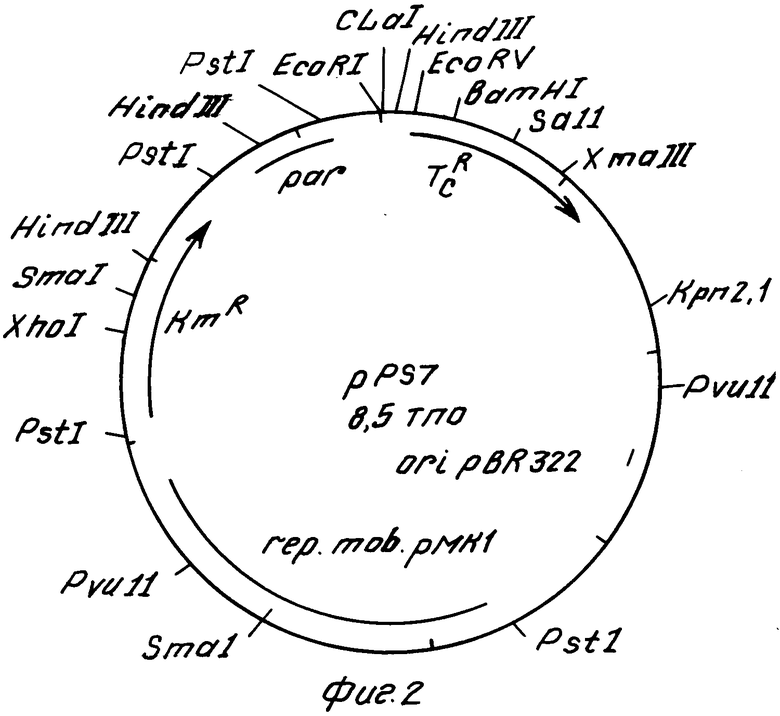
На фиг. 1 показана схема конструирования вектора рРS7; на фиг. 2 - рестрикционная карта вектора рРS7.
П р и м е р 1. Клетки бактерий Е. соli С 600, содержащие плазмидную ДНК рРS5, выращивают в 10 мл бульона до титра 1 х 108 кл/мл. Клетки осаждают центрифугированием (5000 g, 5 мин, +4оС) и ресуспендируют в 0,1 мл лизирующего раствора (лизоцим 2 мг/мл, трис-НСl, рН 8,0-25 мМ, ЭДТА - 10 мМ, глюкоза - 50 мМ), выдерживают 5 мин при 0оС. Далее прибавляют 0,2 мл раствора (NaOH - 0,2, додецилсульфат натрия - 1% ) и перемешивают до осветления лизата. 150 мкл раствора 3М ацетата натрия (рН 4,8) вносят в осветленный лизат, осторожно перемешивают до заметного снижения вязкости раствора, выдерживают 1 ч при +4оС и образовавшийся осадок отделяют центрифугированием (10 000g, 5 мин +4оС). К полученному супернатанту добавляют 2,5 объема охлажденного при -20оС этилового спирта и выдерживают 2 ч при -20оС. Образовавшийся осадок собирают центрифугированием (5000g, 5 мин, 20оС) и ресуспендируют в 0,2 мл буфера (10 мМ трис-НCl, рН 8,0, 1 мМ ЭДТА).
ДНК плазмиды рМТ2 из бактерий Е. соli С600 выделяют таким же методом.
Полученные препараты ДНК плазмид рРS5 и рМТ2 используют для конструирования плазмиды рРS6 (рис. 1), которое проводят следующим образом: 0,5 мкг ДНК плазмиды рРS5 и 1,0 мкг ДНК рМТ2 инкубируют с рестриктазой ЕсоRI (5 ед) в буфере А (50 мМ трис-НСl, рН 7,6, 100 мМ NaCl, 10 мМ МgCl2, 1 мМ 2-меркаптоэтанол). После инкубации смесь прогревают при 65-70оС 10 мин. Анализ полноты гидролиза проводят с помощью электрофореза.
Соединение фрагментов ДНК проводят в буфере А с добавлением АТФ и дитиотреитола до конечной концентрации 0,5 мМ и 5 мМ соответственно и ДНК-лигазы фага Т4 (300 ед/мл) из расчета 1 мкл фермента на 5 мкг ДНК. Легирование проводят в течение 12 ч при 8оС.
Полученную после легирования смесь используют для трансформации клеток Е. соli С600. Трансформацию проводят следующим образом: 0,1 мл суспензии клеток Е. соli С600 вносят в 10 мл питательного бульона LВ и выращивают до титра 5 х 107 кл/мл. После 10-минутного охлаждения (0оС) клетки собирают центрифугированием (5 000 g, 10 мин, 0оС), ресуспендируют в 10 мл 0,1 М раствора СаСl2 и выдерживают 1 ч. Клетки повторно центрифугируют (5 000 g, 10 мин, 0оС), затем ресуспендируют в 0,5 мл 0,1 М CaCl2 (0оС), добавляют ДНК и выдерживают 30 мин при 0оС и 3 мин при 37оС. После десятикратного разбавления бульоном трансформированные клетки подращивают 1 ч и высеивают на агаризованную среду LВ с тетрациклином (15 мкг/мл).
Плазмидную ДНК из 60 трансформантов выделяют экспресс-методом и анализируют с помощью электрофореза в агарозном геле. Экспресс-метод выделения ДНК осуществляется следующим образом: бактериальную колонию ресуспендируют в 50 мкл буфера (сахароза -- 8% , тритон-х-100 - 0,5% , ЭДТА - 50 мМ, трис-НСl, рН 8,0 - 10 мМ), добавляют 10 мкл раствора лизоцима (20 мг/мл) в этом же буфере и помещают в полипропиленовой пробирке объемом 1,5 мл на кипящую водяную баню. Суспензию прогревают в течение 45 с, центрифугируют (10 000 g, 10 мин) и 10 мкл супернатанта используют для электрофореза в агарозном геле.
Среди трансформантов отбирают клоны, несущие вектор рРS5 со вставкой одного из ЕсоRI фрагментов плазмиды рМТ2. для того, чтобы выявить плазмиду с раr-локусом, отобранные гибридные плазмиды передают с помощью мобилизации в бактерии Р. рutida M и определяют стабильность их наследования в течение 120 генераций.
Плазмиду с раr-локусом (рРS6) обрабатывают рестриктазой Stul в буфере Б (50 мМ трис-НСl, рН 7,6, 50 мМ NaCl, 10 мМ, MgCl2, 1 мМ 2-меркаптоэтанол) и затем выдерживают в течение 3 ч с нуклеазой Ваl 31 в буфере В (20 мМ трис-HCl, рН 8,1, 600 мМ, 12,5 мМ СаСl2, 12,5 мМ МgCl2). Полученные фрагменты переводят в кольцевую форму с помощью ДНК-лигазы фага Т4 (фиг. 1) и трансформируют клетки Е. соli С600. Трансформанты отбирают на полноценной среде c тетрациклином и канамицином. Из 30 клонов экспресс-методом выделяют плазмидную ДНК, сравнивают электрофоретическую подвижность полученных плазмид и отбирают плазмиды, близкие по размеру вектору рРS5. Такие плазмиды передают мобилизацией в бактерии Р. рutidaM и определяют стабильность наследования в течение 120 генераций. Стабильно наследующаяся в клетках Рseudomonas векторная плазмида была обозначена рРS7 (фиг. 2).
Размер вектора рРS7 - 8,5 тпо. Вектор придает клетке-хозяину устойчивость к канамицину и тетрациклину. Вектор содержит уникальные сайты для рестриктаз: ЕсоRI, ClaI, EcoRV, ВаmHI, SalI, ХmaIII, Kpn2I, ХhоI. Клонирование может проводиться по всем перечисленным уникальным сайтам. Вставки ДНК-фрагментов в сайтах ЕсоRV, ВаmHI, SalI, ХmaIII приводят к инактивации ТсR-гена, вставки в сайте ХhоI инактивируют КmR ген.
Емкость вектора 0,1-10,0 тпо.
Спектр хозяев: Е coli и бактерии рода Рseudomonas.
Вектор рРS7 эффективно мобилизируется конъюгативными плазмидами рRК2013 и RР4 КmS.
В течение 120 генераций в неселективных условиях вектор стабильно поддерживается в клетках Е. соli и Pseudomonas.
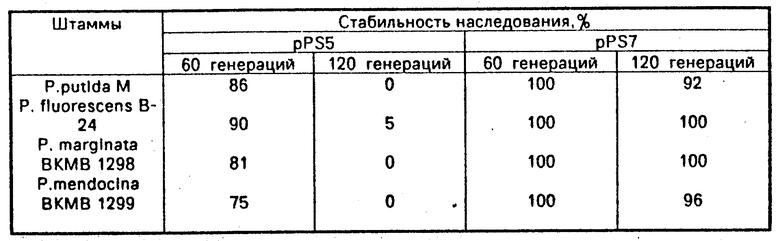
П р и м е р 2. Мобилизация вектора рРS7 в клетки Р. fluorescens В24 осуществлялась в двухфакторных скрещиваниях Е. соli С600 (рРS7, RP4 KmS) Х Р. fluorescens В24. Время скрещивания 2 ч. Частота мобилизации 2 х 10-5. Стабильность наследования в течение 120 генераций 100% .
П р и м е р 3. Мобилизация вектора рРS7 в клетки Р. marginata ВКМВ 1298 осуществлялась в двухфакторных скрещиваниях, как описано в примере 2. Частота мобилизации 1 х 10-6. Стабильность наследования в течение 120 генераций 100% .
П р и м е р 4. Мобилизация вектора рРS7 в клетки Р. mendocina ВКМВ 1299 осуществлялась в двухфакторных скрещиваниях, как описано в примере 2. Частота мобилизации 7 х 10-4. Стабильность наследования в течение 120 генераций 96% .
Стабильность наследования векторов рРS5 и рРS7 в бактериях Pseudomonas представлена в таблице.
Использование: биотехнология, генетическая инженерия. Сущность изобретения: сконструирован вектор pPS7 (8,5 ТПО), стабильно наследующийся в бактериях Pseudomonas. Вектор детерминирует устойчивость к канамицину и тетрациклину, имеет 8 уникальных сайтов для рестрикатаз, мобилизуется конъюгативными плазмидами RP4Kms и pRK2013. Способ получения данного вектора предусматривает введение par-локуса плазмиды р МГ 2 в плазмиду pPS5. 2 с. п. ф-лы, 2 ил. , 1 табл.
Авторы
Даты
1994-05-30—Публикация
1991-06-17—Подача