Изобретение относится к новым векторам клонирования и/или экспрессии с широким спектром хозяев среди грамотрицательных бактерий. Оно относится еще к применению этих векторов, в частности, в производстве рекомбинантных протеинов или метаболитов или в реакциях биотрансформации, а также к клеткам-хозяевам, содержащим такие векторы.
Новые достижения в молекулярной биологии привели к разработке новых векторов, пригодных для использования в процессах генной инженерии, которые имеют широкий спектр хозяев. Эти векторы противопоставляются тем, которые обладают узкой специфичностью, таким как CoIEI, по вездесущему характеру (на таксономическом уровне) хозяев, в которых они реплицируются. Этот характер очень резко выражен по отношению к некоторым плазмидам, которые реплицируются почти во всех грамотрицательных бактериях. Такие плазмиды имеют ту особенность, что они могут использоваться в таких бактериях, как Escherichia coli, для осуществления необходимых построений, чтобы затем непосредственно вводиться в грамотрицательного хозяина, который был выбран. Другой признак этих векторов заключается в присущем им свойстве либо мобилизироваться, либо быть мобилизированными для конъюгативного переноса от бактерии-донора к бактерии-реципиенту. Эти конъюгативные переносы обычно происходят с очень высокой частотой (между 1 и 10-2), значительной большей, чем у известных трансформационных систем.
Описанные в литературе плазмиды с широким спектром хозяев среди грамотрицательных бактерий принадлежат к группам несовместимости C, N, P, Q и W (incC, incN, incP, incQ и incW). Среди последних плазмиды из группы несовместимости P и Q являются такими, которые лучше всего изучены, и такими, для которых было сконструировано большое число производных (Schmidhauser et.al., 1988). Кроме того, почти исключительно используются именно эти плазмиды. К тому же описано, что эти плазмиды реплицируются во всех изученных грамотрицательных бактериях, за исключением Myxococcus xanthus, Bradyrhizobium japonicum и бактерий вида Bacteroides (Kues et. Stahl, 1989). Плазмиды из группы несовместимости W используются побочным образом, с одной стороны, потому что они имеют меньше преимуществ, чем плазмиды из групп несовместимости P и Q, и, с другой стороны, потому что они являются менее хорошо изученными.
Группа несовместимости P делится на две группы: incP α и incP β, причем наиболее изученными плазмидами являются RK2, RK4 (которые на самом деле являются двумя независимыми изолятами одной и той же плазмиды) и R751. Эти плазмиды обладают признаком быть автоконъюгативными, т.е. они имеют функции конъюгации (tra и mob). Кроме того, это большие плазмиды (RK2 имеет размер величиной 60 т.о.) с небольшими числом копий (RK2 имеет число копий, заключенное между 4 и 7 в E.coli).
Репликация этих плазмид была подробно изучена в работах Kues et Stahl. Так, известно, что источник репликации oriV состоит, во-первых, из 8 сегментов величиной 17 п.о., во-вторых, из предполагаемого промотора, окруженного сайтами связывания протеина DnaA из E.coli и предполагаемым сайтом связывания протеина IHF из E.coli, в-третьих, из последовательности величиной 9 п.о. , обогащенной AT, за которой следует сайт связывания протеина DnaA, и, наконец, в-четвертых, из участка, обогащенного GC. Источник репликации, связанный с геном trfA, который транслируется в два протеина A1 и A2, кодируемых одной и той же фазой, но которые инициируются различными кодонами, представляет собой репликон, который имеет одну и ту же вездесущность, что и RK2. В зависимости от хозяев либо A2 оказывается необходимой для репликации, либо оба протеина A1 и A2 являются необходимыми (Thomas, 1986). Репликация этих плазмид контролируется сложной регуляторной сетью (системой), в которой принимают участие гены kil и kor. Гены kor для (kil-override) антагонизируют летальные эффекты генов kil (kilA, kilB, kilC, kilD) и отрицательно регулируют экспрессию гена trfa. Были идентифицированы пять генов kor (korA, korB, korC, korE и korF). Регуляторная сеть этих генов между ними и с геном trfA признается в качестве допускающей адаптацию репликона RK2 в хозяине, в котором он реплицируется (Kues et Stahl, 1989). Schidhauser et Helinski (1985) также показали, что делеция некоторых из этих генов приводит в некоторых хозяевах к более слабой сегрегационной стабильности.
Таким образом, оказывается что все эти гены являются необходимыми для наблюдения наилучшей возможной стабильности производных RK2 или RР4.
Было сконструировано много производных RК2 в качестве векторов-мультихозяев. Это плазмиды, которые сохранили ген устойчивости к тетрациклину исходного вектора, потому что последний находится рядом с источником репликации (oriV). Pечь идет, например, о плазмидах pRK290, pRK404, pRK415 (Ditta et al. , 1980 и 1985; Keen et al., 1988; Schmidhauser et al., 1988). Среди последних отметим, в частности, плазмиду pRK 290 (Ditta et. al., 1980), которая проявляет свойства с большой стабильностью в значительном числе грамотрицательных бактерий Schmidhauser et Helinski, 1985). Эта плазмида ведет себя стабильным образом в бактериях Escherichia coli, Azotobacter, Pseudomonas putida, Rhizobium meliloti, Rhodopseudomonas sphaeroides. Однако в других грамотрицательных бактериях та же самая плазмида не является такой стабильной; речь идет о бактериях Agrobacterium tumefacciens, Acetinobacter, Caulobacter и Pseudomonas aeruginosa ( Schmidhauser et Helinski, 1985). Плазмида pRK290 имеет размер величиной 20 т.о., что много для вектора клонирования. Она была получена в результате серии последовательных делений исходя из RK2. Помимо функций переноса (гены tra), гена устойчивости к канамицину и транспозона tnl, эти делеции установили функции kilA и kilC, korC и korE (Schmidhauser et Helinski, 1985). Таким образом, кажется, что можно было наблюдать определенную стабильность у производного RK2, несмотря на потерю некоторых функций kil и kor. Однако было отмечено, что простая потеря функции kilB проявляется в явном уменьшении стабильности плазмиды во многих грамотрицательных бактериях и что все испытанные производные PK2, имеющие меньший размер, чем pRK290, были явно менее стабильными (Schmidhauser et Helinski, 1985).
Не считая исследований, которые выявили соответствующую важность различных детерминантов RK2, задействованных в регуляторной системе экспрессии гена trfA, был обнаружен фрагмент, который может быть ответственным за сегрегационную стабильность этих плазмид (Sauruger et al, 1986). Этот фрагмент, расположенный между участком tra2 и геном устойчивости к канамицину, кодирует систему деления (par). Было показано, что этот фрагмент способен стабилизировать в Escherichia coli плазмиды pBR322 и pACYC177 (Sauruger et al., 1986).
Что касается природных плазмид из группы несовместимости Q, то можно указать, например, RSF1010, R1162 и R300B. Эти плазмиды имеют число копий, заключенное между 10 и 60 в зависимости от микроорганизмов. Размер этих плазмид намного меньше размера плазмид из группы несовместимости P; действительно, этот размер меньше 10 т.о.
Имеется необходимый участок в цис-положении для репликации этих плазмид, который включает два подучастка: с одной стороны, участок, образованный повторяющимися 3,5-последовательностями: величиной 40 п.о.; обогащенной AT, и величиной 60 п.о., обогащенной GC, - и предполагаемой областью связывания протеина DnaA из E.coli; с другой стороны, участок с повторяющейся обратной последовательностью, которая может образовывать вторичную структуру со стволом величиной от 40 до 60 п.о. Инициация репликации плазмиды RSF1010 требует наличия трех протеинов, кодируемых плазмидой: RepA, RepB и RepC, которые кодируются генами repA, repB и repC. Плазмида RepC узнает источник репликации (на уровне повторяющихся последовательностей) и положительно регулирует инициацию репликации; плазмида RepA имеет активность геликазы; плазмиды RepB и RepB* (которые соответствуют двум протеинам, кодируемым одной и той же фазой, но каждый из которых инициируется различным кодоном) имеют активность примазы, RSF1010-специфичную in vitro. Репликация плазмиды RSF1010 является зависимой от ДНК-полимеразы III и гиразы хозяина. Плазмида RSF1010 может быть мобилизирована от одной грамотрицательной бактерии к другой грамотрицательной бактерии за счет функций tra плазмид из групп немовместимости incIα, incM, incX и особенно incP (Derbyshire et Willets, 1987).
К настоящему времени не было описано никакое исследование, касающееся стабильности плазмиды RSF1010 и ее производных. Более того, хотя последовательность плазмиды RSF1010 является известной (Scholz et Scherzinger, 1979), никакой детерминант стабильности плазмиды не мог быть идентифицирован ни при помощи функционального анализа, ни при помощи молекулярного анализа. Есть все причины считать, что плазмиды из группы несовместимости Q не являются такими же стабильными, как плазмиды из группы несовместимости P.
Несмотря на эти работы, известные плазмиды с широким спектром хозяев имеют определенное число недостатков, связанных с их эффективностью и с их применением в промышленном масштабе.
В частности, для промышленного применения независимо от бактерии-хозяина плазимиды-векторы должны иметь определенное число свойств, которые соответствуют эксплуатационным нагрузкам и биобезопасности.
Эксплуатационные нагрузки связаны в основном с сегрегационной стабильностью плазмиды. Действительно, очень желательным является иметь возможность избегать использования в промышленном масштабе антибиотиков, чтобы противостоять селекционированию потери плазмиды. С этой точки зрения, вектор для промышленного использования должен обладать большой сегрегационной стабильностью. Последняя должна быть большой по меньшей мере для 25 последовательных генераций, которые представляют собой число генераций, необходимое для перехода в состояние консервации штамма, рекомбинируемого до окончания процесса в промышленном ферментере объемом 200 м3 (Stanburry et Whitaker, 1984). Кроме того, эти свойства стабильности должны быть близкими для производных таких плазмид, которые несут нуклеотидную вставку, содержащую последовательности ДНК, которые хотят амплифицировать, экспрессировать и т.д.
Правила биобезопасности требуют, кроме того, надежного биологического заточения для рекомбинантных штаммов. Система биобезопасности уровня I (BLI), описанная в "Guidelines for resеarch involvihg recombinant DNA molecules" из NIH от 7 мая 1987, соответствует наиболее слабым нагрузкам. Эта система, как в Escherichia coli, так и в Pseudomonas putida, предполагает использование неконъюгативных и немобилизируемых плазмид. Действительно, если в результате несчастного случая рекомбинированный микроорганизм оказался выпущенным в природную среду, то требуется, чтобы такие плазмиды не могли бы передаваться другим организмам (Trevors ey al., 1987).
Однако среди плазмид с широким спектром хозяев, описанных в литературе, ни одна полностью не удовлетворяет этим условиям. Во-первых, очень хорошая сегрегационная стабильность никогда не достигалась повсеместно. В самом деле, если некоторые из этих плазмид являются очень стабильными в некоторых хозяевах, то для всех грамотрицательных бактерий это не является аналогичным. Во-вторых, стабильность этих плазмид по большей части не изучалась после включения фрагмента ДНК, содержащего, например, последовательности, которые хотят амплифицировать или экспрессировать. Это, в частности, относится к плазмиде pRK290, показатели стабильности которой никогда не изучались после включения фрагмента ДНК. Кроме того, другой признак плазмид с широким спектром хозяев, описанных в известных технических решениях, заключается в том, что они могут мобилизироваться или быть мобилизированными для конъюгативного переноса от бактерии-донора к бактерии-реципиенту. Это также относится к плазмиде pRK290, которая обладает локусом mob. Эти плазмиды, следовательно, не являются совместимыми с нагрузками по биобезопасности, потому что в случае выброса рекомбинированного организма в результате несчастного случая нельзя исключить того, что плазмида с последовательностями ДНК, которые она содержит, не будет мобилизирована с относительно высокой частотой в других микроорганизмах.
Кроме того, отсутствие стабильности для некоторых из этих плазмид является также синонимом малой эффективности при производстве протеинов или метаболитов и, следовательно, представляет ограниченный интерес для промышленных ферментационных процессов. Одним из предметов настоящего изобретения является, строго говоря, вектор клонирования и/или экспрессии с широким спектром хозяев, отличающийся тем, что он способен реплицироваться почти во всех грамотрицательных бактериях, во-первых, имеет большую сегрегационную стабильность, во-вторых, и является немобилизируемым, в-третьих. Предметом изобретения являются также все производные этого вектора. В рамках изобретения производные этого вектора включают векторы, которые, несмотря на некоторые изменения или модификации (делеции, мутации, включения и т.д.), распространяющиеся на довольно значительные участки, сохраняют указанные выше признаки.
Векторы по изобретению являются производными плазмид с широким спектром хозяев в грамотрицательных бактериях из группы несовместимости P. В частности, они обладают источником репликации, происходящим из плазмиды, принадлежащей группе несовместимости P. Преимущественным образом они происходят из плазмиды RK2. Они комбинируют в себе свойства, которые никогда не были описаны для вектора, а именно: широкий спектр хозяев в грамотрицательных бактериях, большую стабильность и отсутствие функции для мобилизации.
Большая стабильность векторов по изобретению обусловлена включением особого нуклеотидного фрагмента, обладающего стабилизирующими свойствами. В частности, можно использовать особый фрагмент, происходящий из природной плазмиды RP4. Клонированный фрагмент, называемый фрагментом par, был описан в работе Saurugger et al., 1986, так же как и его способность стабилизировать некоторые плазмиды в E.coli. В настоящее время было найдено, что включение фрагмента par сопровождается очень значительным выигрышем в стабильности, не зависящим от вибрационного организма-хозяина и от природы (ген, промотор и т.д.) или размера нуклеотидной вставки. Действительно, сегрегационная стабильность векторов по изобретению, а также их производных является более высокой, чем у производных плазмиды RK2, которые могут служить векторами клонирования, причем это имеет место во всех испытанных грамотрицательных бактериях.
Потери функций для мобилизации является вторым признаком векторов по изобретению. Она приводит к тому, что в отличие от таких плазмид, как pRK290, векторы по изобретению не могут мобилизироваться от одной грамотрицательной бактерии к другой. Следовательно, они образуют с последними пары хозяин-вектор класса I и соответствуют промышленным требованиям. Это очень благоприятное свойство векторов по настоящему изобретению может быть получено, в частности, путем делеции участка, несущего локус mob.
Третье свойство векторов по изобретению заключается в их способности реплицироваться в большинстве грамотрицательных бактерий. Это свойство обладает особым преимуществом, потому что оно позволяет, в частности, работать в E.coli, чтобы осуществить желаемое конструирование перед тем, как ввести вектор в выбранный грамотрицательный микроорганизм-хозяин. Оно также позволяет выбрать наиболее подходящего хозяина в зависимости от желаемого применения вектора (амплифицирование, экспрессия и т.д.) или от природы и размера нуклеотидных вставок.
В частном варианте осуществления изобретения векторы по настоящему изобретению имеют мультисайт клонирования с определенным числом единичных сайтов клонирования, значительно облегчающих интеграцию нуклеотидных вставок, которые желают амплифицировать или экспрессировать.
В другом варианте осуществления векторы по настоящему изобретению имеют маркер селекции, такой как, в частности, ген устойчивости к антибиотику. Они содержат предпочтительно ген к тетрациклу из RK2. Этот ген устойчивости позволяет селекционировать присутствие плазмиды почти во всех грамотрицательных бактериях. Другие гены устойчивости могут быть включены в векторы, описанные в настоящем изобретении, а также в их производные.
Более частный предмет изобретения относится к вектору клонирования и/или экспрессии с широким спектром хозяев в грамотрицательных бактериях, отличающемуся тем, что он является производным плазмиды RK2, имеет размер менее 20 т.о., содержит фрагмент ДНК, несущий участок раr плазмиды RP4, не содержит локус mob и в случае необходимости содержит мультисайт клонирования и маркер селекции.
Векторы по настоящему изобретению могут использоваться для амплификации или выражения данных последовательностей ДНК. Предмет изобретения относится, следовательно, к векторам таким, как определено выше, которые содержат фрагмент рекомбинантной ДНК.
В частности, рекомбинантная ДНК содержит в зависимости от регуляторных последовательностей генной экспрессии один или несколько структурных генов, кодирующих один или несколько данных полипептидов. Опять же по изобретению, структурные гены могут быть зависимыми от их собственных регуляторных сигналов или от отличающихся регуляторных сигналов. В предпочтительном варианте осуществления регуляторные последовательности генной экспрессии состоят из одного или нескольких элементов выбираемых среди промоторов, терминаторов, сигнальных пептидов и сайтов связывания рибосом.
Структурные гены, которые кодируют полипептид, могут, в частности, выбираться среди генов, которые кодируют ферменты, гормоны или факторы роста. Они предпочтительно выбираются среди структурного гена альбумина, tPA, TIMP, интерлейкинов, аполипопротеинов и интерферонов.
В частном варианте осуществления изобретения один или несколько структурных генов являются генами, участвующими на генетическом или биохимическом уровне в биосинтезе метаболита, т.е. генами, кодирующими полипептиды, задействованные в процессе биосинтеза метаболита. В частности, метаболит может быть витамином, аминокислотой, антибиотиком или любым другим бактериальным метаболитом. Метаболит предпочтительно выбирается из группы: витамин B12, биотин, рибофлавин, лизин, треонин, метионин, пенициллин или тетрациклин.
В предпочтительном варианте осуществления векторы по изобретению содержат структурный ген, кодирующий данный протеин, причем структурный ген предшествует сигналам, разрешающим его экспрессию и в случае необходимости секрецию указанного протеина.
Другой предмет изобретения относится к способу производства протеина или метаболита, отличающемуся тем, что:
- вводят в грамотрицательную бактерию вектор такой, как определено выше, который содержит структурный ген, кодирующий указанный протеин, или один или несколько генов, участвующих на генетическом или биохимическом уровне в биосинтезе указанного метаболита,
- культивируют эту бактерию в условиях экспрессии одного или нескольких указанных генов, и
- извлекают выработанные протеин или метаболит.
Векторы, описанные в настоящем изобретении, могут применяться в промышленном масштабе почти во всех грамотрицательных бактериях. В случае плазмиды рХL1635 она может использоваться во всех грамотрицательных бактериях, где реплицируется плазмида RK2, т.е. во всех грамотрицательных бактериях за исключением Myxococcuc xanthus, Bredyrhizobium japonicum и бактерий вида Bacteroides (Kues et Stahl, 1989). Их можно использовать следующим образом: один или несколько фрагментов ДНК, несущих один или несколько генов, которые должны быть, например амплифицированы, клонируются в мультисайте клонирования, например сконструированная таким образом плазмида вводится затем в бактерию, которую желают использовать на промышленном уровне. Система трансформации, такая как электропорация (Wirth et al., 1989), может использоваться для введения сконструированной плазмиды. Рекомбинантные клоны селекционируются по устойчивости, внесенной плазмидой. Эти клоны могут затем храниться в соответствии с традиционными способами хранения рекомбинированных штаммов для промышленного применения (Standburry et Whitaker, 1984).
Еще одним предметом изобретения являются грамотрицательные бактерии, содержащие векторы по изобретению, а также их применениe. В частности, такие бактерии могут использоваться для производства протеина или метаболита или непосредственно в реакции биопревращения.
Другие предметы и преимущества настоящего изобретения будут выявляться при чтении последующих примеров, которые должны рассматриваться как иллюстративные, а не ограничивающие.
Общие методы клонирования, молекулярной биологии и биохимии.
Традиционные методы молекулярной биологии, такие как центрифугирование плазмидных ДНК в градиенте хлорид цезия - бромид этилметаллического соединения, переваривание (расщепление) под действием ферментов рестрикции, электрофорез на геле, электроэлюирование фрагментов ДНК исходя из гелей агарозы, трансформация в E.coli, осаждение нуклеиновых кислот и т.д., описаны в литературе (Maniatis et al., 1982; Ausubel et al., 1987). Нуклеотидные последовательности были определены методом терминации цепей, следуя уже имеющейся методике (Ausubel et al., 1987).
Ферменты рестрикции были поставлены из New-England Biolabs (Biolabs), Bethesda Reseach Laboratories (BRL) ou Amersham Ltd (Amersham).
Для связывания фрагменты ДНК разделяются по их размеру на гелях агарозы с концентрацией 0,7% или акриламина с концентрацией 8%, очищаются методом электроэлюирования, экстрагируются фенолом, осаждаются в этаноле, потом инкубируются в буферном растворе Трис-HCl: pH = 7,4, концентрация - 50 мМ, MgCl2 - 10 мМ, ДТТ - 10 мМ, АТФ - 2 мМ, в присутствии ДНК-лигазы фага Т4 (Biolabs).
Если необходимо, то фрагменты ДНК, имеющие выступающие концы 5', дефосфорилируются в результате обработки щелочной фосфатазой из кишечника теленка (ClP, Фармация) при температуре 37oC в течение 30 мин в следующем буферном растворе: глицин - 100 мМ, MgCl2 - 1 мМ, ZnCl2 - 1 мМ, pH = 10,5. Тот же самый метод используется для дефосфорилирования выступающих или свободных концов 3', но обработка проводится в течение 15 мин при температуре 37oC, а потом 15 мин при 56oC. Фермент инактивируется путем нагревания реакционной смеси при температуре 68oC в течение 15 мин в присутствии 1% SDS и 100 мМ NaCl с последующими экстракцией в смеси фенол-хлороформ и осаждением в этаноле.
Заполнение выступающих концов 5' осуществляется фрагментом Klenow ДНК-полимеразы 1 из E.coli (Biolabs). Реакция проводится при температуре окружающей среды в течение 30 мин в буферном растворе Трис-HCl: pH = 7,2, концентрация - 50 мМ, дНТФ - 0,4 мМ, MgSO4 - 10 мМ, ДТТ - 0,1 мМ, АБС - 50 мкг/мл. Заполнение и/или переваривание выступающих концов 3' осуществляется в присутствии ДНК - полимеразы фага Т4 (Biolabs) в соответствии с рекомендациями производителя.
Олигонуклеотиды синтезируют, используя химические свойства фосфорамидитов, защищенных в β- положении цианоэтильной группировкой (Sinha et al., 1984; Giles, 1985), при помощи автоматического синтезатора ДНК марки Biosearch 8600, применяя рекомендации производителя.
Мутагенез in vitro под действием олигодеоксинуклеотидов осуществляют по методу, разработанному в работе Taylor et al., 1985, используя оборудование, поставляемое фирмой Amersham France, S.A.
Делеции, осуществленные при помощи экзонуклеазы III и нуклеазы SI по методу Henikoff, 1984, были проведены, используя оборудование Erase-a-BaseTM System de Promega (Madison, WI, USA) и следуя методике, поставляемой производителем.
Связанные ДНК используются для трансформации штамма, ставшего подходящим: E. coli MC1060 [ Δ (lac10PZYA) ФХ74, galU, galK, strAr, hsdR (Casadaban et al., 1983) и HB101 (hsdS 20, supE44, recA13, ara-14, proA2, lacYI, galK2, rpsl20, xyl-5, mtl-1, λ- (Maniatis et al., 1982) для плазмид или E.coli TGI [ Δ (lac proA, B), supE, thi, hsdD5/F' traD36, proA+, B+, laclq, lacZ Δ M15] (Gibson, 1984) для репликативных форм фагов, производных бактериофага M13. Используемый штамм polA представляет собой SF 800 (Stachel et al., 1985), этот штамм является устойчивым к налидиксовой кислоте (Nalr). Клон, спонтанно устойчивый к рафампицину (C600 Rifr) (50 мкг/мл) штамма C600 (thi-1, thr1, leu-B6, lacY1, tonA21, supE44, λ- ) (Maniatis et al., 1982), использовался в качестве штамма-реципиента при конъюгации от E.coli до E.coli.
Плазмидные ДНК очищаются по методу Birnboim et Doly, 1979. Минисинтезы плазмидной ДНК проводятся по методике Klein et al., 1980.
Среда для культивирования LB используется для бактериологической части (Maniatis et al. , 1982). Штаммы Pseudomonas denitrificans SC510 Rifr, Agrobacterium tumefaciens C58C9 (Cameron et al.,, 1989), Pseudomobas putida KT2440 (Bagdasarian et. al., 1981), Rhizobium meliloti 102F34 (Leong et al., 1982) также культивируются в среде LB, но температура инкубации составляет 30oC.
Конъюгации были осуществлены, как это уже описано (Ditta et al., 1980). 109 Клеток каждого вида бактерий, участвующих в конъюгации, фильтруются и адсорбируются на фильтре Миллипор с размерами пор 0,45 мкм. Фильтры затем инкубируются в чашках со средой LB при температуре 37oC, потом клетки снова суспендируются в 1 мл 10 мМ MgSO4. Разбавления бактериальной суспензии затем распределяются по чашкам со средой LB, в которые добавлены соответствующие антибиотики.
Пример 1. Конструирование плазмиды рХL 1635.
Этот пример иллюстрирует, каким образом может быть сконструирован вектор с широким спектром хозяев в грамотрицательных бактериях, немобилизируемый и имеющий очень большую сегрегационную стабильность.
Пример 1.1. Получение производного плазмиды pRK290, потерявшего локус mob.
Этот пример иллюстрирует, каким образом локус mob из RK2 может подвергаться делеции из производного RК2.
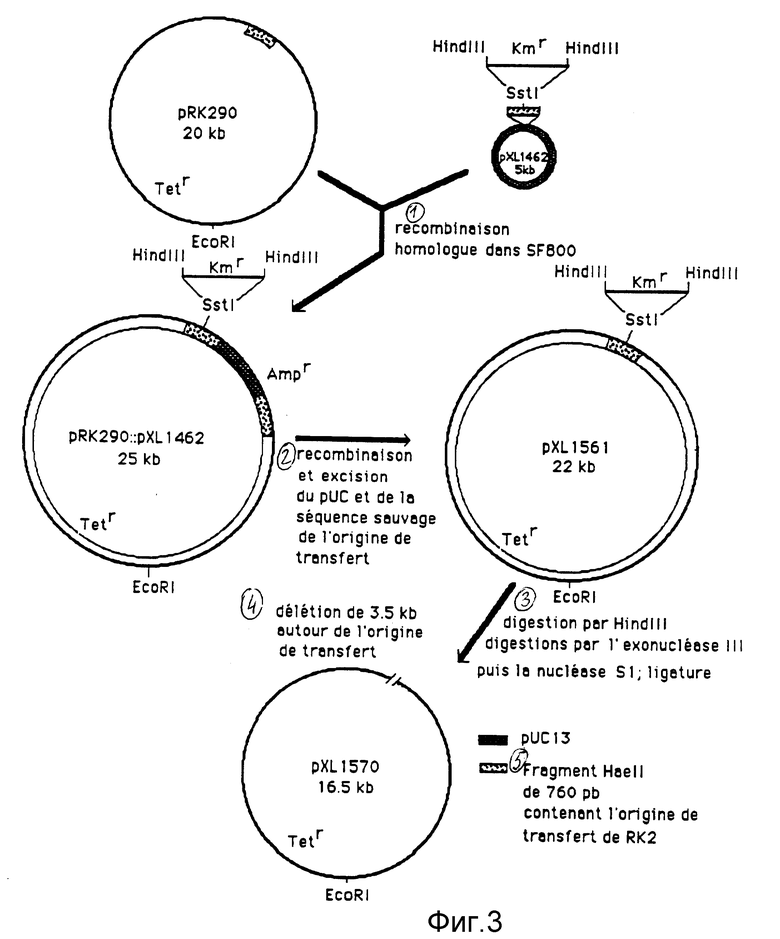
Деления этого локуса осуществляется с трудом в том смысле, что не известен никакой единичный сайт рестрикции поблизости от локуса mob. Если бы это был тот случай, то было бы возможно провести делецию in vitro, используя, например, экзонуклеазу Ваl 31, как это уже описано (Maniatis et al., 1982). Чтобы иметь возможность осуществить эту делению, мы ввели единичный сайт рестрикции в локус mob из RК2. Это было проведено в результате направленного мутагенеза по методу Tylor et al., 1985. Методы направленного мутагенеза проводятся только с небольшими фрагментами. Поэтому мы провели процесс в три стадии: во-первых, подклонирование фрагмента RK2, содержащего начало переноса (oriT), в фаге, производном фага М13 с последующим направленным мутагенезом для введения единичного сайта рестрикции, во-вторых, мутированный таким образом фрагмент затем клонируется на плазмиде pUC13 (Viera et Messing, 1982), а потом кассета, несущая ген устойчивости к канамицину, клонируется в сайте рестрикции, имеющемся в начале переноса, и будет затем служить в качестве маркера вызванной мутации; в-третьих, мутированный фрагмент обменивается в результате двойной рекомбинации с диким фрагментом, носимым плазмидой pRK290. Полученная плазмида является производным плазмиды pRK290, имеющим единичный сайт рестрикции на уровне начала переноса. Следовательно, можно провести мутагенез путем делеции, воздействуя экзонуклеазами, а потом ДНК-лигазой. Подробности этого конструирования приводятся ниже.
Фрагмент НаеII величиной 760 п.о. из RK2, который является достаточным в цис-положении для получения мобилизации (Guiney et Yakobson, 1982), клонировался в М13 mр10 (Viera et Messing, 1982). Этот фрагмент содержит начало переноса RК2 (Guiney et Yakobson, 1983) и, когда он клонируется на плазмиде, то делает последнюю мобилизируемой в транс-положении за счет функций tra RK2. Этот фрагмент очищался, начиная с переваривания НаеII из RK2, концы переваривались при помощи ДНК-полимеразы бактериофага Т4. Кроме того, репликативная форма фага М13 mр10 была линеаризована в результате переваривания при помощи Pstl и Sstl, концы были переварены при помощи ДНК-полимеразы бактериофага Т4. Полученная таким образом репликативная форма и очищенный фрагмент были связаны вместе, потом трансформированы в клетках Escherichia coli TGl, ставших подходящими. Рекомбинантные фаги были детектированы, как это уже описано (Viera et Messing, 1982). Получившаяся репликативная форма была названа рХL1418 (см. фиг. 1).
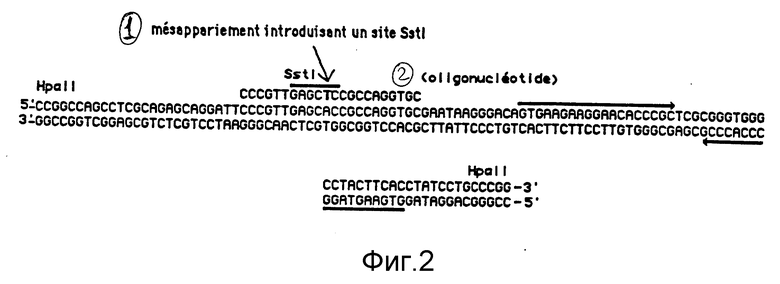
Последовательность фрагмента НраII величиной 112 п.о., содержащая начало переноса плазмиды RК2, уже была опубликована (Guiney et Yakobson, 1983). Этот фрагмент содержится во фрагменте НаеII величиной 760 п.о., носимом в плазмиде рХL1418. Было отмечено, что существует последовательность, повторяющаяся в обратном направлении, которая способна формировать структуру в виде заколки для волос с размером величиной 19 п.о. для каждой повторяющейся последовательности (см. фиг. 2). Направленный мутагенез по методу, разработанному в работе Taylor et al., (1985), был осуществлен на однонитевой ДНК фага, полученной исходя из этой репликативной формы. Используемый олигонуклеотид имеет следующую последовательность: 5'-CCC GTT GAG CTC CGC CAG GTG C-3'. На фиг. 2 приводятся последовательность фрагмента HpaII величиной 112 п.о., а также последовательность олигонуклеотида; как показано здесь, последовательность олигонуклеотида отличается от последовательности фрагмента только одним нуклеотидом, эта мутация вводит сайт Sstl. Сначала было проверено, что олигонуклеотид является точно комплементарным для однонитевой ДНК, полученной в результате инфицирования E.coli TGl репликативной формой плазмиды pXL1418. Чтобы осуществить это, рассматриваемый олигонуклеотид использовался в качестве затравки нуклеотидной последовательности. Хорошо наблюдалось, что имеет место реакция последовательности. Нуклеотидная последовательность считывается, и первые основания хорошо соответствуют последовательности правого конца верхней нити, представленной на фиг. 2.
Направленный мутагенез был осуществлен, как это описано выше. Получаются мутантные клоны, имеющие именно сайт Sstl, введенный в ожидаемое положение. Одна из этих репликативных форм была названа рХL1454 (см. фиг. 1).
Плазмида рХL1454 переваривается посредством EcoRI и HindIII. Фрагмент величиной 760 п.о. очищается, потом связывается с рUC13, переваренной посредством EcoRI и Нind III. После трансформации были получены рекомбинантные клоны. Плазмидный клон был удержан и назван рХL1461 (см. фиг. 1).
Следующая стадия заключалась во введении кассеты, придающей устойчивость к антибиотику, в сайт Sstl, чтобы в последнем находился селективный маркер. Для того чтобы это осуществить, плазмида рХL1461 линеаризовалась посредством Sstl, потом связывалась с фрагментом Sstl, очищалась от pUC4KIXX (Фармация, Франция, CA). Этот фрагмент величиной 1,6 т.о. несет ген устойчивости к канамицину транспозона Тn5. Рекомбинантные клоны были селекционированы после трансформации в среде LВ, дополненной ампицилином и канамицином. Полученная таким образом плазмида была названа рХL1462 (см. фиг. 1).
Плазмида pRK290 трансформируется в штамме Escherichia coli poIA, SF 800 (Stachel et al. , 1985). В таком штамме плазмиды, производные от RK2, реплицируются, так как их репликация не зависит от ДНК-полимеразы 1 из Е.coli, тогда как pUC13 не реплицируется. Плазмида рХL1462 затем трансформируется в штамме SF 800 pRK290. После трансформации бактерии распределяются в среде LB, дополненной тетрациклином, канамицином и ампицилином. Поскольку плазмида рХL 1462 не может реплицироваться в этом штамме, то приобретение устойчивостей, носимых этой плазмидой, может произойти только в результате гомологической рекомбинации между двумя плазмидами. Действительно, две эти плазмиды совместно владеют фрагментом НаеII величиной 760 п.о., который несет начало переноса. Следовательно, может происходить гомологичная рекомбинация между гомологичными участками двух плазмид, что выражается в виде объединения между двумя репликонами. Плазмидная ДНК клона, устойчивого к трем антибиотикам, была проанализирована путем рестрикции. В результате анализа на геле агарозы оказалось, что она содержит только одну единственную плазмиду. Анализ этой плазмиды путем рестрикционного переваривания показывает, что плазмида рХL1462 хорошо прорекомбинировала с плазмидой рRК290 на уровне начала переноса. Плазмида, получающаяся при слиянии двух репликонов, несет два источника переноса RК2: один, дикий, и один, обладающий сайтом Sstl, введенным в результате мутагенеза, в котором находится клонированной кассета, несущая ген устойчивости к канамицину (см. фиг. 3). Клон, содержащий такую плазмиду, культивируется затем в виде разбавленных культур в среде LB, дополненной тетрациклином и канамицином. Отсутствие ампицилина позволит, чтобы акты простой рекомбинации с вырезанием рUC13, несущей дикую копию фрагмента величиной 760 п.о. из начала переноса, не были бы контрселекционированы. Поскольку рUC13 и производные плазмиды не реплицируются, то вырезанная плазмида тут же будет потеряна. После осуществления серии разбавленных культур, представляющих собой 60 генераций, в жидкой среде, селективной для pRK290 и для маркера начала мутированной репликации, бактерии распределяются в среде LB, дополненной теми же самыми антибиотиками. Пересаживают 2000 колоний в ту же самую среду и в чашки со средой LB, в которые добавлен ампицилин. Получаются 2 клона, чувствительных к ампицилину. Плазмиды, носимые этими клонами, очищаются и анализируются путем рестрикции. Эти анализы показывают, что эти плазмиды точно соответствуют вырезанию рUC13 с дикой копией начала переноса RK2. Эта плазмида называется рХL1561 (см. фиг. 3). Поскольку эта плазмида имеет два сайта Hind III на уровне начала переноса, то можно провести делецию в результате переваривания посредством экзонуклеазы после переваривания плазмиды посредством Hind III (см. фиг. 3). Следовательно, плазмида pXL1561 была переварена посредством Hind III, потом была осуществлена серия делеций по методу Henikoff (1984); этот метод использует последовательное действие экзонуклеазы III и нуклеазы Sl; полученные делеции являются бинаправленными. Затем эти делеции связываются, а связка трансформируется в MC1060. Плазмидная ДНК полученных таким образом трансформантов анализируется путем рестрикционного переваривания. Многие клоны оказываются подвергнутыми делеции на уровне локуса mob. Мы удержали плазмиду, которая была подвергнута делеции величиной 3,5 т.о. Эта делеция должна соответствовать, если экзонуклеаза III переварила ДНК плазмиды с одной и той же кинетикой с одной и с другой стороны от сайтов Hind III, делеции величиной 1,75 т.о. с одной и с другой стороны от начала переноса плазмиды. Полученная таким образом плазмида называется рХL1570 (см. фиг. 3).
Плазмида рХL1570 имеет EcoRI и BgIII в качестве единичных сайтов рестрикции. Мы добивались ввести мультисайт клонирования в сайт EcoRI, чтобы получающаяся плазмида содержала несколько сайтов клонирования. Плазмида рFR10 (Shapira et al. , 1983), которая имеет мультисайт клонирования, окаймленный двумя сайтами EcoRI, используется в качестве источника мультисайта клонирования. Плазмида рFR10 переваривается посредством EcoRI полностью как плазмида рXL1570. Оба переваривания связываются, и связка трансформируется в E. coli MC1060. Получаются рекомбинантные клоны, в том числе один, называемый рХL1594 (см. фиг. 4), ориентация мультисайта которого определена.
Пример 1.2. Конструирование производного плазмиды рRК290, немобилизируемого и имеющего локус par из RK2.
Этот пример иллюстрирует, каким образом, клонируя фрагмент, несущий локус par из RP4, на производном плазмиды RK2, получают плазмиду, которая является более стабильной сегрегационно.
Фрагмент BamHI величиной 2,2 т.о. из рGМA28 (Gerlitz et al., 1988), содержащий локус par из RP4, очищается, потом связывается с плазмидой рХL1594, линеаризованной посредством ВgIII. Связка трансформируется в E.coli MC1060. Плазмидная ДНК 24 трансформантов анализируется методом рестрикционного переваривания, и 3 клона оказываются носителями фрагмента величиной 2,2 т.о. Два из них имеют фрагмент одной и той же ориентации, а третий соответствует обратной ориентации. Плазмида, соответствующая двум первым клонам, называется рХL1635, тогда как плазмида, содержащая фрагмент другого направления, называется рХL1634 (см. фиг. 4).
Полученные таким образом плазмиды являются производными плазмиды RK2, а еще более точно - плазмиды рRK290 с делецией величиной 3,5 т.о. вокруг начала переноса интеграцией участка par из RР4 и выборочно мультисайтом клонирования. Следующие сайты могут использоваться для симметричных клонирований: EcoRI, BamHI, Рstl, HindIII, Clal, Хbаl, Xnoll и Sstl, для асимметричных клонирований EcoRI должен быть исключен, но другие ферменты могут использоваться.
Пример 2. Мобилизация плазмиды рХL1635.
Была изучена мобилизация плазмиды рХL1635. Она осуществляется при конъюгативном переносе из E.coli в E.coli. Перенос с тремя партнерами (по методу, уже описанному в работе Ditta et al., 1980) был осуществлен при использовании следующих штаммов:
- штамм, несущий плазмиду, подлежащую мобилизации: НВ101 (рХL1635) или НВ101 (рRК290) или НВ101 (рХL1570) или НВ101 (рUC9 tet);
- штамм, содержащий плазмиду "helper" ("помощник") для мобилизации производных плазмиды RK2: НВ101 рRК2013;
- штамм-реципиент: C600 Rifr.
Плазмида рUC9tet производится фирмой "Фармация Франс С.А."; речь идет о немобилизируемой плазмиде, производной от pBR322, которая придает ту же самую устойчивость, что и плазмиды рRK290, рХL1635 и рХL1570.
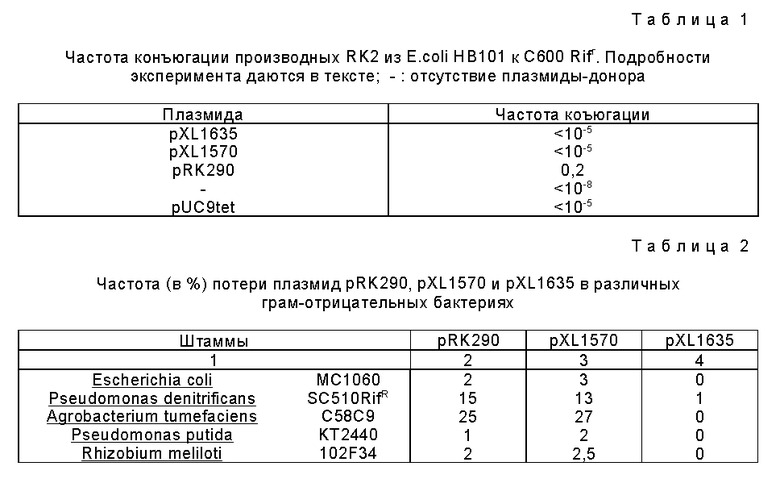
Трансконъюганты селекционируются на среде LB, дополненной тетрациклином и рифампицином. Частота конъюгации рассчитывается, как это обычно делается (Ditta et al., 1980), в виде отношения числа клеток-реципиентов, имеющих эффективно приобретенную устойчивость плазмиды, к общему числу клеток-реципиентов. Конъюгация осуществляется с НВ101 в качестве штамма-донора. Речь идет о штамме recA, что позволяет избегать гомологичной рекомбинации, которая могла бы произойти между рRK2013 и рХL1570, рRK290, pXL1635 и рUC9tet, потому что эти плазмиды имеют гомологичные последовательности (см. табл. 1). Как ясно следует из этой таблицы, потеря локуса mob выражается в виде почти полной потери мобилизации (имеется по меньшей мере коэффициент 2•104 между частотой конъюгации плазмиды рХL1570 и частотой конъюгации плазмиды рRК290, тогда как эти отличаются, только делецией величиной 3,5 т.о.). Плазмида рХL1635 имеет те же самые свойства мобилизации, что и плазмида рХL1570. Вероятно, как это уже было описано выше, что наблюдаемая здесь конъюгация с pXL1570 и рХL1635 обусловлена гомологичной рекомбинацией между этими плазмидами (которые происходят непосредственно из pRK290) и рRК2013, которые имеют гомологичные участки (Ditta et al., 1980). Немобилизируемая плазмида сравнения pUC9tet мобилизируется с частотой, которая не отличается от частоты, наблюдаемой для плазмид pXL1635 и рХL1570, что показывает, что эти плазмиды сильно потеряли их способность к мобилизации и что они могут быть мобилизированы только в результате рекомбинации, даже если в описанном эксперименте штаммы-доноры представляют собой recA (в этом эксперименте речь должна идти о независимой рекомбинации rec). Поскольку механизм конъюгативного переноса плазмиды pRK290 является одним и тем же между двумя штаммами E. coli и между двумя грамотрицательными бактериями, то плазмида рХL1635 должна рассматриваться как немобилизируемая, каков бы ни был хозяин.
Пример 3. Введение плазмиды рХL1635 в грамотрицательные бактерии, отличные от Escherichia coli.
Этот пример иллюстрирует, каким образом немобилизируемая плазмида рХL1635 может быть введена в различные грамотрицательные бактерии.
Поскольку плазмида рХL1635 не несет начала переноса, то она не может быть мобилизирована из Escherichia coli в другую грамотрицательную бактерию. Для введения рХL1635 в различные грамотрицательные бактерии используется метод трансформации при помощи электропорации (Wirth et al., 1989).
При помощи этого метода с плазмидами рRK290, рХL1570 и рХL1635 трансформируются следующие бактерии:
- Pseudomonas denitrificans SC510 RifR;
- Agrobacterium tumefaciens C585C9;
- Pseudomonas putida KT2440;
- Rhizobium meliloti 102F34.
Для каждой бактерии снова выделяется рекомбинантный клон, плазмидная ДНК очищается и оказывается не отличающейся от ДНК исходной плазмиды за счет многих рестрикционных перевариваний. Следовательно, плазмида рХL1635 может быть введена в грамотрицательные бактерии.
Пример 4. Стабильность плазмиды рХL1635.
Этот пример иллюстрирует, в результате чего плазмида рХL1635 является более стабильной, чем плазмида pRK290 в различных грамотрицательных бактериях.
Различные рекомбинантные бактерии, а также родительские штампы культивируются в среде LB без добавления антибиотика. Когда достигается стационарная фаза, то проводится разбавление 1/1000. Эти штаммы культивируются указанным образом в течение 50 генерации (число генераций оценивается как 50 и находится в интервале от 40 до 60). Разбавления культур наносятся затем на агарсодержащую среду LВ. Для каждой культуры 200 независимых клонов пересаживаются на среду, селективную для плазмиды. Была рассчитана частота клонов, потерявших устойчивость и, следовательно, плазмиду. Это значение дается в табл. 2.
Значения соответствуют частоте (в %) клонов, потерявших устойчивость плазмиды после 50 генераций культуры, неселективных, в среде LВ.
Из этой таблицы ясно следует, что плазмида рХL1635 является намного более стабильное, чем плазмида pRK290 и чем плазмида рХL1570, это свойство действительно во всех изученных бактериях. Две эти последние плазмиды имеют одну и ту же частоту клонов, потерявших плазмиду; наблюдаемые различия не являются значимыми с точки зрения статистики. Следовательно, делеция величиной 3,5 т. о. не влияет на свойства репликации и стабильности плазмиды рRК290. Напротив, клонирование фрагмента величиной 2,2 т.о. из pGMA28 приводит к очень значительному выигрышу в стабильности. Эти результаты ясно показывают, что плазмида рХL1635 является плазмидой, которая имеет намного более интересные свойства, чем плазмида pRK290 с точки зрения стабильности. Эти преимущества, разумеется, являются теми же самыми для других производных плазмиды RК2, которые согласно тому, что было опубликовано, обладают меньшими преимуществами, чем pRK290 для промышленного применения (Schmidhauser et al., 1988).
Описание чертежей.
Фиг. 1. Конструирование плазмид рХL1418, рХL1454, рХL1461 и рХL1462. Подробности конструирования приводятся в тексте.
Фиг. 2. Последовательность фрагмента HapII величиной 110 п.о., содержащего начало переноса RK2 (согласно Guiney et Yakobson, 1983). Указывается последовательность олигонуклеотида, который служил для мутагенеза, а также сайт SsI, который был введен. Две последовательности, повторяющиеся в обратном направлении, которые должны образовать структуру в виде заколки для волос, подчеркнуты стрелкой.
Фиг. 3. Конструирование плазмид рХL1561 и рХL1570. Подробности конструирования приводятся в тексте.
Фиг. 4. Конструирование плазмид рХL1594, рХL1635 и рХL1634. Подробности конструирования приводятся в тексте.
Определение используемых терминов и сокращения.
Рекомбинантная ДНК: совокупность методов, которые позволяют либо ассоциировать внутри одного и того же микроорганизма последовательности ДНК, которые не являются природными, либо провести специфический мутагенез фрагмента ДНК.
АТФ: аденозин-5'-трифосфат.
АБС: альбуминовая бычья сыворотка.
Стоп-кодон: кодон терминации трансляции.
ДНТФ: 2'-дезоксирибонуклеозид-5'-трифосфаты.
ДТТ: дитиотреитол.
т.о.: тысяч оснований (кислооснований).
п.о.: пар оснований.
Надписи на чертежах.
Фиг. 1.
1 - Фрагмент HaeII величиной 760 п.о., происходящий из плазмиды RК2. Переваривание при помощи ДHК-полимеризы бактериофага Т4.
2 - Фаг M13mp10, переваренный посредством Sst I и Pstl, потом обработанный при помощи ДНК-полимеразы бактериофага Т4.
3 - Метагенез и введение сайта Sst I на уровне начала переноса.
4 - Переваривание посредством EcoRI и Hind III, очистка фрагмента величиной 760 п.о.
5 - Плазмида рUC13, переваренная посредством EcoRl и Hind III.
6 - Фрагмент Sst I величиной 1,6 т.о., очищенный, исходя из рUC4KIXX, несущий ген устойчивости к канамицину.
7 - Плазмида рХL1461, линеаризованная посредством Sst I.
8 - Плазмида рUC13.
9 - Фрагмент плазмиды рUC4КIХХ, несущий ген устойчивости к канамицину из Тn5.
Фиг. 2.
1 - Спаривание, вводящее сайт Sst I.
2 - Олигонуклеотид.
Фиг. 3.
1 - Гомологичная рекомбинация в SF 800.
2 - Рекомбинация и вырезание pUC и дикой последовательности из источника переноса.
3 - Переваривание посредством Hind III, переваривания посредством экзонуклеазы III, потом нуклеазы SI; связывание.
4 - Делеция величиной 3,5 т.о. вокруг начала переноса.
5 - Фрагмент HaeII величиной 760 п.о., содержащий источник переноса из RK2.
Фиг. 4.
1 - Делеция величиной 3,5 т.о. посредством Ехо III и SI, которая удалила источник переноса.
2 - Введение мультисайта из pFR10.
3 - Плазмида рХL1594, линеаризованная посредством ВgI II.
4 - Очистка фрагмента ВаmHI величиной 2,2 т.о. из рGMA28.
5 - RP4 раr-участок.
Источники информации
1. Ausubel F. M., R. Brent, R. E. Kinston, D. D. Moore, J. A. Smith, J. G. Seidman and K. Struhl. 1987. Current protocols in molecular biology 1987-1988. John Willey and Sons, New York.
2. Bagdasarian, J. Frey, and K. Timmis. 1981. Specific-purpose plasmid cloning vectors. II. Broad host range, high copy number, RSF1010-derived vectors, and a host vector system for gene cloning in Pseudomonas. Gene 16,237-247.
3. Cameron B, K. Briggs, S. Pridmore, G. Brefortand J. Crouzet, 1989. Cloning and analysis of genes involved in coenzyme В 12 biosynthesis in Pseudomongs denitrificans. J. Bacteriol, 171, 547-557.
4. Casadaban, M. J., A. Martinez-Arias, S. T. Shapira and J. Chou. 1983, бета-galactosidase gene fusion for analysing gene expression in Escherichia coli and Yeast. Methods Enzymol. 100, 293-308.
5. Derbyshire, K. M. and N. S. Willets. 1987. Mobilization of the non-conjugative plasmid RSF1010: a genetic analysis of its origin of transfer. Mol. Gen. Genet, 206, 154-160.
6. Ditta G., Schmidhauser Т., Yakobson E., Lu P., Liang X.-W., Finlay D. R. , Guiney D. , Helinski D. R., 1985. Plasmids related to the broad host range vector pRK290, useful for gene cloning and for monitoring gene expression. Plasmid, 13,149-154.
7. Ditta G., Stanfield S., Corbin D., Helinski D. R., 1980. Broad host range DNA cloning system for Gram-negative bacteria: Construction of a gene bank of Rhizobium melitoti. Proc. Nail. Acad.Sri. U.S. A., 77, 7347-7351.
8. Gerlitz, M., O. Hrabak and H. Schwab. Abstract 8th International Biothechnology Symposium, 1988, A156, p. 129.
9. Giles, J. W. 1985. Adances in automated DNA synthesis. Am. Biotechnol., Nov./Dec.
10. Guidelines for research involving recombinant DNA molecules; Notice. National Institute of Health, Federal Register, Vol. 51, No. 88, 16958-16965.
11. Guiney, D. G. and E. Yakobson. 1983. Location and nucleotide sequence of the transfer origin of the broad host range plasmid RK2. Proc. Nail. Acad. Sd. USA, 80,3595-3598.
12. Henikoff S. 1984. Unidirectional digestion with exonuclease III creates targeted breakpoints for DNA sequencing. Gene, 28, 351-359.
13. Keen, N. T.,S. Tamaki, D. Kobayashi and D. Trollinger. 1988. Improved broad host range plasmids for DNA cloning in gram-negative bacteria. Gene, 70,191-197.
14. Kues, U. and U. Stahl. 1989. Replication of plasmid in gram-negative bacteria. Mic. Rev., 53, 491-516.
15. Leong, L. S., G. S. Ditta, and D. R. Helinski. 1982. Identification of a cloned gene coding for дельта-aminolevulinic ,acid synthetase from Rhizobium melitoti. J. Biol. Chem. 257, 8724-8730.
16. Maniatis, Т., E. F. Fritsch, and J. Sambrook. 1982. Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York.
17. Saurugger P. N., O. Hrabak H. Schwab and R. M. Laflerty. 1986. Mapping and cloning of the par-region of broad-host-range plasmid RP4. J. Biotechnol., 4, 333-343.
18. Schmidhauser, T. J. and D. R. Helinski. 1985. Regions of broad-host-range plasmid RK2 involved in replication and stable maintenance in nine species of gram-negative bacteria. J. Bacteriol., 164, 446-455.
19. Schmidhauser, T. J. , G. Ditta and D. R. Helinski. 1988. Broad-Host-Range plasmid cloning vectors for gram-negative bacteria. In R. L. Rodriguer and D. T. Denhardt (ed.). Vectors, a survey of molecular cloning vectors and their uses, Butterworths, Boston.
20. Scholz, P., V. Haring, B. Wittman-Liebholt, K. Ashman, M. Bagdasarian and E. Scherzinger. 1989. Complete nucleotide sequence and gene organization of the broad-host-range plasmid RSF1010. Gene, 75, 271-288.
21. Shapira S. K., J. Chou, F. V. Richaud, and M. C. Casadaban. 1983. New versatile plasmid vector for expresssion of hybrid proteins coded by a cloned gene fused to lacZ gene sequences encoding enzymatically active carboxy-terminal portion of бета-galactosidase. Gene 25, 71-83.
22. Sinha, N. D.,J. Biemat.J. McManus and H.Koster. 1984. Polymer support oligonucleotide synthesis, XVIII: Use of бета-cyanoethyl-N,N- dialkylamino-N-morpholino phosphoramidite of deoxynucleosides for the synthesis of DNA fragments simplifying deprotection and isolation of the final product. Nucl. Adds Res., 12, 4539-4557.
23. Stachel S. E. , G. An, C. Flores and E. W. Nester. 1985. A Tn31acZ transposon for the random generation of бета-galactosidase gene fusions: application to the analysis of gene expression in Agrobacterium. Embo J., 4,891-898.
24. Stanburry, P. F. and A. Whitaker. 1984. Principles of fermentation technology. Pergamon Press, Oxford.
25. Taylor J. W., J. Ott and F. Eckstein. 1985. The rapid generation of oligonucleotide-directed mutations at high frequency using phophorothioate-modified DNA. Nucl. Acid Res., 13, 8764-8765.
26. Thomas C.M. 1986. Evidence for the involvement of the incC locus of broad host range plasmid RK2 in plasmid maintenance. Plasmid, 16, 15-29.
27. Trevors, J. Т., Т. Barkay and A. W. Bourquin. 1987. Gene transfer among bacteria in soil and aquatic environments: a review. Can. J. Microbiol., 33, 191-198.
28. Viera J. and J. Messing. 1982. The pUC plasmids, an M13mp7-derived system for insertion mutagenesis and sequencing with synthetic universal primers. Gene, 19,259-268.
29. Wirth, R.,A. Frieseneger and S. F. Fielder. 1989. Transformation of variu-ous species of gram-negative bacteria belonging to II different genera by electroporation. Mol. Gen. Genet., 216, 175-177.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОБАЛАМИНОВ, ПЛАЗМИДА (ВАРИАНТЫ), МИКРООРГАНИЗМ | 1991 |
|
RU2136753C1 |
| Mob'-ПРОИЗВОДНАЯ ПЛАЗМИДА RSF1010, НЕ СОДЕРЖАЩАЯ ГЕНЫ УСТОЙЧИВОСТИ К АНТИБИОТИКАМ, БАКТЕРИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ ПЛАЗМИДУ, И СПОСОБ ПОЛУЧЕНИЯ ПОЛЕЗНЫХ МЕТАБОЛИТОВ | 2004 |
|
RU2306338C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ ТАБАКА, УСТОЙЧИВЫХ К 3,5-ДИГАЛОГЕН-4-ГИДРОКСИБЕНЗОНИТРИЛАМ | 1987 |
|
RU2043417C1 |
| ГЕН GRB 3-3, ЕГО ВАРИАНТЫ И ИХ ПРИМЕНЕНИЕ | 1994 |
|
RU2159815C2 |
| ФРАГМЕНТ ДНК (ВАРИАНТЫ), ВЕКТОР, СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ, СПОСОБ ИНДУЦИРОВАНИЯ ПРОДУКЦИИ ГАММА-ЛИНОЛЕНОВОЙ КИСЛОТЫ (ВАРИАНТЫ), СПОСОБ ИНДУЦИРОВАНИЯ ПРОДУКЦИИ ОКТАДЕКАТЕТРАЕНОВОЙ КИСЛОТЫ И ДЕЛЬТА-6-ДЕСАТУРАЗА ЦИАНОБАКТЕРИЙ | 1992 |
|
RU2152996C2 |
| ДЕФЕКТНЫЙ РЕКОМБИНАНТНЫЙ АДЕНОВИРУСНЫЙ ВЕКТОР (ВАРИАНТЫ) | 1994 |
|
RU2219241C2 |
| ШТАММ Francisella tularensis 15/23-1ΔrecA СО СНИЖЕННОЙ РЕАКТОГЕННОСТЬЮ ДЛЯ СОЗДАНИЯ ЖИВОЙ ТУЛЯРЕМИЙНОЙ ВАКЦИНЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2567810C2 |
| МОЛЕКУЛА ВЫДЕЛЕННОЙ ДВУНИТЕВОЙ ДНК, МОЛЕКУЛА РЕКОМБИНАНТНОЙ ДВУНИТЕВОЙ ДНК И СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ ТРАНСФОРМИРОВАННЫХ РАСТЕНИЙ | 1991 |
|
RU2168544C2 |
| СИНТЕЗ ГАММА-ЛИНОЛЕНОВОЙ КИСЛОТЫ ПОД ДЕЙСТВИЕМ ДЕЛЬТА-6-ДЕСАТУРАЗЫ | 1995 |
|
RU2181772C2 |
| НОВАЯ СИСТЕМА ИЗМЕНЕНИЯ ГЕНОМА ДЛЯ МИКРООРГАНИЗМОВ | 2014 |
|
RU2694316C1 |
Изобретение относится к векторам клонирования и/или экспрессии с широким спектром хозяев среди грамотрицательных бактерий. Плазмида pXL 1635 имеет размер менее 20 т.п.о. Она содержит фрагмент ДНК, несущий область начала репликации oriV плазмиды RК2. Содержит фрагмент ДНК, несущий область par плазмиды RP4. Не содержит локус mob. Содержит сайт множественного клонирования, в котором присутствует рекомбинантная ДНК, включающая один или несколько кодирующих структурных генов для одного или нескольких полипептидов, под контролем последовательностей регуляции генетической экспрессии. Плазмида содержит ген устойчивости к антибиотику. Использование плазмиды позволяет получать рекомбинантные протеины или метаболиты. 1 з.п. ф-лы, 2 табл., 4 ил.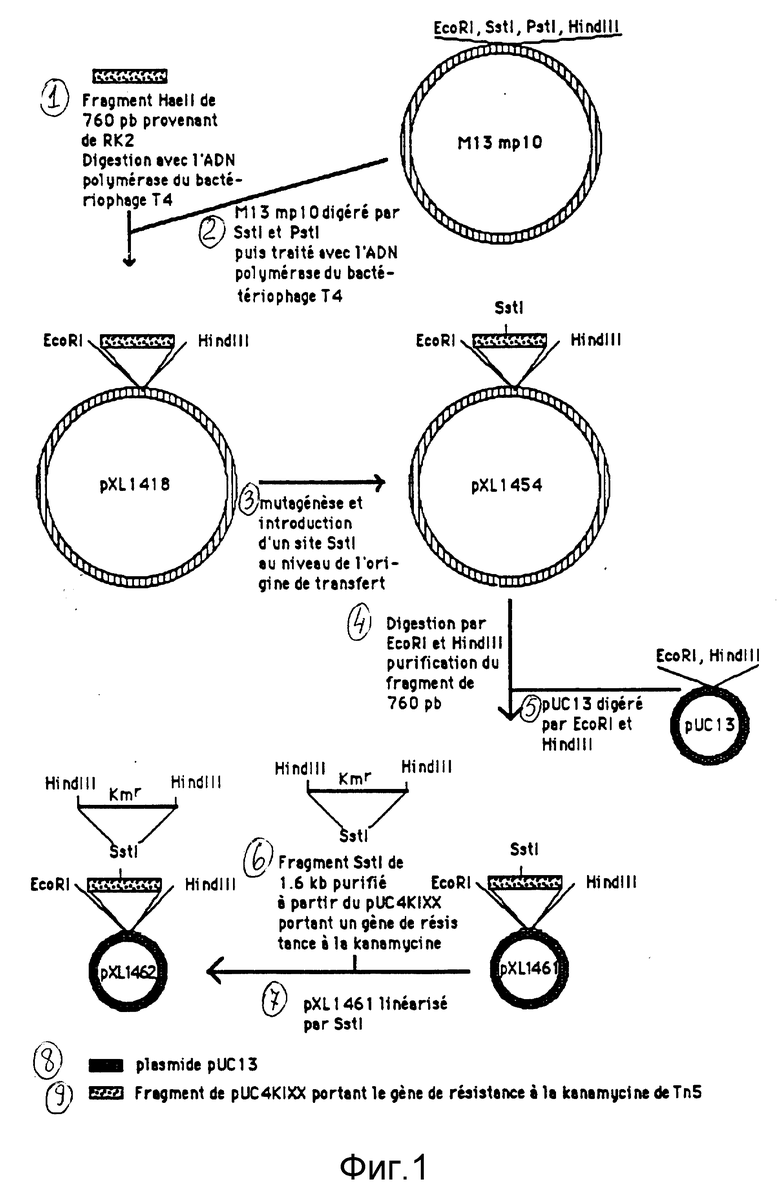
| 4590163 A, 20.05.1986 | |||
| Journal of biotechnology | |||
| Vol | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Elsevier Science Publishers B.V., P | |||
| N | |||
| Saurugger et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Телефонная трансляция с катодными лампами | 1922 |
|
SU333A1 |
Авторы
Даты
1999-03-10—Публикация
1991-04-23—Подача