Изобретение относится к способам получения дельта-пироненов, которые находят применение в синтезе витамина А.
Основными методами получения пироненов являются дегидратация циклогераниола и разложение ониевых солей β-циклогеранида, как описано в патенте США N 4244890 для получения гамма- и дельта-пироненов.
Однако ни один из известных документов не описывает и не указывает на производные гексагидробензотиофена-2,2-диоксида, которые согласно изобретению являются исходными продуктами для синтеза дельта-пироненов, который мог бы быть использован при синтезе витамина А.
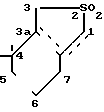
Заявитель предлагает таким образом, новый способ получения дельта-пироненов путем пиролиза в качестве исходного соединения - производных гексагидробензотиофена - 2,2-диоксида формулы I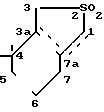 в которой пунктирная линия изображает единственную двойную связь, которая, следовательно, может находиться в положениях 3а-7а, 1-7а, 7а-7.
в которой пунктирная линия изображает единственную двойную связь, которая, следовательно, может находиться в положениях 3а-7а, 1-7а, 7а-7.
Таким образом, возможны три изомера указанной формулы:
4,4-диметил-2,2-диоксо-1,3,4,5,6,7-гек- сагидробензо-/c/-тиофен,
4,4-диметил-2,2-диоксо-3,3а,4,5,6,7-гек- сагидробензо-/c/-тиофен.
4-4-диметил-2,2-диоксо-1,3,3а,4,5,6-гек- сагидробензо-/c/-тиофен.
Среды этих изомеров предпочитают 4,4-диметил-2,2-диоксо-1,3,4,5,6,7-гексаги- дробензо-/c/-тиофен или β-изомер (β-сульфон).
Соединения I легко превращаются в δ -пиронен путем нагревания при высокой температуре, в случае необходимости в присутствии основного катализатора, в соответствии со следующей реакцией исходя из β-сульфона формулы I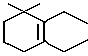 SO2
SO2
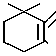 + SO2
+ SO2
Катализатор основного характера выбирается, например, из щелочных гидроксилов (гидроксида калия и гидроксида натрия), карбонатов, оксидов металлов, таких как оксид алюминия, оксид кальция, оксид магния, и алкоголятов щелочных металлов, таких как метилат натрия или деканолят калия. Применяют 10-100 мас.% катализатора по отношению к сульфону формулы I. Когда применяют катализатор на основе оксида щелочного или щелочно-земельного металла, то предпочитают использовать 100% катализатора по отношению к сульфону.
Когда применяют катализатор на основе алкоголята щелочного металла, то предпочитают использовать менее 10 мол.% катализатора по отношению к соединению формулы I.
Температура реакции предпочтительно превышает 150оС и, в частности, включена между 250 и 300оС, когда не применяют катализатор, и между 150 и 250оС, когда применяют катализатор.
Перед реакцией превращения β -сульфона в δ -пиронен, когда исходное вещество содержит α - и γ -сульфоны, легко провести изомеризацию последних соединений в β -сульфон путем нагревания от нескольких минут до нескольких часов при температуре, заключенной между комнатной температурой и 100оС.
Реакция может осуществляться непрерывным или периодическим способом.
δ -Пиронен, полученный после крекинга соединения с формулой I, легко очищается путем дистилляции.
δ -Пиронен применяется при синтезе циклогеранильных промежуточных продуктов, используемых при синтезе витамина А ми картоноидов.
Соединения общей формулы I получают, исходя из сульфонмирцена или 2,5-дигидро-3-/4-метил-3-пентенил/-1,1-диоксида тиофена формулы II
CH3-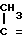 CH - CH2- CH2-
CH - CH2- CH2- 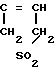 путем циклизации в присутствии сильной кислоты, содержащей менее 5% воды.
путем циклизации в присутствии сильной кислоты, содержащей менее 5% воды.
Сильные кислоты выбираются, в частности, из:
серной кислоты,
алкил-, арил- или галогенсульфоновых кислот общей формулы РО3Н, особенно таких как:
метансульфокислота (Р= СН3-), пара-толуолсульфокислота (Р=CH3-C6H4-), трифторметилсульфоновая кислота (Р=СF3-), фторсульфоновая кислота (Р=F-), хлорсульфоновая кислота (Р=СI-), сульфоновые смолы, такие как амберлит-15, смол Nafions, хлорной кислоты, гетерогенных кислотных катализаторов, таких как: диоксиды кремния, подкисленные обработкой кислотой (НF...), оксиды алюминия, подкисленные обработкой кислотой (НF...), кислотные оксиды переходных металлов, цеолиты, подкисленные глины.
Предпочитают использовать серную кислоту.
Кислота может применяться одна, тогда она является реагентом и растворителем, или в присутствии растворителя, инертного в условиях реакции, смешиваемого с кислотой и с продуктами реакции.
Среди инертных растворителей можно указать: галогенсодержащие растворители, такие как дихлорметан, карбоновые кислоты, такие как уксусная кислота, их сложные эфиры, такие как этилацетат, нитрованные растворители, такие как нитрометан или нитробензол, и сульфоны, такие как сульфолан.
В общем случае, когда применяется растворитель, скорость реакции уменьшается, происходит также появление более значительных количеств α - и γ -изомеров.
Когда реакция осуществляется в серной кислоте, то предпочитают использовать объемное отношение сильной кислоты к сульфону формулы II, меньшее 1, а предпочтительно 0,10-0,50.
Когда применяют сульфоновую кислоту, то предпочитают использовать молярное отношение сульфоновой кислоты к сульфону формулы II 0,1-0,5.
Отношение будет подбираться специалистом в соответствии с: оптимальной скоростью желаемой реакции, природой искомых изомеров, вязкостью реакционной среды.
Оптимальные реакционные условия являются такими, чтобы температура предпочтительно была меньше 0оС, в частности в -10о-0оС. Продолжительность реакции будет подбираться в зависимости от реакционных условий. Осуществление изобретения зависит от того, применяется или нет растворитель.
В случае серной кислоты предпочитают приливать сульфон в кислоту и прекращать реакцию по окончании приливания.
Если применяют в условиях реакции кислоту, разбавленную в инертном растворителе, то контакт сульфона формулы II и сильной кислоты может продолжаться преимущественно и после приливания сильной кислоты в раствор сульфона.
Используемое исходное вещество, которое является сульфонмирценом формулы II, получают при взаимодействии мирцена с диоксидом серы в присутствии ингибитора полимеризации при температуре 60-100оС.
Используемый исходный мирцен может быть чистым продуктом или сырым продуктом, содержащим, например терпеновые полупродукты синтеза, такие как лимонен.
Он также может применяться в качестве промежуточного вещества при синтезе в парфюмерии для получения α -циклогераниола.
Следующие примеры, приведенные не в качестве ограничивающих, позволяют лучше понять изобретение, не ограничивая, однако, его пределы.
П р и м е р 1. В колбе объемом 100 мл охлаждают до -10оС при сильном перемешивании 25 мл 98% Н2SO4. Затем примерно за 10 мин приливают 6,0 г 95% сульфоленмирцена (28,5 ммоль), поддерживая температуру ниже 0оС.
Вязкий раствор коричневого цвета перемешивают в течение 10 мин при 0оС, затем медленно приливают к 100 г водно-ледяной смеси при сильном перемешивании.
Твердое вещество белого цвета, которое выпадает в осадок, фильтруют, промывают водой до нейтральной реакции, затем сушат при температуре 20оС и давлении 1 мм Нg, в результате чего получают 5,9 г сырого продукта.
После перекристаллизации в 20 мл изопропилового эфира получают 5,10 г (25,5 ммоль, выход 90%) сульфолена δ -пиронена (Iа) в виде блесток белого цвета с температурой плавления Т.пл. = 90оС.
Анализ методом ЯМР-спектрометрии дает следующую картину:
Су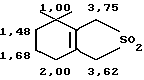
П р и м е р 2. В колбе объемом 2 л, снабженной мощной механической мешалкой, капельной воронкой и термометром, растворяют 500 г 95%-ного сульфоленмирцена (2,375 моль) в 100 мл метиленхлорида. Поддерживая температуру при 0оС, приливают за 2 ч раствор, содержащий 121 г 98% метансульфокислоты в 100 мл метиленхлорида.
Спустя м15 мин, приливают к смеси 500 мл воды и 100 г льда, затем экстрагируют посредством 500 мл метиленхлорида и 300 мл этилацетата.
После выпаривания растворителей получают 450 г очень густой маслянистой жидкости коричневого цвета.
В результате кристаллизации в 2 л изопропилового эфира получают 300 г твердого вещества белого цвета, из которого методом хроматографии на диоксиде кремния получают:
240 г сульфолена Iа с т.пл. = 90оС,
20 г сульфона Iв с т.пл. = 87оС,
20 г смеси сульфонов Iв и 1с.
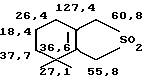
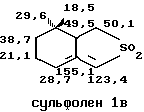
Структура сульфонов Iа и Iс была определена методом ЯМР в СНCI3 со стандартом ГМДС.
IН ЯМР 360 МГц: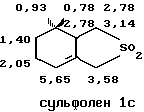
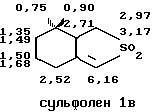
13С ЯМР 90 МГц: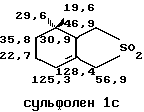
Последующий анализ сырой смеси позволил определить массовый состав: 2,5% углеводородов, 12,6% сульфоленмирцена, 84% циклических сульфонов:
Ia - 85%
Iв - 10%
Ic - 5% т.к. степень превращения равняется: 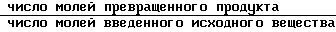 = 85%
= 85%
Выход по сульфону Iа равен примерно 72%, но Iв примерно 8,5%, по Iс примерно 4,3%.
П р и м е р 3. Пиролиз соединения Iа.
В колбу объемом 500 мл, смонтированную на ротационном испарителе, загружают:
40 г циклического сульфолена 1а (0,2 моль),
6 г нейтрального оксида алюминия с активностью 1.
Под вакуумом 150 мм Нg приводят колбу во вращение прим 200-250оС. Дистиллат конденсируют при 20оС и собирают в колбу при 0оС.
Получают 19,5 г бесцветной подвижной жидкости, образованной из: 17 г δ -пиронена, 2,5 г сульфолена Iа (по данным анализа методом IН ЯМР).
Флэш-дистилляция при температуре кипения 102оС/150 мм Нg сырого продукта позволяет получить 15 г чистого δ -пиронена, проанализированного методом хроматографии в паровой фазе, выход: 55%.
П р и м е р 4. Пиролиз соединения Iа.
В колбу объемом 100 мл, смонтированную на ротационном испарителе, загружают: 10 г циклического сульфолена 1а (0,05 моль), 10 г оксида кальция в виде порошка.
Под вакуумом 40-50 мм Нg приводят колбу во вращение при температуре 200-220оС, в ловушке при температуре -80оС собирают 4,2 г чистого δ -пиронена, проанализированного методами газофазной хроматографии и ЯМР (выход= 62%).
П р и м е р 5. В колбу объемом 50 мл, снабженную сверху вертикальным холодильником (с циркуляцией охлаждающей смеси, поддерживаемой при температуре 0оС), загружают:
5 г 80% сульфолена, содержащего 15 ммоль формы Iа и 5 ммоль формы Iс,
48 мг ионола,
104 мг метилата натрия,
12 мл gilothermR (соединение, состоящее из 75% дифенилового эфира и 25% дифенила).
Нагревают в течение 2 ч при 60оС под атмосферным давлением, устанавливают исчезновение изомера Iс.
Затем при использовании двух охлажденных (сухой лед + ацетон) ловушек помещают под вакуум с давлением 200 мм Hg. Постепенно нагревают и поддерживают температуру 160-186оС, постоянно перегоняя образуемый δ -пиронен.
Выход δ -пиронена по отношению ко всему сульфолену составляет 76,5%.
П р и м е р 6. В ту же самую установку, что и в предыдущем примере, загружали 10 г сульфолена (35 ммоль формы Iа и 10 ммоль формы Iс и 5 ммоль формы Iв), 112 мг ионола (0,5 ммоль), 19,8 г (25 мл) деканола, 0,3 г 85% гидроксида калия (5 ммоль).
Нагревают до 87оС в течение 30 мин под атмосферным давлением. Изомеры Iс и Iв полностью исчезают.
Затем поступают, как в примере 5.
После 1 ч дистилляции полученный пиронен ректифицируется в присутствии бикарбоната натрия.
Конечный выход δ -пиронена по отношению ко всему сульфолену равен 81%.
Использование: в производстве витаминов, в частности в способе получения витамина А. Сущность изобретения: дельта-пиронен получают пиролизом производных гексагидробензотиофена - 2,2 - диоксида при температуре, превышающей 150°С, в присутствии катализатора основного характера.
нагревают при температуре более 150oС.
| Патент США N 4244890, кл | |||
| Прибор для механического вычерчивания аксонометрических проекции, симметрических фигур, обращенных изображений и для копирования чертежей | 1923 |
|
SU564A1 |
Авторы
Даты
1994-08-15—Публикация
1991-12-06—Подача