Изобретение относится к способу получения новых имидазопиридинов, обладающих цитотоксической активностью, имеющих формулы:
R Y
Y X
X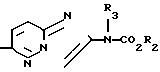 где R1 - карбоциклическая арильная группа, возможно замещенная С1-4алкоксигруппами;
где R1 - карбоциклическая арильная группа, возможно замещенная С1-4алкоксигруппами;
R2 - С1-4 - алкильная группа;
R3 - водород или С1-4-алкил;
Х - кислород;
У - СН2
Известно взаимодействие аминов с карбонильными соединениями.
Применение известного способа позволило получить новые соединения, обладающие ценными свойствами и по активности преобладающие известные препараты, применяемые для тех же целей.
Цель изобретения - получение новых гетероциклических соединений, обладающих ценными фармакологическими свойствами.
Цель достигается взаимодействием соединения формулы: NH2 где R1, У, Х имеют вышеуказанные значения с С1-4 алкилгалоформиатом, с последующим при необходимости алкилированием соединения формулы 1, где R3 - водород.
NH2 где R1, У, Х имеют вышеуказанные значения с С1-4 алкилгалоформиатом, с последующим при необходимости алкилированием соединения формулы 1, где R3 - водород.
П р и м е р 1. Метил-N-(N-метил-6-)-3,4,5-триметоксибензилокси(имидазо)1,2 - в (пиридазин-2-ил)карбамат.
Гидрид натрия (1,26 г, 60% 31,5 ммоля) добавляют порциями к перемешиваемой суспензии метил-N-(6-3,4,5-триметокси-бензилокси(имидазо)1,2 - в (пиридазин -2-ил)карбамат (9,51 г, 24,5 ммоля) в ДМЕИ (100 мл) в атмосфере азота при окружающей температуре. Полученную смесь обрабатывают иодометаном (4,9 г, 2,15 мл, 35 ммолей) и через 1 час полученную смесь обрабатывают молярным эквивалентом гидрида натрия и иодометана. Спустя 2 ч смесь выливают в воду (100 мл) и фильтруют до получения белого твердого продукта, который обрабатывают хроматографически на SiO2, элюируя смесью 2% метанола - хлороформ. Продукт перекристаллизовывают из ДМФ и воды до получения указанного в заглавии соединения в виде белого порошка (8,29 г).
Т.плавления 177-178оС.
ЯМР δН(d6-ДМСО) 8,04 (1Н, с, 3Н), 7,96 (1Н, JАВ 8,8 Гц, 8Н), 6,92 (1Н, JАВ 8,8 Гц, 7Н), 6,86 (2Н, с, АрН), 5,25 (2Н, с, СН2), 3,79 (9Н, с, ОСН3), 3,68 (3Н, с, СО, ОСН3) и 3,42 (3Н, с, NCH3).
П р и м е р 2. Метил-N-N-этил-6-(3,4,5-триметоксибензилокси) имидазо(1,2-b)пиридазин-2-ил(карбамат)
По способу, описанному в примере 1 получают указанное в заглавии соединение в виде белого твердого продукта.
Т.плавления 153-155оС.
ЯМР δН(d6-ДМСО) 8,04 (1Н, с, 3Н), 7,96 (1Н, JАВ 8,8 Гц, 8Н), 6,92 (1Н, JAВ 8,8 Гц, 7Н), 6,86 (2Н, с, АрН), 5,25 (2Н, с, АрСН2), 3,90 (2Н, кв, СН2СН3), 3,78 (9Н, с, АрОСН3), 3,66 (3H, c, NСН3) и 1,19 (3Н, т СН2СН3).
П р и м е р 3. Метил-N-(6-(3,4,5-триметоксибензилокси)имидазо(1,2-b)пиридазин-2-ил)]карбама т
2) 2-амино-6-(3,4,5-триметоксибензилокси)имидазо(1,2-b)пиридазинтрифтора-цетат Трет-бутил-N-6-(3,4,5-триметоксибензилокси)имидазо(1,2-b)пиридазин-2-илкарба - мат (0,43 г, 1 ммоля) растворяют в дихлорметане (2 мл) и обрабатывают трифторуксусной кислотой (1 мл). Через 2 ч при окружающей температуре полученную смесь выпаривают в вакууме до получения коричневого масла, которое тщательно растирают с диэтиловым эфиром до получения указанного в заглавии соединения (0,25 г) в виде твердого продукта кремового цвета.
Т.плавления 150-157оС
ЯМР δН(ДМСО) 8,0 (1Н, JАВ 8,8 Гц, 8Н), 7,48 (1Н, с, 3Н), 7,16 (1Н, JАВ 8,8 Гц, 7Н), 6,44 (2Н, с, СН2), 4,5 (шир,с, NН3), 3,89 (6Н, с, ОМе) и 3,75 (3Н, с, ОМе).
в) 2-амина-6-(3,4,5-триметоксибензилокси)имидазо[1,2-b]пиридазин
Продукт со стадии (а) (1,0 г 3,03 ммоля) суспендируют в дихлорметане и встряхивают с разбавленным раствором гидроксида натрия. Органическую фазу сушат (Na2SO4) и выпаривают до получения указанного продукта в виде коричневого масла.
с) Метил-N-6-(3,4,5-триметоксибензилокси)имидазо[1,2-b)пиридазин-2-ил-карба- мат
Коричневое масло (продукт стадии в) растворяют в дихлорметане и обрабатывают при перемешивании триэтиламином (0,42 мл, 3,03 ммоля) метилхлорформатом (0,23 мл, 3,03 ммоля), и 4-диметиламинопиридином (18 мг, 0,3 ммоля). Полученную смесь перемешивают при комнатной температуре в течение 17 ч, затем нагревают при кипячении с обратным холодильником в течение 2 ч и выпаривают в вакууме. Полученный твердый продукт разделяется между хлороформом и водой, органическую фазу выделяют, сушат (Na2SO4) и выпаривают до получения твердого продукта, который обрабатывают хроматографически на SiO2, элютруют смесью 2% метанола/хлороформ. Продукт перекристаллизовывают из ДМФ - Н2О до получения указанного в заглавии соединения (0,27 г).
Т.плавления 210-212оС.
ЯМР δН (d6 - ДМСО) 10,36 (1Н, ш., с, NH), 7,87 (1Н, JАВ 8,8 Гц, 8Н), 7,85 (1Н, с, 3-Н), (1Н, JАВ 8,8 Гц, 7-Н), 6,85 (2Н, с, Р Н), 5,25 (2Н, С, СН2), 3,79, 3,70 и 3,56 (2Н, с, ОМе).
П р и м е р ы 4-46.
Общим способом, описанным в примерах 1-3, получены следующие соединения:
(4)н-пропил-N-(6-)3,4,5-триметоксибензилокси(имидазо) [1,2-b)пиридазин-2-ил)карбамат
Т.плавления 174-175оС
ЯМР δН(d6 - ДМСО) 10,25 (1Н, шир, С, NH), 7,87 (1Н, JАВ 8,8 Гц, 8-Н), 7,85 (1Н, с, 3-Н), 6,87 (1Н, JАВ 8,8 Гц, 7-Н), 6,85 (2Н, с, ФН), 5,26 (2Н, с, СН2 АВ), 4,07 (2Н, т, J 6 Гц, СН2СН2СН3), 3,80 (6Н, с, ОМе), 3,68 (3Н, с, ОМе), 1,55 (2Н, дт, 6 Гц, СН2СН2СН3) и 0,94 (3Н, т, J 6 Гц, СН2СН2СН3)
(5) н-бутил-N-(6-)3,4,5,-триметоксибензилокси(имидизо) [1,2-b]-пиридазин-2-ил)карбамат
Т.плавления 185-187оС
ЯМР δН(d6 - ДМСО) 1023 (1Н, шир., с. NН), 7,85 (1Н, JАВ 8,8 Гц, 8-Н), 7,8 (1Н, с, 3-Н), 6,86 (1Н, JАВ 8,8 Гц, 7-Н), 6,65 (2Н, с. ФН), 5,27 (2Н, с, СН2Ар), 4,12 (2Н, т, J 6Гц, СН2СН2СН2СН3), 3,80 (6Н, с, ОМе), 3,67 (3Н, с. ОМе), 1,61 (2Н, с, СН2СН2СН2СН2), 1,38 (2Н, м, СН2СН2СН2СН3) и 0,92 (3Н, т., J 6 Гц, СН2СН2СН2СН3)
(6) н-пропил-N-(6-)(2,5-диметоксибензилокси)имидазо[1,2-b] -пиридазин-2-ил)карбам ат
Т.плавления 199-200оС
ЯМР δН(d6 - ДМСО) 9,93 (1Н, шир., с, NН), 7,87 (2Н, м, 3-Н и 8-Н), 7,17 6,89 (4Н, м, 7-Н и ФН), 5,42 (2Н, с, СН2 Ар), 4,17 (2Н, т, J 6 Гц, СН2СН2СН3), 3,85 и 3,80 (6Н, с, ОМе), 1,73 (2Н, дт, J 6 Гц) СН2СН2СН3 и 1,04 (3Н, J 6 Гц, СН2СН2СН3).
(7) Этил-N-(6-)3,4,5-триметоксибензилокси)имидазо[1,2-b]пиридазин-2-ил-карбамат
Т.плавления 204-206оС
ЯМР δН(d6 - ДМСО) 10,25 (1Н, шир.с, N Н), 7,85 (1Н, JАВ 8,8 Гц, 8-Н), 7,83 (1Н, с, 3-Н), 6,85 (1Н, JАВ 8,8 Гц, 7-Н), 6,64 (2Н, с, ФН), 5,27 (2Н, с, СН2 АФ) 4,15 (2Н, 6Н, СН2СН3), 3,28 (6Н, с, ОМе), 3,16 (3Н, с, ОМе) и 1,25 (3Н, J 6 Гц, СН2СН3).
(8) 2-метоксиэтил-N-(6-)3,4,5-триметоксибензилокси(имидазо[1,2-b]пиридазин-2-ил) карбамат
Т.плавления 183-185оС
ЯМР δН(d6 - ДМСО) 10,36 (1Н, шир., с, N Н), 7,85 (1Н, J АВ 8,8 Гц, 8-Н), 7,83 (1Н, с, 3-Н), 6,85 (1Н, J АВ 8,8 Гц, 7-Н), 6,84 (2Н, с, ФН), 5,26 (2Н, с, СН2 ФН), 4,25 (2Н, м, СОСH2), 3,79 (6Н, с, ОМе), 3,18 (3Н, с, ОМе), 3,08 (2Н, с, СН2ОМе), и 3,32 (3Н, с, СН2ОМе).
(9) Метил-N-6-(1-нафтилметилокси)имидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 243-246оС
δН(d6 - ДМСО) 10,05 (1Н, шир.с, N Н), 8,25-7,55 (9Н, м, нафт Н и 3-Н и 8-Н), 6,92 (1Н, J АВ 8,8 Гц, 7-Н), 5,92 (2Н, с, СН2 и 3,80 (3Н, с, ОМе).
(10) Метил-N-6-(2-метоксибензилокси)имидазо[1,2-b] пиридазин-2-ил)карбамат
Т.плавления 241-243оС
δН(d6 - ДМСО) 10,1 (1Н, шир., с, N Н), 7,92 (1Н, с, 3-Н), 7,65 (1Н, J АВ 8,8 Гц, 8-Н), 7,45 (1Н, д, J 7 Гц, ФН), 7,35 (1Н, дд, 7 Гц, ФН), 6,95 (2Н, м, ФН), 6,72 (1Н, J АВ, 8,8 Гц, 7-Н), 5,36 (2Н, с, СН2), 3,89 (3Н, с, ОМе) и 3,77 (3Н, с, ОМе).
(11) Метил-N-6-(3,5-диметоксибензилокси)имидазо[1,2-b] пиридазин-2-ил)карбамат
Т.плавления 236-238оС
δН(d6 - ДМСО) 10,30 (1Н, шир., с, N Н), 7,88 (1Н, J АВ 8,8 Гц, 8-Н), 7,82 (1Н, с, 3-Н), 6,90 (1Н, J АВ, 8,8 Гц, 7-Н), 6,66 (2Н, д, 9 Гц, 2' -Н и 6' -Н), 6,46 (1Н, т., J 9 Гц, 4 -Н), 5,36 (2Н, с, СН2), 3,78 (6Н, с, ОМе) и 3,70 (3Н, с, ОМе).
(12) Метил-N-6-(метилбензилокси)имидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 205-208оС
ЯМР δН(d6 - ДМСО) 9,95 (1Н, шир., с, N Н), 7,85 (1Н, с, 3-Н), 7, 80 (1Н, J АВ 8,8 Гц, 8-Н), 7,30 (3Н, м, 2' Н, 4' -Н и 6' -Н), 7,15 (1Н, м, 5' -Н), 6,82 (1Н, J АВ, 8,8 Гц, 7-Н), 5,80 (2Н, с, СН2), 3,72 (3Н, с, ОМе), и 2,34 (3Н, с, Ме).
(13) Трет-бутил-N-6-(3,4,5-триметоксибензилокси)имидазо[1,2-b]пиридазин-2-ил) карбамат
Т.плавления 191,5-192,5оС
ЯМР δН(d6 - ДМСО) 9,95 (1Н, шир., с, N Н), 7,85 (1Н, J АВ, 8,8 Гц, 8-Н), 7,79 (1Н, шир. , с, 3-Н), 6,87 (1Н, J АВ, 8,8 Гц, 7-Н), 6,86 (2H, C, ФН), 5,25 (2Н, с, СН2), 3,79 (6Н, с, ОМе), 3,68 (3Н, с, ОМе), и 1,50 (9Н, с, трет-бутил).
(14) Метил-N-(6-)3,4,5-триметоксибензилокси(имидазо[1,2-b]пиридазин-2-ил-карбамат
Т.плавления 221-223оС
ЯМР δН(d6 - ДМСО) 10,51 (1Н, шир., с, N Н), 8,11 (1Н, с, 3-Н), 7,87 (1Н, J АВ 8,8 Гц, 8-Н), 7,17 (1Н, J АВ 8,8 Гц, 7-Н), 6,88 (2Н, с, ФH), 4,49 (2Н, с, СН2), 3,83 (6Н, с, ОМе) и 3,70 (3Н, с, ОМе).
(15) Метил-N-(6)-(диметиламинобензилокси)имидазо[1,2-b] пиридазин-2-ил)карба- мат
Т.плавления 200-203оС
ЯМР δН(d6 - ДМСО) 10,05 (1Н, шир., с, N Н), 7,93 (1Н, с, 3-Н), 7,90 (1Н, J АВ 8,8 Гц, 8-Н), 7,30 (1Н, с, 5 -Н), 6,95-6,80 (4Н, м, 2' -Н, 4' -Н, 6' -Н и 7-Н), 5,40 (2Н, с, СН) 3,78 (3Н, с, МеО) и 2,98 (6Н, с, N Ме2)
(16) Метил-N-(6-)6-3-метоксибензилокси)имидазо[1,2-b] пиридазин-2-ил)карбамат
Т.плавления 184-189,5оС
ЯМР δН(СDCl3) 10,55 (1Н, шир., c, N Н ), 8,02 (1Н, шир., с, 3-Н), 7,75 (1Н, J АВ 8,8 Гц, 8-Н), 7,32 (1Н, дд, J 7 Гц, 5' -Н), 7-07 (2Н, м, АрН), 6,88 (1Н, дд, J 7,5 и 2 Гц, Ar Н), 6,70 (1Н, J АВ 8 Гц, 7-Н), 5,34 (2Н, с, СН2), 3,88 и 3,83 (6Н, ОМе).
(17) Этил-N-(6-бензилоксиимидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 211о C с разл.
ЯМР δН(d6 - ДМСО) 10,25 (1Н, шир., с, N Н) 7,87 (1Н, J АВ 8,8 Гц, 8-Н), 7,72 (1Н, с, 3-Н), 7,57-7,37 (5Н, м, Ф), 5,35 (2Н, СН2 Ар), 4,15 (2Н, кв, J 6 Гц, СН2СН3) и 1,27 (3Н, т, J 6 Гц, СН2СН3)
(18) Метил-N-(6-н-бутилтиоимидазо[1,2-b]пиридазин-2-ил-карбамат
Т.плавления 170-171оС
ЯМР δН(d6 - ДМСО) 10,40 (1Н, шир., с, N Н), 7,94 (1Н, с, 3Н), 7,76 (1Н, J АВ 8,8 Гц, 8-Н), 7,06 (1Н, J АВ 8,8 Гц, 7-Н), 3,72 (3Н, с, ОМе), 3,18 (2Н, т, J 6 Гц, СН2 S), 1,68 (2Н, м, СН2СН2 S), 1,44 (2Н, м, СН2СН2СН2 S) и 0,93 (3Н, т, J 6 Гц, СН СН2СН2 S)
(19) Мeтил-N-6-бензилтиомидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 223-225оС (с разл.)
ЯМР δН(d6 - ДМСО) 10,42 (1Н, шир., с, N Н), 7,99 (1Н, с, 3-Н), 7,77 (1Н, J АВ, 8,8 Гц, 8-Н), 7,52-7,20 (5Н, м, Ф), 7,07 (1Н, J АВ 8,8 Гц, 7-Н), 4,45 (2Н, с, СН2) и 3,68 (3Н, с, ОМе).
(20) Метил-N-(6-3,5-диметокси-4-(метоксиэтоксиметокси)имидазо[1,2-b]пиридазин-2-и л-ка
Т.плавления 149-150оС
ЯМР δН(CDCl3) 9,58 (1Н, шир., с, N Н), 8,02 (1Н, шир., с, 3-Н), 7,75 (1Н, J АВ 8,8 Гц, 8-Н), 6,75 (1Н, J АВ 8,8 Гц, 7-Н), 6,70 (2Н, 2' -Н и 6 -Н), 5,29 (2Н, с, СH2), 5,18 (2Н, с, СН2), 4,08-3,91 (2Н, м, СН2), 3,85 (9Н, с, ОМе), 3,6-3,45 (2Н, м, СН2) и 3,35 (3Н, с, ОМе).
(21) Метил-N-(6-)3-хлорбензилокси(имидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 268-270оС
ЯМР δН(d6 - ДМСО) 10,32 (1Н, шир., с, N Н), 7,87 (1Н, J АВ 8,8 Гц, 8-Н), 7,83 (1Н, с, 3-Н), 7,61 (1Н, 2' -Н, 7,53-7,41 (3Н, м, ФН), 6,91 (1Н, J АВ 8,8 Гц, 7-Н), 5,38 (2Н, с, СН2) и 3,68 (3Н, с, ОМе).
(22) Метил-N-(6)2-тиенилметилимидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 207-209оС
ЯМР δН(d6 - ДМСО) 10,38 (1Н, шир., с, N Н), 7,85 (1Н, с, 3-Н), 7,82 (1Н, J АВ 8,8 Гц, 8-Н), 7,58 (1Н, д, 5' -Н), 7,30 (1Н, д, 3' -Н), 7,05 (1Н, т, 4' -Н), 6,82 (1Н, J АВ 8,8 Гц, 7-Н), 5,56 (2Н, с, СН2) и 3,66 (3Н, с, ОМе).
П р и м е р 23. 2,2,2-трифторэтил-N-(6-)3-4-5-триметоксибензилокси(имидазо[1,2-b]пиридазин-2 -ил)
Т.плавления 205-210оС (с разложением)
ЯМР δН(d6 - ДМСО) 10,81 (1Н, шир, с, Н), 7,88 (1Н, АВ, 8,8 Гц, 8Н), 7,85 (1Н, с, 3Н), 6,90 (1Н, АВ 8 Гц, 7Н), 6,85 (2Н, с, АрН), 5,52 (2Н, с, СН2Ар), 4,83 (1Н, кв. 9 Гц, СН2С3), 3,76 (6Н, с, ОСН3) и 3,65 (3Н, с, ОСН3).
П р и м е р 24. 2-гидроксиэтил-N-(6,3,4,5-триметоксибензилокси(имидазо[1,2-b]пири- дазин-2ил)карбамат
Т.плавления 193-195оС
ЯМР δН(d6 - ДМСО) 10,35 (1Н, шир., с, Н), 7,85 (1Н, АВ, 8,8 Гц, 8Н), 7,83 (1Н, с, 3Н), 6,86 (1Н, АВ 8,8 Гц, 3Н), 6,84 (2Н, с, АрН), 5,25 (2Н, с, СН2Ар), 4,82 (1Н, т, 4 Гц, ОН).
4,15 (2Н, м), 3,80 (6Н, с, ОСН3) и 3,66 (5Н, м, ОСН2 и ОСН3)
П р и м е р 25. 2-(1-морфолино)этил-N-(6)3,4,5-триметоксибензилокси(имидазо-[1,2-b]пиридазин -2-и
Т.плавления 161-162оС
ЯМР δН(d6 - ДМСО) 10,30 (1Н, шир., с, N Н), 7,88 (1Н, с, 3Н), 7,85 (1Н, J АВ 8,8 Гц, 8Н), 6,87 (1Н, J АВ 8,8 Гц, 7Н), 6,85 (2Н, с, АрН), 5,26 (2H, c, CH2Ap), 4,22 (2H, ( 2Н, т, J 5 Гц, СО, ОСН2), 3,80 (6Н, с, ОСН3), 3,68 (3Н, с, ОСН3), 3,58 (4Н, м, СН2 ОСН2), 2,59 (2Н, т, J 5 Гц, СО. ОСН2СН2 N) и 2,45 (м, СН2 N СН2)
П р и м е р 26. 2,3-дигидроксипропил-N-(6-)3,4,5-триметоксибензилокси(имидазо-[1,2-b]пиридин -2-и
Т.плавления 175-176оС.
ЯМР δН(d6 -ДМСО) 10,28 (1Н, шир., с, N Н), 7,88 (1Н, J АВ 8,8 Гц, 8Н), 7,86 (1Н, с, 3Н), 6,87 (1Н, J АВ (8,8 Гц, 7Н), 6,85 (2Н, с, АрН), 5,28 (2Н, с, АрСН2), 4,90 (1Н, д, J 4Н, 2 -ОН), 4,65 (1Н, т, J 4 Гц, 1' -ОН), 4,20-4,0 (2Н, м, СО. ОСН2), 3,80 (6Н, с, ОСН3), 3,80-3,70 (1Н, м, НО-СН), 3,69 (3Н, с, ОСН3) и 3,40 (2Н, т. J 4 Гц, НОСН2).
П р и м е р 27. 2-диметиламиноэтил-N-(6-)3,4,5-триметоксибензилокси)имидазо-[1, 2-b]пиридазин-2-ил)карбамат
Т.плавления 185-186оС.
ЯМР δН(d6 - ДМСО) 10,32 (1Н, шир., с, N Н), 7,88 (1Н, J АВ 8,8 Гц, 8Н), 7,85 (1Н, с, 3Н), 6,89 (1Н, J АВ 8,8 Гц, 7Н), 6,85 (2Н, с, АрН), 5,77 (2Н, с, АрСН2), 4,60 (2Н, т, J 4 Гц, СО.ОСН2), 3,80 (6Н, с, ОСН3), 3,69 (3Н, с, ОСН3), 2,50 (2Н, т, СН2 N) и 2,21 (6Н, с, N Ме2).
П р и м е р 28. Фенил-N-(6-)3,4,5-триметоксибензилокси(имидазо[1,2-b] пиридазин-2-ил)карбамат
Т.плавления 210-213оС
ЯМР δН(CDCl3) 10,12 (1Н, шир., с, N Н), 8,05 (1Н, с, 3Н), 7,80 (1Н, J АВ 8,8 Гц, 8Н), 7,55-7,15 (5Н, м, ф), 6,69 (2Н, с., АрН), 6,67 (1Н, J АВ 8,8 Гц, 7Н), 5,28 (2Н, с, АрСН2) и 3,90 (9Н, с, ОСН3).
П р и м е р 29. Метил-N-(6-)2,3-диметоксибензилокси(имидазо[1,2-b]пиридазин-2-ил-карбамат
Т.плавления 210-211оС
ЯМР δН(d6 - ДМСО) 10,35 (1Н, шир., с., N Н), 7,86 (1Н, J АВ 8,8 Гц, 8Н), 7,84 (1Н, с, 3Н), 7,10 (3Н, с, ФН), 6,88 (1Н, J АВ 8,8 Гц, 7Н), 5,35 (2Н, с, СН2), и 3,86, 3,80 и 3,72 (9Н, с, ОСН3).
П р и м е р 30. Метил-N-(6-)3,5-диметокси-4-этоксибензилокси)имидазо[1,2-b]пири- дазин-2-ил)карбамат
Т.плавления 190-193оС
ЯМР δН(d6 - ДМСО) 10,33 (1Н, шир., с, N Н), 7,88 (1Н, J АВ 8,8 Гц, 8 Н), 7,85 (1Н, с, 3Н), 6,88 (1Н, J АВ 8,8 Нц, 7Н), 6,85 (2Н, с, ArН), 5,77 (2Н, с, ArСН2), 3,90 (2Н, кв, J 7 Нц, СН2СН3), 3,80 (6Н, с, АрОСН3), 3,69 (3Н, с, СО.ОСН) и 1,24 (3Н, т, J 7 Гц, СН2СН3).
П р и м е р 31. Метил-N-6-(2-трет.-бутилбензилокси(имидазо[1,2-b]пиридазин-2-ил) карбамат
Т.плавления 220-223оС
δН(ДМСО) 9,95 (1Н, шир., c, NН), 7,85 (1Н, с, 3Н), 7,8 (1Н, J АВ 8 Гц, 8Н), 7,5 (2Н, м, АрН), 7,28 (2Н, м, АрН), 6,8 (1Н, J АВ 8 Гц, 7Н), 5,5 (2Н, с, СН2), 3,7 (3Н, с, ОМе), 1,4 (9Н, с, Ме3).
П р и м е р 32. Метил-N-(6-2-этилбензилокси)имидазо[1,2-b]пиридазин-2-ил)карба- мат
Т.плавления 190-191оС
δН(ДМСО) 9,95 (1Н, шир., с, N Н), 7,85 (1Н, с, 3Н), 7,8 (1Н, J АВ Гц, 8Н), 7,45 (1Н, д, АрН), 7,3 (3Н, м, АрН), 6,8 (1Н, J АВ 8 Гц, 7Н), 5,4 (2Н, с, О-СН2), 3,7 (3Н, с, ОМе), 2,7 (2Н, квадр.СН2), 1,2 (3Н, т, Ме).
П р и м е р 33. н-Пропил-N-(6-)2,5-диметилбензилокси(имидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 196-197оС
δН(ДМСО) 9,85 (1Н, шир., с, N Н), 7,85 (1Н, с, 3Н), 7,80 (1Н, J АВ 8 Гц, 8Н), 7,25 (1Н, с, 6' Н), 7,1 (2Н, 2d 3' Н и 4' Н), 6,8 (1Н, J АВ 8 Гц, 7Н), 5,35 (2Н, с, ОСН2), 4,1 (2Н, т, ОСН2), 2,3 (6Н, 2с, Арме), 1,7 (2Н, квадр. СН2), 0,95 (3Н, с, Ме).
П р и м е р 34. Метил-N-(6-)3,4,5-триметилбензилокси(имидазо[1,2-b]пирадазин-2- ил)карбамат
Т.плавления 227-229оС
δН(ДМСО) 9,90 (1Н, шир., с, NН), 7,85 (1Н, с, 3Н), 7,75 (1Н, J АВ 8 Гц, 8Н), 7,15 (2Н, с, АрН), 6,80 (1Н, J АВ 8 Гц, 7Н), 5,25 (2Н, с, ОСН2), 3,7 (3Н, с, ОМе), 2,28 (6Н, с, 2 х Арме), 2,15 (3Н, с, АрМе).
П р и м е р 35. Метил-N-(6-)2-фенилбензилокси(имидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 203-204оС
δН(ДМСО) 9,92 (1Н, шир., с, N Н), 7,75 (1Н, J АВ 8 Гц, 8Н), 7,70 (1Н, с, 3Н), 7,4 (9Н, м, 9 АрН), 6,75 (1Н, J АВ, 8 Гц, 7Н), 5,3 (2Н, с, ОСН2), 3,7 (3Н, с, ОСН3).
П р и м е р 36. Метил-N-(6-)3-диэтиламинобензилокси(имидазо[1,2-b]пиридазин-2-ил)карбамата гидрохлорид
Т.плавления 220-225оС
δН(ДМСО) 10,35 (1Н, шир., с, N Н), 7,9 (1Н, J АВ 8 Гц, 8Н), 7,8 (1Н, с, 3Н), 7,6 (4Н, м 4 х АрН), 6,9 (1Н, J АВ 8 Гц, 7Н), 5,4 (2Н, с, СН2О), 3,7 (3Н, с, ОМе), 3,5 (4Н, шир. с, 2 х СН2 N), 1,05 (6Н, т, 2 х Ме).
П р и м е р 37. Метил-N-(6-)3-метиламинобензилокси(имидазо[1,2-b]пиридазин-2-ил)карбамата гидрохлорид
Т.плавления 213-215оС (с разл.)
δН(ДМСО) 10,4 (1Н, шир., с, N Н), 7,9 (1Н, J АВ 8 Гц, 8Н), 7,85 (1Н, с, 3Н), 7,3 (4Н, м, 4 АрН), 6,9 (1Н, J АВ 8 Гц, 7Н), 5,4 (2Н, с, СН2О), 3,7 (3Н, с, ОМе), 2,85 (3Н, с, МеN).
П р и м е р 38. Этил-N-(6-)3-диметиламинобензилокси(имидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 204-8оС
δН(ДМСО) 9,95 (1Н, шир., с, NН), 7,85 (1Н, с, 3Н), 7,80 (1Н, J АВ 8 Гц, 8Н), 7,2 (1Н, т, 5 Н, 6,85 (1Н, J АВ 8 Гц, 7Н), 6,75 (3Н, м, 3 АрН), 5,3 (2Н, с, СН2О), 4,2 (2Н, квадр. ОСН2), 2,9 (6Н, с, Ме2 N), 1,25 (3Н, т, Ме).
П р и м е р 39. Этил-N-(6-)1-нафтилметокси(имидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 240-245оС
δН(ДМСО) 10,0 (1Н, шир., с, N Н), 8,2 (1Н, м, АрН), 8,05 (2Н, м, 2 АрН), 7,95 (1Н, с, 3Н), 7,90 (1Н, J АВ 8 Гц, 8Н), 7,85 (1Н, дд, 2' Н), 7,65 (3Н, м, 2 АрН), 6,90 (1Н, J АВ 8 Гц, 7 Н), 5,95 (2Н, с, СН2О), 4,25 (2Н, квадр. ОСН2), 1,35 (3Н, т. Ме).
П р и м е р 40. н-пропил-N-(6-)1-нафтилметокси(имидазо[1,2-b]пиридазин-2-ил)кар- бамат
Т.плавления 208-210оС
δН(ДМСО) 10,25 (1Н, шир., с, N Н), 8,15 (1Н, м, АрН), 8,00 (2Н, м, 2 АрН), 7,90 (1Н, с, 3Н), 7,85 (1Н, J АВ 8 Гц, 8 Н), 7,75 (1Н, д, 2' Н), 7,60 (3Н, м, 3 АрН), 6,85 (1Н, J АВ 8 Гц, 7 Н), 5,8 (2Н, с, ОСН2), 4,1 (2Н, т, ОСН2), 1,65 (2Н, м, СН2), 0,9 (3Н, t, Ме).
П р и м е р 41. Метил-N-(6-)3-метокси-1-нафтилметокси(имидазо[1,2-b]пиридазин-2-ил)карбамат
δН(ДМСО) 10,0 (1Н, шир., с, N Н), 8,1 (1Н, д, АрН), 7,9 (2Н, м, АрН + 3Н), 7,85 (1Н, J АВ 8 Гц, 8Н), 6,85 (1Н, J АВ 8 Гц, 7Н), 5,8 (2Н, с, СН2О), 3,90 (3Н, с, ОМе), 3,7, с, ОМе).
П р и м е р 42. Метил-N-6-[2-[3,4,5-триметоксифенил)этокси]имидазо[1,2-b]пири-дазин-2-ил]кар бама
Т.плавления 203-206оС
δН(ДМСО) 9,95 (1Н, шир., с, N Н), 7,80 (1Н, с, 3Н), 7,75 (1Н, J АВ 8 Гц, 8Н), 6,8 (1Н, J АВ 8 Гц, 7Н), 6,65 (2Н, с, 2 АрН), 4,5 (2Н, т, СH2О), 3,8 (6Н, с, 3 МеО, 5 МеО), 3,7 (3Н, с, ОМе), 3,65 (3Н, с, 4 Мео), 3,0 (2Н, т, СН2).
П р и м е р 43. Метил-N-6-(3,4,5-триметоксифенил)имидазо[1,2-b]пиридазин-2-ил-карбамат
Т.плавления 175-176оС.
ЯМР δН(CDCl3), 10,17 (1Н, шир., с, NН), 8,18 (1Н, шир., с, Гет 3-Н), 7,77 (1Н, д, J АВ = 10 Гц, Гет СН), 6,85 (1Н, д, J АВ = 10 Гц, Гет СН), 6,42 (2Н, с, 2' -Н, 6' -Н), 3,88 (3Н, с, СО2Ме) и 3,82 (9Н, с, 3-МеО), 4' -МеО, 5' -МеО), 3,12 (2Н, част.разр. м, СН2) и 3,02 (2Н, част.разр. м, СН2).
П р и м е р 44. Метил-N-6-(3,4,5-триметокси-α-стирил)имидазо[1,2-b] пиридазин-2-ил- карбамат
Т.плавления 217-219оС
ЯМР δН(d6 - ДМСО) 10,49 (1Н, шир., с, N Н), 7,99 (1Н, с, гет, 3-Н), 7,94 (2Н, д, J AIBI= =10 Гц, Гет СН), 7,60 (2Н, д, J А2В2 = 18 Гц, СН), 7,58 (2Н, д, J AIBI = 10 Гц, Гет СН), 7,28 (2Н, д, J А2В2 = 18 Гц, СН), 7,04 (2Н, с, 2' Н, 6' Н), 3,87 (6Н, с, 3' -МеО и 5' -МеО), 3,72 (3Н, с) и 3,70 (2Н, с, (СО2Ме и 4' -МеО).
П р и м е р 45. Метил-N-(6-)2,5-диметилбензилокси(имидазо[1,2-b]пиридазин-2-ил) карбамат
Т.плавления 208-209оС
ЯМР δН(d6 - ДМСО) 10,05 (1Н, шир., с, N Н), 7,95 (1Н, J АВ 8,8 Гц, 8Н), 7,85 (1Н, с, 3-Н), 7,35 (1Н, с, 6' -Н), 7,20 (2Н, J АВ 8,8 Гц, 7Н + д, 3' или 4' -Н), 6,90 (1Н, д, 3' или 4' -Н), 5,90 (2Н, с, СН2), 3,80 (3Н, с, МОе), 2,35 (3Н, с, Ме).
П р и м е р 46. Метил-N-(6-)2-пиридилметокси(имидазо[1,2-b]пиридазин-2-ил)карбамат
Т.плавления 231-233оС
ЯМР δН(d6 - ДМСО) 9,95 (1Н, шир., с, N Н), 8,55 (1Н, д, 6' -Н), 7,85 (3Н, м, 8-Н + 3-Н + 5' -Н), 7,55 (1Н, д, 3' -Н), 7,35 (1Н, м, 4' -Н), 6,90 (1Н, J АВ 8,8 Гц, 7-Н), 5,45 (2Н, с, СН2), 3,70 (3Н, с, Оме).
Результаты биологических тестов
А) Анализ на полимеризацию Тубулина
Материалы и способы
1. Получение тубулина
а) свежеполученный мозг лошади
в) Буферы:
ВВС ВВ ВЕ2G
10 мм MES* NaOH как BBG, но без Как BBG, но без
2 мм EGTA * глицерина 8М глицерина
1 мм MgSO4 и 1 мМ GТР*
4М глицерина
2 мм дитиэритритола
рН 6,9 при 23оС *МНS-2-N-морфолино/этансульфоновая кислота EGTA - этиленгликоль (бис β-аминоэтиловый эфир N,N,N' ,N' -тетрауксусная кислота GTP-гуанозинтрифосфат
Все манипуляции осуществляют при 4оС, если нет другоих указаний. Лошадиный мозг промывают в ледяном BBG буфере и удаляют кровеносные сосуды и мозговые оболочки. После взвешивания кору мозга измельчают, гомогенизируют в 75 мл BBG буфера на 100 г мозга, центрифугируют при 6500 g в течение 15 мин и после удаления надосадочной жидкости снова центрифугируют при 100000 g 75 мин. Измеряют объем надосадочной жидкости (У мл) и добавляют 10 мл 10 мМ GTP (литиевая соль) в Н2О. Полученную смесь инкубируют в запаянных ампулах для центрифуги (30 мин, 34оС) во встряхиваемой водяной бане для полимеризации тубулина. После полимеризации ампулы балансируют и центрифугируют при 100000 g (1 ч при 27оС) в предварительно нагретом роторе. Центрифугированный с высокой скоростью осадок снова суспендируют в У/4 мл ВВ буфера и препарат перемешивают на льду в течение 30 мин и центрифугируют при 100000 g (1 ч при 4оС) для удаления стабилизированных на холоде микротубул. Равный объем ВВ2G буфера добавляют к надосадочной жидкости, которую быстро замораживают в пластиковых чашках, плавающих на суспензии твердый СО2/этанол, и хранят в течение ночи при -80оС. Примерно через 18 ч замороженные образцы тубулина оттаивают, добавляют 10 мМ GTP в Н2О до получения конечной концентрации 1 мМ и измеряют новый объем (W мл).
Цикл полимеризации (деполимеризацию повторяют точно в соответствии с приведенным ранее описанием, но заменяя на до получения дважды обработанного тубулина.
2. Турбидиметрический анализ полимеризации тубулина
Аппаратура: записывающий спектрофотометр с 6 положениями, термостатированное кюветное отделение; полное отклонение шкалы - 0,2 ед. поглощения.
В кювете спектрофотометра объемом 1 мл перемешивают 100 мкл 10 мМ GTP (литиевая соль), буферированный ВВ буфером, 10 мкл Н2О или ДМСО - в зависимости от выбранного растворителя лекарства ВВ буфер и препарат тубулина так, чтобы окончательное повышение А 350 нм составило 0,15 единиц после 16 мин (приблизительно 100 мкл препарата тубулина или 2,5 мг протеина) в конечном объеме 1 мл при 37оС. Все реагенты хранят на льду. Полимеризацию инициируют, повышая температуру до 37оС и регистрируют возрастание А350нм трех образцов по сравнению с контрольной кюветой. Контрольный образец содержит аналогичным образом инкубированную смесь либо без тубулина, либо с добавлением 1 мМ Са2+. Рассчитывают возрастание по сравнению с начальным А350нм через 10 мин после завершения 1 аg фазы, контрольная полимеризация за это время составляет 80%, и выражают как процент от контрольного значения для ряда концентраций препарата. Определяют концентрацию препарата, необходимую для 50%% изменения (ИК50) в контрольном значении.
В) Анализ на образование колонии Р338Д1
В этом анализе клетки из адаптированной in vitro линии лимфоидных неоплазм мыши Р38В вначале экспонируют сериям разбавлений концентраций тестового соединения в течение 24 ч в культуре. После этого определяют способность обработанным таким образом клеток образовывать дискретные колонии за 14 дней после повторного суспендирования в полутвердой не содержащей препарата среде.
Вначале клетки в log роста помещают в отдельные 25см3 склянки для культуры тканей, каждый из которых содержит конечный объем 5 мл. Через буферированного RРМ1 1640 культуральной средой с добавлением 10% сыворотки плода теленка, антибиотиков и тестового соединения. Все соединения подготавливают вначале в соответствующих концентрациях в ДМСО, 25 мкл которого добавляют затем в каждую склянку. Все соединения оценивают при концентрациях изменяющихся последовательно с коэффициентом 4, начиная с верхней концентрации в 4 раза большей, нежели та, о которой уже известно, что она ингибирует пролиферацию этих клеток около 80-90% в предварительном пролиферативном анализе.
Через 24 ч экспонирования тестового соединения клетки считают и известное количество живых клеток переносят в 15 мл ампулу для центрифуги, в которую затем добавляют 4 мл 0,25% агарозного раствора, желирующегося при низкой температуре в полной RPMI тканевой культуральной среде. Через 13 дней инкубирования при 37оС в верхнюю часть каждой ампулы добавляют 1 мл 1% параиодонитротетразоливиолета и дают возможность проникнуть через агарозу в течение 24-48 ч. Этот краситель разлагается живыми клетками, давая нерастворимый красный кристаллический продукт, который облегчает счет колоний. Образцы отбирают из каждой ампулы и считают количество колоний, содержащих минимум 50 клеток. Определяют концентрацию соединения, необходимую для ингибирования образования колонии на 50% относительно контрольных клеток инкубированных в тех же условиях, но без тестового соединения.
Тест на лимфоцитную лейкемию Р388/0
Мышей СД2 - 1 одного пола массой в интервале 3 г от 20 г использовали в этом опыте. Контрольным и тестовым животным вводили внутрибрюшинно суспензию 106 живых Р388/0 опухолевых клеток в день 0. В каждом тесте исследовали несколько уровней доз, которые давали ЛД20 для соединения; каждый уровень доз вводили группе из 6 животных. Тестовое соединение приготавливали либо в физиологическом растворе, содержащем 0,05% Твина-80, либо в дистиллированной воде, содержащей 5% декстрозы, и вводили внутрибрюшинно в дни 1,5 и 9 после имплантации опухолевых клеток. Дозы рассчитывали в мг/кг в соответствии с индивидуальной массой животных. Фиксировали день гибели для каждого животногоо и для каждой группы определяли среднее значение. Разницу между средним значением времени выживания для контрольной и обработанной групп выражали как % возрастания продолжительности жизни (% JLS).
Д. ЛД20 для мышей
Тестовые соединения подготавливали как описано для теста на лимфоцитную лейкемию Р388/0 и вводили внутрибрюшинно в различных уровнях доз группам из 6 СД2 - F1 мышей одного пола массой 20±3 г в дни 1,5 и 9. Мышей наблюдали вплоть до 14 дней (считая со дня 1) и определяли количество смертей в каждой группе и ЛД20.
Е.Активность против устойчивых к лекарствам опухолей
Используя аналогичную методику с процедурой теста на лимфоцитную лейкемию Р388/0, соединение примера 3 оценивали против Р388/0 опухолей, которые были сделаны устойчивыми к следующим стандартным клинически используемым антиопухолевым агентам: бис-хлоронитрозомочевина (ВС N 4)
Циклофосфамид (СРА)
адриамицин (ADR)
актиномицин Д (Аст Д)
метотрексат (МТХ)
5-фтороурацил (5 FU)
цис-платина (Cis-Pт)
Винкристин (УСR)
Амсакрин (АМ SA)
Клетки линий опухолевых клеток человека Д Д-1, НСТ-116 WiDr и А549 экспонировали концентрациями последовательных разбавлений тестовых соединений после 96 ч культуры. Способность таких клеток к пролиферации за тестовый период определяли.
Клетки в log роста помещали в чашки с множеством углублений для тканевой культуры (96 лунок) в 100 мкл/лунку RРМI 1640 культуральной среды с дополнением 10% сыворотки плода теленка антибиотиков и тестового соединения. Все соединения приготовили вначале в соответствующих концентрациях в ДМСО, причем окончательная концентрация в этом растворителе была в 20 раз выше, чем нужно для пластин. Затем проводили 1 в 10 разбавление в полной среде перед добавлением 100 мкл в каждую лунку пластины. Все соединения оценивали в концентрациях в интервале последовательных четырехкратных уменьшений с верхней концентрацией, которая была в 4 раза больше, чем уже известная концентрация, ингибирующая пролиферацию клеток лимфоидной неоплазмы мыши р 388ДГ на 80-90% в предварительном пролиферационном анализе.
Через 96 ч пролиферацию клеток экспонированных тестовому соединению сравнивали с контрольными необработанными клетками одним из двух способов.
а) Культуральную надосадочную жидкость отсасывают и клетки фиксируют и подкрашивают, добавляя раствор метиленового синего (5 г на 1 л 50% этанола: вода, 100 мкл/лунку). Спустя 30 мин при комнатной температуре несвязанный краситель отмывают, погружая пластины в воду. Окрашенные клетки солюбилизируют в течение ночи используя 1% Саркосил (Сигма) в фосфатио буферированном солевом растворе (100 мкл/лунку). Определяют поглощение на EZISA пластинах спектрофотометра на длине волны 620 нм. ИК50 определяют как концентрацию препарата, которая снижает поглощение до 50% от значения для контрольных (без препаратов) культур. Этот способ использовали для клеточной линии DZD-1.
в) 20 мкл МТТ (5 мг/кл в PBS добавляют в каждую лунку. После инкубирования в течение 4 ч среду из каждой из лунок отсасывают и заменяют 200 мкл ДМСО для растворения образовавшихся кристаллов формазана. Записывают поглощение на EZISA пластинах спектрофотометра на длине волны 540 нм. ИК50 определяют как концентрацию препарата, которая снижает поглощение до 50% от контрольного значения для культур без препарата. Этот способ использовали для WiDr НСТ-116 и А549 клеточных линий.
Используя процедуру, аналогичную с процедурой лимфоцитной лейкемии Р388/0, тестовое соединение примера 1 оценивали по отношению к мышиным опухолям В16, L1210 и М5076. Суспензию 10' опухолевых клеток имплантировали внутрибрюшинно контрольным и тестовым животным в день 0. В16 опухолевые клетки вводили внутрибрюшинно в виде 1:10 Brei клеток в день 0. Тестовое соединение вводили внутрибрюшинно в день 1,5 и 9. Для В16 и М5076 мышей в каждой группе было по 10, а для L210 по 6 мышей в группе. Записывали день гибели каждого из животных и рассчитывали %JZS процент повышения длительности жизни. Полученные результаты приведены в табл.7.
А. Таблетки/ мг.
Соединение формулы (1) 100,0
(в виде гидрохлорода)
Предварительно
желатинизированный
кукурузный
крахмал 60/0
Натрийгликолят крахмала 20/0
Стеарат магния 4/0
Соединение формулы (1) тонко измельчают и тщательно перемешивают с порошком эксципиентов, предварительно желатинизированным кукурузным крахмалом и натрий гликоллятом крахмала. Порошки смачивают очищенной водой до получения гранул. Эти гранулы сушат и смешивают со стеаратом магния. Затем композицию прессуют в таблетки массой приблизительно 184 мг каждая.
В. Таблетки, мг.
Соединение формулы (1) 100,0
Натрий гликоллят крахмала 20,0 Лактоза 83,8 Стеарат магния 4,2
Поливинилпир- ролидон 14,0
Соединение формулы (1) тонко измельчают и тщательно перемешивают с порошкообразными эксципиентами, натрийгликолля- том крахмала и лактозой. Порошки смачивают раствором поливинилпирролидона, растворенного в очищенной воде и денатуриро- ванном спирте до получения гранул. Эти гранулы сушат и смешивают со стеаратом магния. Композицию прессуют в таблетки массой приблизительно 222 мг каждая.
С. Капсулы, мг.
Соединение фор- мулы (1) 100,0 Кукурузный крах- мал 50,0 Стеарат магния 3,0
Тонкоизмельченное соединение формулы (1) смешивают с порошкообразным кукурузным крахмалом. Высушенный порошок смешивают со стеаратом магния и заполняют им твердые желатиновые капсулы.
Д. Суспензия
Соединение фор- мулы (1) 100,0
Диспергируемая целлюлоза 100,0 Глицерин 500,0 Сахароза 3500,0 Отдушка g˙ρ Красящий агент g˙ρ Консервант 0,1%
Очищенная вода до 5,0 мл
Соединение формулы (1) суспендируют в глицерине и в части очищенной воды. Сахарозу и консервант растворяют в другой части очищенной воды, а затем добавляют и растворяют подкрашивающий агент и диспергируемую целлюлозу. Эти два препарата смешивают и охлаждают перед дабавлением отдушки. Добавляют до конечного объема очищенную воду. Полученную суспензию тщательно перемешивают.
Е. Внутривенные инъекции
Соединение фор- мулы (1) 5,0 мг Кислота соляная Столько
сколько нуж-
но для установ-
ления рН
Вода для инъек- ций до 10 мл
Соединение формулы (1) добавляют к части воды для инъекций. рН устанавливают соляной кислотой для растворения соединения. Воду для инъекций добавляют до конечного объема, и после тщательного перемешивания раствор готов. Его стерилизуют, фильтруют через мембранный фильтр 0,22 мкм, и заполняют в асептических условиях в стерильные ампулы или пробирки.




Использование: в качестве препаратов, обладающих цитотоксической активностью. Сущность изобретения: соединение общей ф-лы 1, где R1 -карбоциклическая арильная группа, возможно замещенная C1-C4 -алкоксигруппами, R2-C1-C4 -алкильная группа, R3 -водород или C1-C4 -алкил, X-кислород, Y- CH2 . Реагент 1: соединение ф-лы 2. Реагент 2: C1-C4 -алкилгалоформиат. Соединения ф-лы 1,2: 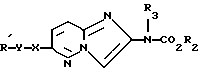 ,
,  .
.
СПОСОБ ПОЛУЧЕНИЯ ИМИДАЗОПИРИДАЗИНОВ общей формулы I CO2R2
CO2R2
где R1 - карбоциклическая арильная группа, возможно замещенная C1-C4-алкоксигруппами;
R2 - C1-C4-алкильная группа;
R3 - водород или C1-C4-алкил;
X - кислород;
Y - -CH2,
отличающийся тем, что осуществляют реакцию соединения общей формулы II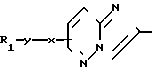 NH2
NH2
где R1, Y и X имеют указанные значения,
с C1-C4-алкилгалоформиатом с последующим при необходимости алкилированием соединения формулы I, где R3 - водород.
| Вейганд-Хильгетаг | |||
| Методы эксперимента в органической химии | |||
| М.: Химия, 1968, с.470. |
Авторы
Даты
1994-08-15—Публикация
1989-06-19—Подача