или их солеЯ, отличающийс я тем, что подвергают циклизации соединение общей формулы
,1
S
(II)
I
в- Z
один из R и 2-МС-СО,где G - водород, карбоксил или его производное, другой из R или R2 - водород, карбоксил или его производное,. при условии, что один из G и R или R и G водород, а Z, Z и Z имеют указанные значения ,
с последующим выделением целевого продукта в виде основания или соли.
2.Способ по п.1, отличающийся тем, что циклизацию проводят при нагревании.
3.Способ по ПП.1 и 2, отличающийся тем, что циклизаци проводят в кислой среде.
4.Способ по пп. 1-3, отличающийся тем, что циклизацию проводят в присутствии инертного растворителя.









| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных гидантоина | 1978 |
|
SU1005658A3 |
| Способ получения производных пурина или их солей | 1977 |
|
SU980623A3 |
| Способ получения амида коричной кислоты | 1975 |
|
SU728712A3 |
| Способ получения производных флавана или их солей | 1979 |
|
SU1072805A3 |
| АМИДИНПРОИЗВОДНЫЕ | 1992 |
|
RU2130014C1 |
| Способ пролучения производных пурина или их солей | 1979 |
|
SU784777A3 |
| Способ получения пептидов или их кислотно-аддитивных солей | 1978 |
|
SU1470199A3 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОБИЦИКЛОАЛКАНОВ | 1991 |
|
RU2034847C1 |
| Способ получения 5-замещенных 2,4-диаминопиримидинов или их кислотно-аддитивных солей | 1987 |
|
SU1535379A3 |
| Способ получения производных циклопентана | 1971 |
|
SU473356A3 |
1. Способ получения производных гидантоина общей формулы Z :-.П -J(-Z Z - водород или Cf-С -алгде кил; один из Z или Z - CHj-X-X -Xi, X - фенилен С;с, цг/с- или TpQHC-CHsCH или (Q}2 ; Q - водород или С,-С -алкил или два Q вместе С4-С -алкилен; X - одинарная связь или разветвленный или неразветвленный С -Cg-алкилен, любая из метиленовых групп которого может быть заменена на оксагруппу, причем по крайней мере один атом углерода отделяет оксагруппу от группы „ СЕС, или CQ; X - 5-тетразолил, карбоксил, карбоксамид, оксиметилен или алкоксикарбонил, где алкил содержит 1-3 атома углерода; другой из 1 или Y-Y -Y-Y: Y - C(R)-CH,p; М водород или метил; карбонил, незамещенный метилен, мeтилeн замещенный гидроксилом, или метиле н,з амещенный гидроксилом и С -Сб-алкклом; , i Y2 одинарная связь или неразветвленный Или разi ветвленный Cf-C-j-алкилен, замещенный по углет СО роду, соседнему с Y , одним или двумя заместителями, такими, как. -алкил, Cj-Ci j -циклоалкил, -бицикпоалкил; Y водород, гидроксил, С q-C,o -циклоалкил, Сц-С,о-бициклоалкил, незамещенные фенил, бенto зил, фенокси- или бензилоксигруппа или бенО зольное кольцо в этих группах замещено одним о или более галогенами, нитро-, амино-, ациламино-, алкоксилгруппами, алкенилами или гш килами, где алкил содержит 1-4 атома углерода и замещен одним или более галогенами; СИ одинарная связь, или Y 2 CHjCH ; Y ,Y и Y вместе - CJ-CT-циклоалкил ,замещенный гидроксилом.

I
Изобретение относится к способу получения новых производных гидантоина, которые обладают простагландиноподобными свойствами и могут найти применение в медицине.
Известна реакция циклизации гидантоиновых кислот и их эфиров в гидантоины при нагревании .в кислой среде l .
Цель изобретения - получение новых производных гидантоина, обладающих ценными фармакологическими свойствами.
Поставленная цель достигается тем, что согласно способу получения производных гидантоина общей формулы
о
(I)
Z - водород или Cj-C -ал:гдекил;
дин из Z-CHj-X-X r-x;
X - фенилен, , или транс-СН СН или сн,2-с(0)/г;
Q - водород или С -С - алкил или два Q вместе С -С -алкилен;
X - одинарная связь или
разветвленный или неразветвленный «алкилен, любая из метиленовых групп которого может быть заменена на оксагруппу, причем по крайней мере один атом углерода отделяет оксагруппу от группы , или CQ;
Х2 5-тетразолил, карбоксил, карбоксамид, оксиметилен или алкоксикарбонил, где алкил содержит 1-3 атома углерода;
другой из Z Y - C(R}y- СНу}
R. - водород или метил; Y - карбонил, незамещенный метилен, метилен, замещенный гидроксилом или метилен, замещенный гидроксилом и С;(-Cg-алкилом;
Y - одинарная связь или неразветвленный или разветвленный С -С -алкилен, замещенный по углероду, соседнему с Y, одним или двумя заместителями, такими, как С -С -алкил, С -С д-циклоалкил, -бицик„ лоалкил;
Y - ВОДОРОД, ГИДРОКСИЛ,
Св-Сд «чдиклоалкил, бициклоалкил, незамещенные фенил, бензил, фенокси- или бензил-. окс.игруппа, или бензольное кольцо в этих группах замещено одним или более галогенг1ми, нитро-, аминр-, ациламино-, алкоксигруппами, алкенилами или алкилами, где алкил содержит 1-4 атома углерода и замещен одним или бо-, лее галогенами;
или Y - одинарная свазь, СН или ; Y ,Y и Y3вместе- Сj-C,n -циклоалк замещенный гидроксил или их солей, подвергают циклизации соединение общей формулы где один из. R или R - Z-NG-CO; G - водор карбоксил или его производное, друго из Н или R2 - водород, карбоксил и его производное, п условии,что один из G и К или R и G - водород, а Z, Z и Z имеют указанные значения, с последующим выделением целевого продукта в виде основания или соли Циклизацию проводят при нагрев НИИ.. Кроме того, циклизацию проводят в кислой среде в присутствии инертного растворителя. Исходные соединения получают из производного аминокислоты формулы где G, Z и Z имеют указанные зн чения, включая и G-нитрил, при де ствии циановой кислоты или её алк производного. в качестве источника циановой лоты используют ее щелочную соль следующем добавлении неорганическ или органической кислоты. В качестве солей целевых соеди нений предпочтительны соли с таки неорганическими катионами, как аммоний, натрий, калий, кальций, магний или органическими основаниями, такими как этаноламин, а также диастёреоизомеры соединений Предлагаемые гидантоины имеют фармакологические свойства, близкие к природным простагландинам и могут усиливать или ослаблять действие простагландинов А, В, С, D, Е и F. В частности, они уси ливают антитромбоцитарный эффект простагландина PGE и угнетают со тительную активность PGE2 и PGF2 гладкой мускулатуре. Гидантоины могут применяться д предупреясдения тромбообразования и лечения тромбозов, инфаркта ми,окарда, атеросклерозов, при сердечно-сосудистых операциях и в соетаве кровезаменителей. Они расширяют гладкую мускулатуру сосудов, снижают давление крови и могут найти применение в качестве антигипертонических средств. Ряд гидантоинов усиливает антигистаминное действие простагландина PGE и может использоваться для профилактики и лечения бронхиальной астмы. Кроме того, гидантоины уменьшают повышенную секрецию желудка и могут найти применение в предупреждении и лечении язв желудочно-кишечного тракта. Целевые соединения усиливают чо чеотделение и могут быть использованы в ряду других мочегонных средств. Гидантоины также усиливают дейстт вие простагландинов РСЕ и PCF на мускулатуру матки и препятствуют выбросу плода при повышенном ее тонусе. ., Пример 1. 5-(б-Карбоксилгексил) -1- (З-окси-4 , 4-диметил-5-(Ъенилпентил)гидантоин. A.Диэтил-2-аминононандиот. 16., 7 г диэтилацетоамидомалоната и 16,6 г этил-7-бромгептаната растворяют в растворе этилата натрия в этаноле, приготовленном из 1,51 г натрия и 30 мл абсолютного этанола и смесь кипятят в течение 27 ч. Охлажденный раствор вливают в ледяную воду, целевой продукт экстрагируют эфиром, высушивают, упаривают и получают неочищенный диэтилацетамидо(б-этоксикарбонилгексил)малонат в виде масла.ПМР-спектр,м.д; 2,2(ЗН, синглет, СОСНз); 4,17 (6Н, мультиплет, Зх-ОСН -СНд ) . Полученный амид кипятят с соляной кислотой (111 мл) в течение 5,5 ч, охлажденный раствор промывают эфиром, обесцвечивают активированным углем и упаривают в вакууме досуха. Бесцветный остаток растворяют в минимальном количестве спирта и добавляют по каплям при перемешивании охлажденную до минус смесь 125 мл спирта и 15,7 г тионила хлорида. Получаемый раствор оставляют при комнатной температуре на 1 ч, кипятят в течение 1,5 ч, охлаждают и выливают в ледяную воду, затем доводят до рН 9 гидроокисью натрия. Смесь экстрагируют эфиром, высушивают эфирный экстракт, .упаривают и перегоняют. Получают диэтил-2-аминононандиот в виде бесцветного масла. Т.кип. И4-115°С/0,02-03 мм. Выход 55%. B.Диэтил-2-(4,4-диметил-З-оксофенйлпентил)аминононандиоат. К 5,18 г диэтил-2-аминононадиоата добавляют по каплям при охлаждении и перемешивании 3,95 г 4,4-диметил -5-фенилпент-1-ен-3-она, Смесь оставляют при комнатной температуре 21 ч, затем получают диэтил-2-(4,4 -диметил-3-оксо-5-фенилпентил)амино надиоат. С. Пиэтил-2-(З-окси-4,4-диметил-5-фенилпентил)аминононандиоат. 5,1 г полученного неочищенного кетона растворяют в 70 мл этанола и перемешивают в ледяной ванне при постепенном добавлении 380 мг боргидрида натрия. Раствор продолжают перемешивать в ледяной ванне в течение последующих 10 мин после окончания прибавления и затем оставляют при комнатной температуре на 5 ч. Большую часть спирта упаривают, добавляют воду и раствор подкисляют до рН 6. Полученный раствор экстрагируют эфиром, сушат и упаривают. Получают 2-(3-окси-4,4-диметил-5-фенилпентил)аминононандиоат в виде масла, которое используют без дальнейшей очистки. Д. 5-(б- токсикарбонилгексил)- -1- (З-оксИ-4 ,4-диметил-5- Т)енилпентил)гидантоин и соответствующая ки лота. Раствор полученного выше спирта (8,45 г) в этаноле (37,6 мл) и 2 и. соляной кислоте (18,8 мл) перемешивают в ледяной ванне и к нем по каплям добавляют раствор цианат калия (3,05 г) в воде (5,6 мл). См оставляют при комнатной температур на 18 ч, затем отгоняют спирт, добавляют воду и экстрагируют эфиром Эфирный экстракт упаривают и получают 6,8 г вязкого масла, которое нагревают на водяной бане в течени б ч. Получают 5-(в-этоксикарбонилгексил)-1-(З-окси-4,4-диметил-5-фенилпентил)гидантоин в виде вязко го масла, который добавляют к смеси 25 мл 2 и. гидроокиси натрия и 60 мл воды. Полученный мутный раствор оставляют при комнатной температуре на 2ч, затем промывают эфиром и водный раствор подкисл ют 2 и. соляной кислотой, выпавшее масло экстрагируют эфиром. Путем упаривания эфира, получают вязкое масло, которое хроматографируют на колонке. Получают 5-(6-к боксигексил)-1-(З-окси-4,4-диметил -5-фенилпентил)гидантоин в виде бес цветного вязкого масла, которое за твердевает (т.пл. 115с) и представляет смесь диастереоизомеров. Путем перекристаллизации из смеси этилацетата и петролейного эфира (т.кип. 60-80°С) получают один из диастереоизомеров в виде мелких иголочек (т.пл. 135-137,С). П р и м е р 2. 5-(6-Карбоксигексил)(3-оксиоктил)гидантоин. А. Диэтил-2- З-(тетрагидропирин2-илокси)октиламиноЗ нонандиоат. Сухой бромистый водород в эфире, полученный рас,творением 26,8 г бромистого водорода в 200 мл эфира при.О-с, добавляют по каплям при перемешивании к раствору 19,15 г акролеина в 100 мл эфира, охлажденному до минус 25с. Перемешиваемую смесь выдерживают при этой температуре в течение 1 ч, доводят до 0°Cj перемешивают еще в течение 1 ч при 0°С и затем добавляют по каплям к пентилмагнийбромиду в Эфире, приготовленному из 54 г 1-бромпентана, 8,8 г магния и 120 мл эфира, и поддерживают кипение. Реакционную смесь разлагают насыщенным раствором хлорида Аммония и экстрагируют эфиром, а высушенный экстракт упаривают и перегоняют, в результате чего получают 1-бромоксиоктан в виде бесцветного масла с т.кип. 68,5-72,5С/0,08 мм. Раствор этого спирта (20,9 г) в дигидропирине (17,0 г) обрабатывают п-толуолсерной кислотой (500 мг) в присутствии небольшого количества эфира, оставляют при комнатной температуре на 18 ч, а затем промывают водным раствором бикарбоната натрия. Органический слой пропускают через силикагель в растворителе (-1:9 эфир/гексан) и растворитель упаривают в вакууме, в результате чего получают 1-бром-3-(тетрагидропирин-2-илокси)октан в виде бесцветного масла.ПМР-спектр, м.д.:0,88 (ЗН, триплет, СН) и 4,62 (1Н, широкий, -О-СН-О-). Раствор 15,0 г тетрагидропирина . и 13,0 г диэтил-2-аминонондиоата в 100 мл з таноле кипятят с обратным холодильником в течение 18 ч, этанол удаляютв.вакууме, осадок разбавляют водой, содержащей карбонат натрия. Смесь экстрагируют дихлорметаном, экстракт сушат сульфатом Нс1трия и упаривают.Остаток очищают в хроматографической колонке с силикагелем (1:4 гексан/эфир) и получают диэтил-2- 3-(тетрагидропирин-2-илокси)октиламино} нонандиоат в виде бесцветного вязкого масла. ПМР-спектр, м.д.: 0,88 (ЗН, триплет, -СН«); 2,28 (2Н, триплет, -CH -CHjEt); 2,61 (2Н, мультиплет, -СН2-); 3,20 (1Н, триплет, -CH-CO Et); 4,13 (4Н, мультиплет, 2Х-О-СН2-СНз ); 4,60 (1Н, широкий, -О-СН-О-). Вышеуказанный гшинодиэфир получают следукяцим образом. 10,40 г диэтил-2-аминононандиоата и 5,04 г окт-1-эн-З-она смешивают при и оставляют при комнат ной температуре на .3 ч, в результате чего получают диэтил-2-(3-оксооктиламино)нонандиоат в виде бесцветного масла. ПЧР-спектр, м.д.: 2,3 (4Н, мультиплет, -CH -COjEi и CH CHfiCO- ; 3,16 (1Н, триплет, EtO C-CH-), 4,11 (2Н, квартет, -О-СН -СН); 4,17 (2Н,квартет, -D-CHj-CHj). Раствор этого кетона (13,5 г) в этаноле (140 мл) при перемешивании обрабатывают боргидридом натрия (665 мг) в спирте (70 мл) при , затем выдерживают в течение 3,5 ч при комнатной температуре и концентрируют при 40°С в вакууме. Остаток растворяют в воде и доводят до рН 5 1 н. соляной кислотой, экстрагируют при помощи хлороформа, экстракт промывают водой, высушивают и упаривают, В результате получают диэтил-2-(3-оксиоктиламин)нонандиоат в виде бесцветного масла, который без дальнейшей очистки растворяют в 14,0 мл дигидропирина, обрабатывают 10 мл эфира и затем 6,72 г п-толуолсерной кислоты (прибавляют по частям)иоставляют при комнатной температуре на 18 ч. Реакционную смесь разбавляют эфиром,промывают водным раствором карбоната натрия, затем водой, высушивают и упаривают, а остаток очищают при помощи хроматографической колонки с силикагелем (1:4 гексан/эфир). В результате получают диэтил-2 з-(тетрагидропирин-2-илокси)октиламино - нонандиоат, идентичный по свойствам (ПМР- и ИК-спектрам, тонкослойной хроматографии) с соединением, приготовленным выше.
В. 5-(6-Карбоксигексил)-1- (3тетрагидропирин-2-илокси)-октил гидантоин.
К раствору 7,8 г диэтил-2-(3-тетрагидропирин-2-илокси)октиламинононандиоата в 32 мл этанола добавляют раствор 3,0 г цианата калия в 6 мл воды. Полученную суспензию перемешивают при охлаждении и добавляют 16,7 мл 2 н. соляной кислоты. Раствор оставляют при комнатной температуре на 22 ч, большую часть этанола упаривают, добавляют воду, а затем экстрагируют эфиром. Эфирны экстракт промывают водой, высушивают сульфатом магния и упаривают. Полученное желтое масло в количестве 8,0 г растворяют в петролейном эфире (т.кип. 60-80с) и кипятят-, с обратным холодильником в течение 4 ч. Упаривают досуха, а остаток нагревают в водяной бане в течение 2 ч. Получают 7,3 г 5-(6-этоксикарбонилгексил) -1- р-тетрагидро-: пирин-2-илокси)октил гидантоина в .виде желтого масла, которое используют без дальнейшей очистки.
6,2 г полученного эфира растворяют в 80 мл 0,5 н. раствора гидро.окиси натрия и оставляют при комнатной температуре на 2,5 ч, после чего промывают эфиром,водный слой 5 подкисляют 2 н. соляной кислотой, а выпавшее масло экстрагируют эфиром. Промытый водой и высушенный экстракт упаривают и получают 5-(6-карбоксигексил)-1- З-(тетрагидропиран0-2-илокси)октил гидантоина в виде желтого масла.
С. 5-(6-Карбоксигексил)-1-(3 г-идроксиоктил) гидантоин.
3,55 г полученного выше продукта
5 растворяют в смеси 28 мл тетрагидрофурана и 7 мл 5 н. соляной кислоты, оставляют при комнатной температуре на 3,5 ч и затем кипятят с обратным холодильником в течение
Q 30 мин. Большую часть растворителя -упаривают, добавляют воду, а затем экстрагируют эЛиром. Эфирный экстракт промывают водой, сушат сульфатом магния, упаривают и получают
5 3,15 г вязкого желтого масла.Масло вносят в хроматографическую колонку с силикагелем и элюируют вначале хлороформом, а затем смесью хлороформа и метанола (19:1)-. Получают
5-(6-карбоксйгексил)-1-(3-оксиоктил)гидантоин в виде очень вязкого, :почти бесцветного масла. ПМР-спектр, м.д. : 0,89 (.1н, триплет, -СН) ; 2,34 (2Н, триплет, -CHj-CO H); 2,9-4,2 (4Н, комплекс, -СН2,
5 СН-, СН-ОН); 5,6 (2Н, широкий,
-СО2Н-ОН); 9,0 (1Н, широкий, NH).
В условиях примера 1 идентичный гидантоин получают, используя диэтил-2- (3-гидроксиоктил) амино нонан0 диоат.
Д. Выделение диастереоизомеров. Вышеполученный гидантоин делят на хроматографической колонке с силик-агелем с использованием сме5 си хлороформа, метанола и уксусной кислоты (97 : 2,5:О,5)на два диастереоизомера, каждый из которых образует мелкие бесцветные иголочки с т.пл. . 76-78с и 63-65 С соответственно. - Те же диастереоизомеры получают циклизацией соответствующих диастереоизомеров формулы IJ. Так, смесь диастерзоизомеров диэтил-2- (З-лгИДроксиоктил)аминэ нонандиоата, полученную по примеру 1, растворяют в этано5 ле и добавляют раствор хлористого водорода в эфире. Раствор упаривают досуха, получают смесь диасте- . реоизомеряых гидрохлоридов в виде вязкого масла, которые частично
0 кристаллизуются. Добавляют эфир, массу перемешивают и охлаждают, в результате- чего получают кристаллический твердый продукт, который отфипьтровывают, промывают эфиром,
5 высушивают и кристаллизуют из этилацетата. Получают мелкие бесцветные пластинки чистого гидрохлорида с т.пл. 95-96,. Эту соль суспендируют в разбавленном растворе гидр окиси натрия и перемешивают с эфиром. Эфирный слой отделяют, промывают водой, высушивают, упаривают и получают один из диастереоизомеров (А) диэтил-2- {(3-гидроксиоктил)аминоТ нонандиоата в виде бесцветного масла. Эфирный фильтрат, полученный после отделения первого твердого гидрохдорида, упаривают, получают маслянистый гидрохлорид, который превращают в основание, как указано выше, и выделяют почти чистый второй диастереоизомер дяэтил-2-(З-гидрооксиоктил)-аминр нонандиоага в виде бесцветного масла. При помощи предлагаемого способа указанный циастереоизомер (А) превр щают в другой диастереоизомер 5-(6-карбоксигексил)-1-(3-гидроксиоктил)гидантоина, который кристаллизуют из смеси зтилацетата и петролейного эфира (т.кип. бО-ЗО с) в виде маленьких бесцветных иголочек при т.пл. 63-65 С, Аналогично диастереоизомер (В) превращают во второй диастереоизомер 5-(б-карбоксигексил)-1-(3-гидро ксиоктил)гидантоина, который кристаллизуется из этилацетата, - петролейный эфир (т.кип. 60-80с) в ви де маленьких бесцветных иголочек с т.пл, 7б-78°С. Е. Взаимное превращение диастере кзомаров, PacTisop 100 мг 5-(6-карбоксигексил) -1-(3-гидроксиоктил)гидантоина (диастереоизомера с т.пл, 76-78 С) в 3 мл 1 н. раствора гидроокиси нат рия оставляют при комнатной темпера туре на 19 ч, затем подкисляют и экстрагируют эфиром,., а эфирный экст ракт промывают водой, сушат и упари вают. Методом жидкостной хроматогра фии полученное масло делят на два диастереоизомера 5-(6-карбоксйгексил)-1-(3-гидроксиоктил)гидантоина с т,пл, 7б-78°С и исходным материаломл40 мг, и т.пл. 63-65°С и ,40 мг диастереоизомера (А), Подобным образом диастереоизомер с т.пл.. 63-65 С превращают в смесь приблизительно равных количеств его самого и диастереоизомера с т.пл, 7в-78°С и. чистые изомеры выделяют методом жидкостной хроматографии. Примеры 3-27. . Используя реакции, аналогичные описанным в примере 1, с соответствующими виниловыми кетонами в качестве исходных материалов, получаютЗа) диэтил-2- (|(3-оксопентил)амино1 ноНандиоат; 4а) диэтил-2- (3-оксо-4,4-диметилпентил)аминоЗ нонандиоат; 5а) дизтил-2- {(3-оксо-4-метилпентил)амино нонандиоат; 6а) диэтил-2- (З-оксононил)амино нонандиоат;7а) дизтил-2- (З-оксо-4-метилоксип)амино| нонандиоат За) диэтил-2- (З-оксодецил)аминс нонандиоат; 9а) дизтил-2- (3-оксо-4,4-димэтилоктил)г1мино нонандиоат; IOa) диэтил-2- |(3-окСо-4-этилгексил)аминоД нонандиоат; На) диэтил-2- (3-циклобутил-Зксопропил) амино нонандиоат; 12а) диэтил-2- (3-циклопентил-Зоксопропил)амино нонандиоат; 13а) диэтил-2-{ (3-оксо-4,4-диметил-5-(3-трифторметилфенил)пентил амино1 -нонандиоат;14а)дизтил-2- (3-циклогексил-Зоксопропил)амино нонандиоат; 15а) диэтил-2- (3-циклогептип3-оксопропил)амино нонандиоат; 16а)диэтил-2- {З-оксо-З-фенилпропил)амино нонандиоат; . 17а) Ш1ЭТИЛ-2- (3-оксо-4-фенилбутил) амино нонандиоат; 18а) дизтил-2- (3-оксооктил) амино пентадиоат;19а) диэтил-2- (3-оксооктил)амиHoJ ундецандиоат; 20а) этил-2- (3-оксооктил) амино -3-(3-зтоксикарбрнилметоксифенил)пропионат;21а) этил-2-.(3-оксо-4,4-диметилпентил)аминб -3-(3-этоксикарбонилметоксифенил)пропионат; i 22а) этил-2- (Зоксооктиламино) (2-этоксикарбонилзтил)фенил, .пропионат; 2За) этил-2-(3-циклобутил-3-оксопропиламино)-3- З-(2-этоксикарбонилэтилфенил) пропионат; 24а) этил-2-(3-циклопентил-З-оксолропиламино)(2-этоксикарбонилзтилфенил) пропиона.т; -25а) этил-2-(3-циклогексил-З-оксопропиламино)-3- З-(2-этоксикарбонилэтилфенил) пропионат; 26а) диэтил-2-(З-оксооктиламин)7-оксононандиоат;27а) дйзтил-2-(3-циклопентил-Зоксопропиламино)-7-оКсанонондиоат, которые превращают в соответствующие оксисоединения: Зв) диэтил-2-.(3-оксипентил)ами- но)нонандиоат; 4в) дизтил-2- (3-окси-4,4-диметилпентил) ёинино нонандиоат 5в) диэтил-2- Г(3-окси-4-метилпентил)амино нонандиоат; 6в) диэтил-2- (3-рксинонил1 амино нонандиоат;
7в) диэтил-2- (З-окси-4-метилоктил)амино нонандиоат;
8в) диэтил-2- С(3-оксидецил)амино нонандиоат;
9в) диэтил-2- (3-окси-4,4-диметилоктил)амино нонандиоат;
10в) диэтил-2-. (З-окси-4-этилгексил) амино нонандиоат ;
11в) диэтил-2- (3-циклобутил-Зоксипропил)амино нонандиоат;
12в) диэтил-2- (3-циклопентил-З-оксипропил)аминоЗ нонандиоат;
13в) диэтил-2- З-окси-4,4-диметил-5-(3-трифторметилфенил)пентил амино нонандиоат;
14в) диэтил-2- (3-циклогексил-Зоксипропил)аминб нонандиоат;
15в) диэтил-2- (3-циклогептил-Зчэксипропил) амянб нонандиоат;
16в) диэтил-2- (3-окси-З-фенилпропил)амино нонандиоат;
17в) диэтил-2- (З-окси-4-фенилбутил) амино нонандиоат;
, 18в) диэтил-2- {(З-оксиоктил) амино пентандиоат;
19в) диэтил-2- (З-оксиоктил)амино | ундбцандиоат;
20в) этил-2- (3-оксиоктил) амино -3-(3-зтоксикарбонилметоксифенил)пропионат;
21в) этил-2- (З-окси-4,4-диметилпентйл)амино -3-(З-этоксикарбонилметоксифенил)пропионат;
22в) этил-2-(3-оксиоктиламино)(2-этоксикарбонилэтил)фенил пропионат;
23в) этил-2-(3-циклобутил-З-оксипропиламино)-3- З-{2-этоксйкарбЬнилэтил)фенилЗ пропионат;
24в) этил-2-(3-циклопентил-З-оксипропиламино)(2-этоксикарбонил)этилфенил) пропионат;
25в) этил-2-(3-циклогексил-З-оксипропиламино)(2-этоксикаобонилэтил)фенилЗпропионат;
26в) диэтил-2-(З-оксиоктиламино)-7-оксанонандиоат;
27в) диэтил-2-ЧЗ-циклопентил-З-оксипропиламино)-7-оксанонандиоат, из которых получают гидантонны формулы I. -.
3с) 5-(6-Карбоксигексил)-1-(3-оксипентил)гидантоин, бесцветное масло, диастереоизомеры, т.пл. 71-73 и 56-5В С;
4с) 5-(6-карбоксигексил)-1-(3-окси-4,4-диметилпентил)гидантоин, диастереоизомеры, т.пл..114-115 и 144-146°С;
5с) 5-(6-карбоксигексил)-1-(3-окси-4-метилпентил)гидантоин, т.пл. V70-80°C, диастереоизомеры с т.пл. 73-76 и ИО-111°С;
6с) 5-(6-карбоксигексил)-1-(3юксинонил)гидантоин, вязкое масло;
7с) 5-(6-карбоксигексил)-1-(3окси-4-метилоктил)гидантоин, вязкое масло;
8с) 5-(6-карбоксигексил)-1-(3юксидецил)гидантоик, вязкое масло, диастереоизомеры, т.пл. 68-70 и 82-830С;
9с) 5-(6-карбоксигексил)-1-(3-окси-4,4-диметилоктил)гидантоин в виде бесцветных кристаллов, т.пл. 9098 с, один изомер выделяется при помощи кристаллизации из этилацетата т.пл. 103-104С;
10с) 5-(6-карбоксигексил)-1-(3-окси-4-этилгексил)гидантоин, Т.ПЛ. 70-80 0, диастереоиэомеры с т.пл. 82-84 и 120-122 С;
11с) 5-(6-карбоксигексил)-1-(3Н1иклобутил-3-оксипропил)гидантоин, диастереоизомеры, т.пл. 114-116 и 103-105°С;
12с) 5-(6-карбоксигексил)-1-(3-циклопентил-3-оксипропил)гидантоин, диастереоизомеры, т.пл. 116-117 и 97-99°С;
13с) 5-(6-карбоксигексил)-1-(3 кси-4,4-диметил-5-триф орметилфенил пентил)гидантоин, диастереоизомеры, т.пл. 118-120 и 145-147 С;
14с) 5-(6-карбоксигексил)-1-(3-циклогексил-3-оксипропил)гидантоин, диастереоизомеры, т.пл. 96-98 и 124-12бС; .
15с) 5-(6-карбоксигексил)-1-(3-циклогептил-3-оксипропил)гидантоин, т.пл. -70-76°С, диастереоизомеры с-т.пл. 107-109 и 107-109С;
16с) 5-(6-карбоксигексил)-1-(3-окси-3-фенилпропил)гидантоин,диастереоизомеры образуют бесцветное вязкое масло;
17с) 5-(6-карбоксигексил)-1-(3-окси-4-фенилбутил)гидантоин, диастереоизомеры, т.пл. 102-104 и б1-630С;
18с) 5-(3-карбоксипропил)-1-(3чэксиоктил) гидантоин, диастереоизомеры образуют бесдветное вязкое масло;
19с) 5-(8-карбоксиоктил)-1-(3-оксоктил) гидантоин, диастереоизомеры, т.пл. 57-60 и 69-71°С:
.20с) 5-(3-карбоксиметоксибензил)-1-(3-рксиоктил)гидантоин, бесцветное масло;
21с) 5-(3-карбоксиметоксибензил)-1- (3-окси-4,4-,диметилпентил) гидантоин, диастереоизомеры с т.пл.100-10 и 151-154 С;
22с) 5- р-(2-карбоксиэтилбензил) -1-(3-оксиоктил)гидантоин, один диастереоизомер с т.пл. 82-86 С;
23с) 5- З- (2-карбоксиэтилбензил)Л-(3-циклобутил-З-оксипропил)гидантоин, один диастереоизомер с т.пл. 118-121 С;
24с) 5- З- (2-карбоксиэтилбензил)Ц.-(3-циклопентил-З-оксипропил)гидантоин; одиндиастереоизомер с т.пл. 140-143°С;
25с) 5- 3-(2-карбоксиэтилбензил) 1- 3-циклогексил-З-оксипропил гидантои
26с) 5-(4-карбоксиметоксибутил)-1- (3-оксиоктил) гидантоин;
27с) 5-(4-карбоксиметокси-бутил)1- (З-циклопентил-З-оксипропил) гидантоин.
Исходные продукты получают следующим образом.
A.Аналогично примеру 1А получаю диэтил-2-аминопентандиоат с
т.кип. 93-9б°С/0,02 мм;п 1,4425/ и диэтил-2-ундецандиоат с т.кип.,1 мм, которые были использованы в примерах 18 и 19 соответственно.
B.Этил-2-амино-З-(3-этоксикарбонилметоксифенил)пропионат.
2,60 г диэтилацетамидомалоната и 2,39 г этил-3-(хлорометил)феноксиацетата, растворяют в растворе этилата натрия, приготовленном из 230 мг Натрия и 10 мл этанола, и кипятят с обратным холодильником в течение 19 ч. Охлаждённый раствор выливают в ледяную воду, экстрагируют эфиром, эфирный экстракт высушивают и упаривают. Остаток кристаллизуют из эфир-гексана и получают диэтилацетамидо-(3-этоксикарбонилметоксифенил)малонат в виде белых призм с т.пл. 98,5-101,5 С. Этот продукт (1,90 мл) кипятят с обратны холодильником Вх 25 мл 10%-ной соляной кислоты в течение 3,5ч и затем упаривают в вакууме. Остаток растворяют в минимальном количестве абсолютного этанола и добавляют по каплям к перемешиваемой охлажденной до минус смеси 15 мл абсолютного этанола и 1,64 г тионилхлорида. Полученный раствор оставляют при комнатной температуре на 18 ч, затем кипятят с обратным .холодильником в течение 1 ч, охлаждают и выливают в ледяную воду, после чего доводят до рН 9-10 водным раствором гидроокиси натрия. CNiecb экстрагируют эфиром, эфирный экстракт концентрируют, получают этил-2-амино-З-(3-этоксикарбонилметоксифенил)пропионат в виде бесцветного масла, который используют без дальнейшей очистки (примеры 20 и 21) .
C.Этил-2-амино-3- З-(2-этоксикарбонилэтил)фенил пропионат.
Раствор 4,04 г диизопропиламина и 25 мл бутиллития (1,60 М в гексане) в 40 мл сухого тётрагидрофурана перемешивают при минус в токе сухого азота, а затем обрабатывают в течение 5 мин трет -бутилацетатом в количестве 4,64 г. К этому раствору добавляют в течение. 5 мин раствор 11,6 г о(, , о -дибром-т-ксилена-и 1,42 г сухого гексаметилфосфорамида в 8,0 мл сухого тётрагидрофуран Полученный желтый раствор перемешивают при минус 78с в течение
0,5 ч, затем оставляют при комнатной температуре на 3 ч.
После этого добавляют ледяную воду и смесь экстрагируют эфиром, а экстракт промывают 60 мл 1 н. соляной кислоты, а затем водой. Высушенны экстракт концентрируют в вакууме, получают желтое масло, котор очищают колоночной хроматографией (силикагель, 1:1 эфир/гексан), в результате чего получают трет-бутил-3-(3-бромметилфенил)пропионат в виде бесцветного масла, который используют в примерах 22-25.
Д. Диэтил-2-амино-7-оксанонандионат.
Получают из этил-4-бромбутоксиапетата аналогично описанному бесцветное масло с т.кип. 120-12lc/ 0,005 мм.
Пример 28. 5-(6-Карбоксигексил)-1-(3-оксооктил)гидантоин.
7,7 г диэтил-2-(3-оксооктиламино нонандиоата смешивают с цианатом калия и соляной кислотой и получают 5-(6-этоксикарбонилгексил)-1-(3-оксооктил) гидантоина.
Гидролиз указанного эфира раствором гидроокиси натрия дает 5-(6-карбоксигексил)-1-(3-оксооктил гидантоин в виде вязкого масла, который кристаллизуется в низкоплавкое твердое вещество.
П р и м е р 29. 5-(6-Карбоксигексил)-1-(3-фенилпентил)гидантоин . .
Смесь 25f9 г диэтил-2-аминонандодиоата и 22,7 г 5-фенилпентилбромида нагревают при ЮОс в течение 3 ч. После охлаждения к смеси добавляют 100 мл эфира и оставляют в течение 2 ч при О С. Бесцветное твердое вещество в количестве 21,95 г, которое кристаллизуется при стоянии, отфильтровывают и высушивают. Этот гидробромид диэтил-2- (5-фенилпёнтил) амино нонандиоата плавится при 70-72°С.
Раствор полученного гидробромида (4,86 г) в 20 мл этанола и 5 мл 2 н соляной кислоты охлаждают в ледяной бане и при перемешивании добавляют раствор 1,62 г цианата калия в 5 мл воды, после чего реак|ЦИОнную смесь оставляют при комнатной температуре на 18 ч. Затем спирт отгоняют, добавляют воду, экстрагируют эфиром, высушивают и упаривают, Получаиот масло, которое нагревают на водяной бане в течение 6 ч, в результате чего получают 5-(6-этокоикарбонилгексил)-1-(5-фенилпёнтил) гидантоин.
Указаннъай эфир в количестве 4,0 г обрабатывают разбавленным раствором гидроокиси натрия и очищают хрома65 тографией на силикагеле. Получают
5-(6-карбоксигексил)-1-{5-фенилпентил)гидантоин в виде бесцветных призматических с т.пл. 90-92с из этилацетата - петролейного эфира с т.кип.60-80°С.
Примеры 30-36. Аналогично примеру 28 получают:
ЗОа) диэтил-2-октиламинононандиоат;
31а) диэтил-2-(4-пропрксибутил)аминононандиоат;
32а) диэтил-2-(4-феноксибутил)аминононандиоат;
ЗЗа) диэтил-2-(4-л-трифторметилфеноксибутил)аминононандиоат;
34а) диэтил-2-(3-М-толилоксипропил)аминононандиоат;
35а) диэтил-2-(3-гидроксипропил)аминононандиоат;
Зба) диэтил-2-(3-гидрокси-З-метиоктил)аминононандионат; которые превращают в гидактоины:
ЗОв) 5-(6-этоксикарбонилгексил)-1-октилгидантоин, т.пл. 46-48 -С;
ЗОв) 5-(6-карбоксигексил)-1-октилгидантоин, т.пл. 88-89°С;
31в) 5- (6-карбоксигексил)-1-(4лропоксибутил)гидантоин, т.пл. 72-74°С;
32в) 5-(6-карбоксигексил)-1-(4-феноксибутил)гидантоин, т.пл. 8390°С;
ЗЗв) 5-(6-карбоксигексил)-1-(4-ц-трифторметилфеноксибутил)гидантоин, т.пл. 51-54°С;
34в) 5-(6-карбоксигексил)-1-(3-н-толилоксипропил)гидантоин, бесцветное вязкое масло;
ЗЗв) 5-(6-карбоксигексил)-1-(3-гидроксипропйл)гидантоин, т.пл. 111ИЗ С;
Збв) 5-(6-карбоксигексил)-1-(3-окси-3-метилоктил)гидантоин, вязкое масло.
При мер 37. 1-(6-Карбоксигексил)-5-октилгидантоин.
16,0 г 2-Амидодеканоиновой кислоты добавляют частями к охлажденной до минус смеси из 70 мл абсолютного этанола и 6 мл хлорида тионила при перемешивании. Полученный раствор оставляют на 2 ч при комнатной температуре, нагревают в течение 1ч с.обратным холодильником, охлаждают, растворяют в ледяной воде и доводят до рН 9 водным раствором гидроокиси натрия. Смесь экстрагируют эфиром, экстракт высушивают, концентрируют, затем перегоняют, в результате чего получают этил-2-аминодеканоат (75%) в Виде бесцветного масла с т.кип.8284 С/0,2 мм.
Раствор полученного аминоэЛира в количестве 18 г и этил-7-бромгеп.таната в количестве 20 г в абсолютном этаноле (50 мл) кипятят с обратным холодильником в течение 24 ч, а
затем этанол отгоняют. Добавка эфира приводит к осаждению гидробромида с т.пл. 98 С. 9ту соль растворяют в малом количестве дихлорметана, обрабатывают эквивалентным количеством триэтиламина, промывают водой и сушат. Отгонка эфира приводит к получению 2-(6-этоксикарбонилгексиламино деканоата (52%) в виде бесцветного вязкого масла с т.кип. 142-144°С/ 0,001 мм.
Этил-2-(6-этоксикарбонилгёксиле1мино)деканоат в количестве 7,4 г подвергают реакции с цианатом калия и соляной кислотой и получают 1-(6-этоксикарбонилгексил)-5-октилгидантоин в виде бесцветных кристаллов ; т.пл. 68-70 0 (из петролейного эфира с т.кип. 60-80°С).
Указанный эЛир в количестве 4,0 г гидролизуют раствором гидроокиси натрия и получают 1-(6-карбоксигексил) -5-октилгидантоин, который кристаллизуют из смеси этилацетата и петролейного эфира (т.кип.60-80 0 в виде бесцветных иголочек с т.пл. 6566°С.
Пример 38. 5-(6-Карбоксигексил)-3-метил-1-октилгидантоин4
Раствор 742 г диэтил-2-октиламинононандиоата и 120 мг метилизоцианата в 7,5 мл сухого эфира выдерживают при комнатной температуре в т.ечёние 48 ч, отгоняют эфир и получают палево-желтое масло в количестве 800 мг. Масло нагревают на водяной бане в течение 2 ч и получают 5-(6-втоксикарбонил)-3 метил-1-октилгидантоин в виде желтого масла.
Полученный эЛир в количестве 650 мг гидролизуют в смеси 2,4 мл этанола и 0,6 мл 5 н. раствора гидроокиси натрия в течение при комнатной температуре. После упаривания этанола целевая кислота экстрагируется эфиром и очищается хроматографией на колонке с силикаге- лем. Получают 5-(6-карбоксигексил)-З-метйл-1-октилгидантоин в виде бес цветного масла.
П р и м е р 39., 5-(6-Карбоксигексил)-3-метил-1-(3-оксиоктил)ги0дантоин.
Диэтил-2- Г(3-оксооктил)aминoJ нонандиоат (пример 28) обрабатывают метилизоцианатом аналогично примет: ру 37 и получают 5-(6-этоксикарбо5нилгексил)-З-метил-1-(3-оксооктил)гидантоин, который гидролизуют до 5-(6-карбоксигексил)-З-метил-1-(3чзксооктил)гидантоина в виде бесцветного масла.
0
Полученную кетокислоту в количестве 1,23 г растворяют в 15 мл 0,25 н. гидроокиси натрия и при перемешивании и охлаждении в ледяной бане вносят боргидрид натрия в количестве 63 мг. После перемешивания
5
при комнатной температуре в течение 3 ч раствор подкисляют и экстрагируют эфиром. Промытый и высушенный эфирный экстракт упаривают, получают масло, которое очищают хроматографией на колонке с силикагелем (элюент-хлороформ и метанол в соотношении 50:1 и получают 5-(6-карбоксигексил)-З-метил-1-(3-гидроксиоктил)гидантоин в виде бесцветного вязкого масла.
Пример40. 1-(6-Карбоксигексил)-З-метиЛ-5-октилгидантоин.
В условиях примера 38 этил-2-(6-этоксикарбонилгексиламино)деканоат превращают в 1-(6-этоксикарбонилгексил)-З-метил-5-октилгидантоин, а затем гидролизуют в 1-(б-карбоксигексил)-З-метил-5-октилгидантоин в виде бесцветного масла.
Пример41. 5-(6-Карбоксигек -2-инил)-1-3-(оксиоктил)гидантоин.
Аналогично примеру 1А реакцией ацетамидомалоната и метил-7-бром-гепт-5-аноата получают диэтилацетамидо-(б-метоксикарб.онилгекс-2- -инил)малонат в виде желтого масла.
Полученный продукт без очистки гидролизуют 5 н. соляной кислотой, перегонкой получают диэтил-2-аминонон-4-инэдиоат с т.кип. 11бс/0,01
Указанное аминосоединение вводят в реакцию с окт-1-эн-З-оном и получают диэтил-2-(З-оксооктил)амино нон-4-инэдиоат, который воссталовлением с натрийборгидридом переводя в диэтил-2- З-оксиоктил) амино |-4-ин диоат.
Обработка этого соединения цианатом калия и соляной кислотой и гидролиз приводят к получению коричневого масла. Очистка при помощи хроматографии в колонке с силикагелем (смесь хлороформа и метанола) дает 5-(б-карбаксигекс-2-инил)-1-(3-оксиоктил)-гидантоин в виде бесцветного масла (смесь диастереоизомеров), показывающего два пятна на хроматограмме: Rt 0,38; 0,44, в .системе хлороформ, метанол, уксусная кислота (90:5:5) на силикагеле. С помощью,жидкостной хроматографии высокого разрешения был выделен один из диастереоизомеров в виде бесцветного, масла, ПМР-спектр (CDClo,) , М.Д.: 0,89 (ЗН, триплет, -СНо); 2,2,2,4 (6Н, мультиплет, -СН, С С-СНг -СН -СО2Н); 3,54 (2Н, триплет, N-CH2-); ,б (1.Н, мультиплет, СН-ОН); 4,11(1Н, триЛлет, NCH-CO-).
Полученное соединение путем каталитического гидролиза переводят в соответствующий 5-(6-карбоксигекс-2-енил)-1-(3-оксиоктил)гидантион.
П р и м е р 42.
А. Этиловый эфир 2-(дибутоксиметил)глицина.
Этиловый эфир N-Формилглицина повергают С-формилированию и полученн соединение превращают в этиловый эф 2- (дибутокси.метил) глицина.
B.1-(6-Карбоксигексил)гидантоин-5-карбоксальдегид.
Смесь 2,0 г -этилового эфира 2-(дибутоксиметил)глицина и 1,82 г этил-7-бромогептаноата нагревают на водяной бане в токе азота в течение 3 ч и получают гидробромид этил-7- f(2,2-либутокси-1-этоксикарбонилэтил)амино гептаноата.
Раствор полученного гидробромида (3,28 г) в этаноле (13 мл) охлаждают ледяной водой и -обрабатывают раствором цианата калия (1,34 в воде (4 .мл), затем 2 н. соляной кислотой (3,63 мл) и перемешивают при комнатной температуре в течение 22 ч. Этанол отгоняют в вакууме осадок встряхивают с водой и эфиром, эфирный раствор отделяют, промывают водой, сушат сульфатом магния. Затем отгоняют эфир, полученное масло нагревают в токе азота при в течение 3 ч и получают 5-дибутоксиметил-1-(6-этоксикарбонилгексил)гидантион в количестве 2,94 г. Его перемешивают с 6 мл эфира, 48 мл воды и 29,4 мл 2 н. гидроокиси натрия при комнатной температуре в течение 1,5 ч, добавляют 50 мл эфира, водную фазу отделяют, охлаждают ледяной водой, перемешивают со свежим эфиром и подкисляют 1 н. соляной кислотой. Эфирный раствор трижды промывалот водой, сушат сульфатом магния, выпаривают и получают 1-(6-карбоксигексил)-5-дибутоксиметилгидантоин в количестве 2,15 г в виде смолисто остатка. При охлаждении 1,89 г полученного остатка в ледяной воде и смешиваниис 8,5 мл концентрированной соляной кислоты из раствора образуется суспензия бесцветных кристаллов. Суспензию оставляют при комнатной температуре на 1,5 ч, разбавляют 10 мл воды и оставляют на 15 мин.Кристаллы затем -отфильтровывают, промывают водой, высушивают в вакууме, суспендируют в 3 эфира, отфильтровывают и получают 1-(6-карбоксигекснл)гидантоин-5-карбоксальдегид в количестве 0,74 г с т.пл. 223,5-225°С.
Найдено, %: С 51,86; Н 6,66; N 10,62.
. (,щo,
Вычислено, %: С 51,56; Н 6,29; N 10,93.
В диметилсульфоксиде - d, укаI ванное соединение существует преимущественно в виде 1-(6-карбоксигексил)-5 оксиметиленгидантоина.
C.1-(.б-Карбоксигексил)-5- (Е)р-З-оксооктилиден) гидаитоин.
, Смесь 20 мг 1-(6-карбоксигексил)гидантоин-5-карбоксиальдегида,
59мг 2-оксогептилидентрифенилЛосфорана и одной капли бензола нагревают в токе азота при в течение 35 мин, охлаждают и добавляют этилацетат. Продукт экстрагируют разбавленным водным раствором бикарбоната натрия, экстракт промывают этилацетатом, подкисляют до кислой реакции по конго красному
1 и. соляной кислотой, а затем экстрагируют эфиром. Эфирный раствор промывают водой, сушат сульфатом магния, упаривают и получают остаток в количестве 25 мг, который идентичен по ЯМР-спектру 1-(б-карбосигексил)-5-((Е)-3-оксооктилиден)гидантоину.,
Д. 1-(6-Кар(боксигексил)-5-((Е)-3-оксиоктилиден)гидантоин.
Раствор 20 мг 1-(б-карбоксигеКсил)-5-((Е)-3-оксорктилиден)гидантоина в 1,5 мл Н2О, содержащий небольшое количество бикарбоната натрия, обрабатывают боргидридом натрия в количестве 5 мг. Через
60мин раствор подкисляют до кислой реакции (конго красное) 1. и. соляной кислотой, экстрагируют этилацетатом, этилацетатный экстракт трижды промывают водой и сушат сульфатом магния. После упаривания этилацетата получают 14 мг палевожелтого остатка, который идентичен по ПМР-спектру 1-(6-карбоксигексил)
5-((Е)-3-оксйоктилиден)гидантоину.
В последующих примерах гидантоины обозначаются следующим образом: соединение 2 - 5-(6-карбоксигексил) -1- (3-оксио-ктил) гидантоин; Соединение 4 - 5-(6-карбоксигексил) -1-(З-окси-4,4-диметилпентил)гидантоин; соединение 6 - 5-(6-карбоксигексил)-1-(оксинонил)гидантоин; соединение 9 - 5-(6-карбоксигексил) -1-(З-окси-4,4-диметилоктил)гидантоин; соединение 11 5-(6-карбоксигексил)-1-(3-окси-З.циклобутилпропил) гидантоин; соединение 12 - 5-(6-карбоксигексил)-1-(3-окси-З-диклопентилпропил)гидантоин; соединение 14 - 5-(6-карбоксигексил) -1-(3-окси-З-циклогексилипропил ) гидантоин; соединение38 5-(6-карбоксигексил)-З-метил-1ИЗ-оксооктил) гидантоин.
Использование отдельных диастереоизомеров указывается по температуре плавления.
П р и м е р А. Сердечно-сосудистые эффекты на крысах.
Крысам - самцам линии Вистар весом 250-350 г с нормальным дав-, лением крови в левую вену внутривенно вводят 60 мкг/кг хлоралозы, а затем анестезию поддерживают хлороформом.Давление крови регистрируют при помощи электронного преобразователя, а частоту биения сердца - при помощи кардиотахомера. Контрольное соединение вводят внутривенно в виде раствора в физрастворе.
В табл.1 показаны данные снижения давления крови под действием гидантоинов.
Таблица 1
Среднее поКонцентранижение кроция, мкг/кг вяного давления, мм.рт.ст.
Соединение 6
40
Соединение 9
22
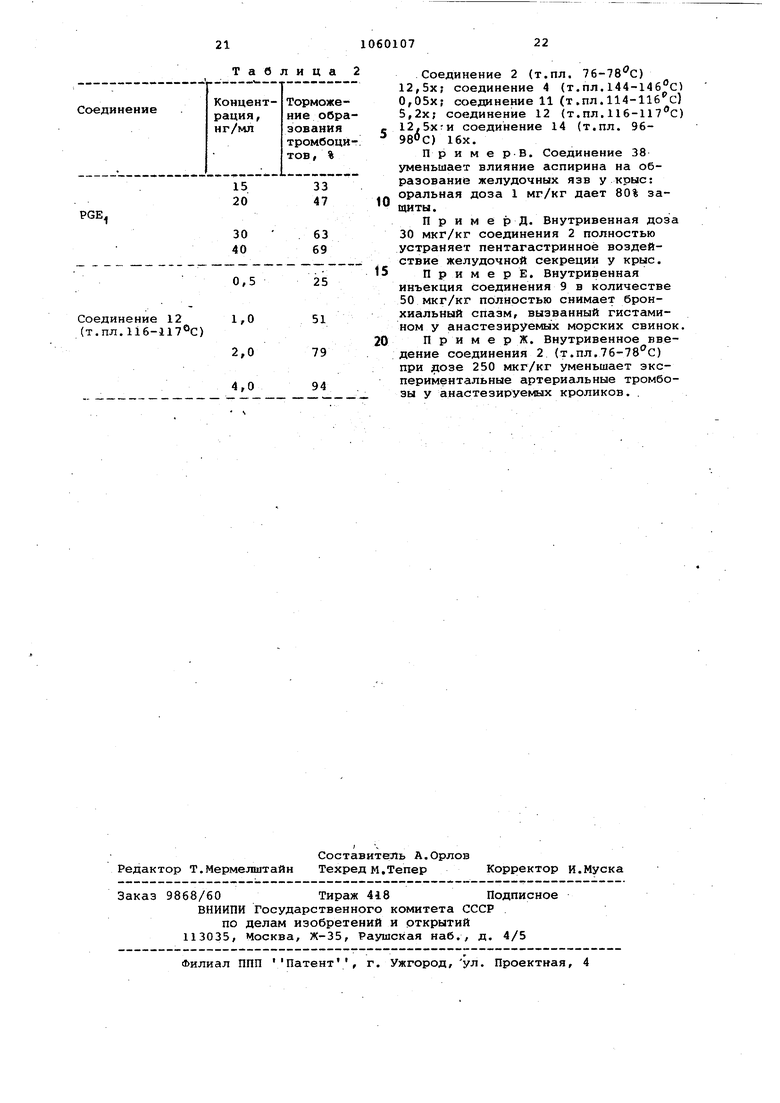
П р и м е р Б. Торможение обра45 зования трог«1боцитов.
Образование тромбоцитов в обогащенной человеческой плазме регистрируют прибором Борна для измерения образования тромбоцитов.
Испытуемое соединение добавляют к плазме и полученную смесь выдерживают при 37 С в течение 1 мин, после чего стимулируют образование тромбоцитов путем добавления гшенозиндифосфата (AD) до концентрации 5 juM.
Угнетение образования тромбоцитов определяют измерения процента роста образования тромбоцитов в присутствии соединения по сравнению с тем, где его не было.
В табл.2 приведены результаты 5 измерения угнетения тромбоцитов.
Таблица 2
PGE.
30
63 40 69
0,5
25
12
1,0
51 79 94 ) 2,0 4,0
Соединение 2 (т.пл. 76-78с) 12,5х; соединение 4 (т.пл. 144-14бс 0,05х; соединение 11 (т .пл. 114-11бс) 5,2х; соединение 12 (т.пл.116-117 С 12.5х:и соединение 14 (т.пл. 969В°С) 16х.
Приме р-В. Соединение 38уменьшает влияние аспирина на образование желудочных язв у крыс: оральная доза 1 мг/кг дает 80% защиты.
П р и м е {э Д. Внутривенная доза 30 мкг/кг соединения 2 полностью устраняет пентагастринноё воздействие желудочной секреции у крыс.
П р и м е р Е. Внутривенная инъекция соединения 9 в количестве 50 мкг/кг полностью снимает бронхиальный спазм, вызванный гистамином у анастезируемых морских свинок
Пример Ж. Внутривенное введение соединения 2 (т.пл.76-78с) при дозе 250 мкг/кг уменьшает экспериментальные артериальные тромбозы у анастезируемых кроликов. .
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| гетероциклические соединения | |||
| Под ред | |||
| Р.Эльдерфильда | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| М | |||
| , 1961, с.204. | |||
Авторы
Даты
1983-12-07—Публикация
1977-06-02—Подача