Способ получения высокофторированных алканов путем контактирования галогенированных алкенов или алканов и фтористого водорода (HF) в присутствии TaFs или NbF4 и избытка HF.
Feiring A. E. Journal of Fluorine Chemistry 13, 7-8 (1979) описывает использование пентафторида тантала в качестве катализатора процесса присоединения фтористого водорода к тетра- и трихлоретену и родственным соединениям. Такой катализатор может быть использован также для реакции обмена фтор-хлор. Применение пентафторида тантала в качестве катализатора реакции присоединения фтористого водорода к ненасыщенным соединениям раскрыто и защищено Feiring V.S. 4, 258, 225.
Потребность в разработке привлекательного в экономическом отношении способа превращения определенных галогенуглеводородов в высокофторированные водородсодержащие алканы, которые могут быть использованы как заменители применяемых сейчас хладагентов, взрывчатых веществ и др., вызвала интерес к исследованиям в данной области. В предлагаемых Feiring условиях, в частности, как указано в V.S.Pat, 4, 259, 225, графа 1, строки с 62-ой по 63-ю, применение TaF5 или NbF5 требует "для получения фторированного алкена введение от 1 до 8 молярных эквивалентов HF в присутствии от 0,01 до 0,25 молярных эквивалентов TaF5 или NbF5. Такие условия способствуют присоединению HF к олефиновым связям исходных галогенированных алкенов, но горазод менее благоприятны для реакций обмена галогенов в получающихся аддуктах. В изобретении раскрывается, что при использовании высоких загрузок определенного катализатора в сочетании с высоким содержанием катализатора и HF по отношению к используемому в качестве исходного материала галогеноуглеводороду возможно прямое получене многих, высокофторированных алканов с экономически привлекательным выходом.
Целью изобретения является обеспечение способа жидкофазного получения 2,2-дихлоро-1,1,1-трифторэтана (HCFC-123э с высоким выходом и низким содержанием других изомеров. Целью изобретения является также обеспечение способа получения CF3CHCl2 высокой чистоты и с высоким выходом, позволяющего применение относительно низких концентраций HF и тем самым сводящего к минимуму обусловленную HF коррозию реактора и необходимость использования дорогостоящего оборудования высокого давления. HCFC-123 является приемлемым для окружающей среды заменителем трихлорфторметана (CFC-11) для использования в качестве растворителя, хладагента, для обработки табака. HCFC-123 является также исходным материалом для производства 2-хлоро-1,1,1,2-тетрафторэтана (HCFC-124) и пентафторэтана (HFC-125), продуктов, приемлемых для окружающей среды, HCFC-124 используется как взрывчатое вещество, хладагент, компонент ракетных топлив, газ-носитель для стерилизации, а также исходный материал для получения 1,1,1,2-тетрафторэтана (HFC-134а) - обладающего нулевым значением потенциала расщепления озона и используемого для замены дихлордифторметана (CFC-12) в качестве хладагента. HFC-124 представляет собой обладающий нулевым значением потенциала расщепления озона заменитель для R-502 (азеотропная смесь хлордифторметана (HCFC-22) и хлорпентафторметана (CFC-115). HFC-125 используется также как сырье для получения тетрафторэтилена (TFE) и является потенциальным кандидтом для замены HCFC-22.
В данном изобретении предлагается способ получения фторированных алканов состава
R1R2R3C - CR4R5R6, где каждая из групп R1, R2, R3, R4, R5 и R6 по отдельности выбирается из элементов H, F и Cl, где по крайней мере одна из групп R1, R2 и R3 представляет собой Н и по крайней мере одна из групп R4, R5 и R6 представляет собой F, путем приведения в контакт при температуре от 0-175оС в основном в условиях отсутствия воды одного молярного эквивалента галогенированного алкена формул
R1R2C = CR2R4, где каждая из групп R1, R2, R3 и R4 в отдельности выбирается из элементов H, F и Cl, c HF, взятым в количестве по меньшей мере стехиометрического молярного эквивалента, в присутствии по меньшей мере 0,25 молярного эквивалента одного, самое меньшее катализатора, который выбирается из пенфафторида тантала (TaF5) или пентафторида ниобия (NbF5), с тем условием, что число молей, х, катализатора в сумме с числом молей, y, HF, отнесенное к числу молей, z, галогенированного исходного вещества, таково, что отношение общего содержания фтора к количеству исходного материала, (5x+y)/z, составляет самое меньшее (6-W), предпочтительно (10-W), где W - это количество атомов фтора в одном моле исходного материала.
Предлагаемое изобретение обеспечивает также получение описанных фторированных алканов в тех же в основном условиях с использованием фторированных алканов формулы
HR1R2C - CR3R4Cl, где каждая из групп R1 и R2 по отдельности выбираются из элементов Н и Cl и где R3 и R4, каждая по отдельности, представляет собой Н, Cl или F.
При проведении процесса в тех же, в основном условиях, данное изобретение обеспечивает также получение фторированных алканов формулы
R1R2R3C - CR4R5 - CR6R7R8, где каждая из групп R1, R2, R3, R4, R5, R6, R7 и R8 отдельно выбирается из элементов H, F и Cl, где самое меньшее одна из групп R4 и R5 представляют собой Н и где самое меньшее одна из групп R6, R7 и R8 представляет собой F, из алкена формулы
R1R2R3C - CR4 = R5R6, где каждая группа R1, R2, R3, R4 и R6, R5 отдельно выбирается среди элементов H, F и Cl. Предпочтение отдается вариантам, когда R1, R2 и R3 индивидуально выбирается из F и Cl, а R4, R5 и R6 представляет собой Cl. Описанные выше фторированные алканы могут быть также получены в тех же в основном условиях их хлорированных алканов формулы
R1R2R3C - CR4R5 - CR6R7R8, где каждая группа R1, R2, R3, R4, R5, R6, R7 и R8 отдельно выбирается из H, F и Cl, с тем условием, что самое меньшее одна из групп R1, R2, R3, R4, R5, R6, R7 и R8 представляет собой Cl. Предпочтительно, чтобы R2, R7 и R8 представляли собой Cl, R4 и R5-F, a R6 было Н.
Все полученные в соответствии с предлагаемым изобретением фторированные алканы отличаются тем, что содержат больше, самое меньшее на один, предпочтительно, более чем на один, атом фтора, чем использованный в качестве исходного сырья галогенированный алкен или алкан, и тем, что по крайней мере один из присутствующих в полученном таким способом фторированном алкане атомов фтора является результатом реакции обмена галогенов.
Изобретение обеспечивает получение фторированных алканов из галогенированных алкенов, содержащих два атома углерода, взаимодействие протекает следующим образом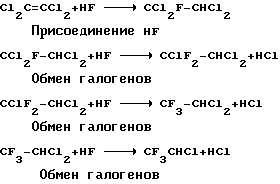 Если исходить из соответствующего алкана с двумя атомами углерода, то реакцию можно представить в следующем виде
Если исходить из соответствующего алкана с двумя атомами углерода, то реакцию можно представить в следующем виде
По изобретению глубину протекания реакций обмена галогенов можно варьировать, одновременно изменяя, в частности, вводимое количество HF и катализатора. Для достижения оптимальной степени обмена галогенов требуется самое меньшее 0,25 молярных эквивалента TaF5 или NbF5 или их смеси, предпочтительно от 0,25 до 5,0 молярных эквивалентов, в расчете на исходный материал. Предпочтительный с точки зрения экономичности и эффективности интервал концентраций составляет 0,27-4,0 молярных эквивалентов. Катализатор, причем предпочтение отдается пентафториду тантала, представляет собой производимый промышленностью твердый кристаллический продукт и может быть использован сам по себе или на носителе, например, на угле или фторированном глиноземе.
Помимо регулирования концентрации катализатора, необходимое также использовать HF в не меньшем, чем установленный минимум, количестве в расчете на исходный галогенуглеводород, для обеспечения оптимальной степени протекания реакции обмена галогенов и таким образом для обеспечения высокого выхода высокофторированных алканов.
При относительно низких, то есть от 0,25 до 0,5 моля на ноль исходного вещества, концентрации катализатора, количество HF, как правило, должно превышать 8 молей на моль исходного вещества и может достигать величины около 30 молей, предпочтительно 15-30 молей на моль исходного вещества. Меньшее число молярных эквивалентов HF, приближающееся к требуемым по стехиометрии пропорциям, можно применять только в сочетании с большим, чем 0,5 моля на моль исходного вещества, число молярных эквивалентов катализатора.
Таким образом, при концентрации пентафторида тантала 1-5 молей на моль исходного вещества можно снизить количество HF до стехиометрического, при условии, что величины концентраций катализатора, HF и исходного вещества обеспечивают высокое значение отношения общего количества фтора к количеству исходного вещества, определение которого дано выше. Другими словами, при делении (5x+y) на z частное должно быть равно по крайней мере (6-W), предпочтительно не меньше (10-W), где х - это число используемых молей HF и z - число молей исходного, подвергаемого фторированию вещества, а W - число атомов фтора в исходном веществе.
В предпочтительном варианте относительные пропорции реагентов должны быть таковы, чтобы указанное соотношение (5x+y)/z принимало значение в интервале 15/1-3/1. Более высокие значения дают небольшое дополнительное преимущество или даже никакого. Например, в производстве HCFC-123 из CCl2= CCl2 (где W = 0, поскольку в исходном материале не содержится фтора) привлекательные результаты можно получить, используя Та, как катализатор, в количестве примерно от 3 до 4 молярных эквивалентов в сочетании с низким (от 3 до 4 молярных эквивалентов) содержанием HF, все в расчете на моль CCl2= CCl2, в в огромной степени сводя тем самым к минимуму производственные проблемы, возникающие при использовании более высоких молярных концентраций HF.
Следует отметить, что пентахлориды Та и Nb могут быть легко превращены в пентафториды за счет взаимодействия с HF при обычных условиях. Следовательно, пентафторид металла, предназначенный для использования в процессе по данному изобретению, можно приготовить непосредственно перед инициированием реакции HF исходное вещество, которая приводит к получению нужного фторированного органического продукта.
Предпочтительные условия осуществления изобретения, когда в качестве исходного галогенированного алкена или алкана используется Cl2С=CCl2, Cl3CCHCl2, CCl2FCHCl2 или CClF2CHCl2, благоприятны для образования CF3CHCl2, а когда исходным галогенированным алкеном или алканом является Cl2C= CHCl, FClC= CHCl, HCl2CCHCl2, HClFCCHCl2, HF2CCHCl2, Cl3CCH2Cl, FCl2CCH2Cl или F2ClCCH2Cl, то условия благоприятны для образования CF3CH2Cl. При использовании в качестве исходного вещества Cl2C=CH, FClC=CH2 или Cl3C-CH3 конечным продуктом может быть CFCl2CH3, CF2ClCH3 и/или CF2CH3,
в зависимости от условий проведения процесса.
В практическом осуществлении предлагаемого изобретения в качестве исходного материала могут быть использованы разнообразные галогенированные алкены или алканы или их смеси. Среди алкентов формулы R1R2C=CR3R4 предпочтение отдается тем, что в составе которых R1 представляет собой Н или Cl, тогда как R1, R2 и R4 - это Cl, или тем, где R1 и R2 представляют собой Н, а R2 иR4 - Cl. Предпочтение среди галогенированных алканов формулы HR1R2C - CR2R4Cl отдается тем, в составе которых R1, R2 R3 и R4 представляют собой Cl, или где R1 это Н, а R2, R3 и R4 это Cl, или где R1 и R2 это Н, а R3 и R4 - Cl.
Особенное предпочтение среди галогенированных алкенов и алканов отдается CCl2= CCl2, CHCl= CCl2, CH2= CCl2, CCl3CHCl2, CHCl2CHCl2, CCl3CH2Cl и
Cl3CH3.
Было найдено, что в производстве из любого указанного сырья CF3CHCl (HCFC-125) образуются также относительно большие количества нежелательных изомеров. Изомеры представлены в основном CClF2CHCl (HCFC-123а) и в меньшей степени CCl2FCHF2(HCFC-123b). Было также обнаружено, что содержание изомеров продуктах реакции можно существенно снизить (вплоть до уровня, не определенного анализом), если продукты остаются в контакте с реакционной массы в продолжение достаточного для достижения нужного низкого содержания изомеров времени. Предполагается, что в понятие "достаточное время" включается время реакции, проводимой в условиях автогенного давления, и время пребывания в условиях непрерывного процесса, когда HF и исходное сырье вместе подаются в жидкую реакционную массу, содержащую пентафторид металла и продукты реакции фторирования, а из нее непрерывно удаляется поток продуктов реакции, причем давление поддерживается за счет контроля количества удаляемых газов. В таком процессе время пребывания определяется, а также контролируется скоростями подачи HF и исходного вещества, температурой и давлением реакции и температурой покидающих реактор газов.
Проведение процесса при условии отсутствия воды или при условии в основном отсутствия воды означает, что вода, представляющая вредное для проведения реакции вещество, должна быть по возможности удалена из зоны реакции. HF в производимом промышленность виде можно непосредственно вводить в реакцию. Галогенированные алкены и алканы, а также катализаторы содержат малые количества воды или совсем ее не содержат и, аналогично, могут быть непосредственно использованы. Удаление влаги из реакционного сосуда с помощью соответствующих влагопоглотителей и т.д. представляет стандартную процедуру и хорошо известно специалистам.
Реакцию можно проводить в виде периодического процесса или непрерывным способом в жидкой фазе при температуре 0-175оС, предпочтительно 60-160оС. Если температура реакции оказывается ниже указанных пределов, реакция замедляется настолько, что не представялет практического интереса, а при температурах, превышающих указанный максимум, снижается выход продуктов за счет побочных реакций и полимеризации.
Реакционный сосуд изготавливают из устойчивых к действию фтористого водорода материалов. В качестве примеров омжно привести нержавеющие стали, сплавы с высоким содержанием никеля, также как монель, "Hastelloy" и "Эnconel", и пластики, такие как полиэтилен, полипропилен, полихлортрифторэтилен и политетрафторэтилен. Предпочтение отдается сплавам с высоким содержанием никеля из-за того, что TaF5 и NbF5 в сочетании с жидким HF представляет собой супер-кислоты. При проведении реакции при температурах ниже точки кипения фтористого водорода (19,5оС) или ниже точки кипения самого легколетучего реагента реакционный сосуд может быть закрыт или открыт в атмосферу, если приняты предосторожности для исключения попадания влаги. В случае проведения реакции при температурах, равных или выше точки кипения фтористого водорода или наиболее летучего компонента, используется закрытый или частично открытый реактор с регулируемым давлением, что имеет целью сведение потерь реагентов до минимального.
Величина давления не является критической. Наиболее удобны и являются поэтому предпочтительными атмосферное или саморегулирующееся (автогенное) давление. Могут быть предусмотрены приспособления для спускания избыточного давления хлористого водорода, образующего в результате реакций замещения, что может благоприятствовать подавлению образования побочных продуктов.
При проведении реакции реагенты вводятся в реактор в любом порядке. Как правило, при проведении процесса в периодическом варианте с саморегулирующим давлением, катализатор и исходный материал помещают в реактор, который затем охлаждается, и в нем конденсируют необходимое количество фтористого водорода. Реактор может быть охлажден сухим льдом или жидким азотом и откачан до введения фтористого водорода, что облегчает реакцию присоединения. Содержание реактора нагревают до соответствующей температуры реакции и перемешивают встряхиванием или агитацией в продолжение периода времени, достаточного для протекания реакции. Время реакции может колебаться от 1 до 1 ч; предпочтение отдается продолжительности 1-6 ч.
Как указывалось выше реакцию фторирования можно проводить непрерывным или полунепрерывным способом, когда HF и исходный галогеноуглеводород подаются в реактор непрерывно или с перерывами, в реакторе находятся пентагалиды Та или Nb при температуре и давлении, обеспечивающих эффективное фторирование исходного вещества и превращение его в требуемый полифторированный продукт. Предпочтительными значениями температуры и давления являются такие, которые обеспечивают газообразное состояние продукта (продуктов), так что становится возможным непрерывное или ступенчатое удаление потока продуктов реакции из реакционной зоны. Давление внутри реактора можно контролировать с помощью регулятора давления, а контроль температуры потока продуктов реакции осуществляется при необходимости, с помощью конденсатора-дефлегматора, все эти методы хорошо известны специалистам.
Оказывается удобным инициировать реакцию HF-исходный материал с пентагалидом металла в присутствии разбавителя, которым может быть высококипящая инертная жидкость, например, перфторированный эфир, или сам продукт, который желательно получить в результате реакции, например, HCFC-123 в процессе производства HCFC-123. В тех случаях, когда доступным пентагалидом металла является пентахлорид, удобным представляется превратить его в пентафторид, обрабатывая его HF и удаляя являющийся побочным продуктом хлористый водород, до инициирования реакции взаимодействия HF с исходным галогенированным материалом в присутствии пентафторида металла, предпочтительно, тантала.
Продукты выделяют любым из многочисленных хорошо известных способов, например, дистилляцией или вымораживанием, промыванием водным раствором едкого натра, затем водой и последующим высушиванием на молекулярных ситах. Особые методики выделения включают поглощене водным раствором HCl концентрации 20,7% , предварительно охлажденным до -60оС. Такой способ позволяет собирать продукты, точка кипения которых ниже температуры льда. Поглощенные продукты могут быть далее очищены фракционной дистилляцией.
Высокофторированные алканы, получаемые по предлагаемому способу, используются в качестве хладагентов, растворителей и т.д. Особенно полезны те из них, в состав которых входит водород, поскольку они обладают менее явно выраженным воздействием на окружающую среду. Они могут также использоваться как сырье для получения других полезных соединений.
В приводимых примерах все составные части приводятся в молярных отношениях, а все температуры - по шкале Цельсия. Во всех реакциях использовался производимый промышленностью безводный HF, и все реакции проводились в отсутствии воды. Смеси полученных продуктов анализировались с помощью газовой хроматографии (ГХ) и масс-спектроскопии с целью идентификации индивидуальных веществ. В тех случаях, когда приводятся результаты анализа, указываются, если специально не оговариваются, проценты по площади.
П р и м е р 1. В облицованной платиной бомбе нагревали 0,038 моль TaF5, 0,097 моля тетрахлорэтилена и 2,0 моля HF при 150оС в течение 3 ч. Молярное отношение HF/тетрахлорэтилен составляло 20,6, а TaF5/тетрахлорэтилен составило 0,37. До того, как жидкие органические продукты были отделены в системе скрубберов, отходящие газы содержали 95,2% CF3CHCl2, 1,4% CF2ClCHCl2 и 0,9% CF3CHFCl.
П р и м е р 2. Следовали процедуре, описанной в примере 1, за исключением того, что вместо тетрахлорэтилена использовали 0,100 моля CFClCHCl. Молярное отношения HF/CF2ClCHCl составило 20, а TaF5/CF2ClCHCl 0,36. Отходящие газы содержали 96,6% Cf3CHCl2, 1,7% Cf2ClCHCl2 и 0,9% CF3CHFCl.
П р и м е р 3. В сосуде высокого давления из нержавеющей стали, снабженном клапаном, перемешивали, нагревая в течение 2 ч при температуре около 108оС, 0,072 моля TaF5, 0,175 моля тетрахлороэтилена и 3,83 моля безводного HF. Молярное отношение HF/тетрахлорэтилен было равно 22,5 и TaF5/тетрахлорэтилен 0,41. Цилиндр охладили до -70оС, и присутствовавший HCl отравили. Оставшиеся летучие отсосали в газовый цилиндр, охлажденный до -70оС, нагревая одновременно сосуд давления. Эти летучие поглощались водным раствором HCl концентрации 20,7%, предварительно охлажденным до -60оС, и поддерживались далее при близкой к этой температуре, 17,0 г бесцветного масла, собранного после поглощения летучих и промывки водой, содержали 20,4% CF3CHCl2, 0,6% CF2ClCHClF, 77,9% CF2ClCHCl2, 0,5% CfCl2CHCl2 и 0,2% смеси CF2ClFCl и CF2ClCHF2.
П р и м е р 4. В соответствии с примером 3 использовали 0,071 моль TaF5, 0,184 моля тетрахлорэтилена и 3,78 моля безводного HF и проводили реакцию при температуре около 130оС в течение 2 ч. Молярное отношение HF/тетрахлорэтилен составило 20,5 и TaF5/тетрахлорэтилен 0,39. В 14,0 г выделенной органической жидкости содержалось 64,7% CF3ClCl2, 34,0% CF2ClCHCl2, 0,3% CFCl2CHCl2 и 0,3% смеси CF3CHFCl и CF2ClCHF2.
П р и м м е р 5. В соответствии с описанной в примере 3 методикой проводили реакцию в течение 2 ч при температуре около 110оС, используя 0,063 моля TaF5, 0,172 моля пентахлорэтилена и 3,72 моля безводного HF. Молярное отношение HF/пентахлорэтан составило 21,6 и TaF5/пентахлорэтан 0,36. В 17,0 г выделенной органической жидкости определили 15,4% CF3CHCl2, 0,8% CF2ClCHFCl, 82,5% CF2ClCHCl2, 0,5% CFCl2CHCl2 и 0,5% смеси CF3CHFCl и CF2ClCHF2.
П р и м е р 6. В соответствии с описанной в примере 3 процедурой в реакцию ввели 0,072 моля TaF5, 0,194 моля тетрахлорэтилена и 3,91 моля безводного HF, нагревая при температуре около -150оС в течение 2 ч. Молярное отношение HF/тетрахлорэтилен составило 2/G- и TaF5/тетрахлорэтилен 0,37. В 10 г выделенной органической жидкости обнаружено 97,2% CF3CHCl2, 1,2% CF2ClCHCl2 и 1,0% смеси CF3CHFCl и CF2ClCHF2.
П р и м е р 7. Следовали методике, описанной в примере 6, но использовали другой способ выделения конечных продуктов. Молярное отношение HF/тетрахлорэтилен составило 19,8 и TaF5/тетрахлорэтилен 0,36. После проведения реакции при примерно 150оС в течение 2 ч отравили летучие из сосуд давления непосредственно в горячем виде в водный раствор HCl концентрации 20,7% при -50оС. Собранный в виде бесцветной органической жидкости продукт, состоящий на 97,0% из CF3CHCl2, содержал, как показала инфракрасная спектроскопия, максимум 1% CF2ClCHFCl.
П р и м е р 8. Процесс проводили в соответствии с описанной в примере 3 методикой, используя 0,076 моля TaF5, 0,283 моля асимметричного (as) тетрахлорэтана (CCl3CH2Cl) и 3,96 моля HF и проводя реакцию при примерно 85оС в течение 2,5 ч. Молярное отношение HF/CCl3CH2Cl составило 14,0 и TaF5/CCl3CH2Cl 0,27. Выделенные органические продукты, находящиеся при температуре выше 15оС в газообразном состоянии, состояли на 95,4% из CF3CH2Cl и содержали 0,9% CF2=CCl2 и 0,7% CCl2=CHCl.
П р и м е р 9. Процесс проводили в соответствии с методикой примера 3, используя 0,079 моля TaF5, 0,296 моля трихлорэтилена и 4,12 моля HF, реакцию проводили при температуре около 102оС в течение 2 ч. Молярное отношение HF/трихлорэтилен было 13,9 и TaF5/трихлорэтилен 0,27. Выделенные летучие органические продукты, газообразные при температуре выше 15оС, состояли на 95,2% из CF3CH2Cl и содержали 0,1% CF3CH3, 3,9% изомеров C4H3ClF6, 0,1% изомеров C3HClF6 и 0,4% изомеров C5H4F6.
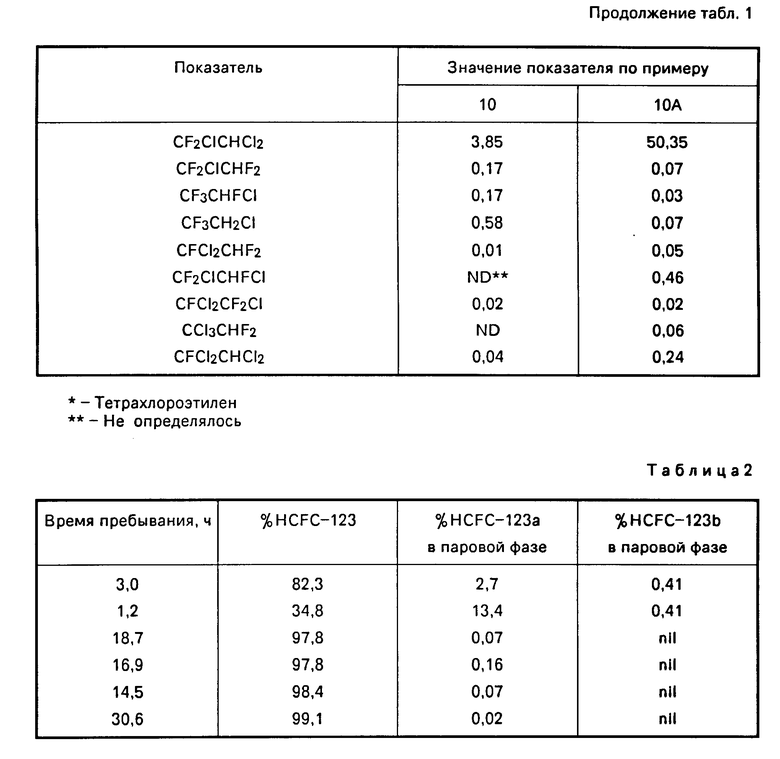
П р и м е р 10. В стальной цилиндр высокого давления из нержавеющей стали емкостью 150 мл поместили 0,093 моля TaF5. Затем клапан цилиндра был закрыт, после чего в цилиндр при температуре около -70оС и под вакуумом было добавлено 0,366 моля тетрахлорэтилена и 3,698 моля HF. Далее цилиндр нагрели до комнатной температуры и поместили на предварительно нагретую масляную баню. Содержимое цилиндра перемешивали магнитной мешалкой и нагревали до температуры реакции в продолжение более 15-20 мин. Процесс протекал при температуре реакции от 143 до 150оС в течение 2 ч, после чего цилиндр охладили до примерно -70оС. Стравили все содержимое цилиндра, несконденсировавшееся при -70оС (в основном HCl). Затем летучие (органика плюс непрореагировавший HF) отогнаны под вакуумом в циилндр-приемник, в котором поддерживалась температура около -70оС после нагрева реакционного цилиндра до примерно 100оС. Летучие поглощали 20,7% водной HCl при температуре около -50оС. Собрали отделенную органическую жидкость и высушили над молекулярными ситами (4 /4  /). Провели анализ органической жидкости с помощью газовой хроматографии и масс-спектроскопии, результаты которого приведены в табл. 1. Было определено, что остаток в реакционном цилиндре из нержавеющей стали содержит только соединение восстановленного Та и продукты коррозии.
/). Провели анализ органической жидкости с помощью газовой хроматографии и масс-спектроскопии, результаты которого приведены в табл. 1. Было определено, что остаток в реакционном цилиндре из нержавеющей стали содержит только соединение восстановленного Та и продукты коррозии.
П р и м е р 10А (сравнительный). Процесс проводили, как описано в примере 10, за исключением того, что использовали 0,034 моля TaF5, 0,383 моля тетрахлорэтилена и 3,838 моля HF. В результате, как показано в табл.1, обнаружилось, что только одно присутствие высокой концентрации HF не обеспечивает высокого выхода нужного высокофторированого алкана, в данном случае - 2,2-дихлоро-1,1,1-трифтороэтана (CF3CHCl2).
П р и м е р 11. В сухой цилиндр из нержавеющей стали емкостью 150 мл, снабженный клапанным затвором и магнитной мешалкой с покрытием из политетрафтороэтилена (тефлон) и находящйся в сухом боксе, наполненном сухим азотом, поместили 225 г (0,815 моля) TaF5 (чистотой 99%). Цилиндр закрыли, наполнили ND до давления 500 psig, охладили смесью сухого льда и этанола и откачали. Затем в цилиндр добавили 39,7 г (0,239 моля) тетрахлорэтилена и 15,7 г (0,785 моля) безводного HF. Затем цилиндр закрыли, оставили нагреваться до комнатной температуры и поместили на предварительно нагретую до 155оС масляную баню. Включили магнитное перемешивание и выдерживали реакциоинную смесь в течение 30 мин для установления теплового равновесия. При температуре масляной бани 149-150оС спустя 120 мин из реактора отбирали пробы пара в водный раствор HCl концентрации 20,7%, охлажденный предварительно до примерно -50оС.
Отделили жидкие органические вещества, высушили на молекулярных ситах и подвергли с целью определения состава газовой хроматографии. Анализ показал, что в процессе подогрева 85% тетрахлорэтилена превратилось в смесь, состоящую в мас.%: из 5% CCl2FCHCl2 (HCFC-121), 40% CClF2CHCl2 (HCFC-122) и 40% CF3CHCl2 (HCFC-123) и содержащую также 0,45% CClF2CHClF (HCFC-123a).
После выдержки при 149-150оС в течение 90 мин конверсия CCl2=CCl2 составила 96% , а продукты реакции состояли из 2% CCl2FCHCl2, 18% CClF2CHCl2 и 76% CF3CHCl2 вместе с изомером, CClF2CHClF, не определяемым далее с помощью газовой хроматографии. При продолжении нагрева реакционной смеси реакция продолжалась в малой степени. Очевидно, имевшийся HF был использован в процессе фторирования и при стравливании цилиндра при отборе проб.
Нужно отметить, что в описанном выше опыте молярное отношение TaF5/C2Cl4 было равно 3,41, молярное отношение HF/C2Cl4 составило всего 3,29 (около 10% избытка против стехиометрии), отношение общего количества фтора к количеству C2Cl4 было равно [5x0,815+0,785]/0,239, или 20,3. Следует также отметить, что в этих условиях, то есть при высоком соотношении фтор-С2Cl4, получается CF3CHCl2 с высоким выходом и свободный, в основном от изомеров.
П р и м е р 12. В реактор емкостью 13,5 галлонов, снабженный мешалкой, устройство для подачи HF и CCl2=CCl2, конденсатором и клапаном для сброса давления, загрузили 20,4 фунта (lb3) (0,057 фунт-моля) TaCl5 и 40 фунтов 99,999% CF2ClCl2, который используется в качестве разбавителя на начальной стадии реакции. TaCl5 превратили в TaF5, добавляя при температуре около 25оС и перемешивании избыток безводного HF до прекращения выделения HCl.
Далее полученную смесь TaF5/CF3CHCl2 нагрели при перемешивании до 125оС и выдерживали при температуре 125-132оС, вводя одновременно HF в количестве 2-4,5 фунт/ч и CCl2=CCl2 в количестве 3-8,5 фунт/ч. Весь реакционный период продолжался 150 ч. В продолжение этого периода времени давление реактора изменялось в пределах от 360 до 465 psig, а температура конденсатора - от 80 до 100оС. Указанные вариации условий протекания процесса использовались для определения влияния продолжительности времени пребывания в реакторе на выход и качество нужного продукта (CF3CHCl2). Время пребывания продуктов реакции в реакторе изменяли от 1,2 до 30,6 ч, меняя скорости подачи HF и C2Cl4, температуру реакции и температуру отходящих газов (температуру конденсатора).
Во время опыта отбирались пробы парообразных продуктов, которые анализировались с помощью газовой хроматографии на содержание CCl2F CHF2(HCFC-123b), CF3CHCl2 (HCFC-123), CClF2CHClF (HCFC-123a), причем параметром, по которому определяли качество получаемого HCFC-123, служило содержание в нем изомеров. Результаты анализа представлены в табл.2 в зависимости от времени пребывания, в том порядке, как они были получены.
Результаты показывают, что в условиях проведения процесса с непрерывной подачей реагентов, чем больше время пребывания, тем ниже содеражние нежелательных изомеров в полученном CF3CHCl2.
Как видно в описанном процессе, проведенном с непрерывной подачей реагентов, и молярное отношение HF/C2Cl4, и молярное отношение TaF5/C2Cl4, хотя и менялись в значительной степени в продолжение опыта, все же были достаточно высоки, чтобы обеспечить высокое значение отношения общее содержание фтора : C2Cl4, намного превышающее требуемое значение 10, что привело к получению высокого выхода CF3CHCl2. Далее за счет контроля времени пребывания можно получать CF3CHCl2 в свободном, в значительной степени, от изомеров вида.
П р и м е р 13. Повторили методику примера 12, с тем исключением, что количество TaCl5 было более чем удвоено и соответственно значению 0,135 фунт-моля. Снова было определено, что количество изомеров уменьшается с увеличением времени пребывания, и было также найдено, что увеличение загрузки TaF5 сокращает необходимое для получения свободного в значительной степени от изомеров CF3CHCl2 время пребывания.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИРОВАННЫХ АЛКАНОВ | 1990 |
|
RU2021243C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИРОВАННЫХ АЛКАНОВ | 1990 |
|
RU2021246C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРМЕТАНОВ ИЛИ ФТОРЭТАНОВ | 1990 |
|
RU2043985C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,1,1-ТРИФТОРДИХЛОРЭТАНА И/ИЛИ 1,1,1,2-ТЕТРАФТОРХЛОРЭТАНА | 1990 |
|
RU2015956C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИФТОРОЛЕФИНОВ, ФТОР-1-ЭТИЛЦИКЛОПЕНТЕН И ПЕРФТОР-2,3-ДИХЛОГЕКС-2-ЕН ИЛИ ПЕРФТОР-4,5-ДИХЛОРОКТ-4-ЕН | 1991 |
|
RU2093502C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,1,1-ТРИФТОРДИХЛОРЭТАНА И 1,1,1,2-ТЕТРАФТОРХЛОРЭТАНА | 1988 |
|
RU2007380C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,1,1,2,2-ПЕНТАФТОРЭТАНА | 2003 |
|
RU2328482C2 |
| СПОСОБ ГИДРОГЕНОЛИЗА ГАЛОГЕНУГЛЕВОДОРОДОВ | 1992 |
|
RU2067971C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИРОВАННЫХ УГЛЕВОДОРОДОВ | 1997 |
|
RU2150454C1 |
| СПОСОБ ГИДРОГЕНОЛИЗА И/ИЛИ ДЕГИДРОГАЛОГЕНИРОВАНИЯ ФТОРГАЛОУГЛЕРОДОВ И/ИЛИ ФТОРГАЛОУГЛЕВОДОРОДОВ | 1991 |
|
RU2026279C1 |

Использование: в производстве фторуглеводородов, в частности высокофторированных алканов-заменителей хладагентов, взрывчатых веществ. Сущность изобретения: синтез высокофторированных алканов ведут фторированием одним молярным эквивалентом HF одного из галоидолефина или галоидуглеводорода: CCl2=CCl2, CHCl=CCl2, CH2CCl2, CCl3-CHCl2, CF2Cl-CHCl2, CCl3-CH2Cl, CHCl2-CHCl2, CCl3-CH3, в присутствии катализатора - TaF5, взятого в количестве не менее чем 0,25 мольного эквивалента, при соблюдении соотношения: (5x + y)/z, равного или меньшего, чем (6 - w), где x - число молей катализатора, y - число молей HF; z - число молей исходного галогенированного соединения, w - число атомов фтора в одном моле исходного соединения. 10 з.п.ф-лы, 2 табл.
с по меньшей мере одним стехиометрическим с молярным эквивалентом HF в присутствии катализатора - пентахлорида тантала (TaF5) при 60 - 160oС, отличающийся тем, что катализатор берут в количестве не мнее чем 0,25 моль эквивалента при условии, что число молей x катализатора плюс число молей y HF по отношению к числу молей z галогенированного исходного соединения таково, что отношение общего фтора к исходному материалу (5x + y) / z ≥ 6 - w, где w - число атомов фтора в 1 моль исходного соединения, с получением по меньшей мере одного образующего фторированного алкана со значительным выходом, имеющего более высокое содержание фтора, чем исходный материал.
| Патент США N 4258225, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
Авторы
Даты
1994-10-15—Публикация
1990-12-21—Подача