Данное изобретение относится к фармацевтической композиции в виде таблеток (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-она (Z)-2-бутендиоата (1: 1) и способу ее применения для лечения болезни Паркинсона.
В патенте США 5 273 975 (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-он (Z)-2-бутендиоат (1: 1) заявлен в общем виде, но не раскрыт. Описано только, что данные соединения используют при лечении болезни Паркинсона.
В патенте США 4 389 393 заявлены фармацевтические таблетки с пролонгированным выделением, которые содержат менее 25,8% гидроксипропилметилцеллюлозы. Гидроксипропилметилцеллюлоза используется экстенсивно для производства препаратов с пролонгированным выделением (медленное разложение) в виде таблеток.
В патенте США 5 000 962 описана фармацевтическая композиция в виде таблеток с длительным действием, которые содержат более чем 35-60 мас.% гидроксипропилметилцеллюлозы и в которых в качестве наполнителя используют лактозу. В данном изобретении лактоза не используется.
В Dow's 1995 Formulating for Control Release With Methocel Premium Cellulose Ethers на рисунке 24 на странице 21 изображено использование крахмала с Метоцелом (гидроксипропилметилцеллюлозой) для получения таблеток, содержащих теофиллин. Таблетки данного изобретения не включают теофиллин, но содержат некоторое количество (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-она (Z)-2-бутендиоата (1:1). На рисунке 20 на странице 20 изображено соотношение между размером таблеток и процентом, выделяемым с лактозой. Обычно крахмал используют в количестве до 15-20% для препаративных форм в виде таблеток с немедленным выделением. Однако в таблетках с пролонгированным выделением его не используют, так как считается, что он способствует разложению. В Dow описано использование крахмала (наполнителя) в количестве 52,6%. В таблетках данного изобретения крахмал используют в количестве более 60%.
В международной публикации WO 97/34932 описаны фармацевтические таблетки, содержащие механически разрушенный крахмал, который обеспечивает препаративные формы с задержанным, контролируемым и целевым выделением. В данном изобретении не используют механически разрушенный крахмал.
В международной публикации WO 97/37639 описаны фармацевтические таблетки с контролируемым выделением, содержащие поперечно связанную амилозу и гидроксипропилметилцеллюлозу и 10-30% гидроксипропилметилцеллюлозы. В таблетках данного изобретения поперечно связанная амилоза не используется и они содержат 30-40% гидроксипропилметилцеллюлозы.
В данном изобретении представлена фармацевтическая композиция, которая представляет собой таблетки с пролонгированным выделением для перорального введения, которые содержат:
(a) (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо 0,3-16%, [4,5-ij)]-хинолин-2(1Н)-он (Z)-2-бутендиоат (1:1) (b) крахмал 60-69%, (c) гидроксипропилметилцеллюлозу 30-40%.
Также описан способ лечения людей, страдающих болезнью Паркинсона, который включает пероральное введение эффективного для лечения болезни Паркинсона количества (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij]-хинолин-2(1Н)-она (Z)-2-бутендиоата(1:1).
Подробное описание изобретения
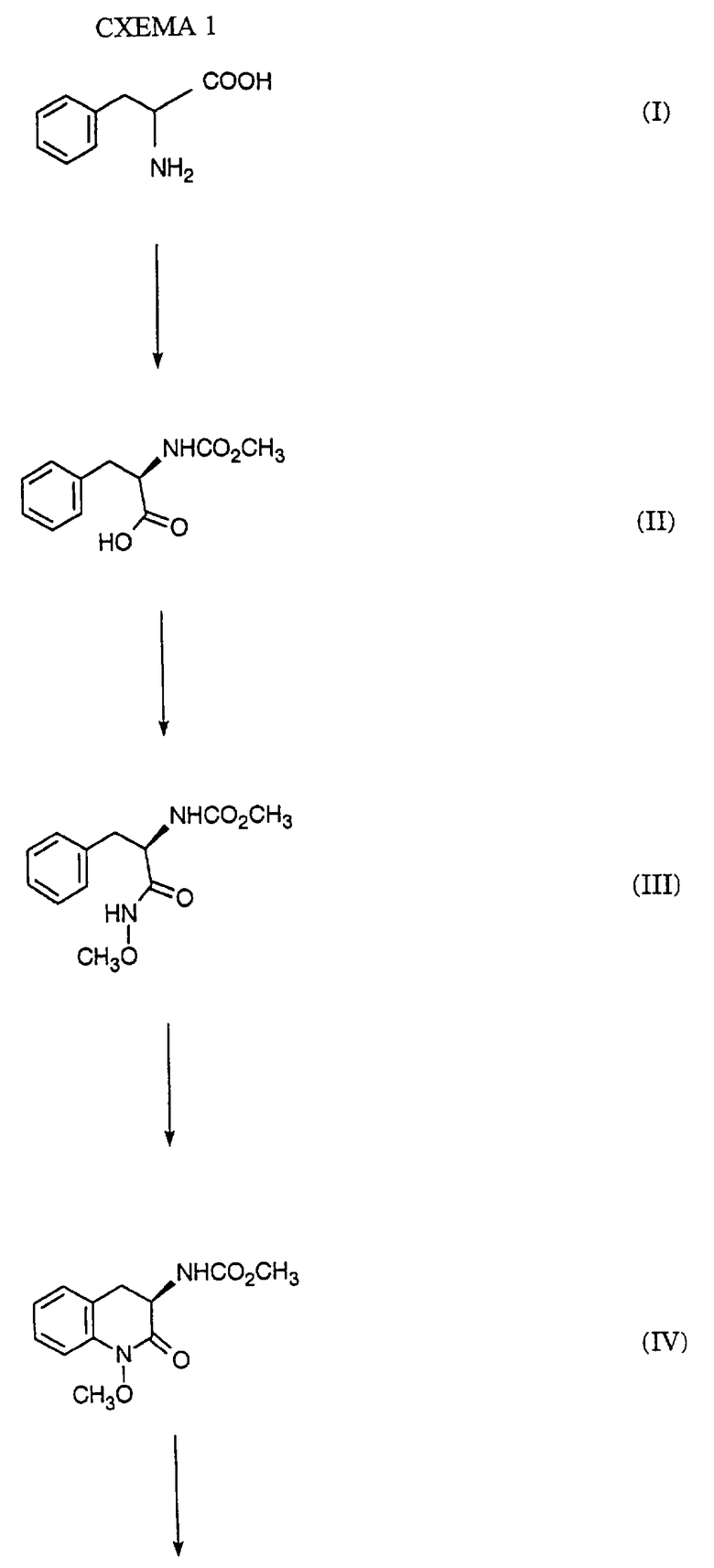
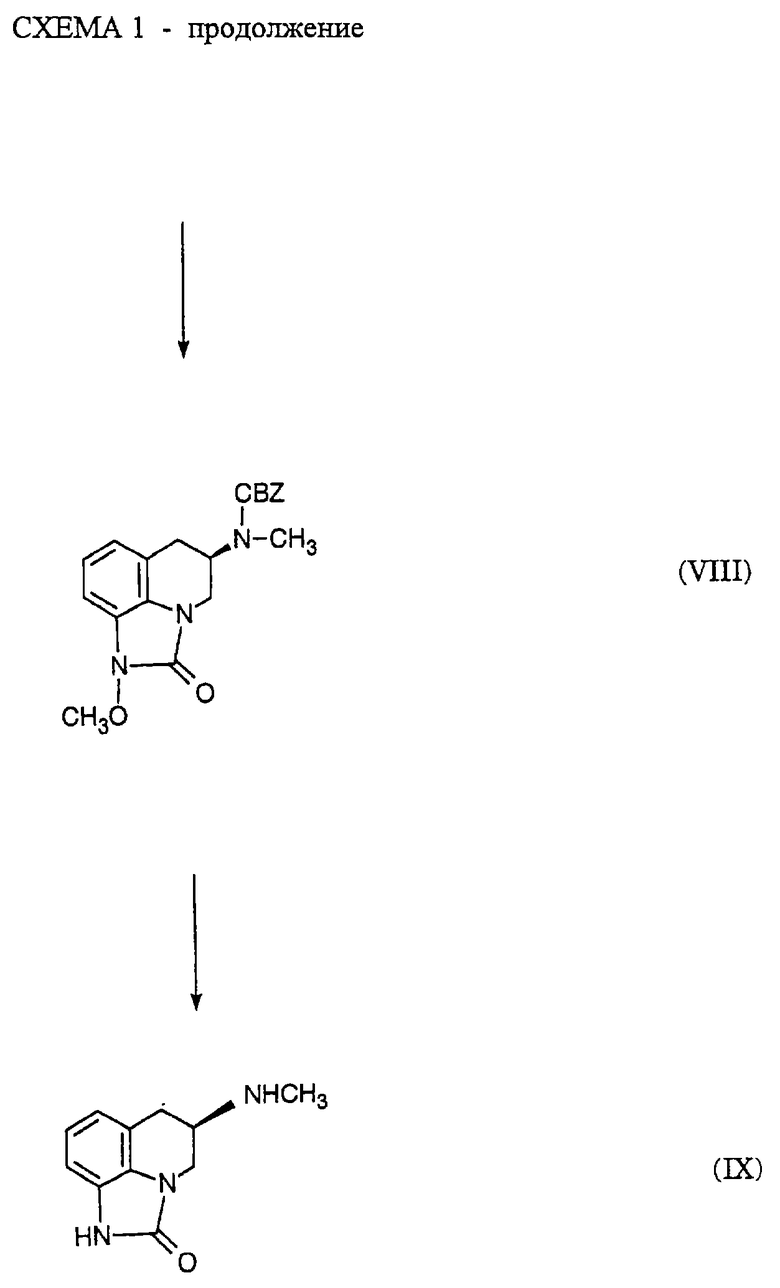
(R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-он (Z)-2-бутендиоат (1:1) получают по методике, описанной на схеме 1 и в примерах 1-8.
Схема 1 представлена в конце описания.
Предпочтительно, чтобы (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-он (Z)-2-бутендиоат (1: 1) вводили в виде капсулы или таблетки, более предпочтительно таблетки. Таблетки содержат следующие компоненты: фармакологически активный ингредиент, крахмал и гидроксипропилметилцеллюлозу.
Количество активного ингредиента, (R)-5,6-дигидро-5-(метиламино) -4Н-имидазо [4, 5-ij] -хинолин-2 (1Н) -она (Z)-2-бутендиоата (1:1), содержащееся в одной таблетке составляет от около 0,3% (1 мг) до около 16% (56 мг) (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-она (Z)-2-бутендиоата (1: 1); предпочтительно от около 0,44% (1,5 мг) до около 10% (35 мг) (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-она (Z)-2-бутендиоата (1: 1)/ таблетку. Необходимо отметить, что 1 мг соли(R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-она (Z)-2-бутендиоата эквивалентен около 0,63 мг свободного основания, (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-она. Предпочтительно, чтобы общий вес таблетки составлял около 350 мг.
Множество различных крахмалов может быть использовано в данном изобретении и эти крахмалы могут применяться вместо друг друга или в сочетании друг с другом в виде смесей. Они включают картофельный, кукурузный, пшеничный, преклейстеризованный крахмал, крахмальный гликолят натрия и их эквиваленты. Предпочтительно, чтобы крахмал являлся либо кукурузным, либо преклейстеризованным крахмалом или их смесью. Крахмал должен присутствовать в количестве от около 60 до около 69%.
Гидроксипропилметилцеллюлоза должна присутствовать в количестве от около 30 до около 40%. Предпочтительно гидроксипропилметилцеллюлоза выбирается из группы, включающей гидроксипропилметилцеллюлозу 2208 USP 100 сП, гидроксипропилметилцеллюлозу 2208 USP 4000 сП, гидроксилропилметилцел-люлозу 2208 USP 15000 сП, гидроксипропилметилцеллюлозу 2208 USP 100000 сП, гидроксипропилметилцеллюлозу 2910 USP 4000 сП, гидроксипропилметилцеллюлозу 2910 USP 10000 сП или их смеси. Предпочтительно, чтобы гидроксипропилметилцеллюлоза представляла собой гидроксипропилметилцеллюлозу 2208 USP 4000 сП или гидроксипропилметилцеллюлозу 2910 USP 4000 сП. Гидроксипропилметилцеллюлоза может представлять собой любую гидроксипропилметилцеллюлозу в чистом виде или в виде смеси.
Предпочтительно, чтобы таблетки содержали стеарат магния, но это не обязательно. Если стеарат магния присутствует, он должен быть в количестве от около 0,2 до около 2,0%.
Предпочтительно, чтобы таблетки содержали коллоидную двуокись кремния, но это не обязательно. Если коллоидная двуокись кремния присутствует, она должна быть в количестве от около 0,2 до около 1,0%.
Как известно специалистам в данной области, другие агенты, такие как подсластители, красители, покрытия и так далее, могут быть добавлены к таблеткам.
Таблетки получают либо осевым сжатием, либо влажной грануляцией, оба способа хорошо известны специалистам в данной области. Если используют способ осевого сжатия, активный ингредиент, (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-он (Z)-2-бутендиоата (1: 1), крахмал и гидроксипропилметилцеллюлозу (и коллоидную двуокись кремния, если используется) сначала отдельно просеивают, а затем смешивают в контейнере или смесителе подходящего размера. Если присутствует стеарат магния, его также просеивают и смешивают с частью материала из контейнера или смесителя и затем материалы тщательно перемешивают. Эту смазанную смесь прессуют в таблетки желаемого веса и физических свойств по методикам, известным специалистам в данной области.
Если используют способ влажной грануляции, получают связывающий раствор, используя гидроксипропилцеллюлозу или повидон (ПВП). Связывающий раствор впрыскивают в смесь фармацевтически активного ингредиента, (R)-5,6-дигидро-5-(метиламино) -4Н-имидазо [4, 5-ij ] -хинолин-2 (1Н) -она (Z)-2-бутендиоата (1:1), и части других ингредиентов, за исключением смазывающего агента (стеарата магния). Влажные гранулы сушат в сушилке, такой как псевдосжиженный слой. Сухую смесь затем смешивают со смазывающим агентом и оставшимися ингредиентами с получением конечной смеси, которую прессуют в таблетки желаемого веса и физических свойств по методикам, известным специалистам в данной области.
(R)-5,6-Дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин -2(1Н)-он (Z)-2-бутендиоата (1: 1), используют при лечении болезни Паркинсона. Его вводят два раза в день перорально в виде таблеток или капсул, предпочтительно таблеток. Так как болезнью Паркинсона страдают взрослые, а дети ей не подвержены, дозу препарата выражают не в мг/кг, а в ежедневной дозе. Предпочтительно, чтобы ((R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-он (Z)-2-бутендиоата (1:1), вводили в количестве от около 2 мг до около 112 мг/день, более предпочтительно от около 3 мг до около 70 мг/день. Предпочтительно, чтобы ежедневная доза была разделена на две равных дозы, так как таблетки с пролонгированным выделением адекватно поддерживают уровень крови при введении два раза в день.
Точная дозировка и частота введения зависят от тяжести состояния больного, его веса, общего физического состояния, других лекарственных препаратов, которые могут вводиться пациентам, хорошо известных специалистам в данной области техники, и может быть более точно определена измерением уровня в крови или концентрации свободного основания (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij]-хинолин-2(1Н)-она (Z)-2-бутендиоата (1:1), в крови пациента и/или восприимчивости пациента к определенному лечимому состоянию.
Определения и условные обозначения
Определения и условные обозначения, представленные ниже, относятся как к описанию, так и к формуле изобретения.
Определения:
Все температуры даны в градусах Цельсия.
ТСХ - тонкослойная хроматография.
ЖХВР - жидкостная хроматография высокого разрешения.
Физиологический раствор - водный насыщенный раствор хлорида натрия.
Хроматография (на колонке и флэш-хроматография) - очистка/отделение соединений, выраженная как (подложка; элюент). Понятно, что соответствующие фракции объединяют и концентрируют с получением желаемого соединения (соединений).
ИК - инфракрасная спектроскопия.
ЯМР - спектроскопия ядерного (протонного) магнитного резонанса, химические сдвиги указаны в чнм (δ) вниз от тетра-метилсилана.
[α] 25 D- угол вращения плоскополяризованного света (определенное оптическое вращение) при температуре 25o с линией натрия D (589A).
МС - масс-спектрометрия, выраженная в m/e, m/z или масс/загрузка единицах. [М+Н]+ относится к положительному иону родительского плюса атома водорода. ЭУ - электронный удар. ХИ - химическая ионизация. ББА - бомбардировка быстрым атомом.
Эфир - диэтиловый эфир.
Термин "фармацевтически приемлемое" относится к свойствам и/или веществам, которые приемлемы пациентом с фармакологической/токсикологической точки зрения, и к производству фармацевтических химических с физической/химической точки зрения относительно композиций, препаративных форм, стабильности, приемлемости для пациента и биодоступности.
Если используется пара растворителей, соотношение растворителей показывают как объем/объем (об/об).
Для указания растворимости твердого вещества в растворителе соотношение твердого вещества к растворителю выражают в мас/об.
Все реакции проводят в атмосфере азота.
Температуры плавления не скорректированы.
Условия ГЖХ: Hewlett-Packard Model 5890A капиллярный газовый хроматограф, J&W Scientific Inc., DB-5,5% колонка фенилметилкремния (15 x 0,53 мм х 1,5 мкм толщина пленки), газ-носитель - гелий (100 мл/мин), определитель водородной пламенной ионизации. Программируемые условия: 100 o, 1 мин/увеличение 20 o/мин до 250 o; 250 o, 10 мин.
Условия ЖХВР: колонка Zorbax Rx-C8 (4,6 мм х 25 см), растворитель А - 10% ацетонитрил и 90% вода (фосфатный буфер рН 3), растворитель В - 85% ацетонитрил и 15% вода (фосфатный буфер рН 3), программируемый градиент: 90% А/10% В до 5% А/95% В в течение свыше 12 мин, сохраняется на уровне 5% А/95% В в течение от 4 до 10 мин; λ=215 нм, поток=2 мл/мин.
USP - фармакопея США
сП - сантипуаз.
ПРИМЕРЫ
Без дальнейшего рассмотрения полагают, что специалист в данной области сможет использовать данное описание и его практическую часть в полном объеме. В представленных ниже подробных примерах описано получение различных соединений и/или представлены различные способы данного изобретения, которые должны быть истолкованы только как иллюстративные, но не ограничивающие объемом данного изобретения. Специалисту в данной области сразу же будут понятны соответствующие изменения в методиках, касающиеся как реагентов, так и условий реакций и методик.
Пример 1
(R)-2-(Метоксикарбониламино)-3-фенилпропановая кислота (II)
Смесь D-фенилаланина (I, 25,00 г, 0,151 моль) и гидроксида натрия (6,05 г, 0,151 моль) в воде (170 мл) и тетрагидрофуране (225 мл) охлаждают до температуры -15o, и по каплям добавляют смесь метилхлорформиата (18,6 г, 0,197 моль) в тетрагидрофуране (50 мл). Когда будет добавлена половина метилхлорформиата, добавляют смесь гидроксида натрия (9,10 г, 0,227 моль) в воде (20 мл). По завершении добавления смесь перемешивают при температуре 25o в течение дополнительных 2 ч и подкисляют соляной кислотой (10%) до рН 2. Смесь экстрагируют дважды эфиром, и экстракты промывают физиологическим раствором и сушат над сульфатом магния. Растворитель удаляют при пониженном давлении с получением целевого соединения, ЯМР (СОСl3) 3,09, 3,19, 3,65, 4,66, 5,25, 7,15-7,31 и 8,22 δ; ИК (тонкая пленка) 1726, 1498, 1455, 1448 и 1377 см-1; МС рассчитано для C11H13NO4 224,0923, найдено 224,0921.
Пример 2
(R)-N-Метокси-2-(метоксикарбониламино)-3-фенилпропанамид
(III) Смесь карбоната натрия (10,20 г, 96,2 ммоль) в воде (170 мл) добавляют к смеси (R)-2-(Метоксикарбониламино)-3-фенилпропановой кислоты (II, пример 1, около 0,148 моль неочищенного вещества) в метиленхлориде. Добавляют метоксиламин гидрохлорид (14,2 г, 0,170 моль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (ЭДК) (31,21 г, 0,163 моль), и смесь перемешивают при температуре 20-25o в течение 22 ч. Смесь разбавляют тетрагидрофураном (для растворения осадка) и слои разделяют. Водный слой экстрагируют 1: 1 тетрагидрофураном/эфиром и объединенные органические экстракты промывают соляной кислотой (10%) и насыщенным раствором бикарбоната натрия. Смесь сушат над сульфатом магния, фильтруют и растворитель удаляют при пониженном давлении. Кристаллизация из этилацетата дает целевое соединение, т. пл. 154-155o; ЯМР (CDCl3) 3,05, 3,58, 3,61, 4,34, 5,66, 7,15-7,31 и 9,44 δ; ИК (минеральное масло) 1694 и 1668 см-1; [α]25D= +5,2o (СН3ОН, с=1,045).
Пример 3
Метиловый эфир (R)-N-(1,2,3,4-тетрагидро-1-метокси-2- оксо-3-хинолинил)карбаминовой кислоты (IV) Суспензию (R)-N-Метокси-2-(метоксикарбониламино)-3-фенилпропанамида (III, пример 2, 11,25 г, 44,6 ммоль) в дихлорметане (170 мл) охлаждают на ледяной бане и добавляют трифторуксусную кислоту (0,25 мл, 13,7 г, 0,120 моль). Порциями добавляют бис(трифторацетокси)йодбензол (19,78 г, 0,046 моль) в течение свыше 10 мин при температуре 0o и смесь перемешивают при этой температуре в течение одного часа. Смесь промывают смесью карбоната натрия (10%) и сушат над сульфатом магния. Растворитель удаляют при пониженном давлении с получением концентрата. Очистка флэш-хроматографией (230-400 меш силикагель, 40-50% этилацетат/гексан) дает желаемый продукт. Аналитический образец кристаллизуют из этилацетата/гексана с получением целевого соединения, т. пл.117-119o; ЯМР (CDCl3) 2,85, 3,44, 3,72, 3,93, 4,42, 5,82, 7,09, 7,33 и 7,22 δ; ИК (минеральное масло) 1722 и 1703 см-1; [α]25 D = +34,2o (СН3ОН, с = 0,927).
Пример 4
(R)-3-Метиламино-1,2,3,4-тетрагидрохинолин малеат (V)
Смесь метилового эфира (R)-N-(1,2,3,4-тетрагидро-1-метокси-2-оксо-3-хинолинил)карбаминовой кислоты (IV, пример 3, 29,1 г, 116,4 ммоль) в сухом тетрагидрофуране (400 мл) охлаждают до температуры 0o и медленно добавляют метилсульфид борана (10,0 М раствор, 70 мл, 6,0 экв.). Смесь нагревают до температуры 25o и перемешивают в течение 2,5 ч. Затем смесь кипятят с обратным холодильником на паровой бане в течение 30 ч и затем охлаждают до температуры 0o, гася добавлением по каплям (осторожно - выделение водорода) соляной кислоты (10%, 160 мл). Эту смесь кипятят с обратным холодильником на паровой бане в течение 1,5 ч, охлаждают во льду и подщелачивают водным гидроксидом натрия (12 N). Смесь экстрагируют дважды эфиром и объединенные экстракты промывают физиологическим раствором и сушат над сульфатом магния. Растворитель удаляют при пониженном давлении с получением концентрата, который используют без дальнейшей очистки. Исследование неочищенного диамина (V) с помощью ГЖХ показало пики в 5,15 мин (2%), 5,46 мин (V, 85%), 5,83 мин (3%) и 7,39 мин (10%). Для получения аналитического образца аликвоту неочищенного соединения (V) кристаллизуют в виде его соли малеиновой кислоты в метаноле/эфире, т. пл.175o;
ЯМР соли малеиновой кислоты ЯМР (СDСl3) 2,64, 2,80, 3,11, 3,20-3,52, 3,55, 5,92, 6,03, 6,53-6,58, 6,927-6,97 и 8,48 δ; [α]25 D = +19,0o (СН3ОН, с= 1,01); ИК (тонкая пленка) 1638 и 1608 см-1.
Пример 5
Фенилметиловый эфир (R)-метил-(1,2,3,4-тетрагидро-3-хинолинил)карбаминовой кислоты (VI)
Смесь (R) -1, 2, 3, 4-тетрагидро-N-метил-3-хинолинамина неочищенного материала, полученного выше (V, пример 4, 15,0 г), приблизительно 84,4 ммоль) в толуоле (50 мл) перемешивают при температуре -40o в течение более одного часа, во время чего добавляют N-(бензилоксикарбонилокси)сукцинимид (24,2 г, 97,1 ммоль) в толуоле (150 мл). Через 30 мин при температуре -40o ГЖХ анализ показал, что все соединение (V) израсходовано. Смесь гасят добавлением бикарбоната натрия (10% водный раствор, 300 мл) и нагревают до температуры 0o с последующим добавлением метанола (100 мл). Эту смесь перемешивают в течение ночи и затем экстрагируют этилацетатом. Сушка над сульфатом магния и удаление растворителя дает жидкость, которую очищают с помощью флэш-хроматографии (230-400 меш силикагель; гексан/этилацетат, 4/1), и затем кристаллизуют из этилацетата/гексана с получением целевого соединения, т. пл. 80o; ЯМР ЯМР (CDCl3) 2,88, 2,80-3,04, 3,30, 3,83, 4,57, 5,16, 6,51, 6,64, 6,96-7,02 и 7,35 δ; [α]25 D = 50,1o (СН3ОН, с = 0,816); ИК (минеральное масло) 1680 и 1606 см-1.
Пример 6
Фенилметиловый эфир (R)-метил-[1,2,3,4-тетрагидро-1-[(метоксиамино)карбонил]-3-хинолинил]карбаминовой кислоты (VII)
Смесь фенилметилового эфира (R)-метил-(1,2,3,4-тетрагидро-3-хинолинил)карбаминовой кислоты (VI, пример 5, 3,81 г, 12,86 ммоль) и триэтиламина (3,9 г, 39 ммоль) в сухом тетрагидрофуране (50 мл) добавляют при перемешивании к смеси фосгена (7,1 мл 1,93 М раствора в толуоле) в тетрагидрофуране (100 мл) при температуре 0o. Через один час добавляют метоксиламин гидрохлорид (2,15 г, 25,7 ммоль) и триэтиламин (3,9 г, 39 ммоль) и смесь перемешивают при температуре 20-25o в течение двух дней. Смесь разбавляют эфиром и промывают водой и физиологическим раствором. Органический слой сушат над сульфатом магния и растворитель удаляют при пониженном давлении. Остаток является достаточно чистым для следующей стадии. Аналитический образец очищают с помощью флэш-хроматографии (230-400 меш силикагель; этилацетат/гексан, 50/50) с получением целевого соединения, ЯМР ЯМР (СDСl3) 2,88, 2,77-2,97, 3,75, 3,52-4,08, 4,54, 5,13, 7,10-7,27, 7,35 и 7,76 δ; ИК (тонкая пленка) 1734, 1697 и 1605 см-1; [α]25 D = +38o (СН3ОН, с=0,980), МС рассчитано для C20H23N3O4 369,1688, найдено 369,1682.
Пример 7
Фенилметиловый эфир (R)-метил-(1,2,5,6-тетрагидро-1-метокси-2-оксо-4Н-имидазо[4,5,1-ij]хинолинил-5-ил) карбаминовой кислоты (VIII)
Смесь фенилметилового эфира (R)-метил-[1,2,3,4-тетрагидро-1-[(метоксиамино)карбонил] -3-хинолинил] карбаминовой кислоты (VII, пример 6, 7,26 г, 19,7 ммоль) в хлороформе (150 мл) охлаждают до температуры -5o на солевой ледяной бане. Добавляют бис(трифторацетокси)йодбензол (10,14 г, 23,6 ммоль) и смесь перемешивают при температуре от -5o до 0o в течение четырех часов и затем при температуре 20-25o в течение еще двух часов, во время чего завершение реакции определяют с помощью ТСХ. Реакционную смесь промывают 10% водным карбонатом натрия, повторно экстрагируя водные фракции эфиром. Объединенные органические слои сушат над сульфатом магния и растворитель удаляют при пониженном давлении с получением концентрата. Очистка концентрата с помощью флэш-хроматографии (230-400 меш силикагель; этилацетат/гексан, 50/50) дает продукт. ЖХВР анализ показывает два пика, 10,79 мин (97,4%) и 11,95 мин (2,6%). Аналитический образец (0,54 г) кристаллизуют из этилацетата/гексана с получением целевого соединения, т. пл. 105-106,5o; ЯМР (СDСl3) 2,93, 2,90-3,30, 3,14, 3,68, 4,07, 4,11, 4,65, 5,16, 6,88, 6,96, 7,04 и 7,36 δ; ИК (минеральное масло) 1725, 1717 и 1694 см-1; [α]25 D+ 46,8o (СН3ОН, с = 0,731).
Пример 8
(R)-5,6-Дигидро-5-(метиламино)-4Н-имидазо[4,5,1-ij] -хинолин-2(1Н)-он малеат (IX)
Смесь фенилметилового эфира метил-(1,2,5,6-тетрагидро-1-метокси-2-оксо-4Н-имидазо[4,5,1-ij]-хинолинил-5-ил)карбаминовой кислоты (VIII, пример 7, 3,87 г, 10,5 ммоль) и 20% гидроксида палладия на угле (1,0 г) в абсолютном этаноле (100 мл) встряхивают в аппарате Парра с исходным давлением водорода от 3,515 кг/см2 (50 пси) в течение 19 часов. Смесь фильтруют через диатомовую землю и катализатор промывают этанолом и растворитель удаляют при пониженном давлении. Концентрат растворяют в метаноле (25 мл) и добавляют к смеси малеиновой кислоты (1,20 г, 10,3 ммоль) в метаноле (25 мл). Кристаллизация дает желаемый продукт, т. пл. 211o. Вторую порцию получают добавлением эфира (0,29 г). ЖХВР анализ целевого соединения показал, что он имеет более чем 99% чистоту; ЯМР соли малеиновой кислоты (ДМСО) 2,68, 3,05, 3,22, 3,90-4,06, 6,05, 6,85-6,97, 8,74 и 10,83 δ; ИК (минеральное масло) 1696 и 1638 см-1; [α]25 D = 26,3o (Н2О, с = 0,836).
Пример 9
Таблетки - 35% гидроксипропилметилцеллюлозы 2208 USP 4000 сП - 350 мг
(R)-5,6-дигидро-5-(метиламино)-4Н-имидазо [4,5-ij] -хинолин-2(1H)-он (Z)-2-бутендиоат (1:1) - 3,97 мг (1,1%)
Преклейстеризованный крахмал - 220,38 мг (62,8%)
Гидроксипропилметилцеллюлоза 2208 USP 4000 - 122,50 мг (35,0%) сП
Коллоидная двуокись кремния - 1,40 мг (0,4%)
Стеарат магния - 1,75 мг (0,5%)
Общий вес таблетки - 350,00 мг (100%)
Таблетку получают сухой грануляцией следующим образом. Фармацевтически активный ингредиент, (R)-5,6-дигидро-5- (метиламино)-4Н-имидазо[4,5-ij]-хинолин-2(1H)-он (Z)-2-бутендиоат (1: 1), крахмал, гидроксипропилметилцеллюлозу и коллоидную двуокись кремния отдельно просеивают и затем смешивают в контейнере или смесителе подходящего размера. Стеарат магния просеивают и смешивают с частью материала из контейнера или смесителя, и затем все материалы тщательно перемешивают. Эту смазанную смесь прессуют в 350 мг таблетки с желательными физическими показателями.
Пример 10
Таблетки - 35% гидроксипропилметилцеллюлозы 2910 USP 4000 сП - 350 мг
(R)-5,6-дигидро-5-(метиламино)-4Н-имидазо
[4,5-ij]-хинолин-2(1Н)-он (Z)-2-бутендиоат (1:1) - 3,97 мг
Преклейстеризованный крахмал - 220,38 мг
Гидроксипропилметилцеллюлоза 2910 USP 4000 сП - 122,50 мг
Коллоидная двуокись кремния - 1,40 мг
Стеарат магния - 1,75 мг
Общий вес таблетки - 350,00 мг
Таблетки по примеру 10 получают по методике примера 9, внося незначительные изменения.
Пример 11
Таблетки - 35% гидроксипропилметилцеллюлозы 2910 USP 4000 сП - 350 мг; кукурузный крахмал
(R)-5,6-Дигидро-5-(метиламино)-4Н-имидазо [4,5-ij] -хинолин-2(1Н)-он (Z)-2-бутендиоат (1:1) - 3,97 мг
Кукурузный крахмал - 220,38 мг
Гидроксипропилметилцеллюлоза 2910 USP 4000 сП - 122,50 мг
Коллоидная двуокись кремния - 1,40 мг
Стеарат магния - 1,75 мг
Общий вес таблетки - 350,00 мг
Таблетки по примеру 11 получают по методике примера 9, внося незначительные изменения.

Изобретение относится к медицине. Описаны таблетки пролонгированного выделения (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij]-хинолин-2(1Н)-она(Z)-2-бутендиоат (1: 1), которые позволяют введение (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4,5-ij] -хинолин-2(1Н)-она(Z)-2-бутендиоат (1: 1) дважды в день для лечения человека, страдающего болезнью Паркинсона. Изобретение обеспечивает точную дозировку и частоту введения препарата. 12 з.п. ф-лы.
| US 5273975 А, 28.12.1993 | |||
| ТРИЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ И ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2023712C1 |
| ПРОИЗВОДНЫЕ N-ФЕНИЛГЛИЦИНАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СРОДСТВОМ К РЕЦЕПТОРАМ ХЦК И ГАСТРИНА | 1991 |
|
RU2076108C1 |
Авторы
Даты
2003-05-27—Публикация
1998-09-03—Подача